14 minute read
Exosomas del plasma seminal porcino
from Albéitar 240
by Grupo Asís
Los exosomas del plasma seminal han demostrado aportar múltiples beneficios para la reproducción asistida en el sector porcino. Sin embargo, actualmente solo se han realizado pruebas in vitro y no se conocen resultados sobre la fertilidad.
Mireya Cantero Nieto, Paula Sánchez Zamora, Chiara Luongo y Carmen Matás Parra Dept. Fisiología. Universidad de Murcia. Instituto Murciano de Investigaciones Biomédicas Arrixaca (IMIB). Murcia Imágenes cedidas por las autoras
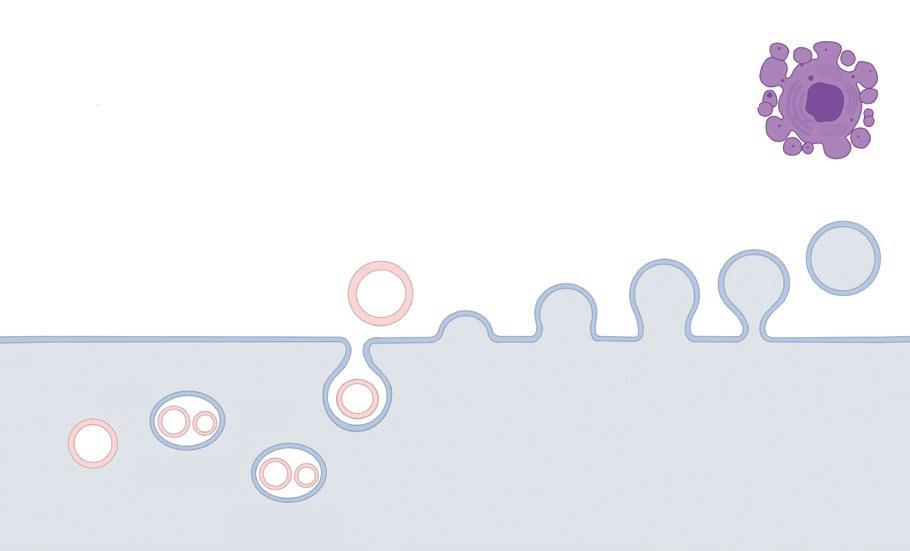
Durante el tránsito epididimario y tras entrar en contacto con la secreción de las glándulas accesorias durante la eyaculación, los espermatozoides son remodelados y adquieren nuevas proteínas. Este hecho sugiere que las proteínas secretadas por estos órganos se transfieren a los espermatozoides directamente por adsorción sobre la membrana plasmática o indirectamente por modificaciones de proteínas existentes en la membrana (Rutllant y Meyers, 2001). Parte de esta remodelación se produce a través de unas vesículas extracelulares (VE), producidas principalmente en las células epiteliales del epidídimo y de las glándulas accesorias. Estas vesículas Exosoma Endosoma multivesicular Vesícula intraluminal se infiltran en la membrana plasmática y mantienen la función del espermatozoide (Du et al., 2016).
FUNCIÓN DEL PLASMA SEMINAL
El plasma seminal (PS) está constituido por las secreciones formadas en el epidídimo y en las glándulas accesorias (próstata, glándulas vesicales y bulbouretrales), y proporcionan a los espermatozoides los componentes necesarios para llegar al lugar de fecundación (Du et al., 2016).
Durante un tiempo se pensó que el PS actuaba simplemente como un medio para la transferencia eficiente de los espermatozoides a la hembra, pero actualmente se ha determinado su implicación en una amplia variedad de funciones importantes en el proceso reproductivo, como la capacitación espermática (Manjunath y Thérien, 2002; Maxwell et al., 2007), la formación del reservorio espermático
Célula apoptótica Cuerpos apoptóticos
Microvesícula
FIGURA 1. Representación esquemática de la liberación de las VE: las microvesículas se liberan al medio extracelular mediante gemación y fisión celular, mientras que los exosomas (inicialmente vesículas intraluminales) se liberan mediante la fusión de los endosomas multivesiculares con la membrana plasmática celular.
en el oviducto (Talevi y Gualtieri, 2010) o el acondicionamiento del sistema inmunitario de la hembra (Robertson, 2005). Sin embargo, también se han demostrado gestaciones con espermatozoides de epidídimo mediante la inyección del espermatozoide en el ovocito (Silber et al., 1995), fecundación in vitro (Songsasen y Leibo, 1998) o tras inseminación intrauterina (Ehling et al., 2006). Esto nos conduce a plantearnos si la exposición al PS es un requisito vital para la función biológica del espermatozoide in vivo.
Se ha observado que el PS tiene el potencial de acelerar la ovulación conduciendo a una reducción en el intervalo entre el pico de LH y el momento de la ovulación (Waberski et al., 2018). Además, promueve cambios en la expresión del gen uterino asociado con el transporte y la protección de los espermatozoides (Chen et al., 2014). Por otro lado, se ha determinado que favorece la implantación, el desarrollo embrionario previo a la implantación y la salud posterior de la descendencia (Bromfield et al., 2014). En cuanto a la función del PS sobre la fisiología y funcionalidad espermática, se ha demostrado que contrarresta los efectos perjudiciales de los agentes oxidantes, estabiliza a los espermatozoides para su tránsito a lo largo del tracto femenino, regula la osmolaridad del eyaculado, es fuente de energía para los espermatozoides y protege contra los cambios de pH. Por lo tanto, desempeña un papel clave en el mantenimiento de su viabilidad, así como en su metabolismo, motilidad y regulación de la capacitación (Maxwell et al., 2007).
VESÍCULAS EXTRACELULARES: EXOSOMAS
Las vesículas extracelulares son un conjunto heterogéneo de estructuras membranosas liberadas por las células que se clasifican a en 3 tipos principales: • Microvesículas: también denominadas micropartículas o ectosomas (tamaño comprendido entre 50 y 500 nm.) que se producen por brotación externa y fisión de la membrana plasmática.
Presentación de antígenos: MHC I, MHC II
Señales de traducción
Enzimas
Transportadores
Proteínas del Proteínas citoesqueleto citosólicas Moléculas de adhesión
Ceramidas
Colesterol
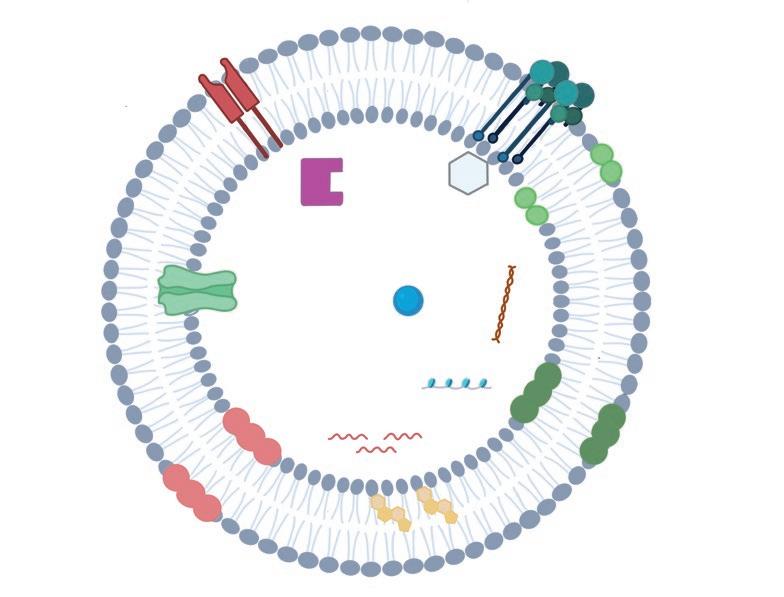
FIGURA 2. Esquema que representa la estructura y composición de los exosomas.
Exosomas (tamaño comprendido entre 50 y 150 nm) que se forman dentro de la red endosómica y se liberan tras la fusión de cuerpos multivesiculares con la membrana plasmática. Cuerpos apoptóticos (tamaño comprendido entre 50 y 5000 nm) que se liberan como ampollas de células que sufren apoptosis (Ferreira y Porter, 2018).
Los exosomas se forman por la fusión de endosomas tardíos (también denominados cuerpos vesiculares) con la membrana plasmática, y serán expulsados de la célula tras su formación (Camussi et al., 2011). Para ello, a lo largo de la membrana plasmática se produce una reorganización con cambios en los componentes proteicos y lipídicos, así como en los niveles de calcio. Todo ello, causa el doblamiento de la membrana y la reestructuración del citoesqueleto, lo que favorece la germinación en la membrana y la formación de las microvesículas (figura 1). Obtención del eyaculado
Identificación y caracterización de exosomas ESTRUCTURA Y COMPOSICIÓN DE LOS EXOSOMAS La membrana de los exosomas presenta doble capa lipídica con pequeñas cantidades de fosfatidilserina, pero grandes cantidades de colesterol, ceramida y esfingolípidos (Van Niel et al., 2018). Cabe destacar que la composición de los exosomas es un reflejo de la composición de la célula de la que proviene, así como del mecanismo que regula. Entre los componentes que contiene (figura 2) se encuentran proteínas, incluyendo receptores, moléculas de adhesión, transportadores de membrana señales de traducción, enzimas, lípidos, así como ácidos nucleicos (Colombo et al., 2014).
Aunque las proteínas que aparecen en los exosomas pertenecen a la célula de la que provienen, todos los exosomas presentan un grupo de proteínas comunes. Ejemplos típicos de ello son las moléculas de
adhesión (CAM), las integrinas, las tetraspaninas o Obtención de exosomas
Ultracentrifugación PS

Medición por DLS
Identificación de exosomas por MET

las MHC I y II (Camussi et al., 2011). Por otro lado, también se encuentran proteínas de fusión como son Rab2, Rab7, flotillin y anexina, así como proteínas de choque térmico como Hsc70 y Hsc90. Además, aparecen proteínas propias del citoesqueleto como la actina, miosina y tubulina (Brinckerhoff, 2017).
En cuanto al contenido lipídico de los exosomas, se puede dividir en cuatro grandes grupos: esfingomielinas, colesterol, fosfolípidos y ceramidas. La proporción de cada uno varía dependiendo de la especie y de la célula de la que procede. P25b RAFT Proteínas no identificadas MIF Además de la compleja composición proteica y lipídica, se han determinado azúcares y una amplia variedad de material genético como ADN, ARN mensajero, ARN no codificante y microARN (Raposo y Stoorvogel, 2013). No obstante, aún no está clara la contribución relativa de las cargas activas y pasivas de ARN y, en general, de los ácidos nucleicos de los exosomas. Por otro lado, se están estudiando los posibles mecanismos por los que el material genético llega a las microvesículas (Van Niel et al., 2018).
MÉTODOS PARA AISLAR Y CARACTERIZAR EXOSOMAS Se han descrito varios métodos para aislar exosomas. No obstante, el método preferente son las centrifugaciones y ultracentrifugaciones (Barranco et al., 2019). Para caracterizar los exosomas tras su aislamiento, nos podemos basar en la morfología (análisis de vesículas individuales con microscopio electrónico de transmisión) y en marcadores de proteínas (Western Blot o citometría de flujo). Con relación a la cuantificación de exosomas, se puede hacer en función de la cantidad de una proteína exosómica particular usando ELISA o inmunotransferencia, o bien medir la concentración de proteínas
A
en las preparaciones de exosomas. En la figura 3 se
B
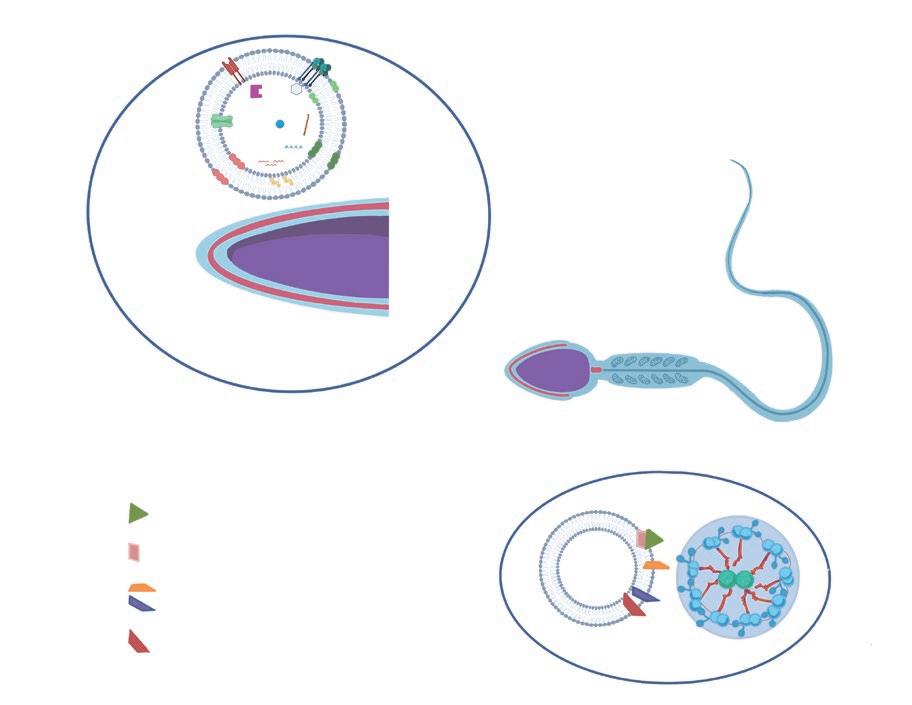
FIGURA 4. Transferencia de la carga del exosoma a la célula espermática. A: Intercambio de proteínas entre el exosoma y la membrana de la cabeza del espermatozoide; B: Intercambio de proteínas entre los exosomas y el axonema del espermatozoide.
muestra a modo de ejemplo un protocolo para aislar exosomas mediante ultracentrifugación seguido de dos técnicas para identificarlos morfológicamente y una técnica para la identificación de proteínas contenidas en ellos.
EXOSOMAS DEL PLASMA SEMINAL Y SU EFECTO SOBRE LA FUNCIÓN ESPERMÁTICA Las múltiples funciones de los exosomas del PS se basan en su capacidad de transferir moléculas, ya sea a las células espermáticas (figura 4) o a las células inmunitarias del tracto reproductor femenino (YáñezMó et al., 2015).
En la especie porcina se ha demostrado que los exosomas del PS están involucrados en la capacitación espermática, la unión del espermatozoide a la zona pelúcida (Du et al., 2016; Piehl et al., 2013) y la modulación de la expresión génica relacionada con el sistema inmunitario endometrial (Bai et al., 2018).
Se ha observado que añadir PS de verraco a preparaciones espermáticas mejora la viabilidad y motilidad y reduce los cambios debidos a la capacitación prematura o espontánea durante su almacenamiento (Du et al., 2016). Los exosomas pueden formar ATP extracelular a través de la glucólisis y, en teoría, este ATP extracelular mejora la motilidad espermática (Guo et al., 2019).
Varios estudios han demostrado que las VE del PS de mamíferos (incluyendo los exosomas) pueden mediar en la capacitación a través de varios mecanismos relacionados con la inhibición en el flujo de colesterol, la modificación de moléculas señalizadoras de calcio o por control la reacción acrosómica, aunque para que los exosomas transfieran su carga a los espermatozoides deben estar en un ambiente neutro o pH ligeramente alcalino (Aalberts et al., 2013). Por tanto, podría ser que in vivo los exosomas se unan a las células espermáticas en el útero, se transporten asociados a los espermatozoides hasta el oviducto y se fusionen con las células espermáticas solo durante el acercamiento final al ovocito.
USO POTENCIAL DE LOS EXOSOMAS DEL PS EN TÉCNICAS DE REPRODUCCIÓN ASISTIDA Se han realizado estudios en los que se demuestra que la adición de exosomas al diluyente de las dosis seminales durante la conservación a 17 °C mejora motilidad espermática, incrementa el tiempo de supervivencia, la integridad de la membrana se mantiene en el tiempo, se produce menor daño oxidativo y se inhibe la capacitación prematura (Du et al., 2016). En definitiva, son indispensables para mantener la calidad seminal. No obstante, actualmente solo se han realizado pruebas in vitro y no se conocen resultados sobre la fertilidad.
Agendade cursos
¡Matricúlate ya!
Curso con experto
PROGRAMA FORMATIVO BIOSEGURIDAD EN GRANJAS
Rafael J. Astorga Márquez y Santiago Vega 20/10 12h 89

Curso con experto
BIOSEGURIDAD EN GRANJAS DE GANADO PORCINO
Rafael J. Astorga Márquez
20/10
6h 49

Curso con experto
BIOSEGURIDAD EN GRANJAS DE GANADO VACUNO
Santiago Vega
19/11
6h 49

Curso autoaprendizaje


CALIDAD DE PRODUCTO EN RUMIANTES
Carlos Sañudo, Marimar Campo y Ana Guerrero

DISPONIBLE 30h 225
Curso autoaprendizaje

¿TE GUSTARÍA SER PERITO VETERINARIO?
Nacho Sáenz Baquerín
DISPONIBLE 20h 199
Accede al listado completo de cursos http://formacion.grupoasis.com

Para más información contacta con formacion@grupoasis.com o llámanos al 976 461 480
CONCLUSIONES
A pesar de los estudios descriptivos sobre la composición del PS, sus efectos biológicos sobre la funcionalidad espermática son complejos y no están, a día de hoy, del todo aclarados. La situación se complica aún más dada la alta variabilidad en la composición del PS entre especies, entre machos dentro de la misma especie e incluso entre eyaculados de un mismo macho (Zhu et al., 2000). Por otro lado, a pesar del efecto beneficioso de los exosomas del PS, aún no se ha dilucidado su composición y los mecanismos moleculares específicos por los cuales ayudan a las células espermáticas in vivo en su camino hacia el ovocito.
BIBLIOGRAFÍA
Alberts, M., Sostaric, E., Wubbolts, R., Wauben, M.W.M., Nolte-’T Hoen, E.N.M., Gadella, B.M., Stout, T.A.E., Stoorvogel, W., 2013. Spermatozoa recruit prostasomes in response to capacitation induction. Biochim. Biophys. Acta - Proteins Proteomics 1834, 2326–2335. https://doi.org/10.1016/j. bbapap.2012.08.008
Bai, R., Latifi, Z., Kusama, K., Nakamura, K., Shimada, M., Imakawa, K., 2018. Induction of immune-related gene expression by seminal exosomes in the porcine endometrium. Biochem. Biophys. Res. Commun. 495, 1094–1101. https://doi.org/10.1016/j.bbrc.2017.11.100
Barranco, I., Padilla, L., Pérez-Patiño, C., Vazquez, J.M., Martínez, E.A., Rodríguez-Martínez, H., Roca, J., Parrilla, I., 2019. Seminal Plasma Cytokines Are Predictive of the Outcome of Boar Sperm Preservation. Front. Vet. Sci. 6, 436. https://doi. org/10.3389/fvets.2019.00436
Brinckerhoff, C.E., Brinckerhoff, C.E., 2017. “Matrix Metalloproteinases: They’re Not Just for Matrix Anymore!,” in: Matrix Metalloproteinases in Health and Disease. WORLD SCIENTIFIC, pp. 65–94. https://doi. org/10.1142/9789813207554_0004
Bromfield, J.J., Schjenken, J.E., Chin, P.Y., Care, A.S., Jasper, M.J., Robertson, SA, 2014. Maternal tract factors contribute to paternal seminal fluid impact on metabolic phenotype in offspring. Proc. Natl. Acad. Sci. U. S. A. 111, 2200–5. https:// doi.org/10.1073/pnas.1305609111
Camussi, G., Deregibus, M.-C., Bruno, S., Grange, C., Fonsato, V., Tetta, C., 2011. Exosome/microvesicle-mediated epigenetic reprogramming of cells. Am. J. Cancer Res. 1, 98–110.
Chen, J.C., Johnson, B.A., Erikson, D.W., Piltonen, T.T., Barragan, F., Chu, S., Kohgadai, N., Irwin, J.C., Greene, W.C., Giudice, L.C., Roan, N.R., 2014. Seminal plasma induces global transcriptomic changes associated with cell migration, proliferation and viability in endometrial epithelial cells and stromal fibroblasts. Hum. Reprod. 29, 1255–1270. https:// doi.org/10.1093/humrep/deu047
Colombo, M., Raposo, G., Théry, C., 2014. Biogenesis, Secretion, and Intercellular Interactions of Exosomes and Other Extracellular Vesicles. Annu. Rev. Cell Dev. Biol. 30, 255–289. https://doi.org/10.1146/annurev-cellbio-101512-122326 Du, J., Shen, J., Wang, Y., Pan, C., Pang, W., Diao, H., Dong, W., 2016. Boar seminal plasma exosomes maintain sperm function by infiltrating into the sperm membrane. Oncotarget 7, 58832–58847. https://doi.org/10.18632/oncotarget.11315
Ehling, C., Rath, D., Struckmann, C., Frenzel, A., Schindler, L., Niemann, H., 2006. Utilization of frozen-thawed epididymal ram semen to preserve genetic diversity in Scrapie susceptible sheep breeds. Theriogenology 66, 2160–2164. https://doi.org/10.1016/j.theriogenology.2006.07.003
Ferreira, E., Porter, R.M., 2018. Harnessing extracellular vesicles to direct endochondral repair of large bone defects. Bone Jt. Res. 7, 263–273. https://doi.org/10.1302/20463758.74.BJR-2018-0006
Guo, H., Chang, Z., Zhang, Z., Zhao, Y., Jiang, X., Yu, H., Zhang, Y., Zhao, R., He, B., 2019. Extracellular ATPs produced in seminal plasma exosomes regulate boar sperm motility and mitochondrial metabolism. Theriogenology 139, 113–120. https://doi.org/10.1016/j.theriogenology.2019.08.003
Manjunath, P., Thérien, I., 2002. Role of seminal plasma phospholipid-binding proteins in sperm membrane lipid modification that occurs during capacitation. J. Reprod. Immunol. 53, 109–119. https://doi.org/10.1016/S01650378(01)00098-5
Maxwell, W.M.C., de Graaf, S.P., Ghaoui, R.E.-H., Evans, G., 2007. Seminal plasma effects on sperm handling and female fertility. Soc. Reprod. Fertil. Suppl. 64, 13–38.
Piehl, L.L., Fischman, M.L., Hellman, U., Cisale, H., Miranda, P. V., 2013. Boar seminal plasma exosomes: Effect on sperm function and protein identification by sequencing. Theriogenology 79, 1071–1082. https://doi.org/10.1016/j.theriogenology.2013.01.028
Raposo, G., Stoorvogel, W., 2013. Extracellular vesicles: Exosomes, microvesicles, and friends. J. Cell Biol. https://doi. org/10.1083/jcb.201211138
Robertson, SA, 2005. Seminal plasma and male factor signalling in the female reproductive tract. Cell Tissue Res. https://doi.org/10.1007/s00441-005-1127-3
Rutllant, J., Meyers, SA, 2001. Posttranslational Processing of pH-20 During Epididymal Sperm Maturation in the Horse1. Biol. Reprod. 65, 1324–1331. https://doi. org/10.1095/biolreprod65.5.1324 Silber, S.J., Van Steirteghem, A.C., Liu, J., Nagy, Z., Tournaye, H., Devroey, P., 1995. High Fertilization and Pregnancy Rate After Intracytoplasmic Sperm Injection With Spermatozoa Obtained From Testicle Biopsy - PubMed. Hum. Reprod. 10, 148–52.
Songsasen, N., Leibo, S.P., 1998. Live mice from cryopreserved embryos derived in vitro with cryopreserved ejaculated spermatozoa. Lab. Anim. Sci. 48, 275–81.
Talevi, R., Gualtieri, R., 2010. Molecules involved in sperm-oviduct adhesion and release. Theriogenology. https://doi.org/10.1016/j.theriogenology.2009.07.005
Van Niel, G., D’Angelo, G., Raposo, G., 2018. Shedding light on the cell biology of extracellular vesicles. Nat. Rev. Mol. Cell Biol. https://doi.org/10.1038/nrm.2017.125
Waberski, D., Schäfer, J., Bölling, A., Scheld, M., Henning, H., Hambruch, N., Schuberth, H.J., Pfarrer, C., Wrenzycki, C., Hunter, R.H.F., 2018. Seminal plasma modulates the immune-cytokine network in the porcine uterine tissue and pre-ovulatory follicles. PLoS One 13. https://doi. org/10.1371/journal.pone.0202654
Yáñez-Mó, M., Siljander, P.R.M., Andreu, Z., Zavec, A.B., Borràs, F.E., Buzas, E.I., Buzas, K., Casal, E., Cappello, F., Carvalho, J., Colás, E., Cordeiro-Da Silva, A., Fais, S., Falcon-Perez, J.M., Ghobrial, I.M., Giebel, B., Gimona, M., Graner, M., Gursel, I., Gursel, M., Heegaard, N.H.H., Hendrix, A., Kierulf, P., Kokubun, K., Kosanovic, M., Kralj-Iglic, V., Krämer-Albers, E.M., Laitinen, S., Lässer, C., Lener, T., Ligeti, E., Line, A., Lipps, G., Llorente, A., Lötvall, J., MančekKeber, M., Marcilla, A., Mittelbrunn, M., Nazarenko, I., Nolte-’t Hoen, E.N.M., Nyman, T.A., O’Driscoll, L., Olivan, M., Oliveira, C., Pállinger, É., Del Portillo, H.A., Reventós, J., Rigau, M., Rohde, E., Sammar, M., Sánchez-Madrid, F., Santarém, N., Schallmoser, K., Ostenfeld, M.S., Stoorvogel, W., Stukelj, R., Van Der Grein, S.G., Helena Vasconcelos, M., Wauben, M.H.M., De Wever, O., 2015. Biological properties of extracellular vesicles and their physiological functions. J. Extracell. Vesicles. https://doi.org/10.3402/ jev.v4.27066
Zhu, J., Xu, X., Cosgrove, J.R., Foxcroft, G.R., 2000. Effects of semen plasma from different fractions of individual ejaculates on IVF in pigs. Theriogenology 54, 1443–1452. https:// doi.org/10.1016/S0093-691X(00)00466-0










