1 minute read
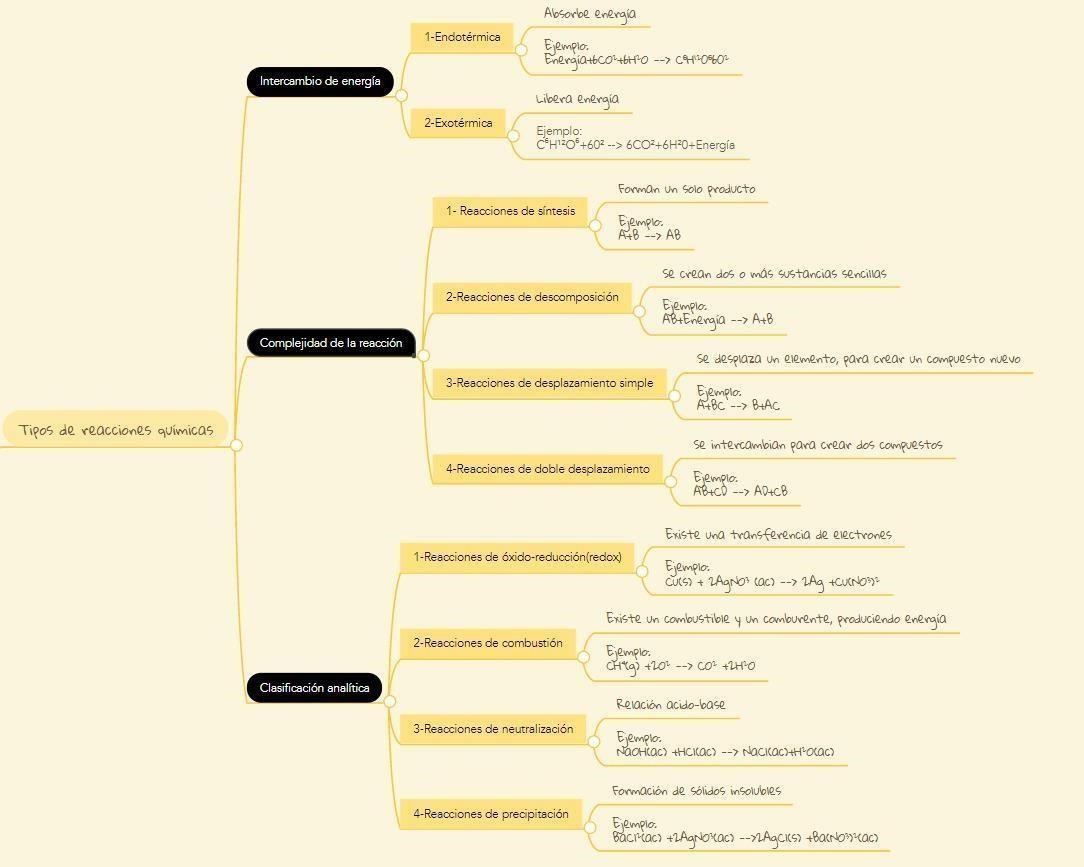
Tipos de reacciones químicas. Organizador graf ico
TIPOS DE REACCIONES QUÍMICAS. ORGANIZADOR GRÁFICO.
ESTEQUIOMETRÍA EN LAS REACCIONES QUÍMICAS.
Advertisement
Analiza detalladamente cada tema y resuelve correctamente los problemas que se muestran a continuación. Después sigue las indicaciones dadas por tu instructor.
CÁLCULOS A PARTIR DE ECUACIONES QUÍMICAS
Masa molar.
Sabemos que un compuesto químico se representa a partir de una fórmula utilizando los símbolos de los elementos que lo integran; su masa se obtiene mediante la suma aritmética de las masas atómicas de todos los átomos presentes en la fórmula del compuesto.
Determina la masa molar de los siguientes compuestos. Na2SO4 2) CO2 3) H2O 4) KMnO4 5) H2SO4

Los cálculos estequiométricos nos permiten conocer las cantidades de reactivos y productos que intervienen en cualquier reacción química, independientemente de su origen, tanto en un laboratorio como en la industria. El requisito previo y necesario para realizarlos es conocer la ecuación química (correctamente balanceada), que representa la reacción sobre la cual se realizarán dichos cálculos.
CÁLCULOS DE MOL A MOL A PARTIR DE ECUACIONES QUÍMICAS.
Las relaciones molares establecidas a partir de una ecuación química sirven como factores de conversión en los cálculos estequiométricos que involucran moles, tanto de la sustancia “conocida” como de la sustancia “buscada”. Ejemplo ilustrativo:
¿Cuántos moles de H2O se producirán en una reacción donde tenemos 1.57 moles de O2?
Escribir correctamente la ecuación que describe el proceso
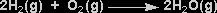
Escribir la relación molar entre la sustancia cuyos moles se desean calcular y la sustancia de partida.
2 moles de H2O 1mol de O2
Los moles de la sustancia de partida (“conocida”) se convierten a los moles de la sustancia deseada (“buscada”), multiplicando la sustancia conocida por la relación molar establecida.
1.57 moles de O2 X 2 moles de H2O = 3.14moles de H2O 1mol de O2









