
CÔNG NGHỆ NANO TRONG SẢN XUẤT THUỐC Ths Nguyễn Thanh Tú eBook Collection CÔNG NGHỆ NANO VÀ ỨNG DỤNG TRONG SẢN XUẤT THUỐC (GIÁO TRÌNH ĐÀO TẠO DƯỢC SĨ ĐẠI HỌC) Chủ biên: PGS. TS. NGUYỄN NGỌC CHIẾN WORD VERSION | 2022 EDITION ORDER NOW / CHUYỂN GIAO QUA EMAIL TAILIEUCHUANTHAMKHAO@GMAIL COM Hỗ trợ trực tuyến Fb www.facebook.com/DayKemQuyNhon Mobi/Zalo 0905779594 Tài liệu chuẩn tham khảo Phát triển kênh bởi Ths Nguyễn Thanh Tú Đơn vị tài trợ / phát hành / chia sẻ học thuật : Nguyen Thanh Tu Group vectorstock com/30951585





DẠYKÈMQUYNHƠN OFFICIALTRƯỜNG ĐẠI HỌC DƯỢC HÀ NỘI BỘ MÔN CÔNG NGHIỆP DƯỢC CÔNG NGHỆ NANO VÀ ỨNG DỤNG TRONG SẢN XUẤT THUỐC (GIÁO TRÌNH ĐÀO TẠO DƯỢC SĨ ĐẠI HỌC) CHỦ BIÊN: PGS.TS.NGUYÊN NGỌC CHIẾN HÀ NỘI 2019 Thuốc Polyme Tiểu phân nano polyme Tác nhân hướng đích 500 nm
TRƯỜNG ĐẠI HỌC DƯỢC HÀ NỘI
MÔN CÔNG NGHIỆP DƯỢC
CÔNG NGHỆ NANO
ỨNG DỤNG TRONG SẢN XUẤT THUỐC
Chủ biên: PGS. TS. NGUYỄN NGỌC CHIẾN
Đồng tác giả: PGS. TS. NGUYỄN NGỌC CHIẾN THS. HỒ HOÀNG NHÂN
DẠYKÈMQUYNHƠN OFFICIAL
BỘ
VÀ
HÀ NỘI -2019
LỜI MỞ ĐẦU
Cuốn “Công nghệ nano và ứng dụng trong sản xuất thuốc” là tài liệu học tập dành cho sinh viên của Trường Đại học DượcHà Nội với thời lượng học phần gồm
2 tín chỉ. Chúng tôi hy vọng tài liệu này sẽ đáp ứng được yêu cầu học tập của sinh viên và là tài liệu tham khảo hữu ích cho các bạn đọc có nhu cầu.
Cho đến nay, công nghệ nano ngày càng thu hút được nhiều sự quan tâm của các nhà khoa học và hiện đã được ứng dụng trong nhiều lĩnh vực của đời sống, trong đó có ngành dược phẩm và mỹ phẩm. Với nhiều ưu điểm so với dạng thuốc truyền thống như cải thiện sinh khả dụng, đưa thuốc đến đích, do vậy việc áp dụng công nghệ nano giúp làm tăng hiệu quả điều trị và giảm tác dụng không mong muốn của thuốc, đặc biệt đối với các thuốc điều trị bệnh ung thư.
Ngoài những kiến thức cơ bản về công nghệ nano, tài liệu “Công nghệ nano và ứng dụng trong sản xuất thuốc” sẽ giới thiệu thêm cho người học về những thành phần cơ bản của một tiểu phân nano, tóm tắt các phương pháp bào chế các tiểu phân này. Đồng thời, tài liệu này sẽ cập nhật các phương pháp đánh giá đặc tính lý hóa cũng như các phương pháp và mô hình đánh giá tác dụng sinh học in vitro và in vivo của tiểu phân nano. Phần cuối của tài liệu sẽ giới thiệu về các ứng dụng của các tiểu phân nano vào các dạng thuốc hiện đang được nghiên cứu và áp dụng thực tế.
Mặc dù đã cố gắng trong quá trình tập hợp tư liệu và biên soạn, chắc chắn không tránh khỏi những thiếu sót, chúng tôi mong nhận được nhiều ý kiến đóng góp của bạn đọc để lần tái bản sau được hoàn thiện hơn.
Các tác giả
DẠYKÈMQUYNHƠN OFFICIAL
DANH MỤC CHỮ VIẾT TẮT VÀ THUẬT NGỮ
Chữ viết tắt Thuật ngữ
Giải thích
Lipid nanoparticle Nano lipid
Lipid polymer hybrid nanoparticle Nano lai lipid polyme hay nano lipid polyme Nanoparticle Tiểu phân nano, viết tắt nano
Organelle escape units Các đơn vị giúp thoát khỏi cơ quan tế bào
Polymeric nanoparticle Nano polyme
Polymer lipid hybird nanoparticle Nano lai polyme lipid hay nano polyme lipid
Spray freeze drying Kỹ thuật phun sấy lạnh
Surface modification Cải biến bề mặt
ART Artesunat
CS Chitosan D/D Dầu/Dầu
D/N Dầu/Nước
DLS Dynamic Light Scattering Tán xạ ánh sáng động
EE
EMA
EPR
FDA
Efficiency Hiệu suất nano hóa
Cơ quan Y tế Châu Âu
and
Hiệu ứng lưu giữ và tăng thấm tăng cường
and Drug Administration Cục quản lí thực phẩm và dược phẩm Mỹ
GEM Genetically Engineered Mouse Mô hình chuột được thiết kế di truyền
DẠYKÈMQUYNHƠN OFFICIAL
Encapsulation
European Medicines Agency
Enhanced Permeability
Retention Effect
Food
ISO International Organization for Standardization
Tổ chức quốc tế về tiêu chuẩn hóa
KLPT Khối lượng phân tử
KTTP Kích thước tiểu phân
LC Loading Capacity Khả năng nạp thuốc, hay tỷ lệ dược chất nano hóa
MFT Minimum Film Formation Temperature Nhiệt độ hình thành phim tối thiểu
MPS Mononuclear Phagocyte System Hệ đại thực bào đơn nhân
NLC Nanostructured Lipid Carrier Hệ mang lipid cấutrúc nano
OCED Organization for Economic Cooperation and Development
Tổ chức hợp tác phát triển kinh tế
RCC Regulatory Cooperation Council Hội đồng pháp lý
REACH Registration, Evaluation, Authorization, and Restriction of Chemical
Đăng kí, đánh giá, thẩm quyền và giới hạn về hóa chất
RES Reticuloendothelial System Hệ lưới nội mô
DẠYKÈMQUYNHƠN OFFICIAL SLN Solid Lipid Nanoparticles Nano lipid rắn
1.1. Giới thiệu về công nghệ
VÀ THUẬT NG
TS. Nguyễn Ngọc Chiến, ThS. H
Hoàng Nhân
1
1.2. Ưu, nhược điểm và thách thức của các tiểu phân nano 2
1.2.1. Ưu điểm 2
1.2.2. Nhược điểm và thách thức.................................................................3
1.3. Phân loại các tiểu phân nano 3
1.3.1. Phân loại dựa vào cấu trúc tiểu phân nano và tá dược sử dụng...........3
1.3.2. Phân loại dựa trên tương tác giữa tiểu phân nano và hệ sinh học........5
1.4. Thành phần, cấu trúc và đặc điểm hòa tan dược chất từ tiểu phân nano 6
1.4.1. Thành phần tiểu phân nano................................................................6
1.4.2. Cấu trúc một số tiểu phân nano..........................................................6
1.4.3. Đặc điểm hòa tan dược chất từ tiểu phân nano 10
1.5. Một số đặc điểm sinh dược học và dược động học của tiểu phân nano.... 12
1.5.1. Đặc điểm sinh dược học chung của các tiểu phân nano 12
1.5.2. Đặc điểm dược động học tiểu phân nano dùng theo đường uống 15
1.5.3.
DẠYKÈMQUYNHƠN OFFICIALMỤC LỤC LỜI MỞ ĐẦU DANH MỤC CHỮ VIẾT TẮT
Ữ MỤC LỤC Chương 1. Đại cương về công nghệ nano............................................................1 PGS.
ồ
nano...................................................................
Đặc điểm dược động học tiểu phân nano dùng theo đường tiêm...... 16 1.5.4. Đặc điểm dược động học tiểu phân nano dùng theo đường khác 18 1.6. Vai trò của công nghệ nano trong dược phẩm......................................... 18 1.6.1. Vận chuyển thuốc............................................................................ 19 1.6.2. Điều trị tại đích 19 1.6.3. Gen trị liệu ...................................................................................... 27 1.6.4. Các vai trò khác............................................................................... 28 1.7. Độc tính của tiểu phân nano 29 Chương 2. Kỹ thuật bào chế tiểu phân nano...................................................... 32
PGS. TS. Nguyễn Ngọc Chiến, ThS. Hồ Hoàng Nhân
2.1. Tá dược chung bào chế tiểu phân nano ...................................................32
2.1.1. Chất mang 32
2.1.2. Chất ổn định 46
2.1.3. Dung môi.........................................................................................47
2.1.4. Chất khác.........................................................................................47
2.2. Phương pháp bào chế..............................................................................56
2.2.1. Bào chế nano tinh thể.......................................................................56
2.2.2. Bào chế nano polyme 64
2.2.3. Bào chế nano lipid ...........................................................................74
2.2.4. Bào chế nano polyme-lipid...............................................................84
Chương 3. Các phương pháp đánh giá tiểu phân nano 89
PGS. TS. Nguyễn Ng
3.1. Các phương pháp đánh giá đặc tính lý hóa
c Chiến, ThS. Hồ Hoàng Nhân
3.1.1. Đánh giá kích thước tiểu phân..........................................................89
3.1.2. Đánh giá điện tích bề mặt.................................................................93 3.1.3. Đánh giá hình thái cấu trúc tiểu phân 98 3.1.4. Đánh giá thành phần, tương tác hóa học và trạng thái kết tinh 101 3.1.5. Đánh giá khả năng nạp thuốc và hiệu suất nano hóa.......................103 3.1.6. Đánh giá khả năng giải phóng thuốc in vitro 107
Phương pháp đánh giá tác d
ng sinh học in vitro
DẠYKÈMQUYNHƠN OFFICIAL
ọ
..............................................89
3.2.
ụ
..................................110 3.2.1. Nuôi cấy tế bào đơn lớp 2 chiều.....................................................110 3.2.2. Nuôi cấy tế bào 3 chiều 114 3.3. Phương pháp đánh giá tác dụng sinh học in vivo ...................................116 3.3.1. Phương pháp đánh giá tác dụng chống khối u ................................117 3.3.2. Phương pháp đánh giá các tác dụng sinh học khác 119 Chương 4. Ứng dụng công nghệ nano trong sản xuất thuốc.............................120 PGS. TS. Nguyễn Ngọc Chiến 4.1. Bào chế thuốc tiêm ...............................................................................120 4.1.1. Các loại tiểu phân nano dùng bào chế thuốc tiêm...........................120
4.1.2. Các dạng bào chế chứa tiểu phân nano dùng cho đường tiêm ........ 122
4.1.3. Bào chế thuốc tiêm chứa tiểu phân nano........................................ 123
4.1.4. Đánh giá các chỉ tiêu chất lượng thuốc tiêm chứa tiểu phân nano 128
4.2. Bào chế thuốc dùng đường uống 131
4.2.1. Các loại tiểu phân nano dùng bào chế thuốc dùng đường uống...... 131
4.2.2. Các dạng bào chế chứa tiểu phân nano dùng đường uống.............. 137
4.2.3. Bào chế thuốc dùng đường uống chứa tiểu phân nano ................... 137
4.2.4. Đánh giá các chỉ tiêu chất lượng thuốc dùng đường uống chứa tiểu phân nano 141
4.3. Bào chế thuốc nhãn khoa...................................................................... 145
OFFICIAL
4.3.1. Các loại tiểu phân nano dùng bào chế thuốc nhãn khoa ................. 145
4.3.2. Các dạng thuốc chứa tiểu phân nano dùng cho nhãn khoa 145
4.3.3. Bào chế thuốc nhãn khoa chứa tiểu phân nano............................... 149
4.3.4. Đánh giá các chỉ tiêu chất lượng thuốc nhãn khoa chứa tiểu phân nano ................................................................................................................ 151
4.4. Bào chế thuốc dùng ngoài da................................................................ 154
4.5. Bào chế thuốc cho đường dùng khác 157 TÀI LIỆU THAM KHẢO 159
DẠYKÈMQUYNHƠN
VỀ CÔNG NGHỆ NANO
Mục tiêu học tập
1. Trình bày được ưu, nhược điểm, cách phân loại của tiểu phân nano và đặc điểm của từng loại.
2. Trình bày và phân tích được một số đặc điểm dược động học của tiểu phân nano.
3. Phân tích được một số vai trò của công nghệ nano trong dược phẩm.
4. Phân tích được
1000 nm) dựa vào tính chất khác biệt của vật liệu khi ở kích thước này và có thể ứng dụng cho tất cả các lĩnh vực khác nhau như vật lý, hóa học, sinh học, y học,… Theo Ủy ban Châu Âu (European Commission), vật liệu nano được định nghĩa là các vật liệu có nguồn gốc tự nhiên, hay tổng hợp chứa các tiểu phân ở trạng thái không gắn kết hoặc phức hợp hoặc kết tụ, trong đó bằng hoặc nhiều hơn 50% số lượng tiểu phân phân bố theo kiểu số lượng (number size distribution) trong khoảng kích thước từ 1 100 nm. Với mục đích sử dụng, Tổ chức khoa học châu Âu (European Science Foundation) mở rộng khái niệm nano trong y học cho các tiểu phân có kích thước đến hàng trăm nanomét, khái niệm này phù hợp hơn với định nghĩa của tiểu phân nano dùng để đưa thuốc đến nơi tác dụng [31].
thước
Công nghệ nano dược hình thành trên cơ sở áp dụng thành tựu của công nghệ nano nói chung vào lĩnh vực nghiên cứu chế tạo các tiểu phân nano dược phẩm, các hệ mang thuốc nano hoặc các thiết bị nano dùng trong chẩn đoán và điều trị bệnh.
Trong ngành dược, việc sử dụng các hệ thống mang thuốc ở kích thước nano có thể đem đến một liệu pháp điều trị khả thi nhờ vào tính đặc hiệu hoặc tác dụng tại đích kết hợp với việc giải phóng thuốc tối ưu, từ đó giúp tăng cường tác dụng dược lý đồng thời giảm tác dụng phụ có hại in vivo của thuốc.
dược phẩm
nano, nhũ tương nano, phức hợp polyme, hoặc phức tạp hơn
(nanopharmaceuticals) được định nghĩa là các phức hợp có kích thước nano, đơn
thuốc,
hoặc gen, các phối tử hướng đích
lâm
không hướng đích (như
và
DẠYKÈMQUYNHƠN OFFICIAL 1 Chương 1. ĐẠI CƯƠNG
độc tính của tiểu phân nano 1.1. GIỚI THIỆU VỀ CÔNG NGHỆ NANO Công nghệ nano là ngành khoa học thực hiện việc nghiên cứu và ứng dụng các vật liệu có kích
cực nhỏ (10 đến
Các
nano
giản như là các tiểu phân
như các hệ đa thành phần kích thước nano có chứa
protein
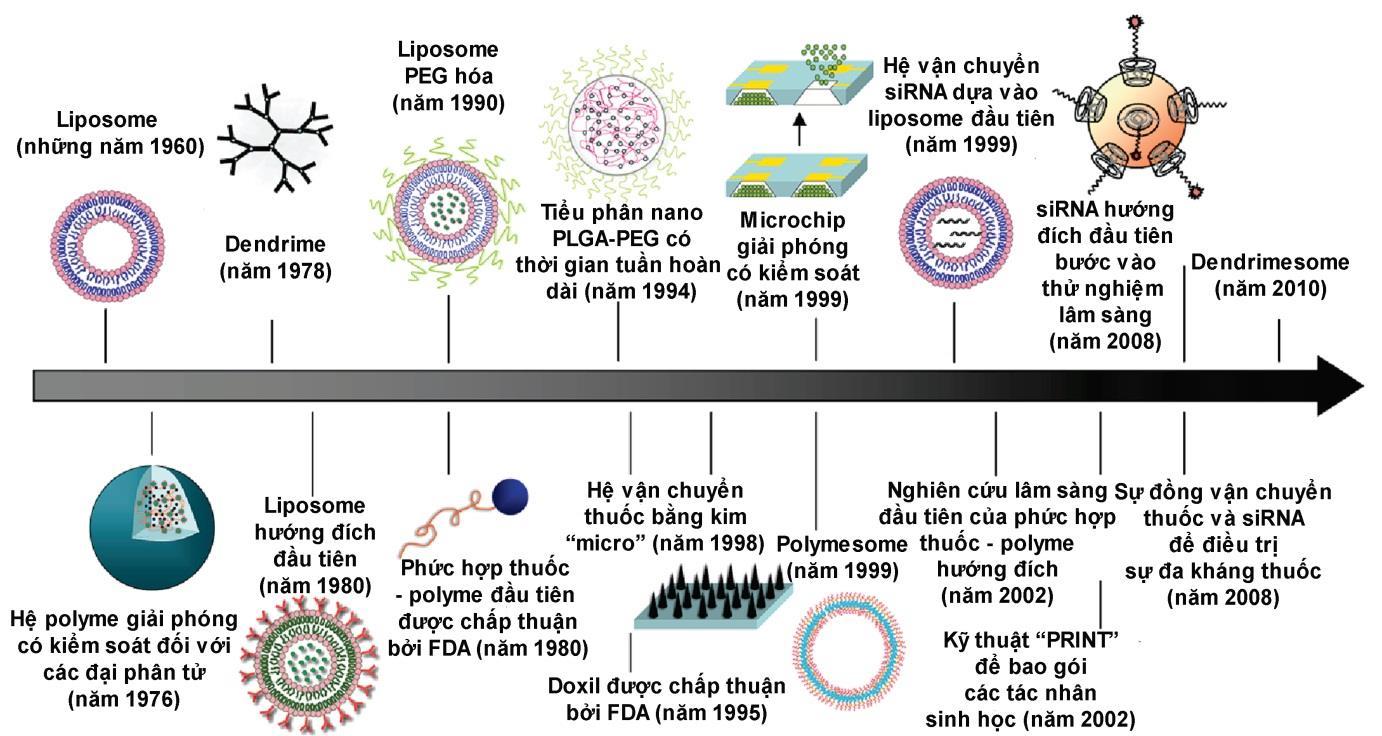
và các tín hiệu để có thể phát hiện trên thử nghiệm in vitro hoặc in vivo [31]. Kể từ khi liposome được mô tả lần đầu tiên vào những năm 1960 và được đề xuất làm hệ vận chuyển thuốc trong điều trị bệnh, công nghệ nano đã có một tác động đáng kể đến sự phát triển của các hệ vận chuyển thuốc. Rất nhiều các vật liệu và thiết bị nano hữu cơ, vô cơ khác nhau đã được sử dụng làm các hệ vận chuyển để phát triển các phương thức điều trị hiệu quả (Hình 1.1). Cho đến nay, đã có hơn 24 sản phẩm điều trị dựa trên công nghệ nano được FDA chấp nhận dùng trên lâm sàng và nhiều sản phẩm khác vẫn đang trong quá trình thử nghiệm
sàng trong đó phần lớn là các sản phẩm thuộc thế hệ 1 thế hệ gồm các hệ vận chuyển
liposome
các nano polyme).
Hình 1.1. Sự phát triển theo thời gian của quá trình phát triển thuốc dựa vào công nghệ nano [103]
1.2. ƯU, NHƯỢC ĐIỂM VÀ THÁCH THỨC CỦA CÁC TIỂU PHÂN NANO
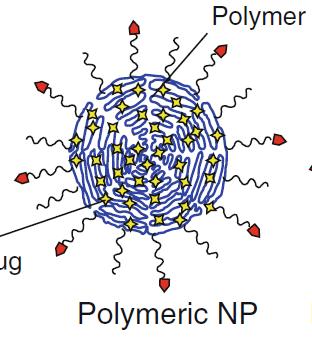
1.2.1. Ưu điểm
Các hệ mang thuốc nano đóng vai trò là “bình chứa” các tác nhân bên trong, bảo vệ tác nhân điều trị khỏi môi trường bên ngoài và môi trường sinh học của cơ thể.
Tăng cường khả năng xâm nhập tế bào và quá trình thoát ra khỏi mao mạch.
- Nâng cao khả năng hấp thu thuốc vào các khối u hoặc vị trí mà thuốc tác dụng.
Giảm được việc tương tác với các tế bào lành dẫn đến giảm tác dụng không mong muốn (ADR).
Giảm sự thải trừ của thận.
Bề mặt lớn trên một tỉ
cho các thay đổi hóa học ở bề mặt.
DẠYKÈMQUYNHƠN OFFICIAL 2
lệ thể tích giúp thuận lợi
Tăng độ tan của dược chất ít tan. - Tăng sinh khả dụng của các thuốc nói chung, đặc biệt các tác nhân chống ung thư. Cho phép kiểm soát tốt hơn về thời gian và sự phân bố của các thuốc trong cơ thể [121]. 1.2.2. Nhược điểm và thách thức Khó khăn trong việc bào chế quy mô lớn và ổn định sản phẩm. Nhiều trường hợp cần thiết phải đánh giá lại sinh khả dụng, tác dụng sinh học, độc tính. Ảnh hưởng tới môi trường do có thể phải sử dụng quá mức dung môi. Một số thách thức lớn khác cần giải quyết, bao gồm [73]: - Định hướng thuốc đến tế bào đích với độ đặc hiệu cao nhất. - Phát triển những công thức thuốc hiệu quả nhằm tăng cường độ an toàn. Đơn giản hóa phác đồ điều trị.
Bảo đảm chi phí hiệu quả và chất lượng thuốc trong mối tương quan với giá cả, việc nâng quy mô sản xuất.
1.3. PHÂN LOẠI CÁC TIỂU PHÂN NANO
Có nhiều cách phân loại các tiểu phân nano khác nhau, bao gồm:
Dựa vào cấu trúc nano và tá dược sử dụng.
Dựa vào tương tác giữa tiểu phân nano và hệ sinh học.
1.3.1. Phân loại dựa vào cấu trúc tiểu phân nano và tá dược sử dụng
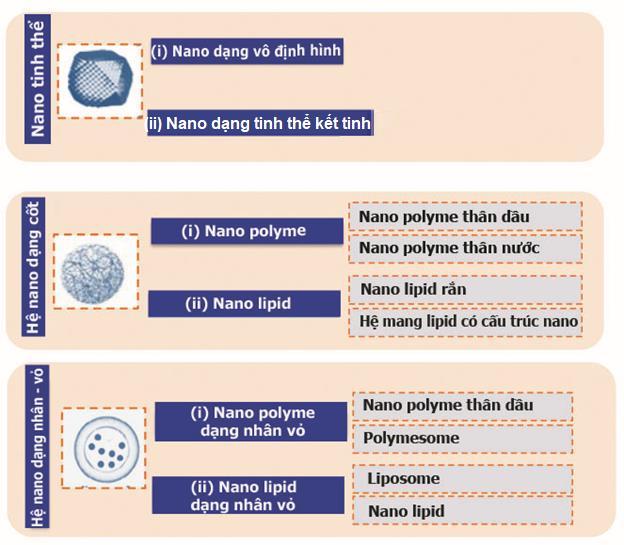
Dựa vào cấu trúc và tá dược sử dụng, hệ mang thuốc ở kích thước nanomét có thể phân loại gồm [31]:
Nano vô cơ: Nano kim loại như nano vàng, bạc và nano không phải kim loại như nano carbon (quantum dot, fulleren, …), nano silica.
Nano hữu cơ:
o Nano tinh thể: Thường chỉ gồm dược chất, không có giá mang, chỉ có tá dược tránh kết tụ, bao gồm nano tinh thể dạng vô định hình và nano tinh thể dạng kết tinh.
o Hệ mang thuốc kích thước nano mét (Hệ mang thuốc nano):
▪ Dạng cốt:
➢ Nano polyme: Là các hệ mang thuốc sử dụng polyme làm giá mang dược chất, bao gồm nano polyme thân dầu, nano polyme thân nước.
➢ Nano lipid: Là các hệ mang thuốc sử dụng các lipid làm giá mang dược chất, bao gồm nano lipid rắn và hệ mang lipid có cấu trúc nano.
▪ Dạng nhân vỏ:
➢ Nano polyme: bao gồm nano polyme thân dầu dạng nhân-vỏ và polymesome.
➢ Nano lipid: bao gồm liposome và nano lipid dạng nhân vỏ.
DẠYKÈMQUYNHƠN OFFICIAL 3
Hình 1.2. Phân loại hệ mang thuốc hữu cơ có cấu trúc nano [31] Ngoài ra, đối với hệ mang thuốc nano có thể được phân loại như sau:
➢ Nano polyme
➢ Nano lipid
➢ Nano polyme lipid và nano lipid polyme: Là các hệ mang thuốc sử dụng cả polyme và lipid làm giá mang dược chất
➢ Dendrime: Là các đại phân tử có cấu trúc nhánh được tổng hợp với cấu trúc hóa học bao gồm một nhân khởi đầu và nhiều
DẠYKÈMQUYNHƠN OFFICIAL 4
lớp nhánh có các nhóm cuối hoạt động. Cấu trúc đặc biệt này của dendrime cho phép nó có thể mang nhiều loại thuốc khác nhau thông qua các gắn kết hóa trị hoặc được bao gói trong các khoang rỗng của nhân thông qua các tương tác thân dầu, liên kết hydro, hoặc liên kết hóa học. ➢ Liposome: Là một hệ mang thuốc gồm một hay nhiều lớp đồng trục được tạo thành từ các cấu trúc màng lipid kép của các phân tử lipid lưỡng tính tự nhiên hay tổng hợp. 1.3.2. Phân loại dựa trên tương tác giữa tiểu phân nano và hệ sinh học Dựa trên những tương tác giữa tiểu phân nano và hệ sinh học (gọi là tương tác nano-bio) có thể phân loại thành 3 thế hệ nano như sau [12]:
Hình 1.3. Mô phỏng các thế hệ nano [12]



Thế hệ thứ nhất bao gồm các tiểu phân nano cổ điển không cải biến đặc tính bề mặt, không có khả năng tránh thực bào, thời gian tuần hoàn ngắn, được bào chế bằng các nguyên liệu đơn có sẵn nhằm chứng minh khả năng tiềm tàng của 1 hệ đưa thuốc mới như tính tương thích sinh học, khả năng hấp thu bởi tế bào và độc tính.
Thế hệ thứ hai bao gồm các tiểu phân nano có bề mặt được cải biến, với 2 đặc trưng quan trọng: Có tính chất lẩn tránh thực bào và hướng đích thụ động; nhằm cải thiện độ ổn định, tăng thời gian tuần hoàn và tăng tính hướng đích trong các hệ sinh học. Thế hệ thứ ba chuyển mô hình thiết kế từ các tiểu phân nano có tính ổn định cao sang các tiểu phân nano “thông minh”, hướng đích chủ động, sử dụng các tín hiệu sinh học, vật lý, hóa học trong môi trường đích để kích hoạt giải phóng thuốc, nhằm đạt được tác dụng tại đích tối ưu. Bảng 1.1. Đặc trưng và thách thức sinh học của các thế hệ nano [12]
Thiết kế, bào chế dễ
Cải thiện độ tan Tương thích sinh học
Tối đa hóa vận chuyển thuốc
Có tính chất ẩn (thụ động)
Hướng đích bị động là chính
Đáp ứng theo môi trường
Có tính linh động
Thế hệ 1 Thế hệ 2 Thế hệ 3 Đặc trưng
Sử dụng các tín hiệu sinh học hoặc nhân tạo để kích hoạt giải phóng thuốc
Có khả năng chẩn đoán trị liệu
Quá phụ thuộc vào hiệu
ứng lưu giữ và tăng thấm
tăng cường (EPR)
- Không có kháng nguyên chung
Tính hướng đích chủ động không tối đa
Dưới 10% liều thuốc đến
được khối u
DẠYKÈMQUYNHƠN OFFICIAL 5 Thế hệ 1 Thế hệ 2 Thế hệ 3 Đang được xác định
Thách thức sinh học Không ổn định Bị thanh thải bởi hệ đại thực bào đơn nhân (MPS) Tính hướng đích thấp
1.4. THÀNH PHẦN, CẤU TRÚC VÀ ĐẶC ĐIỂM HÒA TAN DƯỢC CHẤT TỪ
TIỂU PHÂN NANO
1.4.1. Thành phần tiểu phân nano
Tùy thuộc vào phương pháp bào chế sử dụng và loại nano thu được, thành phần của tiểu phân nano có thể bao gồm dược chất, chất mang, chất ổn định (chất diện hoạt, chất tăng độ nhớt), dung môi và một số chất cải biến sinh học hoặc hướng đích. Dược chất thường là chất có hoạt tính sinh học mạnh, nhưng độ tan kém. Cũng có trường hợp có thể sử dụng dược chất tan trong nước.
1.4.2. Cấu trúc một số tiểu phân nano
Trong khuôn khổ sách này, chúng tôi chỉ tập trung vào nano polyme, nano lipid và nano tinh thể. Đối với liposome, vi nhũ tương người đọc có thể tham khảo sách tiếng Việt “Kỹ thuật nano và liposome ứng dụng trong dược phẩm, mỹ phẩm” đã xuất bản. Đối với dendrime, người đọc tham khảo tài liệu khác. 1.4.2.1. Nano tinh thể
Nano tinh thể gồm các dược chất rất ít tan trong nước, thường được bào chế ở dưới dạng bột hay hỗn dịch bằng phương pháp giảm kích thước tiểu phân (top down). Các nano tinh thể bao gồm 100% dược chất, không có chất mang. Hỗn dịch nano sau khi phân tán trong môi trường lỏng (như nước, PEG,...) cần được duy trì ổn định bằng chất diện hoạt hoặc các chất ổn định có bản chất polyme. Chúng có thể có cấu trúc kết tinh hoặc vô định hình [80].
1.4.2.2. Nano polyme
Nano polyme là các hệ mang thuốc sử dụng polyme làm giá mang dược chất, có cấu trúc dạng siêu vi nang hay siêu vi cầu. Cấu trúc siêu vi nang là cấu trúc nhân vỏ, cấu trúc siêu vi cầu là cấu trúc dạng cốt, trong đó dược chất phân tán đều trong siêu vi cầu. Thực tế khó phân biệt siêu vi nang hoặc siêu vi cầu. Trong cấu trúc này, dược chất hòa tan hoặc phân tán dạng phân tử hoặc tinh thể nano trong polyme, cũng có thể dược chất liên kết cộng trị với polyme. Các polyme sử dụng bào chế nano polyme gồm các polyme tự nhiên hay tổng hợp. Trong đó có cả các loại phân hủy sinh học, tương hợp với cơ thể sống. Phức hợp dược chất và polyme đã có những tác động lâm sàng đáng kể nhờ việc tăng cường hiệu quả và phân liều của những thuốc đã biết. Tuy nhiên, hiệu suất nano hóa thuốc vẫn còn hạn chế do thiếu vị trí liên hợp trên phân tử polyme và phần lớn thiếu khả năng hướng đích chủ động hoặc kiểm soát khả năng giải phóng dược chất. Để tăng hiệu suất nano hóa thuốc đồng thời kiểm soát việc vận chuyển thuốc theo không gian và thời gian, nhiều nano polyme có khả năng phân hủy sinh học đã được phát triển. Các micell polyme cũng đã thu hút nhiều sự quan tâm do có tiềm năng ứng dụng làm các hệ trị liệu. Các micell polyme có thể hình thành do khả năng tự kết hợp của các polyme lưỡng tính có khả năng kỵ nước khác nhau. Đến nay, một vài hệ micell polyme đã đi đến các giai đoạn khác nhau của thử nghiệm lâm sàng và các hệ này đã chứng tỏ có khả năng lưu giữ tác nhân điều trị tại vị trí đích và làm giảm tác dụng không mong muốn của các tác nhân này.
DẠYKÈMQUYNHƠN OFFICIAL 6
Ngoài ra, việc kết hợp các nano polyme với các phức hợp hướng đích cũng giúp kiểm soát quá trình vận chuyển thuốc theo không gian và thời gian. Điều này có thể làm tăng cường hơn nữa hiệu quả điều trị và giảm tác dụng không mong muốn của chúng. 1.4.2.3. Nano lipid
Nano lipid là các hệ mang thuốc sử dụng các lipid làm giá mang dược chất, có cấu trúc dạng siêu vi nang hay siêu vi cầu. Nano lipid gồm các loại khác nhau, tùy loại tá dược sử dụng.
a. Tiểu phân nano lipid rắn (solid lipid nanoparticles SLN): SLN (gọi tắt là nano lipid rắn) có cấu tạo gồm 2 phần: phần lõi rắn là dược chất hòa tan hoặc phân tán trong môi trường lipid rắn, phần vỏ bao quanh lõi lipid rắn, là lớp chất diện hoạt (đầu sơ nước của phân tử chất diện hoạt gắn với phần lõi lipid, đầu thân nước hướng ra ngoài). SLN được phát triển từ những năm đầu thập niên 90. SLN có thể coi là hệ đưa thuốc nhân tạo so với các hệ đưa thuốc truyền thống như nhũ tương lipid, liposome. SLN kết hợp các ưu điểm và đồng thời cũng khắc phục các nhược điểm của hệ chất mang dạng keo kể trên như độ ổn định, khả năng bảo vệ và dung hợp dược chất, khả năng dung nạp tốt. Đồng thời, SLN cũng giúp cải thiện sinh khả dụng của thuốc, kiểm soát duy trì giải phóng các dược chất [44]. SLN cấu tạo từ 0,1 30% lipid rắn, phân tán trong một dung dịch nước và được ổn định với 0,5 5% chất diện hoạt. SLN có hàm lượng thuốc thường thấp, tuy nhiên có trường hợp lên tới 25%, và có độ ổn định tốt. Ngoài ra, dược chất dễ bị thoát ra khỏi tiểu phân do sự biến đổi vật lý trong quá trình bảo quản. b. Hệ mang lipid cấu trúc nano (nanostructured lipid carriers, NLC): Để khắc phục các nhược điểm của nano lipid rắn (hiện tượng tống thuốc ra ngoài khi lipid kết tinh ở dạng β, tỷ lệ phân tán trong pha nước cao nhất chỉ khoảng 30%), hệ mang lipid cấu trúc nano đã ra đời với việc sử dụng đồng thời cả lipid dạng lỏng phối hợp cùng với lipid dạng rắn. Vì sự khác nhau trong cấu trúc, hai dạng lipid này không thể trộn lẫn hoàn toàn để tạo tinh thể, tạo nhiều khe hở (khoảng giữa các chuỗi acid béo triglycerid) để chứa dược chất bên trong. Có thể phối hợp lipid dạng rắn với lipid dạng lỏng ở tỷ lệ từ 70:30 đến 99,9:0,1. Sự có mặt của lipid lỏng sẽ làm giảm nhiệt độ nóng chảy của hỗn hợp so với lipid rắn. Nồng độ của hệ trong pha phân tán có thể lên đến 95% (cao hơn hẳn so với nano lipid rắn). NLC có cấu tạo gồm một lớp chất diện hoạt bao quanh lõi lipid chứa hỗn hợp lipid rắn lỏng, thường có kích thước 100 500 nm. NLC nano hoá dược chất cao hơn SLN do phần lớn các dược chất có khả năng hòa tan trong lipid lỏng cao hơn dạng rắn. Vì vậy, hệ NLC hạn chế được tình
soát
có
cho các
phóng dượ
có
tăng khi
cho thấy hệ NLC có tỉ lệ giải phóng thuốc
Các thử nghiệm in
và duy trì ổn định kéo dài ở giai đoạn sau, có thể kiểm soát được tỉ lệ giải phóng thuốc bằng cách điều chỉnh nồng độ lipid lỏng trong công thức [58] Dựa vào cấu trúc khung xốp bên trong, NLC được chia làm 3 dạng: dạng kết tinh không hoàn toàn, dạng vô định hình, và dạng nhũ tương kép. Hệ NLC được ứng dụng nhiều trong dược phẩm cũng như mỹ phẩm.
DẠYKÈMQUYNHƠN OFFICIAL 7
trạng đẩy dược chất ra khỏi tiểu phân, kiểm
được tốc độ giải
c chất tốt hơn, và được coi là thế hệ hai của SLN. Ví dụ acid stearic là lipid rắn được kết hợp với lipid lỏng là acid oleic với các tỉ lệ khác nhau để bào chế NLC. NLC
tiểu phân
kích thước nhỏ hơn và bề mặt của các tiểu phân nano có hình dạng cầu hơn so với các công thức SLN chỉ chứa lipid rắn. Hiệu suất nano hóa và tỷ lệ dược chất nano hóa
xu hướng
tăng lượng acid oleic (Fu Qiang Hu và cộng sự, [58]).
vitro
cao ở giai đoạn đầu
c. Hệ liên hợp dược chất và lipid: Hệ liên hợp dược chất lipid được hình thành bằng cách tạo muối (với các acid béo) hoặc tạo các dẫn xuất ester hoặc ether. Sau đó, hệ được nhũ hóa với dung dịch chất diện hoạt thân nước để tạo các tiểu phân nano.
1.4.2.4. Nano polyme-lipid
Nano polyme lipid là hệ mang thuốc kết hợp các ưu điểm của hệ mang thuốc liposome và nano polyme, trong đó các lipid và các polyme được đồng thời sử dụng. Những thành công của nano liposome và polyme đã dẫn đến sự ra đời của tiểu phân nano lai polyme lipid, do vậy cho đến nay, một vài nano polyme lipid đã được phát triển.
Ví dụ như các tiểu phân polyme được bao bởi lipid gồm nhân acid poly (lactic co glycolic) (PLGA), vỏ polyethylen glycol (PEG) và một lớp lipid ở lớp giữa đã được bào chế và đánh giá các đặc tính. Nhân PLGA có thể mang các thuốc ít tan trong nước trong khi vỏ PEG giúp làm giảm khả năng tích tụ sinh học (biofouling) và tăng thời gian tuần hoàn. Lớp lipid nằm ở giữa nhân PLGA và vỏ PEG đóng vai trò như một hàng rào phân tử giúp tăng cường khả năng lưu giữ và kéo dài thời gian giải phóng thuốc từ nhân polyme. Ở một ví dụ khác, nano PLGA bao gói bởi liposome (hay được gọi là tế bào nano “nanocell”) đã được phát triển qua nhiều bước với hướng điều trị ung thư. Trong đó, nhân là phức hợp PLGA-doxorubicin, còn vỏ lipid nhiều lớp chứa tác nhân chống sự tăng sinh combretastatin [100].
Nano lai polyme lipid đã kết hợp được tính toàn vẹn cấu trúc cao, đặc tính dễ điều chỉnh, khả năng dễ cải thiện đặc tính bề mặt của phần polyme và tính tương thích sinh học tuyệt vời, tính sinh miễn dịch thấp, độc tính thấp của phần lipid.
Ở nano lai, các lipid có thể làm chậm sự thấm nước và giảm đáng kể sự phân hủy các nano lai, làm kéo dài quá trình giải phóng dược chất. Ngoài ra, lớp bao lipid bên ngoài lớp polyme mô phỏng giống như giao diện của lớp bề mặt sinh học, trong khi đó các polyme đảm bảo sự ổn định cơ học, giúp dễ điều chỉnh tính chất bề mặt cho các tiểu phân.
1.4.3. Đặc điểm hòa tan dược chất từ tiểu phân nano
Dựa vào cấu trúc và tá dược sử dụng, tiểu phân nano có thể được phân loại gồm nano tinh thể, hệ mang thuốc nano (nano polyme, nano lipid và nano lai polyme lipid/lipid polyme và các loại khác). Mỗi loại tiểu phân nano có tốc độ hòa tan và mức độ hòa tan dược chất khác nhau. Đối với nano polyme, nano lipid và nano lai polyme lipid/lipid polyme , tốc độ và mức độ hòa tan dược chất có thể được kiểm soát khác nhau tùy thuộc vào cấu trúc và tá dược sử dụng. Trong môi trường hòa tan, dược chất phân tử và nano tinh thể khuếch tán ra bên ngoài tiểu phân nano. Quá trình hòa tan tiếp tục xảy ra đối với nano tinh thể. Tốc độ hòa tan dược chất phụ thuộc nhiều
chất phân tử, đồng thời phụ thuộc cả vào quá trình khuếch tán nano tinh thể và tốc độ phân hủy của chất mang. Mức độ hòa tan hay độ tan của dược chất tăng ở các tiểu phân kích thước dưới
trình
DẠYKÈMQUYNHƠN OFFICIAL 8
quá
hòa tan và khuếch tán dược
1000 nm do kích thước tiểu phân dược chất giảm mạnh. Đối với nano tinh thể, việc giảm đến kích thước nano dẫn đến tăng tốc độ và mức độ hòa tan dược chất. Bàn luận dưới đây liên quan đến nano tinh thể. Đối với tốc độ hòa tan, dựa vào phương trình Noyes Whitney ta có: ���� ���� = ��.��.(���� ����) ℎ [1]
Trong đó, dc/dt: tốc độ hòa tan; D: hệ số khuếch tán; h: bề dày của lớp khuếch tán; A: diện tích bề mặt tiếp xúc của các tiểu phân; Cs, Cx: lần lượt là độ tan, nồng độ của chất tan. Hình 1.4. Sự tăng diện tích bề mặt do giảm kích thước tiểu phân [80] Dựa vào phương trình [1] cho thấy, việc giảm kích thước tiểu phân dẫn đến việc


DẠYKÈMQUYNHƠN OFFICIAL 9
tăng diện tích bề mặt sẽ làm tăng tốc độ hòa tan Ngoài ra, tốc độ hòa tan tăng còn do dc/dt tỉ lệ thuận với gradient nồng độ (Cs-Cx)/h (xem hình 1.5) và việc tăng hấp thu theo cơ chế khuếch tán thụ động do tăng gradient nồng độ chất tan giữa thành ruột và trong máu. Hình 1.5. So sánh tinh thể micro (A) và tinh thể nano (B) về độ cong bề mặt và gradient nồng độ của chúng trên khoảng cách khuếch tán (h) (Cs: nồng độ tại bề mặt, A, B: lần lượt là tinh thể micro và tinh thể nano; Cx: nồng độ tại khoảng cách khuếch tán h) [80] Đối với độ tan của dược chất, mối quan hệ giữa kích thước tiểu phân và độ tan phức tạp hơn. Độ tan của dược chất phụ thuộc vào đặc tính lý hóa của dược chất, môi trường hòa tan, nhiệt độ và áp suất. Nhưng điều này chỉ đúng với tiểu phân dược chất có kích thước micron trở lên. Với tiểu phân dược chất kích thước dưới 1 μm, độ tan phụ thuộc vào kích thước tiểu phân (KTTP), độ tan dược chất được giải thích theo phương trình Ostwald Freundlich như sau [62]: ������ ���� ���� = 2���� 2,303�������� [2]
Trong đó: Cs là độ tan của tiểu phân kích thước nhỏ (dưới 1000 nm), Cα: độ tan của tiểu phân kích thước micron trở lên, σ: sức căng bề mặt; V là thể tích mol, R là hằng số khí, T là nhiệt độ tuyệt đối; ρ là tỷ trọng tiểu phân, r là bán kính tiểu phân.
Theo phương trình [2], độ tan của dược chất tăng khi KTTP giảm. Cần nhấn mạnh là điều này chỉ áp
Ngoài
NANO Đặc điểm dược động học của tiểu phân nano từ các dạng thuốc khác nhau bao gồm hấp thu, phân bố, chuyển hóa và thải trừ có thể có sự thay đổi khác biệt so với dạng thuốc truyền thống chứa dược chất không ở dạng nano hóa.
1.5.1. Đặc điểm sinh dược học chung của các tiểu phân nano Như đã đề cập trong phần phân loại, có rất nhiều dạng thuốc chứa tinh thể nano hoặc hệ mang thuốc nano. Trong hệ mang thuốc nano, dược chất được bao gói trong các chất mang nhưdendrime, liposome, nano polyme, nano lipid, nano lai lipid polyme/polyme lipid. Hệ mang thuốc nano thường có nhiều ưu điểm như khả năng vận chuyển thuốc đặc hiệu, độ ổn định cao, khả năng thấm qua màng sinh học cao, sinh khả dụng được tăng cường, và tác dụng kéo dài (Bảng 1.2). Bằng cách thay đổi các đặc tính sinh dược học của các chất tiềm năng dùng làm thuốc mới, việc bào chế các dạng thuốc chứa hệ mang thuốc nano có thể là một giải pháp hứa hẹn để giữ vững các đặc tính của thuốc. Các đặc tính lý hóa của các tiểu phân nano như KTTP, điện thế bề mặt và khả năng thân dầu sẽ ảnh hưởng đến đặc tính hấp thu qua màng sinh học của chúng. Các tiểu phân nano có kích thước nhỏ thường có khả năng hấp thu thông qua các nang của biểu mô cao hơn so với các tiểu phân có kích thước lớn. Các tiểu phân nano có thể đi vào tế bào thông qua quá trình nội thực bào như nhập bào qua trung gian caveola và clathrin, ẩm bào. Ngược lại, các tiểu phân lớn hơn có thể bị opsonin hóa nhanh (các
bám dính vào vật ngoại lai hay tế bào giúp chúng dễ bị nhận diện bởi quá
loại khỏi hệ tuần hoàn thông qua các đại thực bào của hệ lưới nội mô.
DẠYKÈMQUYNHƠN OFFICIAL 10
dụng với các tiểu phân nhỏ hơn 1 2μm, đặc biệt tiểu phân kích thước nhỏ hơn 200 nm [62].
ra, đối với dạng nano tinh thể, dược chất có thể ở trạng thái vô định hình. Trạng thái vô định hình có nhiều ưu điểm như độ tan lớn hơn so với dược chất ở dạng kết tinh. Vì thế, các nano tinh thể dược chất ở dạng vô định hình sẽ có độ tan lớn hơn so với các nano tinh thể dạng kết tinh có cùng kích thước. Do đó, để đạt được độ tan lớn nhất, việc kết hợp được đồng thời kích thước nano và dạng vô định hình là điều vô cùng lý tưởng. Tuy nhiên, để có thể ứng dụng trong ngành dược, điều tiên quyết đó là cần phải duy trì được trạng thái vô định hình của dược chất trong suốt thời hạn sử dụng của sản phẩm. 1.5. MỘT SỐ ĐẶC ĐIỂM SINH DƯỢC HỌC VÀ DƯỢC ĐỘNG HỌC CỦA TIỂU PHÂN
protein có khả năng
trình thực bào) và
Bảng 1.2. Đặc điểm sinh dược học của một số dạng thuốc có kích thước nano [86]
Dạng thuốc nano Đặc điểm sinh dược học
Dendrime
Ưu điểm:
Khả năng thấm qua màng cao
Kiểm soát giải phóng
Khả năng vận chuyển thuốc đặc hiệu
- Làm tăng độ tan của dược chất
Nhược điểm:
Hạn chế đường sử dụng
Nano tinh thể Ưu điểm
Tăng tác dụng toàn thân
Khả năng lưu giữ cao ở lớp màng nhầy
Thích hợp nhiều đường dùng khác nhau
Nhược điểm
Khả năng duy trì giải phóng thấp
Nano lipid Ưu điểm
Khả năng phân hủy sinh học và được chuyển hóa nhờ các men như lipase, esterase.
Tác dụng toàn thân kéo dài
Khả năng vận chuyển thuốc đặc hiệu
Khả năng tích lũy tại các khối u Nhược điểm
Đào thải nhanh bởi hệ lưới nội mô (RES)
Hạn chế đường sử dụng
Micell
Ưu điểm
Khả năng thấm qua màng cao
- Làm tăng độ tan của dược chất
Tăng tác dụng toàn thân Nhược điểm
Khả năng duy trì giải phóng thấp
Nano polyme Ưu điểm
Quá trình giải phóng in vivo ổn định
Tác dụng kéo dài Nhược điểm
Cần hạn chế khả năng giải phóng ồ ạt ban đầu
Hạn chế đường sử dụng
Trong việc thiết kế công thức của tiểu phân nano, cần thiết làm giảm thiểu khả năng opsonin hóa và kéo dài thời gian tuần hoàn của các tiểu phân nano. Điều này có thể đạt được bằng cách bao bề mặt của tiểu phân nano bằng các polyme hoặc chất diện hoạt thân nước và/hoặc thiết kế công thức tiểu phân nano với các đồng polyme phân hủy sinh học có thêm các phần thân nước như polyethylen glycol, poloxame, poloxamin và polysorbat [86]
DẠYKÈMQUYNHƠN OFFICIAL 11
Các tiểu phân nano có điện thế bề mặt dương có thể tương tác với điện thế âm của mucin do chứa các hợp phần acid sialic và đường, dẫn đến việc tăng cường quá trình vận chuyển qua màng tế bào và quá trình nội bào nhờ các tế bào biểu mô.
Việc “chức năng hóa” bề mặt tiểu phân nano với các chất tăng cường tính thấm qua màng hoặc các phức hợp có khả năng gắn kết với các thụ thể trên màng tế bào có thể thúc đẩy khả năng vận chuyển qua màng tế bào của các thuốc được bao gói. Ngoài khả năng vận chuyển qua màng tế bào, các thuốc kích thước nano được bao gói hay liên kết với các polyme bám dính sinh học hoặc các chất tạo phức chelat có thể giúp tăng cường khả năng vận chuyển liên bào của các thuốc thông qua việc điều hòa các khe hở hẹp giữa các tế bào. Việc cải biến bề mặt (surface modification) của các tiểu phân nano với các protein đặc hiệu, các kháng thể và các phân tử sinh học khác có thể được sử dụng để thiết kế các thuốc có tác dụng chọn lọc trên các mô cụ thể. Ngoài ra, cũng có thể sử dụng các thành phần trong công thức có khả năng nhạy cảm với các tín hiệu vi môi trường bên trong (như nhạy cảm với pH, nhạy cảm với enzym) hay các tín hiệu ngoại cảnh (như từ trường, ánh sáng). Các giải pháp này giúp tăng cường khả năng điều trị và giảm tác dụng không mong muốn của các thuốc điều trị ung thư vốn là các thuốc độc tế bào thường có cửa sổ điều trị hẹp [5], [86]
Quá trình chuyển hóa dược chất từtiểu phân nano và chuyển hóa bản thân tiểu phân nano tương đối phức tạp so với quá trình chuyển hóa các phân tử dược chất vì sự khác nhau trong cấu trúc của nó. Ví dụ như các tiểu phân nano có thể bao gồm các phối tử trên bề mặt như PEG hay các chuỗi acid amin dạng L, hoặc chúng có thể bao gồm các kim loại, carbon, các polyme bên trong nhân.
Khi các tiểu phân nano đi đến gan để được chuyển hóa thì các phối tử liên kết với các tiểu phân này sẽ được chuyển hóa cùng. Tuy nhiên, con đường chuyển hóa chính xác của chúng vẫn còn chưa được biết. Nhiều quá trình chuyển hóa khác nhau có thể xảy ra đối với từng loại tiểu phân nano khác nhau, do vậy, việc hiểu biết đầy đủ về các cơ chế này đóng vai trò quan trọng trong việc phát triển công thức cũng như đảm bảo độ an toàn của sản phẩm [47].
Đối với quá trình thải trừ, cơ quan thải trừ chính là thận, tuy nhiên, quá trình thải trừ còn có thể xảy ra qua đường mật, mồ hôi, nước bọt, không khí thở hoặc sữa. Các đặc tính của tiểu phân nano thường được tối ưu để đào thải tiểu phân nano khỏi cơ thể mà không gây bất cứ một độc tính nào, các đặc tính này bao gồm chất mang, KTTP, hình dạng, điện thế và hóa học bề mặt. Các tiểu phân nano có kích thước dưới 8 nm thường chịu quá trình đào thải qua thận và bài tiết qua nước tiểu. Trong khi đó, khả năng lọc qua thận giảm do có liên quan đến sự hấp phụ các protein huyết tương trên bề mặt các tiểu phân
phân còn được đào thải ở gan thông qua quá trình bài tiết mật
trừ qua phân. Các đại thực bào Kupffer trong hệ lưới nội mô sẽ bắt giữ các tiểu phân không mong muốn trong máu và là vị trí chính của quá trình chuyển hóa. Hoặc các tiểu phân cũng có thể bị dị hóa thông qua các tế bào gan. Từ đó, các tiểu phân bị giữ bởi các tế bào gan sẽ đi vào mật và bị bắt giữ bởi các tế bào Kupffer, sẽ chịu quá trình phân hủy bởi tế bào. Các tiểu phân chịu sự thải trừ qua gan thường có kích thước từ 10 20 nm. Đồng thời, quá trình đào thải các tiểu phân cũng có thể được thực hiện qua trung gian hệ thống bổ thể như các protein opsonin, giúp tăng cường sự bắt giữ ở gan [47]
và
DẠYKÈMQUYNHƠN OFFICIAL 12
nano mang điện tích hoặc do có sự tương tác với thành phần tích điện trên thành mao mạch của cầu thận. Ngoài quá trình thải trừ ở thận, một số tiểu
vào đường ruột
thải
1.5.2. Đặc điểm dược động học tiểu phân nano dùng theo đường uống Tiểu phân nano có trong các dạng thuốc dùng theo đường uống thường là nano tinh thể, cũng có thể là các tiểu phân nano khác. Đối với các dạng thuốc chứa các tiểu phân nano dùng theo đường uống, sinh khả dụng thường tăng, ổn định không phụ thuộc vào bữa ăn và thể hiện dược động học
phân tử, phân tử dược chất được phân bố, chuyển hóa và thải trừ tương tự dược chất hấp thu từ thuốc uống chứa dược chất kích thước micron. Cụ thể, đối với thuốc dùng đường uống, quá trình hấp thu qua lớp biểu mô của đường ruột có thể diễn ra theo hai cơ chế sau:
+ Con đường liên bào: Các tiểu phân có kích thước dưới 1 nm có thể không đi qua theo con đường này bởi vì các khe hở hẹp giữa các tế bào biểu mô. Tuy nhiên, các khe hở liên bào này có thể mở thuận nghịch đủ lớn để cho các tiểu phân nano đi qua bằng cách dùng các chất tăng cường sự hấp thu bao gồm các polyme ion dương hay ion âm và các phức chelat calci như chitosan, acid polyacrylic và acid ethylenediaminetetraacetic (EDTA). Nếu chúng có kích thước lớn hơn 20 nm, các tiểu phân nano cần phải rã ra đủ nhỏ để giải phóng thuốc và đi qua các khe hở này [47].
+ Con đường xuyên bào: Các tiểu phân nano có thể tránh quá trình chuyển hóa qua gan lần đầu, theo cơ chế này, chúng có thể đi qua các tế bào đường ruột hoặc tế bào M của mảng Peyer (Peyer’s patches). Sự vận chuyển này đạt được bằng quá trình thực bào (phagocytosis), quá trình đại ẩm bào (marcopinocytosis), nội thực bào qua trung gian của clathrin hay caveola [47]. Các tiểu phân có kích thước dưới 200 nm có thể bị nội thực bào qua trung gian của clathrin, trong khi đó, các tiểu phân có kích thước lớn hơn có thể bị bắt giữ bởi các túi caveola. Một số con đường thực bào khác vẫn đang được tiếp tục tìm hiểu và hiện vẫn chưa được phân loại rõ ràng [98] Quá trình hấp thu thuốc qua đường tiêu hóa vào vòng tuần hoàn chung phụ thuộc
các khối u, tích lũy và giải phóng thuốc vào các khối u. Như đã đề cập, các yếu tố như KTTP, thế zeta, các phối tử hướng đích, thành phần công thức đóng
các tiểu phân nano trong cơ thể. Ngoài ra, các quá trình khác
khe hở của niêm mạc, hiện tượng tăng tính thấm và lưu
cũng ảnh hưởng đến sự phân bố của các tiểu phân
DẠYKÈMQUYNHƠN OFFICIAL 13
tuyến tính ví dụ như Lipanthyl Supra NT 145mg (chứa nano tinh thể fenofibrat). Quá trình hấp thu tăng do mức độ và tốc độ hòa tan dược chất tăng. Đặc biệt, kích thước nano có thể làm tăng tính thấm của dược chất qua thành ruột do tiểu phân kích thước dưới 100 nm có thể được hấp thu qua khe kẽ liên bào, các tiểu phân nano kích thước vài nm, có thể đi qua các kênh nước (water channel). Các tiểu phân nano còn có thể bảo vệ dược chất khỏi điều kiện bất lợi trong đường tiêu hóa, do vậy làm giảm sự phân hủy dược chất. Việc này cũng làm tăng hấp thu dược chất. Khi tuần hoàn trong máu dưới dạng
vào nhiều yếu tố như KTTP, điện tích bề mặt, độ ổn định của tiểu phân nano, thời gian lưu của tiểu phân nano tại vị trí hấp thu và các thành phần trong đường tiêu hóa [47]. Để thuốc tạo ra được hiệu quả và thực hiện mục đích của nó thì thuốc cần đến được vị trí tác dụng. Để thực hiện được điều này, thuốc cần đi qua được các hàng rào sinh lý như các hàng rào của tế bào, thể dịch và màng nhầy. Do đó, việc dùng các tiểu phân nhỏ có kích thước nano có thể tăng cường việc đưa thuốc vào tế bào và khả năng ẩm bào, cũng như xâm nhập vào
vai trò quan trọng trong việc phân bố
như quá trình opsonin hóa, khả năng đi qua
giữ (EPR Enhanced permiability and retention)
nano [47]
1.5.3. Đặc điểm dược động học tiểu phân nano dùng theo đường tiêm
Hỗn dịch tiểu phân nano dùng theo đường tiêm là hỗn dịch của nano tinh thể và hỗn dịch hệ mang thuốc nano. Tất cả các tiểu phân nano đều có thể dùng theo đường tiêm nếu đáp ứng được các yêu cầu của thuốc tiêm. Hỗn dịch nano có thể được tiêm bắp, tiêm dưới da, trong phúc mạc ruột hay tiêm tĩnh mạch.
Sau khi tiêm tĩnh mạch, tiểu phân nano trực tiếp tuần hoàn trong máu, sự phân bố của tiểu phân có thể xảy ra theo hai hướng là thanh thải bằng thực bào và phân bố đến cơ quan, tổ chức [6], [98]: Thanh thải bằng thực bào: Hệ thống thực bào trong cơ thể coi tiểu phân như một vật thể lạ và tiến hành thanh thải theo cơ chế bảo vệ của cơ thể. Sau khi thực bào, tiểu phân được đưa về gan, lách… Như vậy, có thể lợi dụng cơ chế thực bào để chủ động đưa thuốc tới gan, lách, phổi…và tăng cường ái lực với thụ thể trên thực bào đơn nhân bằng các phối tử có ái lực. Mặt khác, tổ chức u, viêm là những nơi có quá trình thực bào xảy ra mạnh nhất, trở thành cơ quan đích của tiểu phân. Để tránh thực bào, tăng cường phân bố đến các tổ chức cần phải:
• Ngụy trang tiểu phân nhằm tránh sự nhận diện của tế bào lympho: bao tiểu phân với các polyme thân nước như PEG, khi đó PEG liên kết đồng hóa trị với các tiểu phân như nano albumin, nano PLGA…
• Biến tính bề mặt tiểu phân để ngăn cản quá trình thực bào: tạo ra cấu trúc cồng kềnh hoặc bao chất diện hoạt.
• Bao tiểu phân bằng các tác nhân phân giải màng lysosome. Phân bố đến cơ quan, tổ chức: Các tiểu phân không bị thực bào, dễ dàng đi qua thành mạch mao quản để phân bố tiếp đến các cơ quan, tổ chức trong cơ thể đặc biệt là các tổ chức u, viêm do tính thấm tăng lên. Sau khi qua thành mạch, tùy theo cấu trúc và kích thước, tiểu phân nano được phân bố ở 3 mức độ khác nhau:
• Tới cơ quan đích: G
hỗn dịch tiểu phân nano được hấp thu vào máu dưới dạng phân tử và tiểu phân nano. Quá trình phân bố tiểu phân nano theo hướng trên. Thời gian lưu của tiểu phân nano, đặc biệt tiểu phân nano có cấu trúc đặc biệt, khác xa với phân tử thuốc khi tuần hoàn trong máu. Từ cấu trúc của hệ mang thuốc nano, phân tử dược chất được giải phóng và tham gia vào vòng tuần hoàn, phân bố, chuyển hóa thải trừ tương tự như phân tử dược chất được hấp thu từ các dạng thuốc thường quy. Đồng thời, bản thân tiểu phân nano được
DẠYKÈMQUYNHƠN OFFICIAL 14
an, lách, phổi… • Tới nhóm tế bào đặc biệt (viêm, ung thư, đại thực bào…) • Tới nội bào: Do có kích thước ở mức độ phân tử hoặc kích thước nhỏ hơn khe hở liên bào và nhiều liên kết lỏng lẻo trên màng tế bào, nên tiểu phân nano có khả năng xuyên qua màng tế bào vào nội bào. Nếu kích thước lớn hơn, hệ được vận chuyển bằng cơ chế thực bào hoặc tương hợp với màng tế bào. Sau khi tiêm bắp, tiêm dưới da hay trong phúc mạc ruột,
vận chuyển, phân bố đến các mô nếu không bị nhận diện bưởi hệ thống đại thực bào đơn nhân. Tại các mô, tiểu phân nano có thể giải phóng dược chất gây tác dụng sinh học.
1.5.4. Đặc điểm dược động học tiểu phân nano dùng theo đường khác
Đối với đường phổi, khả năng đưa các tiểu phân vào đường hô hấp phụ thuộc vào đường kính khí động học trung bình khối lượng (MMAD a mass median aerodynamic diameter) của các tiểu phân được hít vào và khả năng khuếch tán của chúng vào toàn bộ đường hô hấp bắt đầu từ mũi đến các phế nang. Các tiểu phân sẽ bị làm ẩm và tương tác với bề mặt bên trong của phổi để đi qua phổi vào hệ bạch huyết thông qua sự bắt giữ bởi các đại thực bào và vào tuần hoàn chung để đi đến các cơ quan khác. Ngoài ra, quá trình hấp thu còn phụ thuộc vào các đặc tính lý hóa khác của tiểu phân và đặc tính giải phẫu của đường hô hấp [47].
























Quá trình vận chuyển thuốc qua da giúp đưa các thành phần có tác dụng trị liệu qua da và vào tuần hoàn chung. Các tiểu phân nano cũng hiện đang được sử dụng để điều trị các bệnh ngoài da, giúp tăng cường khả năng lưu giữ và kiểm soát giải phóng của dược chất. Các tiểu phân này có khả năng đi qua lớp sừng rào cản thông qua các con đường như qua tuyến mồ hôi, lỗ chân lông, hoặc đi vào trong tế bào (đối với các tiểu phân nhỏ). Khả năng thấm của các tiểu phân qua da phụ thuộc vào một số yếu tố như KTTP, đặc tính bề mặt của tiểu phân, nhiệt độ bề mặt da, lượng mồ hôi,... [47].
Ngoài ra, một số đặc điểm dược động học của các tiểu phân nano qua các đường dùng khác nhau còn được trình bày trong các phần tiếp theo.
1.6. VAI TRÒ CỦA CÔNG NGHỆ NANO TRONG DƯỢC PH
có thể tóm tắt qua sơ đồ dưới đây:
DẠYKÈMQUYNHƠN OFFICIAL 15
ẨM Vai trò của công nghệ nano trong dược phẩm
Hình 1.6. Vai trò của công nghệ nano trong dược phẩm 1.6.1. Vận chuyển thuốc Tiểu phân nano có thể ứng dụng trong vận chuyển thuốc nhằm: Nâng cao hiệu quả điều trị và giảm tác dụng bất lợi. Kỹ thuật mô Vận chuyển thuốc Chuẩn đoán hình ảnh Cảm biến sinh học Phát triển thuốc Điều trị tại đích Gene trị liệu Công nghệ nano
Tạo ra các phép điều trị mới. Phục vụ công tác nghiên cứu các hoạt chất có khả năng làm thuốc mà chưa được nghiên cứu đầy đủ.
Ví dụ: Abrego và cộng sự đã bào chế nano PLGA chứa pranoprofen dùng cho nhãn khoa dưới dạng hydrogel. Công thức hydrogel chứa pranoprofen có các đặc tính thể chất và hóa lý phù hợp để dùng trong nhãn khoa. Ngoài ra, nó còn giúp tăng cường các tác dụng chống viêm và giảm đau của
thủ của bệnh nhân
phân phối thuốc mới nhằm khắc phục những hạn chế của các dược chất và dạng thuốc truyền thống trong điều trị các bệnh khó điều trị như ung thư, HIV, bệnh về gen,… [6], [73] Ứng dụng công nghệ nano để điều trị bệnh ung thư là một bước tiến trong ngành dược, do việc tăng sinh khả dụng và đưa thuốc tới đích. Bệnh ung thư là một thách thức của y học cho đến ngày nay. Bất chấp những nỗ lực và nhiều tiến bộ trong suốt 30 năm qua, việc kiểm soát bệnh ung thư vẫn còn những hạn chế. Các hóa chất mới thường bị hạn chế sử dụng do độc tính cao hoặc do hiệu quả thấp. Do vậy, việc tăng nồng độ thuốc tại tế bào ung thư và quá trình phân phối thuốc sẽ tiếp tục đóng vai trò quan trọng trong việc
DẠYKÈMQUYNHƠN OFFICIAL 16
thuốc, do đó có thể góp phần nâng cao sự tuân
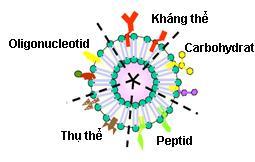
[10] 1.6.2. Điều trị tại đích Việc đưa thuốc tới tổ chức bị bệnh được thực hiện bằng cách sử dụng các hợp phần có khả năng hướng đích như: o Kháng thể Các phần tử mang điện tích o Protein Polysaccharid o Lipoprotein Các phối tử có khối lượng phân tử thấp o Hormon Hình 1.7. Minh họa cấu trúc tiểu phân nano với các hợp phần có khả năng hướng đích Trong đó, các nhóm thuốc thường được ưu tiên trong nghiên cứu để tăng cường tác dụng điều trị tại đích bao gồm: Điều trị ung thư, điều trị tiểu đường, điều trị HIV AIDS, thuốc vào hàng rào máu não, thuốc cần lưu giữ trên niêm mạc mắt, da và đại tràng... 1.6.2.1. Điều trị bệnh ung thư Cùng với sự phát triển của các ngành khoa học khác, trong vài thập kỷ qua, ngành Dược trên thế giới đã vận dụng những thành quả của khoa học nano nói chung vào lĩnh vực nghiên cứu phát triển các dạng thuốc mới, từ đó tạo ra cuộc cách mạng cho ra đời các hệ
tạo ra những tác nhân an toàn và hiệu quả. Việc phân phối thuốc có thể được điều chỉnh bằng cách thay đổi đường sử dụng hoặc thay đổi thiết kế công thức thuốc [73].
Trong công nghệ dược phẩm, công nghệ nano đã được ứng dụng để làm tăng khả năng hấp thu của thuốc qua đó làm tăng hiệu quả điều trị. Các tiểu phân nano có thể giải phóng thuốc tại đích tác dụng với liều lượng và khoảng thời gian như dự kiến, đặc biệt với các tế bào khối u, kết quả là làm tăng hiệu quả điều trị và giảm thiểu độc tính cho cơ thể người bệnh [38], [46]
Việc thiết kế hệ mang thuốc nano thường được dựa trên các đặc điểm sinh học của khối u. Ba đặc điểm sinh học của khối u được sử dụng làm căn cứ cho việc thiết kế tiểu phân nano chứa các thuốc chống ung thư định hướng đến các khối u đích, bao gồm [73], [91]: Cấu trúc bất thường của lớp lót nội mạc của các mạch máu đi qua khối u dẫn đến hiệu ứng tăng tính thấm và lưu giữ (EPR enhanced permeability and retention).
- Vi môi trường khác biệt ở khối u như: pH ngoại bào của khối u thấp hơn cho phép phân phối thuốc từ các tiểu phân nano tại pH thấp hoặc định hướng các khối u đích của các thuốc có nhạy cảm với acid; thân nhiệt cao cục bộ,…
- Các kháng nguyên đặc hiệu của khối u giúp định hướng các tiểu phân nano thuốc đến các tế bào khối u có bộc lộ các kháng nguyên này. Hiệu ứng tăng tính thấm và lưu giữ Sự phát triển nhanh của các khối u rắn tiến triển cùng với sự tăng sinh quá mức của chúng, hai quá trình này được điều khiển bởi một hệ thống phức tạp các yếu tố tiết ra bởi các tế bào khối u. Dấu hiệu phân biệt của quá trình tưới mao mạch và sự dẫn lưu của khối u là sự không lành lặn của lớp nội mạc mao mạch và sự giảm dẫn lưu bạch huyết.
Trái ngược với mao mạch của các mô bình thường, mao mạch của khối u bất thường ở hình dạng và cấu trúc; mao mạch mới thiếu lớp cơ mềm mại hay cứng cáp do đó chúng có các khoang rộng hơn và dễ bị rò rỉ và khúc khuỷu. Một trong những chức năng chính của hệ bạch huyết đó là cung cấp con đường để loại bỏ các protein và tiểu phân ngoài mao mạch, bạch cầu. Trong khi đó, các khối u như trên lại ít có dòng chảy bạch huyết đi qua hơn do áp suất ở bên trong nhân khối u cao hơn áp
bình thường kép của mao mạch bị rò rỉ và sự giảm dẫn lưu của hạch bạch
hiệu
DẠYKÈMQUYNHƠN OFFICIAL 17
suất ở ngoại biên. Sự bất
huyết dẫn đến
ứng EPR hay hiệu ứng ở đó các đại phân tử kích thước dưới micromét như protein hay hệ mang thuốc nano dễ dàng tích tụ và lưu giữ tại vùng khối u [73], [91] Hiệu ứng EPR có bốn điểm đặc trưng chủ yếu bao gồm: Phụ thuộc vào kích thước của phân tử hay tiểu phân; là kiểu hướng đích thụ động; có độ chọn lọc kém; bị ảnh hưởng bởi thời gian tuần hoàn của hệ mang thuốc, với thời gian tuần hoàn kéo dài sẽ làm tăng khả năng phân phối thuốc đến khối u đích. Khe hở liên bào thành mạch khối u được ước tính cỡ khoảng từ 400 600 nm (hay 300 700 nm [6], thậm chí từ 100 nm-2 μm tùy thuộc loại khối u [91]. Hiệu ứng EPR xảy ra đối với bất kỳ một đại phân tử có khả năng tương thích sinh học nào lớn hơn 40kDa và thậm chí lớn hơn 800kDa hoặc lớn như vi khuẩn. Các hệ mang thuốc như micell, liposome, nhũ tương nano, nano polyme, nano lipid và dendrime chứa các thuốc ung thư với kích thước tiểu phân trung bình khoảng 200nm
hay nhỏ hơn là điều kiện lý tưởng đối với hiệu ứng EPR. Thông qua quá trình này, nồng độ thuốc trong khối u tăng lên so với nồng độ thuốc trong các mô khỏe mạnh. Sự khác biệt về hiệu ứng EPR được ghi lại thông qua tỉ lệ giữa nồng độ thuốc trong khối u so với trong máu, bình thường từ 10 30, tuy nhiên có trường hợp có thể lên đến 2000. Việc thay đổi đặc tính bề mặt của tiểu phân nano như gắn các chuỗi polyme trung tính như PEG có thể làm tăng thời gian tuần hoàn trong máu của các tiểu phân nano, từ đó gia tăng sự tích tụ của chúng trong các khối u thông qua hiệu ứng EPR.
Cuối cùng, một vài yếu tố sinh lý học bệnh học có thể làm tăng hiệu ứng EPR bao gồm oxyd nitric, một vài prostaglandin và TNF. Ngoài ra, bệnh tăng huyết áp do angiotensin II và nitroglycerin có thể được sử dụng để làm tăng hiệu ứng EPR.
Vi môi trường xung quanh khối u Quá trình phân chia một cách nhanh chóng của các tế bào ung thư đòi hỏi một tốc độ chuyển hóa cao. pH của các mô bệnh lý như các khu vực quanh vị trí viêm, nhiễm trùng, nhồi máu và ung thư khác biệt so với pH tại các mô thường. Ở mô thường, pH giữ giá trị hằng định bằng 7,4 như pH của máu trong khi pH nội bào bằng 7,2. Ngược lại, ở phần lớn các khối u, sự chênh lệch giá trị pH này bị đảo ngược (pHngoại bào < pHnội bào), với giá trị pH ngoại bào ở khối u thấp hơn giá trị tương ứng ở mô thường. Mặc dù giá trị pH ngoại bào có thể thay đổi phụ thuộc thể tích, loại và đặc tính khối u (như di căn hay không di căn), trong hơn 80% trường hợp, giá trị này thường nhỏ hơn 7,2. Thực tế trong một số vùng khối u, giá trị pHngoại bào có thể thấp đến 6,5. Điều này có liên quan đến quá trình thủy phân glucose nhằm duy trì đủ chất dinh dưỡng và oxy ở các khối u dẫn đến môi trường hơi acid của chúng [91].
Sự khác nhau của giá trị pHngoại bào giữa mô thường và mô của khối u tạo cơ hội để đưa thuốc đến các khối u đích bằng cách sử dụng các thuốc chống ung thư hoặc hệ mang thuốc nhạy cảm với vùng pH thấp. Sự chênh lệch giá trị pH bị đảo ngược của khối u tạo điều kiện giúp tích tụ các thuốc có tính acid nhẹ. Dưới điều kiện acid nhẹ, thuốc sẽ tích tụ trong khối u vì những hệ mang thuốc sẽ tăng cường sự giải phóng thuốc từ các hệ liên kết hoặc bề mặt của chúng sẽ không bền và các chuỗi polyme tách ra, dẫn đến sự tích tụ chọn lọc của thuốc tại các khối u. Các liên kết nhạy cảm với pH càng làm tăng cường sự mất ổn định của chúng tại vùng pH thấp như các liên kết orthoeste hay acylhydrazon. Ngoài ra, hiện tượng thân nhiệt cao có liên quan đến nhiều trường hợp bệnh lý như ung thư buồng trứng
tồn tại của chúng.
chuỗi
DẠYKÈMQUYNHƠN OFFICIAL 18
ở người. Các hệ polyme nhạy cảm với nhiệt chứa các polyme có nhiệt độ dung dịch tới hạn thấp (LCST Low critical solution temperature) và chúng sẽ có khuynh hướng kết tụ lại khi nhiệt độ lớn hơn LCST ở trong khối u với sự giải phóng đồng thời lượng thuốc bao gói. Sự quá nhiệt cục bộ tại khối u có thể được thực hiện bằng cách siêu âm hoặc biện pháp nhiệt quang [91] Hơn thế nữa, các tế bào ung thư có thể tiết ra và giải phóng các men riêng biệt như các men matrix metalloproteinase (MMPs) liên quan đến sự di chuyển và cơ chế
Như trường hợp của dạng gắn với albumin của doxorubicin liên hợp với một
octapeptid đặc hiệu MMP-2 giữa thuốc và chất mang được quan sát thấy rằng bị cắt đứt một cách hiệu quả và đặc hiệu trong một nghiên cứu in vitro [91].
Quá trình hướng đích thụ động còn có thể sử dụng đặc điểm bề mặt của nano như điện tích để hướng đích đến các khối u. Các tế bào ung thư có đặc tính điện tích bề mặt âm tương đối cao hơn tế bào bình thường, do đó tạo điều kiện cho các tiểu phân nano tích điện dương có khả năng gắn vào. Khả năng hướng đích của các tiểu phân nano tích điện dương có thể đạt được bằng tương tác tĩnh điện với các nhóm phospholipid tích điện âm được bộc lộ ở tế bào biểu mô của khối u. Và độc tính tế bào của nano polyme phụ thuộc nhiều vào quá trình nội bào và quá trình khu trú bên trong tế bào của các tiểu phân nano, điều này bị chi phối bởi bản chất tích điện bề mặt của các tiểu phân. Ví dụ, các tiểu phân nano tích điện dương được tìm thấy có hiệu quả trong việc vận chuyển ARN can thiệp (siRNA) để ức chế gen mục tiêu trong tế bào ung thư đồng thời cũng làm tăng nhạy cảm của các tế bào ung thư đối với paclitaxel từ đó làm tăng cường hoạt tính chống ung thư [91] Các kháng nguyên đặc hiệu của khối u
Sau khi đi vào hệ tuần hoàn, chỉ một phần nhỏ thuốc được đưa đến vị trí khối u. Việc bao gói các hóa chất trị ung thư vào các hệ mang thuốc giúp làm tăng phần trăm thuốc tại vị trí khối u và giảm độc tính đối với các mô khỏe thông qua hiệu ứng EPR.
Năm 1975, các kháng thể đơn dòng đã được tìm thấy có khả năng gắn với các kháng nguyên đặc hiệu của khối u. Kể từ đó, một số điều trị ung thư hướng đích sử dụng kháng thể đã được chấp nhận bởi cơ quan quản lý dược phẩm và thực phẩm Mỹ (FDA). Khi các kháng thể này có thể phân biệt được tế bào thường và tế bào ung thư, chúng có thể được đưa vào các hệ mang thuốc để tăng tính chọn lọc và hướng đích tế bào.
Việc hướng đích thông qua hiệu ứng EPR có thể được tăng cường bằng cách kết hợp các phối tử bề mặt như kháng thể đơn dòng, peptid và protein vào các tiểu phân nano để đạt được tác dụng hướng đích.

Tương tự, các thụ thể được tiết quá mức ở các tế bào khối u như transferin và folat cùng với hiệu ứng EPR có thể làm tăng khả năng đưa tiểu phân nano vào trong tế bào đích và làm tăng nồng độ thuốc nội bào. Cơ chế đưa thuốc vào nội bào của transferin đều tương tự đối với tế bào thường và tế bào ung thư. Tuy nhiên, tế bào ung thư bộc lộ nhiều thụ thể transferin nhiều hơn so với tế bào thường, dẫn đến sự tích tụ thuốc vào trong tế bào của khối u cao hơn.
kết đa hóa trị với bề mặt của các tế bào có nhiều thụ thể của các tiểu phân nano có nhiều phối tử hướng đích [33]
DẠYKÈMQUYNHƠN OFFICIAL 19
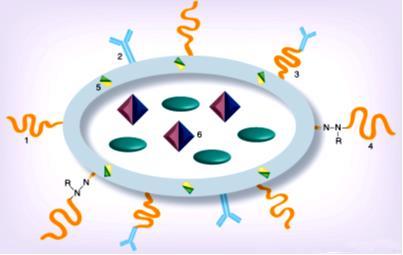
Hình 1.8. Khả năng gắn
Một hướng khác để hướng đích các transferin là dùng các kháng thể có khả năng gắn với các thụ thể của transferin. Tương tự, các thụ thể folat cũng được sử dụng để hướng đích các tiểu phân nano vào tế bào khối u. Acid folic được kết hợp với thuốc hoặc được gắn trên bề mặt của hệ mang thuốc. Một trong hai kiểu kết hợp này đều làm tăng khả năng hướng đích và đưa thuốc vào tế bào thông qua thụ thể folat được bộc lộ quá mức trên các tế bào khối u. Một phương pháp khác liên quan đến các peptid thâm nhập tế bào (CPP Cell penetrating peptides). Ví dụ như protein hoạt hóa phiên mã hoạt hóa chéo từ HIV-1 là TAT peptid và iRGD peptid có chứa một chuỗi arginin glycin aspartat và cùng kéo về khối u bằng cách gắn kết ban đầu với các αv integrin được bộc lộ đặc hiệu trên lớp nội mạc của mao mạch khối u. Các CPP kết hợp với bề mặt các liposome và các tiểu phân nano khác đã được sử dụng để tăng khả năng xâm nhập khối u của nhiều thuốc khác nhau. Lý tưởng hơn, việc kết hợp cả ba yếu tố sinh học này (hiệu ứng EPR, sự đáp ứng với pH, nhiệt độ và các phối tử đặc hiệu của khối u) có thể tăng tối đa hiệu quả và chỉ số điều trị của các thuốc ung thư (Hình 1.9). Tuy nhiên, khả năng này rất khó để thực hiện được. Ví dụ, một hệ mang thuốc nhạy cảm với pH có tác dụng hướng đích được phát triển bằng cách sử dụng các liposome PEG hóa và các micell sử dụng PEG-phosphatidylethanolamin: trong điều kiện bình thường được bảo vệ bởi các chuỗi PEG ngắn có khả năng bị chia cắt do pH và chứa thêm một kháng thể đơn dòng gắn với bề mặt chất mang thông qua một chuỗi PEG dài hơn không bị chia cắt.
trong hóa trị liệu với bệnh ung thư
DẠYKÈMQUYNHƠN OFFICIAL 20
Hình 1.9. Mô hình thiết kế nano hướng đích dùng
[73] (1) các chuỗi polyme linh động thân nước trung tính trên bề mặt cho quá trình tuần hoàn dài hơn; (3) phần hướng đích ở ngoại biên; (4) và/hoặc cầu nối có thể bị cắt bỏ bởi pH; (2 & 5) phần hướng đích bổ sung hoặc phần tăng khả năng xâm nhập tế bào trên bề mặt và (6) dược chất hoặc các chất chẩn đoán hình ảnh Ví dụ, Bai và Liu (2014) đã bào chế tiểu phân nano PLGA PEG chứa cisplatin gắn kháng thể đơn dòng của thụ thể CD44 bằng kỹ thuật phun điện trường. Hỗn dịch thu được cho thấy khả năng hướng đích hiệu quả hơn trên các dòng tế bào ung thư buồng trứng (có sự tăng tiết thụ thể CD44) như CP70 và SKOV 3 trong vòng 6 giờ dùng thuốc so với cisplatin tự do và tiểu phân không gắn kháng thể [18]
Ngoài ra, hệ mang thuốc nano có ưu điểm hơn dạng thuốc tự do thông qua quá trình ức chế lại sự đề kháng thuốc của các tế bào ung thư. Mặc dù các thuốc có khả năng ức chế bơm tháo rỗng để hạn chế khả năng đề kháng thuốc đã được phát triển, tuy nhiên vẫn còn những hạn chế nhất định. Do đó, các tiểu phân nano đã được thiết kế nhằm sử dụng hiệu ứng EPR để thoát khỏi thành mạch máu của khối u, để hướng đích các thụ thể trên bề mặt của các tế bào khối u và để đi vào tế bào khối u thông qua quá trình nội thực bào trước khi giải phóng thuốc bên trong. Phương pháp này cho phép đưa một nồng độ thuốc cao trong nội bào giúp vượt qua sự đề kháng thuốc thông qua quá trình bơm tháo rỗng của các P glycoprotein của tế bào khối u. Sau đây là một số chế phẩm bào chế dưới
Abraxane
Paclitaxel gắn albumin/ 100mg/Nano polyme
Abraxis BioScience, LLC, Tập đoàn Celgene, Mỹ
Ung thư tuyến tụy, ung thư vú di căn, ung thư phổi không tế bào nhỏ [24]
BIND 014
DaunoXome
Docetaxel/Nano polyme hướng đích kháng nguyên màng
Daunorubicin citrat/50mg/Liposome
DepoCyt Cytarabin/50mg/ Liposome
Doxil/Caelyx
Genexol PM
Doxorubicin HCl PEG hóa/20mg/10 ml hoặc 50mg/25ml/Liposome
Paclitaxel/30 100mg/micell
BIND Therapeutics, Mỹ
GileadScience,Mỹ
Almac Pharma Services Ltd, Craigavon, Anh
Alza/Janssen, Tập đoàn Johnson Johnson, Mỹ
Samyang, Hàn Quốc
Takeda Italia Farmaceutici SpA, Cerano,
Ung thư tiền liệt tuyến giai đoạn muộn (pha II) [16]
Ung thư mô liên kết ở bệnh nhân AIDS [24]
Viêmmàngnãoởbệnh bạchcầu [24]
Ung thư tử cung, ung thư vú, ung thư mô liên kết do AIDS, đa u tủy [24]
Ung thư vú, ung thư phổi, ung thư tử cung [13], [28]
Ungthưxươngkhôngdi căn [53]
định
Sopherion Therapeutics,M
Ung thư vú di căn [53]
DẠYKÈMQUYNHƠN OFFICIAL 21
dạng nano trên thị trường. Bảng 1.3. Một số chế phẩm nano sử dụng trong điều trị bệnh ung thư Chế phẩm Dược chất/Hàm lượng/Dạng nano Nhà sản xuất Chỉ định
polyme PEG PLA
Mepact Mifamurtid/4mg/ Liposome
Ý
Bảng 1.3. Một số chế phẩm nano sử dụng trong điều trị bệnh ung thư (tiếp) Chế phẩm Dược chất/Hàm lượng/Dạng nano Nhà sản xuất Chỉ
Myocet Doxorubicin HCl/50mg/Liposome
ỹ
Onco TCS/ Marqibo
Onivyde
Vincristin sulfat/5mg/Liposome
Inex/Talon Therapeutics, Mỹ
Irinotecan PEG hóa/43mg/10ml/ Liposome Merrimack,Mỹ
Bệnh bạch cầu tăng lymphô bào cấp tính [24]
Ungthưtụydicăn [24]
Vyxeos Daunorubicin+Cytarabi n/44+100mg/Liposome Jazz Pharma, Cộng hòa Ireland Ung thư bạch cầu dòng tủy cấp tính [25]
1.6.2.2. Bào chế thuốc hướng đích khác
Tiểu phân nano có thể được ứng dụng để bào chế thuốc thấm vào não. Đối với các thuốc dùng qua hàng rào máu não, khi các tác nhân ngoại lai (như nano polyme hay lipid rắn) tiếp xúc với huyết tương hay huyết thanh thì các protein sẽ hấp phụ trên bề mặt của chúng, đồng thời sẽ chịu trách nhiệm cho sự tương tác với hàng rào máu não và quá trình nội bào tiếp theo, ví dụ như sự hấp phụ Apoliporotein E hoặc B lên bề mặt nano được bao bởi polysorbat 80. Ngoài polysorbat 80 thì việc bao với polysorbat 20, 40, 60 và poloxame 188 cũng cho thấy khả năng đưa thuốc đến não của các tiểu phân nano này. Do đó, đặc tính bề mặt của các tiểu phân đóng vai trò quan trọng cho khả năng đưa thuốc đến não như việc cải biến đặc tính bề mặt cho thấy hiệu quả trên mô hình in vivo trong việc đưa thuốc đến não như liposome được PEG hóa hoặc gắn các phức hợp hướng đích như gắn với folat, peptid TAT (transactivator of transcription),....
1.6.3. Gen trị liệu Các polyme mang điện tích dương đã cho thấy rất có tiềm năng trong liệu pháp gen dựa trên khả năng nội thực bào của hệ mang thuốc chứa các polyme này được gắn kết sinh học với gen hoặc các phân tử sinh học khác. Các nano polyme này có khả năng phân hủy sinh học tốt, độc tính thấp, hoạt hóa quá trình giải phóng acid nucleic và hiệu quả truyền gen tương đối cao.
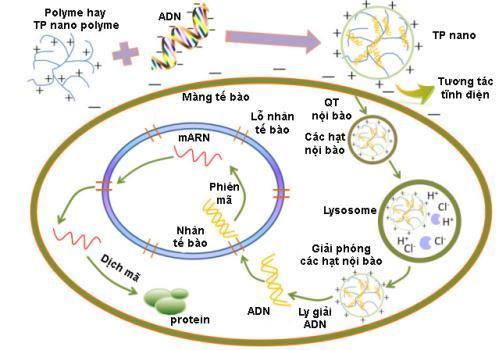
DẠYKÈMQUYNHƠN OFFICIAL 22
Hình 1.10. Minh họa quá trình mang gen của các nano polyme [61]
Do đó, nhiều loại polyme được khảo sát để mang gen như chitosan, polyethylenimin (PEI), polylysin, este polyamin,… các cấu tử mang điện tích dương, các đơn vị giúp thoát khỏi cơ quan tế bào (organelle escape units) và các phần phân hủy sinh học đều rất cần thiết đối với hệ vận chuyển gen dựa trên polyme. Phần lớn các polyme mang điện dương này bắt nguồn từ các polyamin. Chúng không những bảo vệ ADN khỏi bị phân hủy mà còn thúc đẩy quá trình nội thực bào bởi các màng thực bào. Đồng thời các nano polyme có khả năng phân hủy. Quá trình phân hủy này cần thiết trong việc giúp các hệ chất mang giải phóng ADN khi phức hợp đi vào trong tế bào chất. Ngoài ra, các đơn vị giúp thoát khỏi cơ quan tế bào là một trong các yếu tố then chốt ảnh hưởng đến hiệu quả truyền gen [61]. 1.6.4. Các vai trò khác Ngoài các vai trò trên, công nghệ nano còn được sử dụng trong thiết kế các cảm biến sinh học để có thể phát hiện nhanh và cùng một lúc nhiều chất chỉ điểm sinh học (biomarker) của các bệnh lý với độ nhạy cao và lượng mẫu nhỏ. Sự ra đời của cảm biến sinh học, ống nano carbon, thiết bị nano bằng polyme, và các chip sinh học với độ tin cậy và độ nhạy cao giúp phát hiện sớm các bệnh lý nguy hiểm đến tính mạng như ung thư, tim mạch,… ngoài ra, hệ thống lab on chip chứa các vật liệu cảm biến mới hoặc các cảm biến dựa trên chip sinh học cũng đã và đang được phát triển nhằm đem đến hiệu quả tốt hơn trong chẩn đoán và điều trị bệnh tật.
Đồng thời, công nghệ nano còn có vai trò trong chẩn đoán hình ảnh với việc cung cấp một giải pháp nhanh, ít xâm lấn, chính xác hơn để chẩn đoán bệnh ở các giai đoạn sớm cũng như giám sát tiến trình của bệnh. Các tiểu phân nano có thể được kết hợp hoặc đánh dấu bằng các phân tử nhỏ, hoặc các ion phức, kim loại hoặc các nano tinh thể để có thể được phát hiện bằng các thiết bị chẩn đoán hình ảnh như máy chụp cộng hưởng từ (MRI magnetic resonance imaging), chụp X quang (X ray imaging) và chụp vi tính cắt lớp (CT computed tomography imaging), chụp xạ hình cắt lớp positron (PET positron emission tomography imaging), chụp cắt lớp đơn photon (SPECT single photon emission computed tomography imaging), hoặc các kỹ thuật kết hợp PET/CT, SPECT/CT. Ví dụ: các tiểu phân nano vàng, chấm lượng tử (quantum dot), tiểu phân nano oxyd sắt từ, phức hợp của
Trong đó, các tính chất như kích thước, đặc tính bề mặt là các tiêu chí chính ảnh hưởng
khả năng
DẠYKÈMQUYNHƠN OFFICIAL 23
gadolinium.
đến
phân bố, thải trừ, hoặc nhận diện bởi đại thực bào của các tiểu phân nano. Ngoài ra, công nghệ nano còn được ứng dụng để bào chế tiểu phân nano chứa đồng thời tác nhân có tác dụng điều trị và tác nhân có tác dụng chẩn đoán (theranostic nanoparticles). Ngoài ra, việc sử dụng công nghệ nano còn được tìm thấy trong kỹ thuật tạo mô như việc thiết kế và tạo ra các khung giá đỡ có khả năng tương thích sinh học hay các mô có thể sử dụng để cấy ghép vào cơ thể [103]. Trong quá trình phát triển thuốc, công nghệ nano ra đời đã tạo ra cuộc cách mạng làm thay đổi việc thiết kế công thức của các dạng thuốc, giúp tạo ra các thế hệ thuốc mới với nhiều ưu điểm đã trình bày ở trên như có thể giúp tăng sinh khả dụng và giảm độc tính của các công thức/hoạt chất đã được sử dụng trước đây trong điều trị bệnh
ĐỘC TÍNH CỦA TIỂU PHÂN NANO
Cùng với nhiều vai trò và ưu điểm của các tiểu phân nano, việc sử dụng ngày càng tăng các vật liệu nano cũng đi kèm với các yếu tố liên quan đến độ an toàn của chúng. Do các đặc tính sinh học và dược động học của thuốc từ tinh thể nano và hệ mang thuốc nano thay đổi, độc tính của thuốc và hệ mang thuốc nano cũng có thể thay đổi, ví dụ như hệ mang thuốc nano cải biến bề mặt bằng polyethylen glycol giúp hệ mang thuốc nano tuần hoàn trong máu lâu, nhưng lại dẫn đến lắng đọng hệ tại các đầu chi, dẫn đến hoại tử các đầu chi. Ví dụ: Thuốc điều trị ung thư doxorubicin phân bố ở tủy xương và các tế bào cơ tim, gây ức chế tủy xương và độc tính đối với tim. Tuy nhiên, khi thuốc này được bao gói trong liposome được PEG hóa thì chất mang giúp bảo vệ thuốc không phân bố tại tủy xương và mô tim, giúp làm giảm sự ức chế tủy xương và độc tính đối với tim. Tuy nhiên, liposome được PEG hóa lại gây tích tụ thuốc tại da và dẫn đến một độc tính khác là hội chứng taychân và viêm da (vết ban đỏ mất cảm giác ở lòng bàn tay-bàn chân - palmar-plantar erythrodysesthesia). Trong khi đó, nếu sử dụng chất mang là cyanoacrylat thì doxorubicin lại gây độc tính trên thận. Nếu các tiểu phân nano không có khả năng phân hủy sinh học hay có sự phân hủy sinh học quá lâu thì sự tích lũy tiểu phân ở các cơ quan tổ chức, ví dụ gan và lách, có thể dẫn đến độc tính và tăng tác dụng không mong muốn tại các tổ chức này. Hai yếu tố được sử dụng để đánh giá nguy cơ ảnh hưởng bất lợi của các vật liệu nano đối với sức khỏe con người đó là yếu tố phơi nhiễm và khả năng gây độc của chúng. Khi không bị phơi nhiễm thì yếu tố nguy cơ sẽ bị loại trừ mà không cần xem xét đến tính độc của chúng.
Các tiểu phân nano được xem như các hóa chất và được kiểm soát theo quy định về đăng ký, đánh giá, thẩm quyền và giới hạn về hóa chất của Liên minh châu Âu (REACH) và đặt dưới hoạt động kiểm soát các chất độc hại của Mỹ. Một vài sáng kiến quốc tế cũng đang tiến hành để đảm bảo việc sản xuất an toàn và giảm tác động đến môi trường của các sản phẩm dựa trên công nghệ nano. Ví dụ, tổ chức quốc tế về tiêu chuẩn hóa (ISO) và tổ chức hợp tác và phát triển kinh tế (OCED) đang tham gia vào các vấn đề an toàn của công nghệ nano bằng việc cung cấp các tiêu chuẩn để đánh giá vật liệu nano. Tổ chức OECD đã thành lập bộ phận chuyên trách về các vật liệu nano được sản xuất. Bộ phận này điều hành một vài dự án với mục đích nhằm tìm hiểu đặc tính và các nguy cơ tiềm ẩn của vật liệu nano. Mỹ và Canada đã có sáng kiến
y tế được kiểm soát theo khung pháp
Cục quản lý thực phẩm và dược phẩm Mỹ (FDA) và Cơ quan Y tế châu Âu (EMA) đối với các thuốc có
sản phẩm sinh học (như protein hoặc kháng thể có khả năng trị liệu) được xem như sản phẩm kết hợp và được xem xét bởi Văn phòng về sản phẩm kết hợp của Mỹ. Độc tính do tiểu phân nano là một chủ đề rộng liên quan đến môi trường, nghề nghiệp và an toàn sức khỏe. Một vài dạng độc tính do vật liệu nano xuất phát từ các đường phơi nhiễm chung như đường qua da, đường hô hấp, đường tiêu hóa, và đường toàn thân có thể gặp phải. Việc đánh
DẠYKÈMQUYNHƠN OFFICIAL 24 1.7.
hợp tác điều hành một hội đồng hợp tác pháp lý (RCC). Hội đồng RCC nỗ lực kiểm soát vấn đề an toàn môi trường của vật liệu nano và trong các lĩnh vực ứng dụng công nghệ nano bao gồm trong y học và trong các lĩnh vực khác. Tiểu phân nano ứng dụng trong y học hoặc làm các bộ phận của dụng cụ
lý của
khối lượng phân tử thấp hoặc các chế phẩm công nghệ sinh học. Các công thức chứa hệ mang thuốc nano và một thuốc có khối lượng phân tử thấp hoặc
giá độc tính do tiểu phân nano dựa trên vài yếu tố cơ bản như (1) mục đích sử dụng, (2) đường sử dụng hoặc phơi nhiễm, (3) liều lượng và số lần dùng, (4) xem xét đến khả năng phân bố toàn thân hoặc đánh giá độc tính toàn thân thậm chí khi đường sử dụng không phải là đường tiêm tĩnh mạch, (5) sử dụng các mô hình phù hợp nhất và có độ nhạy tốt nhất, (6) xem xét vấn đề chuyển hóa của tiểu phân nano, (7) nhận thức rõ các độc tính trường diễn và độc tính cấp. Việc đánh giá kết hợp đa chiều về các vật liệu nano sẽ định hướng được các ứng dụng của chúng trong y học, và giúp có cái nhìn sâu sắc về sự hình thành của các dấu hiệu độc tính trong các ứng dụng khác nhau của chúng. Đồng thời, việc công nhận về sự an toàn của các vật liệu nano đối với bệnh nhân cũng cần kết hợp với việc đề cao khía cạnh an toàn môi trường và nghề nghiệp. Việc hợp tác giữa những lĩnh vực này sẽ đảm bảo sự tác động tối thiểu lên sức khỏe của bệnh nhân, cũng như môi trường và sức khỏe của nhân viên sản xuất và xử lý các vật liệu nano [31]. Như vậy, các chế phấm chứa tiểu phân nano cần được đánh giá độc tính như là một thuốc mới để đảm bảo an toàn, hiệu quả của thuốc trong chẩn đoán hay điều trị bệnh. Câu hỏi lượng giá
1. Trình bày những ưu, nhược điểm của tiểu phân nano.
2. Dựa vào cách phân loại, trình bày các đặc điểm của từng tiểu phân nano.
3. Phân tích một số vai trò của công nghệ nano trong dược phẩm.
4. Trình bày các yếu tố cơ bản cần xem xét khi đánh giá độc tính của tiểu phân nano. Cho ví dụ.
DẠYKÈMQUYNHƠN OFFICIAL 25
Chương 2. KỸ THU
Mục tiêu học tập
T BÀO CHẾ TIỂU PHÂN NANO
1. Trình bày được các đặc điểm của một số chất mang sử dụng cho các tiểu phân nano như nano polyme, nano lipid.
2. Trình bày được vai trò của chất ổn định, dung môi được sử dụng trong bào chế tiểu phân nano.
3. Trình bày được vai trò và đặc điểm của các quá trình biến đổi bề mặt tiểu phân nano bằng acid hyaluronic, PEG hay acid folic.
4. Phân tích được vai trò các thành phần và xây dựng được công thức bào chế tiểu phân nano.
5. Xây dựng được quy trình
polyme lipid/lipid polyme.
phân nano, phương pháp
t số tiểu phân nano bao gồm nano tinh thể, nano polyme, nano lipid và nano polyme lipid. Trong đó, nguyên tắc cũng như ví dụ minh họa sẽ được trình bày ứng với từng phương pháp kèm theo mô tả một số thiết bị sử dụng trong bào chế.
2.1. TÁ DƯỢC CHUNG BÀO CHẾ TIỂU PHÂN NANO Tùy thuộc vào phương pháp bào chế sử dụng và loại nano thu được, các tá dược bào chế tiểu phân nano có thể bao gồm chất mang, chất ổn định, dung môi, chất khác. Mỗi tá dược có vai trò khác nhau trong công thức. Trong đó, quan trọng nhất là chất mang, tạo giá đỡ vận chuyển.
2.1.1. Chất mang
Chất mang (carrier) là vật liệu được sử dụng với vai trò như một bộ phận vận chuyển, bảo vệ và đưa thuốc đến đích. Dược chất có thể được nano hóa dưới dạng phức hợp với chất mang, hoặc được nang hóa, hấp phụ lên bề mặt chất mang. Tùy thuộc vào dạng nano tạo thành, có thể sử dụng polyme, lipid hay hỗn hợp của chúng. 2.1.1.1. Chất mang cho nano polyme a.
khả năng phân hủy sinh học được sử dụng khá
giải phóng dược chất, độc tính thấp, tương thích sinh học
những polyme được sử dụng nhiều nhất trong
DẠYKÈMQUYNHƠN OFFICIAL 26
Ậ
bào chế nano tinh thể, nano polyme, nano lipid, nano
Chương này chỉ tập trung giới thiệu các tá dược sử dụng trong bào chế tiểu
bào chế mộ
Acid poly lactic co glycolic (PLGA) PLGA là một trong những polyme tổng hợp có
phổ biến do có khả năng kiểm soát và duy trì
với nhiều mô và tế bào. PLGA là một trong
nghiên cứu và ứng dụng của tiểu phân nano. * Cấu trúc
Hình 2.1. Cấu trúc hóa học của a) L PLA (acid poly(L lactic)), b) D PLA (acid poly(D lactic)) c) PGA (acid poly glycolic) d) PLGA [55]

PLGA là một copolyme được polyme hóa từ 2 monome là acid glycolic và acid lactic. Do có nhóm methyl trong phân tử, nên PLA có nguyên tử C bất đối trong phân tử. Điều này hình thành nên cấu hình D và L của PLA, từ đó ảnh hưởng đến đặc tính vật lý của phân tử.
Các PLGA khác nhau bởi tỷ lệ các monome sử dụng và khối lượng phân tử (KLPT), ví dụ PLGA 50:50 chứa 50% acid lactic và 50% acid glycolic [72]
* Tính chất lý hóa
PLGA tan trong nhiều dung môi khác nhau như các dung môi chứa clo, tetrahydrofuran, aceton hoặc ethyl acetat.
Trong phân tử PLGA, phần PLA (poly acid lactic) có cấu trúc kỵ nước hơn PGA (poly acid glycolic). Do đó, nếu PLGA có tỷ lệ PLA cao hơn thì ít thân nước hơn, hấp thu ít nước hơn nên thủy phân chậm hơn. Do khả năng thủy phân của PLGA, các thông số cần kiểm soát trong công thức chứa PLGA là nhiệt độ hóa thủy tinh (Tg), hàm ẩm và KLPT. Sự thay đổi các đặc tính này ảnh hưởng đến tốc độ giải phóng và phân hủy của các phân tử dược chất được bao gói. PLGA được phân hủy bằng cách thủy phân liên kết este tạo thành acid lactic và acid glycolic. Các sản phẩm phân hủy này dễ dàng chuyển hóa trong cơ thể thông qua chu kỳ Krebs và được đào thải ra khỏi cơ thể [72].
Tính chất vật lý của PLGA phụ thuộc vào nhiều yếu tố bao gồm KLPT ban đầu, tỷ lệ PLA và PGA, kích thước của hệ mang thuốc, khả năng tiếp xúc với nước và nhiệt độ bảo quản. Độ bền cơ học của PLGA bị ảnh hưởng bởi các đặc
DẠYKÈMQUYNHƠN OFFICIAL 27
tính vật lý như KLPT và hệ số đa phân tán [72]. Các dạng PLGA trên thị trường thường được đặc trưng bởi độ nhớt, độ nhớt thay đổi phụ thuộc vào KLPT của chúng [72] Bảng 2.1. Đặc điểm của một số loại PLGA [104] Loại PLGA Sản phẩm Khối lượng phân tử (Dalton) Độ nhớt (dL/g) Tg (oC) Nhóm chức cuối 50:50 RESOMER® RG 502 7000 17000 0,16 0,24 42 46 Este RESOMER® RG 502 H 7000 17000 0,16 0,24 42 46 Acid RESOMER® RG 503 24000 38000 0,32 0,44 44 48 Este RESOMER® RG 503 H 24000 38000 0,32 0,44 44 48 Acid
“
RESOMER® RG 504 38000 54000 0,45 0,60 46 50 Este
RESOMER® RG 504 H 38000 54000 0,45 0,60 46 50 Acid
RESOMER® RG 505 54000 69000 0,61 0,74 48 52 Este
65:35 RESOMER® RG 653 H 24000 38000 0,32 0,44 46 50 Acid
RESOMER® RG 752 H 4000 15000 0,14 0,22 42 46 Acid
RESOMER® RG 752 S - 0,16-0,24 44-50 Este
RESOMER® RG 753 H 0,32 0,44 Acid
75:25
RESOMER® RG 753 S 0,32 0,44 44 50 Este
RESOMER® RG 755 S 0,50 0,70 48 54 Este
RESOMER® RG 756 S 76000-116000 0,71-1,0 49-55 Este
RESOMER® RG 750 S 0,8 1,0 Este
85:15
RESOMER® RG 858 S 190000 240000 1,3 1,7 Este
”: không có thông tin
Ngoài các sản phẩm PLGA của hãng Evonik, Boehringer Ingelheim, Đức (với tên thương mại là RESOMER®), hiện nay trên thị trường cũng có nhiều loại PLGA của các hãng khác như Akina, Inc.; Polysciences, Inc.; Durect Corp.; Purac; Mitsui chemicals;… với nhiều tỉ lệ giữa acid lactic và acid glycolic, khối lượng phân tử và nhóm chức cuối ứng dụng trong nhiều lĩnh vực khác nhau của ngành Y Dược.
Ngoài ra, độ bền cơ học, đặc tính trương nở, khả năng bị phân hủy sinh học bị ảnh hưởng trực tiếp bởi mức độ kết tinh của PLGA mà thông số này lại phụ thuộc vào loại và tỷ lệ các thành phần monome trong chuỗi copolyme. Do vậy, tỷ lệ PGA càng cao dẫn đến khả năng phân hủy càng nhanh ngoại trừ PLGA 50:50 cho khả năng phân hủy nhanh nhất, nhanh hơn so với PLGA có tỉ lệ cao của một trong hai thành phần monome. Đồng thời, nhóm chức cuối của PLGA cũng ảnh hưởng đến khả năng phân hủy như nhóm este sẽ kéo dài thời gian phân hủy hơn so với nhóm acid. Đối với nano polyme, không thể bị phá vỡ bình thường bởi các đại thực bào, quá trình tích lũy tại các cơ quan đại thực bào thường xảy ra. Nếu các tiểu phân không có khả năng phân hủy sinh học hay có sự phân hủy sinh
tích lũy tiểu phân ở các cơ quan này, thường là gan
không mong muốn [87]. Do đó, PLGA 50:50 là loại PLGA hay được
giá mang thuốc vì có khả năng duy trì thời gian giải phóng dược chất kéo dài
hủy không quá lâu, do vậy
đồng phân acid poly(L lactic) tồn tại ở dạng bán tinh thể (37%), trong khi hỗn hợp của đồng phân D và L của acid polylactic tồn tại ở dạng vô định hình do sự bất thường trong cấu trúc của polyme. Acid polyglycolic (PGA) tồn tại phần lớn ở dạng tinh thể (55%) do thiếu nhóm methyl ở mạch nhánh so với acid polylactic. PGA dạng tinh thể khi kết hợp với PLA làm giảm mức độ kết tinh của PLGA do đó làm tăng khả năng hydrat hóa và thủy phân. PLGA được tạo thành từ L PLA và PGA có bản chất tinh thể trong khi
DẠYKÈMQUYNHƠN OFFICIAL 28
học quá lâu thì sự
và lách, có thể dẫn đến độc tính và các tác dụng
sử dụng làm
và có khả năng phân
giảm khả năng gây độc tính liên quan đến việc tích lũy tiểu phân tá dược và dược chất. Vì tính đồng nhất cao trong cấu trúc chuỗi polyme nên dạng
đó, PLGA được tạo thành từ hỗn hợp đồng phân D,L của acid lactic là poly(D,L lactic co glycolic) tồn tại dưới dạng vô định hình do bản chất bất thường của cấu trúc của chuỗi polyme [37], [60].
PLGA sẽ tồn tại ở dạng tinh thể nếu PLGA chứa dưới 70% PGA [60] Mức độ kết tinh và nhiệt độ nóng chảy của polyme liên quan trực tiếp đến KLPT của chúng [72].
Nhiệt độ chuyển hóa thủy tinh (Tg) của PLGA ở trên nhiệt độ sinh lý của cơ thể nên PLGA tồn tại ở dạng thủy tinh. Do có cấu trúc chuỗi khá cứng nhắc nên giúp PLGA có đủ độ bền cơ học để thiết kế làm các hệ đưa thuốc. Giá trị Tg giảm khi giảm lượng PLA trong chuỗi đồng polyme và giảm khi giảm khối lượng phân tử của chúng [60].
Quá trình phân hủy và sự phân bố sinh học Hiện nay, PLGA đã được Cục quản lý Dược Mỹ (FDA) và Cơ quan quản lý Dược phẩm châu Âu (EMA) chấp nhận sử dụng trong các dạng thuốc khác nhau dùng trên người. Ngoài ra, PLGA làm chất mang cho các tiểu phân nano đang được nghiên cứu ứng dụng trong các liệu pháp chẩn đoán hình ảnh và điều trị ung thư.
Quá trình phân hủy của PLGA in vivo và in vitro bị ảnh hưởng bởi một vài yếu tố bao gồm phương pháp bào chế; sự có mặt của các hợp chất có khối lượng phân tử thấp (monome, oligome, chất xúc tác); kích thước, hình dạng và hình thái; các đặc tính của PLGA (KLPT, cấu trúc hóa học, độ kỵ nước, sự kết tinh, và nhiệt độ chuyển hóa thủy tinh); các thông số hóa lý (pH, nhiệt độ, lực ion của môi trường); vị trí gắn implant; hàm lượng và loại dược chất và cơ chế thủy phân [72].


Sự ăn mòn toàn bộ (bulk erosion) là con đường phân hủy chính của PLGA thông qua quá trình cắt ngẫu nhiên liên kết este của khung polyme phân bố đồng nhất trong tiểu phân. Quá trình phân hủy sinh học của PLGA được đề xuất với cơ chế gồm ba giai đoạn. Ban đầu, có sự giảm đáng kể KLPT của polyme, nhưng không có bất kỳ sự mất khối lượng nào đáng kể cũng như không có sự tạo thành sản phẩm monome tan được. Giai đoạn này được theo sau bởi sự giảm nhanh KLPT và hình thành các sản phẩm oligome và monome tan được. Cuối cùng, các monome tan được hình thành từ các mảnh oligome tan, dẫn đến quá trình phân hủy hoàn toàn.
tác dụng (location) cần
có hoạt tính. Ngoài
cơ
các nghiên cứu trước
DẠYKÈMQUYNHƠN OFFICIAL 29
*
Hình 2.2. Cơ chế phân hủy của tiểu phân nano PLGA (A) sự ăn mòn toàn bộ (B) sự ăn mòn bề mặt [37] Để có thể ứng dụng trong điều trị, tiểu phân nano sử dụng chất mang PLGA cần có khả năng phân phối thuốc trong khoảng thời gian thích hợp, có khả năng phân bố sinh học và đạt nồng độ phù hợp với tác dụng điều trị mong muốn. Do đó, những yêu cầu thiết kế công thức bao gồm nguyên liệu, cấu trúc không gian (geometry) và vị trí
đáp ứng
chế phân hủy và thải trừ của chất mang cũng như các thành phần
ra,
đây chỉ ra rằng sự thải trừ khỏi tuần hoàn và bắt giữ bởi hệ thống thực bào đơn nhân có thể phụ thuộc vào liều và thành phần của hệ mang thuốc PLGA [72].
Về khả năng phân bố sinh học, phương pháp chụp X quang và các thí nghiệm đã chỉ ra rằng một số công thức tiểu phân nano sử dụng PLGA có khả năng tích lũy nhanh tại gan, tủy xương, các hạch lympho, lách và đại thực bào thuộc màng bụng. Sự phân hủy của PLGA diễn ra nhanh ở giai đoạn ban đầu (khoảng 30%) và chậm ở giai đoạn sau [72] Vì vậy, nồng độ thuốc có thể duy trì trong một thời gian dài, ví dụ thuốc tiêm chứa vi tiểu phân polyme với chất mang PLGA như thuốc Diphereline (thuốc điều trị ung thư tiền
pháp nhũ hóa và bốc hơi dung môi có điều chỉnh. KTTP được đánh giá
phương pháp DLS đạt 207 605nm, có dạng hình cầu với nhiều lỗ xốp qua ảnh FE SEM. EE dao động từ 8 63%, với LC tối đa là 31%. Đồ thị giải phóng dược chất đặc trưng với giai đoạn đầu giải phóng 20%, kéo dài giải phóng 15 ngày. Mô hình thử nghiệm in vivo trên chuột đã phát hiện thuốc trong phổi kéo dài đến 7 ngày và 5 ngày lần lượt đối với tiểu phân nano xốp và không xốp [105].
b. Acid poly glycolic (PGA)
PGA là một polyme có tính tương thích sinh học được sử dụng từ những năm 1950. PGA là một polyeste mạch thẳng đơn giản, có thể được điều chế từ acid glycolic bằng phương pháp trùng ngưng hoặc phản ứng polyme hóa mở vòng. Do có độ tan kém và khả năng phân hủy nhanh thành acid glycolic nên PGA ít được lựa chọn trong việc ứng dụng làm hệ phân phối thuốc dạng nano polyme, tuy nhiên có thể ứng dụng làm chỉ khâu trong phẫu thuật.
Về đặc tính vật lý, PGA có nhiệt độ chuyển hóa thủy tinh khoảng 35 40oC, nhiệt độ nóng chảy từ 224 227oC. Bởi vì cấu trúc hóa học và tính cân đối lập thể đơn giản của nó, PGA có mức độ kết tinh khác nhau từ dạng vô định hình đến tối đa khoảng 55% ở dạng kết tinh. Cũng do trạng thái kết tinh này nên PGA thường kém tan trong phần lớn các dung môi hữu cơ. Ngoài ra, độ tan còn phụ thuộc vào khối lượng phân tử của polyme. Dạng có khối lượng phân tử lớn không tan trong phần lớn các dung môi hữu cơ thông dụng như aceton, dicloromethan, cloroform, ethyl acetat,... trong khi đó, loại có khối lượng phân tử thấp có sự khác biệt đáng kể về đặc tính vật lý với khả năng dễ tan hơn. Tuy nhiên, PGA có thể tan được trong các dung môi chứa nhiều Flo như hexafluoroisopropanol (HFIP) và hexafluoroaceton sesquihydrat, do vậy có thể được sử dụng để pha các dung dịch chứa polyme có khối lượng phân tử cao để tạo sợi đun chảy (melt spinning) hoặc tạo phim.
Quá trình phân hủy của PGA là quá trình ăn mòn và polyme sẽ được chuyển về lại monome ban đầu qua hai bước: đầu tiên, nước sẽ khuếch tán vào vùng vô định hình của cốt polyme, phá vỡ các liên kết este; tiếp theo sau khi các vùng vô định hình bị ăn mòn, còn lại phần kết tinh của polyme nhạy cảm với quá trình thủy phân. Khi các vùng kết tinh của polyme bị phá vỡ, chuỗi polyme còn lại sẽ hòa tan.
DẠYKÈMQUYNHƠN OFFICIAL 30
liệt tuyến) có thể kéo dài nồng độ thuốc từ 1 đến 6 tháng (tùy theo hàm lượng). Ví dụ, năm 2013, Sinha và cộng sự đã bào chế tiểu phân nano PLGA (85:15, Mw = 55000 75000 Da) chứa voriconazole bằng phương
qua
Trong môi trường sinh lý của cơ thể, PGA sẽ bị phân hủy thông qua quá trình thủy phân ngẫu nhiên, đồng thời cũng bị phân hủy bởi một số men, đặc biệt các men esterase. Sản phẩm của quá trình phân hủy là acid glycolic, không độc, và có thể đi vào chu trình acid tricarboxylic, sau đó được bài tiết dưới dạng nước và carbon dioxyd.
Năm 1970, Herrmann và cộng sự đã tiến hành đánh giá các tính chất của chỉ khâu PGA trên phòng thí nghiệm và trên lâm sàng. Kết quả cho thấy chỉ khâu PGA có độ bền khi kéo căng tương đương với chỉ tổng hợp không có khả năng phân hủy là Dacron, và mạnh hơn so với các chỉ khâu có cùng kích thước bằng lụa, vải cotton, nylon, dây ruột mèo khâu vết mổ. Đồng thời, chỉ khâu PGA có các đặc tính dễ thao tác và thắt nút, tương tự như chỉ bằng cotton và Dacron. Ngoài ra, chỉ khâu PGA đã thể hiện khả năng phân hủy sinh học và tương thích sinh học cao như phản ứng đối với mô hầu như không có, phân hủy thông qua cơ chế enzyme [54].
c. Acid poly lactic (PLA)
PLA là polyme thân dầu hơn PGA do có nhóm methyl ở mạch nhánh và đặc tính của PLA có thể thay đổi do đổi trạng thái racemic hóa của dạng D và L. PLA tan trong dung môi chứa Clo, benzen nóng, tetrahydrofuran và dioxan. Polyme PLLA tương ứng từ L lactic là dạng bán tinh thể trong khi đó PDLA từ D,L lactic là dạng vô định hình. Điều này dẫn đến làm thay đổi độ bền cơ học và mức độ phân hủy, như với PLLA cứng và trong suốt hơn với Tg = 53oC; còn PDLA có Tg = 55oC và độ bền cơ học thấp hơn. Nhiệt độ nóng chảy của PLA có thể từ 130oC 180oC. Tốc độ phân hủy của PLA bị ảnh hưởng bởi mức độ kết tinh và do tốc độ phân hủy của PLLA thấp hơn PGA nên dạng đồng polyme của nó là PLGA đã được nghiên cứu và ứng dụng nhiều trong ngành y dược. PLA có thể được ứng dụng để tạo sợi (bằng phương pháp tạo sợi đun chảy) và tạo phim. Với năng lượng bề mặt cao, PLA có khả năng dễ in ấn nên được sử dụng rộng rãi trong in 3D. Ngoài ra, các copolyme PLDLLA (acid poly(L lactic co D,L lactic)) có thể được sử dụng như các khung trong kỹ thuật tái tạo xương. Ngoài các ứng dụng trên, PLA còn được ứng dụng để làm các dụng cụ cấy ghép (implant), hệ giải phóng thuốc có kiểm soát. Trước những năm cuối 1980, giá thành cao đã hạn chế một phần khả năng ứng dụng của PLA ngoài lĩnh vực này. Những tiến bộ trong quá trình lên men vi khuẩn tạo D glucose từ ngô đã giúp thu được acid lactic rẻ hơn nhiều so với đi từ sản phẩm có nguồn gốc hóa dầu. Ngoài ra, việc sử dụng monome acid lactic có hoạt tính quang học còn gặp trong những ứng dụng không cần
sinh học dưới dạng các este và các dẫn chất khác, có thể bằng cách kết hợp với các monome hay polyme khác.
trình phân hủy của PLA cũng tương tự như quá trình phân hủy của PGA, là quá trình ăn mòn và polyme sẽ
chuyển về lại monome ban đầu qua hai bước.
thời quá trình phân hủy PLA trong cơ thể cũng tương tự như ở PGA, thông qua quá trình thủy phân ngẫu nhiên hay bằng các men. Các sản phẩm của quá trình phân hủy sẽ đi vào chu trình acid tricarboxylic, sau đó được bài tiết dưới dạng nước và carbon dioxyd.
DẠYKÈMQUYNHƠN OFFICIAL 31
phân hủy
Quá
được
Đồng
Polycaprolacton
Hình 2.3. Cấu trúc hóa học của polycaprolacton
Polycaprolacton (PCL) là một polyeste có khả năng phân hủy sinh học với nhiệt độ nóng chảy khoảng 60°C và nhiệt độ chuyển hóa thủy tinh khoảng 60°C, khiến nó tồn tại ở dạng bán rắn ở nhiệt độ phòng. PCL có thể tương hợp với nhiều nguyên vật liệu khác nhau như có thể trộn lẫn với tinh bột để hạ giá thành và tăng khả năng phân hủy sinh học hoặc có thể được kết hợp với polyvinyl clorid với vai trò như một chất hóa dẻo. PCL được tổng hợp bằng cách polyme hóa mở vòng của ε caprolacton như thiếc octoat.
PCL tan được trong tetrahydrofuran, cloroform, methylen clorid, carbon tetraclorid, benzen, toluen, và chỉ tan một phần trong aceton, ethyl acetat, acetonitril. Trạng thái kết tinh của PCL tăng cùng với việc giảm khối lượng phân tử, ví dụ nếu KLPT là 100,000 thì tỉ lệ tinh thể là 40%, còn nếu KLPT giảm xuống 5,000 thì tỉ lệ tinh thể là 80%. Do đó, PCL cũng tương tự như PGA có độ kết tinh tăng khi polyme phân hủy.

Cho đến nay, PCL được sử dụng nhiều trong ngành thiết kế mô như vật liệu tạo khung (ví dụ như in 3D) hơn là hệ phân phối thuốc dạng nano. Điều này có liên quan đến độ tan kém và tốc độ phân hủy rất chậm của PCL (2 3 năm đối với dạng PCL tinh khiết). FDA chứng nhận PCL có thể làm vật liệu dẫn thuốc, chỉ khâu y tế cho con người. PCL đặc biệt được ứng dụng trong thiết kế các dụng cụ cấy ghép do có khả năng phân hủy chậm hơn polylactic.
PCL phân hủy bằng cách thủy phân cầu nối este trong môi trường sinh lý cơ thể, trong một số trường hợp nhất định được phân hủy bằng men. Cũng tương tự như PLA, quá trình phân hủy của PCL cũng trải qua hai giai đoạn, với quá trình mất khối lượng phân tử là quá trình chính xảy ra ở giai đoạn đầu, và quá trình mất phần lớn khối lượng và cấu trúc khung ở giai đoạn sau khi khối lượng phân tử khoảng 5000. Tuy nhiên, PCL phân hủy chậm gần 3 lần so với PLA. Tốc độ phân hủy của PCL có thể tăng lên khi tạo copolyme với DL lactic. Ngoài ra, quá trình phân hủy của PCL còn bị ảnh hưởng bởi điều kiện acid cũng như cơ chế phân hủy do tự xúc tác.
th
kế một hệ đưa thuốc nano dùng cho nhãn
bởi một polyme bám
DẠYKÈMQUYNHƠN OFFICIAL 32 d.
Ví dụ, Barbault Foucher và cộng sự (năm 2002)
iết
khoa sử dụng poly--caprolacton (PCL) được bao
dính sinh học là acid hyaluronic (HA). Kết quả thu được các tiểu phân có kích thước trong khoảng 200 280 nm và cho thấy HA gắn kết mạnh với siêu vi cầu tích điện dương do chất diện hoạt mang điện dương, benzalkonium clorid. Sau khi gắn HA, KTTP tăng lên và nằm trong khoảng 220 510 nm [20]. e. Cyclodextrin Các cyclodextrin (CDs), sản phẩm của quá trình thủy phân tinh bột để sản xuất dextrin, là các hợp chất hữu cơ vòng có khả năng bao gói các phân tử trong khoang rỗng của chúng. Các CDs được hình thành dựa trên 6 8 đơn vị đường glucopyranose thông qua các cầu nối α 1 4 glycosid tạo ra một họ các hợp chất với nhiều ưu điểm bao gồm α , β , γ CD (tương ứng với số đơn vị đường
tăng dần). Các phân tử CDs gồm phần ngoài thân nước và phần bên trong là các khung carbon kỵ nước gồm các monome glycopyranose, có cấu trúc dạng hình nón. Vì vậy, với đặc điểm cấu trúc này, CDs là các chất có khả năng giúp làm tăng độ tan đối với các chất kém tan trong nước [66]
Hình 2.4. Cấu trúc chung của cyclodextrin [96]

Các CDs có nhiều tính chất hóa lý và sinh học tương tự các đường dextrin, mạch thẳng tan trong nước của chúng. Tuy nhiên, do có cấu trúc vòng nên CDs ít bị thủy phân hơn so với các dextrin mạch thẳng từ 3 5 lần. Một thống kê trên 30 sản phẩm chứa CDs cho thấy β CD là loại được sử dụng nhiều nhất (Hình 2.5). Tuy nhiên, β CD cũng có hạn chế của nó là độ tan thấp nên không thích hợp đối với thuốc đường tiêm (Bảng 2.2). Do đó, một số dạng dẫn chất của CDs đã ra đời giúp làm tăng độ tan trong nước

DẠYKÈMQUYNHƠN OFFICIAL 33
của chúng như 2-hydroxypropyl (HPβ-CD and HPγ-CD) và sulfobutylether (SBEβ-CD) [66]. Hình 2.5. Tỉ lệ của các CDs được dùng trên thị trường dược phẩm [66] Trong quá trình vận chuyển thuốc, việc bao gói phức hợp thuốc CD giúp cải thiện độ tan, độ ổn định, sinh khả dụng của thuốc, và kéo dài tuổi thọ của chế phẩm. Đồng thời, các CDs cũng đã được ứng dụng trong việc thiết kế các nano polyme giúp làm tăng khả năng mang thuốc dùng trong cả dạng đường uống và đường tiêm [66]. Bảng 2.2. Đặc điểm của các cyclodextrin chính [26] , [95] Loại CD KLPT Đường kính Đường kính khoang rỗng (nm) Thể tích khoang Dạng hydrat (nm)
f. Chitosan
* Nguồn gốc và cấu trúc
Chitosan (CS) là sản phẩm deacetyl hóa (DA) của chitin, một polyme tự nhiên chuỗi dài của N acetylglucosamin và dẫn xuất đường glucose. Chitin là thành phần chính của thành tế bào nấm, xương ngoài của động vật chân đốt như tôm cua, côn trùng, hay lưỡi bào ở động vật thân mềm. CS có độ DA > 50% hay thực tế là một polyme chitin/chitosan, với mức độ DA và khối lượng phân tử có thể thay đổi. Độ DA của CS dùng trong sản xuất thường từ 60 100%.

* Tính chất
Hình 2.6. Cấu trúc hóa học của chitosan
Nhóm amino của CS có pKa ~ 6,5. CS mang điện dương, có tính base yếu, thấm nước, tan trong hầu hết các dung dịch
các
kết
-(1-4)-
hóa và các men thủy phân.
nên
bị cắt mạch
DẠYKÈMQUYNHƠN OFFICIAL 34 ngoài, (nm) Bờ trong Bờ ngoài (mL/g) Độ tan (g/l nước) Khoang rỗng Bên ngoài α, (glucose)6 972 1,52 0,45 0,53 0,10 129,5 2,0 4,4 β, (glucose)7 1134 1,66 0,60 0,65 0,14 18,4 6,0 3,6 γ, (glucose)8 1296 1,77 0,75 0,85 0,20 249,2 8,8 5,4 Ví dụ, Hadian và cộng sự (2018) đã bào chế nano β CD chứa tinh dầu geraniol. Kết quả cho thấy các đặc tính lý hóa của tiểu phân nano bị ảnh hưởng bởi hàm lượng geraniol trong công thức với KTTP nằm trong khoảng 111-258 nm. Hiệu suất nano hóa cao nhất đạt 79,4 ± 5,4 % khi tỉ lệ tinh dầu và β CD bằng 0,44:0,13 và thế zeta âm bằng 21,1 ± 0,5 mV. Phổ 1H NMR đã cho thấy sự hình thành cấu trúc phức hợp. Sự hình thành phức hợp cũng đã dẫn đến sự thay đổi phổ IR, phổ DSC, hình ảnh SEM [51].
acid hữu cơ ở pH < 6,5 như acid formic, acid acetic, acid tartric và acid citric, nhưng không tan trong acid sulfuric và phosphoric. Do các monome của CS được nối với nhau bởi
liên
β
glycosid
dễ
bởi các chất hóa học như: acid, base, tác nhân oxy
Bảng 2.3. Một số loại chitosan trên thị trường
Loại CS
Sigma-Aldrich
Độ deactyl hóa (%)
Độ nhớt (cP)
Khối lượng Mv (kDa)
CS KLPT thấp 75 85 20 300 50 190
CS KLPT cao >75 800-2000 310-375
CS KLPT trung bình 75 85 200 800
HEPPE Medical Chitosan GmbH
Chitoscience CS 80/100 77,6 82,5 151 350
Chitoscience CS 80/200 77,6 82,5 71 150
Chitoscience CS 80/3000 77,6 82,5 2751 3250
Chitoscience CS 75/200 72,6 77,5 151 350
Chitoscience CS 75/100 72,6 77,5 71 150
Mv: KLPT trung bình liên quan độ nhớt [63] (Sigma Aldrich; HEPPE Medical Chitosan GmbH)
CS là một polyme thu hút nhiều sự quan tâm trong các ngành dược học, y học, răng hàm mặt, kỹ thuật mô liên quan đến nhiều tác dụng sinh học của nó như không độc hại, hoạt tính kháng vi sinh vật, tính tương thích sinh học, sự phân hủy sinh học, khả năng bám dính màng nhầy và khả năng mở tạm thời các khe hở hẹp của biểu mô, từ đó tạo điều kiện cho sự thâm nhập của thuốc [82]. Tính chất tích điện dương giúp cho CS hoạt động như một chất bám dính sinh học, có khả năng bám vào các bề mặt tích điện âm như màng nhầy. Ngoài ra nhiều nghiên cứu cho thấy CS có tác dụng độc tính in vitro kháng lại nhiều dòng tế bào ung thư người.
Mặc dù, CS có những đặc tính đáng chú ý nêu trên, nhưng do có độ tan bị giới hạn trong môi trường khá acid làm hạn chế những ứng dụng của nó. Tuy nhiên, việc kiểm soát đặc điểm cấu trúc của CS, chủ yếu là mức độ deacetyl hóa, sự phân bố của các đơn vị đã được deacetyl hóa, cũng như KLPT trung bình và khả năng phân tán có thể
tạo ra bằng cách kết hợp các nhóm kỵ nước nhưcác nhóm alkyl hay acyl vào khung CS dẫn đến khả năng hình thành các micell và nano do quá trình tự kết hợp trong môi trường nước. Ví dụ một số dẫn chất của CS như N naphthyl N,O succinyl chitosan, N-octyl-N,O-succinyl chitosan, và N-benzyl-N,O-succinyl chitosan, deoxycholic acidphosphorylcholin chitosan, N octyl O sulfat chitosan, N palmitoyl chitosan đã được ứng dụng trong bào chế các micell và nano polyme mang thuốc [82]
DẠYKÈMQUYNHƠN OFFICIAL 35
tạo các loại CS khác nhau với các đặc tính tốt, bao gồm độ tan cao trong môi trường sinh lý. Ngoài ra, việc biến đổi hóa học đã được thực hiện để tạo ra các dẫn xuất của CS với các đặc tính được tăng cường trong đó có độ tan, giúp tăng khả năng ứng dụng của CS. Do có nhóm hydroxyl và amin, CS có thể tạo ra các dẫn chất bằng các phản ứng alkyl hóa, acyl hóa, tạo dẫn chất amin bậc 4,... [82] Các dẫn chất lưỡng thân của CS được
Ví dụ, Chen Y. và cộng sự (năm 2009) đã sử dụng các polyme phân huỷ sinh học để tạo hệ nano chứa artemisinin giải phóng kéo dài với mục tiêu là hệ phân phối thuốc điều trị ung thư. Tinh thể dược chất được bao bởi chitosan, gelatin và alginat bằng kỹ thuật bao nhiều lớp với phân bố kích thước khoảng 766nm. Trong đó alginat bao ở lớp đầu tiên và lớp ngoài cùng và hai lớp gelatin/alginat (4 phần) và chitosan/alginat (6 phần) ở giữa. Các đặc tính của hệ nano được đánh giá bao gồm phân bố KTTP, thế zeta, hiệu suất nano hóa dược chất, tỷ lệ dược chất nano, mức độ hút ẩm, đánh giá bề cấu trúc và bề mặt tiểu phân (TEM/SEM) [29].
Dương Thị Ánh Tuyết và cộng sự (2011) đã nghiên cứu chế tạo vật liệu nano chitosan làm chất hấp phụ protein ứng dụng trong dẫn truyền thuốc. Hạt nano chitosan (CS) tripolyphosphat (TPP) đã được nghiên cứu chế tạo làm chất hấp phụ protein ứng dụng trong dẫn thuốc. Nghiên cứu đã đánh giá ảnh hưởng của các yếu tố đến kích thước hạt như các tác nhân tạo nối ngang, tỷ lệ CS/TPP, pH lên các đặc tính hoá lý của tiểu phân. Hiệu suất và khả năng hấp phụ protein của nano chitosan chế tạo được là 96,41% và 1,93mg/mg tại 0,5mg hạt nano chitosan [8] 2.1.1.2. Chất mang cho nano lipid
a. Lipid rắn
Lipid rắn thường được sử dụng là những lipid không độc với cơ thể, và có cấu tạo gần giống với lipid sinh lý. Lipid rắn bao gồm nhiều loại: glycerid (tristearin, glyceryl monostearat, glyceryl behenat, glyceryl palmitostearat…), acid béo (acid stearic, acid palmitic), steroid (cholesterol), sáp (cetyl palmitat) [4], [74].
Ví dụ, Baig và cộng sự (2016) đã bào chế nano lipid rắn chứa levofloxacin dùng trong nhãn khoa. Các lipid đã được khảo sát bao gồm acid stearic, glyceryl monosterat, Gelucire 39/1, Gelucire 50/13, Gelucire 54/14 (các triglycerid của các acid béo có nguồn gốc từ thực vật), Compritol 888 ATO (glyceryl behenat) Trong đó, acid stearic đã được sử dụng làm chất mang do có khả năng hòa tan levofloxacin với tỉ lệ lớn nhất. Tiểu phân được bào chế theo phương pháp bốc hơi dung môi với kết quả KTTP là 236 nm [19].
b. Lipid lỏng
Các triglycerid mạch trung bình (Medium chain triglycerides MCT) và acid oleic, α tocopherol/Vitamin E thường được sử dụng để bào chế giá mang lipid cấu trúc nano (NLC). Các triglycerid mạch trung bình thường là các phân đoạn của các dầu tự nhiên như dầu dừa hay dầu hạt cọ. Ngoài ra, một số loại dầu khác có thể được sử dụng như dầu bắp, dầu đậu nành, dầu
các tá dược lipid như acid stearic, glyceryl
vitamin E và chất diện hoạt là Tween 80 để bào chế nano NLC chứa vitamin E [43] Các lipid rắn, lỏng là các tá dược thông dụng trong bào chế thuốc mỡ, thuốc đạn, hay trong hệ màng bao. Người đọc có thể tham khảo các đặc điểm lý hóa của các tá dược này ở các giáo trình bào chế đã xuất bản.
DẠYKÈMQUYNHƠN OFFICIAL 36
hạt hướng dương như các loại lipid lỏng để tạo NLC [112]. Ví dụ, Chen yu và cộng sự (2012) đã sử dụng
monostearat, triglycerid mạch trung bình và chất diện hoạt là lecithin dầu đậu nành để bào chếnano NLC chứa quercetin. Hay Eiras và cộng sự (2017) đã sử dụng các tá dược lipid như Precirol ATO 5,
2.1.1.3. Chất mang cho tiểu phân nano khác
Các chất mang được sử dụng để bào chế liposome có thể là các phospholipid tự nhiên hay tổng hợp.

Phospholipid tự nhiên: Thường dùng là phosphatidylcholin (từ lecithin của trứng hoặc đậu tương), phosphatidylethanolamin, phosphatidylglycerol,...
Phospholipid tổng hợp: Distearoyl phosphatidylcholin, dioleoyl phosphatidylethanolamin, distearoyl phosphatidylethanolamin...
Đối với các phân tử dendrime, cấu trúc của chúng bắt đầu với một nguyên tử hoặc một nhóm nguyên tử trung tâm được đánh dấu là nhân. Từ cấu trúc trung tâm này, các nhánh của các nguyên tử khác gọi là dendron được phát triển thông qua nhiều phản ứng hóa học khác nhau [9].
Hình 2.7. Hình ảnh minh họa cấu trúc một dendrime G4 với 64 nhóm amin ở ngoại biên (Dendrime này được
các nhánh hay cánh tay được đính bởi phản ứng cộng
bởi phản ứng thủy phân amin của
DẠYKÈMQUYNHƠN OFFICIAL 37
bắt đầu từ nhân ethylen diamin;
hợp Michael với nhóm methyl acrylat theo sau
nhóm este methyl tạo thành bằng ethylen diamin) [9] 2.1.2. Chất ổn định Chất ổn định sử dụng trong các tiểu phân nano là các chất được thường được sử dụng với vai trò nhũ hóa để hình thành nhũ tương, ngăn cản sự kết tập của các tiểu phân nano, giúp ổn định hỗn dịch tiểu phân nano tạo thành. Trong đó, thường sử dụng các chất diện hoạt ion hóa hoặc không ion hóa như poloxame, polysorbat, lecithin, natri lauryl sulfat,… Sự phối hợp nhiều chất nhũ hóa có hiệu quả trong ngăn chặn sự kết tụ của các tiểu phân hơn là sử dụng một chất nhũ hóa. Loại chất nhũ hóa được lựa chọn phụ thuộc rất nhiều vào đường dùng và bị giới hạn với đường tiêm. Ngoài ra, có thể dùng các polyme như HPC (hydroxyl propyl cellulose), HPMC (hydroxyl propyl methyl cellulose), PVA (polyvinyl alcol), Povidon K15... ở dạng riêng lẻ hoặc phối hợp [117]







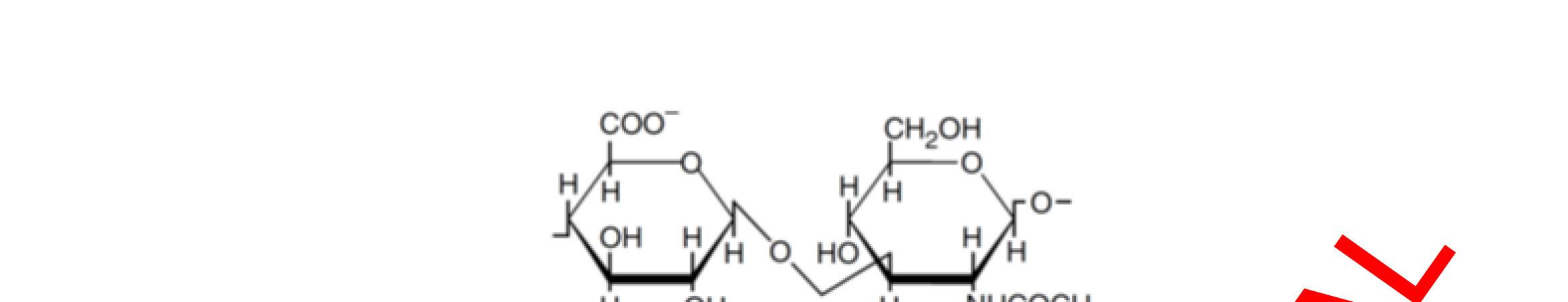








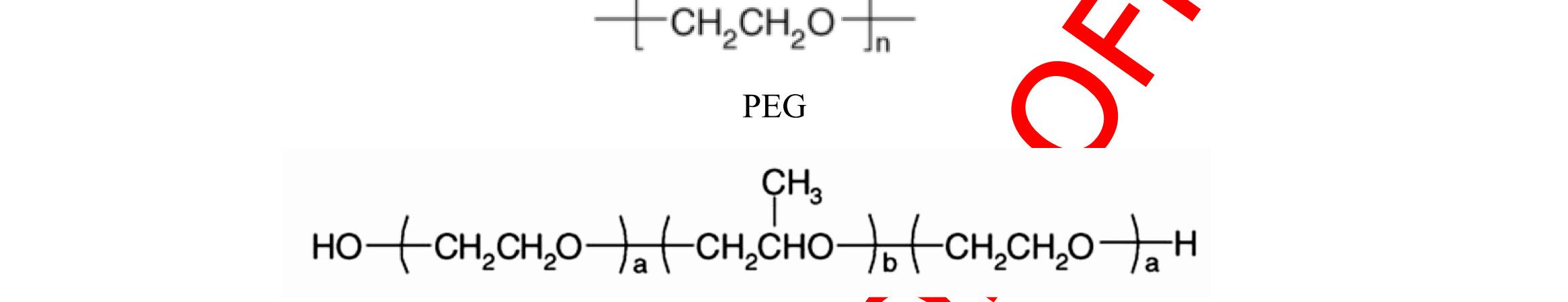
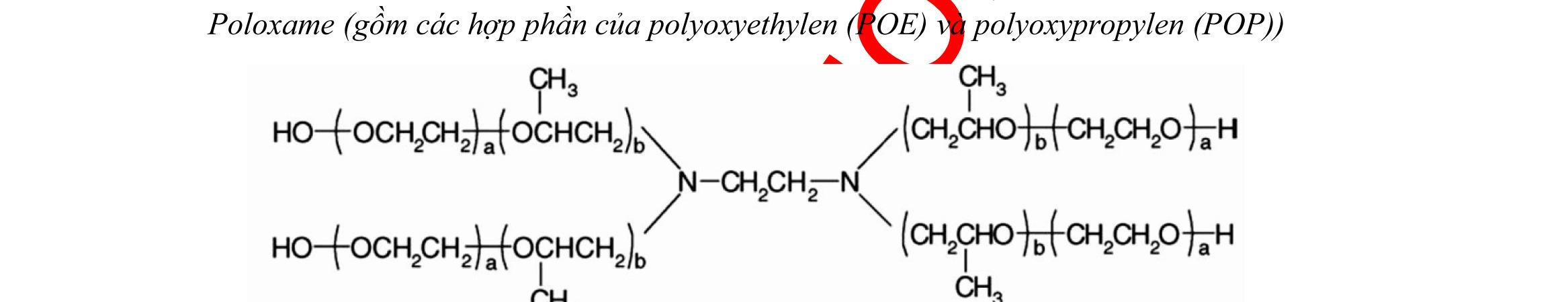








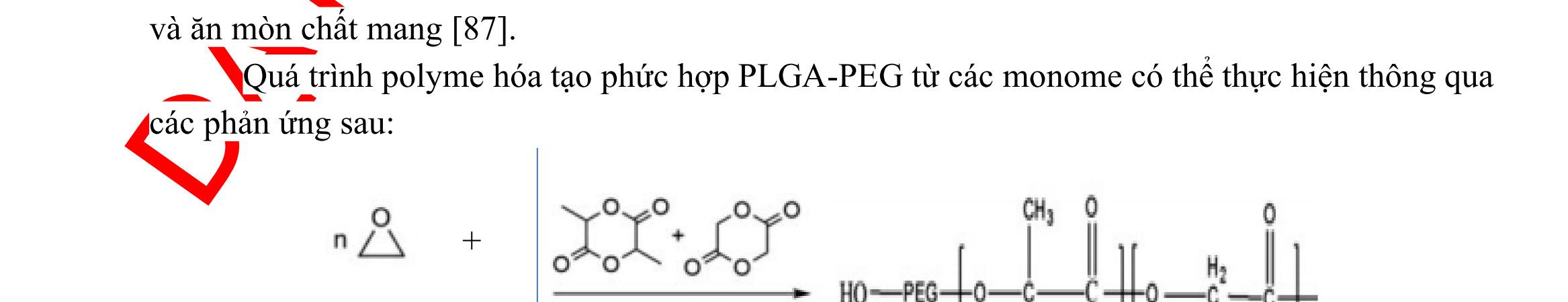



























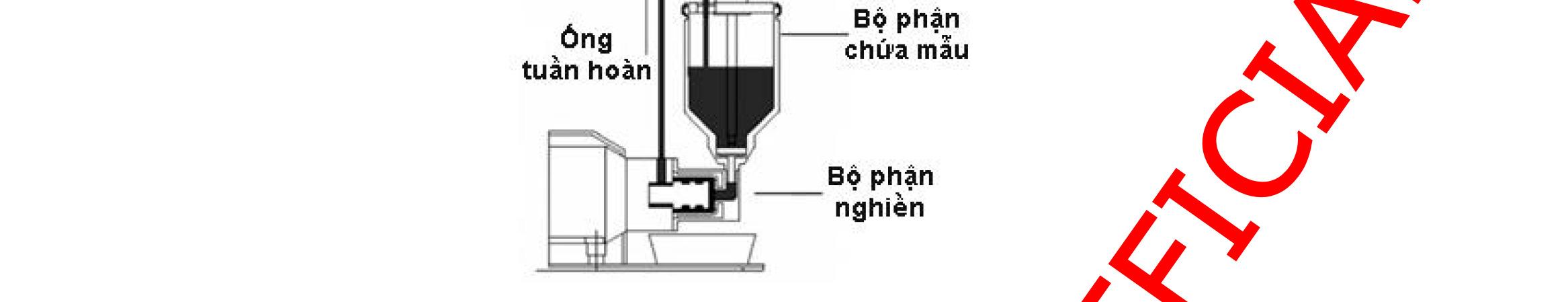




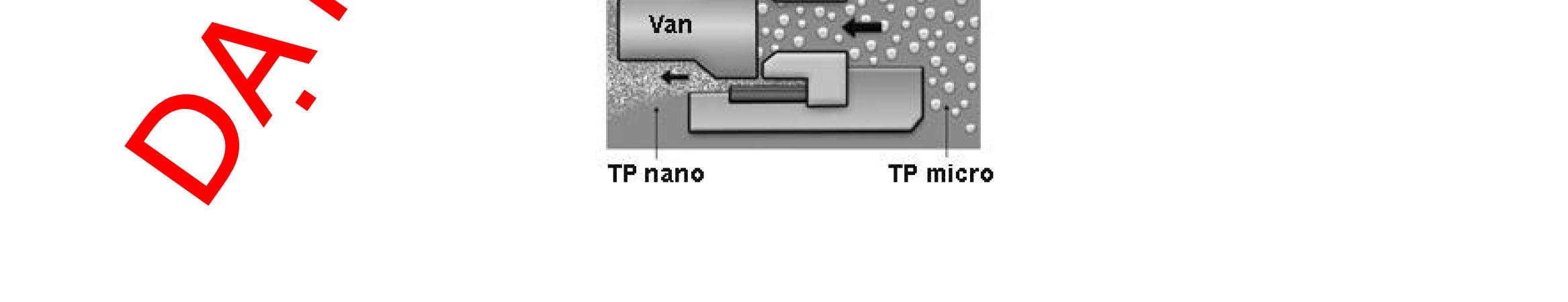
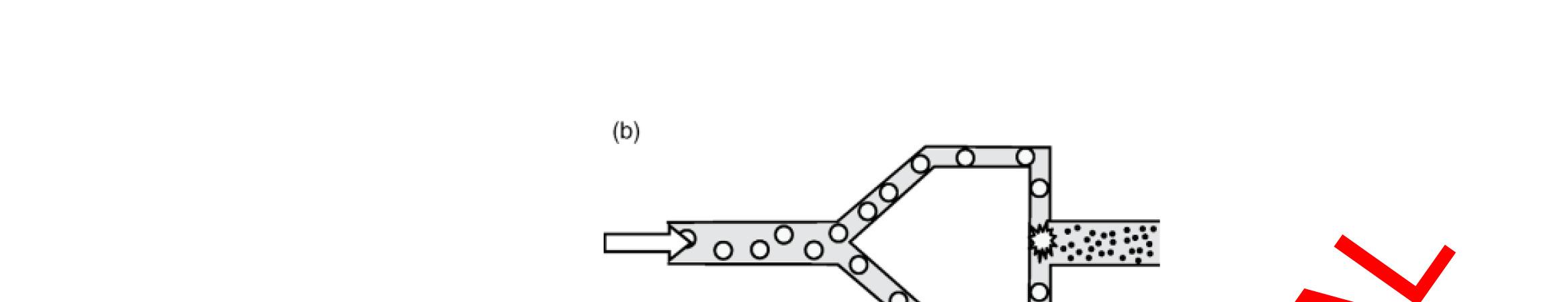













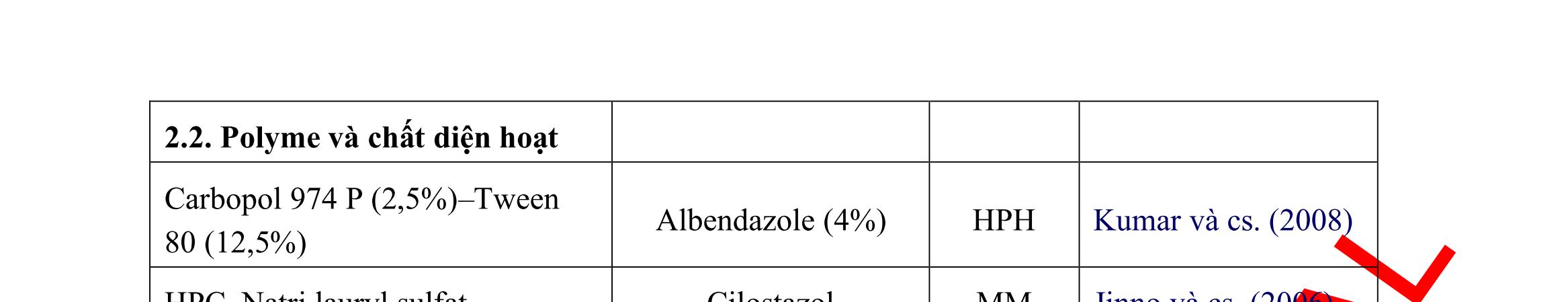









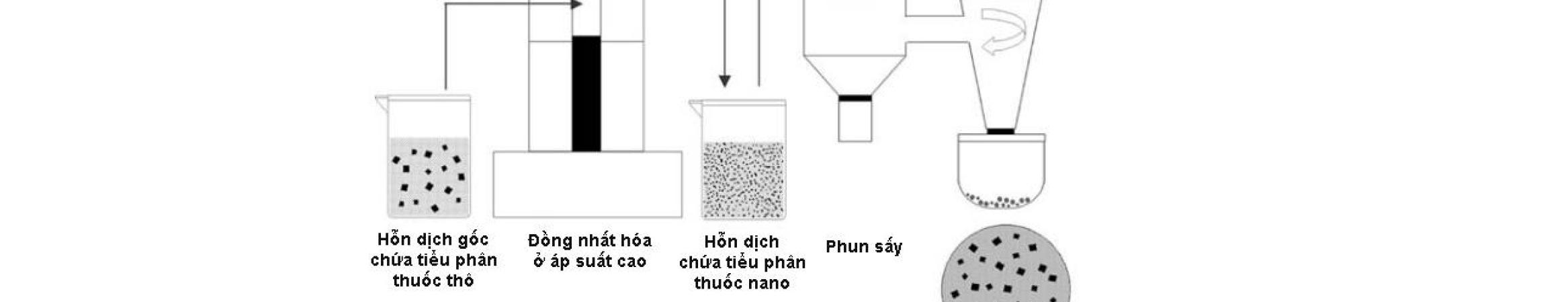






































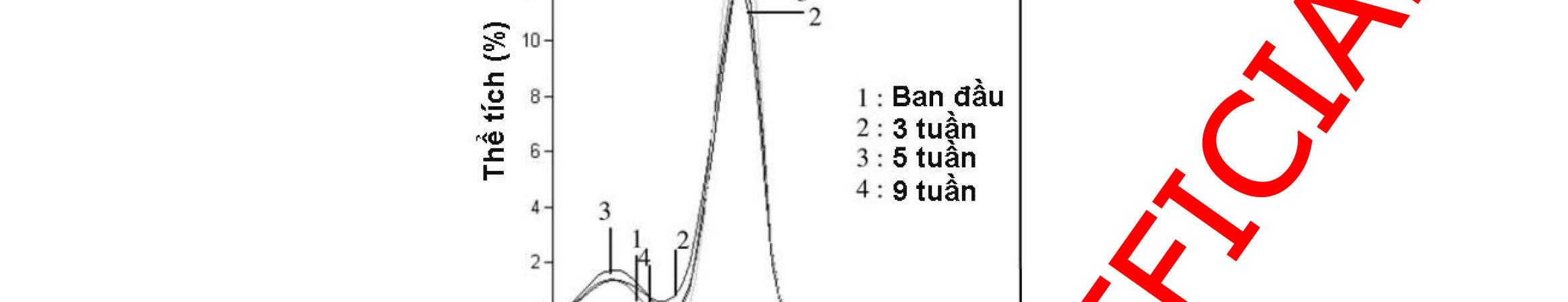




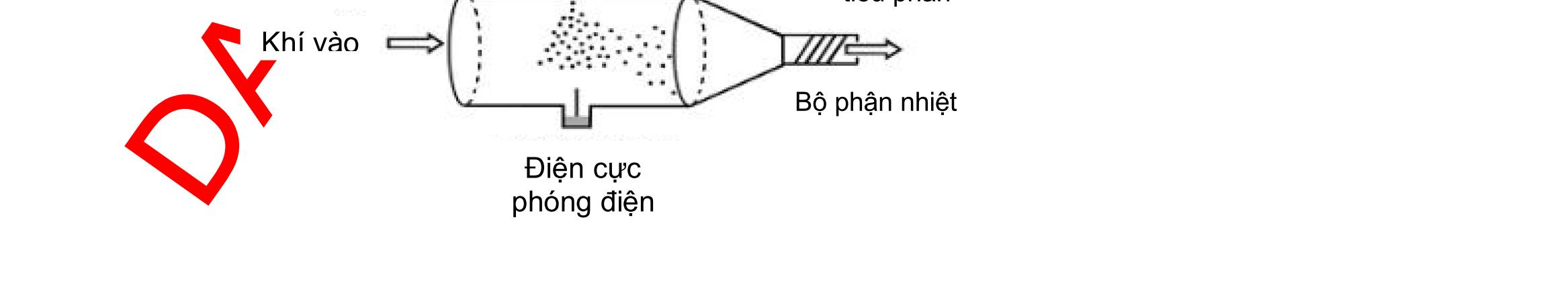


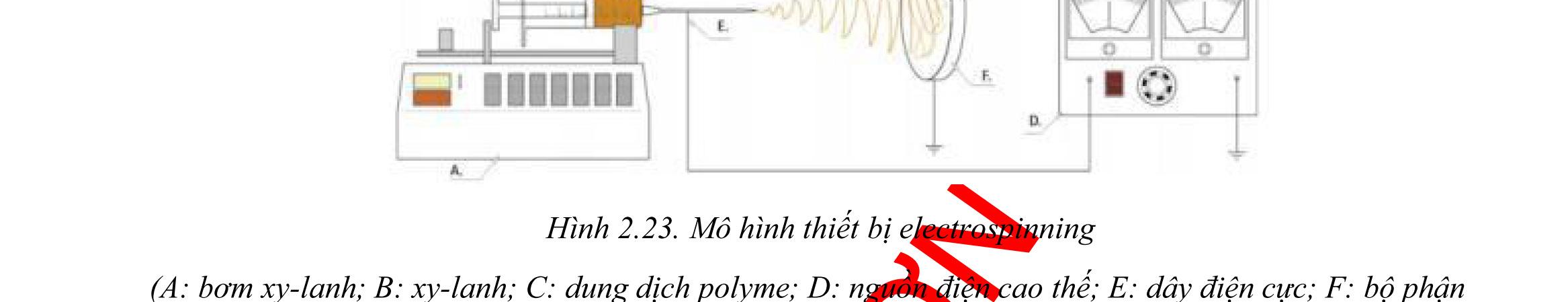













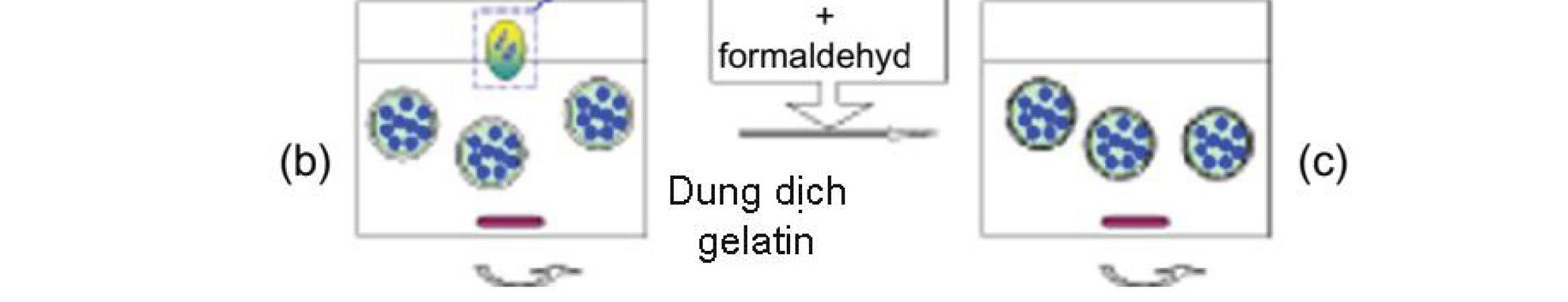





















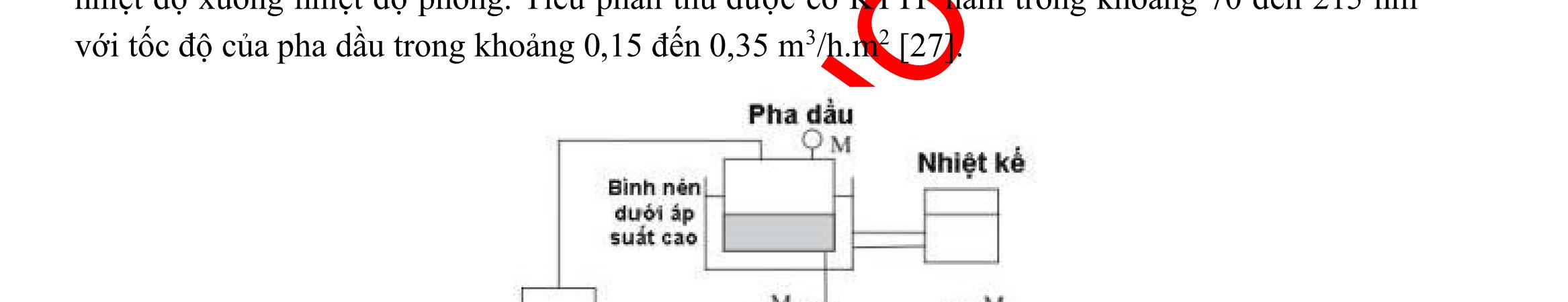
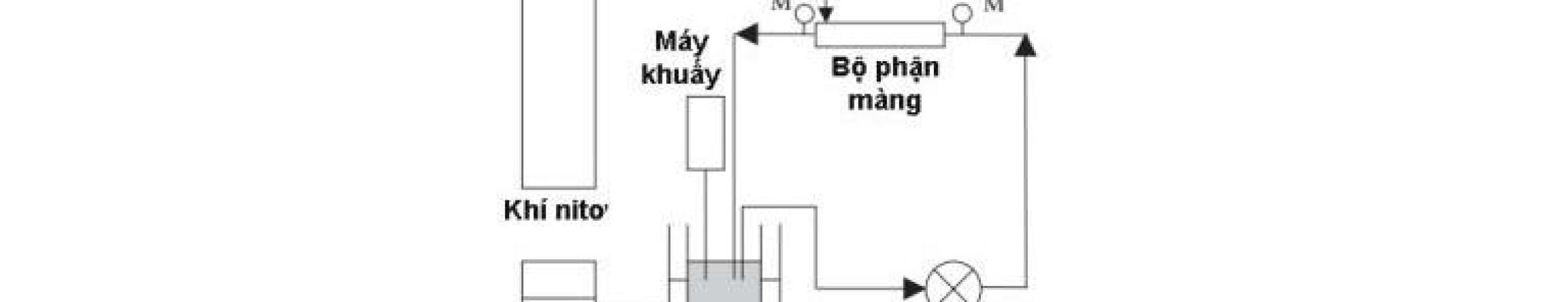












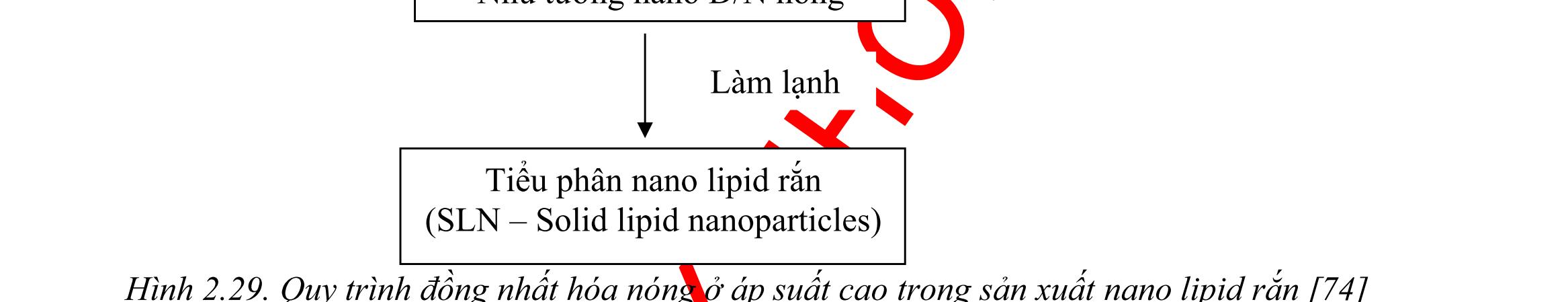



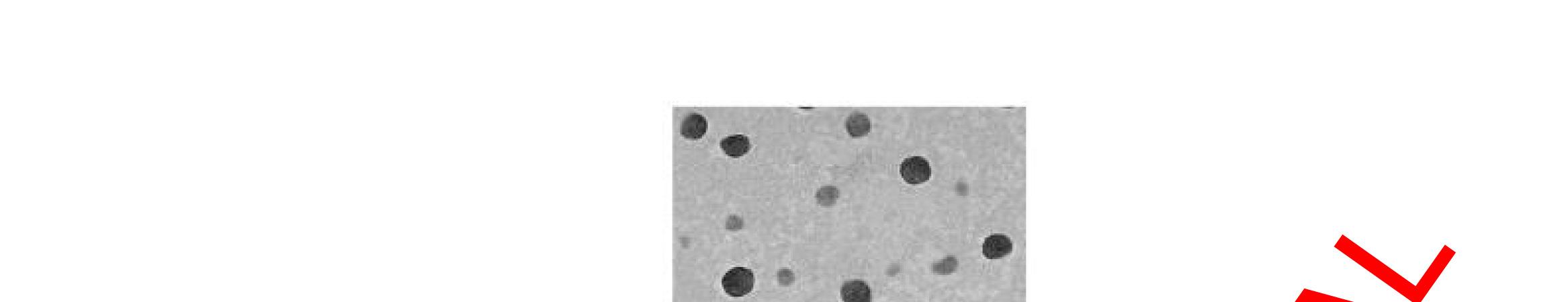




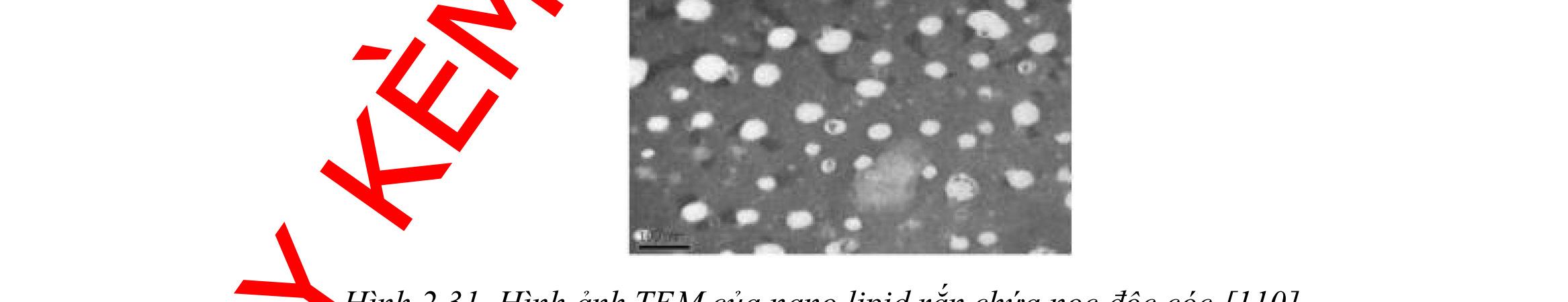

















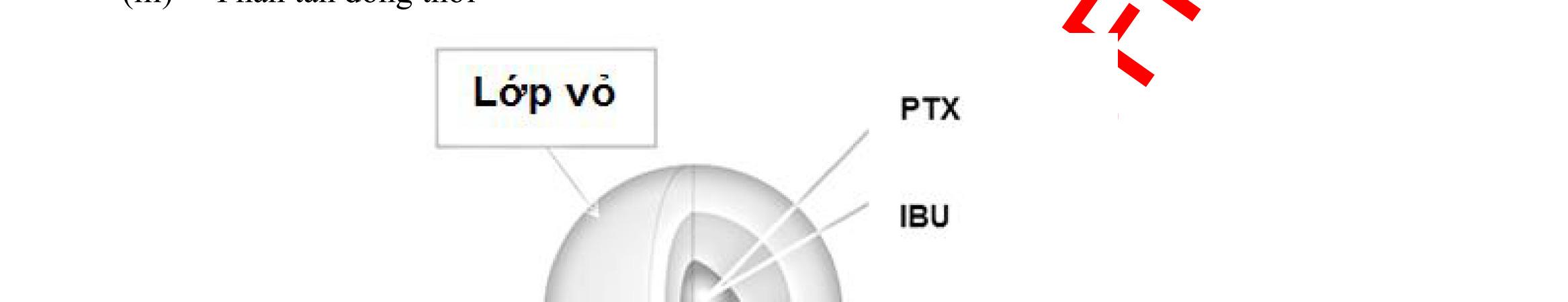

































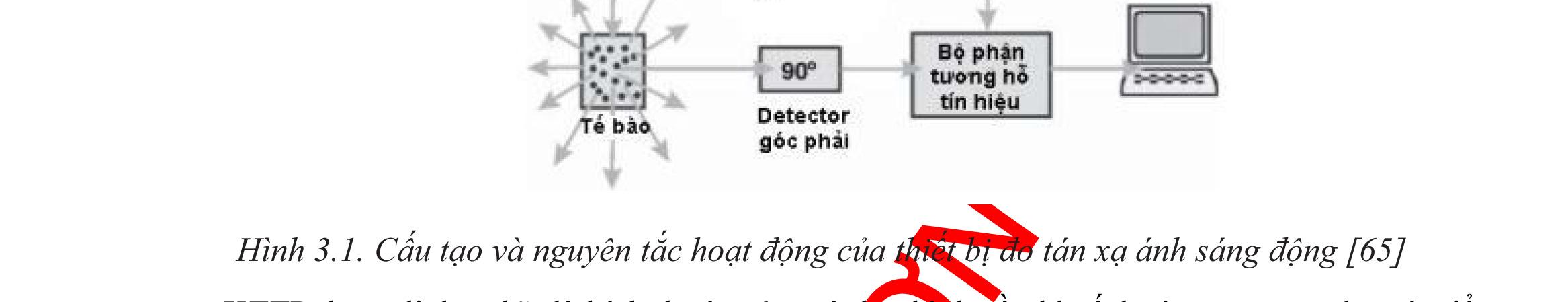







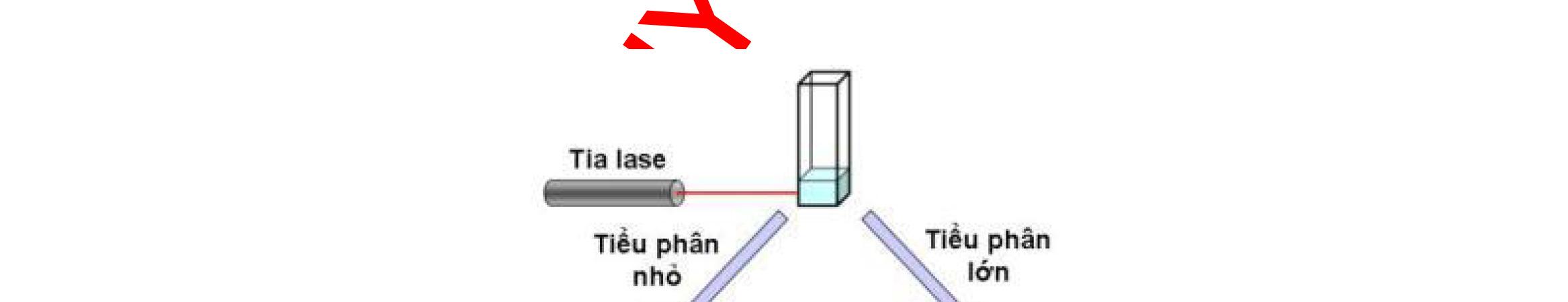























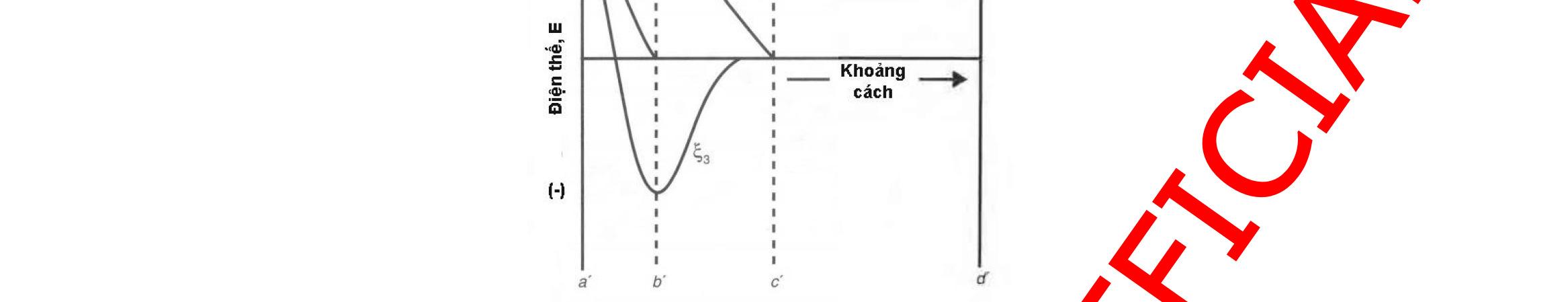


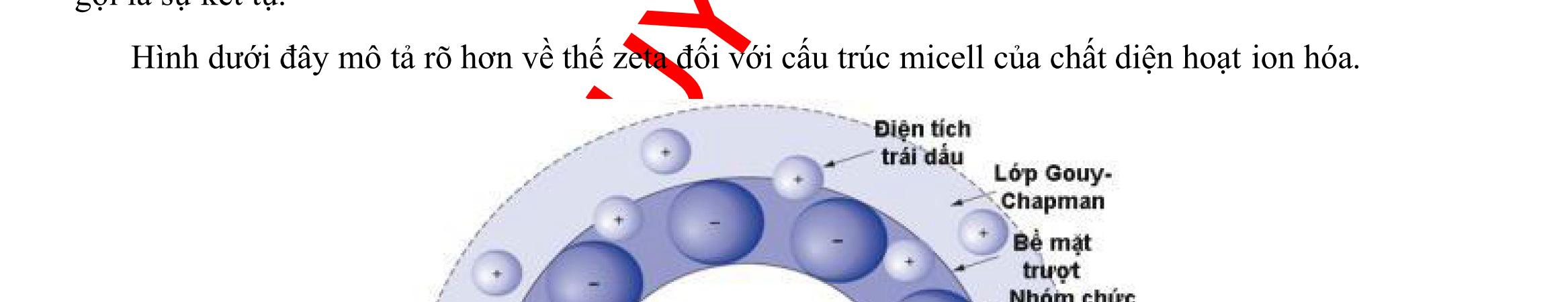






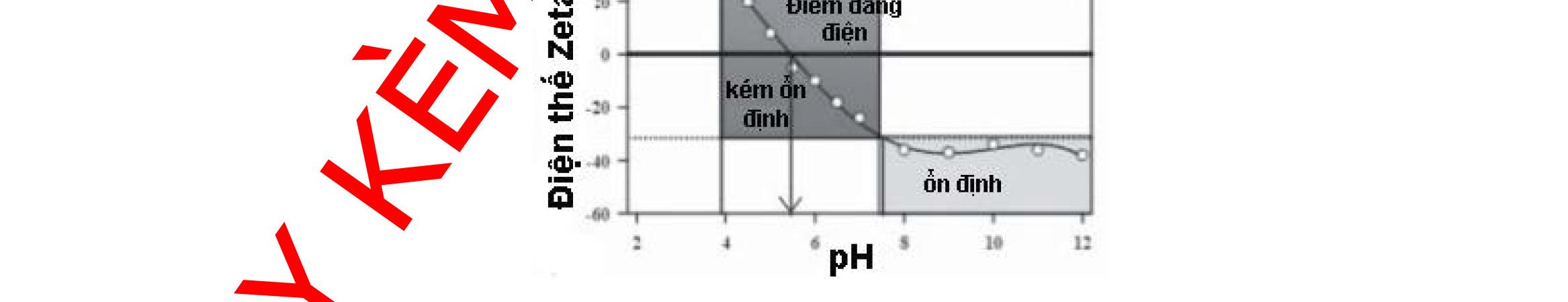





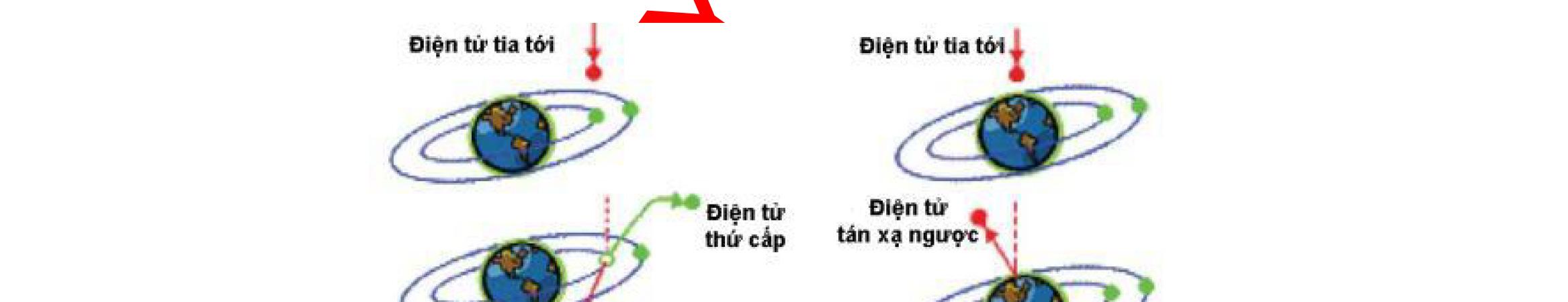







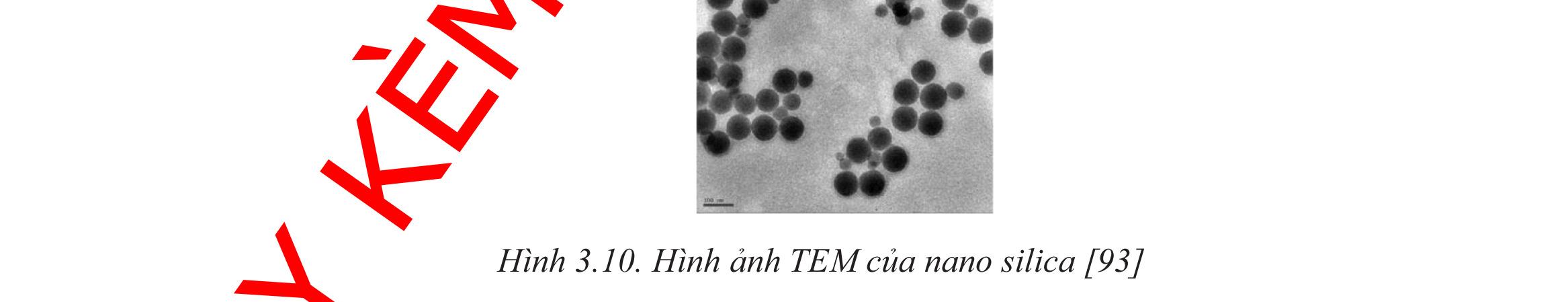





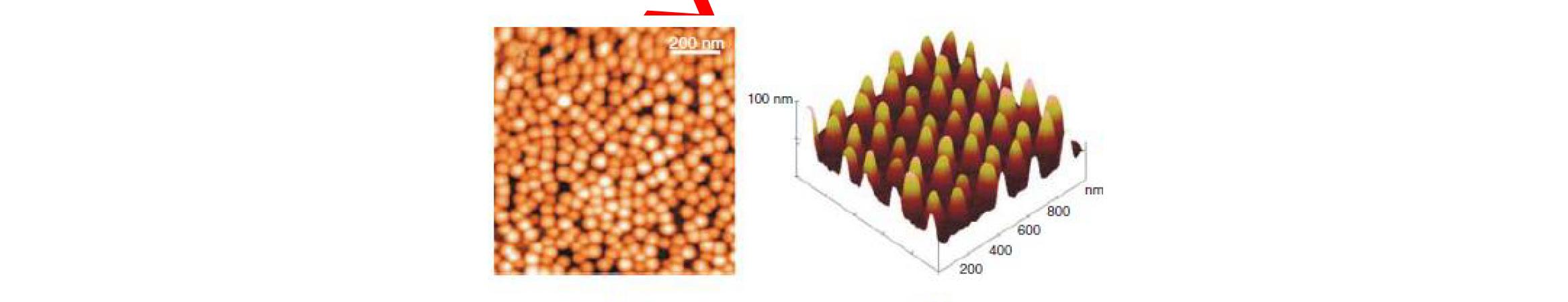

























































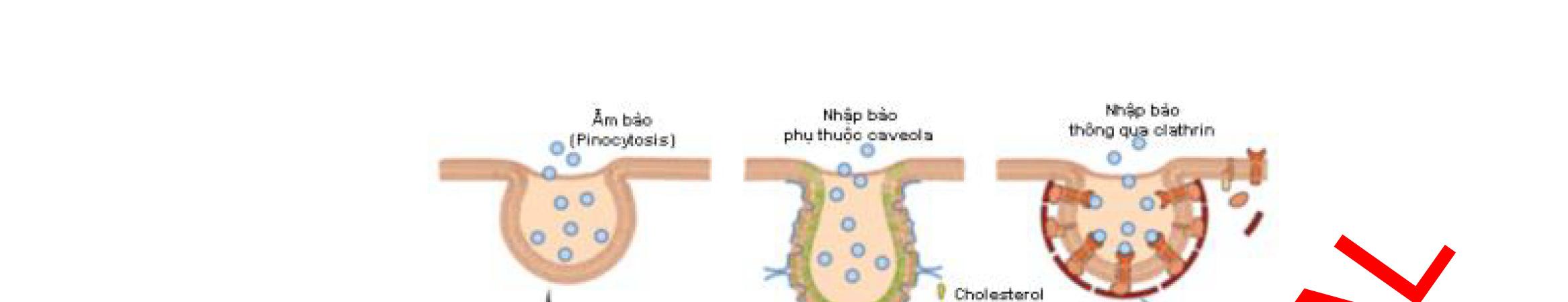









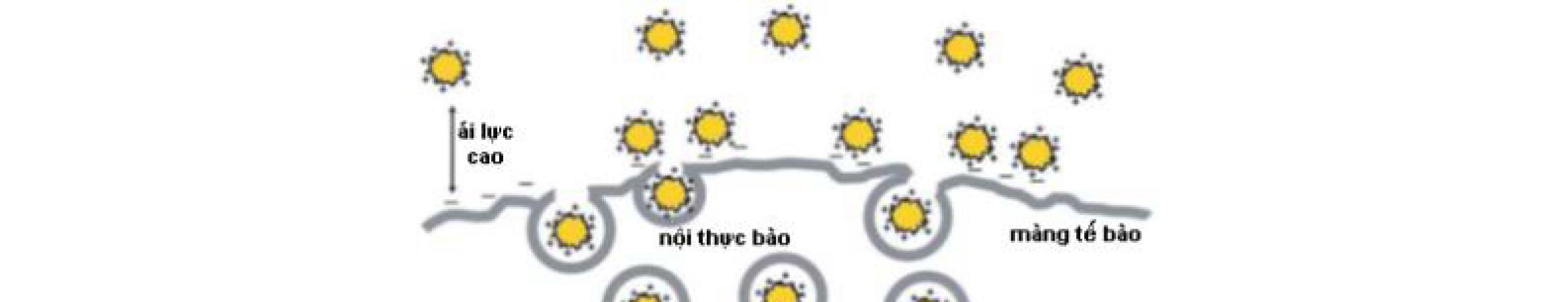
































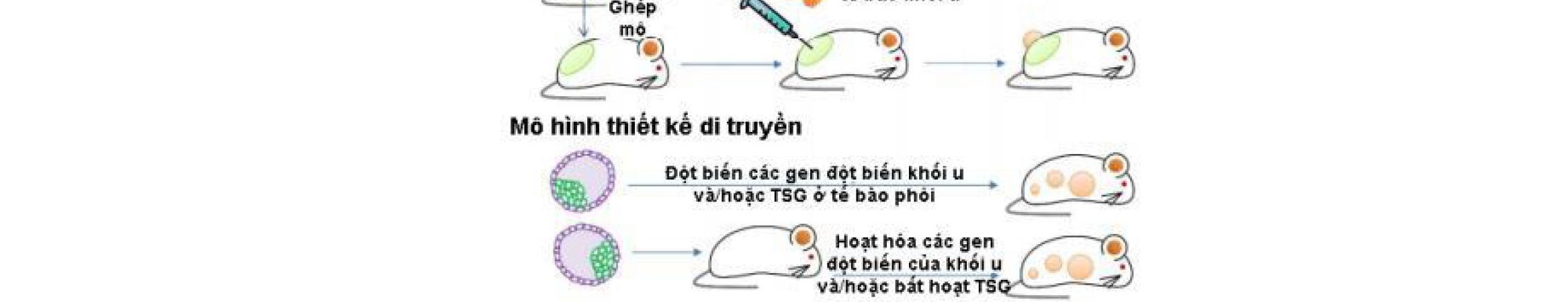








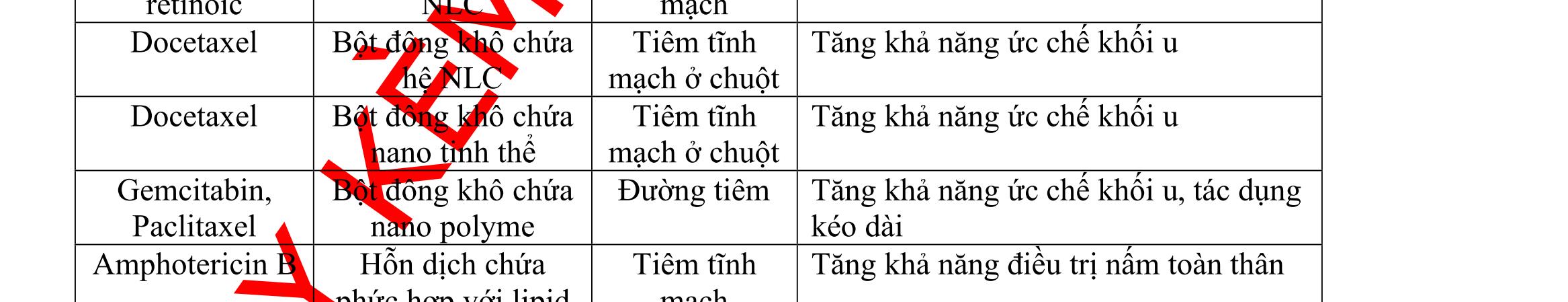




























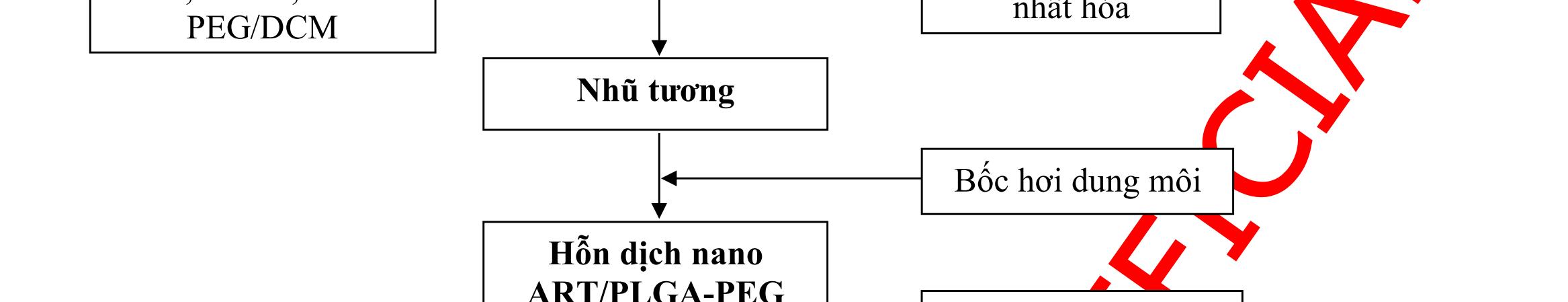















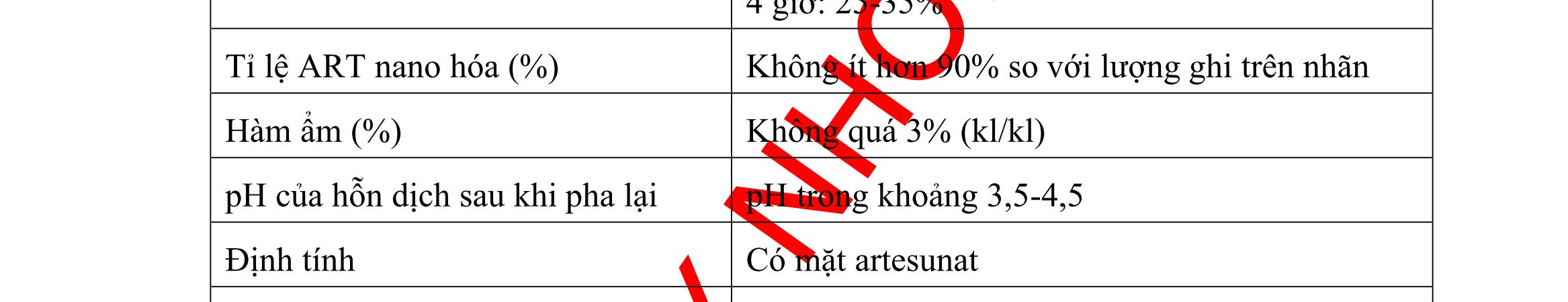
















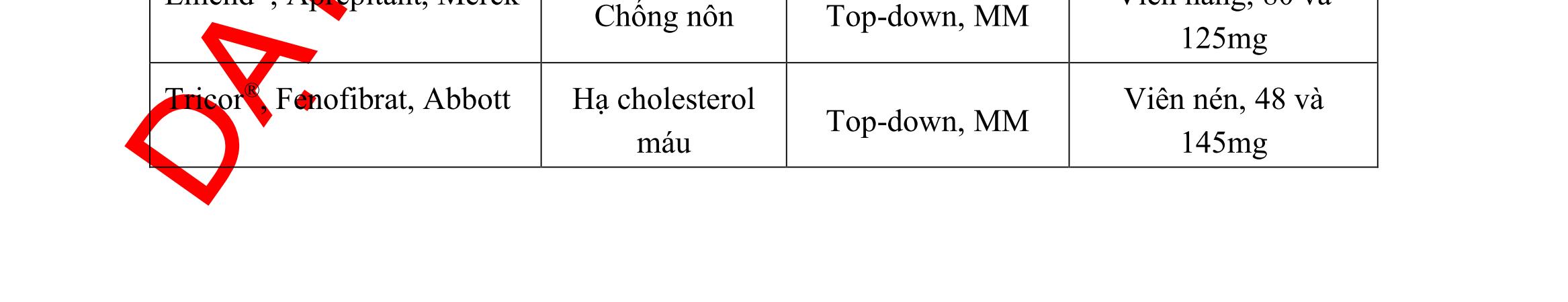
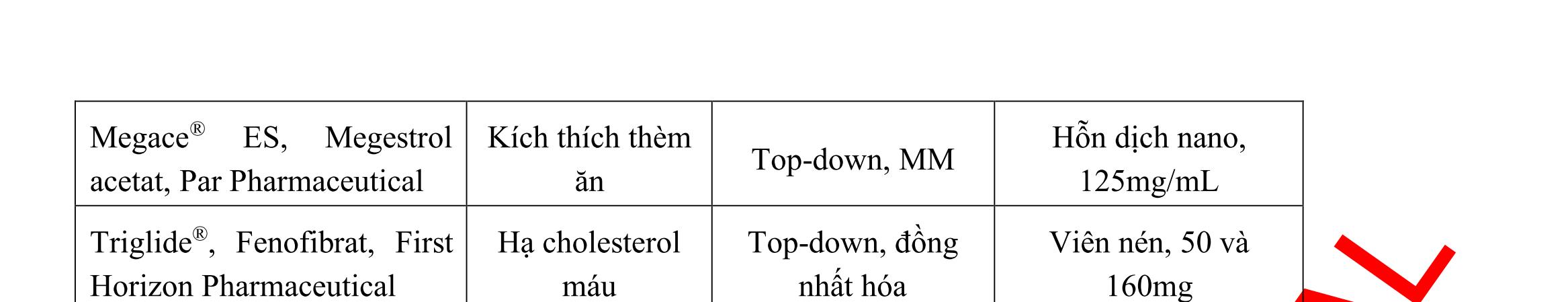
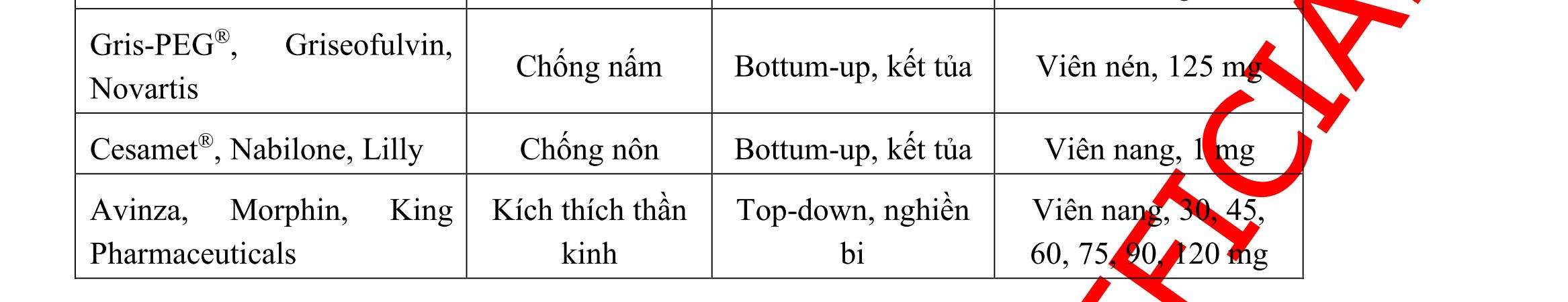





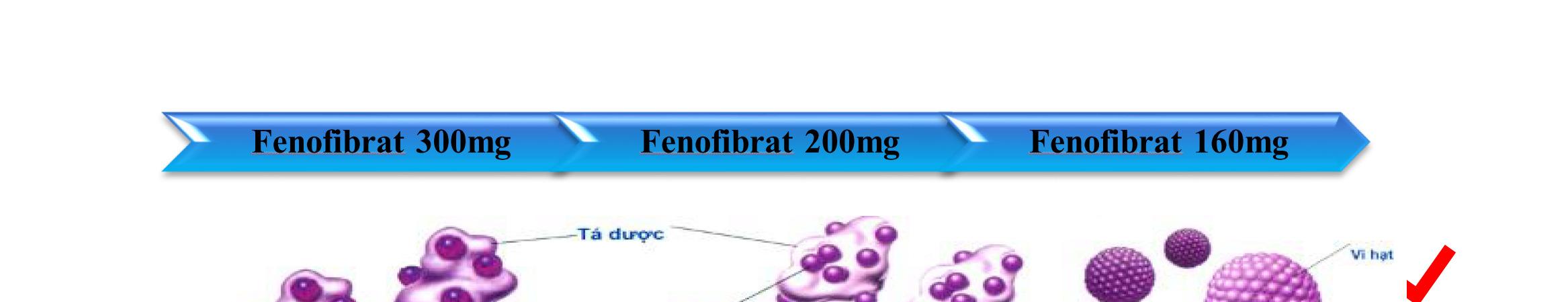







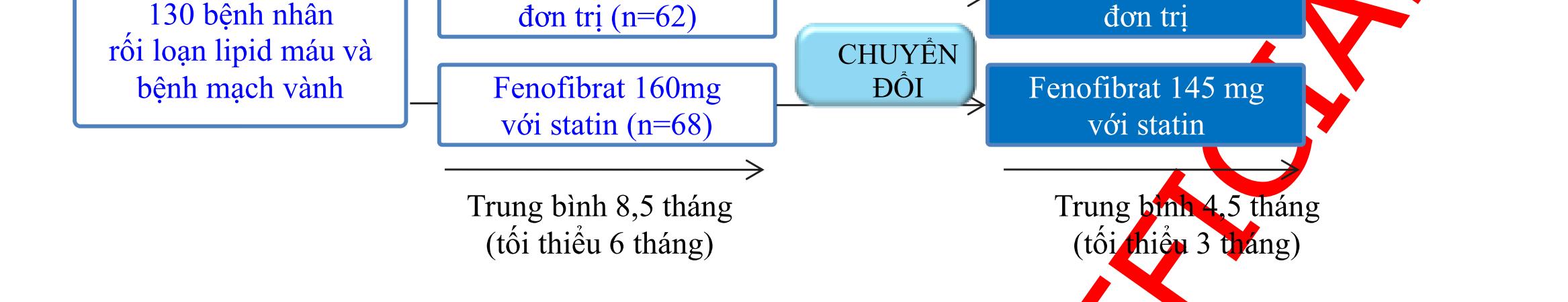



















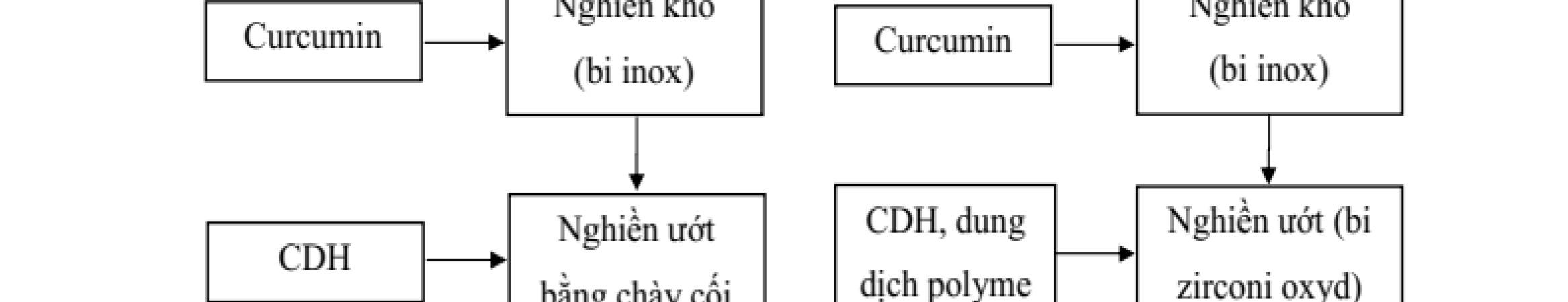
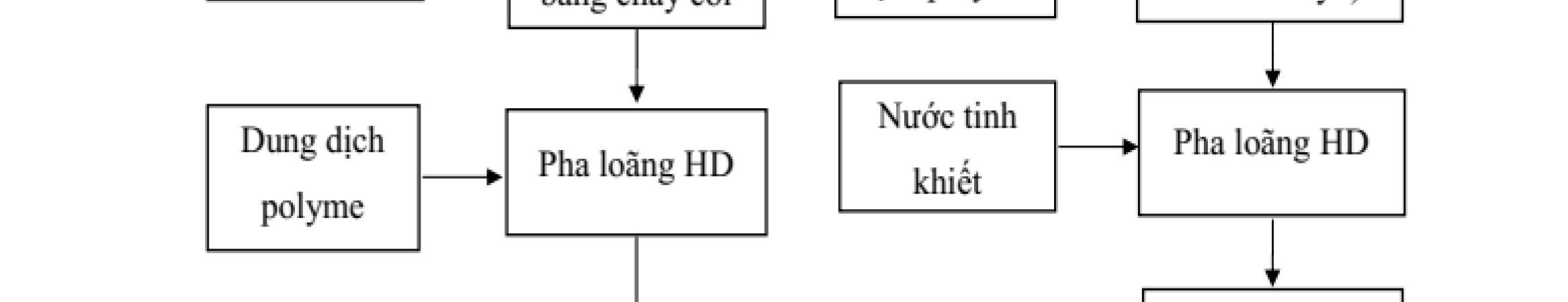




Công thức:
Curcumin 5,0 g
Tween 80 0,6g
Polyvinyl pyrolidon K30 3,75g
Manitol 2,50g
Nước tinh khiết 125ml
Mô tả:
+ Cân dược chất và tá dược theo tỷ lệ đã định.
+ Hòa tan polyme trong 10 ml nước nóng tạo dung dịch polyme.
+ Nghiền mịn curcumin bằng thiết bị nghiền bi inox, kích thước bi 20 mm, mỗi mẻ 5g trong mỗi buồng nghiền, với tần số nghiền 30 Hz và thời gian nghiền 6 giờ.
+ Phối hợp chất diện hoạt và dung dịch polyme, nghiền ướt bằng buồng nghiền chứa 25 g bi zirconi oxyd, kích thước bi 0,8 mm, mỗi buồng nghiền chứa 5 g dược chất, tần số nghiền 30 Hz trong thời gian 4 giờ.
+ Pha loãng hỗn dịch đặc bằng 100 ml nước tinh khiết. Lọc loại bi qua rây 300.
+ Đồng nhất hóa hỗn dịch nhờ lực phân cắt lớn với tốc độ 18000 vòng/phút trong thời gian 60 phút, cứ mỗi 15 phút lại cho máy nghỉ 5 phút.
+ Tiếp theo, tiến hành bào chế bột phun sấy chứa tiểu phân nano curcumin, cụ thể như sau:
Đối với mẻ 1 g, tiến hành phun sấy hỗn dịch nano thu được ở trên.
Đối với mẻ 5 g, hòa tan chất mang thân nước vào 15 ml nước còn lại, phối hợp với hỗn dịch nano. Quá trình phun sấy được tiến hành với các thông số: Nhiệt độ đầu vào 96oC, tốc độ cấp dịch 2 ml/phút và tỷ lệ thông gió 99% (có thể thay đổi phù hợp với điều kiện khảo sát) trên thiết bị phun sấy Buchi mini spray dryer B 191. Hỗn dịch nano được khuấy từ liên tục trong thời gian phun sấy. Bột phun sấy được thu hồi trên cả cyclon và bộ phận thu hồi sản phẩm trong phòng kín với độ ẩm
thủy tinh, đậy nút cao su và chụp nắp nhôm. Các
DẠYKÈMQUYNHƠN OFFICIAL 114
khoảng 30 40%. Bột phun sấy được đóng vào lọ
lọ thủy tinh được bọc kín, tránh ánh sáng và bảo quản trong bình hút ẩm. Trong quy trình bào chế bột phun sấy chứa nano curcumin dùng cho đường uống ở phần trên, các yếu tố ảnh hưởng đến đặc tính lý hóa của tiểu phân nano đã được khảo sát bao gồm các thông số thuộc công thức như loại chất diện hoạt, tỉ lệ chất diện hoạt, loại polyme, tỉ lệ polyme,… và các thông số thuộc quy trình như tốc độ đồng nhất hóa, thời gian đồng nhất hóa, quy trình phun sấy như nhiệt độ khí vào, tốc độ phun dịch,...
4.2.4. Đánh giá các chỉ tiêu chất lượng thuốc dùng đường uống chứa tiểu phân nano
4.2.4.1. Chỉ tiêu chất lượng
Chỉ tiêu chất lượng thuốc sử dụng đường uống chứa tiểu phân nano bao gồm các chỉ tiêu chất lượng chung của thuốc sử dụng đường uống (như thuốc viên nén, thuốc viên nang) và các chỉ tiêu chất lượng đặc thù của tiểu phân nano.
Do đó, các chế phẩm thuốc dùng đường uống cần phải đạt các chỉ tiêu chất lượng chung của thuốc dùng đường uống như hình thức, độ rã, độ hòa tan, định lượng, độ đồng đều khối lượng, độ đồng đều hàm lượng,... Ngoài ra, đối với các chế phẩm thuốc dùng đường uống chứa tiểu phân nano, các tính chất của tiểu phân nano cần được minh chứng như KTTP, phân bố KTTP, hình thái tiểu phân, đặc tính và chức năng bề mặt của tiểu phân, thành phần và độ tinh khiết, khả năng giải phóng dược chất,... Về tiêu chuẩn chất lượng, trong nghiên cứu bào chế bột phun sấy chứa tiểu phân nano curcumin đã đề cập ở mục 4.2.3 để đóng nang dùng đường uống, tiêu chuẩn cơ sở của bột phun sấy được đề xuất như ở bảng 4.6. Bảng 4.6. Dự kiến tiêu chuẩn chất lượng của bột phun sấy chứa nano curcumin [2]
Chỉ tiêu
Dự kiến tiêu chuẩn
Hình thức Bột màu vàng, tơi xốp
Kích thước tiểu phân (nm)
Hệ số đa phân tán PDI < 500 < 0,550
Mất khối lượng do làm khô (%) 12,0
Khối lượng riêng biểu kiến (g/ml) 0,250 Định tính
Sắc ký đồ có 1 pic với thời gian lưu trùng với thời gian lưu của pic curcumin chuẩn
Hàm lượng
Độ
trong bột phun sấy (%) 40,00 43,50
≥ 95,0 % sau 60 phút
lý hóa của tiểu phân nano như KTTP và phân bố
DẠYKÈMQUYNHƠN OFFICIAL 115
curcumin
hòa tan
4.2.4.2. Phương pháp đánh giá Các phương pháp đánh giá một số đặc tính
KTTP, điện tích bề mặt, hình thái cấu trúc hạt, thành phần, tương tác hóa học và trạng thái kết tinh, khả năng nạp thuốc và hiệu suất nano hóa, khả năng giải phóng thuốc in vitro đã được trình bày trong chương 3. Áp dụng đối với bột phun sấy chứa nano curcumin trong mục 4.2.3, các phương pháp đánh giá một số tính chất của tiểu phân nano được trình bày cụ thể như sau: Đánh giá hình thái và kích thước hệ tiểu phân nano bằng kính hiển vi điện tử quét (Scanning Electron Microscope SEM)
Phân tán bột phun sấy chứa nano curcumin vào nước để tạo hỗn dịch nano. Hỗn dịch nano được ly tâm ở tốc độ 10000 vòng/phút trong 10 phút để thu lấy kết tủa, rửa tủa 3 lần bằng nước tinh khiết, làm khô ở nhiệt độ 40 50oC và chụp SEM. Bột phun sấy chứa nano curcumin được chụp SEM trực tiếp.
Tiến hành: Phân tán mẫu bột curcumin trên một khung carbon, sau đó phủ một
phóng
δ = 1,0 nm, điện áp gia tốc U = 10 kV. Đánh giá kích thước tiểu phân trung bình và khoảng phân bố kích thước tiểu phân hoặc hệ số đa phân tán
Tiến hành đánh giá KTTP và khoảng phân bố KTTP (Span) của mẫu curcumin trong giai đoạn nghiền khô và nghiền ướt bằng thiết bị đo Mastersizer 3000E. Đối với mẫu nghiền khô, tiến hành phân tán trong môi trường nước chứa 0,1% Tween 80. Đối với mẫu nghiền ướt, tiến hành phân tán trong nước tinh khiết. Mẫu được phân tán trong môi trường nước chứa 0,1% Tween 80, pha loãng hỗn dịch đến khi thu được hỗn dịch có độ che mờ khoảng 11 15% (xác định bởi thiết bị Mastersizer 3000E). Khuấy đồng nhất và siêu âm trên thiết bị đo để đảm bảo mẫu thử đồng nhất. Tiến hành đo khi mẫu thử không còn bọt khí. Từ các thông số thu được về kích thước tiểu phân, trung bình KTTP theo thể tích (d [4,3]) và hệ số Span được sử dụng để đánh giá KTTP và phân bố KTTP.
Hỗn dịch nano trước khi phun sấy và bột phun sấy chứa tiểu phân nano được tiến hành xác định kích thước và phân bố kích thước bằng thiết bị đo thế zeta và xác định phân bố KTTP Zetasizer Nano ZS90 Malvern. Hỗn dịch nano hoặc bột phun sấy chứa tiểu phân nano được phân tán trong nước tinh khiết đến nồng độ DC sao cho tốc độ đếm tiểu phân khoảng 150 250 kcps. Hệ số tán xạ ánh sáng của curcumin là 1,42. Ánh sáng tán xạ được đo ở góc 90o .
Phương pháp xác định thế zeta Hỗn dịch nano curcumin được pha loãng đến nồng độ tương tự như mẫu đo KTTP trước khi đưa vào máy đo, sử dụng thiết bị Zetasizer ZS90 Malvern với cuvet nhựa có 2 lá điện cực bằng đồng
Phương pháp xác định diện tích bề mặt và độ xốp Nguyên tắc: Dựa theo thuyết hấp phụ Brunauer Emmet
DẠYKÈMQUYNHƠN OFFICIAL 116
lớp platin mỏng và đặt vào buồng soi mẫu của thiết bị. Sử dụng kính hiển vi điện tử FESEM Hitachi S 4800 có độ
đại M = 20-800000x, độ phân giải
Teller (BET) Khi bề mặt tiểu phân rắn tiếp xúc với chất khí, lớp hấp phụ được hình thành trên bề mặt. Lớp hấp phụ cũng được hình thành trên bề mặt lỗ xốp bên trong tiểu phân và khí bị ngưng tụ trong lỗ xốp. Ở nhiệt độ hằng định, lượng khí hấp phụ hoặc ngưng tụ trên bề mặt là hàm số của áp suất khí. Dựa vào sự thay đổi áp suất khí, tính toán được lượng khí hấp phụ hoặc ngưng tụ. Xây dựng đường hấp phụ đẳng nhiệt theo thuyết BET và xác định diện tích bề mặt theo thuyết BET. Thể tích lỗ xốp và đường kính trung bình của lỗ xốp được xác định dựa vào quá trình hấp phụ và phản hấp phụ của khí nitrogen trên bề mặt lỗ xốp Tiến hành: Hút chân không và cung cấp nhiệt để làm khô bột phun sấy chứa nano curcumin ở 100oC và làm sạch bề mặt tiểu phân, lỗ xốp. Khi bề mặt tiếp xúc với khí nitrogen, nitrogen sẽ hấp phụ lên bề mặt và hệ thống mao quản của mẫu tại nhiệt độ nitrogen lỏng ( 196oC)
Định lượng
Hàm lượng curcumin trong các mẫu nghiên cứu được định lượng bằng phương pháp quang phổ hấp thụ UV Vis hoặc HPLC.
✓ Phương pháp quang phổ hấp thụ UV Vis
Quét phổ dung dịch curcumin có nồng độ 5 g/ml trong khoảng bước sóng từ 200 đến 600 nm, lựa chọn bước sóng tại đó curcumin đạt cực đại hấp thụ. Từ dung dịch A pha loãng thành các dung dịch curcumin chuẩn có nồng độ 1; 2; 2,5; 4; 4,5; 5 và 7,5 g/ml. Đo độ hấp thụ của các dung dịch chuẩn tại bước sóng đã lựa chọn với mẫu trắng là dung môi pha loãng và xây dựng đường chuẩn biểu diễn mối tương quan giữa độ hấp thụ và nồng độ curcumin. Dung dịch thử được chuẩn bị bằng cách thay curcumin chuẩn bằng một lượng bột phun sấy chứa nano curcumin tương ứng với 10,0 mg curcumin.
✓ Phương pháp sắc ký lỏng hiệu năng cao
Dung môi pha loãng: Hỗn hợp methanol: acid acetic băng (99:1, tt/tt).
Dung dịch chuẩn: Cân chính xác khoảng 10,0 mg curcumin chuẩn, hòa tan trong dung môi pha loãng, chuyển vào bình định mức 100 ml, thêm dung môi pha loãng tới vạch và lắc kỹ được dung dịch B. Hút chính xác một lượng dung dịch B, thêm dung môi pha loãng tạo thành dung dịch có nồng độ 5 µg/ml, lọc qua màng lọc kích thước lỗ lọc 0,45µm.
- Dung dịch thử được chuẩn bị tương tự như dung dịch chuẩn nhưng thay curcumin chuẩn bằng một lượng bột phun sấy chứa nano curcumin tương ứng với 10,0 mg curcumin.
Pha động: Acetonitril : dung dịch acid acetic 2% (kl/tt) (58:42), được lọc qua màng lọc kích thước lỗ lọc 0,45 µm. Tốc độ dòng: 1,5 ml/phút. Thể tích tiêm mẫu: 20 µl. Detector UV-Vis phát hiện ở bước sóng 430 nm. Phương pháp đánh giá độ hòa tan của curcumin
của bột phun sấy chứa nano curcumin được xác định bằng phép thử độ hòa tan với các điều
Mức độ và tốc độ hòa
cụ thể như sau: - Thiết bị: máy cánh
DẠYKÈMQUYNHƠN OFFICIAL 117
tan
kiện
khuấy, tốc độ quay 100 vòng/phút Môi trường hòa tan: 900 ml nước chứa 0,2% Tween 80 Nhiệt độ môi trường hòa tan: 37 ± 0,5oC Khối lượng mẫu thử: Tương ứng với 5,0 mg curcumin Cách tiến hành: Cho các mẫu thử vào cốc có mỏ chứa một lượng môi trường thử độ hòa tan, siêu âm 3 4 giây và chuyển vào cốc chứa môi trường thử hòa tan. Sau các khoảng thời gian 10, 20, 30, 40, 50 và 60 phút, lấy khoảng 10 ml dung dịch thử, ly tâm 5 phút với tốc độ 12000 vòng/phút. Phần dịch trong được định lượng curcumin bằng phương pháp quang phổ hấp thụ UV Vis ở bước sóng 427 nm, sử dụng mẫu trắng là dung dịch Tween 80 0,2%. Sau khi đo quang, rót toàn bộ phần cắn và phần dịch ly tâm vào cốc thử độ hòa tan.
Ngoài ra, thành phần, tương tác hóa học và trạng thái kết tinh của các thành phần trong công thức bột phun sấy chứa nano curcumin còn có thể được xác định thông qua phổ nhiễu xạ tia X, phổ hồng ngoại và phân tích nhiệt vi sai.
Đồng thời, bột phun sấy chứa nano curcumin đã được đánh giá sinh khả dụng đường uống trên mô hình chuột thí nghiệm và chứng tỏ dạng bào chế chứa nano curcumin có khả năng cải thiện sinh khả dụng của curcumin.
3. BÀO CHẾ THUỐC NHÃN KHOA
Các loại tiểu phân nano dùng bào chế thuốc nhãn khoa Nhiều hệ đưa thuốc dựa vào công nghệ nano đã được nghiên cứu để điều trị các bệnh về mắt từ nano tinh thể đến các hệ chất mang như nano polyme, nano lipid. Các bệnh lý liên quan của mắt trong các nghiên cứu khá đa dạng bao gồm hội chứng khô mắt, glaucom, viêm mắt do dị ứng,...
4.3.2. Các dạng thuốc chứa tiểu phân nano dùng cho nhãn khoa
Về phương diện giải phẫu, đối với thuốc nhãn khoa sẽ đưa thuốc đến vùng trước hoặc vùng sau của mắt. Các mô đích của phần trước mắt bao gồm giác mạc, mống mắt thể mi, thủy tinh thể. Các mô của phần sau mắt gồm màng mắt, võng mạc, dịch kính và thần kinh thị.
Quá trình đưa thuốc tại chỗ vào vùng trước của mắt có thể gặp trở ngại bởi một số yếu tố thuộc vùng giác mạc bao gồm dòng chảy nước mắt, sự nháy mắt, hàng rào biểu mô với sinh khả dụng của thuốc trong thủy dịch dưới 5%. Do đó, việc dùng thuốc thường xuyên là cần thiết đối với dạng thuốc nhãn khoa dùng tại chỗ, đặc biệt trong trường hợp thuốc có thời gian bán thải ngắn. Điều này sẽ ảnh hưởng đến sự tuân thủ của bệnh nhân. Vì vậy, dạng thuốc nano có thể được thiết kế để tăng cường khả năng đưa thuốc vào vùng trước nhãn cầu nhằm khắc phục một số hạn chế kể trên [50]
Tương tự, đối với vùng sau nhãn cầu, ngoài các yếu tố kể trên, thuốc còn phải vượt qua nhiều mô và rào cản mạch máu (như kết mạc, củng mạc, màng bồ đào, màng Bruch, biểu mô sắc tố võng mạc (RPE Retinal Pigment Epithelium) hoặcgiác mạc, thủy dịch, thủy tinh thể, dịch kính). Ngoài ra, đối với các thuốc nhỏ mắt truyền thống, thông thường chỉ có dưới 5% thuốc được sử dụng tại chỗ có thể đi qua giác mạc để đi vào các mô bên trong mắt. Do đó, để có thể tác dụng lên vùng sau nhãn cầu, thuốc cần được dùng một liều rất cao để có tác dụng toàn thân hay được sử dụng bằng con đường khác như tiêm nội nhãn. Tuy nhiên, những giải pháp này có thể dẫn đến tăng cường độc tính hoặc ảnh hưởng đến sự
toàn và việc tuân thủ của bệnh nhân như cao huyết áp, mạch nhanh, hen phế quản. Vì vậy, dạng nano có thể giúp duy trì khả năng đưa thuốc vào võng mạc cũng như đưa thuốc đi vào tế bào
DẠYKÈMQUYNHƠN OFFICIAL 118
4.
4.3.1.
an
hướng đến vùng sau nhãn cầu. Ngoài ra, còn có một số hệ đưa thuốc thay thế để kéo dài khả năng đưa thuốc vào vùng sau nhãn cầu như cấy, gắn vào củng mạc, ... [50]. Khả năng phân bố của các tiểu phân nano dùng trong nhãn khoa có thể được hình dung qua phác thảo ở hình 4.11.
Hình 4.11. Các con đường phân bố, thải trừ nano sau khi sử dụng tại chỗ, bôi quanh mắt hoặc tiêm nội nhãn (Đường đứt nét chỉ khả năng vận chuyển nano vào các mô đích ở ngay vùng phụ cận với vị trí tiêm, đường mũi tên hai chiều chỉ các con đường phân bố có khả năng xảy ra của các tiểu phân nano) [50]
Ngoài các rào cản vật lý, các mô ở mắt còn chứa các men chuyển hóa (như esterase, aldehyd và ceton reductase) có thể phân hủy và làm giảm hiệu lực của thuốc.

Một trong những nguyên nhân chính để phát triển các hệ phân phối thuốc khác với dung dịch nhỏ mắt đó là việc cần thiết giảm tần suất dùng thuốc bằng cách kéo dài tác dụng của thuốc, đặc biệt trong điều trị các rối loạn mạn tính của mắt. Điều này có thể thực hiện được bằng cách phân phối thuốc kéo dài hoặc cung cấp một liều lớn hơn. Bởi vì các hạn chế của dung dịch nhỏ mắt trong việc đưa thuốc liều cao vào các mô ở tiền phòng và khả năng kéo dài tác dụng bị hạn chế khi tăng liều nên nhiều phương pháp giúp kéo dài khả năng phân phối thuốc khác nhau đã thu hút nhiều nghiên cứu. Trong các dạng hỗn dịch chứa thuốc với khả năng giải phóng chậm hơn so với dạng dung dịch thì hệ phân phối thuốc mới như tiểu phân nano hay micro sẽ giúp kéo dài khả năng đưa thuốc khi sử dụng tại chỗ hoặc khi dùng đường tiêm. Các công thức nano giúp thuốc có thể duy trì nồng độ thuốc ở các mô tiền phòng đến vài giờ so với vài phút khi dùng các dung dịch nhỏ mắt. Thời gian lưu có thể tăng bằng cách tăng độ nhớt của công thức. Hay một cách khác, các tiểu phân nano có thể được bao gói bằng các polyme có khả năng bám dính màng nhầy hay bám dính sinh học. Các polyme này có khả năng tương tác vớimàng nhầy hay các tế bào trước giác mạc để tăng thời gian lưu, và từ đó tăng thời gian tác dụng của thuốc. Một số polyme thường được sử dụng trong công thức nano dùng trong nhãn khoa như
polybutylcyanoacrylat, PCL,
(một chất ức chế men tyrosin kinase) công thức sử dụng
(Mucus penetrating nanoparticles, tiểu phân có khả năng thấm qua lớp màng nhầy)
quả nồng độ thuốc tại chỗ cao gấp 10-200 lần so với giá
DẠYKÈMQUYNHƠN OFFICIAL 119
Eudragit RS 100, RL 100, chitosan, polyisobutylcyanoacrylat,
albumin, gelatin, PLA. Ví dụ, đối với axitinib
2% axitinib MPP
dùng đơn liều tại chỗ cho kết
trị IC50 (nồng độ tại đó thuốc có thể trung hòa 50% thụ thể đích) của VEGFR 2 (thụ thể VEGF đích của axitinib) [67].
Các công thức nano sử dụng tại chỗ giúp tăng khả năng hấp thu thuốc và phân phối thuốc kéo dài. Các tiểu phân nano chứa PEG hoặc được bao bởi các polyme có khả năng bám dính màng nhầy dường như có nhiều ưu điểm hơn. Công thức nano trong các hỗn dịch dùng tại chỗ có thể kéo dài khả năng đưa thuốc đến vài giờ.
Ngoài ra, các nano lipid cũng có một số ưu điểm khi sử dụng trong nhãn khoa như tăng sinh khả dụng của các thuốc kém tan, giải phóng thuốc tại đích và có kiểm soát, giảm tác dụng phụ. Đồng thời, các thành phần lipid trong công thức có thể tương tác với lớp lipid trong màng phim nước mắt, giúp làm giảm góc tiếp xúc giữa giọt thuốc và giác mạc, do đó làm tăng khả năng lan rộng và khả năng làm ướt của công thức. Đặc biệt, các công thức có điện thế zeta dương có khả năng tương tác với bề mặt có điện thế âm của giác mạc giúp làm giảm góc tiếp xúc này và tăng khả năng lưu giữ dược chất.
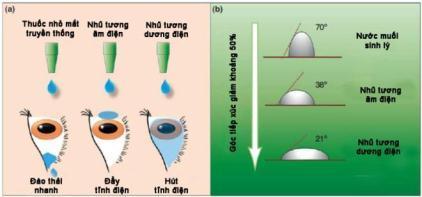
Hình 4.12. Minh họa quá trình lưu giữ dược chất và góc tiếp xúc với giác mạc của các công thức thuốc nhỏ mắt khác nhau [42] Một vài phương pháp mới như kính áp tròng gắn thuốc hay nano có thể kéo dài thời gian đưa thuốc lên đến vài ngày (Hình 4.13.). Sự hấp thu và vận chuyển của tiểu phân nano phụ thuộc vào đặc tính của tiểu phân cũng như điều kiện bệnh của bề mặt mắt. Các tiểu phân có khả năng bám dính màng nhầy hoặc các tiểu phân được bao bởi PEG dường như đi vào các lớp tế bào tốt hơn. Sự hấp thu của các tiểu phân, và sau đó là quá trình đưa thuốc sẽ cao hơn trong trường hợp mắt bị viêm nhiễm.
Các công thức tiêm tiểu phân nano vào nội nhãn giúp kéo dài quá trình đưa thuốc tốt hơn các công thức dùng tại chỗ.
này liên quan đến sự đào thải chậm hơn của các tiểu phân nano ra khỏi các vị trí bên
cầu so với sự đào thải của chúng ở khu vực trước giác mạc. Các công thức tiêm nội
tăng khả năng tiếp cận lớp biểu mô sắc tố võng mạc [50].
DẠYKÈMQUYNHƠN OFFICIAL 120
Điều
trong nhãn
nhãn
Hình 4.13. Minh họa kính áp tròng có mang các tiểu phân nano để đưa thuốc nhãn khoa dùng tại chỗ kéo dài [50]
4.3.3. Bào chế thuốc nhãn khoa chứa tiểu phân nano Thuốc nhãn khoa là dạng thuốc có yêu cầu về độ vô khuẩn tương tự thuốc tiêm. Do vậy, về cơ bản, quá trình bào chế thuốc nhãn khoa chứa tiểu phân nano cũng tương tự như quá trình bào chế thuốc tiêm chứa tiểu phân nano như đã trình bày ở mục 4.1.3. Trong đó, các tiểu phân nano được bào chế bằng các phương pháp thích hợp như đã đề cập ở chương 2. Về dạng bào chế, các tiểu phân nano có thể được phân tán dưới dạng hỗn dịch, hoặc bào chế dưới dạng bột đông khô hay bột phun sấy và phân tán lại trước khi sử dụng. Ngoài ra, một số công trình nghiên cứu cũng đã bào chế dạng gel chứa tiểu phân nano dùng trong nhãn khoa [31], [10]. Để minh họa việc ứng dụng công nghệ nano trong bào chế thuốc nhãn khoa, phần sau đây sẽ trình bày tóm tắt quy trình
dịch nhỏ mắt chứa nano piroxicam, cụ
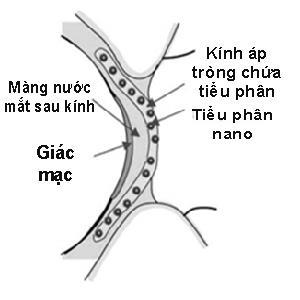
DẠYKÈMQUYNHƠN OFFICIAL 121
sản xuất hỗn
thể như sau [1]: * Công thức: Piroxicam nano polyme đông khô tương ứng với 0,50 g piroxicam (Eudragit RS 100, PVA) Acid citric monohydrat Manitol Benzalkonium clorid Hydroxypropyl methyl cellulose E6 vừa đủ Dung dịch NaOH 0,1 M Nước cất vừa đủ 0,21 g 4,50 g 0,02 g 6 12 cps (0,1; 0,3 ;0,8 g) pH 6,0 6,2 100ml * Mô tả quy trình:
Đầu tiên, tiến hành bào chế môi trường phân tán vô khuẩn, cụ thể bao gồm các bước:
+ Tiệt khuẩn tất cả các dụng cụ, thiết bị sử dụng trong bào chế bằng các phương pháp thích hợp.
+ Ngâm trương nở HPMC nồng độ 0,1% trong nước cất pha tiêm.
+ Hòa tan trong nước cất pha tiêm các thành phần gồm: Hệ đệm, chất bảo quản, chất đẳng trương.
+ Phối hợp với HPMC đã trương nở, khuấy đến khi đồng nhất.
+ Tiệt khuẩn bằng cách lọc dung dịch qua màng lọc cellulose acetat kích thước lỗ lọc 0,2 µm hoặc hấp ở 1200C trong 20 phút.
Tiếp theo, nghiên cứu tiến hành bào chế piroxicam nano đông khô vô khuẩn, cụ thể các bước như sau:
+ Dung dịch dược chất, polyme Eudragit RS 100 trong hỗn hợp dung môi diclorometan và ethanol (tỉ lệ 2:1, tt/tt) và môi trường phân tán chứa dung dịch PVA 5% được lọc loại khuẩn bằng màng lọc kích thước lỗ lọc 0,2 µm.
+ Phối hợp dung dịch dược chất vào môi trường phân tán để tạo nhũ tương trong điều kiện vô khuẩn với tốc độ khuấy trộn 18000 vòng/phút trong 5 phút bằng thiết bị khuấy với 4 cánh khuấy Nhiệt độ duy trì:0 5oC.
+ Tiếp tục khuấy trộn bằng thiết bị đồng nhất hóa Unidrive ở tốc độ 15000 vòng/phút trong 5 phút Nhiệt độ duy trì:0 5oC.
+ Bốc hơi dung môi bằng máy khuấy từ với tốc độ 400 vòng/phút trong 24 giờ ở điều kiện vô khuẩn.
+ Ly tâm 15000 vòng/phút trong 15 phút, rửa tủa 3 lần bằng nước cất để pha tiêm Các thao tác trên được thực hiện dưới laminar flow (L.A.F).
manitol đã lọc loại khuẩn sau đó đông khô với các thông
Phân tán
kỹ thuật
DẠYKÈMQUYNHƠN OFFICIAL 122
+
hệ tiểu phân nano vào dung dịch
số
như sau: * Giai đoạn đông lạnh: nhiệt độ 700C, thời gian 6 giờ. * Giai đoạn làm khô sơ cấp: nhiệt độ 150C, tốc độ gia nhiệt 0,50C/ phút, lưu 20 giờ. * Giai đoạn làm khô thứ cấp: nhiệt độ 300C với tốc độ gia nhiệt 0,250C/ phút, lưu 8 giờ, áp suất 0,5 0,6 mbar. Trong quy trình bào chế bột đông khô chứa nano piroxicam dùng cho nhãn khoa ở phần trên, các yếu tố ảnh hưởng đến đặc tính lý hóa của tiểu phân nano đã được khảo sát bao gồm các thông số thuộc công thức như loại polyme, loại chất diện hoạt, tỉ lệ chất ổn định, loại tá dược tạo bánh,… và các thông số thuộc quy trình như nhiệt độ thí nghiệm, lực gây phân tán, thời gian tác động lực gây phân tán, điều kiện ly tâm, quy trình đông khô.
4.3.4. Đánh giá các chỉ tiêu chất lượng thuốc nhãn khoa chứa tiểu phân nano
4.3.4.1. Chỉ tiêu chất lượng
Chỉ tiêu chất lượng thuốc nhãn khoa chứa tiểu phân nano bao gồm các chỉ tiêu chất lượng chung của thuốc nhỏ mắt dưới dạng hỗn dịch, bột, bột đông khô hay viên nén vô khuẩn được phân tán lại trước khi sử dụng và các chỉ tiêu chất lượng đặc thù của tiểu phân nano.
Do đó, các chế phẩm thuốc dùng cho nhãn khoa cần phải đạt các chỉ tiêu chất lượng chung của thuốc nhỏ mắt như giới hạn về KTTP, độ vô khuẩn, giới hạn cho phép về thể tích,...
Ngoài ra, đối với các chế phẩm thuốc nhãn khoa chứa tiểu phân nano, các tính chất của tiểu phân nano cần được minh chứng như KTTP, phân bố KTTP, hình thái tiểu phân, đặc tính và chức năng bề mặt của tiểu phân, thành phần và độ tinh khiết, khả năng giải phóng dược chất,... Đối với nghiên cứu bào chế bột đông khô chứa tiểu phân nano piroxicam dùng cho nhãn khoa như đã đề cập
piroxicam 0,5% dùng cho nhãn khoa [1]
Chỉ tiêu
Hình thức
Kích thước tiểu phân (nm)
Hàm
Kết quả
Bánh đông khô không nứt, vỡ, màu sắc đồng nhất, xốp, bề mặt mịn
39,08
DẠYKÈMQUYNHƠN OFFICIAL 123
ở mục 4.3.3, các đặc tính của chế phẩm được đề cập như ở bảng 4.7. Bảng 4.7. Các đặc tính của bột đông khô chứa nano
Hệ số đa phân tán PDI 347,2 ± 17,7 0,156 ± 0,028
ẩm (%) ± pH sau khi phân tán lại ± Hàm lượng piroxicam (%) 0,509 ± 0,011 Độ hòa tan (sau 8 giờ, môi trường nước mắt nhân tạo) (%)
± 1,52 Độ vô khuẩn Đảm bảo vô khuẩn 4.3.4.2. Phương pháp đánh giá Các phương pháp đánh giá một số đặc tính lý hóa của tiểu phân nano như KTTP và phân bố KTTP, điện tích bề mặt, hình thái cấu trúc hạt, thành phần, tương tác hóa học và trạng thái kết tinh, khả năng nạp thuốc và hiệu suất nano hóa, khả năng giải phóng thuốc in vitro đã được trình bày trong chương 3. Áp dụng đối với bào chế bột đông khô chứa tiểu phân nano piroxicam dùng cho nhãn khoa như đã đề cập ở mục 4.3.3, các phương pháp đánh giá một số tính chất của tiểu phân nano được trình bày cụ thể như sau: Hình dạng, kích thước
Xác định hình dạng bằng kính hiển vi điện tử quét (SEM)
Sử dụng kính hiển vi điện tử quét FEI Quanta 200 có độ phóng đại M=20x 800000x, độ phân giải δ=1,0 nm, điện áp gia tốc U=0,5 30kV.
Chuẩn bị mẫu: piroxicam được sấy khô, mẫu sau đó được đưa lên khay nhôm nhỏ, và được bao phủ bởi một lớp platin mỏng trong môi trường khí argon bằng thiết bị chuyên dụng. Xác định kích thước bằng phương pháp tán xạ laser
Thiết bị đo: máy phân tích Zetasizer NanoZS 90 (Malvern) đo KTTP trong khoảng 0,011 3,000.
Điều kiện đo: Pha hỗn dịch đến nồng độ dược chất khoảng 0,005%. Hệ số tán xạ ánh sáng của Eudragit là 1,71, piroxicam là 1,33.
Phép đo cho kết quả kích thước trung bình của các tiểu phân, mức độ đồng đều KTTP thể hiện ở chỉ số đa phân tán (PDI). Thế zeta
Hỗn dịch chứa piroxicam nano được pha loãng đến nồng độ 0,005% trước khi đưa vào máy đo. Cấu trúc
Phân bố giữa dược chất và tá dược được xác định bằng hình ảnh chụp qua kính hiển vi điện tử truyền qua (áp dụng cho tiểu phân nano polyme).
Trạng thái kết tinh của dược chất được xác định bằng phương pháp nhiễu xạ tia (X ray): Các mẫu được nghiền mịn, đặt vào khay kim loại đưa vào thiết bị chiếu tia X với bước sóng tia tới từ bức xạ Kα của đồng kim loại (Cu) là λCu = 1,5405A0, cường độ dòng điện 30 mA, điện áp 40 kV, góc quét từ 50 600, tốc độ quét 20/phút. Hàm lượng dược chất Phương pháp sắc ký lỏng hiệu năng cao được sử dụng để định lượng piroxicam.
Mẫu chuẩn: Cân chính xác khoảng 25,0 mg piroxicam chuẩn, hòa tan trong methanol vừa đủ 50 ml. Lấy 1 ml dung dịch này pha loãng 10 lần bằng methanol chứa 0,01 N acid hydrocloric được dung dịch có nồng độ khoảng 50 µg/ml. Lọc qua màng lọc 0,45 µm.
Mẫu thử: Cân chính xác lượng mẫu thử (bột đông khô piroxicam tương ứng với 25 mg piroxicam, hòa tan trong methanol vừa đủ 50 ml, siêu âm 5 phút. Lấy dung dịch này pha loãng 10 lần bằng dung dịch
DẠYKÈMQUYNHƠN OFFICIAL 124
methanol chứa 0,01 N acid hydrocloric. Lọc qua màng lọc 0,45 µm. Pha động: Ethanol : Dung dịch đệm citro phosphat (55:45), pha động được lọc qua màng lọc 0,45 µm, siêu âm 15 phút. pH của pha động trong khoảng 4,9 5,0. Điều kiện sắc ký: Tốc độ dòng: 1,0 ml phút, thể tích tiêm mẫu: 20 µl, detector UV, đo ở bước sóng 254 nm. Tiêm lần lượt dung dịch chuẩn và dung dịch thử lên hệ thống sắc ký, ghi lại sắc ký đồ. Dựa vào diện tích píc, lượng cân chuẩn, hàm lượng chuẩn, hệ số pha loãng tính ra hàm lượng piroxicam trong chế phẩm. Thử nghiệm hòa tan
Sử dụng thiết bị cánh khuấy với tốc độ 100 vòng/phút. Môi trường 900 ml nước cất ở nhiệt độ: 37 ± 0,50C.
Mẫu nano piroxicam sau đông khô được cân chính xác với lượng dược chất tương ứng khoảng 50 mg piroxicam. Sau từng khoảng thời gian nhất định trong vòng 6 giờ, hút 5 ml dung dịch (có bổ sung 5 ml nước vào môi trường). Ly tâm 15000 vòng/phút trong 30 phút. Hút 1 ml dịch sau khi ly tâm, thêm dung dịch methanol chứa 0,01N acid hydrochloric vừa đủ 10 ml. Định lượng piroxicam trong dịch pha loãng bằng phương pháp HPLC.
Ngoài ra, hỗn dịch chứa nano piroxicam đã được đánh giá sinh khả dụng trên mắt thỏ với kết quả chứng tỏ hỗn dịch nano chứa 0,5 % piroxicam có khả năng kéo dài tác dụng và tăng tính thấm của
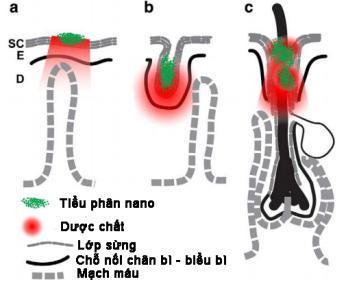
nên cải
có diện tích bề mặt lớn,
kể sinh
dụng của
là cơ quan dễ tiếp
mồ hôi bao gồm cả da chứa lớp sừng ngoài cùng, tạo thành lớp rào cản hiệu quả sự xâm nhập của các chất vào bên trong cơ thể. Con đường qua nang lông và lớp biểu bì (cả liên bào và xuyên bào) là các con đường chính để vận chuyển các phân tử đi qua lớp da còn nguyên vẹn (Hình 4.14).
lông,
DẠYKÈMQUYNHƠN OFFICIAL 125
piroxicam
thiện đáng
khả
chế phẩm. 4.4. BÀO CHẾ THUỐC DÙNG NGOÀI DA Do
da
cận của cơ thể người, là nơi thường được lựa chọn để sử dụng thuốc tại chỗ. Lớp biểu bì, lớp hạ bì, nang
tuyến
Hình 4.14. Các vị trí của quá trình đưa thuốc qua đường bôi da (a) bề mặt lớp sừng, (b) các nếp nhăn (hay chỉ tay, chỉ chân) (c) chỗ hở của nang lông [92] Các dạng bào chế truyền thống để bôi da thường có bản chất bán rắn và bao gồm các gel thân nước (như hydrogel), dầu và gel kỵ nước (nhưoleogel) hay hỗn hợp cả hai như kem dầu trong nước hoặc nước trong dầu. Dựa vào chức năng, lớp sừng là lớp rào cản chính của da đối với quá trình vận chuyển các thuốc. Một phương pháp tiếp cận khá hứa hẹn để tăng cường khả năng xâm nhập của các phân tử qua lớp sừng là sử dụng các nano lipid (như SLN hay NLC) bởi vì tính thân dầu của chúng tạo điều kiện thuận lợi cho các chất đi qua lớp sừng. Ngoài ra, các hệ chất mang này có thể giúp vận chuyển
các phân tử đi vào các nang lông hoặc kiểm soát giải phóng bằng cách tạo các kho chứa trên bề mặt da.
Trong các dạng bào chế kể trên thì hydrogel và nanoemulgel (một hệ tương tự hydrogel) là các công thức bán rắn hứa hẹn nhất dùng để bôi da chứa SLN hay NLC. Tuy nhiên, việc đưa các nano lipid vào dạng kem dầu/nước sẽ thuận lợi hơn bởi vì tác dụng hydrat hóa hiệp đồng có thể thu được nhờ các lipid có ở hai hệ. Việc lựa chọn các tá dược, đặc biệt là lipid và chất diện hoạt đóng vai trò quan trọng đối với cơ chế tương tác giữa các nano lipid với lớp sừng và việc hấp thu các phân tử sau đó [43]. Ví dụ, trong nghiên cứu gel chứa hệ NLC của diclofenac đã được bào chế, hệ NLC được bào chế bằng phương pháp đồng nhất hóa nóng kết hợp siêu âm. Sau đó, hệ NLC được đưa vào các hệ gel thân nước với các tá dược tạo gel là Natri carboxymethyl cellulose, hydroxypropyl cellulose, hoặc Carbopol 934 và tá dược tăng thấm là propylen glycol hoặc glycerin [83]. Các công thức tốt nhất như sau: Bảng 4.8. Các công thức gel chứa nano NLC của dicofenac [83] Thành phần
GMS (%) Diclofenac (%) T80 (%) P90G (%) CBP 934 (%) PG (%)
Công thức
Gel 1 3 0,5 2 0,6 0,3 5
Gel 2 6 0,4 2 1,2 0,3 5 Gel 3 3 0,2 2 0,6 0,3 5 (GMS: Glyceryl monostearat, T80: Tween 80; P90G: Phospholipon® 90G; CBP 934: Carbopol 934; PG: Propylen glycol, %: kl/tt)
Trong quy trình bào chế gel chứa nano diclofenac dùng ngoài da ở phần trên, các yếu tố công thức ảnh hưởng đến
hoạt, hàm lượng dược chất, loại
DẠYKÈMQUYNHƠN OFFICIAL 126
đặc tính lý hóa của tiểu phân nano đã được khảo sát bao gồm các thông số thuộc công thức như loại lipid, tỉ lệ lipid, loại và tỉ lệ chất diện
và tỉ lệ tá dược tạo gel, loại và tỉ lệ tá dược tăng thấm. Chỉ tiêu chất lượng của sản phẩm Kết quả thu được các tiểu phân nano có kích thước từ 50 150 nm, có hình cầu.Về công thức tạo gel, Carbopol 934 được lựa chọn làm tá dược tạo gel và propylen glycol làm tá dược tăng thấm. Kết quả đánh giá tính thấm qua da chuột cho thấy ở cùng một nồng độ lipid, khi kích thước tiểu phân càng nhỏ và khả năng nạp thuốc càng cao thì càng làm tăng tính thấm của dược chất cũng như lượng dược chất lưu giữ ở da. Về hoạt tính chống viêm, kết quả đánh giá cho thấy xu hướng tương tự khi tiểu phân càng nhỏ và khả năng nạp thuốc càng lớn thì hiệu quả chống viêm in vivo càng cao [83]. Phương pháp đánh giá + Kích thước tiểu phân và hình thái
Các mẫu được pha loãng 10 lần trong nước cất trước khi tiến hành đo KTTP và phân bố KTTP bằng phương pháp tán xạ ánh sáng động trên máy Zetasizer Nano ZS.
Hình thái của tiểu phân nano NLC chứa diclofenac được quan sát bằng thiết bị đo TEM (Hitachi 7600, Nhật Bản). Mẫu thử được đưa lên lưới đồng được bao với carbon, cố định bằng acid phosphotungstic 2% (kl/tt), và để khô ngoài không khí trong vòng 15 phút trước khi đo.
+ Xác định hiệu suất nano hóa và khả năng nạp thuốc
Hiệu suất nano hóa được xác định gián tiếp thông qua định lượng dược chất tự do trong môi trường phân tán. Hỗn dịch nano lipid được đưa vào ống ly tâm màng (Amicon Ultra, Millipore, Mỹ) với MWCO 10 kDa và tiến hành ly tâm ở 4000 vòng/phút trong 60 phút.
+ Định lượng
Diclofenac được định lượng bằng phương pháp HPLC với pha động gồm methanol và dung dịch đệm phosphat pH 2,5 (tỉ lệ 80:20, tt/tt). Tốc độ dòng 1,0 ml/phút, thể tích tiêm là 20 µl, bước sóng đo ở 254 nm, cột C18 250 × 4.6 mm, 5 μm.
+ Xác định các đặc tính vật lý của hệ NLC
Sử dụng các phương pháp nhiệt quét vi sai (DSC) trên thiết bị Q 2000 (TA, DE, Mỹ), phương pháp nhiễu xạ tia X trên thiết bị PANalytical, Almelo, Hà Lan với cách chuẩn bị mẫu và phân tích như mô tả ở phần phương pháp đánh giá ở mục bào chế thuốc cho các đường dùng khác kể trên.
+ Khả năng giải phóng thuốc in vitro và khả năng thấm thuốc ex vivo Khả năng giải phóng thuốc in vitro được xác định trong vòng 24 giờ sử dụng màng cellulose acetat với MWCO 12 kDa (Sigma Aldrich, Mỹ) trên các tế bào Franz (Hason Research, Mỹ) với môi trường giải phóng là đệm phosphat salin pH 7,4. Môi trường được khuấy từ ở 400 vòng/phút và duy trì ở 37 ± 0,5oC. Ở các thời điểm nhất định, 1 ml môi trường được hút và thay thế bằng một thể tích tương ứng môi trường mới. Nồng độ diclofenac được định lượng bằng phương pháp HPLC. Tương tự, khả năng thấm thuốc ex vivo cũng được xác định bằng phương pháp như trên, tuy nhiên màng cellulose acetat được thay thế bằng da chuột đực đã được loại bỏ lông và lớp mỡ. Ngoài
xác định bằng cách chiết bằng ethanol kết
có một số thuận lợi khi bào chế ở kích thước nano như đưa tiểu phân vào sâu trong phổi, giải phóng dược chất kéo dài và độc tính thấp, việc sử dụng các tiểu phân nano có chứa thuốc dùng theo đường phổi có hạn chế lớn bởi vì quán tính thấp của chúng có thể khiến chúng có thể bị tống ra sau khi xịt khí dung. Ngoài ra, kích thước nhỏ của chúng có thể dẫn đến sự kết tụ do có năng lượng bề mặt lớn, khiến cho việc xử lý các tiểu phân nano rất khó khăn. Vì vậy, các tiểu phân nano mang dược chất cần các hệ chất mang có đường kính khí động học trung bình khối lượng (MMAD) phù hợp cho việc đưa thuốc theo đường phổi hiệu quả.
DẠYKÈMQUYNHƠN OFFICIAL 127
ra, nồng độ thuốc lưu giữ trên da cũng được
hợp siêu âm và ly tâm. 4.5. BÀO CHẾ THUỐC CHO ĐƯỜNG DÙNG KHÁC Đối với các dạng thuốc dùng qua đường phổi, việc thiết kế công thức chứa tiểu phân nano có thể đưa các phân tử nhỏ và các phân tử lớn hơn như peptid qua đường phổi thông qua bộ phận khí dung, ví dụ như insulin dạng khí dung. Mặc dù
So với các loại nano khác, việc sử dụng nano lipid có nhiều triển vọng trong việc điều trị các bệnh ở phổi tại chỗ hoặc các bệnh toàn thân. Ngoài ra, các tiểu phân nano có thể được bào chế để dùng theo đường trực tràng. Nano lipid rắn có thể đưa vào dạng gel để sử dụng theo đường dùng này. Công thức gel chứa nano lipid rắn của flurbiprofen nhạy cảm bởi nhiệt giúp thuận lợi khi sử dụng đường trực tràng, dễ dàng gel hóa nhanh khi đưa vào trực tràng từ đó giúp làm giảm khả năng giải phóng dược chất ồ ạt ban đầu, kéo dài thời gian giải phóng, và tăng sinh khả dụng so với công thức chứa dược chất [36]. Như vậy, trong các thập kỷ gần đây, rất nhiều chiến lược mới đã và đang được phát triển để bào chế các hệ vận chuyển thuốc dựa trên công nghệ nano. Cho đến nay, các hệ mang thuốc này đã bước đầu mang đến một số sản phẩm và ứng dụng trong lĩnh vực dược phẩm cũng như y sinh học. Tuy nhiên, vẫn còn nhiều vấn đề cần giải quyết để các ứng dụng này mang tính khả thi hơn nữa như việc nâng cấp quy mô bào chế, ổn định sản phẩm và minh chứng tính an toàn, ưu thế tác dụng sinh học. Trong tương lai, hy vọng sẽ có nhiều nghiên cứu chuyên sâu tập trung vào các tiểu phân nano đa thành phần có tác dụng hướng đích nhằm tận dụng tối đa các ưu điểm của hệ vận chuyển thuốc dựa trên công nghệ nano này. Câu hỏi lượng giá
1. Trình bày các ứng dụng của công nghệ nano trong sản xuất thuốc dùng đường tiêm, đường uống, dùng trong nhãn khoa, dùng ngoài da Cho ví dụ.
2. Trình bày các ứng dụng của công nghệ nano trong sản xuất thuốc dùng cho các đường dùng khác
3. Trình bày phương pháp đánh giá tiêu chuẩn chất lượng của các dạng thuốc chứa tiểu phân nano.
DẠYKÈMQUYNHƠN OFFICIAL 128
THAM KH
1. Nguyễn Thị Mai Anh (2014), Nghiên cứu bào chế và đánh giá sinh khả dụng hỗn dịch nano piroxicam dùng cho nhãn khoa, Luận án Tiến sĩ Dược học, Đại học Dược Hà Nội.
2. Dương Thị Hồng Ánh (2017), Nghiên cứu bào chế hệ tiểu phân nano nhằm tăng sinh khả dụng của curcumin dùng theo đường uống, Luận án Tiến sĩ Dược học, Trường Đại học Dược Hà Nội.
3. Bộ Y tế, Dược thư quốc gia Việt Nam. 2018, Nhà xuất bản Y học.
4. Nguyễn Minh Đức, Trương Công Trị (2010), Tiểu phân nano, kỹ thuật bào chế, phân tích ứng dụng trong ngành Dược, Nhà xuất bản Y học, pp. 93 106, 147 176.
5. Phạm Thị Minh Huệ, Nguyễn Thanh Hải (2017), Liposome, phytosome Phỏng sinh học trong bào chế, Nhà xuất bản Đại học Quốc gia
6. Võ Xuân Minh, Phạm Thị Minh Huệ (2013), Kỹ thuật nano và liposome ứng dụng trong dược phẩm, mỹ phẩm, Trường Đại học Dược Hà Nội, Trung tâm thông tin thư viện Đại học Dược Hà Nội
7. Hồ Hoàng Nhân (2019), Nghiên cứu bào chế tiểu phân nano artesunat pha tiêm hướng điều trị ung thư, Luận án Tiến sĩ Dược học, Trường Đại học Dược Hà Nội.
8. Dương Thị Ánh Tuyết, Võ Quốc Khương, và cộng sự (2011), "Nghiên cứu chế tạo vật liệu nano chitosan làm chất hấp phụ protein ứng dụng trong dẫn truyền thuốc", Tạp chí phát triển KH & CN Đại học Quốc gia Hồ Chí Minh, 14(T6), pp. 54 61.
9. Abbasi E., Aval S. F., Akbarzadeh A., Milani M., Nasrabadi H. T., Joo S. W., Hanifehpour Y., Nejati Koshki K., Pashaei Asl R. (2014), "Dendrimers: synthesis, applications, and properties", Nanoscale Res Lett, 9(1), pp. 247.
10. Abrego G., Alvarado H., Souto E. B., Guevara B., Bellowa L. H., Parra A., Calpena A., Garcia M. L. (2015), "Biopharmaceutical profile of pranoprofen loaded PLGA nanoparticles containing hydrogels for ocular administration", Eur J Pharm Biopharm, 95(Pt B), pp. 261 70.
11. Adjei I. M., Sharma B., Labhasetwar V. (2014), "Nanoparticles: cellular uptake and cytotoxicity", Adv Exp Med Biol, 811, pp. 73 91.
12. Albanese A., Tang P. S., Chan W. C. (2012), "The effect of nanoparticle size, shape, and surface chemistry on biological systems", Annu Rev Biomed Eng, 14, pp. 1 16.
13. Alexis F.,Pridgen E.,Molnar L. K.,FarokhzadO. C.(2008),"Factors affectingthe clearance and biodistribution of polymeric nanoparticles", Mol Pharm, 5(4), pp. 505-15.
14. Ali M. E., Lamprecht A. (2017), "Spray freeze drying as an alternative technique for lyophilization of polymeric and lipid based nanoparticles", Int J Pharm, 516(1 2), pp. 170 177.
DẠYKÈMQUYNHƠN OFFICIAL 129 TÀI LIỆU
ẢO
15. Arias J.L. (2014), "Key Aspects in Nanotechnology and Drug Delivery", Nanotechnology and Drug Delivery, Volume One: Nanoplatforms in Drug Delivery, Arias J.L., Taylor & Francis, pp. 1 27.
16. Autio K. A., Dreicer R., Anderson J., Garcia J. A., Alva A., Hart L. L., Milowsky M. I., Posadas E. M., Ryan C. J., Graf R. P., Dittamore R., Schreiber N. A., Summa J. M., Youssoufian H., Morris M. J., Scher H. I. (2018), "Safety and Efficacy of BIND 014, a Docetaxel Nanoparticle Targeting Prostate-Specific Membrane Antigen for Patients With Metastatic Castration Resistant Prostate Cancer: A Phase 2 Clinical Trial", JAMA Oncol.
17. Baek J. S., Cho C. W. (2017), "Surface modification of solid lipid nanoparticles for oral delivery of curcumin: Improvement of bioavailability through enhanced cellular uptake, and lymphatic uptake", Eur J Pharm Biopharm, 117, pp. 132 140.
18. Bai M. Y., Liu S. Z. (2014), "A simple and general method for preparing antibody PEG PLGA sub-micron particles using electrospray technique: an in vitro study of targeted delivery of cisplatin to ovarian cancer cells", Colloids Surf B Biointerfaces, 117, pp. 346 53.
19. Baig M. S., Ahad A., Aslam M., Imam S. S., Aqil M., Ali A. (2016), "Application of Box Behnken design for preparation of levofloxacin loaded stearic acid solid lipid nanoparticles for ocular delivery: Optimization, in vitro release, ocular tolerance, and antibacterial activity", Int J Biol Macromol, 85, pp. 258 70.
20. Barbault Foucher S., Gref R., Russo P., Guechot J., Bochot A. (2002), "Design of poly ε caprolactone nanospheres coated with bioadhesive hyaluronic acid for ocular delivery", Journal of Controlled Release, 83(3), pp. 365 375.
21. Battaglia L., Gallarate M. (2012), "Lipid nanoparticles: state of the art, new preparation methods and challenges in drug delivery", Expert Opin Drug Deliv, 9(5), pp. 497 508.
22. Battaglia L., Muntoni E., Chirio D., Peira E., Annovazzi L., Schiffer D., Mellai M., Riganti C., Salaroglio I. C., Lanotte M., Panciani P., Capucchio M. T., Valazza A., Biasibetti E., Gallarate M. (2017), "Solid lipid nanoparticles by coacervation loaded with a methotrexate prodrug: preliminary study for glioma treatment", Nanomedicine (Lond), 12(6), pp. 639 656.
23. Bhatnagar P., Pant A. B., Shukla Y., Panda A.,Gupta K. C. (2016), "Hyaluronic acid grafted PLGA copolymer nanoparticles enhance the targeted delivery of Bromelain in Ehrlich's Ascites Carcinoma", Eur J Pharm Biopharm, 105, pp. 176 92.
24. Bobo D., Robinson K. J., Islam J., Thurecht K. J., Corrie S. R. (2016), "Nanoparticle-Based Medicines: A Review of FDA Approved Materials and Clinical Trials to Date", Pharm Res, 33(10), pp. 2373 87.
25. Centerwatch (2018), "FDA Approved Drugs for Oncology", Retrieved July, 2018, from https://www.centerwatch.com/drug information/fda approved drugs/therapeutic area/12/oncology
DẠYKÈMQUYNHƠN OFFICIAL 130
26. Chaplin Martin (2017), "Cyclodextrins", Retrieved April, 2018, from http://www1.lsbu.ac.uk/water/cyclodextrin.html.
27. Charcosset C., El Harati A., Fessi H. (2005), "Preparation of solid lipid nanoparticles using a membrane contactor", J Control Release, 108(1), pp. 112 20.
28. Chen H., Khemtong C., Yang X., Chang X., Gao J. (2011), "Nanonization strategies for poorly water soluble drugs", Drug Discov Today, 16(7 8), pp. 354 60.
29. Chen Y., Lin X., Park H., Greever R. (2009), "Study of artemisinin nanocapsules as anticancer drug delivery systems", Nanomedicine, 5(3), pp. 316 22.
30. Cho E. J., Holback H., Liu K. C., Abouelmagd S. A., Park J., Yeo Y. (2013), "Nanoparticle characterization: state of the art, challenges, and emerging technologies", Mol Pharm, 10(6), pp. 2093 110.
31. Cornier J., Owen A., Kwade A., Van de Voorde M. (2017), Pharmaceutical Nanotechnology, 2 Volumes: Innovation and Production, Wiley.
32. Czaplewska Justyna A., Majdanski Tobias C., Barthel Markus J., Gottschaldt Michael, Schubert Ulrich S. (2015), "Functionalized PEG b PAGE b PLGA triblock terpolymers as materials for nanoparticle preparation", Journal of Polymer Science Part A: Polymer Chemistry, 53(18), pp. 2163 2174.
33. Davis M. E., Chen Z. G., Shin D. M. (2008), "Nanoparticle therapeutics: an emerging treatment modality for cancer", Nat Rev Drug Discov, 7(9), pp. 771 82.
34. De Miguel Ignacio, Imbertie Laurent, Rieumajou Valerie, Major Michel, Kravtzoff Roger, Betbeder Didier (2000), "Proofs of the Structure of Lipid Coated Nanoparticles (SMBV™) Used as Drug Carriers", Pharmaceutical Research, 17(7), pp. 817 824.
35. Dhas Namdev L., Ige Pradum P., Kudarha Ritu R. (2015), "Design, optimization and invitro study of folic acid conjugated chitosan functionalized PLGA nanoparticle for delivery of bicalutamide in prostate cancer", Powder Technology, 283, pp. 234 245.
36. Din F. U., Mustapha O., Kim D. W., Rashid R., Park J. H., Choi J. Y., Ku S. K., Yong C. S., Kim J. O., Choi H. G. (2015), "Novel dual reverse thermosensitive solid lipid nanoparticle loaded hydrogel for rectal administration of flurbiprofen with improved bioavailability and reduced initial burst effect", Eur J Pharm Biopharm, 94, pp. 64 72.
37. Dinarvand Rassoul, Sepehri nima, Manouchehri, Rouhani, Atyabi Fatemeh (2011), "Polylactide co glycolide nanoparticles for controlled delivery of anticancer agents", International Journal of Nanomedicine, pp. 877 892.
38. Duran N., Marcato P., Teixeira Z., Duran M., Costa F., Brocchi M. (2009), "State of the Art of Nanobiotechnology Applications in Neglected Diseases", Curr Nanosci, 5(4), pp. 396 408.
39. El Housiny S., Shams Eldeen M. A., El Attar Y. A., Salem H. A., Attia D., Bendas E. R., El Nabarawi M. A. (2018), "Fluconazole loaded solid lipid nanoparticles topical gel for
DẠYKÈMQUYNHƠN OFFICIAL 131
treatment of pityriasis versicolor: formulation and clinical study", Drug Deliv, 25(1), pp. 78 90.
40. FDA (2018), "Drug Approvals and Databases", Retrieved November, 2018, from https://www.fda.gov/Drugs/InformationOnDrugs/default.htm.
41. Fenart L., Casanova A., Dehouck B., Duhem C., Slupek S., Cecchelli R., Betbeder D. (1999), "Evaluation of Effect of Charge and Lipid Coating on Ability of 60 nm Nanoparticles to Cross an In Vitro Model of the Blood Brain Barrier", Journal of Pharmacology and Experimental Therapeutics, 291(3), pp. 1017 1022.
42. Gan L., Wang J., Jiang M., Bartlett H., Ouyang D., Eperjesi F., Liu J., Gan Y. (2013), "Recent advances in topical ophthalmic drug delivery with lipid based nanocarriers", Drug Discov Today, 18(5 6), pp. 290 7.
43. Garces A., Amaral M. H., Sousa Lobo J. M., Silva A. C. (2018), "Formulations based on solid lipid nanoparticles (SLN) and nanostructured lipid carriers (NLC) for cutaneous use: A review", Eur J Pharm Sci, 112, pp. 159 167.
44. Garud Akanksha, Singh Deepti, Garud Navneet (2012), "Solid Lipid Nanoparticles (SLN): Method, Characterization and Applications", International Current Pharmaceutical Journal, 1(11), pp. 384 393.
45. Gonzalez-Lopez J., Alvarez-Lorenzo C., Taboada P., Sosnik A., Sandez-Macho I., Concheiro A. (2008), "Self associative behavior and drug solubilizing ability of poloxamine (tetronic) block copolymers", Langmuir, 24(19), pp. 10688 97.
46. Grabnar P. A., Kristl J. (2011), "The manufacturing techniques of drug-loaded polymeric nanoparticles from preformed polymers", J. Microencapsul., 28(4), pp. 323 35.
47. Grumezescu Alexandru Mihai (2018), Nanoscale Fabrication, Optimization, Scale Up and Biological Aspects of Pharmaceutical Nanotechnology, William Andrew, Applied Science Publishers.
48. Guichard J. P., Blouquin Pascale, Qing Yi (2008), "A New Formulation of Fenofibrate: Suprabioavailable Tablets", Current Medical Research and Opinion, 16(2), pp. 134 138.
49. Gupta A. K., Gupta M. (2005), "Synthesis and surface engineering of iron oxide nanoparticles for biomedical applications", Biomaterials, 26(18), pp. 3995 4021.
50. Gupta R. B., Kompella U. B. (2006), Nanoparticle Technology for Drug Delivery.
51. Hadian Zahra, Maleki Majedeh, Abdi Khosro, Atyabi Fatemeh, Mohammadi Abdoreza, Khaksar Ramin (2018), "Preparation and Characterization of Nanoparticle βCyclodextrin:Geraniol Inclusion Complexes", Iranian journal of pharmaceutical research : IJPR, 17(1), pp. 39 51.
52. Hadinoto K., Sundaresan A., Cheow W. S. (2013), "Lipid polymer hybrid nanoparticles as a new generation therapeutic delivery platform: a review", Eur J Pharm Biopharm, 85(3 Pt A), pp. 427 43.
DẠYKÈMQUYNHƠN OFFICIAL 132
53. Hafner A., Lovric J., Lakos G. P., Pepic I. (2014), "Nanotherapeutics in the EU: an overview on current state and future directions", Int J Nanomedicine, 9, pp. 1005 23.
54. Herrmann John B. (1970), "Polyglycolic Acid Sutures", Archives of Surgery, 100(4), pp. 486.
55. Hines Daniel J., Kaplan David L. (2013), "Poly (lactic co glycolic acid) controlled release systems: experimental and modeling insights", Critical reviews in therapeutic drug carrier systems, 30(3), pp. 257 276.
56. Homayouni A., Sadeghi F., Varshosaz J., Garekani H. A., Nokhodchi A. (2014), "Comparing various techniques to produce micro/nanoparticles for enhancing the dissolution of celecoxib containing PVP", Eur J Pharm Biopharm, 88(1), pp. 261 74.
57. Hosseininasab S., Pashaei Asl R., Khandaghi A. A., Nasrabadi H. T., Nejati Koshki K., Akbarzadeh A., Joo S. W., Hanifehpour Y., Davaran S. (2014), "Synthesis, characterization, and in vitro studies of PLGA PEG nanoparticles for oral insulin delivery", Chem Biol Drug Des, 84(3), pp. 307 15.
58. Hu F. Q., Jiang S. P., Du Y. Z., Yuan H., Ye Y. Q., Zeng S. (2005), "Preparation and characterization of stearic acid nanostructured lipid carriers by solvent diffusion method in an aqueous system", Colloids Surf B Biointerfaces, 45(3 4), pp. 167 73.
59. Hu L., Tang X., Cui F. (2004), "Solid lipid nanoparticles (SLNs) to improve oral bioavailability of poorly soluble drugs", J Pharm Pharmacol, 56(12), pp. 1527 35.
60. Jain Rajeev A. (2000), "The manufacturing techniques of various drug loaded biodegradable poly(lactide-co-glycolide) (PLGA) devices", Biomaterials, 21(23), pp. 2475-2490.
61. Jin L., Zeng X., Liu M., Deng Y., He N. (2014), "Current progress in gene delivery technology based on chemical methods and nano carriers", Theranostics, 4(3), pp. 240 55.
62. Junyaprasert Varaporn Buraphacheep, Morakul Boontida (2015), "Nanocrystals for enhancement of oral bioavailability of poorly water soluble drugs", Asian Journal of Pharmaceutical Sciences, 10(1), pp. 13 23.
63. Kasaai Mohammad R., Arul Joseph, Charlet Gérard (2000), "Intrinsic viscosity molecular weight relationship for chitosan", Journal of Polymer Science Part B: Polymer Physics, 38(19), pp. 2591 2598.
64. Kohli K., Chopra S., Dhar D., Arora S., Khar R. K. (2010), "Self emulsifying drug delivery systems: an approach to enhance oral bioavailability", Drug Discov Today, 15(21 22), pp. 958 65.
65. Kumar Narendra, Kumbhat Sunita (2016), Essentials in Nanoscience and Nanotechnology, John Wiley & Sons, Inc., USA
66. Kurkov S. V., Loftsson T. (2013), "Cyclodextrins", Int J Pharm, 453(1), pp. 167 80.
DẠYKÈMQUYNHƠN OFFICIAL 133
67. Langer Robert, Hanes Justin, Chen Hongming (2014), "The Nano State", The Ophthalmologist, Retrieved, from https://theophthalmologist.com/issues/0814/the nano state/.
68. Limayem Imène, Charcosset Catherine, Fessi Hatem (2004), "Purification of nanoparticle suspensions by a concentration/diafiltration process", Separation and Purification Technology, 38(1), pp. 1 9.
69. Liu J., Hu W., Chen H., Ni Q., Xu H., Yang X. (2007), "Isotretinoin loaded solid lipid nanoparticles with skin targeting for topical delivery", Int J Pharm, 328(2), pp. 191 5.
70. Maciejewski S., Hilleman D. (2008), "Effectiveness of a fenofibrate 145 mg nanoparticle tablet formulation compared with the standard 160 mg tablet in patients with coronary heart disease and dyslipidemia", Pharmacotherapy, 28(5), pp. 570 5.
71. Mah K. H., Yussof H. W., Seman M. N. Abu, Mohammad A. W. (2016), "Separation of xylose using a thin film composite nanofiltration membrane: screening of interfacial polymerization factors", RSC Advances, 6(73), pp. 69454 69464.
OFFICIAL
72. Makadia H.K.,SiegelS.J.(2011),"Poly Lactic-co-Glycolic Acid (PLGA) as Biodegradable Controlled Drug Delivery Carrier", Polymers (Basel), 3(3), pp. 1377 1397.
73. Mattheolabakis G., Rigas B.,Constantinides P.P. (2012), "Nanodelivery strategies in cancer chemotherapy: biological rationale and pharmaceutical perspectives", Nanomedicine (Lond), 7(10), pp. 1577 90.
74. Mehnert W., Mäder Karsten (2001), "Solid lipid nanoparticles Production, characterization and applications", Advanced Drug Delivery Reviews, 47(2-3), pp. 165-196.
75. Merisko Liversidge E. M., Liversidge G. G. (2008), "Drug nanoparticles: formulating poorly water soluble compounds", Toxicol Pathol, 36(1), pp. 43 8.
76. Michalowski C. B., Guterres S. S., Dalla Costa T. (2004), "Microdialysis for evaluating the entrapment and release of a lipophilic drug from nanoparticles", J Pharm Biomed Anal, 35(5), pp. 1093 100.
77. Mizoe T., Ozeki T., Okada H. (2007), "Preparation of drug nanoparticle containing microparticles using a 4 fluid nozzle spray drier for oral, pulmonary, and injection dosage forms", J Control Release, 122(1), pp. 10 5.
78. Moghimi S. Moein,Hunter A.Christy (2000),"Poloxamers and poloxamines in nanoparticle engineering and experimental medicine", Trends in Biotechnology, 18(10), pp. 412 420.
79. Mora-Huertas C. E., Fessi H., Elaissari A. (2010), "Polymer-based nanocapsules for drug delivery", Int J Pharm, 385(1 2), pp. 113 42.
80. Müller Rainer, Junghanns (2008), "Nanocrystal technology, drug delivery and clinical applications", International Journal of Nanomedicine, pp. 295.
DẠYKÈMQUYNHƠN
134
81. Nekkanti V., Pillai R., Venkateshwarlu V., Harisudhan T. (2009), "Development and characterization of solid oral dosage form incorporating candesartan nanoparticles", Pharm Dev Technol, 14(3), pp. 290 8.
82. Neves Ana Rute, Reis Salette (2018), Nanoparticles in Life Sciences and Biomedicine, Pan Stanford Publishing Pte. Ltd, Singapore, pp.
83. Nguyen C. N., Nguyen T. T. T., Nguyen H. T., Tran T. H. (2017), "Nanostructured lipid carriers to enhance transdermal delivery and efficacy of diclofenac", Drug Deliv Transl Res, 7(5), pp. 664 673.
84. Nguyen H. T., Tran T. H., Kim J. O., Yong C. S., Nguyen C. N. (2014), "Enhancing the in vitro anti cancer efficacy of artesunate by loading into poly D,L lactide co glycolide (PLGA) nanoparticles", Arch Pharm Res, 38(5), pp. 716 24.
85. Ober C. A., Gupta R. B. (2011), "Nanoparticle Technology for Drug Delivery", Ide@s CONCYTEG, 6(72), pp. 714 726.
86. Onoue S., Yamada S., Chan H. K. (2014), "Nanodrugs: pharmacokinetics and safety", Int J Nanomedicine, 9, pp. 1025-37.
87. Owens D. E., 3rd, Peppas N. A. (2006), "Opsonization, biodistribution, and pharmacokinetics of polymeric nanoparticles", Int J Pharm, 307(1), pp. 93 102.
88. Paaver U., Heinamaki J., Laidmae I., Lust A., Kozlova J., Sillaste E., Kirsimae K., Veski P., Kogermann K. (2015), "Electrospun nanofibers as a potential controlled release solid dispersion system for poorly water soluble drugs", Int J Pharm, 479(1), pp. 252 60.
89. Park Hyung Kyu, Lee Sang Joon, Oh Jong Suk, Lee Sam Gyu, Jeong Young I. L., Lee Hyun Chul (2015), "Smart Nanoparticles Based on Hyaluronic Acid for Redox Responsive and CD44 Receptor Mediated Targeting of Tumor", Nanoscale Research Letters, 10(288), pp. 1-10.
90. Pawar H., Douroumis D., Boateng J. S. (2012), "Preparation and optimization of PMAA chitosan PEG nanoparticles for oral drug delivery", Colloids Surf B Biointerfaces, 90, pp. 102 8.
91. Prabhu R. H., Patravale V. B., Joshi M. D. (2015), "Polymeric nanoparticles for targeted treatment in oncology: current insights", Int J Nanomedicine, 10, pp. 1001 18.
92. Prow T. W., Grice J. E., Lin L. L., Faye R., Butler M., Becker W., Wurm E. M., Yoong C., Robertson T. A., Soyer H. P., Roberts M. S. (2011), "Nanoparticles and microparticles for skin drug delivery", Adv Drug Deliv Rev, 63(6), pp. 470 91.
93. Rashwan Khaled, Brakke Erik, Sereda Grigoriy (2014), "Fluorescent labeling of materials using silica nanoparticles", Nanotechnology Reviews, 3(6)
94. Rowe R. C., Sheskey P. J., Quinn M. E. (2009), Handbook of Pharmaceutical Excipients, Pharmaceutical Press, London, pp.
DẠYKÈMQUYNHƠN OFFICIAL 135
95. Sabadini E., Cosgrove T., Egidio Fdo C. (2006), "Solubility of cyclomaltooligosaccharides (cyclodextrins) in H2O and D2O: a comparative study", Carbohydr Res, 341(2), pp. 270 4.
96. Saenger Wolfram, Jacob Joël, Gessler Katrin, Steiner Thomas, Hoffmann Daniel, Sanbe Haruyo, Koizumi Kyoko, Smith Steven M., Takaha Takeshi (1998), "Structures of the Common Cyclodextrins and Their Larger AnaloguesBeyond the Doughnut", Chemical Reviews, 98(5), pp. 1787 1802.
97. Sauron R., Wilkins M., Jessent V., Dubois A., Maillot C., Weil A. (2006), "Absence of a food effect with a 145 mg nanoparticle fenofibrate tablet formulation", Int. Journal of Clinical Pharmacology and Therapeutics, 44(02), pp. 64 70.
98. Schmidt Christoph, Lamprecht Alf (2009), "Nanocarriers in Drug Delivery Design, Manufacture and Physicochemical Properties", Nanotherapeutics: Drug Delivery Concepts in Nanoscience, Lamprecht A., Pan Stanford Publishing, pp. 3 30.
99. Schubert M., Muller Goymann C.C. (2003), "Solvent injection as a new approach for manufacturing lipid nanoparticles evaluation of the method and process parameters", European Journal of Pharmaceutics and Biopharmaceutics, 55(1), pp. 125 131.
100. Sengupta S., Eavarone D., Capila I., Zhao G., Watson N., Kiziltepe T., Sasisekharan R. (2005), "Temporal targeting of tumour cells and neovasculature with a nanoscale delivery system", Nature, 436(7050), pp. 568 72.
101. Sharma Sudhir Kumar, Jagannathan Ramesh (2016), "High throughput RESS processing of sub 10nm ibuprofen nanoparticles", The Journal of Supercritical Fluids, 109, pp. 74 79.
102. Shaw Ryan, Dynamic Light Scattering Training Achieving reliable nano particle sizing. 2014: Malvern Panalytical.
103. Shi J., Votruba A. R., Farokhzad O. C., Langer R. (2010), "Nanotechnology in drug delivery and tissue engineering: from discovery to applications", Nano Lett, 10(9), pp. 3223-30.
104. Sigma Aldrich Co. LLC (2016), "Biodegradable Polymers: RESOMER® Materials by Evonik Röhm GmbH", Retrieved 11/12, 2016, from http://www.sigmaaldrich.com/technical documents/articles/materials science/polymer science/resomer.html#groups.
105. Sinha B., Mukherjee B., Pattnaik G. (2013), "Poly lactide co glycolide nanoparticles containing voriconazole for pulmonary delivery: in vitro and in vivo study", Nanomedicine, 9(1), pp. 94 104.
106. Sinko Patrick J. (2011), "Interfacial phenomena", Martin’s Physical Pharmacy and Pharmaceutical Sciences: Physical Chemical and Biopharmaceutical Principles in the Pharmaceutical Sciences, Sinko Patrick J., Lippincott Williams & Wilkins, pp. 355 385.
107. Sjöström Brita, Bergenståhl Björn (1992), "Preparation of submicron drug particles in lecithin stabilized o/w emulsions I. Model studies of the precipitation of cholesteryl acetate", International Journal of Pharmaceutics, 88(1 3), pp. 53 62.
DẠYKÈMQUYNHƠN OFFICIAL 136
108. Song H., Su C., Cui W., Zhu B., Liu L., Chen Z., Zhao L. (2013), "Folic acid chitosan conjugated nanoparticles for improving tumor targeted drug delivery", Biomed Res Int, 2013, pp. 723158.
109. Stella Barbara, Arpicco Silvia, Peracchia Maria Teresa, Desmaële Didier, Hoebeke Johan, Renoir Michel, D'Angelo Jean, Cattel Luigi, Couvreur Patrick (2000), "Design of Folic Acid‐Conjugated Nanoparticles for Drug Targeting", Journal of Pharmaceutical Sciences, 89(11), pp. 1452 1464.
110. Su Juan Zhang, Yong Tai Zhang, Ji Hui Zhao, Li Na Shen, Feng Shi, Feng Nian Ping (2013), "Preparation and in vitro anti tumor properties of toad venom extract loaded solid lipid nanoparticles", Pharmazie, 68(2013), pp. 653 660.
111. Sutradhar Kumar Bishwajit, Khatun Sabera, Luna Irin Parven (2013), "Increasing Possibilities of Nanosuspension", Journal of Nanotechnology, 2013, pp. 1 12.
OFFICIAL
112. Tamjidi Fardin, Shahedi Mohammad, Varshosaz Jaleh, Nasirpour Ali (2013), "Nanostructured lipid carriers (NLC): A potential delivery system for bioactive food molecules", Innovative Food Science & Emerging Technologies, 19, pp. 29 43.
113. Tran B. N., Nguyen H. T., Kim J. O., Yong C. S., Nguyen C. N. (2017), "Combination of a chemopreventive agent and paclitaxel in CD44 targeted hybrid nanoparticles for breast cancer treatment", Arch Pharm Res, 40(12), pp. 1420 1432.
114. Tran T. H., Poudel B. K., Marasini N., Chi S. C., Choi H. G., Yong C. S., Kim J. O. (2013), "Preparation and evaluation of raloxifene loaded solid dispersion nanoparticle by spray drying technique without an organic solvent", Int J Pharm, 443(1 2), pp. 50 7.
115. Tran Tuan Hiep, Nguyen Tuan Duc, Van Nguyen Han, Nguyen Hanh Thuy, Kim Jong Oh, Yong Chul Soon, Nguyen Chien Ngoc (2016), "Targeted and controlled drug delivery system loading artersunate for effective chemotherapy on CD44 overexpressing cancer cells", Archives of Pharmacal Research, 39(5), pp. 687 694.
116. Trotta Michele, Debernardi Francesca, Caputo Otto (2003), "Preparation of solid lipid nanoparticles by a solvent emulsification diffusion technique", International Journal of Pharmaceutics, 257(1 2), pp. 153 160.
117. Van Eerdenbrugh B., Van den Mooter G., Augustijns P. (2008), "Top down production of drug nanocrystals: nanosuspension stabilization, miniaturization and transformation into solid products", Int J Pharm, 364(1), pp. 64 75.
118. Verma A., Stellacci F. (2010), "Effect of surface properties on nanoparticle cell interactions", Small, 6(1), pp. 12 21.
119. Wallace S. J., Li J., Nation R. L., Boyd B. J. (2012), "Drug release from nanomedicines: Selection of appropriate encapsulation and release methodology", Drug Deliv Transl Res, 2(4), pp. 284 92.
DẠYKÈMQUYNHƠN
137
120. Xiao X. C., Hong Z. G. (2010), "Firstborn microcrystallization method to prepare nanocapsules containing artesunate", Int J Nanomedicine, 5, pp. 483 6.
121. Zahr Alisar S., Pishko Michael V. (2008), "Nanotechnology for Cancer Chemotherapy", Nanotechnology in Drug Delivery, de Villiers M.M., Aramwit P.,Kwon G.S., Springer New York, pp. 491 518.
122. Zhang L., Chan J. M., Gu F. X., Rhee J. W., Wang A. Z., Radovic Moreno A. F., Alexis F., Langer R., Farokhzad O. C. (2008), "Self assembled lipid polymer hybrid nanoparticles: a robust drug delivery platform", ACS Nano, 2(8), pp. 1696 702.
123. Zhao P., Wang H., Yu M., Liao Z., Wang X., Zhang F., Ji W., Wu B., Han J., Zhang H., Wang H., Chang J., Niu R. (2012), "Paclitaxel loaded folic acid targeted nanoparticles of mixed lipid shell and polymer core: in vitro and in vivo evaluation", Eur J Pharm Biopharm, 81(2), pp. 248 56.
124. Zheng Y., Wu Y., Yang W., Wang C., Fu S., Shen X. (2006), "Preparation, characterization, and drug release in vitro of chitosan glycyrrhetic acid nanoparticles", J Pharm Sci, 95(1), pp. 181 91.
DẠYKÈMQUYNHƠN OFFICIAL 138
