

MASTIVAC EL PODER ESTÁ EN TU MANO
La protección más efectiva para el control de la mamitis

Composición por dosis (5 ml): Antígenos inactivados de S. agalactiae cepa LO1 ≥1 PR; S. dysgalactiae cepa ATCC 43078 ≥1 PR; S. uberis cepa LO1 ≥1 PR; S. pyogenes cepa LO1 ≥1 PR; S. aureus cepa LO1 ≥1 PR; A. pyogenes cepa ATCC 9730 ≥1 P.R; E. coli cepa Bov-10 ≥1 PR; E. coli cepa Bov-14 ≥1 PR; E. coli cepa Bov-15 ≥1 P.R; E. coli cepa Suis-21 ≥1 PR; E. coli cepa J5 ATCC 43745 ≥1 PR. Indicaciones y especies de destino: Bovino (novillas y vacas). Para la inmunización activa frente a las mamitis clínicas y/o subclínicas producidas por S. agalactiae, S. dysgalactiae, S. uberis, S. pyogenes, S. aureus, A. pyogenes y E. coli. Reducción de los signos clínicos de las mamitis clínicas producidas por S. dysgalactiae, S pyogenes, A. pyogenes y E. coli. Reducción del recuento de células somáticas en las mamitis subclínicas producidas por S. agalactiae, S. uberis y S. aureus Vía de administración: Subcutánea. Posología: 5 ml. Pauta de vacunación: Primovacunación: Administrar 2 dosis separadas 15 días. Novillas: Administrar 2 meses antes del primer parto. Vacas: Administrar en cualquier momento independientemente del estado fisiológico del animal. Revacunación: cada 6 meses. Contraindicaciones: Ninguna. Tiempo de espera: Cero días. Presentación: 20 ml y 100 ml. Con prescripción veterinaria. Titular: CZ Veterinaria S.A. Reg. Nº: 2990 ESP En caso de duda consulte a su veterinario
info@vetia.es (+34) 910 901 526 www.vetia.es
LA IMPORTANCIA DE INSPIRAR A LAS NUEVAS GENERACIONES
A principios de septiembre tuvo lugar en Madrid la XXXI edición del Congreso Mundial de Buiatría. Fue un éxito, no solo por la cantidad de veterinarios que tuvimos la oportunidad de asistir, sino también por el contenido científico y, por qué no decirlo, también por el contenido lúdico.
Fue una alegría coincidir con muchos compañeros de España y otros países, y poder comprobar con satisfacción que hay mucha gente joven que trabaja directa o indirectamente en el ámbito de la buiatría. Además, también hubo estudiantes de veterinaria cuya ilusión es trabajar en el mundo de las vacas que colaboraron activamente en el congreso.
Hay muchos veterinarios jóvenes ligados a la universidad, no solamente aquí sino también en el resto del mundo, realizando tareas de investigación, y esto, cómo no, es muy necesario.
En cambio, se echa en falta a nivel de campo jóvenes veterinarios a los que les interese trabajar con vacas y sospecho que pasa algo similar con los pequeños rumiantes.
Hay estudiantes de 4º y 5º de Veterinaria que tienen claro que se van a dedicar a pequeños animales (muchos de ellos concretan que quieren trabajar con animales exóticos), pero también hay muchos estudiantes que están perdidos a la hora de elegir su futuro.
Algunos nos comentan que no descartan dedicarse a los animales de producción, pero en ningún caso tienen claro que quieran dedicarse a trabajar con vacas, ovejas o cabras.
Es en esta etapa de la carrera cuando los estudiantes están receptivos a todo y una salida de prácticas en la facultad o una salida con un veterinario de campo les puede abrir la mente y, por supuesto, cambiarles el futuro por completo.
Es nuestra labor, tanto de los veterinarios que trabajamos activamente en el campo como los profesores de la facultad, motivar a las nuevas generaciones y transmitirles que es un área de trabajo apasionante y con multitud de salidas donde aún hay mucho trabajo por hacer.
Es cierto que la profesión veterinaria a veces es dura, pero se puede vivir muy dignamente de ella. Aun así, somos testigos de los problemas actuales a la hora de contratar a veterinarios por el simple hecho de que no hay gente que se quiera dedicar a la ganadería.
En estos momentos, el sector ganadero está sufriendo una falta de relevo generacional. Es justamente lo que les está pasando a muchos de nuestros clientes y coincide con lo que nos está pasando a los veterinarios.
DIRECCIÓN
TÉCNICA
Christian de la Fe Rodríguez Luis Miguel Jiménez Galán Vicente Jimeno Vinatea
REDACCIÓN
Daniela Morales Osmayra Cabrera
COLABORADORES
Carlos Ramón Romero Sala Fernando Laguna Fernando Bacha Gema Chacón
ADMINISTRACIÓN
Mercè Soler
Es por todo esto que tenemos una gran asignatura pendiente: hacer atractiva esta profesión tan necesaria.
Esto se debe hacer tanto desde la universidad como desde el campo con el fin de poder tener un relevo generacional. ¡Si no hay veterinarios, se verá comprometida la producción de alimentos!
Tel: +34 93 115 44 15 info@grupoagrinews.com www.rumiantes.com
Precio de suscripción anual: España 30 € Internacional 90 €
DIRIGIDA A VETERINARIOS DE RUMIANTES
Depósito legal rumiNews B-8798-2019
ISSN (Revista impresa): 2696-8185

ISSN (Revista digital): 2696-8193
Revista trimestral
La dirección de la revista no se hace responsable de las opiniones de los autores. Todos los derechos reservados. Imágenes: Noun Project / Freepik/Dreamstime/BioRender
CONTENIDOS
4
El arte de alimentar a las vacas de leche
Carlos R. Romero Sala
Coordinador del Programa de Eficiencia Productiva MID€S de Calidad Pascual
Una vaca bien alimentada se puede considerar una verdadera obra de arte fruto del trabajo de los auténticos artistas: ganaderos y técnicos.
¿Cómo elegir el lactoreemplazante ideal? 14
Alejandra Valentín
Product Manager Trouw Nutrition Spain Sales Ruminiant
22
Producción de metano y estrategias de mitigación basadas en la alimentación
Carlos Fernández
Catedrático de Universidad - Instituto de Ciencia y Tecnología Animal, Universitat Politécnica de Valencia
En este artículo, se abordan las Estrategias Nutricionales de Mitigación de emisiones de metano en rumiantes.
32
“FENCOVIS®, Un paso más en la prevención de enfermedades del ganado vacuno”
Manuel Cerviño Asesor Técnico de Rumiantes de Boehringer Ingelheim Animal Health España
36
Tuberculosis Animal - El reto de controlar una infección compartida entre ungulados domésticos y silvestres
Eduardo Laguna1 , Saúl Jiménez-Ruiz1,2 , Pelayo Acevedo1 , Christian Gortázar1 , Carmen Ruiz1 , Patricia Barroso1,3 , Ignacio García-Bocanegra2,4 , María A. Risalde 4,5 , David Cano-Terriza2,4 , Débora Jiménez-Martín2 , Vidal Montoro1 , Mario Sebastián-Pardo1 , Ludovica Preite1 , César Herraiz1 y Joaquín Vicente1
1Instituto de Investigación en Recursos Cinegéticos, IREC (UCLM-CSIC-JCCM)
2Departamento de Sanidad Animal, Grupo de Investigación GISAZ, UIC Zoonosis y Enfermedades Emergentes ENZOEM, Universidad de Córdoba
3Departamento de Ciencias Veterinarias, Universidad de Turín
4CIBERINFEC, ISCIII - CIBER de Enfermedades Infecciosas, Instituto de Salud Carlos III
5Departamento de Anatomía y Anatomía Patológica Comparadas y Toxicología, Grupo de Investigación GISAZ, UIC Zoonosis y Enfermedades Emergentes ENZOEM, Universidad de Córdoba
La tuberculosis es una enfermedad infecciosa crónica y zoonósica causada por bacterias del complejo Mycobacterium tuberculosis que afecta a mamíferos domésticos y silvestres.
51
Agalaxia contagiosa en pequeños rumiantes: casuística y epidemiología
Cristina Baselga, Oihane Alzuguren y Gema Chacón EXOPOL S.L.
La agalaxia contagiosa ocasiona graves pérdidas económicas en rebaños positivos, siendo necesario instaurar un plan de control y erradicación.
Coccidiosis en rumiantesUna infección inevitable 60
Gutiérrez J., Blasco J.L. y Elvira L. Equipo Técnico Rumiantes MSD Animal Health
Viruela Ovina y Caprina - El resurgir de un viejo conocido 68
Christian de la Fe1 , Román Eliseo2 , Antonio Sánchez1 , Joaquín Amores1 y Juan Carlos Corrales1
1Grupo de Investigación Sanidad de Rumiantes, Departamento de Sanidad Animal, Facultad de Veterinaria, Universidad de Murcia. Campus Regional de Excelencia Internacional Mare Nostrum
2Servicios veterinarios, Piensos Nanta
La reciente declaración de brotes de viruela ovina en España hace indispensable conocer sus características epidemiológicas y signos clínicos para poder actuar con rapidez.
Boehringer Ingelheim Animal Health España: 50 años dejando huella 76
78
Longevidad funcional en la raza Latxa, un carácter de interés para el programa de mejora genética
Carolina Pineda Quiroga y Eva Ugarte
NEIKER-BRTA, Instituto Vasco de Investigación y Desarrollo Agrario, Campus Agroalimentario de Arkaute, Vitoria-Gasteiz
La longevidad es un carácter de interés para el programa de mejora genético de la raza Latxa, estando influenciada por factores de manejo y genéticos.
86
Entrevista a Fernando Freire - Situación actual del manejo reproductivo en el sector ovino
Fernando Freire Gerente de Assafe y Ovigen
Hablamos sobre la situación actual del sector ovino en materia de aplicación de las tecnologías de la reproducción.
Abordaje natural de la coccidiosis en ovino 92
Irene Cabeza Luna Responsable Técnica de Rumiantes, Tecnovit
rumiantes.com
Agradecemos a nuestros anunciantes por hacer posible la publicación de esta revista: Arvet, Bioplagen, Boehringer Ingelheim, Elanco, Lidervet, MSD Animal Health, Qualivet, Tecnovit, Trouw Nutrition, Vetia y Zooallium.
EL ARTE DE VACAS DE LECHE

ALIMENTAR A LAS
 Carlos R. Romero Sala Coordinador del Programa de Eficiencia Productiva MID€S de Calidad Pascual
Carlos R. Romero Sala Coordinador del Programa de Eficiencia Productiva MID€S de Calidad Pascual
“Alimentar a las vacas es el arte de dejar a su alcance una ración que permita preservar su estado sanitario, obteniendo una cantidad razonable de leche y terneros de la mejor calidad y de un modo rentable”.
plenamente vigente.

mismo resultado. Y todos sabemos que esto no sucede así.
Por eso es tan importante la labor de todos los implicados, ganaderos y técnicos, es decir, los artistas que consiguen que la multitud de factores que pueden influir en el potencial productivo de una ración no perjudiquen el resultado previsto.


Entre los factores capaces de alterar los resultados de una misma ración, encontramos la genética, las instalaciones, el comportamiento y salud de las vacas, el manejo de la ración, el manejo de las vacas… La lista es enorme y daría para otro artículo.


ESBOZANDO LA RACIÓN
Siguiendo con las definiciones, entendemos por ración al resultado de un cálculo en el que los nutrientes aportados por los alimentos disponibles deben de cubrir las necesidades de los animales a alimentar.

Suele decirse que hay 3 tipos de raciones, pero, por mi experiencia, yo diría que llegamos a encontrar hasta 5 raciones distintas para las vacas de una granja:
1) 2)
La que optimiza el programa de racionamiento, cubriendo las necesidades nutricionales de la vaca al mínimo coste.
La que entrega el nutricionista al ganadero: es una variación sobre la anterior en la que se redondean ciertos ingredientes o el técnico cambia ligeramente alguno de los componentes para sentirse más cómodo o seguro.
3) 4)
La que prepara el ganadero: los márgenes de error derivados del manejo de los carros mezcladores conllevan variaciones sobre el porcentaje de los distintos alimentos y serán más importantes cuanto menor sea su nivel de inclusión.
5)



La que digiere la vaca, existiendo varios factores que pueden provocar que nos encontremos alimento sin digerir en las heces.

Si la vaca descansa mal y no rumia lo suficiente, pueden quedar fracciones de fibra sin digerir.
La que come la vaca, que siempre intentará seleccionar aquel ingrediente que le resulta más apetecible y, en caso de conseguirlo, no estará comiendo lo que pretendían el técnico y el ganadero.
Exactamente al mismo resultado nos puede llevar una ración poco picada en la que haya una selección importante de ingredientes.
mala calidad microbiológica de los alimentos, incluida el agua, puede aumentar la incidencia de diarreas, por lo que existe una mayor pérdida de nutrientes por las heces.

mal procesado del silo de maíz o una molienda demasiado grosera de los cereales del pienso supondrán una pérdida mayor de almidones.
Presencia de alimento sin digerir en heces de vaca lechera.
Calcio



PERFILANDO LA RACIÓN IDEAL
El éxito de las tres últimas raciones depende exclusivamente del trabajo en la granja y se consigue mediante un adecuado manejo.
El manejo de la ración es el conjunto de prácticas que garantizan que la ración diseñada se parezca a la que prepara el ganadero y a la que come y digiere la vaca.





24h

Ello implica que el alimento debe estar preparado y servido las 24 horas del día de forma que la vaca pueda comer todo lo quiera y en el momento en que le apetezca.
Esto les llama poderosamente la atención y lanzan comentarios del tipo ¿y no se empachan?
La respuesta es sencilla: NO

Y es aquí, precisamente, donde encontramos un componente importante de la dimensión artística de alimentar a las vacas: una vaca debe comer siempre lo mismo a lo largo del día y en cualquier punto del pesebre donde tenga distribuida la ración sin que perjudique su estado sanitario


Si la vaca encuentra disponible toda la cantidad de ración que desea comer en cualquier momento, seguro que podrá expresar plenamente todo su potencial productivo, tanto en litros como en composición de sólidos.







Este objetivo es el que debe conseguir una de las labores más importantes que hay que implantar en la rutina de las granjas: el arrimado del alimento.



Afortunadamente, los técnicos contamos con herramientas, como el separador de partículas de la Universidad de Pensilvania, que nos ayudan a prevenir riesgos. Tanto en versión de 3 como de 4 bandejas, el separador de partículas nos da información muy valiosa sobre el nivel de picado y mezclado de la ración (Imagen 2).
OBJETIVOS CALIDAD DEL MEZCLADO:
Bandeja superior: >2% y <10%
Bandejas intermedias e inferior: <50%
Calidad del picado
La calidad del picado de la ración se mide a través de los valores medios de las distintas bandejas del separador de partículas.
BANDEJA SUPERIOR >10%
Si en la bandeja superior, que es donde se retienen las partículas de mayor tamaño, encontramos valores por encima del 10%, aumentará mucho la probabilidad de que una vaca seleccione la parte de la ración más picada, por lo que una vaca que acuda a comer a un mismo punto a lo largo del día, no encontrará la misma composición de nutrientes.
Imagen 2. Separador de partículas de 3 bandejas.




Calidad del mezclado
OBJETIVO CALIDAD DEL MEZCLADO Coeficiente de variación <3%
Si se toman 10 muestras a lo largo de todo el pasillo de alimentación, el coeficiente de variación, es decir, el cociente entre desviación típica y media, debe ser inferior al 3%.
Cuanto más bajo sea este valor, mayor será la garantía de que una vaca comerá lo mismo independientemente de si acude a comer al principio o al final del comedero, por muy largo que sea.

Este dato es un indicador de la calidad de mezclado de la ración.
De no presentar un valor adecuado, habrá que aumentar los minutos de mezclado en el carro una vez cargado y antes de distribuir el alimento a las vacas.
BANDEJAS INTERMEDIAS E INFERIOR <50%
En el resto de las bandejas, los valores dependerán de si se trabaja con la versión de 3 o 4 bandejas, pero, como norma general, sería conveniente que ninguna de ellas sobrepase el 50%.
BANDEJA SUPERIOR <2%
En el extremo opuesto, si el valor de la bandeja superior es inferior al 2%, el tiempo de rumia se puede ver comprometido por falta de fibra efectiva, aumentando el ritmo de paso por el tracto digestivo y provocando el escape de nutrientes sin digerir.
Los valores conseguidos se pueden mejorar cambiando el orden de llenado del carro o variando los minutos de picado antes de incorporar los alimentos húmedos.
Sistema de pesaje para vacas y terneros en movimiento
La báscula CIMA Control Cattle permite el pesaje de vacas y terneros en movimiento, sin tener que encerrarlos o detenerlos.
Selección de alimentos
Se puede comprobar si ha habido selección de alimentos por parte de la vaca si comparamos la media de las bandejas con las sobras de la ración.



Sería recomendable que, en ninguna de ellas, la diferencia en valor absoluto superara el 10%.
A diario, resulta muy válido comparar el aspecto de la ración distribuida con las sobras: cuanto más se parezcan, mejor habrá sido la preparación del alimento.

OBJETIVO SELECCIÓN ALIMENTOS Medias bandejas – Sobras de la ración = <10%
Peso a la entrada de los terneros. Curvas de crecimiento.
Peso a la carga para matadero.
Peso de la primera cubrición de las novillas.
Peso al parto. Variaciones de peso de las vacas.
Asociacion a identificación electronica, Crotales FDX i HDX by


Rango de peso entre 25 kg1.200 kg.
AL SERVICIO DE TU RENDIMIENTO
Equilibrio entre nutrientes










Una buena ración debe presentar un correcto equilibrio entre todos los nutrientes, es decir, agua, energía, proteína, fibra, minerales y vitaminas, para no interferir en la correcta reproducción de las vacas.
Entre los principales factores alimentarios que perjudican la reproducción podemos mencionar los siguientes:
Balance energético negativo severo en el postparto.
Exceso de proteína en la ración con resultados de urea en leche por encima de 300 ppm de manera sostenida.


Déficit de minerales o vitaminas, con especial atención al fósforo, zinc, cobre y vitamina E.

Presencia de zearalenona en la ración: si bien valores superiores a las 500 ppb serían críticos, es probable empezar a observar resultados negativos en los parámetros reproductivos a partir de 100 ppb.
Agua de bebida con niveles de nitratos por encima de 100 ppm.
Protección de la ubre
La alimentación de la vaca debe contribuir a que no se vea alterada la calidad higiénicosanitaria de su leche, expresada como el recuento de células somáticas.

Lograr este objetivo estará condicionado por determinadas prácticas que permitan mantener un sistema inmunitario fuerte, a la vez que se minimiza la entrada de patógenos por la ubre mediante el manejo de la ración:
Maximizar la ingesta a través de un Bienestar Animal adecuado, una buena calidad de los alimentos y una buena rutina de arrimado de la ración.
Lograr un correcto equilibrio entre todos los nutrientes, tanto en lactación como en preparto, donde se requiere un control del balance aniones-cationes de la dieta (DACD).
Asegurar la máxima calidad microbiológica de todos los ingredientes de la dieta, así como de la ración completa. Por supuesto, aquí incluimos la calidad del agua Distribución de la ración y programación de los arrimados para que las vacas encuentren atractivo acudir a los comederos tras el ordeño, retrasando al máximo el momento de tumbarse para conseguir el mayor grado posible de cierre de esfínteres.
Rentabilidad
Por último, una de las condiciones que debe cumplir la alimentación de las vacas, es que debe contribuir a la rentabilidad de la ganadería.
RENTABILIDAD
Costes Alimentación (60% costes totales) vs. Ingresos por leche vendida (85% ingresos totales)
El coste de la alimentación se encuentra muy próximo al 60% de los costes totales de una explotación de vacuno lechero. Desde el punto de vista aritmético, queda claro que es el principal coste.

En ningún caso debemos caer en la tentación de valorar el coste de la alimentación exclusivamente en base a lo barato que nos salga comprar el pienso. Lo importante es el coste al que podemos producir la leche.
El mayor avance se conseguirá si se compara el principal coste, la alimentación, con el mayor ingreso, la leche vendida, que viene a suponer algo más del 85% de los ingresos totales de una ganadería de vacuno de leche.
Esto lo lograremos a través del ISCA (Ingresos Sobre Costes de Alimentación), que corresponde al dinero que genera cada vaca por la venta de su leche después de haberse pagado el alimento.
ICSA Ingresos por leche vendida – Costes alimentación

Resulta muy conveniente que cada ganadero siga la evolución mensual del ISCA en su negocio. Pero la perspectiva de la comparación con otras granjas también resulta muy interesante.
Según los datos del Programa de Eficiencia Productiva MID€S, el ISCA entre julio de 2021 y junio de 2022 fue de 5,9 + 1,1 € por vaca y día, subiendo a 7,2 + 1,6 € por vaca y día durante el trimestre comprendido entre abril y junio de 2022.


En conclusión, las claves para mejorar los resultados de la alimentación de nuestras vacas pasan por asegurar agua de calidad y en cantidad, trabajar con alimentos de calidad, minimizar las pérdidas, usar raciones equilibradas, proporcionar un adecuado Bienestar Animal y un correcto control de todos los procesos, contando con la ayuda de técnicos que sean capaces de generar confianza al ganadero.
El ISCA obtenido debería contribuir a cubrir el resto de costes de la granja y a la obtención de un beneficio por la actividad.
Está claro que una vaca bien alimentada se puede considerar una verdadera obra de arte fruto del trabajo de los auténticos artistas: ganaderos y técnicos.
El arte de alimentar a las vacas de leche DESCÁRGALO EN PDF

¿CÓMO E LEGIR EL
IDEAL? LACTORE E MPLAZANTE
Alejandra Valentín Product Manager Trouw Nutrition Spain Sales Ruminiant
En los últimos años se ha visto una tendencia creciente a la atención que se muestra a la recría y a su cuidado en las ganaderías. Un acierto sin duda, ya que supone asegurar el futuro de nuestra explotación.
IMPORTANCIA DE LA PROGRAMACIÓN METABÓLICA
Las primeras semanas de vida de la recría tienen un gran impacto, no solo en el desarrollo de las terneras hasta el destete, sino durante toda la vida del animal. Es lo que se conoce como programación metabólica.
Srinivansan et al. (2002) define la programación metabólica como “adaptación temprana a un estímulo o estrés nutricional que cambia permanentemente la fisiología del organismo y su metabolismo, y continúa expresándose incluso en ausencia del estímulo/estrés que lo inició”, lo que implica que el desarrollo externo e interno de las terneras afecta al rendimiento productivo, fertilidad y longevidad en su fase adulta.
Como vemos, no solo la genética es clave para tener las mejores vacas, sino que la forma en la que potenciemos esa genética a través de la programación metabólica de la recría es también de vital importancia.





Fenotipo = G enotipo + A mbiente
Figura 1. El fenotipo, lo que el animal expresa, es resultado del genotipo, su ADN predeterminado y cómo este es afectado por el ambiente.

Junto con el encalostrado y el manejo, la nutrición de nuestras terneras es uno de los parámetros que más puede afectar, de manera positiva o negativa, a esa programación metabólica.
Una alimentación de excelente calidad y cantidad hasta, al menos, las 6 primeras semanas de vida, resulta en una programación metabólica positiva, con efectos beneficiosos en la gestión del metabolismo energético, lo que tiene resultados visibles con mejora de1,2,3:
La producción
La fertilidad
La capacidad de superación de los periodos de transición con éxito
En estas primeras 6 semanas de vida, el principal sustento de una ternera es la leche Durante la fase de pre-rumiante, los sólidos de la leche o su sustituto son digeridos en el abomaso y el intestino.
La gotera esofágica se cierra permitiendo la entrada directa del alimento del esófago al abomaso sin pasar por el rumen1.
LAS CLAVES DE UNA LACTANCIA ÓPTIMA
La recomendación sobre la cantidad de leche por día que deben tomar las terneras y la duración de la lactancia ha evolucionado mucho a lo largo de los últimos años.


Los planos elevados de alimentación se han impuesto frente a la alimentación restringida a la que estaban sometidos los animales hasta ahora.
Este tipo de alimentación, que suministra más litros por día por ternera, es lo que las madres de forma natural harían con la recría, contribuyendo a activar la programación metabólica positiva.
De otra forma, mandaríamos a nuestras terneras un mensaje de restricción en cuanto a su desarrollo:
“Afuera no hay para comer, no desarrolléis todo vuestro potencial, porque no tendréis el alimento suficiente para poder mostrarlo”.
Si después a esos animales les exigimos un alto rendimiento, lo harán a expensas de su salud, y esto reducirá considerablemente la vida media de nuestras vacas.
EsófagoHemos pasado de dar aproximadamente el 10% del PV a dar el 20%, pero ¿es suficiente con únicamente aumentar la cantidad de litros que estábamos dando?
La respuesta es que NO. Es importante dar otro paso más en calidad, ya que conforme aumenta la cantidad de litros, la calidad del lactoreemplazante es incluso más importante. La pregunta es,
¿Cómo saber qué lactoreemplazante elegir?
Hasta ahora, la principal vara de medir que se ha utilizado para valorar la calidad de un lactoreemplazante ha sido el porcentaje de leche descremada que contiene.
La leche descremada es una materia prima que suele ser de buena calidad y nos asegura que un gran porcentaje del producto final lo sea. Sin embargo, solo una parte. ¿Qué hay del porcentaje restante del producto? En algunos casos puede ser más del 50% y es algo que no se está valorando de forma general.

Para valorar de una manera más rigurosa la calidad de los lactoreemplazantes, debemos evaluarlos a tres niveles:
Valor nutricional
El perfil de nutrientes del sustituto lácteo es lo que aparece en la etiqueta para indicarnos la cantidad (normalmente expresado en % o mg/kg) de los diferentes nutrientes, como proteína, grasa, fibra, etc. que contienen los lactoreemplazantes para cumplir con las necesidades de crecimiento y desarrollo de los animales.

En lo que respecta al perfil nutricional, si bien podemos encontrar diferencias entre lactoreemplazantes, no es tan determinante a la hora de valorarlo.
Un punto de partida para comenzar la valoración pueda ser la aparición de fibra en la etiqueta.
De por sí, la leche no tiene fibra, por lo que no es necesaria para alcanzar los niveles deseados de requerimientos. Si en la etiqueta aparece algo más de un 0,1% de fibra bruta, significa que se están utilizando materias primas que no son de origen lácteo, y esto, como veremos, puede acarrear patologías digestivas.
Valor nutricional
Origen y calidad de las materias primas
Origen y calidad de las materias primas
No solo es importante alcanzar los valores nutricionales deseados para el óptimo desarrollo, sino que la forma en la que aportamos los nutrientes tiene incluso mayor relevancia.
Dependiendo de las materias primas que utilicemos, la calidad y los procesos de control de estas, cambiaremos la digestibilidad y la capacidad que tiene el animal de aprovechar un nutriente.
Proceso de fabricaciónEs aquí donde radica una de las grandes diferencias entre los diferentes tipos de lactoreemplazantes.
Lo primero que hay que entender es de dónde vienen las principales materias primas que se utilizan para la fabricación de un lacto-reemplazante (Figura 2).
A continuación, veremos los principales nutrientes que debemos tener en cuenta y cuáles son sus fuentes.
PROTEÍNA
Los valores de proteína son muy importantes para el desarrollo de nuestras terneras.
La calidad de la proteína está condicionada por su digestibilidad y perfil de aminoácidos, que viene impuesta por la fuente que la aporta y que variará con la edad del animal.
Figura 2. Composición de la leche y procedencia de algunas de las materias primas que se obtienen de esta para la elaboración de lactoreemplazantes.
Del total de la leche natural, solo un 13%, aproximadamente, es materia seca.
FABRICACIÓN DE MANTEQUILLA
Si la materia seca se descrema para la fabricación de mantequilla, se obtiene un producto denominado leche descremada
Esta leche descremada, secada por un proceso de spray, es lo que se utiliza para darle el nombre al porcentaje de la leche
Si se utiliza en un 50% en el producto, se llama “leche del 50”, si se utiliza en un 30%, se llama “leche del 30” y así sucesivamente.
FABRICACIÓN DE QUESO
Si los sólidos iniciales se destinan a la fabricación de queso, se utiliza tanto la grasa como la principal fuente de proteína de la leche, la caseína, obteniéndose suero lácteo, que es la base principal de las llamadas “leches 0”.
En el caso concreto de los animales jóvenes, es importante si esta fuente es láctea o no, ya que estamos hablando de animales que, durante esta fase, están genéticamente adaptados para aprovechar al máximo los nutrientes que vienen de la leche.

Existen diferentes fuentes lácteas que nos pueden ayudar a aportar la proteína láctea que el animal necesita. Las principales son (Tabla 1):
Leche descremada Lactosueros Sueros deslactosados Leche mazada
LECHE DESCREMADA
La leche descremada, resultante de retirar la parte grasa al sólido de la leche, tiene como principal fuente proteica la caseína que resulta fundamental para la formación del coágulo en el abomaso.
LACTOSUEROS Y SUEROS DESLACTOSADOS
En los sueros, resultantes de la elaboración del queso, la principal fuente proteica no es caseína, sino proteínas globulares. Estos sueros, pueden mantener la lactosa o no.
Proteína (%) Caseína (%) Proteínas globulares (%) Fibra Digestibilidad
LECHE MAZADA
Otro tipo de aporte proteico lácteo podría ser la leche mazada, un subproducto del proceso de transformación de mantequilla. Sin embargo, al ser un subproducto, su composición es muy variable y no es recomendable su uso en grandes cantidades.
Coagulación
Leche descremada 36 80 20 - 96 Sí
Lactosuero 12 - 100 - 93 No
Lactosuero proteico concentrado 35 - 100 - 93 No
Leche mazada Variable Variable Variable - Variable No
Concentrado de proteína soja 67 - - 3,5 65 No
Concentrado de proteína de guisante 50 - - 3,5 60 No
Las fuentes vegetales disponibles para aumentar los niveles proteicos en los lactoreemplazantes no son recomendables dado que la capacidad para digerir este tipo de proteínas no está del todo desarrollada en el animal, lo que puede conducir a un exceso de proteína en el tracto digestivo provocando diarreas1
¿Cómo saber si se han usado materias primas vegetales para añadir proteína?
Además de encontrarse en los análisis de lactoreemplazantes, en ocasiones puede deducirse de la etiqueta si esta presenta más de un 0,1% de fibra bruta.
Tabla 1. Características de las materias primas de los lactoreemplazantes.
El valor añadido de la leche descremada: la coagulación
La fuente de proteína tiene impacto en el lugar de digestión del lactoreemplazante
En el caso de animales jóvenes, la presencia de leche descremada es muy interesante por el aporte de proteína en forma de caseína, ya que es imprescindible para la formación del coágulo en el abomaso.
La fracción grasa de la leche formará parte de este coágulo, pero las proteínas del suero, la lactosa y las vitaminas y minerales solubles serán liberados lentamente a la porción líquida (suero) a medida que se contraiga.

Los componentes solubles pasan al intestino delgado dentro de las 2-3 primeras horas tras la toma, mientras que la proteína y la grasa inician su digestión más lenta en el abomaso.
Esto facilita, en gran medida, la digestión total del lactoreemplazante de forma paulatina para que se produzca una buena absorción de nutrientes debido a que disminuye la velocidad de paso por el tracto digestivo, evitando así el exceso de proteína y lípidos no digeridos en intestino que puedan provocar patologías digestivas.
20% leche descremada spray
Aunque, la presencia de leche descremada spray es fundamental en la digestión y salud de las primeras edades por su aporte de la caseína, un 20% de leche descremada spray aporta la suficiente cantidad de caseína para que ocurra esta coagulación.
Un lactoreemplazante sin contenido de leche descremada spray y, por ende, sin contenido en caseína, que no coagulará en el abomaso, no tiene por qué ser un problema para las terneras.
Siempre y cuando se aporte proteína de una fuente láctea y las materias primas que se utilicen presenten una alta digestibilidad, se producirá una buena digestión y absorción de la mayor parte de los nutrientes en abomaso e intestino delgado sin que lleguen a intestino grueso donde sí serían causa de patología digestiva.
La digestibilidad de la grasa viene marcada por:
La longitud y el grado de saturación de los ácidos grasos (perfil idóneo el que aparece en aceites de coco, palma y colza).
El tamaño del glóbulo graso, que debe ser lo más reducido posible.
El tamaño del glóbulo es más importante que el perfil de ácidos grasos, ya que interfiere no solo en el proceso de digestión, sino también en la apetecibilidad, enranciamiento y homogenización del sustituto lácteo.
GRASA
Esto también está evolucionando y cada vez más podemos encontrar sustitutos lácteos más parecidos a la leche de las madres.
El aporte energético de los lactoreemplazantes en forma de grasa es uno de los condicionantes más importantes de la nutrición de las terneras. Por tanto, si el contenido en proteína en la dieta es similar a la leche de la madre y de buena calidad, la grasa es el componente que más importancia puede dar al lactoreemplazante.

Proceso de fabricación
Para conseguir todos estos beneficios, es muy importante seguir un proceso de fabricación y un método de incorporación exclusivos. La grasa es la principal fuente de energía para el animal en las primeras edades. Si volvemos a fijarnos en la naturaleza, la leche entera de las madres contiene mayor cantidad de grasa que de proteína. Sin embargo, no es lo común en los lactoreemplazantes, que suelen aportar mayor porcentaje de proteína que de grasa y más lactosa que la leche entera de las madres.
El proceso de fabricación de los lactoreemplazantes es el tercer factor diferenciador en lo que a la calidad del proceso en sí se refiere, pero, sobre todo, en la calidad de la homogeneización del producto. En este punto, interfieren sobre todo dos factores:
1) 2)
El tamaño del glóbulo graso
El tipo de mezclado (si se hace con materias primas en líquido o en seco)
En la Figura 3 se muestra cómo se vería un sustituto lácteo en el que no se ha reducido el tamaño graso y que se encuentra sin homogeneizar.
PROTEÍNA LACTOSA
Figura 3. Lactoreemplazante sin homogeneizar.


LÍQUIDO
Si esta grasa, de unas 20 micras, se reduce a 2 micras, se obtiene un tamaño de grasa que es más parecido al tamaño de las diferentes partículas que la rodean y, por tanto, se consigue una mayor homogeneidad en el producto.
En cambio, sin este proceso de homogeneización, una vez formado el producto, la grasa quedaría rodeando a la proteína, impidiendo su correcta asimilación.
Figura 5. Imagen real de un lactoreemplazante sin homogeneizar visto al microscopio.
Este proceso de homogeneización conlleva a una serie de ventajas que se resumen en la Tabla 2:
Vía seca (sin homogeneizar) Vía húmeda (homogeneizada)
Peor capacidad de dilución
Mejor solubilidad del lactoreemplazante
Mayor riesgo de oxidación (grasa libre) Mayor estabilidad del producto
Peor aprovechamiento de nutrientes
Mejor digestibilidad y palatabilidad
Tabla 2. Ventajas del proceso de homogeneización de la grasa (vía húmeda) durante la fabricación del lactoreemplazante con respecto a ausencia de homogeneización (vía seca).
La recría es un pilar fundamental en el futuro de nuestra ganadería. Es por ello de suma importancia dedicarle la mayor atención y elegir una nutrición de calidad que acompañe a nuestros animales, dándonos beneficios no solo en términos de rendimiento animal, sino también económicos.
ACCEDER A BIBLIOGRAFÍA
Figura 4. Proceso de homogeneización de las partículas de grasa del lactoreemplazante.


PRODUCCIÓN DE METANO Y ESTRATEGIAS DE MITIGACIÓN BASADAS EN LA ALIMENTACIÓN
Carlos Fernández Catedrático de Universidad Instituto de Ciencia y Tecnología Animal, Universitat Politécnica de Valencia
El metano (CH4) entérico producido por los rumiantes es responsable de, aproximadamente, el 6% de las emisiones antropogénicas globales de gases de efecto invernadero.
El CH4 tiene una vida útil mucho más corta (8,6 años, Muller y Muller, 2017 ) que el CO2 en la atmósfera, lo que lo convierte en un objetivo de mejora a corto plazo en la reducción del calentamiento global.

Eeste artículo, se abordan las Estrategias Nutricionales de Mitigación de emisiones de CH 4


CH4
La manipulación dietética puede ser un camino de mitigación de CH 4 muy eficaz,existiendo ya muchas revisiones exhaustivas (Beauchemin et al., 2009; Hristov et al., 2013; Knapp et al., 2014; Beauchemin et al., 2020).
La eficiencia de la mitigación de CH 4 con una dieta en particular dependerá de los siguientes factores y sus interacciones:
Sus efectos sobre el flujo de H 2 en el rumen y su concentración
La comunidad microbiana
Las vías de fermentación
El tiempo de permanencia del alimento en el rumen

ESTRATEGIAS NUTRICIONALES DE MITIGACIÓN DE EMISIONES DE CH 4
» LÍPIDOS
Numerosos estudios han demostrado que, suplementando las dietas con niveles bajos de lípidos (<4% de la materia seca ingerida), se puede reducir la producción de CH4 hasta en un 20% , aunque los resultados son variables.
Al mismo tiempo, se aumenta la densidad energética de las dietas y se mejora la productividad animal en algunos casos.
Los resultados de un metaanálisis indican una disminución de las emisiones de CH4 (g/dia) del 1% al 5% por cada 10 g de grasa/kg de materia seca (Grainger y Beauchemin, 2011; Patra, 2013), con ácidos grasos de cadena media (C12:0, C14), siendo el efecto incluso mayor en el caso de los ácidos grasos poliinsaturados (Patra, 2013).

Los lípidos de la dieta inhiben la metanogénesis al reemplazar la materia orgánica fermentable en el rumen a través de la biohidrogenación de ácidos grasos insaturados, disminuyendo así la proporción de bacterias metanógenas y protozoos ruminales (Patra, 2013).
La biohidrogenación puede proporcionar una alternativa de captación de [H] en el rumen para competir con la metanogénesis, pero es cuantitativamente pequeño (1% a 2% de [H] usado para esta reacción; Nagaraja et al., 1997 ), aunque sería potencialmente mayor si se inhibe la metanogénesis.
mitigación basadas
Sin embargo, la suplementación con lípidos es costosa y puede disminuir la digestibilidad de la fibra y la ingestión de materia seca. Además, inhiben la fermentación ruminal y reducen la síntesis de grasa de la leche (Grainger y Beauchemin, 2011; Patra, 2013).

A pesar de que es posible implementar la suplementación con lípidos en las granjas comerciales, en general, tiene un impacto bajo-moderado en la mitigación de CH4 debido al coste y los posibles efectos negativos sobre la producción animal y la calidad del producto.
» CONCENTRADOS
En comparación con las dietas a base de forrajes, las dietas basadas en concentrados están asociadas con una menor producción de CH 4 porque la fermentación del almidón en el concentrado da como resultado más propionato y butirato que la celulosa en el forraje y, por lo tanto, compite con la metanogénesis por el [H].
El almidón tiene una tasa de digestión y fermentación más rápida que la celulosa (Wang et al., 2014).
La ingesta de altas cantidades de almidón puede disminuir el pH ruminal, lo que inhibe el crecimiento de bacterias metanógenas, pero también puede reducir la digestibilidad de la fibra y aumentar el riesgo de acidosis.

Si bien, la alimentación con dietas con mayor proporción de almidón puede mejorar el rendimiento animal y disminuir la producción de CH4 , su potencial como una estrategia de mitigación de CH4 es baja, ya que la posibilidad global de aumentar la alimentación concentrada en rumiantes es limitada.
Además, las dietas a base de cereales ignoran la importancia de los rumiantes en la conversión de alimentos fibrosos, no aptos para consumo humano, en fuentes de proteínas de alta calidad (como leche y carne).
Habría que ser conscientes de que el aumento de concentrados en las raciones provocaría cambios globales en las emisiones de gases efecto invernadero, ya que se necesitaría incrementar el uso de tierra para poder producir concentrado adicional, siendo éste un aspecto que debería estudiarse con un análisis del ciclo de vida.
Forrajes
Dado que los rumiantes consumen forrajes, se necesitan estrategias para mitigar la producción de CH4, especialmente si tenemos en cuenta que el pastoreo es responsable del 75% de las emisiones mundiales de CH4 de los rumiantes (FAO, 1999).
Algunas de las emisiones de CH4 de los rumiantes en pastoreo puede compensarse mejorando las reservas de carbono del suelo, ya que el pasto elimina CO2 de la atmósfera (Guyader et al., 2016b).
Además, los sistemas de pastoreo bien gestionados pueden reducir la necesidad de usar fertilizantes sintéticos a través de un uso más eficaz del estiércol y mediante la utilización de plantas fijadoras de nitrógeno, lo que contribuiría también a disminuir las emisiones de N2O.
Los sistemas de producción de rumiantes basados en forrajes también proporcionan otros beneficios ecológicos: Conservación de la biodiversidad
Mejora de las propiedades del suelo y de la calidad del agua Creación de un hábitat para la vida silvestre (Guyader et al., 2016b)
La mitigación del CH4 en las dietas a base de forrajes se puede lograr, hasta cierto punto, mejorando la calidad y disponibilidad del forraje mediante:
El manejo del pastoreo
La recolección y uso de especies forrajeras de alta digestibilidad
El uso de plantas ricas en taninos condensados
El almacenamiento óptimo de forrajes para conservar los nutrientes digestibles
El uso de forrajes de alta calidad redunda en una mayor proporción de carbohidratos no fibrosos respecto a la fibra neutro detergente (FND) que, a su vez, estará menos lignificada, lo que promueve la degradación de la materia orgánica en el rumen.
El consumo de forrajes incrementa la disponibilidad de [H] para la metanogénesis y la producción absoluta de CH4 aumentará.
No obstante, los forrajes de alta calidad también favorecen una mayor ingestión de materia seca, lo que se asocia con una mayor productividad y tasa de paso a través del rumen, lo que se traduce en una disminución en la producción de CH4/g de materia seca ingerida.
En resumen, el efecto neto de la calidad del forraje sobre las emisiones diarias de CH4 es variable, pero mejorando la calidad del forraje se disminuirá la intensidad en la emisión de CH4 y, como resultado, se incrementará la productividad del animal.

Inhibidores químicos
La búsqueda de compuestos que disminuyan la producción de CH4 en la alimentación de los rumiantes es un área importante de investigación.
Además de la reducción de las emisiones de CH 4 , la investigación en este área teóricamente podría conducir a mejorar la eficiencia productiva mediante la redirección de [H] desde CH 4 hacia compuestos, como propionato o acetato, que pueden ser utilizados por el animal (Janssen, 2010; Ungerfeld, 2013).
El enfoque más habitual ha sido el uso de compuestos que inhiben la metanogénesis. Estos compuestos deben reducir las emisiones sin provocar efectos tóxicos para los animales, los seres humanos y el medio ambiente.

Con el objetivo de que sean utilizados por los productores, deberían ser de bajo coste, aumentando la productividad y rentabilidad.
Algunos investigadores (Liu et al., 2011; Veneman et al., 2016; Henderson et al., 2018) consideran que el uso de inhibidores sintetizados químicamente es una de las estrategias más prometedoras para reducir las emisiones de CH 4 de los rumiantes.
La mayoría de los inhibidores evaluados se pueden clasificar como análogos de CH4 o análogos de metil-coenzima M , un cofactor implicado en la transferencia de metilo durante la metanogénesis.
Algunos inhibidores que se han evaluado in vivo son la tricloroacetamida, hemiacetal de cloral y almidón, hidrato de cloral, 9, 10-antraquinona, nitroetano, 3-nitrooxipropanol y cloroformo (Ungerfeld, 2018).
Algunos inhibidores son tóxicos, causan efectos secundarios indeseables o solo disminuyen la metanogénesis transitoriamente. No obstante, su estudio ha generado conocimiento en torno a las consecuencias de inhibir la metanogénesis en el rumen.

El 3-nitrooxipropanol es un inhibidor del CH4 interesante que está en periodo experimental.
Se ha observado una disminución constante en la producción de CH 4 (20-40%) según el tipo de animal, la composición de la dieta, dosis y método de suplementación de 3-nitrooxipropanol (Hristov et al., 2015; Dijkstra et al., 2018; Vyas et al., 2018).
No se han observado efectos negativos sobre la digestibilidad de la dieta (Romero-Perez et al., 2014) manteniéndose la disminución de la producción de CH4 durante varios meses en vacas lecheras en lactación (25-32%, estudio de 12 semanas; Hristov et al., 2015) y en vacuno de carne en crecimiento (dieta rica en forrajes durante 105 días, 37% de disminución; alto contenido de cereales dieta durante 105 días, 42% de disminución; Vyas et al., 2018).
Sin embargo, un estudio de McGinn et al. (2019) sugiere que se puede producir una adaptación a los inhibidores a lo largo del tiempo, por lo que es un área de investigación que necesita ser desarrollada.
Características del 3-nitrooxipropanol
Dosis efectiva relativamente baja (1-2 g/ día)
Alta especificidad hacia los metanógenos Degradación en el rumen a concentraciones muy bajas de nitrato, nitrito y 1,3-propanodiol Residuos en leche y carne mínimos o inexistentes Riesgo supuestamente bajo (Thiel et al., 2019a y 2019b)

No obstante, aún hay que esperar a que el compuesto sea aprobado por las autoridades reguladoras.
Algas
Las algas se pueden clasificar según su: Tamaño (micro o macro) Pigmentación (verde, rojo o marrón) Hábitat (agua dulce o salada)
Algunos tipos de algas concentran florotaninos y bromoformas, compuestos halogenados que inhiben a la cobamamida durante la metanogénesis.

Machado et al. (2014) examinaron 20 especies de macroalgas marinas tropicales in vitro y concluyeron que Dictyota (alga marrón) y Asparagopsis (alga roja) tenían el mayor potencial para disminuir la producción de CH4 .
Kinley y col. (2016) mostraron in vitro que Asparagopsis taxiformis suplementado con 20 g/kg de forraje eliminaba casi por completo la producción de CH que se produjeran efectos negativos sobre la digestibilidad del forraje.


Recientemente, Li et al. (2018) que dietas suplementadas con hasta un 3% de A. taxiformis en ovejas disminuyen la producción de CH un 80% con la dosis máxima ocasionar cambios en la ganancia de masa corporal.
Para que las algas sean adoptadas por los productores, la disminución de la metanogénesis tendría que ser persistente y sin los efectos secundarios negativos (las macroalgas que contienen bromoformo son tóxicas para el medio ambiente).
Por tanto, es necesario evaluar el ciclo de vida para examinar las emisiones de CO2 procedentes de la producción, recolección, secado y transporte de algas para así garantizar que no contrarresten su potencial de disminución de las
Sumideros alternativos [H]
El nitrato es un aceptor competitivo que usa [H] a expensas de la metanogénesis durante su reducción a nitrito y, posteriormente, amoniaco en el rumen.
Además, tiene efectos tóxicos directos sobre las bacterias metanógenas a través de su reducción intermedia a nitrito (Lee y Beauchemin, 2014).

En teoría, la reducción de 1 mol (62 g) de nitrato a amoníaco en el rumen debería reducir la producción de CH4 en 1 mol (16 g).
Sin embargo, este potencial nunca se alcanza en los estudios de alimentación porque el nitrato y el nitrito pueden ser absorbidos o expulsados del rumen, aumentando el riesgo de toxicidad . Además, el nitrito puede ser metabolizado hasta dar N2O, otro potente gas de efecto invernadero.
Varios estudios de alimentación han examinado los efectos a corto y largo plazo de la suplementación de las dietas con nitratos (principalmente, nitrato de calcio).
En estudios que duraron varios meses, la inclusión de nitrato (≈20 g/kg de MS) redujo la producción de CH4 en un 12% en ganado de carne (Lee et al., 2017) y un 16% en vacas lecheras (van Zijderveld et al., 2011).
El nitrato es una fuente de nitrógeno (N) no proteico que puede aportar el N necesario a los microorganismos del rumen, siendo beneficioso en dietas bajas en proteínas. No obstante, la adición de nitrato a una dieta con un contenido suficiente de N resultaría en un aumento de N emitido al medio ambiente.

La incorporación de nitrato en las dietas de los animales aumenta ligeramente los residuos de nitrato en los tejidos (Doreau et al., 2018) y en leche (Guyader et al., 2016a), pero los niveles son muy bajos y no se consideran perjudiciales para la salud humana.
El aumento de las concentraciones de nitrato en el rumen hace que aumenten los niveles de nitrato, causando intoxicación por nitratos en los animales.
A pesar de que el riesgo de intoxicación puede reducirse mediante la adaptación gradual de animales (Lee y Beauchemin, 2014), los suplementos de nitrato no están aprobados para el ganado en muchos países (EE. UU., Canadá).
En general, el coste del nitrato de calcio en relación al de la urea (más del doble) y los posibles riesgos para la seguridad pública son los principales impedimentos para el uso de nitrato para la mitigación del CH4
Fitocompuestos
Actualmente, se están investigando los compuestos vegetales secundarios como aceites esenciales, taninos, saponinas, flavonoides y compuestos organosulforados por sus propiedades anti-metanogénicas.
Uno de los estudios más completos en relación a este tipo de compuestos es el proyecto de la UE "Rumen-up" que evaluó 500 plantas y extractos de plantas por sus efectos sobre fermentación in vitro, identificando al menos 25 compuestos con valor potencial como aditivos para piensos.
Numerosos aceites esenciales (por ejemplo, derivados del ajo, tomillo, eucalipto, orégano, canela y ruibarbo) han demostrado tener capacidad para disminuir la producción de CH4 in vitro, pero muy pocos han demostrado tener efectos antimetanogénicos a largo plazo in vivo (Cobellis et al., 2016).

Los compuestos organosulfurados, aliina, dialilsulfuros y alicina, presentes en el aceite de ajo, parecen ser eficaces en la disminución de CH4 in vitro. Por tanto, sus efectos deberían evaluarse en futuros estudios con animales.
Los taninos condensados e hidrolizables también han demostrado ser prometedores para la mitigación del CH4 . Los taninos son compuestos polifenólicos presentes en diversas plantas, con afinidad para unirse a proteínas y otros compuestos.
La producción de CH4 en respuesta a la suplementación con taninos es muy variable dependiendo de la fuente, tipo y peso molecular de los taninos, y la comunidad metanogénica presente en el animal.
Un metaanálisis de 30 experimentos in vitro e in vivo demostraron que niveles crecientes de taninos disminuían la producción de CH4 en relación a la materia orgánica digestible (Jayanegara et al., 2012).
Los estudios in vitro predijeron las respuestas in vivo hasta un nivel de 100 g de taninos/kg materia seca. a.
Un metaanálisis con estudios in vivo reveló una disminución de 0,109 L CH4/kg materia seca ingerida por g de tanino y kg materia seca ingerida. Sin embargo, una limitación importante de los taninos es que a bajas concentraciones (<20 g/kg materia seca ingerida), típico de muchos forrajes y piensos suplementarios, las respuestas hacia las emisiones de CH4 son muy variables.
Además, parte de la disminución de CH 4 debida a los taninos puede deberse a una disminución concomitante en la materia seca ingerida y digestibilidad de los nutrientes.
El uso de taninos como estrategia potencial de mitigación del CH4 requiere una mayor investigación para identificar los tipos y dosis de taninos que reducen el CH4 sin efectos adversos sobre el rendimiento animal.
El empleo de forrajes que contienen taninos es particularmente relevante para el pastoreo del ganado rumiante, ya que muchas leguminosas forrajeras contienen taninos
Se ha demostrado que los taninos ayudan en el control de parásitos gastrointestinales (Min y Hart, 2003) y, además, pueden mejorar la utilización de N (Jayanegara et al., 2012).
Estudiar las comunidades de arqueas y realizar más estudios in vivo con diferentes estrategias nutricionales durante periodos suficientemente largos de tiempo será clave en la toma de decisiones futuras respecto a la mitigación de la producción de CH4 por los rumiantes.
Los productores necesitan estrategias rentables para reducir las emisiones que además permitan satisfacer la demanda por parte de los consumidores de alimentos de alta calidad, seguros, asequibles y producidos a partir de animales sanos.

Producción de metano y estrategias de mitigación basadas en la alimentación
DESCÁRGALO EN PDF
“FENCOVIS®, UN PASO MÁS EN LA PREVENCIÓN DE ENFERMEDADES DEL GANADO
VACUNO"
ENTREVISTA CON MANUEL CERVIÑO

ASESOR TÉCNICO DE RUMIANTES
Boehringer Ingelheim presenta Fencovis®, una nueva vacuna frente a la diarrea neonatal de los terneros, la primera en el mercado europeo diseñada para PREVENIR la diarrea neonatal de los terneros causada por E. coli y Rotavirus bovino, además de para reducir la gravedad de la diarrea neonatal producida por Coronavirus bovino1.




Ante este lanzamiento, Manuel Cerviño, asesor técnico de Rumiantes de Boehringer Ingelheim Animal Health España, analiza las fortalezas de este nuevo producto y lo que supone poder incorporarlo al amplio porfolio de la compañía.
1Información sobre FENCOVIS®

SUSPENSION INYECTABLE – 4097 ESP –Ficha técnica (aemps.es)
¿Qué es Fencovis®?
Podría decir simplemente que Fencovis® es una nueva vacuna frente a la diarrea neonatal de los terneros, y no mentiría, pero dejaría de expresar la esencia de esta vacuna, que más que una vacuna es todo un proyecto.
En el ánimo de Boehringer Ingelheim está el trabajar en el entorno de “Una salud única”, por la salud pública, el bienestar animal, la producción sostenible y el respeto al medio.

En esta ocasión, este compromiso se materializa a través del lanzamiento de un inmunológico frente a uno de los mayores problemas de la producción bovina: las diarreas neonatales de los terneros.
Como elemento de base, Fencovis® es una vacuna inactivada y adyuvantada, que se aplica a las vacas y novillas gestantes para generar una respuesta inmunológica potente y completa.

Esta respuesta, compuesta tanto por inmunoglobulinas como por células inmunitarias específicas, es transferida de manera pasiva al ternero a través del calostro, generando en él un nivel de protección tal que:
1.
Evita las diarreas producidas por Rotavirus y E. coli.
2.
Minimiza la frecuencia e intensidad de las producidas por el Coronavirus bovino.




Además, según ha podido comprobar en los estudios presentados a registro, Fencovis® consigue disminuir la excreción vírica en aquellos terneros infectados, disminuyendo la transmisión de los agentes dentro del rebaño.
2 ml (IM) 3 semanas – 3 meses antes del parto
La aplicación de Fencovis® es sencilla: 2 ml vía IM, entre tres semanas y tres meses antes de la fecha prevista de parto, en dosis única, incluso en primovacunación.
No es ningún secreto que Boehringer Ingelheim ha apostado por la prevención como estrategia para mejorar la producción y sanidad bovina. En este contexto, el lanzamiento de Fencovis® supone un paso más para completar el porfolio de productos para la prevención de enfermedades del ganado vacuno.
Las diarreas neonatales son una enfermedad enormemente costosa que, además, genera una enorme frustración en productores y veterinarios.
Por eso, para Boehringer Ingelheim es un orgullo y supone una enorme satisfacción lanzar Fencovis®. Para el mercado, el tiempo lo dirá, pero estoy absolutamente seguro de que vamos a contribuir de manera clara a la solución del problema.
¿Cuáles son las fortalezas de Fencovis®?
Fencovis® es solo una parte en un todo que conforma un paquete completo destinado a combatir uno de los problemas más serios de la producción y sanidad bovinas.
Boehringer Ingelheim acompañará a esta vacuna con un panel completo de elementos y actividades encaminadas a configurar una acción global frente a todos los elementos relacionados con la enfermedad.
Sistemas y materiales diagnósticos, formación específica para veterinarios y productores, proyectos de investigación, revisiones bibliográficas y publicaciones, o la creación de un grupo de expertos son, entre otras cosas, algunos de los elementos que van a acompañar a Fencovis® en su andadura por el mercado español y europeo, y que iremos descubriendo en próximas fechas.
La fortaleza de Fencovis® está en lo que le acompaña. De la mano de este inmunológico, vendrá:
Un completo programa de formación para veterinarios y ganaderos. Avances en el diagnóstico. Proyectos de investigación. Publicaciones y muchas otras cosas.
¡Sin duda, todo esto, y mucho más, harán fuerte a la marca!
¿Qué supone sumar esta vacuna al porfolio de productos de Boehringer Ingelheim para prevenir las enfermedades en bovino?
Otra de las fortalezas de Fencovis® es el equipo. Un equipo con mayúsculas, ya que contamos con un excelente grupo de profesionales, altamente motivados y perfectamente formados con los que vamos a hacer frente a la diarrea neonatal de los terneros, y vamos a tener éxito.
En cuanto al producto, sí me gustaría resaltar que sale al mercado con la indicación para la PREVENCIÓN, y destaco prevención, de las diarreas generadas por los agentes más comúnmente aislados en los cuadros de Diarrea Neonatal Bovina.

¿Qué incidencia tiene actualmente la diarrea en terneros causada por E. coli F5 y Rotavirus bovino en nuestro país?

Además, claro está, contribuirá a reducir la frecuencia y gravedad de diarreas generadas por otros agentes, como el Coronavirus bovino. También cabe destacar sus adyuvantes de baja reactividad, capaces de generar una respuesta mixta, tanto humoral como celular, así como las cepas elegidas, actuales y muy comunes, que favorecen una respuesta eficaz.
¿En qué formato/ presentación se comercializa?
Esta siempre es una decisión compleja, aunque no lo parezca. Hay que adaptarse a las necesidades del mercado, que es muy heterogéneo, pero también debe tenerse en cuenta el consumo, para no entrar en problemas de suministro o tener que destruir producto porque caduque.
Dicho esto, las presentaciones con las que saldremos al mercado en primera instancia son:
La monodosis en un multipack de 10 dosis
El vial con 5 dosis
De todos modos, hemos registrado otras mayores, de modo que podamos sacarlas con agilidad al mercado, en caso necesario.
Actualmente, no hay estudios epidemiológicos oficiales sobre esta enfermedad centrados solo en nuestro país. Pero, si asumimos que la situación puede ser similar a la que existe en otros países europeos, como Francia, Reino Unido o Alemania, las diarreas neonatales en las que estos agentes están involucrados rozan el 40%. Este dato respalda la importancia de que Fencovis® haya obtenido el registro para la prevención de diarreas neonatales generadas por estos agentes.
Incidencia de E. coli F5 y Rotavirus bovino en diarreas neonatales 40%
¿Hasta qué punto reduce Fencovis® la gravedad de la diarrea causada por Coronavirus bovino?


Los estudios aportados a registro pusieron de manifiesto una diferencia estadísticamente significativa en cuanto al número de animales con diarrea entre el grupo control no vacunado y el grupo cuyas madres recibieron Fencovis® Además, también pudo apreciarse que los casos en los que apareció la enfermedad en el grupo vacunado fue mucho más leve y fácil de tratar.
No es de extrañar el dato a tenor de los resultados serológicos obtenidos que igualmente demostraron que la cantidad de anticuerpos generada por la madre, y posteriormente transferida al ternero a través del calostro, frente a este agente, fueron muy superiores al grupo control.
DESCÁRGALO EN PDF
“FENCOVIS® Un paso más en la prevención de enfermedades del ganado vacuno”

TUBERCULOSIS ANIMAL
EL RETO DE CONTROLAR UNA INFECCIÓN COMPARTIDA ENTRE UNGULADOS DOMÉSTICOS Y SILVESTRES
Eduardo Laguna 1*, Saúl Jiménez-Ruiz 1,2, Pelayo Acevedo 1, Christian Gortázar 1, Carmen Ruiz 1, Patricia Barroso 1,3, Ignacio García-Bocanegra 2,4, María A. Risalde 4,5, David Cano-Terriza 2,4, Débora Jiménez-Martín 2 , Vidal Montoro 1, Mario Sebastián-Pardo 1, Ludovica Preite 1, César Herraiz 1 y Joaquín Vicente 1
1Instituto de Investigación en Recursos Cinegéticos, IREC (UCLM-CSIC-JCCM), Ciudad Real
2Departamento de Sanidad Animal, Grupo de Investigación GISAZ, UIC Zoonosis y Enfermedades Emergentes ENZOEM, Universidad de Córdoba
3Departamento de Ciencias Veterinarias, Universidad de Turín
4CIBERINFEC, ISCIII - CIBER de Enfermedades Infecciosas, Instituto de Salud Carlos III

5Departamento de Anatomía y Anatomía Patológica Comparadas y Toxicología, Grupo de Investigación GISAZ, UIC Zoonosis y Enfermedades Emergentes ENZOEM, Universidad de Córdoba
*Eduardo.Laguna@uclm.es
En las últimas décadas, se ha incrementado el uso del concepto interfase epidemiológica en el ámbito de la Sanidad Animal.
Este término hace referencia a una red dinámica de conexiones entre los distintos componentes de un sistema capaz de mantener a uno o varios patógenos.
La interfase que tiene lugar entre la fauna silvestre y el ganado está mediada principalmente por las acciones del hombre, manifestándose desde el momento en el que los animales domésticos se convierten en una parte integral del paisaje (Vercaureren et al., 2021).
2022 | Tuberculosis animal. El reto de controlar una infección compartida entre ungulados domésticos y silvestres

Las infecciones compartidas en esta interfase son importantes por su elevado impacto en la Sanidad Animal y, consecuentemente, en la producción ganadera. Además, muchas:

Son zoonósicas
Presentan efectos adversos en la conservación de especies silvestres y domésticas
Afectan negativamente a la producción cinegética
(Gortázar et al., 2007)
Aquellos países que llevan a cabo una correcta vigilancia sanitaria de las enfermedades que afectan a las poblaciones silvestres tienen más probabilidades de detectar la presencia de patógenos y, por ende, adoptar medidas de control más efectivas.
En España, disponemos de excelentes estadísticas sobre eventos infecciosos en seres humanos y animales domésticos. Sin embargo, la información epidemiológica a largo plazo y a gran escala en las diferentes especies de fauna silvestre aún es llamativamente escasa (LaHue et al., 2016; Barroso et al., 2021). En consecuencia, no siempre existen evidencias claras sobre la evolución de estas enfermedades en las poblaciones silvestres y, por tanto, de sus impactos sobre la ganadería.



En lo referido a la tuberculosis animal, el Plan Nacional de Vigilancia Sanitaria en Fauna Silvestre (PNVSF) (MAPA, 2022), así como el Programa Nacional de Erradicación de Tuberculosis Bovina (MAPA, 2021) y las recomendaciones del Plan de Actuación sobre Tuberculosis en Especies Silvestres (PATUBES) (MAPA, 2017) vienen trabajando para completar este vacío.
ACCEDER AL PNVSF




ACCEDER AL PROGRAMA NACIONAL DE ERRADICACIÓN DE TUBERCULOSIS BOVINA
ACCEDER AL PATUBES
El Real Decreto 138/2020 establece la normativa básica en materia de actuaciones sanitarias en especies cinegéticas que actúan como reservorio de la tuberculosis, más concretamente, el jabalí (Sus scrofa) y sus hibridaciones, el ciervo (Cervus elaphus) y el gamo (Dama dama), y es de aplicación en las comarcas o unidades veterinarias identificadas en todo el territorio nacional en función del riesgo que se les asigne (comprendidas dentro de las regiones PATUBES).
ACCEDER AL REAL DECRETO 138/2020

LA TUBERCULOSIS ANIMAL: RELEVANCIA DE UNA INFECCIÓN COMPARTIDA
La tuberculosis animal (TB) es una enfermedad infecciosa crónica causada por bacterias pertenecientes al complejo Mycobacterium tuberculosis (CMT) que afecta a numerosas especies de mamíferos domésticos y silvestres.

Esta zoonosis es objeto de control en los países desarrollados, debido a su implicación en Sanidad Animal y Salud Pública, así como en la gestión y conservación de la biodiversidad.
La TB ocasiona graves pérdidas económicas en el sector ganadero, principalmente en ganado bovino, debido a:
Las restricciones al movimiento de animales

Los sacrificios obligatorios y decomisos en matadero
Los costes derivados de la implementación de los programas de control y erradicación
Aun siendo el ganado bovino el principal reservorio doméstico del CMT, el caprino, ovino y porcino también son especies susceptibles a la infección y, de acuerdo con investigaciones recientes, podrían tener ciertas implicaciones epidemiológicas en determinados escenarios o ambientes.
Además de los reservorios domésticos, en España se conocen cuatro especies silvestres capaces de actuar como reservorio de CMT: el jabalí y el ciervo y, con menor relevancia, el gamo y el tejón, este último en el norte de España (Naranjo et al. 2008; Gortázar et al. 2012).

Los animales infectados son responsables de la transmisión de la enfermedad mediante la excreción de las micobacterias, siendo además el ambiente un excelente reservorio debido a la elevada supervivencia de las micobacterias del CMT excretadas por los animales. Por tanto, la transmisión del CMT puede producirse de forma directa o indirecta (Imagen 1)
Transmisión directa
La transmisión directa ocurre por el contacto estrecho o muy próximo con animales infectados, principalmente por vía oronasal o mediante el consumo de carroña o despojos de caza (más frecuente en el jabalí por los hábitos carroñeros facultativos de esta especie).
Transmisión indirecta
La transmisión indirecta se produce a través de la ingestión de vegetación, agua o barro contaminados, principalmente en torno a puntos de agua y lugares de alimentación, especialmente durante la estación seca en ambientes mediterráneos en la que se produce una mayor agregación de los animales (Vicente et al., 2013).

La contaminación ambiental con bacterias del CMT puede desempeñar un papel muy importante en la propagación del CMT por vía indirecta, ya que la supervivencia de las micobacterias en el ambiente puede variar desde pocos días a casi un año en función de:
La temperatura
La humedad
La exposición a la luz solar
La cantidad de materia orgánica en el sustrato (Allen et al., 2021)
Imagen 1. Interacción directa (A) e indirecta (B) entre reservorios domésticos y silvestres de TB.
Fuente: Juan José Negro (A) y Eduardo Laguna (B).
LA TUBERCULOSIS ANIMAL EN ESPAÑA
La TB se ha erradicado casi por completo en muchos países desarrollados, repuntando en algunos casos como consecuencia del papel de la fauna silvestre como reservorio de CMT. En cambio, está muy extendida en países en desarrollo, donde se considera un riesgo para la salud pública y veterinaria.
La TB es una enfermedad de declaración obligatoria en España.
Las primeras actuaciones de lucha frente a TB se iniciaron en España a principios de los años 50, siendo en 1987 cuando se presentó un Programa de Erradicación Acelerada en bovino de acuerdo con las Directivas de la Unión Europea.
rumi
Noviembre 2022 | Tuberculosis animal. El reto de controlar una infección compartida entre ungulados domésticos y silvestres

¿Cuáles son las principales vías de transmisión o rutas de infección de CMT?
REBAÑOS POSITIVOS
El objetivo de este Programa es la erradicación de la enfermedad, considerando como tal, según la última información disponible:
La existencia de una tasa de incidencia de rebaños bovinos confirmados como infectados por CMT no superior al 0,1% en los últimos 3 años.
El Programa de Erradicación de TB ha permitido reducir la proporción de rebaños bovinos positivos desde casi el 20% en los años 70, a menos del 2% en la última década.
20% 2%
ERRADICACIÓN DE
TB
Periodo: últimos 3 años Incidencia en rebaños bovinos infectados <0,1%
99,8% rebaños con calificación de oficialmente libre (99,9% de los animales)
Sin embargo, el Programa no se ejecuta de forma similar en el resto de los reservorios domésticos, por ejemplo:
En el caprino, dependiendo de la comunidad autónoma, únicamente se controlan de forma obligatoria en los rebaños epidemiológicamente conectados con las explotaciones bovinas.
En el porcino, el Programa se limita a un sistema de vigilancia epidemiológica en mataderos.
Sin embargo, la distribución de animales positivos no es uniforme, manteniéndose unas prevalencias más elevadas en el cuadrante suroeste (Figura 1). Aun así, los últimos datos disponibles reflejan un descenso en la prevalencia de esta enfermedad, habiéndose actualizado la declaración oficial de CCAA/provincias libres de TB (MAPA, 2020; 2021).
comarcas)
Figura 1. Evolución de la prevalencia de TB en rebaños bovinos (A. 2018, B. 2020) y última actualización de las CCAA/provincias oficialmente libres de TB (C). Fuente: MAPA, 2020 y MAPA, 2021.

En la actualidad España se divide en 4 regiones biogeográficas de acuerdo con su situación epidemiológica respecto a la TB (Figura 2).
Los primeros trabajos de TB en fauna silvestre permitieron:

Describir las especies implicadas en los ciclos epidemiológicos.
Caracterizar las lesiones en ungulados silvestres.
Describir las prevalencias y la distribución geográfica de la enfermedad.
Identificar los factores de riesgo.
Comenzar a establecer relaciones entre hospedadores silvestres, domésticos y humanos.
Figura 2. Mapa de España reflejando la regionalización respecto a la TB. De menor a mayor intensidad de color: regiones insulares; costa norte (mayor abundancia de tejón); provincias de clima mediterráneo o continental con poco riesgo de TB en fauna silvestre; y provincias de clima mediterráneo con mayor riesgo de TB en fauna silvestre (elevadas densidades de ciervo y jabalí). Fuente: MAPA, 2017.
Estos estudios identificaron los riesgos sanitarios asociados a la “sobreabundancia” de la fauna silvestre y se acuñó el término de “infecciones compartidas con la fauna silvestre” (Imagen 2).

¿Qué sabemos de la tuberculosis en el centro y sur de España?
Estas líneas de trabajo han ido evolucionando hacia la integración de la ecología de la TB en modelos multi-hospedador (Santos et al., 2022), lo que ha resultado fundamental no solo para ampliar los conocimientos sobre la dinámica de la enfermedad, sino también para desarrollar medidas de control en la fauna silvestre y en el ganado (Barasona 2015).

Algunos de los hitos destacables de estas investigaciones han sido:
patología
El reconocimiento del jabalí como principal reservorio silvestre de TB en ecosistemas mediterráneos.
La diferenciación de distintos escenarios epidemiológicos a nivel nacional.
El avance en la comprensión del papel de las diferentes especies en el mantenimiento y dispersión del CMT.
Evidenciar la relación existente entre las altas densidades de ungulados silvestres en torno a puntos de agregación y elevadas prevalencias de TB en las mismas zonas.
La descripción de diferencias en la expresión génica entre jabalíes infectados y no infectados.

La descripción y relevancia de las relaciones intra e interespecí cas en comunidades de hospedadores complejas.
La descripción de los determinantes de TB en poblaciones silvestres a largo plazo: factores estocásticos, denso-dependientes y de gestión.
La importancia de las coinfecciones en la expresión de la enfermedad.
La relación entre la abundancia local de fauna silvestre y el riesgo de incidencia de TB en ganaderías extensivas simpátricas.
La descripción de los primeros casos de TB en tejón en España.
La cuanti cación de la contribución de las especies de fauna silvestre al mantenimiento de patógenos en comunidades multi-hospedador, y el papel del ciervo como un importante potenciador de su mantenimiento en estos sistemas.
La implementación de medidas de bioseguridad e caces en ganadería extensiva, basadas en el conocimiento del comportamiento animal y en la epidemiología ambiental de la TB.

La identi cación de especies domésticas (porcino y caprino) susceptibles a la infección por CMT que deberían ser incluidas en los programas de erradicación actuales para aumentar el éxito de su objetivo principal en los sistemas multi-hospedador.
Trabajos más recientes se han centrado en el estudio detallado de las interacciones entre fauna silvestre (principalmente cérvidos y jabalí) y ganado en extensivo (Triguero-Ocaña et al., 2021), y en la mejora de la bioseguridad.


En este sentido, el control sanitario de las infecciones compartidas en las zonas de contacto entre domésticos y silvestres deberían abarcar todas las opciones de intervención (Gráfica 1):
La mejora de la bioseguridad de las explotaciones

El control poblacional
La vacunación en las especies silvestres

Jabalíes con TBL (probabilidad pronosticada)
0,70 0,65 0,60 0,55 0,50 0,45 0,40 2 2,1 2,2
Jabalíes con TBL (probabilidad pronosticada) Bolsa de caza total (nº) 28.000 30.000 32.000 34.000 36.000 38.000 43
0,70 0,65 0,60 0,55 0,50 0,45 0,40 patología rumiNews

Gráfica 1. Probabilidad pronosticada promedio de que el jabalí tenga lesiones generalizadas compatibles con TB (TBL) dependiendo de (A) la bolsa de caza de ungulados en la provincia de Ciudad Real y (B) la precipitación anual. Fuente: Vicente et al., 2013.
Noviembre 2022 | Tuberculosis animal. El reto de controlar una infección compartida entre ungulados domésticos y silvestres
INVESTIGACIÓN EN EL ÁMBITO DEL CONTROL DE LA TB EN FAUNA SILVESTRE Y SU INTERFASE CON GANADO


Control poblacional Vacunación
Algunos estudios, aun escasos, han abordado la importancia del control poblacional de los reservorios silvestres y su impacto sobre la TB.
Por ejemplo, en el caso del control poblacional de jabalí bajo diferentes presiones de extracción, se ha demostrado que una disminución significativa del número de jabalíes reduce la prevalencia de TB en esta especie, pero también en cérvidos y en bovino, aunque es una medida difícil de mantener a largo plazo (Boadella et al., 2012).
Dado el crecimiento poblacional que siguen experimentando estas especies, principalmente el jabalí, este es un reto aún pendiente y fundamental para desarrollar estrategias sostenibles de control a largo plazo, que además han de involucrar a los sectores de caza, medio ambiente, producción ganadera y Sanidad Animal.
Otras medidas serán poco eficaces si no se dan pasos sólidos en materia del control de las poblaciones de ungulados que, además, tienen importantes connotaciones ambientales (efectos negativos de la sobreabundancia) y socioeconómicos (conflictos por daños, accidentes de tráfico, etc.) (Carpio et al., 2021).
Desde que la magnitud del problema de la TB se dio a conocer en fauna silvestre en nuestro país en la década del 2000, se iniciaron las primeras investigaciones sobre su control en la fauna silvestre, y subsecuentemente, en la interfase ganado-fauna.
Se testaron varias vacunas y formas de administración, incluido el desarrollo de una vacuna oral de manufactura nacional para la fauna silvestre, centrándose en el jabalí principalmente. Se evaluó su seguridad y eficacia en condiciones de laboratorio y, posteriormente, en campo.
Para esto último, ha sido necesario desarrollar los cebos apropiados (como vehículos de la vacuna oral) (Ballesteros et al., 2009) y formas de administración en campo para llegar con la mayor eficacia posible al mayor número de jabalíes en sus poblaciones.
La prueba de campo fue eficaz , consiguiendo reducir a niveles mínimos la presencia de TB en rayones tras apenas tres años vacunación (Díez-Delgado et al., 2018).
Bioseguridad
En relación con la bioseguridad, ya se han desarrollado protocolos para la elaboración de programas de bioseguridad específicos frente a la interacción con la fauna silvestre en explotaciones de bovino y porcino en extensivo (Martínez-Guijosa et al. 2021; Jiménez-Ruiz et al. 2022, ver artículos previos en PorciNews y porciSapiens). Este aspecto se desarrolla en detalle en la siguiente sección.


Los principales resultados de los estudios previos y aplicaciones de relevancia para el control de la TB en la interfase se enumeran en la Tabla 1.
RESULTADO
Uso del hábitat ganadero por parte de la fauna silvestre.
Descripción y cuantificación de los patrones de interacción entre ganado (principalmente bovino) y fauna a una escala espacio-temporal muy precisa a partir de dispositivos de proximidad y telemetría (collares GPS).
Identificación de factores de riesgo que determinan la incidencia de TB en ganado extensivo: la prevalencia local en el jabalí es determinante.
Las tasas actuales de extracción por caza de jabalí no son suficientes, observándose una elevada presencia de individuos adultos infectados (contagiosos).

Detección de ADN del CMT en muestras ambientales y vías de excreción en ciervo y el ambiente.
Aceptación social de las medidas de bioseguridad por parte de los ganaderos y del sector cinegético.


Desarrollo de programas de bioseguridad específicos para explotaciones extensivas.
APLICACIÓN
LEER ARTÍCULO: Auditorias de bioseguridad en explotaciones porcinas extensivas para reducir el riesgo de interacción con fauna silvestre
LEER ARTÍCULO: Guía para la aplicación de protocolos de bioseguridad en explotaciones porcinas extensivas
Fundamental para determinar puntos y fechas de máximo riesgo para la interacción en ganaderías extensivas de porcino y bovino.
Necesario para determinar los puntos de riesgo y periodos en los que implementar bioseguridad en ganaderías extensivas de bovino.
Posibilidades para una gestión ganadera con consideración de los factores de riesgo, en particular, los derivados de la fauna silvestre.
Conocimiento básico para utilizar apropiadamente el control poblacional del jabalí y reducir el riesgo de transmisión de la enfermedad
Intervenciones para mejora de la bioseguridad en sistemas ganaderos extensivos.
Punto de partida para desarrollar programas de bioseguridad eficaces, aceptados y aplicables.
Posibilidades para una gestión ganadera que considere la interacción ganado-fauna.
Tabla 1. Algunos de los principales resultados y aplicaciones del estudio de la interacción entre ungulados domésticos y silvestres en el centro-sur de España de relevancia para el control de la TB en la interfase.
transmisión de enfermedades entre ganado y fauna silvestre.

Los resultados de las investigaciones realizadas en materia de bioseguridad han permitido desarrollar un protocolo de trabajo para instaurar programas de mitigación del riesgo específicos en cada explotación en bovino y porcino en extensivo del centro y sur de España (Martínez-Guijosa et al., 2021; Jiménez-Ruiz et al., 2022), contribuyendo al éxito de las estrategias de control y erradicación de la TB.

En esta línea de investigación, desarrollada en España desde 2015, se evaluó el riesgo de interacción entre los ungulados silvestres y el ganado en 100 explotaciones extensivas (55 bovinas y 45 porcinas, la mayoría de ellas de aprovechamiento mixto entre ambas especies y con intereses cinegéticos) para proponer acciones relacionadas con la bioseguridad (Figura 3).
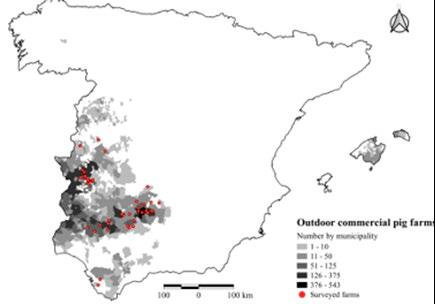
TUBERCULOSIS BOVINA, 2015
Prevalencia máxima en rebaños por comarca Sin datos 0%
0,01-1% 1,01-3% 3,01-100%
Granjas seleccionadas
Granja comercial de cerdos en extensivo Número por municipio 1-10 11-50 51-125 126-375 376-543 Granjas encuestadas
Figura 3. Distribución espacial de las explotaciones investigadas en el suroeste de España (región IV de TB, Figura 2) detallando la prevalencia de TB en bovino por comarca ganadera (arriba) y el número de explotaciones porcinas extensivas (abajo). Fuente: Saúl Jiménez.

El jabalí, seguido del ciervo, son las especies silvestres más relevantes en este ciclo epidemiológico, pero la mayoría de las explotaciones presentan además ganado porcino criado en sistemas de producción extensivos (75%). Esto es importante, ya que el cerdo puede participar en la epidemiología de la TB, pudiendo actuar como reservorio de micobacterias y como enlace entre la fauna silvestre y el ganado bovino.


En una proporción de ganaderías nada despreciable (31%) se proporcionaba alimentación suplementaria a la fauna silvestre con fines cinegéticos.
Esta práctica supone un gran riesgo para la interacción y transmisión de infecciones compartidas, y, por tanto, debe evitarse en la medida de lo posible.

de administrarla), por lo que en una importante proporción de cercas (3,7 cercas por ganadería) los animales únicamente tienen acceso al agua en forma de charca, pantano o arroyo, donde el riesgo de transmisión del CMT es muy elevado. Las medidas en materia de bioseguridad propuestas con mayor frecuencia se dirigen a garantizar que los animales se abreven de forma segura en cada cerca.
Como consecuencia de la diversidad de manejos y ambientes, existen grandes diferencias en el tipo y número de puntos de riesgo presentes en las ganaderías.
En promedio, se identificaron 2 puntos críticos por ganadería, especialmente relacionados con puntos de agua, en los que el riesgo de transmisión de CMT desde la fauna silvestre al ganado es máximo. En este tipo de puntos la intervención es urgente y prioritaria, y habitualmente requieren medidas relativamente económicas.
En más de la mitad de las explotaciones se propusieron como actuaciones prioritarias:
Eliminar algún punto de agua, principalmente manantiales y pequeñas charcas, y sustitución por bebederos elevados para bovino.
Conseguir un uso segregado del agua entre ganado bovino y porcino (utilización de bebederos elevados, que evitan el uso compartido entre las diferentes especies, incluido el jabalí).
No pastorear ciertas cercas cuando presenten puntos de agua difícilmente controlables.
Diagnosticar TB en ganado porcino antes de la montanera . Esta medida debe ir acompañada de la segregación completa del porcino-bovino, así como medidas generales de higiene (desinfección de bebederos).
Incrementar la extracción de las especies silvestres cinegéticas que actúan como hospedadores de TB.

El coste medio de la aplicación del programa de bioseguridad por ganadería bovina fue de 20.000 €. No obstante, aunque existe una gran variación entre ganaderías, es indicativo que en el 70% de las mismas el coste no superó los 7.000 €.

Las medidas más costosas se relacionan con la necesidad de instalar vallados cinegéticos perimetrales o cercas ganaderas alrededor de arroyos o puntos concretos de riesgo. El resto de las medidas requieren una inversión mucho menor.
Las medidas propuestas en los programas de bioseguridad tuvieron gran aceptación por parte de los ganaderos, adoptando los programas en el 75% de las explotaciones auditadas. En promedio, se implementaron el 31,8 % de las acciones de mitigación de riesgos, con un coste real inferior al presupuestado (Gráfica 2).
Gráfica 2. Implementación de programas de bioseguridad en las explotaciones auditadas en términos de porcentaje de acciones implementadas versus acciones recomendadas (eje principal). Los puntos representan estimaciones a priori de los costes del Plan de acción específico de la explotación (puntos verdes) y los gastos reales ejecutados por los ganaderos (puntos azules) en € (eje secundario).
Fuente: Martínez-Guijosa et al., 2021.
RETOS EN EL CAMPO DEL CONTROL DE LA TB
3. Explorar nuevas estrategias integradas de control de la TB en sistemas multi-hospedador
Aún hay muchos aspectos de la relación ‘patógeno-hospedador-medio ambiente’ que no conocemos en suficiente detalle.
¿Cuál es el peso relativo de cada especie hospedadora y del medio ambiente en diferentes contextos epidemiológicos? ¿Cuál es la importancia de las especies porcina y caprina?
Para responder a estas preguntas es necesario combinar técnicas de investigación tradicionales con otras más novedosas (epidemiológicas y moleculares) e incorporar herramientas de otras disciplinas, como la ecología espacial y la dinámica poblacional.
2.
¿Existen tipos o cepas más o menos transmisibles? ¿Y más o menos virulentos? ¿Cuál es el papel de la exposición a micobacterias ambientales en la patogenia de la TB? ¿Y el de las coinfecciones?
El control de las poblaciones de jabalí (pero también de otros ungulados silvestres) es primordial ya que se trata de un problema todavía creciente a nivel internacional y que además amenaza a nuestras cabañas ganaderas mediante otros patógenos, como la Peste Porcina Africana. Por ello, será necesario colaborar con otros sectores, como el ambiental y el cinegético, e involucrar a diferentes disciplinas, incluyendo las ciencias sociales.
El desarrollo de medidas de mejora de la bioseguridad en bovino frente a la fauna silvestre (debe ampliarse a caprino y porcino) abre una oportunidad única de trabajo de interés para el control, no solo de TB, sino de otras enfermedades. En paralelo, los resultados obtenidos sobre vacunación y otras medidas de control en fauna silvestre facilitan la intervención sobre este tipo de reservorios.

¿Cómo podemos actuar para limitar el mantenimiento de la infección? ¿Cuál es el efecto de estas actuaciones en términos de incidencia de TB en especies ganaderas?

1. Conocer en profundidad los mecanismos que posibilitan el mantenimiento de la infección en sistemas multi-hospedador
Entender mejor la interacción CMT-hospedador
Abordar estas y otras cuestiones será de gran utilidad para el control de TB y de otras enfermedades que coinciden en sus principales factores de riesgo y que se benefician de la interacción en las zonas de contacto entre fauna y ganado.
Se deben mejorar las técnicas diagnósticas disponibles para fauna silvestre, el medio ambiente y el ganado, haciéndolas más rápidas y rentables, siendo importante diseñar unas pautas de vacunación adecuadas a las características de la comunidad de hospedadores silvestres.

patología
El conocimiento generado ha de ser transferible a la administración y a los sectores ganadero y cinegético. El principal interés será facilitar a la administración herramientas efectivas para el control de la transmisión, así como a entidades ganaderas y cinegéticas, que redunden en un control más eficaz de la transmisión de enfermedades entre especies domésticas y silvestres. En todo ello, la contribución y apoyo del sector ganadero de rumiantes en extensivo será fundamental.
AGRADECIMIENTOS
Este trabajo se desarrolló en el marco de tres proyectos de investigación, “Factores de riesgo y epidemiología espacio-temporal de la tuberculosis en bovino en extensivo: un modelo para el control de la enfermedad [AGL2010-20730-CO2-01]”; “Desarrollo de protocolos de mitigación del riesgo de contacto y transmisión de enfermedades compartidas entre ganado y ungulados silvestres [AGL2013-48523-C3-1-R]”; “Evaluación de protocolos de bioseguridad y de la gestión de ungulados en la transmisión de enfermedades compartidas (ONEGEST) [AGL2016-76358-R]” de las convocatorias del Programa Estatal de I+D+i Orientada a los Retos de la Sociedad y “Armonización de los datos poblacionales de la fauna silvestre en España: aplicaciones a la vigilancia sanitaria y control de enfermedades” (PID2019111699RB-I00). Asimismo, supone una contribución a los proyectos “One Health Farming [PLEC2021-008113]” (financiado por MCIN/AEI/10.13039/501100011033 y por la Unión Europea NextGenerationEU/PRTR); y “Diseño y evaluación de estrategias de lucha integradas para el control de enfermedades transmisibles en ganado porcino en sistemas silvopastoriles en Andalucía [PYC20 RE 056 UCO]" (financiado por la Junta de Andalucía). Finalmente, agradecer la contribución de todo el equipo de trabajo, tanto en el IREC (Ciudad Real) como en el GISAZ (Córdoba).
DESCÁRGALO EN PDF
ACCEDER A BIBLIOGRAFÍA
Tuberculosis animal. El reto de controlar una infección compartida entre ungulados domésticos y silvestresAGALAXIA CONTAGIOSA EN PEQUEÑOS RUMIANTES CASUÍSTICA Y EPIDEMIOLOGÍA

 S.L.
S.L.
La agalaxia contagiosa es una de las enfermedades más importantes en las ganaderías lecheras de pequeños rumiantes debido a las elevadas pérdidas económicas que puede ocasionar.

Las bacterias del género Mycoplasma son las responsables de esta enfermedad:


Mycoplasmopsis agalactiae (anteriormente denominada Mycoplasma agalactiae) provoca la infección en ovino y caprino.
Mycoplasma mycoides subsp. capri, Mycoplasma capricolum supsp. capricolum y Mycoplasma putrefaciens también pueden ocasionar el cuadro clínico de agalaxia contagiosa en la especie caprina
Contagio
La entrada de la agalaxia contagiosa en un rebaño suele originarse con la introducción de animales infectados a la granja.
El nombre de la enfermedad “agalaxia contagiosa”, es debido a su elevada transmisión entre animales y su principal vía de infección es la galactófora, pudiendo encontrar una elevada concentración de micoplasmas en la leche.

CUADRO CLÍNICO Y EPIDEMIOLOGÍA DE LA AGALAXIA CONTAGIOSA
S ignos clínicos
Los principales signos clínicos observados en animales infectados son mamitis clínica con disminución drástica de la producción láctea, artritis y/o queratoconjuntivitis (Tabla 1)
En ocasiones, estas bacterias también pueden causar abortos, problemas respiratorios y cuadros septicémicos que conducen a la muerte del animal.
El contagio se produce especialmente durante el ordeño y la lactancia natural
En menor medida, se ha observado la transmisión por contacto directo, principalmente a través de exudados respiratorios.
CORTA CON LA AGALAXIA
ALGONTEX ® emulsión inyectable para ovino y caprino

Composición por dosis (2 ml): Mycoplasma agalactiae cepa N-262 ≥ 70 UE. Indicaciones y especies de destino: Para la inmunización activa del ganado ovino y caprino para prevenir los signos clínicos y la infección de la agalaxia contagiosa. Via de administración: Intramuscular o subcutánea. Posología: 2 ml. Contraindicaciones: Ninguna. Precauciones: Conservar y transportar refrigerado (entre 2ºC y 8ºC). Proteger de la luz. No congelar. Tiempo de espera: Cero días Titular: CZ Veterinaria, S.A. Reg. Nº: 2896 ESP. Con prescripción veterinaria.
La vacuna líder frente a la agalaxia contagiosa info@vetia.es (+34) 910 901 526 www.vetia.es
aracterísticas epidemiológicas
Cuando la agalaxia contagiosa aparece en un rebaño libre, suele cursar en forma de brote agudo, lo que conlleva una morbilidad elevada y una mortalidad variable.
Todo ello dependerá del estado inmunitario de los animales, observándose mayor afectación en animales jóvenes y reproductoras en el periparto o inicio de lactación.
En rebaños donde la agalaxia contagiosa es endémica se observa la forma crónica de la enfermedad, mamitis crónicas (inflamación de la glándula mamaria que se prolonga en el tiempo, pudiendo llegar a desarrollar lesiones irreparables en la ubre) con aumento de células somáticas, además de la presencia de portadores asintomáticos.
DIAGNÓSTICO DE LA AGALAXIA CONTAGIOSA
Dependiendo del objetivo del diagnóstico laboratorial es posible utilizar varias técnicas diagnósticas (Tabla 1):
C ultivo microbiológico
Se han descrito casos de rebaños endémicos en los que no se han manifestado signos clínicos durante años. Sin embargo, la enfermedad ha continuado presente gracias a los portadores asintomáticos. Ante esta situación, la circulación de micoplasmas se confirma mediante:
Los micoplasmas se consideran microorganismos de difícil aislamiento puesto que se requiere de: Medios de cultivo específicos Personal cualificado Tiempos de incubación largos
1 mamitis
La monitorización de la leche de tanque.
La detección en hisopado auricular en el ganado caprino.
La detección en hisopado nasal en el ganado ovino.
La obtención de la cepa de micoplasma permite:
Realizar estudios de sensibilidad antibiótica (actualmente disponible en centros de investigación).



2

Técnicas moleculares
En la actualidad, las técnicas moleculares, como la qPCR o PCR a tiempo real, son las más utilizadas para el diagnóstico de agalaxia. La qPCR:

Es más sensible, específica y rápida que el cultivo microbiológico, permitiendo cuantificar el material genético presente en la muestra clínica.


Sirve para identificar los micoplasmas aislados (género y especie).
S erología

Las técnicas serológicas permiten detectar la presencia de anticuerpos en:
Animales infectados con M. agalactiae
Animales que han estado en contacto con M. agalactiae (actualmente no hay kits serológicos disponibles para el análisis de las otras especies).
Habitualmente, esta técnica se utiliza para el diagnóstico a nivel de rebaño, pues presenta una sensibilidad baja para el diagnóstico individual y para la detección de portadores asintomáticos (Gutierrez, 2015).
Su uso en rebaños vacunados frente a agalaxia contagiosa no es de utilidad, ya que no distingue entre anticuerpos vacunales y anticuerpos debidos a la infección, además pueden ocasionarse falsos positivos al existir reacción cruzada con otras especies de micoplasmas (Gutierrez, 2015; Gómez et al., 2013).
SIGNO CLÍNICO MUESTRA ADECUADA
DIAGNÓSTICO DIRECTO
*En este caso, no se suele realizar cultivo selectivo de micoplasmas, dado que los portadores asintomáticos pueden presentar baja concentración de micoplasmas en la zona auricular o nasal y si hay poca carga, habrá menor probabilidad de éxito en el cultivo a pesar de ser un cultivo selectivo.
Agalaxia
TRATAMIENTO Y CONTROL DE LA AGALAXIA CONTAGIOSA

P resentación aguda

Durante el transcurso de un brote agudo de agalaxia en una granja, las medidas correctoras irán enfocadas a disminuir los contagios mediante:
El refuerzo de la bioseguridad interna, principalmente durante el ordeño.
La rápida separación de los animales afectados del resto.
Con el fin de reducir la excreción de micoplasmas en los animales afectados se podrá utilizar antibioterapia.
Mediante estudios de sensibilidad antibiótica, se han observado diferencias entre las especies de micoplasmas, siendo necesario conocer la especie implicada en el proceso para decidir qué antibiótico establecer.
M. putrefaciens, M. mycoides y M. agalactiae suelen presentar una buena sensibilidad frente a tetraciclinas, fluoroquinolonas y macrólidos. En cambio, la eritromicina es eficaz frente a M. putrefaciens y M. mycoides, pero no para M. agalactiae (Gómez et al., 2020). No obstante, sería recomendable realizar pruebas de sensibilidad para maximizar la eficacia del tratamiento.
P resentación endémica
Cuando la enfermedad es endémica en la explotación, las medidas tomadas irán encaminadas a:
Reducir las pérdidas productivas en el rebaño. Reducir la probabilidad de aparición de un nuevo brote. Para lograr estos objetivos, es muy importante:
Establecer un buen protocolo de higiene y manejo durante el ordeño.
Tratar el calostro térmicamente. Instaurar un tratamiento temprano de los animales con signos clínicos.
Eliminar los animales con enfermedad crónica.
Implementar la vacunación como medida preventiva. Si bien es cierto que no evita la infección, sí reduce la aparición de signos clínicos y la excreción de micoplasmas (Gómez et al., 2013; Gutierrez, 2015).
Establecer un periodo de cuarentena y analizar a los nuevos animales antes de introducirlos en el rebaño.
Ganado caprino
Para la detección de portadores asintomáticos en ganado caprino, se recogen muestras del conducto auditivo externo (un hisopo para cada oído), puesto que los micoplasmas pueden permanecer en estado de latencia.
Ganado ovino
En el ganado ovino se ha descrito que el muestreo de fosas nasales es más sensible para la búsqueda de portadores asintomáticos.
ESTUDIO DE AGALAXIA CONTAGIOSA EN CASOS CLÍNICOS
En el laboratorio Exopol S.L. el diagnóstico de agalaxia contagiosa se lleva a cabo mediante qPCR y cultivo microbiológico. A continuación, se muestran los resultados obtenidos de los casos clínicos recibidos durante el periodo comprendido entre 2016 y 2021.

C asos de procesos mamíticos
En las Gráficas 1 y 2 se muestran los casos positivos a las distintas especies de micoplasmas mediante qPCR en muestras de leche de tanque y pooleado de leches individuales procedentes de animales con mamitis.
En el ganado ovino encontramos que casi el 20% de los casos analizados, tanto en el pool de leches como en muestras de tanque, son positivos a Mycoplasmopsis agalactiae, en el caprino detectamos un porcentaje superior de casos con esta especie de micoplasma.
Esto indica que hay un elevado número de rebaños positivos y demuestra la importancia de establecer un programa de control de la enfermedad para reducir su impacto en las ganaderías nacionales de pequeños rumiantes.
En el 5% de los casos de caprino se detectó M. mycoides clúster, mientras que M. putrefaciens tan solo se detectó en el 1% de los casos.

¿Qué hacemos con los portadores asintomáticos?Este análisis sirve para el control de la presencia de portadores en el rebaño y es recomendable acompañarlo de la monitorización en leche de tanque de manera periódica.
M. agalactiae (n=274)
Ovino
M. agalactiae (n=591) Caprino
M. mycoides cluster (n=583) Caprino
M. putrefaciens (n=403) Caprino
Gráfica 1. Detección mediante qPCR de los diferentes micoplasmas analizados en leche de tanque de ovino (rosa) y caprino (verde).


M. agalactiae (n=657) Ovino
M. agalactiae (n=1.133) Caprino
24% 3% 1% mamitis
M. mycoides cluster (n=1.051) Caprino
Gráfica 2. Detección mediante qPCR de los diferentes micoplasmas analizados en muestras pooleadas de leches individuales de ovino (rosa) y caprino (verde).
Casos de procesos articulares
CULTIVO MICROBIOLÓGICO qPCR
En el cultivo microbiológico de las muestras de leche de manera individual recibidas en el periodo de 2018 a 2021 se obtuvieron aislamientos de micoplasma en el 6% de los casos de ovino (n=438) y en el 23% de los casos de caprino (n=674).
El mayor éxito de aislamientos en caprino puede deberse a que procedían de brotes agudos, existiendo una mayor concentración de micoplasmas en las muestras de leche analizadas. Sin embargo, sería necesario estudiarlo en mayor profundidad para hallar la razón de esta diferencia.
18% 19% 23% 5% 4% 58 rumiNews Noviembre 2022 | Agalaxia contagiosa en pequeños rumiantes: casuística y epidemiología
En el estudio de casos de artritis de animales lactantes y adultos se valoraron las muestras analizadas mediante qPCR (Gráfica 3)
El número de muestras analizadas fue muy inferior a las de leche debido a la menor casuística y la mayor dificultad de muestreo.
En el ganado ovino adulto se detectó M. agalactiae en un 5% de casos, mientras que en muestras de corderos no hubo casos positivos.
En corderos lactantes, las artritis suelen asociarse a septicemia bacteriana, mientras que las artritis por M. agalactiae afectan más frecuentemente a animales de edad más avanzada.
En el caso del caprino, observamos positividad de M. agalactiae en adultos y de M. mycoides clúster en cabritos.
qPCR
Adulto Lactante
M. agalactiae (n=38)
M. agalactiae (n=22)
M. mycoides cluster (n=21) M. putrefaciens (n=10)
M. agalactiae (n=70)
M. agalactiae (n=25) M. mycoides cluster (n=24) M. putrefaciens (n=10)
5%
9% 13% 0% 0% 0% 0% 0%
Gráfica 3. Detección mediante qPCR de los diferentes micoplasmas en muestras articulares de ovino adulto y corderos lactantes (rosa) y caprino adulto y cabritos lactantes (verde).
Casos de procesos oculares
En los casos oculares recibidos durante el periodo de estudio, se realizó el análisis mediante qPCR, determinándose la presencia de M. agalactiae en el 9% de los casos de ovino y en el 3% de los casos de caprino (Gráfica 4).
El volumen reducido de casos analizados no permite descartar a los micoplasmas como agentes prevalentes en problemas oculares. Este volumen es debido a que la mayoría de animales con afección ocular también presentan lesiones mamarias, por lo que se toman muestras de leche en lugar de la zona ocular.
9% 3%
M. agalactiae (n=57) Ovino
M. agalactiae (n=30) Caprino
M. mycoides cluster (n=27) Caprino
Gráfica 4. Detección mediante qPCR de los diferentes micoplasmas en muestras oculares de ovino (rosa) y caprino (verde).


En conclusión, la agalaxia contagiosa es una enfermedad que causa graves pérdidas económicas en los rebaños positivos, siendo necesario instaurar en ellos un plan de control para reducir dichas pérdidas. Además, es esencial establecer planes de prevención en los rebaños negativos con medidas de bioseguridad externas e internas para evitar la entrada de esta enfermedad.
Agalaxia contagiosa en pequeños rumiantes: casuística y epidemiología DESCÁRGALO EN PDF
ACCEDER A
BIBLIOGRAFÍA
COCCIDIOSIS EN RUMIANTES UNA INFECCIÓN INEVITABLE
Gutiérrez J., Blasco J.L. y Elvira L. Equipo Técnico Rumiantes MSD Animal Health
La coccidiosis es una enfermedad causada por protozoos gastrointestinales del género Eimeria, comúnmente llamados coccidios.


Prevalencia 100%
La prevalencia de la coccidiosis en rumiantes es elevada y puede llegar a afectar hasta el 100% de los terneros1,3,4,5
La probabilidad de que un animal infectado desarrolle signos clínicos dependerá de…
La dosis infectiva
La patogenicidad de la especie implicada
Los factores de estrés concurrentes …por lo que el impacto de la enfermedad puede parecernos menor de lo que es en realidad.
Los ooquistes de los coccidios son ubicuos en el ambiente y muy resistentes por lo que, tarde o temprano, los terneros, corderos o cabritos acaban infectados1, lo que implica que la infección por especies patógenas de Eimeria es prácticamente inevitable en muchos casos¹.
IMPACTO ECONÓMICO DE LAS COCCIDIOSIS
El impacto económico de la coccidiosis es elevado. Las pérdidas asociadas a los casos clínicos son evidentes (bajas, tratamientos, etc.).
En cambio, las pérdidas debidas a los casos subclínicos, mucho más cuantiosas, suelen ser menos visibles (peores índices de conversión asociados a las lesiones intestinales producidas por el parásito). Además, los animales afectados presentan una mayor susceptibilidad a infecciones secundarias y patologías subsiguientes.
Por ejemplo, los corderos que sufren coccidiosis presentan 2,12 veces más riesgo de sufrir neumonías13 Tabla 1.

EL CICLO VITAL DE EIMERIA
Desarrollar un adecuado plan de control requiere un buen conocimiento del ciclo vital de Eimeria que se divide en dos fases (Figura 1)
La fase exógena tiene lugar en el ambiente, mientras que la fase endógena tiene lugar en el hospedador. Si bien, la duración del ciclo es variable según la especie, suele completarse entre 2-4 semanas6 . 1 2
Ingestión de ooquistes día 0 Merogonia (reproducción asexual)
Fase Endógena: Hospedador interno 3
Fase Exógena: Medioambiente
Los ooquistes se mantienen infecciosos varios meses en el medioambiente
Gametogonia
(reproducción sexual)
Excreción de ooquistes a partir del día 6-21
Esporulación
CARACTERÍSTICAS EPIDEMIOLÓGICAS DE LOS COCCIDIOS

Los coccidios son muy prolíficos, ya que un ooquiste esporulado puede llegar a producir la eliminación de 23 millones de ooquistes6 Esto se traduce en grandes niveles de contaminación en el ambiente, lo que favorece la diseminación de la enfermedad¹.
Los animales del mismo grupo normalmente están expuestos a una carga similar de infección por Eimeria y a los mismos factores de manejo y estrés, además de vivir en el mismo entorno¹. Por consiguiente, todo el grupo se considera infectado, sea de forma clínica o subclínica. De hecho, más que una enfermedad que afecta a algunos animales, la coccidiosis se considera una enfermedad de rebaño o de lote.
Por este motivo se recomienda aplicar las medidas de control y tratamiento a todo el grupo afectado, y no solo a los animales que presentan signos clínicos.
Los animales de más edad actúan como reservorios de la enfermedad, eliminando ooquistes al ambiente, aunque son los animales jóvenes la principal fuente de diseminación, al excretar millones de ooquistes.
A partir del año, los animales desarrollan inmunidad y solo excretan pequeñas cantidades. Sin embargo, las madres pueden incrementar la eliminación de ooquistes en el preparto siendo origen de la infección de los neonatos.
Los ooquistes son extremadamente resistentes en el medioambiente y pueden mantenerse viables hasta un año5
FISIOPATOLOGÍA E INMUNIDAD FRENTE A LA COCCIDIOSIS
TERNEROS
Los terneros de tres semanas a seis meses de edad son los más susceptibles a los efectos de la enfermedad5
E. bovis y E. zuernii E. bakuensis
E. alabamensis E. ovinoidalis
La gran destrucción del epitelio distal del intestino delgado y del intestino grueso produce hemorragias y enteritis, por lo que, en las infecciones por E. bovis y E. zuernii, con frecuencia se observan diarrea hemorrágica y tenesmo.
E. alabamensis es, sin embargo, moderadamente patógeno y suele provocar diarrea acuosa5.
CORDEROS
Los corderos de cuatro semanas a seis meses de edad son los más susceptibles al daño intestinal6
En el ganado ovino, las infecciones mixtas son más frecuentes, pudiendo ser grave, aunque la dosis infectiva sea moderada.
La lesión más comúnmente asociada a E. bakuensis es la formación de pólipos en el intestino delgado resultado de la replicación del parásito.
E. ovinoidalis puede inducir una enteritis grave y mortal poco después de la infección durante las fases asexuales de replicación5.
Para el desarrollo de inmunidad frente a Eimeria, es necesaria la infección con una cantidad suficiente de ooquistes1
La inmunidad protege frente las manifestaciones clínicas de la enfermedad, pero no suprime completamente la replicación del parásito en caso de una posterior exposición². Además, al no haber protección cruzada entre especies, es posible que los animales padezcan la enfermedad más de una vez.
DIAGNÓSTICO DE LAS COCCIDIOSIS

Los factores clave para el diagnóstico de las coccidiosis en rumiantes incluyen: Conocimiento del historial de la explotación
Conocimiento de los signos clínicos y edad de los animales afectados

Buena interpretación de los análisis coprológicos
Signos clínicos
Normalmente, sospecharemos de coccidiosis en base al historial de la explotación y los signos clínicos.
La edad es un factor determinante a tener en cuenta ya que, debido a la duración del periodo de prepatencia, raramente afectará a animales de menos de tres semanas de edad, lo que permite distinguirlo de otras causas de diarrea neonatal².
Los signos clínicos de las coccidiosis incluyen2,6:
Diarrea (a veces hemorrágica con sangre digerida o sin digerir, según la ubicación de las lesiones intestinales)
Anorexia
Dolor abdominal
Dificultad para defecar y prolapso rectal
Deshidratación, depresión y palidez de las membranas mucosas
En terneros, de forma infrecuente, pueden darse casos de coccidiosis nerviosa de alta mortalidad, con aparición de temblores musculares, convulsiones y nistagmo.
Análisis coprológico
A la hora de confirmar el diagnóstico, identificar la presencia de ooquistes de coccidios patógenos en las heces es clave¹.

En vacuno, recuentos superiores a 5.000 ooquistes/g de heces en conjunción con los signos clínicos son una señal clara de coccidiosis5 .
Puede ser interesante identificar la especie involucrada, debido al gran número de especies no patógenas1.
A la hora de tomar las muestras, debemos tener en cuenta que la excreción de ooquistes es muy variable a lo largo del ciclo.
TOMA DE MUESTRAS
CONTROL DE LAS COCCIDIOSIS
¡La prevención es clave para el control de las coccidiosis!
Dado que la infección se produce por vía fecal-oral, las estrategias de manejo encaminadas a reducir la contaminación fecal del alimento y agua, en combinación con una buena higiene, reducirán el riesgo de enfermedad².
Los desinfectantes a base de peróxidos, aminas, cresol o clorocresol son eficaces contra los ooquistes de Eimeria.
No obstante, muchos productos quedan inactivados en presencia de materia orgánica, por lo que un requisito esencial para una buena desinfección es la limpieza física previa, lo que puede ser difícil en muchas instalaciones.
Fases muy tempranas o tardías pueden dar lugar a falsos negativos, ya que el cuadro clínico puede aparecer antes o prolongarse más allá del período de la eliminación de ooquistes.
La mayor excreción de ooquistes se produce al inicio del periodo de patencia, por lo que el momento óptimo para recoger las muestras será al inicio de la diarrea. Otra opción, será muestrear varios animales afectados del grupo en distintas fases.

Necropsia
La necropsia también puede ser útil, siendo la hemorragia intestinal y las manchas blanquecinas-grisáceas en la mucosa signos típicos de coccidiosis. La histopatología puede tener un valor confirmatorio⁶.
La exposición a la luz solar también reduce la supervivencia de los ooquistes5,6
Los esfuerzos en materia de higiene para eliminar o reducir la contaminación fecal tienen un éxito limitado1,2,5. En especies de alta patogenicidad, pequeñas dosis infectivas pueden causar enfermedad, y como el parásito es muy prolífico, la recontaminación tiene lugar rápidamente.
Por ello, administrar un tratamiento metafiláctico de forma puntual en los animales de los grupos afectados puede ser recomendable a fin de cortar el ciclo de replicación del parásito1,2,5,6
Dado que los brotes de coccidiosis clínica son un problema de rebaño que se acelera con el estrés, minimizar los factores de riesgo (transporte, mezcla de animales, destetes bruscos, cambios de alimentación y hacinamiento) será clave para reducir el riesgo de enfermedad5,6.
Opciones farmacológicas
En el pasado, se realizaban tratamientos profilácticos para el control de coccidios. Sin embargo, las restricciones al tratamiento profiláctico con antimicrobianos de la Nueva Normativa Europea de Medicamentos Veterinarios (UE 2019/6), nos llevan en la actualidad a dos posibles enfoques a la hora de combatir la coccidiosis:

Metafiláctico Terapéutico
La metafilaxia es claramente la más recomendable, dado que el enfoque terapéutico no controla las infecciones subclínicas y llegamos tarde en los casos clínicos, una vez que el parásito ya ha producido el daño1,6. En caso de aplicar metafilaxia deberemos contar con la justificación adecuada (Figura 2)
El objetivo del tratamiento metafiláctico consiste en controlar el impacto del parásito en el grupo una vez hemos diagnosticado la enfermedad en el rebaño.
En el caso de tratamientos de dosis única, éste debe aplicarse durante el período inicial de la infección. Así, evitamos la replicación del parásito y reducimos la excreción de ooquistes.
Los compuestos derivados de las triazinas, como el diclazurilo y el toltrazurilo, actúan en varias fases del ciclo de replicación de los coccidios¹.
Una dosis única en el momento adecuado (aproximadamente una semana antes del brote esperado de coccidiosis) puede controlar eficazmente la enfermedad. Sin embargo, si el periodo de riesgo se prolonga en el tiempo, puede ser necesario aplicar un segundo tratamiento1,2,5,6
En el caso del toltrazurilo es importante revisar en el prospecto las posibles restricciones de uso según tipo de producción y peso debidas a motivos medioambientales.
A modo de ejemplo de la eficacia del tratamiento metafiláctico, un estudio14 analizó el impacto del tratamiento metafiláctico con diclazurilo 1 mg/kg en terneros (Vecoxan®, MSD AH) sobre los casos clínicos y subclínicos, evidenciando una reducción importante de la excreción de ooquistes y, lo que es más importante, un incremento de la ganancia de peso con respecto a los animales del grupo control sin tratar.
Este incremento fue de 6 kg en los casos clínicos y 2,1 kg en los subclínicos (84% de los terneros), lo que confirma el interés de la metafilaxia, ya que un 64% de las pérdidas de la enfermedad se debieron a los casos subclínicos.
6 kg en casos clínicos 2,1 kg en casos subclínicos
El momento óptimo para empezar el tratamiento es en fases iniciales de la infección, de forma que haya tiempo para que se establezca inmunidad y para prevenir el desarrollo completo del parásito y las lesiones intestinales1,2,5
De hecho, un estudió15 determinó cómo el tratamiento con diclazurilo 1mg/kg (Vecoxan®, MSD AH) controlaba la coccidiosis al tiempo que permitía el desarrollo de inmunidad natural que protegía a los animales de futuras reinfecciones en caso de gran presión de infección.
Dada la imposibilidad de que los ooquistes puedan eliminarse completamente del ambiente, un enfoque multimodal que combine buenas prácticas zootécnicas junto a tratamientos metafilácticos puntuales cuando sea necesario (en la ventana de riesgo de la enfermedad), constituyen una estrategia práctica y eficaz a la hora de controlar la coccidiosis.

ACCEDER A BIBLIOGRAFÍA
Coccidiosis en rumiantes una infección inevitable DESCÁRGALO EN PDFof immunity
effects
Nunca bajes la guardia
diclazuril (Vecoxan)


pathogenic,
at
Buiatrics
Nice, France,
immunity,
15-19, 2006.
Parasitology 2011; 178: 48-57].
Parahidroxibenzoato de metilo (E 218) 1,8
parahidroxibenzoato
propilo
DE DESTINO:
(corderos)
(terneros).
corderos: Prevención de la coccidiosis causada por Eimeria crandallis y Eimeria ovinoidalis En terneros: Prevención de la coccidiosis causada por Eimeria bovis y Eimeria zuernii. Si no hay un historial reciente y confirmado de coccidiosis clínica, antes de tratar debe confirmarse la presencia de coccidios en el rebaño o manada mediante muestreos fecales. CONTRAINDICACIONES: No usar en caso de hipersensibilidad a la sustancia activa o a algún excipiente. PRECAUCIONES: Evitar infradosificación por subestimación del peso vivo, mala administración del medicamento veterinario o falta de calibración del dispositivo dosificador (si lo hay). Terneros: En ciertos casos, es posible que solo se consiga una reducción transitoria de la excreción de ooquistes. Los casos clínicos de sospecha de resistencia a anticoccidiósicos deben ser investigados mediante tests adecuados (test de reducción de recuento de huevos en heces). Cuando los resultados de los tests sugieren la resistencia a un antiprotozoario concreto, deberá utilizarse un anticoccidiósico perteneciente a otra clase farmacológica y con diferente modo de acción. Precauciones especiales para su uso en animales: El momento idóneo para tratar viene marcado por la epidemiología de Eimeria spp. y la presencia de coccidios en el rebaño o manada. Si no hay un historial reciente y confirmado de coccidiosis clínica, la presencia de coccidios debe ser confirmada mediante muestras fecales antes del tratamiento. La presencia de coccidiosis es un indicador de higiene insuficiente en el rebaño o corral. Se recomienda mejorar la higiene y tratar todos los corderos del rebaño y los terneros del corral. El uso frecuente y repetido de antiprotozoarios puede dar lugar al desarrollo de resistencia en los parásitos diana. Para alterar el curso de una coccidiosis clínica ya establecida, en aquellos animales que ya muestren signos de diarrea puede precisarse un tratamiento de apoyo adicional, pues diclazurilo no tiene actividad antimicrobiana. Precauciones específicas que debe tomar la persona que administre el medicamento a los animales: Lavarse las manos después de administrar el producto. No congelar. Período de validez después de abierto el envase primario: 3 meses. TIEMPO DE ESPERA: Carne: Corderos: cero días. Terneros: cero días. Uso veterinario – medicamento sujeto a prescripción veterinaria. Instrucciones completas en el prospecto. Mantener fuera de la vista y el alcance de los niños. Reg. Nº: 1309 ESP. Merck Sharp & Dohme Animal Health, S.L. Ficha técnica actualizada a 25 de septiembre de 2020.


VIRUELA OVINA Y CAPRINA
EL RESURGIR DE UN VIEJO CONOCIDO
Christian de la Fe1, Román Eliseo2, Antonio Sánchez1, Joaquín Amores1 y Juan Carlos Corrales1
1Grupo de Investigación Sanidad de Rumiantes, Departamento de Sanidad Animal, Facultad de Veterinaria, Universidad de Murcia. Campus Regional de Excelencia Internacional Mare Nostrum. 2Servicios veterinarios, Piensos Nanta
La viruela ovina está causada por un poxvirus (SPPV) del género Capripoxvirus, genéticamente muy similar al virus de la viruela caprina (GTPV) y al de la dermatosis nodular contagiosa (LSD) (que afecta al ganado bovino), enfermedades consideradas entre las más importantes desde el punto de vista de las pérdidas económicas que generan en el sector de los rumiantes a nivel mundial.


En el caso de los pequeños rumiantes, la viruela, junto a otras infecciones como la peste de los pequeños rumiantes o la pleuroneumonía contagiosa caprina, endémicas en muchas zonas de los continentes asiático o africano, suponen un serio hándicap para el desarrollo de la producción ovina y caprina en estas zonas (The Center for Food Security and Public Health, 2008; Limon et al., 2020).
En este sentido, el virus que circula en estos momentos en España es el VIRUS DE LA VIRUELA OVINA y, de hecho, hasta ahora, en los focos declarados solo se han registrado síntomas de la infección en ovino.
Los tres Capripoxvirus comparten el 96-97% del genoma y no es posible distinguirlos serológicamente. De hecho, parece que son unos pocos nucleótidos los que marcan el tropismo por una u otra especie de rumiante.

No obstante, debemos hablar de viruela ovina y viruela caprina, ya que los agentes causales son diferentes y tienen preferencia por cada una de las especies, a pesar de que el cuadro clínico que generan es similar en ambos casos y se ha demostrado la capacidad de determinadas cepas de infectar a ambas especies, tanto de modo natural como experimental (Tulman et al., 2002; Zhou et al., 2012).
Estos virus parecen sensibles a la mayor parte de los desinfectantes comunes, siendo un aspecto clave para la epidemiología y control de la infección su elevada supervivencia fuera de los individuos.

La información bibliográfica consultada indica que estos virus pueden resistir: Hasta 6 meses en los corrales en determinadas circunstancias. 3 meses en la lana.
Un tiempo indeterminado en las costras que se forman con la evolución de las lesiones cutáneas y que, en un momento determinado, pueden suponer una fuente de infección para otros individuos.
(The Center for Food Security and Public Health, 2008)
Viruela ovina y caprina: El resurgir de un viejo conocido
¡CONOCE SU EPIDEMIOLOGÍA Y ADELÁNTATE A SUS PASOS!
HOSPEDADORES
Los virus de la viruela ovina y caprina infectan a ovinos y caprinos, respectivamente, aunque hay cepas que pueden afectar a ambas especies (Babiuk et al., 2019).
La participación de los animales silvestres en la epidemiología no se ha demostrado y tan solo se han registrado focos puntuales de la infección en algunas especies silvestres de la familia Caprinae como el serau rojo (Capricornis rubidus) o el goral del Himalaya (Naemorhedus goral), tras el contacto directo o indirecto con cabras domésticas infectadas en áreas del continente asiático y siempre asociadas a la presencia de cepas de viruela caprina (Dutta et al., 2019; Bora et al., 2021).

Es importante señalar que la viruela ovina y caprina no afecta al ser humano.
 S erau rojo (Capricornis rubidus)
S erau rojo (Capricornis rubidus)
DISTRIBUCIÓN GEOGRÁFICA
La viruela ovina y caprina está presente en multitud de países de África, Oriente Medio y Asia, considerándose endémica en el norte de África desde hace décadas (Fenner’s Veterinary Virology, 2017).
En Europa, hasta la presentación de este brote en España, las últimas incursiones databan de 2018 (Grecia) y 2013 (Bulgaria), asociadas posiblemente a su cercanía a Turquía, donde la infección es considerada endémica.
En Argelia y Túnez la situación es similar a la descrita en Marruecos, con presencia del virus en todo el país y una situación endémica asociada a la presencia de diversos factores de riesgo como:

La presencia de mercados rurales. Actividades como la trashumancia o el comercio.
(Ben Chehida et al., 2017; Kardjadj, 2017)
En Marruecos, se ha documentado la presencia y circulación del virus de la viruela ovina en todo el país, desarrollándose campañas de vacunación más o menos generalizadas desde los años 70.
Las vacunas utilizadas, que inducen una inmunidad de 2 años en los animales vacunados, permitieron disminuir la incidencia anual de casos durante los años 90, coincidiendo con el registro de tasas de vacunación superiores al 80%. No obstante, se han registrado repuntes en el número de brotes acontecidos, asociados a factores como:
La regionalización de la vacunación.
La aparición de nuevas cepas de viruela ovina en el país, como en 2010, asociada a la forma clínica nodular presuntamente procedente de Mauritania.
La aparición del virus de la peste de los pequeños rumiantes. (Lafar et al., 2019)
Figura 1. Distribución geográfica de la viruela ovina y caprina con presencia endémica en países de África, Oriente Medio y Asia (rojo) y algunos brotes recientes declarados en Europa (Bulgaria, Grecia y España).
TRANSMISIÓN Y FACTORES DE RIESGO
Tras la infección y el periodo de incubación, el virus puede encontrarse en la saliva, secreciones nasales, secreciones conjuntivales, heces, orina, leche, así como en las lesiones cutáneas y costras que se forman con la evolución del cuadro clínico.


Las 2 semanas que transcurren entre el comienzo de la sintomatología y la instauración de la respuesta inmunitaria en el individuo infectado son clave para la transmisión.

No obstante, la excreción del virus puede continuar durante semanas o incluso 1-2 meses, como se ha demostrado experimentalmente. No se observan portadores crónicos de la infección (The Center for Food Security and Public Health, 2008; Wolff et al., 2020).


Vías de transmisión
Contacto directo (vía respiratoria)
Contacto directo (vía cutánea)
Saliva y secreciones nasales


Leche
Secreciones conjuntivales
Fuentes de contagio Heces Orina

Lesiones cutáneas y costras



Vectores mecánicos (moscas) Fómites
Figura 2. Fuentes de contagio y vías de transmisión de la viruela ovina (creado con BioRender.com).




La viruela ovina y caprina se transmite entre los animales, principalmente, por contacto directo a través de la vía respiratoria, aunque también se puede producir a través de otras vías de entrada, incluyendo el contacto con la piel a partir de abrasiones y excoriaciones.


La transmisión a través de vectores mecánicos, especialmente moscas, es posible, pero tiene menor importancia que en otras infecciones, como la dermatitis nodular contagiosa que afecta al ganado bovino (The Center for Food Security and Public Health, 2008; Fenner’s Veterinary Virology, 2017).
La entrada del virus en nuevos rebaños se produce a través del movimiento de animales o de fómites contaminados con el virus, por lo que hay que tener muy en cuenta, a efectos de prevenir la transmisión a nuevos individuos, que el virus puede sobrevivir varios meses fuera del hospedador. En los países donde la infección es endémica, diversos aspectos ligados al comercio (celebración de mercados semanales, ferias, etc.) o el tamaño del rebaño (posiblemente ligado a la intensificación) se presentan como factores de riesgo que facilitan la permanencia y transmisión de la viruela debido a que el movimiento favorece el contacto directo o indirecto de animales de distintos rebaños (Ben Chehida et al., 2017; Kardjadj, 2017).
SINTOMATOLOGÍA OBSERVADA
EN ESPAÑA
Pueden registrarse diferencias en la sintomatología en función de la cepa involucrada, por lo que nos referiremos a algunos aspectos que se están observando en España en los focos declarados hasta la fecha (MAPA, 2022).
patología
Periodo de incubación y aparición de lesiones iniciales
Tras un periodo de incubación variable, que podemos estimar entre 1 y 2 semanas, se presenta un cuadro de lesiones cutáneas generalizado (máculas-pápulas) que ocupa buena parte de la superficie corporal del animal, siendo muy evidente en las áreas sin pelo, las patas, y en muchos casos, la cabeza (alrededor de los ojos, nariz y boca), lo que puede provocar rinitis, conjuntivitis, etc.

El cuadro puede observarse tanto en animales jóvenes como en adultos, habiéndose observado también lesiones a nivel pulmonar.
Evolución a focos de necrosis y mortalidad (condicionada por el sacrificio sanitario)
Las lesiones en la piel evolucionan hacia la presencia de focos de necrosis más o menos generalizada, acompañada de la mortalidad de algunos individuos.
No disponemos de datos de morbilidad y mortalidad en los rebaños, al realizarse el sacrificio sanitario del mismo en un periodo corto de tiempo tras el diagnóstico definitivo de los focos, pero es interesante mencionar que el número de individuos que presentan síntomas al comienzo del foco es muy variable y no muy elevado.
¿Qué ocurre en casos de evolución natural del foco? (sin sacrificio sanitario)
Posiblemente, si el foco siguiera evolucionando de forma natural, se registraría el incremento sucesivo del número de individuos afectados en sucesivas fases de la infección, teniendo en cuenta el periodo de incubación de la infección y siempre y cuando la transmisión del virus se produzca una vez que los individuos infectados muestran síntomas.

Imagen 1. Cuadro de lesiones cutáneas generalizadas evidentes en las zonas desprovistas de pelo y lana (extremidades, superficie ventral y costados). A. Presencia de lesiones cutáneas generalizadas en la región ventral de un cordero afectado. B. La presencia de las máculas y pápulas es más evidente en las zonas sin lana. C. Las lesiones observadas son similares en los corderos y en los animales adultos afectados. Imágenes cortesía de Román Eliseo (A y B) y Junta de Castilla – La Mancha (C).
El curso de la infección que estamos observando es muy similar al descrito en otras áreas y la presencia de animales afectados en función de los censos presentes son muy similares a los registrados en países como Grecia o Bulgaria en décadas anteriores.

Viruela ovina y caprina El resurgir de un viejo conocido DESCÁRGALO EN PDF


ACCEDER A BIBLIOGRAFÍA
Viruela ovina y caprina: El resurgir de un viejo conocido
BOEHRINGER INGELHEIM ANIMAL HEALTH ESPAÑA: 50 AÑOS DEJANDO HUELLA
En 1972, Boehringer Ingelheim creó en España su división veterinaria. Desde entonces hasta ahora muchas cosas han cambiado, pero los valores fundacionales y el compromiso con el sector siguen intactos.
Boehringer Ingelheim Animal Health España cumple 50 años y lo hace fiel a la certeza de que la salud y el bienestar de los animales enriquecen la salud de las personas.
Para Elena Gratacós, directora gerente de Boehringer Ingelheim Animal Health España: “Cumplir 50 años de trabajo diario para mejorar la salud y bienestar de los animales es un orgullo, pero también una responsabilidad. Hemos llegado hasta aquí trabajando codo con codo con veterinarios, productores y proveedores con la finalidad de ser su opción de referencia. Y lo cierto es que nos sentimos más comprometidos que nunca con nuestro objetivo, que no es otro que transformar vidas creando valor a través de la innovación. Para Boehringer Ingelheim el BIENESTAR ANIMAL y HUMANO es nuestro propósito, nuestra inspiración y nuestro objetivo”.
Preocupados por la salud de todos los animales, Luis Santos, Business Unit Head Livestock de Boehringer Ingelheim Animal Health España, cree que:
“El mayor hito alcanzado es el de haber entendido rápidamente que había que cambiar el paradigma de pensar en tratar enfermedades a prevenirlas, con lo que todo eso conlleva”.
Una convicción perfectamente alineada con el reto de la compañía por avanzar hacia un concepto de salud global.
Un futuro One Health que es prioritario y que se basa en ese vínculo único que hace que, si los animales están bien, los humanos también lo estarán.
En este medio siglo de historia, la compañía ha seguido un principio como eje central: aportar valor a través de la innovación. Un objetivo que ha seguido en todas sus actividades, generación tras generación.
En cuanto a los desafíos a los que debe hacer frente la producción animal en la actualidad, afirma que:
“Más allá de las enfermedades emergentes, favorecidas por el cambio climático y la globalización, y de las amenazas de otras que nos acechan, en nuestro contexto geográfico los principales retos son más económicos, ambientales y de sostenibilidad, que sanitarios. Los elevados costes de producción en nuestro entorno están haciendo muy difícil que las explotaciones sean rentables, a la vez que las garantías en cuanto a Bienestar Animal y Sostenibilidad Ambiental, totalmente necesarias, exigen un esfuerzo cada vez mayor a los productores”.
EL ÁREA DE SALUD ANIMAL
Actualmente, y a nivel global, Boehringer Ingelheim Salud Animal es una de las empresas de salud animal más grandes del mundo.
Destaca especialmente en vacunas y productos farmacológicos, siendo el segundo mayor proveedor a nivel mundial.
Trabaja en un proceso continuo de investigación para ofrecer, en todo momento, los mejores productos para prevenir, tratar y curar las enfermedades, tanto de los animales de compañía como de los de producción (porcino, rumiantes, equino y avicultura).
Fue en el año 1972 cuando se creó la división veterinaria en España, fruto del fuerte crecimiento que vivía el país en el sector agropecuario.
En 1997, la fusión de Rhône Mérieux y MSD AgVet tuvo como resultado la constitución de Merial, una empresa que, en el año 2009 se convirtió en subsidiaria de propiedad exclusiva de Sanofi.
En 2017, se produjo la unión entre Boehringer Ingelheim y Merial, dos compañías vinculadas gracias a aspectos tan importantes como la pasión por los animales y una historia conjunta de integridad, calidad y confianza.
Comprometidos con las generaciones futuras, la formación de los profesionales y el deseo de mejorar la Salud y Bienestar Animal son parte de la misión y el propósito de la compañía.
Boehringer Ingelheim Salud Animal es una empresa innovadora focalizada en el desarrollo de herramientas de monitorización, diagnóstico y soluciones preventivas, sobre todo para aquellas enfermedades para las que no existe todavía un tratamiento satisfactorio.
COMPROMETIDOS CON LA SALUD ANIMAL DESDE 1972
En 1885, Albert Boehringer fundó una empresa familiar de 28 empleados en la localidad alemana de Ingelheim. Entonces no lo sabían, pero se estaban dando los primeros pasos para convertirse en una compañía farmacéutica global.
Una compañía centrada en pensar no solo en el presente, sino también en las generaciones futuras, y que inauguró en 1955, en Alemania, su división de salud animal.
Un año después, en 2018, el negocio de Salud Animal en España se constituyó como empresa independiente, dando paso a su nueva denominación: Boehringer Ingelheim Animal Health España.
50 AÑOS TRABAJANDO POR LA SALUD DE LOS RUMIANTES
En estos 50 años de presencia de Boehringer Ingelheim Animal Health en España, Luis Santos, Business Unit Head Livestock de Boehinger Ingelheim Animal Health España, destaca algunos de los hitos en producción de rumiantes.
“Remontándonos cronológicamente en el tiempo, el registro de la primera Ivermectina para uso animal cambió diametralmente la forma de luchar contra los parásitos en producción animal. Se creó un nuevo segmento como es el de Endectocidas que, hasta el lanzamiento de Ivomec, era imposible de imaginar”.
Si mira hacia delante, tiene claro que:
“El futuro más próximo, e incluso el presente, pasa por el lanzamiento de nuevos productos que complementan la actual oferta de la compañía”.
LONGEVIDAD FUNCIONAL EN LA RAZA LATXA UN CARÁCTER DE INTERÉS
PARA EL PROGRAMA DE MEJORA
GENÉTICA
Carolina Pineda Quiroga y Eva Ugarte
NEIKER-BRTA, Instituto Vasco de Investigación y Desarrollo Agrario, Campus Agroalimentario de Arkaute, Vitoria-Gasteiz
MEJORA GENÉTICA DE LA RAZA
LATXA
La Latxa es una raza ovina de aptitud lechera, autóctona de la Comunidad Autónoma Vasca (CAPV) y Navarra, compuesta por tres poblaciones diferentes:


Latxa Cara Rubia (LCR)
Latxa Cara Negra de Euskadi (LCNEAE)
Latxa Cara Negra de Navarra (LCNNAV)
Se trata de una raza caracterizada por una elevada rusticidad, con buena adaptación a la orografía montañosa, las bajas temperaturas y la alta pluviosidad del norte de la Península Ibérica.
Su sistema de producción es semiextensivo, muy ligado al entorno rural, y caracterizado por el pastoreo en zonas de valle y en pastos comunales de montaña durante parte de la primavera, el verano y parte del otoño (Beltrán de Heredia et al., 2021).
Desde 1985, esta raza tiene implementado un programa de mejora genética sólido y consolidado que funciona de manera independiente para las tres poblaciones, y que inicialmente tuvo como objetivo común de selección el aumento de la producción de leche.
Con el paso de los años y gracias a la recogida sistemática de datos fenotípicos en los rebaños, se han integrado nuevos caracteres de interés como la composición de leche (porcentaje de grasa y proteína en la leche, año 2000) y la morfología de ubre (profundidad, inserción, verticalidad y longitud, año 2005). Recientemente, también se ha estudiado la base genética de la termotolerancia (Carabaño et al., 2021).
LA LONGEVIDAD FUNCIONAL
Tras varios años obteniendo resultados positivos al seleccionar por los caracteres productivos citados anteriormente, se planteó evaluar la inclusión de caracteres de tipo funcional en los criterios de selección, tanto por el interés que tienen en sí mismos, como por las correlaciones negativas que suelen existir con los caracteres productivos.
Un animal longevo es aquel que permanece en el rebaño por un periodo largo de tiempo. Sin embargo, tan importante como la duración de su vida es el desempeño productivo que tiene durante la misma. Así, la longevidad funcional abarca conjuntamente a la capacidad del animal de:
Producir de manera óptima (leche en este caso)
Reproducirse satisfactoriamente
Mantenerse sano o con baja incidencia de problemas sanitarios a lo largo de su vida (McLaren et al., 2020)
Generalmente, la longevidad funcional se mide como el tiempo transcurrido entre el inicio de la fase productiva de una oveja (primera lactación) y el fin de esta (por desecho o muerte).
Entre otras cosas, en un rebaño, el aumento de ovejas más longevas y sanas permite la reducción de los costes de producción asociados a la cría de las corderas de reemplazo, así como de los costes asociados a la atención veterinaria de los animales menos vigorosos (Berghof et al., 2018).

ESTUDIO DE LA LONGEVIDAD FUNCIONAL EN LA RAZA LATXA
Para estudiar la longevidad funcional en la raza Latxa, se recopilaron los datos productivos y genealógicos de ovejas nacidas entre los años 2000 y 2018.
En el procesamiento de los datos se exigió que todas las ovejas contaran con padre y madre conocidos, y que tuvieran registrada:
La edad al primer parto
El número total de corderos nacidos en cada parto
El número de lactación
La leche total producida por lactación
Sobre los datos productivos se realizaron controles de calidad para eliminar registros erróneos o sin sentido biológico.
La variable producción de leche se distribuyó en 3 categorías*:
CATEGORÍA
1
Ovejas con producción baja (2-130 L/lactación)
CATEGORÍA 2 CATEGORÍA 3
Ovejas con producción media (131-197 L/lactación)
Ovejas con producción alta (198-300 L/lactación)
La variable de estudio, o lo que se conoce en genética como “criterio de selección”, fue la longitud de la vida productiva (LVP) que se calculó de dos maneras diferentes, según el caso:
1)
Para aquellas ovejas que tenían fecha de baja registrada, la LVP se calculó como la diferencia (en días) entre la fecha de baja y la fecha del primer parto.
2)
Para las ovejas que no tenían registro de fecha de baja a 31 de diciembre del 2018, la LVP se calculó como la fecha del último control y la fecha del primer parto.
El resumen general de los datos utilizados en los análisis se presenta en la Tabla 1.
Latxa Cara Rubia (LCR)
Latxa Cara Negra de Euskadi (LCNEAE)
Latxa Cara Negra de Navarra (LCNNAV)
Número de ovejas 28.466 26.045 10.385
Número de rebaños 119 136 47
LVP1 ± sd (días) 1.351 ± 713 1.419 ± 706 1.499 ± 746
Producción de leche2(L) 163 ± 65 156 ± 62 146 ± 59 Número de lactaciones 2,5 ± 1,5 2,6 ± 1,5 2,7 ± 1,5

Longitud de la lactación (meses) 5,0 ± 1,3 4,4 ± 1,2 5,2 ± 1,4
Corderos nacidos por parto 1,3 ± 0,5 1,3 ± 0,5 1,2 ± 0,4
Animales en genealogía 29.782 27.256 10.865

1LVP: Valor medio de la longitud de la vida productiva. 2Media de producción de leche estandarizada a 120 días.
Tabla 1. Datos empleados en el estudio de longevidad funcional de ovejas Latxa nacidas entre 2000 y 2018.
*Categorización según la distribución propia de los datos por cuartiles de 33%.
Con toda esta información, se estimó el riesgo de desvieje asociado a las variables mencionadas anteriormente.
Además, se estimó la heredabilidad de la LVP, así como las correlaciones entre los valores genéticos de longevidad y de todos los caracteres que actualmente forman parte del esquema de mejora. Los análisis se realizaron utilizando el programa de acceso libre Survival Kit v6 (Mèszáros et al., 2013).
RESULTADOS
Riesgo de desvieje
Con los datos analizados, se pudo determinar que, conforme aumenta la edad a la que ocurre el primer parto y el número de corderos nacidos por oveja por parto, también aumenta el riesgo de desvieje (Gráfica 1).
EDAD AL PRIMER PARTO
CORDEROS NACIDOS/ OVEJA Y AÑO
PRODUCCIÓN DE LECHE
En el primer caso, una oveja que pare por primera vez con más de 1 año tendrá más riesgo de ser desechada del rebaño, pues tendrá menos lactaciones durante su vida y, por ende, producirá menos leche.
En cuanto al número de corderos, ovejas con partos múltiples generalmente tendrán una peor condición corporal de difícil recuperación, afectando su productividad.
En cambio, puede observarse en la misma gráfica que el riesgo de desecho disminuye cuando el nivel de producción de leche aumenta, pues los ganaderos siempre preferirán tener animales de alta producción en el rebaño.
1,5 1,0 0,5 0,0 1
Edad al primer parto (años) Años
Latxa Cara Rubia (LCR)
Latxa Cara Negra de Euskadi (LCNEAE)
Latxa Cara Negra de Navarra (LCNNAV)
Edad 1er parto y no corderos nacidos/oveja y parto Riesgo de desvieje 1,0 0,75 0,5 0,25 0,0 1
Riesgo relativo de desvieje 2 3 1,0 0,5 0,0 1
Corderos nacidos Corderos
Riesgo relativo de desvieje 2 3
Producción de leche Categorías
Riesgo relativo de desvieje 2 3
Gráfica 1. Riesgo de desvieje asociado a la edad al primer parto, el número de corderos nacidos y la producción de leche.
Longevidad funcional en la raza latxa, un carácter de interés para el programa
Heredabilidad y correlaciones entre valores genéticos
Del análisis también se concluyó que existe cierta variabilidad genética susceptible de ser explotada en el carácter LVP, aunque el valor estimado para la heredabilidad fue bajo: 0,061 en la Latxa Cara Rubia 0,042 en la Latxa Cara Negra de Euskadi 0,053 en la Latxa Cara Negra de Navarra
Esta baja heredabilidad indica que hacer selección directa por LVP conllevaría a un progreso genético lento, por lo que sería interesante encontrar otros caracteres correlacionados genéticamente de manera positiva que puedan servir de predictores de la longevidad. En la Gráfica 2 se muestran los valores estimados para la correlación entre los valores genéticos de LVP y otros caracteres.
Correlaciones genéticas positivas con el carácter LVP
Se observó una correlación positiva entre: LVP e inserción de la ubre LVP y verticalidad del pezón
Este resultado sugiere que ubres más altas y con pezones más verticales presentan menos problemas sanitarios, además de facilitar el encalostramiento de los corderos y el ordeño mecánico.
Correlaciones genéticas negativas con el carácter LVP
Se determinó la existencia de una correlación negativa entre: LVP y producción de leche LVP y profundidad de la ubre LVP y longitud del pezón LVP y recuento de células somáticas (RCS)

Estos hallazgos indican que seleccionar animales por volumen de leche resulta contraproducente desde el punto de vista genético cuando se busca longitud de la vida útil de los animales.
La correlación negativa con respecto a la profundidad de la ubre, longitud del pezón y RCS implica que ubres más descolgadas y con pezones más largos son más propensas a sufrir infecciones y, por ende, a tener altos RCS, lo que claramente reduce la longevidad de los animales.
Latxa Cara Rubia (LCR)
Latxa Cara Negra de Euskadi (LCNEAE)
Latxa Cara Negra de Navarra (LCNNAV)
Gráfica 2. Correlación genética entre el carácter LVP y otros caracteres genéticos.


La longevidad es un carácter de interés para el programa de mejora genética de la raza Latxa y está influenciada por factores de manejo y genéticos. En esta raza, el retraso del inicio reproductivo o el incremento en la prolificidad se relacionan con un mayor riesgo de desvieje de las ovejas, mientras que una mayor producción de leche reduce la probabilidad de que sean desechadas.
Desde el punto de vista genético, dado que la respuesta obtenida por la selección genética directa por LVP sería escasa, las correlaciones entre valores genéticos sugieren que la selección por morfología de ubre favorece la longevidad de los animales y podría convertirse en una herramienta útil de selección indirecta.

Agradecimientos.
Este estudio fue realizado en el marco del proyecto ARDI EFA208/16, INTERREG POCTEFA. Los datos utilizados fueron proporcionados por CONFELAC – Confederación de Asociaciones de Criadores de Ovino de Razas Latxa y Carranzana
Longevidad funcional en la raza latxa, un carácter de interés para el programa de mejora genética
DESCÁRGALO EN PDF
ACCEDER A BIBLIOGRAFÍA
ENTREVISTA
A FERNANDO FREIRE
Gerente de Assafe y Ovigen
SITUACIÓN ACTUAL DEL MANEJO REPRODUCTIVO EN EL SECTOR OVINO

Fernando Freire, licenciado en Veterinaria por la Universidad de León y gerente de Assafe (Asociación Nacional de Criadores de Ganado Ovino de Raza Assaf) y de Ovigen (Centro de Selección y Mejora Genética de Castilla y León) desde el año 2000-2013, nos habla sobre la situación actual del sector ovino en materia de manejo reproductivo.

¿Cómo definiría la situación actual del uso de las tecnologías de la reproducción en el ganado ovino español?
Se utilizan poco para lo que podrían aportar, especialmente si miramos el número de inseminaciones que se hacen. Por ejemplo, la inseminación artificial, con respecto al censo de ganado ovino, es inferior al 1%. Por lo tanto, hay un recorrido enorme que hacer.
No obstante, si nos fijamos en las tendencias, otras tecnologías, como la transferencia de embriones, van en ligero aumento y creo que se irán utilizando o demandando cada vez más. Y la inseminación es la que no conseguimos que despunte porque se hace en un porcentaje muy bajo.
¿Hablar de transferencia de embriones y otros objetivos más ambiciosos es una utopía, un objetivo lejano o una realidad próxima en el ámbito del ganado ovino?
Cada vez hay más ganaderos que exploran o demandan la transferencia de embriones. Los resultados tampoco son espectaculares, pero son aceptables. Evidentemente, al igual que en la inseminación, los resultados se pueden mejorar en lo que respecta a la transferencia de embriones, pero sí hay cada vez más demanda.
Lógicamente, es la pescadilla que se muerde la cola, si hay mayor demanda de esta técnica, habrá más profesionales que la practiquen y más animales en los que se aplique, lo que permitirá ir mejorando y afinando cada vez más.
Siempre hay un perfil de ganadero que demanda este tipo de servicios, como ha ocurrido con todas las demás tecnologías. En este sentido, cada vez hay más gente que pregunta por la transferencia de embriones, de modo que va ganando visibilidad.
En referencia al uso de la inseminación en el ganado ovino, siempre se le ha achacado una tasa de fertilidad que no es la idónea. ¿Dónde están los puntos de mejora en este aspecto?
Hay muchos aspectos que influyen en la fertilidad de la inseminación y su resultado, tanto por parte del macho como de la hembra.
Es cierto que hay ganaderos que aceptan que una tasa del 50% es razonable. La comparan con el vacuno y dicen “bueno, tampoco tiene mucho más y, claro, es otro sistema de explotación”.
Lo que se pide en algunas razas es un nivel de producción que permita una alta producción lechera y, a la vez, que queden gestantes cuando nosotros queremos.
Por poner un ejemplo, en la raza Assaf, que conlleva la inseminación de animales con altos niveles de producción lechera y pocos días postparto, hemos estudiado ya ventanas de fertilidad y momentos más adecuados y, seleccionando bien el lote, se puede afinar un poco más en el resultado final.

Como comentaba, existen más de 20 factores que influyen en los resultados reproductivos y la investigación es imprescindible. En este sentido, los proyectos de investigación son de enorme interés si queremos seguir avanzando.
Por ejemplo, en un proyecto de investigación en colaboración con la Universidad de Murcia, hemos tratado de analizar todo el proceso desde que se produce el semen hasta que llega a la oveja receptora. Todo ese APPCC (Análisis de Peligros y Puntos de Control Crítico) es muy interesante y nos permitirá ir definiendo mejor los factores susceptibles de mejora.
Es frecuente observar la presencia de datos muy diferentes de fertilidad, incluso dentro de la misma ganadería. ¿Por qué sucede eso? ¿Se están planteando opciones de mejora en esa línea?
Con la misma ganadería, cuando estamos utilizando el mismo sistema, la misma elaboración, casi la misma distancia, los mismos plazos, lo único que cambia son los animales, con lo que el factor individual del animal creemos que tiene importancia.
Una ganadería puede tener resultados muy variables (de 20 puntos arriba o abajo) en inseminación a pesar de que el resto del proceso se mantenga igual, pues el animal es factor diferenciador.
No es el mismo estado de producción, no es la misma edad, en teoría es la misma alimentación, pero no siempre es la misma si están a baja producción, no tiene los mismos días postparto, etc.
Hay un montón de factores que controlar, pero controlarlos todos es imposible. Lo que se puede hacer es mantener todos los factores fijos y cambiarlos uno a uno, como se hace en economía, para ver cómo evoluciona el resultado.
Es evidente que el uso de las técnicas de reproducción tiene la ventaja de la mejora genética que introducen, pero también la ventaja sanitaria asociada a la limitación del movimiento de animales de unas explotaciones a otras. ¿Cree que el sector es consciente de esa ventaja sanitaria?
No. Seguramente, si enumeráramos las ventajas de las técnicas de reproducción, la ventaja sanitaria no se encontraría entre las primeras, pero es muy, muy importante, y más ante la situación actual.
No hay más que ver lo que ha ocurrido en los últimos meses en los que, por precaución sanitaria, se ha optado por no llevar animales a determinadas ferias ganaderas por la presencia de brotes de Lengua Azul, Viruela y otras enfermedades surgidas últimamente.
Son alertas que nos deberían hacer reflexionar sobre el riesgo asociado al movimiento de animales y que es un factor determinante si queremos garantizar el buen estado sanitario de nuestros rebaños.
En este sentido, entre las ventajas de la inseminación, deberíamos destacar siempre la ventaja sanitaria y más aún con las tecnologías avanzadas, como la transferencia de embriones, ya que contribuyen a reducir muchísimo los riesgos.

Imagine que tiene una varita mágica, ¿a qué país le gustaría parecerse en el ámbito de la tecnología de reproducción en ovino y por qué?
En algún aspecto me gustaría que nos pareciéramos a Francia, por el manejo que tienen de la transferencia de la tecnología desde los centros de investigación al ganadero directamente, y también podríamos fijarnos en Nueva Zelanda y Australia en lo que respecta al uso de tecnologías más novedosas.
No obstante, tenemos nuestra propia identidad y, aunque hay cosas puntuales que pueden ser interesantes, no copiaría el modelo completo, sino que tenemos que fabricar en nuestro propio modelo.
Creo que estamos en el buen camino, mejorando con las colaboraciones realizadas con universidades y con los proyectos en los que vamos participando.
Nuestro sector está tremendamente profesionalizado, con excelentes profesionales veterinarios, grandísimos visionarios, ganaderos e investigadores. Aun así, a pesar de que hemos recorrido un camino muy grande, nos queda todavía mucho por recorrer.
Existen multitud de ámbitos aún por explorar, especialmente con la irrupción de las "ómicas". Ahora hay un montón de líneas nuevas de investigación por las que habría que apostar mucho más.
A su juicio, ¿se hace suficiente investigación y transferencia de conocimientos sobre reproducción del ganado ovino en España? ¿En qué ámbitos sugeriría incrementar la inversión en I+D?
En todos. Actualmente tenemos un potencial genético enorme y hay que complementarlo con unas garantías sanitarias y con unas tecnologías que permitan desarrollar y perfeccionar las técnicas reproductivas.
¡Somos un modelo de referencia y no podemos perder el puesto puntero que tenemos como sector en España y en Europa!
De hecho, hay muchos países que están desarrollando su sector ganadero y que nos están mirando. El modelo de España es para exportar en todos los sentidos, especialmente cuando hablamos del manejo del potencial genético y el control sanitario. Incluso hay planes sanitarios que nos han pedido otros países que se desarrollen aquí y son modelos que se pueden copiar.
¡Nos lo tenemos que creer! Tenemos un potencial enorme que, a nivel económico, siempre compensa, tanto desde el punto de vista ganadero como desde el punto de vista del país o de la región que lo quiere implementar.
¿Cualquier explotación puede “subirse” de un día para otro al carro de las tecnologías de reproducción o debe reunir ciertas características?
Cualquier explotación que quiera hacer las cosas bien puede implementar las tecnologías de reproducción y las ventajas las verá claramente.
Se puede empezar por un lote pequeño de 50 animales y, viendo los resultados que va a tener, creo que es evidente que compensará.
Ahora, se debe saber hacer las cosas bien, es decir, se tiene que seleccionar correctamente, no dejando los animales que no quedan preñados y utilizarlos para inseminar, porque ese no será el lote adecuado. Más bien al contrario, se deben elegir los animales más adecuados y, partiendo de ahí, seguir las pautas de trabajo y los protocolos que el veterinario indique. No es necesario tener unos requisitos específicos, pero sí la voluntad de trabajar bien y mejorar.
Como gerente de Assafe y Ovigen, ¿cuáles son los objetivos que se han marcado a corto y medio plazo?
En Ovigen tenemos el objetivo de mejorar y democratizar la inseminación artificial e implementar estas nuevas tecnologías que cada vez se demandan más. De hecho, ya tenemos un grupo de trabajo dedicado a la transferencia de embriones.
Además, recientemente, hemos presentado en Ovinnova los primeros corderos nacidos in vitro, que es una línea de investigación interesante porque los resultados de la vía tradicional a veces no son adecuados, pero hay que combinar las dos.
En cuanto a Assafe, estamos trabajando en la mejora de los caracteres productivos desde la selección genética, por ejemplo, velocidad de ordeño y otros caracteres que se están implementando.
Por otro lado, estamos pensando ya en el tamaño y la eficiencia de los animales. Hay que buscar animales más eficientes y hay que desarrollar proyectos en ese sentido.

Recientemente, hemos hecho un contrato interesante para empezar a desarrollar una prueba del semen sexado, lo que en el vacuno revolucionó bastante el sector. No sé si económicamente compensará, pero quizá será interesante a nivel de apareamientos dirigidos para la obtención de machos que llegan a los centros de inseminación.

Otra vía interesante es la preservación del semen, buscando mantener su viabilidad más de 6-8 horas, que es lo que se ha conseguido hasta ahora (a partir de las 6 horas empieza a disminuir mucho la fertilidad), y vamos a probar con nuevos diluyentes que contribuyan a mantener esta viabilidad hasta las 24-72 horas.


Creo que los ganaderos españoles tienen un perfil muy interesante y se merecen que se trabaje y que nos esforcemos.
Ellos son los que, al fin y al cabo, han conseguido el gran progreso que vemos actualmente, en muchos casos con apoyo de la administración, pero pagándolo ellos muchas veces. Tienen una tenacidad que les impulsa a tirar siempre hacia delante, a innovar y, ante la situación actual con el coste de la electricidad y de la alimentación por las nubes, a seguir aguantando y apostando por el sector.
Entrevista a Fernando Freire - Situación actual del manejo reproductivo en el sector ovino DESCÁRGALO EN PDF x yDE LA COCCIDIOSIS


ABORDAJE NATURAL EN OVINO
Irene Cabeza Luna Responsable Técnica de Rumiantes, TecnovitLa coccidiosis ovina es una enfermedad de distribución cosmopolita y de gran relevancia, tanto en granjas con sistemas extensivos como en granjas de estabulación. Sin embargo, es destacable la presencia de la enfermedad en explotaciones intensivas en las que los animales se mantienen en espacios reducidos en contacto con las heces.

El hacinamiento de los animales y las deficiencias higiénicas contribuyen a mantener la infección.
Por tanto, se trata de una de las parasitosis más frecuentes en el cebo intensivo de corderos, alcanzando una prevalencia próxima al 100% de las explotaciones y al 70% del colectivo.
Los corderos jóvenes menores de tres meses de edad son los más receptivos a la infección y pueden llegar a eliminar cantidades superiores a 100.000 ooquistes/g de heces.
<3 meses
>100.000 ooquistes/g
EIMERIA – UN PROTOZOO INSIDIOSO
La coccidiosis es una parasitosis producida por protozoos pertenecientes al género Eimeria que infecta a las células del epitelio intestinal. De las 16 especies de Eimeria que parasitan al ganado ovino, las más patógenas son:







E. ovinoidalis
E. crandalis
Cabe mencionar que la infección generalmente sucede de forma mixta, es decir, que en un cuadro de coccidiosis lo normal es que se vean implicadas varias especies, lo que determina la variabilidad en la patogenicidad y el cuadro clínico que acompaña al proceso.

La forma infectante es el ooquiste esporulado, produciéndose el contagio por vía oral. Una vez en el tracto digestivo, el ooquiste esporulado libera ocho esporozoítos (cuatro esporocistos con 2 esporozoítos cada uno) que invaden las células epiteliales del intestino delgado donde llevan a cabo varios ciclos de multiplicación asexual con la formación de merozoítos que infectan a enterocitos sanos.
Posteriormente, tiene lugar el ciclo de multiplicación sexual con la formación de microgametos y macrogametos para dar lugar al cigoto. Finalmente, la maduración del cigoto conduce a la formación del ooquiste no esporulado para su eliminación al medio a través de las heces.




La esporulación de los ooquistes tiene lugar en el medio externo al cabo de horas o de días, cuando existen condiciones favorables de humedad y temperatura Los ooquistes tienen una elevada capacidad de supervivencia en el medio, lo que dificulta el control de la enfermedad.
Infección oral con ooquiste esporulado con 4 esporocistos (2 esporozoitos/esporocisto)
Esporulación del ooquiste en el ambiente
Liberación de esporozoitos en el intestino e infección de enterocitos


Multiplicación asexual con la formación de merozoitos que infectan enterocitos sanos
PREVENCIÓN DE LA COCCIDIOSIS
La mejor opción para minimizar los costes económicos asociados a la coccidiosis es adoptar un enfoque preventivo. Para ello, es necesario establecer medidas de control sanitario, de manejo y control terapéutico.


Medidas higiénico-sanitarias
Las medidas higiénico-sanitarias van encaminadas a evitar las fuentes de contagio, así como la esporulación de ooquistes en el medio. Algunas de estas medidas son:
Impedir el acceso de animales jóvenes a espacios ocupados previamente por adultos portadores o enfermos.
Realizar cambios frecuentes de la cama de los animales, evitando camas húmedas.
Realizar la limpieza frecuente de las explotaciones con productos antisépticos.
Evitar mezclar animales de explotaciones diferentes.


Evitar una densidad excesiva de animales.
Mantener un buen estado inmunitario de los animales: alimentación, vacunaciones, bienestar, etc.

Multiplicación sexual con la formación de un cigoto que, al madurar, se convierte en un ooquiste no esporulado.
Figura 1. Representación esquemática del ciclo biológico de Eimeria spp. (Creado con BioRender.com).
Control terapéutico
Para el control terapéutico, actualmente es común el uso de coccidiostáticos a través del pienso o agua de bebida de modo profiláctico. Estos medicamentos tienen diferentes modos de acción y a veces se usan combinados:
Decoquinato: inhibición de la respiración mitocondrial del parásito
Sulfonamidas: inhibición de la síntesis de ácidos nucleicos, impidiendo la división celular del parásito
Amprolium: inhibición del consumo de tiamina
(Felice et al., 2021)
VENTAJAS
El decoquinato es capaz de disminuir en un 95% la eliminación de ooquistes, evitando la multiplicación del parásito desde las primeras etapas del ciclo parasitario.
Las sulfamidas son eficaces en la segunda etapa del ciclo parasitario, ayudando a controlar los síntomas de diarrea específicos de la coccidiosis y ayudando a controlar las bacterias que favorecen otros procesos patológicos.
INCONVENIENTES
Las especies de Eimeria responsables de la coccidiosis son capaces de desarrollar resistencias frente a todos los fármacos descritos. La formación de cepas resistentes se ve facilitada cuando se utilizan dosis bajas durante largos períodos de tiempo.

El uso de fármacos tiene impacto en la cadena alimentaria y en el medioambiente. Por ello, existe la necesidad urgente de buscar principios activos caracterizados por su bajo riesgo para la salud del consumidor y el medioambiente.

CONTROL DE LA COCCIDIOSIS MEDIANTE ADITIVOS NATURALES
El empleo de aditivos naturales para el control de la coccidiosis y la mejora de la eficiencia nutricional son alternativas a tener en cuenta.
En las últimas décadas se ha reforzado la investigación para tratar de encontrar alternativas viables a los métodos comúnmente utilizados contra la coccidiosis.
Existen aceites esenciales en el mercado a los que se les atribuyen efectos coccidiostáticos, aunque con resultados inconsistentes en algunas ocasiones (Felici et al., 2021).
Numerosos estudios han reportado una reducción de la parasitación in vitro e in vivo con el uso de aceites esenciales y, en ocasiones, un efecto sinérgico (Remmal et al., 2011; Burt et al., 2013; Alnassan et al., 2015; Sidiropoulou et al., 2020).
Otros principios activos que han sido propuestos como alternativas prometedoras a los coccidiostáticos convencionales son el ácido maslínico y las saponinas.
Aceites esenciales

La mayoría de los aceites esenciales son metabolitos secundarios de plantas cuyos componentes químicos activos son diversos. Un aceite esencial se define como la sustancia volátil con aroma y sabor que se obtiene de plantas a partir de un proceso físico (Martínez et al., 2015).
Entre los beneficios que tiene el uso de aceites esenciales en la alimentación animal se encuentran sus propiedades antimicrobianas, antioxidantes, antiparasitarias, antiinflamatorias, antidiarreicas y antimicóticas.
En el caso de los animales rumiantes, los aceites esenciales son capaces de modificar la fermentación ruminal, haciendo más aprovechables los nutrientes de los alimentos, mejorando la eficiencia de producción de leche y de carne en bovino, ovino y caprino, y obteniendo mayores ganancias de peso y mejores conversiones alimenticias (Moreno et al., 2009; Giannenas et al., 2011; Tager y Krause, 2011).
Ácido maslínico
El ácido maslínico (2-α,3-β-dihidroxi-28-carboxiolean-12-eno) es un triterpeno pentacíclico presente en las hojas y frutos del árbol Olea europaea, comúnmente llamado olivo, cuyo origen es la cuenca del Mediterráneo, donde es endémico.

Este ácido se encuentra dentro de la fracción insaponificable de los componentes del olivo, entre los que se puede destacar también el ácido olenólico, otro triterpeno pentacíclico. Entre los componentes de la oliva, es en la piel donde más abunda esta sustancia.
En recientes publicaciones se ha demostrado que el ácido maslínico procedente del aceite de oliva posee capacidades antiparasitarias frente a Eimeria spp. (de Pablos et al., 2010; Rambozzi et al., 2016).
El ácido maslínico es capaz de inhibir la actividad enzimática de las serín-proteasas, unas enzimas fundamentales para protozoos del filo Apicomplexa, ya que son las encargadas de facilitar la invasión celular del hospedador.
Las saponinas son detergentes naturales con componentes polares y apolares. Cuentan con un núcleo liposoluble, que puede ser un esteroide o un triterpeno y una o más cadenas de restos polares, o solubles en agua.
Esta naturaleza anfipática les confiere la propiedad de poder introducir proteínas y otras moléculas a través de las membranas celulares.
Además, gracias a su excelente capacidad surfactante, se han utilizado en medicina tradicional para disolver trombos y reducir riesgo de ataque al corazón.
COCCITEC PLUS combina los efectos beneficiosos de subproductos de la aceituna, aceites esenciales encapsulados y saponinas que actúan en sinergismo, mejorando la salud e integridad intestinal en condiciones de infección por Eimeria spp.
La encapsulación de parte de los principios activos impide que los productos sean liberados y absorbidos por completo en niveles proximales del tracto gastrointestinal, lo que permite la llegada de las moléculas activas a las partes distales del tracto gastrointestinal donde son liberadas gracias a la acción de la lipasa pancreática.
Entre todas las propiedades beneficiosas de las saponinas, cabe destacar que ciertos estudios han demostrado una capacidad antiprotozoaria, ya que son capaces de unirse al colesterol de las membranas celulares del protozoo ocasionando su muerte, lo que podría ser útil para combatir la coccidiosis (Cheeke et al., 2006).
Además, se sabe que las saponinas son inmunoestimulantes, por lo que aumentan la resistencia a enfermedades (Cheeke et al., 2001), y tienen efectos antioxidantes (Piacente et al., 2004).
Esta es una condición indispensable para cualquier solución nutricional que tenga como objetivo mejorar la salud de la pared intestinal y actuar contra organismos patógenos albergados en porciones distales del intestino.
COCCITEC PLUS optimiza el crecimiento bajo condiciones de desafío por coccidios y mejora la eficiencia digestiva, siendo una alternativa eficaz al empleo de vacunas y/o coccidiostáticos.
La aplicación de COCCITEC PLUS en granja es sencilla, recomendándose su inclusión en el pienso a dosis en torno a 3-4 kg/tonelada, en función de la especie y del estado productivo de los animales.
 Saponinas
Saponinas





