Biodegradación de TOXINAS FUSARIALES asociadas a alimentos y piensos
de Mysore, Manasagangotri, Mysore, Karnataka, India.
Correspondencia: +91-821-2419733; sreenivasamy@gmail.com; mys@microbiology.uni-mysore.ac.in
 N. Deepa y M.Y. Sreenivasa Laboratorio de Micotoxicología Molecular, Departamento de Estudios en Microbiología, Universidad
N. Deepa y M.Y. Sreenivasa Laboratorio de Micotoxicología Molecular, Departamento de Estudios en Microbiología, Universidad
Las toxinas fusariales son metabolitos secundarios producidos por especies de Fusarium, siendo las fumonisinas, los tricotecenos y la zearalenona las más significativas:
Las fumonisinas son micotoxinas tóxicas producidas principalmente por Fusarium verticillioides y F. proliferatum.
Aspergillus niger también produce estas toxinas, pero en menor cantidad en comparación con las especies de Fusarium

Fumonisinas
Se han identificado cerca de 28 fumonisinas clasificadas en cuatro grandes grupos (A, B, C y P), de los cuales el grupo B es conocido como uno de los principales contaminantes de alimentos y piensos.
La fumonisina B (FB) se clasifica a su vez en FB1, FB2, FB3 y FB4
FB1 representa el 70% de las fumonisinas reportadas, con una distribución predominante en todo el mundo (Deepa y Sreenivasa et al., 2017a, 2017b).

2
Tricotecenos
Los tricotecenos son un grupo de metabolitos secundarios sesquiterpenoides producidos por especies de Fusarium, como F. oxysporum, F. graminearum, F. poae, F. solani, F. equisiti, F. sporotrichoides y F. xyrophilum.
En función de la ubicación del grupo funcional, los tricotecenos se clasifican a su vez en tipo A, B, C y D, entre los cuales el tipo D es el más tóxico y los tipos A y B tienen toxicidad mixta.
Los tricotecenos tipo A -toxina T-2 (T-2) y toxina HT-2 (HT-2)- y los tricotecenos tipo B -nivalenol (NIV) y deoxinivalenol (DON)- son los más relevantes de este grupo (Zhang et al., 2020).
Distribución de toxinas fusariales
Las toxinas fusariales pueden encontrarse por todo el mundo en alimentos, piensos y productos agrícolas recién cosechados y almacenados.
Zearalenona
La zearalenona está producida por F. culmorum, F.cerealis, F. semitectum, F. equiseti y F.graminearum (Krol et al., 2018).

Están muy asociados al maíz y a los productos a base de maíz, pero también pueden encontrarse en arroz, sorgo, mijo perla, trigo, judías, curry, cebada, espárragos, chile en vinagre, caupí, triticale, soja, vino tinto, cerveza, cebolla, ajo, rábano negro, té negro, café, uvas, productos a base de mandioca, higos, cacahuetes, leche, carne, huevos, hojas de naranjo, plantas dietéticas, menta, hojas de salvia, plantas medicinales, coadyuvantes cerveceros, raíz de valeriana, flores de tilo y manzanilla en China, Tanzania, Costa de Marfil, Italia, Sudáfrica, Portugal, India, Turquía y España (Ma et al., 2018) (Tabla 1).
3
Especies de Fusarium Micotoxinas
F. verticillioides FB1, FB2, FB3
F. acuminatum T-2, MON, HT-2, DAS, MAS, NEO, BEA
F. anthophilum FB1, FB2, BEA
F. avenaceum MON, BEA
F. cerealis NIV, FUS, ZEN, ZOH
F. chlamydosporum MON
F. culmorum DON, ZEN, NIV, FUS, ZOH, AcDON
F. equiseti ZEN, ZOH, MAS, DAS, NIV, DAcNIV, FUS, FUC, BEA
F. graminearum DON, ZEN, NIV, FUS, AcDON, DAcDON, DAcNIV
F. heterosporum ZEN, ZOH
F. nygamai FB1, FB2, BEA
F. oxysporum MON, BEA
F. poae DAS, NIV, FUS, MAS, T-2, HT-2, NEO, BEA
F. proliferatum FB1, BEA, MON, FUP, FB2
F. sambucinum DAS, T-2, NEO, ZEN, MAS, BEA
F. semitectum ZEN, BEA
F. sporotrichioides T-2, HT-2, NEO, MAS, DAS
F. subglutinans BEA, MON, FUP
F. tricinctum MON, BEA
Mecanismos de acción y degradación de toxinas fusariales
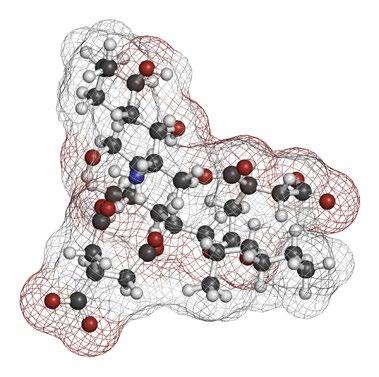
Fumonisinas
Las fumonisinas inhiben la función de la enzima clave ceramida sintasa, interrumpiendo el metabolismo de los esfingolípidos en células, hepatocitos, tejidos, células renales y neuronas.
La biosíntesis de los esfingolípidos se produce en el retículo endoplásmico a través de un proceso de hidrólisis de los esfingolípidos complejos a ceramidas y, posteriormente, a esfingosina, que es fosforilada y escindida a aldehído graso y fosfato de etanolamina para su posterior incorporación a la fosfatidil-etanolamina.
Tabla 1. Especies de Fusarium asociadas a alimentos y piensos y sus micotoxinas.
4
La alteración de la biosíntesis de esfingolípidos puede desempeñar un papel crucial en la carcinogénesis y el desarrollo de enfermedades al dañar el ADN (Alizadeh et al., 2012) (Figura 1).

Tricotecenos
Fumonisina B1
Inhibe la función de la ceramida sintasa
Ceramida
Acumulación de esfinganina libre causante de citotoxicidad
Esfinganina
La degradación de los tricotecenos se basa principalmente en su grupo epóxido y sus cadenas laterales aciladas (los tricotecenos acilados se refieren a la toxina T-2 y los no acilados al DON).
La degradación de los tricotecenos implica dos mecanismos:
1. La desacilación se produce en la degradación de tricotecenos acilados (T-2 a HT-2 a T-2 triol).
2. La desoxidación se produce en la degradación de tricotecenos no acilados (DON).
Algunos estudios señalan que la oxidación o isomerización, la hidroxilación y la glicosilación también son vías implicadas en la degradación de los tricotecenos, formando compuestos que posteriormente pueden regenerarse o rehidrolizarse en el tracto digestivo de humanos y animales (Wang et al., 2020).
5 OH OH H3N+
Figura 1. Mecanismo de acción de la fumonisina B1
El metabolismo de la ZEN implica dos mecanismos de degradación:
1. Escisión de una estructura de anillo de lactona en un compuesto menos tóxico ( La enzima ZEN lactonohidrolasa contribuye a esta vía, resultando perjudicial para la actividad estrogénica a través de la descarboxilación

2. Otra vía se produce a través de un intermediario lactona sin descarboxilación, sin observación de actividad estrogénica (Tintelnot et al., 2011).
Efectos de las toxinas fusariales
Las toxinas fusariales tienen importantes efectos tóxicos en los seres humanos y los animales.
Han demostrado ser nefrotóxicos, carcinogénicos, hepatotóxicos, hepatocarcinogénicos y citotóxicos en células de mamíferos, con efectos estrogénicos, inmunotóxicos y eméticos, provocando daños intestinales, pulmonares, hepáticos y renales (Yu et al., 2021) (Figura 2).

Además, la ingestión de piensos contaminados con toxinas fusariales está relacionada con la leucoencefalomalacia en caballos, y con el síndrome de edema pulmonar e hidrotórax en cerdos (Kaminski et al., 2020).

6
Zearalenona
TOXINAS FUSARIALES
EFECTOS TÓXICOS
Leucoencefalomalacia
Edema pulmonar
Daño renal
Destrucción intestinal Daño hepático
Retraso en el crecimiento
Carcinogénesis
Toxicidad reproductiva
Disminución de la fertilidad
Neurotoxicidad
Hepatotoxicidad
Nefrotoxicidad
ANIMALES Y HUMANOS
CEREALES Y PIENSOS
Fumonisinas
Los esfingolípidos derivados de FB1 presentan un intrincado protagonismo en muchos procesos de la función celular.
La acumulación de bases esfingoides inhibe el crecimiento celular, provocando citotoxicidad e interfiriendo con la proteína quinasa C, la Na+/K+ ATPasa, desencadenando o limitando las enzimas implicadas en las vías de señalización lipídica y activando la fosfolipasa D, así como interfiriendo con la desfosforilación de la proteína retinoblastoma.
Este proceso aumenta el riesgo de cáncer a través de mediadores lipídicos y apoptosis que controlan la proliferación celular.
La inhibición de la ceramida sintasa provoca la acumulación de esfinganina libre en los riñones, hígado y pulmones.
Este compuesto hidrófobo es capaz de atravesar las membranas celulares y aparece en orina y sangre.
Este mecanismo afecta al riñón e hígado en la mayoría de los animales aumentando la necrosis oncótica, la regeneración, la apoptosis y la hiperplasia de los conductos biliares (Liu et al., 2019).
Por ello, la Agencia Internacional para la Investigación del Cáncer (IARC) considera a la FB1 un carcinógeno del Grupo 2B en humanos desde 2002.
Las fumonisinas también son conocidas por ser fitotóxicas.
Los estudios han demostrado que la FB1 es perjudicial para el bledo, cáñamo de río y lenteja de agua, causando pérdida de clorofila y retraso del crecimiento.
7
Figura 2. Efectos tóxicos de las micotoxinas fusariales.
Zearalenona Tricotecenos
La ZEN es citotóxica, lo que provoca una disminución de la fertilidad, así como efectos antiandrogénicos en cerdos, vacas y ovejas (Feizollhi et al., 2020).
El núcleo 12,13-epoxi-tricotec-9-eno que se encuentra en los tricotecenos es necesario para su toxicidad, ya que inhibe la síntesis de ADN y ARN, afecta a la integridad intestinal y provoca inmunotoxicidad y efectos eméticos.
Remediación de toxinas fusariales
Debido a la toxicidad de las toxinas de fusariales, es importante implementar medidas para reducir la contaminación en matrices de alimentos y piensos para disminuir el riesgo de peligros para la salud entre humanos y animales (Buszewska-Forajta et al., 2020).
Organizaciones internacionales como la Agencia Europea de Seguridad Alimentaria (EFSA), la Organización Mundial de la Salud (OMS) y la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) han establecido estrictas medidas de control, fijando límites máximos de residuos en alimentos y piensos, por ejemplo:
FB1 y FB2 total: 2000 µg/kg en harina de maíz
ZEN: 0,25 µg/kg en cereales/piensos
DON: 2000 µg/kg en trigo, cebada y maíz
(Schrenk et al., 2020)
En este contexto, se han puesto en marcha muchas estrategias de remediación, incluidos métodos físicos, químicos y biológicos (Li et al., 2021).
8
Biodegradación de toxinas fusariales
Los métodos de detoxificación biológica son eficaces, específicos y respetuosos con el medio ambiente.
Aunque los microorganismos utilizados en ellas tienen el factor limitante de requerir ciertas condiciones de crecimiento, debido a sus enormes aplicaciones beneficiosas para la degradación de toxinas, la biodegradación de toxinas fusariales con bioadsorbentes y enzimas es una estrategia prometedora que ha atraído la atención de la comunidad científica (Deepa et al., 2021) (Figura 3).
TRICOTECENOS Y ZEARALENONA
Proceso de degradación
Fumonisina B1 (FB1)
ENZIMAS
Esterasa, lacasa, proteasa, endoenzimas, exoenzimas, enzimas intracelulares, peptidasas
MECANISMOS
Desoxidación, desacilación, descarboxilación, glicolización, reducción, escisión del anillo lactónico, adsorción, oxidación

Fumonisina B1 hidrolizada (HFB1)
Productos tóxicos reducidos
Los grupos tóxicos de las fumonisinas, como el grupo del ácido tricarboxílico (-TCA) y el grupo amino (-NH2), inhiben la esfingosina N-acetiltransferasa durante el metabolismo de los esfingolípidos, bloqueando la señalización de los esfingolípidos y afectando a la diferenciación, la apoptosis y la proliferación celular.
9
Figura 3. Biodegradación de toxinas fusariales.
Biodegradación de fumonisinas
La enzima carboxilesterasa que degrada la FB1 puede eliminar el grupo -TCA, dando lugar a la formación de fumonisina B1 hidrolizada (HFB1) con efectos menos nocivos que la FB1 (Alberts et al., 2019).
Se ha demostrado que la presencia de FB1 en las células intestinales inhibe la enzima ceramida sintasa, formando N-acil HFB1 acetilado, que es más tóxico que el HFB1, reduciendo el peso corporal y alterando el equilibrio microbiano intestinal en pollos de engorde (Yu et al., 2022).
En un estudio, se diseñó una enzima de fusión para la degradación de FB1 utilizando carboxilesterasa y aminotransferasa. Esta enzima se clonó en el vector pPIC9K, se expresó con éxito en el hospedador Pichia pastoris GS115 y se denominó FUMD1.
Evaluada en células GES-1, demostró ser segura para controlar la contaminación por FB en piensos y alimentos (Li et al., 2022).

Las cepas IS1/1 y SC82 de Saccharomyces cerevisiae degradaron el FB1 en un 45% y un 22%, y la mezcla de FB1 y FB2 en un 50% y un 25%, respectivamente.
Camilo et al. (2000) aplicaron tres cepas de especies de Bacillus (S9, S10, S11) que degradaron el FB1 en un 43%, 48% y 83%, respectivamente.
La degradación completa de FB1 se observó 24h después de aplicar la cepa NCB 1492 y el consorcio bacteriano SAAS79 (Benedetti et al., 2006).
La enzima FumD degradó completamente FB1 a HFB1 en duodeno y yeyuno de cerdos en pavos (Schaumerger et al., 2016).
La levadura negra Exophiala spinifera degradó FB1 a AP1 (Poliolamina) y 2-OP1 por la enzima extracelular carboxilesterasa.
Recientemente, se demostró que Azotobacter es una bacteria clave para la degradación de FB1, reportando un 98% de degradación después de una incubación de 2 horas (Deepa et al., 2022).
Deepthi et al. (2016) informaron de la degradación de FB1 en un 61,7% tras el tratamiento con Lactobacillus plantarum MYS6.
10
Biodegradación de ZEN, DON, DAS y toxina T-2
Algunas bacterias lácticas, como Pseudomonas otitidis (Tan et al., 2015), cepas K408/ AK37 de Rhodococcus pyridinivorans (Cserhati et al., 2013) y cepa ANSB01E de Bacillus velezensis (Guo et al., 2019) degradan y detoxifican ZEN y toxina T-2 simultáneamente (Barlkiene et al., 2018).
Saccharomyces cerevisiae CECT 1891 y L. acidophilus 24 actúan como adsorbente, degradando ZEN, DON y FB1 (Campaginolloo et al., 2015).

La enzima lacasa Ery4 de Pleurotus eryngii degrada múltiples micotoxinas, incluyendo FB1, ZEN y toxina T-2 (Lio et al., 2018).
La microbiota aislada de intestinos de pollo tuvo la capacidad de degradar a cerca de 12 tricotecenos a través de la desepoxidación y la diacilación (Young et al., 2007).
La microbiota de la rata, a través de la desepoxidación, transformó la toxina T-2 en toxina HT-2, así como desepoxiló el triol T-2 y el DAS en desepoxiscirpentriol y desepoximoniacetoxiscirpenol.
La microbiota intestinal de los cerdos degradó la ZEN mediante hidrólisis en α-zearalenol y el DON en DON de-epoxi mediante un mecanismo de de-epoxidación.
No obstante, ciertos informes sugieren que los productos derivados de ZEN son más tóxicos que la ZEN (zearalenol > α-zearalanol > zearalenona > β-zearalenol) (Krol et al., 2018).
Las especies de Eggerthella DII-9 degradan hasta un 86% de tricotecenos (DON, T2 triol, HT-2, T-2 tetraol) a través de la desepoxidación (Gao et al., 2018).
Bacillus pumilus ES-21 degradó ZEN más del 95,7% con liberación del producto degradado 1-(3,5-dihidroxifenil)-60hidroxi-l0-undecen-l00-ona a través de la actividad esterasa (Wang et al., 2017).
Bacillus amyloliquifaciens degradó ZEN a través de enzimas extracelulares sin ningún derivado (Xu et al., 2016).
Nueve agentes de biocontrol de Aspergillus y Rhizopus detoxificaron el ZEN, dando lugar a cinco compuestos degradados α-zearalenolsulfato, ZEN- O-16-glucósido, α-zearalenol, ZEN-14-sulfato y ZEN-O-14 (Koch et al., 2014)
Las especies Bifidobacterium y Lactococcus lactis aisladas de la leche neutralizaron el ZEN mediante un proceso de absorción de hasta el 88% (Mokoena et al., 2005).
CONCLUSIONES
La contaminación de alimentos y piensos con toxinas fusariales supone un grave riesgo para la salud humana y animal, por no hablar de los costes económicos que suponen para los agricultores.
La biodegradación desempeña un papel dinámico como método fiable, eficaz, sencillo, respetuoso con el medio ambiente y menos costoso en comparación con otros métodos.
Sin embargo, todavía se dispone de poca información sobre los mecanismos implicados en la degradación de las toxinas de la fusariosis.
Por lo tanto, es necesario llevar a cabo más investigaciones para arrojar luz sobre estos procesos y sus posibles aplicaciones en el campo.

 N. Deepa y M.Y. Sreenivasa Laboratorio de Micotoxicología Molecular, Departamento de Estudios en Microbiología, Universidad
N. Deepa y M.Y. Sreenivasa Laboratorio de Micotoxicología Molecular, Departamento de Estudios en Microbiología, Universidad
















