





SPECIALE 15° CONGRESSO NAZIONALE con la collaborazione di












SPECIALE 15° CONGRESSO NAZIONALE con la collaborazione di





Guida alla interpretazione delle immagini: Ecografia, OCT, OCTA, Fluorangiografia
Luisa Pierro




Volume 1

Volume 2

FABIANO GRUPPO
EDITORIALE
Redazione: Strada 4 Milano Fiori, Palazzo Q7 – 20089 Rozzano (MI) Sede operativa: FGE srl – Regione Rivelle 7/F – 14050 Moasca (AT) Tel. 0141 1706694 – Fax 0141 856013 – e-mail: info@fgeditore.it – www.fgeditore.it
Giuseppe Lo Giudice
La saldatura corneale laser-assistita
Luca Menabuoni
Il cambiamento climatico e dry eye
Luigi Marino
Topografia corneale
Massimo Camellin, Umberto Camellin
Approfondimenti in collaborazione con le aziende del settore Board
M. Borgioli
L. Menabuoni
S. Zuccarini
M. Camellin
U. Camellin
G. Lo Giudice
L. Marino
Editore
FGE S.r.l
Fabiano Gruppo Editoriale
Redazione: Strada 4 Milano Fiori, Palazzo Q7 20089 Rozzano (MI)
Sede legale: Regione Rivelle, 7 14050 Moasca (AT) Tel. 0141 1706694 - Fax 0141 856013
Pubblicità info@fgeditore.it tel. 0141 1706694
Direttore responsabile
Ferdinando Fabiano f.fabiano@fgeditore.it
Registrazione presso il Tribunale di Asti N. 02/2024 in data 14 marzo 2024
© Copyright FGE srl È vietata ogni riproduzione totale o parziale di testi e immagini




Le lenti Essilor® Stellest® rallentano la progressione della miopia del 67%(1)
Le lenti Stellest® sono la soluzione visiva di Essilor® progettata per contrastare la miopia dei tuoi bambini. Rallentano in media del 67%(1) la progressione della miopia rispetto alle lenti monofocali, se indossate 12 ore al giorno.
(1) Rispetto alle lenti monofocali, se indossate dai bambini almeno 12 ore al giorno, tutti i giorni. Bao, J., Huang, Y., Li, X., Yang, A., Zhou, F, Wu, J., Wang, C., Li, Y., Lim, E.W., Spiegel, D.P. Drobe, B., Chen, H., 2022. Spectacle Lenses With Aspherical Lenslets for Myopia Control vs Single-Vision Spectacle Lenses: A Randomized Clinical Trial. JAMA Ophthalmol. 140(5), 472-478. https:/doi.org/10.1001/ jamaophthalmol.2022.0401. Essilor® e Stellest® sono marchi registrati di Essilor International. Montatura Ray-Ban®

Inquadra il QR Code per guardare il video
EssilorLuxottica ha partecipato al World Congress of Pediatric Opthalmology and Strabismus , dove esperti internazionali tra cui il Professor Aldo Vagge*, hanno discusso della promettente combinazione di lenti Essilor® Stellest® e atropina, e dell’importanza del tempo all’aria aperta e della protezione solare.
*Professore Associato, Clinica Oculistica, Università di Genova, IRCCS Policlinico San Martino




Complimenti a noi tutti per il traguardo raggiunto!
È evidente che questo primo anno di vita del giornale abbia rappresentato una fase di apprendimento e crescita e, il fatto di riconoscere le sfide affrontate, è un segno di maturità e serietà nel nostro lavoro.
Il quarto volume, descritto come il più vero e sofferto, sembra promettere una riflessione profonda e autentica sul percorso già intrapreso. È bello vedere come l'interazione con i lettori abbia contribuito a migliorare e a definire meglio ciò che vogliamo comunicare.
Sicuramente, la consapevolezza delle trasformazioni delle nostre società scientifiche e la volontà di adattarsi sono fondamentali per un'informazione di qualità.
Continueremo a coinvolgere i nostri lettori, poiché il vostro supporto sarà essenziale per affrontare le nuove sfide.
Buona lettura a tutti!
Giuseppe Lo Giudice
Specialista in patologie della retina - Chirurgo vitreoretinico
Direttore U.O.C. di Oculistica - Ospedali Riuniti Padova Sud
ULSS 6 - Euganea
1.1 Definizione e cenni di eziopatogenesi
Secondo l'IMI (International Myopia Institute),(1) la miopia patologica è considerata un allungamento assiale eccessivo del bulbo oculare capace di determinare cambiamenti strutturali nel segmento posteriore dell'occhio (inclusi lo sviluppo di uno stafiloma miopico, la maculopatia miopica e la neuropatia ottica associata a miopia elevata) ed essere la causa della perdita della migliore acuità visiva corretta. Il termine "miopia patologica" viene spesso ed erroneamente confuso con "miopia elevata". Infatti, queste due entità sono nettamente diverse; la miopia elevata è definita come un alto grado di errore refrattivo miopico, mentre la "miopia patologica" è caratterizzata dalla presenza di tipiche lesioni miopiche, caratterizzati da cambiamenti degenerativi che si verificano soprattutto a carico del polo posteriore del globo oculare. Le lesioni miopiche caratteristiche della miopia patologica includono una maculopatia miopica uguale o più grave dell'atrofia corioretinica diffusa (uguale alla categoria (2) secondo la classificazione per la miopia patologica 2) e/o la presenza di uno stafiloma posteriore.(3) I valori limite dell'errore refrattivo miopico e della lunghezza assiale non sono stati stabiliti per la definizione di miopia patologica perché è stato evidenziato come uno stafiloma posteriore si possa verificare in occhi con lunghezza assiale normale (4) o in occhi con una lunghezza assiale inferiore a 26,5 mm, (5) sebbene una lunghezza assiale elevata sia uno dei fattori di rischio per le complicazioni del fondo. La presenza di uno stafiloma posteriore è il reperto più caratteristico e il principale marcatore della miopia patologica. Tuttavia, mentre la maggior parte degli oftalmologi concorderebbe sul fatto che lo stafiloma posteriore sia probabilmente una delle cause principali della maculopatia miopica, non può essere considerato l'unica causa, dato che anche l'allungamento assiale senza stafiloma posteriore può portare alla maculopatia miopica, sebbene ciò sia molto meno


Giuseppe Lo Giudice
comune. È probabile che un allungamento assiale eccessivo possa innescare uno stress nel polo posteriore che può portare alla comparsa di una degenerazione locale o diffusa della sclera e/o della retina e/o della coroide, e che una qualsiasi di queste alterazioni degenerative possa indurre alterazioni patologiche negli altri tessuti.
Poiché l'assottigliamento progressivo della coroide e la formazione di difetti della membrana di Bruch nella regione maculare sono fenomeni chiave associati alla maculopatia miopica, le lesioni della maculopatia miopica sono meglio classificate in base al loro aspetto nelle immagini della tomografia a coerenza ottica (OCT) piuttosto che in base alla morfologia rilevata nelle fotografie del fondo oculare. (6) Le scansioni OCT orizzontali della macula in pazienti con miopia elevata rivelano una concavità progressivamente crescente all'aumentare della lunghezza assiale e pendenze diverse a seconda delle dimensioni e della posizione dello stafiloma. Inizialmente, la concavità è minima, ma col tempo aumenta, arrivando a coinvolgere anche il disco ottico. In alcuni casi, il disco ottico può essere visto nella parte inferiore della concavità. Il profilo può essere regolare o, meno comunemente, presentare una chiara irregolarità. Nella maggior parte dei casi, le scansioni B verticali producono immagini regolari, dal profilo concavo ad eccezione della “Dome Shaped Macula”. È stato postulato come diversi meccanismi che coinvolgono il processo di emmetropizzazione e difetti strutturali nelle fibre di collagene, possano causare lo stafiloma posteriore. Negli occhi fortemente miopi, lo stafiloma posteriore sembra essere correlato a una struttura sclerale alterata. Grossniklaus e Green (7) hanno valutato le caratteristiche istologiche di 308 occhi fortemente miopi, scoprendo che i due riscontri istologici più comuni erano una configurazione miopica del nervo ottico (un disco “tiltato” in quasi il 40% degli occhi) e uno stafiloma (35% degli occhi), loca-
lizzato principalmente al polo posteriore polo posteriore. I cambiamenti sclerali negli occhi fortemente miopi comportano un assottigliamento diffuso o locale, con fasci di collagene assottigliati, maggiore separazione interfibrillare, striature di collagene ridotte e una struttura lamellare simile a quella dello stroma corneale, che apparentemente consente lo scorrimento delle lamelle sclerali (8). Lo stafiloma posteriore è caratterizzato dalla presenza di un margine brusco. Rispetto alla retina normale, l'area ectasica presenta un pallore relativo associato a una maggiore visibilità dei vasi coroidali. Le caratteristiche dello stafiloma sono correlate all'entità dell'assottigliamento sclerale. Ohno-Matsui et al. hanno descritto la presenza di molteplici fossette coniche in occhi fortemente miopi (9). Tali autori hanno anche segnalato una condizione che assomiglia alla schisi sclerale peripapillare nelle aree limitrofe. Lo stafiloma posteriore è frequentemente associato all'atrofia corioretinica. Infatti, questi due segni sono i reperti maculari più comuni correlati alla miopia, che si verificano in circa il 20-23% degli occhi altamente miopi negli adulti (10) .
1.2 Classificazione
Di recente un gruppo internazionale di ricercatori sulla miopia ha esaminato studi precedenti ed ha proposto un sistema di classificazione semplificato e uniforme per la miopia (2). In questo sistema semplificato (la classificazione META-PM), le lesioni della maculopatia miopica sono suddivise in cinque categorie, da nessuna lesione retinica miopica (categoria 0), solo fondo “tassellato” (categoria 1), atrofia corioretinica diffusa (categoria 2), atrofia corioretinica a patch (categoria 3), ad atrofia maculare (categoria 4).
A queste categorie sono state aggiunte tre ulteriori caratteristiche, incluse come "segni plus": (1) “Laquer cracks”, (2) MNV miopica e (3) macchia di Fuchs. Il motivo per cui questi “segni plus” sono stati separati dalle categorie principali è che questi influenzano o potenzialmente possono influenzare l'acuità visiva centrale, svilupparsi o coesistere in occhi con qualsiasi categoria di maculopatia miopica. In base a questa classificazione, la miopia patologica è definita come uguale o maggiore della maculopatia miopica di categoria 2, o della presenza di una lesione plus, o della presenza di uno stafiloma posteriore. Sebbene la classificazione META-PM sia adatta a identificare vari stadi di maculopatia miopica, questa classificazione si basa solo su fotografie del fondo oculare che potrebbero portare a una diagnosi accurata delle lesioni atrofiche a causa delle diverse presentazioni visive
in base al grado di pigmentazione del fondo oculare tra le razze. Inoltre, altre lesioni maculari miopiche come la maculopatia da trazione miopica e la macula a cupola non sono state incluse. Pertanto, è stata sviluppata una classificazione basata su OCT. (6) Combinando i tratti distintivi della maculopatia miopica nella miopia patologica, è stata proposta una nuova classificazione. In questo nuovo sistema, si suggerisce che l'atrofia coroideale diffusa, venga chiamata "assottigliamento coroideale peripapillare" e "assottigliamento coroideale maculare". Sulla base di questi risultati, il valore di cut-off dello spessore coroideale come strumento diagnostico per l'atrofia diffusa è stato aggiunto a questo sistema. Vale a dire, l'assottigliamento coroideale peripapillare è definito come uno spessore coroideale inferiore a 56,5 μm a 3000 μm nasali dalla fovea e l'assottigliamento coroideale maculare è definito come uno spessore coroideale inferiore a 62 μm nella sottofovea. L'atrofia a chiazze e l'atrofia maculare correlata a CNV non sono semplicemente dovute all'atrofia, ma a fori nella membrana di Bruch. L'atrofia a chiazze è vista come una lesione ben definita, bianco-grigiastra, da una fotografia del fondo che raramente coinvolge la fovea centrale, che è appropriatamente chiamata "difetti della membrana di Bruch extrafoveali" dalla definizione OCT. Al contrario, i difetti della membrana di Bruch foveali sono chiamati atrofia maculare, ovvero categoria 4 nella classificazione META-PM, sia per la malattia correlata a CNV che per quella a chiazze. Inoltre, la maculopatia da trazione miopica e la Dome-Shaped macula, entrambe come potenziali complicazioni maculari che mettono a rischio la vista e che possono essere rilevate solo su OCT, sono incluse nella classificazione della maculopatia miopica basata su OCT. Ovviamente Sono necessari ulteriori studi per convalidare se i valori di cut-off dello spessore coroidale di una singola clinica per miopia elevata possano funzionare bene nella pratica clinica. Ulteriori studi dovrebbero indagare il ruolo della coroide nella miopia elevata, non solo tramite una misurazione dello spessore, ma anche esaminando altri parametri, come il flusso sanguigno coroidale e le caratteristiche morfologiche e vascolari della coroide. Studi longitudinali sul cambiamento coroidale ci aiuteranno a descrivere un quadro reale dei cambiamenti coroidali nei pazienti con miopia elevata.
Prevalenza e impatto sulla vista È stato riportato come la miopia patologica colpisce
fino al 3% della popolazione mondiale, con differenze di razza per quanto riguarda la prevalenza della malattia. (11) Circa l'1% al 3% degli asiatici e l'1% dei caucasici presentano miopia patologica. Tuttavia, la definizione di miopia patologica utilizzata in studi precedenti non era coerente e la miopia patologica veniva confusa con la miopia elevata. Pertanto, è necessario determinare una prevalenza accurata in base alla nuova definizione standard di miopia patologica. La miopia patologica causa problemi di vista o cecità nello 0,2%-1,5% degli asiatici e nello 0,1%-0,5% dei caucasici. (11) In particolare, è una delle principali cause di ipovisione nelle popolazioni in età lavorativa, così come nella popolazione anziana. In Asia, la miopia patologica è la principale causa di cecità irreversibile a Taiwan, Giappone e Cina. In Giappone, la miopia patologica è la terza causa di ipovisione bilaterale e la principale causa di cecità monoculare negli individui di età pari o superiore a 40 anni. (12) In Cina, la miopia patologica è la principale causa di cecità e ipovisione negli individui di età compresa tra 40 e 49 anni. (13) Nei paesi occidentali, la miopia patologica è la terza causa di cecità secondo lo studio di Rotterdam, lo studio della città di Copenhagen e lo studio della vista latino di Los Angeles. (14-15) Di recente, a causa di cambiamenti nei fattori ambientali e di stile di vita, la prevalenza della miopia e della miopia elevata è aumentata rapidamente. Pertanto, anche la prevalenza associata della miopia patologica potrebbe aumentare drasticamente nel prossimo futuro. La miopia elevata può essere definita come un errore refrattivo di almeno -5,00 diottrie (D). (16) La miopia elevata è collegata alla miopia patologica. La maggior parte della miopia patologica si verifica in occhi con miopia elevata, sebbene anche la miopia bassa e alcuni individui con emmetropia svilupperanno miopia patologica. Circa il 28,7%, il 44,4%, il 45,9%, il 47,6%, il 58,31%, il 72,7% e il 65% dei casi di miopia elevata nelle popolazioni adulte o anziane presentano miopia patologica del sudest asiatico. Ciò significa che circa la metà dei soggetti con miopia elevata nella popolazione adulta svilupperebbe miopia patologica.
Circa il 22,9% della popolazione mondiale ha avuto una diagnosi di miopia nel 2000 e l'11,6% aveva una miopia elevata tra la popolazione miope. Si stima che entro il 2050, circa la metà della popolazione mondiale avrà la miopia e fino a un quinto della popolazione miope sarà altamente miope. (23) Pertanto, le aree con alti tassi di prevalenza della miopia avrebbero tassi più elevati di miopia elevata e miopia patologica. La
miopia patologica sarà associata a un numero elevato di individui affetti da deficit visivo e avrà un impatto negativo significativo sulla società. Il grado di miopia è associato al rischio di miopia patologica. La prevalenza di miopia patologica è solo dell'1% al 19% nella popolazione con miopia da bassa a moderata (-3 D), ma la sua prevalenza è alta quanto il 50% al 70% nella popolazione con miopia elevata. (18, 19, 20) Un aumento di 1 D della miopia è associato a un aumento del 67% della prevalenza di miopia patologica. (21) Si osserva un andamento lineare per l'aumento delle diottrie di miopia fino a -7,00 D, seguito da un andamento esponenziale nei tassi di prevalenza di miopia patologica. (22)
L'età è un fattore importante nello sviluppo della miopia patologica. La prevalenza della miopia patologica è bassa nei bambini e negli adolescenti, ma aumenta con l'avanzare dell'età. Negli individui con miopia elevata di età pari o superiore a 40 anni, è stato notato un aumento progressivo della prevalenza e della gravità della maculopatia. La maculopatia miopica è rara nei bambini con miopia elevata. (23) Tuttavia, uno studio di follow-up a lungo termine ha dimostrato che l'83% degli adulti con miopia patologica e maculopatia miopica aveva già sofferto di atrofia coroideale diffusa attorno al disco ottico durante l'infanzia. (24) Questa scoperta ha suggerito la possibilità che i bambini, che alla fine sviluppano miopia patologica, possano essere molti anche in età precoce.
Dal punto di vista epidemiologico esistono due tipi di miopia: miopia congenita o miopia infantile e miopia acquisita o miopia scolastica. La miopia congenita ha aggregazione familiare ed è fortemente influenzata da fattori genetici. Tuttavia, la prevalenza della miopia congenita è bassa, inferiore all'1% nella popolazione caucasica. (25) Il grado iniziale di miopia infantile è spesso elevato e si osserva anche una progressione della miopia. Una durata di vita più lunga con miopia elevata può essere collegata all'elevata prevalenza di miopia patologica.
La miopia acquisita o scolastica si verifica nei bambini che sviluppano la miopia nella scuola primaria o nei primi anni della scuola secondaria, ad esclusione della miopia congenita con forte ereditarietà familiare. Va notato che, a partire dai 6 anni, il tasso di progressione annuale per i bambini con miopia è di circa 1 D fino alla fine dell'adolescenza, con lo sviluppo di miopia elevata tra gli 11 e i 13 anni. (26) Considerato il boom della miopia nei bambini in tutto il mondo, la gravità della miopia patologica associata alla compromissione della vista è prevedibile. Nel caso della
miopia acquisita, potrebbe esserci una predisposizione genetica dovuta a una variazione nella prevalenza osservata in diverse aree. Sebbene siano state trovate più di 200 varianti genetiche associate alla miopia, nessuna contribuisce in modo predominante alla miopia acquisita. (27) Pertanto, i fattori ambientali svolgono un ruolo più importante nello sviluppo della miopia e della miopia elevata. I fattori di rischio includono stress educativo, tempo e intensità vicino al lavoro e mancanza di tempo all'aria aperta. (28, 29) Inoltre, l'aumento del tempo trascorso davanti allo schermo digitale a causa dell'era degli smartphone e la popolarità dell'istruzione online dovuta alla pandemia di coronavirus del 2019 potrebbero aggravare la prevalenza della miopia nel prossimo futuro. (30) Studi di associazione genomica (GWAS) hanno identificato più di centinaia di geni di suscettibilità alla miopia. (31) Tuttavia, il background genetico della miopia patologica non è stato chiarito completamente. Ad esempio, si sa poco se tutti i soggetti con miopia elevata abbiano lo stesso rischio di sviluppare miopia patologica o se il rischio di sviluppare miopia patologica dipenda dal background genetico del paziente. Diversi studi hanno esaminato l'associazione tra neovascolarizzazione maculare miopica (MNV) e geni di suscettibilità per miopia, miopia elevata e AMD. Tra i geni di suscettibilità per AMD e i geni correlati, ARMS2, CFH, C2/CFB, C3, CFI, ABCA1, APOE, LIPC, CETP, TIMP3, COL8A1, COL10A1, VEGFA e PEDF sono stati valutati per la loro associazione con MNV. CFI, COL8A1 e PEDF sono stati suggeriti come geni di suscettibilità per MNV, (32) ed è stato riportato che VEGFA è associato alle dimensioni di MNV e alla prognosi visiva dopo il trattamento per MNV. (33) Tuttavia, queste associazioni non sono state confermate in studi successivi. Tra i geni di suscettibilità alla miopia e alla miopia elevata, GJD2, RASGRF1, TOX, RDH5 e SHISA6 sono stati valutati per l'associazione con MNV, ma non è stata trovata alcuna associazione. (34) Nel 2019, la distribuzione del genotipo di 50 geni di suscettibilità alla miopia è stata confrontata tra 348 casi altamente miopi con maculopatia miopica e 898 controlli altamente miopi senza maculopatia miopica, ma nessuno dei geni ha mostrato un'associazione significativa con la maculopatia miopica negli occhi altamente miopi. (35)
Un GWAS sulla maculopatia miopica in una popolazione giapponese ha identificato CCDC102B come un gene di suscettibilità per la maculopatia miopica. (36) La distribuzione del genotipo di CCDC102B era significativamente diversa tra i 1381 casi altamente
miopi con maculopatia miopica e i 936 controlli altamente miopi senza maculopatia miopica. Al contrario, CCDC102B non era significativamente associato alla lunghezza assiale e precedenti GWAS sulla miopia non hanno riportato alcuna associazione tra CCDC102B e miopia. CCDC102B è un gene di suscettibilità per la maculopatia miopica, ma non per la miopia. Dato che il background genetico per lo sviluppo della miopia e il background genetico per lo sviluppo della maculopatia miopica sono diversi, saremmo in grado di sviluppare metodi preventivi per la maculopatia miopica, anche per i pazienti che hanno già sviluppato miopia o miopia elevata. Il ruolo del CCDC102B nello sviluppo della maculopatia miopica dovrebbe essere chiarito. La scoperta di CCDC102B suggerisce che potremmo essere in grado di prevenire lo sviluppo della maculopatia miopica, anche dopo lo sviluppo di miopia elevata. Per controllare lo sviluppo di miopia patologica in pazienti con miopia elevata, ulteriori studi devono scoprire più geni di suscettibilità per la maculopatia miopica che non siano associati a miopia elevata. Poiché lo stafiloma posteriore è associato a maculopatia miopica in occhi con miopia elevata, l'identificazione di geni di suscettibilità per lo stafiloma posteriore e/o la forma posteriore dell'occhio contribuirebbe anche al controllo futuro dello sviluppo di miopia patologica. La forma posteriore del fondo può essere valutata quantitativamente utilizzando OCT. (37) GWAS sulla forma del fondo potrebbero essere in grado di scoprire geni associati alla forma del fondo e/o allo stafiloma e contribuire al controllo futuro dello sviluppo di miopia patologica.
Una delle caratteristiche che contraddistingue la miopia patologica è il possibile sviluppo di complicanze potenzialmente impattanti per la conservazione della capacità visiva. La complicazione più importante della miopia è la degenerazione maculare miopica (DMM), che è una causa comune di deficit visivo, seguita dal distacco di retina (RD), cataratta, glaucoma ad angolo aperto. Per la cataratta, la relazione con la miopia è meno evidente. In particolare, la cataratta nucleare può causare uno spostamento miopico, che ostacola la determinazione dell'errore refrattivo originale. Considerando il glaucoma ad angolo (OAG) aperto Perkins et al. (38) hanno già pubblicato nel 1982 una percentuale più alta di pazienti miopi nella popolazione OAG. Una meta-analisi condotta su 11 studi basati sulla popolazione ha inoltre identificato un rischio aumentato di OAG per i soggetti miopi. (39) Non è ancora chiaro se la progressione del campo
visivo nei miopi sia simile a quella di altri pazienti con OAG. Sebbene l'associazione con le complicazioni miopiche sia stata ben stabilita, le stime precise del rischio di MMD, RD, cataratta e OAG per grado di miopia sono ancora sconosciute.
La prevalenza di MMD derivante dalle meta-analisi, che includono studi basati sulla popolazione, hanno rilevato un OR aumentato per qualsiasi miopia (OR, 102,11; intervallo di confidenza al 95% [CI], 52,60-198,22, eterogeneità moderata); miopia bassa (OR, 13,57; IC al 95%, 6,18-29,79, eterogeneità elevata); miopia moderata (OR, 72,74; IC al 95%, 33,18-159,48, eterogeneità moderata); e miopia alta (OR, 845,08; IC al 95%, 230,05-3104,34, nessuna eterogeneità) (40-43). tutti gli studi hanno mostrato una BCVA peggiore negli occhi con MMD rispetto agli occhi senza MMD. L'atrofia maculare ha avuto il maggiore impatto sulla BCVA, seguita da CNV, atrofia a chiazze, atrofia diffusa o crepe laccate secondo uno studio longitudinale su pazienti con MMD in Giappone. I pazienti con solo un fondo tassellato non avevano una BCVA ridotta. (44) La progressione della MMD verso stadi più gravi era più frequente nei pazienti più anziani. Nel caso del DR, esiste un rischio aumentato in tutti i gruppi di miopia, con un rischio più elevato per quelli con miopia più grave. Le analisi aggregate hanno rivelato un OR aumentato per qualsiasi miopia (OR, 3,45; IC al 95%, 1,0811,00, nessuna eterogeneità); miopia bassa (OR, 3,15; IC al 95%, 1,92-5,17, nessuna eterogeneità); miopia moderata (OR, 8,74, IC al 95%, 7,28-10,50, nessuna eterogeneità); e miopia elevata (OR, 12,62; IC al 95%, 6,65-23,94, nessuna eterogeneità). L'OR per la miopia moderata era già 8,7 e, data la frequenza relativamente alta di miopi in questa categoria, si prevede che la prevalenza di RD aumenterà drasticamente. l'idea che i tassi di RD aumenteranno quando la miopia diventerà più prevalente è molto forte. Esite una forte associazione tra miopia, cataratta a sottocoppa posteriore e cataratta nucleare, ma non tra miopia e cataratta corticale. Tale associazione può trovare spiegazione in tre possibile cause patogenetiche: 1) livello più elevato di stress ossidativo causato da una più rapida liquefazione del vitreo o da un livello ridotto di glutatione; 2) livello più elevato di sottoprodotti della perossidazione lipidica nella miopia può aumentare la formazione di cataratta; 3) ridotta diffusione dei nutrienti dalla camera posteriore al cristallino causando la cataratta. La cataratta è un disturbo che può essere risolto piuttosto facilmente mediante estrazione chirurgica. Nei pazienti miopi,
tuttavia, i report suggeriscono un rischio aumentato di RD postoperatorio ad anche se il lungo intervallo tra estrazione chirurgica e RD in alcuni studi rende improbabile una relazione causale diretta sono giustificati un'attenta ispezione preoperatoria per le rotture della retina e un trattamento profilattico con laser. L'associazione positiva tra miopia e OAG è in linea con i precedenti report. (45) Distinguere la neuropatia ottica miopica dall'OAG rimane una sfida e potrebbe aver portato a una classificazione errata e a stime non valide dell'OR calcolato. Il meccanismo sottostante a una predisposizione all'OAG non è ancora chiaro. È possibile che una lunghezza assiale maggiore porti all'inclinazione del disco ottico e potrebbe eventualmente causare danni agli assoni nella lamina cribrosa. L'OAG miopica difficilmente progredisce verso difetti del campo visivo centrale. In conclusione Uno su tre miopi elevati è a rischio di ipovisione bilaterale con l'età. I miopi bassi e moderati hanno meno probabilità di sviluppare un esito visivo così grave; tuttavia, sono a rischio significativo di sviluppare MMD, RD, cataratta e OAG. Ciò non riguarda solo il singolo paziente, ma ha un impatto importante sull'assistenza sanitaria e sulla società, in particolare perché le generazioni future potrebbero diventare ancora più miopi. La consapevolezza delle complicazioni della miopia è fondamentale e una strategia globale per la prevenzione e il trattamento della progressione della miopia dovrebbe diventare una priorità.
1.4 Percorsi di prevenzione
Misure preventive della malattia in generale e dei sottotipi/complicanze in particolare abbinate al
Il peso della miopia è enorme, poiché gli adulti con miopia elevata hanno maggiori probabilità di sviluppare cambiamenti della miopia patologica che possono portare alla cecità. Di conseguenza, sono necessarie misure preventive per ogni fase della progressione della miopia verso la perdita della vista. Gli approcci per prevenire la cecità correlata alla miopia dovrebbero quindi tentare di prevenire o ritardare l'insorgenza della miopia tra i bambini; ritardare la progressione da miopia bassa/lieve a HM, attraverso interventi ottici (ad esempio, lenti a contatto morbide con defocus incorporato, ortocheratologia e lenti progressive-addizionali) e farmacologici (ad esempio, basse dosi di atropina); e/o ritardare la progressione attraverso trattamenti medici/chirurgici (ad esempio, terapie anti-VEGF, buckling maculare e crosslinking sclerale). Nel caso specifico della miopia patologica il
concetto di prevenzione si deve esplicare attraverso la possibilità di evitare l’insorgenza delle complicanze associate ad essa. Nei pazienti con miopia patologica possono svilupparsi varie complicazioni che mettono a rischio la vista, tra cui stafiloma posteriore, atrofia corioretinica, atrofia dell'epitelio pigmentato retinico, crepe della lacca, neovascolarizzazione coroideale (CNV), foveoschisi miopica e foro maculare miopico (MH). Tra queste, la CNV miopica (mCNV) è una delle condizioni più gravi che mettono a rischio la vista, che si verifica nel 5%-10% degli occhi altamente miopi.
Criteri diagnostici (segni, sintomi e valutazioni clinico-strumentali) della malattia in generale e dei sottotipi/complicanze in particolare abbinate al
Le caratteristiche dei test diagnostici variano in base al tipo di aspetto clinico della degenerazione maculare miopica. In questo senso la fluorangiografia con fluoresceina e in parte l’angiografia con ICG insieme all’esame OCT rappresentano i test diagnostici di riferimento nella gestione clinica, diagnostica e terapeutica della DMM. Le caratteristiche dei test diagnostici sono dipendenti dal tipo di quadro clinico in corso di DMM. Nel caso dell'atrofia coroideale diffusa all’angiografia con fluoresceina (FA) si rileva una lieve iperfluorescenza dovuta alla colorazione dei tessuti nella fase tardiva dell'angiogramma. Nell'angiografia con verde di indocianina (ICGA), si può osservare una pronunciata diminuzione dei capillari coroidali e dei vasi coroidali di medie e grandi dimensioni nell'area di atrofia diffusa. L'OCT mostra un marcato assottigliamento della coroide nell'area di atrofia diffusa. Lo spessore coroidale subfoveale negli occhi con atrofia maculare diffusa è solitamente inferiore a 100 μm e lo spessore coroidale medio è di 50 μm sulla base di uno studio clinico. (6) Nella maggior parte dei casi, la coroide è quasi assente, sebbene siano sporadicamente presenti grandi vasi coroidali. Con l'uso dell'OCTA (OCT-angiography), è possibile rilevare un'alterazione del flusso coriocapillare, anche se la visualizzazione della circolazione corioideale rimane una sfida per l'interpretazione negli occhi con miopia patologica. L'OCTA negli occhi con atrofia diffusa mostra la coriocapillare a bassa densità, con la presenza di vasi corioideali medi e grandi.
Nell’atrofia coroideale a chiazze la FA e ICGA mostrano un difetto di riempimento coroidale nell'area di atrofia a chiazze, suggerendo che questa lesione è
una chiusura completa della coriocapillare. (46) Utilizzando l'OCT, l'atrofia a chiazze è caratterizzata dalla mancanza di RPE e retina esterna con perdita della maggior parte della coroide. Pertanto, gli strati retinici interni hanno un contatto diretto con la superficie sclerale interna. L'OCT swept source ha anche mostrato discontinuità della membrana di Bruch nell'area di atrofia a chiazze. (47) L'RPE termina all'esterno del margine del difetto della membrana di Bruch maculare. L'atrofia a chiazze potrebbe essere considerata una rottura della membrana di Bruch, non solo un'atrofia. La diagnosi delle laquer cracks viene effettuata in base all'imaging multimodale. L'ICGA è considerata il gold standard per la rilevazione delle crepe della lacca, osservata come ipofluorescenza lineare nella fase tardiva. (48) Su FA, le stesse mostrano un'iperfluorescenza lineare costante durante l'intera fase angiografica, un difetto finestra dovuto all'atrofia dell'RPE che ricopre i difetti della membrana di Bruch nella fase iniziale e una colorazione del tessuto cicatriziale che riempie il difetto della membrana di Bruch nella fase tardiva. L'autofluorescenza del fondo mostra ipoautofluorescenza, che è dovuta all'RPE atrofizzato che ricopre la rottura. Le laquer cracks al contrario vengono facilmente non evidenziate sull'OCT perché sono troppo strette per essere rilevate. Tuttavia, quando le lesioni sono all'interno delle scansioni OCT, appaiono come discontinuità dell'RPE e una trasmissione aumentata nel tessuto più profondo oltre l'RPE. (49)
I test diagnostici risultano di importanza fondamentale in corso di CNV. Su OCT, la CNV miopica si presenta come un'area altamente riflettente contigua sopra l'RPE (CNV di tipo 2), solitamente con fluido sottoretinico minimo (SRF). La diagnosi clinica di CNV miopica è solitamente confermata alla FA, con una iperfluorescenza ben definita nella fase iniziale e leakage nella fase tardiva in un classico schema CNV. Più di recente, è stato dimostrato che l'OCTA rileva la CNV miopica in modo non invasivo con elevata sensibilità e specificità. (50) Il vantaggio principale dell'OCTA risiede nella sua natura non invasiva, che consente di eseguire scansioni ripetute a ogni visita. Pertanto, alcuni centri ora accettano che la diagnosi di CNV miopica venga effettuata tramite entrambe le forme di angiografia. Tuttavia, poiché l'OCTA è una tecnologia relativamente nuova, gli utenti devono essere consapevoli delle limitazioni, tra cui vari artefatti ed errori di segmentazione. (51) Una limitazione principale dell'OCTA è che l'attività non può essere valutata in modo affidabile sulla base della sola OCTA. Si
raccomanda pertanto di interpretare l'OCTA insieme all'OCT strutturale per valutare completamente la presenza, il tipo, l'area e l'attività della CNV. In conclusione, la FA appare fondamentale nel fornire informazioni dettagliate sul tipo e l'attività della CNV miopica e aiuta a pianificare il trattamento. Può aiutare a distinguere tra emorragia da una CNV miopica rispetto a una laquer crack, con quest'ultima che mostra fluorescenza da impregnazione.
L’OCT è adatto per la diagnosi e il monitoraggio dell'atrofia dell'epitelio pigmentato retinico, della CNV miopica e della maculopatia trazionale miopica. L'OCT fornisce una misurazione regolare dello spessore retinico e coroidale e del fluido sottoretinico o intraretinico. Evidenzia anche la presenza di fori maculari, retinoschisi o distacchi. La dome-shaped maculopathy è meglio visualizzata su sezioni OCT radiali o verticali
Altri test, come l'angiografia OCT, l'ecografia, la risonanza magnetica per immagini e l'angiografia con verde di indocianina, possono essere utili per valutare la forma e la perfusione della retina e della coroide. Tuttavia, questi test sono raramente utilizzati in un contesto clinico.
Aspetti clinici della miopia patologica
La degenerazione maculare miopica (DMM), è una caratteristica fondamentale della miopia patologica.
a) Stafiloma posteriore
Gli stafilomi posteriori sono i tratti distintivi della miopia patologica e sono tra le altre cause principali o conseguenze dello sviluppo della maculopatia miopica. (2,19) È un'estroflessione di una regione circoscritta del fondo posteriore e ha un raggio di curvatura inferiore al raggio di curvatura della parete oculare adiacente. Sulla base delle immagini della risonanza magnetica tridimensionale dell'occhio, è stato dimostrato che la differenza nella forma oculare è correlata allo sviluppo di condizioni che minacciano la vista negli occhi con miopia patologica. Una nuova classificazione dello stafiloma posteriore in base alla sua posizione ed estensione: Tipo I → stafiloma maculare largo, Tipo II → stafiloma maculare stretto, Tipo III → stafiloma peripapillare, Tipo IV → stafiloma nasale, Tipo V → stafiloma inferiore, Altri → stafilomi diversi dal tipo I al V. (2) Utilizzando l'OCT a campo ampio, il bordo degli stafilomi ha mostrato caratteristiche coerenti con un graduale assottigliamento della coroide dalla periferia verso il bordo
dello stafiloma e un graduale riispessimento della coroide dal bordo dello stafiloma in direzione del polo posteriore, accompagnato da un cambiamento nel raggio di curvatura della sclera al bordo dello stafiloma. (52)
b) Fondo tassellato (o tigroide) (Categoria 1) Il fondo tassellato è definito dalla maggiore visibilità dei grandi vasi coroidei dovuta all'allungamento assiale. La tassellazione inizia a svilupparsi attorno al disco ottico, specialmente nell'area tra il disco ottico e la fovea centrale. Un fondo tassellato da solo non influisce sulla visione centrale, a differenza delle altre lesioni della maculopatia miopica. Un fondo tassellato, insieme al cono miopico, è uno dei segni visibili preliminari negli occhi con miopia in generale e spesso osservato nei bambini con miopia elevata. I pazienti fortemente miopi con fondo tassellato sono significativamente più giovani dei pazienti con altre lesioni di maculopatia miopica. la tassellazione potrebbe essere il primo segno che gli occhi miopi diventano patologici (53)
c) L'atrofia coroideale diffusa si manifesta principalmente attorno al disco ottico e aumenta con l'età, per poi coprire l'intero polo posteriore. Pertanto, l'atrofia coroideale diffusa è sottoclassificata in atrofia coroideale diffusa peripapillare (PDCA) e atrofia coroideale diffusa maculare (MDCA). si verificava solitamente intorno ai 40 anni ed era osservata in circa il 30-40% dei pazienti dopo i 40 anni. (54)
d) L'atrofia coroidale a chiazze può essere vista come un'atrofia ben definita, bianco-grigiastra. La dimensione media dell'atrofia a chiazze era di 1,73 mm 2, variando da 0,03 a 101,3 mm 2 , con un diametro inferiore a uno o più lobuli della coriocapillare (55) La percentuale di atrofia a chiazze aumenta linearmente con l'età e raggiunge il 32,5% dopo i 60 anni. (56) La prevalenza di atrofia a chiazze è del 3,3% negli occhi con una lunghezza assiale da 27,0 a 27,9 mm e supera il 25% e il 50% se la lunghezza assiale è più lunga di 31 mm e 32 mm, rispettivamente.
e) L'atrofia maculare è una lesione atrofica ben delimitata, bianco-grigiastra o biancastra, centrata sulla fovea. Le caratteristiche di imaging sono simili a quelle dell'atrofia corioretinica a chiazze. La differenza principale tra atrofia a chiazze e atrofia maculare è la sua posizione rispetto alla fovea centrale. Sulla base dell'osservazione di follow-up a lungo termine, si suggerisce che l'atrofia maculare
potrebbe essere sottoclassificata in atrofia maculare correlata a MNV e atrofia maculare correlata a chiazze. L'atrofia maculare correlata a MNV si sviluppa centrata nella fovea centrale e si ingrandisce verso la periferia, mentre l'atrofia maculare correlata a chiazze si sviluppa all'esterno dell'area foveale e si ingrandisce, o si fonde con altre atrofie a chiazze, nel centro foveale. La differenziazione si basa principalmente sulle sue caratteristiche morfologiche o è assistita dalla storia di MNV. La maggior parte dell'atrofia maculare è uno stadio atrofico della MNV, con pochissime percentuali legate al coinvolgimento foveale secondario dovuto all'ingrandimento dell'atrofia a chiazze. (6)
f) Laquer craks sono linee sottili, irregolari e gialle dentro e intorno alla macula. Si ritiene che rappresentino rotture guarite e meccaniche dell'RPE, della membrana di Bruch e del complesso coriocapillare. Laquer multiple possono spesso essere osservate in modelli ramificati e incrociati. si verificano più spesso negli occhi con una lunghezza assiale compresa tra 29,0 mm e 32,0 mm (57) Sebbene siano spesso osservate in prossimità di CNV è insolito che CNV si sviluppi secondariamente. Queste sono considerate come lesioni lineari da tessuto cicatriziale guarito. Quando le laquer cracks sono di nuova formazione, CNV potrebbe svilupparsi attraverso la rottura della membrana di Bruch. Tuttavia, una volta che la rottura della membrana di Bruch è guarita con tessuto cicatriziale, raramente si verifica una CNV secondaria. È raro che si sviluppino attraverso la fovea centrale stessa. Quindi, di per sé non compromettono generalmente la visione centrale; tuttavia, il sanguinamento sottoretinico che si sviluppa all'inizio della rottura della membrana di Bruch potrebbe causare la compromissione della visione centrale anche dopo l'assorbimento dell'emorragia.
g) La CNV è una delle principali cause di compromissione della visione centrale nella miopia patologica. È stata inclusa come segno “plus” nella classificazione META-PM. La CNV comprendeva tre fasi: la fase attiva con proliferazione di una membrana fibrovascolare che include la CNV, essudazione ed emorragia; la fase cicatriziale esemplificata da una macchia di Fuchs; e la fase atrofica rappresentata dall'atrofia maculare correlata alla CNV. Pertanto, le macchie di Fuchs non sono considerate lesioni indipendenti ed sono una fase cicatriziale della CNV.
Approcci terapeutici della malattia in generale e dei sottotipi/complicanze in particolare abbinate
Poiché fino al 10 percento degli occhi con miopia degenerativa può sviluppare CNV, è importante riconoscere questa condizione e comprendere che la gestione della CNV miopica differisce da quella della CNV dovuta alla degenerazione maculare legata all'età (AMD).
La patogenesi della CNV miopica non è pienamente compresa e sono state proposte diverse teorie, come la teoria meccanica e la teoria eredodegenerativa. Si ritiene che i cambiamenti di fondo in un occhio con miopia patologica contribuiscano alla patogenesi della CNV miopica. Questi cambiamenti strutturali coinvolgono più strati dell'occhio, tra cui l'RPE, la membrana di Bruch, la coriocapillare e la coroide, nonché la sclera, e sono per lo più guidati dall'allungamento assiale. (58) Un marcato assottigliamento della coroide e la perdita di grandi vasi coroidali suggeriscono che una perfusione coroidale compromessa possa contribuire allo sviluppo di un'atrofia progressiva in una macula miopica. Sono state descritte anche alterazioni nei livelli di citochine in occhi con miopia patologica e possono contribuire alla patogenesi della MNV miopica. (59) Negli occhi con MNV miopica, è stato riscontrato un aumento del livello di VEGF nell'umore acqueo rispetto agli occhi sottoposti a chirurgia della cataratta. (60) È stato anche suggerito che fattori genetici o ereditari possano svolgere un ruolo nello sviluppo della MNV miopica. (61) Il polimorfismo a singolo nucleotide nel gene del fattore I del complemento è stato associato alla MNV miopica. La storia naturale della MNV miopica è generalmente scarsa senza trattamento. l'acuità visiva diminuisce significativamente a 10 anni, con la percentuale di occhi con un'acuità visiva di 20/200 o meno aumentata dal 29,6% all'88,9% e al 96,3% a 5 e 10 anni, rispettivamente. Pertanto, il trattamento della CNV miopica è giustificato per prevenire la progressiva perdita della vista. a terapia fotodinamica con verteporfina (vPDT) è diventata il primo trattamento approvato per la CNV miopica poiché gli occhi trattati con vPDT avevano una migliore acuità visiva media corretta rispetto al trattamento fittizio. Tuttavia, la vPDT non è stata in grado di determinare un guadagno nell'acuità visiva media a 2 anni. (62) La vPDT ha anche determinato uno sviluppo significativamente più frequente di atrofia corioretinica e un'acuità visiva significativamente peggiore rispetto alla terapia anti-VEGF intra-
vitreale. (63) Pertanto nell'era della terapia anti-VEGF, il trattamento standard per la MNV miopica è l'uso della terapia anti-VEGF intravitreale e la vPDT non è raccomandata. L'efficacia e la sicurezza della terapia anti-VEGF intravitreale per il trattamento della CNV miopica sono state valutate in una serie di ampi studi clinici di fase III, multicentrici, randomizzati e controllati, tra cui RADIANCE, (64) , (65) BRILLIANCE, (66) MYRROR, (67) e SHINY. (68) I risultati di questi studi clinici randomizzati hanno tutti dimostrato in modo conclusivo che ranibizumab, aflibercept e conbercept intravitreali hanno determinato significativi guadagni di acuità visiva media nei pazienti con MNV miopica ai loro endpoint primari con un eccellente profilo di sicurezza. Questi risultati positivi hanno portato all'approvazione di questi agenti anti-VEGF per il trattamento della MNV miopica da parte di varie autorità sanitarie. L'uso off-label di bevacizumab e ziv-aflibercept intravitreali, originariamente progettati per trattare la neoplasia sistemica, è stato valutato anche per il trattamento della CNV miopica ed entrambi gli agenti hanno determinato guadagni favorevoli di acuità visiva dopo il trattamento. (69) Tuttavia, mancano dati solidi di studi clinici sull'uso di bevacizumab o ziv-aflibercept intravitreali per la CNV miopica. L'uso di questi agenti anti-VEGF per la MNV miopica dovrebbe pertanto essere limitato ai pazienti che non hanno accesso agli agenti anti-VEGF approvati in etichetta. Rispetto al trattamento anti-VEGF per CNV dovuto ad AMD neovascolare, l'onere del trattamento nell'uso della terapia anti-VEGF per CNV miopica è notevolmente inferiore. La strategia di trattamento raccomandata nell'uso della terapia anti-VEGF intravitreale per CNV miopica è con una singola iniezione iniziale seguita da un'iniezione al bisogno con monitoraggio regolare usando SD-OCT per valutare l'attività della malattia. Questa strategia si basa sui protocolli di trattamento usati nei bracci guidati dall'attività della malattia ranibizumab degli studi RADIANCE e BRILLIANCE e nel braccio aflibercept dello studio MYRROR. L'efficacia di questo approccio di trattamento al bisogno è stata valutata in vari studi del mondo reale. (70), Lo studio prospettico LUMINOUS ha dimostrato nel contesto del mondo reale che il ranibizumab per la CNV miopica ha determinato un miglioramento visivo medio di 9,7 lettere e 1,5 lettere a 1 anno negli occhi mai trattati in precedenza e in quelli precedentemente trattati, con un basso numero medio di iniezioni di ranibizumab rispettivamente di 3,0 e 2,6 iniezioni in 12 mesi. I risultati a lungo termine dello studio RADIANCE
hanno anche confermato i risultati visivi favorevoli e il basso numero di nuovi trattamenti, con un guadagno medio dell'acuità visiva di 16,3 lettere e l'83% dei pazienti non ha richiesto ulteriori trattamenti per la MNV miopica dopo un follow-up fino a 48 mesi.
consensus papers
a) Maculopatia miopica da trazione. La maculopatia da trazione miopica comprende una varietà di patologie secondarie alla forza di trazione sulla retina in occhi fortemente miopi. Sono incluse la membrana epiretinica, il foro lamellare e molte altre condizioni che generano trazione sulla retina. Tra le maculopatie da trazione miopica, la foveoschisi miopica è unica della miopia patologica e vale la pena di essere appresa come complicazione specifica. A causa della limitazione di spazio, questo articolo farà luce su questa patologia. La foveoschisi miopica è definita distacco di retina posteriore senza foro maculare in occhi fortemente miopi. La chirurgia retinica nei pazienti con miopia elevata è tra i tipi di chirurgia oftalmologica più difficili e impegnativi, anche in mani esperte. Non sorprende che questo tipo di chirurgia comporti un rischio di complicazioni iatrogene. L'obiettivo principale della chirurgia nella MTM è ridurre le forze di trazione sulla macula evitando di infliggere ulteriori danni alla retina nel processo. Per ottenere questo rilassamento della macula, la chirurgia può essere eseguita ab interno utilizzando la vitrectomia, con o senza l'ausilio di una modifica esterna della curvatura sclerale alla fovea, avvicinando così le due strutture. La vitrectomia pars plana è un approccio comprovato per migliorare l'anatomia maculare.
a) Membrana epiretinica: Le membrane epiretiniche (ERM) sono descritte oftalmoscopicamente come uno strato riflettente, relativamente opaco sulla superficie della retina. Queste membrane possono imitare l'aspetto del cellophane e possono causare trazione inducendo la piegatura della superficie retinica. Nelle immagini OCT, le ERM sono facilmente identificabili come una banda iperriflettente situata sopra l'ILM. Le ERM si trovano nell'11,3%–45,7% dei pazienti altamente miopi. Per rimuovere un ERM è necessario un intervento chirurgico, ma questo può rivelarsi impegnativo nei pazienti con miopia elevata a causa delle loro caratteri-
stiche anatomiche usuali (ad esempio, lunghezza assiale maggiore), specialmente nei casi con stafiloma posteriore o atrofia del polo posteriore che possono impedire la visualizzazione.
b. Maculopatia da trazione miopica / foveoschisi miopica: La foveoschisi miopica può essere diagnosticata oftalmoscopicamente in alcuni casi, ma l'esame OCT è essenziale per stabilire la diagnosi corretta e per scopi di follow-up. La foveoschisi miopica comporta una progressiva separazione degli strati retinici, che rimangono collegati dalle cellule di Müller, un processo noto come foveoschisi miopica.
b) Foro maculare miopico: La trazione anteroposteriore e tangenziale esercitata dal vitreo sulla macula è strettamente correlata allo sviluppo di MH negli occhi miopi, in modo simile a quanto avviene negli occhi emmetropi. Tuttavia, in presenza di uno stafiloma posteriore, che promuove la scissione dello strato retinico, l'MH miopica è comunemente associata a foveoschisi, una differenza importante rispetto all'MH emmetropi. Nel complesso, la presenza di foveoschisi concomitante indica una prognosi anatomica e funzionale peggiore, che può persino portare al distacco della retina. L'MH lamellare o non a tutto spessore è un riscontro comune all'OCT nei pazienti miopi asintomatici. Tuttavia, questi casi possono solitamente essere gestiti solo con l'osservazione. L'intervento chirurgico è necessario solo in presenza di una chiara trazione vitrea o di un calo visivo attribuibile all'MH lamellare. Recentemente è stato riportato che la proliferazione epiretinica associata all'MH miopico lamellare tende a essere più diffusa e aderente all'ialoide posteriore rispetto agli occhi non miopi. (71). Il trattamento risulta essere di tipo chirurgico. La vitrectomia posteriore può essere eseguita con strumenti calibro 23 o più piccoli. È importante che l'intero vitreo venga rimosso dalla superficie maculare e successivamente eseguito un peelgin della membrana limitante interna.
a. Distacco di retina da foro maculare: Il distacco della retina derivante da un foro maculare è una complicazione tipica negli occhi fortemente miopi. La corteccia vitrea che aderisce alla superficie retinica attorno al foro provoca una trazione tangenziale che genera una componente vettoriale verso l'interno nello stafiloma profondo negli occhi fortemente miopi, con conseguente distacco della retina. Il trattamen-
to è chirurgico mediante impiego di vitrectomia.
c) Dome-shaped macula: Il DSM è stato descritto per la prima volta da Gaucher et al. in occhi fortemente miopi con deficit visivo, metamorfopsia e alterazioni atrofiche nell'RPE combinate con punti focali di perdita limitata. Nelle scansioni ecografiche e OCT, si nota un rigonfiamento nella retina maculare, nella coroide e nell'RPE all'interno dello stafiloma posteriore; in un'alta percentuale di casi, queste caratteristiche sono combinate con un distacco retinico superficiale localizzato nella parte superiore della macula. Sebbene la patogenesi della DSM rimanga poco chiara, diversi autori ritengono che essa sia correlata ad un relativo ispessimento della sclera rispetto alle aree circostanti (72) È stato anche suggerito che l'RPE potrebbe essere danneggiato meccanicamente dalla sporgenza della cupola all'interno dello stafiloma, portando così all'accumulo di fluido sottoretinico, che potrebbe verificarsi anche al bordo dello stafiloma. Il fluido sottofoveale cronico, la cui presenza è associata a una diminuzione della vista, è più comune quando il rigonfiamento maculare è molto elevato. Attualmente, mancano trattamenti efficaci per gestire il fluido sottoretinico associato al DSM e il fluido al bordo dello stafiloma. Tuttavia, è stata segnalata la risoluzione spontanea del fluido sottofoveale nel DSM. il declino della BCVA associato al DSM avviene molto lentamente, solitamente manifestandosi solo diversi anni dopo l'insorgenza della malattia, un'osservazione coerente con precedenti report. Le attuali terapie, come la fotocoagulazione laser a soglia e la PDT sui punti iperfluorescenti, possono danneggiare ulteriormente l'RPE, contribuendo così ad accelerare la perdita di BCVA.
d) Glaucoma
in generale e dei sottotipi/complicanze in particolare
Laddove disponibile, dato pertinente i rapporti costi/ benefici (QALY).
Una valutazione economica degli interventi sanitari offre informazioni utili per la difesa basata sulle prove, l'elaborazione di politiche e le decisioni di assistenza ai pazienti (72). Dato l'onere sulle risorse sanitarie e l'elevata prevalenza della miopia, una valutazione economica oggettiva del trattamento della miopia è essenziale per massimizzare i risultati be-
nefici. I benefici economici degli interventi per la miopia non sono ancora stati esaminati sistematicamente. L'adozione diffusa di interventi per la miopia può essere ostacolata dalla mancanza di prove sulle valutazioni economiche. tra cui il trattamento della miopia patologica fondamentale per prevenire la compromissione della vista da miopia patologica in età adulta. Tre studi (73-75) hanno analizzato il rapporto costo-efficacia del trattamento della miopia patologica con iniezione intravitreale di anti-VEGF (ranibizumab e conbercept) e PDT in diversi paesi. Nel Regno Unito, il ranibizumab è risultato più conveniente della PDT rispetto alla sola osservazione (74). Il ranibizumab è dominante sulla PDT per il trattamento della miopia patologica perché il primo ha avuto più successo nel miglioramento della vista (76) ed è stato meno costoso [£ 12.866 (US$ 17.636) per il ranibizumab contro £ 14.421 (US$ 19.767) per la PDT] (74). In Cina, il ranibizumab è risultato meno conveniente del conbercept per il trattamento della miopia patologica dal punto di vista del pagatore. Il conbercept ha mostrato una significativa convenienza anche quando i costi e il numero di iniezioni variavano. Secondo l'analisi di sensibilità, il ranibizumab aveva circa il 49,6% di probabilità di essere economicamente vantaggioso in Cina (73). È noto che la variazione delle situazioni economiche e della pratica clinica influenza i risultati della CEA. Le diffe-
renze di costo-efficacia del ranibizumab nel Regno Unito e in Cina potrebbero essere dovute alle differenze nelle situazioni economiche di questi paesi. Il ranibizumab, ad esempio, costa di più nel Regno Unito (17.636 $ USA) che in Cina (17.335 $ USA) (73, 74). Nessun altro studio ha valutato il costo-efficacia del conbercept in regioni diverse dalla Cina perché era stato approvato per l'uso solo in Cina al momento di questo studio. I tre studi (73-75) differivano nelle loro situazioni e nel tipo di comparatori utilizzati, rendendo difficile confrontare il loro costo-efficacia.
Tuttavia, ranibizumab e conbercept sembrano essere opzioni migliori della PDT (73, 74), dato che la PDT è stata meno conveniente rispetto alla sola osservazione (77, 78) e può portare ad atrofia corioretinica a lungo termine e perdita della vista in alcuni pazienti (79, 80) . Un altro potenziale anti-VEGF che ha dimostrato di essere sicuro ed efficace per il trattamento della miopia patologica è l'aflibercept (81). Tuttavia, si dice che l'aflibercept sia il più costoso tra i farmaci anti-VEGF clinicamente disponibili. Il conbercept, d'altro canto, è sicuro, efficace e conveniente per il trattamento della miopia patologica in Cina. Non è stato identificato nessuno studio che abbia confrontato il rapporto costo-efficacia di aflibercept con il conbercept per il trattamento della miopia patologica. Sono necessari ulteriori studi per confrontare il loro rapporto costo-efficacia.
Bibliografia
1. Flitcroft DI, He M, Jonas JB, et al. IMI - defining and classifying myopia: a proposed set of standards for clinical and epidemiologic studies. Invest Ophthalmol Vis Sci. 2019; 60: M20–M30.
2. Ohno-Matsui K, Kawasaki R, Jonas JB, et al. International photographic classification and grading system for myopic maculopathy. Am J Ophthalmol. 2015; 159: 877–883.
3. Ohno-Matsui K, Lai TY, Lai CC, Cheung CM. Updates of pathologic myopia. Prog Retin Eye Res. 2016; 52: 156–187.
4. Moriyama M, Ohno-Matsui K, Hayashi K, et al. Topographic analyses of shape of eyes with pathologic myopia by high-resolution three-dimensional magnetic resonance imaging. Ophthalmology. 2011; 118: 1626–1637.
5. Wang NK, Wu YM, Wang JP, et al. Clinical characteristics of posterior staphylomas in myopic eyes with axial length shorter than 26.5 mm. Am J Ophthalmol. 2016; 162: 180–190.
6. Fang Y, Du R, Nagaoka N, et al. OCT-based diagnostic criteria for different stages of myopic maculopathy. Ophthalmology. 2019; 126: 1018–1032.
7. H.E. Grossniklaus, W.R. Green Pathologic findings in pathologic myopia Retina, 12 (1992), pp. 127-133.
8. B.J. Curtin, C.C. Teng Scleral changes in pathological myopia Trans. Am. Acad. Ophthalmol. Otolaryngol.
9. K. Ohno-Matsui. Pathologic myopia. Asia-Pacific J. Ophthalmol (2016).
10. L. Chang, C.W. Pan, K. Ohno-Matsui, X. Lin, G.C.M. Cheung, G. Gazzard, V. Koh, H. Hamzah, E.S. Tai, S.C. Lim, P. Mitchell, T.L. Young, T. Aung, T.Y. Wong, S.M. Saw. Myopia-related fundus changes in Singapore adults with high myopia. Am. J. Ophthalmol., 155 (2013), pp. 991999.
11. Wong TY, Ferreira A, Hughes R, Carter G, Mitchell P. Epidemiology and disease burden of pathologic myopia and myopic choroidal neovascularization: an evidence-based systematic review. Am J Ophthalmol. 2014; 157: 9–25.
12. Iwase A, Araie M, Tomidokoro A, et al. Prevalence and causes of low vision and blindness in a Japanese adult population: the Tajimi Study. Ophthalmology. 2006; 113: 1354–1362.
13. Xu L, Wang Y, Li Y, et al. Causes of blindness and visual impairment in urban and rural areas in Beijing: the Beijing Eye Study. Ophthalmology. 2006; 113: 1134.e1–11.
14. Klaver CC, Wolfs RC, Vingerling JR, Hofman A, de Jong PT. Age-specific prevalence and causes of blindness and visual impairment in an older population: the Rotterdam Study. Arch Ophthalmol. 1998; 116: 653–658.
15. Cotter SA, Varma R, Ying-Lai M, Azen SP, Klein R, Los Angeles Latino Eye Study Group. Causes of low vision and blindness in adult Latinos: the Los Angeles Latino Eye Study. Ophthalmology. 2006; 113: 1574–1582.
16. World Health Organization (WHO). The impact of myopia and high myopia. Report of the Joint World Health Organization–Brien Holden Vision Institute Global Scientific Meeting on Myopia, University of New South Wales, Sydney, Australia, 16–18 March 2015. Geneva: World Health Organization; 2017. Licence: CC BY-NC-SA 3.0 IGO.
17. Holden BA, Fricke TR, Wilson DA, et al. Global prevalence of myopia and high myopia and temporal trends from 2000 through 2050. Ophthalmology. 2016; 123: 1036–1042.
18. Gao LQ, Liu W, Liang YB, et al. Prevalence and characteristics of myopic retinopathy in a rural Chinese adult population: the Handan Eye Study. Arch Ophthalmol. 2011; 129: 1199–1204.
19. Vongphanit J, Mitchell P, Wang JJ. Prevalence and progression of myopic retinopathy in an older population. Ophthalmology. 2002; 109: 704–711.
20. Healey PR, Mitchell P, Gilbert CE, et al. The inheritance of peripapillary atrophy. Invest Ophthalmol Vis Sci. 2007; 48: 2529–2534.
21. Bullimore MA, Brennan NA. Myopia control: why each diopter matters. Optom Vis Sci. 2019; 96: 463–465.
22. Verkicharla PK, Ohno-Matsui K, Saw SM. Current and predicted demographics of high myopia and an update of its associated pathological changes. Ophthalmic Physiol Opt. 2015; 35: 465–475.
23. Samarawickrama C, Mitchell P, Tong L, et al. Myopia-related optic disc and retinal changes in adolescent children from Singapore. Ophthalmology. 2011; 118: 2050–2057.
24. Yokoi T, Jonas JB, Shimada N, et al. Peripapillary diffuse chorioretinal atrophy in children as a sign of eventual pathologic myopia in adults. Ophthalmology. 2016; 123: 1783–1787.
25. Curtin BJ . The pathogenesis of congenital myopia. A study of 66 cases. Arch Ophthalmol. 1963; 6: 166–173.
26. Morgan IG, He M, Rose KA. Epidemic of pathologic myopia: what can laboratory studies and epidemiology tell us? Retina. 2017; 37: 989–997.
27. Tedja MS, Haarman AEG, Meester-Smoor MA, et al. IMI - myopia genetics report. Invest Ophthal Vis Sci. 2019; 60: M89–M105.
28. Morgan IG, French AN, Ashby RS, et al. The epidemics of myopia: aetiology and prevention. Prog Retin Eye Res. 2018; 62: 134–149.
29. Wu PC, Huang HM, Yu HJ, Fang PC, Chen CT. Epidemiology of myopia. Asia Pac J Ophthalmol (Phila). 2016; 5: 386–393.
30. Guan H, Yu NN, Wang H, et al. Impact of various types of near work and time spent outdoors at different times of day on visual acuity and refractive error among Chinese school-going children. PLoS One. 2019; 14: e0215827.
31. Solouki AM, Verhoeven VJ, van Duijn CM, et al. A genome-wide association study identifies a susceptibility locus for refractive errors and myopia at 15q14. Nat Genet. 2010; 42: 897–901.
32. Leveziel N, Yu Y, Reynolds R, et al. Genetic factors for choroidal neovascularization associated with high myopia. Invest Ophthal Vis Sci. 2012; 53: 5004–5009.
33. Miyake M, Yamashiro K, Akagi-Kurashige Y, et al. Vascular endothelial growth factor gene and the response to anti-vascular endothelial growth factor treatment for choroidal neovascularization in high myopia. Ophthalmology. 2014; 121: 225–233.
34. Hayashi H, Yamashiro K, Nakanishi H, et al. Association of 15q14 and 15q25 with high myopia in Japanese. Invest Ophthal Vis Sci. 2011; 52: 4853–4858.
35. Wong YL, Hysi P, Cheung G, et al. Genetic variants linked to myopic macular degeneration in persons with high myopia: CREAM Consortium. PLoS One. 2019; 14: e0220143.
36. Hosoda Y, Yoshikawa M, Miyake M, et al. CCDC102B confers risk of low vision and blindness in high myopia. Nat Commun. 2018; 9: 1782.
37. Miyake M, Yamashiro K, Akagi-Kurashige Y, et al. Analysis of fundus shape in highly myopic eyes by using curvature maps constructed from optical coherence tomography. PLoS One. 2014; 9: e107923.
38. Perkins ES, Phelps CD. Open angle glaucoma, ocular hypertension, low-tension glaucoma, and refraction. Arch Ophthalmol. 1982; 100: 1464–1467.
39. Marcus MW, de Vries MM, Junoy Montolio FG, Jansonius NM. Myopia as a risk factor for open-angle glaucoma: a systematic review and meta-analysis. Ophthalmology. 2011; 118: 1989–1994.e2.
40. Choudhury F, Meuer SM, Klein R, et al. Prevalence and characteristics of myopic degeneration in an adult Chinese American population: the Chinese American Eye Study. Am J Ophthalmol. 2018; 187: 34–42.
41. Vongphanit J, Mitchell P, Wang JJ. Prevalence and progression of myopic retinopathy in an older population. Ophthalmology. 2002; 109: 704–711.
42. Liu HH, Xu L, Wang YX, Wang S, You QS, Jonas JB. Prevalence and progression of myopic retinopathy in Chinese adults: the Beijing Eye Study. Ophthalmology. 2010; 117: 1763–1768.
43. Gao LQ, Liu W, Liang YB, et al. Prevalence and characteristics of myopic retinopathy in a rural Chinese adult population: the Handan Eye Study. Arch Ophthalmol. 2011; 129: 1199–1204.
44. Hayashi K, Ohno-Matsui K, Shimada N, et al. Long-term pattern of progression of myopic maculopathy: a natural history study. Ophthalmology. 2010; 117: 1595–1611.e1–4.
45. Marcus MW, de Vries MM, Junoy Montolio FG, Jansonius NM. Myopia as a risk factor for open-angle glaucoma: a systematic review and meta-analysis. Ophthalmology. 2011; 118: 1989–1994.e2.
46. Tokoro T (ed) Atlas of Posterior Fundus Changes in Pathologic Myopia. Tokyo: Springer-Verlag; 1998: 5–22.
47. Du R, Fang Y, Jonas JB, et al. Clinical features of patchy chorioretinal atrophy in pathologic myopia. Retina. 2019; 40: 951–959.
48. Ohno-Matsui K, Morishima N, Ito M, Tokoro T. Indocyanine green angiographic findings of lacquer cracks in pathologic myopia. Jpn J Ophthalmol.
49. Liu CF, Liu L, Lai CC, et al. Multimodal imaging including spectral-domain optical coherence tomography and confocal near-infrared reflectance for characterization of lacquer cracks in highly myopic eyes. Eye (Lond). 2014; 28: 1437–1445.
50. Querques L, Giuffre C, Corvi F, et al. Optical coherence tomography angiography of myopic choroidal neovascularisation. Br J Ophthalmol. 2017; 101: 609–615.
51. Coscas G, Lupidi M, Coscas F. Image analysis of optical coherence tomography angiography. Dev Ophthalmol. 2016; 56: 30–36.
52. Shinohara K, Shimada N, Moriyama M, et al. Posterior staphylomas in pathologic myopia imaged by widefield optical coherence tomography. Invest Ophthalmol Vis Sci. 2017; 58: 3750–3758.
53. Fang Y, Yokoi T, Nagaoka N, et al. Progression of myopic maculopathy during 18-year follow-up. Ophthalmology. 2018; 125: 863–877.
54. Tokoro T . Explanatory Factors of Chorioretinal Atrophy. Atlas of Posterior Fundus Changes in Pathologic Myopia. Tokyo: Springer; 1998: 23–50.
55. Du R, Fang Y, Jonas JB, et al. Clinical features of patchy chorioretinal atrophy in pathologic myopia. Retina. 2019; 40: 951–959.
56. Tokoro T . Explanatory Factors of Chorioretinal Atrophy. Atlas of Posterior Fundus Changes in Pathologic Myopia. Tokyo: Springer; 1998: 23–50.
57. Chang L, Pan CW, Ohno-Matsui K, et al. Myopia-related fundus changes in Singapore adults with high myopia. Am J Ophthalmol. 2013; 155: 991–999.e991.
58. Lai TY, Cheung CM. Myopic choroidal neovascularization: diagnosis and treatment. Retina. 2016; 36: 1614–1621.
59. Wong CW, Yanagi Y, Tsai ASH, et al. Correlation of axial length and myopic macular degeneration to levels of molecular factors in the aqueous. Sci Rep. 2019; 9: 15708.
60. Tong JP, Chan WM, Liu DT, et al. Aqueous humor levels of vascular endothelial growth factor and pigment epithelium-derived factor in polypoidal choroidal vasculopathy and choroidal neovascularization. Am J Ophthalmol. 2006; 141: 456–462.
61. Leveziel N, Yu Y, Reynolds R, et al. Genetic factors for choroidal neovascularization associated with high myopia. Invest Ophthal Vis Sci. 2012; 53: 5004–5009.
62. Blinder KJ, Blumenkranz MS, Bressler NM, et al. Verteporfin therapy of subfoveal choroidal neovascularization in pathologic myopia: 2-year results of a randomized clinical trial–VIP report no. 3. Ophthalmology. 2003; 110: 667–673.
63. Hayashi K, Ohno-Matsui K, Teramukai S, et al. Comparison of visual outcome and regression pattern of myopic choroidal neovascularization after intravitreal bevacizumab or after photodynamic therapy. Am J Ophthalmol. 2009; 148: 396–408.
64. Wolf S, Balciuniene VJ, Laganovska G, et al. RADIANCE: a randomized controlled study of ranibizumab in patients with choroidal neovascularization secondary to pathologic myopia. Ophthalmology. 2014; 121: 682–692.e682.
65. Holz FG, Tufail A, Leveziel N, et al. Ranibizumab in myopic choroidal neovascularization: a subgroup analysis by ethnicity, age, and ocular characteristics in RADIANCE. Ophthalmologica. 2016; 236: 19–28.
66. Chen Y, Sharma T, Li X, et al. Ranibizumab versus verteporfin photodynamic therapy in Asian patients with myopic choroidal neovascularization: brilliance, a 12-month, randomized, double-masked study. Retina. 2019; 39: 1985–1994.
67. Ikuno Y, Ohno-Matsui K, Wong TY, et al. Intravitreal aflibercept injection in patients with myopic choroidal neovascularization: the MYRROR study. Ophthalmology. 2015; 122: 1220–1227.
68. Zhou Y, Yang S, Yuan Y, et al. Progression and new onset of macular retinoschisis in myopic choroidal neovascularization eyes after Conbercept therapy: a post-hoc analysis. Eye (Lond). 2020; 34: 523–529.
69. Lai TY, Luk FO, Lee GK, Lam DS. Long-term outcome of intravitreal anti-vascular endothelial growth factor therapy with bevacizumab or ranibizumab as primary treatment for subfoveal myopic choroidal neovascularization. Eye (Lond). 2012; 26: 1004–1011.
70. Hamilton RD, Clemens A, Minnella AM, et al. Efficacia e sicurezza nel mondo reale del ranibizumab per il trattamento della neovascolarizzazione coroideale miopica: risultati dello studio LUMINOUS. PLoS Uno . 2020; 15: e0227557. T. Lai, C. Yang
71. Lamellar hole-associated epiretinal proliferation in lamellar macular hole and full-thickness macular hole in high myopia Retina (2017), pp. 1-8
72. Sorenson C, Drummond M, Kanavos P. Ensuring Value for Money in Health Care: The Role of Health Technology Assessment in the European Union. Rome: WHO Regional Office Europe; (2008).
73. Cui Z, Zhou W, Chang Q, Zhang T, Wang H, Meng X, et al.. Cost-effectiveness of conbercept versus ranibizumab for age-related macular degeneration, diabetic macular edema and pathological myopia: population-based cohort study and Markov model. Front Med. (2021) 8:750132. 10.3389/fmed.2021.750132
74. Claxton L, Malcolm B, Taylor M, Haig J, Leteneux C. Ranibizumab verteporfin photodynamic therapy or observation for the treatment of myopic choroidal neovascularization: cost effectiveness in the UK. Drugs Aging. (2014) 31:837–48
75. Sharma S, Bakal J. The value component of evidence-based medicine: the cost-utility of photodynamic therapy for pathologic myopia. Evidence-Based Ophthalmology. (2002) 3:49–53.
76. Zhu Y, Zhang T, Xu G, Peng L. Anti-vascular endothelial growth factor for choroidal neovascularisation in people with pathological myopia. Cochrane Datab Syst Rev. (2016) 12:CD011160. 10.1002/14651858.CD011160.pub2.
77. Hong CY, Boyd M, Wilson G, Hong SC. Photorefraction screening plus atropine treatment for myopia is cost-effective: a proof-of-concept Markov analysis. Clinical Ophthalmology. (2022) 16:1941.
78. Lamparter J, Dick HB, Krummenauer F. Clinical benefit, complication patterns and cost effectiveness of laser in situ keratomileusis (LASIK) in moderate myopia: results of independent meta analyses on clinical outcome and postoperative complication profiles. Eur J Med Res. (2005) 10:402.
79. Hayashi K, Ohno-Matsui K, Shimada N, Moriyama M, Hayashi W. Long-term results of photodynamic therapy for choroidal neovascularization in Japanese patients with pathologic myopia. Am J Ophthalmol. (2011) 151:137–47.
80. Giansanti F, Virgili G, Donati MC, Giuntoli M, Pieretti G, Abbruzzese G, et al.. Long-term results of photodynamic therapy for subfoveal choroidal neovascularization with pathologic myopia. Retina. (2012) 32:1547–52.
81. Chen SL, Tang PL, Wu TT. Result of intravitreal aflibercept injection for myopic choroidal neovascularization. BMC Ophthalmol. (2021) 21:342.











Luca Menabuoni
Medico chirurgo Casa di Cura Villa Donatello - Firenze

Introduzione
La saldatura laser è una tecnica sviluppata per indurre la chiusura di una ferita, chirurgica o accidentale, senza l’ausilio di punti di sutura, ovvero con un ridotto numero degli stessi. Nel corso delle numerose sperimentazioni condotte negli anni, sia ex vivo sia in vivo su modello animale, la saldatura laser ha dimostrato di possedere innumerevoli requisiti competitivi rispetto alle convenzionali tecniche di chiusura di una ferita: ad esempio la semplicità di realizzazione, i ridotti tempi d’intervento, le ridotte reazioni da corpo estraneo e conseguente risposta infiammatoria, una più rapida guarigione e la possibilità di indurre rigenerazione del tessuto, con notevoli vantaggi anche da un punto di vista estetico. Nella nostra esperienza sperimentale e clinica, abbiamo sviluppato una particolare procedura di saldatura laser1-4: si utilizza un diodo laser che emette nel vicino infrarosso, a 810 nm (Mod. WELD 800 by El. En. SpA, Calenzano, Italia), associato all’applicazione topica di una soluzione di Verde Indocianina (ICG). La tecnica si basa sull’in-
terazione fototermica della radiazione laser con le principali componenti della matrice extracellulare dello stroma: l’assorbimento della radiazione induce un aumento di temperatura all’interno del tessuto, che causa una ristrutturazione del collagene, con conseguente creazione di nuovi legami tra molecole adiacenti, che si stabilizzano durante il successivo raffreddamento. La procedura di saldatura, ottimizzata su modello animale, è proposta nella pratica clinica come sostitutiva o integrativa della sutura tradizionale nella chirurgia della cataratta e nella cheratoplastica perforante, lamellare ed endoteliale. Analisi istologiche effettuate su tessuto animale e osservazioni morfologiche sui pazienti trattati hanno dimostrato che in una ferita saldata con laser, il tessuto stromale riguadagna una citoarchitettura molto simile a quella del tessuto integro, con tutte le sue proprietà principali (trasparenza e resistenza meccanica). Le procedure di saldatura laser in chirurgia oculistica Sono state sviluppate due diverse modalità di saldatura laser: continua (CWLW), e pulsata (PLW). La pri-

Figura 1. Istologie su campioni di tessuto animale saldati. In (A) si riporta una microscopia di birifrangenza di un taglio (linea tratteggiata) a tutto spessore praticato in una cornea di maiale; le frecce indicano la zona dove si è avuto effetto fototermico con immediata chiusura del taglio; la procedura applicata è CWLW. In (B) si mostra la sezione di due tessuti (capsula di cristallino estratta da maiale) in microscopia ottica con colorazione con Blu di Toluene: sono stati saldati con tecnica PLW; la zona omogenea centrale corrisponde alla zona di danno
ma è indicata per la sigillatura immediata dei margini di una ferita: è utilizzata nelle PK e nelle DALK. La modalità pulsata è impiegata per stabilizzare il lembo nella cheratoplastica endoteliale e nella procedura, ancora sperimentale, della phacoersatz per la chiusura della capsula del cristallino. In entrambi i casi si osserva una ristrutturazione del collagene stromale, dovuta all’effetto termico controllato e localizzato nella zona direttamente irraggiata e colorata con il cromoforo (Figura 1).
L’applicazione clinica è stata preceduta da numerosi e approfonditi studi sul meccanismo della saldatura, con analisi termografiche dirette, modelli termici, analisi istologiche standard, microscopia a forza atomica (AFM), microscopia elettronica (TEM) e microscopia di seconda armonica4-7. Il principio della saldatura laser indotta La saldatura laser della cornea è dovuta principalmente ad un effetto fototermico, che induce una ristrutturazione del collagene stromale.
Il collagene presente nella matrice extracellulare dello stroma corneale, è in larga parte di tipo I e viene detto anche collagene fibrillare o fibroso. Questa proteina assume una configurazione a tripla elica costituita da tre catene polipeptidiche stabilizzate tra loro da legami a idrogeno intramolecolari (intercatena e intracatena).
A sua volta, le molecole di collagene si organizzano parallelamente tra loro in sistemi sfalsati di un quarto (quarter-staggered) stabilizzati da cross-link covalenti. In particolare, i legami a idrogeno intramolecolari stabilizzano la tripla elica, mentre quelli intermolecolari (cross-link covalenti) servono a

mantenere l’arrangiamento fibrillare contribuendo alle proprietà meccaniche del tessuto. Una volta che il collagene è scaldato a una determinata temperatura critica, i legami a idrogeno intramolecolari si rompono e la proteina subisce una trasformazione di fase da struttura cristallina altamente ordinata allo stato cosiddetto di random coil. Questa transizione di fase avviene in maniera approssimativa nell’intervallo 5565 °C. All’aumentare della temperatura si osserva un effetto di denaturazione che porta a una sorta di restringimento del tessuto, ed è detta “temperatura di shrinkage”. Lo shrinkage del collagene precede la sua denaturazione completa (ovvero l’omogeneizzazione completa del tessuto) che avviene per temperature superiori ai 65-70 °C e che deriva dalla rottura dei cross-link covalenti intermolecolari. A seguito del processo di shrinkage le fibre di collagene perdono le caratteristiche striature che sono normalmente presenti nel collagene naturale integro.
Tali striature sono facilmente visibili al microscopio elettronico come bande trasversali alla fibra distanti tra loro 67nm. In aggiunta le fibre appaiono deformate con un diametro fibrillare incrementato del 2050% e risultano scomposte in strutture sub-fibrillari (Figura 2).
In proposito, sono stati condotti studi sperimentali, sia ex vivo su modelli animali5, sia in vivo durante le procedure chirurgiche6: tramite le analisi termografiche e i modelli teorici si è valutato l’effetto termico. Durante la CWLW si raggiunge una temperatura di circa 55°C all’interno del taglio corneale, dunque un danneggiamento dei legami intramolecolari.
Questo dato è stato confermato da analisi di microscopia elettronica e a luce polarizzata: il collagene fibrillare rimane intatto, mentre si perde la sua regolare distribuzione spaziale in piani paralleli. Questo facilita una sorta di ridistribuzione spaziale del collagene stromale tra i due margini della ferita, e dunque innesca più rapidamente il processo di riparazione del tessuto stesso (Figura 3).
Nel caso di PLW l’analisi termografica e i modelli teorici mostrano un aumento termico più rilevante (si raggiungono temperature superiori a 80°C), ma limitate nel tempo alla durata dell’impulso (40 ms) e nello spazio alla dimensione della fibra ottica utilizzata (300 micrometri di diametro). Dunque il danno termico seppure elevato è localizzato a una zona estremamente limitata e inoltre risulta essere reversibile nel tempo.
Le istologie hanno ampiamente confermato questi dati (Figura 1B)7

microscopia TEM (Transmission Electron Microscopy): a sinistra è riportato il tessuto intatto, dove sono riconoscibili i piani lamellari
danneggiato ma è distribuito nello spazio in modo disordinato; a facilmente distingui-bili le tipiche striature
La saldatura laser in cheratoplastica Nella CWLW si utilizza una soluzione acquosa di cromoforo ICG per colorare uniformemente i margini del taglio. Dopo l’apposizione di 8-16 punti di ancoraggio, si sottopone al trattamento laser la parte precedentemente preparata. Si utilizza una fibra ottica, montata su un manipolo: la punta della fibra è mantenuta inclinata di circa 45° rispetto all’asse del taglio e a una distanza di circa 1 mm dalla superficie, così da permettere un irraggiamento omogeneo. L’irraggiamento dell’intero perimetro si attua in circa 120 s.
Questa procedura si adatta in maniera particolare all’uso combinato col laser a femtosecondi: il taglio del laser consente di avere ampie superfici di contatto e profili perfettamente congruenti, tali da permettere l’ottimizzazione del processo di saldatura laser assistita.
Un’altra procedura d’intervento sviluppata sfruttando le potenzialità dell’uso combinato del laser a femtosecondo con il laser a diodo, è la cheratoplastica endoteliale.
Il laser a femtosecondo si utilizza per la preparazione di un flap endoteliale sulla cornea del donatore (Figura 4). La periferia della superficie stromale del flap si colora con la soluzione di ICG. La tecnica laser per stabilizzare il lenticolo innestato è attuabile sia nel caso in cui si utilizzi il lembo corneale nella modalità convenzionale (stripping dell’endotelio del ricevente), sia nel caso in cui si prepari la cornea del ricevente asportando un lenticolo descemetico stromale di dimensioni e forma identici a quelli preparati nel donatore8-10
Si evitano così le possibili dislocazioni del flap in camera anteriore e l’ipertono conseguente all’utilizzo della bolla d’aria.
Sono sufficienti 10-15 spot di saldatura, con un’energia di 40 mJ e una durata dell’impulso pari a 80 ms per ottenere una buona adesione.

Figura 4. Rappresentazione schematica della preparazione del lembo corneale in cheratoplastica lamellare tutto laser (PK), cheratoplastica lamellare anteriore per trattamento del cheratocono (LK), cheratoplastica endoteliale (EK)
La saldatura corneale laser assistita è una nuova tecnica che permette di migliorare qualitativamente la chirurgia dei trapianti.
Consente di ottenere un processo di guarigione del la ferita sorprendente rispetto alla sutura tradizionale: la ferita viene chiusa immediatamente, riducendo così il rischio di infezioni postoperatorie; il processo infiammatorio postoperatorio e la reazione da corpo estraneo risultano notevolmente ridotti. La struttura del collagene corneale riacquista in tempi ridotti la sua regolare organizzazione spaziale.
In modo particolare questa tecnica trova l’ottimizzazione del suo utilizzo quando combinata al laser a femtosecondi nella PK, DALK ed EK, ottenendo così una chirurgia minimamente invasiva, con rapidi processi di guarigione e un buon mantenimento della normale morfologia corneale.
Bibliografia
1. L. Menabuoni, B. Dragoni and R. Pini, Proc. SPIE 2922, 449 (1996) 2. L. Menabuoni, F. Mincione, B. Dragoni, et al., Proc. SPIE 3195, 25 (1998)
3. L. Menabuoni, R. Pini, F. Rossi, I. Lenzetti, S. H. Yoo, J.-M. Parel, J Cataract Refract Surgery 33: 1608-1612 (2007).
4. F. Rossi, P. Matteini, F. Ratto, L. Menabuoni, I. Lenzetti, R. Pini, Laser tissue welding in ophthalmic surgery. J Biophotonics 1(4):33142 (2008).
5. F. Rossi, R. Pini and L. Menabuoni, J Biomed Opt 12, 014031 (2007)
6. F. Rossi, P. Matteini, R. Pini, L. Menabuoni, Proc SPIE Vol. 6632, 663215 (2007).
7. P. Matteini, F. Rossi, L. Menabuoni, R. Pini, Lasers Surg Med 39 (7), 597-604 (2007).
8. L. Menabuoni, R. Pini, M. Fantozzi, et al., Invest. Ophthalmol. Vis. Sci. 47, E(2006)
9. R. Pini, L. Menabuoni, I. Lenzetti, et al., VII International Sym- posium on Ocular Trauma, Rome (2006)
10. R. Pini, F. Rossi, P. Matteini, F. Ratto, L. Menabuoni, I. Lenzetti, S. H. Yoo, J.-M. Parel, Proc SPIE 6844, 684411-1 (2008).






















Sostanze ad effetto nutritivo o fisiologico
Scutellaria e.s.
Bromelina


Compresse con matrice lipidica gastroresistente
Diosmina
Artemisia e.s.
Ananas e.s.
La tecnologia T-Matrix Lipid™ è caratterizzata da una matrice lipidica a base di sostanze alimentari in grado di conferire gastroresistenza alle molecole in essa contenute.
Inoltre, permette il graduale e prolungato assorbimento degli attivi, ottimizzandolo così durante l'intera giornata.
re etto r ni egg
Luigi Marino
Medico Chirurgo - Specialista Clinica Oculistica
Il cambiamento climatico ha certamente conseguenze sia dirette sia indirette sulla nostra salute: gli effetti del clima sulla salute possono manifestarsi a breve come a lungo termine.
Quanto questo può incidere sull'incidenza della sindrome dell'occhio secco.
Secondo un recente studio dell'OMS, entro il 2040 siamo destinati a raggiungere i 250.000 decessi l'anno.
In Europa la mortalità dovuta alle ondate di calore e alle alluvioni è destinata ad aumentare e le variazioni nella distribuzione di patologie trasmesse da vettori causeranno anch'essi importanti conseguenze sulla salute.
Perché aumenta il rischio di occhio secco?
Le ondate di calore costituiscono un problema soprattutto nell'Europa meridionale e nel Mediterraneo e sappiamo che le alte temperature, associate a inquinamento atmosferico, oltre a problemi respiratori e cardiovascolari, possono causare dry eye specialmente tra i bambini e gli anziani.
Anche l’aumento eccessivo di umidità durante piogge torrenziali (Dana a Valencia ad esempio) altera il


Marino
film lacrimale (anche in seguito alle ansie e allo stress conseguente a questi cataclismi).
Altri rischi per i nostri occhi sono legati alla contaminazione ambientale: agenti inquinanti e chimici provenienti da strutture industriali, acque reflue e di fognatura. Quando le acque nere e industriali non vengono smaltite accuratamente, le acque straripano portando agenti contaminanti nei laghi e nel mare e alcune di queste sostanze rimangono a lungo nell’aria causando la Urban Eye Allergy Syndrome (sempre più associata a dry eye).
Le temperature più elevate favoriscono gli incendi boschivi: raramente gli incendi di foreste causano morti, ma tutti gli incendi generano inquinamento atmosferico da combustione e le sostanze volatili prodotte causano dry eye estremo.
Le temperature più alte, gli inverni più miti e le estati più umide fanno aumentare le aree in cui gli insetti vettori di malattie (zanzare, zecche e pidocchi) sopravvivono e si moltiplicano.
Nel prossimo futuro il riscaldamento globale potrebbe far sì che le zecche si diffondano ad altitudini maggiori e sempre più a nord, fino a colpire cervi, marmotte e caprioli.
Anche le variazioni stagionali, hanno conseguenze negative sulla salute, specialmente per le persone affette da allergie: oggi troviamo congiuntiviti vernal in ogni periodo dell’anno.
Ci sono poi dei picchi atipici (non più stagionali) di atopia legati a diversi allergeni e pollini contemporaneamente: dovremmo utilizzare anche in oculistica le “applicazioni” (app) così diffuse tra i pazienti allergici o asmatici per prevenire l'esposizione oculare all'inquinamento e agli allergeni.
Sappiamo che la secchezza della superficie oculare influisce sulle qualità ottiche del nostro occhio.
Con gli esami strumentali abbiamo dimostrato che i cambiamenti dello spessore e della composizione del
film lacrimale inducono aberrazioni ottiche. Il TFOS 2024 a Venezia ha sottolineato ancora una volta le alterazioni neurosensoriali corneali sino a un vero e proprio dolore neuropatico.
Certo è intuitivo che durante con le alte temperature e l’aria molto secca i nostri occhi soffrano, ma anche durante i mesi invernali abbiamo una esacerbazione della secchezza oculare.
In montagna e nei luoghi con clima rigido, i venti freddi e l'aria molto secca, associati al riscaldamento eccessivo delle nostre case montane costituiscono una associazione pericolosa per i nostri occhi.
Le condizioni meteorologiche avverse riducono la componente acquosa del film lacrimale e l'irritazione che si viene a creare non solo da una sensazione di bruciore o prurito, ma spesso ci porta a sfregare gli occhitanto da graffiare o lesionare la superficie corneale.
A volte possiamo avere la sensazione di corpo estraneo, e gli occhi troppo “asciutti “possono causare lacrimazione eccessiva, poiché cercano di compensare con una secrezione improvvisa alla mancanza di una lacrima sana, completa e protettiva.
Durante i mesi invernali è importante proteggere gli occhi. In caso di condizioni meteorologiche avverse, come freddo o vento estremi, meglio proteggersi con occhiali da vista grandi con protezione UV al 100%. Meglio indossare un cappello a tesa larga, occhiali da "sole", occhiali protettivi o una visiera. Il vento, i raggi UV e le intemperie distruggono gli occhi affetti da dry eye, durante i mesi più freddi. Inoltre, i dannosi raggi UV causano danni corneali e retrinici.
Se siamo appassionati di sport invernali, meglio indossare occhiali da sci di ottima qualità e ben aderenti.
Quando il clima diventa più freddo, i pazienti con secchezza oculare soffrono di più, perché l'umidità dell’aria diminuisce in autunno e in inverno. Durante le giornate ventose, gli occhi si seccano ancora di più.
Il vento fresco e frizzante irrita gli occhi già affetti da dry eye.
Negli ambienti chiusi è sempre utile un umidificatore all'interno delle nostre abitazioni, soprattutto in montagna.
L’umidità scende all'esterno, ma alzando la temperatura del riscaldamento l'aria all'interno diventa ancora più secca dell'aria all'esterno: l'umidificatore aggiunge un'umidità lenitiva all'aria e allevia i sintomi di un occhio secco.

Rimaniamo idratati bevendo molta acqua e se l'acqua naturale non piace, proviamo tisane o acqua calda. Un altro aspetto che dobbiamo considerare è l'associazione dell'occhio secco con la vita sedentaria e la costante esposizione a strumenti video, come pc, tablet, smartphone.
In un recente studio su videoterminalisti si è valutata l'attività fisica e il comportamento sedentario dei partecipanti utilizzando l'International Physical Activity Questionnaire (IPAQ) e il livello di attività fisica è stato calcolato in unità metaboliche equivalenti a settimana (MET, min/settimana).
I risultati suggeriscono che un livello più basso di attività fisica e comportamento sedentario sono associati alla sindrome dell'occhio secco.
L'uso di videoterminali (VDT), inclusi laptop, tablet elettronici e lettori, nonché smartphone, può avere un'ampia gamma di effetti negativi psicologici e fisiologici, inclusi i sintomi dell'occhio secco.
Poiché gli impiegati tendono a usare spesso il videoterminale, la DED (Dry Eye Desease) è più diffusa tra loro.
È stato riportato che lo sviluppo del disturbo dell'occhio secco può portare a un deterioramento delle prestazioni lavorative; pertanto, la DED dovrebbe essere considerata importante nella gestione degli impiegati.
Inoltre, il mantenimento della salute mentale degli impiegati è stato riconosciuto come una componente critica nella gestione dell'ufficio.
I sintomi oculari come secchezza oculare, affatica-

mento degli occhi e visione offuscata sono sintomi comunemente riportati dagli utenti di videoterminali: studi epidemiologi su larga scala tra gli impiegati hanno dimostrato che il lavoro con videoterminale è un importante fattore di rischio per sviluppare il disturbo dell'occhio secco.
La sindrome dell’occhio secco è altamente prevalente, circa il 12% tra gli impiegati che trascorrono 8 ore al giorno lavorando al VDT. Si ritiene che la DED correlata a VDT derivi da tassi di ammiccamento inferiori e da un aumento del tasso di evaporazione lacrimale con instabilità del film lacrimale.
La formula dell'International Physical Activity Questionnaire (IPAQ-J) è utilizzata per determinare l'attività fisica durante il tempo libero, il lavoro domestico, il lavoro e i trasporti.
Oltre a bassi livelli di attività fisica, un prolungato periodo di comportamento sedentario (seduto ad esempio) è un fattore di rischio per vari problemi di salute, comprese malattie croniche come malattie cardiovascolari, diabete e sindrome metabolica.
Poiché l'inattività fisica e uno stile di vita sedentario sono dannosi per la salute, affrontare questi comportamenti è diventata una priorità globale per la salute pubblica.
Gli impiegati che tendono a stare seduti per lunghi periodi di tempo generalmente soffrono di dolore lombare astenopia accomodativa, se non addirittura di dolore oculare. L'astenopia accomodativa e la computer vision syndrome contribuiscono drammaticamente allo sviluppo della DED.
Un livello più elevato di attività fisica è associato a un minor rischio di Dry Eye Desease.
L’attività fisica influenza positivamente le caratteristiche qualitative e/o quantitative del film lacrimale mentre il comportamento sedentario induce vari disturbi cronici, tra cui malattie correlate all'infiammazione sistemica, con eccesso di stress ossidativo, che induce un'infiammazione cronica della superficie oculare, riducendo l'espressione della mucina.
Un aumento del livello di attività fisica è un modo efficace per la prevenzione e/o il trattamento della DED: più il livello di attività fisica è elevato più abbiamo un miglioramento della salute mentale, ma non solo perché l'esercizio di uno sport è tra le strategie terapeutiche di intervento per chi soffre di occhio secco.
Pochi minuti di attività fisica al giorno migliorano le condizioni dei nostri occhi, alleviando anche i dolori al collo, alle spalle alla schiena e facendo diminuire la depressione.


Volume 1

Ophthalmology up-to-date




Volume 2

FABIANO GRUPPO
EDITORIALE
Redazione: Strada 4 Milano Fiori, Palazzo Q7 – 20089 Rozzano (MI) Sede operativa: FGE srl – Regione Rivelle 7/F – 14050 Moasca (AT) Tel. 0141 1706694 – Fax 0141 856013 – e-mail: info@fgeditore.it – www.fgeditore.it
Prima parte
Massimo Camellin
Medico Chirurgo Oculista
Direttore Sanitario di Sekal Microchirurgia Rovigo
Umberto Camellin
Medico Chirurgo in formazione specialistica in Oftalmologia - Università di Messina
La topografia corneale è un esame di fondamentale importanza perché permette lo studio della cornea anteriore che, dal punto di vista quantitativo, è il diottro più rilevante dell’occhio. Il potere corneale medio è pari a circa 43 D sulle 60 D totali circa dell’intero sistema ottico dell’occhio. Una variazione di curvatura sulla cornea, anche modesta, comporta una variazione significativa della messa a fuoco.
Fino a trent’anni fa era possibile studiare la cornea solo con l’oftalmometro di Javal-Schiotz o Helmholtz, attualmente, con l’avvento della chirurgia refrattiva, che si effettua principalmente a livello corneale, è stato necessario sviluppare strumenti che fornissero maggiori informazioni di forma e funzione.
La topografia computerizzata permette una ricostruzione cromatica delle variazioni della curvatura corneale anteriore fino alla periferia.
In questo capitolo tratteremo:
– Algoritmi di ricostruzione delle curvature;
– Le scale cromatiche; – La topografia dell’occhio astigmatico; – Acquisizione ed artefatti; – Topografi a breve ed a lunga distanza; – Gli indici topografici.
I topografi computerizzati o videocheratoscopi permettono di effettuare acquisizioni della cornea sulla quale si proietta un disco di Placido ideato da Antonio Placido da Costa nel 1882. Originariamente questo disco era costituto da un pannello circolare con disegnati anelli concentrici (bianchi su sfondo nero) con un foro centrale attraverso il quale l’osservatore poteva valutare in maniera qualitativa le eventuali deformità degli anelli del disco riflessi dalla cornea. Oggi gli anelli del disco di Placido, riflettendosi sulla cornea, vengono acquisiti da una videocamera e rielaborati da un software presente nel topografo. Utilizzando diverse tipologie di algoritmi: assiale, tangenziale, refrattivo ed altitudinale, i dati numeri-


ci dei raggi di curvatura, vengono convertiti in una scala cromatica che li trasforma in diottrie o micron (in caso di algoritmo altitudinale). Nella topografia i colori freddi corrispondo a curvature minori (cornea piatta) ed i colori caldi a curvature maggiori (cornea curva). Le migliaia di punti acquisiti vengono processati da un software che elabora così le variazioni di curvatura degli anelli riflessi e ne calcola il relativo potere diottrico. Il punto di partenza dell’analisi matematico/geometrica è il centro di fissazione (centro degli anelli) per cui è importante la corretta fissazione del paziente.
Le Scale Cromatiche
Dopo l’acquisizione, la prima scelta che dobbiamo effettuare riguarda il tipo di scala a cui si riferiscono i colori. Questa può essere assoluta, normalizzata o aggiustabile. La scala cromatica assoluta parte da un raggio di curvatura molto basso per arrivare ad uno molto alto comprendendo così tutte le variazioni diottriche possibili anche in cornee patologiche. La scala normalizzata è impostata automaticamente dallo strumento ed ha come limiti il valore di curvatura massimo e minimo rilevati nella cornea analizzata. Lo step dell’analisi sarà calcolato di conseguenza. Nella scala aggiustabile invece stabiliremo noi il range di analisi e lo step desiderato. Questa scala risulta utile quando dobbiamo analizzare particolari aree.
Scala assoluta
La scala assoluta detta di Klyce va da un valore assoluto massimo di circa 100 D che corrisponde ad un colore bianco, ad un valore minimo di 9 D, che corrisponde ad un colore blu scuro. Nei valori medi di curvatura (da 35.5 D a 50.50 D) gli step sono di 1.5 D; mentre, negli estremi gli step sono di 5 D. I colori caldi corrispondono a poteri diottrici maggiori, mentre i colori freddi a
poteri diottrici minori. Questa scala permette di avere un’idea generale della cornea, ma non evidenzia i dettagli. È comoda, comunque, come prima scelta per poi valutare, se necessario, altri dettagli passando alla scala aggiustabile.
Scala normalizzata
La scala normalizzata espande l’analisi limitandola al potere corneale massimo e minimo rilevati nella cornea in esame.
La scala normalizzata è quindi ottimizzata dallo strumento in modo automatico ed ha come intervallo il potere diottrico della curvatura massima e minima della cornea analizzata diviso per il numero di colori (14 nel topografo Keratron [Optikon]). Quindi ogni colore, con questa scala, corrisponde ad un valore diverso a seconda della cornea analizzata. Non dobbiamo quindi usare le scale normalizzate per confrontare esami in quanto potrebbero essere diverse.
Scala aggiustabile
La scala aggiustabile permette di decidere massimo, minimo e step di analisi. Si espande in tal modo la rappresentazione, evidenziando ulteriormente ogni dettaglio dell’area interessata (Figura 1).
Algoritmi di ricostruzione delle curvature
Le rappresentazioni topografiche rappresentano
mappe cromatiche basate su algoritmi di ricostruzione delle curvature.
L’algoritmo assiale è stato il primo algoritmo ad essere sviluppato per la ricostruzione delle curvature della superficie corneale, seguito dall’algoritmo locale detto anche tangenziale o true. L’algoritmo refrattivo è un algoritmo che permette di trasformare i raggi di curvatura in potere diottrico funzionale (il potere è quindi legato al centro dell’analisi ossia al centro di fissazione ed è influenzato dall’aberrazione sferica) non è significativo ai fini della ricostruzione della forma della cornea ma della sua funzione diottrica. Le mappe altitudinali trasformano le mappe cromatiche delle curvature corneali in altezze e consentono più facilmente di stabilire se è presente un’ectasia o un infossamento per confronto con una superficie di riferimento che può essere sferica, asferica od asfero/ torica (Figura 2).
Algoritmo assiale (noto anche come “sagittale”)
L’algoritmo assiale è il primo storicamente ad essere stato introdotto ed è il più semplice da comprendere. Secondo tale algoritmo i centri delle varie curvature della cornea da analizzare giacciono sull’asse cheratoscopico. L’esame topografico prevede la proiezione sulla cornea degli anelli concentrici del disco di Placido. L’immagine riflessa viene acquisita da una telecamera ed, in base alla deformazione degli anelli proiettati si ot-



tiene la ricostruzione della mappa di curvatura corneale nei vari punti.
Con una semplificazione possiamo rappresentare una cornea normale con una curvatura centrale (più curva) ed una periferica (più piatta). Avremo quindi due raggi di curvatura, uno più centrale C (più curvo) ed uno periferico C1 (più piatto). Le cornee sono tipicamente superfici asferiche, cioè più curve al centro e più piatte in periferia. Pertanto, in maniera esemplificativa, la sezione di una cornea può essere interpretata come la composizione di due sfere i cui raggi di curvatura sono più curvi al centro e più piatti in periferia. L’assunto dell’algoritmo assiale postu-
la che il centro della curvatura C ed il centro della curvatura C1 siano sullo stesso asse e coincidano con l’asse cheratoscopico (Figura 3).
Se osserviamo l’immagine frontalmente otteniamo una rappresentazione cromatica, nella quale è presente un’area verde al centro che corrisponde all’area di curvatura C centrale ed un’area blu periferica che corrisponde al raggio di curvatura C1.
In figura 4 si osserva la rappresentazione cromatica di un astigmatismo congenito lieve in algoritmo assiale. È presente il tipico aspetto a clessidra con il meridiano verticale più curvo ed il meridiano orizzontale più piatto.
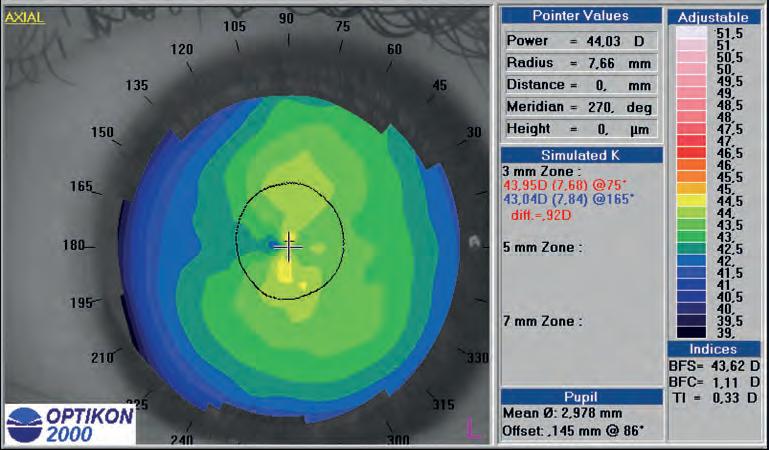
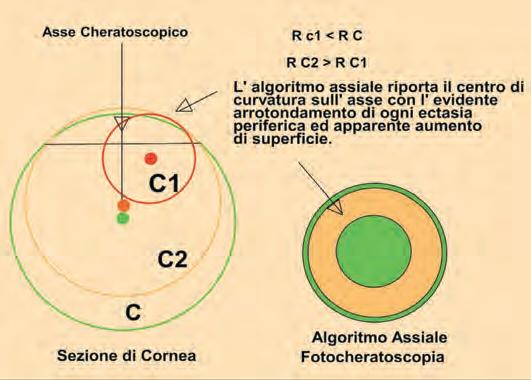
algoritmo assiale. RC1<RC, RC2> RC1. Dove: RC1 = raggio corneale di c1; RC2 = raggio corneale di c2 e RC= raggio corneale di C.
Tale algoritmo è particolarmente indicato per lo studio della cornea centrale ma presenta evidenti limiti nell’interpretazione delle deformazioni periferiche. Una cornea che presenta uno sfiancamento periferico localizzato, come ad esempio nel cheratocono o dopo chirurgia refrattiva miopica, ha un raggio di curvatura periferico più piccolo del centrale. In questo caso il centro di curvatura non può giacere sull’asse cheratoscopico e l’algoritmo assiale sposta il centro di curvatura (in modo fittizio) fino ad intercettare l’asse cheratoscopico stesso. Così facendo si spalma l’aumento di curvatura su un’area più ampia di quella reale, aumentando in maniera errata il raggio
di curvatura. Si ottiene quindi una rappresentazione falsata (dell’ectasia periferica) che non mette correttamente in risalto una piccola bozza di sfiancamento ma trasforma l’ectasia in un aumento di curvatura con base più ampia, lo stesso ragionamento vale per il ginocchio di transizione dopo chirurgia miopica (Figura 5).
L’algoritmo assiale è utile comunque perché offre una visione d’insieme pur avendo il limite di non mettere in evidenza i bruschi cambi di curvatura localizzati in media periferia.
Per ovviare a questo limite, è necessario utilizzare un algoritmo differente secondo il quale il centro di curvatura non cade sull’asse cheratoscopico, questo si chiama algoritmo Locale o Tangenziale o True.
In figura 6 la topografia corneale di un cheratocono in scala assoluta con il tipico aumento di curvatura spalmato nella zona infero-temporale. L’algoritmo assiale interpreta erroneamente la bozza di sfiancamento che risulta più ampia di quanto è in realtà.
Algoritmo Locale, o Tangenziale o True L’algoritmo locale, o tangenziale o True, prevede che il raggio della curvatura in analisi, possa non essere coincidente con l’asse cheratoscopico e riconosce così le variazioni di curvatura in media periferia anche se i centri di curvatura non sono posizionati sull’asse cheratoscopico. Risulta molto utile quindi per l’analisi di cornee con variazioni di curvatura localizzate perifericamente. Un esempio tipico è il caso di cornee operate di chirurgia refrattiva con tecniche di appiattimento centrali (presenza di un ginocchio
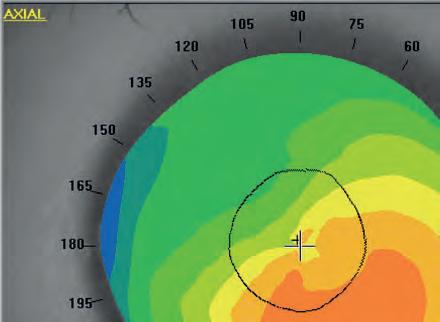



di transizione nei trattamenti laser miopici o nelle cheratotomie radiali) o nel caso di ectasie periferiche (cheratocono – in questo caso non avremo un anello ma un’area di sfiancamento circolare).
Nella rappresentazione secondo lo schema della sezione di cornea, ruotando la sezione per 360° si ottiene un anello rosso (Figura 7).
L’algoritmo locale, tangenziale o true permette di valutare quindi situazioni in cui sono presenti aumenti di curvatura periferici ottenendo rappresentazioni più consone alla forma reale.
In figura 8 abbiamo rappresentazioni topografiche con algoritmo True di alcune condizioni caratterizzate da un aumento di curvatura in media periferia.
Algoritmo refrattivo
L’algoritmo refrattivo è indicato nello studio della refrazione della cornea. È quindi funzionale e scarsamente morfologico. L’algoritmo refrattivo è legato al percorso che i raggi fanno attraversando mezzi con indice di refrazione diverso. Ovviamente il raggio di curvatura incide sul percorso della luce. I raggi periferici, in una superficie sferica, sappiamo andare a fuoco prima di quelli parassiali (miopizzazione periferica) ed il potere diottrico della lente aumenta quindi dal centro alla periferia. Questo algoritmo considera quindi il percorso dei raggi luminosi in relazione alla loro incidenza su una superficie curva (Figura 9).

La figura 10 mostra la ricostruzione cromatica di una superficie sferica regolare analizzata con l’algoritmo refrattivo e con l’algoritmo assiale o locale. L’algoritmo refrattivo evidenzia la variazione del potere diottrico dal centro alla periferia in seguito alla miopizzazione periferica dei raggi; si otterrà così una differente rappresentazione cromatica tra il centro e la periferia. La rappresentazione con algoritmo assiale o locale di una superficie sferica regolare risulta invece uniforme in quanto non sono presenti variazioni di curvatura.
In figura 11 le topografie di una superficie sferica
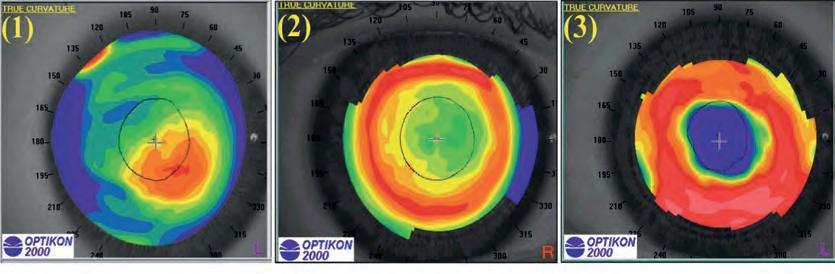

La rappresentazione diottrica di una cheratoscopia è basata sull'ottica parassiale, in cui si semplifica la refrazione utilizzando la legge del diottro semplice. In realtà l'aberrazione di sfericità periferica aumenta il potere diottrico di una superficie sferica in periferia.

analizzata con algoritmo assiale, algoritmo True e algoritmo refrattivo. Con il True si notano solo piccoli artefatti sparsi smussati invece dell’algoritmo assiale. L’algoritmo refrattivo evidenzia quindi il potere convergente funzionale della cornea in periferia. È simile all’algoritmo assiale ma è indicato per lo studio refrattivo della cornea. Risulta di scarsa utilità pratica e non è adatto allo studio della morfologia corneale. La figura 12 mostra la rappresentazione di una cornea normale con algoritmo assiale e con algoritmo refrattivo in scala normalizzata: la zona periferica rossa nella mappa analizzata con algoritmo refratti-



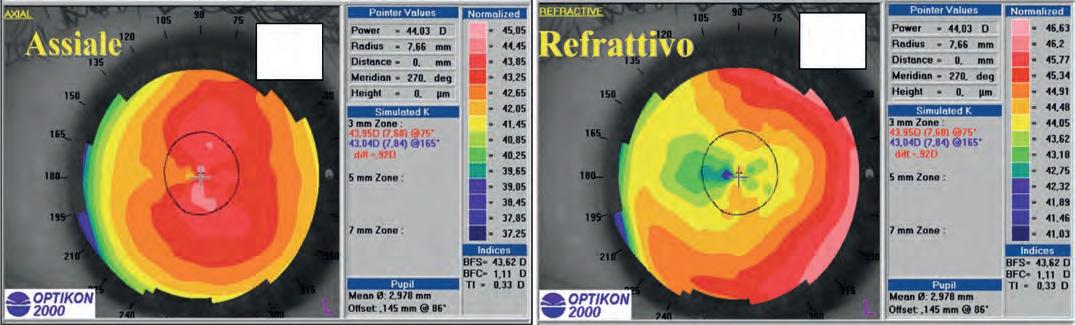
vo esprime una miopizzazione dei raggi in periferia per l’aberrazione sferica presente sulla superficie corneale.
Algoritmi Altitudinali
Nel caso di una diagnosi differenziale di un aumento di potere corneale medio periferico, è necessario distinguere se si tratta di un incurvamento che origina dalla parte centrale della cornea, o di un’ectasia periferica, avendo però sempre presente che la diagnosi differenziale è relativa al punto di fissazione che è vicino all’apice corneale. Questa diagnosi è molto importante per stabilire se una cornea presenta una deformazione patologica (ectasia tipo cheratocono o post trapianto o post Lasik).
Nell’astigmatismo congenito, rispetto al centro della cornea, è presente un incurvamento che parte dalla zona centrale della cornea, si prolunga verso la media periferia e va riducendosi verso la periferia stessa (Figura 13).
Nel caso di un’ectasia localizzata, come ad esempio nel cheratocono, abbiamo un aumento di curvatura nella media periferia ma questa, a differenza dell’astigmatismo congenito, va ad appiattirsi centralmente e perifericamente (Figura 14).
Nell’incurvamento quindi il potere diottrico dell’area in esame rimane costante o aumenta dal centro alla periferia della cornea; nell’ectasia invece il potere diottrico è massimo in corrispondenza dell’ectasia e diminuisce progressivamente verso il centro e verso la periferia. È importante ricordare che la diagnosi differenziale tra incurvamento ed ectasia è relativa al punto di fissazione. In figura 15 un semplice esempio per dimostrare come varia la percezione di un aumento di curvatura rispetto al punto di fissazione pur avendo la stessa morfologia.
In figura 16 l’immagine di un occhio in sezione dove il punto di fissazione dell’osservatore è posto sulla sclera periferica ed è possibile osservare la differenza morfologica tra un incurvamento ed un’ectasia.

con appiattimento verso la zona ottica centrale e periferica.

Nell’analisi di una variazione di curvatura è necessario ricordare che il nostro cervello opera automaticamente un confronto con una superficie sferica regolare (Figura 17).
Il topografo deve perciò essere in grado di rappresentare una variazione morfologica e rendere intuibile all’esaminatore se si tratta di una superficie ectasica o infossata rispetto ad una superficie di riferimento. Questo è il concetto delle mappe altitudinali. In figura 18 sono rappresentate schematicamente le sezioni di due sfere con raggi di curvatura identici (RC=RC1) ma con diversa posizione del centro di curvatura nello spazio. Se si ruotano le sezioni per 360° su un’asse detto cheratoscopico ed analizziamo l’immagine con l’algoritmo assiale, la curvatura periferica

viene allargata e spalmata su uno spazio maggiore. Di conseguenza un algoritmo assiale non evidenzia il reale profilo, né morfologico né funzionale, di una cornea che presenta una curvatura periferica con lo stesso raggio ma diverso centro. Nella rappresentazione cromatica che si ottiene, la cornea apparirà più curva al centro e più piatta in periferia.
Lo stesso caso analizzato con l’algoritmo locale (o Tangenziale o True) riferito a due curve con lo stesso raggio di curvatura e quindi con lo stesso potere diottrico, mostra la stessa curvatura e non fornisce quindi informazioni sulla reale morfologia (Figura 19).
In queste situazioni complesse, l’analisi può essere effettuata mediante l’algoritmo altitudinale che confronta le due curvature con una superficie sferica ide-

incurvamento/ectasia. Viene ricostruito un appiattimento periferico inesistente da un punto di vista morfologico.
Algoritmo Locale
Incurvamento / Ectasia

incurvamento/ectasia. Non si evidenzia la forma della cornea in come in periferia
ale di riferimento, centrata sull’asse del cheratoscopio. Nel caso del Keratron (Optikon) tale algoritmo è lo Spherical Offset.
Analizzando le due curve C e C1, aventi lo stesso raggio di curvatura, e confrontandole con la curva C2 (curva nota posta come riferimento), è possibile osservare che la curva C è interna mentre la curva C1 è esterna perifericamente rispetto alla curva di riferimento C2. Quindi dall’analisi con una superficie

Figura 21. Spherical offset: rappresentazione pseudoisocromatica incurvamento/ectasia. La differenza fra la cornea in esame e la curva di riferimento viene rappresentata con falsi colori. I colori al di fuori.

incurvamento/ectasia. Le curve C e C1 hanno lo stesso raggio ma il centro è posizionato in zone differenti. C ha un percorso in incurvamento mentre C1 in ectasia.
sferica di riferimento (analisi altitudinale) è possibile stabilire se è presente un incurvamento od un’ectasia di due curve che hanno lo stesso raggio (Figura 20). L’algoritmo altitudinale effettua dunque un’analisi morfologica grazie ad un confronto con una curva nota posta come riferimento. Le variazioni altitudinali vengono rappresentate con una scala pseudoisocromatica.
Le variazioni in altezza delle superfici corneali (C1 e C) dalla sfera di riferimento (C2) sono ricostruite con colori freddi che corrispondono a valori negativi (infossamenti) e con colori caldi che corrispondono ad elevazioni (ectasie) (Figura 21).
Testo tratto dal libro "Appunti di SemeiOTTICA fisiopatologica" (2023)
Seguirà nei prossimi numeri.
Durante il congresso SICSSO, riconosciuto a livello internazionale come uno dei più importanti eventi dedicati alla cornea, abbiamo avuto l’opportunità di conversare con Simone Bagaglia, un chirurgo oftalmico il cui impegno va oltre la sala operatoria. Con un’esperienza che spazia dall’eccellenza chirurgica alla missione umanitaria, Simone incarna la passione per la medicina e il desiderio di fare la differenza nel mondo.
Dalla passione per la fisica alla scelta dell’oftalmologia Il percorso di Simone verso l’oftalmologia è stato influenzato da una combinazione di passioni personali e influenze esterne. “La mia passione per la fisica e la tecnica ha radici profonde, alimentate da una professoressa di scienze che mi ha fatto amare la fisica delle lenti. Inoltre, frequentavo spesso oculisti perché i miei genitori, entrambi con problemi visivi, mi portavano con loro anche in città come Mosca, dove abbiamo vissuto per un periodo e dove si facevano seguire da Fiodoroff.”
Curiosamente, Simone non ha subito scelto la medicina. “Da ragazzo, sognavo di diventare pilota di aerei, ispirato dal film Top Gun. Costruivo modellini di aerei e ho persino frequentato l’Accademia Aeronautica. Tuttavia, dopo dieci giorni, ho capito che la vita militare non faceva per me. Mi sono quindi iscritto a medicina, dove ho riscoperto il mio amore per la fisica e la microchirurgia, elementi chiave dell’oftalmologia.”
La formazione in un contesto di eccellenza
Simone ha ricevuto una formazione chirurgica di

altissimo livello, frequentando la Scuola di Specializzazione dell’Università di Siena, sotto la guida del professor Caporossi, un nome di grande prestigio nel campo dell’oftalmologia. “La Scuola di Siena mi ha dato l’opportunità di apprendere non solo la teoria, ma di lavorare tantissimo in sala operatoria, acquisendo una solida esperienza chirurgica già durante la specializzazione.”
I suoi maestri non si limitano solo a Caporossi. Simone ha lavorato con figure di spicco come Silvio Zuccarini, conosciuto durante la sua esperienza a
Villa Donatello, Luca Menabuoni e Angelo Balestrazzi, con cui collabora ancora oggi. “Ho avuto la fortuna di incontrare molti maestri durante il mio percorso, ognuno dei quali ha contribuito a formarmi come chirurgo. Oltre a Zuccarini e Balestrazzi, devo molto anche a Alberto D’Autilia, che mi ha ispirato nel volontariato, e a Franco Passani e Marco Fantozzi, con cui ho lavorato nel nord della Toscana.”
L’impegno umanitario in Africa
Accanto alla sua carriera in Italia, Simone dedica parte del suo tempo al volontariato in Africa, un’esperienza che ha arricchito profondamente la sua vita professionale e personale. “Collaboro con due associazioni: Occhi della Speranza, un’organizzazione toscana, e Medici Volontari Italiani, una piccola associazione di Cuneo. Questi progetti ci portano in Sierra Leone e Madagascar, dove le condizioni di lavoro sono estremamente difficili ma il valore umano è incalcolabile.”
In questi contesti, Simone si trova spesso a operare in condizioni estreme, senza le attrezzature avanzate a cui è abituato in Italia. “Lavoriamo in sale operatorie dove spesso manca anche una zanzariera, e lo strumentario è obsoleto. Eppure, riuscire a ridare la vista a una persona che non vede da anni è un’esperienza incredibile. Il giorno dopo l’intervento, vedere il sorriso delle persone che tornano a vedere è una sensazione indescrivibile.”
Simone sottolinea anche l’importanza formativa di queste missioni: “Operare in Africa è un’esperienza che consiglio a tutti i colleghi, sia a quelli già formati sia a chi è ancora in fase di specializzazione. Si imparano tantissime cose, non solo dal punto di vista tecnico, ma anche umano. Ci si confronta con barriere linguistiche, strumentazione limitata e condizioni operative molto lontane da quelle a cui siamo abituati in Europa.”
L’importanza della sostenibilità e dei progetti futuri Uno degli obiettivi principali delle missioni è garantire che il lavoro continui anche in assenza del team italiano. “In Sierra Leone, stiamo cercando di formare personale locale e di collaborare con l’università del posto per creare un programma di formazione per i medici africani. Il nostro sogno è che la struttura che abbiamo costruito possa esse-
re gestita in modo autonomo dal personale locale, permettendo alla popolazione di avere accesso a cure oftalmiche continuative.”
Simone è particolarmente entusiasta del futuro di questi progetti: “Ora stiamo ampliando le strutture, costruendo nuovi alloggi per accogliere più volontari e creare una presenza costante sul campo. Collaboriamo con l’Università di Medicina della Sierra Leone e abbiamo in programma di portare specializzandi italiani per fare pratica sotto la nostra guida. Questo ci permetterà di creare una sinergia tra formazione e aiuto umanitario.”
La passione per la subacquea e l’aviazione
Oltre alla medicina, Simone coltiva diverse passioni personali, tra cui la subacquea e l’aviazione. “Ho recentemente conseguito il brevetto di secondo livello per immersioni subacquee, che mi permette di scendere fino a trenta metri. È un’esperienza straordinaria che mi rilassa e mi permette di esplorare il mondo sottomarino.”
Il sogno di volare non è mai svanito del tutto, tanto che Simone ha iniziato a lavorare per ottenere il brevetto di volo: “Volare è sempre stato un sogno per me, fin da quando ero bambino. Ora sto riprendendo quel percorso e mi sto preparando per ottenere la licenza di pilota.”
Non manca la “meccanica” collezionistica che ha visto Simone possedere, smontare e rimontare, decine di “cinquantini" (Vespa 50 – ndr).
Un percorso di equilibrio e dedizione
Simone ha trovato un perfetto equilibrio tra la sua attività professionale in Italia e il suo impegno umanitario in Africa. “Lavoro nel sistema sanitario italiano alcuni giorni alla settimana e il resto del tempo lo dedico alla mia attività privata e ai progetti di volontariato. Sono estremamente soddisfatto di questo equilibrio e del percorso che ho costruito. Il mio obiettivo è continuare a crescere professionalmente, ma soprattutto espandere i progetti umanitari, perché sento che possiamo fare ancora tanto per chi ha più bisogno.”
Simone rappresenta un esempio di come la passione per la medicina, la curiosità e l’umanità possano convivere armoniosamente in una carriera che non solo cura, ma cambia vite.
approfondimenti in collaborazione con le Aziende del settore
Lo scopo di un trattamento di somministrazione topica di luteina è quello di migliorare le strategie di prevenzione fornendo un metodo efficiente nell’arricchire il pigmento maculare e per ottenere una maggiore compliance del paziente alla terapia rispetto alla somministrazione orale.
La luteina
Nel corpo umano, la luteina è concentrata nella macula, l’area centrale della retina deputata alla visione distinta e dei colori, dove agisce da schermo protettivo naturale della funzione ed integrità delle cellule retiniche. Essa è infatti in grado di assorbire selettivamente la luce blu, che risulta particolarmente dannosa, essendo principale cause del danno foto-ossidativo cellulare. La fisiologica presenza di questo pigmento contribuisce pertanto a proteggere le delicate strutture dell’occhio e a conservare la funzione visiva.
La luteina non può essere prodotta dal nostro organismo e viene assunta solo tramite il consumo di alimenti ricchi di questi pigmenti o tramite l’assunzione di integratori. Una volta ingerita per via orale, la luteina viene assorbita e proporzionalmente riesce ad accumularsi selettivamente a livello retinico, ed in particolare nella macula. Dagli studi clinici controllati, in particolare l’Age-Related Eye Disease Study 2 (AREDS 2), è raccomandata la somministrazione di almeno 10 mg al giorno di luteina per bocca al fine di avere un effetto, clinicamente evidente, di riduzione della progressione della Degenerazione Maculare Legata all’Età (DMLE). A seguito di un’integrazione orale giornaliera di 10 mg di luteina (dosaggio più comune nei prodotti in commercio), è stato dimostrato che la concentrazione plasmatica di luteina aumenta da 3 a 5 volte rispetto ai valori basali negli adulti sani e nei soggetti affetti da DMLE.

Un aumento sostanziale dei pigmenti maculari può essere riscontrato solo dopo almeno tre mesi di integrazione orale e può essere influenzata da diversi fattori coinvolti nel suo assorbimento e trasporto plasmatico:
• tipo di luteina
• quantità di grassi nella dieta
• concomitante ingestione di fibre
• fattori genetici
• età
Il maggior limite dell’assunzione orale giornaliera è tuttavia la scarsa compliance della maggior parte dei pazienti, che dopo un periodo più o meno lungo, tende ad interrompere l’integrazione di luteina. L’interruzione dell’assunzione di luteina, tuttavia, fa perdere dopo pochi mesi ogni beneficio della terapia e la degenerazione maculare può continuare a progredire. (1)
Nuova metodologia di somministrazione di luteina mediante IONTOFORESI SCLERALE
Recentemente è stato brevettato un nuovo metodo di somministrazione della luteina per via topica, denominato IONTORETINA®
Si tratta di un trattamento di iontoforesi che viene eseguito con un dispositivo medico, certificato CE, per la somministrazione topica oculare di luteina attraverso la sclera.
Lo scopo della somministrazione topica di luteina è quello di veicolare una concentrazione maggiore del carotenoide alla macula, intensificandone gli effetti protettivi e minimizzando i limiti della ridotta compliance dei pazienti all’integrazione orale, come sopra esposto.
Attraverso il principio dell’elettroforesi, la iontoforesi consente la veicolazione di alcune tipologie di sostanze ionizzate nel tessuto bersaglio attraverso i tessuti

oculari esterni (in questo trattamento la sclera). Durante la iontoforesi, la corrente pulsata applicata tramite un elettrodo a forma di imbuto posto a contatto dell’epitelio che ricopre la sclera e un secondo elettrodo posto sulla cute intorno all’orbita, consente la formazione di un microcampo elettrico unidirezionale attraverso l’epitelio congiuntivale e la sclera, che permette di far penetrare la soluzione di luteina ionizzata. La iontoforesi non induce surriscaldamento dei tessuti e non danneggia gli epiteli dei tessuti oculari. Gli elettrodi sono collegati ad un generatore di corrente pulsata a bassissima intensità (2.5 mA). La durata della somministrazione durante l’applicazione di iontoforesi sclerale è di quattro minuti.
Il mantenimento dell’integrità della superfice oculare durante il trattamento (non è necessario rimuovere gli
epiteli corneali o sclerali) consente di eliminare teoricamente ogni complicanza legata all’intervento stesso, come evidenziato negli studi preclinici e clinici eseguiti sulla procedura.1,2
È un dispositivo medico composto da due Kit.
Il primo kit Iontoretina è un Medical Device di classe IIB e contiene:
– Siringa pre-riempita, sterile monouso contenente 2 ml di LIPO+, una soluzione ipotonica liposomiale cationica di LUTEINA (0,1% di luteina cristallina FloraGLO®, Kemin Foods L.C.)
– Applicatore oculare corneo-sclerale sterile monouso per iontoforesi
– Elettrodo di ritorno
Il secondo Kit Iontoretina K-IONO è un Medical Device di classe IIA e contiene:
– Generatore K IONO
– Cavo di connessione caricatore per il generatore.
Dati preclinici sul nuovo dispositivo di trattamento per iontoforesi sclerale
Dopo la iontoforesi sclerale, la microscopia a due fotoni è stata utilizzata per valutare la quantità di luteina che raggiunge la regione maculare nella retina di globi oculari umani di donatori.
Un'ora dopo la iontoforesi, è stata riscontrata la presenza di liposomi di luteina sia nella retina centrale che periferica degli occhi trattati.
Le maggiori differenze tra occhi trattati e controlli sono state riscontrate negli strati retinici tra i fotorecettori e le fibre di Henle. La concentrazione di luteina maculare era di 40 μM aumentando così la quantità di luteina nella macula di 1,9 volte rispetto ai controlli. (Valori aumentati del 90%)1
La spettroscopia Raman è stata utilizzata per confermare l'efficacia della somministrazione di iontoforesi sclerale della soluzione di luteina caricata positivamente alla retina di globi oculari umani di donatori. Un'ora dopo la iontoforesi, la sclera interna, la coroide e la periferia della retina erano notevolmente arricchite con luteina negli occhi trattati; non è stata trovata luteina nelle stesse regioni oculari dei campioni non trattati. La concentrazione media di luteina nella macula dei campioni trattati è risultata 1,3 volte maggiore rispetto ai controlli. (Valori aumentati del 30%)1
Key points
• Nuovo metodo di somministrazione topica della luteina
• L'applicazione diretta nella macula arricchisce efficacemente il pigmento maculare
• Maggiore compliance del paziente rispetto alla somministrazione orale
• Veloce: l'applicazione di iontoforesi sclerale dura 4 minuti
• Sicuro e ben tollerato
Studio clinico pilota sulla somministrazione di luteina tramite iontoforesi sclerale
Uno studio pilota è stato condotto per confermare la sicurezza e valutare la tollerabilità del trattamento nei pazienti con Degenerazione Maculare Legata all’Età (DMLE).
La valutazione della sicurezza della iontoforesi sclerale della luteina è stata determinata fornendo ai pazienti trattati un questionario da compilare per l'autovalutazione del prurito/fastidio oculare, della lacrimazione, della fotofobia e del discomfort una settimana dopo l'intervento.
I pazienti non hanno lamentato dolore o fastidio durante il trattamento.
Dopo una settimana, il punteggio relativo alla tollerabilità riportato dal paziente era buono per tutti i sintomi.1
1. Lombardo M, Serrao S, Lombardo G. Challenges in Age-Related Macular Degeneration: From Risk Factors to Novel Diagnostics and Prevention Strategies. Front Med (Lausanne). 2022 Jun 6; 9:887104. doi: 10.3389/fmed.2022.887104. PMID: 35733877; PMCID: PMC9207205. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9207205/pdf/fmed09-887104.pdf
2. Lombardo M, Villari V, Micali N, Roy P, Sousa SH, Lombardo G. Assessment of trans-scleral iontophoresis delivery of lutein to the human retina. J Biophotonics. 2018 Mar;11(3). doi: 10.1002/jbio.201700095. Epub 2017 Sep 8. PMID: 28700128. https://pubmed.ncbi. nlm.nih.gov/28700128/
Ulrich Spandau
Edizione italiana a cura di Alfonso Anania
Presentazione del Prof. Stanislao Rizzo



FABIANO GRUPPO
EDITORIALE
Redazione: Strada 4 Milano Fiori, Palazzo Q7 – 20089 Rozzano (MI)
Sede operativa: FGE srl – Regione Rivelle 7/F – 14050 Moasca (AT) Tel. 0141 1706694 – Fax 0141 856013 – e-mail: info@fgeditore.it – www.fgeditore.it
Menicon Co. Ltd in prima linea all’International Myopia Conference con il team Ricerca e Sviluppo
Dal 25 al 28 settembre si è svolto a Sanya, sull’isola di Hainan in Cina, l’International Myopia Conference - IMC, evento biennale di primaria importanza sulla miopia. Organizzato dalla società AIER EYE Hospitals, una delle maggiori realtà oftalmologiche del continente asiatico con oltre 800 cliniche e circa 7000 oculisti, il congresso ha accolto circa mille partecipanti provenienti da oltre 50 Paesi, compresa una delegazione italiana.
Il team Ricerca e Sviluppo di Menicon Co. Ltd ha presentato studi relativi all’efficacia e sicurezza del controllo della progressione della miopia con lenti a contatto con un particolare approfondimento sull’ortocheratologia.
Menicon Bloom™ è un sistema completo che include

due differenti opzioni di lenti a contatto ad uso diurno e notturno approvate CE specificamente per il controllo della progressione miopica nei bambini. In combinazione con soluzioni appositamente formulate per la manutenzione delle lenti, un software di applicazione all'avanguardia e un'innovativa app per monitorare e comunicare con i portatori, fornisce tutti gli strumenti per una gestione sicura ed efficace della miopia.
Le ricerche cliniche dimostrano che l’approccio combinato del sistema Menicon Bloom può ridurre significativamente la velocità di progressione della miopia, migliorando così la qualità della visione e diminuendo il rischio di patologie oculari legate alla miopia elevata in età adulta.
Durante i quattro giorni di conferenze, sono stati evi-



denziati dal team R&D, i progressi tecnologici nel design delle lenti a contatto e le collaborazioni con vari istituti di ricerca per sviluppare ulteriori soluzioni efficaci, ponendo l’accento sull’importanza di approcci basati su evidenze scientifiche.
Un’attenzione particolare è stata dedicata ai Paesi del sud-est asiatico, dove l’incidenza della miopia raggiunge anche l’80%.
In queste regioni, le istituzioni hanno implementato iniziative preventive che coinvolgono l’intera società, tra cui attività scolastiche all’aperto e controlli refrattivi semestrali, a cui si affiancano soluzioni come occhiali e lenti a contatto multifocali, ortocheratologia e atropina.
Un altro tema di grande interesse è stato l’integrazione dell’intelligenza artificiale (IA), sia nella ricerca genetica e statistica sulla miopia, sia nei sistemi di gestione e controllo della patologia. L’applicazione dell’IA offre infatti nuove prospettive nell’analisi dei dati e nelle tec-
niche di monitoraggio tra cui diagnosi precoce, previsioni e piani di trattamento personalizzati, sviluppo e ottimizzazione di tecnologie più avanzate.
Fabio Carta, Global Professional Services Manager Myopia Management Business Division, Menicon Co. Ltd. ha dichiarato: “È stata una preziosa opportunità di crescita personale e professionale confrontarsi con esperti internazionali su un tema di così grande attualità. In Menicon, ci dedichiamo a sostenere i professionisti della vista nella lotta contro la miopia, offrendo strumenti all’avanguardia che testimoniano il nostro costante impegno.
Spero di poter partecipare al prossimo evento, che si terrà nel 2026 presso l’Università di optometria texana a Houston.”
Per informazioni sul programma Menicon Bloom™ e i prodotti correlati visitare il sito www.meniconbloom.com

Parte I Segmento anteriore



FABIANO GRUPPO
EDITORIALE


Redazione: Strada 4 Milano Fiori, Palazzo Q7 – 20089 Rozzano (MI) Sede operativa: FGE srl – Regione Rivelle 7/F – 14050 Moasca (AT) Tel. 0141 1706694 – Fax 0141 856013 – e-mail: info@fgeditore.it – www.fgeditore.it





































































































































