GENIE



Via www.ididdit.be heb je toegang tot het onlineleerplatform bij GENIE Chemie leerboek 5
Activeer je account aan de hand van de onderstaande code en accepteer de gebruiksvoorwaarden. Kies je ervoor om je aan te melden met je Smartschool-account, controleer dan zeker dat je e-mailadres aan dat account gekoppeld is. Zo kunnen we je optimaal ondersteunen.
Let op: deze licentie is uniek, eenmalig te activeren en geldig voor een periode van 12 maanden na activatie.
Help, de activatiecode hierboven is al gebruikt!
Krijg je bij het activeren van de bovenstaande code de melding dat de activatiecode reeds in gebruik is? Dan ben je wellicht niet de eerste leerling die met dit leerboek aan de slag gaat. Op vanin.be/leerboeklicentie kun je terugvinden welke stappen je kunt ondernemen of hoe je een nieuwe licentie kunt aankopen.
Tip: Normaal gezien mag je niet schrijven in een leerboek. Per uitzondering mag jij na activatie de bovenstaande activatiecode doorstrepen.
Fotokopieerapparaten zijn algemeen verspreid en vele mensen maken er haast onnadenkend gebruik van voor allerlei doeleinden. Jammer genoeg ontstaan boeken niet met hetzelfde gemak als kopieën. Boeken samenstellen kost veel inzet, tijd en geld. De vergoeding van de auteurs en van iedereen die bij het maken en verhandelen van boeken betrokken is, komt voort uit de verkoop van die boeken. In België beschermt de auteurswet de rechten van deze mensen. Wanneer u van boeken of van gedeelten eruit zonder toestemming kopieën maakt, buiten de uitdrukkelijk bij wet bepaalde uitzonderingen, ontneemt u hen dus een stuk van die vergoeding. Daarom vragen auteurs en uitgevers u beschermde teksten niet zonder schriftelijke toestemming te kopiëren buiten de uitdrukkelijk bij wet bepaalde uitzonderingen. Verdere informatie over kopieerrechten en de wetgeving met betrekking tot reproductie vindt u op www.reprobel.be. Ook voor het digitale lesmateriaal gelden deze voorwaarden. De licentie die toegang verleent tot dat materiaal is persoonlijk. Bij vermoeden van misbruik kan die gedeactiveerd worden. Meer informatie over de gebruiksvoorwaarden leest u op www.ididdit.be
© Uitgeverij VAN IN, Wommelgem, 2023
De uitgever heeft ernaar gestreefd de relevante auteursrechten te regelen volgens de wettelijke bepalingen. Wie desondanks meent zekere rechten te kunnen doen gelden, wordt verzocht zich tot de uitgever te wenden.
Credits
p. 8 foto Applet gaswet: Simulation by PhET Interactive Simulations © University of Colorado Boulder, licensed under CC-BY-4.0 (https://phet. colorado.edu), p. 21 foto Frisdrank: monticello © Shutterstock, p. 22 foto Alcoholcontrole: Karolis Kavolelis © Shutterstock, p. 24 foto Alberto Contador: zixia © Shutterstock, p. 25 foto CO2-concentratie in de lucht (maandelijks) © NOAA, p. 25 foto CO2-concentratie in de lucht (jaarlijks) © NOAA, p. 52 foto Clubje van geniale wetenschappers: Emilio Segrè / American Institute of Physics © Science Photo Library, p. 57 foto Stroomnet: Alex Yeung © Shutterstock, p. 63 foto Werner Heisenberg: Alpha Historica © Alamy, p. 67 foto Arnold Sommerfeld © Science Photo Library, p. 79 foto Wolfgang Pauli © Science Photo Library, p. 132 foto Ronald Nyholm © National Portrait Gallery, Londen, p. 133 3D-beeld BH3: fabianfranco436 © Sketchfab, p. 138 3D-beeld HNO3: fabianfranco436 © Sketchfab, p. 151 3D-beeld C6H6: dbr3d © Sketchfab, p. 172 foto Blauw kopersulfaat: Martyn F. Chillmaid © Science Photo Library, p. 177 foto Atomium: © 2023 – www.atomium.be –SOFAM, p. 179 3D-beeld ijs: Justus Mutanen © Sketchfab, p. 222 foto Chloroform: Bettmann / Contributor © Getty Images, p. 227 foto Ether: The first use of ether in dental surgery, 1846. Ernest Board. Wellcome Collection. Public Domain Mark, p. 238 3D-beeld fructose: akasha99 © Sketchfab, p. 243 foto Softenon-baby: Omikron © Science Photo Library p. 27 artikel Botox: Lenderink A. Giftig tiental waar je voor op moet passen [Internet]. Bijwerkingen van werk. 2017 [geciteerd 2 september 2023]. Beschikbaar op: https://bijwerkingenvanwerk.nl/een-giftig-tiental/, p. 31-32 oefening 11, 12 en 14 © Vlaamse Olympiades voor Natuurwetenschappen, p. 65 oefening 4 © Vlaamse Olympiades voor Natuurwetenschappen, p. 92-93 oefening 11, 12, 13, 14 en 15 © Vlaamse Olympiades voor Natuurwetenschappen, p. 171 artikel Bicarbonaat © VRT
Eerste druk 2024 Vormgeving en ontwerp cover: Shtick ISBN 978-94-647-0702-1 Tekeningen: Geert Verlinde, Tim Boers (Studio B), Julie Lefevre D/2023/0078/89 Zetwerk: Barbara Vermeersch Art. 606867/01 NUR 120
1.1 Concentratie van een oplossing
1.3 Massaconcentratie
1.4 Concentratiegrootheden versus massadichtheid
1.5 Oplossingen indampen en verdunnen 14 1.6 Oplossingen met verschillende concentraties aan opgeloste stoffen mengen
2 De procentuele samenstelling van een verbinding 16
3 Fractionele concentratiegrootheden
3.3
1 De grondtoestand en aangeslagen toestand van een elektron
Energie als
1 Het uitsluitingsprincipe van Pauli
2 Opvullingsvolgorde van de orbitalen
3 Elektronenconfiguratie met spinaanduiding: het hokjesmodel
4 De regel van Hund
5 Inversies en stabiele elektronenconfiguraties 87
Vraagstukken
` HOOFDSTUK 1: Bindingen tussen atomen 108
1 Waarom vormen atomen verbindingen? 108
2 Soorten bindingen 109
3 Op welke afstand zitten de atomen in een molecule? 111
` HOOFDSTUK 2: Lewisstructuren 116
1 Soorten bindingen 116
1.1 Enkelvoudige atoombinding 116
1.2 Dubbele binding 117
1.3 Drievoudige binding 118
1.4 Datieve binding of donor-acceptorbinding 118
2 Lewisstructuren opstellen 119
3 Mesomerie 123
4 Tekortkomingen van de lewisstructuur 126
` HOOFDSTUK 2: De hybridisatie van atomen en de ruimtelijke bouw van molecule 128
1 De promotie van een elektron en de aangeslagen toestand van een atoom 128
2 Hybridisatie en ruimtelijke rangschikking 129
2.1 Tetragonale of sp3-hybridisatie 129
2.2 Trigonale of sp2-hybridisatie 132
2.3 Digonale of sp-hybridisatie 134
3 Het sterisch getal (SG) van het centrale atoom in een verbinding 137
4 De vorming van molecuulorbitalen 141
4.1 De sigma- of σ-binding 143
4.2 De pi- of π-binding 147
5 Vergelijking tussen de σ- en π-binding 154 THEMASYNTHESE 156
` HOOFDSTUK 1: Indeling in stofklassen 161
1 Herhaling 161
1.1 Oxidatiegetal 161
1.2 Anorganische stofklassen 163
2 Stofklassen 165
2.1 De oxiden 165
2.2 De hydroxiden: naam- en formulevorming 167
2.3 De zuren: naam- en formulevorming 168
2.4 De zouten 170
` HOOFDSTUK 2: Eigenschappen van anorganische stoffen 177
1 Herhaling 177 1.1 Roostertypes 177
1.2 Polariteit van bindingen en verbindingen 179
1.3 Intermoleculaire krachten 183
2 Kook- en smeltpunt van anorganische stoffen 184
2.1 Metaalrooster 184
2.2 Ionrooster 186
2.3 Atoomrooster 186
2.4 Molecuulrooster 186
3 Oplosbaarheid van stoffen 188
3.1 Metaalrooster 188
3.2 Ionrooster 189
3.3 Atoomrooster 189
3.4 Molecuulrooster 190
4 Geleidbaarheid van stoffen 191
4.1 Metaalrooster 191
4.2 Ionrooster 191
4.3 Atoomrooster 192
4.4 Molecuulrooster 192 THEMASYNTHESE 195
THEMA 05: ORGANISCHE
` HOOFDSTUK 1:
Naam- en formulevorming van organische stoffen
1 Bindingsmogelijkheden van het koolstofatoom 199
2 Notatiemogelijkheden van een organische stof 200
3 Naamvorming van een organische stof 202
HOOFDSTUKSYNTHESE
` HOOFDSTUK 2:
1 Acyclische verzadigde koolwaterstoffen
1.1 Niet-vertakte alkanen
1.2 Vertakte alkanen
2 Cyclische verzadigde koolwaterstoffen 212
3 Acyclische onverzadigde koolwaterstoffen 214
3.1 Naamvorming van alkenen en alkynen 214
3.2 Formulevorming van alkenen en alkynen 216
` HOOFDSTUK 3:
HOOFDSTUK
eigenschappen
` HOOFDSTUK 6:
Soorten organische reacties
Indeling volgens de aard van de splitsing
Indeling volgens de aard van het aanvallende deeltje
Indeling volgens het reactietype
Voorbeelden van organische reacties
THEMA 06: REACTIESNELHEID voor GO!
` HOOFDSTUK 1: Verklaring van de reactiesnelheid aan de hand van het botsingsmodel
` HOOFDSTUK 2: De gemiddelde en de ogenblikkelijke reactiesnelheid
` HOOFDSTUK 3: Factoren die de reactiesnelheid beïnvloeden
` HOOFDSTUK 4: Reactiesnelheidsconstante en snelheidswet
` HOOFDSTUK 5: Orde van een reactie
Op de website van de FOD Mobiliteit en Vervoer staat duidelijk vermeld wat het wettelijk maximale BAC (bloedalcoholconcentratie in promille) voor automobilisten bedraagt. Voor professionele bestuurders ligt de limiet op 0,2 promille. In Europa zijn er een tiental landen die zelfs nultolerantie hanteren, waaronder Roemenië en Hongarije.
Wettelijk maximale BAC
0,8
0,5
0,4
0,3
0,2
0,1
0 geen data
` Wat betekent het precies om 0,2 promille alcohol in je bloed te hebben?
` Kun je dat promillage (of die concentratie) ook nog op een andere manier uitdrukken?
We zoeken het uit!

• de ideale gaswet definiëren en gebruiken bij normomstandigheden.


• de concentratie van oplossingen uitdrukken in g L en mol L .
• eenvoudige stoichiometrievraagstukken oplossen.
• de ideale gaswet gebruiken in (complexere) chemische vraagstukken en bij nietnormomstandigheden.
• enkele andere (fractionele) concentratiegrootheden definiëren en gebruiken;
• omzettingen maken tussen de concentratiegrootheden;
• de concentratiegrootheden gebruiken in vraagstukken.
• stoichiometrievraagstukken oplossen waarbij je je kennis uit het 4e jaar en de nieuwe leerstof uit dit thema moet combineren.
In dit thema ga je een stapje verder met chemische berekeningen. Je gaat rekenen met gegeven grootheden van vaste stoffen, vloeistoffen en gassen. Je werkt in formules met de juiste grootheden en eenheden en kunt vlot omzettingen maken. Ten slotte bekijk je reactievergelijkingen en bereken je de hoeveelheden van de gevormde stoffen (of reactieproducten). Je berekent ook of alle reagentia wegreageren of niet.
Om dat vlot te doen, moet je steunen op de basiskennis die je al in de 2e graad verwierf. In dit onderdeel vind je een overzicht van de grootheden en formules die je al kent en die je in dit thema nog nodig zult hebben. Aan het begin van elk hoofdstuk herhaal je even kort de relevante leerstof uit de 2e graad, voordat je aan de nieuwe leerstof begint.
In de 2e graad leerde je de volgende grootheden kennen, die belangrijk zijn voor het vak chemie.
GROOTHEID MET SYMBOOL
EENHEID MET SYMBOOL gemiddelde relatieve atoommassa<A r > / /
molaire massa M gram mol g mol massa m gram g stofhoeveelheid n mol mol volume V liter L massaconcentratie c gram liter g L
molaire concentratie c mol liter mol L druk p pascal Pa temperatuur θ graden Celsius°C T kelvin K
massadichtheid ρ kilogram per kubieke meter kg m3
Je herinnert je misschien nog dat je in oefeningen (maar ook in het dagelijks leven) niet altijd met die eenheden werkt. Het blijft dus belangrijk om eenheden vlot te kunnen omzetten! Enkele belangrijke omzettingen vind je in tabel 1.
GROOTHEID EENHEID AFGELEIDE EENHEDEN
volume liter
druk pascal
temperatuur
1 m3 = 1 ∙ 103 L 1 L = 1 dm3 = 10-3 m3
1 atm = 1,013 25 ∙ 105 Pa = 1 013 hPa
graden Celsius 0 K = –273,15 °C
kelvin 273,15 K = 0 °C
Vervolgens leerde je ook enkele belangrijke formules, die je meteen ook duidelijk maakten wat het verband is tussen al die grootheden in de chemie.
n = m M
delen door molaire massa
Tabel 1 Enkele veelgebruikte omzettingen aantal mol n
aantal gram m
vermenigvuldigen met molaire massa
m = n M
n = V V m
oplossingen (c, V)
c = n V
n = c · V
N = n · NA vermenigvuldigen met het getal van Avogadro delen door het getal van Avogadro aantal deeltjes
n = N NA
V = n · V m
delen door molair volume vermenigvuldigen met molair volume
deeltjes mol g mol g mol deeltjes mol L mol L mol
gassen (V, V m )
Denk ook nog even aan deze belangrijke waarden:
• constante van Avogadro NA = 6,02 ∙ 1023 deeltjes mol ;
• normomstandigheden (n.o.): een druk van 1 013 hPa en een temperatuur van 273 K;
• bij n.o. (voor gassen): V m = 22,4 L mol ;
• bij n.o. (voor gassen): 1 mol = 22,4 L.
Een ideaal gas is een gas waarbij je veronderstelt dat de aanwezige gasdeeltjes zich ‘ideaal’ gedragen:
• De deeltjes zijn zo klein dat ze geen invloed hebben op het volume van het gas.
• De deeltjes gedragen zich volledig onafhankelijk van elkaar. Er zijn met andere woorden geen interacties tussen de deeltjes van het gas.
Je kunt het gedrag van ideale gassen beschrijven met 3 toestandsfactoren: de druk, het volume en de temperatuur. Het verband tussen die 3 toestandsfactoren wordt voor een ideaal gas gegeven door de ideale gaswet:
∙ V = n ∙ R ∙ T
Daarbij geldt:
p = druk in Pa
V = volume in m3
n = stofhoeveelheid in mol
R = gasconstante (= 8,31 J ∙ mol-1 ∙ K-1) = 8,31 m3 ∙ Pa ∙ mol-1 ∙ K-1
T = temperatuur in K
Het molair gasvolume is het volume dat wordt ingenomen door 1 mol gasdeeltjes van eender welk gas bij een bepaalde druk en temperatuur: V m = V n = R ∙ T p
Bij normomstandigheden (n.o.) is de getalwaarde van het molair gasvolume (dus voor 1 mol gas) voor elk gas gelijk: V m = 22,4 L mol
Naast de normomstandigheden (p = 1 013 hPa en T = 273,15 K), die vaak gebruikt worden, werkt IUPAC met standaardomstandigheden: een standaarddruk van 1 000 hPa en een standaardtemperatuur van 273,15 K. Bij die standaardomstandigheden is de getalwaarde van het molair gasvolume (en dus voor 1 mol gas) voor elk gas gelijk aan 22,7 L mol Merk op dat het molair gasvolume (onder welke omstandigheden dan ook) onafhankelijk is van het soort gas. 1 mol waterstofgas zal dus hetzelfde volume innemen als 1 mol stikstofgas of 1 mol zuurstofgas of …
VOORBEELDVRAAGSTUK
Hoeveel liter neemt 0,29 g C4H10 (n-butaan) in bij een temperatuur van 20 °C en een druk van 1 020 hPa?
Gegeven: • m = 0,29 g n-butaan
• T = (20 + 273,15) K = 293 K
• p = 1 020 hPa = 1 020 ∙ 102 Pa
Gevraagd: V (L) = ?
Oplossing: n = m M = 0,29 g (4 ∙ 12,0 + 10 ∙ 1,0) g mol = 0,0050 mol Ideale gaswet: p
Denk aan de omzettingen!
Bekijk goed de eenheden die gebruikt worden in de ideale gaswet. Zo druk je het volume uit in m³ en niet in liter, en de temperatuur in kelvin in plaats van in graden Celsius.
In de 2e graad werkte je al met de concentratie van oplossingen. Zo maakte je een onderscheid tussen de massaconcentratie en de molaire concentratie. Je definieerde de begrippen ‘opgeloste stof’, ‘oplosmiddel’ (meestal water) en ‘oplossing’. In dit hoofdstuk maak je kennis met enkele nieuwe concentratiegrootheden en leer je hoe je ermee moet rekenen.
LEERDOELEN
L Nieuwe (fractionele) concentratiegrootheden definiëren en gebruiken: massaprocent, massavolumeprocent, volumeprocent, promille, parts per million (ppm) en parts per billion (ppb)
L De procentuele samenstelling van een verbinding berekenen
L Een onderscheid maken tussen massadichtheid en concentratiegrootheden
L Concentratiegrootheden omzetten
L Gebruikmaken van de verdunningsformule en de nieuwe (fractionele) concentratiegrootheden in vraagstukken
1.1 Concentratie van een oplossing
De concentratie van een oplossing bepaalt mee de eigenschappen van de oplossing. Denk maar aan het eenvoudige voorbeeld van koffie met suiker: hoe meer suiker je in de koffie oplost, hoe hoger de concentratie aan suiker en dus hoe zoeter de smaak van de koffie wordt.

Het begrip ‘concentratie’ kun je dus enkel begrijpen als je ook goed snapt wat een oplossing precies is.
Een oplossing bestaat uit een oplosmiddel of solvent (s). Dat kan bijvoorbeeld water zijn. Een oplossing bevat ook een opgeloste stof (d). In het voorbeeld van daarnet was de opgeloste stof suiker. Het geheel, de opgeloste stof en het oplosmiddel samen, noem je de oplossing (S)
Om vraagstukken te kunnen oplossen, is het belangrijk dat je de begrippen ‘opgeloste stof’, ‘oplosmiddel’ en ‘oplossing’ goed uit elkaar houdt.
opgeloste stof of dissolute (d) d
oplosmiddel of solvent (s)
oplossing of solution (S)
Wanneer je de concentratie van een opgeloste stof wilt bepalen, wil je de hoeveelheid van de opgeloste stof in een welbepaalde hoeveelheid oplossing kennen.
c = de hoeveelheid opgeloste stof de hoeveelheid oplossing
De molaire concentratie c, uitgedrukt in mol liter ( mol L ), wordt ook wel de molariteit genoemd (symbool: M). Ze geeft aan welke stofhoeveelheid (aantal mol) van een opgeloste stof aanwezig is in een bepaald volume van een oplossing:
c = n (opgeloste stof) V (oplossing)
Daarbij geldt:
n = stofhoeveelheid van de opgeloste stof (mol)
V = volume van de oplossing (L)
VOORBEELD MOLAIRE CONCENTRATIE
De concentratie van een oplossing die 0,1 mol glucose per liter oplossing bevat, is een 0,1 molaire oplossing van glucose:
c = n (glucose) V (oplossing) = 0,1 mol 1 L = 0,1 mol L = 0,1 M
De massaconcentratie c, uitgedrukt in gram liter (gL), geeft aan welke massa van een opgeloste stof aanwezig is in een bepaald volume van een oplossing:
c = m (opgeloste stof) V (oplossing)
Daarbij geldt:
m = massa van de opgeloste stof (g)
V = volume van de oplossing (L)
VOORBEELD MASSACONCENTRATIE
Je hebt een 0,1 M glucoseoplossing. Bereken de massaconcentratie c ( g L ).
Je kunt de molhoeveelheid glucose eenvoudig omzetten naar de massa glucose door gebruik te maken van de molaire massa van glucose. Die is gelijk aan 180,0 g mol
0,10 mol glucose stemt overeen met 18 gram glucose.
In 1 liter oplossing is er dus 18 gram glucose aanwezig. Met andere woorden: 0,10 mol L of 0,10 M = 18 g L .
TIP
molaire concentratie c = n V (mol L ) en molhoeveelheid n = m M (mol)
massaconcentratie: c = m V = n ∙ M V = c (mol L ) ∙ M ( g mol)
Let op! Het symbool M kan dus zowel de eenheid M zijn, die de molariteit uitdrukt, als de grootheid M, die staat voor de molaire massa (uitgedrukt in gram per mol).
In de 2e graad maakte je al kennis met de grootheid massadichtheid:
GROOTHEID MET SYMBOOL
EENHEID MET SYMBOOL
massadichtheid ρ = m V kilogram per kubieke meter kg m3
Ook de massaconcentratie kun je soms uitdrukken in kg m3 . Daarom is het belangrijk om het onderscheid tussen massadichtheid en massaconcentratie te onthouden. De massadichtheid geeft immers de verhouding weer tussen de massa van een stof (of de oplossing in haar geheel) en het volume dat die stof (of die oplossing in haar geheel) inneemt bij een bepaalde temperatuur.
Je kunt de formule(s) dus eigenlijk beter als volgt noteren:
ρ = m (oplossing) V (oplossing)
ρ = m (stof) V (stof)
MASSADICHTHEID
ρ = m (oplossing) V (oplossing)
ρ = m (stof) V (stof)
MASSACONCENTRATIE
c = m (opgeloste stof) V (oplossing)
VOORBEELD MASSADICHTHEID VERSUS MASSACONCENTRATIE
Een klontje suiker heeft een massadichtheid van 1,59 g cm3 bij kamertemperatuur.
Als je een klontje suiker (m = 5 g) oplost in water en aanlengt tot 100 mL, dan zal de massaconcentratie van de oplossing gelijk zijn aan:
c = m V = 5 g 100 mL = 0,05 g mL = 0,05 g cm3 = 0,05 103 kg m3
In de 2e graad leerde je ook hoe je verdunningen moet berekenen met behulp van de verdunningsformule:
Daarbij steun je op het gegeven dat de hoeveelheid opgeloste stof niet verandert (n1 = n2) wanneer je verdunt met water of een oplossing indampt.

Afb. 2 Opgeloste stof voor en na verdunning voor verdunning na verdunning + V (oplosmiddel) c1 c2
1.6 Oplossingen met verschillende concentraties aan opgeloste stoffen mengen
Als je een zuiver oplosmiddel toevoegt aan een stof, verandert de hoeveelheid van de opgeloste stof niet. Dat zal natuurlijk wel het geval zijn als je aan een oplossing een andere oplossing toevoegt die ook een hoeveelheid van die opgeloste stof bevat.
Als de toegevoegde oplossing (n2) een lagere concentratie heeft dan de eerste oplossing (n1), zal de concentratie na de samenvoeging (ntot) ook lager worden. Op die manier kun je een oplossing dus verdunnen. Maar let op: de hoeveelheid van de opgeloste stof voor en na de verdunning is dus niet meer hetzelfde.
Afb. 3 Oplossingen met een verschillende concentratie van dezelfde opgeloste stof mengen
In dit specifieke geval moet je de verdunningsformule herwerken.
Als je bij het aantal mol vóór verdunning (n1) het aantal mol uit de verdunnende oplossing (n2) optelt, krijg je een nieuw totaal aantal mol van de opgeloste stof (ntot):
Vermits het aantal mol altijd gegeven wordt door n = c ∙ V, kun je het volgende besluiten:
Het bekomen volume Vtot is de som van de samengevoegde volumes V1 en V2, wat voor de formule het volgende betekent:
1 · V1 + c2 · V2 = ctot · (V1 + V2)
Merk op dat de bekomen concentratie ctot altijd lager is dan de beginconcentratie c1, maar hoger blijft dan de concentratie van de verdunnende oplossing c2.
WEETJE
Vind je de koffie in de pot maar aan de slappe kant? Het kan helpen om er een kop extra sterke espresso aan toe te voegen. De koffie zal uiteindelijk sterker smaken dan de originele koffie, maar vanzelfsprekend minder sterk dan de espresso.
VOORBEELDVRAAGSTUK
Welk volume van een zilvernitraatoplossing van 0,100 mol L moet je bij 80,0 mL
zilvernitraatoplossing van 0,500 mol L voegen om een oplossing van 0,200 mol L te bekomen?
Gegeven:
• c1 = 0,500 mol L
• V 1 = 80,0 mL of 0,0800 L
• c2 = 0,100 mol L
• ctot = 0,200 mol L
Gevraagd: V2 = ?
Oplossing: c1 · V1 + c2 · V2 = ctot · (V1 + V2)
0,500 mol L · 0,0800 L + 0,100 mol L · V2 = 0,200 mol L · (0,0800 L + V2)
Als je de vergelijking oplost naar V2, bekom je:
0,0400 mol + 0,100 mol L · V2 = 0,0160 mol + 0,200 mol L · V2
0,0240 mol = 0,100 mol L · V2 V2 = 0,0240 mol 0,100 mol L = 0,240 L of 240 mL
Conclusie: Het volume (V2) van de zilvernitraatoplossing van 0,100 mol L dat je moet toevoegen, is 240 mL.
Je kunt de samenstelling van een stof weergeven als een procentuele samenstelling van de massa van de elementen in de verbinding.
Als je dat in een formule giet, krijg je:
massa-aandeel van X = totale massa van alle X-atomen in de formule totale formule- of molecuulmassa van de verbinding
Zo bekom je een getal tussen 0 en 1, dat men vaak ook weergeeft als een percentage.
VOORBEELDVRAAGSTUK
Water bestaat uit 11 % waterstof en 89 % zuurstof. Bereken de procentuele samenstelling.
Gegeven: • H2O
• M (H) = 1,0 g mol
• M (O) = 16,0 g mol
Gevraagd: procentuele samenstelling = ?
Oplossing: M (H2O) = 2 · 1,0 g mol + 1 · 16,0 g mol = 18,0 g mol
massa-aandeel van H = 2,0 g mol 18,0 g mol = 0,11 of 11 %
massa-aandeel van O = 16,0 g mol 18,0 g mol = 0,89 of 89 %
Omgekeerd kun je uit die procentuele samenstelling ook de verhoudingsformule van de stof afleiden.
VOORBEELDVRAAGSTUKKEN
1 Een verbinding (HxOy) bevat 5,9 % H-atomen en 94,1 % O-atomen.
Om welke stof gaat het?
Gegeven:
• massa-aandeel H = 5,9 %
• massa-aandeel O = 94,1 %
Gevraagd: x en y = ?
Oplossing: M (H) = 1,0 g mol
M (O) = 16,0 g mol
massa-aandeel van H = x · 1,0 g mol (x · 1,0 + y · 16,0) g mol = 0,059 of 5,9 %
massa-aandeel van O = y · 16,0 g mol (x · 1,0 + y · 16,0) g mol = 0,941 of 94,1 %
Je verkrijgt een stelsel van 2 vergelijkingen met 2 onbekenden:
x · 1,0 = 0,059 · (x + 16,0 · y) y · 16,0 = 0,941 · (x + 16,0 · y)
x = 0,059x + 0,944y 16,0y = 0,941x + 15,056y
(1 – 0,059)x = 0,944y (16,0 – 15,056)y = 0,941x
0,941x = 0,944y
0,944y = 0,941x
x = y = 1
De verbinding heeft 2 keer index 1. Het gaat dus om OH: de alcoholgroep in organische stoffen of het hydroxide-ion in anorganische verbindingen.
2 Een stof bevat 17 % H-atomen en 83 % C-atomen. Om welke stof (CxHy) gaat het?
Gegeven: • massa-aandeel H = 17 %
• massa-aandeel C = 83 %
Gevraagd: x en y = ?
Oplossing: M (H) = 1,0 g mol
M (C) = 12,0 g mol
massa-aandeel van H = y · 1,0 g mol
(y · 1,0 + x · 12,0) g mol = 0,17 of 17 %
massa-aandeel van C = x · 12,0 g mol
(y · 1,0 + x · 12,0) g mol = 0,83 of 83 %
Je verkrijgt een stelsel van 2 vergelijkingen met 2 onbekenden:
y · 1,0 = 0,17 · (y + 12,0 · x)
x · 12,0 = 0,83 · (y + 12,0 · x)
y = 0,17y + 2,0x
12,0x = 0,83y + 10x
(1 – 0,17)y = 2,0x
(12,0 – 10)x = 0,83y
0,83y = 2,0x
2x = 0,83y
y = 2,4x
Je werkt uiteraard niet met kommagetalen als het gaat om het aantal atomen:
x = 1 → y = 2,4 (kan niet)
x = 2 → y = 4,8 (kan niet)
x = 3 → y = 7,2 (kan niet)
x = 4 → y = 9,6 (kan niet)
x = 5 → y = 12
Conclusie: De verbinding is C5H12 of pentaan.
In het algemeen kun je het begrip concentratie definiëren als de verhouding van een grootheid (massa, molhoeveelheid, aantal deeltjes, volume) van de opgeloste stof tot een grootheid (massa, molhoeveelheid, aantal deeltjes, volume) van de oplossing.
Bij de massaconcentratie (c) gebruik je de massa van de opgeloste stof (m) en het volume van de oplossing (V). Bij de molaire concentratie (c) gebruik je de molhoeveelheid van de opgeloste stof (n) en het volume van de oplossing (V). Er bestaan echter nog andere concentratiegrootheden, die ook een concentratie weergeven. Je spreekt dan van fractionele concentratiegrootheden.
Massaprocent m% is de verhouding van de massa van de opgeloste stof tot de totale massa van de oplossing, vermenigvuldigd met 100. Het massaprocent is een onbenoemd getal
Je zou het simpelweg kunnen voorstellen als het aantal gram opgeloste stof per 100 g oplossing:
m% → g
100 g (oplossing)
De formule is als volgt:
m% = m (opgeloste stof)
m (oplossing) ∙ 100 %
Massaprocent wordt vaak gebruikt wanneer je de concentratie van vaste stoffen in vaste oplossingen wilt definiëren, zoals de hoeveelheid suiker in een pot choco of het percentage aan zout in een mengsel van peper en zout.
VOORBEELDEN MASSAPROCENT
• ‘Een staal ijzererts met een onzuiverheid van 25 %’ betekent: er bevinden zich 25 g onzuiverheden (en dus 75 g ijzererts) in een totale massa staal van 100 g.
• ‘Een suikeroplossing met m% = 35 %’ wil zeggen: er bevindt zich 35 g suiker in 100 g suikeroplossing.
Volumeprocent V% gebruik je vooral wanneer je een vloeistof oplost in een oplossing. Het volumeprocent is de verhouding van het volume van een opgeloste stof tot het totale volume van de oplossing, vermenigvuldigd met 100. Ook het volumeprocent is een onbenoemd getal, maar meestal duid je het aan met %. Je zou het simpelweg kunnen voorstellen als het aantal milliliter opgeloste stof per 100 mL oplossing.
V% → mL (opgeloste stof) 100 mL (oplossing)
De formule is als volgt: V% = V (opgeloste stof) V (oplossing) ∙ 100 %
WEETJE
Massaprocent wordt vaak gebruikt bij mengsels van 2 vaste stoffen (bv. suiker in Nutella) en volumeprocent bij oplossingen van 2 vloeistoffen (bv. azijnzuur in azijn). Maar ze worden ook weleens door elkaar gebruikt.
VOORBEELDEN VOLUMEPROCENT
• 100 mL van een waterige oplossing die 5 mL glycerol bevat, heeft een concentratie van 5 % aan glycerol in water.
• Keukenazijn uit de winkel is een 7 %-azijnzuuroplossing. Dat wil zeggen dat er per 100 mL oplossing 7 mL azijnzuur in de fles zit.
Je spreekt hier van een fractionele concentratie.
Een massaprocent van 0,20 (of 20 honderdsten) is hetzelfde als 20 %.
Met het alcoholpercentage van een alcoholische drank bedoelt men het V% aan ethanol dat die drank bevat. In de meeste landen is het verplicht om het alcoholpercentage te vermelden op de verpakking, zeker voor consumptievloeistoffen (alcoholische drank), maar ook bijvoorbeeld bij ontsmettingsmiddelen.

ALCOHOLPERCENTAGE
alcoholvrij bier minder dan 0,1 % cider 2-8,5 %
bier 1,2-12 % (bij gewone pilsbieren 4-6 %) alcopops, breezers 5-8 % wijn 9-16 % (meestal rond de 12-13 %) likeur 15-55 % (bij de meeste merken 20-40 %)
jenever 35-38 %
vodka
35-50 % (meestal 38 %) tequila 35-60 %
cognac 40 % gin 40-55 % raki 42-86 %
‘zuivere’ alcohol 96 % (niet geschikt voor consumptie) absolute alcohol > 99 % (niet geschikt voor consumptie)
Men drukt het alcoholgehalte ook vaak uit in graden (°). Dan spreek je van de alcoholgraad. Dat is echter niets anders dan het volumeprocent aan alcohol.
Het massavolumeprocent m/V% of mV% is de verhouding van de massa van de opgeloste stof op 100 mL oplossing, vermenigvuldigd met 100. Je zou het simpelweg kunnen voorstellen als het aantal gram opgeloste stof per 100 mL oplossing.
m/V% → g (opgeloste stof) 100 mL (oplossing)
De formule is als volgt:
m/V% = m (opgeloste stof) 100 mL oplossing ∙ 100 %
Massavolumeprocent gebruik je meestal als je de concentratie van vaste stoffen in vloeibare oplossingen wilt definiëren.
VOORBEELD MASSAVOLUMEPROCENT
Om de neusjes van baby’s te reinigen, gebruikt men vaak ‘fysiologisch water’, een 0,9 % NaCl-oplossing. Maar ook voor inspuitingen gebruikt men vaak een 0,9 % zoutoplossing. Dat wil zeggen dat er 0,9 g NaCl (zout) is opgelost per 100 mL oplossing.
Het is altijd handig om te weten hoeveel suiker er in frisdrank zit. Als je suikerrijke dranken drinkt, loop je immers een groter risico op diabetes type 2. Hoeveel suiker er in een glas frisdrank zit, hangt af van het soort drank. Wil je het suikergehalte per soort weten? Bekijk dan de onderstaande suikerlijst per frisdrank. 1 suikerklontje heeft een massa van ongeveer 4 g.


Coca-Cola Light
Coca-Cola Zero
ijsthee – Fuze
ijsthee – Lipton Zero
lemon – Sprite Zero
sinas – Fanta 5,6
sinas – Fanta Zero
3.4 Promille
Promille ‰ betekent letterlijk ‘1 duizendste deel’. Een promille geeft dan ook de verhouding van de opgeloste stof tot de totale hoeveelheid oplossing, vermenigvuldigd met 103.
Om daar goed mee te kunnen werken, moet je eerst weten om welk type mengsel het gaat.
Voor gasmengsels gebruik je ‰ ( V V ). Voor vaste mengsels gebruik je ‰ ( m m ) en bij waterige oplossingen maak je gebruik van ‰ ( m V ).
De formules zijn als volgt: vaste mengsels: ‰ = m (opgeloste stof) m (oplossing) ∙ 103
gasmengsels: ‰ = V (opgeloste stof) V (oplossing) ∙ 103
waterige oplossingen: ‰ = m (opgeloste stof) V (oplossing) ∙ 103
Promille wordt het vaakst geassocieerd met de hoeveelheid alcohol in je bloed. Bij een alcoholcontrole meet men het aantal gram alcohol per liter bloed.
‰ = m (opgeloste stof) V (oplossing) ∙ 103

De maximale toegelaten waarde om een voertuig te mogen besturen, bedraagt in België 0,5 promille BAG (het bloedalcoholgehalte). Dat wil zeggen dat er in je bloed maximaal 0,5 gram alcohol per liter (1 000 mL) bloed aanwezig mag zijn. Je zegt dus dat het BAG of de BAC (de bloedalcoholconcentratie) niet hoger mag zijn dan 0,5 promille.
Voor professionele bestuurders is dat maar 0,2 promille.
Hoe bereken je de alcoholconcentratie in je bloed?
Het aantal glazen dat je kunt drinken voordat je 0,5 promille alcohol in je bloed hebt, verschilt van persoon tot persoon. Het hangt onder andere af van je massa, de snelheid waarmee je drinkt, het soort drank, of je al dan niet gegeten hebt, en het feit of je een man of een vrouw bent.
een glas wijn (100 mL van een fles van 0,75 L; 12 % alcohol) 12 % (volumeprocent) alcohol in de fles wijn = 12 mL alcohol per 100 mL wijn
Daarbij heeft alcohol de volgende massadichtheid:
(alcohol)
Daaruit volgt dat 12 mL alcohol deze massa heeft:
9,5 g
Die alcohol wordt gelijkmatig opgenomen in ons lichaam, meer bepaald door ons lichaamsvocht (bloed, weefselvocht ...). Bij mannen is dat lichaamsvocht ongeveer 70 % en bij vrouwen 60 % van het totale lichaamsgewicht. Stel nu dat je, als meisje, een massa hebt van 60 kg. Dan bevat je zo’n 36 kg aan lichaamsvocht. Wanneer je 1 glas wijn drinkt, wordt de 9,5 g alcohol dus verdeeld over 36 kg lichaamsvocht (wat meteen verklaart waarom men de grootheid promille gebruikt). Je bloedalcoholgehalte (BAG-waarde) of promille is dan:
BAG = m (alcohol) in gram m (lichaamsvocht) in kilogram = 9,5 g 36 kg = 0,26 promille
Enkele andere waarden
glas
Drink je liever iets zoeters, dan kom je als meisje van 60 kg na 3 Bacardi Breezers aan een bloedalcoholgehalte van:
BAG = 33 g 36 kg = 0,92 promille
Dat is bijna het dubbele van de wettelijk toegelaten limiet om een voertuig te besturen!
3.5 Ppm
Parts per million ppm, oftewel ‘delen per miljoen’, is ook een maat voor de concentratie. Het is de verhouding van de opgeloste stof tot de totale hoeveelheid oplossing, vermenigvuldigd met 106
Om daar goed mee te kunnen werken, moet je eerst weten om welk type mengsel het gaat. Voor gasmengsels gebruik je ppm ( V V ). Voor vaste mengsels gebruik je ppm ( m m ) en bij waterige oplossingen maak je gebruik van ppm ( m V ).
De formules zijn als volgt:
vaste mengsels: ppm ( m m ) = m (opgeloste stof) m (oplossing) ∙ 106
gasmengsels: ppm ( V V ) = V (opgeloste stof) V (oplossing) ∙ 106
waterige oplossingen: ppm ( m V ) = m (opgeloste stof) V (oplossing)
106
‘Een concentratie van 1 ppm’ wil zeggen dat er 1 g van de opgeloste stof zit in een oplossing van 106 g of 1 000 kg. Die dimensieloze grootheid gebruikt men vooral om erg kleine concentraties aan te duiden in de toxicologie en de milieuwetenschappen.
VOORBEELD PPM
In het oude Rome stierven mensen door loodvergiftiging, omdat de waterleidingen er uit lood waren gemaakt. Hoewel lood slecht oplost, kwamen er sowieso looddeeltjes in het water terecht. Archeologen schatten dat er per 5 kg water in het oude Rome 18 mg lood aanwezig was. We berekenen de concentratie in ppm.
18 mg 5 kg = 18 ∙ 10-6 kg 5 kg = 3,6 ppm

De maximaal toegestane waarde aan CO2 in een klaslokaal is 900 ppm. Als de waarde hoger is, krijg je hoofdpijn en concentratiestoornissen. Je kunt dan ook het best zo snel mogelijk een raam of deur openen. Wat is het volume aan CO2 in een klaslokaal van 2,5 m hoog, 5,0 m breed en 6,0 m lang bij 900 ppm?
Gegeven: • ppm (CO2) ( V V ) = 900
• V (oplossing) = V (klaslokaal) = 2,5 m ∙ 5,0 m ∙ 6,0 m = 75 m3 = 75 ∙ 103 L
Gevraagd: V (CO2) = ?
Oplossing: ppm ( V V ) = V (CO2) V (klaslokaal) ∙ 106 → V (CO2) = ppm ∙ V (klaslokaal) 106 = 900 ∙ 75 ∙ 103 L 106 = 68 L
Je kunt besluiten dat je vanaf 68 L CO2 in een klaslokaal van 75 m3 beter een raam opent.
Hoe weinig is nul?
Heel wat wetten betreffende milieu en gezondheid dateren uit de tijd dat onze methodes om de aanwezigheid van de meeste onzuiverheden te meten, beperkt waren tot relatief ‘grote’ hoeveelheden (miljoenste delen).
Verontreinigingen in kleinere hoeveelheden werden door de toenmalige technologie beschouwd als onbestaand en weergegeven als ‘hoeveelheid = 0’.
De wet schrijft nog dikwijls voor dat er bijvoorbeeld in voedingsmiddelen geen schadelijke stoffen aanwezig mogen zijn, dus dat hun concentratie 0 moet zijn. Dat is een abstract punt dat je kunt benaderen, maar niet kunt bereiken. Hoe dicht je bij 0 kunt komen, hangt af van de gevoeligheid van je meetinstrumenten.
20 jaar geleden kon men een miljoenste van een gram stof in een oplossing detecteren, tegenwoordig al een triljoenste van een gram stof. Een triljoenste komt zowat overeen met een korrel suiker in een vol Olympisch zwembad. Doordat men nu veel nauwkeuriger kan meten dan 20 jaar geleden, kan men elementen detecteren die in uiterst kleine hoeveelheden voorkomen. Dergelijke elementen noem je sporenelementen

In 2010 werd Tourwinnaar Alberto Contador betrapt op het gebruik van doping. In zijn urine trof men sporen van het verboden middel Clenbuterol aan, namelijk 0,000 000 000 05 g of 50 pg.
Niet alleen bij dopingcontroles zoekt men naar heel kleine hoeveelheden van een stof. Ook in de lucht, het water en de bodem zijn kleine hoeveelheden soms al gevaarlijk. Zo drukt men bijvoorbeeld ook de CO2-concentratie in de lucht uit in ppm.
Ppm in het dagelijks leven: CO2-concentraties in de lucht
De ijskap als klimaatarchief
De ijskap van Antarctica is, net als alle andere gletsjers op aarde, gevormd doordat er elk jaar een laagje sneeuw achterblijft dat in de zomer niet smelt. Als de massa van de sneeuwlaag groot genoeg is geworden (voor droge sneeuw moet de laag 70 à 100 m dik zijn), worden door de enorme druk van het bovenliggende sneeuwpakket de luchtkanaaltjes tussen de sneeuwkristallen afgesloten.
De aldus ontstane luchtbelletjes bevatten lucht met een samenstelling die gelijk is aan die van de atmosfeer ten tijde van de afsluiting. Door de geringe hoeveelheid neerslag en de kilometers dikke ijskap duurt het op Antarctica honderdduizenden jaren voordat die luchtbelletjes de onderkant van de ijskap hebben bereikt. Door een ijskern te boren tot de bodem van de ijskap en de luchtbelletjes in het ijs te analyseren, kunnen wetenschappers de samenstelling van de atmosfeer tot enkele honderdduizenden jaren terug reconstrueren.
Afbeelding 6 toont de data die men verkreeg door de ijsstalen uit het observatiestation in Vostok (Antarctica) te onderzoeken.
De stalen geven informatie over de CO2-concentraties tot 450 000 jaar geleden. Op de afbeelding zie je duidelijk dat de CO2-concentratie in de lucht gedurende die tijdspanne nooit de waarde van 300 ppm heeft overschreden.
Huidige CO2-metingen
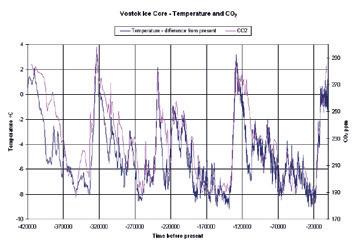
Afb. 6 De CO2-concentratie in verschillende lagen van de ijskap op Antarctica, gerelateerd aan de ouderdom van de laag
Over heel de wereld bestaan er ondertussen meetstations die de (huidige) CO2-concentratie in de lucht meten. In het meetstation op Mauna Loa (Hawaï) meet men bijvoorbeeld sinds 1959 constant CO2-waarden. Sinds die datum is de CO2-concentratie in de lucht alleen maar gestegen. Op dit ogenblik is de gemiddelde CO2-concentratie zo’n 400 ppm.
Afb. 7 De CO2-concentratie in de lucht Meer weten?
Ondertussen worden er klimaatconferenties georganiseerd om de gevolgen van de CO2-uitstoot te bespreken en in te perken. In 2021 (van 21 oktober tot en met 12 november) ging de klimaatconferentie door in Glasgow. De klimaatconferentie van 2022 ging door van 6 tot en met 18 november in Sharm-el-Sheikh (Egypte).
3.6 Ppb
Parts per billion ppb, oftewel ‘delen per miljard’, gebruik je voor nog kleinere concentraties. Die concentratiegrootheid is analoog aan ppm. Het is de verhouding van de opgeloste stof tot de totale hoeveelheid oplossing, vermenigvuldigd met 109.
Ook hier is het weer belangrijk dat je kijkt naar het soort mengsel waarmee je werkt. Voor een vast mengsel werk je met ppb ( m m ), voor gasmengsels met ppb ( V V ) en voor waterige oplossingen met ppb ( m V ).
De formules zijn als volgt:
vaste mengsels: ppb ( m m ) = m (opgeloste stof) m (oplossing) ∙ 109
gasmengsels: ppb ( V V ) = V (opgeloste stof) V (oplossing) ∙ 109
waterige oplossingen: ppb ( m V ) = m (opgeloste stof) V (oplossing) ∙ 109
‘Een concentratie van 1 ppb’ wil zeggen dat er 1 (opgelost) deeltje aanwezig is op een totaal van een miljard aanwezige deeltjes. Die dimensieloze grootheid gebruikt men vooral om heel lage concentraties aan te duiden in de analytische chemie en de toxicologie (sporenonderzoek – heel giftige stoffen – forensische geneeskunde). Er bestaan niet zoveel meettoestellen die zulke kleine concentraties van stoffen kunnen meten.
Billion versus biljoen
Let altijd op met de Engelse termen!
Het Engelse woord billion is een zogenoemde ‘valse vriend’. Het Engelse billion is wat je in het Nederlands een miljard noemt, dus 1 000 miljoen of 1 000 000 000 (109).

Een biljoen is tien tot de twaalfde macht, 1012, dus 1 000 000 000 000. Een biljoen heet in het Engels trillion.
Het Nederlandse triljoen staat op zijn beurt voor een miljoen tot de derde macht, oftewel een miljoen keer een miljoen keer een miljoen (1018).
NEDERLANDSE TERMEN
ENGELSE TERMEN biljoen
Het is erg belangrijk om rekening te houden met dat onderscheid tussen de Engelse en Nederlandse getallen, want vaak worden hoeveelheden van giftige stoffen uitgedrukt in ppb.
Ppb in het dagelijks leven: giftige stoffen
Botulinetoxine in botox
Botulinetoxine is voor mensen de giftigste stof op aarde. Iemand die met dat spul in aanraking komt, sterft binnen enkele seconden. Botulinetoxine valt het zenuwstelsel aan en laat alle zenuwen tegelijkertijd ‘vuren’. Dat is extreem pijnlijk, maar gaat ook redelijk snel. Enkele seconden is de gemiddelde duur van een botulinetoxinevergiftiging. Een lepel van het goedje is genoeg om miljoenen mensen te vermoorden. Of heel concreet: 1 gram botulinetoxine kan 1,5 miljoen mensen doden.
De LD50 (Lethal Dose 50, de waarde waarbij 50 % van de mensen sterft bij inname) ligt tussen de 0,005 en 0,05 μg per kg lichaamsgewicht.
Opmerkelijk genoeg gebruikt men dat gif ook in de medische wereld om bijvoorbeeld ouderdomsverschijnselen zoals rimpels te verdoezelen: botox. Het gaat hier echter om een opgezuiverd eiwit uit 1 van de verschillende toxines van de bacterie.
Bij een behandeling van de wenkbrauwen (tegen rimpels) spuit men ongeveer 20 units in. 1 unit is zo’n 0,2 ng botulinetoxine.
Je maakte kennis met enkele nieuwe (fractionele) concentratiegrootheden. Daarmee leer je vlot te rekenen door te oefenen. We beginnen alvast met enkele voorbeeldvraagstukken.
VOORBEELDVRAAGSTUKKEN
1 Bereken de hoeveelheid glycol (ethaan-1,2-diol) die je moet toevoegen aan 200 mL water om een oplossing van 40,0 V% glycol te bereiden.
Gegeven: • V (water) = 200 mL
• V% = 40,0
• V (oplossing) = V (water) + V (glycol)
Gevraagd: V (glycol) = ?
Oplossing: 40,0 V% = V (glycol) V (oplossing) ∙ 100
40,0 = x x + 200 ∙ 100
40,0 ∙ (x + 200) = x ∙ 100
40,0x + 8 000 = 100x
60x = 8 000
x = V (glycol) = 8 000 60 = 133 mL
Conclusie: Je moet 133 mL glycol toevoegen aan 200 mL water om uiteindelijk een volumeprocent van 40,0 te bekomen.
2 De massadichtheid van een oplossing van zwavelzuur in water is 1,30 g mL . De oplossing bestaat voor 40,0 m% uit zwavelzuur. Bereken de molaire concentratie van die oplossing.
Gegeven:
• ρ = 1,30 g mL
• m% = 40,0 m% zwavelzuur = 40,0 g zwavelzuur 100 g oplossing
Gevraagd: c = ?
Oplossing: c = n (opgeloste stof) V (oplossing) = n (zwavelzuur) V (oplossing)
a Omzetting van m (oplossing) naar V (oplossing)
ρ (oplossing) = m (oplossing) V (oplossing)
→ V (oplossing) = m (oplossing)
ρ (oplossing) = 100 g 1,30 g mL = 76,9 mL
b Omzetting van m (zwavelzuur) naar n (zwavelzuur)
n (opgeloste stof) = n (zwavelzuur) = m (zwavelzuur) M (zwavelzuur)
M (H2SO4) = 2 ∙ 1,0 g mol + 1 ∙ 32,1 g mol + 4 ∙ 16,0 g mol = 98,1 g mol
n (H2SO4) = 40,0 g 98,1 g mol = 0,408 mol
c Berekening van de molaire concentratie
c = n (zwavelzuur) V (zwavelzuur) = 0,408 mol 76,9 ∙ 10‐3 L = 5,30 mol L
Conclusie: De molaire concentratie is 5,30 mol L .
3 Aceton in de gasfase (CH3-CO-CH3) heeft een MAC-waarde (= maximaal aanvaardbare concentratie in de lucht) van 750 ppm. Zet die concentratie om in mg m3 (bij normomstandigheden).
Gegeven: • ppb ( V V ) = 750
• normomstandigheden
Gevraagd: concentratie in mg m3 = ?
Oplossing: 750 ppm = 750 L 106 L
Je werkt hier met volume-eenheden, omdat aceton en lucht zich in de gasfase bevinden.
750 L 106 L = 0,750 L 103 L = 0,750 L m3
Je zet hier om naar m3, omdat je het aantal mg aceton per m3 moet berekenen. (1 dm3 = 1 L)
0,750 L CH3-CO-CH3
Normomstandigheden: V m = 22,4 L mol = V n
Dus: n = V 22,4 L mol = 0,750 L 22,4 L mol = 0,0335 mol
n = m M , dus m = n ∙ M = 0,0335 mol ∙ 58,0 g mol = 1,94 g = 194 ∙ 10 mg
Conclusie: 750 ppm aceton komt overeen met 194 ∙ 10 mg m3 bij normomstandigheden.
Concentratiegrootheden
GROOTHEID MET SYMBOOL EENHEID FORMULE
molaire concentratie c mol L
massaconcentratie c g L
massaprocent m%
n (opgeloste stof)
V (oplossing)
m (opgeloste stof)
V (oplossing)
m (opgeloste stof) m (oplossing)
100 %
volumeprocent V% V (opgeloste stof) V (oplossing) ∙ 100 %
massavolumeprocent m/V% m (opgeloste stof) 100 mL oplossing ∙ 100 %
GROOTHEID MET SYMBOOL
promille
parts per millionppm
(vaste mengels)
parts per billionppb
(gasmengsels) ‰ (waterige oplossingen) = m (opgeloste stof) m (oplossing)
ppm ( m m ) vaste mengsels
ppm ( V V ) gasmengsels
103 = V (opgeloste stof)
(oplossing)
m (opgeloste stof)
103
103
(oplossing)
(oplossing)
V (opgeloste stof)
(oplossing)
m (opgeloste stof)
ppm ( m V ) waterige oplossingen = m (opgeloste stof)
ppb ( m m ) vaste mengsels
ppb ( V V ) gasmengsels
106
106
106
(oplossing)
ppb ( m V ) waterige oplossingen = m (opgeloste stof) m (oplossing)
Massadichtheid versus massaconcentratie
MASSADICHTHEID
ρ = m (oplossing) V (oplossing)
ρ = m (stof) V (stof)
Verdunningsformule – oplossingen mengen
De procentuele samenstelling van een verbinding
109 = V (opgeloste stof) V (oplossing)
m (opgeloste stof)
109
109
(oplossing)
MASSACONCENTRATIE
c = m (opgeloste stof) V (oplossing)
massa-aandeel van X = totale massa van alle X-atomen in de formule totale formule- of molcuulmassa van de verbinding
De dichtheid van een 7,21 molaire oplossing van bijtende soda in water is 1,36 g mL
Bereken het massaprocent bijtende soda.
Bereken de molaire concentratie van een 27,0 m%-zwavelzuuroplossing met een massadichtheid van 1,198 g mL .
Bereken hoeveel gram ethanol er aanwezig is in een volle fles Bombay Sapphire Gin (40 V%), als je weet dat zuivere ethanol een massadichtheid heeft van 0,800 kg L en het volume van de fles 70 cL bedraagt.
Je lost 310,0 g keukenzout op in water en lengt de oplossing aan tot 4,00 L. De dichtheid van de verkregen oplossing is 0,84 g mL
Bereken de concentratie van keukenzout in:
a g L
b massaprocent
c mol L
Bereken de procentuele samenstelling van calciumhydroxide.
Een oxide van stikstof bevat 30,4 % stikstof. Bepaal de verhoudingsformule.
Een organische stof bevat 50,7 % C, 4,25 % H en 45,1 % O.
Bepaal de verhoudingsformule.
Bereken de procentuele samenstelling van fosforzuur (H3PO4).
De analyse van 10,0 g van een gasvormig staal toont aan dat het 2,5 g waterstof en 7,5 g koolstof bevat. Wat is de procentuele samenstelling van beide elementen in dat staal?
Bereken de massa HCl in 25,0 mL van een 37 m%-oplossing met een massadichtheid van 1,19 kg L .
Stel dat je beschikt over een waterige oplossing die 28,0 g Na2SO4 per liter oplossing bevat.
Bijkomende gegevens:
• de molaire massa van Na2SO4 = 126 g mol
• de molaire massa van H2O = 18 g mol
• de dichtheid van zuiver water = 1,00 g mL
Welke van de volgende concentratiegrootheden
kun je berekenen met die gegevens?
a zowel de molariteit als de massaconcentratie van Na2SO4
b zowel de molariteit van Na2SO4 als de dichtheid van de oplossing
c zowel de molariteit en de massaconcentratie van Na2SO4 als het massapercentage van Na2SO4
d zowel de massaconcentratie als het massapercentage van Na2SO4
Een oplossing A heeft een massaconcentratie van 17 g KMnO4 per liter oplossing.
Een oplossing B heeft een concentratie van 26 g K2SO4 per liter.
KMnO4 en K2SO4 zijn allebei sterke elektrolyten.
Dat betekent dat ze in een oplossing volledig splitsen in ionen.
Je bereidt een oplossing C met een volume van 1,5 L door een welbepaald volume van oplossing A samen te voegen met een welbepaald volume van oplossing B. De molaire concentratie aan K+-ionen in oplossing C is gelijk aan 0,24 mol L
Welk volume van oplossing A en oplossing B gebruikte je om oplossing C te bereiden?
(Er traden tijdens het mengen geen dichtheidsveranderingen op.)
a V (oplossing A) = 300 mL en V (oplossing B) = 1 200 mL
b V (oplossing A) = 650 mL en V (oplossing B) = 850 mL
c V (oplossing A) = 500 mL en V (oplossing B) = 1 000 mL
d V (oplossing A) = 1 350 mL en V (oplossing B) = 150 mL
Een laborant vindt een fles met het volgende etiket.
Op een flesje Duvel staat vermeld: 8,5 V%; 33,0 cL.
a Bereken hoeveel mL aan 100 % zuivere ethanol maximaal aanwezig mag zijn in het bloed van Jan (5,00 L bloed) om de wettelijk toegelaten
BAC-waarde van 0,5 promille ( m V ) niet te overschrijden, als je weet dat zuivere ethanol een massadichtheid van 0,790 kg L heeft.
b Bereken het promille ( m V ) in het bloed van Jan nadat hij 1 flesje Duvel heeft leeggedronken.
Veronderstel dat 10 % van de alcohol in het bloed wordt opgenomen.
De laborant wil 3,0 L van een 0,30 molaire
NaOH-oplossing bereiden.
Hoeveel mL moet hij dan pipetteren uit de fles?
a 9 mL
b 100 mL
c 11 mL
d Geen van de vorige antwoorden is juist.
Een waterige oplossing van een onbekend zuur met brutoformule HX heeft een massaprocentuele samenstelling van 2,56 % en een massadichtheid van 1,1 g mL . Je neemt 10 mL van die oplossing en voegt water toe tot je een totaalvolume van 500 mL bereikt. De concentratie van de resulterende verdunde oplossing van HX is 0,0045 mol L
Wat is de identiteit van X?
a broom
b jood
c fluor
d chloor
Als je vis eet met een kwikgehalte van 24 ppm, kan dat vergiftiging veroorzaken.
Bereken hoeveel gram kwik er dan per kilogram vis voorkomt.
Een HCl-oplossing met massadichtheid ρ = 1,19 kg L bevat 38,3 m% HCl.
Bereken de molariteit van die oplossing.
De MAC-waarde in de toxicologie is de maximaal aanvaarde concentratie van een (schadelijke) stof.
De MAC-waarde van koolstofmonoxide is 23 mg per m³. Hoeveel ppm is dat? We gaan hier uit van normomstandigheden.
In een gesloten ruimte van 300 m3 ontsnapt er 200 g propaan (C3H8).
Wat is het V% van dat gas in die ruimte bij een temperatuur van 25 °C en een druk van 1 013 hPa?
Zeewater bevat 35 m/V% NaCl.
Hoeveel liter zeewater moet je laten verdampen om 1 000 kg NaCl te bekomen?
Hoeveel liter kaliumchlorietoplossing van 0,30 mol L moet je toevoegen aan 2,5 L kaliumchlorietoplossing van 0,70 mol L om een oplossing van 0,60 mol L te bekomen?
Aan 300 mL keukenzoutoplossing met een concentratie van 0,60 mol L voeg je 200 mL keukenzoutoplossing met een concentratie van 0,40 mol L toe.
Wat is de concentratie van de bekomen oplossing?
Welk volume van een zwavelzuuroplossing van 0,12 mol L moet je aan 500 mL van een zwavelzuuroplossing van 0,090 mol L toevoegen om een oplossing van 0,10 mol L te bekomen?
` Meer oefenen? Ga naar .
Stoichiometrie is ‘de leer van de verhoudingen waarin chemische stoffen met elkaar reageren’. De basis heb je al geleerd in de 2e graad. Je herhaalt daarom eerst de begrippen die je al kent, en breidt vervolgens je kennis uit.
LEERDOELEN
L Stoichiometrievraagstukken oplossen, gebruikmakend van de geziene concentratiegrootheden, de ideale gaswet en de verdunningsregel
L Een onderscheid maken tussen een reagens in overmaat en een limiterend reagens
L Gebruikmaken van je kennis over een limiterend reagens om de hoeveelheid aan reactieproducten en de resthoeveelheid of overmaat aan reagentia te berekenen na de reactie
1 Vraagstukken waarbij 1 stofhoeveelheid gegeven is
1.1
Herhaling
Zoals je leerde in het 4e jaar, reageren de stoffen bij een reactie niet in een willekeurige verhouding, maar moeten ze de verhouding van de coëfficiënten respecteren. Die coëfficiënten geven het aantal mol – en niet de massa – weer van elk deeltje in de reactie. Om vraagstukken met 1 gegeven stofhoeveelheid op te lossen, gebruik je het onderstaande stappenplan
Stap 1: Lees het vraagstuk.
Stap 2: Analyseer wat gegeven en gevraagd wordt.
Stap 3: Noteer de reactievergelijking.
Stap 4: Zet de gegeven stofhoeveelheid om naar mol.
Stap 5: Pas de molverhouding toe.
Stap 6: Zet het resultaat om naar de gevraagde eenheid.
De molverhouding, of de verhouding waarin stoffen met elkaar reageren, wordt gegeven door de coëfficiënten uit de reactie. Let op: die voorgetallen geven nooit informatie over de stofhoeveelheid die je ter beschikking hebt!
h is de 7e letter van het Griekse alfabet: èta.
Wanneer er maar van 1 stof een stofhoeveelheid of een massa wordt gegeven, dan mag je ervan uitgaan dat er bij een aflopende reactie voldoende aanwezig is van de 2e stof om de 1e volledig te laten wegreageren.
Als controle bij je berekeningen kun je altijd de wet van behoud van massa toepassen: de som van de massa’s van de reagentia = de som van de massa’s van de reactieproducten.
In de 2e graad ging je ervan uit dat een reactie altijd de maximale stofhoeveelheid oplevert. In de praktijk zal dat altijd een kleiner percentage zijn door verliezen en door het chemisch evenwicht. (Die leerstof komt aan bod in het 6e jaar.) Je spreekt dan ook van het rendement h dat een reactie behaalt.
Normaal gezien heb je die term ook al gehoord in de lessen fysica, als het ging over het rendement van een energieomzetting. Een gloeilamp heeft bijvoorbeeld een rendement van 10 %: slechts 10 % van de elektrische energie wordt omgezet in lichtenergie. De andere 90 % wordt omgezet in de vorm van warmte.
In de chemie bedoelen we met ʻrendementʼ de effectieve hoeveelheid reagens die zal wegreageren in verhouding tot wat er maximaal had kunnen wegreageren, of de verhouding van de effectief bekomen hoeveelheid reactieproduct tot de maximaal mogelijk te bekomen hoeveelheid reactieproduct. Wanneer je bijvoorbeeld een houtblok of een stukje magnesiumlint verbrandt, zal het hele houtblok of het volledige stukje lint verbranden. Die reacties hebben een rendement van 100 %.
Vaak gaat de reactie echter niet volledig op (zie de leerstof over chemisch evenwicht in het 6e jaar). Daardoor zal het rendement kleiner dan 100 % zijn.
η = werkelijk gevormde stofhoeveelheid reactieproduct maximaal te vormen stofhoeveelheid reactieproduct ∙ 100 %
η = effectieve stofhoeveelheid weggereageerd reagens maximaal weg te reageren stofhoeveelheid reagens ∙ 100 %
VOORBEELD RENDEMENT BEREKENEN
Beschouw de fictieve reactievergelijking 2 A + 3 B → 4 D.
Gegeven:
• n (stof A) = 4,0 mol
• n (stof B) = 6,0 mol
• rendement = 60 %
Oplossing: Onder ideale omstandigheden (= een rendement van 100 %) zou er 8 mol van stof D gevormd worden. Daarvoor houd je rekening met de molverhouding van de stoffen in de reactie:
2 A + 3 B → 4 D
2 mol A reageert met 3 mol B ter vorming van 4 mol D.
4 mol A reageert met 6 mol B ter vorming van 8 mol D.
Vermits de reactie echter een rendement van 60 % heeft, wordt er maar 4,8 mol D (= 60 % van 8 mol) gevormd.
1 Gebluste kalk of calciumhydroxide reageert met 283,5 g salpeterzuur tot calciumnitraat en water. Hoeveel gram gebluste kalk kan reageren met het salpeterzuur en hoeveel gram calciumnitraat ontstaat er dan? Ga ervan uit dat de reactie een rendement van 100 % heeft. Ca(OH)2 + 2 HNO3 → Ca(NO3)2 + 2 H2O
Gegeven: m (HNO3) = 283,5 g
Gevraagd: • m (Ca(OH)2) = ?
• m (Ca(NO3)2) = ?
Oplossing: Ca(OH)2 + 2 HNO3 → Ca(NO3)2 + 2 H2O M (HNO3) = 1
n (HNO3) = m (HNO3) M (HNO3) = 283,5 g 63,0 g mol = 4,50 mol
Stel een stoichiometrietabel op:
Ca(OH)2 +2 HNO3 →Ca(NO3)2 +2 H2O molverhouding1 mol 2 mol 1 mol2 mol
n0 (mol) 1 ∙ 2,25 4,50 = 2 ∙ 2,25
(mol) 0 0 2,25 4,50
Je hebt 4,50 mol salpeterzuur. De molverhouding leert je dat je dan maar de helft aan gebluste kalk nodig hebt om daarmee te reageren. Diezelfde molverhouding leert je ook dat er dan 2,25 mol calciumnitraat en 4,50 mol water worden gevormd.
M (Ca(OH)2) = 40,1 g mol + 2 ∙ 16,0 g mol + 2 ∙ 1,0 g mol = 74,1 g mol
m (Ca(OH)2) = n ∙ M = 2,25 mol ∙ 74,1 g mol = 167 g
M (Ca(NO3)2) = 40,1 g mol + 2 ∙ 14,0 g mol + 6 ∙ 16,0 g mol = 164,1 g mol
m (Ca(NO3)2) = n ∙ M = 2,25 mol ∙ 164,1 g mol = 369 g
Je weet nu dus dat er 167 g gebluste kalk of Ca(OH)2 kan reageren met 283,5 g salpeterzuur of HNO3 en dat er dan maximaal 369 g calciumnitraat of Ca(NO3)2 kan worden gevormd.
Een stoichiometrietabel is een tabel waarbij de molhoeveelheden per stof worden genoteerd. Je begint met de molhoeveelheid vóór de reactie (n0), vervolgens noteer je wat er is weggereageerd/ gevormd (Δn), en ten slotte noteer je de molhoeveelheden op het einde van de reactie voor alle reagentia en reactieproducten.
2 200 g zwavelzuur reageert met aluminiumhydroxide. Een laborant bekomt via die reactie 110 g zout. De reactievergelijking is als volgt: 3 H2SO4 + 2 Al(OH)3 → Al2(SO4)3 + 6 H2O. Welk rendement behaalde de laborant?
Gegeven: • m (H2SO4) = 200 g
• m (Al2(SO4)3) = 110 g
Gevraagd: rendement η = ?
Oplossing: 3 H2SO4 + 2 Al(OH)3 → Al2(SO4)3 + 6 H2O
M (H2SO4) = 2 ∙ 1,0 g mol + 1 ∙ 32,1 g mol + 4 ∙ 16,0 g mol = 98,1 g mol
n (H2SO4) = m (H2SO4) M (H2SO4) = 200 g 98,1 g mol = 2,04 mol
M (Al2(SO4)3) = 2 ∙ 27,0 g mol + 3 ∙ 32,1 g mol + 12 ∙ 16,0 g mol = 342,3 g mol
n (Al2(SO4)3) = m (Al2(SO4)3) M (Al2(SO4)3) = 110 g 342,3 g mol = 0,321 mol
In werkelijkheid wordt er dus 0,321 mol aluminiumsulfaat gevormd. Als je dat vergelijkt met de werkelijke hoeveelheid gevormd zout, kun je het rendement bepalen.
Stel een stoichiometrietabel op: 3 H2SO4 +2 Al(OH)3 →Al2(SO4)3 +6 H2O molverhouding3 mol 2 mol1 mol6 mol n0 (mol) 2,04
Bij een rendement van 100 % zou er dus 0,68 mol aluminiumsulfaat gevormd zijn.
η = werkelijk gevormde stofhoeveelheid Al2(SO4)3 maximaal te vormen stofhoeveelheid Al2(SO4)3 ∙
2 Vraagstukken waarbij de stofhoeveelheden van alle reagentia gegeven zijn
In de 2e graad loste je meestal vraagstukken op waarbij er maar 1 stofhoeveelheid gegeven was of waarbij de molverhouding van de reagentia altijd klopte.
In werkelijkheid krijg je echter vaak een gegeven hoeveelheid van beide reagentia. Dan moet je controleren of de coëfficiëntenverhouding gerespecteerd wordt. Als dat niet zo is, zal 1 stof te veel aanwezig zijn, in overmaat. De andere stof is te weinig aanwezig. Dat is het limiterende reagens
De hoeveelheid reactieproduct wordt dan bepaald door de hoeveelheid van het limiterende reagens.
Om te weten hoeveel reactieproduct er wordt gevormd, pas je dezelfde werkwijze toe als voordien, maar reken je met de gegeven hoeveelheid van het limiterende reagens. De stof die in overmaat aanwezig is, zou geen correcte berekeningen opleveren, want die stof reageert niet volledig. In het stappenplan voeg je 1 stap toe, waarbij je het limiterende reagens bepaalt (stap 5):
Stap 1: Lees het vraagstuk.
Stap 2: Analyseer wat gegeven en gevraagd wordt.
Stap 3: Noteer de reactievergelijking.
Stap 4: Zet de gegeven stofhoeveelheid om naar mol.
Stap 5: Zoek het limiterende reagens.
Stap 6: Pas de molverhouding toe.
Stap 7: Zet het resultaat om naar de gevraagde eenheid en bereken, indien gevraagd, de overmaat.
Het limiterende reagens noemt men ook wel het ‘beperkende reagens’. Het is immers dat reagens dat de chemische reactie een beperking oplegt: als het reagens uitgeput is, zal de reactie stoppen.
1 Een bekende chemische reactie is het Haber-Boschproces. Bij die reactie reageren stikstofgas en waterstofgas ter vorming van ammoniak. Hoeveel gram ammoniak kun je produceren door 75,00 g stikstofgas te laten reageren met 10,0 mol waterstofgas?
Gegeven:
• m (N2) = 75,00 g
• n (H2) = 10,0 mol
Gevraagd: m (NH3) = ?
Oplossing: N2 + 3 H2 → 2 NH3
n (N2) = m M = 75,00 g 2 ∙ 14,0 g mol = 2,68 mol
molverhouding1
Het limiterende reagens is stikstofgas: je hebt maar 2,68 mol stikstofgas en je hebt 3,3 mol stikstofgas nodig om met 10 mol waterstofgas te reageren. Het stikstofgas zal dus volledig wegreageren, maar van het waterstofgas zal er maar 3 ∙ 2,68 mol wegreageren.
molverhouding1
Er wordt dus 5,36 mol ammoniak gevormd.
n = m M → m = n M
M (NH3) = (1 ∙ 14,0 + 3 ∙ 1,0) g mol = 17,0 g mol
m = n M = 5,36 mol ∙ 17,0 g mol = 91,1 g
Conclusie: 5,36 mol ammoniak heeft een massa van 91,1 g.
2 Je brengt 2,43 g magnesium in 0,250 L van een HCl-oplossing van 1,00 mol L .
Wat is de molaire concentratie aan magnesiumchloride op het einde van de reactie?
Mg + 2 HCl → H2 + MgCl2
Gegeven:
• m (Mg) = 2,43 g
• V (HCl) = 0,250 L
• c (HCl) = 1,00 mol L
Gevraagd: c (MgCl2) = ?
Oplossing: Mg + 2 HCl → H2 + MgCl2
n (Mg) = m M = 2,43 g 24,3 g mol = 0,100 mol
c (HCl) = n (HCl) V (HCl) → n (HCl) = c (HCl) ∙ V (HCl) = 1,00 mol L ∙ 0,250 L = 0,250 mol
Mg+2 HCl→H2 +MgCl2
molverhouding1 mol 2 mol 1 mol1 mol
n0 (mol) 0,1000,250 = 2 ∙ 0,125
1 mol magnesium reageert met 2 mol HCl.
Je hebt 0,100 mol magnesium, die zou reageren met 0,200 mol HCl. Er is dus een overmaat aan HCl (totaal = 0,250 mol → 0,050 mol overmaat).
Het limiterende reagens is het magnesium.
Het magnesium zal volledig wegreageren, maar van het zoutzuur zal er maar 0,200 mol wegreageren.
Mg+2 HCl→H2 +MgCl2
molverhouding1 mol 2 mol 1 mol1 mol
n0 (mol) 0,1000,250 = 2 ∙ 0,125
∆n (mol)– 1 ∙ 0,100– 2 ∙ 0,100+ 1 ∙ 0,100+ 1 ∙ 0,100
n e (mol) 0 0,050 0,100 0,100
n (MgCl2) = 0,100 mol
c (MgCl2) = n (MgCl2) V (oplossing) = 0,100 mol 0,250 L = 0,400 mol L
3 Je beschikt over 100 g NaOH en 100 g HCl. Na reactie ontstaan er natriumchloride en water. Hoeveel gram zout kan er maximaal gevormd worden? Hoeveel gram van welke stof blijft er over?
NaOH + HCl → NaCl + H2O
Gegeven: • m (NaOH) = 100 g
• m (HCl)= 100 g
Gevraagd: • m (zout) = ?
• m (rest, reagens in overmaat) = ?
Oplossing: NaOH + HCl → NaCl + H2O
n (NaOH) = m M = 100 g 40,0 g mol = 2,50 mol
n (HCl) = m M = 100 g 36,5 g mol = 2,74 mol
NaOH+ HCl →NaCl+H2O
molverhouding1
In dit geval stopt de reactie wanneer NaOH is opgebruikt.
Die stof is het limiterende reagens. HCl is in overmaat aanwezig: voor 2,50 mol NaOH is er ook maar 2,50 mol HCl nodig, omdat de molverhouding 1 : 1 is.
NaOH+ HCl →NaCl+H2O molverhouding1 mol 1 mol 1 mol 1 mol
n0 (mol) 2,50 2,74 0 0 ∆n (mol) – 1 ∙ 2,50 – 1 ∙ 2,50+ 1
2,50+ 1
2,50 n e (mol) 0 0,24
Er wordt dus 2,50 mol NaCl (zout) gevormd en er blijft 0,24 mol HCl (reagens in overmaat) over op het einde van de reactie.
m (NaCl) = n (NaCl) ∙ M (NaCl) = 2,50 mol ∙ 58,5 g mol = 146 g
m (HCl, rest) = n (HCl) ∙ M (HCl) = 0,24 mol ∙ 36,5 g mol = 8,8 g
Conclusie: Er wordt maximaal 146 g zout gevormd en er blijft 8,8 g zoutzuur over.
4 200,0 g calciumhydroxide reageert met 196,0 g fosforzuur tot calciumfosfaat en water. Bereken hoeveel gram calciumfosfaat er gevormd wordt en hoeveel gram van het reagens in overmaat er overblijft.
3 Ca(OH)2 + 2 H3PO4 → Ca3(PO4)2 + 6 H2O
Gegeven:
• m (Ca(OH)2) = 200,0 g
• m (H3PO4) = 196,0 g
Gevraagd: • m (Ca3(PO4)2) = ?
• m (rest, reagens in overmaat) = ?
Oplossing: 3 Ca(OH)2 + 2 H3PO4 → Ca3(PO4)2 + 6 H2O
n (Ca(OH)2) = m (Ca(OH)2) M (Ca(OH)2) = 200,0 g 74,1 g mol = 2,70 mol
n (H3PO4) = m (H3PO4) M (H3PO4) = 196,0 g 98,0 g mol = 2,00 mol
3 Ca(OH)2 +2 H3PO4
Ca3(PO4)2 +6 H2O
molverhouding3 mol 2 mol 1 mol6 mol
n0 (mol)2,70 = 3 ∙ 0,90 2,00 = 2 ∙ 1,00
Opgelet: op het eerste gezicht zou je denken dat fosforzuur hier het limiterende reagens is, omdat dat de kleinste stofhoeveelheid is. De molverhouding leert je echter dat je voor de reactie van 2 mol fosforzuur 3 mol calciumhydroxide nodig hebt, terwijl je slechts over 2,7 mol beschikt. Niet H3PO4, maar Ca(OH)2 is dus het limiterende reagens. Je rekent dan ook verder met het juiste limiterende reagens.
3 Ca(OH)2 +2 H3PO4
Ca3(PO4)2 +6 H2O molverhouding3 mol 2 mol 1 mol6 mol
n0 (mol)2,70 = 3 ∙ 0,90 2,00 = 2 ∙ 1,00
∆n (mol) – 3 ∙ 0,90– 2 ∙ 0,90+ 1 ∙ 0,90+ 6 ∙ 0,90
n e (mol) 0 0,20 0,90 5,40
Er blijft dus 0,20 mol fosforzuur over. Er werd 0,90 mol calciumfosfaat gevormd.
m (H3PO4, rest) = n (H3PO4) ∙ M (H3PO4) = 0,20 mol ∙ 98,0 g mol = 20 g
m (Ca3(PO4)2) = n (Ca3(PO4)2) ∙ M (Ca3(PO4)2) = 0,90 mol ∙ 310,3 g mol = 28 g
Conclusie: Er blijft 20 g waterstoffosfaat over en er wordt 28 g calciumfosfaat gevormd.
Stoichiometrische vraagstukken
met 1 gegeven stofhoeveelheid
Stap 1: Lees het vraagstuk.
Stap 2: Analyseer wat gegeven en gevraagd wordt.
Stap 3: Noteer de reactievergelijking.
Stap 4: Zet de gegeven stofhoeveelheid om naar mol.
Stap 5: Pas de molverhouding toe.
Stap 6: Zet het resultaat om naar de gevraagde eenheid.
met 2 gegeven stofhoeveelheden
Stap 1: Lees het vraagstuk.
Stap 2: Analyseer wat gegeven en gevraagd wordt.
Stap 3: Noteer de reactievergelijking.
Stap 4: Zet de gegeven stofhoeveelheid om naar mol.
Stap 5: Zoek het limiterende reagens.
Stap 6: Pas de molverhouding toe.
Stap 7: Zet het resultaat om naar de gevraagde eenheid en bereken, indien gevraagd, de overmaat.
• limiterend of beperkend reagens: het reagens dat tijdens een reactie volledig wordt opgebruikt
• overmaat: de hoeveelheid stof die overblijft of niet reageert na de reactie
• rendement van de reactie: η = werkelijk gevormde stofhoeveelheid reactieproduct X maximaal te vormen stofhoeveelheid reactieproduct X ∙ 100 %
Vroeger maakte men zuiver zuurstofgas door kwik(II)oxide te verhitten.
Bereken hoeveel mol kwik en hoeveel mol dizuurstof er gevormd worden uit 91 g kwik(II)oxide.
Je hebt een meting uitgevoerd bij 1,00 atm en 25 °C. Wat zal het volume aan geproduceerd gas zijn wanneer je 1,00 g kaliumchloraat omzet in kaliumchloride en zuurstofgas?
Je brengt 2,43 g magnesium in 0,250 L van een 1,00 mol L HCl-oplossing.
a Welk volume waterstofgas (n.o.) wordt er gevormd?
b Wat is de concentratie aan magnesiumchloride op het einde van de reactie?
Welk volume aan koolstofdioxide wordt er geproduceerd bij de verbranding van 1,00 g koolstof bij normomstandigheden?
Gebluste kalk reageert met fosforzuur tot calciumfosfaat en water.
Hoeveel gram calciumfosfaat kan er ontstaan bij de inwerking van 15,0 g calciumhydroxide op 100 mL van een oplossing fosforzuur van 0,800 mol L ?
In een airbag vindt de volgende reactie plaats. Bij een aanrijding vanaf 25 km h geven de sensoren een impuls aan de ontstekingsmechanismen, die een hoeveelheid natriumazidekorrels (NaN3) laten ontploffen. Daarbij ontstaan er natriummetaal en stikstofgas:
2 NaN3 (v) → 2 Na(v) + 3 N2 (g)
Alkalimetalen kunnen voor gevaar zorgen. Daarom moet het natrium meteen opgevangen worden in kaliumnitraat. Daarbij vormen zich natriumoxide, kaliumoxide en opnieuw stikstofgas:
10 Na(v) + 2 KNO3 (v) → 5 Na2O(g) + K2O(v) + N2 (g)
Autoconstructeurs ontwerpen de airbag zodanig dat hij bij een temperatuur van 20 °C en de normaaldruk precies 20 L moet bevatten om volledig opgeblazen te worden.
Hoeveel gram natriumazidekorrels moeten er aanwezig zijn achter het stuur?
Je bereidt salpeterzuur uit ammoniak via de volgende stappen:
stap 1: ammoniak + dizuurstof
→ stikstofmonoxide + water
stap 2: stikstofmonoxide + dizuurstof → stikstofdioxide
stap 3: stikstofdioxide + water → salpeterzuur + stikstofmonoxide
a Hoeveel gram ammoniak heb je nodig bij de vorming van salpeterzuur, wanneer 20,0 L zuurstofgas, gemeten bij normale omstandigheden, volledig opgebruikt wordt?
b Hoeveel liter salpeterzuuroplossing met een concentratie van 0,20 mol L kun je nu maken? (Water is onbeperkt voorradig.)
E10-brandstof bevat de organische stoffen ethanol en octaan. Bij de verbranding van E10 reageren die componenten volgens deze reactievergelijkingen:
C2H5OH + 3 O2 → 2 CO2 + 3 H2O en 2 C8H18 + 25 O2 → 16 CO2 + 18 H2O
1,00 g ethanol en 1,00 g octaan worden volledig verbrand met voldoende zuurstofgas.
Wat is dan het totale volume aan CO2 (gemeten bij 25 °C en 100 kPa) dat vrijkomt bij die verbranding?
Op een wijngaard oogstte men vorig jaar
1,20 ton druiven per hectare. Rijpe druiven bevatten gemiddeld 16,0 m% glucose (C6H12O6).
Ethanol (CH3CH2OH) kan ontstaan door de vergisting van glucose volgens de reactie
C6H12O6 → 2 CH3CH2OH + 2 CO2. De massadichtheid van ethanol bij 20 °C bedraagt 800 kg ∙ m-3.
Welk volume aan ethanol (gemeten bij 20 °C) kon men zo vorig jaar per hectare maximaal verkrijgen uit de druivenoogst?
Los op.
a Welke massa aan Zn kan reageren met 300 mL van een H2SO4-oplossing met c = 0,250 mol L ?
b Welke massa aan ZnSO4 ontstaat er in die reactie?
c Welk volume aan H2-gas ontstaat er als de reactie bij normomstandigheden verloopt?
Je brengt een overmaat aan calcium (Ca) in 500 mL van een HCl-oplossing van 1,00 M.
a Wat is het massaverlies door het ontsnappende H2 (g)?
b Bereken de molariteit en de massaconcentratie van de CaCl2-oplossing wanneer de reactie afgelopen is.
Je verhit 14,0 g Fe met 16,0 g S8. Het reactieproduct is FeS.
Welke stoffen en hoeveel gram van elke stof zullen er na de reactie aanwezig zijn?
Wat is de molariteit van een H2SO4-oplossing, als 20,0 mL van die oplossing reageert met 50,0 mL van een NaOH-oplossing van 0,100 M ter vorming van Na2SO4 en water?
Bij de thermolyse van HgO ontstaat er zuurstofgas. Nadat men heeft afgekoeld tot normomstandigheden, meet men een volume van 68,3 mL O2-gas.
a Welke massa aan HgO wordt er tijdens die reactie omgezet?
b Welke massa aan Hg ontstaat er daarbij?
Bij een druk van 1 020 hPa en een temperatuur van 20 °C breng je 2,43 g Ca in 250 mL van een H2SO4-oplossing van 0,500 M. Als reactieproducten ontstaan er CaSO4 en H2-gas.
a Welk volume aan H2 (g) wordt er gevormd in die omstandigheden?
b Welke molaire concentratie heeft de CaSO4-oplossing op het einde van de reactie?
c Welk reagens is in overmaat aanwezig en hoeveel bedraagt die overmaat in gram?
Voor de neutralisatie van 25,0 mL NaOH-oplossing van 0,500 M heb je exact 2,50 g van een H3PO4-oplossing nodig. Als reactieproducten ontstaan er Na2HPO4 en H2O.
a Bereken het m% van de H3PO4-oplossing.
b Bereken de molariteit van de H3PO4-oplossing, als de dichtheid (ρ) 1,25 kg L bedraagt.
Door het erts hematiet (Fe2O3) te verhitten met cokes (C), kun je ijzer verkrijgen.
Ga uit van 2 700 kg erts en 300 kg cokes.
2 Fe2O3 + 3 C → 4 Fe + 3 CO2
a Is er een reagens in overmaat?
Zo ja, hoeveel mol is er in overmaat?
b Welke massa ijzer kun je vormen bij een rendement van 100 %?
Als 2e reactieproduct ontstaat er koolstofdioxide.
c Je bekomt bij de reactie 1,66 ∙ 103 kg Fe. Wat is het rendement van de reactie?
Hexaandizuur (C6H10O4) is een van de grondstoffen voor de synthese van sommige soorten nylon.
De stof zelf wordt bereid door de reactie van cyclohexeen (C6H10) met waterstofperoxide:
C6H10 + 4 H2O2 → C6H10O4 + 4 H2O
Tijdens een proef heb je uit 100 g cyclohexeen 161 g zuiver hexaandizuur verkregen.
Wat was het rendement van dat proces?
Een mengsel van 200,0 g N2 en 48,0 g H2 reageert bij een hoge druk en hoge temperatuur tot 57,8 g NH3 (g).
a Wat is het rendement van die reactie?
b Wat is de massa van het reagens dat in overmaat aanwezig is?
1 Concentratiegrootheden
molaire concentratie c mol L
massaconcentratie c g L
massaprocent m%
volumeprocent V%
promille ‰
parts per million ppm
parts per billion ppb
2 Massadichtheid versus massaconcentratie
ρ = m (oplossing) V (oplossing)
ρ = m (stof) V (stof)
3 Verdunningsformule – oplossingen mengen
vaste mengsels: ‰ ( m m )
gasmengels: ‰ ( V V )
(opgeloste stof) V (oplossing)
(opgeloste stof) V (oplossing)
(opgeloste stof)
(oplossing)
stof)
(opgeloste stof)
(oplossing)
(opgeloste stof)
(oplossing)
(opgeloste stof)
waterige oplossingen: ‰ ( m V ) = m (opgeloste stof)
vaste mengsels: ppm ( m m )
gasmengels: ppm ( V V )
waterige oplossingen: ppm ( m V )
vaste mengsels: ppb ( m m )
gasmengels: ppb ( V V )
waterige oplossingen: ppb ( m V )
(oplossing)
m (opgeloste stof) m (oplossing)
103
103
103
106 = V (opgeloste stof) V (oplossing)
m (opgeloste stof)
106
106
(oplossing)
m (opgeloste stof)
(oplossing)
109 = V (opgeloste stof) V (oplossing)
109 = m (opgeloste stof) V (oplossing)
109
c = m (opgeloste stof) V (oplossing)
4 De procentuele samenstelling van een verbinding
massa-aandeel van X = totale massa van alle X-atomen in de formule totale formule- of molcuulmassa van de verbinding
5 Stoichiometrie
Stoichiometrische vraagstukken
met 1 gegeven stofhoeveelheid met 2 gegeven stofhoeveelheden
Stap 1: Lees het vraagstuk.
Stap 2: Analyseer wat gegeven en gevraagd wordt.
Stap 3: Noteer de reactievergelijking.
Stap 4: Zet de gegeven stofhoeveelheid om naar mol.
Stap 5: Pas de molverhouding toe.
Stap 6: Zet het resultaat om naar de gevraagde eenheid.
Stap 1: Lees het vraagstuk.
Stap 2: Analyseer wat gegeven en gevraagd wordt.
Stap 3: Noteer de reactievergelijking.
Stap 4: Zet de gegeven stofhoeveelheid om naar mol.
Stap 5: Zoek het limiterende reagens.
Stap 6: Pas de molverhouding toe.
Stap 7: Zet het resultaat om naar de gevraagde eenheid en bereken, indien gevraagd, de overmaat.
• limiterend of beperkend reagens: het reagens dat tijdens een reactie volledig wordt opgebruikt
• overmaat: de hoeveelheid stof die overblijft of niet reageert na de reactie
• rendement van de reactie: η = werkelijk gevormde stofhoeveelheid reactieproduct maximaal te vormen stofhoeveelheid reactieproduct ∙ 100 %
η = effectieve stofhoeveelheid weggereageerd reagens maximaal weg te reageren stofhoeveelheid reagens ∙ 100 %
Een atoom wordt vaak voorgesteld als een kern met elektronen, die zich in cirkelvormige banen rond die kern bewegen. Dat model steunt op het atoommodel dat Rutherford en Bohr voorstelden. Vandaag is dat model deels nog altijd bruikbaar, al zijn wetenschappers hier en daar op wat tekortkomingen gestoten vanaf het 20e element.

` Wat zijn de tekortkomingen van het model van Bohr-Rutherford?
` Sommige overgangselementen hebben niet de verwachte ionlading: zilver heeft, in tegensteling tot de meeste overgangselementen, een ionlading van 1+. Het koperion komt voor met zowel een lading van 1+ als een lading van 2+. Bestaat er een verklaring?
` Hoe kan het dat er stoffen zoals zwavelhexafluoride of fosforpentachloride bestaan, als zwavel maar 2 en fosfor maar 3 ongepaarde elektronen heeft?
We zoeken het uit!
protonen en neutronen
• het atoommodel van Bohr-Rutherford toelichten. elektronenschillen
vrijgave van energie (– ΔE) (bv. licht)
toestand instabiel
elektron in grondtoestand energiearm, dus stabiel
• het duale karakter van een elektron als massa- én energiedeeltje beschrijven.
• de elektronenconfiguratie van een atoom schrijven met het aantal elektronen per schil.
• uitleggen dat het gecombineerde atoommodel van Bohr-Rutherford sprak over 7 schillen of energieniveaus.
• de theorie omtrent de verdeling van elektronen rond het atoom begrijpen: de orbitaaltheorie.
• de energieniveaus in een atoom verder opdelen;
• uitleggen dat de energie van de elektronen in een atoom gekwantiseerd is.
• uitleggen hoeveel gepaarde of ongepaarde elektronen er per schil kunnen zijn.
• de grootte van een atoom inschatten aan de hand van het aantal schillen.
• uitleggen dat er negatieve en positieve deeltjes in een atoom zitten die elkaar aantrekken.

• de opvullingsvolgorde van de orbitalen toepassen en het begrip ‘inversie’ begrijpen.
• de atoom- en ionafmetingen nauwkeuriger voorspellen en verklaren.
• de grootteorde van de ionisatie-energie van atomen en ionen verklaren.
Uit het gecombineerde atoommodel van Bohr-Rutherford leerden we het volgende:
• Protonen zijn positief geladen deeltjes.
• Neutronen dragen geen lading.
elektronenschillen
elektronen
3D-beeld gecombineerd atoommodel van Bohr-Rutherford
• Elektronen zijn negatief geladen deeltjes.
• Een proton en een neutron bevatten een massa van 1 u (= 1 12 van de massa van het 12C-atoom).
• De massa van elektronen is verwaarloosbaar klein in verhouding tot die van protonen en neutronen ( 1 2 000).
• Een atoom is elektrisch neutraal. Het heeft dus evenveel protonen als elektronen.
• Als een atoom elektronen opneemt of afstaat, ontstaan er ionen.
Een nuclide of nucleïde is een atoom met een gegeven aantal protonen Z en een welbepaald aantal neutronen N
protonen en neutronen
Afb. 8 Het gecombineerde atoommodel van Bohr-Rutherford
• De gemiddelde relatieve atoommassa vind je in het periodiek systeem. <Ar> is een gewogen gemiddelde van de relatieve atoommassa’s van de voorkomende isotopen. Bijvoorbeeld: chloor heeft een <Ar> van 35,5. Heeft chloor dan een half neutron in de kern zitten? Nee, maar elementen komen nu eenmaal voor in verschillende isotopen: nucliden met hetzelfde aantal protonen, maar een verschillend aantal neutronen.
Waterstof heeft 3 isotopen, ondanks het feit dat <Ar> erg dicht bij het geheel getal 1 aanleunt. Toch kunnen wetenschappers bijvoorbeeld in kernreactoren de isotopen ‘deuterium’ en zelfs ‘tritium’ aantreffen.
Dat zijn waterstofatomen met respectievelijk 1 of 2 neutronen extra in de kern. De isotopen van waterstof krijgen uitzonderlijk een aparte naam toebedeeld.
proton
elektron proton neutron
* radionuclide (een atoom dat spontaan deeltjes uit de kern zal zenden) proton 2 neutronen
elektron
Afb. 9 De isotopen van waterstof
Als je de gemiddelde relatieve atoommassa <A r> kent, kun je voor elementen met 2 isotopen ook het voorkomen van elk van die isotopen berekenen met deze formule: x ∙ A1 + (1 – x) ∙ A2 = <A r >
Daarbij geldt:
x = voorkomen 1e isotoop
1 – x = voorkomen 2e isotoop
A1 = relatieve atoommassa 1e isotoop
A2 = relatieve atoommassa 2e isotoop
VOORBEELD VOORKOMEN ISOTOPEN VAN CHLOOR BEREKENEN
Chloor komt voor als het 35- en het 37-isotoop. Wat is het procentuele voorkomen van beide isotopen?
Als je het voorkomen van het 35Cl-isotoop x noemt, dan moet het voorkomen van het 37Cl-isotoop 100 % – x of 1 – x zijn.
Als je die eerstegraadsvergelijking oplost, krijg je:
x ∙ 35 + (1 – x) ∙ 37 = 1 ∙ 35,5
–2x = –1,5 x = 0,75 of 75 %
Het 35Cl-isotoop komt dus in 3 van de 4 gevallen of 75 % voor. 1 op de 4 atomen chloor (25 %) zal echter 2 extra neutronen in de kern hebben en is een 37Cl-isotoop. Dat heeft een invloed op de totale massa van een groot aantal chlooratomen. Daar moet je dus rekening mee houden. Vandaar dat het PSE altijd <Ar> vermeldt. In het geval van chloor is <Ar> = 35,5.
Sinds Bohr en Rutherford zijn we door onderzoek al heel wat meer te weten gekomen over de fundamentele deeltjes die aanwezig zijn in atomen. Doordat men steeds kleinere deeltjes zichtbaar maakte en men de opgedane kennis op allerlei vlakken combineerde, evolueerden de bestaande theorieën. Zo ook het gecombineerde atoommodel van Bohr-Rutherford.
Tot 1978 aanvaardde men 4 fundamentele natuurkrachten in de fysica: gravitatie- of zwaartekracht, elektromagnetisme (magneetkrachten opgewekt door elektrische stroom), sterke kernkrachten (kernenergie) en zwakke kernkrachten (radioactief verval van atomen).
Een jaar later ontdekten wetenschappers dat zwakke kernkrachten en elektromagnetisme van dezelfde soort zijn. Sindsdien spreken we van nog maar 3 fundamentele krachten. Ook stelde men toen al de 3 fundamentele deeltjes (neutronen, protonen en elektronen) in vraag. Men ontdekte immers dat die deeltjes zelf een structuur en variatie kenden.
In de atoomkern ontdekten wetenschappers honderden soorten deeltjes die onderhevig zijn aan sterke kernkrachten: de hadronen. Hadronen bestaan zelf uit nog kleinere bouwstenen, de quarks, die in veel variëteiten voorkomen: up, down, strange, charmed …
(VERVOLG)
Ook buiten de atoomkern bleef men nieuwe deeltjes ontdekken: een neutron in de kern kon namelijk in bepaalde omstandigheden splitsen in een proton, een elektron en een neutrino, wat dan weer een soort van ongeladen elektron is.
Afb. 10 De opbouw van materie
Er bestaan 6 quarks, waarvan ‘up’ en ‘down’ de best gekende zijn. Zo bestaan protonen en neutronen uit up- en downquarks. Een proton heeft 2 ups en 1 down. Een neutron bezit 2 downs en 1 up.
u
Afb. 11 Up- en downquarks in een proton en een neutron
Net zoals we steeds verder kunnen kijken in de oneindig grote ruimte, kunnen we ook steeds dieper afdalen naar kleinere deeltjes. Bekijk de video.
Vanwege nog andere problemen moest men het schillenmodel bijsturen en verfijnen. Zo ontstond het orbitaalmodel.
In 1927 bogen verschillende wetenschappers zich al over het onderwerp ‘elektronen en lichtenergie’ tijdens een van de ondertussen beroemde Solvay-conferenties.

Veel van deze namen zul je gaandeweg tegenkomen in dit thema: Schrödinger (orbitaalvergelijkingen), Bohr (atoommodel), Einstein (E = mc²), Heisenberg (onzekerheidsrelatie), Planck (kwantumtheorie), Pauli (uitsluitingsprincipe), De Broglie (golfkarakter elektron), Lorentz (magnetisch veld) … Een feestje voor de wetenschap!
HOOFDSTUK 1
Hoe kwamen wetenschappers tot nieuwe inzichten? Het gecombineerde atoommodel van Bohr-Rutherford was correct om bijvoorbeeld de cirkelvormige baan van elektronen in waterstofatomen te beschrijven. Bij atomen van elementen met een groter aantal elektronen bleek echter dat de baan van een elektron niet altijd cirkelvormig is. De kleuren van het licht hebben daarbij geholpen. Je zou kunnen zeggen: de wetenschappers hadden letterlijk het licht gezien. Je zult merken dat in dit hoofdstuk de namen van heel wat beroemde wetenschappers aan bod komen.
LEERDOELEN
L De grondtoestand en aangeslagen toestand van het elektron onderscheiden
L De energieniveaus in een atoom beschrijven
L De kwantificering van de energie van elektronen in een atoom omschrijven
DEMO
Vlamproeven
Onderzoeksvraag
Welke specifieke kleur krijgt de vlam wanneer je metaalionen verhit of verbrandt?
Werkwijze
Je leerkracht verstuift achtereenvolgens een oplossing van koperchloride, lithiumchloride en natriumchloride in de vlam van een bunsenbrander.
Waarnemingen
• Koperchloride kleurt de vlam groen.
• Lithiumchloride geeft een rode vlamkleur.
• Natriumchloride brandt met een oranje vlam.
Besluit
Afhankelijk van welk metaal(ion) je in de vlam brengt, krijgt de vlam een andere kleur.
Bohr leidde uit de vlamproeven af dat elektronen zich niet zomaar willekeurig in een elektronenmantel bevinden, maar op welbepaalde schillen. Die komen overeen met energieniveaus of hoofdkwantums.
De kleur die wordt uitgezonden wanneer je een bepaald metaal(ion) in de vlam houdt, kun je verklaren door de energiesprongen die de elektronen tussen de schillen maken.
De vlam brengt elektronen van het metaal(ion) in een aangeslagen toestand: de elektronen absorberen de energie bij verwarming en verplaatsen zich naar een schil die zich verder van de kern bevindt. Ze hebben nu meer bewegingsvrijheid, want ze worden minder aangetrokken door de positieve kern. Ze bezitten extra potentiële energie
Die aangeslagen (of geëxciteerde) toestand is voor het elektron echter minder stabiel. Het elektron keert terug naar zijn oorspronkelijke niveau of zijn grondtoestand. Bij die terugkeer naar de eigen schil of de grondtoestand wordt de opgenomen energie weer uitgezonden onder de vorm van lichtenergie
toevoeging van energie (+ ΔE) (bv. in een vlam brengen)
elektron in grondtoestand energiearm, dus stabiel
vrijgave van energie (– ΔE) (bv. licht)
elektron in aangeslagen toestand energierijk, dus instabiel
13 De aangeslagen toestand en grondtoestand van een elektron
Niels Bohr had dus al ontdekt dat de elektronen in een atoom een welbepaalde energie-inhoud hebben. Max Planck vulde de theorie van Bohr verder aan:
• Zonder invloed van buitenaf blijft de energie-inhoud die eigen is aan een bepaald elektron, onveranderd.
• Die energie-inhoud neemt niet eender welke waarde aan, maar enkel bepaalde waarden van hoeveelheden ondeelbare energie: kwanta
• Een elektron kan overgaan van het ene naar het andere niveau door een welbepaalde energiehoeveelheid op te slorpen of af te staan. Als een elektron terugvalt naar een lager energieniveau, straalt het dat energiepakketje weer uit.
elektron in grondtoestand energiearm, dus stabiel

• Zo'n energiepakketje dat een elektron vrijgeeft wanneer het terugvalt op de eigen schil, noem je een kwantum: de minimale energie die betrokken is bij de verandering in de elektronenconfiguratie van een element. Een lichtkwantum noem je een foton.
Albert Einstein ontving in 1921 de Nobelprijs omdat hij fotonen poneerde als energiepakketjes, die gerelateerd zijn aan de energie-inhoud van een elektron. Dankzij die theorie wekken we vandaag elektrische energie op met zonnepanelen.

De kleur van het uitgezonden licht is evenredig met het energieverschil tussen de aangeslagen toestand en de grondtoestand van het elektron. Elke kleur in het zogenoemde ROGGBIV-spectrum komt namelijk overeen met een bepaalde hoeveelheid energie van dat licht.
rood infrarood oranjegeelgroenblauwindigoviolet ultraviolet energie (E )
15 Energie per kleur
Als je even opnieuw je waarnemingen tijdens de demo ‘Vlamproeven’ (p. 53) bekijkt, dan zie je het volgende:
• Koperion Cu2+ : de vlam krijgt een groene kleur.
• Lithiumion Li+: de vlam krijgt een rode kleur.
• Natriumion Na+: de vlam krijgt een oranje kleur.
Merk op dat de kleur van het uitgezonden licht in die proef een verband aantoont tussen het aantal schillen van het metaalion (en dus de energiesprongen die de aangeslagen elektronen kunnen maken) en de plaats van de kleur in het ROGGBIV-spectrum:
energie (E )
rood infrarood oranjegeelgroenblauwindigoviolet ultraviolet
Li+ Na+ Cu2+ 2 schillen 3 schillen 4 schillen
16 Energie per kleur
In de lessen fysica leer je dat licht een vorm van energie is en dat je energie kunt beschouwen als een golf. Een golf wordt gekenmerkt door een bepaalde frequentie (het aantal keren dat de golf door het nulpunt gaat per tijdseenheid), een amplitude (de maximale uitwijking) en een golflengte. Hoe hoger de frequentie van de golfbeweging, hoe meer energie er is. Elke kleur licht heeft een bepaalde energiewaarde en dus een bepaalde golffrequentie.
Afbeelding 17 leert je dat de golven met de hoogste frequenties de meeste energie bevatten. De energie-inhoud E is immers evenredig met de frequentie f
golflengte hoge frequentie / korte golflengte amplitude tijd
Afb. 17 De kenmerken van een golfbeweging
golflengte lage frequentie / lange golflengte
amplitude
GAMMASTRALING
RÖNTGENSTRALING valsgelddetector UV-STRALING



röntgenfoto zonlicht en de regenboog
ZICHTBAAR





In de lessen fysica leer je dat de kleur van het licht recht evenredig is met de golflengte en de energie-inhoud. Het verband tussen de frequentie van een golf en de energie ervan wordt beschreven door de theorie van Max Planck: E = h ∙ f = h ∙ c λ
h = constante van Planck = 6,626 070 15 ∙ 10-34 J ∙ s
Daarbij geldt:
f = frequentie van het licht (Hz)
c = lichtsnelheid = 3 ∙ 108 m s
λ = golflengte van het licht (m)
Wij zien met het menselijk oog maar een heel klein deel van het totale golfspectrum. Als je magnetron aanstaat, zie je het licht van de magnetronstralen niet. Met uv-licht doet de politie vaak sporenonderzoek: bewijzen die normaal niet zichtbaar zijn voor het menselijk oog, lichten dan letterlijk op. Wij kunnen enkel de kleuren uit het zogenoemde ROGGBIV-spectrum waarnemen.

20

19
Heb je een huisdier? Voor dieren verschilt het zichtbare spectrum vaak van het onze. Een hond ziet bijvoorbeeld ook ultraviolet licht.
Bekijk de video over hoe het komt dat bepaalde elementen andere kleuren geven in een vlam dan andere. De zogenoemde Lyman-Balmer-Paschenreeksen verklaren dat heel precies.
BALMER (400 nm < zichtbaar licht < 800 nm)
experiment + warmte-energie + aangeslagen toestand
LYMAN uv-straling (< 400 nm)
654321 = nn = 1 2
Afb. 21 De energiesprongen en hun overeenkomstige kleuren
violet blauw
turquoise rood 3456
PASCHEN infraroodstraling (> 800 nm)
Bohr stelde een atoom voor met ‘virtuele’ schillen: hoe verder de schil verwijderd is van de kern, hoe hoger het energieniveau van de elektronen op die schil.
Max Planck werkte daarop verder. Hij deed proeven met een natriumlamp. Het uitgezonden licht stuurde hij door een prisma, om zo te komen tot het emissiespectrum van natrium.
Tijdens de proef werden de natriumionen opgewarmd in de lamp. Ze kregen dus extra energie. Die energie gaven ze opnieuw af in de vorm van lichtenergie. Het emissiespectrum van natrium bevat enkel de gele kleur. Wanneer je andere elementen in een vlam brengt, ontstaat er een emissiespectrum met meerdere kleuren.
gloeiende chemische stof
Het feit dat natrium maar 1 enkele spectraallijn geeft, zou later van pas komen om de subniveaus van energie te onderscheiden. Veel verschillende elementen geven telkens weer een ander emissiespectrum en andere waarneembare kleuren. opening
Uit de spectra leidden de wetenschappers ook af dat de energiesprong tussen de schillen niet altijd even groot is. De schillen liggen dus niet allemaal even ver van elkaar verwijderd.
De elektronen rond een nucleus bevinden zich op schillen, die overeenkomen met energieniveaus of hoofdkwantums. Hoe verder de schil van de kern ligt, hoe hoger de energie-inhoud is. De elektronen ondervinden immers minder elektrostatische aantrekkingskracht (of coulombkracht) als ze verder verwijderd zijn van de kern, en hebben dan meer bewegingsvrijheid of potentiële energie.
Een elektron kan overgaan van het ene naar het andere niveau door een welbepaalde energiehoeveelheid op te slorpen of af te staan. Wanneer een elektron terugvalt op een lager energieniveau, straalt het dat energiepakketje weer uit.
Als je een atoom opwarmt, komen de elektronen op een hoger niveau te liggen: de aangeslagen toestand.
Die energie kunnen ze opnieuw afstaan in welbepaalde hoeveelheden (kwanta), waardoor ze terugkeren naar hun oorspronkelijke positie: de grondtoestand
De energie-inhoud van een elektron neemt niet eender welke waarde aan, maar enkel bepaalde waarden van hoeveelheden ondeelbare energie: kwanta
Met elke lijn van het emissiespectrum komt dan ook een bepaalde energiesprong overeen. De energiesprong is niet altijd even groot: de schillen liggen niet allemaal even ver van elkaar.
Zonder invloed van buitenaf blijft de energie-inhoud die eigen is aan een bepaald elektron, onveranderd.
Hoewel we in het 3e jaar de massa van een elektron verwaarloosden, omdat ze qua grootteorde maar 1 2 000 is van de eenheidsmassa, heeft het elektron wel degelijk een massa. We zouden het dus ook als dusdanig moeten beschouwen, onderhevig aan de wetten van Newton. Met experimenten bewezen wetenschappers echter dat elektronen eerder een golfkarakter vertonen en we ze dus ook moeten beschouwen als een energiedeeltje: een deeltje dat enkel energie bezit
spleet S
e--bron divergerende elektronen
Afb. 26 Elektronen uitzenden vanuit een smalle spleet
Door elektronen met een grote snelheid door een smalle spleet te sturen richting een elektrongevoelige plaat, konden wetenschappers aantonen waar die elektronen terechtkwamen.
De aantrefkans was het grootst in de richting waarin de elektronen werden uitgestuurd, en werd kleiner hoe meer men afweek van die richting.
De typische klokvorm die je grafisch bekomt, wordt in de wiskunde weleens een gausscurve genoemd. De grafiek heeft een symmetrische verdeling.
Die gausscurve of gaussiaanse verdeling kom je wel vaker tegen bij grafieken. Als je bijvoorbeeld aan alle leerlingen in een humanioraschool vraagt wat hun lengte is, zul je een gemiddelde bekomen van om en bij de 1,65 meter. Hoe verder de lengte afwijkt van dat gemiddelde, hoe minder je dergelijke leerlingen tegenkomt. De aantrefkans zal een klokvormdiagram vertonen.
aantal e- per tijdseenheid
Safwijking t.o.v. de spleet S
Afb. 27 De gausscurve
Open de applet en experimenteer zelf met divergerende golven.
S 1 S 2
e--bron verwachte aantrefkans
Afb. 28 Elektronen uitzenden vanuit 2 smalle spleetopeningen
Als je hetzelfde experiment uitvoert met 2 spleten waardoor je elektronen stuurt, zou je verwachten dat er 2 gausscurves verschijnen en dat de aantrefkans de som van die 2 curves is, zoals op afbeelding 28.
S 1 S 2
Afb. 29 De aantrefkans bij het dubbelespleetexperiment is afwisselend groot en klein.
Men kan echter vaststellen dat er plaatsen zijn waar de aantrefkans heel gering is.
In 1922 maakte De Broglie al een vergelijking tussen die waarneming en golven op water
Met behulp van een watertank en trilstiften veroorzaakte hij divergerende watergolven. Vergelijk het met een steen die je in het water gooit.
S 1
Afb. 30 Divergerende watergolven
S 1 geen golf S 2
Afb. 31 Interferentie in het circulaire golffront
Toen De Broglie het experiment herhaalde met 2 trilstiften, merkte hij op dat, net als bij het elektron, er zich op 2 plaatsen cirkelvormige golffronten vormden. Die golffronten interfereerden met elkaar, waardoor het water op bepaalde plaatsen geen golfbeweging vertoonde (de golven heffen elkaar op) en op andere plaatsen een sterker golfeffect (de golven versterken elkaar).
De Broglie besloot uit zijn experimenten dat elektronen wel degelijk de eigenschappen vertonen van een golf
Het elektron is dus enerzijds een massadeeltje en anderzijds een deeltje met een golfkarakter (energie). Die tweestrijd noemt men ook weleens het duale karakter van een elektron. Men spreekt van een gecombineerd golfmechanisch model In de lessen fysica van het 6e jaar ga je dieper in op golfbewegingen.
Energie plant zich voor als een golfbeweging. De frequentie van die golf is evenredig met de energie-inhoud van de golf. Een elektron gedraagt zich net zoals een golf.
Het elektron heeft echter ook een massa, hoewel we die voorheen verwaarloosden. Het elektron is dus zowel een energiedeeltje als een massadeeltje.
Dat noem je het duale karakter van het elektron.
De Duitse natuurkundige Werner Heisenberg bouwde verder op de theorie van De Broglie. Hij voerde het experiment opnieuw uit met watergolven, maar ook met een bredere spleet.
Toen Heisenberg een golffront door een bredere spleet stuurde, merkte hij op dat het golffront voortbewoog in een rechte lijn.

waarnemer W
In dat experiment kon hij dus nauwkeurig de richting van de golf bepalen.
Ook de snelheid van het golffront kon hij nauwkeurig bepalen. Waar de waarnemer (W) zich ook op de stippellijn bevindt, het golffront zal hem op hetzelfde tijdstip (t) bereiken. Je kunt de snelheid (v = ∆x ∆t ) dus makkelijk eenduidig berekenen.
De plaats (S) waar de golf vertrekt, is moeilijker te bepalen, want die kan zich over de hele breedte van de spleet bevinden.
Bij het experiment van De Broglie, waarbij de spleet erg nauw was, was het resultaat een cirkelvormig golffront.
waarnemer W
Afb. 34 De circulaire voortplanting van het golffront
Doordat de spleet heel nauw is, kun je precies de plaats van de golf bepalen. De richting varieert nu echter. Bovendien zal het tijdstip waarop het golffront de waarnemer bereikt, afhangen van waar die waarnemer zich bevindt op de stippellijn. Je kunt in dit tweede experiment van De Broglie dus wel nauwkeurig de plaats bepalen, maar niet de richting en de snelheid van de golf.
Ook wanneer je de snelheid en de plaats van elektronen bepaalt, gebruik je formules die de golflengte en de amplitude van de golf bevatten. Door wiskundige formules te combineren met de waarnemingen uit de voorgaande experimenten, kwam men tot het besluit dat je niet tegelijkertijd de plaats en de snelheid van een deeltje met een golfkarakter (zoals een elektron) kunt bepalen.
Dat noem je de onzekerheidsrelatie van Heisenberg. S
Wat is de aangeslagen toestand van een elektron?
Leg uit.
Wat is een kwantum?
Leg uit.
Kunnen elektronen willekeurige energieniveaus aannemen?
Leg uit.
Het onderstaande diagram toont 4 mogelijke elektronenovergangen tussen energieniveaus binnen hetzelfde atoom.
energie van een foton: E = h ∙ c λ
c = voortplantingssnelheid van het licht
λ = golflengte van het licht
h = 6,6 ∙ 10-34 J ∙ s (constante van Planck)
Bij welk van die overgangen is de golflengte van het geabsorbeerde licht het grootst?
elektronenovergangen
energieniveaudiagram
a overgang 1 (3s → 1s)
b overgang 2 (2s → 3s)
c overgang 3 (1s → 2s)
d overgang 4 (2p → 2s)
Meer oefenen?
Arnold Sommerfeld steunde op de theorieën van De Broglie en Heisenberg om de positie van elektronen, en dus eigenlijk van de schillen, ter discussie te stellen. Een atoom kon volgens Bohr maximaal 7 schillen bevatten (K, L, M, N, O …), waarbij de energie van de elektronen toeneemt als de schil zich verder van de kern bevindt. Maar Sommerfeld had wel meer dan 7 energieniveaus in gedachten …
LEERDOELEN
L Het atoommodel van Sommerfeld (de opsplitsing van de energieniveaus op basis van lijnenspectra) uitleggen
L De betekenis van de kwantumgetallen koppelen aan orbitalen
L Een overzicht van de energieniveaus in een atoom geven en uitleggen dat de energie van de elektronen in een atoom gekwantiseerd is
Hoofd- en nevenkwantumgetal
Het schilnummer kreeg het symbool n. Het is de belangrijkste indeling in energieniveaus, oftewel het hoofdkwantumgetal
Sommerfeld stelde echter experimenteel vast uit het emissiespectrum dat de kleurvariaties niet scherp afgelijnd zijn en dat er dus naast de hoofdenergieniveaus (of schillen van Bohr) ook nog subniveaus moeten bestaan.
Wetenschappers begonnen bewust niet met A, omdat ze vermoedden dat men later nog schillen dichter bij de kern zou ontdekken. Dat bleek niet het geval te zijn. Tegenwoordig heeft men het zelfs over een 8e schil.
M (n = 3)
L (n = 2)
K (n = 1)
Afb. 35 De hoofdenergieniveaus en subniveaus van de schillen
Het energieverschil tussen de subniveaus van dezelfde schil is bijzonder klein. Dat is ook de reden waarom Bohr er geen rekening mee kon houden.
Met experimenten toonde Sommerfeld aan dat je elke schil nog verder kunt opsplitsen in maximaal 4 subniveaus. Die duidde hij aan met de letters s, p, d en f

Ook bij gewone diffractie van wit licht door de zon zie je dat er subniveaus bestaan: de regenboog bestaat niet uit 7 scherp afgelijnde kleuren, maar uit 7 kleuren die in elkaar overlopen.

Sommerfeld merkte op dat het aantal subniveaus verschilt per schil:
K-schil (n = 1) Op de 1e schil zag hij nooit veel afwijkingen in energie-inhoud. Hij noemde het enige subniveau het s-niveau (s van sharp).
L-schil (n = 2) De 2e schil kon hij verdelen in 2 soorten subniveaus.
Naast het s-subniveau benoemde hij daar ook het p-subniveau (p van principal).
M-schil (n = 3) De 3e schil splitste hij op in 3 subniveaus.
Naast het s- en p-subniveau beschreef hij ook het d-subniveau (d van diffuse).
N-schil (n = 4) Vanaf de 4e schil kon hij 4 soorten subniveaus afleiden uit de emissiespectra.
Naast de 3 voornoemde subniveaus benoemde hij ook het f-subniveau (f van fundamental).
Ook de overige schillen kregen enkel die 4 subniveaus s, p, d en f toebedeeld.
Om het energieniveau van een elektron eenduidig te bepalen, had Sommerfeld dus niet meer genoeg aan enkel het schilnummer of hoofdkwantumgetal n (1 tot en met 7). Hij definieerde ook het nevenkwantumgetal l:
l = 0 s-subniveau
l = 1 p-subniveau
l = 2 d-subniveau
l = 3 f-subniveau
Het nevenkwantumgetal l heeft een waarde van 0 tot en met n – 1, waarbij n het hoofdkwantumgetal is. De hoogst mogelijke waarde voor het nevenkwantumgetal is 3.
Een subniveau van een hoofdkwantum kun je beschouwen als een afwijking van het hoofdkwantum (voorheen de schil) en dus als een subschil.
VOORBEELD AANTAL NEVENKWANTUMGETALLEN OP SCHIL 3
Op schil 3 (n = 3) kan het nevenkwantumgetal de waarden van 0 tot en met n – 1 aannemen. De waarden kunnen dus variëren van 0 tot en met 2 en kunnen daardoor 0, 1 of 2 zijn.
Het specifiekere energieniveau werd voortaan aangeduid met het hoofdkwantumgetal, gevolgd door het nevenkwantumgetal l.
Bijvoorbeeld: 3d is het diffuse subniveau van de 3e schil.
Het maximale aantal elektronen dat je per subniveau terugvindt, kun je makkelijk afleiden uit het maximale aantal elektronen per schil. In de 2e graad leerde je al het volgende:
K-schil (n = 1) 2
L-schil (n = 2) 8
M-schil (n = 3) 18
N-schil (n = 4)
O-schil (n = 5)
P-schil (n = 6)
Q-schil (n = 7)
32
32
* Vanaf hier geldt de regel 2n² niet meer.
18
18
De onderzoekers in het CERN zijn inmiddels zo ver gevorderd dat ze niet alleen het PSE vervolledigd hebben tot 118 elementen, maar er ook aan denken om een 8e periode toe te voegen. Er is immers geen limiet aan het aantal protonen in een kern, maar wel aan de stabiliteit van die atomen. Meer en meer is er bovendien sprake van 50 elektronen in de O-schil, en zelfs over een g-subniveau.
Omdat op de K-schil (n = 1) enkel het s-subniveau voorkomt (0 tot en met n – 1, dus kan l enkel de waarde 0 hebben), kun je besluiten dat het s-subniveau maximaal 2 elektronen kan bevatten.
Analoog daarmee kun je stellen dat de L-schil (n = 2) 2 subniveaus heeft (0 tot en met 1, dus l = 0 of l = 1: s- en p-subniveau). Je weet al dat er maximaal 2 elektronen op het s-subniveau zitten. Aangezien de L-schil in totaal 8 elektronen kan bevatten, zitten er maximaal 6 elektronen op het p-subniveau.
Als je die redenering doortrekt naar de volgende schillen, kun je berekenen dat het d-subniveau maximaal 10 elektronen kan bevatten en het f-subniveau maximaal 14 elektronen. SCHIL HOOFDKWANTUMGETAL nNEVENKWANTUMGETAL l NOTATIE SUBNIVEAU
n = 1 l = 0 1s 2
n = 2 l = 0 of 12s 2p 2 + 6 = 8 M n = 3 l = 0, 1 of 23s 3p 3d 2 + 6 + 10 = 18 N n = 4 l = 0, 1, 2 of 34s 4p 4d 4f2 + 6 + 10 + 14 = 32 O n = 5 l = 0, 1, 2 of 35s 5p 5d 5f2 + 6 + 10 + 14 = 32
P n = 6 l = 0, 1, 2 of 36s 6p 6d 2 + 6 + 10 = 18
Q n = 7 l = 0, 1, 2 of 37s 7p 7d 2 + 6 + 10 = 18
Tabel 2 Aantal elektronen per nevenkwantum
Het zogenoemde nevenkwantumgetal l kon men daarna linken aan de bewegingsvrijheid van bepaalde elektronen.
Wetenschappers ontdekten dat elektronen zich niet netjes in een perfecte cirkelvormige beweging rond de kern verplaatsen, maar dat ze zich telkens binnen een bepaalde driedimensionale ruimte bevinden. Die ruimte noem je het orbitaal van het elektron.
Als je op onnoemelijk veel tijdstippen een puntje zet op de plek waar je het elektron aantreft op dat moment, zul je tot een aantal vaste 3D-volumes komen. Zo bekom je het stippenmodel van de locatie van een bepaald elektron.
Uit het stippenmodel van bijvoorbeeld 1 1H blijkt dat het elektron een bolvormige ruimte rond de atoomkern inneemt. Andere elektronen tonen vaak andere orbitaalvormen.
Het stippenmodel van andere elektronen levert bijvoorbeeld ook een andere vorm op. Als we hier de (grijze) contourlijnen tekenen, wordt het duidelijk dat dit orbitaal een haltervorm heeft.
Het was de wetenschapper Schrödinger die met de ondertussen beroemde Schrödingervergelijkingen de ruimtelijke vorm van die orbitalen beschreef.
Erwin Schrödinger (1887-1961) stelde een wiskundige vergelijking op waarmee hij de waarschijnlijkheid kon berekenen om een elektron aan te treffen in een bepaald gebied rond de atoomkern. In de praktijk geeft men die waarschijnlijkheid weer met een stippenmodel. Je kunt je dat voorstellen als een foto van een elektron op verschillende tijdstippen. Wanneer je telkens de locatie van het elektron aanduidt en alle plaatsen bij elkaar zet, verkrijg je een beeld van het gebied waar dat elektron zich kan bevinden. Het aantal stippen per oppervlakte-eenheid is een maat voor de waarschijnlijkheid dat je het elektron daar aantreft.

Om een reële begrenzing van de bewegingsruimte van een elektron te verkrijgen, trekt men contourlijnen rond een stippenmodel, zodat het afgebakende volume 90 % van de elektronenwolk omvat. Die afgebakende zone of dat trefkansgebied noem je een orbitaal
De definitie van een orbitaal is dus: de plaatsafhankelijke waarschijnlijkheidsverdeling (PW), oftewel een beschrijving van de ruimte waarin een elektron zich 90 % van de tijd bevindt.
Schrödinger merkte op dat elektronen zich in verschillende ‘ruimten’ bevinden.
Het nevenkwantumgetal l linkte hij dus aan de vorm van het orbitaal. Afhankelijk van de waarde van het nevenkwantumgetal l kwam hij tot de volgende besluiten:
a) Nevenkwantumgetal l = 0
l = 0 s-orbitaal
Het orbitaal is SHARP: sferisch symmetrisch. De elektronen bevinden zich in een bolvormige ruimte rond de kern.
b) Nevenkwantumgetal l = 1
l = 1 p-orbitaal
Het orbitaal is PRINCIPAL: haltervormig, met een vernauwing bij de kern.
Opmerking:
Omdat dit geen sferisch orbitaal meer is, zijn er hier meerdere oriëntaties ten opzichte van de hoofdassen in het assenstelsel mogelijk. Afhankelijk van hoe de haltervorm georiënteerd is ten opzichte van de kern, zal het gemiddelde energieniveau van de elektronen in dat orbitaal verschillen. Daar komen we later op terug.
c) Nevenkwantumgetal l = 2
l = 2 d-orbitaal
Het orbitaal is DIFFUSE: een dubbele halter of een halter met ring.
Hier zijn 5 verschillende oriëntaties of variaties mogelijk.
d) Nevenkwantumgetal l = 3
l = 3 f-orbitaal
Het orbitaal is FUNDAMENTAL: meerdere halters of 1 halter met 2 ringen.
Zoals je merkt, zijn hier 7 verschillende oriëntaties of variaties mogelijk.
Voor hetzelfde hoofdkwantumgetal is het energieniveau als volgt: E s < E p < Ed < Ef Uit de 3D-weergave van de respectievelijke stippenmodellen blijkt duidelijk dat de bewegingsvrijheid in een s-orbitaal kleiner is dan in een p-orbitaal. Daar is de bewegingsvrijheid dan weer kleiner dan in een d-orbitaal enzovoort.
video: experiment van Schrödinger
De vorm van een orbitaal is dan weer onafhankelijk van het hoofdkwantumgetal. Alleen het volume stijgt wanneer de waarde van het hoofdkwantumgetal toeneemt. Een s-orbitaal zal bijvoorbeeld zowel op de 1e als op de 2e schil een bolvorm hebben, maar op de 2e schil zal het volume groter zijn.
1s 2s 2py 2pz 2px
Afb. 41 De relatieve grootte van orbitalen volgens hoofdkwantumgetal
Een orbitaal kun je omschrijven als de plaatsafhankelijke waarschijnlijkheidsverdeling (PW), oftewel een beschrijving van de ruimte waarin een elektron zich 90 % van de tijd bevindt.
Het energieniveau van elektronen wordt bepaald door meerdere kwantumgetallen: het hoofdkwantumgetal (of schilnummer), maar ook het nevenkwantumgetal, dat de vorm van het orbitaal weergeeft (bolvormig, haltervormig ...).
WEETJE
Schrödingers kat
De Oostenrijkse wetenschapper Schrödinger kreeg de Nobelprijs voor Natuurkunde vanwege zijn gedachteexperimenten. Zijn stelling was: ‘Je kent nooit met zekerheid de realiteit, tot je ze kunt observeren.’ Om dat te illustreren, stopte hij een kat in een doos met gifgas. Zou de kat het overleven? Als je het experiment vele keren doet, kun je stellen dat de kans daartoe 50 % is. Het enige wat je met zekerheid kunt zeggen, is dat de kat leefde toen je ze in de doos stopte. Dat noemde Schrödinger de kwantumtoestand. Maar of de kat het experiment overleeft, kun je enkel vaststellen bij een observatie achteraf. Dat leidde tot een gedachte-experiment: de mens bepaalt hier voor een stuk wat er met de kat gebeurt, maar wie of wat bepaalt wat er met de mens of met de natuur gebeurt?

De wetenschap gebruikt nog altijd de methode ‘vaststellen = weten’. Wetenschappers voeren experimenten uit en leiden wetmatigheden af uit hun vaststellingen.
Meer weten over het experiment van Schrödinger? Bekijk de video.
De wetenschap evolueerde en wetenschappers merkten verschillen op in energieniveau bij elektronen die zich binnen hetzelfde hoofdkwantum en nevenkwantum bevinden. Die verschillen kon men toeschrijven aan de ruimtelijke oriëntatie van het orbitaal. Om de verschillen duidelijk te maken, definieerde men voor elk elektron naast het hoofd- en nevenkwantumgetal nog een derde kwantumgetal: het magnetisch kwantumgetal ml
Het magnetisch kwantumgetal ml bepaalt de oriëntering van het orbitaal langs de hoofdassen, want ook dat zorgt voor een verschil in energieniveau. Het kwantumgetal ml kan alle waarden tussen –l en +l aannemen (waarbij l het nevenkwantumgetal is).
a) l = 0
→ Maar 1 mogelijke waarde voor het magnetisch kwantumgetal: ml = 0. Het bolvormige s-orbitaal heeft maar 1 mogelijke oriëntatie.
b) l = 1
→ Het magnetisch kwantumgetal ml kan de waarden –1, 0 of +1 aannemen. 3 oriënteringsmogelijkheden: een p-orbitaal volgens de x-, y- of z-as.
De lorentzkracht is een kracht die ontstaat door een bewegende lading in een magnetisch veld. De grootte van de kracht hangt af van de grootte van het magnetisch veld, en van de snelheid en de grootte van de lading. De richting is loodrecht op de snelheid en het magnetisch veld. De zin hangt af van het ladingsteken.
c) l = 2
→ Het magnetisch kwantumgetal ml kan de waarden –2, –1, 0, +1 of +2 aannemen.
5 oriënteringsmogelijkheden: 5 verschillende d-orbitalen.
d) l = 3
→ Het magnetisch kwantumgetal ml kan de waarden –3, –2, –1, 0, +1, +2 of +3 aannemen.
7 oriënteringsmogelijkheden: 7 verschillende f-orbitalen.
Maar nog altijd waren wetenschappers niet in staat om alle elektronen een energieniveau toe te wijzen met enkel die 3 kwantumgetallen. Er bleek namelijk nog een mogelijk verschil in energie-inhoud te bestaan tussen elektronen met hetzelfde hoofd-, neven- en magnetisch kwantumgetal. Dat komt doordat een elektron om zijn eigen as wentelt. Je kunt dat vergelijken met de aarde, die om de zon draait en tegelijkertijd ook om haar eigen as.
Die omwenteling of spin wekt een magnetisch veld op, dat door lorentzkrachten zal zorgen voor verschillende energieniveaus. Elektronen met dezelfde spin stoten elkaar af, terwijl elektronen met een tegengestelde spin elkaar aantrekken. Botsingen zijn echter uitgesloten, omdat alle elektronen dezelfde negatieve lading dragen.
Het 4e en laatste kwantumgetal, het spinkwantumgetal ms, geeft dus de richting van de spin van het elektron aan met een waarde van – 1 2 of + 1 2 .
Later zul je 2 elektronen met een tegengestelde spin voorstellen met pijltjes:
Je mag aannemen dat het totaal van alle orbitalen van een atoom altijd een bolvormige negatieve ladingswolk rond de kern oplevert. Daardoor kun je atomen dus nog altijd voorstellen als bollen. Dat blijkt uit de voorstelling van 10Ne op afbeelding 43.
Tabel 3 vat de elektronenverdeling in orbitalen en het aantal elektronen per schil samen voor de 5 eerste perioden van het periodiek systeem. SCHIL HOOFDKWANTUMGETAL
Met de theorie van Bohr-Sommerfeld in het achterhoofd kun je het energieniveau van eender welk elektron aanduiden met behulp van een set van 4 kwantumgetallen: n, l, ml en m s .
Het hoofdkwantumgetal n (1 tot en met 7) geeft het hoofdenergieniveau aan.
Het nevenkwantumgetal l (0 tot en met n – 1, maximaal 3) geeft het subniveau aan. Dat komt overeen met het soort orbitaal waarin een elektron zich bevindt.
Het magnetisch kwantumgetal ml (–l tot en met +l) geeft de ruimtelijke oriëntatie van het orbitaal aan.
Het spinkwantumgetal ms (– 1 2 of + 1 2 ) geeft de spin van het elektron om zijn eigen as weer.
Geef de 4 kwantumgetallen met hun betekenis en hun mogelijke waarden.
Bestaan er d-orbitalen met hoofdkwantumgetal 2? Licht toe.
Geef 4 mogelijke kwantumgetallen n, l, ml en m s voor het ongepaarde elektron bij deze atomen: a jood, I b kalium, K c aluminium, Al
Zijn de onderstaande stellingen juist of fout?
a Het hoofdkwantum geeft aan in welke groep van het PSE een element voorkomt.
b Als het nevenkwantumgetal 2 is, dan kan het magnetisch kwantumgetal 5 verschillende waarden aannemen.
c Het spinkwantumgetal geeft de vorm van het orbitaal aan.
d Het energieniveau van een elektron wordt telkens aangeduid met 4 kwantumgetallen.
Meer oefenen? Ga naar .
Nu we weten dat elektronen zich in orbitalen bevinden, moeten we de elektronenconfiguratie zoals we die vroeger schreven, ook aanpassen en uitbreiden met informatie over de orbitalen. Daarvoor bekijken we wat de wetenschappers Pauli en Hund toevoegden aan de atoomtheorie.
LEERDOELEN
L De elektronenconfiguratie van elementen uit de a-groepen en de b-groepen schrijven: de opvullingsvolgorde van orbitalen en inversie
L Het verband tussen die elektronenconfiguraties en de opbouw van het periodiek systeem beschrijven: de blokken in het PSE
L Elektronenconfiguraties met pijltjes schrijven en de regel van Hund en het uitsluitingsprincipe van Pauli toepassen
Pauli voegde aan de theorie van de kwantumgetallen toe dat er binnen hetzelfde atoom geen 2 elektronen voorkomen met exact dezelfde 4 kwantumgetallen. Dat betekent dus dat binnen 1 atoom elk elektron een verschillend energieniveau heeft dan eender welk ander elektron Daaruit kun je ook afleiden dat 2 elektronen die hetzelfde hoofd- en nevenkwantumgetal hebben, met hetzelfde magnetisch kwantumgetal, sowieso een verschillend 4e kwantumgetal hebben. Ze zullen dus een tegengestelde spinrichting hebben.
Dat uitsluitingsprincipe van Pauli kun je op 2 manieren beschrijven:

1 In hetzelfde atoom kunnen nooit 2 elektronen voorkomen met exact dezelfde waarden voor de 4 kwantumgetallen.
2 Hetzelfde orbitaal kan maximaal 2 elektronen bevatten. Die elektronen hebben een tegengestelde spin.
Opmerking:
2 elektronen in hetzelfde orbitaal noemde je vroeger al een elektronenpaar.
1 geïsoleerd elektron in een orbitaal noemde je een ongepaard elektron.
Op elk energieniveau kun je dus een beperkt aantal elektronen aantreffen. Dat maakte het overzicht op p. 76 al duidelijk.
1 2 3 4 5 6 7
Met onze huidige kennis kunnen we de elektronen verdelen in orbitalen met hun respectievelijke kwantumgetallen. In deze paragraaf beschouwen we dus alle elektronen in hun grondtoestand (met de kleinst mogelijke energie-inhoud). Wanneer elektronen zich in een aangeslagen toestand bevinden, betekent dat dat ze ofwel naar een hogere schil of hoger hoofdkwantum zijn verplaatst, ofwel naar een ander, energetischer orbitaal (bijvoorbeeld van het s-orbitaal naar een p-orbitaal).
Elektronen worden in een atoom in orbitalen geplaatst volgens stijgende energie-inhoud. De orbitalen met de kleinste energie-inhoud worden dus het eerst opgevuld. In eerste instantie zullen de orbitalen van het 1e hoofdniveau gevuld worden, vervolgens die van het 2e enzovoort.
Binnen hetzelfde hoofdniveau of hoofdkwantum (voorheen: schil) worden eerst de orbitalen met het laagste subniveau gevuld: eerst het s-orbitaal, vervolgens de p-orbitalen, dan de d-orbitalen en ten slotte de f-orbitalen.
atoomnummer (Z)
waarde (EN)
Wanneer je elektronenconfiguraties schrijft, noteer je de symbolen van de bezette orbitalen volgens toenemende energie achter elkaar. Het cijfer voor het orbitaalsymbool (s, p, d, f) duidt op het hoofdenergieniveau. De exponent wijst op het aantal elektronen in de overeenstemmende orbitalen.
VOORBEELD OPVULLINGSVOLGORDE VAN DE ORBITALEN VAN MAGNESIUM
gemiddelde relatieve atoommassa (
Magnesium, met atoomnummer Z = 12, heeft 12 elektronen.
Die komen achtereenvolgens terecht in 1s (2 elektronen), 2s (2 elektronen), 2p (6 elektronen) en 3s (2 elektronen).
Je noteert de opvullingsvolgorde als volgt: 1s2 2s2 2p6 3s2.
Vanaf een zeker hoofdniveau (de 3e schil of n = 3) overlappen de energieniveaus van de subniveaus van verschillende hoofdkwantums elkaar. Een subniveau van een lager gelegen hoofdkwantum kan een hogere energie-inhoud hebben dan een subniveau van een hoger gelegen hoofdkwantum.
VOORBEELD ENERGIEOVERLAPPING
Elektronen in een 4s-orbitaal (n = 4, l = 0, ml = 0) hebben een lagere energie-inhoud dan elektronen in een 3d-orbitaal.
TOENEMENDE ENERGIE n = 4 n = 3 n = 2 n = 1
HOOFDKWANTUM
10e6e10e2e6e2e6e2e2e-
NEVENKWANTUM OF SOORT ORBITAAL
In volgorde van energieniveau zou je de orbitalen als volgt moeten rangschikken: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Er bestaat een geheugensteuntje om die opvullingsvolgorde te onthouden, in de vorm van een pijlendiagram of referentiediagonaal. n l 0 1 2 3
Afb. 45 De referentiediagonaal
VOORBEELD OPVULLINGSVOLGORDE VAN DE ORBITALEN VAN BROOM
Broom heeft atoomnummer Z = 35 en bezit dus 35 protonen in de kern en 35 elektronen in de orbitalen, met de volgende opvullingsvolgorde: 1s (2 elektronen), 2s (2 elektronen), 2p (6 elektronen), 3s (2 elektronen), 3p (6 elektronen), 4s (2 elektronen), 3d (10 elektronen), 4p (5 elektronen).
Je noteert de opvullingsvolgorde als volgt 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5.
We bekijken nu de elektronenconfiguratie met orbitalen van enkele elementen. Wanneer we de elektronenconfiguratie schrijven, houden we opnieuw rekening met de opvullingsvolgorde. ELEMENT ELEKTRONENCONFIGURATIE
Conclusie: het laatste elektron wordt telkens toegevoegd aan een s-orbitaal. Deze elementen staan allemaal in dezelfde groep (Ia) in het PSE.
ELEMENT
8O 1s2 2s2
ELEKTRONENCONFIGURATIE
Conclusie: het laatste elektron wordt telkens toegevoegd aan een p-orbitaal. Deze elementen staan allemaal in dezelfde groep (VIa) in het PSE.
Je kunt de elektronenconfiguratie dus makkelijk linken aan de plaats van het element in het PSE
Je zult merken dat je het periodiek systeem kunt indelen in blokken. De elementen staan namelijk gegroepeerd volgens het laatst opgevulde orbitaal. Het PSE is op die manier onderverdeeld in het s-blok (elementen die als laatste een s-orbitaal opvullen), een p-blok (elementen die als laatste een p-orbitaal opvullen), een d-blok (elementen die als laatste een d-orbitaal opvullen), en een f-blok (de actiniden en lanthaniden, die als laatste een f-orbitaal opvullen).
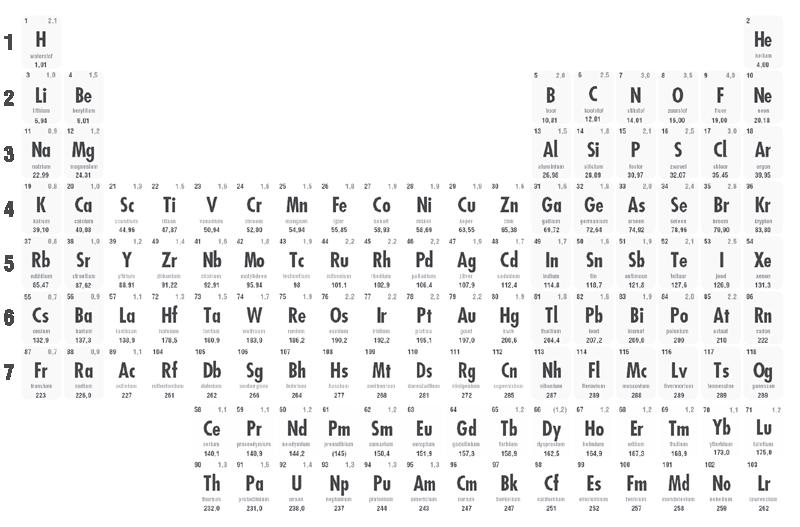
s-blokelementen
p-blokelementen
d-blokelementen
f-blokelementen
Opmerking:
Helium is blauw gekleurd en behoort dus eigenlijk tot het s-blok. Je zou helium dus naast waterstof kunnen zetten. Toch staat het in kolom VIIIa, want met een volledige edelgasconfiguratie is het ook een edelgas.
Andersom kun je bij een gegeven elektronenconfiguratie met orbitalen nu ook afleiden om welk element het gaat. Daarvoor maak je gebruik van de volgende 3 wetmatigheden:
1 Het periodenummer van een element is altijd gelijk aan het hoogste hoofdkwantumgetal dat voorkomt in de elektronenconfiguratie van dat element.
2 Het blok waartoe het element behoort, wordt gegeven door het laatst opgevulde orbitaal. Elementen die als laatste een s- of p-orbitaal vullen, staan in de hoofdgroepen. Elementen die als laatste een d-orbitaal opvullen, zijn overgangselementen uit de b-groepen. Om helemaal volledig te zijn, kunnen we nog toevoegen dat elementen die als laatste een f-orbitaal opvullen, behoren tot de actiniden of lanthaniden.
3 Het aantal elektronen in het laatst opgevulde orbitaal bepaalt de plaats in het blok in het PSE.
VOORBEELD
1 Van welk element is dit de elektronenverdeling in orbitalen: 1s2 2s2 2p6 3s2 3p5?
Je ziet dat het grootste hoofdkwantumgetal 3 is. Het is dus een element van de 3e periode. De laatst opgevulde orbitalen zijn p-orbitalen, dus het element bevindt zich in het p-blok. Er zitten 5 elektronen in p-orbitalen. Het gaat dus om het 5e element in het p-blok van de 3e periode: chloor.
Je kunt ook gewoon alle elektronen optellen (= getallen in superscript). Dan kom je aan 17 elektronen. Het gaat dus om een atoom met 17 elektronen en bijgevolg ook 17 protonen. Het atoomnummer Z is dan 17. Het atoom is dus een chlooratoom.
1 H 2 He
2 Van welke element is dit de elektronenverdeling in orbitalen: 1s2 2s2 2p6 3s2 3p6 4s2 3d10?
Je ziet dat het grootste hoofdkwantumgetal 4 is. Het is dus een element van de 4e periode. De laatst opgevulde orbitalen zijn d-orbitalen, dus het element bevindt zich in het d-blok. Het gaat om een overgangselement. Er zitten 10 elektronen in d-orbitalen. Het gaat dus om het 10e element in het d-blok van de 4e periode: zink.
3 Elektronenconfiguratie met spinaanduiding: het hokjesmodel
We herhalen nogmaals het maximale aantal elektronen per hoofdniveau of schil en hoe je dat noteert met orbitalen
K: 2 elektronen, die allebei in een s-orbitaal zitten
aantal elektronen in dat orbitaal
hoofdkwantumgetal n 1s² soort orbitaal, afgeleid van het nevenkwantumgetal l
L: 8 elektronen, 2s² en 2p6
M: 18 elektronen, 3s², 3p6 en 3d10
N: 32 elektronen, 4s², 4p6, 4d10 en 4f14
O: 32 elektronen, 5s², 5p6, 5d10 en 5f14
P: 18 elektronen, 6s², 6p6 en 6d10
Q: 8 elektronen, 7s² en 7p6
Als je elektronenconfiguraties schrijft, noteer je de symbolen van de bezette orbitalen achter elkaar volgens toenemende energie. Het cijfer voor het orbitaalsymbool (s, p, d, f) duidt op het hoofdenergieniveau. De exponent wijst op het aantal elektronen in de overeenstemmende orbitalen.
De bezetting van de laatste orbitalen schrijf je vaak in detail door middel van pijltjes in hokjes, die ook de spin van het elektron weergeven: de zogenoemde hokjesvoorstelling. Binnen 1 subniveau teken je de hokjes aan elkaar vast. Op die manier geef je aan dat ze tot hetzelfde nevenkwantum behoren.
VOORBEELD
1 Argon
Z = 18 elektronenconfiguratie: 1s2 2s2 2p6 3s2 3p6
Hokjesvoorstelling
1s2 2s2 2p6 3s2 3p6
2 Calcium
Z = 20 elektronenconfiguratie: 1s2 2s2 2p6 3s2 3p6 4s2
Hokjesvoorstelling
Je kent nu de orbitalen, de opvullingsvolgorde en de regel van Pauli. Als je daar nog de regel van Hund aan toevoegt, dan ben je in staat om correcte elektronenconfiguraties met subniveaus te schrijven.
Volgens de regel van Hund hebben de elektronen die zich in gelijksoortige orbitalen van hetzelfde energieniveau bevinden, zo veel mogelijk dezelfde spin.
Dat betekent concreet het volgende: vermits in 1 orbitaal de 2 elektronen een tegengestelde spin hebben (Pauli), hebben elektronen in hetzelfde orbitaalblok van een bepaald hoofdkwantum zo veel mogelijk eerst dezelfde spin en zijn ze dus ongepaard. Pas daarna worden orbitalen opgevuld met een 2e elektron met een tegengestelde spin.
VOORBEELD REGEL VAN HUND
1 Zuurstof
O: Z = 8
1s2 2s2 2p4 of, meer gedetailleerd, 1s2 2s2 2px2 2py1 2pz1
Merk op dat de laatste 2 elektronen ongepaard in hun eigen p-orbitaal zitten: een gevolg van de regel van Hund.
1s2 2s2 2p4
2px2 2py1 2pz1
Die elektronenconfiguratie komt overeen met de lewisstructuur die we eerder zagen.
Zuurstof heeft 2 elektronenparen en 2 ongepaarde elektronen in de buitenste schil (n = 2).
2 Stikstof
N: Z = 7
1s2 2s2 2p3 of, meer gedetailleerd, 1s2 2s2 2px1 2py1 2pz1
Houd altijd rekening met de regel van Hund wanneer je de p-orbitalen opvult.
Je krijgt dus:
1s2 2s2 2p3
In de voorgaande voorbeelden merk je wellicht op dat de opvulling van de eerste orbitalen altijd op dezelfde manier gebeurt. Tenzij je graag pijltjes tekent, kan dat al snel vervelen.
Je kunt de elektronenconfiguratie daarom ook vereenvoudigd weergeven door tussen vierkante haakjes eerst het symbool te schrijven van het edelgas dat het kortst voor het onderzochte element staat in het PSE (de zogenoemde shorthand electron configuration). Het zullen toch telkens weer de elektronen met het grootste hoofdkwantumgetal zijn die een rol spelen bij ionvorming en bindingen.
Voor zuurstof is de verkorte elektronenconfiguratie [2He] 2s2 2p4
Of met de hokjesvoorstelling: [2He] 2s2 2p4
Voor calcium is dat [18Ar] 4s2
Of met de hokjesvoorstelling: [18Ar] 4s2
VOORBEELD VEREENVOUDIGDE ELEKTRONENCONFIGURATIE SCHRIJVEN
Schrijf de volledige en de vereenvoudigde elektronenconfiguratie van vanadium, Z = 23.
1s2 2s2 2p6 3s2 3p6 4s2 3d3 of [18Ar] 4s2 3d3 [18Ar]
Opmerking:
Als vanadium geïoniseerd wordt en een positief ion vormt, wordt er geen 3d-elektron weggenomen, maar een 4s-elektron. Eenmaal de orbitalen zijn opgevuld, schrijf je dus beter: [18Ar] 3d3 4s2. De elektronen met het grootste hoofdkwantumgetal worden immers eerst geïoniseerd.
Het opvullingsdiagram voor de elektronenconfiguraties is dus geen energiediagram. Het geeft geen informatie over de energieniveaus na de opvulling, wel over die ervoor.
Je weet al dat atomen streven naar een edelgasconfiguratie. Ze vormen ionen door elektronen af te staan of op te nemen. In het licht van de orbitaaltheorie kun je die edelgasconfiguratie ook een configuratie ‘met volledig gevulde orbitalen’ noemen. Wanneer alle orbitalen vol zitten, is dat voor het atoom een stabielere situatie.
We bekijken even de elektronenconfiguratie van de elementen zwavel en natrium, allebei uit de a-groep:
• Zwavel 16S [10Ne] 3s2 3p4 [10Ne]
3s2 3p4
Als zwavel er nog 2 extra elektronen bij krijgt, zitten ook de p-orbitalen allemaal vol. Dan is zwavel stabieler, want het bereikt de edelgasconfiguratie van Ar. Zwavel zal dan ook het S2--ion vormen.
• Natrium 11Na [10Ne] 3s1 [10Ne]
3s1
Als natrium dat ene 3s-elektron afstaat, blijven er enkel nog volle orbitalen over en bereikt het atoom de edelgasconfiguarie van Ne. Natrium zal dus voor een betere stabiliteit een Na+-ion vormen.
Inversie is niet hetzelfde als de ionisatie van een atoom. Er wordt wel een elektron verplaatst, maar het elektron blijft een deel van hetzelfde atoom.
Niet alleen volledig gevulde orbitalen geven het element meer stabiliteit. Ook een elektronenconfiguratie met half opgevulde orbitalen zorgt voor een stabielere situatie.
Bekijk de (verkorte) elektronenconfiguratie van chroom (Z = 24). Ondanks het feit dat het 4s-orbitaal eerder werd opgevuld dan het 3d-orbitaal, is het energieniveau na de opvulling toch hoger voor de elektronen in het 4s-orbitaal.
[18Ar] 4s2 3d4 [18Ar]
4s2 3d4
Experimenteel stelde men echter vast dat de werkelijke configuratie van chroom er als volgt uitziet:
[18Ar] 4s1 3d5 [18Ar]
4s1 3d5
Je merkt dat chroom een elektron inverteert van een 4s- naar een 3d-orbitaal met een lagere energie-inhoud. Daardoor zijn alle orbitalen nu halfgevuld, wat dus een stabielere toestand is. Ook wanneer orbitalen van een lager energetisch kwantum volledig opgevuld kunnen worden door een elektron te inverteren, zal er binnen het atoom een elektron verplaatst worden.
De bovenstaande inversie heeft dus dit rechtstreekse gevolg: chroomatomen die de inversie ondergaan, hebben nog maar 1 elektron in hoofdkwantum (of schil) 4 en zullen dus ioniseren tot Cr+ in plaats van tot Cr2+
Een atoom kan elektronen inverteren zonder hulp van buitenaf. Er is geen extra energie voor nodig. Integendeel, want het elektron verhuist naar een lager gelegen energieniveau.
In het 4e jaar leerde je al dat een zilverion altijd een ionlading van 1+ draagt, terwijl de overgangsmetalen meestal 2+ als lading hebben. Ook dat verklaren we met de opvullingsvolgorde van de orbitalen en de inversie van elektronen. We verklaren alweer 2 fenomenen die je vroeger gewoon als feit moest aanvaarden:
1 Waarom hebben de overgangsmetalen doorgaans een ionlading van 2+?
Als je goed kijkt, zie je dat de overgangsmetalen eerst het s-blok vullen met 2 elektronen, vooraleer de laatste elektronen in een d-orbitaal terechtkomen. Zoals gezegd, zullen echter eerst de elektronen met het hoogste hoofdkwantumgetal geïoniseerd worden. Dat zijn telkens de 2 elektronen uit het s-orbitaal. Vandaar dat je in de 2e graad te horen kreeg dat de overgangselementen een ionlading van 2+ hebben.
2 Waarom hebben sommige overgangselementen toch een andere ionlading dan 2+?
Je leerde dat zilver altijd een ionlading van 1+ heeft in plaats van 2+ en dat sommige metalen, zoals ijzer, met meerdere ionladingen kunnen voorkomen. Die 2 fenomenen verklaren we met wat je nu weet:
47Ag: [36Kr] 5s2 4d9 of met de hokjesvoorstelling: [36Kr] 5s2 4d9
Door de inversie van een elektron bekomt het zilveratoom een stabielere configuratie, want dan is het onderliggende d-orbitaal volledig opgevuld. Er blijft maar 1 elektron over in het 5s-orbitaal. Zilver zal dus het Ag+-ion vormen:
47Ag: [36Kr] 5s1 4d10 of met de hokjesvoorstelling: [36Kr]
Opmerking:
5s1 4d10
Bij inversie wordt er dus altijd een elektron verplaatst van een s-orbitaal naar een d-orbitaal met een lager hoofdkwantumgetal. Een atoom zal enkel een elektron inverteren als het daardoor een volledig of halfgevuld d-orbitaal bekomt.
WEETJE
De overgangselementen bereiken na ionisatie niet de edelgasconfiguratie. Het zijn enkel de elektronen van het hoogste hoofdkwantum die bij ionisatie geioniseerd worden.
Als je het PSE bekijkt, merk je dat vooral de elementen met 4 of 9 elektronen in het d-niveau baat zullen hebben bij een inversie van een elektron. Als zij een elektron inverteren, zal het d-niveau immers voor de helft of volledig opgevuld zijn.
WEETJE
Deze elementen vertonen allemaal inversies: Cr, Cu, Mo, Pd, Ag, Gd, Au, Cm, Nb, Ru, Pt, Rh, La, Ac en Eu. De inversie van elektronen bij sommige van die elementen is moeilijk te verklaren.
Niet elk atoom zal altijd inverteren. Zo zal het koperion voorkomen als Cu+ (na inversie), maar ook als Cu2+ (zonder inversie).
Ook het feit dat het ijzerion bijvoorbeeld soms de lading 3+ draagt, kun je verklaren vanuit de zoektocht van het atoom naar een stabiele elektronenconfiguratie.
We schrijven de verkorte elektronenconfiguratie van ijzer:
26Fe: [18Ar] 4s2 3d6 of met de hokjesvoorstelling: [18Ar] 4s2 3d6
IJzer zal bij oxidatie dus eerst de 4s-elektronen kwijtraken. Daardoor ontstaat het Fe2+-ion met deze elektronenconfiguratie:
26Fe2+: [18Ar] 3d6 of met de hokjesvoorstelling: [18Ar] 3d6
Het ijzerion kan een stabielere toestand bereiken als het ook nog een 3d-elektron kwijt kan raken. Dan bekomt het ion immers alweer een elektronenconfiguratie met een half opgevuld orbitaal. Het Fe2+-ion kan daarom verder ‘roesten’ tot Fe3+:
26Fe3+: [18Ar] 3d5 of met de hokjesvoorstelling: [18Ar] 3d5
In hetzelfde atoom kunnen nooit 2 elektronen voorkomen met exact dezelfde waarden voor de 4 kwantumgetallen. Dat is het uitsluitingsprincipe van Pauli
De orbitalen worden in een welbepaalde volgorde opgevuld. Die volgorde wordt gegeven door de referentiediagonaal
Het opvullingsdiagram is geen energiediagram. Het geeft geen informatie over de energieniveaus na de opvulling, wel over die ervoor.
Je kunt het PSE opdelen in een s-blok, een p-blok, een d-blok en een f-blok.
Volgens de regel van Hund hebben de elektronen die zich in gelijksoortige orbitalen van hetzelfde energieniveau bevinden, zo veel mogelijk dezelfde spin.
Vaak schrijf je de bezetting van de laatste orbitalen in detail door middel van pijltjes in hokjes, die ook de spin van het elektron weergeven: de zogenoemde hokjesvoorstelling
Atomen (uit de a-groepen) vormen ionen om een stabielere toestand te bekomen met enkel volledig gevulde orbitalen
Atomen uit de b-groepen zullen vaak 2 s-elektronen afstaan, om zo een ionlading van 2+ te krijgen.
Een atoom uit de b-groepen kan ook een stabielere elektronenconfiguratie bekomen door een elektron te inverteren van een orbitaal met een hogere naar een orbitaal met een lagere energie-inhoud, als het daardoor een toestand bereikt waarbij alle orbitalen halfgevuld of volledig opgevuld zijn.
Sommige elementen ondergaan zelfs een dubbele inversie om een stabiele toestand te bekomen. Het heel dure metaal palladium zal op die manier overgaan van 46Pd: [36Kr] 5s2 4d8 naar de elektronenconfiguratie [36Kr] 4d10. Omdat de 5s-elektronen dan al weg zijn en het volledig gevulde 4d-orbitaal een heel stabiele toestand geeft, zal palladium nog moeilijk te oxideren zijn. Daarom gebruikt men het veel in de juwelenindustrie als vervanger voor goud en zilver. Door de schaarste is het metaal nu echter duurder dan goud.

Schrijf de elektronenconfiguratie met orbitalen voor deze elementen:
a chloor b fosfor
Schrijf de verkorte elektronenconfiguratie voor deze elementen:
a jood
b nikkel
c titanium
Los op.
a Noteer de inversie van molibdeen (42Mo).
b Verklaar waarom Mo die inversie ondergaat.
Schrijf de volledige elektronenconfiguratie met orbitalen van 56Ba.
Los op.
a Schrijf de verkorte elektronenconfiguratie met de hokjesvoorstelling voor goud.
b Welk ion zal goud vormen? Verklaar.
Verklaar waarom Fe zowel ionen met een lading van 2+ als ionen met een lading van 3+ vormt.
Gebruik daarvoor de elektronenconfiguratie met de hokjesvoorstelling.
Welk element heeft volledig gevulde d-orbitalen en p-orbitalen, en 9 elektronen in s-orbitalen?
Welke van de 3 onderstaande elektronenconfiguraties is correct?
Leg uit waarom de andere 2 niet mogelijk zijn.
Met andere woorden: geef aan welke regel er wordt overtreden.
px py pz
Wat is de juiste elektronenconfiguratie van de grondtoestand van het N-atoom?
1s2s2px 2py 2pz
Je ziet de elektronenconfiguratie van 4 elementen. Welke elektronenconfiguratie verwijst naar een element uit een b-groep (nevengroep, overgangselement) van de vierde periode?
a (Kr) 5s2 4d10 5p4
b (Ar) 3d5 4s2
c (Xe) 6s2 5d10 4f10
d (Ar) 4s2
Welk atoom heeft in de grondtoestand hetzelfde aantal ongepaarde elektronen als het stikstofatoom in de grondtoestand?
a Sr b V c S d Cu
Een onbekend element X heeft in de grondtoestand de volgende elektronenconfiguratie voor zijn buitenste elektronenschil:
(n)s(n – l)d (n)p
Tot welke groep van het PSE behoort dat element?
a groep 13 (IIIa)
b groep 15 (Va)
c groep 12 (IIb)
d groep 3 (IIIb)
Welke elektronenconfiguratie is niet mogelijk, noch voor een neutraal atoom in zijn grondtoestand, noch voor een ion in zijn grondtoestand?
a 1s2 2s2 2p3
b 1s2 2s2 2p6 3s2 3p6 3d3
c 1s2 2s2 2p6 3s2 3p6 3d10 4s1
d 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d5 5s2 5p6
Welk van de volgende ionen bezit uitsluitend volledig bezette subniveaus en heeft toch geen edelgasconfiguratie?
a Ca2+
b Fe3+
c Zn2+
d Sc3+
Hieronder zie je 5 elektronenconfiguraties. 1s2s2p3s3p
Welke elektronenconfiguraties zijn toegelaten grondtoestanden van een zuurstofatoom?
a enkel I
b I en V
c I, III en V
d alle 5 ` Meer oefenen? Ga naar .
Ook de afmetingen van atomen en ionen tonen een rechtstreeks verband met de elektronenverdeling over de orbitalen. We bekijken in dit hoofdstuk de afmetingen en zoeken verklaringen.
LEERDOELEN
L Het verband leggen tussen de afmetingen van atomen en ionen en hun elektronenconfiguratie
Op afbeelding 49 (afmetingen in pm) zie je dat de straal van elk cirkeltje evenredig getekend is met de grootte van het atoom of ion. Merk al meteen op dat er een duidelijk verschil is tussen de afmetingen van ionen en die van ongeladen atomen. Daar komen we straks op terug.
atoomstraal neemt af
atoomstraal neemt toe
49
Binnen 1 periode merk je dat de atoomstraal afneemt. Dat is makkelijk te verklaren aan de hand van coulombkrachten: de krachten die elektrische puntladingen op elkaar uitoefenen.
Tegengestelde ladingen, zoals elektronen en protonen, oefenen een aantrekkingskracht op elkaar uit.
Gelijke ladingen, zoals 2 elektronen of 2 protonen, oefenen een afstotingskracht op elkaar uit.
In de lessen fysica leer je de formule om de grootte van die coulombkracht te berekenen:
Daarbij geldt:
Q1 en Q2: puntladingen, beide uitgedrukt in coulomb (C)
F: de kracht die de ladingen op elkaar uitoefenen
r: de afstand tussen beide ladingen
Door het toenemende aantal protonen in de kern stijgt de coulombkracht. Die zorgt voor aantrekking van de elektronen, en dat zorgt dan weer voor meer elektrostatische aantrekking op de elektronen naar de kern toe. De orbitalen zitten allemaal op hetzelfde hoofdkwantum.
Een uitzondering zijn echter de edelgassen. De atoomstraal daarvan blijkt plots een stuk groter te zijn. Dat zou een gevolg kunnen zijn van alle orbitalen die perfect gevuld zijn en die dus de elektronen afschermen van de kern. De elektronen uit de meest energetische orbitalen worden dus minder onderhevig aan de elektrostatische aantrekking van de positief geladen kern, zodat het atoom plots een grotere afmeting krijgt.
Binnen 1 groep zie je ook dat de atoomstraal toeneemt van boven naar onderen. Dat is logisch te verklaren omdat er altijd weer een schil bijkomt, of een hoger energetisch orbitaal met een groter hoofdkwantumgetal.
Om de afmetingen van de ionen te verklaren, bekijken we even de afmetingen van positieve en negatieve ionen.
Uit afbeelding 49 blijkt:
• Positieve ionen zijn kleiner dan de overeenkomstige atomen van hetzelfde element (bijvoorbeeld Na+ versus Na).
Verklaring: Met minder elektronen is de aantrekking per elektron vanuit de positieve kernlading groter. Dezelfde elektrostatische kernkrachten (coulombkrachten) werken nu in op minder elektronen. Die worden dan ook harder naar de kern toe getrokken.
• Negatieve ionen zijn groter dan de overeenkomstige atomen van hetzelfde element (bijvoorbeeld Cl- versus Cl).
Verklaring: De ionen hebben e- opgenomen. Hun elektronenaantal neemt toe en door onderlinge afstoting of repulsie wordt de omtrek groter.
• Hoe negatiever het ion geladen is, hoe groter het is. Hoe positiever het ion, hoe kleiner.
Verklaring: Ook hier kun je de verhouding van elektronen/protonen en dus de aantrekkingskrachten op elk elektron inroepen als verklaring.
applet: ionstraal
VOORBEELD AFMETINGEN IONEN VERKLAREN
We verklaren de verschillen tussen het Na+- (95 pm), het Mg2+- (65 pm), het O2-- (140 pm) en het F--ion (136 pm). Al die ionen hebben exact dezelfde elektronenconfiguratie als neon. Toch zijn de afmetingen telkens anders.
Neon: [10Ne] 1s2 2s2 2p6
Fluoride-ion: [9F-] 1s2 2s2 2p6
Oxide-ion: [8O2-] 1s2 2s2 2p6
Natriumion: [11Na+] 1s2 2s2 2p6
Magnesiumion: [12Mg2+] 1s2 2s2 2p6
Neon bezit de edelgasconfiguratie.
Er werd een extra elektron opgenomen door het fluoratoom.
Het fluoride-ion bezit dezelfde edelgasconfiguratie.
Er werden 2 extra elektronen opgenomen door het zuurstofatoom.
Het oxide-ion bezit dezelfde edelgasconfiguratie.
Er werd een elektron afgestaan door het natriumatoom.
Het natriumion bezit dezelfde edelgasconfiguratie.
Er werden 2 elektronen afgestaan door het magnesiumatoom.
Het magnesiumion bezit dezelfde edelgasconfiguratie.
Hetzelfde stramien zie je bijvoorbeeld bij het sulfide-ion S2-, het chloride-ion Cl-, het argonatoom Ar, het kaliumion K+ en het calciumion Ca2+. Ook die hebben allemaal dezelfde elektronenconfiguratie, dus dezelfde orbitalen en opvulling daarvan, maar toch zie je ook daar weer andere afmetingen: S2- (184 pm), Cl- (181 pm), Ar (154 pm), K+ (133 pm) en Ca2+ (99 pm).
Wil je de vorming van ionen even herhalen? Ga aan de slag met de applet.
De afmetingen van atomen en ionen hebben een rechtstreeks verband met de elektronenconfiguratie en elektrostatische aantrekkingskrachten van de kern op de elektronen.
Rangschik de volgende atomen/ionen van klein naar groot, zonder de tabel met afmetingen te raadplegen. Geef telkens een verklaring voor je rangschikking.
a natrium, zwavel en kalium b chlooratoom en chloride-ion c magnesiumatoom en magnesiumion
` Meer oefenen? Ga naar
Met wat je net leerde over de verdeling van de elektronen over de orbitalen, kun je nog wat cijfers verklaren: de energie die nodig is om een atoom te ioniseren.
LEERDOELEN
L Het verband leggen tussen de elektronenconfiguratie met orbitalen en de ionisatie-energie
De ionisatie-energie IE is de hoeveelheid energie, uitgedrukt in kJ mol, die nodig is om een elektron weg te halen bij een atoom in de gasfase en er zo een positief ion van te maken.
Tabel 4 toont de ionisatie-energie IE per element.
We onderscheiden zo de 1e, de 2e, de 3e, de 4e en zelfs de 5e ionisatie-energie om respectievelijk een 1e, 2e, 3e, 4e of 5e elektron weg te halen bij een atoom.
6CIV 21s2 2s2 2p2 1 0902 3554 6226 224
7N V 21s2 2s2
0418 405 10 Ne0 21s2 2s2 2p6 2 0843 9666 1289 360 11 NaI 3[10Ne] 3s1 492 4 5646 9199 544
12MgII 3[10Ne] 3s2 733 1 4477 73010 520 13 AlIII 3[10Ne] 3s2 3p1 579 1 814 2 741 11 580 14SiIV 3[10Ne] 3s2 3p2 782 1 573 3 2334 352
15P V 3[10Ne] 3s2 3p3 1 0131 9012 9144 960
16S Va 3[10Ne] 3s2 3p4 1 0042 2583 3774 564
17 Cl VII 3[10Ne] 3s2 3p5 1 254 2 297 3 8505 163
18Ar0 3[10Ne] 3s2 3p6 1 5252 663 3 947 5 771
19K I 4[18Ar] 4s1 415 3 069 4 439 5 877
20 Ca II 4[18Ar] 4s2 589 1 148 4 941 6 465
Tabel 4 ionisatie-energie van de eerste 20 atomen in kJ mol
de tabel
VOORBEELD VERLOOP IONISATIE-ENERGIE
Beryllium (1s2 2s2) ioniseren tot Be+ kost 897 kJ mol aan energie:
Be → Be+ + 1 e-
Het kost nog meer energie om vervolgens een 2e elektron weg te halen: 1 756 kJ mol.
Be+ → Be2+ + 1 e-
Als je bij het Be2+-ion nog een 3e elektron wilt weghalen, is die energiekost plots heel hoog: 14 860 kJ mol.
Be2+ → Be3+ + 1 e-
Ook het 4e elektron weghalen bij een Be3+-ion kost nog extra energie: 21 040 kJ mol
Be3+ → Be4+ + 1 e-
IE2 is groter dan IE1, hoewel het in beide gevallen gaat om elektronen die in hetzelfde hoofdkwantum zitten en zelfs in hetzelfde s-orbitaal. De oorzaak is dat het 2e te ioniseren elektron harder aangetrokken wordt door het ion, dat nu al een positieve lading draagt. Je kunt dus stellen: een positief geladen ion laat moeilijker een 2e elektron los.
IE3 is nog groter. Je ziet dat de benodigde energiehoeveelheid om verder te ioniseren, nu plots veel hoger is. Dat is makkelijk te verklaren omdat dat 3e elektron zich in een lager hoofdkwantum bevindt en dus dichter bij de kern zit. Bovendien heeft het Be2+-ion nu de edelgasconfiguratie, wat zeer stabiel is.
Die wetmatigheden gelden ook voor alle andere elementen. Bovendien stellen we vast dat de ionisatie-energie plots veel groter wordt als de edelgasconfiguratie is bereikt. Zoals dat bij beryllium gebeurt bij IE3, is dat bij lithium al het geval bij IE2 en bij koolstof bij IE5.
Voor hetzelfde atoom neemt de ionisatie-energie toe als de lading van het ion groter wordt, en neemt die sterk toe zodra de edelgasconfiguratie is bereikt.
De ionisatie-energie IE1 van atomen binnen 1 periode van het periodiek systeem neemt toe van links naar rechts, omdat steeds meer protonen een aantrekkingskracht uitoefenen op de elektronen.
Opmerking:
Er zijn een paar uitzonderingen op het normale verloop van de ionisatie-energie. Zo hebben bijvoorbeeld B en O voor IE1 telkens een lagere waarde dan respectievelijk Be en N, die er vlak voor staan.
Dat valt makkelijk te verklaren: als die elementen 1 elektron kwijt zijn, bekomen zij al de stabielere toestand waarbij de orbitalen volledig gevuld zijn of halfvol zitten. De elementen in de gekleurde cellen van tabel 4 tonen allemaal een lagere IE1-waarde dan verwacht.
Naast het begrip ionisatie-energie zou je ook de elektronenaffiniteit EA kunnen gebruiken om tot dezelfde besluiten te komen. De elektronenaffiniteit kun je definiëren als de energie die vrijkomt bij de opname van een elektron door een gasvormig atoom om er een negatief geladen ion van te maken. De voornoemde tendensen in tabel 4 zullen dan net omgekeerd evolueren, maar de verklaringen zijn hetzelfde.
Voor hetzelfde atoom neemt de ionisatie-energie toe als de lading van het ion groter wordt, en neemt die sterk toe zodra de edelgasconfiguratie is bereikt.
De ionisatie-energie IE1 van atomen binnen 1 periode van het periodiek systeem neemt toe van links naar rechts, omdat steeds meer protonen een aantrekkingskracht uitoefenen op de elektronen.
De elektronenaffiniteit EA kun je definiëren als de energie die vrijkomt bij de opname van een elektron door een gasvormig atoom om er een negatief geladen ion van te maken.
Verklaar:
a IE1 voor zuurstof < IE1 voor stikstof
b IE3 voor magnesium is abnormaal hoog.
c IE1 voor kalium < IE1 voor natrium
d IE2 > IE1 voor elk atoom
` Meer oefenen? Ga naar .
Hoofdstuk 1: Op weg naar een nieuw atoommodel
hoofdkwantums De elektronen rond een nucleus bevinden zich op schillen, die overeenkomen met energieniveaus of hoofdkwantums. Hoe verder een schil zich van de kern bevindt, hoe hoger de energie-inhoud.
duale karakter van het elektron
Q (n = 7)
P (n = 6)
O (n = 5)
N (n = 4)
M (n = 3)
L (n = 2)
K (n = 1)
kern
aangeslagen toestand
grondtoestand kwanta
Energie plant zich voor als een golfbeweging. De frequentie van die golf is evenredig met de energie-inhoud van de golf.
Een elektron gedraagt zich net als een golf.
Een elektron heeft echter ook een massa, hoewel we die vroeger verwaarloosden. Het elektron is dus zowel een energiedeeltje als een massadeeltje.
Als je een atoom opwarmt, komen de elektronen op een hoger niveau te liggen.
Opgewarmde atomen kunnen die energie opnieuw afstaan in welbepaalde hoeveelheden (kwanta), waardoor ze naar hun oorspronkelijke positie terugkeren.
De energie-inhoud van een elektron neemt niet eender welke waarde aan, maar enkel bepaalde waarden van hoeveelheden ondeelbare energie.
Hoofdstuk 2: De kwantumgetallen
orbitaal
hoofdkwantumgetal n
nevenkwantumgetal l
magnetisch kwantumgetal ml
Een beschrijving van de ruimte waarin een elektron zich 90 % van de tijd bevindt.
• 1 tot en met 7
• Geeft het hoofdenergieniveau aan (= het vroegere schilnummer in het model van Bohr-Rutherford).
• 0 tot en met n – 1, maximaal 3
• Geeft aan in welk soort orbitaal een elektron zich bevindt.
• –l tot en met +l
• Een subniveau van het nevenkwantum, dat de ruimtelijke oriëntatie van het orbitaal aangeeft.
Hoofdstuk 2: De kwantumgetallen (vervolg)
spinkwantumgetal ms
• –1 2 of + 1 2
• Geeft de spin van het elektron om zijn eigen as weer.
Hoofdstuk 3: De elektronenconfiguratie met orbitalen
uitsluitingsprincipe van Pauli
In hetzelfde atoom kunnen nooit 2 elektronen voorkomen met exact dezelfde waarden voor de 4 kwantumgetallen.
referentiediagonaal De orbitalen worden in een welbepaalde volgorde opgevuld. Die volgorde wordt gegeven door de referentiediagonaal.
regel van Hund Elektronen die zich in gelijksoortige orbitalen van hetzelfde energieniveau bevinden, hebben zo veel mogelijk dezelfde spin.
hokjesvoorstelling Een weergave van de bezetting van de laatste orbitalen door middel van pijltjes in hokjes, die ook de spin van het elektron tonen.
inversie van elektronen
Atomen (uit de a-groepen) vormen ionen om een stabielere toestand te bekomen met enkel volledig gevulde orbitalen. Atomen uit de b-groepen zullen vaak 2 s-elektronen afstaan, om zo een ionlading van 2+ te krijgen.
Een atoom uit de b-groepen kan ook een stabielere configuratie bekomen door een elektron te inverteren van een orbitaal met een hogere naar een orbitaal met een lagere energie-inhoud, als het daardoor een toestand bereikt waarbij alle orbitalen halfgevuld of volledig opgevuld zijn.
Hoofdstuk 4: De afmetingen van atomen en ionen
afmetingen van atomen
De afmetingen van een atoom worden bepaald door de coulombkrachten tussen elektronen en protonen. Tegengestelde ladingen, zoals elektronen en protonen, oefenen een aantrekkingskracht op elkaar uit. Gelijke ladingen, zoals 2 elektronen of 2 protonen, oefenen een afstotingskracht op elkaar uit.
De atoomstraal van edelgassen blijkt plots een stuk groter te zijn door de afscherming van de buitenste schil elektronen.
afmetingen van ionenPositieve ionen zijn kleiner dan de overeenkomstige atomen van hetzelfde element. Negatieve ionen zijn groter dan de overeenkomstige atomen van hetzelfde element. Hoe negatiever het ion geladen is , hoe groter het is.
Hoe positiever het ion, hoe kleiner.
Hoofdstuk 5: Ionisatie-energie
ionisatie-energie
De hoeveelheid energie, uitgedrukt in kJ mol, die nodig is om een elektron weg te halen bij een atoom in de gasfase en er zo een positief ion van te maken.
grootteorde IE De ionisatie-energie zal klein zijn als het atoom een stabielere toestand bereikt door een elektron af te staan.
De ionisatie-energie neemt toe naarmate de positieve lading van het ion groter is: IE1 < IE2 < IE3 < …
De ionisatie-energie neemt plots toe als het ion al de edelgasconfiguratie had bereikt, of een stabielere toestand met volledig opgevulde of halfvolle orbitalen.
elektronenaffiniteit
De energie die vrijkomt bij de opname van een elektron door een gasvormig atoom om er een negatief geladen ion van te maken.
In thema 02 bestudeerde je de bouw en de eigenschappen van atomen. In de natuur zijn monoatomische stoffen zeldzaam: enkel de edelgassen komen in die vorm voor. De edelgassen bezitten immers de stabiele edelgasconfiguratie. De meeste stoffen zijn verbindingen van 2 of meerdere atomen die tot dezelfde of verschillende elementen behoren. De atomen binden met elkaar omdat ze streven naar de edelgasconfiguratie door elektronen over te dragen naar elkaar of gemeenschappelijk te stellen.
In dit thema gaan we dieper in op de manier waarop de atomen aan elkaar gebonden zijn (de binding), en meer specifiek op de atoombinding.

` Waarom vormen atomen verbindingen?
` Zijn alle atoombindingen gelijk aan elkaar?
` Heeft de vorming van een molecule een invloed op de plaats waar we een elektron aantreffen?
` Kunnen we de ruimtelijke bouw van een molecule voorspellen?
We zoeken het uit!
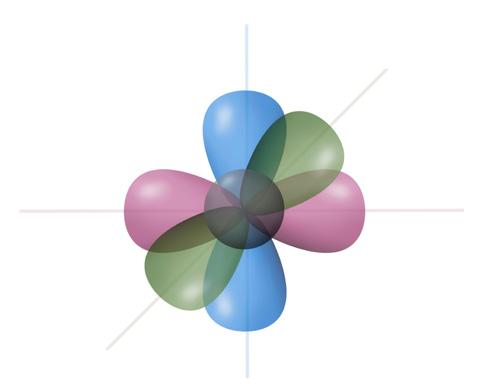
• toelichten wat atoomorbitalen zijn.
metaal nietmetaal = ionbinding + nietmetaal nietmetaal = atoombinding + metaal metaal = metaalbinding +
JE LEERT NU ...
109° 28’
• molecuulorbitalen beschrijven.
• de verschillende soorten bindingen herkennen.
ΔE = bindingsenergie afstoting
aantrekking
stabiele toestand afstand tussen de kernen (pm) r bindingslengte r
• toelichten waarom atomen een binding aangaan en wat de afstand tussen de atoomkernen in een binding bepaalt.
• de structuurformules van eenvoudige moleculen opstellen.
• toelichten dat alkenen 1 dubbele binding bevatten tussen 2 koolstofatomen.
• toelichten dat een lewisstructuur een tweedimensionale weergave van de structuur van een molecule is.
• de structuurformules van complexere moleculen opstellen.
• uitleggen dat een meervoudige binding uit verschillende soorten atoombindingen bestaat.
• toelichten hoe je de ruimtelijke bouw van een molecule kunt bepalen op basis van de structuurformule.
HOOFDSTUK 1
In de voorbije schooljaren kwamen al verschillende soorten bindingen aan bod. In dit hoofdstuk herhaal je kort de 3 soorten bindingen. Je leert ook wat het verband is tussen de energie van een binding en de vorming van een binding, en welke factoren de afstand tussen 2 atomen in een molecule bepalen.
LEERDOELEN
L De vorming van een covalente binding verklaren
L Het verband tussen bindingsenergie en bindingslengte uitleggen
1 Waarom vormen atomen verbindingen?
In de natuur streven deeltjes altijd naar een zo stabiel mogelijke toestand. Dat is de toestand met een zo laag mogelijke energie-inhoud. Atomen zullen dus spontaan met elkaar binden als de energie-inhoud van de verbinding lager is dan de som van de energie-inhouden van de atomen in niet-gebonden toestand. Omdat de edelgasconfiguratie energetisch een heel gunstige toestand is, streven atomen die configuratie na.
Zo zullen 2 waterstofatomen met elkaar reageren tot waterstofgas, omdat de energie-inhoud van een molecule H2 kleiner is dan die van de afzonderlijke waterstofatomen. Wanneer 1 mol waterstofgas wordt gevormd, komt er 436 kJ aan energie vrij.
Afb 50 Het energiediagram van het reactieverloop van de vorming van H2 uit 2 losse H-atomen. 2 waterstofatomen reageren tot H2 omdat de energie-inhoud van een molecule H2 lager is dan de som van de energie-inhouden van 2 afzonderlijke waterstofatomen.
De exacte hoeveelheid energie die vrijkomt bij de vorming van een binding, hangt af van welke atomen met elkaar binden. Dat zal ook de hoeveelheid energie zijn die nodig is om de bindingen te verbreken. De energie die nodig is om een binding te verbreken, noem je de bindingsenergie Dat is een maat voor de sterkte van de binding: hoe meer energie er nodig is om de binding te verbreken, hoe sterker de binding is. Zo zal er 436 kJ aan energie nodig zijn om 1 mol H2 te verbreken tot afzonderlijke atomen.
Afb 51 De bindingsenergie is de energie die je nodig hebt om 1 mol bindingen te verbreken tot losse atomen.
Atomen vormen bindingen omdat ze streven naar een zo laag mogelijke energie-inhoud De bindingsenergie is een maat voor de sterkte van de binding.
Atomen kunnen de stabiele edelgasconfiguratie bereiken door atoombindingen, ionbindingen of metaalbindingen te vormen. Het soort binding dat ontstaat, hangt af van de aard van de bindingspartners.
• Een ionbinding ontstaat wanneer metaalatomen reageren met niet-metaalatomen. De elektronegatieve elementen (niet-metalen) trekken zo hard aan de valentie-elektronen van de elektropositieve elementen (metalen) dat de metalen elektronen afstaan aan de niet-metalen. Zo ontstaan er negatieve niet-metaalionen en positieve metaalionen. Door de elektrostatische aantrekking tussen de positieve en negatieve ionen ontstaat er een ionbinding en rangschikken de ionen zich in een rooster molecule
Ga naar en bekijk het vademecum: soorten bindingen.
Afb. 52 De vorming van een ionbinding tussen calcium en chloor. Calcium staat de 2 elektronen van zijn buitenste schil af aan 2 chlooratomen. Daardoor ontstaan er een positief calciumion (lading van 2+) en 2 negatieve chloride-ionen (lading van 1–), die allebei de edelgasconfiguratie hebben.
• Een metaalbinding ontstaat tussen elementen die behoren tot de metalen. Metalen hebben weinig elektronen op de buitenste schil. Doordat metalen elektropositief zijn, is een overdracht van elektronen waardoor positieve en negatieve ionen ontstaan, energetisch heel ongunstig. Omdat de valentie-elektronen slechts zwak gebonden zijn, komen ze gemakkelijk vrij. Zo ontstaan er positieve ionen met daartussen een zee van elektronen die zich tussen de metaalionen bewegen. De elektronen vormen kortstondig elektronenparen, die uiteenvallen en nieuwe elektronenparen vormen. Die binding noem je een metaalbinding.
positieve metaalionen vrij bewegende elektronen die tot geen enkel metaalion behoren
Afb 53 Een metaalrooster is opgebouwd uit positieve metaalionen en een zee van vrij bewegende elektronen.
• Atoombindingen of covalente bindingen worden gevormd tussen 2 niet-metalen. Niet-metalen zijn elektronegatief en willen de edelgasconfiguratie bereiken door elektronen op te nemen. Wanneer 2 elektronegatieve elementen (niet-metalen) geen elektronen van elkaar kunnen wegtrekken zodat er ionen ontstaan, kunnen ze de edelgasconfiguratie bereiken door elektronen gemeenschappelijk te stellen.
1s1 1s1
1s2 atoombinding ↓
Afb 54 De vorming van een molecule H2: een atoombinding ontstaat doordat 2 H-atomen een elektronenpaar gemeenschappelijk stellen.
In de rest van dit thema bespreken we vooral atoombindingen of moleculen. De verschillende atomen zijn er met elkaar verbonden door gemeenschappelijke elektronenparen.
Atomen vormen bindingen omdat ze streven naar de edelgasconfiguratie. De aard van de bindingspartners bepaalt het type binding:
• Een ionbinding ontstaat na de overdracht van elektronen van metalen naar niet-metalen.
• Een metaalbinding ontstaat tussen metaalatomen die elektronen afstaan.
• Een atoombinding ontstaat als 2 niet-metaalatomen elektronen gemeenschappelijk stellen.
In realiteit bestaat er een continuüm tussen ideale, zuivere atoombindingen (ΔEN = 0) en ideale ionbindingen (ΔEN = 3,3). In een ideale atoombinding trekken beide partners even hard aan het gemeenschappelijk elektronenpaar. Het gaat dan om een apolaire binding. Naarmate ΔEN groter wordt, verschuift het gemeenschappelijk elektronenpaar steeds meer in de richting van het meest elektronegatieve element. Zodra ΔEN ≥ 0,5, zeg je dat de atoombinding polair is. De covalente binding krijgt een gedeeltelijk ionkarakter.
Bij ΔEN = 1,7 heeft de binding eigenschappen van zowel een ionbinding als een atoombinding. Bij ΔEN > 1,7 overheerst de ionbinding, maar is er nog een covalent karakter aanwezig. Pas als ΔEN = 3,3 spreek je van een ideale ionbinding. Een duidelijk afgebakende scheiding tussen een atoombinding en een ionbinding is er niet.
% ionkarakterbindingstype
apolaire covalente binding polaire covalente binding
overwegend ionbinding
ideale covalente binding
voorbeeldelektroneninteractie
vorming van gemeenschappelijk doublet door herschikking van elektronen
vorming van een positief en negatief ion door overdracht van elektronen
ideale ionbinding
De afstand tussen 2 atoomkernen in een molecule noem je de bindingslengte. De bindingslengte wordt bepaald door de energie-inhoud. Het is de afstand tussen de atoomkernen waarbij de potentiële energie van de binding zo laag mogelijk is (zie nummer 3 op afbeelding 56):
• Als 2 atomen niet met elkaar gebonden zijn en zich op een grote afstand van elkaar bevinden, is er geen wisselwerking tussen de atomen. Je stelt hun potentiële energie-inhoud arbitrair gelijk aan 0 (zie nummer 1 op afbeelding 56).
• Als beide atomen elkaar naderen, ontstaan er aantrekkingskrachten tussen de atoomkern van het ene atoom en de elektronen van het andere atoom. Daardoor daalt de potentiële energie-inhoud van beide atomen (zie nummer 2 op afbeelding 56).
• Vanaf een bepaalde afstand neemt de elektrostatische afstoting tussen de positieve kernen toe, waardoor de energie-inhoud heel snel stijgt. Omdat systemen streven naar een zo laag mogelijke energie-inhoud, bewegen de kernen zich weer uit elkaar, waardoor de energieinhoud daalt (zie nummer 4 op afbeelding 56).
energie vrijgesteld bij vorming van binding (– bindingsenergie)
energie die opgenomen wordt wanneer binding wordt verbroken (bindingsenergie)
afstand tussen de kernen (in pm)
Afb. 56 De bindingslengte wordt bepaald door de energie-inhoud. De atoomkernen nemen plaats op de afstand waar de potentiële energie het laagst is. Voor waterstofgas is dat 74 pm.
De bindingslengte zal kleiner zijn dan de som van de afzonderlijke atoomstralen en hangt af van:
• de grootte van de bindingspartners;
• de sterkte van de atoombinding.
350 pm
2 · atoomstraal = 2 · 175 pm
Cl Cl
bindingslengte = 200 pm
Afb 57 De bindingslengte is kleiner dan de som van de atoomstralen. De atoomstraal van chloor is 175 pm. De afstand tussen de 2 kernen in een molecule Cl2 bedraagt 200 pm.
VOORBEELD BINDINGSLENGTE EN BINDINGSENERGIE VAN ENKELE ATOOMBINDINGEN
De bindingslengte en -energie hangen af van de bindingspartners. Als er meervoudige bindingen ontstaan tussen atomen, stijgt de bindingsenergie en daalt de bindingslengte.
BINDING
Als er meervoudige bindingen worden gevormd tussen 2 atomen, daalt de energie-inhoud nog verder: de bindingslengte wordt kleiner dan bij een enkelvoudige binding. Later zul je zien dat een 2e of 3e binding tussen 2 atomen reactiever is dan de 1e binding.
De bindingslengte is de afstand tussen 2 atoomkernen en wordt bepaald door de energie-inhoud. Ze hangt af van de grootte van de atomen en de sterkte van de binding.
Welke verbinding bevat alleen atoombindingen (covalente bindingen) tussen de atomen?
a NaNO3
b H2SO3
c CaCO3
d NaHPO4
Gegeven: de bindingslengte van Cl2 en HCl.
Wat is de bindingslengte in de molecule H2?
Rangschik de volgende bindingen volgens stijgende bindingslengte: C-Cl, C-P en C-S.
Je mag enkel een periodiek systeem gebruiken.
Rangschik de volgende bindingen volgens stijgende bindingsenergie: C-Cl, C-P en C-S.
Je mag enkel een periodiek systeem gebruiken.
Gegeven is de volgende molecule, waarbij
X = F, Cl, Br, I.
a 100 pm
b 27,5 pm
c 72,0 pm
d 55,0 pm
e 63,5 pm
Welke molecule heeft de kortste binding tussen 2 koolstofatomen?
a
a Welke binding heeft de kortste bindingslengte?
Leg uit waarom.
1 C-F
2 C-I
3 C-Br
4 C-Cl
b Welke binding heeft de grootste bindingsenergie?
Leg uit waarom.
1 C-F
2 C-I
3 C-Br
4 C-Cl
Rangschik N2, As2 en P2 volgens stijgende bindingsenergie.
c
Beoordeel de volgende stellingen en licht kort toe.
a De bindingen in NH3 zijn korter dan die in NF3
b De bindingen in CBr4 zijn sterker dan die in CCl4
In welke molecule is de bindingslengte het kleinst: in F2, N2 of O2?
Gegeven zijn de lewisstructuren van methaanamine en acetonitril. In een van de verbindingen is de bindingslengte tussen C en N 116 pm en in de andere verbinding 147 pm. Leg uit in welke molecule de C-N-binding 116 pm is en in welke molecule 147 pm.
` Meer oefenen? Ga naar .
In de chemie is het belangrijk om lewisstructuren of structuurformules correct te noteren, omdat ze inzicht geven in bepaalde chemische eigenschappen van moleculen, zoals de polariteit en het kookpunt. Ze worden ook vaak gebruikt om reactiemechanismen voor te stellen of de reactiviteit van een molecule te bepalen. Hoewel een lewisstructuur geen werkelijke weergave is van de ruimtelijke structuur van een molecule, kun je er de ruimtelijke structuur wel uit afleiden.
LEERDOELEN
L Structuurformules van organische en anorganische moleculen opstellen
L Formele ladingen aanbrengen in een lewisstructuur
L Verschillende soorten bindingen herkennen
1 Soor ten bindingen
Vorig jaar leerde je al dat je lewisstructuren gebruikt om moleculen voor te stellen. In tegenstelling tot een brutoformule geeft de lewisstructuur weer welke atomen aan elkaar gebonden zijn in de molecule. In de lewisstructuur teken je bij alle atomen alle valentie-elektronen, zowel de vrije elektronenparen (vrije doubletten) als de bindende elektronenparen die de atoombindingen vormen. Naargelang het aantal atoombindingen tussen 2 atomen onderscheid je enkelvoudige bindingen, dubbele bindingen en drievoudige bindingen
Op basis van de herkomst van de elektronen van het gemeenschappelijk elektronenpaar onderscheid je een normale atoombinding en een datieve binding
2 atomen in een molecule zijn soms met elkaar gebonden door 1 gemeenschappelijk elektronenpaar. Een dergelijke atoombinding is een enkelvoudige atoombinding
In een structuurformule wordt die binding voorgesteld als een streepje tussen 2 atomen. Zo zag je vorig jaar dat in de stofklasse van de alkanen alle koolstofatomen verbonden zijn met 4 andere atomen door een enkelvoudige binding.
VOORBEELDEN ENKELVOUDIGE BINDINGEN
• Dichloor Cl2
• Diwaterstofoxide H2O
• Ethaan C2H6
Doordat er elektronen gemeenschappelijk worden gesteld, ontstaan er enkelvoudige atoombindingen tussen de 2 chlooratomen in Cl2, tussen het waterstofatoom en het zuurstofatoom in H2O en tussen de waterstofatomen en koolstofatomen en de koolstofatomen onderling in ethaan.
1.2 Dubbele binding
2 atomen in een molecule bereiken soms pas de edelgasconfiguratie als ze elk 2 elektronen gemeenschappelijk stellen, waardoor de atomen met elkaar verbonden zijn door 2 gemeenschappelijke elektronenparen. Een dergelijke binding noem je een dubbele binding Vorig jaar zag je dat in de stofklasse van de alkenen 2 koolstofatomen met elkaar verbonden zijn door een tweevoudige binding.
VOORBEELDEN DUBBELE BINDINGEN
• Zuurstofgas O2
• Koolstofdioxide CO2
• Etheen C2H4
In sommige moleculen vormen atomen een dubbele binding om de edelgasconfiguratie te bereiken.
1.3 Drievoudige binding
2 atomen kunnen ook 3 elektronenparen gemeenschappelijk stellen. Een dergelijke binding noem je een drievoudige binding
VOORBEELDEN DRIEVOUDIGE BINDING
• Stikstofgas N2
• Waterstofcyanide HCN
• Ethyn C2H2
In bepaalde moleculen bevindt er zich tussen 2 atomen een drievoudige binding. Die ontstaat als er tussen 2 atomen 3 gemeenschappelijke elektronenparen worden gevormd.
2 atomen in een molecule kunnen gebonden zijn door 1, 2 of 3 gemeenschappelijke elektronenparen. Je stelt ze in de lewisstructuur voor door een enkelvoudige binding, een dubbele binding of een drievoudige binding.
1.4
Een atoombinding bestaat soms uit 2 elektronen die gemeenschappelijk worden gesteld door hetzelfde atoom. Een dergelijke atoombinding noem je een datieve binding of een donoracceptorbinding. Ze wordt soms voorgesteld door een pijltje van de donor naar de acceptor. Een donor-acceptorbinding is even lang en even sterk als een gewone atoombinding en heeft dezelfde eigenschappen.
In de molecule HClO2 vormt 1 zuurstofatoom met enerzijds H en anderzijds Cl telkens een atoombinding door een ongepaard valentie-elektron gemeenschappelijk te stellen met een ongepaard valentie-elektron van H en Cl. Het chlooratoom kan geen gewone atoombinding meer vormen met het 2e zuurstofatoom, omdat het maar 1 ongepaard valentie-elektron heeft. Bij dat 2e zuurstofatoom zullen beide ongepaarde elektronen een niet-bindend elektronenpaar vormen. De atoombinding ontstaat doordat chloor een elektronenpaar gemeenschappelijk stelt tussen het Cl- en het O-atoom.
Afb. 58 Chloor beschikt over maar 1 ongepaard elektron. Het vormt een atoombinding met een 2e zuurstofatoom door een elektronenpaar gemeenschappelijk (rood) te stellen, nadat de 2 ongepaarde valentie-elektronen van zuurstof (blauw) zelf een elektronenpaar hebben gevormd.
Op basis van de herkomst van het gemeenschappelijk paar onderscheid je een normale atoombinding (het gemeenschappelijk elektronenpaar bestaat uit een elektron afkomstig van elk van de bindingspartners) en een datieve of donor-acceptorbinding (het gemeenschappelijk elektronenpaar is afkomstig van maar 1 van de bindingspartners, de donor).
De lewisstructuur geeft niet de werkelijke structuur van moleculen weer, maar is een vlakke projectie van de structuur waaruit je de ruimtelijke structuur wel kunt afleiden. Ze levert ook inzicht in andere eigenschappen van moleculen. Het is daarom heel belangrijk dat je lewisstructuren correct kunt opstellen.
Met het volgende stappenplan kun je vlot een lewisstructuur opstellen:
1
Bereken het aantal te plaatsen elektronenparen (PVE).
→ Neem daarvoor de som van de valentie-elektronen van alle atomen van de molecule of het polyatomisch ion. Vermeerder dat aantal met het aantal negatieve ladingen bij een negatief polyatomisch ion of verminder het met het aantal positieve ladingen bij een positief polyatomisch ion.
→ Het aantal te plaatsen elektronenparen (PVE) bepaal je door de som te delen door 2.
STAP 2
Bereken het aantal elektronenparen dat nodig is om elk atoom de edelgasconfiguratie te bezorgen (EP).
STAP 3
Bepaal het aantal atoombindingen (EP – PVE).
→ Omdat er minder elektronenparen aanwezig zijn dan nodig voor de edelgasconfiguratie, moet je sommige elektronenparen dubbel tellen. Die paren vormen de atoombindingen (EP – PVE).
STAP 4
Teken de structuur zo symmetrisch mogelijk en voeg de atoombindingen toe.
→ Bij ternaire zuren bevinden de zuurstofatomen zich rond het centrale atoom (het niet-metaal).
→ Waterstofatomen plaats je eindstandig (bij ternaire zuren dus op de zuurstofatomen).
→ Maak geen ringstructuren, tenzij je dat afleidt uit de naamgeving of je leerkracht dat vraagt.
→ Verbind gelijke elementen niet met elkaar, tenzij in enkelvoudige stoffen of in de koolstofchemie.
STAP 5
Voeg de vrije elektronenparen toe, zodat elk element de edelgasconfiguratie bereikt.
→ Het aantal vrije elektronenparen is gelijk aan het aantal elektronenparen (PVE) min het aantal atoombindingen.
→ Controle: het totale aantal geplaatste elektronenparen moet na deze stap gelijk zijn aan het aantal dat je berekende in stap 1 (PVE).
STAP 6
Voeg formele ladingen toe.
→ Als het aantal elektronen rond een atoom in een lewisstructuur niet gelijk is aan het aantal valentie-elektronen in ongebonden toestand, dan krijgt het atoom een formele lading. Vrije elektronen reken je altijd tot het atoom waarbij ze staan. Van een bindend elektronenpaar ken je 1 elektron toe aan elke bindingspartner. Een negatieve formele lading ontstaat als het aantal omringende elektronen groter is dan in ongebonden toestand, een positieve formele lading als het aantal omringende elektronen kleiner is dan in ongebonden toestand.
PVE en EP zijn geen officiële afkortingen. Het zijn afkortingen voor ‘paren valentieelektronen’ en ‘elektronenparen voor de edelgasconfiguratie’.
De som van alle formele ladingen moet gelijk zijn aan de lading van het deeltje.
VOORBEELDEN LEWISSTRUCTUUR OPSTELLEN
• Teken de lewisstructuur van H2SO4
STAP 1
Bereken het aantal te plaatsen elektronenparen (PVE).
STAP 2
Bereken het aantal elektronenparen dat nodig is om elk atoom de edelgasconfiguratie te bezorgen (EP).
Som van de valentie-elektronen:
2 ∙ 1 + 1 ∙ 6 + 4 ∙ 6 = 32
Aantal te plaatsen streepjes: PVE = 32 2 = 16
H: 2 elektronen
STAP 3
Bepaal het aantal atoombindingen (EP – PVE).
STAP 4
Teken de structuur zo symmetrisch mogelijk en voeg de atoombindingen toe.
STAP 5
Voeg de vrije elektronenparen toe, zodat elk element de edelgasconfiguratie bereikt.
S: 8 elektronen
O: 8 elektronen
Som van het aantal elektronen nodig voor de edelgasconfiguratie: 2 ∙ 2 + 1 ∙ 6 + 4 ∙ 6 = 44
Aantal elektronenparen nodig voor de edelgasconfiguratie: EP = 44 2 = 22
22 – 16 = 6
Controle: je plaatste in totaal 16 elektronenparen of streepjes. Dat is het aantal dat je berekende in stap 1 (PVE).
Voeg formele ladingen toe.
• Teken de lewisstructuur van PO43-.
STAP 1
Bereken het aantal te plaatsen elektronenparen (PVE).
• Zuurstof heeft in ongebonden toestand 6 valentie-elektronen. De zuurstofatomen die niet gebonden zijn aan waterstof, hebben in hun onmiddellijke omgeving 7 elektronen: 3 vrije elektronenparen en 1 elektron van de atoombinding. Die zuurstofatomen hebben 1 elektron meer dan in ongebonden toestand en krijgen daarom een negatieve formele lading.
• Zwavel heeft in ongebonden toestand 6 valentieelektronen. In de lewisstructuur staan in de onmiddellijke omgeving van zwavel maar 4 elektronen: van elke atoombinding wordt maar 1 elektron bij zwavel gerekend. Zwavel krijgt daarom een positieve formele lading met grootte 2+.
STAP 2
Bereken het aantal elektronenparen dat nodig is om elk atoom de edelgasconfiguratie te bezorgen (EP).
Som van de valentie-elektronen: 1 ∙ 5 + 4 ∙ 6 = 29
Omdat dit polyatomisch ion een lading van 3+ draagt, vermeerder je dat aantal met 3.
Aantal te plaatsen streepjes: PVE = 29 + 3 2 = 32 2 = 16
P: 8 elektronen
O: 8 elektronen
Som van het aantal elektronen nodig voor de edelgasconfiguratie: 1 ∙ 8 + 4 ∙ 8 = 40
Aantal elektronenparen nodig voor de edelgasconfiguratie: EP = 40 2 = 20
STAP 3
Bepaal het aantal atoombindingen (EP – PVE).
STAP 4
Teken de structuur zo symmetrisch mogelijk en voeg de atoombindingen toe.
20 – 16 = 4
5
Voeg de vrije elektronenparen toe, zodat elk element de edelgasconfiguratie bereikt.
STAP 6
Voeg formele ladingen toe.
• In de lewisstructuur zijn rond elk zuurstofatoom 7 elektronen getekend, terwijl zuurstof in ongebonden toestand 6 valentie-elektronen heeft.
→ Elk zuurstofatoom krijgt een formele lading van 1–.
• In de lewisstructuur zijn rond fosfor 4 elektronen getekend, terwijl fosfor in ongebonden toestand 5 valentie-elektronen heeft.
→ Het fosforatoom krijgt een formele lading van 1+.
Het is belangrijk om lewisstructuren correct op te stellen, omdat je er eigenschappen van de molecule uit kunt afleiden. Een lewisstructuur teken je door het volgende stappenplan te volgen:
Stap 1: Bereken het aantal te plaatsen elektronenparen (PVE).
Stap 2: Bereken het aantal elektronenparen dat nodig is om elk atoom de edelgasconfiguratie te bezorgen (EP).
Stap 3: Bepaal het aantal atoombindingen (EP – PVE).
Stap 4: Teken de structuur zo symmetrisch mogelijk en voeg de atoombindingen toe.
Stap 5: Voeg de vrije elektronenparen toe, zodat elk element de edelgasconfiguratie bereikt.
Stap 6: Voeg formele ladingen toe.
Een model is een hulpmiddel, niet bindend Wanneer je op het internet op zoek gaat naar de lewisstructuur van bijvoorbeeld fosforzuur en zwavelzuur, zie je vaak lewisstructuren waarbij rond het centrale atoom 5 (bij P) of 6 (bij S) atoombindingen zijn getekend:
Dat komt doordat bij elementen met 3 of meer schillen een elektron uit het s-subniveau verplaatst kan worden naar het d-niveau van dezelfde schil. Zo ontstaan bij die elementen 5 of 6 ongepaarde valentie-elektronen en kunnen die elementen meer dan 4 atoombindingen vormen.
Die elementen volgen de edelgasconfiguratie of octetstructuur dan niet. Dat verklaart meteen ook het bestaan van stoffen zoals fosforpentachloride (PCl5) en zwavelhexafluoride (SF6). In elk van die stoffen is het centrale atoom omringd door meer dan 4 atomen.
Als we in dit leerboek lewisstructuren opstellen, gaan we ervan uit dat de elementen streven naar de edelgasconfiguratie. VERDIEPING
Soms kun je van een molecule meerdere lewisstructuren opstellen, waarbij de atomen op dezelfde plaats staan, maar enkel de plaatsing van de elektronenparen verschillend is. Je spreekt dan van mesomerie of resonantie. Elk van de lewisstructuren noem je een grensstructuur. De elektronenparen die verplaatst worden om van de ene grensstructuur de andere te bekomen, noem je gedelokaliseerde elektronen. Wanneer er mesomerie optreedt, teken je een dubbelpuntige pijl tussen de verschillende grensstructuren.
De werkelijke elektronenverdeling ligt tussen die van de grensstructuren in en wordt voorgesteld met een resonantiehybride. De resonantiehybride bekom je door in de lewisstructuur alle bindingen en vrije elektronenparen te tekenen die in elk van de grensstructuren aanwezig zijn.
Op de plaats waar in bepaalde grensstructuren een dubbele of drievoudige binding aanwezig is, teken je die binding met een stippellijn. Je tekent de resonantiehybride tussen vierkante haken. Een eventuele lading van het polyatomisch ion voeg je buiten de haken toe.
Mesomerie heeft een sterk stabiliserende invloed op de molecule.
WEETJE
Niet alle grensstructuren dragen in gelijke mate bij tot de resonantiehybride. Als niet alle grensstructuren evenveel formele ladingen hebben, dragen enkel de grensstructuren met het kleinste aantal formele ladingen bij tot de resonantiehybride. Ook structuren met gelijksoortige ladingen op naburige atomen of met positieve ladingen op sterk elektronegatieve elementen worden niet gebruikt om de resonantiehybride te bepalen.
VOORBEELDEN MESOMERIE
• Ozon O3
Voor de molecule O3 kun je 2 verschillende grensstructuren opstellen door 2 elektronenparen te verplaatsen.
Volgens elk van die lewisstructuren zijn er 2 verschillende types O-O-bindingen aanwezig (een enkelvoudige en een dubbele atoombinding). Metingen wijzen echter uit dat beide O-O-bindingen in de molecule O3 identiek zijn: ze hebben dezelfde bindingsenergie en -lengte.
De resonantiestructuur is als volgt:
De stippellijn stelt 4 gedelokaliseerde elektronen voor, die verspreid zijn over 3 atoomkernen.
• Salpeterzuur HNO3
Voor HNO3 kun je 3 lewisstructuren tekenen. De laatste grensstructuur draagt niet bij tot de vorming van de resonantiehybride. Ze bezit niet alleen meer formele ladingen dan de eerste 2 structuren, maar ook gelijke formele ladingen op buuratomen. Bovendien draagt het zuurstofatoom, dat een hoge elektronegatieve waarde heeft, een positieve formele lading. De resonantiehybride van salpeterzuur is bijgevolg:
Wanneer er mesomerie of resonantie optreedt, kun je voor dezelfde molecule verschillende lewisstructuren tekenen die onderling alleen verschillen in de plaatsing van de elektronen. Die lewisstructuren noem je grensstructuren. Ze verschillen onderling alleen door de plaatsing van de elektronen. De werkelijke elektronenverdeling stel je voor door een resonantiehybride. Mesomerie werkt stabiliserend.
Salpeterzuur ioniseert in water tot het nitraation (NO3-) en het proton (H+). Van het nitraation bestaan er 3 grensstructuren. Door de mesomerie is het heel stabiel. Dankzij zijn goede oplosbaarheid kun je het niet door neerslagreacties verwijderen uit afvalwater. Nitraat is gevaarlijk omdat het in het lichaam omgezet kan worden tot nitriet (NO2-), dat giftig is. Nitriet zorgt ervoor dat bloed minder goed zuurstofgas kan binden (omdat de Fe2+ van hemoglobine omgezet wordt tot Fe3+). Vooral bij baby’s heeft dat ernstige gevolgen (blauwe babyziekte of methemoglobinemie). Bij volwassenen verhogen veel nitraten in het water het risico op kanker.
Een belangrijke bron van nitraten in ons oppervlaktewater is de overbemesting van landbouwgronden. Omdat nitraationen goed oplossen en zich niet hechten aan de bodem, lossen ze op in regenwater en komen ze in onze waterlopen terecht. Om de hoeveelheid nitraten in ons water te beperken, stelde Vlaanderen het mestactieplan (MAP) op. Het MAP bestaat uit een reeks maatregelen die het gebruik van meststoffen reguleren, en is onderdeel van een veel ruimer stikstofakkoord, dat de uitstoot van stikstof drastisch moet beperken.


Hoewel lewisstructuren bruikbare modellen zijn om bepaalde eigenschappen van moleculen af te leiden (zie verder), kennen ze ook enkele belangrijke tekortkomingen. Eerder zag je al dat een lewisstructuur de ruimtelijke structuur van een molecule niet correct weergeeft. Wanneer er mesomerie optreedt, blijven lewisstructuren ook in gebreke en biedt de resonantiehybride een oplossing. Als je lewisstructuren opstelt volgens het stappenplan, levert dat ook problemen op bij moleculen zoals BeF2 en BF3
Als je de lewisstructuur van berylliumdifluoride opstelt volgens het stappenplan, bekom je een structuurformule met twee dubbele bindingen en meerdere formele ladingen:
Uit experimenteel onderzoek blijkt dat gasvormig BeF2 een lineaire molecule is waarbij beide bindingen tussen Be en F enkelvoudig zijn. Een betere structuurformule is dus:
Iets gelijkaardigs treedt op bij de molecule boortrifluoride BF3. Volgens het stappenplan verwacht je:
Experimenteel onderzoek toont echter aan dat BF3 een vlakke molecule is met gelijke bindingshoeken en dat alle atoombindingen ook enkelvoudige bindingen zijn. Een betere benadering wordt dus gegeven door de volgende structuurformule, waar geen formele ladingen aanwezig zijn:
In moleculen zoals BeF2 en BF3 hebben de centrale atomen dus geen octetstructuur.
Lewisstructuren maken ook geen onderscheid tussen verschillende enkelvoudige en meervoudige bindingen: ze geven atoombindingen altijd weer door even grote streepjes. Eerder in dit thema zag je dat de bindingslengte van dubbele en drievoudige bindingen kleiner is dan die van enkelvoudige bindingen. Wanneer je een dubbele binding verbreekt (618 kJ mol), kost dat niet exact 2 keer zoveel energie als wanneer je een enkelvoudige binding verbreekt (384 kJ mol ). Een dubbele binding is dus niet gewoon 2 keer een enkelvoudige binding.
Hoewel lewisstructuren een handig middel vormen om moleculen voor te stellen, kent het gebruik ervan ook beperkingen. Als bepaalde atomen van de molecule niet de octetstructuur hebben, kun je de lewisstructuur niet opstellen volgens het stappenplan. Een lewisstructuur geeft ook geen informatie over de ruimtelijke bouw van een molecule en maakt geen onderscheid tussen verschillende soorten enkelvoudige en meervoudige bindingen.
Wat is een correcte lewisstructuur voor N2H2 (diazeen)?
Structuur A: NH N H
Structuur B: NH N H
Structuur C:
Structuur D:
Teken een correcte lewisstructuur van de volgende moleculen.
Wat kan het symbool zijn van het element dat in de onderstaande lewisstructuur van een neutrale molecule wordt voorgesteld door X?
a B
b C
c N
d S
Teken de lewisstructuur van de volgende moleculen.
Duid er de formele ladingen op aan.
a H2CO3
b H2SO4
c Br2
d PBr3
e N2F2
f POCl3
g SO2
Teken de grensstructuren en de resonantiehybride van O3 en CO32-
Hieronder zie je 3 mogelijke grensstructuren van N2O.
Wat is de meest waarschijnlijke structuur van N2O? Leg uit.
Meer oefenen? Ga naar .
HOOFDSTUK 3
De voorbije jaren ontdekte je al dat water (H2O) een geknikte molecule is en dat de waterstofatomen in methaan (CH4) gericht zijn naar de hoekpunten van een tetraëder. In dit hoofdstuk leer je hoe je de ruimtelijke bouw van een molecule kunt voorspellen door gebruik te maken van onder meer de lewisstructuur.
LEERDOELEN
L Het sterisch getal van een atoom bepalen
L De bindingshoek tussen de atomen in een molecule afleiden
L De ruimtelijke structuur van een molecule voorspellen
1 De promotie van een elektron en de aangeslagen toestand van een atoom
Vorig jaar besprak je al de stofklasse van de alkanen. Elk koolstofatoom is er gebonden aan 4 andere atomen. In de grondtoestand van het koolstofatoom zijn er maar 2 ongepaarde elektronen aanwezig. Een koolstofatoom zou dus maar 2 in plaats van 4 atoombindingen kunnen aangaan. Wanneer een C-atoom gaat binden, zal een elektron uit het 2s-orbitaal verspringen naar een 2p-orbitaal. Zo beschikt koolstof over 4 ongepaarde elektronen en kunnen er 4 atoombindingen worden gevormd.
1s2 2s2 2p2
1s2 2s1 2p3 + energie
grondtoestand van het C-atoom aangeslagen toestand van het C-atoom
Afb 60 Door de promotie van een elektron beschikt C over 4 ongepaarde elektronen.
Het verschijnsel dat elektronen verspringen naar een orbitaal binnen dezelfde schil (hetzelfde hoofdkwantum) met een hogere energie, zodat het atoom meer atoombindingen kan aangaan, noem je promotie. Door promotie gaat een atoom van zijn grondtoestand naar de aangeslagen toestand. Promotie kost een kleine hoeveelheid energie. Doordat het atoom na promotie een groter aantal atoombindingen kan aangaan, zal het stabieler worden, omdat er meer energie wordt vrijgesteld.
Bij promotie verspringt een elektron naar een hoger energetisch orbitaal op hetzelfde hoofdkwantum (bijvoorbeeld van het 3s- naar het 3p-subniveau), zodat het atoom meer atoombindingen kan vormen. Bij overgangselementen kan er inversie optreden: een elektron valt terug naar een d- of f-subniveau van een lagere schil of lager hoofdkwantum (bijvoorbeeld van 4s naar 3d), zodat dat subniveau half of volledig bezet wordt. Een atoom ondergaat inversie omdat het dan stabieler is, niet omdat het meer bindingen kan vormen.
Lewissvoorstellingen zijn tweedimensionale voorstellingen van een ruimtelijke molecule. Ze laten niet toe om uitspraken te doen over de ruimtelijke gerichtheid of geometrie van atomen en groepen. De VSEPR-theorie (valentieschil-elektronenpaar-repulsietheorie) is een model dat men in de chemie gebruikt om de vorming van de binding en de ruimtelijke rangschikking te bepalen. Daarbij maakt men ook gebruik van hybridisatie. Hybridisatie is het combineren van orbitalen.
Hybridisatie treedt pas op wanneer een atoom bindingen aangaat. Daarbij vormen 2 of meer ongelijke orbitalen zich om, of hybridiseren ze, tot 2 of meer gelijkwaardige hybrideorbitalen. De gevormde hybrideorbitalen hebben dezelfde energie en stoten elkaar maximaal af in de ruimte, waardoor hun oriëntatie verschilt ten opzichte van de orbitalen waaruit ze gevormd zijn. Een atoombinding ontstaat als er door de interactie van een (halfgevuld) hybrideorbitaal met een (halfgevuld) orbitaal van een ander atoom een elektronenpaar wordt gevormd. De ruimtelijke oriëntatie van die hybrideorbitalen laat je toe om de ruimtelijke schikking of geometrie rond een atoom in een molecule te bepalen. Het atoom waarvan je de geometrie bepaalt, noem je het centrale atoom
De lewisstructuur van methaan (CH4) suggereert dat het een vlakke molecule is met hoeken van 90° tussen de C-H-bindingen. Eerder zag je dat de molecule een ruimtelijke tetraëder vormt en dat de hoeken tussen de C-H-bindingen 109° 28ʼ bedragen:
Wanneer het koolstofatoom een binding aangaat met 4 andere atomen, zullen na promotie het 2s-orbitaal en de 3 2p-orbitalen omgevormd worden tot 4 gelijkwaardige sp3-hybrideorbitalen.
Afb. 62 Na promotie zullen 1 s-orbitaal en 3 p-orbitalen hybridiseren tot 4 gelijkwaardige sp3-orbitalen.
Het superscript 3 wijst niet op het aantal elektronen in die orbitalen, maar wel op het feit dat de orbitalen ontstonden door de hybridisatie van 3 p-orbitalen met 1 s-orbitaal. De energieinhoud van elk sp3-orbitaal ligt tussen die van de p-orbitalen en het s-orbitaal.
energie p S sp3 voor na hybridisatie
Afb. 63 Na de hybridisatie van 1 s-orbitaal met 3 p-orbitalen ontstaan er 4 gelijkwaardige sp3-orbitalen. Hun energie-inhoud ligt tussen die van de s- en de p-orbitalen.
De sp3-hybrideorbitalen hebben de vorm van een halter met een grote en een kleine lob die een gemeenschappelijke symmetrieas hebben.
Doordat de 4 sp3-orbitalen elkaar maximaal afstoten, zijn ze gericht naar de hoekpunten van een tetraëder en bedraagt de hoek tussen hun symmetrieassen 109° 28’. Men zegt ook dat het atoom een tetragonale structuur heeft. 1s2 2s1 2px1 2py1 2pz1 sp3 sp3 sp3 sp3
nucleus
Afb. 64 Een sp3-hybrideorbitaal
combineren om 4 gelijkwaardige sp³-orbitalen te vormen
Afb. 65 De 4 sp3-hybrideorbitalen stoten elkaar maximaal af, waardoor ze zich richten naar de hoekpunten van een tetraëder.
De atoombindingen in de molecule CH4 ontstaan als de ongepaarde elektronen in de 1s-orbitalen van waterstof telkens een gemeenschappelijk elektronenpaar vormen met de ongepaarde elektronen in de sp3-hybrideorbitalen van C.
66 De vorming van de atoombindingen in CH4


De theorie die stelt dat paren valentie-elektronen elkaar maximaal afstoten, zodat hun onderlinge afstand zo groot mogelijk is, is gekend onder de naam valentieschilelektronenpaar-repulsietheorie of VSEPR-theorie. Ze werd opgesteld door de Britse wetenschapper Ronald Gillespie en de Australische wetenschapper Ronald Nyholm.
In hoofdstuk 2 leerde je dat experimenteel onderzoek aantoont dat boortrifluoride een vlakke molecule is met 3 identieke, enkelvoudige atoombindingen. Dat geldt ook voor de molecule BH3 (boraan). De bindingshoeken tussen de atoombindingen zijn bovendien gelijk en de bindingen vormen dus onderling een hoek van 120°. De molecule heeft een trigonaal planaire structuur. Een correctere voorstelling van BH3 is dus:
Hybridisatie en de VSEPR-theorie kunnen opnieuw de ruimtelijke geometrie rond het centrale booratoom verklaren. Na promotie hybridiseert 1 s-orbitaal met 2 p-orbitalen tot 3 gelijkwaardige sp2-hybrideorbitalen.
1s2 2s1 2px1 2py1 2pz0 sp2 sp2 sp2 2pz0
Afb. 68 1 s-orbitaal hybridiseert na promotie met 2 p-orbitalen tot 3 gelijkwaardige sp2-hybrideorbitalen.
De energie-inhoud van die sp2-orbitalen ligt tussen die van de 2s- en de 2p-orbitalen.
De sp2-orbitalen hebben een haltervorm met een kleine en een grote lob. Beide lobben hebben, net als een sp3-orbitaal, een gemeenschappelijke symmetrieas.
Omdat de sp2-orbitalen elkaar maximaal afstoten, ontstaat er een trigonaal planaire geometrie: de 3 sp2-orbitalen liggen in 1 vlak in een hoek van 120° ten opzichte van elkaar.
Het p-orbitaal dat niet betrokken is bij de hybridisatie, blijft ongewijzigd en staat loodrecht op het vlak dat de sp2-orbitalen bevat.
VOOR HYBRIDISATIE
Door de interactie van de halfgevulde 1s-orbitalen van H met de halfgevulde sp2-hybrideorbitalen van boor ontstaan er 3 identieke, enkelvoudige bindingen die in 1 vlak liggen en onderlinge bindingshoeken van 120° vormen. Het pz-orbitaal van het element B is leeg en wordt daarom soms niet getekend. x z y x z y x z px py pz
combineren tot 3 gelijkwaardige sp²-orbitalen
Afb. 69 Bij sp2-hybridisatie hybridiseren 1 s-orbitaal en 2 p-orbitalen tot 3 sp2-orbitalen. Ze liggen in 1 vlak en vormen hoeken van 120° ten opzichte van elkaar. Het resterende p-orbitaal staat loodrecht op het vlak met de sp2-orbitalen.
Afb. 70 De vorming van de atoombindingen in de molecule boraan (BH3). Merk op dat het overblijvende, lege pz-orbitaal niet wordt getekend.
Experimenteel onderzoek toont aan dat BeH2 een lineaire molecule is met 2 identieke, enkelvoudige atoombindingen. De structuurformule van BeH2 is: BeHH
Hoewel BeH2 opgebouwd is uit een metaal en een niet-metaal, is de binding tussen waterstof en beryllium een atoombinding. Dat is een gevolg van het kleine verschil in elektronegativiteit (ΔEN) tussen beide elementen.
Je kunt de ruimtelijke geometrie van die molecule opnieuw verklaren op basis van hybridisatie.
Na promotie hybridiseren 1 s-orbitaal en 1 p-orbitaal van Be tot 2 gelijkwaardige sp-hybrideorbitalen. Hun energie ligt tussen het 2s-niveau en het 2p-niveau.
De sp-hybrideorbitalen zijn ook haltervormig, met een grote en een kleine lob die een gemeenschappelijke symmetrieas hebben. 1s2 2s1 2px1 2py0 2pz0 spsp2py0 2pz0
Afb. 71 1 s-orbitaal en 1 p-orbitaal van Be hybridiseren na promotie tot 2 gelijkwaardige sp-hybrideorbitalen.
De sp-orbitalen liggen op 1 lijn, omdat ze elkaar maximaal afstoten. De hoek tussen beide sp-hybrideorbitalen is dus 180°. Ze hebben een lineaire of digonale geometrie. De 2 p-orbitalen die niet bij de hybridisatie betrokken zijn, staan loodrecht op de as van de hybrideorbitalen.
combineren tot 2 gelijkwaardige sp-orbitalen
Afb. 72 Bij de hybridisatie van 1 s- en 1 p-orbitaal ontstaan er 2 sp-orbitalen. De hoek tussen beide
Door de interactie tussen de halfgevulde s-orbitalen van waterstof met de halfgevulde sp-hybrideorbitalen van het centrale berylliumatoom ontstaan er 2 identieke atoombindingen die onderling een hoek van 180° vormen. De lege p-orbitalen die niet betrokken zijn bij de hybridisatie, worden vaak niet getekend.
VERDIEPING
In verbindingen zoals PCl5 en SF6 is het centrale atoom omringd door meer dan 4 atomen. In dat geval worden er ook 1 of 2 d-orbitalen opgenomen in de hybridisatie. Zulke verbindingen bespreken we dit jaar niet.
HYBRIDISATIE
HYBRIDISERENDE ORBITALEN
sp3dd + s + px + py + pz
sp3d2 d + d + s + px + py + pz
HOEK TUSSEN DE HYBRIDEORBITALEN
OVERBLIJVENDE p-ORBITALEN VOORBEELD
120° en 90° (trigonaal bipiramidaal) / PCl5
90° (tetragonaal bipiramidaal) /SF6
Wanneer een atoom gaat binden, kan er hybridisatie optreden. Door hybridisatie ontstaan er gelijkwaardige hybrideorbitalen die elkaar maximaal afstoten in de ruimte. De oriëntatie van de hybrideorbitalen bepaalt de geometrie van het centrale atoom.
In dit leerboek beschouwen we 3 mogelijke hybridisatietoestanden:
1 sp3-hybridisatie leidt tot 4 gelijkwaardige hybrideorbitalen die een tetragonale structuur vormen (bindingshoeken van 109° 28ʼ).
sppp sp3 sp3 sp3 sp3
2 sp2-hybridisatie leidt tot 3 gelijkwaardige hybrideorbitalen die een vlakke, trigonale structuur vormen (bindingshoeken van 120°). Het overblijvende p-orbitaal staat loodrecht op het vlak van de hybrideorbitalen.
sppp sp2 sp2 sp2
p
3 sp-hybridisatie leidt tot 2 gelijkwaardige hybrideorbitalen die een lineaire of digonale structuur vormen (hoeken van 180°). De 2 overblijvende p-orbitalen staan loodrecht op de sp-hybrideorbitalen en onderling ook loodrecht op elkaar.
sppp sp2 sp2 p p p p
3
Het sterisch getal (SG) van het centrale atoom in een verbinding
Je kunt de ruimtelijke schikking van atomen in een verbinding verklaren of voorspellen door gebruik te maken van hybridisatie. Het atoom waarvan je de ruimtelijke geometrie bepaalt, noem je het centrale atoom. De hybridisatie van het centrale atoom kun je afleiden uit het sterisch getal (SG), dat bepaald wordt uit de lewisstructuur. Het sterisch getal van een centraal atoom is de som van het aantal bindingspartners en het aantal vrije elektronenparen
Tabel 5 toont het verband tussen het sterisch getal (SG) en de hybridisatie:
SG HYBRIDISATIE
HYBRIDISERENDE ORBITALEN
2 sp s + px
3 sp2 s + px + py
4
HOEK TUSSEN DE HYBRIDEORBITALEN OVERBLIJVENDE p-ORBITALEN
py + pz
pz
Atomen zoals H die niet over vrije elektronenparen beschikken en maar 1 atoombinding aangaan, hebben SG 1 en ondergaan geen hybridisatie.
VOORBEELDEN STERISCH GETAL BEREKENEN
• C in CH4
SG = 4 + 0 = 4
Het koolstofatoom heeft 4 bindingspartners en geen vrije of vrije elektronenparen. Het heeft daarom SG 4. Het koolstofatoom kent dus een sp3-hybridisatie: het bezit 4 gelijkwaardige sp3-oribtalen die naar de hoekpunten van een tetraëder gericht zijn. De hoek tussen de atoombindingen bedraagt dus 109° 28ʼ.
109° 28'
Afb 74 Het koolstofatoom in methaan heeft SG 4. Daaruit bepaal je dat de bindingshoeken tussen de C-H-bindingen 109° 28ʼ bedragen.
• S in SO2
De lewissstructuur van SO2 is als volgt:
3D-beeld SO2 OOS + -
3D-beeld HNO3











Het centrale zwavelatoom heeft 2 buuratomen en een niet-bindend elektronenpaar. Het heeft SG 3. Het zwavelatoom kent dus een sp2-hybridisatie. De bindingshoek tussen beide S-O-bindingen bedraagt daarom 120°. Een betere voorstelling van de molecule is bijgevolg:
Op basis van die structuur heeft 1 van de zuurstofatomen SG 4 en het andere zuurstofatoom SG 3.
SG = 3 + 1 = 4
SG = 2 + 1 = 3
Metingen tonen echter aan dat beide atomen dezelfde ruimtelijke geometrie kennen. Bij de molecule SO2 treedt mesomerie op. Als er mesomerie optreedt, moet je de hybridisatie van een atoom bepalen uit de resonantiehybride. Beide zuurstofatomen hebben 1 bindingspartner en 2 vrije elektronenparen. Daarom hebben ze beide SG 3.
N in HNO3
Het stikstofatoom heeft 3 bindingspartners, maar geen vrije elektronenparen. Het heeft SG 3. Het stikstofatoom kent dus een sp2-hybridisatie. De 3 zuurstofatomen en het stikstofatoom liggen in 1 vlak en de hoeken tussen de 3 N-O-bindingen bedragen 120°.
SG = 2 + 1 = 3
SG = 2 + 1 = 3
Afb 76 De ruimtelijke structuur van HNO3. Het stikstofatoom kent een trigonale hybridisatie: de 3 zuurstofatomen en het stikstofatoom liggen in hetzelfde vlak.
• De atomen in HF
Op basis van de lewisstructuur kun je afleiden dat waterstof SG 1 heeft. Waterstof ondergaat geen hybridisatie. Omdat het fluoratoom 3 vrije elektronenparen en 1 bindingspartner heeft, heeft het SG 4.
H F SG = 3 + 1 = 4
• De koolstofatomen in etheen (C2H4)
Bij grotere moleculen, zoals etheen, beschouw je meerdere atomen als centraal atoom. De geometrie van die atomen bepaalt de ruimtelijke structuur van de molecule. Beide koolstofatomen in de molecule C2H4 hebben SG 3, omdat ze elk 3 bindingspartners hebben en niet over vrije elektronenparen beschikken. De hoeken tussen alle bindingen bedragen 120°.
SG = 3 + 0 = 3
SG = 3 + 0 = 3
Vorig jaar leerde je mogelijk al dat water een geknikte molecule is. Dat kun je nu zelf afleiden uit de lewisstructuur: het centrale zuurstofatoom heeft SG 4.
SG = 2 + 2 = 4
Het zuurstofatoom ondergaat een sp3-hybridisatie. De atoombindingen met de waterstofatomen ontstaan door de interactie van de 1s-orbitalen van waterstof met 2 sp3-orbitalen van het zuurstofatoom. Op basis van de hybridisatie zou je dus een bindingshoek van 109° 28ʼ verwachten tussen beide O-H-bindingen. De 2 resterende sp3-hybrideoribalen bevatten elk een niet-bindend elektronenpaar van zuurstof. Die elektronenparen nemen ruimtelijk meer plaats in dan een atoombinding en duwen de O-H-atoombindingen naar elkaar toe. Daarom is de bindingshoek tussen beide O-H-bindingen kleiner dan de hoek van 109° 28ʼ die je theoretisch verwacht. De effectieve bindingshoek bedraagt 104,5°. Vrije elektronenparen in hybrideorbitalen kunnen ervoor zorgen dat de effectieve bindingshoeken kleiner zijn dan de theoretische.
bevat niet-bindend elektronenpaar gemeenschappelijk elektronenpaar
Afb 78 De 2 vrije elektronenparen in de sp3-orbitalen duwen de atoombindingen naar elkaar toe, waardoor de effectieve bindingshoek tussen de atoombindingen kleiner is dan 109°.
Het sterisch getal (SG) kun je afleiden uit de lewisstructuur. Het bepaalt de hybridisatie en de ruimtelijke geometrie van een centraal atoom.
2 sp
3 sp2
4 sp3
Vrije elektronenparen in hybrideorbitalen kunnen atoombindingen naar elkaar toe duwen, waardoor de effectieve bindingshoek kleiner wordt dan de theoretische. Dat effect is groter in grotere atomen.
WEETJE
Het zwavelatoom in H2S heeft, net als het zuurstofatoom in H2O, SG 4. Hoewel er ook 2 sp3-orbitalen gevuld zijn met vrije elektronenparen, is de bindingshoek in H2S veel kleiner (92°) dan die in H2O (104,5°). De grootte van het centrale atoom beïnvloedt ook de bindingshoek: bij het zuurstofatoom hybridiseren de s- en p-orbitalen van de 2e schil, bij het zwavelatoom de s- en p-orbitalen van de 3e schil. De bindende elektronenparen in H2S zitten verder uit elkaar dan in H2O en stoten elkaar daarom minder af. In een groter atoom kunnen de vrije elektronenparen de atoombindingen daarom gemakkelijker naar elkaar toe duwen, waardoor de bindingshoek verkleint.
O H H 104,5°
S H H 92°
Afb. 79 De bindingshoek in H2S is kleiner dan die in H2O.
In thema 02 leerde je dat een atoomorbitaal de meest waarschijnlijke ruimte weergeeft waarin een elektron zich bevindt. Wanneer 2 atomen elkaar naderen en een atoombinding vormen, komen de elektronen van het ene atoom onder invloed van de kern van het andere atoom. De atoomorbitalen of hybrideorbitalen vervormen en overlappen, en geven zo aanleiding tot molecuulorbitalen. Molecuulorbitalen geven dus met een bepaalde zekerheid de plaats weer waar elektronen zich bevinden in een molecule. Net zoals bij een atoomorbitaal kunnen er maximaal 2 elektronen plaatsnemen in elk molecuulorbitaal.
klassieke bindingstheorie: vorming van een gemeenschappelijk doublet
molecuulorbitaalmodel: vorming van een molecuulorbitaal
Afb 80 Volgens de klassieke bindingstheorie ontstaat een binding als atoomorbitalen overlappen en de gemeenschappelijke elektronen in de overlappingsruimte terechtkomen. De molecuulorbitaaltheorie stelt dat de waarschijnlijkheidsverdeling om elektronen aan te treffen, beïnvloed wordt door de kernen van beide bindingspartners.
Op basis van het type orbitalen dat met elkaar in interactie treedt, kun je 2 soorten atoombindingen onderscheiden. Als er een atoombinding wordt gevormd door de overlapping en vervorming van s- of hybrideorbitalen, bevindt het gemeenschappelijk elektronenpaar zich tussen beide atoomkernen en ontstaat er een sigma- of σ-binding. Als er na hybridisatie p-orbitalen overblijven, kunnen de p-orbitalen van buuratomen met elkaar in interactie treden en aanleiding geven tot een ander soort molecuulorbitaal, dat je een pi- of π-binding noemt.
Molecuulorbitalen ontstaan wanneer atoomorbitalen en/of hybrideorbitalen overlappen en vervormen. Ze geven de meest waarschijnlijke plaats in een molecule weer waar elektronen zich bevinden. Er kan een onderscheid worden gemaakt tussen de σ-binding en de π-binding.
De molecuulorbitaaltheorie is een vrij complexe theorie. Wanneer 2 atoomorbitalen met elkaar overlappen, ontstaan er 2 nieuwe molecuulorbitalen:
1 een bindend molecuulorbitaal met een lagere energie-inhoud dan elk van beide atoomorbitalen afzonderlijk;
2 een anti-bindend molecuulorbitaal met een hogere energie-inhoud dan elk van beide atoomorbitalen afzonderlijk.
De opvullingsvolgorde is hetzelfde als bij atomen: elektronen plaatsen zich eerst in de orbitalen met de laagste energie (Aufbau-principe). Wanneer het anti-bindend orbitaal gevuld wordt, zal de binding worden verbroken.
VOORBEELDEN MOLECUULORBITALEN
• H2
Als de 1s-orbitalen van beide waterstofatomen overlappen, ontstaan er 2 molecuulorbitalen: een bindend met een lagere energie-inhoud en een anti-bindend met een hogere energie-inhoud. Beide elektronen nemen plaats in het orbitaal met de laagste energie en vormen zo de atoombinding in waterstof.
atoomorbitaal
anti-bindend molecuulorbitaal
σ * 1s
energie bindend molecuulorbitaal
H 2
σ 1s
1s1 H
atoomorbitaal
Afb 81 De vorming van het bindend en anti-bindend molecuulorbitaal bij de H2-molecule. De binding tussen de H-atomen blijft, omdat enkel het bindend molecuulorbitaal een elektronenpaar bevat.
• He
Als 2 heliumatomen een chemische binding willen vormen, ontstaan er door de interactie van de 2 1s-orbitalen een bindend en een anti-bindend orbitaal. De 4 elektronen moeten plaatsnemen in beide orbitalen. De 2 elektronen die plaatsnemen in het bindend molecuulorbitaal met de laagste energie, zouden zorgen voor een stabielere He2-molecule. De 2 resterende elektronen nemen plaats in het anti-bindend molecuulorbitaal en zorgen voor een stijging in energie. Die stijging zorgt ervoor dat de binding tussen de 2 heliumatomen niet wordt gevormd. Het molecuulorbitaalmodel verklaart waarom het edelgas He geen bindingen aangaat met andere atomen en in de natuur voorkomt als monoatomaire stof. H 1s1
VERDIEPING (VERVOLG)
VOORBEELDEN MOLECUULORBITALEN (VERVOLG)
anti-bindend molecuulorbitaal
He 1s1 1s1 He He 2 atoomorbitaal bindend molecuulorbitaal atoomorbitaal
Afb 82 Omdat zowel het bindend als het anti-bindend molecuulorbitaal wordt opgevuld, wordt er tussen 2 heliumatomen geen atoombinding gevormd.
4.1 De sigma- of σ-binding
De 1e atoombinding die tussen 2 atomen wordt gevormd, is altijd een σ-binding. Een σ-binding ontstaat door:
• de overlapping van 2 s-atoomorbitalen, zoals in H2;
• de overlapping van een s-orbitaal met een hybrideorbitaal , zoals in CH4;
• de overlapping van 2 hybrideorbitalen, zoals in F2
Die σ-binding kent een axiale symmetrie. Dat wil zeggen dat de aantrefkrans voor de bindende elektronen in alle punten van de ruimte op een gelijke afstand van de bindingsas hetzelfde is. De elektronendichtheid is het grootst tussen beide atoomkernen.
s-soverlap
s-sp3overlap
sp3-sp3overlap
Afb 83 De σ-binding is axiaal symmetrisch.
zijaanzicht σ-binding
vooraanzicht σ-binding
grootste elektronendichtheid tussen beide kernen op gelijke afstand van de as is de elektronendichtheid hetzelfde
Een σ-binding is een stevige binding. Als het de enige binding tussen 2 atomen is, heerst er vrije draaibaarheid rond de binding.
Afb 84 Rond een enkelvoudige atoombinding heerst er vrije draaibaarheid.
We lichten de vorming van molecuulorbitalen verder toe aan de hand van enkele voorbeelden. In elk voorbeeld vertrekken we van de lewisstructuur en volgen we hetzelfde stappenplan:
STAP 1
Bepaal het SG en de hybridisatie van de atomen.
STAP 2
Bepaal de elektronenconfiguratie van elk atoom en de hokjesvoorstelling van de valentieelektronen vóór de hybridisatie.
STAP 3
Noteer de hokjesvoorstelling van de valentie-elektronen na de hybridisatie.
STAP 4
Ga na welke orbitalen met elkaar in interactie treden om een atoombinding te vormen.
STAP 5
Geef de vorming van de molecuulorbitalen weer.
VOORBEELDEN σ-BINDING
• In de molecule H2
De lewisstructuur van H2 is: HH
STAP 1
Bepaal het SG en de hybridisatie van de atomen.
STAP 2
Bepaal de elektronenconfiguratie van elk atoom en de hokjesvoorstelling van de valentie-elektronen vóór de hybridisatie.
STAP 3
H heeft SG 1 en vormt bijgevolg geen hybrideorbitalen.
H: 1s1
Noteer de hokjesvoorstelling van de valentie-elektronen na de hybridisatie. σ 1s1 1s1
STAP 4
Ga na welke orbitalen met elkaar in interactie treden om een atoombinding te vormen.
STAP 5
Geef de vorming van de molecuulorbitalen weer.
De atoombinding ontstaat door de interactie van de 2 halfgevulde 1s-orbitalen.
interactie van orbitalen molecuulorbitaal Afb 85 De vorming van de molecuulorbitalen in een molecule H2
De enkelvoudige binding in de molecule H2 is een σ-binding. Ze ontstaat door de interactie van 2 halfgevulde s-atoomorbitalen.
• In de molecule HF
De lewisstructuur van HF is: FH
STAP 1
Bepaal het SG en de hybridisatie van de atomen.
H heeft SG 1 en ondergaat geen hybridisatie.
F heeft SG 4 en ondergaat een sp3-hybridisatie (4 hybrideorbitalen in onderlinge hoeken van 109° 28ʼ).
STAP 2
Bepaal de elektronenconfiguratie van elk atoom en de hokjesvoorstelling van de valentie-elektronen vóór de hybridisatie.
H: 1s1
F: 1s2 2s2 2p5
Noteer de hokjesvoorstelling van de valentie-elektronen na de hybridisatie.
STAP 3 sp3 sp3 sp3 sp3
STAP 4
Ga na welke orbitalen met elkaar in interactie treden om een atoombinding te vormen.
STAP 5
Geef de vorming van de molecuulorbitalen weer.
De atoombinding ontstaat door de interactie tussen een halfgevuld s-atoomorbitaal van H en een halfgevuld sp3-orbitaal van F.
De enkelvoudige binding in de molecule HF is een σ-binding en ontstaat door de interactie van een halfgevuld s-atoomorbitaal van waterstof met een halfgevuld sp3-hybrideorbitaal van fluor. De 3 vrije elektronenparen van fluor bevinden zich in de 3 andere sp3-orbitalen. Die worden hier niet getekend.
• In de molecule F2
De lewisstructuur van F2 is: FF
STAP 1
Bepaal het SG en de hybridisatie van de atomen.
STAP 2
Bepaal de elektronenconfiguratie van elk atoom en de hokjesvoorstelling van de valentie-elektronen vóór de hybridisatie.
STAP 3
Noteer de hokjesvoorstelling van de valentie-elektronen na de hybridisatie.
Elk F-atoom heeft SG 4 en kent een sp3-hybridisatie (hoeken van 109°).
F: 1s2 2s2 2p5
F: F:
STAP 4
Ga na welke orbitalen met elkaar in interactie treden om een atoombinding te vormen.
STAP 5
Geef de vorming van de molecuulorbitalen weer.
De atoombinding ontstaat door de interactie van een halfgevuld sp3-orbitaal van elk F-atoom.
sp3 x z y z y x z y z y x z y x z y
(
van
) sp3 Afb 87 De vorming van de
in een molecule F2
De enkelvoudige binding in de molecule F2 is een σ-binding die ontstaat door de interactie van een halfgevuld sp3-hybrideorbitaal van elk van beide fluoratomen. Elk fluoratoom heeft ook nog 3 vrije elektronenparen in de overige sp3-orbitalen, die hier niet getekend worden.
Een sigma- of σ-binding ontstaat als 2 s-orbitalen, 1 s-orbitaal en 1 hybrideorbitaal, of 2 hybrideorbitalen met elkaar in interactie treden en molecuulorbitalen vormen. De binding heeft een axiale symmetrie en de elektronen bevinden zich tussen de atoomkernen.
Een σ-binding laat vrije rotatie toe.
4.2 De pi- of π-binding
Bij sommige atomen combineren niet alle p-orbitalen met het s-orbitaal tot hybrideorbitalen. Zo houden atomen met een sp2-hybridisatie 1 p-orbitaal en atomen met een sp-hybridisatie 2 p-orbitalen over. Die overblijvende p-orbitalen staan loodrecht op de hybrideorbitalen. Soms bevatten die p-orbitalen elektronen. (Soms zijn ze ook leeg. Dan tekenen we ze niet.)
Als er een σ-binding is gevormd, kunnen overblijvende, (half)gevulde p-orbitalen molecuulorbitalen vormen door zijdelingse interactie. De binding die zo ontstaat, noem je een pi- of π-binding. De 2e en 3e atoombinding tussen 2 atomen zijn π-bindingen. Door de zijdelingse interactie beslaat de π-binding een zone met een grotere aantrefkans voor de elektronen aan beide zijden van de σ-binding. Net omdat de elektronen van een π-binding zich niet tussen beide atoomkernen bevinden, is een π-binding veel reactiever dan een σ-binding.
p-orbitaal +
p-orbitaal
p-p-overlap
orbitaal van een π-binding
Afb 88 Een π-molecuulorbitaal ontstaat door de zijdelingse interactie van p-orbitalen. Het π-molecuulorbitaal kent zowel boven als onder de bindingsas een zone met een grote aantrefkans voor de elektronen van de π-binding.
Een π-binding verhindert de vrije rotatie rond de σ-binding.
Afb 89 De 2 lewisstructuren bovenaan stellen dezelfde stof voor, omdat er rond een enkelvoudige binding vrije rotatie heerst. De 2 lewisstructuren onderaan stellen een andere stof voor, omdat de π-binding vrije rotatie rond de σ-binding verhindert. In thema 05 komen we daarop terug.
Hierna lichten we de vorming van π-molecuulorbitalen toe met enkele voorbeelden. We volgen het stappenplan op p. 144, dat we ook gebruikten om de vorming van de σ-binding te illustreren.
VOORBEELDEN σ- EN π-BINDING
• In de molecule O2
De lewisstructuur van O2 is: O O
STAP 1
Bepaal het SG en de hybridisatie van de atomen.
STAP 2
Bepaal de elektronenconfiguratie van elk atoom en de hokjesvoorstelling van de valentie-elektronen vóór de hybridisatie.
STAP 3
Noteer de hokjesvoorstelling van de valentie-elektronen na de hybridisatie.
Elke O in de molecule heeft SG 3. → Er zijn 3 sp2-hybrideorbitalen en 1 overblijvend p-orbitaal.
O: 1s2 2s2 2p4
O:
O:
STAP 4
Ga na welke orbitalen met elkaar in interactie treden om een atoombinding te vormen.
Door de interactie van de halfgevulde sp2-orbitalen van elk van de zuurstofatomen ontstaat er een σ-binding.
De zijdelingse interactie van de resterende p-orbitalen leidt tot de vorming van een π-binding.
STAP 5
Geef de vorming van de molecuulorbitalen weer.
De σ-binding tussen beide zuurstofatomen wordt gevormd door de interactie van 2 halfgevulde sp2-orbitalen. Allebei de vrije elektronenparen van elk zuurstofatoom bevinden zich in de 2 resterende sp2-orbitalen. Merk op dat de hoek tussen de vrije elektronenparen en de σ-binding 120° bedraagt (trigonaal planaire structuur).
Elk zuurstofatoom beschikt nog over een overblijvend, halfgevuld p-orbitaal.
Door de zijdelingse interactie van die p-orbitalen ontstaat er een π-binding. De dubbele binding bestaat dus uit 1 σ-binding en 1 π-binding. In de lewisstructuur stel je elk van de bindingen voor door een streepje.
• In de molecule CO2
De lewisstructuur van CO2 is: OCO
1
Bepaal het SG en de hybridisatie van de atomen.
STAP 2
Bepaal de elektronenconfiguratie van elk atoom en de hokjesvoorstelling van de valentie-elektronen vóór de hybridisatie.
O heeft SG 3
(3 sp2-hybrideorbitalen en 1 p-orbitaal).
C heeft SG 2 (2 sp-orbitalen en 2 p-orbitalen).
O: 1s2 2s2 2p4
C: 1s2 2s2 2p2
C ondergaat promotie: C: 1s2 2s1 2p3
STAP 3
Noteer de hokjesvoorstelling van de valentie-elektronen na de hybridisatie.
STAP 4
Ga na welke orbitalen met elkaar in interactie treden om een atoombinding te vormen.
sp2 sp2 sp2 py O: spsppy pz
sp2 sp2 sp2 pz
De σ-bindingen tussen C en O ontstaan door de interactie van een halfgevuld sp-orbitaal van C met een halfgevuld sp2-orbitaal van zuurstof. Door de zijdelingse interactie van de halfgevulde p-orbitalen van het C-atoom met de halfgevulde p-orbitalen van O ontstaan er 2 π-bindingen.
Geef de vorming van de molecuulorbitalen weer.
-binding (1 elektronenpaar) π-binding (1 elektronenpaar) π-binding (1 elektronenpaar)
σ y z y x z z y x z z y y y
De molecule CO2 bevat 2 σ-bindingen en 2 π-bindingen. De 2 σ-bindingen ontstaan door de interactie van een halfgevuld sp2-orbitaal van elk O-atoom met een halfgevuld sp-orbitaal van het C-atoom. De 3 atoomkernen liggen op dezelfde as, omdat de hoek tussen beide sp-orbitalen van C 180° bedraagt. De resterende sp2-orbitalen van de O-atomen bevatten de vrije elektronenparen.
De 2 p-orbitalen van C staan loodrecht op elkaar. Ze kunnen elk interageren met een p-orbitaal van een O-atoom, waardoor de 2 π-bindingen in de molecule loodrecht op elkaar staan. Elk van de dubbele bindingen in CO2 bestaat uit 1 σ-binding en 1 π-binding.
• In de molecule C6H6
Voor C6H6 kun je 2 grensstructuren tekenen:
De resonantiehybride is:
STAP 1
Bepaal het SG en de hybridisatie van de atomen.
STAP 2
Bepaal de elektronenconfiguratie van elk atoom en de hokjesvoorstelling van de valentie-elektronen vóór de hybridisatie.
Elk H-atoom heeft SG 1. Elk C-atoom heeft SG 3. (Alle C-atomen beschikken dus over 3 sp2-orbitalen (120°) en een vrij pz-orbitaal.)
H: 1s1
STAP 3
Noteer de hokjesvoorstelling van de valentie-elektronen na de hybridisatie.
C: 1s2 2s2 2p2
C ondergaat promotie:
C: 1s2 2s1 2p3
STAP 4
Ga na welke orbitalen met elkaar in interactie treden om een atoombinding te vormen.
sp2 sp2 sp2 p
C: de p-orbitalen
Door de overlapping van elk van deze 2 sp2-orbitalen met een sp2-orbitaal van 2 buur-C-atomen ontstaan er σ-bindingen met de buur-C-atomen.
Door interactie met de 1s van H ontstaat er een σ-binding tussen C en H.
De σ-binding tussen H en C ontstaat door de interactie van het 1s-orbitaal van H met een halfgevuld sp2-orbitaal van C. De σ-binding tussen 2 C-atomen ontstaat door de interactie tussen halfgevulde sp2-orbitalen. De zijdelingse interactie van de halfgevulde p-orbitalen leidt tot de vorming van een grote π-binding.
STAP 5
Geef de vorming van de molecuulorbitalen weer.
Afb 92 De vorming van de molecuulorbitalen in een molecule C6H6
In de ringstructuur is elk C-atoom verbonden met 2 buuratomen door σ-bindingen die ontstaan door de interactie van halfgevulde sp2-orbitalen. De σ-bindingen met waterstof ontstaan door de overlap van het 3e sp2-orbitaal van C met een halfgevuld 1s-orbitaal van H.
Het overblijvende pz-orbitaal van elk van de C-atomen staat loodrecht op het vlak met de 3 sp2-orbitalen. Door de zijdelingse interactie van die pz-orbitalen ontstaat er 1 grote π-binding, waarbij de 6 gedelokaliseerde elektronen verdeeld zijn over de 6 C-atomen.
• In de molecule C2H2
De lewisstructuur van C2H2 is: CH C H
STAP 1
Bepaal het SG en de hybridisatie van de atomen.
Elk H-atoom heeft SG 1 (geen hybridisatie).
C heeft SG 2 (2 sp-orbitalen, lineaire geometrie).
STAP 2
Bepaal de elektronenconfiguratie van elk atoom en de hokjesvoorstelling van de valentie-elektronen vóór de hybridisatie.
STAP 3
Noteer de hokjesvoorstelling van de valentie-elektronen na de hybridisatie.
H: 1s1
C: 1s2 2s2 2p2
C ondergaat promotie: C: 1s2 2s1 2p3
H:
spsppy pz
C:
spsppy pz C:
Ga na welke orbitalen met elkaar in interactie treden om een atoombinding te vormen.
4 STAP 5
Geef de vorming van de molecuulorbitalen weer.
De σ-binding tussen H en C ontstaat door de interactie van het 1s-orbitaal van H met een halfgevuld sp-orbitaal van C. De σ-binding tussen de 2 C-atomen ontstaat door de interactie tussen halfgevulde sp-orbitalen van 2 C-atomen. Door de zijdelingse interactie van de 2 halfgevulde p-orbitalen van C met de halfgevulde p-orbitalen van het andere C-atoom ontstaan er 2 π-bindingen die loodrecht op elkaar staan.
De σ-binding tussen H en C ontstaat door de overlap van een halfgevuld 1s-orbitaal van H met een halfgevuld sp-orbitaal van C. De σ-binding tussen de 2 C-atomen ontstaat door de interactie van een halfgevuld sp-orbitaal van elk. Door de paarsgewijze interactie van de halfgevulde py- en pz-orbitalen ontstaan er 2 π-bindingen die loodrecht op elkaar staan. De drievoudige binding tussen beide C-atomen is dus opgebouwd uit 1 σ-binding en 2 π-bindingen.
Een pi- of π-binding ontstaat als er molecuulorbitalen worden gevormd door de zijdelingse interactie van p-orbitalen die niet in de hybridisatie werden opgenomen. Een π-binding is reactiever dan een σ-binding omdat een π-molecuulorbitaal een zone van hogere elektronendichtheid aan beide zijden van de bindingsas kent. Bovendien verhinderen π-bindingen de vrije rotatie rond de σ-binding. Tussen 2 atomen kunnen er maximaal 2 π-bindingen voorkomen.
5 Vergelijking tussen de σ- en π-binding
In een molecule kunnen enkelvoudige, dubbele en drievoudige atoombindingen voorkomen.
Hoewel elke atoombinding in de lewisstructuur wordt weergegeven met een streepje, maken we een onderscheid tussen de σ-binding en de π-binding
In tabel 6 zetten we de verschillen op een rijtje:
σ-BINDING
π-BINDING
de binding in een enkelvoudige bindingKan pas ontstaan in aanwezigheid van een σ-binding. Een dubbele binding bestaat uit 1 σ-binding en 1 π-binding. Een drievoudige binding bestaat uit 1 σ-binding en 2 π-bindingen.
overlapping van s- en/of hybrideorbitalen → sterke binding
zijdelingse overlapping van p-orbitalen → minder sterke binding
Deze binding kan gemakkelijker verbroken worden. Stoffen met π-bindingen zijn daarom vaak reactiever dan stoffen zonder π-bindingen.
De elektronen bevinden zich tussen beide atoomkernen (gelokaliseerd) en de elektronenverdeling is symmetrisch rond de bindingsas (axiale symmetrie).
De binding laat vrije rotatie toe.
Tabel 6 De verschillen tussen een σ-binding en een π-binding
Door de zijdelingse overlapping kent 1 π-binding 2 zones met een hogere elektronendichtheid, gelegen aan beide zijden ‘boven/onder’ of ‘voor/achter’ de bindingsas. Als er mesomerie optreedt, ontstaat er een π-binding waarvan de elektronen zich verdelen over meerdere atoomkernen: de elektronen zijn gedelokaliseerd
De binding verhindert de vrije rotatie van de σ-binding.
De σ-binding is altijd de eerste binding tussen 2 atomen.
De 2e en 3e binding in een meervoudige binding zijn π-bindingen
De π-binding is minder sterk dan de σ-binding en laat geen vrije rotatie toe, omdat het gemeenschappelijk elektronenpaar zich niet tussen de kernen bevindt.
Hieronder zie je een molecule vanille.
Welke van de volgende voorstellingen kan een leerkracht gebruiken om de vorming van een π-binding te illustreren?
Wat is het aantal C-atomen met een sp2-hybridisatie, het aantal C-atomen met een sp3-hybridisatie en het aantal π-elektronen in de molecule?
Geef de hybridisatie van elke C in deze molecule.
Gegeven is de volgende organische verbinding:
Vergelijk en bespreek de geometrie van een molecule C3H4 waarin wel en geen dubbele bindingen voorkomen.
a een molecule C3H4 met dubbele bindingen:
a Hoe groot (aantal graden) zijn de bindingshoeken die worden aangeduid door de letters A, B en C?
b Welke ruimtelijke structuur tref je aan rond het koolstofatoom dat wordt aangeduid door de pijl?
In de molecule C2H4 komen 2 soorten bindingen voor. Welke?
b een molecule C3H4 met een drievoudige binding:
Bespreek voor de volgende moleculen:
a de geometrie rond en de hybridisatie van elk atoom;
b welke bindingen er voorkomen (σ en/of π) en hoe ze tot stand komen.
Hoofdstuk 1: Bindingen tussen atomen atoombindingen
Niet-metaalatomen vormen gemeenschappelijke elektronenparen omdat ze streven naar een zo stabiel mogelijk toestand (edelgasconfiguratie).
Daarbij stellen ze energie vrij.
bindingsenergie
bindingslengte
Hoofdstuk 2: Lewisstructuren lewisstructuur
mesomerie tekortkomingen
afstoting
aantrekking
afstand tussen de kernen (pm)
stabiele toestand
De energie die vrijkomt bij de vorming van een binding, is ook nodig om een binding te verbreken. Hoe groter de bindingsenergie, hoe sterker de binding.
De afstand tussen de atoomkernen in een verbinding is de afstand waarbij de potentiële energie van de molecule het laagst is. De bindingslengte hangt ook af van de grootte van de atomen en het aantal atoombindingen tussen de kernen (enkelvoudige binding, dubbele binding of drievoudige binding).
Een voorstelling van de molecule waarin alle valentie-elektronen zijn getekend.
Je kunt de lewisstructuur opstellen volgens het stappenplan op p. 119.
Je kunt meerdere lewisvoorstellingen opstellen die enkel verschillen in de plaatsing van de elektronen: grensstructuren. De resonantiehybride is een ‘gemiddelde’ van de grensstructuren.
Lewisstructuren geven de ruimtelijke structuur van een molecule niet correct weer en kennen nog enkele andere tekortkomingen.
Hoofdstuk 3: De hybridisatie van atomen en de ruimtelijke bouw van moleculen promotie hybridisatie
Als elektronen verspringen naar een verder van de kern gelegen subniveau, gaat het atoom over van de grondtoestand naar de aangeslagen toestand. Na promotie kunnen er meer atoombindingen worden gevormd, wat energetisch gunstiger is.
Je kunt de ruimtelijke geometrie rond een atoom verklaren doordat de atoomorbitalen omgevormd worden tot gelijkwaardige hybrideorbitalen. Het sterisch getal (SG) bepaalt de hybridisatie. ΔE = bindingsenergie
Hoofdstuk 3: De hybridisatie van atomen en de ruimtelijke bouw van moleculen (vervolg)
sterisch getal (SG)
• SG 1: geen hybridisatie
• SG 2: 2 overblijvende p-orbitalen en 2 sp-hybrideorbitalen; lineaire structuur (180°)
• SG 3: 1 overblijvend p-orbitaal en 3 sp2-hybrideorbitalen; trigonaal planaire structuur (120°)
• SG 4: geen overblijvende p-orbitalen en 4 sp3-hybrideorbitalen; tetragonale structuur (109° 28ʼ)
sppp sp3 sp3 sp3 sp3
molecuulorbitalen
σ-binding
π-binding
Molecuulorbitalen geven de aantrefkans van elektronen in een molecule weer.
Ze ontstaan door de overlap van atoom- en/of hybrideorbitalen.
• de eerste binding tussen twee atoomkernen
• axiale symmetrie
• ontstaat door de interactie van 2 s-atoomorbitalen, 1 s-atoomorbitaal en 1 hybrideorbitaal, of 2 hybrideorbitalen
• ontstaat door de zijdelingse interactie van overgebleven p-orbitalen
• bestaat uit 2 zones met een hogere elektronendichtheid, gelegen aan beide zijden van de bindingsas
• reactiever dan een σ-binding
• verhindert vrije rotatie
• een dubbele binding bestaat uit 1 σ- en 1 π-binding; een drievoudige binding uit 1 σ- en 2 π-bindingen
In de 2e graad maakte je al kennis met verschillende anorganische stoffen en leerde je een aantal eigenschappen te verklaren. In dit thema breiden we de anorganische stoffen uit, zowel qua naamgeving als qua eigenschappen.

` Waarom zijn sommige stoffen gasvormig bij kamertemperatuur en andere stoffen vloeibaar of vast?
` Welke krachten moeten overwonnen worden om een stof van aggregatietoestand te laten veranderen?
We zoeken het uit!
• de naam en formule van verschillende anorganische stoffen vormen.
• van eenvoudige moleculen bepalen of de verbinding polair of apolair is.
• eigenschappen van eenvoudige moleculen verklaren op basis van de aanwezige intermoleculaire krachten.
LEERT NU ...
• die naamgeving toepassen voor een grotere groep van anorganische stoffen.
• van meer complexe moleculen bepalen of de verbinding polair of apolair is.
• eigenschappen van meer complexe moleculen verklaren op basis van de aanwezige intraen intermoleculaire krachten.
In het 4e jaar heb je de anorganische stofklassen al besproken. Je kunt ze op basis van hun naam of formule indelen bij de oxiden, hydroxiden, zuren of zouten. Van een aantal stoffen ken je ook de toepassing en eventueel een gebruiksnaam. In dit hoofdstuk zul je nog een aantal extra stoffen bestuderen, zoals de dubbelzouten.
LEERDOELEN
L De namen en formules van anorganische stoffen vormen
L De stofklassen uitbreiden met onder andere de afgeleide zuren en dubbelzouten
1.1 Oxidatiegetal
Het oxidatiegetal (OG) van een gebonden atoom geeft aan hoeveel elektronen een atoom (gedeeltelijk) meer (negatief oxidatiegetal) of minder (positief oxidatiegetal) bezit dan het ongebonden atoom.
Bij een ionverbinding worden er elektronen overgedragen, waardoor er ionen ontstaan. Daardoor is het oxidatiegetal voor metalen hetzelfde als de ionlading. De ionlading wordt alleen anders genoteerd. Een ionlading noteer je met Arabische cijfers, terwijl je een oxidatiegetal voorstelt met Romeinse cijfers.
Je kunt het OG van atomen in een atoomverbinding bepalen aan de hand van de lewisstructuur:
• Vrije elektronenparen behoren tot het atoom waarbij ze staan.
• Bindende elektronenparen behoren tot het atoom met de grootste elektronegatieve waarde (EN). Als beide atomen dezelfde elektronegatieve waarde hebben, krijgt elk atoom 1 elektron toegewezen.
VOORBEELD HET OXIDATIEGETAL VAN CHLOOR IN Cl2O BEPALEN MET BEHULP VAN DE LEWISSTRUCTUUR
lewisstructuur Cl2O: Er vindt een verschuiving van de elektronenparen plaats tussen tussen Cl en O als gevolg van het verschil in elektronegatieve waarde. Omdat EN (Cl) < EN (O), verschuiven de elektronen in elke chloor-zuurstofbinding naar zuurstof. Daarom heeft zuurstof een oxidatiegetal van -II, want het heeft 2 elektronen (gedeeltelijk) meer dan in de ongebonden toestand. Elk chlooratoom heeft een oxidatiegetal van +I, want het heeft 1 elektron (gedeeltelijk) minder dan in de ongebonden toestand. Een ongebonden chlooratoom heeft 7 valentie-elektronen. In deze molecule krijgt elk chlooratoom, door de verschuiving van de bindende elektronenparen, maar 6 elektronen toegewezen.
De pijlen in deze lewisstructuur stellen geen datieve bindingen voor, maar de verschuiving van de elektronen als gevolg van het verschil in EN.
Je kunt het oxidatiegetal van een atoom ook afleiden uit de brutoformule en gekende oxidatiegetallen van de andere aanwezige atomen. Dat is vaak eenvoudiger dan via de lewisstructuur.
Voor een enkelvoudige stof of een monoatomisch ion lees je het oxidatiegetal rechtstreeks uit de formule af:
• Het oxidatiegetal van een atoom in een enkelvoudige stof is altijd gelijk aan 0.
• Het oxidatiegetal in een monoatomisch ion is altijd gelijk aan de lading van dat ion.
• Edelgassen bezitten logischerwijze een oxidatiegtal van 0: ze hebben al een stabiele elektronenconfiguratie en willen dus geen elektronen meer opnemen of afgeven.
VOORBEELD OXIDATIEGETAL VAN EEN AANTAL ENKELVOUDIGE STOFFEN OF MONOATOMISCHE IONEN
O2- O2 Fe3+ Fe He -II 0 +III 0 0
Voor een samengestelde stof of een polyatomisch ion is de som van de oxidatiegetallen gelijk aan de lading van het deeltje.
De volgende oxidatiegetallen liggen vast en moet je dus kennen:
groep Ia = +I
groep IIa = +II
groep IIIa = +III F: -I O = -II (met uitzondering van de peroxiden)
Voor de metalen uit groep Ia, IIa en IIIa komt het oxidatiegetal dus overeen met de ionlading. Zo zal Mg in een verbinding een ionlading van 2+ hebben of een oxidatiegetal van +II.
Voor de a-groepen IVa tot en met VIIa is het hoogst mogelijke oxidatiegetal gelijk aan het groepsnummer. Het laagst mogelijke oxidatiegetal in atoomverbindingen is het groepsnummer min 8. Zo is het hoogst mogelijke oxidatiegetal van chloor dus +VII en het laagst mogelijke oxidatiegetal -I.
In thema 02 besprak je al de overgangselementen. Uit hun elektronenconfiguratie kun je afleiden dat de meeste overgangselementen een oxidatiegetal van +II of een ionlading van 2+ hebben. Zo is de elektronenconfiguratie van Zn: [18Ar] 3d10 4s2. Het afstaan van 2 elektronen levert een stabiele elektronenconfiguratie op, namelijk Zn2+: [18Ar] 3d10, waarbij het 3d-subniveau volledig bezet is.
Zilver vormt daar bijvoorbeeld een uitzondering op. Het enige mogelijke oxidatiegetal van zilver is +I (zilver heeft een ionlading van 1+), wat heel logisch is met een elektronenconfiguratie van [36Kr] 3d10 4s1. Het afstaan van 1 elektron levert de stabiele elektronenconfiguratie [36Kr] 3d10 op.
Voor oefeningen kan het handig zijn om een aantal veelvoorkomende oxidatiegetallen (of ionladingen) te kennen. De volgende tabel vat ze samen, maar is dus zeker niet volledig:
ELEMENT
MOGELIJKE OG IN IONVERBINDINGEN/ZOUTEN
MOGELIJKE IONLADINGEN
Fe +II, +III 2+, 3+
Cu +I, +II 1+, 2+
Ag +I
Pb +II, +IV 2+, 4+
Sn +II, +IV 2+, 4+
Mn +II, +III, +IV, +VI, +VII 2+, 3+, 4+, 6+, 7+
Cr +II, +III, +VI 2+, 3+, 6+
7 Een aantal veelvoorkomende oxidatiegetallen of ionladingen
VOORBEELD OXIDATIEGETALLEN IN IJZERSULFAAT (FeSO4) BEPALEN
FeSO4 zuurrest afkomstig van H2SO4 → SO42OG (Fe) + OG (S) + 4 · OG (O) = 0 OG (S) + 4 · OG (O) = 2OG (Fe) = +II (uit de lading van SO42- kun je dat afleiden) OG (S) + 4 · (-II) = 2-
Of: de ionlading van Fe is 2+.
De naam van de stof is dan ook ijzersulfaat.
OG (S) = +VI
Vorig schooljaar hebben we de verschillende anorganische of minerale stofklassen besproken. In de volgende tabel vind je de basisstructuur van elke stofklasse:
Functionele groepO OH H geen functionele groep
Algemene formuleMO of nMO MOH HZ MZ
Uitgang naam-oxide-hydroxide-ide -aat -iet -ide -aat -iet
M = metaal, nM = niet-metaal, O = zuurstof, H = waterstof, Z = zuurrest = nM of nMOx
8 De basisstructuur van anorganische stofklassen
Wanneer je de naam van verschillende anorganische stoffen bekijkt, valt het op dat je ze kunt indelen in 3 groepen:
Groep 1 Ionverbindingen met een beknopte naam
Wanneer het metaal maar 1 mogelijk oxidatiegetal of 1 mogelijke lading heeft, is de systematische naam als volgt: metaal + uitgang
Als je van stoffen die deze naamgeving volgen, de formule moet vormen op basis van een gegeven naam, moet je extra opletten. Je moet zelf het oxidatiegetal of de ionlading afleiden uit het PSE en dan de kruisregel nog toepassen. Zoals hoger aangegeven, kun je voor metalen kiezen of je gebruikmaakt van het oxidatiegetal of de ionlading. Dat komt namelijk op hetzelfde neer, alleen wordt het anders voorgesteld.
Als de index bij het metaal 1 bedraagt, vermeld je ʻmonoʼ niet bij dat metaal. TIP
VOORBEELD NAAM EN FORMULE VAN EEN AANTAL METAALOXIDEN MET EEN BEKNOPTE NAAM
Na2O natriumoxide Al2O3 aluminiumoxide
Van zowel natrium als aluminium kan maar 1 oxide gevormd worden. Het is daarom niet nodig om de coëfficiënten via Griekse telwoorden in de naam te vermelden.
Aangezien natrium in groep Ia staat, zal het 1 elektron willen afstaan om de edelgasconfiguratie te bereiken. Daarom is de ionlading 1+ en het oxidatiegetal +I. Vandaar dat de formule Na2O is, want zuurstof heeft een oxidatiegetal van -II of een ionlading van 2-.
Voor aluminium kun je een analoge redenering toepassen. Aluminium staat in groep IIIa. Het bezit dus 3 valentie-elektronen en wil die elektronen afstaan om een edelgasconfiguratie te bereiken. Aluminium kan dus alleen een ionlading van 3+ hebben of een oxidatiegetal van +III. Daarom is de formule van het oxide van aluminium dus Al2O3.
Groep 2 Ionverbindingen met een systematische naam en een stocknotatie
Voor ionverbindingen waarbij het metaal meerdere mogelijke ionladingen of oxidatiegetallen heeft, moet je gebruikmaken van deze naamgeving:
• systematische naam: Grieks telwoord + metaal + Grieks telwoord + uitgang;
• stocknotatie: metaal (Romeins cijfer van de lading of het OG van het metaal) + uitgang
VOORBEELD FORMULE, SYSTEMATISCHE NAAM EN STOCKNOTATIE VAN DE OXIDEN VAN IJZER
FeO ijzermonoxide of ijzer(II)oxide Fe2O3 di-ijzertrioxide of ijzer(III)oxide
Van ijzer bestaan er 2 mogelijke oxiden: de naam ‘ijzeroxide’ verwijst naar de mogelijke oxiden van ijzer. Ze kan dus slaan op zowel ijzermonoxide als di-ijzertrioxide. De naam ʻijzermonoxideʼ verwijst eenduidig naar FeO. En ʻdi-ijzertrioxideʼ hoort logischerwijze bij Fe2O3
Groep 3 De niet-metaaloxiden
Ook hier gebruik je de systematische naam, omdat niet-metalen telkens meerdere oxiden vormen:
• systematische naam: Griekse telwoord + niet-metaal + Grieks telwoord + oxide;
• stocknotatie: niet-metaal (OG van het niet-metaal) + uitgang
VOORBEELD NAAM EN FORMULE VAN DE OXIDEN VAN KOOLSTOF
CO koolstofmonoxide (of koolstof(II)oxide)
CO2 koolstofdioxide (of koolstof(IV)oxide)
Ook hier verwijst ‘koolstofoxide’ naar alle mogelijke oxiden van koolstof. Daarom moet je met Griekse telwoorden werken.
Je kunt hier ook gebruikmaken van de stocknotatie, maar omdat die naamgeving niet vaak gebruikt wordt, gaan we er niet te diep op in. Ter illustratie voegen we die naamgeving tussen haakjes toe.
Waar je bij de ionverbindingen gebruik kunt maken van zowel het oxidatiegetal als de ionlading, kun je bij atoomverbindingen enkel het oxidatiegetal gebruiken. Zoals hoger al aangegeven, komt dat door het wezenlijke verschil tussen een ionbinding en een atoombinding. Bij een ionbinding worden er elektronen overgedragen, waardoor er ionen ontstaan en het oxidatiegetal dus overeenkomt met de ionlading (op een verschil in notatie na). Maar bij de atoomverbindingen worden er elektronen gedeeld. Daar ontstaan er dus geen ionen en kun je bijgevolg niet van een ionlading spreken. Daarom kun je daar dus alleen het oxidatiegetal gebruiken.
Helaas sterven er elk jaar nog verschillende mensen in België aan een CO-vergiftiging. CO is een geur- en kleurloos gas dat ontstaat bij een onvolledige vebranding. Goed verluchten en verwarmingsinstallaties regelmatig laten nakijken zijn geen overbodige luxe. En eigenlijk is een CO-melder essentieel wanneer je verwarmt op gas of met een open haard …

2.1
Naam- en formulevorming
De algemene formule van een oxide is MO of nMO, waarbij O2- de functionele groep is. Bij de oxiden komen de 3 groepen van naamvorming voor. In tabel 9 is er per groep een voorbeeld opgenomen: FORMULE
Na2O natriumoxide / Cu2O dikoperoxide koper(I)oxide
N2O3 distikstoftrioxide (stikstof(III)oxide)
Tabel 9 De formule, systematische naam en (eventuele) stocknotatie van een aantal oxiden
Wanneer je de formule voor natriumoxide moet vormen uit de gegeven naam, mag je niet vergeten om via het PSE de ionlading of het oxidatiegetal van natrium te bepalen, vervolgens de kruisregel toe te passen en eventueel te vereenvoudigen:
Na2 O +I -II
Ga naar en bekijk de toepassingen en het voorkomen van enkele oxiden en waterstofperoxide.
Waterstofperoxide
Er is 1 groep van moleculen waarbij het oxidatiegetal van zuurstof niet -II, maar -I is: de peroxiden. Dat is logisch, aangezien er telkens 2 zuurstofatomen aan elkaar gebonden zijn. Een peroxide dat je misschien kent, is waterstofperoxide H2O2. Die stof is bij veel mensen beter bekend onder de gebruiksnaam zuurstofwater
In de onderstaande lewisstructuur is aangegeven hoe de elektronen in waterstofperoxide verdeeld zijn en verschuiven als gevolg van het verschil in elektronegatieve waarde:
Afb. 95 Verklaring van het oxidatiegetal van -I voor zuurstof op basis van de lewisstructuur en de elektronenverschuiving in waterstofperoxide. De pijlen stellen GEEN datieve binding voor.
Uit de lewisstructuur kun je afleiden hoe het komt dat zuurstof hier een oxidatiegetal van -I heeft. Een ongebonden zuurstofatoom heeft 6 valentie-elektronen. In deze molecule krijgt elk zuurstofatoom, door de verschuiving van de bindende elektronenparen, 7 elektronen toegewezen. Daarom is het oxidatiegetal dus -I.
Chemische reacties met oxiden
Je hebt misschien weleens van zure regen gehoord. Natuurlijk regenwater is door de reactie van onder andere CO2 met water ook zuur, maar door menselijke activiteiten is de pH van regenwater nog zuurder geworden. Een aantal niet-metaaloxiden zijn daarvoor verantwoordelijk. Niet-metaaloxiden reageren met water tot een ternair zuur Daarom worden niet-metaaloxiden ook zuurvormende oxiden genoemd.
Algemeen kun je die reactie voorstellen door het volgende reactiepatroon:
nMO + H2O → HnMO

VOORBEELD VORMING VAN EEN AANTAL TERNAIRE ZUREN UIT NIET-METAALOXIDEN
We hebben bij elk van deze reacties het oxidatiegetal van het specifieke niet-metaal toegevoegd, om aan te tonen dat het behouden blijft.
CO2 + H2O → H2CO3
OG (C) = +IV
OG (C) = +IV
SO2 + H2O → H2SO3
OG (S) = +IV
OG (S) = +IV
SO3 + H2O → H2SO4
OG (S) = +VI
OG (S) = +VI
In tegenstelling tot de niet-metaaloxiden zijn de metaaloxiden basevormende oxiden
Metaaloxiden reageren met water tot een hydroxide. De pH van die oplossing is groter dan 7, dus basisch. Ook bij die reactie verandert het oxidatiegetal van het metaal niet. Enkel metaaloxiden met metalen uit groep Ia en IIa zullen die reactie ondergaan. Andere metaaloxiden zijn namelijk niet oplosbaar in water.
Algemeen kun je die reactie voorstellen door het volgende reactiepatroon: MO + H2O → MOH
VOORBEELD VORMING VAN GEBLUSTE KALK UIT ONGEBLUSTE KALK
Door deze reactie wordt ongebluste kalk (calciumoxide) omgezet in gebluste kalk (calciumhydroxide):
CaO + H2O → Ca(OH)2 OG (Ca) = +II OG (Ca) = +II
Niet alle oxiden volgen die indeling. Zo zijn er oxiden die niet met water reageren, de zogenoemde indifferente oxiden, zoals N2O, CO en MnO2. Maar er zijn ook oxiden die afhankelijk van de reactiepartner zowel zuur als basisch kunnen reageren. Dat zijn de amfotere oxiden, zoals Al2O3, ZnO en PbO2. (ἀμφοτερος, amfoteros, is Grieks voor ʻbeideʼ.)
In hoofdstuk 2 gaan we dieper in op een aantal fysische eigenschappen van de oxiden.
2.2 De hydroxiden: naam- en formulevorming
De algemene formule van een hydroxide is MOH, waarbij OH- de functionele groep is. De naam- en formulevorming is analoog aan die van de metaaloxiden, maar uiteraard gebruik je ‘-hydroxide’ als uitgang in plaats van ‘-oxide’. Een hydroxide kan niet alleen starten met een metaalion, maar ook met een ammoniumion of NH4+
In tabel 10 kun je een aantal voorbeelden van hydroxiden terugvinden:
FORMULE
SYSTEMATISCHE NAAM STOCKNOTATIE
Ca(OH)2 calciumhydroxide / Pb(OH)4 loodtetrahydroxide lood(IV)hydroxide NH4OH ammoniumhydroxide /
Tabel 10 De formule, systematische naam en eventuele stocknotatie van een aantal hydroxiden
Wanneer een afvoer verstopt is, kun je die ontstoppen door er een oplossing van NaOH in te gieten (die in water dissocieert in Na+ en OH-). De oplossing breekt het haar, dat samengeklit is met zeepresten, af. Pas wel op als je de stof gebruikt, want ze kan ook brandwonden veroorzaken!
Wanneer je een te grote hoeveelheid ontstopper gebruikt, kan de afvoerleiding zelf ook aangetast worden door de dissociatiewarmte.
Afb 97 Ontstopper lost haren en zeepresten op.
Deze reactie is ook een exotherme reactie: een reactie waarbij energie vrijkomt.
Ga naar en bekijk de toepassingen en het voorkomen van enkele hydroxiden.
*Eigenlijk is het correcter om te zeggen dat HCN een pseudo-binair zuur is (zie weetjeskader).
De algemene formule van een zuur is HZ, waarbij H+ de functionele groep is. Je kunt de zuren indelen in 2 grote groepen: de binaire en de ternaire zuren. Bij de binaire zuren is er geen zuurstofatoom in de zuurrest aanwezig, in tegenstelling tot bij de ternaire zuren, waar er minstens 1 zuurstofatoom in de zuurrest aanwezig is.
In de binaire zuren (HnM) heeft het specifieke niet-metaal het laagst mogelijke oxidatiegetal (= groepsnummer – 8). De naam eindigt altijd op -ide
FORMULE BINAIR ZUURSYSTEMATISCHE NAAMFORMULE ZUURREST NAAM ZUURREST
HF waterstoffluorideF- fluoride-ion
HCl waterstofchloride Cl- chloride-ion
HBr waterstofbromideBr- bromide-ion
HI waterstofjodideI- jodide-ion
H2S waterstofsulfideS2- sulfide-ion
HCN* waterstofcyanideCN- cyanide-ion
Tabel 11 Binaire zuren en zuurresten
Waterstofchloride staat beker bekend onder de triviale naam zoutzuur en waterstofcyanide als blauwzuur
Waterstofcyanide (HCN) of blauwzuur is een zeer giftig zuur. Hoewel dat zuur een koolstofatoom bevat, behoort het niet tot de organische zuren. De organische zuren bevatten -COOH als karakteristieke groep. Vroeger dacht men dat cyaan 1 atoom was. Daarom deelde men het in bij de binaire zuren.

Blauwzuur werd in de Tweede Wereldoorlog gebruikt in verschillende gaskamers. Je hebt misschien al gehoord van Zyklon B, waarbij de B naar blauwzuur verwijst. Blauwzuur verstoort de ATP-productie in de mitochondriën. Tijdens de lessen biologie ga je ongetwijfeld dieper in op de productie van ATP. Niet alleen het zuur is giftig, maar ook zouten van blauwzuur zijn giftig. Het is geen fabeltje dat er in kersenpitten cyanide zit. Het inslikken van een kersenpit is echter niet onmiddellijk gevaarlijk: het zijn kapotte pitten waarvoor je moet opletten.
Het kaliumzout van blauwzuur werd vaak door spionnen of oorlogsmisdadigers gebruikt om zelfmoord te plegen. Onder andere Himmler en Goebbels namen het in, en meer recent Praljak. Ook verschillende films, zoals Mission Impossible, verwijzen naar de stof. De dodelijke dosis van kaliumcyanide of cyaankali (KCN) voor een gemiddelde mens is minder dan een gram: de LD50 (Lethal Dose 50, de waarde waarbij 50 % van de mensen sterft bij inname) ligt op 2,857 mg kg lichaamsgewicht .
De lijst met ternaire zuren (HnMO) is veel uitgebreider dan die van de binaire zuren. Als je de naam en formule van de stamzuren goed kent, kun je die van de afgeleide zuren gemakkelijk zelf bepalen. De stamzuren, of ‘-aatzuren’, zijn de meest voorkomende ternaire zuren.
FORMULE TERNAIR STAMZUUR SYSTEMATISCHE NAAM TRIVIALE NAAM
FORMULE ZUURREST NAAM ZUURREST
HNO3 waterstofnitraatsalpeterzuurNO3- nitraation
H2CO3 waterstofcarbonaatkoolzuur CO32- carbonaation
H2SO4 waterstofsulfaatzwavelzuurSO42- sulfaation
H3PO4 waterstoffosfaatfosforzuurPO43- fosfaation
HClO3 waterstofchloraatchloorzuur ClO3- chloraation
HBrO3 waterstofbromaatbroomzuurBrO3- bromaation
HIO3 waterstofjodaatjoodzuurIO3- jodaation
Door de stapsgewijze ionisatie van zuren ontstaan er zuurresten met nog 1 of meerdere waterstofatomen, zoals HCO3-, het waterstofcarbonaation. Voor fosforzuur zijn er 3 mogelijke zuurresten, namelijk H2PO4-, HPO42- en PO43-. Per waterstofatoom dat verwijderd wordt, krijgt de zuurrest een extra lading van 1-. In de naam van de zuurrest wordt (indien nodig) het aantal waterstoffen vermeld. De juiste naam voor H2PO4- is bijgevolg het diwaterstoffosfaation. Met die zuurresten worden waterstofzouten gevormd (zie verder).
VOORBEELD STAPSGEWIJZE IONISATIE VAN KOOLZUUR EN FOSFORZUUR
H2CO3 + H2O → HCO3- + H3O+ waterstofcarbonaation
HCO3- + H2O → CO32- + H3O+ carbonaation
H3PO4 + H2O → H2PO4- + H3O+ diwaterstoffosfaation
H2PO4- + H2O → HPO42- + H3O+ waterstoffosfaation
HPO42- + H2O → PO43- + H3O+ fosfaation
Van verschillende ternaire zuren bestaan er afgeleide zuren, omdat ze meer of minder zuurstofatomen in de formule hebben in vergelijking met het stamzuur. De formule van die afgeleide zuren ziet er hetzelfde uit als die van de stamzuren, alleen verschilt het aantal zuurstofatomen.
BRUTOFORMULESYSTEMATISCHE NAAMTRIVIALE NAAMZUURREST NAAM ZUURREST
HClO4 waterstofperchloraat perchloorzuur ClO4- perchloraation
HClO3 waterstofchloraat chloorzuur ClO3- chloraation
HClO2 waterstofchloriet chlorigzuur ClO2- chlorietion
HClO waterstofhypochloriethypochlorigzuur ClO- hypochlorietion
Tabel 13 Afgeleide zuren en zuurresten
Ga naar en bekijk de toepassingen en het voorkomen van enkele zuren.
Wanneer het afgeleide zuur 1 zuurstofatoom meer bevat dan het stamzuur, dan voeg je ‘per-’ toe in de naam. Denk maar aan iemand die hyPER is: die heeft te veel energie (hier dus: ‘te veel’ zuurstofatomen).
Wanneer het afgeleide zuur 1 zuurstofatoom minder bevat dan het stamzuur, dan vervang je de stamuitgang ‘-aat’ door ‘-iet’ (of ‘-ig’ in de triviale naam).
Wanneer het afgeleide zuur nog een zuurstofatoom minder bevat, dan voeg je ‘hypo-’ … ‘-iet’ toe in de naam (en ‘hypo-’ … ‘-ig’ in de triviale naam).
Denk maar aan hypoglycemie: dat is een te lage bloedsuikerspiegel.
Hier dus: ‘te weinig’ zuurstofatomen. Enkel van de ternaire zuren met chloor, broom of jood bestaan die 3 verschillende afgeleide zuren.
Het totale overzicht van ternaire zuren ziet er als volgt uit. De stamzuren zijn vetgedrukt.
BRUTOFORMULESYSTEMATISCHE NAAMTRIVIALE NAAMZUURREST NAAM ZUURREST
H2CO3* waterstofcarbonaatkoolzuur CO32- carbonaation
HNO3 waterstofnitraatsalpeterzuurNO3- nitraation
HNO2 waterstofnitrietsalpeterigzuurNO2- nitrietion
H3PO4 waterstoffosfaatfosforzuurPO43- fosfaation
H3PO3 waterstoffosfietfosforigzuurPO33- fosfietion
H3PO2 waterstofhypofosfiethypofosforigzuurPO23- hypofosfietion
H2SO4 waterstofsulfaatzwavelzuurSO42- sulfaation
H2SO3* waterstofsulfietzwaveligzuurSO32- sulfietion
HClO4 waterstofperchloraatperchloorzuur ClO4- perchloraation
HClO3 waterstofchloraatchloorzuur ClO3- chloraation
HClO2 waterstofchlorietchlorigzuur ClO2- chlorietion
HClO waterstofhypochloriethypochlorigzuur ClO- hypochlorietion
* instabiele zuren die ontbinden met gasontwikkeling Tabel 14 Stamzuren, afgeleide zuren en hun zuurresten
De afgeleide zuren van HBrO3 en HIO3 zijn volledig analoog aan die van HClO3.
Naam- en formulevorming
De algemene formule van een zout is MZ. De naamgeving verloopt analoog aan die van de metaaloxiden en hydroxiden. De uitgang is echter minder eenvoudig: daarvoor moet je de zuren zeer goed kennen.
FORMULE
SYSTEMATISCHE NAAM STOCKNOTATIE
Ca(IO4)2 calciumperjodaat / Sn(NO2)2 tindinitriet tin(II)nitriet
Ag2S zilversulfide / KCN kaliumcyanide / Pb(SO3)2 looddisulfiet lood(IV)sulfiet
Tabel 15 De formule, systematische naam en eventuele stocknotatie van een aantal zouten
Het actieve bestanddeel van bleekwater is natriumhypochloriet NaClO. Bleekwater wordt vaak als poetsmiddel gebruikt vanwege zijn ontsmettende en blekende werking. Pas tijdens het poetsen (of het behandelen van het zwembadwater) wel op dat je bleekwater niet mengt met een zuur. Want dan kan het giftige chloorgas ontstaan. Jaarlijks gebeuren daar vaak ongelukken mee: veel ontkalkers bevatten zuren. Aangezien chloorgas zwaarder is dan lucht, zal het zich tegen de grond ophopen, waardoor je er heel gemakkelijk door bevangen wordt. Het gas werd tijdens de Eerste Wereldoorlog vaak gebruik omdat het in de loopgraven bleef hangen.
Als je tijdens het poetsen met bleekwater op je kleding morst, resulteert dat in vlekken die je er niet meer uitkrijgt omdat de kleur door het bleekwater weggehaald is. Het is echter geen goed idee om je haar of tanden te bleken met de stof. Afhankelijk van de concentratie zul je lichte irritatie tot een ernstige brandwonde ervaren.
Ook in het dagelijks leven is je kennis van chemie dus cruciaal. Zo is het essentieel om altijd naar de gevarenlogo’s op huishoudproducten te kijken, niet zomaar verschillende producten te mengen en zeker extra op te letten wanneer er een veiligheidsdop op de fles staat.
Wanneer het zuur niet volledig geïoniseerd is en de zuurrest nog 1 of meerdere waterstofatomen bevat, spreek je van waterstofzouten
Het bekendste voorbeeld is natriumwaterstofcarbonaat of natriumbicarbonaat NaHCO3, ook wel gekend als bakpoeder
In sommige gevallen moet je het aantal waterstofatomen vermelden:
Na2HPO4 natriumwaterstoffosfaat
NaH2PO4 natriumdiwaterstoffosfaat
Let op: NH4Cl is geen waterstofzout, maar een ammoniumzout. De waterstofatomen behoren nu eenmaal niet tot de zuurrest.
WEETJE
Bicarbonaat helpt ook om de verzuring van spieren tegen te gaan tijdens intensieve inspanningen. Wielrenners gebruiken het dan ook vaak om hun prestaties te verbeteren. Ze nemen het gemengd met andere producten in.
Naar: sporza.be, 28/03/2023
Er zijn zouten die zo’n grote affiniteit hebben voor water, dat ze water uit de lucht opnemen in hun kristalrooster. Ze vormen zo hydraten. Het opgenomen water noem je kristalwater. Hydraten worden dan ook vaak als vochtvreter gebruikt of om bij organische reacties het laatste water uit het reactiemengsel te verwijderen. Ook al nemen ze veel water op, toch blijven sommige hydraten vaste stoffen. Het aantal moleculen water dat per formule-eenheid aanwezig is, wordt in de formule aangegeven:
Na2CO3 10 H2O natriumcarbonaat decahydraat
Wanneer je die zouten verwarmt, zal het water verdampen en bekom je het anhydraat (letterlijk: ‘zonder water’) van het hydraat.
Na2CO3 10 H2O → Na2CO3 + 10 H2O
De eigenschappen van het hydraat zijn vaak totaal anders dan die van het anhydraat. Je zou misschien denken dat het hydraat minder sterk is, maar soms is het net het tegenovergestelde. Zo is gips een hydraat van CaSO4. Als je water toevoegt aan CaSO4 en het geheel vervolgens laat uitharden, ontstaat er een extra stevige stof: calciumsulfaat dihydraat of CaSO4 2 H2O.
Soms heeft de gehydrateerde vorm een andere kleur. Die eigenschap kun je gebruiken om de aanwezigheid van water aan te tonen. Wanneer je blauw CoCl2 in aanraking brengt met een stof die water bevat, verandert de kleur naar roze, doordat CoCl2 . 6 H2O gevormd wordt. Je kunt dus kobaltdichloride gebruiken als indicator voor water. Hoewel die stof ten strengste verboden is in schoollabo’s, kun je ze wel nog aantreffen in DIY-projecten. Pas dus zeker en vast goed op als je die gevaarlijke stof gebruikt.
Analoog kun je wit kopersulfaat gebruiken. In aanwezigheid van water wordt een blauw hydraat CuSO4 5 H2O gevormd.



DDubbelzouten
Naast hydraten en waterstofzouten is er nog een laatste specifieke groep bij de zouten: de dubbelzouten. Dat zijn zouten met 2 verschillende metaalionen of met 2 verschillende zuurresten.
Bij de naamgeving zet je de positieve ionen meestal alfabetisch, alhoewel men er soms voor kiest om eerst de eenwaardige ionen te vermelden.
De eigenschappen van die zouten verschillen van de eigenschappen van de afzonderlijke zouten. Bij het uitkristalliseren van een oplossing die beide zouten bevat, ontstaat een kristal met een specifieke schikking van de verschillende ionen en dus ook specifieke interacties en eigenschappen.
Mohrs zout of ammoniumijzer(II)sulfaat hexahydraat (NH4)2Fe(SO4)2 6 H2O wordt in een labo gebruikt om de concentratie van andere stoffen te bepalen. Mohrs zout is veel stabieler dan zijn samenstellende zouten, doordat het veel beter bestand is tegen oxidatie. Het is trouwens zowel een dubbelzout als een hydraat.

Ga naar en bekijk de toepassingen en het voorkomen van enkele zouten.
Te kennen oxidatiegetallen in samengestelde stoffen: groep Ia: +I groep IIa: +II groep IIIa: +III F: -I O: -II of -I in een peroxide
Oxiden: MO of nMO
MO:
• beknopte naamgeving
• Griekse telwoorden of stocknotatie
• zijn basevormende oxiden: MO + H2O → MOH
nMO:
• Griekse telwoorden (of stocknotatie)
• waterstofperoxide of zuurstofwater: H2O2
• zijn zuurvormende oxiden: nMO + H2O → HnMO
Hydroxiden: MOH
• beknopte naamgeving
• Griekse telwoorden of stocknotatie
Zuren: HZ
• binaire zuren: HnM
• blauwzuur of waterstofcyanide: HCN
• ternaire zuren: HnMO
FORMULE BINAIR STAMZUUR SYSTEMATISCHE NAAM TRIVIALE NAAM FORMULE ZUURREST NAAM ZUURREST
HNO3 waterstofnitraatsalpeterzuurNO3- nitraation
H2CO3 waterstofcarbonaatkoolzuur CO32- carbonaation
H2SO4
H3PO4
Ga naar en bekijk ook de ontdekplaat over anorganische stoffen.
waterstofsulfaatzwavelzuurSO42- sulfaation
waterstoffosfaatfosforzuurPO43- fosfaation
HClO3 waterstofchloraatchloorzuur ClO3- chloraation
HBrO3 waterstofbromaatbroomzuurBrO3- bromaation
HIO3 waterstofjodaatjoodzuurIO3- jodaation
BRUTOFORMULESYSTEMATISCHE NAAMTRIVIALE NAAMZUURREST NAAM ZUURREST
HClO4
HClO3
HClO2
HClO
Zouten: MZ
waterstofperchloraat perchloorzuur ClO4- perchloraation
waterstofchloraat chloorzuur ClO3- chloraation
waterstofchloriet chlorigzuur ClO2- chlorietion
waterstofhypochloriethypochlorigzuur ClO- hypochlorietion
• beknopte naamgeving
• Griekse telwoorden of stocknotatie
• waterstofzouten: in de zuurrest zijn er 1 of meerdere waterstofatomen aanwezig
• hydraten: water wordt mee opgenomen in het kristalrooster
• dubbelzouten: bevatten verschillende soorten metalen en/of verschillende soorten zuurresten
Aluin is de verzamelnaam voor dubbelzouten van sulfaten, genoemd naar KAl(SO4) 12 H2O. De naam van de andere zouten in die groep vorm je door eerst het eenwaardige positieve ion te zetten, gevolgd door de naam van het driewaardige ion: NH4Fe(SO4)2 12 H2O ammoniumijzer(III)aluin of ammoniumijzer(III)sulfaat dodecahydraat
(De Griekse telwoorden gaan natuurlijk verder dan 10. Zo is 12 in het Grieks dodeca. Letterlijk wil dat zeggen: 2 + 10.)
Aluin wordt tegenwoordig vooral gebruikt om kleine bloedingen, veroorzaakt tijdens het scheren, te stelpen. Het kan ook gebruikt worden tegen zweetvoeten of als deodorant. Aluin zorgt ervoor dat de poriën samentrekken, waardoor je minder gaat zweten. Verder zorgt het er ook voor dat de pH-waarde van de huid daalt. Daardoor kunnen de bacteriën die voor de onaangename zweetgeur zorgen, zich minder goed ontwikkelen. Het werkt met andere woorden antibacterieel.


Bepaal het oxidatiegetal van deze stoffen via de lewisstructuur:
a NH3
b N2O5
c H3PO4
Wat is de ionlading van Ti in Ti3K4O3S2?
Noteer telkens de juiste formule van deze anorganische stoffen:
a het oxide van stikstof waarbij stikstof het hoogst mogelijke oxidatiegetal heeft
b het ternaire zuur van chloor waarbij chloor zijn hoogst mogelijke oxidatiegetal heeft
c het hydroxide van zink
d een waterstofzout van zwavel en een alkalimetaal
Noteer telkens het gevraagde:
a de stocknotatie van ijzermonosulfiet
b de systematische naam van Ba(OH)2
c de formule van zinkhypofosfiet
d de systematische naam van koper(II)nitraat
e de formule van magnesiumperjodaat
f de stocknotatie van roest
Vervolledig deze reacties:
a P2O5 + H2O → ?
b Na2O + H2O → ?
c ? + ? → HNO2
d Cl2O7 + H2O → ?
e BaO + H2O → ?
f ? + ? → KOH
Wat is de waarde van n in NaKAlO n Cl?
Bepaal het oxidatiegetal van de vetgedrukte elementen in deze formules:
a Ar
b H2O2
c Cu(NO3)2
d Mn2+
e Pb(OH)4
f HBrO4
Noteer van de onderstaande stoffen telkens:
a de formule
b de systematische naam
c de stocknotatie
d de stofklasse
Stoffen:
aluminiumoxide – HIO – bariumnitriet –ijzer(III)cyanide – Mn(OH)7 – SO3 –
calciumwaterstofcarbonaat – ammoniumsulfiet –mangaandicarbonaat – KH2PO4
HOOFDSTUK 2
De kristalstructuur van edelstenen en metalen spreekt veel mensen aan: je wordt als het ware betoverd door de schoonheid van de natuur. Denk maar aan onder andere diamanten, die vaak gebruikt worden in juwelen. Maar hoe komt het dat metalen glanzen en plooibaar zijn, terwijl edelstenen wel glanzen, maar niet plooibaar zijn? De verklaring daarvoor is heel vaak te vinden in hun roosterstructuur.
LEERDOELEN
L De polariteit van bindingen en verbindingen bepalen
L De fysische eigenschappen van anorganische stoffen, zoals kookpunt en oplosbaarheid, verklaren aan de hand van de aanwezige intermoleculaire krachten
De voorbije jaren leerde je al over een aantal eigenschappen van stoffen. Sommige eigenschappen verklaarde je door de roosterstructuur van de vaste stof, terwijl je voor andere eigenschappen je kennis van polariteit en intermoleculaire krachten nodig had. We frissen die kennis eerst op en breiden daarna een aantal eigenschappen verder uit.
Er zijn 4 verschillende roostertypes mogelijk: metaalroosters, ionroosters, atoomroosters en molecuulroosters. De benaming van de verschillende types zit zeer logisch in elkaar: die verwijst naar het type deeltje dat op de hoekpunten van het kristalrooster zit.
Ga naar en bekijk de ontdekplaat over roosters en hun toepassingen. A
Metaalrooster
Het spreekt voor zich dat dit rooster bij de metalen optreedt. Op de hoekpunten van het rooster zitten metaalionen, met ertussen vrij bewegende elektronen
positieve metaalionen vrij bewegende elektronen die tot geen enkel metaalion behoren

De sterke krachten tussen de elektronen en de metaalionen zorgen ervoor dat metalen vaste stoffen zijn bij kamertemperatuur, met uitzondering van kwik. De elektronen en metaalionen hebben een tegengestelde lading, wat resulteert in een sterke aantrekkingskracht.
De elektronen zorgen ook voor de typische glans van metalen.
Ionrooster
De ionverbindingen schikken zich volgens een ionrooster.
Daarbij zitten afwisselend positieve en negatieve ionen op de hoekpunten van het rooster.
Die stoffen zijn altijd vast bij kamertemperatuur, aangezien er sterke coulombkrachten overwonnen moeten worden.
Bij hydraten worden er 1 of meerdere watermoleculen opgenomen tussen de ionen.
Atoomrooster
Op de hoekpunten van dit rooster zitten atomen. Bij zowel grafiet als diamant zijn dat koolstofatomen. Maar ook fullereen is enkel opgebouwd uit C-atomen. Op basis van die roosterschikking kun je bijvoorbeeld heel goed het verschil in eigenschappen tussen grafiet en diamant verklaren. Zo geleidt grafiet de elektrische stroom heel goed en diamant niet.
De verklaring daarvoor leer je verderop in dit hoofdstuk.

diamant grafiet fullereen
Naast de mooie roosterstructuur van grafiet en diamant bestaat er ook amorfe koolstof.
Daarbij is er geen regelmatige schikking van de koolstofatomen aanwezig. Voorbeelden zijn roet, houtskool en actieve kool.

Molecuulrooster
Naast het atoomrooster komt bij moleculaire verbindingen ook het molecuulrooster voor. Daarbij zitten er volledige moleculen op de roosterpunten.
Die stoffen hebben eerder een laag kook- en smeltpunt, doordat er enkel zwakke intermoleculaire krachten verbroken moeten worden. Daarom zijn ze eerder vloeibaar of gasvormig bij kamertemperatuur. Maar sommige stoffen, zoals I2, zijn vaste stoffen bij kamertemperatuur. Dat komt door de grote molaire massa van I2. Bij de bespreking van de intermoleculaire krachten (paragraaf 1.3) gaan we daar verder op in.
Om verschillende stofeigenschappen te verklaren, moet je weten of een verbinding polair of apolair is. Een verbinding is opgebouwd uit 1 of meerdere bindingen, die ook polair of apolair zijn.
De krachten tussen de atomen zijn de intramoleculaire krachten, terwijl de krachten tussen de moleculen de intermoleculaire krachten zijn.
intramoleculaire kracht een verbinding of molecule een binding intermoleculaire kracht
Afb. 116 Intramoleculaire krachten zijn krachten tussen de atomen in een verbinding, terwijl intermoleculaire krachten tussen moleculen onderling optreden.
De elektronegatieve waarde geeft aan hoe hard een atoom aan de elektronen van een binding trekt. Wanneer 2 elementen een verschillende elektronegatieve (EN) waarde hebben, verschuiven de elektronen naar het element met de hoogste elektronegatieve waarde. Daardoor wordt het element met de hoogste elektronegatieve waarde gedeeltelijk of partieel negatief geladen en het element met de laagste elektronegatieve waarde gedeeltelijk positief geladen: de binding is polair. De waarde ∆EN moet voldoende groot zijn om een polaire binding te hebben:
∆EN < 0,5 → binding is apolair
∆EN > 0,5 → binding is polair
Afb 117 Het verband tussen het verschil in elektronegatieve waarde en het soort binding. Dat is geen strikte indeling, maar eerder een continuüm.
In thema 03 haalden we al aan dat het verschil tussen een atoombinding en een ionbinding geen zwart-witverhaal is, maar dat je dat eerder als een continuüm moet zien. Die indeling kun je verder aanvullen met de polariteit van de bindingen. Een ionbinding is dus ook een polaire binding. TIP
VOORBEELD POLAIRE EN APOLAIRE BINDINGEN
• F-F ∆EN = 0 → binding is apolair
Aangezien beide atomen even hard aan de bindende elektronen trekken, is er geen verschuiving van het elektronenpaar en zal de binding dus apolair zijn.
• H-Cl ∆EN > 0,5 → binding is polair
Afb 118 Door het verschil in EN tussen de elementen waterstof en chloor verschuiven de elektronen van de atoombinding in de richting van het element chloor. Daardoor krijgt het element waterstof een partieel positieve lading en het element chloor een partieel negatieve lading.
De ladingsvector (pijl) wijst naar het element met de hoogste EN-waarde, in dit voorbeeld chloor. Het bindende elektronenpaar schuift in die richting op. Daardoor wordt het element met de hoogste EN-waarde gedeeltelijk negatief (δ-), terwijl het andere element gedeeltelijk positief (δ+) wordt.
De binding is dus polair: de ene kant van de binding is immers gedeeltelijk negatief geladen en de andere kant van de binding gedeeltelijk positief geladen.
Polariteit van verbindingen
Het schema geeft weer hoe je bepaalt of een verbinding polair of apolair is. Als alle bindingen in een molecule apolair zijn, zal de verbinding zelf ook apolair zijn. Zijn er 1 of meerdere polaire bindingen aanwezig, dan bepaalt de structuur van de molecule of de verbinding zelf polair of apolair is.
Polaire bindingen aanwezig?
verbinding = apolair
Centrum negatieve en positieve deelladingen vallen samen?
verbinding = polair
HCl is een polaire molecule. In het voorbeeld op p. 180 zag je al dat de binding polair is. Aangezien er maar 1 binding aanwezig is, zal de molecule ook polair zijn. De kant van waterstof is partieel positief geladen en die van chloor partieel negatief geladen. Er zijn dus 2 polen in de molecule: het is een polaire molecule of een dipoolmolecule.
VOORBEELD POLAIRE EN APOLAIRE MOLECULEN
• Water is een polaire molecule of dipoolmolecule.
verbinding = apolair
Het sterisch getal van zuurstof is 4 door de aanwezigheid van 2 bindingspartners en 2 vrije elektronenparen. Daardoor heeft zuurstof een sp3-hybridisatie en is de geometrie rond het zuurstofatoom tetragonaal. EN (O) = 3,5 EN (H) = 2,1
120 Water is geen lineaire, maar een geknikte molecule. Beide bindingen zijn polair.
De ladingscentra vallen niet samen en de som van de vectoren is niet 0. Daarom is de molecule polair.
Door het verschil in elektronegatieve waarde verschuift de elektronenwolk naar O, en dat voor elk van de bindingen. Daarom zijn er 2 polaire bindingen. Voor elk van de bindingen geldt dat de kant van O gedeeltelijk negatief geladen is en die van H gedeeltelijk positief geladen. Bij deze molecule vallen de ladingscentra niet samen en is de som van de ladingsvectoren verschillend van 0. Daarom is de verbinding polair.
Open de applet en onderzoek het effect van de elektronegatieve waarde en de ruimtelijke schikking op de grootte van het dipoolmoment van de bindingen en de molecule.
Als water een lineaire molecule was, zou ze apolair zijn. Dan zou het negatieve ladingscentrum immers samenvallen met het positieve ladingscentrum, of de som van de ladingsvectoren zou gelijk zijn aan 0.
δ+ 2δ-
• Koolstofdioxide is een apolaire molecule. Het sterisch getal van koolstof is 2: het heeft 2 bindingspartners en geen vrije elektronenparen. Daardoor heeft koolstof een sp-hybridisatie en is de geometrie rond het koolstofatoom lineair.
EN (O) = 3,5 EN (C) = 2,5
Afb 123 Koolstofdioxide is een lineaire molecule. De 4 bindingen zijn polair. De ladingscentra vallen samen en de som van de vectoren is 0. Daarom is de molecule apolair.
De elektronenwolk verschuift naar O, en dat voor elk van de bindingen. Daarom zijn er 4 polaire bindingen. Voor elk van de bindingen geldt dat de kant van O gedeeltelijk negatief geladen is en die van C gedeeltelijk positief geladen. Wanneer je naar de hele molecule kijkt, valt het op dat de ladingscentra van de positieve en negatieve deelladingen samenvallen op C en dat de som van de vectoren 0 is. Daarom is CO2, ondanks de aanwezigheid van 4 polaire bindingen, toch een apolaire molecule.
TIP
Op basis van de verschuiving van de elektronen kun je verklaren waarom het oxidatiegetal van C in CO2 +IV is.
De juiste ruimtelijke structuur voor een molecule is dus essentieel! Je ziet onmiddellijk in waarom je de kennis uit de vorige thema's nodig hebt: uit de juiste lewisstructuur bepaal je de ruimtelijke structuur. Die heb je dan weer nodig om de polariteit van een verbinding te bepalen.
Intramoleculaire krachten zijn de krachten in een molecule, dus tussen atomen. Die krachten zijn veel sterker dan de intermoleculaire krachten, waardoor je dus meer energie moet toevoegen om ze te verbreken. De sterkte van die krachten (of bindingsenergie) hebben we in thema 03 besproken. Wanneer ze verbroken worden, treedt er een chemische reactie op.
Intermoleculaire krachten zijn de krachten die tussen moleculen optreden. Dat zijn de krachten die verbroken worden bij fysische processen zoals het smelten van een stof. Kennis van de sterkte van die krachten heb je dus nodig om het verschil in kook- en smeltpunt tussen stoffen te kunnen verklaren.
intermoleculaire kracht
intramoleculaire kracht H O H
Afb. 124 Het voorkomen van inter- en intramoleculaire krachten in water. Wanneer je de intermoleculaire krachten verbreekt, laat je water smelten. Het verbreken van de intramoleculaire krachten gebeurt bij de elektrolyse van water.
Bij apolaire moleculen is de londonkracht de enige intermoleculaire kracht die aanwezig is. Doordat elektronen continu in beweging zijn, kan dat resulteren in een tijdelijke onevenwichtige verdeling van de elektronenwolk. Daardoor zal de ene kant van de molecule een heel klein beetje positief worden en de andere kant een heel klein beetje negatief. Dat noem je geïnduceerde dipolen. Die zorgen ervoor dat de moleculen elkaar aantrekken. Hoe groter een molecule is, hoe groter de elektronenwolk, hoe gemakkelijker polariseerbaar de molecule, en dus hoe groter de london- of london-dispersiekracht.
asymmetrische verdeling van elektronen
symmetrische verdeling van elektronen
asymmetrische verdeling van elektronen
aantrekkingskrachten tussen moleculen tot stand komen.
Bij polaire moleculen moet je naast de londonkracht rekening houden met de dipoolkracht. Die kracht is afkomstig van de aanwezige permanente dipolen. Hoe groter het verschil in elektronegatieve waarde, hoe sterker de dipoolkracht, want hoe meer uitgesproken de (deel)lading op de atomen.
video: zout oplossen in water
Tussen sommige polaire moleculen komt ook nog de sterke waterstofbrug voor. Dat is een kracht tussen een sterk gepolariseerd waterstofatoom (een waterstofatoom dat gebonden is op F, O of N) van de ene molecule en 1 atoom F, O of N van een andere molecule.
Afb 127 Waterstofbruggen tussen moleculen water, ammoniak en waterstoffluoride, en tussen die moleculen onderling D
Wanneer een ionverbinding of een zuur in water wordt opgelost, zijn de ion-dipoolkrachten belangrijk: de aantrekkingskracht tussen een ion enerzijds en een dipoolmolecule anderzijds.
Afb. 128 Schematische voorstelling van dissociatie
Het roostertype vertelt veel over de sterkte van de krachten die aanwezig zijn, en zal dus een sterke invloed hebben op het kook- en smeltpunt.
Metaalionen zijn gerangschikt in een metaalrooster, waarbij de bewegende elektronen kortstondige atoombindingen vormen die de metaalionen met elkaar verbinden. Die sterke interactie zorgt ervoor dat metalen een heel hoog kook- en smeltpunt hebben en vast zijn bij kamertemperatuur (op kwik na).
Het kookpunt van metalen, maar ook van ionverbindingen, wordt bepaald door de grootte van de coulombkracht
De grootte van de coulombkracht FC voor 2 puntladingen q1 en q2 op een afstand r is gelijk aan:
FC = k · |q1| · |q2| r 2
Daarbij is k = k0 = 8,99 · 109 N · m2 C2 een evenredigheidsconstante (in vacuüm), die men ook wel de constante van Coulomb noemt.
De bindingssterkte en dus het kookpunt nemen toe als de coulombkracht groter wordt en dus als:
• het aantal vrije elektronen groter is en de lading van het metaal groter is;
• de straal van het metaalion kleiner is.
VOORBEELD SMELTPUNT VAN EEN AANTAL METALEN
1
smeltpunt (°C)
0 200 LiBeNaMgKCaRbSrCsBa
Afb. 129 Het smeltpunt van de metalen uit groep Ia en IIa
Als je het smeltpunt van lithium en beryllium met elkaar vergelijkt, merk je dat beryllium een veel hoger smeltpunt heeft dan lithium, ondanks het feit dat beide metalen amper verschillen in atomaire massa. Dat komt doordat beryllium meer vrije elektronen heeft dan lithium (2 versus 1), en ook de straal van beryllium is kleiner dan die van lithium.
In dezelfde periode neemt de straal af van links naar rechts. Dat komt doordat er meer protonen in de kern zitten, waardoor de kracht tussen de kern en de elektronen sterker wordt. Dat geldt ook voor andere combinaties van metalen die in dezelfde periode zitten, zoals Na en Mg, of K en Ca.
Het effect van de straal zie je ook wanneer je het smeltpunt van lithium, natrium, kalium, rubidium en cesium met elkaar vergelijkt. Die elementen staan in dezelfde groep en hebben dus hetzelfde aantal vrije elektronen. Maar aangezien de straal in dezelfde groep toeneemt van boven naar onderen (door het toenemende aantal bezette schillen), daalt het kookpunt van boven naar beneden. De coulombkracht is immers omgekeerd evenredig met de straal.
Voor de elementen uit groep IIa zie je dat magnesium een ‘afwijkend’ smeltpunt heeft. Op basis van afbeelding 130 zou je nochtans verwachten dat magnesium een hoger smeltpunt heeft dan calcium. Chemici zijn nog niet 100 % zeker wat daarvan de oorzaak is. Vermoedelijk heeft de kristalstructuur van magnesium in vaste en vloeibare toestand ermee te maken. Zo zie je maar dat iets dat zo vanzelfsprekend lijkt als het smeltpunt van een stof, niet altijd zo gemakkelijk te verklaren is.
De grootte van de coulombkracht FC voor 2 puntladingen q1 en q2 op een afstand r is gelijk aan:
Alle ionverbindingen zijn geordend volgens een ionrooster, waarbij de tegengesteld geladen ionen via sterke coulombkrachten bij elkaar gehouden worden. Daardoor zijn alle ionverbindingen vast bij kamertemperatuur.
De coulombkracht en dus het kook- en smeltpunt nemen toe als:
• de absolute lading van de ionen toeneemt;
• de straal van de ionen afneemt
Aangezien dit geen ionverbindingen zijn, treden hier ook geen coulombkrachten op! TIP
VOORBEELD SMELTPUNT VAN EEN AANTAL IONVERBINDINGEN
SMELTPUNT (°C) 2 852 714 1 263 2 000
MgF2 heeft duidelijk een hoger smeltpunt dan MgCl2. Ze bevatten hetzelfde metaalion, dus de lading van het positieve ion is in beide gevallen hetzelfde. Maar ook de lading van het negatieve ion is hetzelfde. Zowel chloor als fluor heeft een ionlading van 1–. De verklaring voor het verschil in smeltpunt is dus afkomstig van het verschil in straal. Chloor heeft 3 bezette schillen en fluor slechts 2. Daarom is de straal van het chloride-ion groter dan die van het fluoride-ion. Uit de formule van de coulombkracht haal je dat die kracht omgekeerd evenredig is met het kwadraat van de straal. Hoe groter de straal, hoe kleiner de coulombkracht en dus hoe lager het smeltpunt.
Het smeltpunt van MgO bedraagt 2 852 °C, terwijl dat van MgCl2 slechts 714 °C bedraagt. Het hogere smeltpunt van MgO kun je verklaren door de kleinere straal van het oxide-ion in vergelijking met het chloride-ion, maar vooral het verschil in lading van beide negatieve ionen (2– versus 1–) ligt hier aan de basis.
Wanneer je het smeltpunt van MgS vergelijkt met dat van MgF2, stel je vast dat het smeltpunt van MgS groter is. Wanneer je kijkt naar de straal van de ionen, zou je verwachten dat MgF2 het hoogste smeltpunt heeft, aangezien de straal van het fluoride-ion kleiner is dan de straal van het sulfide-ion. Maar de absolute waarde van de lading van het sulfide-ion is groter dan die van het fluoride-ion. Dat verklaart het hoge smeltpunt van MgS. Het effect van de lading is dus veel belangrijker dan het effect van de straal.
2.3 Atoomrooster
Aangezien bij dit roostertype de atomen door middel van zeer sterke krachten, namelijk atoombindingen, worden samengehouden, zijn die stoffen vast bij kamertemperatuur. Denk maar aan diamant en grafiet.
2.4 Molecuulrooster
De meeste atoomverbindingen worden gerangschikt volgens een molecuulrooster. Daarbij moet je de london- of london-dispersiekracht en eventueel de dipoolkracht en/of de waterstofbrug in rekening brengen. Afhankelijk van de grootte van de aanwezige krachten is de aggregatietoestand bij kamertemperatuur vast, vloeibaar of gasvormig.
Bij apolaire moleculen is enkel de london- of london-dispersiekracht aanwezig. Die kracht wordt sterker naarmate de molecule groter wordt. Bij grotere moleculen is de kans om een geïnduceerde pool te creëren groter, wat natuurlijk resulteert in een sterkere kracht en een hoger kook- of smeltpunt.
VOORBEELD KOOKPUNT VAN DIHALOGENEN
FORMULEBOLVOORSTELLING
VOORKOMENKOOKPUNT (°C)
F2 lichtgeel gas –188
Cl2 geelgroen gas –35
Br2 roodbruine vloeistof 59
I2 donkerpaarse vaste stof185
Het is duidelijk dat de moleculaire massa van boven naar onderen toeneemt. Tegelijkertijd neemt in dezelfde groep (hier VIIa) het aantal bezette schillen en dus de grootte van een atoom toe van boven naar onderen. Daardoor neemt de london- of london-dispersiekracht toe van boven naar onderen, en dus ook het smelt- en kookpunt.
Bij polaire moleculen moet je niet alleen de london- of london-dispersiekracht in rekening brengen, maar ook dipoolkrachten en eventuele waterstofbruggen.
VOORBEELD KOOKPUNT WATERSTOFHALOGENIDEN
Wanneer je de kookpunten van HF, HCl, HBr en HI met elkaar vergelijkt, valt het op dat HF het hoogste kookpunt heeft. Dat komt door de heel sterke waterstofbruggen tussen de moleculen.
Afb. 132 Tussen HF-moleculen treden er sterke waterstofbruggen op.
Afb. 131 De verschillen in kookpunt bij de waterstofhalogeniden kun je verklaren met behulp van de aanwezige intermoleculaire krachten.
Bij de andere moleculen treden geen waterstofbruggen op. De verklaring voor het verschil in kookpunt moet gezocht worden in de toenemende moleculaire massa, dus de londonkracht en/of een verschil in dipoolkracht.
Voor de moleculen HCl, HBr en HI neemt de dipoolkracht af, doordat het verschil in elektronegatieve waarde steeds kleiner wordt. Dat kan de stijging in het kookpunt in deze reeks dus niet verklaren.
Het toenemende kookpunt kun je wel verklaren door de toenemende londonkracht of london-dispersiekracht (en dus de toenemende molecuulmassa). Net zoals bij de dihalogenen nemen de straal en de massa van het halogeen toe (van fluor naar jood), wat resulteert in een betere polariseerbaarheid en dus een sterkere london- of london-dispersiekracht.
Afb 133 Bij HF is de dipoolkracht het grootst en bij HI het kleinst. Dat kan je afleiden uit de gebruikte kleuren. HI is zelfs een apolaire molecule. Bij HI is de london-dispersiekracht dan weer het grootst. Dat kun je afleiden uit de grootte van de atomen.
Je moet dus zowel de molecuulmassa (dus de londonkracht) als de eventuele andere intermoleculaire krachten in rekening brengen om kook- en smeltpunten te verklaren bij atoomverbindingen.
londonkracht sterk <<<<<<<<<<< zwak
dipoolkracht zwak >>>>>>>>>>> sterk
H-brug? – – – + Tk en T s hoog > laag < heel hoog
Conclusie: de londonkrachten hebben hier een grotere invloed dan de dipoolkrachten.
Een stof lost op als de krachten die overwonnen moeten worden, kleiner zijn dan de aanwezige krachten in de gevormde oplossing.
3.1
Door de sterke coulombkrachten in het metaalrooster lossen metalen niet op in water. Watermoleculen zijn niet sterk genoeg om de coulombkrachten te verbreken. Sommige metalen reageren wel met water, bijvoorbeeld natrium. Volgend schooljaar ga je verder in op die reacties van metalen met water. Ze behoren tot de redoxreacties.
3.2
Ionverbindingen zijn polair en lossen dus niet op in een apolair oplosmiddel, zoals n-hexaan.
Ondanks hun polaire karakter lossen toch niet alle ionverbindingen op in water. Dat komt doordat de krachten tussen de ionen in het rooster zeer sterk zijn. Is de coulombkracht kleiner dan de ion-dipoolkracht, dan lost de ionverbinding op in water. Ze dissocieert. Daarbij komen de ionen los. Dat is het geval bij bijvoorbeeld NaCl:
NaCl(s) H2O Na+(aq) + Cl-(aq)
AgCl daarentegen is slecht oplosbaar in water: daar zijn de aanwezige coulombkrachten groter dan de ion-dipoolkracht.
Aangezien hier heel sterke atoombindingen moeten worden verbroken, zijn deze stoffen niet oplosbaar in water. Denk maar aan bijvoorbeeld diamant en grafiet.
Onderzoek zelf het verschil in oplosbaarheid van verschillende zouten via de applet.
Koolstof is om meerdere redenen een bijzonder element. Zowel grafiet (een van de zachtste bekende materialen) als diamant (een van de hardste bekende materialen) bestaat enkel uit koolstofatomen. Diamant en grafiet noem je daarom enkelvoudige stoffen: ze zijn opgebouwd uit 1 element. Koolstof heeft 4 valentie-elektronen. Het kan dus met 4 andere C-atomen binden door elektronenparen te vormen. Als dat gebeurt, ontstaat diamant, een driedimensionale structuur waarin elk koolstofatoom met covalente bindingen aan 4 andere koolstofatomen gebonden is. Dankzij die 4 bindingen is diamant een van de hardste materialen die voorkomen in de natuur. We gebruiken het in sieraden, maar ook in werktuigen die door hard gesteente moeten boren of slijpen.
In grafiet is elk koolstofatoom gebonden aan 3 andere koolstofatomen via enkelvoudige en dubbele covalente bindingen. Daardoor ontstaat een vlak. Grafiet zelf is opgebouwd uit verschillende laagjes die op elkaar gestapeld zijn en door zwakke krachten bijeengehouden worden. Wanneer daar dunne laagjes lucht of water tussen glippen, kunnen de koolstoflaagjes gemakkelijk verschuiven. Dat verklaart waarom grafiet ‘afgeeft’ en het gebruikt kan worden in potloden en smeermiddel. Koolstof komt ook nog in andere vormen voor. Je fiets of tennisracket is misschien vervaardigd uit koolstofvezels, een uiterst licht, maar sterk materiaal. Tegenwoordig maken techneuten ook dankbaar gebruik van nanobuizen (nanotubes in het Engels), waarbij een laagje grafiet is opgerold als een buisje. Nanotubes kennen ondertussen verschillende toepassingen in onder andere zonnecellen, de elektronica en geneesmiddelen (om bacteriën te doden, zoals E. coli).
3.4 Molecuulrooster
Algemeen kun je hier stellen dat polaire stoffen goed oplossen in het polaire water, terwijl apolaire stoffen niet oplossen in water. Apolaire stoffen lossen wel op in apolaire oplosmiddelen.
Tussen apolaire moleculen heersen zwakke londonkrachten. Wanneer je een apolaire stof oplost in een apolair oplosmiddel, is de onderlinge wisselwerking ongeveer gelijk. Daarom lossen apolaire stoffen op in apolaire oplosmiddelen.
Apolaire stoffen lossen niet goed op in het polaire water. De sterke waterstofbruggen tussen de watermoleculen duwen de apolaire moleculen als het ware er terug uit. Sommige kleine apolaire moleculen zoals O2 lossen, in beperkte mate, op in het polaire water. Ze zijn zo klein dat ze zich in de intermoleculaire ruimten tussen de watermoleculen kunnen nestelen.
Wanneer je een polaire stof wilt oplossen in een apolair oplosmiddel, lukt dat niet omdat het apolaire oplosmiddel niet sterk genoeg is om de dipoolkrachten te verbreken.
Polaire stoffen die waterstofbruggen kunnen vormen, lossen zeer goed op in water: de waterstofbruggen moeten verbroken worden, maar er worden opnieuw waterstofbruggen gevormd. Polaire stoffen die geen waterstofbruggen kunnen vormen, lossen vooral goed op in water wanneer hun dipoolkracht voldoende groot is. De positieve pool van de dipoolmolecule richt zich naar de negatieve pool van de watermolecule en omgekeerd.
Wanneer zuren in water worden opgelost, zal de stof ioniseren. De aantrekkingskracht tussen het zuurstofatoom van de watermoleculen en het waterstofatoom van het zuur zijn zo groot dat het zuur uit elkaar getrokken wordt. Daarbij ontstaan het positief geladen hydroxoniumion (H3O+) en een negatief geladen zuurrestion:
HCl + H2O → H3O+ + Cl-
Als je ammoniak, een polaire molecule, oplost in water, zal het partieel positief geladen waterstofatoom van een watermolecule zich richten naar het partieel negatief geladen stikstofatoom. Die aantrekkingskracht is zo groot dat er een proton (H+) van water afgesplitst wordt, waarbij er een ammoniumion en een hydroxide-ion ontstaan:
NH3 + H2O → NH4+ + OH-
Stoffen geleiden de elektrische stroom als er vrij beweeglijke ladingen aanwezig zijn.
Door de aanwezigheid van vrij beweeglijke elektronen geleiden metalen de elektrische stroom.
elektronen positieve metaalionen
134 Metalen geleiden de elektrische stroom doordat de elektronen vrij kunnen bewegen.
In het rooster zijn er wel ionen aanwezig, maar aangezien die ionen niet vrij kunnen bewegen, geleiden ionverbindingen in vaste toestand de elektrische stroom niet.
Wanneer je ionverbindingen smelt of oplost in water, kunnen de ionen wel vrij bewegen, waardoor ze de elektrische stroom wel geleiden + ionen verplaatsen naar de – kant – ionen verplaatsen naar de + kant
Afb 135 Gesmolten ionverbindingen geleiden de elektrische stroom doordat de ionen vrij kunnen bewegen.
Grafiet geleidt de elektrische stroom doordat er maar 3 van de 4 elektronen van de buitenste schil gebruikt worden om bindingen aan te gaan met naburige koolstofatomen. Het laatste elektron is zwak gebonden en kan zich vrij bewegen. Bij diamant is elk koolstofatoom verbonden met 4 andere koolstofatomen. Daarom geleidt diamant de elektrische stroom niet.
diamant
Afb 136 De C-atomen in grafiet (links) zijn maar met 3 andere C-atomen gebonden, in tegenstelling tot diamant (rechts), waar elk C-atoom aan 4 andere C-atomen gebonden is. Dat verklaart het verschil in elektrische geleiding tussen beide stoffen. grafiet
Sommige elementen komen in verschillende vormen voor. Dat maakt het identificeren van stoffen moeilijker. Koolstof komt voor als grafiet, maar ook als diamant. Het verschijnsel waarbij stoffen onder meerdere gedaanten voorkomen, noem je allotropie.


4.4 Molecuulrooster
Moleculaire verbindingen geleiden de elektrische stroom niet. Zo zal bijvoorbeeld suiker, maar ook water in vaste toestand, de elektrische stroom niet geleiden. Sommige moleculaire verbindingen zullen de elektrische stroom echter wel geleiden als ze in water opgelost worden. Zo zullen zuren en ammoniak, wanneer je ze oplost in water, de elektrische stroom geleiden. Bij het oplosproces worden er ionen gevormd:
HCl + H2O → H3O+ + ClNH3 + H2O → NH4+ + OH-
Daarom geleiden zuren en ammoniak in (zuivere) vloeibare toestand de elektrische stroom niet. Er zijn nog geen ionen aanwezig, want de ionen moeten gevormd worden door interactie met water.
Er zijn 4 roostertypes:
1 Metaalrooster: metaalionen op roosterpunten + vrije elektronen
2 Ionrooster: positieve en negatieve ionen op roosterpunten
3 Atoomrooster: atomen op roosterpunten
4 Molecuulrooster: moleculen op roosterpunten
Polariteit:
∆EN < 0,5 → binding is apolair → alle bindingen = polair → verbinding = apolair
∆EN > 0,5 → binding is polair → ladingscentra vallen samen → verbinding = apolair → ladingscentra vallen niet samen → verbinding = polair
Intermoleculaire krachten: van zwak naar sterk
• Londonkracht: polariseerbaarheid molecule = geïnduceerde dipool hoe zwaarder de molecule, hoe sterker de kracht
• Dipoolkracht: permanente dipool hoe groter het verschil in EN, hoe sterker de kracht
• Waterstofbrug: tussen H (op F, O of N) en F, O of N
• Ion-dipoolkracht: tussen ion en dipoolmolecule
Kook- en smeltpunt:
• Metaalrooster: sterke coulombkracht → hoog kook- en smeltpunt
De kracht stijgt als: het aantal vrije elektronen stijgt; de straal daalt.
• Ionrooster: sterke coulombkracht → hoog kook- en smeltpunt
De kracht stijgt als: de absolute waarde van de ladingen stijgt; de straal daalt.
• Atoomrooster: sterke intra-atomaire kracht (atoombinding)
• Molecuulrooster: samenspel tussen londonkracht, dipoolkracht, waterstofbrug
Oplosbaarheid:
• Metaalrooster: lost niet op in water.
• Ionrooster: wanneer de coulombkracht groter is dan de ion-dipoolkracht, dan lost de stof niet op in water. Wanneer de coulombkracht kleiner is dan de ion-dipoolkracht, dan lost de stof op in water. De stof dissocieert.
• Atoomrooster: lost niet op in water.
• Molecuulrooster: polaire stoffen lossen op in polaire oplosmiddelen, maar niet in apolaire oplosmiddelen, en omgekeerd.
• Zuren en ammoniak in water: ioniseren.
Geleidbaarheid:
• Metalen en grafiet geleiden door de aanwezigheid van vrij bewegende elektronen.
• Ionverbindingen geleiden wanneer ze gesmolten zijn of opgelost zijn in water.
• Zuren en ammoniak geleiden alleen wanneer ze opgelost zijn in water.
Bepaal of deze bindingen en verbindingen polair of apolair zijn. Teken de formules over op een apart blad en breng alle nodige informatie aan (ENwaarde, ladingsvectoren …):
d Is deze uitspraak juist of fout? Verklaar.
‘Moleculen met polaire bindingen zijn altijd polair.’
Stel: AB2 is een apolaire molecule met polaire bindingen en A is het centrale atoom.
a Geef de mogelijke lewisformule van die molecule.
b Wanneer is die molecule apolair?
Noteer telkens de stof die beantwoordt aan het gevraagde:
a sterkste dipoolkracht H2S H2O
b minst vluchtig He Ar
c laagste smeltpunt CaO CaF2
d hoogste smeltpunt Na Al
e sterkste londonkracht H2S H2O
Welke stoffen kunnen waterstofbruggen vormen?
a HCl
b NH3
c H2O
d HF
Welke stoffen zijn goed oplosbaar in water?
a AgCl
b I2
c NaOH
d H2O2
Welke stoffen geleiden in de gegeven omstandigheden de elektrische stroom?
a NaOH v
b KClvl
c HIvl
d NH3 (opl)
e C(grafiet)
Zal fullereen de elektrische stroom geleiden of niet?
Verklaar je antwoord.
Welke krachten worden overwonnen als je een hydraat verwarmt?

Rangschik deze moleculen volgens stijgend kookpunt (van links naar rechts) en verklaar:
a KF – KI – KBr – KCl
b NH3 – PH3
c H2S – H2O
d K – Li – Na ` Meer oefenen? Ga naar .
Overzicht anorganische stofklassen
OXIDEN: MO OF nMO
MO:
• beknopte naam
• Griekse telwoorden/ stocknotatie
nMO: Griekse telwoorden (stocknotatie)
H2O2 = waterstofperoxide/ zuurstofwater
Polariteit
HYDROXIDEN: MOH
• beknopte naam
• Griekse telwoorden/ stocknotatie
ZUREN: HZ
HnM:
• binair
• ‘-ide’
• HCN = blauwzuur/ waterstofcyanide
HnMO
• ternair
• ‘-aat’ voor stamzuur
ZOUTEN: MZ
• binair/ternair
• waterstofzout
• hydraat
• dubbelzout
ΔEN < 0,5 → binding is apolair → alle bindingen = polair → verbinding = apolair
ΔEN > 0,5 → binding is polair → ladingscentra vallen samen → verbinding = apolair ladingscentra vallen niet samen → verbinding = polair
Roostertypes en eigenschappen
ROOSTERTYPE TYPE VERBINDING
KRACHT DIE VERBROKEN MOET WORDEN BIJ SMELTEN/KOKEN
HOOG/LAAG SMELT- EN KOOKPUNT? OPLOSBAAR IN WATER?
GELEIDER VOOR DE ELEKTRISCHE STROOM?
ATOOMROOSTERatoomverbindingatoombinding = intra-atomair hoog nee nee, op grafiet na
MOLECUULROOSTER atoomverbinding• londonkracht
• dipoolkracht
• waterstofbrugkracht
laag tot eerder hoog (bij waterstofbruggen of heel grote massa’s) enkel als voldoende polair nee, op zuren en ammoniak opgelost in water na
IONROOSTERionverbindingencoulombkrachthoog ja, als de coulombkrachten niet te groot zijn ja, als opgelost in water of gesmolten
METAALROOSTERmetaalverbinding coulombkrachthoog nee ja
Ben je al eens in de kelders of op de zolders van je school gaan kijken? Misschien vind je er nog wel dieren die bewaard worden in glazen bokalen. Ze lijken te zweven in water, maar schijn bedriegt: het is een organische stof opgelost in water. In de volksmond spreken we weleens van ‘sterkwater’. Je kunt sterkwater met verschillende organische stoffen maken, waarbij veiligheid een belangrijke rol speelt.

` Welke organische stof gebruikte men vroeger om sterkwater te maken?
` Welke organische stof gebruikt men nu om sterkwater te maken?
` Waarom gebruikt men nu een andere organische stof?
We zoeken het uit!
• de formule en de naam vormen van enkele koolwaterstoffen: alkanen en alkenen.

• de wetenschappelijke naam, gebruiksnaam en formule van de organische stof in alcoholische dranken geven.

• de naamgeving en formulevorming van organische stoffen uit de 2e graad uitbreiden met enkele nieuwe stofklassen.

• nog meer toepassingen van organische stoffen.
• fysische eigenschappen van anorganische stoffen en sommige organische stoffen beschrijven en onderling vergelijken, bijvoorbeeld: – kook- en smeltpunt; – oplosbaarheid; – polariteit.
• dezelfde eigenschappen bij enkele organische stoffen karakteriseren;
• isomerie bij organische stoffen interpreteren en toepassen;
• organische reacties herkennen.
HOOFDSTUK 1
In de 2e graad maakte je al kennis met enkele organische stoffen. Omdat in elke organische stof het koolstofatoom voorkomt, spreken we ook wel van koolstofchemie. In dit hoofdstuk herhaal je de basiskennis uit de 2e graad, om er vervolgens op te steunen om nieuwe stofklassen te leren:
• Welke bindingen kan een koolstofatoom aangaan?
• Hoe stel je een organische stof voor?
• Hoe wordt de systematische naam van een organische stof opgebouwd?
LEERDOELEN
L De bindingsmogelijkheden van het koolstofatoom interpreteren en toepassen
L De brutoformule, structuurformule en skeletnotatie van een organische stof interpreteren en naar elkaar omzetten
Het koolstofatoom bezit 4 valentie-elektronen. Om de octetstructuur te bereiken, zal het atoom dus nog met 4 extra elektronen moeten binden: elk koolstofatoom vormt 4 bindingen.
In thema 03 leerde je dat dat gepaard gaat met de promotie van elektronen en het aangaan van enkelvoudige (σ), dubbele (σ + π) of drievoudige (σ + 2π) bindingen. Dat leidt ertoe dat elk koolstofatoom zal binden met 4, 3 of 2 atomen.
BINDING MET 4 ATOMEN
Koolstof kan een atoombinding aangaan met 4 atomen (bv. C, H, O en/of halogenen), die telkens 1 ongepaard elektron delen met het koolstofatoom.
BINDING MET 3 ATOMEN
Koolstof kan de octetstructuur ook bereiken door met maar 3 atomen te binden. Het zal dan een dubbele binding vormen met 1 atoom (bv. C of O).
BINDING MET 2 ATOMEN
Koolstof kan de octetstructuur ook bereiken door met maar 2 atomen te binden. Het zal dan bv. een drievoudige binding vormen met 1 atoom.
De sp3-hybridisatie zorgt voor een tetragonale structuur (hoek van 109° 28ʼ).
De sp2-hybridisatie zorgt voor een trigonale structuur (hoek van 120°).
De sp-hybridisatie zorgt voor een lineaire structuur (hoek van 180°).
Je kunt een organische stof weergeven met behulp van 3 notaties:
1 de brutoformule;
2 de structuurformule;
3 de skeletnotatie.
We herhalen kort die 3 voorstellingen.
SYSTEMATISCHE
weergave:
• element
+ aantal (index)
• volgorde:
C-H-andere (alfabetisch)
voorbeelden: propeen
butaan-1-ol
extra weergave:
• elk koolstofatoom apart, met aantal gebonden waterstofatomen bij elkaar
• binding tussen atomen, uitgezonderd C-H en O-H binding
CH2=CH-CH3
CH3-CH2-CH2-OH
weergave:
• koolstofskelet met juiste hoeken
• functionele groep(en)
Wanneer er in een structuurformule een atoomgroep, bijvoorbeeld CH2, vaak voorkomt, dan kun je dat als volgt verkort weergeven:
CH3-CH2-CH2-CH2-CH2-CH2-CH3 → CH3-(CH2)5-CH3
In het 4e jaar heb je geleerd over een uitgebreide en een beknopte structuurformule
De uitgebreide structuurformule noem je ook wel de lewisstructuur. In de uitgebreide structuurformule worden ook telkens de C-H en O-H bindingen getoond. In het 5e jaar word je verondersteld die leerstof te kennen en gebruik je daarom enkel de beknopte structuurformule. Het is ook belangrijk om te weten dat in een beknopte structuurformule de eigen doubletten van een atoom, bv. zuurstof, niet worden weergegeven als dat atoom deel uitmaakt van de functionele groep (bv. -OH).
VOORBEELD NOTATIE METHANOL
UITGEBREIDE STRUCTUURFORMULE (OF LEWISSTRUCTUUR)
STRUCTUURFORMULE
Ook in een skeletnotatie wordt bijvoorbeeld de -OH-groep vaak beknopt weergegeven:
In dit thema zul je leren dat de brutoformule van een organische stof niet altijd verwijst naar een enkele molecule: het kan de brutoformule zijn van 2 of meer verschillende organische stoffen die verschillende chemische en fysische eigenschappen hebben. Later in het thema leer je dat je dat isomeren van elkaar noemt.
Daarom maak je bij het overlopen van de verschillende organische stofklassen telkens enkel gebruik van de structuurformule of de skeletnotatie.
Voorbeeld:
Brutoformule: C4H8
Structuurformule: CH2=CH-CH2-CH3
CH3-CH=CH-CH3 but-1-een but-2-een
Later in dit thema zul je zien dat met de brutoformule C4H8 nog meer moleculen gevormd kunnen worden.
Over het algemeen wordt de naam van een organische stof in eerste instantie gekenmerkt door:
• het aantal C-atomen in de verbinding;
• het type binding tussen de C-atomen.
Het aantal C-atomen wordt in de naamgeving aangeduid door een stam (algemeen: alk-).
Met die stamvormen geef je ook het aantal koolstofatomen in een zijketen weer. De aard van de binding tussen de koolstofatomen geef je aan door een achtervoegsel of suffix te gebruiken.
Algemeen:
aantal C-atomen aard van de binding
In de 2e graad maakte je al kennis met de alkanen en alkenen. Koolwaterstoffen kunnen ook een drievoudige binding bevatten. Je spreekt dan van alkynen.
alkaan → suffix -aan = enkelvoudige bindingen tussen de C-atomen ethaan → CH3-CH3
alkeen → suffix -een = dubbele binding tussen 1 paar C-atomen etheen → CH2=CH2
alkyn → suffix -yn = drievoudige binding tussen 1 paar C-atomen ethyn → CH CH
Bij organische stoffen kunnen naast C- en H-atomen ook andere atomen in de verbindingen voorkomen, bijvoorbeeld O, N of halogenen. Die atomen vormen een specifieke functionele groep, bijvoorbeeld -OH of -NH2. Die functionele groep geef je in de naam weer door een 2e suffix of een voorvoegsel of prefix
Algemeen:
PREFIX STAM SUFFIX 1 SUFFIX 2 functionele groepaantal C-atomenaard van de bindingfunctionele groep
In de 2e graad maakte je al kort kennis met de alcoholen en carbonzuren, waarbij je suffix 2 gebruikte.
alcohol → hydroxylfunctie (-OH) in molecule ethanol → CH3-CH2-OH
carbonzuur → carboxylfunctie (-COOH) in molecule ethaanzuur → CH3-COOH
Je gebruikte een suffixnotatie als verwijzing voor de stofklasse ook al bij de anorganische stoffen.
Voorbeeld: metaaloxiden → suffix = -oxide = O-atoom achteraan
• Een koolstofatoom kan met 4, 3 of 2 bindingspartners binden.
• Organische stoffen worden voorgesteld door 3 notaties.
Voorbeeld:
BRUTOFORMULE STRUCTUURFORMULE SKELETNOTATIE
C6H12O2
CH3-CH2-CH2-CH2-CH2-COOH of CH3-(CH2)4-COOH OH O
• De naamgeving van een organische stof geeft informatie over de samenstelling van de stof.
Voorbeeld:
HEXAANZUUR
CH3-CH2-CH2-CH2-CH2-COOH stam: hex-: 6 C-atomen
suffix 1: -aan-: altijd C-C
suffix 2: -zuur: -COOH-groep
Geef de brutoformule, structuurformule en/of skeletnotatie van deze stoffen:
a CH3-CH2-CH2-CH2-CH3
b
c CH3-CH2-CH=CH-(CH2)3-CH3
d CH3-COOH
Welke informatie over de structuurformule geven deze organische stofnamen? De eerste stof is gegeven als voorbeeld.
ORGANISCHE STOF AANTAL C-ATOMEN TYPE BINDING TUSSEN DE C-ATOMEN FUNCTIONELE GROEP
a n-hexaan hex- = 6enkelvoudige bindingen (C-C) /
b ethanol c propeen
d pentaanzuur
In thema 03 heb je geleerd dat 1 elektron in een koolstofatoom promotie ondergaat om de 4 bindingen aan te gaan. Wat houdt promotie in en waarom is dat noodzakelijk?
Bepaal het type hybridisatie (sp3, sp2 of sp) en de grootte van de hoek rond de met rood aangeduide koolstofatomen.
a CH3-CH2-CH3
b CH2=CH-CH2-CH3
c CH3-CH2-OH
d CH3-COOH e CH C-CH3
Waarom stel je een organische stof beter niet voor met een brutoformule? Maak gebruik van een voorbeeld om je antwoord te ondersteunen.
Geef de brutoformule, structuurformule en/of skeletnotatie van deze stoffen:
a CH3-CH2-OH
b CH3-CH2-CH2-CH=CH-CH2-CH3
Zijn deze stellingen juist of fout?
Is de stelling fout, verbeter dan de onderlijnde tekst.
a In een organische verbinding heeft elk koolstofatoom 4 bindingspartners.
b Bij een organische stof wordt tussen een C- en H-atoom altijd een enkelvoudige binding gevormd.
c CH2-CH2-CH2-CH3 is een juiste weergave van een organische verbinding met alleen enkelvoudig gebonden C- en H-atomen.
d CH2=CH-CH2-CH3 is een juiste weergave van een organische verbinding met enkel C- en Hatomen en één dubbele binding. ` Meer oefenen? Ga naar .
• Een koolstofatoom kan met 4, 3 of 2 bindingspartners binden.
• Organische stoffen worden voorgesteld door 3 notaties:
BRUTOFORMULE
C6H12O2
STRUCTUURFORMULE
CH3-CH2-CH2-CH2-CH2-COOH of CH3-(CH2)4-COOH
• De naamgeving van een organische stof geeft informatie over de samenstelling van de stof.
HEXAANZUUR
STAM: hex-: 6 C atomen
SUFFIX 1: -aan-: altijd C-C
CH3-CH2-CH2-CH2-CH2-COOH
SUFFIX 2: -zuur: -COOH-groep
HOOFDSTUK 2
In de 2e graad maakte je binnen de koolwaterstoffen al kennis met 2 stofklassen: 1 de alkanen: alle koolstofatomen zijn met elkaar verbonden via enkelvoudige bindingen; 2 de alkenen: 2 koolstofatomen zijn met elkaar verbonden via een dubbele binding.
Alkanen vormen de verzadigde koolwaterstoffen: ze bezitten het maximale aantal bindingspartners dat mogelijk is. Door de aanwezigheid van de meervoudige binding worden alkenen ook onverzadigde koolwaterstoffen genoemd. De vermelde stofklassen kunnen lineair (acyclisch) of in gesloten vorm (cyclisch) voorkomen. We bespreken ook de aanwezigheid van koolstofzijketens
LEERDOELEN
L De naam van een verzadigde koolwaterstof (cyclisch en acyclisch) formuleren op basis van de structuurformule of skeletnotatie en omgekeerd
L De naam van een onverzadigde koolwaterstof formuleren op basis van de structuurformule of skeletnotatie en omgekeerd
L Zijketens weergeven in een formule en vermelden in een systematische naam
In de 2e graad maakte je al kennis met acyclische verzadigde koolwaterstoffen of alkanen. De term acyclisch wijst op het lineair voorkomen van de moleculen. Verzadigd betekent dat elk koolstofatoom omringd is door 4 bindingspartners. Met andere woorden: elk C-atoom vormt 4 enkelvoudige bindingen. Dus ook tussen 2 C-atomen komen alleen enkelvoudige bindingen voor. De andere bindingen bij alkanen worden gevormd tussen C- en H-atomen.
Algemene formule: C nH2n + 2
1.1 Niet-vertakte alkanen
Algemene naam: n-alkanen
Het prefix n- moet je gebruiken vanaf butaan. Het benadrukt dat met dezelfde bouwstenen ook een vertakt alkaan kan worden gevormd (n = normaal of niet-vertakt).
Als je de structuurformule van een niet-vertakt alkaan opstelt, overloop je het best het volgende stappenplan:
Stap 1: Schrijf het aantal C-atomen.
Stap 2: Plaats een enkelvoudige binding tussen de C-atomen.
Stap 3: Vul de formule aan met H-atomen tot elk C-atoom 4 keer gebonden is.
VOORBEELD N-HEXAAN
SYSTEMATISCHE NAAM STRUCTUURFORMULE SKELETNOTATIE n-hexaan CH3-CH2-CH2-CH2-CH2-CH3 of CH3-(CH2)4-CH3
1.2 Vertakte alkanen
Algemene naam: alkylalkanen
Een organische stof kan een vertakking bevatten. Die vertakkingen of zijketens zijn afgeleid van de overeenkomstige alkanen door de afsplitsing van een H-atoom. Ze kunnen voorkomen bij alle stofklassen, maar we bekijken ze nu bij de alkanen.
Het aantal C-atomen in de zijketen van een vertakt alkaan geef je aan door een specifieke stam Het achtervoegsel -aan vervang je door -yl.
ALKAAN: C nH2n + 2
NAAMALKYLGROEP: -C nH2n + 1 NAAM
CH4 methaan-CH3 methyl
C2H6 ethaan-CH3-CH2 ethyl
C3H8 propaan-CH3-CH2-CH2 propyl
C4H10 n-butaan-CH3-(CH2)2-CH2 butyl
C5H12 n-pentaan-CH3-(CH2)3-CH2 pentyl
C10H22 n-decaan-CH3-(CH2)8-CH2 decyl
Tabel 16 Naamgeving van de alkylgroepen bij een organische stof
VOORBEELD METHYLPROPAAN
SYSTEMATISCHE NAAM STRUCTUURFORMULE SKELETNOTATIE
methylpropaan
CH3-CH-CH3
CH3 of CH3-CH(CH3)-CH3
Alle stammen vind je terug op p. 202. TIP
Naamvorming van vertakte alkanen
Bij zijketens is er vaak extra informatie in de naamgeving nodig: de exacte positie van de zijketen in de hoofdketen. Gebruik daarbij een positiecijfer. Zo is een naam eenduidig en vermijd je verwarring. Vermeld het positiecijfer enkel als de zijketen op meerdere plaatsen op de hoofdketen kan worden geplaatst.
We bekijken opnieuw methylpropaan:
• De methylgroep kan enkel op het 2e koolstofatoom geplaatst worden: je geeft het positiecijfer 2 niet weer in de naam van de stof.
• Als je de methylgroep op het 1e of laatste koolstofatoom plaatst, ontstaat de structuurformule van n-butaan.
Algemeen kun je stellen bij de vertakte verzadigde koolwaterstoffen:
x-R1-y-R2ALKAAN, waarin:
ALKAAN = hoofdketen;
x en y = positiecijfers (eventueel meerdere), geplaatst vlak voor de zijketen waarbij ze horen;
R1, R2 = zijketens (alfabetisch gerangschikt), eventueel voorafgegaan door een Griekse notatie (di, tri, tetra …).
Om de naam van een vertakt alkaan te vormen, volg je een stappenplan:
Stap 1: Zoek de langste koolstofketen (hoofdketen) en vermeld met behulp van de stam het aantal koolstofatomen in die keten.
Stap 2: Benoem de zijketens en schrijf hun namen in alfabetische volgorde.
Stap 3: Plaats een positiecijfer bij de zijketens, als dat nodig is, gevolgd door een koppelteken. Nummer de C-atomen in de hoofdketen zodanig dat de eerste zijketen een zo laag mogelijk positiecijfer krijgt. Bij gelijkheid kijk je naar de volgende zijketen.
VOORBEELD NAAMGEVING VERTAKTE ALKANEN
STAP 1
Zoek de langste koolstofketen (hoofdketen) en vermeld met behulp van de stam het aantal koolstofatomen in die keten.
STAP 2
Benoem de zijketens en schrijf hun namen in alfabetische volgorde.
CH3-CH-CH2-CH2-CH -CH2-CH3 CH3 C2H5
Langste keten = 7 C-atomen → heptaan (-aan verwijst naar C-C bindingen)
STAP 3
Plaats een positiecijfer bij de zijketens, als dat nodig is, gevolgd door een koppelteken. Nummer de C-atomen in de hoofdketen zodanig dat de eerste zijketen een zo laag mogelijk positiecijfer krijgt. Bij gelijkheid kijk je naar de volgende zijketen.
CH3-CH-CH2-CH2-CH-CH2-CH3 CH3 C2H5
Zijketen: methyl; zijketen: ethyl → ethyl-methylheptaan
Er zijn 2 opties: Optie 1:
1 2 3 4 5 6 7
CH3-CH-CH2-CH2-CH-CH2-CH3 CH3 C2H5 5-ethyl-2-methylheptaan
Optie 2:
7 6 5 4 3 2 1
CH3-CH-CH2-CH2-CH-CH2-CH3 CH3 C2H5 3-ethyl-6-methylheptaan
Laagste cijfer is 2 → correcte naam = 5-ethyl-2-methylheptaan
Opmerkingen:
• Een zijketen kan ook in de lijn van de stam worden weergegeven.
Voorbeeld:
2-methylhexaan:
CH3-CH-CH2-CH2-CH2-CH3 → CH3-CH(CH3)-CH2-CH2-CH2-CH3 CH3
• De zijketen die alfabetisch eerst gerangschikt staat, krijgt, als dat mogelijk is, het laagste positiecijfer.
Voorbeeld:
CH3-CH2-CH -CH -CH2-CH3
CH3 CH2 CH3
De juiste naam is 3-ethyl-4-methylhexaan (niet 4-ethyl-3-methylhexaan).
• Als een zijketen meer dan 1 keer voorkomt, vermeld dan het aantal door middel van Griekse notaties (di, tri, tetra). Je neemt die notaties niet mee op in de alfabetische rangschikking van de zijketens. Elke zijketen krijgt een positiecijfer, ook wanneer dat hetzelfde is.
Voorbeeld: CH3
CH3 CH2
CH3-C-CH2-CH -CH2-CH3 CH3
De juiste naam is 4-ethyl-2,2-dimethylhexaan (niet 2,2-dimethyl-4-ethylhexaan).
Rond een enkelvoudige binding is altijd rotatie mogelijk. Daarom kan er op het eerste of laatste C-atoom van de keten geen vertakking staan. De ‘schijnbare vertakking’ plaatst zich daar altijd in het verlengde van de keten.
CH3
CH2-CH2-CH2 wordt dus CH3-CH2-CH2-CH2-CH2-CH3 CH2 CH3 TIP
Formulevorming van vertakte alkanen
Om de structuurformule van een vertakt alkaan te vormen, kun je het volgende stappenplan overlopen:
Stap 1: Schrijf de koolstofatomen uit de hoofdketen naast elkaar.
Stap 2: Vorm de bindingen tussen de koolstofatomen.
Stap 3: Schrijf per zijketen het aantal koolstofatomen ter hoogte van het aangegeven koolstofatoom in de hoofdketen (positiecijfer).
Stap 4: Vul de formule aan met H-atomen tot elk C-atoom 4 keer gebonden is.
VOORBEELD FORMULEVORMING VERTAKTE ALKANEN
STAP 1
Schrijf de koolstofatomen uit de hoofdketen naast elkaar.
STAP 2
Vorm de bindingen tussen de koolstofatomen.
STAP 3
Schrijf per zijketen het aantal koolstofatomen ter hoogte van het aangegeven koolstofatoom in de hoofdketen (positiecijfer).
STAP 4
Vul de formule aan met H-atomen tot elk C-atoom 4 keer gebonden is.
2,3-dimethylhexaan
C C C C C C
2,3-dimethylhexaan
C-C-C-C-C-C
2,3-dimethylhexaan
C-C-C-C-C-C
C C
2,3-dimethylhexaan
CH3-CH-CH-CH2-CH2-CH3 CH3 CH3
Wanneer de hoofdketen van een koolwaterstofmolecule een ringstructuur maakt, krijg je een cyclische koolwaterstofmolecule. In de naamgeving geef je dat aan door het prefix cyclovoor de molecule te schrijven: het zijn cycloalkanen
Doordat de kring gesloten is, zijn er 2 H-atomen minder aanwezig. Daardoor is de brutoformule van een cycloalkaan altijd gelijk aan dat van een alkeen.
Algemene formule: CnH2n
Algemene naam: cyclo + stamnaam + -AAN
Vanaf cyclobutaan zijn de cyclische alkanen stabiel.
Bij vertakkingen vermeld je het positiecijfer als er verwarring mogelijk is.
VOORBEELDEN NAAMGEVING CYCLISCHE VERZADIGDE KOOLWATERSTOFFEN
• Als structuurformule:
cyclohexaan 1,3-dimethylcyclohexaan
• Als skeletnotatie:
methylcyclopentaan cycloheptaan
Acyclische verzadigde koolwaterstoffen ‘Alkanen’
niet-vertakt alkaan vertakt x-R1-y-R2alkaan
aantal C-atomen altijd C-C
Voorbeeld:
CH3-(CH2)3-CH3 n-pentaan
alkaan: langste hoofdketen
x, y:
R1, R2:
• positiecijfer (als het nodig is)
• zo laag mogelijk vanaf 1e zijketen
• naam zijketen: alkyl
• alfabetisch gerangschikt
• di/tri/... bij meerdere gelijke zijketens.
Voorbeeld:
CH3-CH-CH-CH2-CH2-CH3 CH3 CH3
2,3-dimethylhexaan
Cyclische verzadigde koolwaterstoffen ‘Cycloalkanen’
niet-vertakt vertakt cycloalkaan
Voorbeeld: CH2 CH2 CH2 H2C H2C cyclopentaan
x-R1-y-R2 cycloalkaan
Voorbeeld: CH2 CH CH-CH3 CH2 H2C H2C CH3 1,3-dimethylcyclohexaan
Onverzadigd wil zeggen dat een aantal C-atomen maar 2 of 3 bindingspartners heeft. Dat heeft dubbele of drievoudige bindingen tussen C-atomen tot gevolg.
De naam van die verbindingen is altijd afgeleid van het alkaan met hetzelfde aantal C-atomen. Omdat hier een meervoudige binding voorkomt tussen 2 C-atomen, bestaat vanzelfsprekend een onverzadigde organische stof met 1 C-atoom (dus afgeleid van methaan) niet.
De aanwezigheid van een dubbele of drievoudige binding wordt specifiek in de naamgeving aangegeven.
Dubbele binding: -EEN in plaats van -AAN
Voorbeeld: CH2=CH2: etheen
Drievoudige binding: -YN in plaats van -AAN
Voorbeeld: CH CH: ethyn
AANTAL EN AARD VAN DE MEERVOUDIGE BINDINGEN
1 dubbele bindingCnH2n alkenen propeen
CH2=CH-CH3
1 drievoudige bindingCnH2n – 2 alkynen ethyn
CH CH
In tegenstelling tot de niet-vertakte alkanen is bij niet-vertakte alkenen en alkynen vaak wel extra informatie in de naamgeving nodig: de locatie van de meervoudige binding. Als je uitgaat van 1 meervoudige binding, breng je een positiecijfer aan bij een meervoudige binding vanaf 4 C-atomen. Je plaatst het positiecijfer altijd vlak voor de aanduiding van de kenmerkende structuur in de molecule (bv. een meervoudige binding). Het positiecijfer moet daarbij zo laag mogelijk zijn.
Voorbeeld:
1 2 3 4 5
CH3-CH2-CH=CH-CH3 5 4 3 2 1
(pent-3-een)
pent-2-een = correcte naam (3-penteen) (2-penteen)
De bepaling van het positiecijfer startend vanaf rechts is hier van toepassing (2 < 3).
Ook een onverzadigde koolwaterstof kan een zijketen bezitten. Net zoals bij de vertakte alkanen vorm je de hoofdketen met de langste keten.
Opgepast: binnen de context van dit leerboek zal de hoofdketen altijd de meervoudige binding bevatten. Maar dat is niet vereist. De aanwezigheid van een meervoudige binding in een zijketen bespreken we niet in dit leerboek.
Ook voor de naamgeving van vertakte alkenen en alkynen volg je een stappenplan:
Stap 1: Bepaal de langste koolstofketen.
Stap 2: Geef, als dat nodig is, de plaats van de meervoudige binding in de keten aan met een positiecijfer, dat zo laag mogelijk is. De meervoudige binding heeft dus bij de nummering voorrang op de zijketens.
Stap 3: Benoem en lokaliseer de zijketens. Gebruik de nummering bepaald door de meervoudige binding.
STAP 1
Bepaal de langste koolstofketen.
STAP 2
Geef, als dat nodig is, de plaats van de meervoudige binding in de keten aan met een positiecijfer, dat zo laag mogelijk is. De meervoudige binding heeft dus bij de nummering voorrang op de zijketens.
STAP 3
Benoem en lokaliseer de zijketens. Gebruik de nummering bepaald door de meervoudige binding.
CH3-CH-CH=CH-CH3 CH3
pent-
5 4 3 2 1
CH3-CH-CH=CH-CH3 CH3
pent-2-een
5 4 3 2 1
CH3-CH-CH=CH-CH3 CH3
= 4-methylpent-2-een
Om de structuurformule van vertakte alkenen of alkynen te vormen, kun je het volgende stappenplan overlopen:
Stap 1: Schrijf de koolstofatomen uit de hoofdketen naast elkaar.
Stap 2: Vorm de meervoudige binding op de aangegeven plaats. Teken enkelvoudige bindingen tussen de andere C-atomen.
Stap 3: Schrijf per zijketen het aantal koolstofatomen ter hoogte van het aangegeven koolstofatoom in de hoofdketen (positiecijfer).
Stap 4: Vul de formule aan met H-atomen tot elk C-atoom 4 keer gebonden is.
VOORBEELD FORMULEVORMING VERTAKTE ALKENEN EN ALKYNEN
STAP 1
Schrijf de koolstofatomen uit de hoofdketen naast elkaar.
STAP 2
Vorm de meervoudige binding op de aangegeven plaats. Teken enkelvoudige bindingen tussen de andere C-atomen.
STAP 3
Schrijf per zijketen het aantal koolstofatomen ter hoogte van het aangegeven koolstofatoom in de hoofdketen (positiecijfer).
STAP 4
Vul de formule aan met H-atomen tot elk C-atoom 4 keer gebonden is.
4-ethyl-5-methyloct-1-yn
C C C C C C C C
4-ethyl-5-methyloct-1-yn
C C-C-C-C-C-C-C
4-ethyl-5-methyloct-1-yn
C C-C-C-C-C-C-C C C C
4-ethyl-5-methyloct-1-yn
CH C-CH2-CH-CH-CH2-CH2-CH3 CH2 CH3 CH3
Acyclische onverzadigde koolwaterstoffen ‘Alkenen en alkynen’
niet-vertakt vertakt
• stam = aantal C’s
• meervoudige binding: -CH=CH- → -een -C C- → -yn positiecijfer als dat nodig is
Voorbeeld:
CH3-CH2-CH2-C CH pent-1-yn
• langste keten = hoofdketen
• positiecijfer: eerst meervoudige binding zijketenregels toepassen
Voorbeeld:
CH3-CH-CH=CH-CH2-CH-CH3 CH3 CH3
2,6-dimethylhept-3-een
Net zoals verzadigde koolwaterstoffen kunnen ook onverzadigde koolwaterstoffen cyclisch voorkomen. Een voorbeeld is cyclohexeen, waarbij er 1 dubbele binding is in de gesloten ringstructuur.
In een ringstructuur kunnen ook meerdere dubbele bindingen voorkomen. Zo bevat cyclohexatrieen (C6H6) 3 dubbele bindingen, die telkens worden afgewisseld met een enkelvoudige binding tussen de C-atomen. De stof is beter gekend onder haar triviale naam benzeen. De benzeenmolecule is bijzonder stabiel, doordat de 3 dubbele bindingen tussen de C-atomen voortdurend van plaats verspringen: de 6 elektronen komen gedelokaliseerd voor in de ringvormige vlakke structuur. In thema 03 maakte je al kennis met die eigenschap van chemische stoffen: mesomerie.
In de ring van C-atomen in benzeen is het mogelijk dat de π-elektronen zich verplaatsen over de bindingen heen. Dat geef je in de structuurformule aan met een cirkel in de zeshoek.
(A) algemene skeletnotatie
skeletnotatie van de uiterste structuren van benzeen (B)
De Duitse chemicus Friedrich Kekulé (1829-1896) is vooral bekend geworden door zijn ontdekking van de ringvormige structuurformule van benzeen. Men beweert dat hij de verklaring van de benzeenring te danken had aan een droom waarin hij een slang in haar eigen staart zag bijten.

Geef de systematische naam van deze stoffen:
a CH3
CH3-C-CH2-CH2-CH3 CH3
b CH3
CH3-CH-CH-CH3 C2H5
c CH3
CH3-CH2-CH2-C-CH2-CH-CH2-CH2-CH3 CH3 C2H5
d CH3C 2H5
CH3-C - CH-CH3 CH3CH3
e CH3
CH2-CH-CH2-CH2 CH3 CH3
Geef 3 mogelijke structuurformules met bijbehorende systematische naam voor C8H18.
Geef voor deze systematische namen de juiste structuurformule:
a 2,3,4-trimethylhexaan
b 3-ethyl-2-methylhexaan
Geef de systematische naam van deze skeletnotaties:
a
b
c
Geef voor deze systematische namen de juiste structuurformule:
a hept-3-yn
b 4-propyloct-2-een
c 4-ethyl-5,5-dimethylhept-2-een
Geef de systematische naam voor:
a CH3 C2H5
CH3-C - C=CH CH3CH3
b
Een student kreeg 2 structuurformules als opgave en gaf er foute namen aan. Leid de 2 opgegeven structuurformules af en geef de juiste naam.
a oct-6-een
b 4,5-methyl-3-ethyldecaan
Op de afbeelding zie je een deel van een riooldeksel.
Daarop staan een aantal verschillende geometrische figuren afgebeeld die overeenstemmen met de vereenvoudigde structuurformules van alkanen.

Welk vertakt alkaan komt er NIET op voor?
a 2,3,4-trimethylpentaan
b 2,4-dimethylpentaan
c 2,2-dimethylbutaan
d 2,3-dimethylbutaan
Waarom kan een ethylgroep nooit op plaats 2 voorkomen in een vertakte koolwaterstof?
Gebruik een structuurformule om je antwoord te ondersteunen. Geef die molecule de juiste systematische naam.
Bouw een structuurformule van een koolwaterstof die voldoet aan deze voorwaarden.
Geef de naam van de molecule die je vormde.
a 6 koolstofatomen
1 koolstofatoom met een sp-hybridisatie
b 5 koolstofatomen
1 koolstofatoom met een sp²-hybridisatie
c 8 koolstofatomen
2 zijketens met respectievelijk
1 en 2 koolstofatomen ` Meer oefenen? Ga naar
ACYCLISCHE VERZADIGDE KOOLWATERSTOFFEN ‘ALKANEN’
NIET-VERTAKT VERTAKT alkaan
Voorbeeld:
Voorbeeld:
CH3-(CH2)3-CH3 n-pentaan
x-R1-y-R2-alkaan
C2H5 |
CH3-CH-C-CH2-CH2-CH3 | | CH3 CH3
3-ethyl-2,3-dimethylhexaan
CYCLISCHE VERZADIGDE KOOLWATERSTOFFEN ‘CYCLOALKANEN'
NIET-VERTAKT VERTAKT cycloalkaan
Voorbeeld: CH2 CH2 CH2 H2C H2C cyclopentaan
Voorbeeld:
x-R1-y-R2-cycloalkaan
Voorbeeld: CH2 CH CH-CH3 CH2 H2C H2C CH3
1,3-dimethylcyclohexaan
ACYCLISCHE ONVERZADIGDE KOOLWATERSTOFFEN ‘ALKENEN EN ALKYNEN’
NIET-VERTAKT VERTAKT
Voorbeeld:
CH3-CH2-CH2-C CH pent-1-yn
CH3-CH-CH=CH-CH2-CH-CH3 | | CH3 CH3
2,6-dimethylhept-3-een
Je weet al dat koolwaterstoffen bestaan uit koolstof- en waterstofatomen. De aanwezigheid van enkelvoudige en/of meervoudige bindingen wordt aangegeven in de naam van de stof. Organische stoffen kunnen ook andere atomen bevatten. Voorbeelden daarvan zijn het zuurstof- en het stikstofatoom. In dit hoofdstuk behandelen we een tiental zogenoemde monofunctionele koolstofverbindingen: ze bevatten een atoom of een groep van atomen die kenmerkend is voor één stofklasse.
LEERDOELEN
L de naam van verschillende monofunctionele koolstofverbindingen (halogeenalkanen, aminen, alcoholen, ethers, aldehyden, ketonen, carbonzuren, esters en amiden) formuleren op basis van de structuurformule of skeletnotatie en omgekeerd
1 Systematische
Je vormt de systematische naam van een monofunctionele koolstofverbinding op een analoge manier als de naam van een koolwaterstof. Bij de monofunctionele koolstofverbindingen moet je de specificiteit van de stofklasse nog toevoegen. Die geef je ofwel als prefix, ofwel als suffix 2 weer. Het is dan respectievelijk een prefix- of een suffixnaam.
Algemeen:
functionele groepaantal C-atomenaard van de bindingfunctionele groep
Voorbeeld:
• prefixnaam
CH3-CH2-Cl
1
2 chloorethaanchloor- -eth- -aan /
• suffixnaam
CH3-COOH
2 ethaanzuur/ eth- -aan- -zuur
Zoals bij de vertakte alkanen of onverzadigde koolwaterstoffen duid je een functionele groep, als dat nodig is, aan met een positiecijfer. Je nummert de koolstatomen op een analoge manier als bij een vertakte koolwaterstofmolecule. Is de functionele groep eindstandig, dan vermeld je het positiecijfer ervan niet
In dit hoofdstuk zul je kennismaken met een tiental monofunctionele stofklassen, elk met hun eigen functionele groep. Sommige functionele groepen hebben een specifieke naam:
FUNCTIONELE GROEP IN MOLECULE
NAAM FUNCTIONELE GROEP -NH2
aminegroep -OH
hydroxylgroep of alcoholgroep -CO-
carbonylgroep
carboxylgroep
amidegroep
Halogeenalkanen worden gekenmerkt door de aanwezigheid van 1 of meer halogeenatomen (-F, -Br, -I, -Cl, algemeen: -X) die enkelvoudig gebonden zijn aan de hoofdketen. De koolstofketen bevat alleen enkelvoudig gebonden C-atomen. Het halogeen kan apart gebonden weergegeven worden of in de hoofdketen.
Voorbeeld:
CH3-CH-CH2-CH2-CH3 Cl
CH3-CHCl-CH2-CH2-CH3
In de systematische naam voeg je de naam van het halogeen toe als prefix. De plaats waar het halogeen bindt aan de hoofdketen, duid je aan zoals bij de alkylzijketens.
Voorbeeld:
CH3-CHCl-CH2-CH2-CH3 → 2-chloorpentaan NAAM PREFIX STAM SUFFIX 1 SUFFIX 2 2-chloorpentaan2-chloor--pent- -aan /
Wanneer hetzelfde halogeen meermaals voorkomt, wordt dat in de naam aangegeven door di-, tri- …
Voorbeeld:
CHCl3 → trichloormethaan
Als er zowel een halogeen als een koolstofzijketen aanwezig is, rangschik je die in de naam alfabetisch. Je bepaalt het positiecijfer zodanig dat het 1e halogeen of de 1e koolstofzijketen een zo laag mogelijk cijfer heeft. Bij gelijkheid kijk je naar de volgende keten.
Voorbeeld:
CH3-CHCl-CH2-CH(CH3)-CH3 → 2-chloor-4-methylpentaan
CH3-CH2-CH(C2H5)-CHBr-(CH2)4-CH3 → 4-broom-3-ethylnonaan
Halogeenatomen kunnen ook worden toegevoegd aan alkenen of alkynen. Dan bepaal je eerst het positiecijfer van de meervoudige binding.
Voorbeeld:
CH2Br-(CH2)4-C CH → 7-broom-hept-1-yn
Halogeenalkanen kennen verschillende toepassingen. Trichloormethaan (CHCl3) is bijvoorbeeld een goed oplosmiddel voor vetten en organische stoffen. Maar als je er te veel van inademt, verlies je het bewustzijn. Je zult het dan ook vooral kennen onder zijn triviale naam, chloroform. Het werd vroeger daarom ook gebruikt als verdovingsmiddel.

Halogeenalkanen worden ook gebruikt als koelmiddel in koel-, vries- en airconditioninginstallaties. Ze worden gebundeld onder de afkorting CFK’s (chloor-fluor-koolstofverbindingen). Vroeger werden die CFK’s, zoals CFCl3 en CF2Cl2, gebruikt als drijfgas in spuitbussen, maar ze zijn milieuonvriendelijk. Ze tasten de ozonlaag (in de atmosfeer) aan, die ons beschermt tegen het uv-licht. Daarom moeten ze apart worden ingezameld in het containerpark.
Aminen worden gekenmerkt door een aminegroep (-NH2) Die groep kan in de hoofdketen worden weergegeven of apart enkelvoudig gebonden aan de keten.
In de systematische naam wijst het suffix -amine naar het voorkomen van de -NH2-groep.
Voorbeeld:
CH3-CH2-NH2
NAAM PREFIX STAM SUFFIX 1 SUFFIX 2 ethaanamine/ eth- -aan- -amine
Als er verwarring mogelijk is, geef je de locatie van de -NH2-groep aan door een positiecijfer te plaatsen vlak voor ‘-amine’.
Voorbeeld:
CH3-CH2-CHNH2-CH3 → CH3-CH2-CH-CH3 NH2 → butaan-2-amine
Start bij het plaatsen van positiecijfers altijd bij de suffixnaam van de organische stof.
Voorbeeld:
CH3-CH(CH3)-CH2-CH2-CH2-NH2 4-methylpentaan-1-amine
Bij de aminen kun je ook gebruikmaken van een prefixnaam: amino- verwijst naar de -NH2-groep.
Voorbeeld:
CH3-CHNH2-(CH2)3-CH3 → hexaan-2-amine → 2-aminohexaan
De aminen die we behandelen in dit leerboek, zijn primaire aminen. Het N-atoom bindt aan 1 C-atoom (en 2 H-atomen): het is een primair N-atoom. Bij aminen spreek je ook van secundaire en tertiaire aminen, waarbij het N-atoom respectievelijk gebonden is aan 2 of 3 C-atomen.
Voorbeeld:
CH3-CH2-NH2 → een primair amine: het N-atoom bindt maar aan 1 C-atoom.
CH3-CH2-NH-CH3 → een secundair amine: het N-atoom bindt aan 2 C-atomen.
CH3-CH2-N-CH3 → een tertiair amine: het N-atoom bindt aan 3 C-atomen.
CH3
De naamgeving van secundaire en tertiaire aminen behandelen we in dit leerboek niet.
Aminen worden gekenmerkt door hun straffe, onaangename geur vanwege hun link met ammoniak (NH3). Die typische ammoniakgeur tref je aan bij korte aminen. In een juiste dosis staan ze in voor de typische geur van oude kaas, serranoham en schimmelkazen.


De vrijgave van aminen wordt in de industrie gebruikt om de versheid van vis na te gaan. De viskwaliteit wordt als excellent beschouwd wanneer het vrijgekomen gehalte aan aminen lager is dan 10 ppm. Als je in een viswinkel de vis sterk ruikt, is de vis dus niet heel vers meer. Maar wat is ppm ook alweer? Zoek het eens op in thema 01.
In de 2e graad leerde je al 2 alcoholen kennen: methanol en ethanol. Als kenmerkende functionele groep komt de hydroxylfunctie (-OH) voor. De -OH-groep kan apart gebonden of in de hoofdketen worden weergegeven. In de systematische naam wijst het suffix -ol naar het voorkomen van de -OH-groep.
De systematische naam van alcoholen wordt als volgt opgebouwd:
Voorbeeld:
CH3-CH2-OH
De plaats waar de functionele groep bindt aan de hoofdketen, duid je aan door vlak voor de verwijzing ‘-ol’ een positiecijfer te plaatsen.
Voorbeeld:
CH3-CH2-CHOH-CH2-CH3 → → pentaan-3-ol
Bij de alcoholen kun je ook gebruikmaken van een prefixnaam: hydroxy- verwijst naar de -OH-groep.
Sommige monofunctionele stofklassen bezitten 2 namen.
Voorbeeld:
CH3-CH2-OH
NAAM PREFIX STAM SUFFIX 1SUFFIX 2 ethanol/ eth- -an- -ol hydroxyethaanhydroxy--eth- -aan /
Alcoholen worden dus gekenmerkt door de aanwezigheid van een hydroxylfunctie (-OH). In thema 04 leerde je al dat hydroxiden ook een -OH-groep bevatten. Maar in een hydroxide is er een ionbinding met een metaal aanwezig, waardoor bv. NaOH en KOH de basische OH--ionen vrijgeven in water. In een alcohol komen enkel atoombindingen voor. De -OH-groep wordt niet vrijgegeven. In het 6e jaar zul je leren dat alcoholen in een zuur-basereactie H+-ionen kunnen afgeven, maar ze doen dat nog moeilijker dan water: het zijn zeer zwakke zuren.
Je kunt alcoholen opdelen in 3 groepen: primaire, secundaire en tertiaire alcoholen
Die opdeling wordt bepaald door het aantal C-atomen waarmee het OH-dragende C-atoom gebonden is.
Afhankelijk van het aantal C-atomen dat op een bepaald C-atoom gebonden is, onderscheid je in een koolstofketen:
• primaire C-atomen: er is 1 C-keten op gebonden;
• secundaire C-atomen: er zijn 2 C-ketens op gebonden;
• tertiaire C-atomen: er zijn 3 C-ketens op gebonden;
• quaternaire C-atomen: er zijn 4 C-ketens op gebonden.
CH3-CH2-CH-CH2-CH3 | OH CH3 CH3 | | CH3‒ C ‒ CH ‒ CH2 ‒ CH3 | CH3
Dat leidt tot primaire, secundaire en tertiaire alcoholen.
Voorbeeld:
• ethanol: CH3-CH2-OH is een primair alcohol (-OH is gebonden aan een primair C-atoom).
• propaan-2-ol: CH3-CHOH-CH3 is een secundair alcohol (-OH is gebonden aan een secundair C-atoom).
• methylpropaan-2-ol: CH3-C(CH3)OH-CH3 is een tertiair alcohol (-OH is gebonden aan een tertiair C-atoom).
• Een quaternair alcohol bestaat niet: alle bindingen zijn ingenomen door C-atomen.
In de lessen biologie heb je zeker al gehoord van glycerol. Chemici spreken van propaan1,2,3-triol (CH2OH-CHOH-CH2OH): glycerol bevat dus 3 hydroxylfuncties. De molecule vormt de basis voor de fosfolipiden die in het celmembraan van onze cellen voorkomen.
Aan 2 hydroxylfuncties worden vetzuren gehecht, die de apolaire staart vormen van de fosfolipide. De 3e hydroxylgroep draagt bij tot de vorming van de polaire kop van de fosfolipide.
Glycerol wordt ook gebruikt in medische bereidingen, om een vergladdend of verzachtend effect te bereiken. Het wordt toegepast in hoestdranken en zetpillen.
Wanneer in een molecule een O-atoom gebonden wordt tussen twee koolstofketens (R-O-R’, waarbij R en R’ koolstofketens zijn, eventueel met een gelijke lengte), dan is dat een nieuwe stofklasse: de ethers. Ethers worden opgedeeld in:
• symmetrische ethers: de 2 koolstofketens hebben een gelijke lengte;
• asymmetrische ethers: de 2 koolstofketens hebben een verschillende lengte.
SYMMETRISCHE ETHER
CH3-CH2-O-CH2-CH3
ASYMMETRISCHE ETHER
CH3-CH2-O-CH2-CH2-CH3
Je kunt de benaming op 2 manieren uitvoeren. We passen dat toe op de formules in de bovenstaande tabel.
Optie 1: Je vermeldt de stofklasse -ether achteraan als suffix, voorafgegaan door de ketennaam van de 2 koolstofketens (alfabetisch gerangschikt). Bij een symmetrische ether gebruik je de notatie di-.
NAAM KOOLSTOFKETENS (ALFABETISCH) SUFFIX diëthylether diëthyl -ether ethylpropylether ethyl- -propyl- -ether
Optie 2: Het zuurstofatoom in de molecule duid je aan met -oxy-. In het prefix geef je ook een aantal C-atomen weer (bv. methoxy-). De langste koolstofketen beschouw je als de stam.
NAAM PREFIXSTAM (LANGSTE) SUFFIX 1SUFFIX 2
ethoxyethaanethoxy- -eth- -aan / ethoxypropaanethoxy- -prop- -aan /
De synthese van een symmetrische en een asymmetrische ether berust op een andere organische reactie (zie verder).
STOFKLASSE
halogeenalkanen
aminen
alcoholen
ethers
STRUCTUURFORMULE SYSTEMATISCHE NAAM
CH3-CH2-CH2Cl 1-chloorpropaan
CH3-CHNH2-(CH2)4-CH3 heptaan-2-amine
CH3-CHOH-CH2-CH3 butaan-2-ol
CH3-O-CH2-CH3 methoxyethaan ethylmethylether
Wanneer je in een apotheek ether bestelt, zul je diëthylether krijgen. Vroeger werd dat gebruikt als anestheticum. In tegenstelling tot wat velen denken, heeft ether geen ontsmettende eigenschappen. Dokters en verpleegkundigen gebruiken het om lijmsporen van pleisters te verwijderen van de huid. De typische geur doet dan ook denken aan ziekenhuizen.
Ether is een vluchtige stof met een kenmerkende geur. Het is ook zeer brandbaar. De mengsels van de damp met lucht zijn explosief en de damp is zwaarder dan lucht. Dat maakt werken met ether zeer gevaarlijk.

De aldehyden worden gekenmerkt door een carbonylfunctie (-CO- of ‒C‒O ).
Die functionele groep staat bij de aldehyden eindstandig en wordt genoteerd als -CHO of C
Het O-atoom in de carbonylfunctie is dus dubbel gebonden aan het C-atoom. Bij consensus mag je niet -COH schrijven, omdat dat lijkt op de hydroxylfunctie van een alcohol.
Bij een aldehyde geef je de functionele groep in de naam aan met het suffix -al. Omdat die carbonylfunctie altijd eindstandig staat, hoef je geen positiecijfer te plaatsen in de naam. Het C-atoom van de -CHO-groep neem je op in de stam van de hoofdketen. NAAM PREFIXSTAM (LANGSTE) SUFFIX 1 SUFFIX 2 ethanal / eth- -an- -al
Voorbeeld:
CH3-CH2-CH2-CHO → → butanal
CH3-CH2-CH2 C O H
Wanneer een aldehyde een koolstofzijketen draagt, plaats je aan de koolstofzijketen een positiecijfer conform de regels. De carbonylfunctie krijgt daarbij altijd positiecijfer 1, maar dat wordt niet genoteerd. Daaruit leid je de andere positiecijfers af.
Voorbeeld:
4 3 2 1
CH3-CH(CH3)-CH2-CHO → → 3-methylbutanal
CH3-CH-CH2 | CH3 C O H
Op de themapagina verwezen we naar sterkwater. Dat wordt gebruikt om organismen te conserveren. Je kunt sterkwater op 2 manieren maken:
• een waterige oplossing van ethanol van circa 70 %;
• een oplossing van het gas methanal of formaldehyde in water (40 %), formol genoemd.
Beide methoden hebben voor- en nadelen. Ethanol is brandbaar en vluchtig en zal, als de pot niet hermetisch gesloten is, langzaam verdampen. In ethanol zal het organisme ook zijn kleur verliezen, in formol minder snel.
WEETJE (VERVOLG)
Formol is kleurloos, maar giftig, kankerverwekkend en bij inademing sterk prikkelend. Formol vernietigt ook het DNA, ethanol niet. Op het DNA van organismen/weefsels bewaard in formol is geen DNA-analyse meer mogelijk. In een school werd formol recent verboden. Ondanks het suffix -ol mag je de naam ‘formol’ niet linken aan de stofklasse van de alcoholen. Het is zoals vermeld een oplossing van een aldehyde, methanal in water.
Collecties in musea zijn vaak opgebouwd uit organismen op sterkwater. Voornamelijk diersoorten met weke delen, zoals vissen, weekdieren, spinnen en sommige zoogdieren, worden op sterkwater bewaard. Het belangrijkste alternatief, drogen, leidt tot sterke vervorming. Opzetten bewaart alleen de uiterlijke verschijningsvorm. Een relatief nieuwe techniek is plastinatie. Die techniek werd bij het grote publiek gekend door de voorstellingen van Körperwelten.
Net zoals de aldehyden worden de ketonen gekenmerkt door een carbonylfunctie. Die staat bij ketonen in de keten niet eindstandig, maar wel tussen 2 koolstofketens. De functionele groep wordt weergegeven in de koolstofketen (-CO-) of de dubbele binding tussen C en O wordt apart weergegeven: ‒C‒
O
In de systematische naam gebruik je het suffix -on om de functionele groep aan te duiden. Het koolstofatoom in de carbonylfunctie (-CO-) tel je mee in de stam van de hoofdketen. Vermeld, als er verwarring mogelijk is, een positiecijfer vlak voor ‘-on’.
NAAM PREFIXSTAM (LANGSTE)
SUFFIX 1 SUFFIX 2 propanon/ prop- -a(a)n- -on
Voorbeeld:
CH3-CH2-CO-CH2-CH3 → → pentaan-3-on
3D-beelden
Misschien vind je thuis wel aceton terug. De wetenschappelijke naam van die vloeistof is propanon, met als formule CH3-CO-CH3. Het is een kleurloze vloeistof die als oplosmiddel wordt gebruikt. Je kunt het gebruiken om lijm, verf of nagellak te verwijderen. In hoofdstuk 5 zul je zien dat we het een universeel solvent noemen.

Carbonzuren worden gekenmerkt door een eindstandige functionele groep: de carboxylfunctie.
Je geeft die functionele groep in de structuurformule weer als -COOH of als C O OH
In het 4e jaar maakte je al kennis met 2 carbonzuren: methaanzuur en ethaanzuur.
In de naam van een carbonzuur geef je de functionele groep achteraan aan door het suffix -zuur. Omdat die carboxylfunctie altijd eindstandig staat, hoef je geen positiecijfer te plaatsen in de naam. Het C-atoom van de -COOH-groep neem je op in de stam van de hoofdketen.
NAAM PREFIXSTAM (LANGSTE) SUFFIX 1 SUFFIX 2 ethaanzuur/ eth- -aan- -zuur
Voorbeeld:
CH3-CH2-CH2-COOH → → butaanzuur
CH3-CH2-CH2 C O OH
Zoals bij de aldehyden plaats je nooit positiecijfer 1 voor het 2e suffix. Maar het is wel bindend, als cijfer 1, voor de bepaling van het positiecijfer van de zijketens bij vertakte carbonzuren.
6 (5←3) 2 1
CH3-(CH2)3-CH(CH3)-COOH → → 2-methylhexaanzuur
CH3-(CH2)3-CH-C | CH3 O OH
In ons lichaam komen verschillende moleculen voor die een carboxylgroep dragen. Zo heb je misschien al gehoord van dierlijke en plantaardige vetzuren. Boterzuur is het vierwaardig carbonzuur butaanzuur, CH3-(CH2)2-COOH. Langere vetzuren vormen een belangrijk onderdeel van ons dieet, bijvoorbeeld palmitinezuur, CH3-(CH2)14-COOH. In de lessen biologie heb je geleerd dat aminozuren de bouwstenen zijn van eiwitten. Zoals de naam zelf zegt, bevat een aminozuur 2 functionele groepen: -NH2 (amino) en -COOH (zuur).
fenylalaninetryptofaan glycine lysine tyrosine
Afb. 155 Enkele voorbeelden van aminozuren met hun kenmerkende aminegroep (-NH2) en carboxylgroep (-COOH)
De volgende groep, de esters, zijn afgeleid van carbonzuren: het zijn carbonzuurderivaten
Het waterstofatoom in de carboxylgroep -COOH wordt vervangen door een alkylgroep. In een ester komt daardoor tussen twee koolstofketens de volgende functionele groep voor: -COO- of O O C
Bij de naamgeving van een ester kun je 2 delen onderscheiden: 1 de hoofdketen, die de -COO-groep bevat en als 2e suffix -oaat draagt; 2 de koolstofketen, die de plaats inneemt van het H-atoom van het corresponderende carbonzuur. Die keten draagt de naam van een zijketen, -yl.
Voorbeeld:
CH3-COO-CH3
NAAM PREFIXSTAM (LANGSTE) SUFFIX 1 SUFFIX 2 methylethanoaatmethyl- -eth- -an- -oaat
Voorbeelden:
• CH3-CH2-COO-CH3 methylpropanoaat
(corresponderend zuur CH3-CH2-COOH: propaanzuur)
‒ Hoofdketen met 3 C-atomen → -propanoaat
‒ Koolstofketen met 1 C-atoom → methyl-
• HCOO-(CH2)2-CH3 propylmethanoaat
‒ Hoofdketen met 1 C-atoom → -methanoaat
‒ Koolstofketen met 3 C-atomen → propyl-
(corresponderend zuur HCOOH: methaanzuur)
Op vind je een totaalbeeld van de mogelijke smaakstoffen die gesynthetiseerd kunnen worden.
Je vermeldt de hoofdketen in de structuurformule van een ester meestal vooraan, maar het is niet fout om de structuurformule te starten met de zijketen.
Voorbeeld:
HCOO-CH2-CH3 → ethylmethanoaat
CH3-CH2-OOCH
Zoals vermeld zijn esters derivaten van carbonzuren, waarbij een alkylgroep de plaats van het H-atoom in de -COOH-groep inneemt. In het 6e jaar zul je leren dat carbonzuren zwakke zuren zijn en dat ze dus na een reactie met een base ook kunnen leiden tot de vorming van een zout Daarbij komt een ionbinding voor tussen het metaalion en de carbonzuurrest.
Voorbeeld:
CH3-CH2-COONa → natriumpropanoaat
Esters hebben een typische geur. Je kunt ze dan ook terugvinden in parfums, feromonen en smaakstoffen. Esters vinden ook nog toepassingen als oplosmiddel, in polyesterkunststoffen en in biodiesel.


Afb. 157 Enkele smaakstoffen



A framboos: butylmethanoaat | B druif: ethylnonanoaat | C ananas: propylpentanoaat | D banaan: ethylbutanoaat | E peer: propylethanoaat
Sommige esters kennen specifieke triviale namen:
HCOOCH3 methylmethanoaat methylformiaat
CH3-COOCH3 methylethanoaat methylacetaat
CH3-CH2-COOCH3 methylpropanoaat methylpropionaat
Als laatste groep bespreken we een 2e derivaat van carbonzuren: de amiden. In die groep wordt de -OH-groep in de carboxylfunctie -COOH vervangen door een -NH2-groep. Amiden worden
daardoor gekenmerkt door een eindstandige amidegroep -CONH2 of O NH2 C
Je telt het koolstofatoom in de amidegroep mee in de hoofdketen. Zoals bij de aldehyden en de carbonzuren plaats je geen positiecijfer bij het suffix -amide.
NAAM PREFIXSTAM (LANGSTE)
SUFFIX 1 SUFFIX 2
ethaanamide/ eth- -aan- -amide
Bij de aanwezigheid van een zijketen bepaalt de amidefunctie wel de locatie van die zijketen.
Voorbeeld:
CH3-CH2-CH(C2H5)-(CH2)2-CONH2 → → 4-ethylhexaanamide
STOFKLASSE
carbonzuren
esters
amiden
STRUCTUURFORMULE SYSTEMATISCHE NAAM
CH3-(CH2)5-COOH heptaanzuur
CH3-COO-(CH2)2-CH3 propylethanoaat
CH3-CONH2 ethaanamide
Amiden vormen de basis van specifieke kunststoffen, de zogenaamde polyamiden (PA). Nylon is een voorbeeld van een PA en wordt onder andere gebruikt bij de productie van nylonkousen, visdraad en veiligheidsvesten, zoals Kevlar. Daar gaan we verder op in als we de kunststoffen behandelen in het 6e jaar.



Geef de systematische naam van deze stoffen:
a CH3-CHBr-CH2-CH2-CH3
b CH3-CH(CH3)-CHI-CH3
c CH3-CH2-CCl2-CHBr-CH=CH-CH2-CH3
d CH3-CHNH2-(CH2)3-CH3
e CH3-CH2-CH2OH
f CH3-CH2-CH2-O-CH3
Geef voor deze systematische namen de juiste structuurformule:
a 2,3,4-trijoodoctaan
b 2-broom-3-chloorbutaan
c dec-3-yn
d 3-broompent-2-een
e 4-chloor-5,5-dimethylhept-2-een
f methaanamine
g pentaan-2-ol
h ethoxybutaan
Geef de systematische naam van deze skeletnotaties:
a OH
b O
Geef de skeletnotatie van deze molecule: pentaan-1-ol
Geef de systematische naam van deze aldehyden en ketonen:
a CH3-CH2-CH2-CHO
b CH3-CO-CH2-CH3
c CH3-CHCl-(CH2)3-CHO
d CH3-CO-(CH2)5-CH3
Geef de structuurformule van deze aldehyden en ketonen:
a propanon
b methanal
c pentaan-3-on
d 3-methylbutanal
Geef de skeletnotatie van deze molecule:
CH3-CH2-CH2-CHO
Geef de systematische naam van deze carbonzuren, esters en amiden:
a HCOOH
b CH3-COO-CH3
c CH3-CH2-CH2-CONH2
d CH3-CHCl-(CH2)5-COOH
e HCOO-(CH2)3-CH3
f CH3-CONH2
Geef de structuurformule van deze carbonzuren, esters en amiden:
a pentaanzuur
b methylmethanoaat
c ethaanzuur
d ethylbutanoaat
e propaanamide
f 4-chloorpentaanamide
Geef de skeletnotatie van deze molecule:
CH3-CH2-COO-CH3
Geef de systematische naam van deze stoffen:
a CH3-(CH2)4-CHI-CH3
b CH3-C(CH3)2-CHBr-CH(CH3)-CH2-CH2-CH3
c CH3-CH=CH-CHI-CH2-CHBr-CH2-CH2-CH3
d CH3-CH2-CH2NH2
e CH3-CHNH2-(CH2)3-CH3
f CH3-CH2-CH2-CH2OH
g CH3-(CH2)4-O-CH3
h CH3OH
Geef voor deze systematische namen de juiste structuurformule:
a 2-chloorhexaan
b 1-jood-2-methylheptaan
c pent-1-een
d 2-broomdec-3-yn
e 2-chloorbut-2-een
f 7-chloor-5-joodhept-3-yn
g 3-methylbutaan-1-amine
h ethanol
i hexaan-1-ol
j 3-jood-5-methyloctaan-2-ol
k methoxypropaan
Geef de systematische naam van deze skeletnotaties:
a Cl b OH
Geef de skeletnotatie van deze molecule: 3-methylheptaan-3-ol
Geef de systematische naam van deze aldehyden en ketonen:
a CH3-(CH2)4-CHO
b CH3-CO-CH2-CH2-CH3
c CH2I-(CH2)6-CHO
d CH3-CH2-CO-(CH2)3-CH3
Geef de structuurformule van deze aldehyden en ketonen:
a methylbutanon
b ethanal
c propanon d 2-chloorpentanal
Geef de systematische naam van deze carbonzuren, esters en amiden:
a CH3-CH2-COOH
b CH3-CH2-CH2-COO-CH3
c CH3-CH2-CH2-CH2-CONH2
d CH3-(CH2)5-COOH
e CH3-COO-(CH2)4-CH3
f CH3-CH2-CH2-CONH2
Geef de structuurformule van deze carbonzuren, esters en amiden:
a butaanzuur
b propylethanoaat
c octaanzuur
d pentylhexanoaat
e ethaanamide
Meer oefenen? Ga naar .
kennisclip
halogeenalkanen
aminen alcoholen ethers aldehyden ketonen carbonzuren
esters amiden
= C-KETEN)
R-X
R-NH2
R-OH
R-O-R'
R-C-H II O
R-C-R' II O
R-C-OH II O
R-C-O-R' II O
R-C-NH2 II O
CH3-CH-CH3 | Cl
CH3-(CH2)4-CH2NH2
CH3-CHOH-CH2-CH3
CH3-CH2-O-CH3
CH3-C-H II O
CH3-(CH2)2-C-CH3 II O
CH3-(CH2)5-C-OH II O
CH3-CH2-C-O-CH2-CH3 II O
CH3-(CH2)7-C-NH2 II O
2-chloorpropaan
hexaan-1-amine
butaan-2-ol
methoxyethaan
ethanal
pentaan-2-on
heptaanzuur
ethylpropanoaat
nonaanamide
HOOFDSTUK 4
In hoofdstuk 3 leerde je verschillende monofunctionele stofklassen kennen. Daardoor is de groep van de organische stoffen al erg uitgebreid. Is het je opgevallen dat we telkens de structuurformule gebruikten en de brutoformule achterwege lieten? Een brutoformule kan immers de bouwstenen bevatten van verschillende structuurformules met verschillende chemische en fysische eigenschappen, dus van verschillende chemische stoffen. Je spreekt van de eigenschap isomerie: met dezelfde bouwstenen kun je verschillende organische stoffen vormen. Je zult ook merken dat je sommige organische stoffen uit hoofdstuk 2 nog kunt opsplitsen in 2 organische stoffen.
But-2-een zullen we gebruiken om 1 type isomerie aan te duiden: cis-trans-isomerie. Zo bespreken we elke isomerievorm met behulp van eenvoudige moleculen. We leggen ook de link met reële processen. Cis-trans-isomerie speelt bijvoorbeeld een rol in het biochemisch mechanisme dat de basis vormt van ons gezichtsvermogen. Een ander type isomerie, optische isomerie, linken we dan weer aan ouderdomsverschijnselen bij de mens.
LEERDOELEN
L Het begrip ʻisomerieʼ uitleggen aan de hand van concrete voorbeelden
L Structuurisomeren herkennen en opstellen (plaats-, functie- en ketenisomerie)
L Stereo-isomeren herkennen en opstellen (cis-trans- en optische isomerie)
L Voorbeelden van isomerie uit het dagelijks leven geven
Sommige organische verbindingen hebben wel dezelfde brutoformule, maar een verschillende molecuulbouw. Dat verschijnsel noem je isomerie. De moleculen van die stoffen zijn dus opgebouwd uit hetzelfde aantal identieke atomen, maar die atomen worden anders geordend (gebonden). Daardoor bezitten de stoffen verschillende fysische en chemische eigenschappen.
Voor de brutoformule C2H6O bestaan er bijvoorbeeld 2 isomeren:
1 Ethanol (CH3-CH2OH) is een stof met de eigenschappen van een alcohol en een kookpunt van +78 °C.
2 Methoxymethaan of dimethylether (CH3-O-CH3) is een stof met de eigenschappen van een ether en een kookpunt van –24 °C.
Isomeren moeten dan ook een verschillende naam dragen, zodat duidelijk is welke isomeer specifiek bedoeld wordt. Dat kan leiden tot:
• duidelijk verschillende namen (bv. ethanol en methoxymethaan/dimethylether);
• een ander positiecijfer (bv. pent-1-yn en pent-2-yn);
• extra informatie (bv. (2Z)-but-2-een en (2E)-but-2-een).
Isomeren zijn stoffen met dezelfde brutoformule, maar een verschillende molecuulbouw en verschillende eigenschappen.
Isomerie komt van het Griekse ἰσος (isos), dat ʻgelijkʼ betekent, en μερος (meros), ʻdeelʼ.
In de lessen biologie leerde je al meer over de suikers fructose en glucose. Die moleculen dragen beide als brutoformule C6H12O6, maar hebben een andere structuurformule: het zijn isomeren van elkaar. Als je dus specifiek glucose of fructose wilt weergeven, maak je het best gebruik van de structuurformule. BRUTOFORMULE
Je spreekt van structuurisomerie wanneer specifieke atomen of een atoomgroep op een andere plaats op de hoofdketen voorkomen. Je onderscheid 3 vormen van structuurisomerie: 1 ketenisomerie; 2 plaatsisomerie; 3 functie-isomerie.
Je spreekt van ketenisomerie als bij 2 moleculen met een gelijke brutoformule de structuur van de stam verschilt. Daarbij kunnen de moleculen al dan niet vertakt zijn, een verschillend aantal vertakkingen hebben of verschillende vertakkingen bezitten.
VOORBEELD KETENISOMERIE
C4H10 CH3-CH2-CH2-CH3 CH3 | CH3-CH-CH3 n-butaan methylpropaan
C9H20 CH3 | CH3-CH-CH-CH-CH2-CH3 | | CH3 CH3 CH3 | CH3-CH2-CH-CH-CH2-CH3 | CH2 | CH3 2,3,4-trimethylhexaan 3-ethyl-4-methylhexaan
Je spreekt van plaatsisomerie als bij 2 moleculen met een gelijke brutoformule de plaats van een functionele groep, een meervoudige binding of een vertakking verschilt
VOORBEELDEN PLAATSISOMERIE
C3H8O HHH ||| H-C-C-C- OH ||| HHH HHH ||| H-C-C-C-H ||| HOHH propaan-1-ol propaan-2-ol
C4H8 HH C CHH || HC-C-H || HH HH
HC CH | | H-CC-H || HH but-1-een but-2-een
C6H14 HHHHH ||||| H-C-C-C-C-C-H ||||| HCH3 HHH HHHHH ||||| H-C-C-C-C-C-H ||||| HHCH3 HH 2-methylpentaan 3-methylpentaan
Je spreekt van functie-isomerie als je bij 2 moleculen met een gelijke brutoformule 2 structuurformules kunt maken van stoffen uit een verschillende stofklasse: de moleculen dragen een verschillende functionele groep.
• Ketonen en aldehyden zijn functie-isomeren van elkaar.
C3H6O HH || H-C-C-C-H | | HOH HHO || H-C-C-C || HHH propanon propanal
• Alcoholen en ethers zijn functie-isomeren van elkaar.
C4H10O HHHH |||| H-C-C-O-C - C - H |||| HHHH HHHH |||| H-C-C-C-C-H |||| HHOHH ethoxyethaan (diëthylether) butaan-2-ol
• Esters en carbonzuren zijn functie-isomeren van elkaar.
C4H8O2 HOHH | || H-C - C-O-C - C - H ||| HHH
HHHO ||| H-C-C-C-C ||| HHHOH ethylethanoaat butaanzuur
Bij stereo-isomerie of geometrische isomerie nemen bepaalde atomen of atoomgroepen andere ruimtelijke posities in ten opzichte van elkaar. Bij die vorm van isomerie heeft elk atoom echter wel dezelfde bindingspartners. Je onderscheidt 2 types van stereo- of geometrische isomerie:
• cis-trans-isomerie;
• optische isomerie
Cis-trans-isomerie is kenmerkend voor de alkenen. Omdat er geen rotatie mogelijk is rond een dubbele binding, kunnen er 2 verschillende moleculen gevormd worden als beide C-atomen 2 verschillende substituenten hebben.
• De Z-variant: dezelfde substituent ligt bij beide C-atomen aan dezelfde zijde van de dubbele binding (Z = zusammen). Vroeger sprak men van de cis-variant.
• De E-variant: dezelfde substituent ligt bij beide C-atomen aan weerszijde van de dubbele binding (E = entgegen). Vroeger sprak men van de trans-variant.
De codes Z en E worden tussen haakjes schuingedrukt weergegeven, eventueel voorafgegaan door het positiecijfer van de dubbele binding.
VOORBEELD CIS-TRANS-ISOMERIE
(2Z)-but-2-een cis-but-2-een (2E)-but-2-een trans-but-2-een
WEETJE
Cis-trans-isomerie en het gezichtsvermogen In het biochemisch mechanisme dat de basis vormt van het gezichtsvermogen, speelt de cis-trans-isomerie rond de 3e dubbele binding een belangrijke rol. De lichtgevoelige molecule rodopsine (een proteïne) in de staafjes van het netvlies bevat een Z-retinalmolecule. Wanneer er een foton met gepaste energie op die molecule invalt, zal ze isomeriseren tot E-retinal, waardoor een zenuwimpuls naar de hersenen wordt geleid. Het E-retinal wordt vervolgens weer omgezet in de Z-vorm, die dan opnieuw een foton kan ontvangen.
Optische isomerie treedt op wanneer in een molecule een C-atoom voorkomt met 4 verschillende gebonden atomen of atoomgroepen: je spreekt van een asymmetrisch C-atoom of een chiraal centrum. De 2 isomeren hebben dezelfde structuurformule, maar hun ruimtelijke opbouw is verschillend.
VOORBEELDEN OPTISCHE ISOMERIE
butaan-2-ol
3D-beelden
CH3-CH2-CHOH-CH3 C* CH3 H CH2-CH3 OH C* CH3 H CH3-CH2 OH spiegelvlak
2-hydroxypropaanzuur
CH3-CHOH-COOH C* H3C COOH H OH C* CH3 HOOC H HO spiegelvlak
2-aminopropaanzuur
H2N-CH-COOH | CH3 C* HOOC H NH2 CH3 C* COOH H H2N CH3 spiegelvlak
Je noemt die isomeren ook chirale isomeren, omdat ze ruimtelijk gezien elkaars spiegelbeeld zijn, zoals de linkerhand het spiegelbeeld is van de rechterhand. Een chiraal C-atoom wordt in een molecule aangeduid als C*
2-aminopropaanzuur is hetzelfde als het aminozuur alanine, dat je waarschijnlijk kent uit de lessen biologie.
Chiraal is afgeleid van het Griekse χειρ (cheir), dat ʻhandʼ betekent.
Optische isomeren verschillen maar weinig in hun fysische en chemische eigenschappen. Een van de eigenschappen waarin ze verschillen, is hun vermogen om de draaiing van gepolariseerd licht te veranderen: ze hebben een andere optische activiteit. Je spreekt daarom van optisch actieve stoffen. Wanneer licht door een oplossing van die stoffen gestuurd wordt, dan draait het licht, afhankelijk van de isomeer, naar links of naar rechts. Je duidt dat aan door ofwel + (= rechts), ofwel – (= links) voor de naam te vermelden. Je spreekt daarom ook van rechts- en linksdraaiende moleculen. Het betreft een fysische eigenschap die je niet kunt aflezen uit de structuurformule. We beperken ons daarom tot het herkennen van optische isomerie in een structuurformule. De specifieke optische eigenschap van een stof hoef je niet te kennen.
Ketenisomerie
De structuur van de hoofdketen varieert.
Voorbeeld: n-pentaan methylbutaan
Plaatsisomerie
De plaats van de functionele groep of zijketen varieert.
Voorbeeld: Br 2-broompentaan Br 3-broompentaan
Cis-trans-isomerie
De schikking van de substituenten rond de dubbel gebonden C-atomen varieert.
Voorbeeld:
Functie-isomerie
De functionele groep varieert.
Voorbeeld: OH propaan-1-ol O methoxyethaan
Optische isomerie
De schikking van de 4 verschillende bindingspartners rond een asymmetrisch C-atoom varieert.
Voorbeeld:
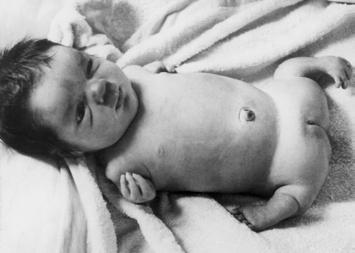
Optische isomerie en Softenon Onder meer bij de bereiding van medicijnen is het belangrijk om de gewenste spiegelbeeldvorm te bereiden. Dat werd dramatisch aangetoond in de jaren vijftig van de vorig eeuw, toen men thalidomide gebruikte onder de merknaam Softenon. Dat medicijn werd gegeven aan zwangere vrouwen tegen ochtendmisselijkheid. Thalidomide bleek echter ook te leiden tot ernstig misvormde ledematen bij de ongeboren babyʼs. Het tablet verscheen op de markt als een racemisch mengsel (een equimoleculair mengsel van beide optische isomeren). Uit wetenschappelijk onderzoek bleek dat het teratogene effect (waarbij afwijkingen ontstaan aan de foetus) toe te schrijven is aan 1 van de optische isomeren (het links-thalidomide), terwijl de andere isomeer de correcte werking veroorzaakt. Tegenwoordig kan men 1 van de spiegelbeelden in zuivere vorm synthetiseren.
De Softenon-ramp heeft de ogen geopend van bedrijven die geneesmiddelen produceren. De kosten voor research lopen hoog op alvorens men een geneesmiddel op de markt brengt. Ter compensatie kan een bedrijf een octrooi aanvragen en gedurende een aantal jaren het alleenrecht hebben op de verkoop. Als die periode voorbij is, kan de concurrentie spelen en daalt de prijs van het geneesmiddel. Je spreekt dan van generische geneesmiddelen.
Geef voor C4H10O voorbeelden (systematische naam en structuurformule) van: a plaatsisomerie b ketenisomerie c functie-isomerie d optische isomerie
Teken deze lewisformule over:
Bekijk aandachtig de structuur van deze organische moleculen, die vaak in zonneproducten aanwezig zijn:
a Markeer waar mogelijk in die formule:
1 een secundair C-atoom: markeer met geel; 2 een asymmetrisch C-atoom: markeer met groen.
b Is hier cis-trans-isomerie mogelijk? Omcirkel in dat geval de verantwoordelijke structuren.
Geef de structuurformule en de systematische naam van het kleinste alkaan met optische isomerie.
Waarom is pent-2-een een verzamelnaam en propeen niet? Leg uit met behulp van de structuurformules en de systematische namen.
Geef alle mogelijke isomeren van n-heptaan. Noteer het isomerietype en de systematische naam.
Beantwoord deze vragen over de opgegeven moleculen:
a Avobenzon: is het C-atoom waarop de ethergroep (zie pijl) hangt, een asymmetrisch C-atoom? Leg bondig uit waarom wel/niet.
b Octylmethoxycinnamaat: bestaat er van die molecule cis-trans-isomerie? Indien ja: staat hier de cis- of de trans-vorm voorgesteld? Indien nee: leg bondig uit waarom niet.
Van welke niet-vertakte esters is pentaanzuur een isomeer? Geef de structuurformule en de systematische naam.
• Isomeren zijn stoffen met dezelfde brutoformule, maar een verschillende molecuulbouw en verschillende eigenschappen.
• Er bestaan verschillende soorten isomerie:
KETENISOMERIE
De structuur van de hoofdketen varieert.
Voorbeeld: n-pentaan methylbutaan
PLAATSISOMERIE
De plaats van de functionele groep of zijketen varieert.
Voorbeeld: Br 2-broompentaan Br 3-broompentaan
CIS-TRANS-ISOMERIE
De schikking van de substituenten rond de dubbel gebonden C-atomen varieert.
Voorbeeld:
FUNCTIE-ISOMERIE
De functionele groep varieert.
Voorbeeld: OH propaan-1-ol O methoxyethaan
OPTISCHE ISOMERIE
De schikking van de 4 verschillende bindingspartners rond een asymmetrisch C-atoom varieert.
Voorbeeld:
spiegelvlak (2Z)-but-2-een versus (2E)-but-2-een butaan-2-ol
HOOFDSTUK 5
In thema 04 bespraken we de fysische eigenschappen van de anorganische stoffen. Voor het kook- en smeltpunt van de atoomverbindingen moest je de sterkte van de verschillende intermoleculaire krachten nagaan. Aangezien (bijna) alle organische stoffen atoomverbindingen zijn, moet je daar op dezelfde manier te werk gaan. Je moet dus nagaan hoe groot de londonkracht en dipoolkracht zijn, maar ook of er eventueel waterstofbruggen kunnen worden gevormd. Voor de oplosbaarheid geldt ook nog altijd dezelfde regel: polaire stoffen lossen goed op in polaire oplosmiddelen, maar niet in apolaire oplosmiddelen en omgekeerd. Kortweg: ʻsoort zoekt soortʼ.
LEERDOELEN
L Het kook- en smeltpunt van organische stoffen verklaren aan de hand van de aanwezige intermoleculaire krachten
L De oplosbaarheid van organische stoffen verklaren aan de hand van de aanwezige intermoleculaire krachten
Voor het kook- en smeltpunt van apolaire moleculen – de alkanen, de alkenen en de alkynen – moet je enkel rekening houden met de zwakke london- of london-dispersiekracht. Vorig schooljaar en in thema 04 haalden we al aan dat die kracht toeneemt als de polariseerbaarheid van de molecule stijgt. Voor moleculen die tot dezelfde stofklasse behoren, betekent dat dat die kracht toeneemt met een toenemende molaire massa. Vandaar dat het kooken smeltpunt voor dezelfde stofklasse toeneemt met het aantal C-atomen. Eigenlijk is dat heel logisch. Een stof laten smelten of koken wil zeggen dat je ervoor zorgt dat de deeltjes meer ten opzichte van elkaar gaan bewegen. Dat gaat vlotter naarmate de deeltjes lichter zijn, dus minder C-atomen bevatten. Maar de deeltjes zijn dan niet alleen lichter, het contactoppervlak is ook nog eens kleiner. Die twee factoren zorgen ervoor dat het kookpunt lager is naarmate er minder C-atomen in de keten zitten, zoals je kunt zien in de volgende tabel.
Maar ook de vertakkingsgraad speelt een rol. Wanneer je het kookpunt van de volgende moleculen vergelijkt, stel je vast dat het kookpunt daalt wanneer de vertakkingsgraad stijgt. De moleculen zijn allemaal even zwaar, maar het contactoppervlak verschilt. Bij n-pentaan is het contactoppervlak het grootst. Vandaar dat die molecule het hoogste kookpunt heeft, zoals je kunt zien in de volgende tabel.
In eerste instantie bekijken we het verschil in kookpunt tussen stoffen die tot dezelfde stofklasse behoren (zie afbeelding 164).
Aangezien de molaire massa een invloed heeft op de london- of london-dispersiekracht, is in de volgende grafiek voor elke stofklasse het kookpunt weergegeven in functie van de molaire massa. Het is beter om op de x-as de molaire massa uit te zetten in plaats van het aantal C-atomen. Anders breng je de massa van de functionele groep niet in rekening en kun je dus moeilijker een juiste conclusie over de stofklassen heen trekken. Binnen dezelfde stofklasse komt een toenemende molaire massa natuurlijk overeen met een toenemend aantal C-atomen.
In plaats van te kijken naar de vertakkingsgraad, kun je ook nagaan hoe goed de molecule de bolvorm benadert. Hoe groter de vertakkingsgraad, hoe meer bolvormig een molecule is en hoe lager het kook- en smeltpunt zijn.
halogeenalkanen aldehyden
alkynen alkenen
n-alkanen
molaire massa ( g mol)
Afb. 164 Het kookpunt van een organische stof hangt niet alleen af van de molaire massa (london- of london-dispersiekracht), maar ook van de dipoolkracht en eventueel de waterstofbrug(gen).
Je kunt ook het verschil in kookpunt verklaren tussen moleculen die tot een verschillende stofklasse behoren. Dat is echter alleen mogelijk als je het aantal C-atomen bij de moleculen gelijk houdt, zodat het effect van de molaire massa verwaarloosbaar is.
Je kunt vaststellen dat de alkanen, alkenen en alkynen het laagste kookpunt hebben. Dat zijn apolaire moleculen waarbij alleen maar de zwakke london- of london-dispersiekracht aanwezig is.
De meeste organische stoffen bevatten een polaire functionele groep. Om het kook- en smeltpunt van die stoffen in te schatten, moet je niet alleen rekening houden met de londonof london-dispersiekracht, maar ook met de dipoolkracht en eventueel de waterstofbruggen.
De ethers hebben, ondanks de aanwezigheid van een zuurstofatoom, een eerder laag kookpunt.
Dat komt doordat het zuurstofatoom zeer afgeschermd is, waardoor de polariteit niet echt tot uiting komt. Ethers met een langere C-keten zijn zelfs eerder apolair.
Opmerking:
Ondanks het voorkomen van een O-atoom kunnen ethers geen waterstofbruggen vormen, omder er geen enkel H-atoom op dat O-atoom gebonden is.
Vervolgens zijn er een heel aantal monofunctionele stofklassen met een polaire functionele groep, zoals de halogeenalkanen, de aldehyden en de ketonen. Die hebben een iets hoger kookpunt door de aanwezigheid van de dipoolkracht naast de london-dispersiekracht.
De alcoholen, maar zeker de carbonzuren, springen eruit door hun extreem hoge kookpunt. Dat komt door de aanwezigheid van waterstofbruggen. Door het extra zuurstofatoom bij de carbonzuren zijn er meer waterstofbruggen mogelijk, waardoor het kookpunt nog hoger is in vergelijking met dat van de alcoholen. Ze kunnen zelfs paren of dimeren vormen. Daarbij worden er 2 waterstofbruggen per dimeer gevormd.
Ethanol:
Ethaanzuur:
Afb. 166 Waterstofbruggen tussen respectievelijk ethanolmoleculen en ethaanzuurmoleculen. 2 ethaanzuurmoleculen vormen dimeren met elkaar.
Ook aminen kunnen waterstofbruggen vormen, want er is een H-atoom aanwezig dat op N gebonden is. Toch hebben de aminen een veel lager kookpunt dan de alcoholen en de carbonzuren. Aangezien N een lagere EN-waarde heeft dan O, zijn de waterstofbruggen bij de aminen zwakker dan bij de alcoholen en de carbonzuren. Ook de dipoolkrachten zijn, om dezelfde reden, zwakker bij de aminen dan bij de alcoholen en de carbonzuren.
VOORBEELD VERBAND KOOKPUNT EN LONDON-DISPERSIEKRACHT
NAAM propaan-1-ol butaan-1-ol methylpropaan-1-ol
Het kookpunt van propaan-1-ol is beduidend lager dan dat van butaan-1-ol. Beide stoffen kunnen waterstofbruggen aangaan en bezitten dipoolkrachten. Het verschil in kookpunt is te verklaren door het verschil in massa tussen de moleculen en ook door het verschil in londondispersiekracht dat daaruit volgt. De koolstofketen van butaan-1-ol bevat 4 C-atomen, terwijl die van propaan-1-ol 3 C-atomen lang is. De london-dispersiekracht in butaan-1-ol is dus groter, wat resulteert in een hoger kookpunt.
Als je het kookpunt van butaan-1-ol vergelijkt met dat van methylpropaan-1-ol, zie je dat butaan-1-ol een hoger kookpunt heeft. Beide moleculen hebben dezelfde molaire massa, maar hier zorgt het verschil in vertakkingsgraad voor een verschil in london-dispersiekracht. Methylpropaan-1-ol is meer vertakt (en benadert dus meer de bolvorm), waardoor de londondispersiekracht in die stof kleiner is, wat resulteert in een lager kookpunt.
Het kookpunt van organische stoffen hangt af van:
• de london- of london-dispersiekracht:
‒ neemt toe met een toenemende molaire massa;
‒ neemt af als de vertakkingsgraad toeneemt of als de molecule meer een bolvorm benadert;
• de dipoolkracht: aanwezig bij moleculen met een polaire functionele groep;
• waterstofbrug: aanwezig bij alcoholen en carbonzuren en minder sterke waterstofbruggen bij aminen. Carbonzuren vormen zelfs dimeren.
Net als bij de anorganische verbindingen geldt hier dat een stof pas zal oplossen in een oplosmiddel als de te verbreken krachten kleiner zijn dan de gevormde krachten. Zo zullen de zwakke london-dispersiekrachten tussen de apolaire alkanen niet in staat zijn om de waterstofbrugkrachten tussen de watermoleculen te verbreken. Vandaar dat de alkanen niet oplosbaar zijn in het polaire water.
Voor de stofklassen met een polaire functionele groep zal de oplosbaarheid in water afnemen naarmate de C-keten langer wordt. De C-keten is apolair, waardoor het apolaire karakter van de molecule toeneemt. Als er waterstofbruggen kunnen worden gevormd met de watermoleculen, zal de oplosbaarheid natuurlijk heel hoog zijn. Dat is onder andere het geval bij de ethers, de alcoholen en de carbonzuren.
VOORBEELD
NAAM
STRUCTUURFORMULE OPLOSBAARHEID IN WATER
methoxymethaan of dimethyletherCH3-O-CH3 oplosbaar
methoxyethaan of ethyl-methyletherCH3-O-CH2-CH3 oplosbaar
ethoxyethaan of diëthyletherCH3-CH2-O-CH2-CH3 minder oplosbaar
ethoxypropaan of ethyl-propyletherCH3-CH2-O-CH2-CH2-CH3 nog minder oplosbaar
propoxypropaan of dipropylether
methanol
ethanol
propaan-1-ol
butaan-1-ol
pentaan-1-ol
decaan-1-ol
CH3-CH2-CH2-O-CH2-CH2-CH3 zeer weinig oplosbaar
CH3OH oplosbaar
CH3-CH2OH oplosbaar
CH3-CH2-CH2OH oplosbaar
CH3-CH2-CH2-CH2OHminder oplosbaar
CH3-CH2-CH2-CH2-CH2OHnog minder oplosbaar
CH3-(CH2)8-CH2OH onoplosbaar
Zowel bij de ethers als bij de alcoholen valt het op dat naarmate het aantal C-atomen in de molecule toeneemt, de oplosbaarheid in water daalt. Hoe langer de C-keten, hoe groter het apolaire karakter van de molecule. Dan is het ook logisch dat de molecule minder oplosbaar is in het polaire water.
Sommige organische stoffen, zoals aceton, kunnen zelfs als universeel solvent worden gebruikt. Ze hebben een polair en een apolair deel, waardoor ze in staat zijn om zowel polaire als apolaire moleculen op te lossen.
WEETJE ©VANIN
apolair polair

Afb. 167 Aceton heeft zowel een polair als een apolair deel, waardoor het als universeel solvent kan worden gebruikt, bijvoorbeeld als nagellakverwijderaar.
Polaire stoffen lossen op in polaire oplosmiddelen zoals water, apolaire niet. Als de C-keten toeneemt, wordt de molecule meer apolair en daalt de oplosbaarheid in water. Universele solventen zijn moleculen met zowel een polair als een apolair deel.
In het 3e jaar leerde je al over emulsies: heterogene mengsels van 2 vloeistoffen, bijvoorbeeld olie en water. Om beide vloeistoffen toch een min of meer homogeen geheel te doen vormen, voegt men er een emulgator aan toe. Die techniek wordt gebruikt om mayonaise te maken, maar ook bij dragcrème.
toevoegen emulgator water olie waterminnend (hydrofiel) emulgator
watervrezend (hydrofoob) water olie olie-wateremulsie (oplossing)
Afb. 168 Emulgatoren hebben een polaire kop en een apolaire staart. Op die manier zorgen ze voor een homogeen geheel wanneer je olie in water (zoals bij mayonaise) of water in olie (zoals bij een dagcrème) wilt mengen.
Welke molecule heeft het hoogste kookpunt?
Leg uit.
a methylpropaan-1-ol
b methylpropaan-2-ol
Rangschik deze moleculen volgens stijgend kookpunt (van links naar rechts) en verklaar.
a CH3-COOH CH3-COONa CH3-CH2OH
b n-heptaan n-pentaan n-hexaan
c ethanol glycerol methanol
d butaan-1-ol ethanol propaan-1-ol
e CH3OH HCHO C2H2
f pentaan-1-ol dimethylpropaan-1-ol 3-methylbutaan-1-ol
Welke factoren zijn bepalend voor de aggregatietoestand bij kamertemperatuur van deze stoffen? Benoem de krachten zo specifiek mogelijk.
a C2H5OH
b C2H2
c CH4
d CH3COONa
e CH3COOH
Welke molecule is het minst vluchtig?
Leg uit.
a n-propaan b propaanzuur
c n-butaan
Welke krachten moet je overwinnen bij het verdampen van aceton? Benoem de krachten zo specifiek mogelijk.
Jim wil de intermoleculaire krachten van deze stoffen vergelijken: ethanol, butaan-1-ol, propaan-1-ol en n-pentaan. Hij volgt daarvoor de temperatuurverandering tijdens het verdampen van elk van die stoffen. Het resultaat van het experiment zie je in deze grafiek:
Welke stof hoort bij curve A? Leg uit.
Van 2 koppels isomeren is het kook- of smeltpunt gegeven.
Er is amper een verschil in kookpunt tussen het 1e koppel isomeren, terwijl er bij het andere koppel wel een verschil is.
a Hoe kun je op basis van de heersende intermoleculaire krachten het kleine verschil in kookpunt bij koppel 1 verklaren?
b Hoe kun je op basis van de heersende intermoleculaire krachten het grotere verschil in kookpunt bij koppel 2 verklaren?
Koppel 1:
Koppel 2:
Lossen deze verbindingen het best op in water of in n-pentaan? Verklaar met behulp van de intermoleculaire krachten.
a CCl4
b C2H5Cl
c CH3COOH
d CH3-OH
De onderstaande afbeelding toont emulgatormoleculen op de grens van olie en water.
Welke deeltjes vind je hoogstwaarschijnlijk terug op plaats A?
Welke stof lost het best op in water: (2E)-but-2-een of (2Z)-but-2-een? Verklaar met behulp van de intermoleculaire krachten.
De onderstaande afbeelding toont 4 mogelijke liggingen van een eiwit in een celmembraan.
De donkerroze regio’s zijn voornamelijk samengesteld uit polaire en geladen aminozuren, terwijl de lichtroze regio’s vooral niet-polaire aminozuren bevatten.
Welke positie (1, 2, 3 of 4) is de meest waarschijnlijke ligging van de proteïne ten opzichte van het celmembraan? ` Meer oefenen? Ga naar
LONDON- OF LONDON-DISPERSIEKRACHT
• Neemt toe als de massa toeneemt.
• Neemt af als de vertakkingsgraad toeneemt of als de molecule beter de bolvorm benadert.
• Komt voor bij alle stofklassen. Bij apolaire verbindingen (alkanen, alkenen, alkynen) is dat de enige kracht die aanwezig is.
SMELT- EN KOOKPUNT
DIPOOLKRACHT
• Neemt toe als het verschil in EN-waarde toeneemt.
• Komt voor bij monofunctionele verbindingen. Komt minder tot uiting bij de ethers.
WATERSTOFBRUG
• Komt voor bij stofklassen met H die op F, O of N staat.
• Komt voor bij de aminen en de alcoholen, en nog meer bij de carbonzuren.
APOLAIRE MOLECULEN
• De C-keten is apolair: hoe langer de C-keten is, hoe minder goed de molecule oplosbaar is in water (en omgekeerd in een apolair solvent).
POLAIRE MOLECULEN
• De moleculen zijn oplosbaar in water.
• Als er waterstofbruggen gemaakt kunnen worden, zal dat een gunstig effect hebben op de oplosbaarheid in water.
• Hoe langer de C-keten, hoe slechter de oplosbaarheid in water.
HOOFDSTUK 6
Je hebt al geleerd dat tijdens een anorganische reactie tussen bijvoorbeeld een zuur en een base er een zout en water worden gevormd. Die reactie is een ‘neutralisatiereactie’. Ook binnen de organische chemie treden er specifieke reacties op. In dit hoofdstuk zul je kennismaken met enkele types van organische reacties, zoals de additie- en substitutiereactie
We starten met enkele belangrijke termen die aangeven hoe een binding in een organische stof gebroken wordt (heterolytisch of homolytisch), of welk deeltje de chemische reactie initieert (elektrofiel of nucleofiel). Vervolgens bespreken we elk type organische reactie aan de hand van 1 stofklasse. Je zult leren hoe de stoffen reageren, welke reactieproducten er worden gevormd, en waarom bepaalde reactieproducten soms niet worden gevormd.
LEERDOELEN
L De begrippen ʻionairʼ, ʻradicalairʼ, ʻheterolytischʼ, ʻhomolytischʼ, ʻelektrofielʼ en ʻnucleofielʼ verklaren en toepassen
L Een gegeven organische reactie herkennen en benoemen als degradatie, substitutie, additie of eliminatie
L Het reactiemechanisme van een organische reactie interpreteren
In de 2e graad heb je al geleerd dat je anorganische reacties kunt opdelen in verschillende reactiesoorten, zoals ionenuitwisselingsreacties en redoxreacties.
Ook organische reacties worden ingedeeld. Daarvoor kun je verschillende criteria gebruiken:
• de aard van de splitsing;
• de aard van het aanvallende reagensdeeltje;
• het reactietype.
Koolstofverbindingen bevatten bijna uitsluitend atoombindingen. De elektronen tussen de atomen worden gemeenschappelijk gesteld. Die binding kan op 2 manieren worden gesplitst: homolytisch of heterolytisch.
Tijdens een symmetrische of homolytische splitsing van een atoombinding ontvangt elk atoom 1 elektron: de bindingselektronen worden verdeeld over de 2 partners. In het algemeen worden apolaire bindingen homolytisch gesplitst. Binnen de organische chemie denken we dan in eerste instantie aan de apolaire C-C en C-H bindingen
De gevormde deeltjes bevatten een vrij elektron en worden radicalen genoemd. Radicalen zijn atomen of atoomgroepen met ongepaarde elektronen. Ze zijn elektrisch neutraal, maar zeer reactief door de aanwezigheid van het ongepaarde elektron.
In de reactie wordt de beweging van de elektronen tijdens een homolytische splitsing aangegeven door 2 gebogen pijlen (rood).
VOORBEELD HOMOLYTISCHE SPLITSING
CH3-CH2-CH2-CH2 — CH3 →
CH3-CH2 — H →
CH3-CH2-CH2-CH2 + CH3 butylradicaal + methylradicaal
CH3-CH2 + H ethylradicaal + waterstofradicaal Cl — Cl → Cl + Cl chloorradicaal + chloorradicaal
Een organische reactie waarbij radicalen ontstaan, noem je een radicalaire reactie. Dat type organische reactie vindt plaats in een apolair reactiemilieu. Het kan ook plaatsvinden in de gasfase van een stof.
Tomaten: beschermers tegen radicalen Radicalen ontstaan bij normale stofwisselingsprocessen in het lichaam. Sigarettenrook, vervuiling, uitlaatgassen, ultraviolet licht en stress verhogen de kans op radicalenvorming. Radicalen zijn heel reactief en kunnen ons beschermen tegen bacteriën, maar ze kunnen ook grote schade veroorzaken in ons lichaam: hartkwalen, kanker, veroudering, cataract …

Onze natuurlijke wapens tegen radicalen zijn de antioxidantia: enzymen, vitamine C en E …
Radicalen worden oxidantia genoemd, omdat ze spontaan elektronen onttrekken aan moleculen, waardoor het OG van enkele atomen in die moleculen verhoogt: de moleculen worden geoxideerd. Daardoor kunnen die moleculen aangetast worden en bijvoorbeeld een belangrijke biofunctie niet meer uitvoeren, waardoor cellen en weefsels worden aangetast.
Voeding speelt een belangrijke verdedigende rol. Vooral tomaten worden aangeraden als bron van antioxidantia. Die bevinden zich vooral in het rode vruchtvlees. Tomaten bevatten immers niet alleen veel vitamine C, zink, calcium en ijzer, maar ook lycopeen, dat behoort tot de carotenoïden (natuurlijke kleurstoffen). Die stof is een erg gezond antioxidant. Lycopeen is het natuurlijk pigment waaraan tomaten hun rode kleur te danken hebben. Lycopeen wordt vooral aangemaakt tijdens het rijpingsproces, dus hoe roder de tomaat, hoe meer lycopeen. Ook watermeloenen, rozenbottels, wortels en paprika’s bevatten lycopeen. Lycopeen is een tien keer betere antioxidant dan vitamine E.

Heterolytische splitsing
Tijdens een asymmetrische of heterolytische splitsing van een atoombinding worden beide bindingselektronen overgedragen aan 1 atoom. Dat atoom heeft binnen de binding de hoogste EN-waarde. Wanneer een σ-binding wordt gebroken, ontstaan er 2 ionen: een positief ion (kation) en een negatief ion (anion). Het anion heeft de 2 elektronen ontvangen. Ionen zijn reactief in aanwezigheid van een deeltje met een reactief centrum met een tegengestelde lading. Over het algemeen worden polaire bindingen heterolytisch geopend. Binnen de organische chemie denken we daarbij bijvoorbeeld aan de binding tussen het koolstofatoom en een halogeen.
In een reactie met een heterolytische splitsing gebruik je 1 gebogen pijltje (rood) om de ladingsverschuiving aan te geven: dat is gericht van de binding naar de plaats waar de elektronen terechtkomen als vrij elektronenpaar (in een polaire binding van het atoom met δ+ naar het atoom met δ-).
VOORBEELD HETEROLYTISCHE SPLITSING
Een organische reactie waarbij ionen ontstaan, noem je een ionaire reactie. Dat type organische reactie vindt vooral plaats in een polair reactiemilieu
1.2 Indeling volgens de aard van het
In de meeste organische reacties is er sprake van 2 reagerende stoffen. In de organische chemie worden die benoemd als substraat en reagens
• Het substraat (S) ondergaat de reactie. Het bevat het koolstofskelet waarop verder wordt gebouwd. Het substraat is meestal het grootste deeltje dat aan de reactie deelneemt. We schrijven het in dit leerboek als 1e in de reactie.
• Het substraat wordt aangetast door een (meestal) kleiner deeltje: het aanvallende reagens (R) We schrijven het in dit leerboek als 2e in de reactie.
Tussen een substraat en een reagens tonen 2 blauwe pijlen hoe de nieuwe reactieproducten gevormd worden.
• Bij een radicalaire reactie gebruik je altijd een pijl met 2 pijlpunten, omdat beide partners een elektron aanbrengen bij de vorming van de nieuwe bindingen. CH3 —CH3 +Br—Br→CH3 —Br+CH3 —Br
substraat (S) reagens (R)
• In een ionaire reactie wijst de pijl, die aangeeft hoe de stoffen hercombineren, met zijn pijlpunt altijd van het deeltje dat de elektronen geeft, naar het deeltje dat de elektronen krijgt.
—CH2 —Cl+H—N—H→CH3 —CH2 —N—H+H—Cl δ+ δ- δ+ | | H H δ-
substraat (S) reagens (R)
In een ionaire reactie is er dus altijd sprake van de vorming van ionen. Je spreekt daarbij van een elektrofiel en een nucleofiel reagensdeeltje.
• Een elektrofiel reagensdeeltje (El) heeft een plaats met een lage elektronendichtheid of een positief ladingskarakter. Het gaat op zoek naar elektronen (elektrofiel: ‘dat houdt van elektronen’). Je spreekt van een elektronenpaaracceptor (EPA). Een elektrofiel deeltje wordt daarom ook een lewiszuur genoemd. Een deeltje kan in aanmerking komen als elektrofiel als het een atoom bevat met een positieve (deel)lading.
Mogelijke elektrofiele reagensdeeltjes zijn:
positieve ionen, zoals H+ en metaalionen;
polaire atoombindingen waarin atomen voorkomen met een positieve deellading, zoals HCl (H draagt δ+);
– moleculen die een positief geladen koolstofatoom, een carbokation, kunnen vrijmaken.
carbokation
• Een nucleofiel reagensdeeltje (Nu) heeft een plaats met een hoge elektronendichtheid of een negatief ladingskarakter. Het stelt een elektronenpaar ter beschikking (nucleofiel: ‘dat houdt van de nucleus’). Je spreekt van een elektronenpaardonor (EPD). Een nucleofiel deeltje wordt daarom ook een lewisbase genoemd. Een deeltje kan in aanmerking komen als nucleofiel als het een atoom bevat met een vrij elektronendoublet. Zo’n atoom draagt ook bijna altijd een negatieve (deel)lading.
Mogelijke nucleofiele reagensdeeltjes zijn:
negatieve ionen, zoals:
– moleculen, zoals:
We gebruiken die 2 types van reagensdeeltjes om ionaire organische reacties op te delen in 2 groepen.
Groep 1: Een ionaire organische reactie waarbij het aanvallende reagensdeeltje een elektrofiel deeltje is, noem je een elektrofiele reactie.
Algemeen:
Voorbeeld:
CH2=CH2 + H-Cl → CH3-CH2-Cl (H+ wordt als 1e reagens toegevoegd.)
Groep 2: Een ionaire organische reactie waarbij het aanvallende reagensdeeltje een nucleofiel deeltje is, noem je een nucleofiele reactie
Algemeen:
S (–) R (+) elektrofiel reactieproducten + S (+) R (–) nucleofiel reactieproducten +
Voorbeeld:
CH3-CH2-Cl + H2O → CH3-CH2-OH + H-Cl (OH- vervangt het Cl-atoom.)
1.3 Indeling volgens het reactietype
Tijdens een organische reactie wordt het substraat gewijzigd. Op basis van die verandering bespreken we in dit leerboek 4 reactietypes: degradatie, additie, substitutie en eliminatie
In deze paragraaf stellen we de 4 reactietypes kort voor.
In het 6e jaar zul je bij de bespreking van biomoleculen, onder andere suikers en eiwitten, ook kennismaken met de polymerisatiereactie.
Tijdens een degradatiereactie (D) wordt het substraat drastisch gewijzigd: het splitst in verschillende kleinere moleculen.
Een voorbeeld van een degradatiereactie is de volledige verbranding van alkanen.
Voorbeeld:
2 C8H18 + 25 O2 → 16 CO2 + 18 H2O
Tijdens een substitutiereactie (S) wordt in het substraat een atoom(groep) vervangen door een ander(e) atoom(groep). Dat reactietype is specifiek voor verzadigde verbindingen. Het atoom (of de atoomgroep) dat vervangen wordt, noem je de leaving group.
Halogeenalkanen vormen vaak het substraat voor een substitutiereactie waarbij het halogeen wordt vervangen door een andere atoomgroep.
Voorbeeld:
CH3-CH2-Br + NH3 → CH3-CH2NH2 + H-Br
Substitutiereacties komen ook voor bij alcoholen. Omdat die reacties moeilijk plaatsvinden, gebruikt men vaak een sterk zuur als katalysator. Tijdens de reacties wordt een kleine molecule, H2O, gevormd. Je spreekt daarom ook van een condensatiereactie
Voorbeeld: H2SO4
CH3-CH2OH + CH3-CH2OH → CH3-CH2-O-CH2-CH3 + H2O
Een condensatiereactie is een chemische reactie waarbij relatief eenvoudige organische moleculen (of monomeren) met elkaar reageren tot grotere moleculen: dimeren, oligomeren of polymeren. Zo is de verbinding van glucosemoleculen tot het polymeer glycogeen in onze lever een voorbeeld van een condensatiereactie. Tijdens die reactie wordt er altijd een kleinere molecule gevormd, vaak water. Vandaar de term ʻcondensatiereactieʼ. Er kunnen echter ook andere kleine moleculen gevormd worden, zoals HCl en NH3.
Een hydrolysereactie is het tegenovergestelde van een condensatiereactie: water is daar een reagens, waarbij grotere moleculen worden gesplitst in kleinere moleculen. Een voorbeeld van een hydrolysereactie is de splitsing van ester in een carbonzuur en een alcohol:
CH3-COO-CH2-CH3 + H2O → CH3-COOH + CH3-CH2-OH
In het 6e jaar zul je leren dat ons lichaam op die manier grote eiwitten, suikers ... afbreekt tot hun basisgroepen: de monomeren.
Tijdens een additiereactie (A) worden er extra atomen of atoomgroepen toegevoegd aan het substraat. Additie treedt op bij moleculen met meervoudige bindingen. De π-binding wordt daarbij (meestal) heterolytisch doorbroken.
Een typische additiereactie is het halogeneren van een alkeen.
Voorbeeld: CH2=CH2 + H-Cl → CH3-CH2-Cl
Tijdens een eliminatiereactie (E) worden er 1 of meerdere atoomgroepen uit het substraat onttrokken. In 1 van de reactieproducten ontstaat een π-binding.
Alcoholen ondergaan een eliminatiereactie in aanwezigheid van de katalysator zwavelzuur. Er wordt dan een alkeen gevormd.
Voorbeeld: H2SO4
CH3-CH2OH → CH2=CH2 + H2O
Bij een eliminatiereactie ontstaat er dus een meervoudige binding. Je kunt dan ook stellen dat een eliminatiereactie het tegenovergestelde is van een additiereactie.
Aard van splitsing Aard van aanvallend deeltje Reactietype
• homolytisch
– apolaire moleculen
– vorming van radicalen
– radicalaire reactie
• heterolytisch
– polaire moleculen
– vorming van ionen
– ionaire reactie
• radicalaire reactie aanvallend deeltje = radicaal
• ionaire reactie
• elektrofiele reactie aanvallend deeltje = (gedeeltelijk) positief geladen
• nucleofiele reactie aanvallend deeltje = (gedeeltelijk) negatief geladen
• degradatie splitsen van het substraat in kleine deeltjes
• substitutie vervangen van (een groep) atomen
• additie toevoegen van atomen aan een meervoudige binding
• eliminatie verwijderen van (een groep) atomen
We bespreken van elke type organische reactie enkele voorbeelden en geven telkens het bijhorende reactiemechanisme weer. We maken gebruik van het onderstaande schema en voegen zachte oxidatie toe als een extra voorbeeld van een eliminatiereactie.
aardolie aardgas
alkanen
halogeenalkanen
ethers alkenen alkynen
zachte oxidatie
ketonen
Schema 2 Enkele organische reacties (D = degradatie, AE = elektrofiele additie, E = eliminatie, SN = nucleofiele substitutie, SH = homolytische substitutie, I alc = primair alcohol, II alc = secundair alcohol)
We overlopen stap voor stap de reacties in het schema.
Als voorbeeld van een degradatiereactie bespreken we het kraakproces bij de alkanen. Daarbij ontstaan kortere alkanen en koolwaterstoffen met een extra binding tussen de C-atomen, bv. alkenen.
Ook de verbranding van koolstofverbindingen is een degradatiereactie.
aardolie aardgas
Schema 3 Degradatiereacties
Verbranding van koolstofverbindingen
Afhankelijk van de hoeveelheid zuurstofgas die beschikbaar is, spreek je van een onvolledige (CO-vorming, bij sterk O2-tekort vorming van roet C) of een volledige verbranding (CO2-vorming).
De onvolledige verbranding van n-butaan:
2 C4H10 + 9 O2 → 8 CO + 10 H2O
De volledige verbranding van n-butaan:
2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
Merk op dat per mol n-butaan er 2 mol meer zuurstofgas nodig is om de stof volledig te verbranden.
CO-vergiftiging
Koolstofmonoxide of CO komt van nature voor in het leefmilieu als gevolg van vulkaanuitbarstingen, bosbranden ... Ook bij heel wat industriële activiteiten en door het autoverkeer komt er CO vrij. Het gas ontstaat bij de onvolledige verbranding van steenkool, petroleumderivaten of gas. Binnenshuis is tabaksrook de voornaamste bron van CO. Slecht afgestelde verwarmingstoestellen zijn de belangrijkste oorzaak van CO-vergiftiging.
Wanneer je CO inademt, staan CO en O2 in competitie voor dezelfde bindingsplaats op hemoglobine. Hemoglobine heeft wel een grotere affiniteit (voorkeur) voor CO dan voor O2
Geleidelijk aan zullen meer en meer hemoglobinemoleculen bezet worden door CO en niet meer gebruikt kunnen worden voor het transport van het levensnoodzakelijke zuurstofgas. Op die manier komt er stilaan een tekort aan O2 in vitale organen, zoals de hersenen. Dat kan uiteindelijk leiden tot de dood.
CO is kleurloos en reukloos en kan daardoor dus ongemerkt zorgen voor een levensbedreigende situatie. Volgens het antigifcentrum is CO-vergiftiging de belangrijkste vorm van dodelijke intoxicatie in ons land! Jaarlijks zijn er 1 000 tot 1 750 slachtoffers, waarvan er 10 tot 60 het niet overleven.
Hoe kun je een CO-vergiftiging vermijden?
• Laat kachels, geisers en andere toestellen met een open vlam regelmatig onderhouden.
• Zorg voor voldoende luchttoevoer (sluit een ruimte met een geiser nooit af!) en een goede afvoer van de verbrandingsgassen. De meeste ongevallen (ongeveer 30 %) gebeuren in een (gesloten) badkamer!

• Plaats goede CO-detectoren. (Let op: zulke detectoren geven soms een vals gevoel van veiligheid!)
• Als iemand zich onwel voelt (de 1e symptomen zijn duizeligheid, hoofdpijn en misselijkheid), haal het slachtoffer dan zo snel mogelijk uit de ruimte en laat hem of haar frisse lucht inademen. Verwittig altijd de hulpdiensten. Schakel het toestel dat vermoedelijk verantwoordelijk is voor de CO, uit en verlucht de ruimte.
(VERVOLG)
Alkanen en milieuverontreiniging


Omdat langere alkanen weinig reactief zijn, worden ze vaak aangeduid met de term ‘paraffine’ (Latijn: parum = onvoldoende, affin = affiniteit). Ze reageren enkel met apolaire stoffen, zoals Cl2 en O2.
Aardolie bevat veel alkanen. De lage reactiviteit van die koolwaterstoffen zorgt er bijvoorbeeld voor dat olieverontreiniging in de zee een grote milieu-impact heeft: vissterfte als gevolg van verstopping van de kieuwen, vogelsterfte doordat de veren samenplakken ...
In alkanen komen alleen sterke C-C en C-H bindingen voor. Er zijn geen reactieve centra (elektronenarme of -rijke plaatsen). Alkanen zijn daardoor weinig reactief
Langere alkanen kunnen in een anaeroob milieu wel thermisch en/of katalytisch gebroken worden tot kortere alkanen, alkenen/alkynen en diwaterstof: je spreekt van het kraken van alkanen De bindingen worden willekeurig gebroken, waardoor verschillende stoffen kunnen ontstaan.
Bij het kraakproces van n-octaan kan bijvoorbeeld de volgende reactie plaatsvinden:
T, kat.
C8H18
C4H10 + C4H8 n-butaan but-1-een
Omdat n-octaan een apolaire organische stof is en enkel apolaire C-C of C-H bindingen bevat, worden de bindingen homolytisch gebroken met vorming van radicalen.
Je kunt het radicalaire reactiemechanisme van het aangegeven kraakproces van n-octaan als volgt voorstellen:
• Homolytische splitsing van de bindingen:
• Hercombinatie van de radicalen:
Tijdens dat kraakproces kunnen er ook andere koolwaterstoffen ontstaan, zoals ethaan en hex-1-een of propeen en pent-1-een. Omdat de reactie plaatsgrijpt in afwezigheid van zuurstofgas, spreek je ook van een pyrolyse
Verbranding van organische stoffen Kraken van alkanen
• onvolledige verbranding vorming van CO en H2O
• volledige verbranding vorming van CO2 en H2O
• homolytische splitsing
• vorming van radicalen
• breken van langere alkanen in kleinere alkanen en alkenen in een anaeroob milieu
Pyrolyse (Grieks: πυρ (pyr) = vuur, λυσις (lysis) = ontleding) is een proces waarbij organisch materiaal wordt ontleed door het te verhitten tot hoge temperaturen (200 à 900 °C) zonder dat er zuurstofgas bij kan.
Voorbeelden van pyrolyse zijn cokesproductie, houtskoolproductie en houtvergassing.
Bij die processen ontstaan gas en teer als nevenproducten.
Een praktisch gebruik van pyrolyse is het schoonmaakprogramma van sommige moderne ovens. De oven wordt verhit tot een temperatuur van 500 °C, waardoor alle etensresten en vetspatten worden verpulverd tot as. Een geïntegreerde katalysator reinigt de vrijgekomen dampen en voorkomt dat er rookwolken uit de oven komen. Na het verhittingsproces kun je alles makkelijk met een doekje uit de oven vegen. Door de hoge temperatuur die bereikt moet worden, vergt het proces veel energie en gaat het gepaard met een financiële en ecologische kost.

Substitutiereacties (S) kunnen plaatsvinden in een apolair of polair milieu. In dit leerboek werken we substitutiereacties uit bij alkanen (apolair milieu) en bij halogeenalkanen en alcoholen (polair milieu).
Tijdens een substitutiereactie wordt telkens een atoom(groep) in het substraat vervangen door een atoom(groep) van het reagens.
ASchema 4 Substitutiereacties (SN nucleofiele substitutie, SH homolytische substitutie)
Substitutie van alkanen
Je weet al dat alkanen weinig reactief zijn. Toch is het in strikte omstandigheden mogelijk om halogeenalkanen te vormen vanuit alkanen. Belangrijk is dat het halogeen wordt aangebracht vanuit een apolair reagens, zoals Cl2, en niet via een polair reagens, zoals HCl. Omdat alkanen radicalair reageren, moet immers ook het reagens radicalen aanmaken, en dus een apolair karakter hebben.
Omdat tijdens de reactie de bindingen altijd homolytisch gesplitst worden en een waterstofatoom in het alkaan vervangen wordt door een halogeen, spreek je van een homolytische substitutie (SH). Je noemt dat ook wel een radicalaire substitutie.
VOORBEELD HOMOLYTISCHE SUBSTITUTIEREACTIE
De vorming van 1-chloorbutaan tijdens de reactie tussen n-butaan en chloorgas:
Opmerking:
Het chlooratoom kan tijdens deze reactie ook op een ander koolstofatoom terechtkomen. Er kan zelfs een langer alkaan, hier n-octaan, ontstaan door het aan elkaar hechten van de 2 butylradicalen.
Halogeenalkanen bevatten een halogeenatoom, waardoor er een meer polaire binding aan de koolstofketen wordt toegevoegd. Daardoor worden halogeenalkanen meer polaire moleculen.
Tijdens een reactie zal telkens de polaire binding met het halogeen heterolytisch geopend worden. De snelheid waarmee dat gebeurt, wordt bepaald door de samenstelling van het halogeenalkaan: de aanwezigheid van extra atomen of atoomgroepen in het halogeenalkaan.
Het atoom dat of de atoomgroep die een H-atoom op het C-skelet vervangt, noem je de substituent. Het atoom van de substituent dat gebonden is aan het C-skelet, noem je het sleutelatoom. Bij een monoatomisch substituent zijn de substituent en het sleutelatoom aan elkaar gelijk.
Voorbeeld: CH3-CH2-Cl
• CH3- = substituent
Br-CH2-Cl
• Br- = substituent (vervangt H in chloormethaan) (vervangt H in chloormethaan)
• C in CH3- = sleutelatoom
• Br- = sleutelatoom
De belangrijkste reactie die plaatsvindt bij halogeenalkanen, is de substitutiereactie (S). Omdat het halogeen vervangen wordt door een nucleofieldeeltje, spreek je van een nucleofiele substitutie (SN). Experimenteel kan aangetoond worden dat chloorethaan gemakkelijker een chloride-ion afsplitst dan chloormethaan. Dat kun je enkel verklaren door de extra CH3-groep (substituent) in chloorethaan. Je spreekt van het inductieve effect van een substituent.
Afhankelijk van de ladingsverschuiving spreek je van:
• een positief inductief effect (+I-effect): de substituent wordt positiever in vergelijking met een H-atoom. De substituent duwt elektronen meer van zich af. Rond het C-atoom dat het halogeen bindt, verhoogt de elektronendichtheid (lagere positieve deellading), waardoor de binding met het halogeen meer naar het halogeen ligt. Bijgevolg zal in een halogeenalkaan het halogeen sneller loskomen onder invloed van een +I-effect.
HH | | H C C—Cl | | HH 1 1 1,5 1
Afb. 170 De methylgroep zorgt voor een grotere duwkracht op het C-atoom: het is +I.
Het +I-effect van de CH3-substituent kun je als volgt verklaren. Het +I-effect van een substituent plant zich voort langs de σ-bindingen met afnemende intensiteit. Het +I-effect van die substituent op het naastliggende atoom wordt naar het volgende atoom herleid tot ongeveer 1/2. Wanneer je het effect van H op C fictief voorstelt als waarde 1, wil dat zeggen dat de CH3-substituent op het volgende C-atoom nog een waarde van 1,5 (1/2 van 3 · 1) uitoefent. Die inductieve waarde (1,5) van de CH3-substituent is groter dan die van H, waardoor de CH3-substituent een +I-effect uitoefent en het Cl-atoom relatief gezien sneller zal loskomen. De C-C binding heeft geen effect, omdat er geen verschil is in EN-waarde.
• een negatief inductief effect (–I-effect): de substituent wordt negatiever in vergelijking met een H-atoom en trekt meer elektronen naar zich toe.
De elektronendichtheid rond de C-atomen van het skelet neemt af. In een halogeenalkaan zal het halogeen moeilijker loskomen onder invloed van dat –I-effect.
Afb. 171 Het Br-substituent zorgt voor een –I-effect.
Het negatieve inductieve effect van de Br-substituent kun je verklaren met behulp van de EN-waarden. ENBr > ENH: Br trekt elektronen meer naar zich toe. Het is –I.
We vatten alles samen in de onderstaande tabel.
+I-EFFECT –I-EFFECT
De substituent trekt de e-
De substituent ...
De substituent is een e- ...
De substituent wordt ...
minder naar zich toe. (Het sleutelatoom heeft een kleinere EN-waarde dan een H-atoom.)
stoot elektronen af. donor. positiever dan een H-atoom.
meer naar zich toe. (Het sleutelatoom heeft een grotere EN-waarde dan een H-atoom.)
trekt elektronen aan. acceptor. negatiever dan een H-atoom.
De C-atomen in de keten krijgen een ... grotere e- dichtheid. kleinere e- dichtheid.
De C-atomen in de keten zullen gemakkelijker reageren met een ...
elektrofiel reagensdeeltje (minder met een nucleofiel).
Tabel 17 De invloed van een +I- en –I-effect binnen een organische verbinding
nucleofiel reagensdeeltje (minder met een elektrofiel).
De volgende tabel toont het I-effect van enkele substituenten. Het sleutelatoom wordt telkens in het vet weergegeven. Voor alkylgroepen geldt dat het +I-effect toeneemt met de lengte van de alkylgroep (+Iethyl > +Imethyl).
+I-EFFECT –I-EFFECT een atoom met een grote EN -Cl -O-H een verzadigd C-atoom (alkylgroep) -CH2-CH3 een onverzadigd C-atoom -CH=CH2
WEETJE
Het verhaal is complexer … De reactiviteit van halogeenalkanen wordt niet alleen beïnvloed door het inductieve effect. Ook het halogeentype (Cl, Br …) bepaalt de reactiviteit van halogeenalkanen. Die neemt toe met de atoommassa van het halogeen, waardoor de alkyljodiden het meest reactief zijn.
De aanwezige koolstofketens in een halogeenalkaan hebben niet alleen een inductief effect. Naarmate hun lengte toeneemt, vormen ze ook een langere apolaire staart. Die zorgt voor een lagere polariteit van de molecule en verlaagt bijgevolg de reactiviteit in een polair milieu. Daarnaast zorgt ze voor sterische hinder: het halogeen is minder bereikbaar voor een substitutiereactie. De reactiviteit hangt dus ook af van de positie van het halogeen in de molecule. Halogeenatomen gelegen aan het einde van een koolstofketen zullen gemakkelijker loskomen.
In dit leerboek beperken we ons tot het inductieve effect als bepalende factor voor de reactiviteit van halogeenalkanen.
In elke substitutiereactie wordt in het halogeenalkaan (het substraat) het halogeen heterolytisch afgesplitst. In de voorbeelden in dit leerboek geeft het reagensdeeltje een waterstofion (het elektrofiele deeltje) af. Het resterende deel van het reagensdeeltje (negatief geladen; het nucleofiele deeltje) vervangt het halogeen in het halogeenalkaan.
Zo kunnen vanuit halogeenalkanen verschillende stofklassen worden gemaakt.
Voorbeelden:
• halogeenalkanen + water → alcoholen
• halogeenalkanen + alcohol → ethers
• halogeenalkanen + carbonzuur → esters
• halogeenalkanen + ammoniak → aminen
VOORBEELD SUBSTITUTIEREACTIE
Tijdens de reactie tussen 1-broompropaan en water worden propaan-1-ol en waterstofbromide gevormd.
Wanneer een reagens H+ afgeeft, moet dat heterolytisch gebeuren. H+ zal dus nooit kunnen worden afgegeven vanuit een apolaire C-H binding, maar wordt afgegeven vanuit een functionele groep. Zo zal bijvoorbeeld in methanol H+ vrijkomen vanuit de hydroxylgroep (-OH).
Opmerking:
Een reagens hoeft niet altijd H+ af te geven. Zo kan een halogeenalkaan ook reageren met NaOH. Tijdens de reactie tussen broomethaan en NaOH worden ethanol en NaBr gevormd.
Substitutie van alcoholen
Ook alcoholen kunnen een substitutiereactie ondergaan. Daarbij wordt de hydroxylfunctie vervangen. Die atoomgroep is wat men noemt een slechte leaving group: de OH-groep splitst moeilijk af van de alcohol. Daarom wordt de reactie bijvoorbeeld uitgevoerd in een zuur milieu.
Zo kunnen vanuit alcoholen verschillende stofklassen worden gemaakt.
Voorbeelden:
• alcoholen + H-X → halogeenalkanen (-X = halogeen)
• alcoholen + carbonzuur → esters
• alcoholen + ammoniak → aminen
• alcoholen + alcohol → ethers
De ethersynthese vanuit een alcohol kun je indelen in 2 groepen:
1) Bij de synthese van een symmetrische ether voert men een dehydratatie uit van een alcohol in aanwezigheid van een sterk zuur. Omdat de hydroxylfunctie vervangen wordt door een andere atoomgroep, spreek je hier ook van een substitutiereactie.
VOORBEELD SYNTHESE SYMMETRISCHE ETHER
De vorming van diëthylether vanuit ethanol in aanwezigheid van geconcentreerd H2SO4: HH HH HHHH || || H2SO4 |||| H—C—C —O—H +H—C—C—O —H →H—C—C—O—C—C—H+ H—O—H || || δ- ||||
Die reactie wordt ook een condensatiereactie genoemd, omdat er tijdens de reactie een kleine molecule, hier water, vrijkomt. Dat geldt bijvoorbeeld ook voor de reactie tussen een carbonzuur en een amine, waarbij er ook water vrijkomt.
2) Een asymmetrische ether wordt gesynthetiseerd door gebruik te maken van de Williamsonsynthese. Daarbij treedt een reactie op tussen een halogeenalkaan en een alkoxide (of alkanolaat), de geconjugeerde base van een alcohol. Het alkoxide kan gevormd worden door de alcohol eerst in contact te brengen met een sterke reductor (= vormt graag een ion), zoals Na. Het alkoxide reageert met een halogeenalkaan met een andere ketenlengte.
VOORBEELD SYNTHESE ASYMMETRISCHE ETHER
Vorming van ethoxide (of ethanolaat): 2 CH3-CH2OH + 2 Na → 2 CH3-CH2O-Na+ + H2
Reactie tussen natriumethanolaat en 1-chloorpropaan:
• Alkanen
– Alkanen ondergaan een homolytische substitutie (SH).
– De bindingen in het alkaan en in het reagens worden radicalair geopend.
• Halogeenalkanen
– Halogeenalkanen ondergaan een nucleofiele substitutiereactie (SN).
– Het inductieve effect van de alkylgroepen bepaalt de reactiviteit van de halogeenalkanen.
INDUCTIEF EFFECT (I) +I
• De substituent duwt elektronen meer van zich af.
• De elektronendichtheid rond de C-atomen van het skelet wordt verhoogd.
• Het halogeen komt onder invloed van +I gemakkelijker los.
• De substituent trekt elektronen meer naar zich toe.
• De elektronendichtheid rond de C-atomen van het skelet wordt verlaagd.
• Het halogeen komt onder invloed van –I moeilijker los. Alkylgroepen (bv. CH3-) vormen +I-substituenten. -OH en halogenen zijn –I-substituenten.
• Alcoholen
– Alcoholen ondergaan een nucleofiele substitutiereactie (SN).
– Tijdens de reactie worden de bindingen heterolytisch gebroken en kunnen er onder andere halogeenalkanen en esters worden gevormd.
– Symmetrische ethers ontstaan tijdens de dehydratatie van een alcohol.
– Asymmetrische ethers ontstaan tijdens de Williamsonsynthese, waarbij een alkoxide betrokken is.
Additiereacties zijn kenmerkende reacties voor onverzadigde koolwaterstoffen. Tijdens een additiereactie worden extra atomen of atoomgroepen toegevoegd. Algemeen geldt dat de atomen van het reagens worden toegevoegd aan de koolstofatomen die de meervoudige binding vormden in het substraat.
In dit leerboek werken we in eerste instantie additiereacties bij alkenen uit. Ook alkynen ondergaan additiereacties. Ze zijn gelijkaardig aan die bij alkenen, maar door de drievoudige binding bij alkynen ondergaan die moleculen 2 opeenvolgende additiereacties. Daardoor zal bij de additie van zoutzuur aan alkynen, bijvoorbeeld, een halogeenalkaan met 2 chlooratomen ontstaan.
VOORBEELD ADDITIEREACTIES
• alkeen: CH2=CH2 + H-Cl → CH3-CH2-Cl
• alkyn: – CH CH + H-Cl → CH2=CH-Cl – CH2=CH-Cl + H-Cl → CH3-CH-Cl Cl
Naast halogeenalkanen kunnen bijvoorbeeld ook de volgende stofklassen worden aangemaakt:
• alkenen + waterstofgas → alkanen (hydrogenering);
• alkenen + water → alcoholen.
In thema 03 heb je geleerd dat een π-binding boven en onder een σ-binding (axiaal georiënteerd) ligt, waardoor ze gemakkelijker bereikbaar is om te breken. Experimenteel stelt men dan ook vast dat een π-binding breken minder energie vergt dan een σ-binding breken (respectievelijk 267 kJ mol en 343 kJ mol). Alkenen zijn daarom reactiever dan alkanen.
Tijdens de additiereactie zal de π-binding geopend worden. Omdat alkenen net zoals alkanen apolair zijn, zou je verwachten dat die opening homolytisch gebeurt, gepaard gaande met radicalaire reacties. Maar onder invloed van de π-elektronen wordt het aanvallende reagensdeeltje zo gepolariseerd dat er ionen ontstaan (heterolytische splitsing). Daardoor ontstaan bij het aanvallende reagens een elektrofiel en een nucleofiel deeltje. Die deeltjes worden toegevoegd aan het alkeen, waar de π-binding ook heterolytisch zal worden geopend. Omdat het elektrofiele deeltje het eerst wordt toegevoegd, spreek je van de elektrofiele additiereactie (AE) van alkenen.
Ook bij de additiereactie kan een inductief effect bepalen welk reactieproduct er gevormd wordt.
AInductief effect
Net als bij de halogeenalkanen vertonen alkylgroepen in een onverzadigde koolstofverbinding een +I-effect. Daarbij is de substituent altijd rechtstreeks gebonden aan een dubbel gebonden koolstofatoom: het bevindt zich op 1 σ-binding van de dubbele binding. Je noemt dat de conjugatieve positie +I CH3 H δ+ δC C H H
Afb. 172 Het +I-effect van een CH3-groep als gevolg van de conjugatieve positie
Het +I-effect van de alkylgroep veroorzaakt een specifieke ladingsverschuiving van de π-elektronen. Tijdens een reactie zal de π-binding heterolytisch geopend worden in de richting van het verste C-atoom dat daardoor een volledig negatieve lading krijgt. Het 2e C-atoom (δ-) zal daarom een elektrofiel deeltje binden, terwijl het 1e C-atoom (δ+) een nucleofiel deeltje bindt.
Tijdens de reactie tussen propeen en zoutzuur wordt daarom 2-chloorpropaan en niet 1-chloorpropaan gevormd.
CH3-CH=CH2 + H-Cl → CH3-CH-CH3 Cl
• Het elektrofiele deeltje (H+) bindt aan het C-atoom (δ-) dat het verst van de methylgroep ligt.
• Het nucleofiele deeltje ( Cl - ) bindt met het 1e C-atoom (δ+) van de dubbele binding.
• Experimenteel kan aangetoond worden dat 1-chloorpropaan niet wordt gevormd tijdens deze reactie.
Het inductieve effect van een alkylgroep is ook gekend als de regel van Markovnikov:
• Bij de additie van een verbinding H-X aan een alkeen zal het waterstofatoom gebonden worden aan het koolstofatoom dat al de meeste waterstofatomen heeft. De groep X zal gebonden worden aan het koolstofatoom met de minste waterstofatomen.
• Wanneer beide C-atomen van de dubbele binding hetzelfde aantal H-atomen bevatten, dan komt de H terecht op het C-atoom waarop de kortste C-keten hangt. Aan de volgende molecule zal bij een reactie aan het 2e C-atoom dus een extra H-atoom worden toegevoegd, terwijl een nucleofiel deeltje (bv. een Cl--ion) bindt aan het 1e C-atoom. Dat komt overeen met de redenering opgebouwd rond het sterkere +I-effect van een langere alkylgroep.
WEETJE
Mesomeer effect
In een alkeen of alkyn kunnen naast alkylgroepen ook andere substituenten voorkomen, zoals halogenen, -OH, -CO-, -NO2, -CN ... Die substituenten worden elk gekenmerkt door de aanwezigheid van een eigen doublet. Dat eigen doublet zorgt ook een verschuiving van de π-elektronen. De aanwezigheid van het eigen doublet en de C=C binding kun je linken aan mesomerie (zie thema 03). Die verschuiving ten gunste van een eigen doublet in een alkeen of alkyn noem je daarom het mesomere effect.
Welk mesomeer effect van toepassing is, hangt af van de substituent. Zoals bij het inductieve effect spreek je van een +M-effect (elektronenstuwend) of een –M-effect (elektronentrekkend).
+M-EFFECT
–M-EFFECT halogenen / -OH -CO- / -NO2 / -CN
Het inductieve effect van de alkylgroepen heeft altijd een bepalende rol in een asymmetrisch alkeen. In een symmetrisch alkeen worden eventuele effecten opgeheven. We schrijven enkele concrete reactiemechanismen uit.
Additie van symmetrische alkenen
Bij een symmetrisch alkeen – waar links en rechts van de dubbele binding evenveel of even grote alkylgroepen staan – kan het elektrofiele deeltje aan beide meervoudig gebonden C-atomen adderen: de π-elektronen kunnen worden doorgegeven aan beide C-atomen van de meervoudige binding. Er wordt altijd hetzelfde reactieproduct gevormd.
Bij een symmetrisch alkeen mag je dus kiezen in welke richting de π-binding heterolytisch wordt geopend.
VOORBEELD ADDITIEREACTIE SYMMETRISCHE ALKENEN
Tijdens de reactie tussen but-2-een en HBr ontstaat 2-broombutaan:
Methode 1:
CH3 H Br δ- δ+ δ+ δ- || C C+ H Br → CH3 —C—C—CH3 + H + Br → CH3 —C—C—CH3 || || H H HH HH 2-broombutaan
- + + -
Methode 2 (de tussenstap met de ionen wordt vanaf nu niet meer getoond): CH3 CH3 Br H δ+ δ- δ+ δ- || C C+ H Br → CH3 —C—C—CH3 || H H HH
Additie van asymmetrische alkenen
Bij asymmetrische alkenen bepaalt het +I-effect van de alkylgroepen wél welk reactieproduct er gevormd wordt. Een elektrofiel deeltje komt altijd terecht op het C-atoom dat het verst gelegen is van de alkylgroep.
VOORBEELD ADDITIEREACTIE ASYMMETRISCHE ALKENEN
Tijdens de reactie tussen but-1-een en waterstofbromide ontstaat 2-broombutaan: +I
CH3—CH2 H Br H δ+δ- δ+δ- || C C+ H Br → CH3—CH2 —C—C—H || H H HH
Symmetrisch alkeen
• Het elektrofiel (H+) kan toegevoegd worden aan beide C-atomen van de dubbele binding.
• Voorbeeld:
CH2=CH2 + H-Cl → CH3-CH2-Cl
Asymmetrisch alkeen
• Het elektrofiel (H+) moet toegevoegd worden aan het C-atoom dat het verst ligt van de bepalende alkylgroep (+I).
• Voorbeeld:
CH3-CH=CH2 + H-Cl → CH3-CH-CH3 Cl +I
De reactie tussen een alkyn en water Zoals vermeld kunnen additiereacties ook worden uitgevoerd bij alkynen. Het reagens wordt dan 2 keer toegevoegd aan het alkyn. De reactie tussen een alkyn en water vertoont echter een specifiek verloop.
Tijdens de additie van water aan een alkyn wordt tijdens de 1e additie een OH--substituent toegevoegd aan de molecule: er ontstaat een alcohol (of alkanol) met een dubbele binding tussen 2 C-atomen: een alkenol. Maar de OH-groep aan 1 van de dubbel gebonden C-atomen brengt een +M-effect in de molecule, waardoor er een omlegging plaatsvindt: de inwendige structuur van het substraat verandert. Daardoor wordt het alkenol omgezet in een aldehyde of een keton.
In stappen kun je het als volgt beschrijven:
• Stap 1: Het eigen doublet van de OH-groep springt tussen de C-O binding.
• Stap 2: De π-binding springt naar het andere C-atoom.
• Stap 3: Het vrije elektronenpaar maakt een binding met het H-atoom van de OH-groep.
• Stap 4: Er ontstaat een carbonylgroep in plaats van een hydroxylgroep.
Voorbeelden:
• additie van H2O aan ethyn: er ontstaat ethanal
van de
• additie van H2O aan propyn: er ontstaat propanon Door het +I-effect van de alkylgroep (-CH3) is het 2e C-atoom van de meervoudige binding negatief geladen.
van de OH-groep
Omdat water gebruikt wordt als reagens, kun je die reactie ook beschouwen als een hydrolyse. De reactie wordt een keto-enoltautomerie genoemd. Tautomeren zijn isomeren van elkaar en kunnen bovendien snel in elkaar overgaan via de verschuiving van een waterstofatoom en een π-binding. Bij tautomeren is het onmogelijk om 1 van de 2 isomeren zuiver in handen te krijgen. Eigenschappen van de stof zijn daardoor een gemiddelde van de eigenschappen van de tautomeren.
Tijdens een eliminatiereactie verliest een molecule 2 atomen of atoomgroepen en ontstaat in die molecule een meervoudige binding. Een eliminatiereactie is dus het omgekeerde van een additiereactie. We bespreken eliminatiereacties bij 2 stofklassen: halogeenalkanen en alcoholen.
Eliminatie bij halogeenalkanen
C ROH alcoholen RX halogeenalkanen
alkenen Schema 6 Eliminatiereacties
Halogeenalkanen ondergaan niet alleen een nucleofiele substitutie. Zo ontstaat het gas methylpropeen als je 2-broommethylpropaan in contact brengt met een geconcentreerde hydroxide-oplossing. In die reactie wordt het halogeen samen met een waterstofatoom verwijderd: het is een eliminatiereactie.
Voorbeeld:
Bij de eliminatiereactie van 2-broommethylpropaan wordt er methylpropeen gevormd.
Door het –I-effect van het broomatoom zijn de H-C bindingen aan het andere einde van 2-broommethylpropaan sterker polair. De sterke base OH- valt met een van de vrije doubletten op het O-atoom zo’n H-atoom aan. Daardoor verschuift het bindende doublet tussen dat H-atoom en het C-atoom nog meer in de richting van koolstof.
Meteen verplaatst ook het elektronenpaar dat het aangrenzende C-atoom verbindt met het Bratoom, zich meer naar dat laatste atoom toe. Het gevolg is dat het bromide-ion wordt afgesplitst en dat er een extra binding gevormd wordt tussen de 2 laatste C-atomen.
Wanneer een eliminatiereactie wordt uitgevoerd op een halogeenalkaan (of een organische stof die een andere geschikte uittredende groep draagt, zoals de OH-groep bij de alcoholen), geldt de regel van Zaytzeff. Die regel stelt dat na eliminatie van het halogeen vooral het meest gesubstitueerde alkeen wordt gevormd. Dat komt overeen met het alkeen dat de minste H-atomen rond een dubbel gebonden C-atoom draagt. De aanwezigheid van meer alkylsubstituenten leidt tot een grotere stabilisatie.
Voorbeeld:
Tijdens de eliminatie van het chlooratoom in 2-chloorpentaan wordt vooral pent-2-een gevormd (en minder pent-1-een).
Bij een hoge temperatuur en met H2SO4 als katalysator (in een hoge concentratie) gebeurt er eliminatie van de OH-groep en van een H-atoom op het naburige C-atoom (= dehydratatie).
Daarbij ontstaat een alkeen
De aanwezigheid van zwavelzuur is essentieel. Enerzijds functioneert het als katalysator Anderzijds is het sterk hygroscopisch: het trekt het gevormde water naar zich toe.
CH3-CH2OH CH2 CH2 + H2O
Het reactiemechanisme is hieronder weergegeven en start met zwavelzuur als protonendonor.
Tijdens de reactie worden een oxoniumion en een carbokation gevormd.
Stap 1: H2SO4 +H2O HSO4- +H3O+
Stap 2:
Stap 3:
+H2O
Stap 4:
+HSO4-
In een eliminatiereactie worden 2 atomen of een atomengroep uit het substraat verwijderd. Daarbij ontstaat een extra binding in de koolstofketen:
• Halogeenalkanen vormen in aanwezigheid van een sterke base een alkeen
• Alcoholen vormen in aanwezigheid van sterk zuur een alkeen. Het sterke zuur treedt op als katalysator.
WEETJE
Zachte oxidatie van alcoholen
Bij het gebruik van oxidantia, weergegeven als [OX] boven de reactiepijl, kan er bij sommige alcoholen zachte oxidatie optreden. Mogelijke oxidantia ([OX]) zijn CuO, K2Cr2O7 en KMnO4, beide laatste in een zuur milieu. Zoals hoger aangehaald, zal er bij aanwezigheid van O2 een degradatie plaats vinden, met vorming van CO2 en H2O.
alc I alc ketonen
Schema 7 Zachte oxidatie van alcoholen (I alc = primair alcohol, II alc = secundair alcohol)
Tijdens de zachte oxidatie worden waterstofionen uit de alcoholen verwijderd. Het is dus een voorbeeld van een eliminatiereactie. Tijdens die reactie worden er ook 2 elektronen losgemaakt. De 2 waterstofionen kunnen met de 2 elektronen waterstofgas (H2) vormen: je spreekt daarom ook van een dehydrogenatie
Welk organisch reactieproduct er ontstaat, is afhankelijk van het type alcohol dat gebruikt wordt:
• primair alcohol: vorming van een aldehyde en verder een alkaanzuur [OX]
CH3-CH2-OH → CH3-CHO + 2 H+ + 2 e- → CH3-CHO + H2 [OX]
CH3-CHO + H2O → CH3-COOH + 2 H+ + 2 e- → CH3-COOH + H2
• secundair alcohol: vorming van een keton [OX]
CH3-CHOH-CH3 + H2O → CH3-CO-CH3 + 2 H+ + 2 e- →CH3-CO-CH3 + H2
Een tertiair alcohol kan geen zachte oxidatie ondergaan.
Vermeld of de bindingen in deze moleculen homolytisch of heterolytisch worden gebroken.
a zoutzuur
b dibroom (apolair milieu)
c propaan
d ammoniak
Vermeld of deze deeltjes een nucleofiel of elektrofiel reagensdeeltje zijn.
a waterstofion
b chloride-ion
c carbokation
d metaalion
Vermeld na elke reactie de toepasselijke reactiesoort: degradatie/additie/substitutie/ eliminatie.
a C5H12 + Cl2 → C5H11Cl + HCl
b CH3–CH2OH → CH2=CH2 + H2O
c C2H5I + H2O → C2H5OH + HI
d CH2=CH2 + Cl2 → CH2Cl-CH2Cl
e CH3OH + 3 O2 → 2 CO2 + 4 H2O
f C8H18 → C4H8 + C4H10
Gegeven is de volgende organische reactie.
Bij welke 2 soorten van organische reacties
kun je die reactie plaatsen?
CH3-CH2-COOH + NH3 → CH3-CH2-CONH2 + H2O
Welk type reactie zie je?
CH3-CH2-Br + NH3 → CH3-CH2-NH2 + H-Br
a een elektrofiele additie
b een nucleofiele substitutie
c een elektrofiele substitutie
d een eliminatie
Welk type reactie zie je? H HBr | δ- | H3C—C—Br H3C—C | | H OH HOH
a een nucleofiele additie
b een nucleofiele substitutie
c een elektrofiele substitutie
d een eliminatie
Welk type reactie zie je?
a een elektrofiele additie
b een nucleofiele substitutie
c een elektrofiele substitutie
d een nucleofiele additie
In een kolf van 5 L bevindt zich waterstofchloridegas onder een druk van 1 025 mbar bij een temperatuur van 28 °C. Dat gas wordt gemengd met 15 g propeen. Beide stoffen reageren. Hoeveel gram reactieproduct kan er maximaal worden gevormd?
C3H6 + HCl → C3H7Cl
Vervolledig de reactievergelijking van deze organische reacties.
a Schrijf de structuurformule van de producten.
b Benoem daarna voor elke reactie de aard van de skeletverandering (reactiesoort).
c Benoem waar mogelijk de aard van het reagensdeeltje (nucleofiel, elektrofiel of radicaal).
1 CH3-CH2-CH2-CH3 + Br2 → … + …
2 … + … → CH3-CH2-CH2-OH + HBr
3 CH3-CH2-CH=CH-CH3 + HF → …
Kraak n-decaan zodat ethaan ontstaat. Schrijf het reactiemechanisme.
Bepaal welke van deze 4 moleculen het gemakkelijkst het chloride-ion afgeeft.
Rangschik van meest reactief naar minst reactief.
a 1-chloorpropaan
b chloormethaan
c 3-chloorpropeen
d chloorethaan
Los deze reacties op.
Toon telkens duidelijk hoe de reactie verloopt.
a 2-broompropaan + ammoniak
b joodethaan + methanol
Schrijf de reactie tussen etheen en waterstofbromide volledig uit. Mag je kiezen welke C bij de dubbele binding de negatieve lading draagt?
Test dat door de reactie 2 keer uit te schrijven, waarbij je telkens een andere C de negatieve deellading geeft. Als je niet mag kiezen, welke reactie is dan de juiste? Leg uit.
Schrijf de reactie tussen propeen en waterstofbromide volledig uit. Mag je kiezen welke C bij de dubbele binding de negatieve lading draagt?
Test dat door de reactie 2 keer uit te schrijven, waarbij je telkens een andere C de negatieve lading geeft. Als je niet mag kiezen, welke reactie is dan de juiste? Leg uit.
Vul deze organische reacties verder aan.
Toon telkens het reactiemechanisme.
a pent-2-een + waterstofjodide b propeen + chloorgas
Hoeveel gram dibroom moet je hebben om 25,0 g but-2-yn te laten reageren tot een tetrahalogeenbutaan?
C4H6 + 2 Br2 → C4H6Br4
Door de additie van water op pent-2-een ontstaat er een alcohol.
Over hoeveel gram pent-2-een moet je beschikken om 33 g reactieproduct te bekomen?
C5H10 + H2O → C5H12O
Je voegt 75 g hexaan-1-ol toe aan 30 g Na-metaal. Het reactieproduct reageert verder met 120 mL verdunde chloorethaan (dichtheid: 1,04 g cm3 en 30 m% zuivere stof). De betrokken reacties zijn gegeven.
Hoeveel gram ether kan er maximaal worden gevormd? Bereken.
a CH2OH-CH2-CH2-CH2-CH2-CH3 + Na →
Na+-O-CH2-CH2-CH2-CH2-CH2-CH3 + 1 2 H2
b Na+-OCH2-CH2-CH2-CH2-CH2-CH3 + CH2Cl-CH3 →
CH3-CH2–O-CH2-(CH2)4-CH3 + NaCl
AARD VAN SPLITSING
• homolytisch
– apolaire moleculen – vorming van radicalen
– radicalaire reactie
• heterolytisch
– polaire moleculen
– vorming van ionen
– ionaire reactie
INDELING ORGANISCHE REACTIES
AARD VAN AANVALLEND DEELTJE REACTIETYPE
• radicalaire reactie
aanvallend deeltje = radicaal
• ionaire reactie
• elektrofiele reactie
aanvallend deeltje = (gedeeltelijk)
positief geladen
• nucleofiele reactie
aanvallend deeltje = (gedeeltelijk) negatief geladen
• degradatie splitsen van het substraat in kleine deeltjes
• substitutie vervangen van (een groep) atomen
• additie
toevoegen van atomen aan een meervoudige binding
• eliminatie verwijderen van (een groep) atomen
halogeenalkanen
aardolie aardgas
zachte oxidatie
• Onvolledige en volledige verbranding van organische stoffen
• Kraken van alkanen
C6H14 → C2H4 + C4H10
– Homolytische splitsing (radicalen)
– Splitsen van lange alkanen in kleinere alkanen en alkenen
• Alkanen ondergaan een homolytische substitutie (SH).
C5H12 + Cl-Cl → C5H11-Cl + H-Cl
De bindingen in het alkaan en in het reagens worden radicalair geopend.
• Halogeenalkanen ondergaan een nucleofiele substitutiereactie (SN).
CH3-CH2-CH2-Cl + NH3 → CH3-CH2-CH2-NH2 + H-Cl
Het inductieve effect van de alkylgroepen bepaalt de reactiviteit van de halogeenalkanen.
• Alcoholen ondergaan een nucleofiele substitutiereactie (SN).
H2SO4
CH3-CH2-CH2-CH2-OH + H-Br → CH3-CH2-CH2-CH2-Br + H2O
– Symmetrische ethers ontstaan tijdens de dehydratatie van een alcohol.
– Asymmetrische ethers ontstaan tijdens de Williamsonsynthese, waarbij een alkoxide betrokken is.
• Alkenen ondergaan elektrofiele addities (AE)
CH3-CH2-CH=CH2 + H2O → CH3-CH2-CHOH-CH3
Bij asymmetrische alkenen wordt het elektrofiele deeltje toegevoegd aan het atoom dat het verst ligt van de bepalende alkylgroep (+I).
• Halogeenalkanen vormen in aanwezigheid van een sterke base een alkeen
CH3-CH2-Br + NaOH → CH2=CH2 + H2O + NaBr
• Alcoholen vormen in aanwezigheid van sterk zuur een alkeen. Het sterke zuur treedt op als katalysator H2SO4
CH3-CH2OH → CH2=CH2 + H2O
SYMBOOL ELEMENT MOGELIJKE OXIDATIEGETALLEN
+III +V
-I +I +III +V +VII
+II
-I +I +III +V +VII
+II +III +VI
-III +III +V
+I +III
+II +III
-I +I +III +V +VII
+II +III
+II +IV
+I +II
+I +II
Oplosbaarheidstabel
VERBINDINGEN
GOED OPLOSBAAR
SYMBOOL ELEMENT MOGELIJKE OXIDATIEGETALLEN
+IV
+III +IV +VI +VII
+III
+IV +IV +V +VI
+I +II +III +IV +V +II +IV +IV +VI
+IV +VI
SLECHT OPLOSBAAR
verbindingen met Na+ verbindingen met K+ verbindingen met NH4+ alle alle alle / / /
Zouten van:
nitraat (NO3-) bromide (Br-) chloride (Cl-) jodide (I-) sulfaat (SO42-) sulfiet (SO32-) sulfide (S2-) fosfaat (PO43-) carbonaat (CO32-) alle alle, behalve → alle, behalve → alle, behalve → alle, behalve →
Na+, K+, NH4+
Na+, K+, NH4+, Mg2+, Ba2+, Ca2+ Na+, K+, NH4+ Na+, K+, NH4+ /
Ag+, (Hg+, Pb2+: matig) Ag+, (Hg+, Pb2+: matig) Ag+, (Hg+, Hg2+ en Pb2+: matig) Ba2+, (Pb2+, Ca2+: matig) Fe2+, Zn2+, Cu2+, Ca2+, Pb2+, Hg+, Ag+, (Mg2+: matig) alle andere alle andere alle andere
hydroxide (OH-) groep IA, beperkter voor groep IIA andere groepen
Koolstofverbindingen
halogeenalkanen aminen alcoholen ethers aldehyden
Algemeen schema organische reacties
halogeenalkanen esters
alkenen alkynen CCC aardolie aardgas
CCC alkanen RNH 2 aminen ROH alcoholen II alc I alc ethyn ketonen
zachte oxidatie