Klinisk ekko -
kardiografi
 Paul Anders Sletten Olsen og Jan Otto Beitnes
Paul Anders Sletten Olsen og Jan Otto Beitnes

 Paul Anders Sletten Olsen og Jan Otto Beitnes
Paul Anders Sletten Olsen og Jan Otto Beitnes
© H. Aschehoug & Co. (W. Nygaard) AS ved Universitetsforlaget 2024
ISBN 978-82-15-06038-5
Materialet i denne publikasjonen er omfattet av åndsverklovens bestemmelser. Uten særskilt avtale med rettighetshaverne er enhver eksemplarfremstilling og tilgjengeliggjøring bare tillatt i den utstrekning det er hjemlet i lov eller tillatt gjennom avtale med Kopinor, interesseorgan for rettighetshavere til åndsverk. Utnyttelse i strid med lov eller avtale kan medføre erstatningsansvar og inndragning og kan straffes med bøter eller fengsel.
Henvendelser om denne utgivelsen kan rettes til:
Universitetsforlaget
Postboks 508 Sentrum 0105 Oslo
www.universitetsforlaget.no
Omslag: Cecilie Mohr
Sats: ottaBOK
Trykk og innbinding: Livonia Print, Latvia
Boken er satt med: Minion Pro 10,5/14 pkt
Papir: 100 g Arctic Matt
Ideen om å skrive en lærebok i ekkokardiografi ble vekket av et ønske om at flere skulle få innsikt i, og kunnskap om, dette verdifulle verktøyet. Vår erfaring er at ekkokardiografisk kompetanse er etterspurt i den kliniske hverdagen, og det er viktig at flere mestrer denne undersøkelsen. Samtidig foreligger det sparsomt med norske bøker innen denne tematikken, og et så viktig fagområde fortjener en egen lærebok dedisert til et norsk publikum.
Tanken med Klinisk ekkokardiografi er at den kan benyttes av de som er nybegynnere på området og skal lære seg ekkokardiografi fra bunnen av, men også at erfarne ekkokardiografører skal kunne tilegne seg ny kunnskap og få nyttige tips som kan forbedre egen undersøkelsesteknikk. Det er i tillegg et poeng for oss at den ekkokardiografiske undersøkelsen skal tolkes i en klinisk kontekst. Boken omhandler derfor ikke bare ekkokardiografi, men også symptomer, kliniske funn, utredning og behandling omkring mange av sykdommene og tilstandene som omtales. De fleste av kapitlene er beriket med en kasuistikk, mens for eksempel en del kliniske poenger er rammet inn i blå bokser. Utfyllende kunnskap tilegnet de spesielt interesserte er skrevet med mindre skrift på blå bakgrunn. Engelske ord og uttrykk er i all hovedsak forsøkt oversatt til norsk.
Vi har tatt utgangspunkt i et rikt kildegrunnlag under skrivingen av boken, og basert på egen erfaring har vi forsøkt å belyse på en pedagogisk måte de områdene som kan være utfordrende å mestre når man skal lære seg ekkokardiografi. Utviklingen innen medisinen går raskt, og retningslinjer oppdateres jevnlig. Detaljer omkring for eksempel behandling av en del av sykdommene kan det derfor være nødvendig å tilegne seg fra andre kilder etter hvert som kunnskapsgrunnlaget oppdateres.
Ekkokardiografi er et visuelt fag, og en bok kan aldri erstatte det visuelle inntrykket når man faktisk utfører en ekkokardiografisk undersøkelse. Vi har forsøkt å benytte representative og illustrative bilder fra eget arkiv ved Oslo universitetssykehus, Rikshospitalet.
Vi håper at denne boken kan fungere som en inngangsbillett til ekkokardiografi, både for medisinstudenter, leger, ekkoteknikere og annet helsepersonell med spesiell interesse for ekkokardiografi. Samtidig kan den være et nyttig oppslagsverk for de som allerede mestrer denne «kunsten», men som ønsker utfyllende kunnskap om ekkokardiografi både ved basale, men også mer sjeldne, sykdommer. Forhåpentligvis kan Klinisk ekkokardiografi være et bidrag til å øke kompetansen og kunnskapen på området, og danne et solid grunnlag for den praktiske treningen som også må til for å bli en dyktig ekkokardiografør.
Vår egen interesse for ekkokardiografi har blitt vekket og stimuleres jevnlig gjennom god opplæring, interessante, faglige diskusjoner med kolleger og stadig nye utfordringer og kliniske problemstillinger som vi møter i hverdagen. Vi ønsker å takke det fremragende fagmiljøet ved Oslo universitetssykehus, Rikshospitalet, som bidrar til å opprettholde og vedlikeholde denne interessen. En særlig takk rettes til de strålende kollegene ved Hjerte-/lungemedisinsk seksjon ved Bærum sykehus. Deres smittende dedikasjon til faget, gode humør og vilje til å vise tillit har vært avgjørende for at boken ble til. En takk sendes også til Universitetsforlaget og de dyktige medarbeiderne som har bidratt i utgivelsesprosessen, og som har sørget for at en høytsvevende idé har blitt realisert på papiret.
Oslo, februar 2024
Paul Anders Sletten Olsen Jan Otto BeitnesEn del av forkortelsene i boken regnes som så innarbeidet i medisinsk litteratur at de ikke er skrevet helt ut fortløpende i teksten, men er allikevel tatt med i listen nedenfor. Mindre vanlige forkortelser er både inkludert i listen nedenfor og skrevet helt ut første gang de tas i bruk i hvert kapittel.
2D 2-dimensjonal
3D 3-dimensjonal
A areal
AEKG arbeids-EKG
AI aortainsuffisiens
ALCAPA anomal avgang av venstre hovedstamme fra truncus pulmonalis (anomalous left coronary artery from the pulmonary artery)
ARCAPA anomal avgang av RCA fra truncus pulmonalis (anomalous origin of the right coronary artery from the pulmonary artery)
ARVC arytmogen høyre ventrikkelkardiomyopati
AS aortastenose
ASD atrieseptumdefekt
ASH asymmetrisk septumhypertrofi
AV-blokk atrioventrikulært blokk
AV-klaff atrioventrikulærklaff
AV-knute atrioventrikulærknute
AVR aortaklafferstattende behandling (aortic valve replacement)
AVSD atrioventrikulær septumdefekt
BCPC bidireksjonal cavopulmonal forbindelse
BSA kroppsoverflate (body surface area)
BV tykkelsen av venstre ventrikkels bakrevegg
CI indeksert minuttvolum (cardiac index)
CRP C-reaktivt protein
CRT kardial resynkroniseringsterapi
CT computertomografi
CX ramus circumflexus
D diameter
DCM dilatert kardiomyopati
DORV dobbelt utløpende høyre ventrikkel
DT deselerasjonstid
DVI hastighetsindeks målt med doppler (doppler velocity index)
EF ejeksjonsfraksjon
EGPA eosinofil granulomatose med polyangiitt
EKG elektrokardiogram
ELI indeksert energitap (energy loss index)
EOA effektivt åpningsareal
EROA det effektive arealet av insuffisiensåpningen (effective regurgigant orifice area)
ET ejeksjonstid
FAC fraksjonell arealendring (fractional area change)
FS forkortningsfraksjon (fractional shortening)
GLS global longitudinell strain
GUCH voksne med medfødt hjertesykdom (grown-up congenital heart disease)
HCM hypertrofisk kardiomyopati
HES hypereosinofilt syndrom
HFmrEF hjertesvikt med lett redusert ejeksjonsfraksjon (heart failure with mildly reduced ejection fraction)
HFpEF hjertesvikt med bevart ejeksjonsfraksjon (heart failure with preserved ejection fraction)
HFrEF hjertesvikt med redusert ejeksjonsfraksjon (heart failure with reduced ejection fraction)
HIV humant immunsviktvirus
HOCM hypertrofisk, obstruktiv kardiomyopati
ICD implanterbar defibrillator
ICE intrakardial ultralyd
INR internasjonal normalisert ratio
IVCT isovolumetrisk kontraksjonstid
IVRT isovolumetrisk relaksasjonstid
KOLS kronisk obstruktiv lungesykdom
L lengde
LAD ramus interventricularis anterior
LVOT venstre ventrikkels utløpstraktus (left ventricular outflow tract)
MAC kalsifisering i mitralannulus (mitral annular calcification)
MAPCA kollateralarterier mellom aorta og lungearteriene (major aortopulmonary collateral arteries)
MAPSE forflytning av mitralannulus (mitral annulus plane systolic excursion)
MI mitralinsuffisiens
ML myokardlengde
MR magnetisk resonanstomografi
MS mitralstenose
NDLVC ikke-dilatert venstre ventrikkelkardiomyopati
NSAIDs ikke-steroide inflammatoriske legemidler
NSTEMI hjerteinfarkt uten ST-elevasjon på EKG
NYHA New York Heart Association
P trykk (pressure)
PAPVC partiell anomal lungeveneforbindelse
PCI perkutan koronar intervensjon
PDA åpenstående (persisterende) ductus arteriosus
PET positronemisjonstomografi
PFO åpentstående (patent) foramen ovale
PH pulmonal hypertensjon
PHT trykkhalveringstid (pressure half time)
PI pulmonalinsuffisiens
PISA proximal isovelocity surface area
PS pulmonalstenose
Q blodvolum (volumstrøm)
r radius
RA revmatoid artritt
RCA arteria coronaria dextra
RCM restriktiv kardiomyopati
RIMP right ventricular index of myocardial performance
RVOT høyre ventrikkels utløpstraktus (right ventricular outflow tract)
RVT relativ veggtykkelse
SAM systolisk anterior bevegelse av mitralklaffen (systolic anterior motion)
SCAD spontan koronararteriedisseksjon
SLE systemisk lupus erythematosus
SR senkningsreaksjon
STE speckle tracking-ekkokardiografi
STEMI hjerteinfarkt med ST-elevasjon på EKG
SV slagvolum
SVi indeksert slagvolum
TAPSE bevegeligheten av trikuspidalplanet (tricuspid annular plane systolic excursion)
TAPVC total anomal lungeveneforbindelse
TAVI transkateter aortaventilimplantasjon
TCPC total cavopulmonal forbindelse
TI trikuspidalinsuffisiens
TS trikuspidalstenose
TTE transtorakal ekkokardiografi
TØE transøsofageal ekkokardiografi
v hastighet
V volum
Vp strømningshastigheten til blodet som går gjennom mitralklaffen mot apex (propagation velocity)
VS tykkelsen av ventrikkelseptum
VSD ventrikkelseptumdefekt
VTI integralet av hastighetskurven (velocity time integral)
VVEDV venstre ventrikkels endediastoliske volum
VVESV venstre ventrikkels endesystoliske volum
VVID venstre ventrikkels indre diameter
Ekkokardiografi, ultralyd av hjertet, er en essensiell undersøkelse innenfor kardiologi. Siden kardial ultralyd først ble benyttet av Inge Edler og Carl Hellmuth Hertz i 1953, har undersøkelsen utviklet seg til å spille en sentral rolle i diagnostikk og behandling av tilnærmet alle hjertesykdommer. I tillegg er den viktig i vurderingen av akutt syke og hemodynamisk ustabile pasienter.
Ekkokardiografi brukes i dag ikke bare ved de kardiologiske avdelingene, men også i akuttmottak, på intensivavdelinger og ved noen fastlegekontor. En rekke ulike spesialister – i tillegg til kardiologer – har nytte av undersøkelsen, for eksempel infeksjonsmedisinere, onkologer, revmatologer og nevrologer. Som ekkokardiografi-kompetent lege vil man raskt oppdage at man er ettertraktet, og lærer man seg denne kunsten, vil man «aldri ha en rolig arbeidsdag igjen».
Ekkokardiografi kan si oss noe om hjertets anatomi, funksjon og hemodynamikk. Undersøkelsen er ikke-invasiv, bivirkningsfri, relativt billig og kan utføres pasientnært der pasienten befinner seg. Den innebærer verken bruk av stråling eller røntgenkontrastmidler, og med litt opplæring og trening er det mulig for alle å oppnå et akseptabelt ferdighetsnivå slik at den kan tas i bruk i den kliniske hverdagen. Tabell 1.1 lister opp noen typiske indikasjoner.
For å begynne å bruke ekkokardiografi må man ikke lære seg de tekniske og fysiske prinsippene som ligger til grunn for undersøkelsen. En viss kunnskap om dette kan allikevel gjøre det lettere å forstå og tolke bildene som fremstilles. Dette kapittelet vil derfor omhandle basal ultralydfysikk og tekniske aspekter rundt undersøkelsen.
Tabell 1.1: De vanligste indikasjonene for ekkokardiografi
Indikasjoner for ekkokardiografi
Klaffesykdom
Hjertesvikt
Akutt koronarsyndrom
Kardiomyopati
Perikardvæske
Hypertensjon med mistanke om endeorganskade
Endokarditt
Myokarditt
Perikarditt
Spørsmål om kardial embolikilde
Medfødte hjertefeil
Vurdering av klaffeproteser
Lydbølger er mekaniske svingninger, eller trykkvariasjoner, som brer seg i et medium. De er karakterisert av en viss frekvens, bølgelengde og amplitude (figur 1.1).
Frekvensen er antall svingninger per sekund, bølgelengden er definert som avstanden mellom to bølger i en gitt periode, mens amplituden er det maksimale utslaget av en svingning og sier noe om styrken til bølgen. Frekvens måles i hertz (Hz), bølgelengden i meter (m) og amplituden i desibel (dB). Hastigheten til lydbølgen avhenger av de fysiske egenskapene (tettheten og stivheten) til mediet som den går gjennom. Gjennomsnittshastigheten i bløtvev og blod hos mennesker er omtrent 1 540 m/s, mens den i luft kun er omtrent 330 m/s.
Lydbølger som kan høres av mennesker, har typisk frekvenser mellom 20 og 20 000 Hz. Ultralyd, derimot, har mye høyere frekvens, mellom 1 000 000 og 20 000 000 Hz (1–20 MHz). Ved transtorakal ekkokardiografi (TTE) benyttes gjerne ultralyd med en frekvens på 1–8 MHz.
Sammenhengen mellom ultralydbølgens hastighet (v), bølgelengde (λ) og frekvens (f) kan uttrykkes som:
λ = v/f
Oppløsningen på ultralydbildet bestemmes av bølgelengden. Bølgelengden svarer til den minste strukturen vi kan visualisere med ekkokardiografi, også kalt spatial oppløsning. Fordi bølgelengden er bestemmende for oppløsningen, og bølgelengden bestemmes av hastigheten og frekvensen, er det de to sistnevnte som grunnleggende sett er avgjørende for hvor god bildeoppløsningen er. Hastigheten i vevet er konstant, dermed er det i praksis frekvensen som har betydning for oppløsningen. Av formelen ser vi at høy frekvens gir kort bølgelengde, mens lav frekvens gir lang bølgelengde.
Med ekkokardiografi gir bølgelengder som er < 1 mm adekvat oppløsning, det betyr en frekvens rundt 2,5 MHz. Enda høyere frekvens gir bedre oppløsning, men ultralydbølger penetrerer dårligere ned i vevet jo høyere frekvensen er. Økt frekvens (og dermed oppløsning) går derfor på bekostning av hvor langt ned i vevet vi kan se med tilstrekkelig signalstyrke. Dermed vil ultralydbølger med høy frekvens
og kort bølgelengde gi god bildeoppløsning og kunne visualisere svært små strukturer, men ikke penetrere like dypt ned i vevet som ultralydbølger med lav frekvens og lang bølgelengde, som derimot gir dårligere oppløsning.
Som et kompromiss fungerer som regel frekvenser mellom 1,4–3,75 MHz når vi gjør ekkokardiografi hos voksne. Hos barn kan vi tillate oss høyere frekvens fordi det er kortere vei fra thoraxveggen til hjertet. 3,5–5 MHz fungerer da bra. Ved transøsofageal ekkokardiografi (TØE) og intrakardial ultralyd (ICE) kan man benytte frekvenser fra 5 til 10 MHz.
Ekkokardiografimaskinen og dannelsen av ultralyd
Ekkokardiografimaskinen består av en transduser, også kalt probe, en datamaskin, et kontrollpanel, en skjerm og en bildelagringsenhet. Transduseren danner og mottar ultralydbølgene, mens datamaskinen bearbeider signalene som mottas, og fremstiller dem som bilder på skjermen. Bildene kan lagres og modifiseres underveis på maskinen eller overføres til en server for analyse i et eget dataprogram på et senere tidspunkt. Undersøkeren styrer det hele via kontrollpanelet –som med sin «knottologi» for øvrig har tatt motet fra mange som har vurdert å lære seg ekkokardiografi.
Det er transduseren som sørger for å generere ultralydbølger. Transduseren består av en matrise av krystaller med piezoelektriske egenskaper, og når det sendes strøm i krystallene, gir dette mekaniske vibrasjoner. Disse sendes ut i vevet som ultralydimpulser i form av fokuserte skannelinjer.
Transduseren vil samtidig motta ultralydbølger som reflekteres tilbake fra vevet i pausene mellom impulsutsendingen. Disse mekaniske vibrasjonene vil i de piezoelektriske krystallene omdannes tilbake til elektrisk spenning, som forsterkes og analyseres av datamaskinen. På bakgrunn av de reflekterte signalenes frekvens, signalstyrke og tidsforskjellen mellom sending og mottak av signaler danner maskinen et bilde på skjermen. Amplituden tildeles en pikselverdi, og jo høyere amplitude, jo lysere avbildes bølgene på skjermen. Tettheten til vevet som reflekterer bølgene,
påvirker frekvensen til det reflekterte signalet, så vev med større tetthet fremstår lysere enn vev med lavere tetthet.
Bildedannelsen tar også utgangspunkt i tidsintervallet mellom sending og mottak av ultralydbølgene, slik at de ulike strukturene lokaliseres på riktig sted på skjermen. Jo lengre tid det tar fra sending til mottak, jo lenger bort fra transduseren vil maskinen tolke at strukturen befinner seg. Samtidig må det være en viss avstand mellom to strukturer for at maskinen skal evne å skille dem som nettopp to strukturer lokalisert på ulike dybdenivå. Dette kalles aksialoppløsning (figur 1.2). Aksialoppløsningen på dagens maskiner er omtrent 1 mm.
Transduseren kan ikke generere og sende ut en ny ultralydimpuls før den har mottatt den forrige. Dermed vil antallet impulser per sekund, pulsrepetisjonsfrekvensen, avhenge av den maksimale reisetiden for impulsen fra og til transduseren. Reisetiden er igjen avhengig av bildedybden, slik at jo dypere ned i vevet transduseren «ser», jo lengre reisetid og lavere pulsrepetisjonsfrekvens. Det betyr at bildefrekvensen (antallet bilder generert på skjermen per sekund, eller hvor raskt unike, etterfølgende bilder produseres) går ned.
I praksis vil det si at dersom vi vil studere strukturer som er dypt i thorax, går det på bekostning av bildefrekvensen. Samtidig er bildefrekvensen også avhengig av antallet skannelinjer, som vi snart skal se.
Ultralydbølgenes forplantning i thorax
Etter at transduseren har generert ultralydbølgene, vil de sendes ned i vevet. Når ultralydbølger penetrerer et heterogent medium, vil de utsettes for fire prosesser:
1) refleksjon, 2) spredning, 3) brytning og 4) attenuasjon (figur 1.3). Disse er viktige for hvordan bildet av strukturene vi studerer, fremtrer på skjermen.
Refleksjon Spredning fra erytrocytter
Brytning og attenuasjon

Figur 1.3: De fire prosessene som ultralydbølgene utsettes for: refleksjon, spredning, brytning og attenuasjon
Refleksjon er avgjørende for bildedannelsen ved ekkokardiografi. Når bølgene går gjennom thorax, vil de treffe overganger mellom vev med ulik tetthet, for eksempel fett og bindevev. Ved slike overganger vil en viss andel av ultralydbølgene reflekteres tilbake, og dette avhenger av vevets akustiske impedans (motstand). Impedansen er igjen avhengig av vevets tetthet og hastigheten til ultralydbølgene, og refleksjonen er kraftigere jo større forskjell det er i tetthet mellom vevene. Kraftig refleksjon fremstår som hvit, mens svakere refleksjon blir grålig.
Størrelsen på ultralydimpulsen som mottas av transduseren, avhenger også av vinkelen mellom ultralydstrålen og vevet den treffer. Størst refleksjon skjer dersom ultralydstrålen treffer vevet vinkelrett.
Når transduseren sender ut en ultralydimpuls og mottar refleksjoner fra den samme impulsen, vil den tolke alle signaler den mottar, som å komme fra denne samme skannelinjen. De reflekterte signalene kan derimot også komme fra strukturer som ligger utenfor skannelinjen. Lateraloppløsning er evnen å skille mellom to objekter som er plassert ved siden av hverandre (figur 1.2). En smal og fokusert ultralydimpuls er bedre til å diskriminere mellom to nærliggende strukturer enn en bred ultralydimpuls, og lateraloppløsningen er også bedre nært transduser (i nærfeltet) enn dypere ned i vevet (i fjernfeltet). Dersom lateraloppløsningen er dårlig, kan ekkokardiografimaskinen tolke to nærliggende strukturer som én struktur.
Ved ekkokardiografi er aksialoppløsningen bedre enn lateraloppløsningen, det vil si at maskinen er bedre til å skille to nærliggende strukturer som ligger på ulik dybde, enn de som ligger ved siden av hverandre.
Spredning skjer dersom ultralydbølgene treffer små strukturer hvor bare en liten del av ultralydimpulsen som sendes ut, reflekteres tilbake til transduseren. I stedet blir impulsen spredt ut i alle retninger. Graden av spredning avhenger av frekvensen, så jo høyere frekvens, jo mer spredning.
Når ultralydbølgene passerer fra et vev til et annet med ulik tetthet, vil noen av dem reflekteres, mens andre vil brytes og gå videre i vevet med en annen retning. Hvor mye de brytes, er avhengig av vinkelen bølgene treffer vevet med, og tetthetsforskjellen mellom vevene, det vil si forskjellen i ledningshastighet. Stor forskjell i ledningshastighet mellom ulike vev gir mye refleksjon i grenseflatene, som er årsaken til at bein og luft (lunger) er dårlige ekkomedier. Gjennomsnittshastigheten i luft og kortikalt bein er henholdsvis 330 m/s og 3 500 m/s.
Attenuasjon betyr at ultralydimpulsen svekkes når den går gjennom vevet. Det skyldes at energien absorberes i vevet ved at den omdannes til varme, men også refleksjon og spredning. Hvor mye impulsen svekkes, avgjøres av lengden impulsen har gått, frekvensen og vevets impedans.
Attenuasjonen øker med avstanden fra transduser. Det betyr at strukturer som ligger dypt i thorax, fremstilles dårligere (de reflekterer mindre ultralydbølger) enn de som sitter overfladisk.
Ultralydbølger med høy frekvens svekkes raskere enn de med lav frekvens. For eksempel vil en transduser som genererer bølger med en frekvens på 1 MHz, penetrere omtrent 30 cm ned i vevet, mens ultralydbølger med 20 MHz penetrerer omtrent 1,5 cm ned i vevet. Hver transduser er tilpasset sitt bruk og har sitt optimale frekvensområde; derfor brukes ulike transdusere til for eksempel kardial og abdominal ultralyd.
I en ekkokardiografisk undersøkelse benytter vi flere teknikker som utnytter forskjellige aspekter ved ultralydteknologien for å fremstille ultralydbølgene på ulike måter. Dette er M-modusekkokardiografi, 2D-ekkokardiografi, spektraldoppler (kontinuerlig og pulset doppler), fargedoppler og vevsdoppler. Nyere teknikker er deformasjonsanalyse (strain) og 3Dekkokardiografi.
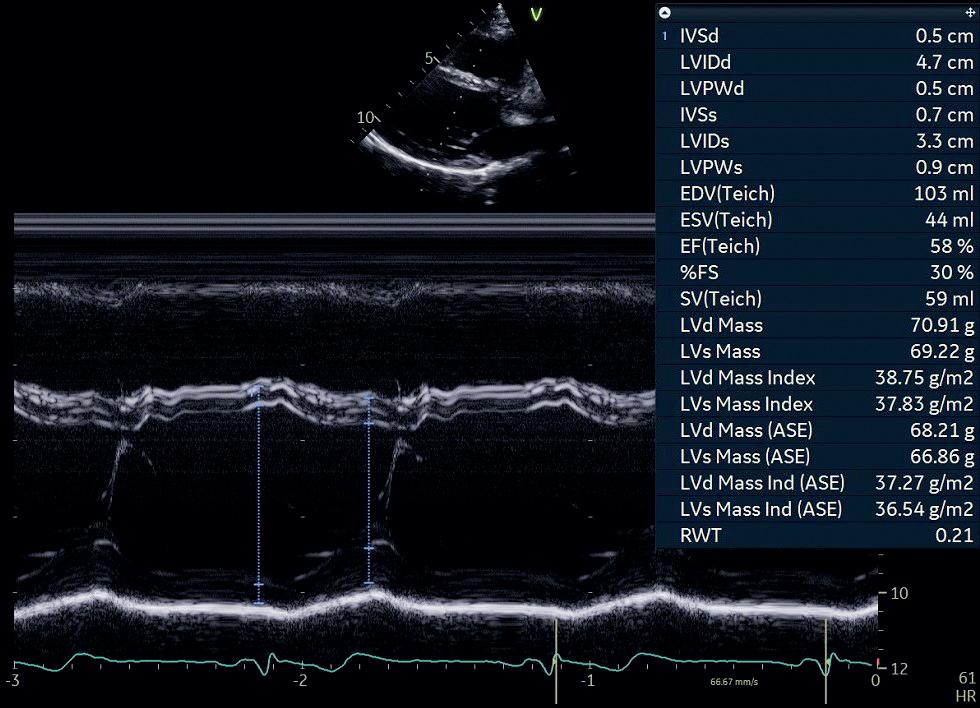
Ved M-modusekkokardiografi (M for motion) er det kun én krystall i transduseren som sender ut og mottar ultralydimpulser i rask rekkefølge. Pulsrepetisjonsfrekvensen er > 1 000/s, som gir en svært god tids- og dybdeoppløsning. Strukturer som beveger seg, vil fremtre som kurver på skjermen, og kombinert med registrering av EKG kan bevegelsene til strukturene vi studerer, tidsrelateres til hjertesyklus (figur 1.4).
M-modusekkokardiografi er ikke like mye brukt i dag som tidligere, og denne teknikken må uansett
sempel si at aortaklaffen bruker 0,04 sekunder fra å være helt lukket til å være helt åpen. Dersom bildefrekvensen er 30 bilder per sekund, vil hvert sveip ta 0,03 sekunder. Dermed vil det være umulig å se selve åpnings- og lukkeprosessen av klaffen fordi klaffen vil være tilnærmet helt åpen eller lukket fra ett bilde til det neste. Et kompromiss kan i dette tilfellet være å redusere antallet skannelinjer, som fører til høyere bildefrekvens, men noe dårligere oppløsning.
brukes sammen med 2D-ekkokardiografi, som fungerer som veiledning for hvor M-modusstrålen (som på skjermen vises som en markørlinje) skal plasseres.
Dersom vi klarer å unngå vinkelfeil, kan M-modusekkokardiografi brukes for eksempel til måling av dimensjoner og veggtykkelser, og for å studere hjerteklaffenes bevegelse.
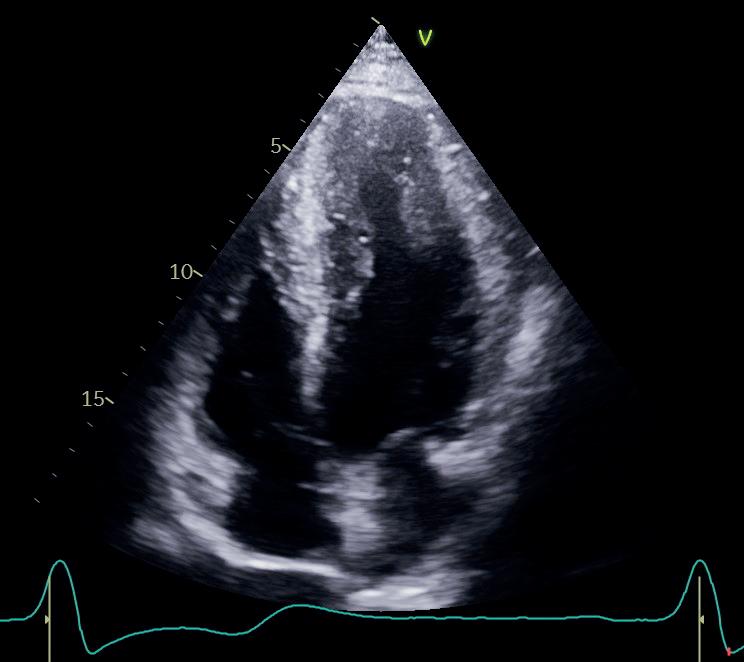
2D-ekkokardiografi er «arbeidshesten» innen ekkokardiografi (figur 1.5). Denne teknikken lager et gråtonebilde av hjertet i sanntid ved at flere titalls piezoelektriske krystaller aktiveres sekvensielt (phased array) og genererer en ultralydstråle som sveiper over området vi vil studere. Ultralydstrålen består av mange skannelinjer, som hver utgår fra én krystall. Dette står i motsetning til M-modusekkokardiografi, hvor vi kun benytter én skannelinje.
Bildeoppløsningen avgjøres blant annet av antallet skannelinjer – jo flere skannelinjer, jo bedre oppløsning. Samtidig vil flere skannelinjer gjøre at ultralydstrålen bruker lengre tid på sveipe over området, så bildefrekvensen går ned. Siden hjertet er en struktur i bevegelse, må bildefrekvensen være relativt høy for at bildet vi får frem på skjermen, skal være godt nok. Tidsoppløsningen må altså være god. La oss for ek-
Når 2D-bildet kommer opp på skjermen, er konsensus at transduseren er øverst på skjermen og de overfladiske strukturene som ligger nærmest transduser, visualiseres øverst. De dypere strukturene følger etter nedover på skjermen. Transduseren definerer et bildeplan, og markøren på transduserhodet definerer hva som vises på høyre side av skjermen. På de fleste maskinene er det imidlertid mulig å omdefinere bildeplanene både med hensyn til hva som er opp, ned, høyre og venstre, dersom man ønsker dette.
Dopplereffekten
Spektraldoppler er en fellesbetegnelse på kontinuerlig og pulset doppler. Med disse teknikkene kan vi få
informasjon om blodstrømmens hastighet, retning, intensitet og om det er laminær eller turbulent blodstrøm. Dopplerekkokardiografi kan brukes alene eller kombinert med 2D-ekkokardiografi, som er det vanlige.
Det er den såkalte dopplereffekten som benyttes for å måle blodstrømshastigheter. Dopplereffekten betegner det fenomenet at frekvensen til ultralydbølgene som reflekteres tilbake til transduseren, endrer seg hvis de treffer et objekt i bevegelse. Dersom objektet beveger seg mot transduseren, vil frekvensen til de reflekterte bølgene være høyere enn frekvensen til de utsendte bølgene, og motsatt dersom objektet beveger seg fra transduseren. Denne forskjellen i frekvens kalles dopplerskift.
Sammenhengen mellom den relative hastigheten mellom sender og mottaker og dopplerskiftet er gitt i dopplerligningen:
Δf = 2f 0 x (v x cosθ/c),
hvor Δf er dopplerskiftet, f0 er frekvensen til den utsendte ultralydimpulsen, v er hastigheten til objektet, cosθ er cosinus til vinkelen mellom objektets retning og ultralydstrålens akse, og c er ultralydens hastighet. Fordi vi kan måle Δf og vi kjenner f0, cosθ og c, kan vi finne hastigheten til objektet. I klinisk praksis er det hastigheten til blodstrømmen og vevet (hvis vi bruker vevsdoppler) som er av interesse.
Legg merke til viktigheten av vinkelen mellom ultralydstrålen og blodets eller vevets retning. Markørlinjen bør gå parallelt med det vi ønsker å måle, for jo større vinkel, jo mer underestimerer vi hastigheten. Dersom vinkelfeilen overstiger 20 grader, blir hastigheten så unøyaktig at den ikke bør brukes.
Ved kontinuerlig doppler benyttes to ultralydkrystaller hvor den ene kontinuerlig sender ut ultralydimpulser, mens den andre kontinuerlig mottar impulser. Dette gjør at man ikke er begrenset av pulsrepetisjonsfrekvensen, og høye frekvensendringer (dopplerskift) kan registreres langs ultralydstrålen, eller sagt med

andre ord: høye hastigheter kan måles (figur 1.6). Når impulsene registreres kontinuerlig, er maskinen ikke i stand til å tolke hvor den høye hastigheten registreres. Det eneste vi kan vite, er at den hastigheten vi måler, befinner seg et eller annet sted langs markørlinjen.
I motsetning til 2D-ekkokardiografi, hvor amplituden til de reflekterte ultralydbølgene tildeles en pikselverdi og lyser opp på skjermen, er det ved dopplerekkokardiografi frekvensen som tildeles en pikselverdi. Det kontinuerlige dopplersignalet fremstilles på skjermen som en hastighetskurve med tid langs x-aksen og hastighet langs y-aksen. I denne kurven inngår hastigheten til alle blodcellene, også de med lavere hastigheter som registreres proksimalt og distalt for maksimalhastigheten. Hastigheten til blodet som beveger seg bort fra transduseren, fremkommer under basislinjen, mens hastigheten til blodet som beveger seg mot transduseren, fremkommer over basislinjen. Ut fra kurven kan vi enkelt måle den maksimale hastigheten, og ved å trekke en linje langs kurven (trace eller «tegne rundt» kurven) finner vi integralet (arealet under kurven). Dette benevnes VTI (velocity time integral), og er matematisk sett distansen blodet har forflyttet seg (hastighet x tid). Dette gir oss flere verdier som vi bruker i mange analyser.
Pulset doppler muliggjør nøyaktig måling av hastigheter på bestemte steder, og ikke bare den høyeste hastigheten langs markørlinjen. Det gjøres ved at vi plasserer et såkalt målevolum på det stedet i 2D-bildet hvor vi ønsker å måle blodstrømshastigheten. Transduseren sender ut en ultralydimpuls og analyserer bare refleksjoner som svarer til tiden impulsen bruker frem og tilbake til dette stedet. Den sender og mottar altså ikke kontinuerlig, som ved kontinuerlig doppler. Hastigheten fremstilles som en kurve på skjermen.
Med pulset doppler er det en grense for hvor store dopplerskift – og dermed hastigheter – som kan måles. Denne grensen kalles Nyquist-grensen, og den har nær sammenheng med pulsrepetisjonsfrekvensen. Vi husker at pulsrepetisjonsfrekvensen er antallet ultralydimpulser som transduseren sender ut per sekund, og med pulset doppler vil den begrenses av tiden det tar for impulsen å nå målevolumet og returnere til transduseren. Nyquist-grensen vil per definisjon alltid være halvparten av pulsrepetisjonsfrekvensen (pulsrepetisjonsfrekvensen/2).
Dersom dopplerskiftet/hastigheten er høyere enn Nyquist-grensen, oppstår såkalt aliasing. Det gjør at hastigheten til blodstrømmen registreres feil og i motsatt retning av den reelle. Fenomenet skyldes at hastigheten er så høy at maskinen ikke klarer å analysere den utsendte ultralydimpulsen før det kommer en ny impuls. Aliasing kan forsøksvis unngås ved å justere på basislinjen eller øke pulsrepetisjonsfrekvensen. Maksimal hastighet som kan måles med pulset doppler, er omtrent 1,5–2 m/s. Nyquist-grensen, og dermed den maksimale hastigheten man kan måle uten aliasing, blir lavere jo lengre avstanden er mellom målepunktet og transduseren.
Blodstrømmen i hjertet kan fargelegges oppå 2D-bildet ved hjelp av fargedoppler. Det er basert på samme prinsipp som pulset doppler, men hastighetene er uttrykt i form av farger. Fargene representerer hastigheten i små målevolum som ligger etter hverandre, og fargekoden angir retning og hastighet. Blodstrøm som
går mot transduseren, er rød, mens blodstrøm som går bort fra transduseren, er blå (huskeregelen BART kan benyttes – blue away, red towards). Høye hastigheter med aliasing fremstår som grønne eller ses som en fargemosaikk.
Fargedopplerbildet har lavere bildefrekvens enn vanlig 2D-ekkokardiografi. For å øke frekvensen kan fargesektoren gjøres smalere, som betyr at maskinen bruker kortere tid på å oppdatere bildene. For å tidfeste hendelser i fargebildet mer nøyaktig kan farge-M-modusekkokardiografi benyttes, hvor fargekoding er lagt til et vanlig M-modusbilde. I klinisk praksis er det sjelden behov for denne funksjonen.
Vevsdoppler
Vevsdoppler er en form for pulset doppler som brukes for å måle vevshastigheten i myokard. Prinsippet er det samme som når vi registrerer blodstrømshastigheter, men myokardbevegelsen har lavere hastighet enn blodstrømmen, og signalstyrken er kraftig. Vevsdoppler bruker filtre til å fokusere på disse signalene. Dersom tidsoppløsningen er god, kan vi analysere hvor i myokard bevegelsen begynner, hvor mye og hvor raskt det beveger seg. Vevsdoppler kombineres med pulset doppler, slik at vi måler vevshastigheten i kun ett punkt av gangen. På den måten økes tidsoppløseligheten.
Vevsdoppler har en særlig viktig plass i vurderingen av venstre ventrikkels diastoliske funksjon og fyllingstrykk, og høyre ventrikkels systoliske funksjon.
Deformasjonsanalyse – strain
Deformasjonsanalyse, som blant annet omfatter strain, er en relativt ny teknikk innen ekkokardiografi. Den brukes per i dag hovedsakelig for å vurdere venstre ventrikkels globale og regionale systoliske funksjon, høyre ventrikkels systoliske funksjon samt venstre atrium, men bruksområdet utvides stadig.
Strain betegner hvor mye et myokardsegments lengde forandrer seg i forhold til utgangslengden. Sagt med andre ord er det et mål på hvor mye myokard deformeres. Denne deformasjonen uttrykkes i prosent. Fordi myokard forkortes når det kontraherer, vil en
normal kontraksjon ha negativ strainverdi, mens et eventuelt strekk vil gi positiv verdi.
En variant av strainmåling er måling av strain rate, altså hvor raskt deformasjonen eller den prosentvise endringen skjer Strain rate uttrykkes i enheten s-1 Denne teknikken er lite brukt i klinikken
Strainmålinger kan baseres på vevsdoppler eller på såkalt flekksporing (speckle tracking), hvor ekkogene punkter i myokard (speckles, som er mikrostrukturer i vevet) følges. Speckle tracking-ekkokardiografi (STE) er det vanligste å bruke, hvor programvaren analyserer og følger bevegelsen til de ekkogene punktene. Det kan gjøres i både longitudinell, radial og sirkumferensiell retning, dermed kan strain måles longitudinelt, radialt og sirkumferensielt.
I klinisk praksis er longitudinell strain av venstre ventrikkel mest i bruk. Da tas bildeopptak fra tre ulike projeksjoner (apikal 4-kammer, apikal 2-kammer, apikal langakse), og måleområdet plasseres over myokard. Maskinen kan foreslå hvor måleområdet skal plasseres, men ofte må det i tillegg justeres manuelt. Når målingen er utført, lages det kurver for hvert segment som viser regional strain, og det kalkuleres et gjennomsnitt, global longitudinell strain (GLS) (figur 4.3). GLS har i mange studier vist seg å være et mer sensitivt mål på ventrikkelfunksjonen enn den mer brukte ejeksjonsfraksjonen (EF). I tillegg til kurver kan strainmålingen uttrykkes i et bull’s eye plot, hvor hjertets apex er innerst og basis ytterst. De ulike delene av sirkelen representerer ulike ventrikkelsegmenter.
Et velkontraherende myokardsegment vil trekke seg mer sammen enn et dårlig kontraherende myokardsegment, så den prosentvise forandringen i utgangslengden blir større jo bedre kontraksjonene er. En normal longitudinell strainverdi vil derfor – forvirrende nok –være mer negativ i prosent enn en dårlig verdi. Skadet myokard vil kontrahere dårligere enn friskt myokard, og den prosentvise forandringen vil derfor være mindre. Strainverdien vil være høyere (altså mindre negativ).
For en mest mulig korrekt strainmåling er det viktig at bildefrekvensen er høy nok (helst 60–70 bilder
per sekund), at bildesektoren gjøres så smal som mulig, og at kun veggsegmenter som er av interesse, inkluderes. Pasienten bør holde pusten mens målingen gjøres, for å unngå drifting og artefakter. Det er dessuten viktig å vite at strainmåling kan basere seg på ulike algoritmer avhengig av produsenten av maskinvaren. Disse kan ha forskjellige normalverdier, så vi kan ikke uten videre sammenligne strainverdier gjort på ulike ekkokardiografimaskiner.
Radial og sirkumferensiell strain – som måles fra parasternal kortakseprojeksjon – er lite i bruk i klinikken Radial strain måler deformasjonen (normalt fortykkelsen) mot sentrum i venstre ventrikkelkaviteten, mens sirkumferensiell strain måler deformasjonen (normalt forkortningen) langs omkretsen av ventrikkelen STE kan også brukes til å vurdere vridningsbevegelsen til venstre ventrikkel, som er en del av den normale kontraksjonen Vridningen har motsatt retning i basis og apex, og analysen går ut på å analysere den netto forskjellen i gjennomsnittlig rotasjon Dette er heller ikke i rutinemessig bruk
Utviklingen innen ekkokardiografi med bedre datakraft, økt prosessorkapasitet, analysemuligheter og transdusere med flere piezoelektriske elementer arrangert i en matrise som kan lage pyramidale datasett, har gjort det mulig å gå fra 2D-ekkokardiografi til 3D-ekkokardiografi. Da vil hjertet i tre plan kunne fremstilles i sanntid. 3D-opptak kan gjøres over ett eller flere hjerteslag, og selv om tids- og bildeoppløsningen taper seg noe sammenlignet med 2D-ekkokardiografi, vil det romlige forholdet mellom strukturene i hjertet komme bedre frem. Vi slipper dermed å ta forbehold om hjertets geometri, slik vi må gjøre når vi ser hjertet i kun to plan. Målingene blir mer nøyaktige og reproduserbare, og hjerteklaffene kan visualiseres på en ny måte (figur 1.7).
Teknikken er i økende grad i bruk og er i visse situasjoner og ved enkelte sykdomstilstander svært nyttig. Den kliniske nytten viser seg for eksempel ved måling av hjertekamrenes volum, masse og EF, ved vurdering av klaffenes anatomi og visse klaffefeil, ved medfødte hjertefeil, intrakardiale lesjoner og i forbindelse med operative eller perkutane inngrep.
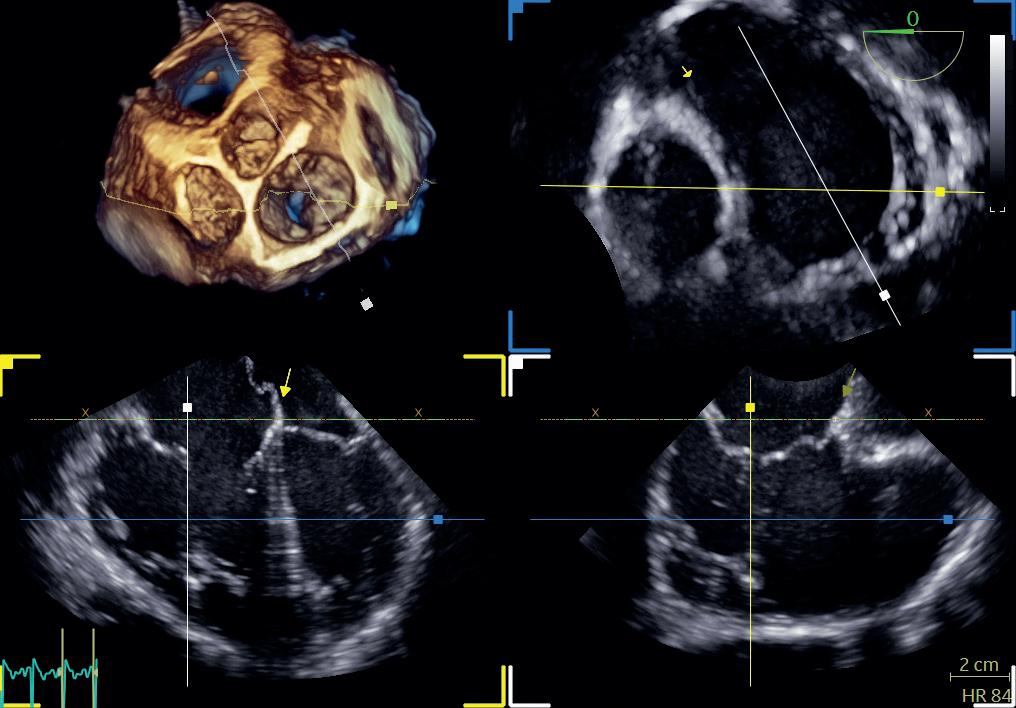
En sentral utfordring med 3D-ekkokardiografi er kompromissene mellom tidsoppløsning og lateraloppløsning. Dette kan delvis løses ved å «stifte sammen» delvolumer fra flere hjertesykluser, men ved uregelmessige hjerterytmer eller dersom pasienten beveger seg mye under opptakene, vil datasettene «stiftes» ujevnt sammen og det oppstår artefakter. Undersøkelsen krever også en del tid og kompetanse, og det kan være mer utfordrende å få gode bilder fordi 3D-transdusere er større enn 2D-transdusere og innsynet interkostalt vanskeliggjøres. Det kan være krevende å orientere seg i 3D-opptak når man ser på mindre avsnitt av hjertet, så det er derfor nyttig å lære seg de standardiserte bildeplanene for 3D.
Prinsipper for måling av trykkgradient og volum
En viktig del av den ekkokardiografiske undersøkelsen er å estimere trykkgradienter og volum. Trykkgradienten benyttes for eksempel til å vurdere alvorlighetsgraden av klaffestenoser eller å estimere lungearterietrykket. Volumberegning er viktig ved kalkulering av slagvolum, shuntberegning og vurdering av størrelsen av insuffisienser.
Måling av trykkgradient
En stenose eller obstruksjon, for eksempel en trang hjerteklaff, medfører en trykkforskjell (trykkgradient) over klaffen. Fordi det er en matematisk sammen-
heng mellom blodets hastighet gjennom en stenose og trykkgradienten over en stenose, kan måling av trykkgradienten enkelt gjøres ved å måle hastigheten. Sammenhengen er gitt av den forenklede Bernoulliligningen:
ΔP = 4(vstenose2 – v prestenose2), hvor ΔP er trykkgradienten, vstenose er blodets hastighet gjennom stenosen, og vprestenose er blodets hastighet før stenosen. Dersom den prestenotiske hastigheten er liten (< 1 m/s) og hastigheten over stenosen er høy nok (> 3 m/s), kan prestenotisk hastighet neglisjeres, og vi kan forenkle ligningen ytterligere:
ΔP = 4v2
Ved hjelp av denne kan vi estimere både den maksimale trykkgradienten og middelgradienten over stenosen, sistnevnte ved å benytte gjennomsnittlig hastighet (som vi finner ved å analysere hastighetskurven med kontinuerlig doppler).
Vi benytter den samme matematiske sammenhengen når vi for eksempel estimerer trykkgradienten mellom høyre ventrikkel og atrium ved å bruke den maksimale hastigheten til insuffisiensen i trikuspidalklaffen. Denne kan igjen brukes til å estimere det systoliske lungearterietrykket.
Ekkokardiografi kan brukes til å estimere blodvolumet som passerer en hjerteklaff eller går gjennom et blodkar i løpet av en viss tid, den såkalte volumstrømmen. Volummålinger tar utgangspunkt i at vi har et blodvolum (Q) som går gjennom et sirkulært tverrsnitt med diameter D. VTI er hastighetsintegralet:
Q = (π x D2 x VTI)/4
Dette er volumet i en sylinder, der grunnflaten i sylinderen er arealet av det sirkulære tverrsnittet, og høyden er VTI (hastighet x tid). Ved hjelp av denne ligningen kan vi for eksempel regne ut slagvolumet gjennom aortaklaffen ved å måle diameteren til aortaannulus og finne VTI med pulset doppler. Vi kan dessuten kalkulere minuttvolum og størrelsen av shunter.
Blodvolumet kan også brukes til å estimere klaffearealer. Utgangspunktet er kontinuitetsligningen, som sier at blodvolumet som strømmer inn mot klaffen, må være det samme som strømmer ut gjennom klaffen. Dersom vi kjenner diameteren og hastighetsintegralet i området før klaffen, samt hastighetsintegralet til blodstrømmen gjennom klaffen, kan vi finne diameteren til klaffen og ut fra denne beregne arealet.
Når vi gjør ekkokardiografi, bør vi følge et systematisk oppsett hvor hjertet og de store karene vurderes fra ulike vinkler og i ulike bildeplan. Målet er å gjøre oss opp en mening om hjertets geometri, ventriklenes funksjon, klaffenes anatomi, om det foreligger stenoser eller insuffisienser, og hvordan de hemodynamiske forholdene i hjertet er. En standardisert undersøkelse tar utgangspunkt i flere akustiske vinduer hvor hjertet avbildes i ulike projeksjoner. Projeksjonene fremstiller vi ved å plassere transduseren i spesielle posisjoner på thorax.
Vi vil i dette kapittelet først gjennomgå den praktiske utførelsen av en transtorakal ekkokardiografi (TTE) og de ulike projeksjonene. Videre vil vi se på hvordan bildefremstillingen kan forbedres gjennom å justere de tekniske innstillingene. Vi må også kunne gjenkjenne artefakter og andre fallgruver som kan føre til feildiagnostisering.
Selv om fokuset i denne boken er TTE, vil vi til slutt gi en oversikt over transøsofageal ekkokardiografi (TØE). Det vil både gi utfyllende kunnskap når vi senere omtaler TØE, og innsikt i mulighetene som fins for den som vil ta ekkokardiografikompetansen et steg lenger.
Ved TTE ligger pasienten i venstre sideleie med venstre arm under hodet. På denne måten kommer hjertet bedre frem til venstre for sternum, og så nært thoraxveggen som mulig. Armløftet gir større mellomrom mellom ribbeina. Noen projeksjoner krever ryggleie, og i noen spesielle situasjoner kan pasien-
ten også ligge mot høyre side. Det vanlige i Norge er at undersøkeren sitter på pasientens høyre side med transduseren i høyre hånd, mens den venstre hånden håndterer ekkokardiografimaskinen. Det er imidlertid en fordel å lære seg å gjennomføre undersøkelsen fra begge sider.
Før undersøkelsen begynner, registrerer vi personalia, høyde og vekt på pasienten. 3-avleders EKG kobles til slik at vi har kontinuerlig rytmeregistrering. Måling av blodtrykk kan ofte gi verdifull tilleggsinformasjon. En passelig mengde ultralydgelé brukes på transduserhodet.
Det er viktig å sette av nok tid til å gjennomføre en skikkelig undersøkelse. Det er ikke uvanlig å bli bedt om å gjøre en «rask, orienterende ekkokardiografi», noe man selvsagt kan gjøre, men dersom det dukker opp uventede funn som krever flere analyser, vil den «raske undersøkelsen» fort ta lengre tid.
Husk til slutt at kvaliteten på en ekkokardiografisk undersøkelse avgjøres både av undersøkerens kompetanse, innsynet til hjertet og hvor god ekkokardiografimaskinen er. En såkalt «normal ekkokardiografi» kan skjule mye oversett patologi.
De ulike projeksjonene
I en vanlig transtorakal undersøkelse fremstilles følgende projeksjoner (og i denne rekkefølgen): parasternal langakse, parasternal kortakse, apikal 4-kammer, apikal 5-kammer, apikal 2-kammer, apikal langakse, subkostal og suprasternal projeksjon (figur 2.1).
Plasseringen av transduseren er veiledende og må tilpasses hver enkelt pasient. Hjertets leie, kroppsfa-
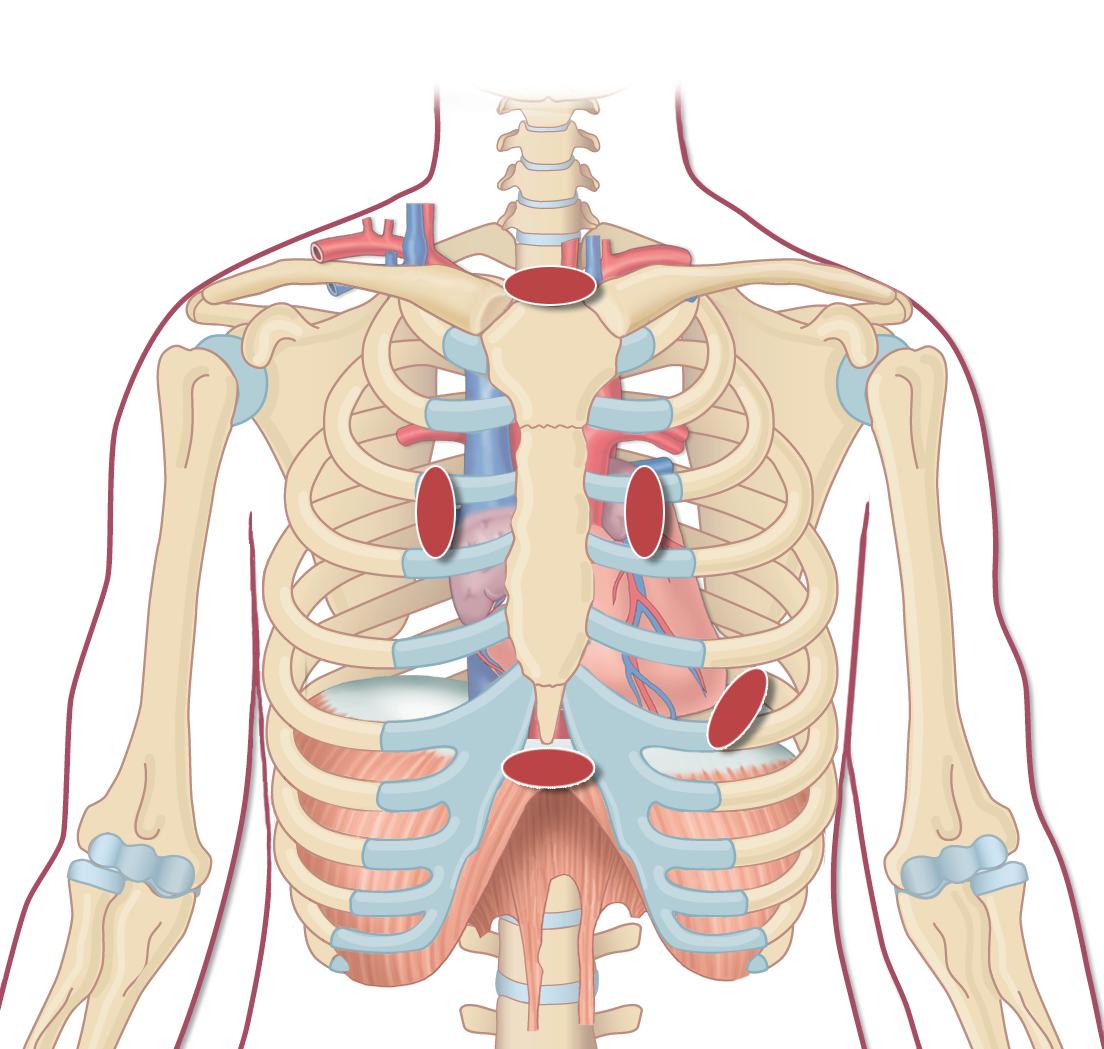
Suprasternal
Venstre parasternal
song og underliggende tilstander (for eksempel emfysem, hiatushernie eller brystimplantater) kan gjøre det nødvendig med tilpassede eller utradisjonelle projeksjoner.
Underveis bruker vi flere teknikker, både M-modusekkokardiografi, 2D-ekkokardiografi, fargedoppler, pulset doppler og kontinuerlig doppler. Strainmåling og 3D-ekkokardiografi brukes på indikasjon. Se tabell 2.11 for en oversikt over teknikker som bør benyttes,
og bildeopptak som bør gjøres. Dette må naturligvis tilpasses hver enkelt pasient og kliniske situasjon.
Sentrale målinger er oppgitt for hver projeksjon, men disse er ikke utfyllende og må suppleres med flere analyser ved funn av patologi. Måling av veggtykkelser, dimensjoner og volum gjøres som hovedregel med 2D-ekkokardiografi. Hastigheter måles med kontinuerlig eller pulset doppler. Ikke glem at riktig vinkel på markørlinjen er avgjørende, så man må oppsøke den projeksjonen som kan tilby måling mest mulig parallelt med blodstrømmen. Fargedoppler brukes over alle klaffer, obstruksjoner og shunter. Eventuelle klaffestenoser eller -insuffisienser bør graderes.
Dagens ekkokardiografimaskiner har muligheter for lagring av bilder, og opptak over 1–2 hjertesykluser er vanlig, med mindre det er et poeng å ta flere, for eksempel ved atrieflimmer.
Pasienten ligger i venstre sideleie. Transduseren plasseres parasternalt i tredje eller fjerde venstre interkostalrom. Markøren på transduseren rettes mot pasientens høyre skulder.
I denne projeksjonen ses hjertet i langakse fra venstre (figur 2.2).

Øverst i bildet, anteriort mot transduseren, ligger høyre ventrikkels utløpstraktus (RVOT). Posteriort for den ligger venstre ventrikkel med anteriore septum og inferolaterale (også kalt posteriore) vegg. Ventrikkelens lengdeakse skal ligge horisontalt i bildet, og apex skal som regel ikke være synlig, ellers har vi vinklet transduseren feil. Videre ses venstre atrium nede til høyre i bildet, og hos noen kan aorta descendens i kortakse visualiseres posteriort for atriet. Sinus coronarius kan ses i bakkant av atriet nede ved atrioventrikulærovergangen, men er knapt synlig med mindre den er dilatert.
Venstre ventrikkels utløpstraktus (LVOT) og aortaklaffen skiller venstre ventrikkel og aorta ascendens. To av klaffens tre kusper er synlige: Anteriort ligger den høyre koronare kuspen, mens den posteriore vanligvis er den non-koronare kuspen – men man er så nær kommissuren mot den venstre koronare kuspen at man unntaksvis kan visualisere eller gjennomskjære denne. Aortaroten med sinus Valsalvae, den sinotubulære overgangen og proksimale aorta ascendens ligger til høyre i bildet. Et tips for å visualisere mer av aorta ascendens er å flytte transduseren ett interkostalrom høyere opp. Fra denne posisjonen kan også LVOT og aortaroten ofte komme bedre frem.
Posteriort for aortaklaffen ligger mitralklaffen med sitt fremre og bakre seil. Begge er festet til papillemusklene via chordae tendineae. Perikard ses som en høyekkogen struktur som omgir hjertet.
Tabell 2.1 lister opp sentrale målinger i parasternal langakseprojeksjon
Tabell 2.1: Sentrale målinger i parasternal langakseprojeksjon
Målinger i parasternal langakseprojeksjon
Veggtykkelser (endediastolisk) og dimensjoner (endesystolisk, endediastolisk) av venstre ventrikkel
Proksimale RVOT (endediastolisk)
Aortaannulus’ diameter (midtsystolisk)
Sinus Valsalvae, den sinotubulære overgangen og aorta ascendens (endediastolisk)
Mitralannulus og lengden av mitralseilene
Parasternal langakseprojeksjon – høyre ventrikkels innløp
Mange velger å hoppe over denne projeksjonen da mye av informasjonen fremkommer av andre projeksjoner, men det er en fin måte å fremstille høyre ventrikkels innløp på. Transduseren er plassert på samme sted som i standard parasternal langakseprojeksjon, men vinkles inferiort mot pasientens høyre hofte. Noen ganger må den også roteres litt mot klokken.
Høyre atrium ses nederst i bildet og innløpet til høyre ventrikkel øverst. Til høyre er ventrikkelens anteriore vegg, mens den inferiore veggen ligger til venstre. Trikuspidalklaffen fremstilles sentralt i bildet, og man vil se henholdsvis fremre og septale/bakre seil. Sinus coronarius kan visualiseres langs høyre atriums vegg, nær trikuspidalannulus. Ostiet til vena cava inferior ses under sinus coronarius.
I denne projeksjonen kommer man ofte parallelt med retningen for trikuspidalinsuffisiensen (TI), som brukes til å estimere lungearterietrykket. Man er også nærmere klaffen enn i apikal projeksjon, slik at selv minimale lekkasjer lar seg fremstille og måle.
Tabell 2.2 lister opp sentrale målinger i parasternal langakseprojeksjon – høyre ventrikkels innløp.
Tabell 2.2: Sentrale målinger i parasternal langakseprojeksjon –høyre ventrikkels innløp
Målinger i parasternal langakseprojeksjon – høyre ventrikkels innløp
Kontinuerlig doppler over trikuspidalklaffen
Parasternal langakseprojeksjon – høyre ventrikkels utløp
Transduseren er plassert på samme sted som i standard parasternal langakseprojeksjon, men vinkles anteriort (opp mot pasientens hode) og roteres litt med klokken. Lignende opptak kan gjøres i parasternal kortakseprojeksjon, som de fleste heller vil velge.
Dersom innsynet er godt, kan vi se RVOT, pulmonalklaffen og proksimale del av truncus pulmonalis.
Tabell 2.3 lister opp sentrale målinger i parasternal langakseprojeksjon – høyre ventrikkels utløp.
Målinger i parasternal langakseprojeksjon – høyre ventrikkels utløp
Pulset doppler i RVOT (målevolumet plassert 5–10 mm proksimalt for pulmonalklaffen)
Kontinuerlig doppler over pulmonalklaffen
– aortaklaffnivå
Fra parasternal langakseprojeksjon roterer vi transduseren 90 grader med klokken slik at markøren peker mot pasientens venstre skulder. Vi kommer da til parasternal kortakseprojeksjon på aortaklaffnivå (figur 2.3).
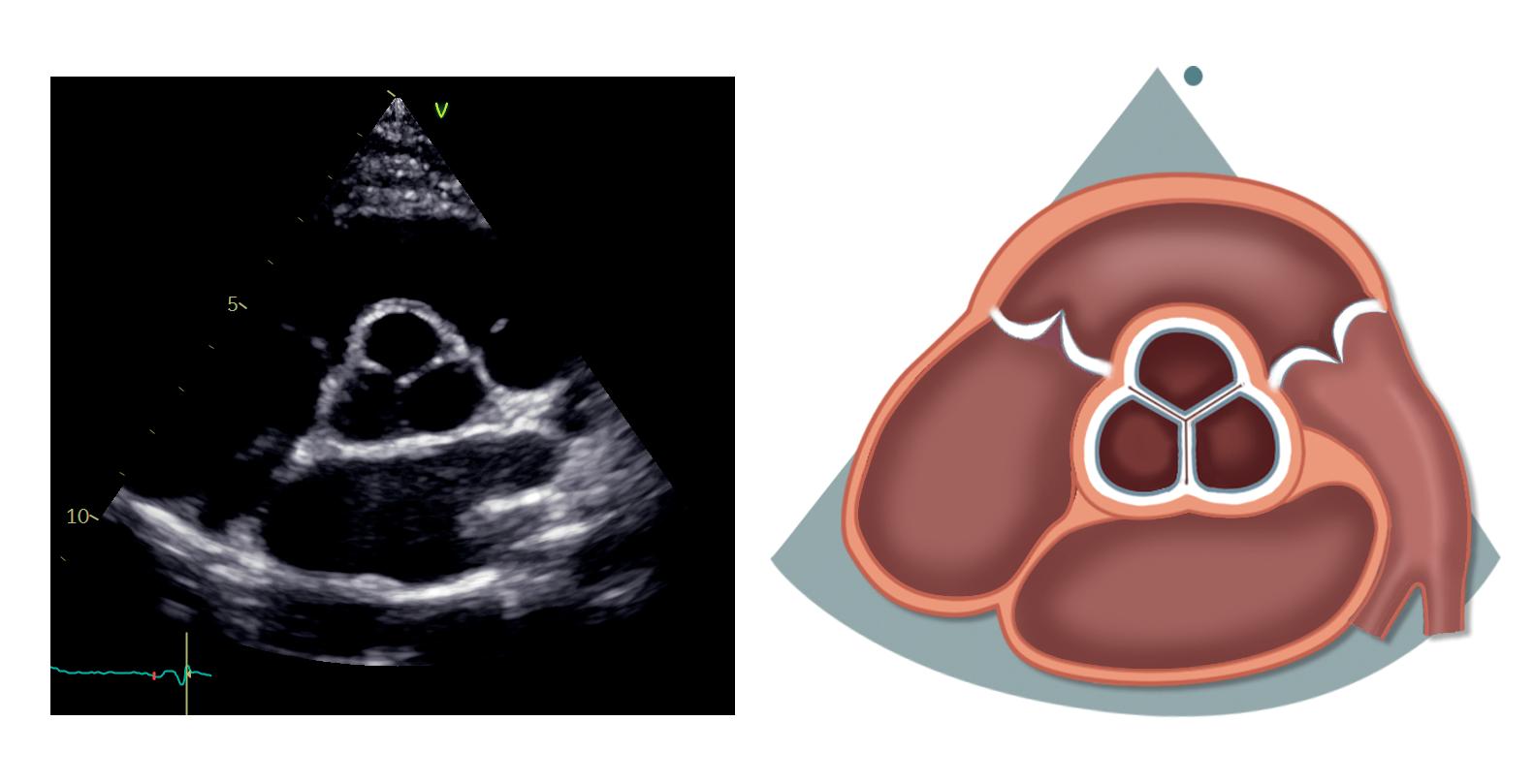
Trikuspidalkla en (TK)
Pulmonalkla en (PK)
Aortakla en (AK)
Truncus pulmonalis (TP)
Venstre arteria pulmonalis (VAP)
Høyre arteria pulmonalis (HAP)
Ved å vinkle og reposisjonere transduseren med utgangspunkt i denne projeksjonen kan vi skanne gjennom hele venstre ventrikkel fra basis til apex.
I aortaklaffnivå ses aortaklaffen i kortakse sentralt i bildet. Klaffens tre kusper fremstilles med den non-koronare kuspen mot atrieseptum, den høyre koronare kuspen nærmest RVOT (høyre kusp grenser kun mot høyresidige hjertekamre) og den venstre koronare kuspen på venstre side (mot truncus pulmonalis og venstre aurikkel).
Dersom vi vinkler transduseren litt anteriort og innsynet er godt, kan ostiene til koronarkarene noen ganger komme frem der de utgår fra aortaroten. Venstre hovedstamme ses vanligvis klokken 4, mens høyre koronararterie ses klokken 11–12. Her er det imid-
lertid noe variasjon, både i rotasjonen av aortaroten og i anatomien til koronararteriene.
RVOT ligger over aortaklaffen på bildet, mens pulmonalklaffen ligger over og til høyre. Truncus pulmonalis ses til høyre, og noen ganger får vi også frem bifurkaturen, høyre og venstre lungearterie. Til venstre ses trikuspidalklaffen med det septale og fremre (eventuelt bakre) seilet. Litt avhengig av transduserposisjon kan noen ganger alle tre seil visualiseres samtidig – det septale inn mot aortaroten til høyre, det bakre muralt til venstre, mens fremre seil kommer frem i midten. Begge atriene og atrieseptum ligger under aortaklaffen, og hos noen kan deler av venstre aurikkel ses til høyre på bildet.
Tabell 2.4 lister opp sentrale målinger i parasternal kortakseprojeksjon – aortaklaffnivå.
Tabell 2.4: Sentrale målinger i parasternal kortakseprojeksjon –aortaklaffnivå
Målinger i parasternal kortakseprojeksjon – aortaklaffnivå
Proksimale RVOT (endediastolisk) og distale RVOT (midtsystolisk)
Lungearteriens
diameter (endediastolisk)
Pulset doppler i RVOT (målevolumet plassert 5–10 mm proksimalt for pulmonalklaffen)
Kontinuerlig doppler over pulmonalklaffen
– mitralklaffnivå
Fra aortaklaffnivå vinkles transduseren inferiort for komme til mitralklaffen i kortakse (figur 2.4).
Det fremre seilet er øverst i bildet, det bakre er nederst. Deler av høyre ventrikkel ses oppe til venstre.
– papillemuskelnivå
Fra mitralklaffnivået vinkles transduseren enda mer inferiort til vi ser begge papillemusklene (figur 2.5).

Høyre ventrikkel (HV)
Ventrikkelseptum (IVS)
Fremre mitralseil (FMS)
Venstre ventrikkel (VV)
Bakre mitralseil (BMS)

Høyre ventrikkel (HV)
Ventrikkelseptum (IVS)
Venstre ventrikkel (VV)
Anterolaterale papillemuskel (ALP)
Posteromediale papillemuskel (PMP)
Den anterolaterale ligger cirka klokken 3, og den posteromediale ligger cirka klokken 8. Vi befinner oss nå omtrent midt mellom apex og basis i venstre ventrikkel, og ventrikkelen skal fremstå sirkelrund. Dette er den eneste projeksjonen, i tillegg til apikal 4-kammer, hvor ventrikkelsegmenter forsynt av alle tre koronararteriene ses i det samme bildet. Det er nyttig å vite ved for eksempel mistanke om hjerteinfarkt. Denne projeksjonen er også fin for å vurdere bevegelsen til ventrikkelseptum.
Parasternal kortakseprojeksjon – apikalt nivå
Ved ytterligere vinkling inferiort ses apex i kortakse. Av og til må transduseren flyttes ett eller to interkostalrom ned og eventuelt lateralt for å fremstille apex best mulig.
Apikal 4-kammerprojeksjon
Pasienten ligger fortsatt på siden mot venstre. Transduseren flyttes til femte interkostalrom omtrent i fremre aksillærlinje, over apex (palper gjerne etter ictus cordis). Markøren på transduseren skal peke omtrent mot klokken 3. Husk å unngå forkortning av venstre ventrikkel, det ses ved at apex har en avrundet
form og tykt myokard. Løsningen kan i så fall være å flytte transduseren ett interkostalrom lenger ned eller mer lateralt. Man vil også se at hjertet vil flytte seg ned når pasienten puster inn.
Venstre ventrikkel skal være formet som en geværkule, og ventrikkel- og atrieseptum skal være sentralt plassert og gå rett vertikalt i bildet. Ofte må plasseringen av transduseren eller pasientens leie justeres underveis for å få et best mulig bilde.
Apikal 4-kammerprojeksjon er svært nyttig og fremstiller alle fire hjertekamre, mitral- og trikuspidalklaff (figur 2.6).
Venstre ventrikkel med inferiore septum, apex og anterolateralveggen ligger øverst til høyre. Høyre ventrikkel ligger øverst til venstre. Atriene ligger nederst i bildet. Mitralklaffen er plassert mellom venstre atrium og ventrikkel med det fremre seilet til venstre og det bakre til høyre. Trikuspidalklaffen ligger mer apikalt enn mitralklaffen. Det septale seilet ses ved septum, mens det andre trikuspidalseilet i bildet er enten det fremre eller det bakre. Lungevenene ses munne ut i venstre atrium, eventuelt visualiseres de bedre med litt justering av transduserens plassering eller vinkling. Dersom vi er heldige kan tre av venene ses i standard apikal 4-kammerprojeksjon, mens den siste, som er den øvre høyre venen, kan ses med litt
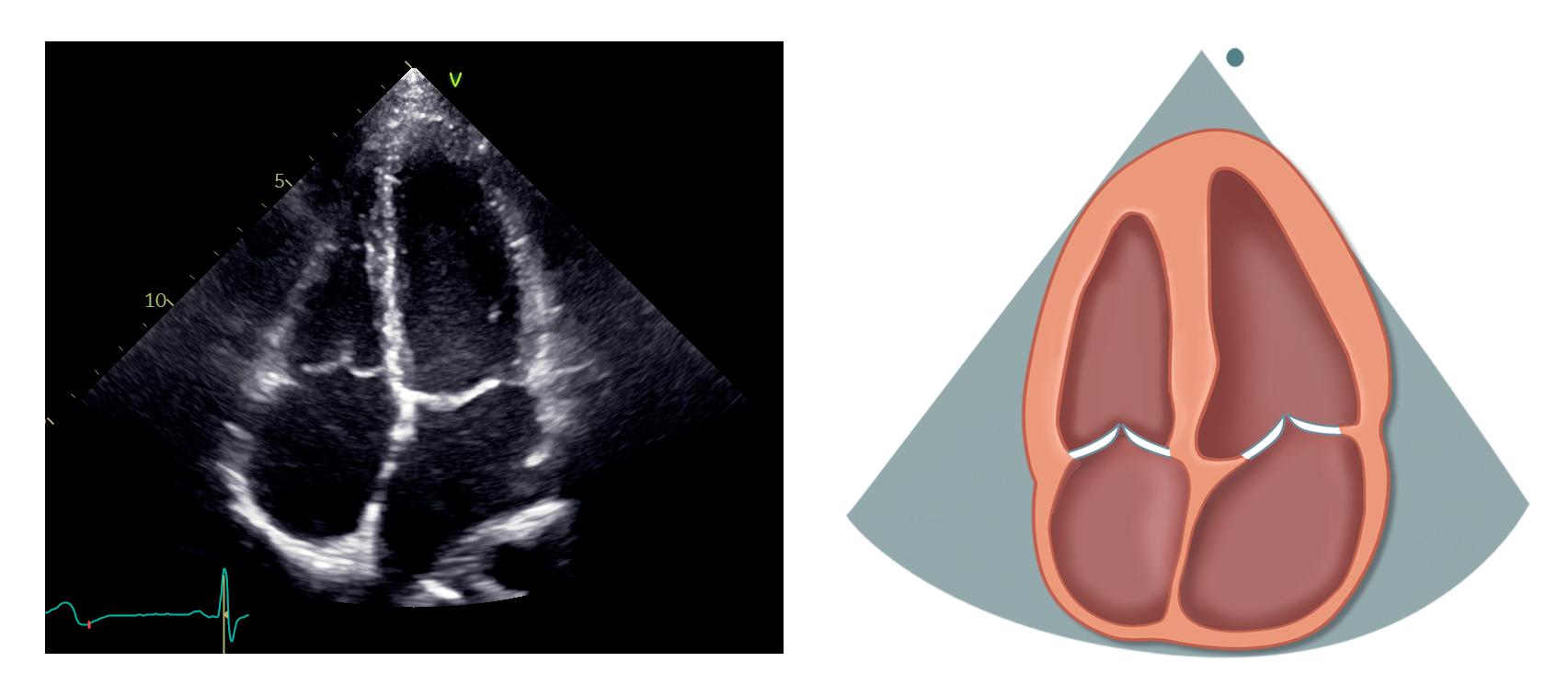
mer anterior vinkling av transduseren i retning apikal 5-kammerprojeksjon.
Dersom transduseren vinkles posteriort (kaudal retning) kan sinus coronarius ses som et kar løpende langs gulvet av venstre atrium med utmunning i septale del av høyre atrium.
Tabell 2.5 lister opp sentrale målinger i apikal 4-kammerprojeksjon.
Tabell 2.5: Sentrale målinger i apikal 4-kammerprojeksjon
Målinger i apikal 4-kammerprojeksjon
Venstre ventrikkels volum og ejeksjonsfraksjon (EF) (Simpsons metode)
Venstre atriums volum (Simpsons metode, endesystolisk)
Høyre atriums volum (endesystolisk)
Pulset doppler ved tuppen av de åpne mitralseilene i diastolen
TAPSE (M-modusekkokardiografi)
Kontinuerlig doppler over trikuspidalklaffen
Pulset doppler i en lungevene (målevolumet plassert 10 mm fra innmunningen til venstre atrium)
Vevsdoppler i laterale og septale mitralannulus
Apikal 4-kammerprojeksjon – fokusert over høyre ventrikkel
Transduseren roteres litt mot klokken fra standard apikal 4-kammerprojeksjon, eventuelt må transduseren hos noen vinkles mer mot høyre ventrikkel eller flyttes lenger medialt og ett interkostalrom opp.
Poenget med denne projeksjonen er å få frem den reelle størrelsen av høyre ventrikkel og å vurdere den systoliske funksjonen. Trikuspidalklaffen kommer også bedre frem enn i standard apikal 4-kammerprojeksjon.
Tabell 2.6 lister opp sentrale målinger i apikal 4-kammerprojeksjon – fokusert over høyre ventrikkel.
Tabell 2.6: Sentrale målinger i apikal 4-kammerprojeksjon fokusert over høyre ventrikkel
Målinger i apikal 4-kammerprojeksjon – fokusert over høyre ventrikkel
Dimensjoner av høyre ventrikkel (endediastolisk)
Fraksjonell arealendring av høyre ventrikkel
Apikal 5-kammerprojeksjon
Fra apikal 4-kammerprojeksjon kan transduseren vinkles anteriort for å komme til apikal 5-kammerprojeksjon (figur 2.7).
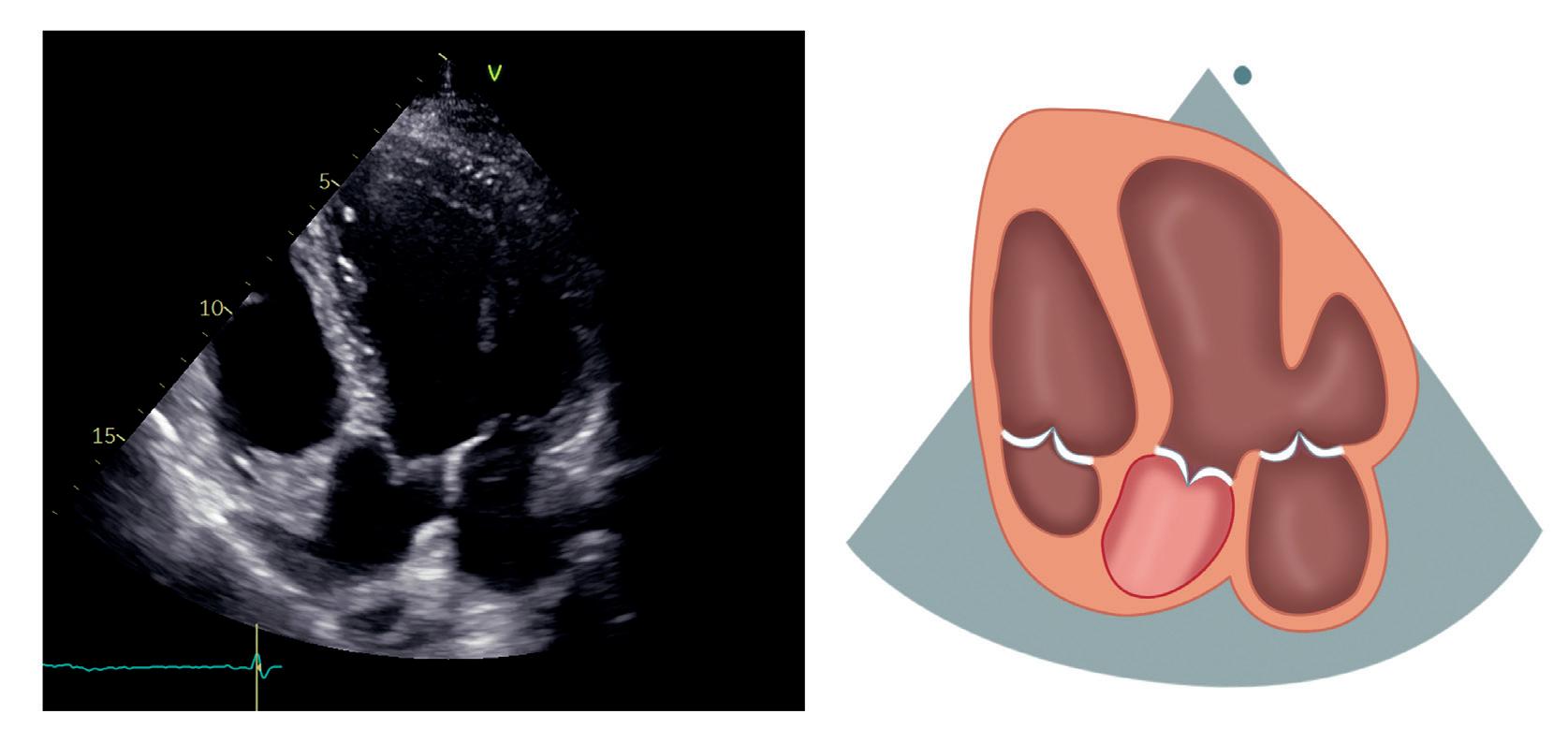
Høyre ventrikkel (HV)
Ventrikkelseptum (IVS)
Venstre ventrikkel (VV)
Sentralt i bildet kommer LVOT og aortaklaffen frem som et slags femte hjertekammer.
Tabell 2.7 lister opp sentrale målinger i apikal 5-kammerprojeksjon.
Tabell 2.7: Sentrale målinger i apikal 5-kammerprojeksjon
Målinger i apikal 5-kammerprojeksjon
Pulset doppler i LVOT (målevolumet plassert
5 mm proksimalt for aortaklaffen)
Kontinuerlig doppler over aortaklaffen
Apikal 2-kammerprojeksjon
Med utgangspunkt i apikal 4-kammerprojeksjon roteres transduseren 60–90 grader mot klokken slik at markøren peker omtrent mot venstre skulder og høyre ventrikkel ikke lenger er synlig til venstre i bildet (figur 2.8).
Øverst i bildet ses venstre ventrikkel med inferiore vegg til venstre og anteriore vegg til høyre, og nederst i bildet ligger venstre atrium. Mitralklaffen er plassert mellom dem, og litt avhengig av rotasjonen
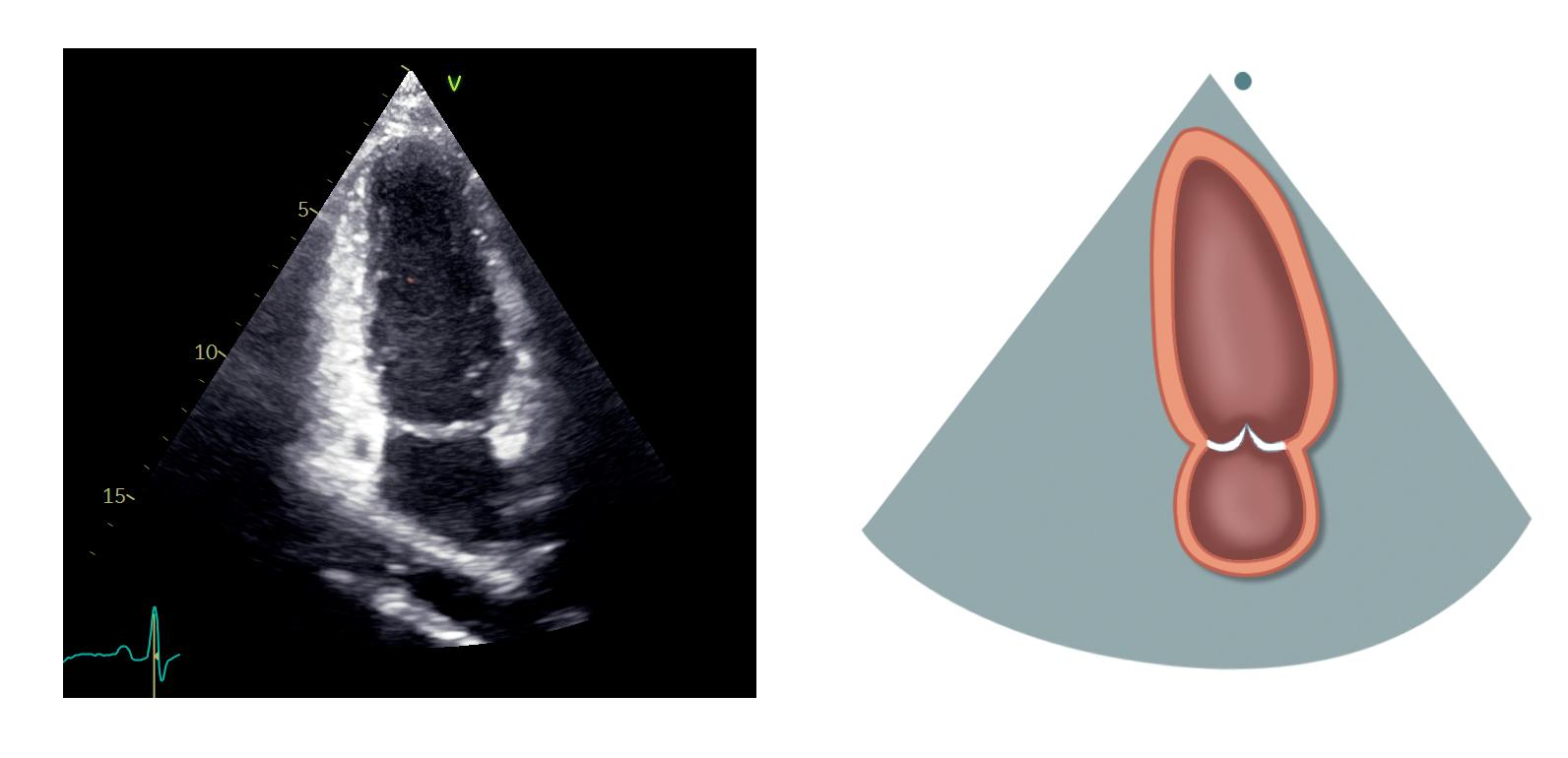
Venstre ventrikkel (VV)
Mitralkla en (MK)
Venstre atrium (VA)
på transduseren kan man fremstille begge papillemusklene med den anterolaterale til høyre og den posteromediale til venstre. Klaffen kan fremstilles som et «interkommissuralbilde» med P1-segmentet til høyre, A2-segmentet i midten og P3-segmentet til venstre (mer om mitralklaffens segmenter i kapittel 7).
Sinus coronarius kan noen ganger ses som tverrsnittet av et kar ved atrioventrikulærfuren til venstre i bildet. Deler av venstre aurikkel kan ses til høyre i bildet som en utposning på venstre atrium rett under mitralplanet. Øvre venstre lungevene kan noen ganger ses munne ut i venstre atrium under aurikkelen til høyre i bildet.
Tabell 2.8 lister opp sentrale målinger i apikal 2-kammerprojeksjon.
Tabell 2.8: Sentrale målinger i apikal 2-kammerprojeksjon
Målinger i apikal 2-kammerprojeksjon
Venstre ventrikkels volum og EF (Simpsons metode)
Venstre atriums volum (Simpsons metode, endesystolisk)
Apikal langakseprojeksjon (apikal 3-kammerprojeksjon)
Fra apikal 2-kammerprojeksjon roteres transduseren ytterligere 60 grader mot klokken slik at markøren pe-
ker mot pasientens høyre skulder og man ser venstre ventrikkel, venstre atrium, LVOT og aortaklaff, samt en liten flik av høyre ventrikkel til høyre i bildet (figur
2.9). Denne projeksjonen viser i hovedsak det samme som parasternal langakse, bortsett fra at apex også fremstilles.

Subkostal projeksjon
Pasienten ligger i ryggleie, gjerne med flekterte hofter og knær slik at abdominalmusklene relakserer. Ofte kommer hjertet bedre frem dersom pasienten holder pusten etter inspirasjon.
Det spesielle med subkostal projeksjon er at svært mange av de andre projeksjonene kan fremstilles
fra denne projeksjonen dersom innsynet er godt og transduseren vinkles riktig. Pasienter med KOLS, emfysem eller overtrykksventilasjon kan ha best innsyn subkostalt fordi de gjerne har store lunger som presser hjertet i kaudal retning.
Transduseren plasseres i epigastriet, like under processus xiphoideus, vinklet mot pasientens venstre
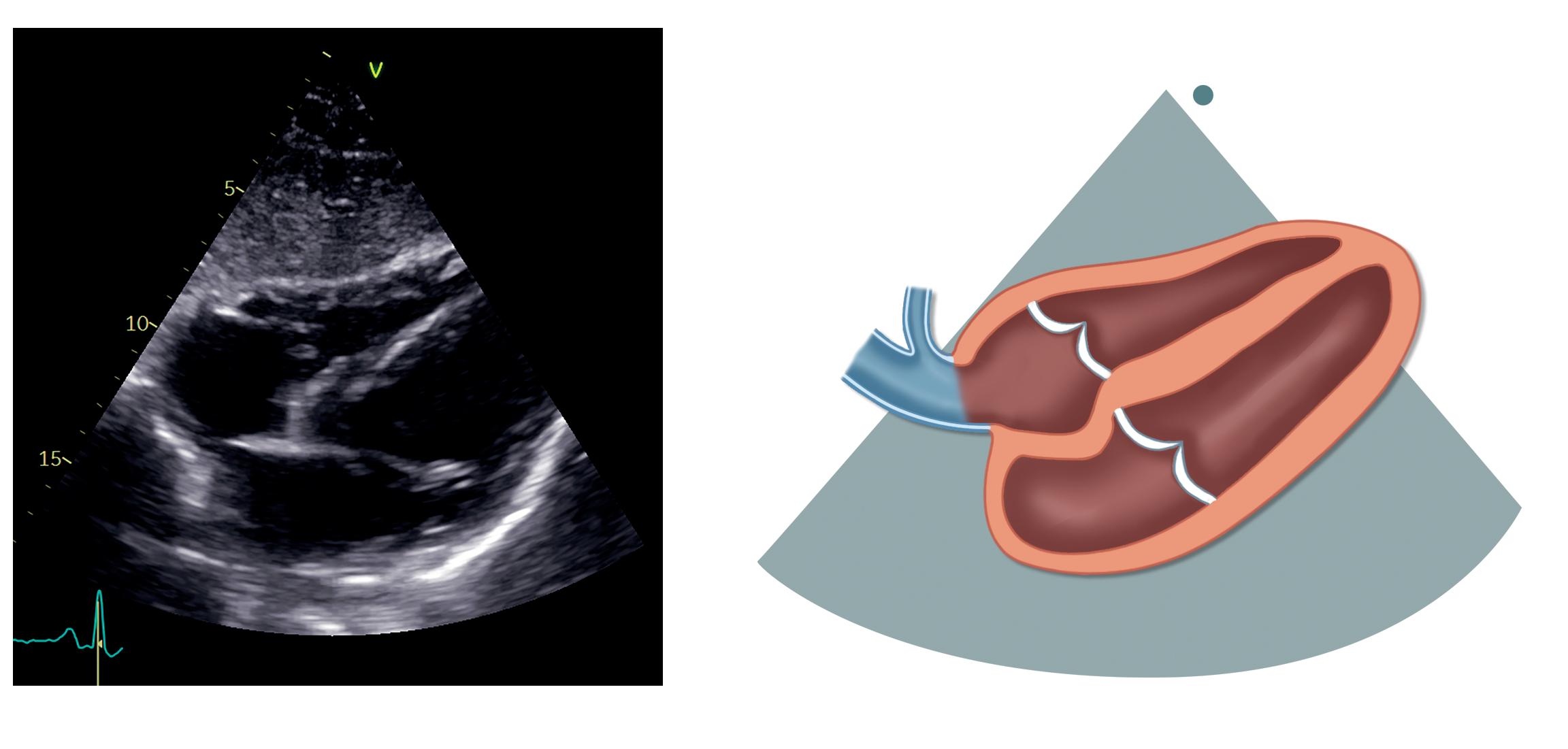
skulder og markøren pekende mot klokken 3. Den første projeksjonen vi får opp, er subkostal 4-kammerprojeksjon (figur 2.10).
Her ses venstre ventrikkel nede til høyre, venstre atrium nede til venstre, høyre ventrikkel oppe til høyre og høyre atrium oppe til venstre.
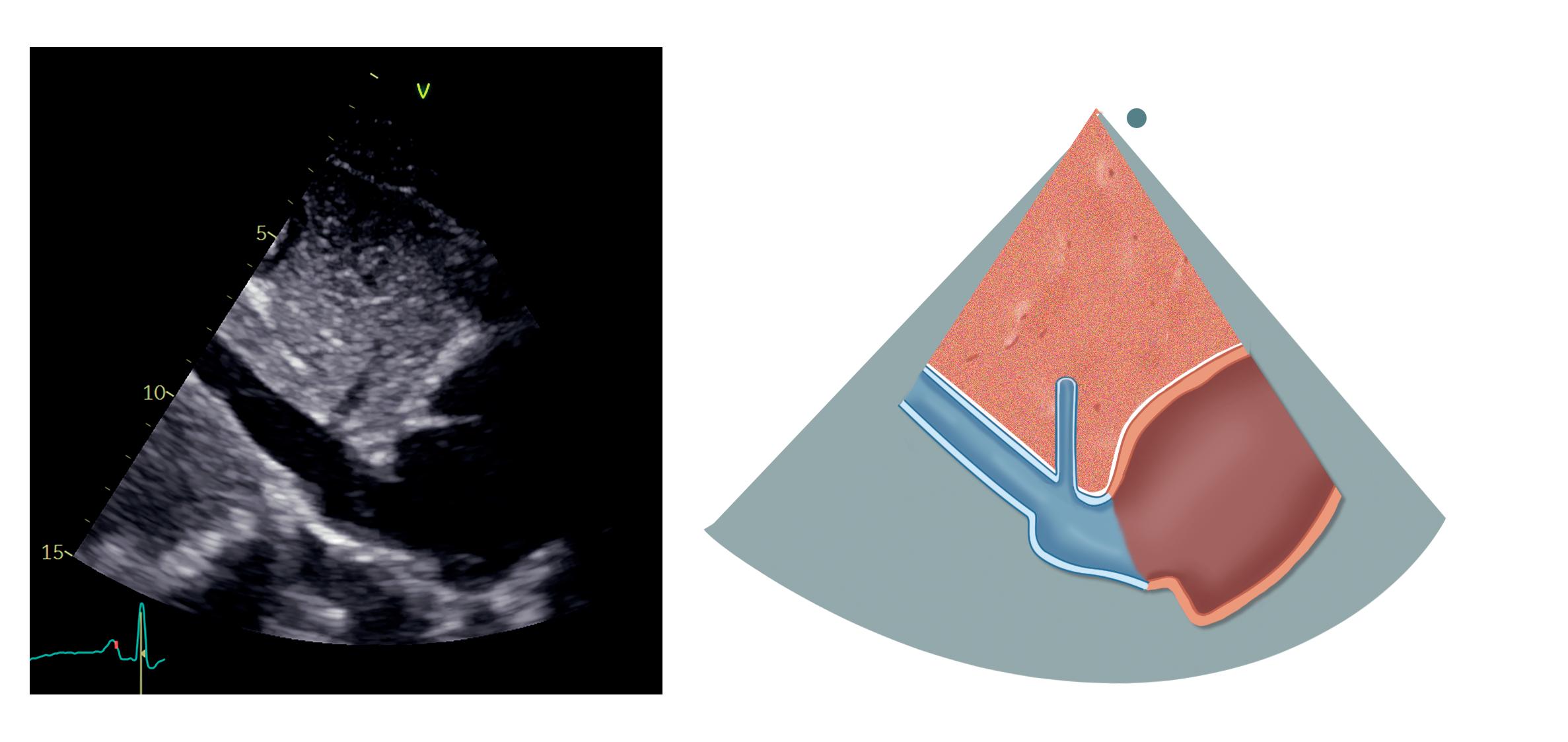
Transduseren roteres cirka 90 grader mot klokken og hjertet i kortakse fremstilles. Dette bildet tilsvarer parasternal kortakseprojeksjon. Ved å vinkle transduseren mot pasientens høyre skulder ser vi leveren og vena cava
inferior, som munner ut i høyre atrium. Levervenene ses munne ut i vena cava inferior (figur 2.11).
Ved å rotere transduseren ytterligere litt mot klokken og vinkle bildeplanet mot venstre side av columna kan aorta abdominalis ses i langakse. Denne må ikke forveksles med vena cava inferior – de kan skilles med fargedoppler. Aorta gir et rødt, pulsatilt, systolisk signal, mens vena cava inferior har blått signal, mer kontinuerlig preg, og blodstrømmen vil øke markant med inspirasjon.
Målinger i subkostal projeksjon
Vena cava inferiors diameter (endeekspiratorisk og -inspiratorisk, 1–2 cm proksimalt fra innmunningen til høyre atrium Eventuelt med M-modusekkokardiografi)
Høyre ventrikkels veggtykkelse (endediastolisk)
Pulset doppler i levervene (målevolumet plassert 10–20 mm fra innmunningen til vena cava inferior)
Suprasternal projeksjon
Pasienten ligger i ryggleie, gjerne med en liten pute mellom skulderbladene slik at nakken er lett ekstendert, og hodet vendt mot venstre. Transduseren plasseres i fossa jugularis, vinklet inferiort og nesten parallelt med nakken, med markøren pekende klokken 12. Transduseren roteres gradvis mot klokken 2. Projeksjonen kan være utfordrende å mestre, og innsynet er ikke like godt hos alle (figur 2.12).
Ultralyd av hjertet, ekkokardiografi, er en viktig undersøkelse i utredning og behandling av all hjertesykdom. Undersøkelsen har en sentral plass på alle sykehus. Denne boken tar for seg de fleste temaer innen ekkokardiografi, inkludert transøsofageal undersøkelse og medfødte hjertefeil.
Teksten er klinisk rettet, inneholder flere kasuistikker, og plasserer den ekkokardiografiske undersøkelsen i relevante situasjoner som håndteres på daglig basis. Det gjør boken spennende og interessant, også som en generell lærebok i kardiologi. Både vanlige og mer sjeldne kardiologiske tilstander blir beskrevet grundig, inkludert symptomer og annen utredning og behandling, men med hovedfokus på ekkokardiografiske funn.
Forfatterne tar for seg hele spekteret av problemstillinger, fra de enkle og vanlige man møter på et lokalsykehus, til de kompliserte som stort sett håndteres på et universitetssykehus. Dette gjør boken godt egnet både som en introduksjon for nybegynnere i faget, og for kardiologer. Bokens oppbygging gjør den til et godt oppslagsverk.
PAUL ANDERS SLETTEN OLSEN er lege i spesialisering ved Kardiologisk avdeling, Oslo universitetssykehus, Rikshospitalet.
JAN OTTO BEITNES er overlege ved Kardiologisk avdeling, Oslo universitetssykehus, Rikshospitalet.