4 minute read
Dit doen zij Vier gedreven
Dit doen zij
Van samenwerken met patiënten tot onderzoek op celniveau: het UMC Utrecht Hersencentrum heeft een rijke variatie aan wetenschappers. Allemaal zijn ze op zoek naar de allerbeste antwoorden op hun vragen, zoals ook deze vier gedreven onderzoekers.
Door Aafke Kok Beeld: Bram Belloni
Frank Meye Translationele neurowetenschappen
Breinverandering bij vreetbuien
Als reactie op stress gaan mensen, maar ook dieren, veel suiker en vet eten. ‘Vooral bij obesitas, eetstoornissen en mensen met impulsief gedrag zoals bij ADHD vormen vreetbuien een probleem,’ aldus Frank Meye. De behoefte aan ‘slecht’ eten gaat gepaard met veranderingen in de communicatie tussen verschillende hersengebieden die betrokken zijn bij de verwerking van beloning. Dat is wat Meye onderzoekt.
Daarvoor gebruikt hij muizen die aan sociale stress onderworpen zijn en daardoor vreetbuigedrag vertonen. Van die muizen bekijkt Meye het hersenweefsel. Met behulp van elektrodes meet hij daarin de elektrische signalen waar zenuwcellen mee communiceren. Hoe meer ze communiceren, hoe sterker de verbinding. Meye kijkt naar verschillen in die verbindingssterkte tussen gestreste muizen en controlemuizen. Hij bestudeert bijvoorbeeld verbindingen met dopamineneuronen, een belangrijke groep cellen in het beloningscircuit van het brein.
Vervolgens kan Meye in levende muizen specifieke zenuwcellen aansturen en dan het eetgedrag van muizen bestuderen. Dat doet hij met opto- of chemogenetica, waarmee hij zenuwcellen ‘aan’ of ‘uit’ zet door respectievelijk licht of speciale virussen. Zo probeert hij de link tussen veranderingen in het brein en vreetbuigedrag te achterhalen. Uiteindelijk hoopt hij hiermee te begrijpen hoe we die hersenveranderingen tegen kunnen gaan, om zo vreetbuien te verminderen.
Natalia Petridou Beeldvormingstechnieken
Begrip van fMRI

Marjolijn Ketelaar Revalidatiegeneeskunde
Samen met patiënten
Voor een onderzoek rond cerebrale parese (CP), een aangeboren hersenbeschadiging, betrok Marjolijn Ketelaar twaalf tieners met CP als ambassadeurs bij haar studie. Zij dachten bijvoorbeeld mee over onderzoeksvragen – patiënten hebben vaak een heel andere kijk op wat echt belangrijk is in het onderzoek naar hun ziekte. Ketelaar keek met haar team onder andere naar problemen van jongeren met CP in het onderwijs. Naast wetenschappelijke publicaties leidde dat ook tot producten die ze samen met de jongeren maakte, zoals een poster voor docenten met uitleg over CP, om onbegrip over de ziekte weg te nemen.
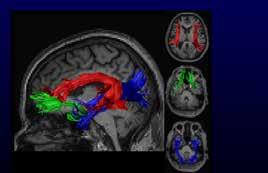
Dat is nou echte patiëntparticipatie, niet zomaar een vinkje op een checklist van onderzoekers. ‘Echt samenwerken met patiënten, van begin tot eind, leidt tot veel beter onderzoek,’ aldus Ketelaar. Ze probeert het belang van patiëntparticipatie ook bij haar collega’s door te laten dringen. Zo droeg ze bij aan de ontwikkeling van een hulpmiddel voor onderzoekers om gewenste betrokkenheid in elke stap van het onderzoek te bespreken. Ook organiseerde ze een congres met steeds niet één maar twee voorzitters: een onderzoeker of arts naast een patiënt, of ouder van een patiënt. Daardoor blijft de vraag ‘voor wie doen we het eigenlijk?’ centraal staan. Om de werking van de hersenen te begrijpen, maken veel onderzoekers gebruik van fMRI-scanners. In de plaatjes die ze daarmee maken lichten hersengebieden die actief zijn op. Ook in de kliniek wordt deze techniek veelvuldig gebruikt. ‘Maar fMRI meet de activiteit van de hersenen op een indirecte manier,’ aldus Natalia Petridou. Eigenlijk meet je er de eigenschappen van bloeddoorstroom in hersendelen mee. Het idee is dat die bloeddoorstroom verband houdt met de activatie van zenuwcellen. Die hebben immers zuurstof uit het bloed nodig om iets te kunnen doen. ‘Maar hoe die koppeling tussen bloed en zenuwcellen precies werkt, is niet bekend,’ zegt Petridou. Zij hoopt dat uit te vinden.
Ze bouwt modellen die moeten voorspellen hoe bepaalde hersengebieden werken. Die modellen test ze vervolgens uit. Daarvoor gebruikt ze de 7 Tesla MRI-scanner, een scanner met een supersterk magneetveld. Petridou ontwikkelt methodes om daarmee zeer gedetailleerde plaatjes van het brein te maken. Daarnaast gebruikt ze speciale camera’s om heel precies veranderingen in de bloedbaan te bestuderen. Ook doet ze metingen met elektrodes in het brein. Uiteindelijk hoopt Petridou hiermee de link tussen bloed en zenuwcellen te begrijpen, en haar bevindingen in te zetten voor beter gebruik van fMRI.
Jan Veldink Neurogenetica

Gentherapie
Jan Veldink ziet als arts wekelijks ALS-patiënten. ‘Nu is hun levensverwachting drie tot vijf jaar, en het huidige medicijn kan dat tot maximaal zes maanden verlengen,’ zegt Veldink. Dat hoopt hij te veranderen met zijn onderzoek. Het met crowdfunding opgerichte Project Mine brengt DNA van 22.500 patiënten in kaart. De teller staat nu op 10.000. Door DNA te vergelijken, vonden onderzoekers nu al vijf nieuwe plekken in het DNA die betrokken zijn bij het ontstaan van ALS. Dat kan een insteek zijn voor nieuwe behandeling, zoals gentherapie. Daarbij richten medicijnen zich op het eiwit van een gen dat uit het onderzoek naar voren komt, of blokkeren zo’n gen direct.
Maar ALS ontstaat niet alleen door genetische afwijkingen. Daarom kijkt Veldink ook naar het omhulsel van DNA, waar levensstijlfactoren als dieet en stress invloed op hebben. Op basis van het DNA-omhulsel kan Veldink ALSpatiënten in nieuwe subgroepen indelen en zo de interactie met levensstijl meenemen.
De aanknopingspunten voor nieuwe therapieën zijn veelbelovend, maar omdat deze therapieën een kleine subgroep van patiënten bedienen, is het lastig bedrijven te vinden voor verdere ontwikkeling. Toch blijft Veldink hoopvol, ‘vooral vanwege de enorme stijging in aandacht voor ALS van de laatste jaren.’