6 minute read
alcalino2.9. El balance ácido
2.9. El balance ácido-alcalino
El pH es una medida de acidez o de alcalinidad que indica la cantidad de iones de hidrógeno presentes en una solución o en una sustancia tal como sería en los terrenos agrícolas. Las siglas pH significan potencial hidrógeno o potencial de hidrogeniones, del latín pondus: peso, potentia: potencia e hydrogenium: hidrógeno, es decir pondus hydrogenii o potentia hydrogenii.
Advertisement
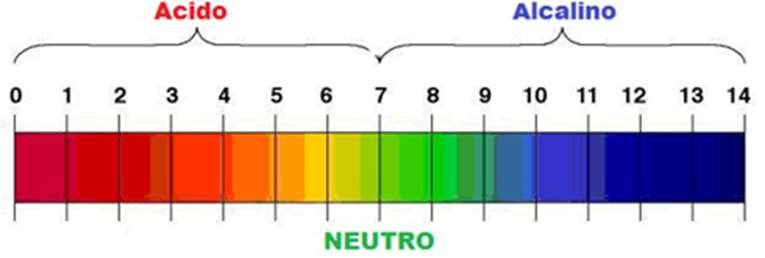
El terminó PH fue propuesto por el químico danés Sørense al definirlo como el opuesto del logaritmo en base 10 o el logaritmo negativo de la actividad de los iones de hidrógeno, cuya ecuación es pH= -log10[aH+]. El pH se puede medir en una solución acuosa utilizando una escala de valor numérico que mide las soluciones ácidas (mayor concentración de iones de hidrógeno) y las alcalinas (base, de menor concentración) de las sustancias. La escala numérica que mide el pH comprende los números de 0 a 14. Las sustancias más ácidas se acercan al número 0, y las más alcalinas (o básicas) las que se aproximan al número 14.
GRAFICA 4
Existen sustancias neutras como el agua o la sangre, cuyo pH está entre de 7 y 7,3. La medición de la acidez o de la alcalinidad del suelo, es una variable muy importante ya que afecta la absorción de minerales por parte de las plantas. Es decir, puede facilitar o perjudica la actividad biológica del suelo y el desarrollo de las plantas. Los niveles recomendables de pH del suelo tienen una medida entre 5,5 y 7. Sin embargo, los valores de pH en suelo pueden oscilar entre 3.5 y 9.0.
Algunos tipos de plantas pueden crecer y se desarrollarse en ambientes extremos donde los niveles de acidez o alcalinidad del suelo son muy variables. Hay que recordar que (a) el ión H+, o protón, es el núcleo del átomo de hidrógeno que tiene una carga eléctrica elemental positiva; (b) los iones H+ disociados forman, con una molécula de agua, los iones hidronio H2O+; que están en equilibrio con los iones H+ adsorbidos sobre las partículas sólidas del suelo. Estas mismas partículas sólidas pueden fijar otros cationes , principalmente el calcio, el potasio, el magnesio ,el sodio y el aluminio. . Todos en equilibrio con la solución del suelo. La cantidad total de cationes que pueden estar así adsorbidos determina la “Capacidad de Intercambio Catiónico -CIC” del suelo. En el siguiente punto 2.11 “El complejo adsorbente”, retomaremos este tema) Los cationes se clasifican en dos categorías; los cationes que no tienen efecto sobre el pH ( Calcio, Magnesio, Potasio, Sodio) y los dos cationes específicos de la acidez de intercambio, el Aluminio y el hidrógeno. En condiciones ácidas, la acidificación se traduce por el aumento de la acidez de intercambio(Al3+, y H+) y por la disolución de los minerales. El PH baja muy lentamente. En condiciones alcalinas, que sería el caso de las piedras calcáreas, la acidificación conlleva la disolución de las partículas calcáreas. Se da en consecuencia una disminución de la reserva alcalina total, sin que baje el pH.
La acidez del suelo depende del equilibrio entre las fuentes de acidez y las de alcalinidad que reaccionan rápidamente con el agua del suelo. La acidez del suelo está controlada por las cargas eléctricas presentes en la superficie de sus componentes. Podemos diferenciar tres tipos de componentes del suelo que son portadores de cargas eléctricas:
La materia orgánica, cuya carga superficial negativa aumenta con el pH, por lo que a este componente se le dice de “ carga variable” Los óxidos de hierro o de aluminio, cuya carga puede ser positiva o negativa en función del pH. Las arcillas, en las cuales una parte de la carga es permanente, es decir independiente del pH, pero que también poseen cargas variables parecidas a las de los óxidos.
El pH Tampón o “amortiguador”
Se denomina como “poder tampon” la propiedad del suelo de moderar (“amortiguar”)la variación del pH cuando hay aportaciones básicas o ácidas. En los pH altos (superiores a 8) depende del contenido de carbonatos y en pH bajos (inferiores a 4) va en función de las reacciones de disolución de los óxidos de aluminio y de los aluminosilicatos. Para valores intermedios de pH (entre 5.5 y 7.5) las aportaciones de ácidos o de bases modifican principalmente el estado de los intercambios variables que están presentes en la superficie de algunos componentes del suelo. (Materia orgánica y arcillas mineralógicas). Cuando el contenido de arcilla es bajo, se justifica entonces evaluar el porcentaje de carbono orgánico: el contenido de carbono permite estimar un poder tampón promedio de 0.15 cmol H+ por gramo de carbono orgánico, por kilogramo de suelo y por unidad de pH. En los suelos orgánicos la solubilidad del hierro y aluminio no es tan grande como en los suelos minerales, su muy alta capacidad de intercambio suministra amplias cantidades de calcio a los niveles de pH altos. Este tipo de suelo puede funcionar en forma satisfactoria para muchos cultivos con pH en el rango entre 5.0 y 5.5.
Disponibilidad de nutrientes y pH del suelo
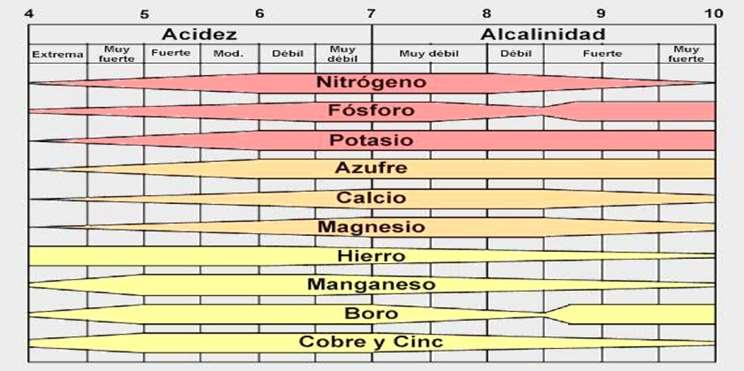
La acidez- alcalinidad de un suelo determina la mayor o menor capacidad de absorber nutrientes por las raíces de las plantas. En la Gráfica 5 se muestra la disponibilidad de los distintos nutrientes para distintos valores del pH del Suelo, donde el mayor ancho de banda indica mayor facilidad de absorción . Los pH indicados van del 4 al 9. Esta gráfica es meramente descriptiva pues la capacidad de absorción se encuentra condicionad no solo por el pH sino también por otros factores y propiedades de los suelos, tales como su mineralogía, la cual nos dicta la solubilidad de los de los distintos minerales. También depende del grado de saturación del Complejo de Intercambio o “Capacidad de Intercambio Catiónico – CIC ” al cual haremos referencia en el siguiente inciso 2.12 .Bajo ciertas circunstancias, el pH afecta a la actividad microbiana indispensable a la transformación de elementos que se presentan en formas no asimilables hacia otras que sí lo son. Este, es el caso del nitrógeno, cuyas formas inorgánicas son todas solubles independientemente del pH reinante. Señalaremos, sin
embargo, que cuando el pH excede valores de 8 o es inferior a 6, se produce una menor actividad microbiana, disminuyendo tanto la liberación de amonio como su oxidación a nitrato, por lo que se reduce la concentración del nitrógeno asimilable. En suelos muy ácidos (pH interior a 5 ), los sistemas radiculares de diversas especies de plantas pueden resultar dañados. La enmienda con carbonato de calcio es el método más comúnmente utilizado para corregir la acidez excesiva del suelo. (“Encalado de los predios”). Del mismo modo, cuando el pH supera el umbral de 9, esta alcalinidad excesiva puede dificultar la absorción de fósforo, hierro, molibdeno, así como otros nutrientes y microelementos. En el caso de suelos demasiado alcalinos la corrección del pH se puede llevar a cabo aplicando al suelo azufre en polvo ( de preferencia micronizado para reducir volatilidad). Solicite al laboratorio el cálculo de la cantidad a aplicar en función del pH alcalino y la reducción que se desea lograr. Los valores de pH mencionados son en gran parte meramente orientativos.
GRAFICA 5. DISPONIBILIDAD DE NUTRIENTES EN FUNCIÓN DEL pH del suelo