LI HT NE

AATOMI EHITUS
PERIOODILISUSTABEL
KEEMILISED REAKTSIOONID TUUMATEADUS
RADIOAKTIIVSUS
SIDEMED JA MOLEKULID ELEKTROKEEMIA


AATOMI EHITUS
PERIOODILISUSTABEL
KEEMILISED REAKTSIOONID TUUMATEADUS
RADIOAKTIIVSUS
SIDEMED JA MOLEKULID ELEKTROKEEMIA


HAPPED, ALUSED JA p H BIOKEEMIA




06 Aatomite jõud Täielik ehituskonstruktor 10 Aatomi anatoomia
Mikroskoopilised ehitusklotsid
14 Elementide teejuht
Perioodilisustabel
20 Mis on DNA?
Avasta, kuidas see toimib
22 Keemilised sidemed
Kõik põhineb külgetõmbel
23 Gaasikromatograafia ülevaade
Ainete tükeldamine
24 Süsinikukeemia võlumaailm
Muutlik element
30 Väävliringe
Element, millele meeldib ringi liikuda
32 Kuidas väärisgaasid toimivad?
Mis teeb selle rühma „väärikaks”
34 Heeliumi kergus
Mitmekülgne element
36 Vesinik: ühendav element
Kosmoses tavaline, Maal haruldane
38 Happed ja alused
Leia nende erinevused
40 pH skaala
Hapete eristamine alustest
43 Kuidas kloor basseine puhastab?
Kuidas see kaitseb suplejaid haiguste eest
44 Kuidas valgendi pisikuid tapab?
Valkude, bakterite ja viiruste hävitaja
46 Fluoriidi tutvustus
Kuidas see sinu hambaid kaitseb
Väetise tootmine
Haberi protsess
47 Kust tuleb happevihm?
Kuidas see nähtus tekib
Vihma lõhn
Miks sademetel on aroom
48 Katalüsaatorid
Ahelreaktsiooni südames
Mis on kuiv jää?
Hollywoodi õhustiku loomine
49 Elavhõbe
Ainulaadne vedel metall
50 Kuld: rikas element
Tekkimine, kaevandamine ja kasutamine
52 Alumiinium
Kõige levinum metall Maal
56 Uraani saladused
Radioaktiivse metalli kaevandamine
58 Mis on plutoonium?
Ohtlik element
60 Vismut: väga
rahutu metall
Metalne kristall
61 Katlakivi
Tülikas veesade
Roostevaba teras
Igapäevane supermaterjal
62 Sulamid: tipptasemel materjalid
Kuidas metallide segamine on kujundanud tänapäeva maailma
64 Termiidi jõud
Raua ja alumiiniumi plahvatuslik segu
66 Tapvad kemikaalid
Looduse surmavalt ohtlikud elemendid
70 Mürgine teadus
Kõige mürgisemad teada olevad ained
74 Imelised keemilised reaktsioonid
Hämmastavad keemilised ja aatomitasandi reaktsioonid








80 Plahvatuslik toime
Inimese loodud süütematerjalid
84 Tikud
Meie kaasaskantav leek
Kuidas värv kuivab?
Värvi keemia
85 Kuidas suitsuandurid töötavad?
Elupäästvate seadmete tutvustus
Mis on suits?
Kui tuli ei saa hapnikku
86 Tule taltsutamine
Küünalde keemiast leekideni kosmoses
92 Kuidas ilutulestikud töötavad?
Pürotehnikateadus
94 Vedel lämmastik
Aine, mis suudab peatada Terminaatori
95 Kristalliseeritud alkohol
Meie lemmikjookide ilu
96 Destilleerimise teadus
Iidse protsessi saladused
98 Toiduteadus
Keemia köögis
102 Ensüümid
Molekulid, mis tekitavad biokeemilisi reaktsioone
104 Loominguline kulinaaria
Molekulaarne gastronoomia
106 Kosmeetiline keemia
Meie näoveed ja kreemid
108 Šampooniteadus
Keemiline protsess, mis puhastab meie juukseid
110 Kuidas luminool toimib?
Kriminalistikas kasutatav kemikaal
112 10 supermaterjali
Looduslike võimaluste täiustamine
118 Nafta kasutamine
„Musta kulla” saladused
122 Mis on plast?
Materjal, mis võimaldab kõike
124 13 keemianippi argielus
Mõned teaduslikud teadmised aitavad igapäevaseid probleeme lahendada

Nende mikroskoopiliste ehitusklotside struktuuril põhineb kogu universumi keemia

Aatomid on ehitusklotsid, millest koosneb kõik sinu sees ja ümber, alates su keha rakkudest kuni teetassini, mida sa käes hoiad. Nad koosnevad elementaarosakestest, neid hoiavad koos füüsikalised põhijõud ning neil põhineb kogu universumi keemia.
Igal aatomil on tilluke positiivse laenguga tuum, mida tasakaalustab negatiivse laenguga elektronide pilv. Need määravad aatomi omadused. Kui aatomituum lahti murda, leiab sellest aatomisisesed osakesed, mida nimetatakse prootoniteks ja neutroniteks. Kõige lihtsamal, vesiniku aatomil on ainult üks prooton ja neutronid puuduvad. Ent perioodilisustabelis edasi liikudes suureneb prootonite arv ühe haaval. Iga täiendava prootoniga muutub ka aatomi käitumine.
Prootonitel on positiivne laeng ning iga prootoni lisandumisel saab aatom juurde ka ühe negatiivse elektroni. Need elektronid kogunevad kindlatesse tsoonidesse aatomituuma ümber, mida nimetatakse kihtideks. Igas kihis saab olla ainult teatud arv elektrone. See tähendab, et kui kiht täitub, peavad järgmised elektronid uue moodustama.
Aatomid on kõige stabiilsemad siis, kui nende elektronkihid on täitunud, kuid enamikul elementidel on vabu elektrone. Sellel põhineb kogu meid
„Kui aatomituum lahti murda, leiab sellest aatomisisesed osakesed.”
Universum tekkis Suure Pauguga umbes 13,8 miljardit aastat tagasi. Esimestel hetkedel oli see niivõrd kuum ja tihe, et osakesed ei saanud selles püsida. Iga kord, kui kvargid ja elektronid tekkisid, lagunesid nad sedamaid. Ent kui universum paisus ja jahtuma hakkas, muutusid need elementaarosakesed stabiilsemaks. Seejärel hakkasid kvargid koonduma, moodustades prootoneid ja neutroneid. Mõne minuti pärast kogunesid need juba kokku, mille tulemusena tekkisid esimesed aatomituumad.
Kulus veel 380 000 aastat, kuni universum jahtus piisavalt, et võimaldada terviklike vesiniku aatomite moodustumist, ning siis hakkas toimuma imepäraseid asju. Raskusjõud tõmbas aatomid kimpudeks ja kui need kasvasid, hakkas nende sisemuses suurenema rõhk. Aatomituumad jõudsid üksteisele nii
lähedale, et hakkasid liituma ning sündisid esimesed tähed. Need hiiglaslikud tuumaahjud on sellest ajast saadik aatomituumi sünteesinud, luues kõik erinevad elemendid, mida täna meie ümber leida võib.
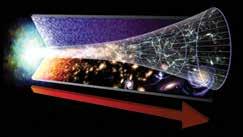
Universumi sünni järel tekkisid kõigepealt vesiniku aatomid
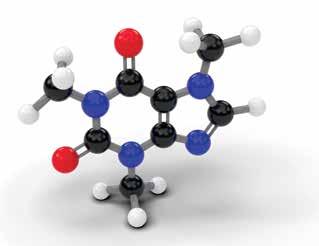
Erinevad elemendid võivad liituda, moodustades keerukaid ühendeid
Millest su tee tehtud on?
Teetassis on rohkem aatomeid kui kruusitäisi vett kõikides ookeanides kokku
Sinu teetass on segu, kombinatsioon erinevatest molekulidest ja ühenditest, mida ei ühenda keemilised sidemed. See sisaldab vett, ent ka molekule teest endast: polüfenoole, aminohappeid, ensüüme, pigmente, lenduvaid aineid ja kofeiini. Võib-olla on selles ka piima, mis sisaldab rasvu, valke ja suhkruid. Ja lisaks võib seal olla ka peensuhkrut.
Mõõtkava: 10 sentimeetrit
Ühend
Kui sa suunaksid teetassi sisse võimsa mikroskoobi, siis näeksid ühendeid, millest see segu koosneb. Ühendid on ained, mis koosnevad kahest või enamast erinevast elemendist, mille vahel on side. Kofeiini keemiline valem on C8H10N4O2. See sisaldab kaheksat süsiniku, kümmet vesiniku, nelja lämmastiku ja kahte hapniku aatomit. Mõõtkava: 0,78 nanomeetrit
Kui kofeiin osadeks lahti võtta, saab tulemuseks molekulid. Need sisaldavad ainult ühte tüüpi aatomit ja on kõige väiksemad üksused, mis saavad keemilistes reaktsioonides osaleda. Kofeiiniühendi lagundamisel moodustavad selle hapniku aatomid paari, tekitades kahe identse aatomiga hapniku molekuli.
Mõõtkava: 292 pikomeetrit
Element
Kui sa hapniku molekuli pilti suurendad, näed eraldi hapniku elementi. Elemendid on ained, mis sisaldavad ainult ühte tüüpi aatomit. Maal leidub üle 90 loodusliku elemendi ja lisaks valmistatakse laborites sünteetiliselt tehiselemente. Hapnik on element number 8.
Mõõtkava: 60 pikomeetrit
Aatom
Viimane suurendus tooks päevavalgele aatomisisesed osakesed: positiivsed prootonid, neutraalsed neutronid ja negatiivsed elektronid. Nende arv annab erinevatele elementidele iseloomulikud keemilised omadused. Hapniku aatomis on kaheksa prootonit, kaheksa neutronit ja kaheksa elektroni.
Mõõtkava: 1 femtomeeter
Heidame pilgu aatomisisestele osakestele, millest koosnevad õhu aatomid, mida me hingame
Elektron
Nende aatomisiseste osakeste mass on peaaegu null ja laeng -1.

Prooton
Nende aatomisiseste osakeste mass on 1 ja laeng +1.

Elektronkihid
Hapniku aatomis on kaheksa elektroni, mis paiknevad kahes orbitaalkihis.
Neutron
Nende aatomisiseste osakeste mass on 1 ja laeng 0.
Tuum
Hapniku aatomi tuumas on kaheksa prootonit ja kaheksa neutronit.
Vabad elektronid
Kahel välimise kihi elektronil puudub paariline. See võimaldab hapniku aatomil keemilisi sidemeid moodustada.
118
Elementide arv perioodilisustabelis


90
Elementide arv, mida leidub
Maal looduslikult arvestatavas koguses
75%
Kõrgeima eraldusvõimega elektronmikroskoobid võimaldavad vaadelda üksikuid aatomeid Enamik kogu universumi ainest on vesinik
50 miljonit
Kemikaalid, mida inimesed on avastanud või valmistanud

2,6 sek
Uued kemikaalid valmivad regulaarselt ja kiiresti
Praegu tööstuses kasutusel olevate kemikaalide arv
7700



Kõik vesinikust ja heeliumist raskemad elemendid on tekkinud tähtedest
ümbritsev keemia. Pooltühjade kihtide täitmiseks moodustavad aatomid keemilisi sidemeid. Nad võivad omavahel elektrone jagada, et moodustada kovalentseid sidemeid, või üksteiselt elektrone näpata, moodustades ioonsidemeid.
Kovalentsed sidemed on levinud meie endi kehas. Süsiniku aatomid vajavad välimise kihi täitmiseks nelja elektroni ja seepärast jagavad neid kuni nelja muu aatomiga, sealhulgas teiste süsiniku aatomitega. Selle omaduse tõttu on nad ideaalsed suurte bioloogiliste molekulide (näiteks DNA) moodustamiseks.
Ioonsidemeid võib rohkem leida maapõues. Need tekivad, kui mittemetall varastab metallilt elektrone ja saab selle tulemusena negatiivse laengu. Samal ajal omandab metall positiivse laengu. Need ioonid tõmbuvad teineteise poole,
„ Nad võivad omavahel elektrone jagada, et moodustada kovalentseid sidemeid, või üksteiselt elektrone näpata.”
liitudes korduvatesse struktuuridesse, nagu näiteks soolakristallid.
Aatomitevahelised sidemed võivad laguneda ja uuesti tekkida ning see võimaldab elementidel keemilisi trikke teha. Ühinemine tekitab suuremaid ühendeid, lagunemine väiksemaid ning ühe elemendi asendamine teisega annab tulemuseks erinevate omadustega kemikaali. Selline dünaamiline koostöö toimub pidevalt kõikjal meie ümber.
Aatomituuma moodustavad prootonid ja neutronid ei ole kõige väiksemad aineosakesed. Viimasteks on „elementaarosakesed” – kvargid ja leptonid. Olemas on kuut tüüpi kvarke, mis paiknevad paarides: alla ja üles suunatud, sarmikad ja veidrad, tipu- ja põhjakvargid. Neil on osaline elektrilaeng ja „värvilaeng”: punane, roheline või sinine. Lisaks on olemas kuut tüüpi leptoneid: elektron, müüon, tau ja nendega seotud neutriinod. Lihtsaima vesiniku aatomi moodustamiseks on vaja nelja osakest: kahte üles suunatud kvarki ja ühte alla suunatud kvarki prootoni jaoks ning ühte elektroni, mis tiirleb välisküljel. Kõige levinumal vesiniku vormil neutronid puuduvad.
Olemas on kuus kvarki ja kuus leptonit, igaüks erinevate omadustega.
Meie arusaamad aatomi ehitusest on viimase 200 aasta jooksul läbi teinud pika teekonna
1803 Tahke kera
Esimesena kirjeldas aatomeid John Dalton. Selle termini moodustas ta kreekakeelsetest sõnadest „a”, mis tähendab „mitte” ja „temnein” ehk „tükeldama”. Tema arvates olid need osakesed jagamatud.
TÄPSUS
Dalton mõistis, et erinevat tüüpi aatomitel olid erinevad omadused. Kuid ta ei saanud aru, et need sisaldasid väiksemaid aatomisiseseid osakesi.
1904 Ploomipuding
J. J. Thomson avastas elektronid ja koostas uue aatomi mudeli, mis neid sisaldas. Ta paigutas need positiivselt laetud kerasse nagu rosinad saia sisse.
TÄPSUS
Selle mudeli kohaselt sisaldasid aatomid väiksemaid komponente, sealhulgas elektrone. Kuid struktuur ei olnud õige: selles puudus aatomituum.
1911 Tuumamudel
Kui Ernest Rutherford oma katsetes aatomeid väikeste osakestega pommitas, liikus suurem osa neist aatomist läbi. See näitas, et enamiku aatomist moodustab tühi ruum, mille keskel asub väike tuum.
TÄPSUS
Positiivne tuum, mida ümbritsevad negatiivsed elektronid – see on üsna sarnane kaasaegse ettekujutusega aatomist. Kuid Rutherford polnud siiski täpselt mõistnud, kuidas elektronid liiguvad.
1913 Planetaarsus
Niels Bohri planetaarse mudeli kohaselt liiguvad elektronid orbiitidel, mida nimetatakse „kihtideks”. Need asuvad kindlal kaugusel tuumast ja neil on kindel energiatase.
TÄPSUS
Planetaarne mudel selgitab, miks väikesed elemendid teatud kiirgussagedusi neelavad ja kiirgavad. Ent selle korral tekivad probleemid, kui elemendid raskemaks muutuvad.
1926 Kvantmudel
Erwin Schrödinger käsitles kihte ringikujuliste trajektooride asemel tõenäosuspilvedena. Kihis elektroni leidmise tõenäosus on 90 protsenti.
TÄPSUS
See mudel on kõige ajakohasem. Elektronide käsitlemine lainetena tõenäosuspilvedes aitab selgitada aatomisiseste osakeste käitumist.
Oleme kõik näinud,
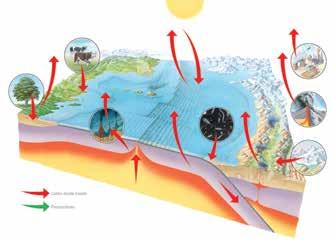
Vihmavesi on alati vähesel määral happeline, sest atmosfääris sisalduv süsinikdioksiid lahustub vees ja moodustab süsihappe. Tugevam happevihm võib aga kahjustada kivist ehitisi ja põllukultuure ning reostada veekogusid. See tekib atmosfääris, kui inimtegevuse tõttu sinna sattunud mürgised gaasid puutuvad kokku vihmapilvedes oleva niiskusega.
Fossiilkütuseid
kasutavatest elektrijaamadest ja bensiini ning diiselsõidukitest erituvad keemilised saasteained – peamiselt vääveldioksiid (SO2) ja lämmastikoksiidid (NOx). Õhus oleva veega segunedes hakkavad need reageerima ja muutuvad happeliseks.


2 Tuul Tuul kannab gaasid kõrgemale, vihmapilvede poole.
1Happelised gaasid
Tööstusettevõtted ja sõidukid heidavad vääveldioksiidi ja lämmastikoksiidid atmosfääri.
Kuidas sademed tekitavad iseloomuliku lõhna, mis on kogu maailmas samasugune
Vihma lõhna on võimalik tunda juba enne saju algust. Äike suudab lõhustada atmosfääris leiduvad lämmastiku ja hapniku molekulid üksikuteks aatomiteks. Nende aatomite reageerimisel tekib lämmastikoksiid, mis võib omakorda koostoimes teiste kemikaalidega tekitada osooni – selle lõhn meenutab pisut kloori ja just seda lõhna seostame me vihmaga. Kui see aroom tuulega edasi kandub, saame ennustada vihma tulekut enne seda, kui sadu algab.
Teine vihmaga seotud lõhn on petrikoor ehk vihmavärske lõhn. Selle väljendi võtsid 1960. aastate keskel kasutusele kaks Austraalia teadlast. Pärast kuiva ilma perioodi toob esimene vihmasadu endaga kaasa väga erilise aroomi, mis on kõikjal samasugune. Selle kirjeldamatu aroomi tekke põhjustavad kaks kemikaali. Ühte neist kemikaalidest eritavad konkreetsed maapõues elavad bakterid, teine aga on õli, mida nõristavad janused taimed. Maapinnal saavad need ühendid kokku ja kui vihma sadama hakkab, täidab värske lõhn sinu ninasõõrmed.
3
Gaasid lahustuvad
Vihmapilvedes veeauruga (vee ja hapnikuga) kokku puutudes hakkavad gaasid reageerima, tekitades nõrga, kuid kahjuliku mõjuga happe. Tööstusest pärinevast vääveldioksiidist saab väävelhape.
4 Happevihmasadu
Kui happevihm maapinnale sajab, võib see kahjustada taimestikku, imbuda veekogudesse ning murendada ehitisi ja monumente.
Väävli ja lämmastiku oksüdeerumine
Vääveldioksiid (SO2)
See tekib rasketööstuse kõrvalsaadusena, näiteks elektrijaamades.
Lämmastikoksiidid (NOx)
Need satuvad õhku autode heitgaasides.
Selgitus
Sinine: lämmastik
Kollane: väävel
Punane: hapnik
