
27 minute read
J. Holzinger, K. Öttl, S. Hallström, W. Domej
from Jahrbuch 2017
by bigdetail
❙ Johannes Holzinger, Karl Öttl, Seth Hallström, Wolfgang Domej ❙
Oxidation von Albumin unter normobarer Hypoxie
Oxidation of Albumin in normobaric hypoxia
SUMMARY
Oxidative stress refers to a condition in which the dynamic equilibrium between oxidative compounds and antioxidant defences is shifted towards oxidants with the consequence of severe modification of biomolecules and/or redox dysregulation. Hypoxia at high altitudes causes endogenous oxidative stress that is also of significance in acclimatization processes to high altitudes. Human serum albumin is a quantitatively significant plasma protein and also an important plasma buffer in the sense of acid/base- as well as redox-chemsitry. Albumin (AL) is well suited as an indicator of redox processes in the organism; based on a free thiol group the AL-molecule may reach different levels of oxidation. However, changes of the molecule in the context of hypoxia have been rarely investigated in the past. In the current pilot study the redox status of AL in relation to the long established marker malondialdehyde (MDA) was investigated in healthy voluntary subjects before and after four hours stay in a normobaric hypoxic chamber (altitude equivalent 5000 m). The hypoxic exposure resulted in a slight but significant increase in oxidized AL, while MDA remained largely unchanged. The fraction of human mercaptalbumin (HMA) as the completely reduced form of AL was decreased by 1.6% from basic values, while non-mercaptalbumin-I (HNA-1) as the slightly oxidized form increased by 1.4%. In contrast, HNA-2, representing the highest stage of oxidized AL, remained nearly unchanged. Keywords: albumin (AL), mercaptalbumin, non-mercaptalbumin, normobaric hypoxia, hypoxic chamber (HC)
ZUSAMMENFASSUNG
Oxidativer Stress beschreibt einen Stoffwechselzustand, bei dem das dynamische Gleichgewicht zwischen oxidativen Substanzen und antioxidativer Ab-
27
wehr zur Seite der Oxidantien verschoben ist, wodurch es zur Veränderung von Biomolekülen und/oder einer Redox-Dysregulation kommt. Durch die Hypoxie in großer Höhe wird endogen oxidativer Stress generiert, welcher aber auch als Trigger für den Akklimatisationsprozess in der Höhe erforderlich ist. Das humane Serumalbumin stellt ein quantitativ bedeutendes Plasmaprotein und zugleich einen wichtigen Plasmapuffer sowohl für den Säure-Basen- als auch für den Redox-Haushalt dar. AL eignet sich ausgezeichnet als Indikator für Redox-Vorgänge im Organismus, denn es weist eine freie Thiolgruppe auf, die unterschiedliche Oxidationsstufen erreichen kann. Die Änderungen des AL-Moleküls im Rahmen der Hypoxie wurden bisher kaum untersucht. In der vorliegenden Pilotstudie wurde der AL-Redox-Zustand im Vergleich zu einem lange etablierten Marker, nämlich Malondialdehyd (MDA), bei gesunden freiwilligen Probanden und Probandinnen vor und nach vierstündiger normobarer Hypoxieexposition in einer Hypoxiekammer (HK) bei einer Äquialenzhöhe von 5.000 m gemessen. Es zeigte sich ein leichter, aber signifikanter Anstieg von oxidiertem AL, während MDA als Indikator weitgehend unbeeinflusst blieb. Der Anteil an humanem Mercaptalbumin (HMA), die vollständig reduzierte Form des Albumins, verringerte sich dabei um 1,6% im Vergleich zum Ausgangswert, während Non-Mercaptalbumin I (HNA-1) als mild oxidierte Form, um 1,4% anstieg. HNA-2 blieb als die höchste erreichbare Oxidationsstufe hingegen nahezu unverändert. Schlüsselwörter: Albumin (AL), Mercaptalbumin, Non-Mercaptalbumin, normobare Hypoxie, Hypoxiekammer (HK)
EINLEITUNG
Höhenbergsteigen und alpinsportliche Aktivitäten aller Art erfreuen sich zunehmender Beliebtheit. Der medizinische wie auch der technische Fortschritt machen Aufenthalte in großen Höhen heute der breiten Masse aber auch Menschen mit stabilen chronischen Erkrankungen zugänglich. Die Forschung hat sich bereits seit Jahrzehnten des Themas „große Höhen“ angenommen und deren Auswirkung auf den menschlichen Organismus untersucht. Zahlreiche Studien beschäftigten sich bisher mit den Auswirkungen von oxidativem Stress in einer hypoxischen Umgebung. Trotz der inversen Korrelation des arteriellen O2-Partialdruckes (paO2) bzw. O2-Sättigung (SaO2) mit der terrestrischen Höhe nehmen oxidative Veränderungen von Biomolekülen infolge verstärkter endogener Generation reaktiver Sauerstoffspezies (ROS) zu (1–3). Die beson-
28
deren Auswirkungen der Höhe auf das Redox-Gleichgewicht des menschlichen Blutes mit dem Fokus reduktiver und oxidativer Veränderungen am Albuminmolekül wurden bisher kaum untersucht. Ziel der vorliegenden Arbeit war den Einfluss von normobarer Hypoxie sowie das daraus resultierende Ausmaß an oxidativem Stress anhand des Redox-Zustandes von AL zu evaluieren. AL kann in drei Redoxstufen vorliegen. In vollständig reduzierter Form als Humanes Mercaptalbumin (HMA), in mild oxidierter Form als Non-Mercaptalbumin I (HNA-1) und in höherer Oxidationsstufe als Non-Mercaptalbumin II (HNA-2).
Oxidativer Stress und Hypoxie
Oxidativer Stress beschreibt einen pathophysiologischen zellulären Zustand, bei dem das Gleichgewicht zwischen prooxidativen Substanzen und der antioxidativen Abwehr zur Seite der Oxidantien verschoben ist. In der Folge können Schäden an Biomolekülen auftreten bzw. es kann die Redoxregulation entgleisen (4,5). Im menschlichen Organismus erfolgt durch Stoffwechselvorgänge aber auch äußere Einflüsse eine kontinuierliche Synthese von ROS. Wie der Name schon sagt sind diese ausgesprochen reaktionsfreudig und in der Lage, alle relevanten Gruppen von Molekülen zu verändern. Diese oxidativen Vorgänge werden auch immer wieder mit Alterungsprozessen, degenerativen Veränderungen und malignen Transformationen in Zusammenhang gebracht (6–9). Auch ein Zusammenhang zur Entwicklung von akuter Höhenkrankheit (AMS), Höhenlungenödem (HAPE) und Höhenhirnödem (HACE) wurde vielfach diskutiert (1,3). Die Bedeutung der Generation von ROS in großen Höhen liegt jedoch nicht nur in ihrer potentiell gewebsschädigenden Wirkung, sondern ROS sind auch bedeutende zelluläre Botenstoffe, die für die Initiierung zahlreicher Anpassungsvorgänge verantwortlich sind; insbesondere in Hinblick auf die Aktivierung des bedeutenden Transkriptionsfaktors „hyoxia inducible factor 1 a“ (HIF-1a) spielen ROS eine zentrale Rolle (1,10,11,12). Da ROS in erster Linie zur Oxidation anderer Moleküle führen, fallen sie unter den Begriff der Oxidantien. Wichtige Vertreter sind unter anderem das Superoxid-Anion (Hyperoxid-Anion) (•O2 -), das Hydroperoxyl-Radikal (•O2H), Wasserstoffperoxid (H2O2) und das Hydroxyl-Radikal (•OH) (4). Allerdings können nicht nur Sauerstoffspezies oxidative Schädigungen hervorrufen, sondern auch andere reaktive Verbindungen, wie reaktive Stickstoff- und Halogenspezies können als Oxidantien wirksam sein (13). Bedeutende endogene ROS-Quellen im menschlichen Organismus stellen neben den Mitochondrien
29
auch Entzündungsreaktionen sowie immunologische Prozesse dar, die zur Generation nicht unwesentlicher Mengen an Oxidantien beitragen können.
Veränderungen des Redox-Status in großen Höhen wurden bereits vielfach untersucht (1,2). Trotzdem konnte bis heute nicht eindeutig nachgewiesen werden, aus welchen Quellen die dafür verantwortlichen ROS stammen. Einige der in der Literatur beschriebenen Theorien zur Bildung von reaktiven Spezies in großen Höhen sollen hier ansatzweise angeführt werden. Ein möglicher Ursprung von ROS in großen Höhen liegt in den Mitochondrien bzw. in der Atmungskette, also dort, wo am meisten Sauerstoff verbraucht, das heißt zu Wasser reduziert wird. Paradoxerweise wird gerade in Mangelsituationen Sauerstoff mehr als sonst nur partiell reduziert, was die Bildung von Superoxid-Anionen (•O2 –) nach sich zieht. Diese reagieren mit Wasser zu weiteren ROS wie Wasserstoffperoxid (H2O2) und Hydroxyl-Radikalen (•OH) (1,14,15). Eine weitere bedeutende ROS-Generation dürfte unter Hypoxiebedingungen über das Xanthinoxidase-System laufen. Unter Sauerstoff-Mangelbedingungen wird aus zwei Molekülen ADP (Adenosin-Di-Phosphat) ein Molekül ATP (Adenosin-Tri-Phosphat) und ein Molekül AMP (Adenosinmonophosphat). Da die Atmungskette unter Hypoxie schlecht funktioniert, wird AMP vermehrt zu Harnsäure abgebaut. Erfolgt dieser Abbau über den Xanthinoxidase-Weg, werden die anfallenden Elektronen auf molekularen Sauerstoff übertragen, sobald dieser wieder zur Verfügung steht. Nebenprodukte, die dabei auftreten, sind wiederum Superoxid-Anionen (O2 –) und Wasserstoffperoxid (H2O2) (1). Es gibt zudem Hinweise, dass unter Hypoxie die körpereigenen enzymatischen Abwehrsysteme, wie etwa die Glutathion-Reduktase, weniger aktiviert sind (15). Maiti et al. konnten tierexperimentell unter hypobarer Hypoxie eine verminderte Aktivität der Superoxiddismutase (SOD), Glutathionreduktase (GR) und Glutathionperoxidase (GPX) in Rattengehirnen nachweisen (14). Ein weiterer Ansatz ist, dass durch Hypoxie Entzündungsvorgänge getriggert oder verstärkt werden, die zu einer verstärkten Expression entzündlicher Zytokine führen. Liu et al. konnten tierexperimentell zeigen, dass IL-1β, IL-6 und TNFα bereits nach einem Tag in Hypoxie innerhalb des Glomus caroticum von Ratten signifikant ansteigen (16).
30
Veränderungen von Biomolekülen
Eine spezifische Form der oxidativen Schädigung insbesondere von Lipiden ist die Lipidperoxidation. Nach einer Startreaktion durch ein reaktives Molekül und einer ungesättigten Fettsäure kann sich eine Kettenreaktion einstellen, bei der ungesättigte Fettsäuren oxidiert und gleichzeitig neue Radikale generiert werden. Letztere halten die Kettenreaktion in Gang, die erst dann zum Stillstand kommt, wenn zwei Radikale miteinander reagieren, oder wenn alle Radikale von Antioxidantien abgefangen wurden. Das bedeutendste Antioxidans im lipophilen Milieu ist α-Tocopherol (Vitamin E). Es fungiert sowohl als Unterbrecher der Kettenreaktion bzw. verhindert als Radikalfänger, dass diese überhaupt gestartet wird (6,7,17). Beim Abbau von Lipidradikalen entstehen unterschiedliche, zum Teil mutagene und toxische Aldehyde (18,19) wie der Malondialdehyd (MDA), der zytotoxisch wirkt und vermutlich auch das mutagenste Produkt der Lipidoxidation darstellt (18,20). Die Bedeutung dieses Moleküls liegt insbesondere auch darin, dass es für ein leicht messbares Produkt der Lipidoxidation, vor allem von Omega-3- und Omega-6-Fettsäuren steht. MDA wird häufig zur Quantifizierung von oxidativen Lipidschäden herangezogen (20). Aus diesem Grund wurde auch in der vorliegenden Pilotstudie MDA mitbestimmt, um etwaigen oxidativen Stress mit einem dafür lange in Verwendung stehenden Parameter zu dokumentieren. Der Fokus der vorliegenden Pilotstudie liegt auf den oxidativen Veränderungen von Proteinen, konkret dem Serumalbumin. Die beiden schwefelhaltigen Aminosäuren Cystein und Methionin sind für eine Oxidation besonders anfällig. Cystein hat eine freie Thiolgruppe, welche leicht oxidiert werden kann. Die typische Redoxreaktion der Thiolgruppe besteht in der Bildung einer Disulfidbrücke mit einer anderen Thiolgruppe, die dabei ebenfalls oxidiert wird. Tritt eine solche zwischen zwei Cystein-Molekülen auf, so bildet sich die Aminosäure Cystin. Diese Verbindung kommt häufig in Proteinen vor, um deren Tertiärstruktur zu stabilisieren. Es kann auch zwischen zwei verschiedenen Proteinen zur Ausbildung von Disulfidbrücken und damit zu einer Vernetzung von Makromolekülen kommen. Durch ein Enzym aus der Klasse der Disulfid-Reduktasen, wie etwa der Glutathion-Disulfid-Reduktase, sind diese Reaktionen reversibel (6,21,22). Protein-Thiole können außerdem Disulfide mit kleinen Thiol-Verbindungen wie einem freien Cystein, Homocystein, Cysteinylglycin oder Glutathion eingehen. Auch diese Reaktionen sind reversibel. Die Thiolgruppe kann außerdem auch stärker oxidiert werden, wobei es dann zur Bildung von Sulfin- oder Sulfonsäure kommt. Diese Oxidation ist dann irreversibel, das betroffene Protein muss bei entsprechender Funktions-
31
einschränkung durch Proteasen erkannt und abgebaut werden (6,21,22). Die Oxidationsstufen von AL, die in dieser Arbeit beschrieben werden, betreffen genau solche Veränderungen am Cystein in Position 34 des Albuminmoleküls. Die Veränderungen während einer Hypoxie könnten somit die individuelle Belastung mit ROS abbilden, wobei ein Ansteigen von HNA-1 ein reversibles Ansprechen des Antioxidantien-Netzwerkes anzeigt, während HNA-2 einen Indikator für irreversible Schädigung darstellt. Daraus lassen sich möglicherweise Hinweise auf die Anpassungsfähigkeit eines Individuums an hypoxische Bedingungen ableiten.
Antioxidative Abwehr
Um Leben mit einem aeroben Stoffwechsel überhaupt erst zu ermöglichen, bedarf es eines differenzierten antioxidativen Abwehrsystems, damit Schäden an Proteinen, Kohlenhydraten, Lipiden und Nukleinsäuren weitgehend verhindert werden. Man unterscheidet zwischen enzymatischen und nicht-enzymatischen Abwehrmechanismen. Die Aufgabe der nicht-enzymatischen Abwehr ist es, mit reaktiven Spezies zu weniger reaktiven Verbindungen zu reagieren oder die Bildung reaktiver Spezies überhaupt zu verhindern. Sogenannte Radikalfänger können reaktive Spezies beseitigen und Kettenreaktionen unterbinden. Eine wichtige Gruppe von Radikalfängern stellen Moleküle mit einer freien Thiolgruppe (-SH), sogenannte Thiole dar. Dazu zählen u.a. Glutathion und Mercaptalbumin. Die mengenmäßig bedeutenste freie Thiolgruppe findet sich am Cystein an Stelle 34 am Albumin (21,22,24). Dieses Protein-Thiol macht 70–80% des Thiol-Pools im Plasma aus (22–24). Thiole oxidieren reversibel unter Bildung von Disulfidbrücken und stellen somit ein wichtiges Bindeglied im antioxidativen Netzwerk dar. Dabei ist etwa die Oxidation zweier Glutathion-Moleküle zu Glutathiondisulfid von besonderer Bedeutung (22,25). Weitere bekannte Vertreter von Radikalfängern sind Alpha-Tocopherol (Vitamin E), Ascorbinsäure (Vitamin C), Harnsäure/Urat, Bilirubin oder auch Beta-Carotin (Vitamin A) (4,6). Enzymatische Abwehrsysteme zielen ebenfalls darauf ab, ROS zu ungefährlichen Verbindungen zu katalysieren. Durch einige enzymatische Abwehrmechanismen können reaktive Spezies direkt unschädlich gemacht werden; dazu zählen Enzyme wie die Superoxid-Dismutase, Glutathion-Peroxidase oder Katalase. Andere Enzyme sorgen dafür, dass nicht-enzymatische Antioxidantien regeneriert werden, wie etwa die Glutathionreduktase (GSSG-Reduktase) oder die Chinon-Reduktase (4,6). Verschiedene Mechanismen greifen dabei eng ineinander, sodass ein dichtes antioxidatives Netzwerk (antioxidative Kapazität) entsteht (10).
32
Albumin
Das zentrale Molekül in dieser Pilotstudie stellt das humane Serumalbumin dar, das als Protein im menschlichen Organismus von multifunktioneller Bedeutung ist. Ein 70 Kilogramm schwerer Mensch enthält durchschnittlich 360 g AL, wovon sich nur etwa ein Drittel intravaskulär im Blutplasma befindet. Die beiden restlichen Drittel finden sich in unterschiedlichen Geweben und Körperflüssigkeiten wie etwa im Liquor, Speichel, Schweiß, Lymphe, Tränenflüssigkeit oder Kammerwasser des Auges. AL wird in den Hepatozyten gebildet und hat eine biologische Halbwertszeit von etwa 19 Tagen; etwa 13,3 g AL werden täglich abgebaut und müssen in derselben Menge nachgebildet werden. Das entspricht etwa 3,7% der Gesamtmenge (26). Neben der Aufgabe als Proteinspeicher besitzt AL auch eine Reihe wichtiger Transportfunktionen, wie etwa von Fett- und Aminosäuren, Bilirubin, Kupfer- und Kalziumionen, Steroid- und Schilddrüsenhormonen sowie Phospholipiden. Auch zahlreiche Medikamente werden an AL gebunden transportiert. Eine weitere wichtige Aufgabe des Albumins ist die Aufrechterhaltung des kolloidosmotischen Drucks. Obwohl AL „nur“ 60% der Masse der Plasmaproteine ausmacht, ist es für 80% des kolloidosmotischen Druckes verantwortlich. Zudem ist AL das wichtigste Pufferprotein im Säure-Basen-Haushalt und besitzt, nicht zuletzt durch seine freie Thiolgruppe, eine antioxidative Wirkung (26,27). Die primäre Fragestellung der vorliegenden Arbeit war, ob sich der Redoxzustand der Aminosäure Cystein an Position 34 (cys-34) des AL-Moleküls unter normobarer Hypoxie-Exposition kurzfristig ändert. Die Thiolgruppe des cys-34 ist als einziges der 35 Cystein-Moleküle des Albumins nicht an einer intramolekularen Disulfidbindung beteiligt und liegt an der Außenseite des AL-Moleküls. Es kann daher leicht oxidiert oder auch wieder reduziert werden (24) (Abb. 1). Die vollständig reduzierte Form wird auch als humanes Mercaptalbumin (HMA) bezeichnet, denn das Cystein liegt mit einer freien Thiol-Gruppe (Mercapto-Gruppe) vor. HMA kann reversibel zum humanen Non-Mercaptalbumin 1 (HNA-1) oxidiert werden. Das Cystein liegt dann als Disulfid mit einem anderen Thiol, wie etwa einem zweiten Cystein, Homocystein oder Gluthation, vor. Wird hingegen HNA-1 weiter oxidiert, so ist dieser Prozess irreversibel und es entsteht humanes Non-Mercaptalbumin 2 (HNA-2). Dabei liegt das Cystein als Sulfin- oder Sulfonsäure vor. Bei einem jungen normoxämischen Menschen liegt der Anteil von HMA bei etwa 80%, der von HNA-1 etwa bei 18% und der von HNA-2 überwiegend unter 4%. Die Redoxzustände des AL sind in Abbildung 1 dargestellt.
33
Abb. 1: Struktur des Albuminmoleküls (linke Seite). Das Cystein an Position 34 ist hervorgehoben. Diese Abbildung wurde erstellt auf Basis der PDB-Datei 1BJ5 von Curry et al. (28). Die Redoxzustände des Cysteins an Position 34 am Albumin (rechte Seite). Beim HMA liegt es als Thiol vor, beim HNA-1 bildet es ein Disulfid mit einem anderen Cysteinmolekül und beim HNA-2 liegt es als Sulfonsäure vor.
METHODEN
Hypoxiekammertechnologie
Die Höhenexposition wurde durch einen Aufenthalt in einer normobaren Hypoxiekammer (HK) erreicht. Dabei wurde der Sauerstoffgehalt der Atemluft reduziert und durch Stickstoff substituiert. Der Sauerstoffpartialdruck (paO2) im Blut wurde äquivalent zu terrestrischer großer Höhe (5.000 m/FiO2 0,11) abgeändert. Derartige Anlagen sind geeignet, höhenmedizinische Fragestellungen einfach und unter kontrollierbaren Bedingungen durchzuführen (29). Nach dem Prinzip der Druckwechseladsorption wurde Sauerstoff partiell abgetrennt und auf diesem Wege in der Einatemluft reduziert. Die HK umfasste ein Raumvolumen von 30 Kubikmetern. Der gewählte Grad an normobarer Hypoxie wurde mit 4 Generatoren (Hypoxico Everest II) konstant gehalten. Für die Durchführung des Pilotprojekts wurden 33 freiwillige Probanden und Probandinnen rekrutiert. Als Ausschlusskriterien wurden akute bzw. chronische Erkrankungen, Nikotinabusus, besondere Diätformen (Veganer), kurz zurückliegende Hypoxieexposition sowie körperliche Belastung (Sport) definiert. Vor Eintritt in die HK wurden Blutdruck, Herzfrequenz und Sauerstoffsättigung gemessen und venöse Blutproben gewonnen (8 mL EDTA-Blut
34
und 4 mL Na-Heparin-Blut). Die Messung der Herzfrequenz sowie der Sauerstoffsättigung erfolgte pulsoxymetrisch (Modell MD300C2). In weiterer Folge wurden obige Parameter stündlich während des 4-stündigen passiven Aufenthaltes in der HK geprüft. Am Ende der Hypoxieexposition erfolgte eine zweite Blutabnahme (4mL EDTA-Blut). Alle Blutproben wurden gekühlt in das Labor weitergeleitet. Zur Bestimmung des Albumin-Redoxzustandes wurde EDTA-Blut zentrifugiert (2500 U/min über 10 Minuten), das Plasma bei –70°C tiefgefroren. Dadurch konnte die weitere Stabilität des Albumin-Redox-Zustandes auch bei längerer Lagerung garantiert werden (21). Zur Analyse wurden die Plasmaproben wiederum auf Raumtemperatur gebracht und in einem Vibrationsmixer durchmischt, bevor die Analyse mittels Hochleistungsflüssigkeitschromatographie (HPLC/Hitachi) durchgeführt werden konnte. Die Analyse erfolgte nach dem von Imai et al. 2005 beschriebenen Verfahren (30). Für die HPLC-Analyse wurden die Plasmaproben im Verhältnis 1:100 mit einem Puffer gemischt; ein Volumen von 20 µL wurde dem HPLC-System zugeführt und entlang einer Anionentauscher Säule (Shodex) bei 35°C mit einer mobilen Phase aus 50 mM Natriumacetat und 400 mM Natriumsulfat aufgetrennt. Zur Elution wurde ein Gradient von 0–6% Ethanol mit einer Flußrate von 1 mL/min verwendet. Die Detektion erfolgte anhand der Fluoreszenz bei 280 nm (Exzitation) und 340 nm (Emission). Für die Quantifizierung wurde die Fläche unter den Peaks der individuellen Detektionskurven durch das Einpassen von Gauss’schen Glockenkurven verglichen. Die Bestimmung von Malondialdehyd (MDA) erfolgte ebenfalls mittels HPLC, anhand des von Pilz et al. 2000 beschriebenen Verfahrens (19). Die Messungen erfolgten nach Derivatisierung mit 2,4-Dinitrophenylhydrazin. Die alkalische Hydrolyse des proteingebundenen MDA erfolgte mit einer Natriumhydroxid-Lösung. Anschließend wurden die Proben mit 35%-iger Perchlorsäure deproteinisiert und nach Zentrifugation (14.000 G/2 Minuten) der Überstand mit 2,4-Dinitrophenylhydrazin (DNPH) inkubiert. Für die Standards wurden 25 µL Tetramethoxypropan in 100 mL bidestilliertem Wasser gelöst. 200 µL dieser Lösung wurden zwecks Hydrolyse mit 10 mL 1-%iger Schwefelsäure vermengt. Der dadurch entstehende MDA-Standard von 20 nmol/mL wurde mit 1%-iger Schwefelsäure auf die endgültigen Standardkonzentrationen verdünnt. Die Proben, die derivatisierten MDA-Standard-Lösungen (0.625 nmol/mL-10 nmol/mL), sowie Blindproben wurden dem HPLC-System zugeführt. Die mobile Phase bestand aus 0,2%-iger Essigsäurelösung mit 50% Acetonitril. Die Detektor-Signale wurden bei einer Wellenlänge von 310 nm
35
aufgezeichnet. Zur quantitativen Auswertung wurden die jeweiligen Peakhöhen herangezogen und daraus die Standardkurven erstellt, mit deren Hilfe die MDA-Konzentrationen berechnet wurden. Das Li-Heparin-Blut für die Messwerte der klinischen Chemie wurde nach Routineverfahren analysiert und das Blutbild mit einem Hämatologie-Analysator bestimmt (Sysmex KX-21N).
ERGEBNISSE
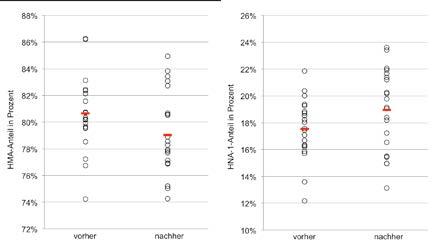
Nach dem Ende der Analysen konnten die Messwerte von 21 Probanden und Probandinnen (14 M, 7 F) ausgewertet werden. Die Hauptzielgröße dieser Arbeit war die Änderung des Verteilungsmusters der einzelnen Albuminfraktionen. Die mittlere HMA-Fraktion verringerte sich statistisch signifikant von 80,7% auf 79,0%. Das bedeutet eine absolute Verringerung um 1,6%, was einer relativen Abnahme von 2,0% (p=0,003) entsprach. Dabei gab es keine signifikanten Unterschiede zwischen Männern und Frauen (mittlere Änderung m=–0,01; w=–0,01; p=0,56). Der Median der erhobenen HMA-Anteile lag vor der Hypoxie-Exposition bei 80,3% und nach dem Aufenthalt in der Höhenkammer bei 78,3%. Betrachtet man allerdings den HMA-Abfall jeweils getrennt, war dieser bei Männern nicht signifikant (p=0,067), bei den Frauen allerdings sehr wohl (p=0,008). Insgesamt kam es bei 16 Probanden und Probandinnen zu einer Abnahme und bei 5 Versuchspersonen zu einem Anstieg der HMA-Fraktion. Die HMA-Anteile vor und nach der Exposition wurden in Abbildung 2 grafisch dargestellt. HNA-1 stieg hingegen durchschnittlich in gleichem Umfang wie das HMA sank. Im Mittel betrug die HNA-1-Fraktion vor dem Versuch 17,5% und nach der Hypoxie Exposition 19,0%. Somit betrug der absolute Anstieg 1,4%, was einem relativen Anstieg von 8,1% entsprach (p=0,011). Der Median der erhobenen HNA-1-Anteile stieg von 17,6% vor der Hypoxie-Exposition auf 19,1% danach, wobei sich kein signifikant unterschiedlicher Anteil zwischen den Geschlechtern ergab (HNA-1-Anstieg m=0,01; w=0,02, p=0,65); auch hier war der Anstieg allein auf die Männer bezogen statistisch nicht signifikant (p=0,110), bei den Frauen lag dieser an der Signifikanzgrenze (p=0,035). Im Gegensatz zu den Ergebnissen der HMA-Fraktion kam es bei 16 Versuchspersonen zu einem Anstieg und bei 5 Versuchspersonen zu einem Absinken der HNA-1-Fraktion. Die Änderungen von HNA-1 wurden in Abbildung 2 grafisch dargestellt. Die Änderungen von HMA korrelierten statistisch signifikant, jedoch invers mit den Änderungen von HNA-1 (r=–0,94, p=0,001).
36
Abb. 2: HMA- und HNA-1-Anteile vor und nach Hypoxie-Exposition (rot: Mittelwerte).
Der prozentuale Anteil von HNA-2 war bei allen Teilnehmern sehr gering. Vor Hypoxieexposition lag der Anteil von HNA-2 durchschnittlich bei 1,8%, nach der 4-stündigen Exposition betrug HNA-2 2,0%. Das entsprach einer absoluten Steigerung von 0,2% und einem relativen Anstieg von 11,6%. Dieser hohe relative Anstieg war zum überwiegenden Teil dem nur geringen Ausgangswert von HNA-2 zuzuschreiben und könnte auch durch den bei diesen geringen Absolutwerten großen Messfehler hervorgerufen worden sein. Der Anstieg von HNA-2 war statistisch nicht signifikant (p=0,25). Der Median der gemessenen HNA-2-Fraktionen stieg von 1,6% vor der Hypoxie-Exposition auf 1,9% danach. Es wurden keine wesentlichen geschlechtsspezifischen Unterschiede detektiert. Als weiterer Indikator für oxidativen Stress wurde Malondialdehyd (MDA) bestimmt, wobei ein nicht signifikanter Anstieg um 0,1 nmol/mL von 1,4 nmol/ mL auf 1,5 nmol/mL registriert wurde (p=0,19). Nur bei 12 der 21 Probanden und Probandinnen kam es zu einem Anstieg, bei 8 Teilnehmern nahm der Malondialdehydgehalt sogar ab, und in einem Fall blieb MDA unverändert. Es gab auch keine relevanten geschlechtsspezifischen Unterschiede. Vier der fünf Versuchspersonen, bei denen der HMA-Anteil im Laufe des Versuches anstieg, befanden sich unter jenen 9 Versuchspersonen, bei denen MDA im gleichen Zeitraum abfiel bzw. unverändert blieb. Eine Person mit ge-
37
-1,0
Änderung des HMA-Anteils in % -0,5 0,0 0,5 1,0 1,5 6%
4%
2%
0%
-2%
-4%
Änderung des MDA in nmol/mL -6%
Abb. 3: Änderungen der MDA-Konzentrationen in Relation zu Änderungen des prozentuellen HMA-Anteils.
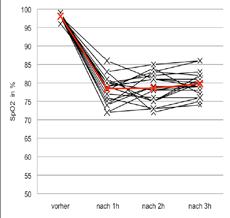
stiegenem HMA-Anteil hatte zudem einen nur minimalen MDA-Anstieg von 0,05 mmol/L (Abb. 3). Durchschnittlich lagen die SpO2-Werte nach 1, 2 und 3 Stunden in der Kammer bei 78,4%, 78,6% sowie 79,8%. Bei der ersten Messung vor Betreten der Kammer lag der Durchschnitts-SpO2 bei 98,0%. Der Verlauf der Sauerstoffsättigung während der Hypoxie-Exposition bei den Teilnehmern ist in Abbildung 4 dargestellt. Die genaue Begutachtung der individuellen Werte der Versuchspersonen schien aufgrund der eingeschränkten Präzision der Finger-Pulsoxymetrie nicht zielführend. Allerdings zeigten die Durchschnittswerte plausible Dimensionen, welche hier als gute Näherung für das tatsächliche Verhalten der Sauerstoffsättigung herangezogen wurden. Es gab keine signifikanten Unterschiede zwischen den Geschlechtern (p=0,61). Als unspezifischer Marker für eine Stressreaktion wurden weiters die Leukozyten aus dem Blutbild sowohl vor Betreten der Kammer als auch nach der Exposition bestimmt. Im Durchschnitt kam es zu einem Anstieg der Leukozyten von 6,2x103/µL auf 7,4x103/µL. Das ist ein absoluter Anstieg von 1,2x103/
38
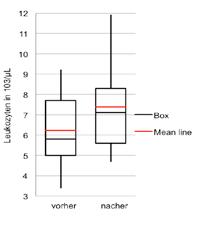
µL und das entspricht einer relativen Steigerung um 18,6%. Diese Steigerung war signifikant (p=0,002). Die Verteilung der Leukozytenwerte vor und nach der Hypoxieexposition ergab eine deutliche Differenz zwischen Männern und Frauen (Abb. 4). Während der Anstieg bei den männlichen Probanden sehr deutlich ausfiel, war ein solcher bei den teilnehmenden Frauen nicht erkennbar. Der Anstieg bei den Männern betrug im Durchschnitt 1,8x103/mL, bei den Frauen kam es sogar zu einer minimalen Abnahme der Leukozytenzahl um 0,1x103/µL. Dieser Unterschied war statistisch signifikant (p=0,007), allerdings war die individuelle Streuung beträchtlich. Die Änderungen der Leukozyten lagen bei den Männern zwischen –0,5x103/µL und +4,3x103/µL, bei den Frauen zwischen –1,4x103/µL und +1,5x103/µL.
Leukozyten in 10 3 / µ L Leukozyten in 10 3 /µL
SpO 2 in % SpO 2 in %
Abb. 4: Boxplot der Leukozyten vor und nach Exposition (linke Seite) und Verlauf der Sauerstoffsättigung der einzelnen Teilnehmer im Zeitverlauf (rechte Seite); rot: Mittelwerte.
Die durchschnittliche Leukozytenanzahl vor dem Versuch betrug bei den Männern 5,7x103/µL und bei den Frauen 7,2x103/µL; dieser Unterschied war statistisch signifikant (p=0,047). Nach der Hypoxie-Exposition betrug die Leukozytenanzahl bei den Männern 7,5x103/µL und bei den Frauen 7,2x103/µL. Durch die deutliche Zunahme bei den Männern war der Unterschied zwischen Männern und Frauen post-expositionell nicht mehr evident (p=0,71).
39
DISKUSSION
Die absolute Abnahme des HMA-Anteiles von 1,6% nach vierstündiger Hypoxieexposition und dem zeitgleichen Anstieg des HNA-1-Anteils um 1,4% scheint recht gering, doch relativiert sie sich an der großen AL-Plasmakonzentration. Auf Basis eben dieser hohen Plasmakonzentration ist ein doch beachtlicher oxidativer Einfluss auf Albumin zu erkennen. Bezogen auf die mittlere AL-Konzentration aller Probanden (4,9 g/dL bzw. 737,3 µmol/L) bedeutet dies eine Abnahme von HMA um 12 µmol/L, was immerhin der doppelten Gesamtkonzentration von Glutathion im Plasma (4,9 – 7,3 µmol/L) entspricht. Diese Änderung ist auch hoch gemessen an der Konzentration von vielen anderen Antioxidantien des Plasmas. So finden sich etwa die reduzierten niedermolekularen plasmatischen Thiole in einem Konzentrationsbereich von 12–20 µmol/L (22). Aus dieser Perspektive betrachtet, erscheint der oxidative Einfluss nach nur vier Stunden auf simulierten 5.000 m Seehöhe doch beachtlich. Während der Hypoxie kam es zu keinem Anstieg des Hauptmarkers der Lipidoxidation, dem MDA. Möglicherweise kommt es erst nach einer längeren Hypoxieexposition zu einem MDA-Anstieg oder die antioxidative Abwehr inklusive dem AL als Redox-Puffer ist imstande, die milde oxidative Belastung soweit abzufangen, dass es zu keiner Lipidoxidation kommt. Es gibt aber auch Hinweise, dass es vor allem in der Phase der Reoxygenierung zu einer deutlichen Zunahme des MDA-Spiegels im Blut kommt (19). In dieser Arbeit wurde die letzte Blutabnahme noch vor der Reoxygenierung durchgeführt, somit liegen keine Daten zu diesem Zeitraum vor. Bei vier Probanden und Probandinnen kam es, entgegen dem Trend und der Erwartung, zu einem Anstieg des HMA. Betrachtet man diese Teilnehmer und Teilnehmerinnen, so fällt auf, dass bei allen zusätzlich auch die MDA-Konzentration sank. Bei einer Versuchsperson kam es zu keiner Änderung des HMA-Wertes, wobei die MDA-Konzentration minimal anstieg. Das könnte ein Hinweis darauf sein, dass diese Versuchspersonen bereits vor dem Betreten der Hypoxiekammer einem oxidativen Stressor (physische Belastung) ausgesetzt waren. Die Regeneration des antioxidativen Abwehrsystems könnte dann gegenüber der milden oxidativen Belastung überwiegen. Auch eine individuelle Disposition zu besserer Hypoxietoleranz ist denkbar. Dass sowohl beim MDA als auch beim HNA-2 kein deutlicher Anstieg während der Hypoxie eintrat, spricht dafür, dass die oxidative Belastung während der Hypoxie eher gering war und mit der großen Menge an reduzierten Thiolen besonders in Form des HMA im Plasma ein potenter und leicht regenerier-
40
barer Redox-Puffer zur Verfügung stand, wofür die Erhöhung der HNA1-Anteile spricht. Teilweise kam es zu großen relativen Anstiegen beim HNA-2, die vermutlich auch auf die geringen Mengen von HNA-2 im Plasma zurückzuführen waren. Gerade beim HNA-2 und seinen geringen Mengen wird auch die verwendete Meßmethode verhältnismäßig ungenau. Auffällig war jedoch ein deutlicher Anstieg der Gesamtleukozytenzahl bei den Männern. Während die mittlere Leukozytenzahl bei den Probandinnen beinahe gleich blieb, stieg diese bei den männlichen Teilnehmern von 5,7x103/µL auf 7,5x103/µL. Trotz einer großen individuellen Streuung war dieser Unterschied signifikant. Vermutlich spielten geschlechtsspezifische Unterschiede in Bezug auf die hypoxische Atemantwort (HVR) eine Rolle. Tierexperimentell konnten Knoferl et al. 2000 in einer Studie mit hypoxieexponierten Mäusen einen deutlicheren Anstieg von IL-6 und TNF-alpha bei den männlichen Versuchstieren nachweisen (31). Ob dieser Effekt auch auf den Menschen übertragbar ist, wurde allerdings nicht untersucht. In der vorliegenden Arbeit gilt es zu beachten, dass die Probandenzahl aus logistischen Gründen gering und das Verhältnis Männer zu Frauen nicht ausgeglichen war. Größer angelegte, speziell für diese Zielgrößen konzipierte Studien wären erforderlich, um die Reproduzierbarkeit der Ergebnisse zu prüfen und nach weiteren kausalen Faktoren zu fahnden. Bei der Betrachtung der Sauerstoffsättigung (SpO2) war die Tatsache auffallend, dass es beträchtliche Unterschiede zwischen den einzelnen Probanden und Probandinnen gab. Auch Letzteres ist vermutlich Ausdruck einer individuell unterschiedlichen Hyperventilationsfähigkeit und respiratorischen Hypoxieantwort. Wegen der höheren Präzision sollte bei zukünftigen Untersuchungen die Sauerstoffsättigung über eine arterielle Blutgasanalyse bestimmt werden. Dadurch könnte durch den paCO2- und pH-Wert auch auf das Ausmaß der reaktiven Hyperventilation geschlossen werden. Natürlich konnte diese Pilotstudie nur erste Hinweise auf die Albuminoxidation in großen Höhen geben. Die geringe Anzahl der eingeschlossenen Versuchspersonen schränkt die Aussagekraft ein. Trotz dieses Vorbehaltes wiesen die Ergebnisse der Untersuchung auf eine deutliche Reaktion des Albumin-Redoxsystems hin und die registrierten Änderungen waren statistisch signifikant. Der kurze Aufenthalt in simulierter Höhe und die Tatsache, dass sich die Teilnehmer in körperlicher Ruhe in der HK befanden, reflektierten auch nur marginal die realen Bedingungen terrestrischer großer Höhen wider. Damit die AL-Oxidation unter Hypoxiebedingungen genauer untersucht werden kann, wären Studien mit größeren Probandenzahlen sowie längeren Expositionszei-
41
ten in einer HK erforderlich. Dabei sollte auch der Phase der Reoxygenierung besondere Aufmerksamkeit zukommen. Im Rahmen definierter sportlicher Belastungen gesunder Männer unter normoxischen Bedingungen konnten Lamprecht et al. bereits vor 10 Jahren auf signifikante Auslenkungen des Albumin-Redox-Status bei gesunden Männern hinweisen (32). Es wäre daher auch sinnvoll, die oxidative Belastung während körperlicher Anstrengung in großen Höhen mit Bedingungen auf Normalhöhe zu vergleichen. Obwohl sich doch deutliche Auslenkungen am Redox-Puffer AL zeigten, gibt es deutliche interindividuelle Streuungen, die darauf schließen lassen, dass nicht alle Individuen im gleichen Ausmaß von der Generation von ROS betroffen sind. Da ROS wichtig für die Stabilisierung von HIF1-a sind, und dieser Transkriptionsfaktor eine wichtige Rolle für die Induktion der Mechanismen während der Höhenanpassung spielt, wäre es durchaus von Interesse, zu untersuchen, ob es einen Zusammenhang zwischen dem Ausmaß der AL-Oxidation und der individuellen Anpassungsfähigkeit an Hypoxie bzw. an große Höhen gibt (10,11).
Abb. 5. Exogene und endogene ROS: Erfordernis für den Akklimatisationsvorgang in der Höhe (Foto W. Domej)

42
Es ist auch vorstellbar, dass Alpinisten, die nur in sehr geringem Ausmaß mit Änderungen der Oxidationsstufe des AL reagieren auch lange Akklimationszeiten aufweisen bzw. sich überhaupt nur sehr schwer auf einer bestimmten Höhenstufe akklimatisieren können. Dadurch wäre mit einer Quantifizierung der AL-Oxidation möglicherweise eine gewisse Prädiktion der individuellen Akklimatisationsfähigkeit auf biochemischem Wege gegeben.
43
LITERATUR
(1) Dosek A., Ohno H., Acs Z., Taylor A.W., Radak Z. High altitude and oxidative stress.
Respir Physiol Neurobiol 2007; 158(2–3): 128–131. (2) Askew E. Work at high altitude and oxidative stress: antioxidant nutrients. Toxicology 2002; 180(2): 107–119. (3) Bakonyi T., Radak Z. High altitude and free radicals. J Sports Sci Med 2004; 3: 64–69. (4)
Sies H. Oxidative stress: Introductory Remarks. In: Helmut Sies (Hrsg.) Oxidative
Stress, Academic Press London, 1985: 1–8.
(5) Sies H., Berndt C., Jones D.P. Oxidative Stress. Annu Rev Biochem 2017; 86: 715–748.
(6) Davies K.J. Oxidative stress: the paradox of aerobic life. Biochem Soc Symp 1995; 61: 1–31.
(7) Bandyopadhyay U., Das D., Banerjee R.K. Reactive oxygen species: oxidative damage and pathogenesis. Curr Sci 1999; 77: 658–666.
(8) Rees M.D., Kennett E.C., Whitelock J.M., Davies M.J. Oxidative damage to extracellular matrix and its role in human pathologies. Free Radic Biol Med 2008; 44(12): 1973–2001.
(9)
Pisoschi A.M., Pop A. The role of antioxidants in the chemistry of oxidative stress: A review. Eur J Med Chem 2015; 97: 55–74. (10) Domej W., Oettl K., Siebenhofer G., Küpper T. Reactive species in hypobaric and normobaric hypoxia. In: Schobersberger W., Schobersberger B., Sumann G., Domej W. (Hrsg.) Jahrbuch 2014 der Österreichischen Gesellschaft für Alpin- und Höhenmedizin, Athesia Tyrolia Druck GmbH, Innsbruck, 2014: 287–310.
(11)
Zepeda A.B., Pessoa A., Castillo R.L., Figueroa C.A., Pulgar V.M., Farías J.G. Cellular and molecular mechanisms in the hypoxic tissue: role of HIF1a and ROS. Cell Biochem Funct 2013; 31(6): 451–459. (12) Prabhakar N.R. Invited Review: Oxygen sensing during intermittent hypoxia: cellular and molecular mechanisms. J Appl Physiol 2001; 90(5): 1986–1994. (13) Turrens J.F. Mitochondrial formation of reactive oxygen species. J Physiol 2003; 552(2): 335–344. (14) Maiti P., Singh S.B., Sharma A.K., Muthuraju S., Banerjee P.K., Ilavazhagan G. Hypobaric hypoxia induces oxidative stress in rat brain. Neurochem Int 2006; 49(8): 709–716. (15) Clanton T.L. Hypoxia-induced reactive oxygen species formation in skeletal muscle. J
Appl Physiol (1985) 2007; 102(6): 2379–2388. (16) Liu X., He L., Stensaas L., Dinger B., Fidone S. Adaptation to chronic hypoxia involves immune cell invasion and increased expression of inflammatory cytokines in rat carotid body. Am J Physiol Lung Cell Mol Physiol 2009; 296(2): 158–166.
44
(17) Schneider C. An update on products and mechanisms of lipid peroxidation. Mol Nutr
Food Res 2009; 53(3): 315–321.
(18) Marnett L.J. Oxygen radicals, lipid peroxidation and DNA damage. Toxicology 2002; 181: 219–222.
(19) Pilz J., Meineke I., Gleiter C.H. Measurement of free and bound malondialdehyde in plasma by high-performance liquid chromatography as the 2,4-dinitrophenylhydrazine derivative. J Chromatogr B 2000; 742(2): 315–325.
(20) Ayala A., Munoz M.F., Arguelles S. Lipid peroxidation: production, metabolism, and signaling mechanisms of malondialdehyde and 4-hydroxy-2-nonenal. Oxid Med Cell
Longev 2014; (Article ID 360438).
(21) Oettl K., Marsche G. Redox State of human serum albumin in terms of cysteine-34 in health and disease. Meth Enzymol 2010; 474: 181–195.
(22) Turell L., Radi R., Alvarez B. The thiol pool in human plasma: the central contribution of albumin to redox processes. Free Radic Biol Med 2013; 65: 244–253.
(23) Taverna M., Marie A., Mira J., Guidet B. Specific antioxidant properties of human serum albumin. Ann Intensive Care 2013; 3(1): 4.
(24) Turell L., Botti H., Carballal S., Radi R., Alvarez B. Sulfenic acid – a key intermediate in albumin thiol oxidation. J Chromatogr B 2009; 877(28): 3384–3392.
(25) Davies K.J.A. An overview of oxidative stress. IUBMB Life 2000; 50(4–5): 241–244.
(26) Peters T. Metabolism: Albumin in the Body. In: Peters T. (Hrsg.) All about albumin – biochemistry, genetics and medical applications, Academic Press, San Diego, 1996: 188–250.
(27) Anraku M., Chuang V.T.G., Maruyama T., Otagiri M. Redox properties of serum albumin. Biochim Biophys Acta 2013; 1830(12): 5465–5472.
(28) Curry S., Mandelkow H., Brick P., Franks N. Crystal structure of human serum albumin complexed with fatty acid reveals an asymmetric distribution of binding sites. Nat
Struct Biol 1998; 5(9): 827–835.
(29) Domej W., Schwaberger G., Rohrer R., Burtscher M., Faulhaber M., Mutschler H.
Simulation of altitude environment: Technique and impact for medicine, training and reseach. A first standardization . In: Schobersberger W, Schobersberger B, Domej W,
Sumann G (Hrsg.) Jahrbuch 2012 der Österreichischen Gesellschaft für Alpin- und
Höhenmedizin, Steigerdruck GmbH, Axams, 2012: 33–72.
(30) Imai H., Era S., Hayashi T., Negawa T., Matsuyama Y. et al. Effect of Propolis Supplementation on the Redox State of Human Serum Albumin during High-Intensity
Kendo Training. Adv Exerc Sport Physiol 2005; 11(3): 109–113.
45
(31) Knoferl M.W., Jarrar D., Schwacha M.G., Angele M.K., Cioffi W.G. et al. Severe hypoxemia in the absence of blood loss causes a gender dimorphic immune response. Am J
Physiol Cell Physiol 2000; 279(6): 2004–2010. (32) Lamprecht M., Greilberger J.F., Schwaberger G., Hofmann P., Oettl K. Single bouts of exercise affect albumin redox state and carbonyl groups on plasma protein of trained men in a workload-dependent manner. J Appl Physiol (1985) 2008; 104(6): 1611–1617.




