
24 minute read
T. Dünnwald
from Jahrbuch 2017
by bigdetail
❙ Tobias Dünnwald ❙
Intermittierende Hypoxie: nützliche Effekte auf das kardiovaskuläre System?
Intermittend hypoxia: beneficial effects on the cardiovascular system?
SUMMARY
Hypoxic conditioning in its various forms has successfully been applied for enhancement of exercise performance and altitude preacclimatization in athletes since many years. However, observed physiological adaptations generated by repeated hypoxic stimuli could have important relevance in the treatment or prevention of a diversity of human diseases. In recent years, there is increasing research investigating the question of potential therapeutic benefits of hypoxic conditioning. Especially, the application of interval hypoxia with short cycles over a period of 2–4 weeks seems to be of interest. Effects generated by the relatively non-invasive method imply improved blood pressure control, increased exercise tolerance and performance as well as improved autonomic control, which have positive impact on cardiovascular health in different ways. At the same time, this type of intermittent hypoxia illustrates to be well tolerated in healthy as well as in patients and is quite straightforward in its application. Keywords: Intermittent hypoxia, cardiovascular system, exercise tolerance, therapy
ZUSAMMENFASSUNG
Hypoxietraining in seinen unterschiedlichen Ausprägungen wird bereits seit vielen Jahren erfolgreich zur Leistungssteigerung von Spitzensportlern sowie zur Präakklimatisation im Bergsport eingesetzt. Die durch den wiederholten Hypoxiereiz erzeugten physiologischen Adaptationseffekte könnten sich jedoch auch besonders bei einer Vielzahl von Erkrankungen bzw. deren Prävention als äußerst nützlich erweisen. In den letzten Jahren wurde daher vermehrt der Frage nach einem potentiellen therapeutischen Nutzen hypoxischer
47
Hypoxic conditioning in i ious forms has successfully been applied performance and altitude preacclimatization in athletes since many years. However, observed physiological adaptations generated by repeated hypoxic stimuli could have important relevance in the treatment or prevention of a diversity of human diseases. In recent years, there is increasing research investigating the question of potential therapeutic benefits of hypoxic conditioning. Especially, the application of interval hypoxia with short cycles over a period of 2-4 weeks seems to be of interest. Konditionierung nachgegangen. Besonders die intervallartige Anwendung Effects generated by the relatively non-invasive method imply improved blood pressure control, von Hypoxie in Ruhe mit kurzer Zyklusdauer über einen Zeitraum von 2–4 Wochen scheint von großem Interesse. Zu entscheidenden Veränderungen der increased exercise tolerance and performance as well as improved autonomic control, which have positive impact on cardiovascular health in different ways. At the same time, this type of intermittent hypoxia illustrates to be well tolerated in healthy as well as in patients and is quite straightforward in relativ nicht-invasiven Methode zählen verbesserte Blutdruckkontrolle, gesteiits application. gerte Belastungstoleranz und Leistungsfähigkeit sowie verbesserte autonome Keywords: Intermittent hypoxia, cardiovascular system, exercise tolerance, therapy
Kontrolle, welche die kardiovaskuläre Gesundheit auf unterschiedliche Art und Weise positiv beeinflussen. Gleichzeitig weist diese Form der intermitZUSAMMENFASSUNG tierenden Hypoxie eine gute Verträglichkeit sowohl bei gesunden als auch bei Hypoxietraining in seinen unterschiedlichen Ausprägungen wird bereits seit vielen Jahren erfolgreich erkrankten Personen auf und ist durchaus unkompliziert in ihrer Anwendung. Schlüsselwörter: Intermittierende Hypoxie, kardiovaskuläres System, Belaszur Leistungssteigerung von Spitzensportlern sowie zur Präakklimatisation im Bergsport eingesetzt. Die durch den wiederholten Hypoxiereiz erzeugten physiologischen Adaptationseffekte könnten sich jedoch auch besonders bei einer Vielzahl von Erkrankungen bzw. deren Prävention als äußerst tungstoleranz, Therapie nützlich erweisen. In den letzten Jahren wurde daher vermehrt der Frage nach einem potentiellen therapeutischen Nutzen hypoxischer Konditionierung nachgegangen. Besonders die intervallartige Anwendung von Hypoxie in Ruhe mit kurzer Zyklusdauer über einen Zeitraum von 2-4 Wochen HINTERGRUND scheint von großem Interesse. Zu entscheidenden Veränderungen der relativ nicht-invasiven Methode zählen verbesserte Blutdruckkontrolle, gesteigerte Belastungstoleranz und Leistungsfähigkeit sowie verbesserte autonome Kontrolle, welche die kardiovaskuläre Gesundheit auf unterschiedliche Art und Um einen Sauerstoffmangel im Körper und die damit verbundenen, potentiel-Weise positiv beeinflussen. Gleichzeitig weist diese Form der intermittierenden Hypoxie eine gute len positiven Anpassungsreaktionen auszulösen, kommen bei inaktiven Personen bzw. Patienten grundsätzlich auch all jene im Spitzensport angewendeten Verträglichkeit sowohl bei gesunden als auch bei erkrankten Personen auf und ist durchaus unkompliziert in ihrer Anwendung. Schlüsselwörter: Intermittierende Hypoxie, kardiovaskuläres System, Belastungstoleranz, Therapie
Formen des Hypoxietrainings in Frage (Abb. 1).
Hypobare Hypoxie
Atmosphärendruck↓ Natürliche Höhe oder Unterdruckkammer
Normobare Hypoxie
O2↓, N2↑ Druck ↔ Simulierte Hypoxie Kammer, Zelt, Maske
passiv aktiv
Abb. 1: Formen des HypoxietrainingsAbb. 1: Formen des Hypoxietrainings
aktiv passiv
Studien bei dieser Zielgruppe lassen jedoch einen klaren Fokus auf sogenannte Intermittierende Hypoxie-Anwendungen erkennen, welche durch wiederholte Sauerstoffmangelexpositionen im Wechsel mit Phasen der Normoxie gekennzeichnet sind (1). Hierbei sind Zyklusdauer, Hypoxiegrad Studien bei dieser Zielgruppe lassen jedoch einen klaren Fokus auf sogenannte Intermittierende Hypoxie-Anwendungen erkennen, welche durch wiederholte
Sauerstoffmangelexpositionen im Wechsel mit Phasen der Normoxie gekenn- 1 zeichnet sind (1). Hierbei sind Zyklusdauer, Hypoxiegrad und Gesamtdauer der Hypoxiephasen sowie Dauer der Normoxiephasen nicht vordefiniert. Die positiven kardiovaskulären Effekte von prolongierten Höhenaufenthalten in natürlicher Höhe sind zwar bekannt (2), jedoch kann diese Art der Höhenex-
48
position besonders bei Patienten mit einem erhöhten medizinischen Betreuungsaufwand, zusätzlichem Reiseaufwand sowie daraus resultierenden hohen Kosten in Verbindung stehen. Hinzu kommt eine hohe Variabilität aufgrund unterschiedlicher geographischer und klimatischer Bedingungen, sodass insgesamt der prolongierte Höhenaufenthalt in natürlicher Höhe für eine zukünftige, standardisierte, medizinische Therapiemaßnahme, welche möglichst massentauglich angewendet werden kann, eher ungeeignet scheint (3).
INTERMITTIERENDE HYPOXIE (IH) UND KARDIOVASKULÄRE GESUNDHEIT
Blickt man vornehmlich auf Studien, welche sich primär mit kardiovaskulären Effekten intermittierender Hypoxie bei inaktiven Personen bzw. Patienten mit unterschiedlichen Erkrankungen beschäftigt haben, so können hinsichtlich eingesetzter Hypoxie-Protokolle zumindest grob drei unterschiedliche Formen voneinander abgegrenzt werden: 1.) kontinuierliche IH in Ruhe ≥30 Minuten bis zu mehreren Stunden (meist 3–4h) pro Tag, hypobar oder normobar, für 2–6 Wochen; 2.) IH in Ruhe mit kurzen Hypoxiezyklen von 2–10 Minuten im Wechsel mit etwa gleichlangen Phasen der Normoxie für 40–90 Minuten pro Tag über 2–5 Wochen; 3.) kontinuierliche intermittierende Hypoxie in Kombination mit Belastung für 30 min bis zu 2 Stunden pro Tag für mehrere Tage bis Wochen (vereinzelt bis zu mehreren Monaten) (Abb. 2).
Abb. 2: Eingesetzte Hypoxieprotokolle bei inaktiven Personen und Patienten hinsichtlich kardiovaskulärer Gesundheit.
49
Grundsätzlich entscheidet die Wahl des Hypoxieprotokolls und damit die “Dosis“ über optimalen Nutzen (Adaption) oder schlimmstenfalls Maladaption einer IH-Anwendung. Dies zeigt sich recht deutlich am Beispiel der durch obstruktive Schlafapnoe (OSA) induzierten chronischen intermittierenden Hypoxie, welche mit nachteiligen kardiovaskulären, respiratorischen sowie metabolischen Veränderungen einhergehen kann (4). So kommt es bei OSA zu sehr kurzen (ca. 30 sec.) jedoch schweren Hypoxieexpositionen (inspiratorische Sauerstofffraktion (FiO2):2–8%), welche mit großer Wiederholungszahl pro Tag (mehrere hunderte) stattfinden (4). OSA stellt eine reine Stressreaktion dar, bei der keine Zeit für einen kompensatorischen Effekt bleibt. Ein Akklimatisationsprozess kann daher nicht stattfinden. Vielmehr kann ein derartiger Hypoxiereiz über eine Steigerung der Sympathikusaktivität bei gleichzeitiger Reduktion der Baroreflexsensitivität in letzter Konsequenz zur Entstehung einer Hypertonie führen sowie das kardiovaskuläre Risiko (Infarkt, Schlaganfall, Arrhythmien) steigern (5,6). Im Gegensatz dazu zielen länger andauernde Expositionen (5min bis mehrere Stunden), welche jedoch mit deutlich geringerer Wiederholungszahl pro Tag sowie niedrigerem Hypoxiegrad (FiO2: 10–15%) stattfinden, auf einen starken kompensatorischen Effekt ab. Inwieweit die IH-Expositionen das kardiovaskuläre System beeinflussen können, soll im Folgenden genauer beleuchtet werden.
1) Kontinuierliche IH in Ruhe mit einer Dauer von ≥ 30 Minuten bis zu mehrere Stunden/Tag, 2–6 Wochen:
Insgesamt hat sich nur eine geringe Anzahl an Studien mit kardiovaskulären Auswirkungen derartiger Hypoxieexpositionen bei Patienten oder inaktiven Personen auseinandergesetzt. Den größten Anteil stellen hierbei Untersuchungen mit hypobaren Hypoxieanwendungen, die für eine Dauer von 30 Minuten bis zu 4 Stunden eingesetzt wurden. Eine signifikante Abnahme des arteriellen Blutdruckes konnte bereits nach 30 minütigen Anwendungen, welche über einen Zeitraum von 3 Wochen durchgeführt wurden, bei Patienten mit grenzwertiger Hypertonie beobachtet werden (7). Ähnlich positive Effekte auf den systolischen (–14%) sowie diastolischen Blutdruck (–8%) zeigte sich bei etwas längerer Expositionsdauer (3h) bei Patienten mit Grad-1-Hypertonie (8). Patienten mit koronarer Herzerkrankung (KHK) wiesen nach den hypobaren IH-Expositionen eine verbesserte myokardiale Perfusion (9) sowie ein verbessertes Lipidprofil auf (Abnahme von Gesamtcholesterin und LDL, Steigerung von HDL), wobei das Ausmaß des Effektes positiv mit der Höhe der Ausgangslevel korrelierte (10). Positive kardiovaskuläre Effekte zeigten zudem Saeed et
50
al. bei Patienten mit stabiler chronischer Herzinsuffizienz, welche unter normobaren Bedingungen durchgeführt wurde (11). Hierbei war nicht nur ein Trend hinsichtlich Verbesserung der linksventrikulärer Ejektionsfraktion zu beaobachten, sondern auch eine signifikante Steigerung der Leistungsfähigkeit (Verbesserung im 6-Minuten Gehtest, Zunahme von VO2max und Belastungszeit; (11). Hervorzuheben gilt, dass die festgestellten Verbesserungen bei dieser Studie nicht nur unmittelbar nach Vollendung der Intervention erzielt wurden, sondern auch 4 Wochen danach noch anhielten. Inwieweit der gewählte Hypoxiegrad Hämodynamik und Belastungstoleranz bei untrainierten, inaktiven Personen beeinflusst, war Gegenstand der Untersuchungen von Wang et al. (12–14). Bei Anwendungen mit einem FiO2 von 15% (2733m simulierte Höhe) für eine Stunde pro Tag zeigte sich sowohl nach vier als auch nach acht Wochen eine deutliche Zunahme der VO2max, der submaximalen Leistungsfähigkeit, der pulmonalen Ventilation sowie eine reduzierte pro-inflammatorische Zytokinreaktion auf anstrengende Belastung (12,13). Im Gegensatz dazu wurde bei Absenkung des FiO2 auf 12% (4.500 m) bereits nach vier Wochen eine Reduktion hyperämischer Effekte, eine gesteigerte Lipidperoxidation, eine Abnahme der Vitamin E-Level sowie eine Reduktion der vaskulären Endothelfunktion festgestellt (12). Bei Anwendung des gleichen Protokolls (FiO2:12%) über einen Zeitraum von 8 Wochen zeigte sich jedoch eine Abnahme der pro-inflammatorischen Zytokinreaktion auf Belastung bei gleichzeitiger Zunahme anti-inflammatorischer Zytokine (Interleukin-6, Interleukin-10) in Ruhe (13). Eine verallgemeinernde Aussage zur Favorisierung des einen oder anderen Protokolls (i.e. Hypoxiegrad) ist aber aufgrund der unzureichenden Datenlage nicht möglich. Gründe für die geringe Anzahl an in hypobarer Hypoxie durchgeführten Studien, welche sich auf kardiovaskuläre Effekte durch kontinuierliche IH-Expositionen fokussieren, sind möglicherweise auf nicht selten auftretende Nebeneffekte zurückzuführen, die teilweise bei bis zu einem Drittel der Patienten berichtet wurden (6). Hierzu zählen u.a. Kopfschmerzen, Angina Pectoris oder Herzrhythmusstörungen (6). Zudem besteht bei Mehrplatzkabinen die Schwierigkeit, die Hypoxiedosis individuell anzupassen.
2) IH in Ruhe mit kurzen Hypoxiezyklen von 2–10 Minuten im Wechsel mit etwa gleichlangen Phasen der Normoxie für 40–90 Minuten pro
Tag über 2–5 Wochen:
Im Vergleich zu längeren IH-Anwendungen scheinen kürzere IH-Interventionen mit Maskenatmung eine unkomplizierte und kostengünstige normobare
51
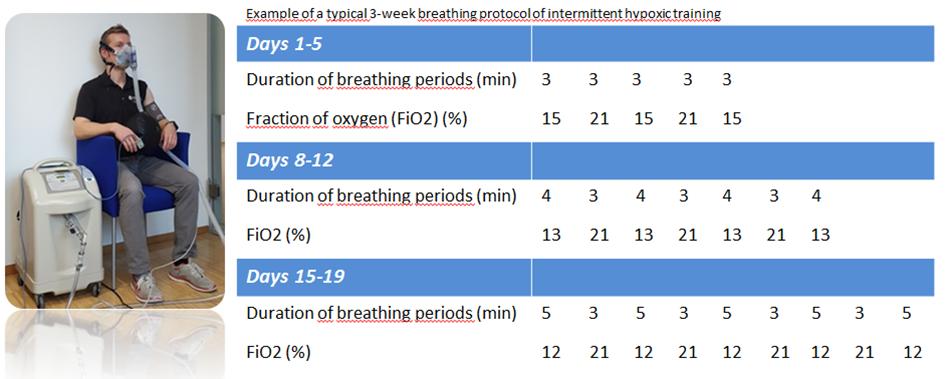
der Normoxie für 40 90 Minuten pro Tag über 2 5 Wochen: Im Vergleich zu längeren IH-Anwendungen scheinen kürzere IH-Interventionen mit Maskenatmung eine unkomplizierte und kostengünstige normobare IH-Maßnahme darzustellen. Bei einigen Protokollen erfolgt eine sukzessive, wöchentliche Steigerung des Hypoxiegrades bei g IH-Maßnahme darzustellen. Bei einigen Protokollen erfolgt eine sukzessive, wöchentliche Steigerung des Hypoxiegrades bei gleichzeitiger Zunahme der Zunahme der Dauer sowie Anzahl der Zyklen (Abb.3).
Dauer sowie Anzahl der Zyklen (Abb. 3).
Tage 1–5 Tage 1-5
Dauer der Atemperiode (min) 3 3 3 3 3 Dauer der Atemperiode (min) Sauerstofffraktion (FiO2) (%) 15 21 15 21 15Sauerstofffraktion (FiO2) (%)
Tage 8–12 Tage 8-12
Dauer der Atemperiode (min) 4 3 4 3 4 3 FiO2 (%) 13 21 13 21 13 21
3 3 3 3 3 15 21 15 21 15
4 13
Tage 15–19
Dauer der Atemperiode (min) 5 3 5 3 5 3 5 3 FiO2 (%) 12 21 12 21 12 21 12 21 Abb. 3: Beispiel für ein typisches 3-wöchiges intermittierendes Atem-Protokoll (mod. nach Burtscher et al. (15)).
5 12
Unter Einsatz eines solchen Protokolls untersuchten Haider et al. erstmalig kardiovaskuläre Effekte von IH bei Patienten mit milder chronisch obstruktiver Lungenkrankheit (COPD) (16). Dabei wurde unter anderem eine Steigerung des RR-Intervalls auf ein vergleichbares Level gesunder Kontrollpersonen beobachtet. Neben einer leichten (nichtsignifikanten) Absenkung des systolischen Blutdrucks konnte außerdem ein positiver Einfluss auf die eingangs reduzierte Baroreflexsensitivität (BRS) gezeigt werden, ebenfalls in Richtung normaler Werte. Diese Ergebnisse sind insofern relevant, da eine reduzierte BRS mit einem erhöhten Risiko kardiovaskulärer Morbidität sowie Mortalität, Herzrhythmusstörungen und Schlaganfall einhergehen kann (17). Ein antihypertensiver Effekt durch IH konnte außerdem bei Patienten mit Grad I Hypertonie festgestellt werden. Die auf Normalniveau reduzierten systolischen und diastolischen Blutdruckwerte waren zusammen mit einer gesteigerten Stickoxid (NO)-Synthese bei 85% der Patienten auch 3 Monate nach Beendigung der Intervention noch zu beobachten (18). Der positive Effekt auf den diastolischen Blutdruck war dabei ausgeprägter, wenn die Dauer der Hypertonie-Erkrankung weniger als 5 Jahre betrug. Bei aktiven, gesunden älteren Personen (60–74 Jahre) scheint hingegen eine Beeinflussung des Blutdruckes zumindest nach einer 10-tägigen Anwendung von IH im Gegensatz zur Gruppe der inaktiven Personen, welche eine signifikante Reduktion des arteriellen Blutdrucks
52
aufzeigten, nicht gegeben zu sein (19). Ein Ausbleiben des Effektes auf die mikrovaskuläre Endothelfunktion bei der Gruppe der gesunden aktiven Personen wurde darauf zurückgeführt, dass körperliches Training per se bereits die mikrovaskuläre Endothelfunktion steigert (19). Dass eine Abnahme des systolischen Blutdruckes auch bei übergewichtigen und teilweise adipösen Personen erreicht werden kann, zeigten unlängst Costalat et al. (20). Im Gegensatz zu den bereits angeführten Studien wurden hierbei die Dauer der Hypoxie- und Normoxiephasen individuell angepasst. Dementsprechend wurden die Hypoxiephasen jeweils erst dann beendet und die Phasen der Normoxie bis zu einen SpO2 von 95% eingeleitet, wenn ein Schwellenwert des SpO2 von 70% erreicht wurde. Ziel war es, über die Dauer einer Anwendung einen durchschnittlichen SpO2-Wert von 80% zu erreichen (Abb. 4). Aufgrund der durch die IH-Exposition unveränderten Herzfrequenzvariabilitätsparameter (rMSSD) sowie Ruhe-Herzfrequenz wurde hierbei angenommen, dass der Blutdruck-Abfall nicht über eine veränderte BRS zu erklären ist, sondern vielmehr die Folge einer NO Steigerung ist (20).
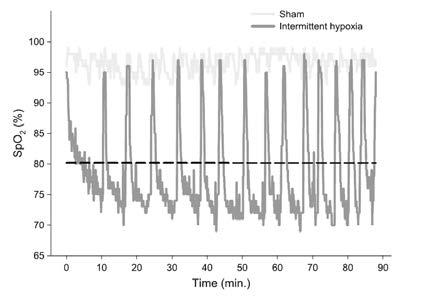
Abb. 4: Exemplarischer Verlauf individueller Hypoxie- und Normoxiephasen während einer einzelnen IH Anwendung eines Probanden (20).
53
Weiterhin konnte bei inaktiven Personen nach 4-wöchiger IH-Exposition mit sukzessiver Reduktion des FiO2 (16–12%) eine verbesserte parasympathische Modulation des Autonomen Nervensystems (ANS) mit reduzierter Ruheherzfrequenz (–10%), gesteigerter rMSSD (+72%) sowie verlängertem RR-Intervall (+8%) als adaptive Anpassungsreaktion an die wiederkehrenden Hypoxiereize gezeigt werden (21). Möglicherweise hat daher eine zu geringe Dauer der IH Anwendung (2 Wochen) trotz eines insgesamt moderat höheren Hypoxiegrades bei der Untersuchung von Costalat et al. verhindert, dass Veränderungen im Bereich der Herzfrequenz oder der rMSSD aufgetreten sind (20). Ein positiver Effekt auf das kardiovaskuläre System konnte außerdem erst kürzlich bei Patienten mit Prädiabetes festgestellt werden. Die durch eine dreiwöchige IH-Intervention gesteigerte Toleranz gegenüber akuter Hypoxie (22) äußerte sich in einer Reduktion des hypoxie-induzierten Anstieges des systolischen Blutdrucks sowie in einer signifikant verminderten Herzfrequenz während akuter Hypoxieexposition sowohl unmittelbar nach der Intervention als auch noch ein Monat nach deren Beendigung (22). Beachtliche antihypertensive Effekte bei Patienten mit Hypertonie Grad 1 und 2 wurden in einer Übersichtsarbeit von Serebrovskaya et al. beschrieben (6). So zeigten sich Reduktionen des systolischen (10–30 mmHg) sowie des diastolischen Blutdrucks (10–15 mmHg), welche bis zu 6 Monate und mitunter sogar bis zu einem Jahr andauerten (6). So sollen die IH-Anwendungen nicht nur den antihypertensiven Effekt blutdrucksenkender Medikamente verstärken, sondern teilweise auch zur Absetzung dieser geführt haben (6). Die angeführten Studien weisen zwar teilweise recht hohe Stichprobenumfänge auf, sind aber überwiegend in russischer Sprache verfasst und oftmals ohne Kontrollgruppen durchgeführt. Die beobachteten positiven Effekte durch IH können daher möglicherweise auch auf eine anhaltende Medikamenteneinnahme zurückzuführen sein. Generell lässt sich die Wirkung von IH auf die Blutdruckreaktion einerseits dadurch erklären, dass diese positive Form der IH zu einem nur moderaten Anstieg reaktiver Sauerstoffradikale (ROS) und damit zu einer gesteigerten zytoprotektiven, antioxidantischen Enzymaktivität in den Erythrozyten führt (23–25). Auf der anderen Seite ist von adaptiven Veränderungen im NO-Stoffwechsel auszugehen, die z.B. über eine Absenkung der intrazellulären Kalzium (CA2+)-Konzentration zur Vasodilatation führen (26). Zudem können IH-Anwendungen den parasympathischen Tonus steigern (27).
54
Inwieweit die kardiovaskuläre Gesundheit außerdem durch IH beeinflusst werden kann, zeigt sich bei verschiedenen Erhebungen zur Wirkung von IH auf die körperliche Leistungsfähigkeit. So ist eine Steigerung der submaximalen Leistungsfähigkeit bzw. Belastungstoleranz nicht nur bei älteren Personen mit und ohne Koronare Herzerkrankung (KHK) zu beobachten (28), sondern auch bei Patienten mit milder COPD (16) und bei übergewichtigen und/oder inaktiven Personen (19,21,29). Charakteristisch hierbei sind die Abnahme von Herzfrequenz, systolischem Blutdruck sowie Laktatlevel während submaximaler Belastung (15,19,21,28). Verbesserungen der maximalen Sauerstoffaufnahme (VO2max) aufgrund passiver IH- Expositionen konnten hingegen lediglich in der Studie von Balykin et al. mit übergewichtigen und inaktiven Personen festgestellt werden (29). Da der Effekt durch IH auf die Leistungsfähigkeit bei Erkrankten höher als bei gesunden Personen zu sein scheint (39), könnte das Ausmaß der VO2max-Veränderungen vom Gesundheitszustand der Versuchspersonen zu Studienbeginn abhängen. Die Verbesserungen im Bereich der Leistungsfähigkeit lassen sich vermutlich auf Veränderungen wie z.B. Steigerung der Lungendiffusionskapazität, effizientere Ventilation, Zunahme der totalen Hämoglobinmasse und/oder Abnahme der relativen Sympathikus-Aktivität zurückführen (15). Auch eine veränderte Sensitivität der beta-Adrenorezeptoren sowie eine Zunahme der parasympathischen Aktivität durch reduzierte vagale Abschwächung wurde in diesem Zusammenhang diskutiert (15). Nützliche Effekte auf das Herzkreislaufsystem durch IH konnten jedoch auch im Bereich des autonomen Nerversystems (ANS) erzielt werden. Neben den bereits erwähnten Verbesserungen von BRS und hyperkapnischer Atemantwort (HCVR) bei COPD-Patienten (16) konnte eine Steigerung der Herzfrequenzvariabilität bei inaktiven Personen (21), eine Reduktion der Sympathikusaktivität und Steigerung der Parasympathikusaktivität bei inaktiven, übergewichtigen Personen (29) sowie eine Zunahme der Atemantwort auf Hypoxie (HVR) bei gesunden Personen festgestellt werden (27,30–32). Positiv zu bewerten sind diese Ergebnisse auch insofern, als dass eine verbesserte HVR bei Patienten mit kardiorespiratorischen Erkrankungen mit einer gesteigerten Belastungstoleranz einhergehen kann (33).
Verträglichkeit
Insgesamt wurden IH-Anwendungen mit Maskenatmung und entsprechender kurzer Zyklusdauer sowohl von Patienten als auch gesunden (inaktiven) Personen innerhalb der hier angeführten Studien gut toleriert. Wenig Information liegt jedoch zur Reaktion des Herzkreislaufsystems während den einzelnen
55
Hypoxiezyklen vor. Faulhaber et al. haben in diesem Zusammenhang die kardiovaskuläre Beanspruchung einer 3-wöchigen IH-Intervention bei Patienten mit COPD untersucht (34). Beobachtet wurde ein entsprechend dem progressiven, wöchentlich gesteigerten Hypoxiegrad (FiO2: 15–12%, siehe Abb. 3) zunehmender, moderater Anstieg der Herzfrequenz (durchschnittlich maximal um 5,3%) (34). Veränderungen im Bereich des Blutdruckes waren hingegen unwesentlich. Ein Effekt, der auf eine periphere Vasodilatation als kompensatorische Antwort auf die hypoxie-induzierte Steigerung des Herzminutenvolumens zurückzuführen ist (34). Ein solcher Kompensationseffekt könnte jedoch bei Patienten mit Hypertonie etwas abgeschwächter ausfallen und zu leicht höheren Blutdruckwerten während der Hypoxieexposition führen. Bei der Frage nach der subjektiven Befindlichkeit einer ebenfalls 3-wöchigen IH-Anwendung, welche bei inaktiven Personen durchgeführt wurde, gaben die meisten Teilnehmer an, diese als angenehm empfunden zu haben. Einige berichteten neben Müdigkeit von einer unkomfortablen Atmung (insbesondere das Bedürfnis einer schnelleren oder tieferen Atmung), Kopfschmerz als Nebeneffekt wurde nur selten angeführt (21).
c) Kontinuierliche IH in Kombination mit Belastung für 30 Minuten bis zu 2 Stunden pro Tag für mehrere Tage bis 5 Wochen (selten bis zu mehreren Monaten):
Da körperliche Aktivität per se das Herzkreislaufsystem positiv beeinflusst, liegt es nahe, Belastungen auch während einer Hypoxieexposition durchzuführen um dadurch potentielle additive Effekte zu erzielen. Einige Studien untersuchten die Auswirkungen von Ausdauertraining in Hypoxie bei gesunden, inaktiven Personen, jedoch nicht bei Patienten. Eine im Vergleich zur in Normoxie trainierenden Kontrollgruppe deutlich größere Verbesserung der aeroben Leistungsfähigkeit konnte bei Studien festgestellt werden, bei jenen die Trainingsintensität in beiden Gruppen ident war (simulierte Höhe von 2.700 m bis 4.500 m) (14,29,35,36). Im Gegensatz dazu zeigte sich kein Unterschied bezüglich des Ausmaßes der Leistungssteigerung bei den Erhebungen von Engfred et al. (37), Emonson et al. (38), Geiser et al. (39) und Vogt et al. (40). Diese gegensätzlichen Ergebnisse können einerseits darauf zurückgeführt werden, dass in simulierter Höhe teilweise mit einer vergleichsweise niedrigeren absoluten Leistung trainiert wurde (37,38). Auf der anderen Seite können individuelle Unterschiede in der Hypoxiereaktion sowie Unterschiede im Trainingszustand dafür verantwortlich sein. Je niedriger das Leistungsniveau zu Beginn der Anwendungen, desto niedriger muss der Belastungsreiz insgesamt
56
sein, um bereits relativ große Veränderungen im Bereich des Leistungsniveaus erzielen zu können. Auch bei deutlicher Steigerung der Dauer der Intervention (≥10 Wochen bis zu mehreren Monaten) konnte kein Vorteil auf die Leistungsfähigkeit durch Training in Hypoxie festgestellt werden (41). Auch dann nicht, wenn zusätzlich zur 30-minütigen Belastungsphase eine anschließende, 90-minütige Phase passiver Hypoxie erfolgte (42). Insgesamt scheint ein Training in Hypoxie jedoch zumindest ebenso effektiv zur Verbesserung der Leistungsfähigkeit wie ein Training in Tallage zu sein (42,43). Hervorzuheben ist die bei Training in Hypoxie dadurch vergleichsweise niedrigere erforderliche Belastung auf den Bewegungsapparat, um einen effektiven und physiologisch gleichwertigen Belastungsreiz zu erzeugen (43). Verbesserungen im Bereich der autonomen Kontrolle waren indessen nur bei Training in Hypoxie zu beobachten, wenn auch in vergleichbarem Ausmaß passiver Hypoxieexpositionen (29). Hämodynamische Veränderungen zeigten sich interessanterweise ebenfalls nur bei Training in Hypoxie, nicht aber bei Training in Normoxie. So konnte eine Reduktion arterieller Gefäßsteifigkeit bereits bei moderater, simulierter Höhen von 2.000 m bis 2.500 m sowie eine Vasodilatation der Koronargefäße und eine gesteigerte Produktion des vaskulären endothelialen Wachstumsfaktors (VEGF) bei simulierten Höhen von 3.850 m oder 4.500 m festgestellt werden (44,45). Insgesamt könnte die Kombination von derartigen IH-Expositionen mit moderatem Ausdauertraining besonders für Personen mit eingeschränkter Leistungsfähigkeit interessant sein. Limitierend für die Aussagekraft zum Effekt der unterschiedlichen IH-Interventionen auf das Herzkreislaufsystem ist sicherlich die große Heterogenität zwischen den einzelnen Studien selbst. Diese äußert sich in einer hohen Divergenz hinsichtlich Gesundheits- und Fitnesszustand der Versuchsgruppen, Zielsetzung, Dauer, Anzahl und Hypoxiegrad der einzelnen Expositionen sowie Gesamtdauer der IH-Anwendungen. Daher wird es in Zukunft von großer Bedeutung sein, der Frage nach einer optimalen individuellen Dosis, dem Einfluss von Alter, Geschlecht und Gesundheitszustand auf die Wirkung von IH, sowie der Interaktion zwischen IH und Bewegung genauer nachzugehen. Die bisherigen Erkenntnisse speziell in Bezug auf Effekte durch IH in Ruhe mit Maskenatmung mit einer Zyklusdauer von 3–5 Minuten für ca. 1 Stunde pro Tag über 2–4 Wochen sind durchaus vielversprechend. Sei es als vorgeschaltete Maßnahme, um die körperliche Leistungsfähigkeit auf ein Level zu heben, das eine Aufnahme körperlicher Aktivität erleichtert bzw. überhaupt erst wieder ermöglicht oder aber als adjuvante Präventions – oder Therapiemaßnahme, als Ergänzung zu regelmäßiger körperlicher Bewegung.
57
LITERATUR
(1) Neubauer J.A. Invited review: Physiological and pathophysiological responses to intermittent hypoxia. J Appl Physiol (1985) 2001; 90: 1593–1599. (2) Neumayr G., Fries D., Mittermayer M. et al. Effects of hiking at moderate and low altitude on cardiovascular parameters in male patients with metabolic syndrome: Austrian Moderate Altitude Study. Wilderness Environ Med 2014; 25: 329–334. (3) Serebrovskaya T.V., Xi L. Intermittent hypoxia training as non-pharmacologic therapy for cardiovascular diseases: Practical analysis on methods and equipment. Exp Biol
Med (Maywood) 2016; 241(15): 1708–1723. (4) Dempsey J.A., Veasey S.C., Morgan B.J. et al. Pathophysiology of sleep apnea. Physiol
Rev 2010; 90: 47–112. (5) Verges S., Chacaroun S., Godin-Ribuot D. et al. Hypoxic Conditioning as a New Therapeutic Modality. Front Pediatr 2015; 3: 58. (6) Serebrovskaya T.V., Manukhina E.B., Smith M.L. et al. Intermittent hypoxia: cause of or therapy for systemic hypertension? Exp Biol Med (Maywood) 2008; 233: 627–650. (7) Aleshin I.A., Kots Ia I., Tverdokhlib V.P. et al. The nondrug treatment of hypertension patients by their adaptation to periodic hypoxia in a barochamber. Ter Arkh 1993; 65: 23–29. (8) Tin’kov A.N., Konstantinova O.D., Kshniaseva S.K. Efficacy of hypobaric hypoxia in the treatment of arterial hypertension in postmenopausal women. Ter Arkh 2011; 83: 16–19. (9) del Pilar Valle M., Garcia-Godos F., Woolcott O.O. et al. Improvement of myocardial perfusion in coronary patients after intermittent hypobaric hypoxia. J Nucl Cardiol 2006; 13: 69–74. (10) Tin’kov A.N., Aksenov V.A. Effects of intermittent hypobaric hypoxia on blood lipid concentrations in male coronary heart disease patients. High Alt Med Biol 2002; 3: 277–282. (11) Saeed O., Bhatia V., Formica P. et al. Improved exercise performance and skeletal muscle strength after simulated altitude exposure: a novel approach for patients with chronic heart failure. J Card Fail 2012; 18: 387–391. (12) Wang J.S., Chen L.Y., Fu L.L. et al. Effects of moderate and severe intermittent hypoxia on vascular endothelial function and haemodynamic control in sedentary men. Eur J
Appl Physiol 2007; 100: 127–135. (13) Wang J.S., Lin H.Y., Cheng M.L. et al. Chronic intermittent hypoxia modulates eosinophil- and neutrophil-platelet aggregation and inflammatory cytokine secretion caused by strenuous exercise in men. J Appl Physiol (1985) 2007; 103: 305–314.
58
(14) Wang J.S., Wu M.H., Mao T.Y. et al. Effects of normoxic and hypoxic exercise regimens on cardiac, muscular, and cerebral hemodynamics suppressed by severe hypoxia in humans. J Appl Physiol (1985) 2010; 109: 219–229. (15) Burtscher M., Haider T., Domej W. et al. Intermittent hypoxia increases exercise tolerance in patients at risk for or with mild COPD. Respir Physiol Neurobiol 2009; 165: 97–103. (16) Haider T., Casucci G., Linser T. et al. Interval hypoxic training improves autonomic cardiovascular and respiratory control in patients with mild chronic obstructive pulmonary disease. J Hypertens 2009; 27: 1648–1654. (17) Costes F., Roche F., Pichot V. et al. Influence of exercise training on cardiac baroreflex sensitivity in patients with COPD. Eur Respir J 2004; 23: 396–401. (18) Lyamina N.P., Lyamina S.V., Senchiknin V.N. et al. Normobaric hypoxia conditioning reduces blood pressure and normalizes nitric oxide synthesis in patients with arterial hypertension. J Hypertens 2011; 29: 2265–2272. (19) Shatilo V.B., Korkushko O.V., Ischuk V.A. et al. Effects of intermittent hypoxia training on exercise performance, hemodynamics, and ventilation in healthy senior men. High
Alt Med Biol 2008; 9: 43–52. (20) Costalat G., Lemaitre F., Tobin B. et al. Intermittent hypoxia revisited: a promising non-pharmaceutical strategy to reduce cardio-metabolic risk factors? Sleep Breath 2017; Feb 2. doi: 10.1007/s11325-017-1459-8. (21) Lizamore C.A., Kathiravel Y., Elliott J. et al. The effect of short-term intermittent hypoxic exposure on heart rate variability in a sedentary population. Acta Physiol Hung 2016; 103: 75–85. (22) Serebrovska T.V., Portnychenko A.G., Drevytska T.I. et al. Intermittent hypoxia training in prediabetes patients: Beneficial effects on glucose homeostasis, hypoxia tolerance and gene expression. Exp Biol Med (Maywood) 2017; 242: 1542–1552. (23) Asha Devi S., Subramanyam M.V., Vani R. et al. Adaptations of the antioxidant system in erythrocytes of trained adult rats: impact of intermittent hypobaric-hypoxia at two altitudes. Comp Biochem Physiol C Toxicol Pharmacol 2005; 140: 59–67. (24) Meerson F., Pozharov V., Minyailenko T. Superresistance against hypoxia after preliminary adaptation to repeated stress. J Appl Physiol (1985) 1994; 76: 1856–1861. (25) Meerson F.Z., Malyshev I., Zamotrinsky A.V. Differences in adaptive stabilization of structures in response to stress and hypoxia relate with the accumulation of hsp70 isoforms. Mol Cell Biochem 1992; 111: 87–95. (26) Manukhina E.B., Malyshev I., Arkhipenko Iu V. Nitric oxide in the cardiovascular system: its role in adaptive protection. Vestn Ross Akad Med Nauk 2000: 16–21.
59
(27) Bernardi L., Passino C., Serebrovskaya Z. et al. Respiratory and cardiovascular adaptations to progressive hypoxia; effect of interval hypoxic training. Eur Heart J 2001; 22: 879–886. (28) Burtscher M., Pachinger O., Ehrenbourg I. et al. Intermittent hypoxia increases exercise tolerance in elderly men with and without coronary artery disease. Int J Cardiol 2004; 96: 247–254. (29) Balykin M.V., Gening T.P., Vinogradov S.N. Morphological and Functional Changes in Overweight Persons under Combined Normobaric Hypoxia and Physical Training.
Human Physiology 2004; 30: 184–191. (30) Foster G.E., McKenzie D.C., Milsom W.K. et al. Effects of two protocols of intermittent hypoxia on human ventilatory, cardiovascular and cerebral responses to hypoxia.
J Physiol 2005; 567: 689–699. (31) Serebrovskaya T.V. Intermittent hypoxia research in the former soviet union and the commonwealth of independent States: history and review of the concept and selected applications. High Alt Med Biol 2002; 3: 205–221. (32) Serebrovskaya T.V., Karaban I.N., Kolesnikova E.E. et al. Human hypoxic ventilatory response with blood dopamine content under intermittent hypoxic training. Can
J Physiol Pharmacol 1999; 77: 967–973. (33) Hadeli K.O., Siegel E.M., Sherrill D.L. et al. Predictors of oxygen desaturation during submaximal exercise in 8,000 patients. Chest 2001; 120: 88–92. (34) Faulhaber M., Gatterer H., Haider T. et al. Heart rate and blood pressure responses during hypoxic cycles of a 3-week intermittent hypoxia breathing program in patients at risk for or with mild COPD. Int J Chron Obstruct Pulmon Dis 2015; 10: 339–345. (35) Mao T.Y., Fu L.L., Wang J.S. Hypoxic exercise training causes erythrocyte senescence and rheological dysfunction by depressed Gardos channel activity. J Appl Physiol (1985) 2011; 111: 382–391. (36) Katayama K., Sato Y., Ishida K. et al. The effects of intermittent exposure to hypoxia during endurance exercise training on the ventilatory responses to hypoxia and hypercapnia in humans. Eur J Appl Physiol Occup Physiol 1998; 78: 189–194. (37) Engfred K., Kjaer M., Secher N.H. et al. Hypoxia and training-induced adaptation of hormonal responses to exercise in humans. Eur J Appl Physiol Occup Physiol 1994; 68: 303–309. (38) Emonson D.L., Aminuddin A.H., Wight R.L. et al. Training-induced increases in sea level VO2max and endurance are not enhanced by acute hypobaric exposure. Eur
J Appl Physiol Occup Physiol 1997; 76: 8–12. (39) Geiser J., Vogt M., Billeter R. et al. Training high--living low: changes of aerobic performance and muscle structure with training at simulated altitude. Int J Sports Med 2001; 22: 579–585.
60
(40) Vogt M., Puntschart A., Geiser J. et al. Molecular adaptations in human skeletal muscle to endurance training under simulated hypoxic conditions. J Appl Physiol (1985) 2001; 91: 173–182. (41) Pesta D., Hoppel F., Macek C. et al. Similar qualitative and quantitative changes of mitochondrial respiration following strength and endurance training in normoxia and hypoxia in sedentary humans. Am J Physiol Regul Integr Comp Physiol 2011; 301: 1078–1087. (42) Gatterer H., Haacke S., Burtscher M. et al. Normobaric Intermittent Hypoxia over 8 Months Does Not Reduce Body Weight and Metabolic Risk Factors--a Randomized, Single Blind, Placebo-Controlled Study in Normobaric Hypoxia and Normobaric
Sham Hypoxia. Obes Facts 2015; 8: 200–209. (43) Pramsohler S., Burtscher M., Faulhaber M. et al. Endurance Training in Normobaric
Hypoxia Imposes Less Physical Stress for Geriatric Rehabilitation. Front Physiol 2017; 8: 514. (44) Nishiwaki M., Kawakami R., Saito K. et al. Vascular adaptations to hypobaric hypoxic training in postmenopausal women. J Physiol Sci 2011; 61: 83–91. (45) Shi B., Watanabe T., Shin S. et al. Effect of normobaric hypoxia on cardiorespiratory and metabolic risk markers in healthy subjects. Advances in Bioscience and Biotechnology 2013; 4(3): 6.




