

















Julie Boucher
Étienne Meyer

















Isabelle Dumont
Dominic Paul

François Pomerleau
Vincent Roy








Un grand nombre d’exercices et de problèmes bien gradués
Des analyses technologiques avec animations 3D

Des capsules numériques (clics +) qui présentent des compléments d’information variés

Un cahier de révision avec réseaux de concepts et résumés théoriques

Parution en avril 2025







Chapitre 5
La
5.1
Savoir-faire 1 Les opérations de fabrication d’un objet technique
5.2 Les machines simples 17 7
5.3 Les mécanismes de transmission du mouvement 190
5.4 Les mécanismes de transformation du mouvement 196
de synthèse 5 202

Chapitre 7
Chapitre 6
Les systèmes technologiques
6.1 Les caractéristiques d’un système technologique
6.2 Les composantes d’un système technologique
de l’énergie 2
de synthèse 6
7.1
7.2
7.5
Chapitre 8 Les
Chapitre 9
Ce cahier d’apprentissage couvre l’ensemble des concepts prescrits par le programme Science et technologie de la 2e secondaire.
Ce cahier est divisé en quatre univers : l’univers matériel, l’univers vivant, l’univers technologique et l’univers Terre et espace. Chaque univers comporte des chapitres organisés de façon à respecter le plus fidèlement la Progression des apprentissages (PDA). Le cahier se termine par une Révision, un glossaire et un index.
Une citation illustre les contenus de l’univers.


Un court texte d’introduction présente les contenus de l’univers.














Chaque univers se termine par une section ludique proposant des exercices de révision sous forme de jeux (charades, mots entrecroisés, mots cachés, etc.).













Un sommaire détaillé présente le contenu de chacun des chapitres de l’univers.

Un court texte met en contexte les connaissances à acquérir dans le chapitre.
Les concepts de la Progression des apprentissages (PDA) abordés dans le chapitre sont listés.
Des connaissances préalables de 1re secondaire sont présentées.
Les mots en bleu dans le texte sont définis dans le glossaire à la fin du cahier.
DÉFINITION Modèle Représentationimagéed’unevéritéinaccessibleparlessens.
TABLEAU 1 Les caractéristiques d’un bon modèle scientifique CaractéristiqueExemple Évolution du modèle représentant le système solaire
1. Le modèle explique les phénomènes observés. On a longtemps cru que la Terre était le centre du système solaire et que les astres tournaient autour d’elle. Ce modèle permettait



Des capsules historiques ou de connaissances générales sont présentées à l’occasion.
La définition des termes importants est mise en évidence.






Chaque section se termine par des activités en lien avec l’ensemble des concepts étudiés dans la section.
3













Des clics + présentant des compléments d’information variés sont offerts en suppléments numériques.
1.2 Le tableau périodique des éléments
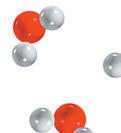
1.2.1 Les éléments et les composés À l’état naturel, on trouve 90 sortes d’atomes. On peut donc comparer la matière à un jeu de construction infiniment petit qui comporte 90 types de briques, les atomes, que l’on peut agencer dans une infinité de combinaisons appelées molécules Chacune de ces briques, donc chaque sorte d’atome, constitue un élément chimique DÉFINITION Élément chimique Substancepureforméed’uneseulesorted’atome.
Pour savoir si une substance est un élément, il faut regarder quelle est son unité de base c’est-à-dire la plus petite partie possible de cette substance. Le schéma ci-dessous te permettra de mieux comprendre les distinctions entre atomes, molécules, éléments et composés. clic
L’unité de base de la substance est-elle un atome ou une molécule

Atome Molécule
La substance est un élément



On la trouve dans le tableau périodique des éléments. Dans cette substance, il y a une multitude d’atomes identiques de cet élément.


EXEMPLES L’argent est un élément En e et son unité de base est l’atome d’argent l’atome d’argent se trouve dans le tableau périodique des éléments.






























Combien de sortes d’atomes contient cette molécule ?
Plusieurs Une seule
La substance est un composé On ne la trouve pas dans le tableau périodique des éléments.



Le dihydrogène (H ) est un élément En e et son unité de base est une molécule composée d’une seule sorte d’atome l’atome












Un pictogramme annonce un enrichissement selon la PDA.



Une rubrique Savoir-faire présente des techniques en lien avec les notions à l’étude ou prescrites dans la section « Techniques » de la PDA.











Questions à choix multiple
1 Parmi les énoncés suivants, lequel ou lesquels décrivent adéquatement le modèle atomique de John Dalton ?
a) La matière est constituée de quatre éléments (eau, air, terre et feu).
b) Tous les atomes d’un même élément sont identiques.
c) Il est possible que des atomes d’éléments différents soient identiques.
d) Les atomes s’assemblent pour former des molécules.
e) Les molécules ont les propriétés des atomes qui les constituent.
f) La matière est constituée de particules indestructibles.
g) Il est impossible de distinguer un atome de sodium d’un autre atome de sodium.
2 À quoi correspond l’unité de masse atomique (u) ? Encercle ta réponse.
a) À la masse d’un gramme d’oxygène
c) À la masse d’une molécule d’eau
b) À la masse d’un atome d’hydrogène d) À un millionième de gramme
3 Parmi les substances suivantes, encercle celle qui n’est pas un élément.
a) Le tungstène b) Le silicium c) L’acier d) L’argent
4 Parmi les énoncés suivants, encercle celui qui n’exprime pas une caractéristique d’un bon modèle scientifique.
a) Il doit être le plus simple possible.
b) Il doit expliquer les résultats des expériences effectuées.
c) Il doit faciliter la prédiction de nouveaux résultats.
d) Il doit confirmer l’intuition des scientifiques.
5 Au cours du 20 siècle, les chimistes ont découvert des atomes de carbone dont la masse était différente des autres atomes de carbone. Encercle l’aspect du modèle de Dalton qui est contredit par cette découverte.
a) Les atomes sont indestructibles.
c) Les atomes d’un même élément sont identiques. b) Les atomes d’éléments différents sont différents. d) Les atomes sont microscopiques.
6 Quel phénomène n’est pas expliqué par le modèle atomique de John Dalton ?
a) Une centrale nucléaire fonctionne en brisant des atomes.
b) Les molécules contiennent des nombres entiers d’atomes.
c) Un échantillon d’or provenant d’Europe a les mêmes propriétés qu’un échantillon d’or provenant d’Amérique.
d) On n’a jamais
À l’aide de questions à choix multiple, à réponse courte et à développement , la Révision fait un survol des connaissances acquises dans le cahier et le Bilan de fin de cycle, un survol des connaissances acquises au 1er cycle du secondaire.
La couleur de la pastille du numéro indique de quel univers provient la connaissance ciblée par la question.
La page du cahier où cette notion est présentée est indiquée.
À l’aide de questions à choix multiple, à réponse courte et à développement , les Activités de synthèse permettent un retour sur l’ensemble des notions présentées dans le chapitre.

« Dans quelques décennies, nous ne serons plus, mais nos atomes existeront toujours, poursuivant ailleurs l’élaboration du monde. » Hubert Reeves
La découverte de l’univers matériel nécessite un voyage au cœur de la matière. Pour exploiter cette dernière, il faut connaître sa structure et son comportement. Par exemple, l’acier inoxydable serait inconcevable sans la connaissance de l’oxydation des métaux. Dans cet univers, tu approfondiras ta compréhension de la matière. Tu verras que moins d’une centaine d’éléments distincts s’agencent pour former les molécules qui constituent la base de toute la matière existante. Cela t’amènera à comprendre les changements qui s’opèrent au cœur de la matière et certains phénomènes de la vie courante : la rouille sur une bicyclette ou l’effervescence d’un comprimé plongé dans l’eau, par exemple.

Ce chapitre présente la construction de la matière à l’échelle de l’infiniment petit. En effet, il est essentiel de bien comprendre la structure de la matière et son organisation pour expliquer certains phénomènes. C’est ainsi que John Dalton a établi le premier modèle atomique en essayant d’expliquer des phénomènes concernant les gaz. Dans ce chapitre, tu étudieras ce modèle et tu verras la manière dont les atomes ont été répertoriés et organisés dans le tableau périodique des éléments. Finalement, tu examineras la façon dont les atomes se combinent entre eux pour former des molécules qui constituent les unités de base de plusieurs substances existantes.

À la fin de ce chapitre, tu seras en mesure de :
décrire le modèle atomique de Dalton ; définir l’atome comme étant l’unité de base de la molécule ; décrire une molécule à l’aide du modèle atomique de Dalton ; représenter la formation d’une molécule à l’aide du modèle atomique de Dalton ; définir un élément comme étant une substance pure formée d’une seule sorte d’atomes ; décrire le tableau périodique comme un répertoire organisé des éléments.
Concept
La matière est tout ce qui possède une masse et occupe un volume. Elle est constituée d’atomes.
La matière existe principalement sous trois états.
Les particules de matière sont en perpétuel mouvement.
Explications
• La masse mesure la quantité de matière.
• Le volume mesure l’espace occupé par la matière.
• L’atome constitue la plus petite particule possible de matière.
• À l’état solide, la matière est pratiquement incompressible et a une forme bien définie, car la position des particules de matière est fixe et celles-ci se touchent les unes les autres.
• À l’état liquide, la matière est pratiquement incompressible et n’a pas de forme définie ; en effet, même si les particules de matière se touchent, elles peuvent glisser les unes sur les autres.
• À l’état gazeux, la matière est compressible et n’a pas de forme définie, car les particules de matière sont espacées et peuvent se déplacer librement.
Le degré d’agitation est mesuré par la température. Ainsi, plus l’agitation des particules d’un échantillon de matière est importante, plus la température de l’échantillon est élevée.
Exemples
Bien que les blocs de fer et de glace occupent le même volume, ils ont des masses différentes.

État solide État liquide
Certaines propriétés de la matière permettent d’identifier les substances ou les groupes de substances.
La combinaison de plusieurs substances sans réaction chimique crée un mélange.
Les points de fusion et d’ébullition, la conductibilité électrique et thermique, et la malléabilité sont des propriétés caractéristiques
État gazeux
Plusieurs techniques facilitent la séparation des constituants d’un mélange.
• Les mélanges peuvent être homogènes (une seule phase visible) ou hétérogènes (plusieurs phases visibles).
• Lorsqu’une substance (soluté) est dissoute dans une autre (solvant), on a une solution
Le choix de la technique dépend de la nature des phases concernées. Ces techniques sont la sédimentation, la décantation, la filtration, l’évaporation et la distillation
























La décantation
























































































Un échantillon d’or et de pyrite sont semblables au premier regard.














Mélange homogèneMélange hétérogène

Pour étudier des réalités partiellement accessibles ou carrément inaccessibles pour nos sens, les scientifiques font appel à la notion de modèle. En d’autres mots, ils construisent à partir d’un raisonnement scientifique une image qui rend compte des observations effectuées.
Si de nouvelles observations ou de nouveaux résultats expérimentaux ne concordent pas avec le modèle construit, il faut le modifier en conséquence. Le tableau 1 illustre la notion de modèle et les caractéristiques qu’il doit respecter.
Modèle : Représentationimagéed’unevéritéinaccessibleparlessens.
TABLEAU 1 L es caractéristiques d’un bon modèle scientifique
Caractéristique Exemple : Évolution du modèle représentant le système solaire
1. Le modèle explique les phénomènes observés.
• On a longtemps cru que la Terre était le centre du système solaire et que les astres tournaient autour d’elle.
• Ce modèle permettait d’expliquer la plupart des mouvements des planètes, mais pas tous.
• Il a donc fallu le modifier.

2. Le modèle est le plus simple possible.
• On a ajouté au modèle des trajectoires circulaires pour les planètes.
• Ce nouveau modèle fonctionnait, mais était devenu trop complexe.
• On obtient les mêmes mouvements dans un système où les planètes tournent autour d’un Soleil central.

3. Le modèle prédit avec exactitude de nouvelles observations.
• Grâce à ce nouveau modèle, on a pu prédire l’existence d’une planète avant sa découverte.
• La planète Neptune a été observée pour la première fois en 1843 à l’endroit exact où on avait prédit sa présence.
• C’est la preuve que le modèle est bon... pour le moment.

Fenêtre sur…
Les quatre éléments contre l’atome
Puisque la composition infiniment petite de la matière est inaccessible à nos sens, il a fallu établir des modèles pour l’expliquer. Issu de l’Antiquité grecque, le modèle des quatre éléments d’Aristote (environ 350 av. J.-C.) stipulait que la matière était constituée de différentes combinaisons d’air, de terre, d’eau et de feu. Ce modèle s’opposait à la théorie atomiste de Démocrite (environ 400 av. J.-C.) selon laquelle la matière était formée de particules minuscules et indestructibles, les atomes. À cette époque, ni Aristote ni Démocrite n’avaient les moyens technologiques de prouver scientifiquement la validité de leur modèle respectif.
Au 19e siècle, plusieurs expériences scientifiques sur les gaz ont amené les chimistes à revoir leur conception de la matière. Contrairement au modèle des quatre éléments d’Aristote, la notion d’atome permettait de rendre compte des résultats expérimentaux observés. John Dalton a été le premier à publier, en 1808, un modèle atomique détaillé (voir le tableau 2). La théorie des quatre éléments a été définitivement abandonnée après la publication de ses travaux.
DÉFINITION
Atome : Pluspetitepartiepossibledelamatière.C’estl’unitédebase de la matière.
TABLEAU 2 Les principaux aspects du modèle atomique de John
Toute la matière est constituée d’atomes. L’atome constitue la plus petite particule possible de matière.
Chaque atome est infiniment petit et indivisible
Tous les atomes d’un même élément sont identiques. Ils ont la même masse, la même taille et les mêmes propriétés.
Les atomes d’éléments différents sont différents. Ils ont des masses, des tailles et des propriétés différentes.
Des atomes peuvent se combiner pour former une nouvelle substance. La molécule ainsi créée aura des propriétés différentes des atomes qui la constituent.
L’atome constitue la « brique élémentaire » avec laquelle est construite toute la matière, qu’elle soit à l’état solide, liquide ou gazeux.






























































































































































































Il est impossible de différencier un atome d’oxygène d’un autre atome d’oxygène.

Puisque l’hydrogène, l’azote et l’oxygène sont des éléments différents, leurs atomes sont nécessairement différents (masse, taille et propriétés).

En combinant un atome d’oxygène et deux atomes d’hydrogène, on forme une molécule d’eau. Cette molécule a des propriétés différentes de l’oxygène et de l’hydrogène.

Il existe des ensembles de manipulation basés sur le modèle de Dalton et dont on peut se servir pour fabriquer et visualiser les molécules (voir la figure 1.1).


FIGURE 1.1 Les accessoires utilisés en classe pour représenter la matière sont basés sur le modèle atomique de John Dalton. Les liaisons entre deux atomes sont généralement représentées par des tiges de bois ou de plastique. On y trouve les atomes les plus fréquents.
Dans ce cahier, nous utiliserons les représentations montrées dans le tableau 3 pour visualiser les atomes. Ces sphères collées les unes aux autres représenteront les molécules.
TABLEAU 3 La représentation de quelques atomes usuels selon le modèle atomique de Dalton
Nom HydrogèneCarboneAzoteOxygèneSoufre Chlore Sodium
Représentation





En réalité, l’atome n’est pas une petite bille, et le modèle de Dalton sera vite modifié pour expliquer d’autres observations. Les expériences scientifiques du dernier siècle ont révélé que l’atome était beaucoup plus complexe que Dalton le croyait. Cependant, la représentation simplifiée du modèle de Dalton est suffisante pour expliquer, à ce stade-ci de ton parcours scolaire, les phénomènes qui nous intéressent.
Fenêtre sur… John Dalton
Issu d’une famille britannique modeste, John Dalton (1766-1844) se passionna d’abord pour la météorologie. C’est en étudiant la composition et les caractéristiques de l’air qu’il conçut sa théorie atomique. Bien que d’autres scientifiques aient pressenti l’existence de l’atome avant lui, John Dalton fut le premier à créer un modèle basé sur des mesures précises. C’est ainsi qu’il identifia quelques atomes auxquels il attribua une masse relative par rapport à l’atome d’hydrogène.
John Dalton était atteint d’une maladie génétique des yeux qui l’amenait à confondre les couleurs. Cette maladie porte d’ailleurs son nom : le daltonisme.




Liste des atomes répertoriés par John Dalton




1 Indique si chaque énoncé suivant est vrai ou faux selon le modèle atomique de John Dalton. Vrai Faux
a) Deux atomes de carbone peuvent avoir des tailles différentes. ⌧
b) Dans certaines conditions, un atome d’hydrogène pourrait être identique à un atome d’azote. ⌧
c) Deux atomes de sodium ont nécessairement la même masse. ⌧
d) Si deux atomes n’ont pas la même masse, alors ils représentent des substances différentes. ⌧
e) Il est possible de combiner un atome d’oxygène avec la moitié d’un atome de carbone. ⌧
f) Deux atomes du même élément ont les mêmes propriétés. ⌧
g) Même si deux atomes n’ont pas les mêmes propriétés, ils peuvent correspondre à un même élément. ⌧
h) Une molécule possède les propriétés des atomes qui la constituent. ⌧
i) Toutes les molécules contiennent nécessairement un nombre entier d’atomes. ⌧
2 Parmi les énoncés suivants, encercle celui qui ne cadre pas avec le modèle atomique de John Dalton.
a) Les atomes peuvent être brisés.
b) Les atomes d’un même élément sont identiques.
c) Les atomes d’éléments différents sont différents.
d) Les atomes peuvent se combiner.
3 Représente chacune des substances suivantes selon le modèle de Dalton (voir le tableau 3, à la page précédente).
a) Un échantillon de sodium solide
Les atomes doivent être colorés en violet.
b) Un échantillon de diazote gazeux constitué de molécules formées de 2 atomes d’azote
Les molécules doivent être colorées en bleu.
c) Un échantillon d’eau liquide constitué de molécules formées de 2 atomes d’hydrogène et de 1 atome d’oxygène
Les gros atomes doivent être colorés en rouge et les petits, en blanc.
4 Comme le montrent les illustrations ci-dessous, des atomes peuvent s’assembler pour former de nouvelles substances. Le modèle de Dalton est particulièrement efficace pour les représenter. Dans chaque cas, détermine :
1) le nombre total d’atomes ; 2) le nombre de sortes d’atomes.
a) Eau

b) Éthanol


c) Caféine





5 La molécule de sel est formée d’un atome de chlore et d’un atome de sodium. S’il était possible de découper à l’infini un bloc de sel en morceaux de plus en plus petits, obtiendrait-on autre chose que du sel ?
d) Adrénaline











Si on découpait un bloc en morceaux de plus en plus petits, on obtiendrait à un moment une seule molécule de sel. Si on pouvait continuer à découper, on séparerait le chlore et le sodium. À ce moment, il n’y aurait plus de molécules de sel, donc plus de sel, car les atomes seuls ont des propriétés différentes des molécules desquelles ils font partie.
6 Explique pourquoi le fait de représenter les atomes par des billes de tailles et de couleurs différentes constitue un modèle.
Parce que les atomes ne sont pas réellement de petites billes avec une couleur ou une taille spécifique. Puisque l’atome réel n’est pas accessible à nos sens, cette image de bille aide à rendre compte de certains phénomènes observés.
7 Donne un argument qui explique pourquoi le modèle atomique de Dalton a remplacé le modèle des quatre éléments d’Aristote.
Plusieurs réponses possibles. Exemple : Le modèle atomique de Dalton explique mieux les différents phénomènes observables que le modèle d’Aristote. OU Le modèle de Dalton permet de faire des prédictions plus justes que celui d’Aristote.
8 Au 20e siècle, les physiciens ont observé la radioactivité créée par la cassure des atomes. Cela les a conduits à découvrir que les atomes étaient constitués de particules encore plus petites. Quels aspects du modèle de Dalton ont alors été remis en question par ces résultats ?
L’atome est indivisible et il constitue la plus petite particule possible de matière.
9 À l’aide du modèle de Dalton, représente les molécules suivantes et colorie-les en respectant la couleur de chacun des atomes.
Accepter toute géométrie du moment que la sorte et le nombre d’atomes sont respectés.

a) Méthane : un atome de carbone et quatre atomes d’hydrogène
Blanc
Blanc Blanc





b) Dioxyde de carbone : un atome de carbone et deux atomes d’oxygène
Blanc Noir Noir Rouge Rouge
c) Ammoniac : un atome d’azote et trois atomes d’hydrogène
d) Hydroxyde de sodium : un atome de sodium, un atome d’oxygène et un atome d’hydrogène
Blanc Violet Rouge
Blanc Blanc Bleu
e) Acétylène : deux atomes de carbone et deux atomes d’hydrogène
f ) Chlorure d’hydrogène : un atome d’hydrogène et un atome de chlore
10 a) Selon le modèle de Dalton utilisé dans ce cahier, pourquoi ne peux-tu pas représenter un atome d’aluminium par une boule noire semblable à celle du tableau du no 9 ?
Parce que les atomes de carbone sont déjà représentés par des boules noires. Deux atomes différents ne peuvent pas avoir des représentations identiques.
b) Comment pourrais-tu représenter un atome d’aluminium ?
Je pourrais le représenter par une boule grise, ou d’une autre couleur non utilisée dans le tableau.
À l’état naturel, on trouve 90 sortes d’atomes. On peut donc comparer la matière à un jeu de construction infiniment petit qui comporte 90 types de briques, les atomes, que l’on peut agencer dans une infinité de combinaisons appelées molécules. Chacune de ces briques, donc chaque sorte d’atome, constitue un élément chimique.
DÉFINITION
Élément chimique : Substancepureforméed’uneseulesorted’atome.
Pour savoir si une substance est un élément, il faut regarder quelle est son unité de base, c’est-à-dire la plus petite partie possible de cette substance.
Le schéma ci-dessous te permettra de mieux comprendre les distinctions entre atomes, molécules, éléments et composés.
L’unité de base de la substance est-elle un atome ou une molécule ?

Atome

EXEMPLES
Molécule




• La substance est un élément
On la trouve dans le tableau périodique des éléments.
• Dans cette substance, il y a une multitude d’atomes identiques de cet élément.

L’argent est un élément. En effet :
• son unité de base est l’atome d’argent ;
• l’atome d’argent se trouve dans le tableau périodique des éléments.
Le dihydrogène (H2) est un élément En effet :

Combien de sortes d’atomes contient cette molécule ?

Une seule

Plusieurs



• son unité de base est une molécule composée d’une seule sorte d’atome, l’atome d’hydrogène ;
• l’atome d’hydrogène se trouve dans le tableau périodique des éléments.












La substance est un composé. On ne la trouve pas dans le tableau périodique des éléments.

EXEMPLE
L’eau est un composé. En effet :
• son unité de base est une molécule composée de deux sortes d’atomes, l’oxygène et l’hydrogène ;
• l’eau ne se trouve pas dans le tableau périodique des éléments.





Au fur et à mesure que les chimistes découvraient de nouveaux éléments, ils ont remarqué que certains avaient des propriétés semblables. Ces ressemblances ont permis de classer les atomes en familles ayant des propriétés semblables. Le tableau périodique des éléments (voir à la page suivante), résultat de plusieurs tentatives de classification, est aujourd’hui un outil essentiel en sciences.
Le tableau périodique des éléments fournit plusieurs informations sur chaque élément chimique (voir la figure 1.2).
Le symbole chimique
L’état physique de l’atome à une température de 25 °C Dans le tableau de la page 12, les éléments solides sont sur fond orangé, les éléments liquides, sur fond bleu et les éléments gazeux, sur fond vert. Les éléments synthétiques sont quant à eux sur fond gris. Ces 28 éléments n’existent pas à l’état naturel, ils doivent être créés en laboratoire.
Le numéro atomique
Ce numéro permet d’ordonner les éléments et de les repérer facilement. En général, plus le numéro atomique est grand, plus la masse de l’atome est élevée.
Le nom
Le nom attribué à chacun des éléments chimiques est généralement d’origine latine ou grecque et varie d’une langue à l’autre.
FIGURE 1.2 Les informations contenues dans le tableau périodique des éléments.
Dmitri Ivanovitch Mendeleïev
C’est au chimiste russe Dmitri Ivanovitch Mendeleïev (1834-1907) que l’on doit le tableau périodique moderne. Bien que sa version originale contienne beaucoup moins d’éléments qu’aujourd’hui, Mendeleïev a établi la logique qui conduira au tableau utilisé actuellement. Pour respecter sa classification, Mendeleïev devait laisser des espaces vides. Il prédisait ainsi l’existence d’éléments n’ayant pas encore été découverts à son époque.
À chaque élément est associé un symbole correspondant généralement à une ou plusieurs lettres représentatives du nom latin de l’élément.
La première lettre est toujours majuscule.
Le symbole chimique du potassium, K, provient de son nom latin kalium
La masse atomique relative
Comme les atomes sont infiniment petits, les scientifiques ont conçu une nouvelle unité de mesure pour exprimer leur masse, l’unité de masse atomique (u)
Par définition, le plus léger des atomes, l’hydrogène, a une masse atomique de 1 u (1 u ≈ 0,000 000 000 000 000 000 000 000 001 667 g).
Le potassium a une masse atomique relative d’environ 39,10 u, ce qui signifie qu’un atome de potassium est d’environ 39,10 fois plus massif qu’un atome d’hydrogène.







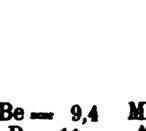



















1 Indique si chaque énoncé suivant est vrai ou faux. S’il est faux, explique pourquoi.
Au besoin, consulte le tableau périodique des éléments. Vrai Faux
a) L’eau est un élément. ⌧
L’eau n’est pas dans le tableau périodique.
b) L’or est un élément. ⌧
c) Si une substance figure dans le tableau périodique, alors c’est un élément. ⌧
d) Tous les composés sont des molécules. ⌧
e) Toutes les molécules sont des composés. ⌧
Une molécule peut être un élément, comme H2
f) Puisque l’hydrogène se présente dans la nature sous la forme d’une molécule, alors c’est un composé.
L’hydrogène se présente dans la nature sous la forme H2 , or H est dans le tableau périodique. C’est donc un élément.
2 Écris à quoi correspond l’information indiquée par chaque étiquette.
Numéro atomique Nom
3 Les illustrations suivantes représentent cinq substances différentes.







a) Lesquelles de ces substances sont des éléments ? B , C et E
b) À quoi reconnaît-on que les autres substances sont des composés ?
Symbole chimique
Masse atomique relative






Elles sont constituées de deux sortes d’atomes ou plus liés ensemble.
4 Le symbole d’un élément correspond généralement à des lettres représentatives de son nom latin. En te servant de cette convention et du tableau périodique, associe chaque élément de la colonne de gauche à son nom latin dans la colonne de droite.
Nom français
Nom latin
A Or 7 1 Natrium

B Mercure 5 2 Stibium
C Sodium 1 3 Nitrogenium
D Potassium 4 4 Kalium
E Azote 3 5 Hydrargyrum
F Étain 6 6 Stannum
G Antimoine 2 7 Aurum
5 Réponds à chaque question suivante en te servant du tableau périodique.
a) Quel est le nom de l’élément dont le numéro atomique est 34 ? Sélénium
b) Quelle est la masse atomique relative du plomb ? ≈ 207,2 u
c) Quel est le symbole chimique du sodium ? Na
d) Quel est le numéro atomique de l’élément ayant une masse de 186 u ? 75
e) Quelle est la masse atomique relative du 77e élément ? ≈ 192,22 u
f) Quel est le nom de l’élément ayant la plus petite masse atomique ? Hydrogène
g) Quel est le nom de l’élément situé juste au-dessus du rutherfordium ? Hafnium
6 Explique dans tes mots à quoi correspond une unité de masse atomique (1 u).
Elle correspond à la masse d’un atome d’hydrogène.
7 Complète la case du tableau périodique correspondant à chaque élément nommé dans le texte ci-dessous.












En combinant de l’hydrogène et de l’oxygène, on forme des molécules d’eau. Si un échantillon de rubidium entre en contact avec cette eau, il se produit une explosion. Si on fait évaporer le surplus d’eau, on obtient de l’hydroxyde de rubidium, une substance solide incolore dont la molécule est représentée ci-contre.
8 Sachant que la masse atomique relative du carbone est d’environ 12 u, encercle l’énoncé vrai.
a) Un atome de carbone pèse 12 g.
b) Il faut 12 atomes de carbone pour avoir 1 g de carbone.
c) L’atome de carbone a la même masse que 12 atomes d’hydrogène.
d) Un atome de carbone pèse 12 fois moins qu’un atome d’hydrogène.
9 L’illustration ci-contre montre une balance qu’on veut équilibrer à l’aide d’atomes.
a) De quel côté penchera la balance ? Explique ta réponse et utilise des masses atomiques arrondies à l’unité près.
Elle penchera du côté droit parce que la masse du béryllium (Be), placé sur le plateau de gauche, est d’environ 9 u, ce qui correspond à 9 atomes d’hydrogène. Or, le plateau de droite contient 11 atomes d’hydrogène, donc environ 11 u.
b) Combien d’atomes d’hydrogène faudrait-il ajouter ou enlever sur le plateau de droite pour que les plateaux soient en équilibre ?
Il faudrait enlever 2 atomes d’hydrogène.











c) Si l’on ne modifie pas le plateau de droite, par quel atome faudrait-il remplacer celui sur le plateau de gauche pour que la balance soit en équilibre ?
Il faudrait le remplacer par un atome dont la masse atomique est d’environ 11 u, soit un atome de bore (B).
10 Donne un avantage d’utiliser l’unité de masse atomique (u).
Puisque 1 u correspond approximativement à la masse d’un atome d’hydrogène, la masse des éléments exprimée en unités de masse atomique permet de comparer la masse des atomes les uns par rapport aux autres.
11 Trouve, dans le tableau périodique, trois éléments chimiques dont le nom évoque un scientifique et complète le tableau ci-dessous. Plusieurs réponses possibles. Exemple :


Il est possible de créer de nouvelles substances en assemblant plusieurs atomes. Ces assemblages se nomment molécules. À l’exception des métaux, la plupart des substances pures ont pour unité de base une molécule (voir la figure 1.3).
Les propriétés de la molécule dépendent des sortes d’atomes présents, du nombre d’atomes de chaque sorte, de leur ordre d’assemblage et de la forme géométrique de la molécule.
DÉFINITIONS
Molécule : Ensembledeplusieursatomes,delamêmesorteoudesortes différentes,attachésensemblepardesliaisonschimiques.
Substance pure : Substanceconstituéeuniquementdeparticules(atomes oumolécules)identiques.
En liant 1 atome d’oxygène à 2 atomes d’hydrogène, on crée une molécule d’eau



En liant, dans un ordre particulier, 6 atomes de carbone, 6 atomes d’oxygène et 12 atomes d’hydrogène, on crée une molécule de glucose (sucre).






En liant 3 atomes d’oxygène, on obtient une molécule d’ozone.




Il est possible de décrire rapidement une molécule à l’aide de sa formule chimique (voir la figure 1.4). Cette formule indique les sortes d’atomes présents dans la molécule à l’aide de leur symbole chimique ainsi que le nombre d’atomes de chaque sorte.
Les symboles chimiques indiquent que la molécule contient des atomes de carbone (C), des atomes d’hydrogène (H) et des atomes d’oxygène (O).

Les indices, placés en bas et à droite de chaque symbole, indiquent le nombre d’atomes de chaque sorte. S’il y a un seul atome d’une sorte, alors on ne met pas d’indice.
Le tableau 4 illustre les molécules de quelques substances connues et donne leur formule chimique.
TABLEAU 4 Quelques molécules et leur formule chimique
Substance Molécule
Eau

Dioxyde de carbone

Formule chimique
Substance Molécule
Formule chimique



Les propriétés d’une molécule sont totalement différentes des propriétés des éléments qui la composent (voir la figure 1.5). De plus, le moindre changement à l’intérieur d’une molécule en modifiera complètement les propriétés et donnera une toute nouvelle substance (voir les figures 1.6 et 1.7).
Formation d’une molécule de dioxyde de carbone



FIGURE 1.5 Le dioxygène (O2), un gaz présent dans l’air, permet de respirer. Pourtant, combiné à un atome de carbone (C), il forme un gaz asphyxiant, le dioxyde de carbone (CO2). L’oxygène a donc perdu ses propriétés.
Molécule de dioxygène (O2)

Molécule d’ozone (O3)

FIGURE 1.6 Bien que l’ozone et le dioxygène soient constitués uniquement d’atomes d’oxygène, ils n’ont pas les mêmes propriétés. Alors que le dioxygène est vital pour la respiration, l’ozone est irritant et toxique. La raison : la molécule d’ozone contient un atome d’oxygène de plus que la molécule de dioxygène.
Molécule de propène (C3H6)

Molécule de cyclopropane (C3H6)

FIGURE 1.7 Bien que le propène et le cyclopropane contiennent exactement les mêmes sortes d’atomes et le même nombre de chacun, ils n’ont pas les mêmes propriétés. En eff et, au contact d’une flamme, le propène brule de façon régulière et contrôlée, tandis que le cyclopropane explose. La raison : la géométrie de la molécule est différente.
Une fois qu’une molécule est formée, il est possible de retrouver les éléments de départ en brisant les liaisons chimiques créées. On peut les briser de différentes façons, soit :
• en utilisant la thermolyse, c’est-à-dire en chauffant la substance au-delà de son point d’ébullition ;
• en utilisant l’électrolyse, c’est-à-dire en faisant circuler un courant électrique dans la substance. En effet, en faisant passer un courant électrique dans un échantillon d’eau (H2O), on peut :
• briser les molécules d’eau en leurs éléments constitutifs : l’oxygène et l’hydrogène ;
• recueillir séparément ces éléments sous forme de dihydrogène gazeux (H2) et de dioxygène gazeux (O2) (voir la figure 1.8).























Les nanotechnologies
Même si nous n’en sommes pas encore pleinement conscients, les nanotechnologies façonnent déjà notre quotidien. Ces technologies utilisent des matériaux dont la taille est d’environ 10 −9 m (un million de fois plus petit qu’un millimètre). À cette dimension, ces matériaux ont des propriétés bien différentes de celles qu’on leur connaît à une taille plus conventionnelle. Par exemple, des filaments d’argent deviennent bleutés et acquièrent des propriétés optiques. Ou bien une poudre de dioxyde de titane (TiO2) normalement blanche devient transparente. Il existe déjà plusieurs applications des nanotechnologies dans notre quotidien, par exemple dans des bâtons de hockey, de la peinture, des crèmes solaires ou hydratantes et même certains aliments. Puisque cette technologie utilise des matériaux qui ont une grosseur qui se rapproche beaucoup de la dimension des atomes, certains scientifiques s’interrogent sur ses risques potentiels sur la santé. En effet, nos barrières de protection naturelles, comme les pores de notre peau, ne peuvent empêcher de telles particules de circuler librement dans notre organisme. La vigilance sera donc de mise dans les prochaines années.





1 Indique si chaque énoncé suivant est vrai ou faux. S’il est faux, corrige-le. Vrai Faux
a) Une molécule est obligatoirement formée d’atomes de sortes différentes.
Par exemple, le diazote est formé de deux atomes d’azote identiques.
b) Si on enlève un seul atome d’une molécule, on ne modifie pas ses propriétés caractéristiques.
Le moindre changement dans une molécule modifie ses propriétés.
c) Si deux molécules contiennent le même nombre d’atomes de chaque sorte, elles ont nécessairement les mêmes propriétés.
Les propriétés dépendent aussi de l’ordre d’assemblage et de la géométrie de la molécule.
d) Il est possible que deux molécules contenant les mêmes sortes d’atomes aient des propriétés différentes.
e) Tous les composés ont une molécule comme unité de base.
2 Complète le tableau associé à chaque molécule ci-dessous.
d’acide sulfurique : H2 SO 4
3 Le nitrate d’ammonium est une molécule qu’on trouve dans la composition de l’ammonitrate, une substance aux multiples usages. Elle peut être utilisée comme engrais, comme explosif et est également exploitée dans la conception de compresses froides instantanées.
La molécule de nitrate d’ammonium contient 2 atomes d’azote, 4 atomes d’hydrogène et 3 atomes d’oxygène. Encercle la formule chimique qui peut représenter cette molécule.
a) 2N4H3O b) A 2H4O3 c) N2H4O3 d) 2 A4H3O

4 Le gaz CR est un gaz lacrymogène utilisé par les forces de l’ordre. Sa formule chimique est C13H9NO. Si on brise les liaisons chimiques reliant les atomes d’une molécule de gaz CR, on obtient divers éléments. Encercle la lettre qui leur correspond.
a) Du carbone, de l’hydrogène et du nobélium.
b) Du carbone, de l’hydrogène, de l’azote et de l’oxygène.
c) Du cobalt, de l’hydrogène, du néon et de l’oxygène.
d) Du calcium, de l’hydrogène, du néon et de l’oxygène.
5 En te référant à la légende et à la liste de symboles, écris la formule chimique de chaque molécule représentée ci-dessous.












6 Voici la formule chimique d’une molécule d’acésulfame de potassium, une molécule qui peut remplacer le sucre dans les aliments.

Indique si chaque énoncé suivant concernant cette molécule est vrai ou faux. Vrai Faux
a) Cette molécule contient 4 atomes d’hydrogène. ⌧
b) Cette molécule est constituée de 16 atomes. ⌧
c) Cette molécule contient un atome de neptunium. ⌧
d) Cette molécule contient un atome d’azote. ⌧
e) Puisque le symbole « S » n’est pas affecté d’un indice, la molécule ne contient pas de soufre. ⌧
f) La molécule a les propriétés caractéristiques de chaque atome qui la constitue. ⌧
7 Le propane et le butane sont deux substances servant de combustible. Le tableau ci-dessous fournit quelques renseignements à leur sujet.
a) Inscrit la formule chimique du butane dans le tableau.




b) Bien que les deux substances contiennent les mêmes sortes d’atomes, elles n’ont pas les mêmes propriétés. Pourquoi ?
Parce que les propriétés dépendent aussi du nombre d’atomes de chaque sorte et de la façon dont ils sont attachés ensemble dans la molécule. Or, la molécule de butane ne contient pas le même nombre d’atomes de carbone et d’hydrogène que la molécule de propane.
8 Pourquoi est-il avantageux en science d’utiliser des formules chimiques ?
Parce que les formules chimiques indiquent les sortes d’atomes contenus dans une molécule et leur nombre.
La représentation des molécules en est facilitée.
1 Parmi les énoncés suivants, lequel ou lesquels décrivent adéquatement le modèle atomique de John Dalton ?
a) La matière est constituée de quatre éléments (eau, air, terre et feu).
b) Tous les atomes d’un même élément sont identiques.
c) Il est possible que des atomes d’éléments différents soient identiques.
d) Les atomes s’assemblent pour former des molécules.
e) Les molécules ont les propriétés des atomes qui les constituent.
f) La matière est constituée de particules indestructibles.
g) Il est impossible de distinguer un atome de sodium d’un autre atome de sodium.
2 À quoi correspond l’unité de masse atomique (u) ? Encercle ta réponse.
a) À la masse d’un gramme d’oxygène
c) À la masse d’une molécule d’eau
b) À la masse d’un atome d’hydrogène d) À un millionième de gramme
3 Parmi les substances suivantes, encercle celle qui n’est pas un élément.
a) Le tungstène b) Le silicium c) L’acier d) L’argent
4 Parmi les énoncés suivants, encercle celui qui n’exprime pas une caractéristique d’un bon modèle scientifique.
a) Il doit être le plus simple possible.
b) Il doit expliquer les résultats des expériences effectuées.
c) Il doit faciliter la prédiction de nouveaux résultats.
d) Il doit confirmer l’intuition des scientifiques.
5 Au cours du 20e siècle, les chimistes ont découvert des atomes de carbone dont la masse était différente des autres atomes de carbone. Encercle l’aspect du modèle de Dalton qui est contredit par cette découverte.
a) Les atomes sont indestructibles.
c) Les atomes d’un même élément sont identiques.
b) Les atomes d’éléments différents sont différents.
d) Les atomes sont microscopiques.
6 Quel phénomène n’est pas expliqué par le modèle atomique de John Dalton ?
a) Une centrale nucléaire fonctionne en brisant des atomes.
b) Les molécules contiennent des nombres entiers d’atomes.
c) Un échantillon d’or provenant d’Europe a les mêmes propriétés qu’un échantillon d’or provenant d’Amérique.
d) On n’a jamais découvert un atome d’argent qui possède des propriétés identiques à un atome d’or.
7
Quel aspect du modèle de John Dalton permet d’affirmer que les molécules contiennent toujours un nombre entier d’atomes ?
a) Les masses d’atomes différents sont différentes.
c) Les atomes d’un même élément sont identiques.
b) Les atomes sont infiniment petits.
d) Les atomes sont indivisibles.
8 E xplique dans tes mots la ou les différences entre un atome et une molécule.
Un atome est une particule unique d’un des éléments du tableau périodique tandis qu’une molécule est un assemblage d’au moins deux atomes (identiques ou différents) unis par des liaisons chimiques.
9 Voici la case du mercure dans le tableau périodique.
a) Quelles sont les cinq informations fournies dans cette case ?
1) Le numéro atomique, soit 80
3) Le symbole chimique, soit Hg
5) L’état à 25 °C, soit liquide
2) La masse atomique relative, soit ≈ 200,59
4) Le nom, soit mercure
b) À quoi reconnaît-on que le mercure est liquide à 25 °C ?
La couleur de la case est bleue. Or, selon la légende du tableau de la page 12, un fond bleu correspond à un élément liquide à 25 °C.
c) Pourquoi le symbole chimique du mercure est-il Hg et non M ou Me ?
Parce que le symbole chimique est généralement constitué de lettres représentatives du nom latin. Or, ce dernier n’est pas nécessairement proche du nom français.
10 À l’aide du tableau périodique des éléments, complète le tableau ci-dessous.
11
12
La première colonne du tableau ci-dessous donne la formule chimique de plusieurs substances. Pour chacune de ces substances, indique :
• si l’unité de base est un atome ou une molécule ; • si la substance est un composé ou un élément. Formule
Ce lac volcanique indonésien est le plus acide du monde. Il contient entre autres de grandes quantités d’acide sulfurique, substance dont la formule chimique est H2SO4. Parmi les énoncés suivants sur l’acide sulfurique, lesquels sont vrais ?
A La molécule d’acide sulfurique contient 4 atomes d’oxygène.
B L’unité de base de l’acide sulfurique est une molécule.
C La molécule d’acide sulfurique contient 2 atomes de soufre.
D La molécule d’acide sulfurique contient 3 atomes.
E L’acide sulfurique est un élément.
F La molécule d’acide sulfurique contient 7 atomes.
G L’atome d’acide sulfurique existe.
H La molécule d’acide sulfurique contient 3 sortes d’atomes.
A , B , F et H
a) d’eau (H2O) ; ≈ 18,02 u
c) de corindon (Al2O3) ; ≈ 101,96 u
e) de dioxyde de carbone (CO2) ; ≈ 44,01 u
g) d’aspartame (C14H18N2O5) ; ≈ 294,4 u
i) de gypse (CaSO4) ; ≈ 136,14 u










13 Sachant que la masse d’une molécule correspond à la somme des masses des atomes qui la constituent, détermine la masse (en u) d’une molécule :
b) de quartz (SiO2) ; ≈ 60,09 u
d) de propane (C 3H8) ; ≈ 44,11 u
f) d’acide nitrique (HNO3) ; ≈ 63,02 u
h) d’acide lactique (C 3H6O3) ; ≈ 90,09 u
j) de talc (Mg3Si4O12H2). ≈ 379,31 u

14 Voici deux molécules qui contiennent les mêmes sortes d’atomes.
Suboxyde de carbone

Ces molécules ont-elles les mêmes propriétés ? Explique ta réponse.
Dioxyde de carbone

Non, car les propriétés d’une molécule dépendent aussi du nombre d’atomes de chaque sorte.
15 Voici deux molécules ayant la même formule chimique, soit C4H8
Molécule 1

Molécule 2

Ces molécules ont-elles les mêmes propriétés ? Explique ta réponse.
Non, car les propriétés d’une molécule dépendent aussi de la façon dont ses atomes sont assemblés.
Or, ils ne sont pas assemblés de la même façon.

16 Dans l’atmosphère, l’oxygène peut se présenter sous la forme de dioxygène (O2) ou sous la forme d’ozone (O3). Illustre dans les espaces ci-dessous ce qu’on verrait en observant un échantillon de chacun de ces gaz avec un appareil assez puissant pour voir à l’échelle atomique.
Dioxygène Ozone


17 Est-il possible de trouver du meitnérium (numéro atomique 109) dans la nature ? Explique ta réponse.
Non, car le meitnérium est un élément synthétique. Or, par définition, ce type d’élément n’existe pas à l’état naturel et doit être produit artificiellement par l’être humain dans des laboratoires.
18 Une bouteille contient du peroxyde d’hydrogène dont la formule chimique est H2O2. Claire affirme :
« P uisque l’eau (H2 O) est comestible et non toxique, le peroxyde d’hydrogène l’est aussi, car on a seulement ajouté un atome d’oxygène à la molécule d’eau. Or, l’oxygène n’est pas dangereux pour la santé. On peut donc consommer sans crainte du peroxyde d’hydrogène. »
Que penses-tu de cette affirmation ?
Cette affirmation est fausse. Ce n’est pas parce que deux substances prises individuellement sont comestibles et non toxiques que la combinaison des deux l’est. Lorsqu’on combine des substances pour former une nouvelle molécule, cette dernière possède des propriétés complètement différentes des deux substances de départ.
On ne peut donc pas se fier aux propriétés des substances initiales pour déduire celles de la substance finale.
19 Au cours d’une expérience scientifique, tu dois déterminer la composition d’une molécule inconnue. Les résultats que tu obtiens sont résumés ci-dessous.
• La molécule est composée de 3 sortes d’atomes.
• L a molécule ne peut contenir autre chose que du carbone (C), de l’hydrogène (H), de l’azote (N), de l’oxygène (O), du phosphore (P) et du soufre (S).
• L a masse de la molécule est de 30 u.
• L a molécule contient de l’hydrogène, mais pas plus de deux atomes.
Décris la composition de cette molécule. Laisse les traces de ton raisonnement et utilise des masses atomiques arrondies à l’unité près.
• Puisque la masse de la molécule est 30 u, elle ne peut pas contenir de S ou de P, car la masse atomique de ces atomes est supérieure à 30 u. Il y a donc 4 combinaisons possibles, soit carbone-hydrogène-oxygène (CHO), carbone-hydrogène-azote (CHN), hydrogène-azote-oxygène (HNO) ou carbone-azote-oxygène (CNO).
• La combinaison CNO est à exclure, car la molécule contient de l’hydrogène.
• La combinaison CHN est à exclure, car la seule façon de combiner ces sortes d’atomes sans excéder 30 u est d’unir 1 atome de carbone, 1 atome d’azote et 4 atomes d’hydrogène. Or, la molécule ne peut en contenir plus de 2.
• La combinaison HNO est à exclure, car en combinant un atome d’oxygène à un atome d’azote, on a déjà 30 u, et la molécule doit comporter 3 sortes d’atomes.
• La combinaison restante est donc CHO. La seule façon d’obtenir 30 u en unissant ces atomes est d’unir 1 atome de carbone (12 u), 1 atome d’oxygène (16 u) et 2 atomes d’hydrogène (2 u).
12 u + 16 u + 2 u = 30 u
Composition de la molécule : La molécule contient 1 atome de carbone, 1 atome d’oxygène et 2 atomes d’hydrogène.
20 Complète la grille de mots entrecroisés suivante.

Horizontalement
1 Si petit qu’on ne peut le voir à l’œil nu.
2 Combinaison de deux atomes ou plus.
3 On lui doit le tableau périodique des éléments moderne.
4 Représentation imagée d’une vérité inaccessible par les sens.
5 Il a été le premier à publier un modèle atomique détaillé.
6 Molécule dont la formule chimique est O3
7 Plus petite particule de matière selon Dalton.
8 Élément chimique dont le numéro atomique est 20.
9 Caractéristiques propres à un élément.
Verticalement
10 Substance dont l’unité de base est constituée de plus d’un élément chimique.
11 Suite de symboles chimiques et d’indices permettant de décrire la composition d’une molécule.
12 Substance pure formée d’une seule sorte d’atome.
13 La matière en compte trois : solide, liquide et gazeux.
14 Information contenue dans le tableau périodique permettant d’ordonner les éléments.
15 Élément chimique dont la masse atomique relative est d’environ 19,00 u.



La collection Origines est destinée à l’enseignement du cours de Science et technologie de la 1re et de la 2e année du secondaire. Elle couvre l’ensemble des concepts prescrits par le Programme de formation du ministère de l’Éducation.

Origines propose une approche notionnelle divisée en quatre univers dont la séquence des chapitres respecte la pratique enseignante.
Découvrez les atouts de la 3e édition :


• Une organisation simple et une présentation visuelle attrayante facilitant le repérage par les élèves.


• Des concepts théoriques appuyés par des exemples concrets.
• Un grand nombre d’exercices et de problèmes bien gradués.
• Des rubriques de connaissances générales et historiques qui enrichissent les notions théoriques.
• Des Savoir-faire qui présentent des techniques à l’étude.
• Des activités de synthèse à la fin de chaque chapitre.
• Une section Joindre l’utile à l’agréable à la fin de chaque univers qui propose des exercices de révision sous forme de jeux.
• Une révision globale à la fin du cahier.




• Un Cahier de révision à remplir par les élèves, comportant des réseaux de concepts et des résumés théoriques.
• Une foule de documents reproductibles : exercices supplémentaires, tests et évaluations de chapitre, banques de questions, laboratoires et ateliers, évaluations de fin d’année, situations d’apprentissage et projets, etc.
Un contenu numérique riche et varié
Sur maZoneCEC, accédez aux cahiers et aux guides en format numérique ainsi qu’à de nombreux enrichissements, dont :
• un grand nombre d’exercices interactifs autocorrectifs ;




• des capsules numériques (clics +) présentant des compléments d’information variés ;
• des hyperliens permettant d’accéder à des contenus multimédias ;
• des images interactives et des vidéos ;
• des analyses technologiques accompagnées d’animations 3D




