8 minute read
Pasteurelosis septicémica (septicemia hemorrágica) en el cerdo Ibérico
from Albéitar 244
by Grupo Asís
Este proceso, pese a ser poco frecuente en el ganado porcino, ha provocado brotes esporádicos durante la última década que hacen pensar que se trate de una enfermedad endémica en determinadas zonas de España.
García A.1, Gil-Molino M.2, Zurita S.2 y Alonso JM.3 1Producción Animal, CICYTEX, Badajoz 2Servicio de recepción y procesado de muestras, Hospital clínico Veterinario, UEX, Cáceres 3Sanidad Animal. Facultad de Veterinaria, UEX, Cáceres Imágenes cedidas por los autores
Las especies de Pasteurella causan numerosas enfermedades endémicas y/o epizoóticas en una amplia gama de animales (mamíferos y aves) domésticos y salvajes. P. multocida es un patógeno común, comensal u oportunista que se encuentra en el tracto respiratorio superior de la mayoría de los animales domésticos y salvajes.
P. multocida afecta principalmente al sector ganadero porcino de cría intensiva industrial, donde aparece implicada como agente etiológico en dos importantes enfermedades porcinas: la rinitis atrófica progresiva (RAP) y procesos neumónicos.
La pasteurelosis septicémica o septicemia hemorrágica (SH), al contrario, está considerada poco frecuente en el cerdo. Sin embargo, han sido notificados brotes esporádicos en determinadas regiones geográficas (García et al., 2011). Desde el primer brote notificado en España de SH, que afectó a cerdos ibéricos en extensivo (Cardoso-Toset et al., 2013), son varios los autores, entre los que se encuentra nuestro grupo, que han descrito brotes esporádicos de septicemia aguda en cerdos ibéricos (Cardoso-Toset et al., 2013) y jabalíes (Risco et al., 2013). La presencia de brotes periódicos durante la última década en ganado criado en extensivo indica la posibilidad de que la SH sea endémica en ciertas áreas de España, donde puede estar subestimada. El conocimiento del curso y características de los brotes de SH podría evitar la confusión con otras enfermedades, facilitando el diagnóstico de esta enfermedad en la que el tratamiento temprano es fundamental (Cuevas-Gómez, 2020).
AGENTE ETIOLÓGICO
P. multocida es un cocobacilo facultativo gramnegativo, no móvil, perteneciente a la familia Pasteurellaceae (Carter, 1987). Las cepas de P. multocida se clasifican en 5 serogrupos capsulares (A, B, D, E y F). Además, los aislados también se subtipifican en función de su lipopolisacárido (LPS), que separa los aislados en 16 serovares (Tang et al., 2009). Las designaciones de los aislados suelen consistir en una letra capsular de serogrupo seguida de un número somático de serovariedad (por ejemplo, A:1, A:2, A:3, B:2, etc.).
En el caso del cerdo, P. multocida se asocia con un amplio espectro de enfermedades causadas por diferentes serogrupos y su prevalencia puede cambiar con el tiempo dentro de determinadas regiones (García et al., 2011). Existe una clara correlación entre el tipo de cápsula y la enfermedad. Lo que no está claro es si la expresión de un determinado tipo de LPS o el tipo y la cantidad de proteínas que se presentan en la superficie de la bacteria también contribuyen a la especificidad de la enfermedad.
Las cepas capsulares toxigénicas de tipo D y, con menor frecuencia, las de tipo A contribuyen a la RAP. Principalmente las cepas no toxigénicas de tipo A y un pequeño número de cepas de tipo D y/o toxigénicas pueden desempeñar un papel crucial en el complejo de enfermedades respiratorias porcinas (PRDC), que se considera una de las enfermedades más comunes y costosas de los cerdos alojados en régimen intensivo.
Los aislados del tipo capsular B (figuras 1 y 2), y en menor medida del E, son considerados los agentes etiológicos de la SH, proceso poco frecuente en cer-
FIGURA 1. Crecimiento de P. multocida en agar sangre. FIGURA 2. La identificación del tipo capsular se suele realizar a través de PCR.

do intensivo (Dziva et al., 2008), pero que manifiesta brotes esporádicos, con graves consecuencias, asociados principalmente a los sistemas de explotación extensivo de cerdo Ibérico.
Utilizando la amplificación de elementos palindrómicos extragénicos repetitivos (REP-PCR), las cepas de P. multocida asociadas a la pasteurelosis septicémica porcina son idénticas a las cepas causantes de septicemia hemorrágica en ganado vacuno (Townsend et al., 1997). La marcada homogeneidad de estas cepas sugiere transmisión entre el ganado bovino y el porcino (Townsend et al., 1998).
EPIDEMIOLOGÍA Y PATOGENIA
El agente causal puede transmitirse por ingestión o inhalación, ya sea a través de contacto directo o de vehículos como el pienso y/o agua contaminados. Se cree que P. multocida se propaga principalmente por las secreciones respiratorias, pero también pueden encontrarse en otras secreciones y excreciones (heces, orina, etc.). Algunos animales infectados se convierten en portadores inaparentes, con presencia de bacterias en los ganglios linfáticos del tracto respiratorio superior. Determinadas situaciones de estrés pueden desencadenar el inicio de su excreción.
P. multocida no persiste mucho tiempo en el medio ambiente y su viabilidad depende de las condiciones de temperatura y humedad (Backstrand y Botzler, 1986; Rosen, 1975). Puede permanecer viable en agua de 7 a 25 días, en suelo durante más de 21 días y largos periodos en materia orgánica (Bredy y Botzler, 1989).
P. multocida posee varios factores de virulencia, incluyendo fimbrias, adhesinas y toxinas. Sin embargo, la mayoría de las cepas de P. multocida implicadas en la SH no se conocen por expresar ninguna toxina. Otros factores de virulencia, como las neuraminidasas, las proteínas secuestradoras de hierro y las enzimas metabólicas, desempeñan un papel clave en la adquisición y utilización de sustratos para el crecimiento dentro del hospedador, que suele ser un entorno relativamente pobre en nutrientes y hostil.
Se ha avanzado poco en la comprensión de cómo invade exactamente P. multocida las superficies de la mucosa para acceder a la sangre y cómo el hospedador responde a la infección. Si bien Cuevas-Gómez (2020) destaca la importancia de la hemaglutinina filamentosa PfhA, que aparentemente incrementa la dispersión y colonización de P. multocida (Fuller et al., 2000).
SINTOMATOLOGÍA
La evolución de la enfermedad es aguda o hiperaguda, la muerte sobreviene por un shock séptico después de un periodo de enfermedad que no dura más de 12 horas en la mayoría de los casos, raramente llega a las 24-48 horas.
Los signos clínicos suelen incluir coloración cianótica de la piel del hocico, las orejas y las regiones ventrales del cuello, los flancos y el abdomen, letargo, fiebre, disnea y renuencia a moverse. Ocasionalmente, en la forma aguda también aparece lagrimeo, descarga nasal, temblores musculares, dolor cólico leve o diarrea. En algunos cerdos se han observado signos neurológicos (por ejemplo, tetraparesia y opistótonos).
Además de los edemas, son frecuentes las hemorragias petequiales o equimóticas generalizadas en distintas localizaciones, especialmente en las superficies serosas. En algunos casos hiperagudos estas lesiones no son manifiestas y aparecen únicamente petequias dispersas.
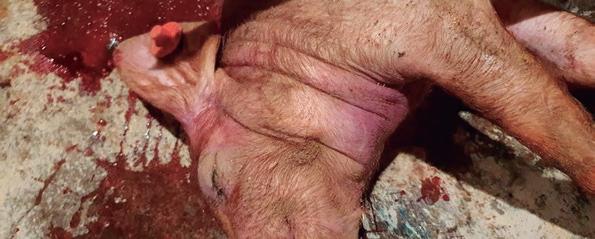
FIGURA 3. Coloración cianótica y edema submandibular en cerdos muertos por pasteurelosis septicémica. FIGURA 4. Detalle del edema submandibular en uno de los cerdos muertos.

La lesión más evidente en un animal que ha muerto a causa de la SH es el edema subcutáneo (figuras 3 y 4), que se extiende desde la región submandibular hasta el pecho. Este edema puede variar desde una sustancia gelatinosa y amarillenta hasta un fluido serosanguinolento. También puede aparecer edema en la musculatura, en la cavidad torácica y abdominal, en el saco pericárdico o en las articulaciones.
Se puede encontrar una faringitis aguda de catarral a fibrinosa acompañada de edema perifaríngeo, úlceras gastrointestinales (figura 5); congestión y hemorragias multifocales del bazo; ganglios linfáticos aumentados de tamaño, edematosos y hemorrágicos; y petequias en los riñones. Los cerdos que sobreviven presentan ocasionalmente lesiones cutáneas persistentes decoloradas y necróticas en la parte ventral del cuello, la garganta y/o el abdomen.
Nuestro grupo ha encontrado en algunos brotes de pasteurelosis septicémica en los que se vieron afectados cerdos ibéricos de 3-4 meses la presencia de coinfecciones por Clostridium novyi y Cl. chauvoei incrementándose de esta manera su gravedad y las tasas de mortalidad. La única forma de prevenir la SH es combinando la inmunoprofilaxis con un manejo adecuado, especialmente considerando las grandes limitaciones de la terapia médica.
TRATAMIENTO Y CONTROL
El tratamiento etiológico de esta enfermedad se basa en la administración parenteral de antibióticos (por ejemplo, penicilina, ampicilina, tetraciclina, estreptomicina o neomicina), que solo son eficaces en los animales afectados en las primeras fases de la enfermedad (Shivachandra et al., 2011; De Alwis, 1992).
Sin embargo, el uso excesivo y desmedido de antibióticos en los países en vías de desarrollo está muy probablemente contribuyendo al grave problema de la resistencia a los antibióticos, cuyos genes pueden estar en los plásmidos y la transferencia de dichos plásmidos entre cepas patógenas puede dar lugar a una propagación epidémica de la infección. La coexistencia y la propagación de pequeños plásmidos son utilizadas por P. multocida para hacerse multirresistente (Shivachandra et al., 2011) .
Desde hace más de una década varios antibióticos resultan prácticamente inactivos frente a las cepas de P. multocida aisladas de porcino en España o muestran altos porcentajes de resistencia. Es el caso de la clindamicina, eritromicina o sulfamidas (Petrocchi-Rilo et al., 2019; Vera Lizarazo et al., 2006).
En los brotes que nuestro grupo ha diagnosticado, los aislamientos de P. multocida de tipo B obtenidos manifestaron resistencia frente a los β-lactámicos y tetraciclinas y únicamente fueron sensibles a las quinolonas.
La única forma de prevenir la SH es combinando la inmunoprofilaxis con un manejo adecuado, especialmente considerando las grandes limitaciones de la terapia médica. Para reducir la difusión del microorganismo se han propuesto sistemas de manejo que suelen ser comunes a los utilizados en el control de
FIGURA 5. Úlceras gástricas en un animal muerto por pasteurelosis septicémica.