





Nos enorgullece seguir contribuyendo desde Oviedo a enriquecer el conocimiento que, a nivel mundial, se tiene sobre las bases de las enfermedades que afectan a la salud visual”.
La Fundación de Investigación Oftalmológica (FIO) y el Instituto Universitario Fernández-Vega comparten un año más su gran vitalidad a través de estas páginas, que resumen la actividad realizada durante el año 2023. Nos enorgullece seguir contribuyendo desde Oviedo a enriquecer el conocimiento que, a nivel mundial, se tiene sobre las bases de las enfermedades que afectan a la salud visual.
A través de esta Memoria podrán conocer los proyectos en los que estamos involucrados, que afectan a la investigación básica, traslacional y clínica, así como a la docencia y la divulgación, aspectos que consideramos de máxima relevancia para
Queremos estar al día y por eso nuestra perspectiva formativa es de 360º, con formación para nuestros profesionales en los principales congresos de cada especialidad y también impartiendo docencia a estudiantes de Universidad, futuros profesionales de la oftalmología, y a médicos rotantes que se acercan a nosotros desde orígenes de lo más diverso. Es nuestros mejores esfuerzos.
que estamos profundamente agradecidos. Mención especial dedico a nuestros mecenas, la Fundación BBVA, Telefónica, Fundación Ramón Areces, Fundación Endesa, Staar Surgical, Fundación Caja Rural y la Fundación que, sin duda, nos enriquece como sociedad y como expertos en salud ocular.
A nuestros mecenas, al equipo de profesionales que hace realidad esta actividad y también a los pacientes que hecho posible el desempeño de este ejercicio.

Prof. Luis Fernández-Vega Sanz. Presidente de la Fundación de Investigación Oftalmológica y del Instituto Universitario Fernández-Vega. Catedrático de Universidad.
Memoria de Investigación y Docencia
“Es de destacar este año la consolidación de productos de medicina regenerativa y terapias avanzadas y próte
Nos alegra presentar, un año más, la Memoria de Investigación y Docencia de la Fundación de Investigación Oftalmológica (FIO) relativa al último ejercicio.
Ha sido un año intenso. Durante este curso se han defendido tres tesis doctorales, merecedoras de menciones internacio nales e industriales. Se han publicado más de 30 artículos ori básica, traslacional y clínica en oftalmología y ciencias de la visión. Además, se ha logrado una destacada presencia en los congresos nacionales, europeos e internacionales de máximo prestigio.
La FIO participa en estructuras estables de investigación bio médica a nivel nacional, como las redes de investigación clí nicas orientadas a resultados en salud de terapias avanzadas

Salud del Principado de Asturias, al que la FIO se ha adherido como miembro asociado, (todas ellas ligadas al Instituto de Salud Carlos III, del Gobierno de España).
Es de destacar este año la consolidación de productos de medicina regenerativa y terapias avanzadas y prótesis
La actividad de investigación y clínica se pone al servicio de alumnos de grado y postgrado y en el Instituto Ofcórnea, retina, glaucoma, terapias avanzadas, enfermería oftalmológica y optometría clínica, entre otras.
Toda esta actividad se realiza con el soporte económico de la Fundación de Investigación Oftalmológica, de proyectos competitivos obtenidos por los investigadores en las convocatorias del Principado de Asturias, nacionales y europeas, los contratos con la industria farmacéutica y las colaboraciones de mecenazgo con diversas entidades nacionales y donaciones de pacientes.

Prof. Jesús Merayo Lloves.
Director del Instituto Universitario Fernández-Vega.
Catedrático de Oftalmología de la Universidad de Oviedo.
Ciencia que ilumina.
Investigamos para avanzar en la salud ocular de nuestros pacientes.
La Fundación de Investigación Oftalmológica, con en lana de investigadores de gran prestigio internacional;de la visión, para lograr nuevas medidas de preven-
a la vez que proporcionar una oferta formativa de
oftalmología internacional.





m2 dedicada a la investigación.
cie ocular, neurobiología de la retina y genética de glaucoma, trabajan en laboratorios equipados con la última tecnología, complementando su actividad con una cuarta unidad de investigación traslacional en el campo de la medicina regenerativa de la su-
Cuenta, entre sus equipamientos, con una unidad de microscopía avanzada y una unidad de experimentación animal, con un quirófano dotado con láser Excimer.
Los distintos laboratorios de la FIO están dotados con microtomos de rotación y de corte en congelación (criostato), así como con un microscopio endotelial especular, sistemas de detección de proteínas y ácidos nucleicos por electroforesis, un equipo de electroforesis capilar (secuenciador de ADN) y un sistema de fotodocumentación de geles, sin olvidar varios termocicladores y RT-PCR.
También cabe destacar entre su equipamiento una unidad de cultivos celulares que consta de una sala de cultivos primarios y una sala de líneas celulares, y una unidad de criopreservación dotada con ultracongeladores.
145 Publicaciones en libros 531 Artículos científicos
CONGRESOS 613
ESTUDIANTES DE POSTGRADO 490
124 Estudiantes de doctorado
155 Estudiantes de máster
102 Estudiantes de experto universitario
109 Estudiantes de formación
TESIS DOCTORALES DEFENDIDAS 32
PROYECTOS DE INVESTIGACIÓN 213
95 Financiación competitiva 118 Financiación privada
ENSAYOS CLÍNICOS ACTIVOS 16
13 Seminarios/Jornadas monográfico/a de oftalmología 676 PUBLICACIONES 676
ESTUDIANTES DE GRADO (Convenio IOFV-Uniovi)
TRABAJOS DE MÁSTER Y DE GRADO 61
SEMINARIOS Y SESIONES 559
228 Sesiones clínicas
73 Sesiones bibliográficas
62 Sesiones de actualización
133 Seminarios de investigación
50 Seminarios regionales de oftalmología
Desde la FIO queremos un mundo sostenible. Queremos luchar porque los países y sus sociedades emprendan un nuevo camino con el que mejorar la vida de todas las personas, sin dejar a nadie atrás. Por eso, trabajamos en proyectos que fomenten objetivos de desarrollo sostenible, y nos alineamos con varios de los ODS:







Mejora de la calidad de vida de las personas enfermas graves, tanto aquellas que sufren ceguera, como aquellas que sufren enfermedades neurodegenerativas.
Proporcionar formación de calidad en oftalmología a médicos oftalmólogos de todo el mundo.
Trabajamos con un nutrido equipo de investigadoras, que centran sus esfuerzos en solucionar graves patologías que, además, acaban impactando mucho más en la mujer, en ocasiones por su desarrollo fisiológico y en otras por el impacto socioeconómico que provoca la enfermedad y las necesidades de cuidados.
Usamos la energía para el bien de las personas. Transformándola en luz que ayude a evitar la ceguera y a la neurodegeneración.
Trabajamos para la inclusión de las personas con discapacidad, paliando los efectos de la ceguera y la neurodegeneración y proporcionando una mejor calidad de vida e integración social.
De ese modo, contribuimos a un envejecimiento saludable de la población mundial, creando un futuro sostenible y mejorando el impacto socio-económico asociado al cuidado de las personas mayores.
Y lo hacemos colaborando con entidades e instituciones que tienen nuestros mismos objetivos. Vivir en un mundo mejor y dejar un futuro sostenible a nuestras hijas e hijos.
Superficie ocular; Medicina regenerativa y terapias avanzadas

Genética ocular, Nutrición y Salud visual
Neurobiología de la retina
Investigación clínica (Instituto Oftalmológico Fernández-Vega)

más a la población de los países desarrollados. Muchas de estas enfermedades no tienen tratamiento curativo en el momento actual.
En el marco de estas patologías, se investiga el ojo seco, el envejecimiento y enfermedades neurodegenerativas, el queratocono, la medicina regenerativa de la córnea y terapias avanzadas como la celular o la ingeniería tisular.
• MEDICINA REGENERATIVA DE LA SUPERFICIE OCULAR.
• BIOLOGÍA CELULAR E INERVACIÓN.
• GLICÓMICA, MATRIZ Y SEÑALIZACIÓN.






Los estudios en materia de genética ocular se centran en varias líneas diferenciadas para la detección precoz del glaucoma -segunda causa de ceguera en el mundo-, mediante la búsqueda de biomarcadores proteicos de la enfermedad y el estudio de los genes de riesgo asociados.
Estas importantes investigaciones básicas están encaminadas a curar las enfermedades que causan la ceguera y a medida que se descubren, van traslapaciente.
• NUTRICIÓN Y SALUD VISUAL.
• METALÓMICA EN ENFERMEDADES OCULARES.
• GLAUCOMA: MARCADORES GENÉTICOS, PROTEÓMICOS Y METABOLÓMICOS.

La investigación de la neurobiología de la retina se centra en las células dañadas en la retina (células ganglionares) para evitar su muerte y lograr una supervivencia más larga mediante el empleo de factores que protegen la parte de la célula que le da energía (las mitocondrias). Entre los factores, se encuentran la modulación de la luz que entra al ojo (dejando pasar la que protege y blo queando la que hace daño) o fármacos como la rapa micina.
Asimismo, hay abierta una investigación dedicada al es tudio de la implicación del zinc y las metalotioneínas (las proteínas más importantes en la regulación de los nive les de zinc) en el desarrollo de la degeneración macular asociada a la edad (DMAE).



• FISIOPATOLOGÍA DE LAS NEURODEGENERACIONES RETINIANAS: GLAUCOMA.
• ESTUDIO DE LA CICATRIZACIÓN EN CIRUGÍA FILTRANTE DE GLAUCOMA.
• NEUROPROTECCIÓN EN LA ENFERMEDAD DEL GLAUCOMA: APLICACIÓN TERAPÉUTICA DEL PLASMA RICO EN FACTORES DE CRECIMIENTO.
• FOTOBIOMODULACIÓN EN ENFERMEDADES NEURODEGENERATIVAS.


El Instituto Oftalmológico Fernández-Vega también concede extraordinaria importancia a la investigación clínica. Un área de trabajo que se coordina desde la propia institución sanitaria.
La investigación clínica está centrada en el estudio del segmento anterior y posterior del ojo. Un equipo multidisciplinar del Instituto Oftalmológico Fernández-Vega, compuesto por oftalmólogos, optometristas, personal de enfermería y farmacia así como auxiliar, entre otros, se dedica a estudiar las patologías y tratamientos que afectan a la córnea, el cristalino, la retina y el glau-
Estas investigaciones son posibles gracias a latituto a lo largo del año, más de 110.000, lo que se traduce en más de 220.000 ojos que pueden ser analizados para poder avanzar en la investigación de las patologías oculares.
caminados a curar las enfermedades que causan ceguera. En la actualidad, contamos con 16 ensayos clínicos en marcha, en los que participan
SUPERFICIE OCULAR: CÓRNEA, CIRUGÍA REFRACTIVA Y CRISTALINO.
- VÍTREO Y RETINA.
- GLAUCOMA.

venio de Colaboración entre la Universidad de Oviedo y la Fundación de Investigación Oftalmológica (FIO) mediante el cual, la FIO se adscribió a la Universidad como Instituto Universitario de Investigación Fernández-Vega. Dicha adscripción fue autorizada por el Gobierno del Principado de
3 de junio. El Instituto Universitario de Investigación Fernández-Vega es pionero, a nivel estatal, en colaboración público-privada y sirve de modelo para el desarrollo de otros institutos universitarios de investigación en España.
La docencia y la investigación son dos de los pilares del Instituto Universitario Fernández-Vega, que de la mano de la Universidad de Oviedo forma a nuevos profesionales en el campo de la oftalmología en los ámbitos teórico y práctico.
El Instituto Universitario Fernández-Vega ofrece a Oftalmólogos, Ópticos-Optometristas, Enfermeros, Investigadores, así como a estudiantes de pre y postgrado en ciencias de la salud, una formación de excelente calidad basada en una rigurosa actividad clínica y de investigación.
MÁSTER EN SUPERFICIE OCULAR, CÓRNEA, CRISTALINO Y CIRUGÍA ADITIVA.
MÁSTER EN GLAUCOMA.
MÁSTER EN RETINA Y VÍTREO.
MÁSTER EN OPTOMETRÍA CLÍNICA.
MÁSTER EN ENFERMERÍA OFTALMOLÓGICA.
MÁSTER EN TERAPIAS AVANZADAS Y MEDICINA REGENERATIVA.
EXPERTO UNIVERSITARIO EN CIRUGÍA CON SEGMENTOS INTRACORNEALES.
EXPERTO EN DONACIÓN, EXTRACCIÓN, MANIPULACIÓN Y GESTIÓN DE TEJIDOS.
EXPERTO EN INMUNOLOGÍA OCULAR Y UVEÍTIS.
EXPERTO EN LENTES FÁQUICAS EPICAPSULARES.
FORMACIÓN CONTINUADA EN CIENCIAS DE LA VISIÓN.
• MÁSTER OFICIAL EN NEUROCIENCIAS.
• PROGRAMA DE DOCTORADO EN CIENCIAS DE LA SALUD: LÍNEA DE INVESTIGACIÓN DE OFTALMOLOGÍA Y CIENCIAS DE LA VISIÓN.
• PROGRAMA DE DOCTORADO EN BIOLOGÍA MOLECULAR.
• PROGRAMA DE DOCTORADO EN ANÁLISIS QUÍMICO, BIOQUÍMICA Y ESTRUCTURAS Y MODELIZACIÓN COMPUTACIONAL.
El Instituto Universitario Fernández-Vega está en permanente contacto con la actividad clínica e investigadora.
Acuerdo con la Universidad de Oviedo
Existe un convenio del Instituto Oftalmológico Fernández-Vega con la Universidad de Oviedo que tiene como objeto fomentar la formación práctica. Cada curso reciben formación práctica estudiantes de la asignatura de oftalmología del Grado de Medicina y realizan prácticas de empresa estudiantes de distintos grados.
Tanto el Instituto Oftalmológico como la FIO cuentan con acuerdos con centros de Formación Profesional para la formación práctica de estudiantes. Acuerdos FP


Director del Instituto Universitario “Fernández-Vega” (2016) y Catedrático de la Universidad de Oviedo (2019).
seco, cirugía refractiva, uveítis y medicina regenerativa ocular. Licenciado en Medicina y Cirugía en la Universidad de Valladolid (1986), Especialista en Oftalmología (1992), Doctor en Medicina y Ci-
Al terminar la residencia, hizo la Alta Especialidad (Fellowship) en Inmunología Ocular y Uveítis en el Massachusetts Eye and Ear In-
formación postgraduada en Cirugía Refractiva en la Universidad Autónoma de Bucaramanga (Colombia, 1997) y los estudios de Óptica y Optometría en la Universidad CEU-San Pablo de Madrid (2002). Su formación en Gestión es un Máster en Dirección y Administración de Empresas (EAP, 1997); Especialista Universitario en Evaluación,
dirección y gestión de fundaciones (1999).
600 participaciones en congresos, cursos y seminarios. Sus publicaciones cuentan con 10.863 citas. Ha participado en 93 proyectos de investigación (66 como Investigador Principal), ha dirigido 24 tesis

Doctor en Medicina y Cirugía por la Universidad de Oviedo, realizó la especialidad de Medicina Interna en el Hospital Universitario Central de Asturias y es Máster en Virología Médica y Virología General por el Instituto Pasteur de París.
Realizó una estancia de 2 años en el Hospital Bichat-Claude Bernard de París (Laboratorio de Virología) como becario del Fondo de Investigaciones Sanitarias (FIS).
Posteriormente realizó una estancia de 6 meses en el Instituto Nazionale per la Ricerca sul Cancro (IST)-Genova.
Ha trabajado como facultativo especialista de área en los hospitales asturianos de Valle del Nalón, Jove y Cabueñes.
Comunitario de Sangre y Tejidos de Asturias y actualmente dirige el propio Banco de Tejidos.
Desde 2012 desarrolla un programa de Medicina Regenerativa en Oftalmología en la Fundación de Investigación Oftalmológica del Instituto Universitario Fernández-Vega.
Tiene publicados 80 trabajos en revistas internacionales de Medicina regenerativa y solicitadas 8 patentes en dicho campo.
Ha codirigido 10 Tesis Doctorales relacionadas con ingeniería tisular.
Ha participado en 14 proyectos de investigación.
Ha participado en más de 60 congresos internacionales y ha sido profesor en dos cursos de formación organizados por la Agencia Internacional de Energía Atómica.

Licenciado en Ciencias Biológicas por la Universidad de Salamanca. Doctor Cum Laude en Neurobiología por la Universidad de Valladolid, en la que fue profesor de Histología, de Biología y de Biología Celular. Es profesor en el Máster en Investigación en Neurociencias por la Universidad de Oviedo y coordinador de los Seminarios de Investigación del IUFV.
especializadas en el campo de la reparación tisular y la regeneración nerviosa, es autor de 9 capítulos de libro y coautor de una patente internacional.
de ellos.
Mantiene colaboraciones con la Universidad de L’Aquila (Italia), Universidad de Valladolid (Grupo de Investigación Reconocido (GIR) en Neurobiología), Hospital 12 de Octubre (Madrid) y CIMUS (Santiago de Compostela).
Es Académico Correspondiente de la Real Academia de Medicina y Cirugía de Valladolid, miembro del Instituto de Neurociencias del Principado de Asturias (INEUROPA), del Instituto de Investigación de
ISCIII. Miembro de la Comisión Permanente del Reference Site de Asturias para el Envejecimiento Activo y Saludable.
En la actualidad desarrolla su actividad como Investigador Principal en la línea de investigación en Biología Celular e Inervación de la Su-
Oftalmológica y coordina el laboratorio de Histología y Microscopía.

Ocular de la Fundación de Investigación Oftalmológica (FIO) y es colaboradora de Honor del Departamento de Especialidades Médico-Quirúrgicas de la Universidad de Oviedo.
comenzó su carrera investigadora en el departamento de Biología Investigadora en el Programa de Doctorado de Biología Funcional y Clínica. Tras su paso por diferentes instituciones sanitarias públicas y privadas, en el año 2012 se incorporó como investigadora a la FIO, su tesis doctoral, titulada “Desarrollo de endotelio corneal mediante Ingeniería Tisular para empleo en trasplante”, siendo actualmentegías oculares cornales, con dos líneas de investigación principales:sarrollo de modelos corneales para su utilización en la evaluación de fármacos.
Ha participado en diferentes proyectos de investigación de concurrencia competitiva, siendo la investigadora principal de dos de ellos; ámbito internacional; y ha presentado más de 30 trabajos de investigación en congresos nacionales e internacionales. En los próximos años su actividad se centra en llevar a cabo la traslación clínica de los modelos tisulares desarrollados, y en el desarrollo de nuevos modelos terapéuticos y de testeo.

Doctor en Química con Mención Internacional.
Investigador Colaborador en el marco del Plan General de Actuación entre el CSIC, la FIO y el IOFV.
Investigador postdoctoral de la FIO de 2010 a 2016. Investigador Principal y Director de la Unidad de Genética ocular de 2016 a 2022.
Director del Grupo “Analytical Nutriageing” en el IPLA-CSIC e Investigador Colaborador del Grupo de Genética Ocular, Alimentación y Salud Visual de la Fundación de Investigación Oftalmológica.
Profesor del Máster Universitario Internacional en Ciencias Analíticas y Bioanalíticas de la Universidad de Oviedo.
Ha dirigido, como IP, nueve proyectos de investigación de concurrencia competitiva y dos contratos con empresas.
rrespondencia.
Ha dirigido 3 Tesis Doctorales y co-dirige 2 en curso.
Ha participado en más de 90 congresos internacionales y en más de 12 proyectos de investigación competitivos.
Ha realizado estancias de investigación en la Universidad de Creta y en el Imperial College London.

Investigadora Principal en el Grupo de Genética Ocular, Alimentación y Salud Visual de la Fundación de Investigación Oftalmológica.
Licenciada en Biología con premio extraordinario de Licenciatura, comenzó su carrera investigadora en el Departamento de Biología Funcional de la Universidad de Oviedo, donde realizó su tesis doctoral en el área de Genética. Posteriormente disfrutó de una beca de investigación postdoctoral en el Instituto Universitario de Oncología del Principado de Asturias. En el año 2009 se incorporó a la Unidad de Genética Ocular de la FIO como investigadora asociada, centrando sus investigaciones en el análisis del componente genético del glaucoma y en la búsqueda de biomarcadores para su diagnóstico precoz.
de ámbito internacional, ha presentado más de 40 trabajos de investigación en congresos nacionales e internacionales y ha participadotiva.
en el grupo de Genética Ocular, Alimentación y Salud Visual de la FIO, están enfocados al estudio del papel de los elementos esenciales y los suplementos nutricionales en las, cada vez más prevalentes, enfermedades oculares asociadas a la edad, principalmente en lalizan abordajes multidisciplinares que integran técnicas avanzadas nuevas dianas terapéuticas que permitan el desarrollo de tratamientos para mejorar la salud visual durante el envejecimiento.

Investigadora Principal en el Grupo de Genética ocular, Nutrición y Salud visual de la Fundación de Investigación Oftalmológica (FIO) y es profesora asociada del Departamento de Morfología y Biología Celular de la Universidad de Oviedo.
gadora en el departamento de Biología Molecular y Bioquímica de la Universidad de Oviedo, donde defendió su tesis doctoral, titulada “Anexinas-Evolución molecular, predicción de nuevos motivos funcionales y estudios experimentales de modelos atípicos”.
En el año 2011 se incorporó como investigadora postdoctoral del Instituto Oftalmológico Fernández-Vega, adscrita a la Unidad de Genética Ocular, creciendo profesionalmente dentro del instituto hasta alcanzar en 2020 su rol actual.
oculares asociadas a la edad más prevalentes y devastadoras, como la degeneración macular asociada a la edad (DMAE) y el glaucoma, desde un abordaje multidisciplinar y con proyección traslacional. En el área del glaucoma, ha contribuido en los últimos años a la identide variantes de riesgo genético asociadas al glaucoma pseudoexfoliativo.
En los próximos años contribuirá al estudio de la relación entre la alimentación, los nutrientes, el envejecimiento poblacional y las alteraciones de la visión.

Investigadora Principal del Grupo de Neurobiología de la Retina de la Fundación de Investigación Oftalmológica (FIO) desde el año 2020. Es Licenciada en Biología por la Universidad de León, con Máster en Investigación en Ciencias de la Visión por la Universidad de Valladolid y Doctora por la Universidad de Oviedo con un trabajo de Tesis Doctoral sobre neuroprotección en glaucoma.
de proyectos de investigación de convocatorias competitivas y no
30 trabajos en revistas internacionales especializadas de impacto y divulgando los avances en la investigación en más de 40 trabajos en congresos nacionales e internacionales. En colaboración con otras organizaciones, cuenta con una patente.
En el ámbito docente es colaboradora de Honor del Departamento de Especialidades Médico Quirúrgicas de la Universidad de Oviedo desde 2013 y profesora, desde 2018, en el Máster de Neurociencias de la Universidad de Oviedo. Coordina la asignatura “Seminarios
ciencias de la visión” y dirige trabajos de Fin de Grado de la Universidad de Oviedo que se realizan en colaboración con el Instituto Universitario Fernández-Vega. Además, la alta capacidad docente de sus proyectos de investigación le permite ayudar en la formación de nuevos investigadores con la dirección de trabajos de tesis doctoral. Sus líneas de investigación se centran en el estudio de los mecanismos moleculares que se producen en las degeneraciones retinianas como el glaucoma y la degeneración macular asociada a la edad (DMAE) para la búsqueda de dianas terapéuticas. Además, trabaja en el desarrollo de nuevos tratamientos neuroprotectores para dichas enfermedades, en el que se incluyen la medicina regenerativa y las terapias avanzadas. Todo ello con un enfoque de investigacióntema sanitario.
El Instituto Oftalmológico Fernández-Vega contribuye a la buena marcha de los proyectos de la Fundación de Investigación Oftalmológica mediante aportaciones económicas y la cesión de sus instalaciones para los laboratorios en los que desarrolla, básicamente, su cometido. Es, de este modo, su principal patrocinador.
La Fundación BBVA colabora con la Fundación de Investigación Oftalmológica, desde el año 2009, a través de la Cátedra en Biomedicina Fundación BBVA. Ha suscrito en 2023 un nuevo convenio de colaboración con aplicaciones novedosas para el tratamiento de las patologías asociadas.
Telefónicación de Investigación Oftalmológica y, al amparo del nuevo convenio suscrito entre ambas entidades, la FIO ha desarrollado el siguiente proyecto: “Desarrollo mediante técnicas de Ingeniería Tisular de estructuras con actividad biológica obtenidas a partir de productos autólogos y/o heterólogos para su empleo en la patología ocular”.
La Fundación Ramón Areces presta su colaboración especialmente a proyectos relacionados con patologías
Fundación Endesa colabora en el ejercicio 2023 apoyando la investigación con el proyecto “Neuroprotección en Retina”.
Staar Surgical AG ha becado parte de la investigación clínica durante el año 2023.

La Fundación Caja Rural -
La Fundación Rafael del Pino un convenio de colaboración, entre ambas entidades, en el año 2009. Proyecto desarrollado durante 2023: “Nuevos abordajes para el estudio de enfermedades oculares neurodegenerativas: Glaucoma y Degeneración Macular Asociada a la Edad (DMAE)”.

La FIO cuenta además con el apoyo económico, desde el año 2009, de D. Tomás Rey Gómez y con la igualmente inestimable colaboración de Dña. Mercedes Saez-Díez de la Gándara, entre otros particulares.
La Fundación de Investigación Oftalmológica agradece las donaciones, para proyectos de investigación, de todos los pacientes que, voluntariamente y de una forma anónima, vienen colaborando con nuestra actividad.


DIRECCIÓN DE LA FUNDACIÓN DE INVESTIGACIÓN OFTALMOLÓGICA
PATRONATO
Presidente: Prof. Luis Fernández-Vega Sanz.
Secretaria: Dña. María Victoria Cueto-Felgueroso Botas.
Tesorero: D. Luis Ángel Machín Gutiérrez.
Vocales: D. Álvaro Fernández-Vega Sanz y D. Javier Fernández-Vega Sanz.
DIRECCIÓN DE INVESTIGACIÓN Y DOCENCIA
Prof. Jesús M. Merayo Lloves.
EQUIPO ASESOR, GERENCIA Y GESTIÓN
Asesores del Presidente: Prof. Carlos Belmonte Martínez, D. Enrique Chico Picaza, D. Gonzalo Macías Gómez, Dr Luis Fernández-Vega Cueto-Felgueroso y Dr Álvaro Fernández-Vega González.
Gerencia: D. Luis A. Machín Gutiérrez.
Administración: D. Alfredo Cernuda Albuerne.
COMISIÓN DE INVESTIGACIÓN
Dr. José F. Alfonso Sánchez, Prof. Carlos Belmonte Martínez, Prof. Jesús M. Merayo Lloves, D. Luis A. Machín Gutiérrez y Dr. Luis Fernández-Vega Cueto-Felgueroso.
DIRECCIÓN DEL INSTITUTO UNIVERSITARIO FERNÁNDEZ-VEGA
COMISIÓN MIXTA UNIVERSIDAD DE OVIEDO-FUNDACIÓN DE INVESTIGACIÓN OFTALMOLÓGICA
Presidente: Prof. Ignacio Villaverde Menéndez (Rector de la Universidad de Oviedo).
Secretario: Prof. Jesús M. Merayo Lloves (Director de Investigación y Docencia de la FIO).
Vocales: Prof. Luis Fernández-Vega Sanz (Presidente del Patronato de la FIO), Dr. Álvaro Fernández-Vega Sanz (Vocal del Patronato de la FIO), Dra. Begoña Baamonde Arbaiza (Profesora del Área de Oftalmología) y Dr. José Antonio Vega Álvarez (Decano de la Facultad de Medicina y Ciencias de la Salud).
CONSEJO DE DIRECCIÓN
Presidente: Prof. Luis Fernández-Vega Sanz.
Secretario: D. Luis Ángel Machín Gutiérrez.
Vocales: Dr. Luis Fernández-Vega Cueto-Felgueroso, Prof. Carlos Belmonte Martínez, D. Enrique Chico Picaza, D. Gonzalo Macías Gómez, Prof. Jesús M. Merayo Lloves y Dr. Álvaro Fernández-Vega González.
DIRECTOR
Prof. Jesús M. Merayo Lloves.
SUBDIRECTOR
Dr. Luis M. Quirós Fernández.
COORDINADORA DE DOCENCIA
Dra. Begoña Baamonde Arbaiza.
COORDINADORES DE UNIDADES
Investigación Traslacional: Prof. Jesús Merayo Lloves.
Investigación Clínica: Dr. José F. Alfonso Sánchez.


ÁREAS DE INVESTIGACIÓN:
INVESTIGACIÓN BÁSICA
Neurobiología de la retina
Genética ocular, Nutrición y Salud visual
Glicómica, matriz y señalización.
INVESTIGACIÓN TRASLACIONAL
Medicina regenerativa y terapias avanzadas
INVESTIGACIÓN CLÍNICA (IOFV)
Segmento anterior / córnea
Retina
Glaucoma

Investigación Básica
Esta área de investigación básica la trabaja el Grupo de Investigación en Biología Celular e inervación de
Se dedica a la investigación de algunos de los problemas no resueltos de la neurobiología ocular y de la medicina regenerativa: el ojo seco, la regeneración
dolor ocular y el queratocono. La actividad del grupo une la investigación preclínica con el estudio clínico
Los esfuerzos del Grupo se concentran en la descripción de los procesos degenerativos que afectan
ocular como en la retina. La caracterización de biomarcadores morfofuncionales de neuropatía y neurodegeneración permite el diseño de estrategias te-
Cuenta con una línea de investigación: Degeneración y regeneración del Sistema Nervioso en la A su vez, esta línea acoge dos proyectos:
- Mecanismos de regeneración nerviosa y neuroprotección.
- Efecto de las enfermedades neurodegenerativas en la neurobiología ocular.
Investigadores principales junto al Prof. Jesús Merayo Lloves:
Equipo Investigador:
Investigadores:
Dr. Ignacio Alcalde.
Prof. Jesús Merayo.
Dña. Cristina Sánchez.
Dña. Rosa Alvarado.

Dr. Ignacio Alcalde Domínguez
Clínicos IOFV:
Dr. José F. Alfonso.
Dra. Begoña Baamonde.
Dr. Luis Fernández-Vega Cueto-Felgueroso.
Dña. Belén Alfonso.
Dña. Carmen Carús.
D. Javier Lozano.
D. Alberto Barros.
Colaboradores Externos:
Dr. Luis M. Quirós (IP, Universidad de Oviedo).
Dr. Iván Fernández Vega (PhD, HUCA - Universidad de Oviedo).
Dr. Eva Carro (IP, Hospital 12 de Octubre).
Dra. Silvia Bisti (IP, Universitá de L’Aquila, Italia).
Dr. Stefano Di Marco (PhD, Istituto Italiano di Tecnologia. Génova, Italia).
Dña. María José Alonso (IP, CIMUS - Universidad de Santiago de Compostela).
Dña. Anna Abbadessa (IP, PhD, CIMUS - Universidad de Santiago de Compostela).
DEGENERACIÓN Y REGENERACIÓN DEL SISTEMA NERVIOSO EN LA SUPERFICIE OCULAR
PROYECTO I: MECANISMOS DE REGENERACIÓN NERVIOSA Y NEUROPROTECCIÓN
REGENERACIÓN NERVIOSA
Existe un interés creciente en el estudio de las alteraciones neurosensoriales de la inervación corneal relacionadas con la enfermedad de ojo seco (EOS). La microscopía confocal corneal in vivo (MCIV) es una técnica segura y no invasiva para el estudio y análisis de la inervación corneal. Recientemente, varios estudios han utilizado la MCIV para analizar los cambios en el plexo nervioso subbasal en la EOS y también para evaluar las diferencias en la inervación entre los distintos tipos de ojo seco. Esta
técnica se ha utilizado para analizar la inervación corneal en diferentes afecciones oculares, como en enfermedades sistémicas como la diabetes. Más recientemente, la MIVC se ha utilizado para evaluar los cambios en el plexo nervioso subbasal de pacientes afectados por enfermedades neurodegeParkinson, la esclerosis múltiple e incluso nuestro grupo describió por primera vez su uso para evaluar
por Sars-CoV-2. Los tratamientos actuales para la EOS incluyen la hidratación ocular con lágrimas ar-
máticos han ido ganando protagonismo en el tratamiento de la EOS, destacando el Suero Autólogo (SA), que fue el primer derivado hemático autólogo que se utilizó para el tratamiento de la EOS. En los últimos años, nuestra institución ha desarrollado un colirio a base de derivados hemáticos, conocido como PR-
GF-Endoret® (BTI, Vitoria, España) que es un plasma rico en factores de crecimiento. Los tratamientos con PRGF han demostrado efectos regenerativos sobre -
postoperatorios. A pesar de la existencia de numero-
telial y estromal, se conoce muy poco sobre el efecto del tratamiento con PRGF en la reparación de la inervación corneal.
Pacientes con ojo seco evaporativo y con ojo seco en el IOFV y examinados mediante MCIV para analizar la morfología del plexo nervioso subbasal de la córnea. Los resultados del estudio apuntan a que la de un tratamiento convencional en términos de regeneración del plexo nervioso subbasal, aumentando
tivamente la estabilidad de la película lagrimal anali-

Figura 1. con un paciente con enfermedad de ojo seco, tomadas mediante microscopía confocal in vivo. Las líneas coloreadas son el resultado de la detección automática de los elementos nerviosos para su análisis cuantitativo (tomado de Barros et al.,
Debido a la alta concentración en factores de crecimiento, los colirios de PRGF promueven una serie de acontecimientos biológicos, como la proliferación, migración y diferenciación celular, al tiempo que protegen contra la contaminación microbiana
concentración de la mayoría de los factores de crecimiento en las formulaciones de PRGF que en las de SA. Entre los factores de crecimiento, se ha demostrado que el NGF estimula la proliferación del epitelio corneal y promueve la regeneración del plexo nervioso subbasal.
Nuestros resultados sugieren que el tratamiento combinado con PRGF en pacientes con ojo seco por -
el que se promueve la regeneración corneal. Esto
induce una mejora en la estabilidad y cantidad derios y factores de crecimiento, que crean el contexto perfecto para el proceso de reinervación corneal y -
ración nerviosa en comparación con el grupo tratado con tratamiento convencional. En los pacientes con ojo seco evaporativo el tratamiento también contri-
no resuelve la patología palpebral que es central en este tipo de ojo seco. En cualquier caso, nuestra investigación ha demostrado un efecto potenciador de la regeneración nerviosa por parte del PRGF y como dato importante, hemos planteado una correlación directa entre regeneración nerviosa del plexo subba-
secreción.
La integridad y la transparencia de la córnea dependen en gran medida del correcto funcionamiento del
ser un sistema de alerta extremadamente sensible, la inervación sensitiva de la córnea juega un papel importante en la homeostasis del epitelio. Es conocida la relación entre la infección o la lesión de las aferencias sensitivas del trigémino y la aparición de lesiones en la córnea, incluyendo la formación de úlceras y perforaciones. Por otro lado, los nervios
córnea y son el fundamento del dolor neuropático. Enfermedades altamente prevalentes como el ojo relacionadas con alteraciones en la inervación de la córnea. Estas enfermedades causan un gran impacto en la percepción individual de la pérdida de calidad de vida.
Aparte de algunas enfermedades conocidas, los segmentos distales de los receptores sensitivos de la córnea se ven afectados por procesos degenerativos continuos cuyas causas no son bien conocidas. El proceso natural de envejecimiento produce una disminución en la densidad de terminaciones sensitivas en la córnea y contribuye a la aparición de sintomatología similar a la de la enfermedad de ojo seco. Recientemente se ha descrito que la degeneración -
vas está directamente relacionada con la generación de la sequedad ocular. Una de las causas más pro-
bables de degeneración de los elementos neurales de la córnea es la acumulación de especies reactivas del oxígeno (ERO) por causa del estrés oxidativo (EO). Durante el envejecimiento, así como ante la exposición a otros daños oxidativos continuados,
ERO incompatibles con un funcionamiento normal.
Los efectos del EO sobre los tejidos y órganos son generalmente bien conocidos y se sabe que el EO
agrava o desencadena procesos patológicos relael efecto del EO sobre la inervación de la córnea es prácticamente desconocido. Nuestro grupo de investigación ha descrito de manera exhaustiva los daños de las terminaciones nerviosas de la córnea causados por distintas fuentes de ERO. Nuestros datos sugieren la implicación de la disfunción de la actividad mitocondrial como inductora de procesos degenerativos en los extremos distales de las neuronas sensitivas que inervan la córnea. Tras
N acetilcisteína, la rapamicina y la crocina (un derivado del azafrán), para la prevención de la lesión oxidativa de la inervación de la córnea. Nuestros datos sugieren que una formulación tópica basada en nuestras propuestas, podría reducir el impacto de los procesos oxidativos asociados a enfermedaenvejecimiento.
Investigación Básica
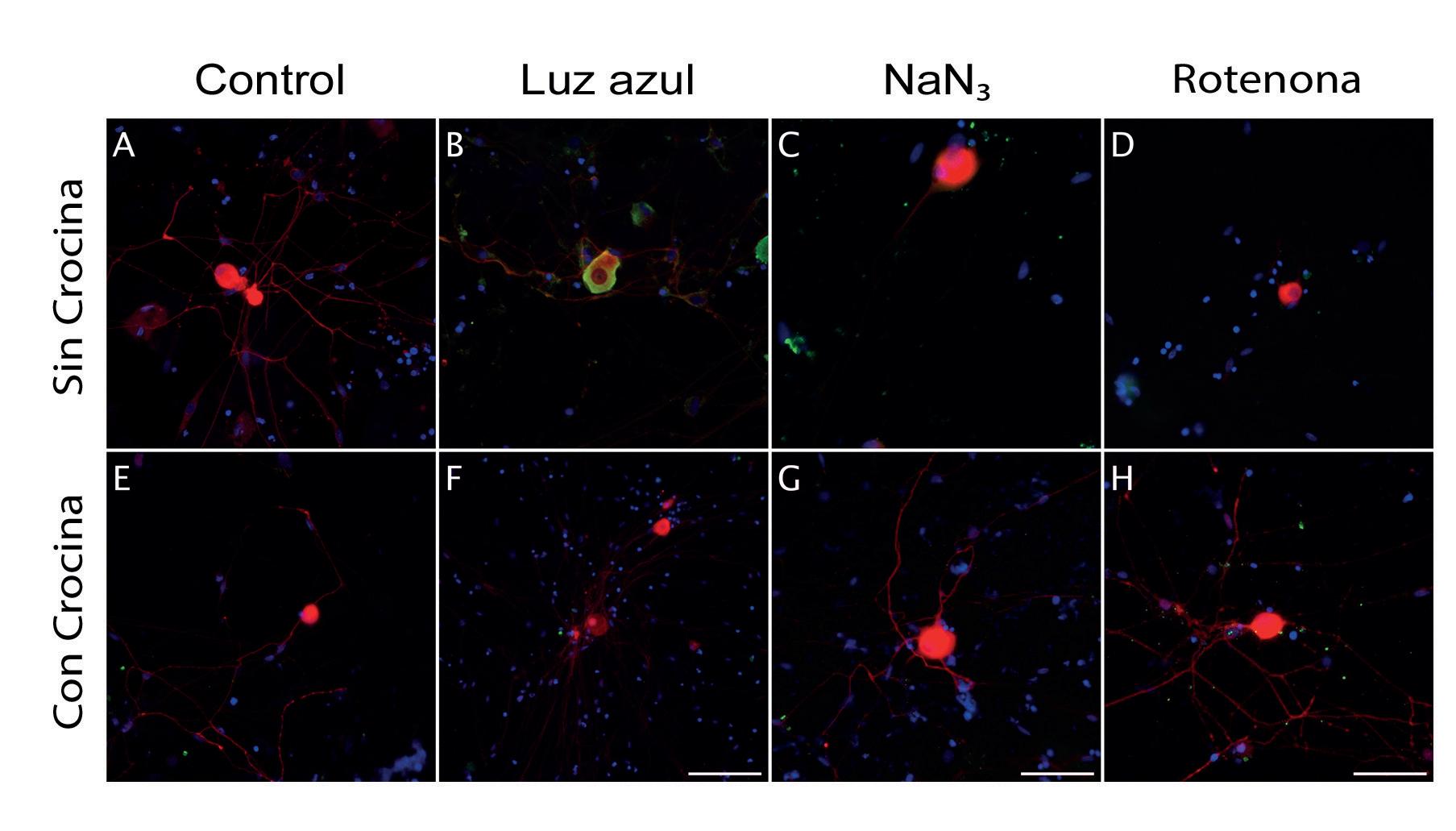
Figura 2.drítica de las neuronas se ve reducida respecto al control (A) a la vista de la detección de la proteína asociada al citoesqueleto, tau. Además, la enzima CaMKII (calmodulina quinasa II) se activa en respuesta al estrés oxidativo, especialmente cuando se estimula con densidad de neuritas en los cultivos tratados con crocina antes del daño, así como la reducida expresión de CaMKII. (Barras de
EFECTO DE LAS ENFERMEDADES NEURODEGENERATIVAS EN LA NEUROBIOLOGÍA OCULAR
La retina está conectada al sistema nervioso central (SNC) por el tracto retino-hipotalámico (TRH), formado por los axones de las neuronas ganglionares de la retina. La información visual y luminosa se transporta desde la retina al cerebro a través del TRH. Al formar parte del SNC es susceptible de manifestar signos patológicos de enfermedades neurodegenerativas como el Parkinson o la enfermedad de Alzheimer (EA). Nuestro grupo de investigación, en colaboración con investigadoras del Hospital 12 de Octubre, ha descrito la presen-
modelo murino de EA. Este modelo de ratón también presenta niveles reducidos de neurotransmisores como la acetilcolina o el GABA. La reducción
de GABA en la retina coincide con la disminución de la expresión de GAD (su enzima de síntesis) en neuronas hipotalámicas. La disfunción de las vías GABAérgicas y la pérdida de neuronas GABAérgicas están directamente implicadas en la patogénesis de la EA. Las neuronas ganglionares de la retina son principalmente GABAérgicas (la información de la retina se envía al SNC transformada en este neurotransmisor).
Nuestra investigación también ha descrito una reducción en los niveles retinianos de colín-acetil transferasa, que es la enzima que cataliza la producción de acetilcolina, uno de los principales neurotransmisores excitatorios de la retina. Se ha
relacionado la presencia de oligómeros o agregados
colinérgicas. En la retina de ratones con EA se observa una disminución en el número de neuronas amacrinas starburst, que son las únicas neuronas colinérgicas de la retina. Dado que la acetilcolina y el GABA son liberados conjuntamente por las células amacrinas Starburst para modular la transmisión sináptica rápida, sugerimos que el procesamiento de las señales luminosas está seriamente comprometido en la retina de ratones EA.
Estas alteraciones morfológicas de la retina afectan a la función visual, como hemos comprobado mediante el estudio de la electrorretinografía de los ratones. Se han descrito disfunciones a nivel de los potenciales oscilatorios y de las capas internas de la retina.
Además, también hemos encontrado pérdida de neuronas ganglionares melanopsínicas (producen melanopsina) en la retina de los ratones con EA. Es-
tas neuronas son las encargadas de transmitir la información luminosa que no va a ser empleada para la formación de imágenes, sino para la evaluación de la intensidad lumínica ambiental. Están conectadas directamente con el hipotálamo a través del TRH y la información luminosa que portan sirve para sincronizar los ritmos circadianos endógenos de luz y oscuridad. La reducción de la transmisión de neurotransmisores desde las células ganglionares altera el ritmo circadiano hipotalámico en los ratones EA. Las alteraciones del ritmo circadiano se han postulado como indicadores tempranos de neurodegeneración de tipo EA en humanos.
Todos estos cambios han sido detectados en ratones de edad joven, sin signos conductuales de declive cognitivo. Dado que la retina es una parte del sistema nervioso central que es accesible fácilmente mediante métodos no invasivos, estos hallazgos podrían suponer un avance en la detección temprana de los signos de la EA y adelantar un abordaje neuroprotector en los pacientes.

Figura 3. Alteraciones morfológicas en la retina de ratones transgénicos APP/PS1 que cursan con degeneración neuronal de tipo Alzheimer. Las neuronas amacrinas colinérgicas (ChAT) disminuyen levemente en número en función de la edad en ratones normales (WT) y muy bruscamente en los transgénicos de Alzheimer (APP/PS1). Además, se observa una reducción en la expresión de la proteína GAD (precursora de los neurotransmisores glutamato y GABA) en los ratones APP/PS1, evidenciando una patología localizada et al.
Investigación Básica
Este grupo, en colaboración con la Universidad de Oviedo, centra su actividad en el estudio de la señalización celular mediada por proteoglicanos (PGs) y glicosaminoglicanos (GAGs) desempeñan en el desarrollo de diferentes patologías oculares, así como como vesículas extracelulares.
Cuenta con dos proyectos en marcha:
ocular modulados por la microbiota para su apli-
cación en queratitis infecciosas y regeneración corneal.
- Aplicación de nanovesículas como método diagcorneal. Estimulación de los factores de virulencia de patógenos oculares inducida por exosomas producidos por células corneales.
Investigadores principales junto al Prof. Jesús Merayo Lloves:

Dr. Luis M. Quirós Fernández

Prof. Fernando Vázquez Valdés
Doctor en Biología, especialidad Biología Fundamental, por la Universidad de Oviedo con Premio Extraordinario. Investigador experto en síntesis de moléculas bioactivas, antibióticos y antitumorales ha trabajado en el Departamento de Bioquímica de la Universidad de Cambridge y en el Departamento de Biología Fundamental, Área Microbiología, de la Universidad de Oviedo donde es actualmente Profesor Titular. Durante 8 años dirigió el grupo de investigación sobre proteoglicanos y cáncer del Instituto de Oncología del Principado de Asturias (IUOPA). En la actualidad, es el subdirector del Instituto Universitario Fernández-Vega (IUFV) y director del grupo Grupo de Investigación en Glicopatología, Oftalmología y Terapias Avanzadas de la Universidad de Oviedo. Tiene más de 100 publica-
Doctor en Medicina y Cirugía por la Universidad de Oviedo. Realizó su especialización clínica posdoctoral en Microbiología y Parasitología en la Universidad de Leicester (Reino Unido). En la actualidad es Jefe del Servicio de Microbiología y Director del Área de Gestión Clínica del Laboratorio de Medicina del Hospital Universitario Central de Asturias (HUCA), Catedrático de Universidad Vinculado de la Facultad de Medicina de Oviedo y recientemente nombrado Académico de Número de la Real Academia de Medicina del Principado de Asturias. Tiene más de 200 publicaciones, 36 capítulos de libros, 30 proyectos de investigación, 6 patentes, y 19 premios.
Equipo Investigador:
Investigadores:
Dr. Iván Fernández Vega. Dra. Noelia Blanco.
Los PGs son moléculas complejas integradas por covalentemente cadenas de GAGs. Se sitúan pre-
extracelular (Figura 1)

Los GAGs son polisacáridos lineales integrados por un disacárido unidad que se repite un número de veces variable, de docenas a centenares. Depen-
diendo de la estructura química de este disacárido, existen 4 especies diferentes de GAGs (Figura 2).

Figura 2. Estructura del disacárido base que forma los 4 tipos fundamentales de glicosaminoglicanos.
Investigación Básica
PROYECTO I:
DESARROLLO DE GLICOSAMINOGLICANOS DE SUPERFICIE
LAR
La hipótesis de partida del estudio se sustenta en el hecho de que las bacterias presentes sobre la suinteraccionar con el epitelio corneal produciendo
Por otra parte, los PGs y GAGs son esenciales en dinámicas, y sufren rápidas alteraciones en función células. Además, nuestros estudios previos han mostrado 2 hechos relevantes:
corneal, particularmente el HS, como receptores de adhesión.
2. La adherencia bacteriana a las células epiteliales modula la expresión de PGs y GAGs. Basándonos en las consideraciones anteriores, el primer objetivo de este estudio ha sido determinar el efecto de EVs sobre los PGs y GAGs de la super-
El estudio se realizó tanto empleando Staphylococcus aureus como modelo de comensal de la microbiota, y Pseudomonas aeruginosa como modelo de patógeno ocular. A partir de cultivos de estos
centrifugación. Una vez obtenidas, se añadieron a cultivos de células corneales.
Posteriormente, se analizó la variación en los nivemediante PCR en tiempo real.
La adición de MVs de S. epidermidis alteró la expresión de 7 genes, siendo 4 sobreexpresados y 3 subexpresados (Figura 4). Sin embargo, la adición de vesículas de P. aeruginosa a las células corneales resultó en la alteración de la transcripción de 24 (Figura 5)

Figura 4. Resumen de las diferencias en expresión de genes de PGs y GAGs inducidas por EVs de Staphylococcus epidermidis. Se representa la diferencia en ciclos cada gen frente al –log10 del valor diferentes familias de genes aparecen remarcadas por distintos símbolos. (SLRPs: Small leucin rich proteoglycans; KS: queratán sulfato; Ha: ácido hialurónico.
El heparán sulfato (HS) y el condroitín sufato (CS)lular y en la matriz pericelular. Tras la polimerización de las cadenas, tienen lugar diferentes reacciones
Estas sulfataciones se producen de modo controlado por las células, generando moléculas complejascuencias cortas (dominios) ordenados secuencialmente (Figura 3)

3.
secuencias aporta información espacial que lestitud de diferentes ligandos. Estas interacciones funciones celulares, incluyendo adhesión, migración, proliferación, diferenciación y morfología celular, endocitosis y diferentes procesos metabólicos. Mediante el control de estas funciones, desempeñan papeles esenciales en la regulación de diversos
nutricional, la morfogénesis, la organización de las membranas basales, la cicatrización, la hemostasis, inmune o la señalización intercelular. Dentro de la señalización celular, desempeñan funciones críticas mediadas por su capacidad de unión selectiva a diferentes ligandos, tanto solubles como insolubles, así como de vesículas extracelulares, incluyendo exosomas o vesículas microbianas (EVs).

En cuanto a las conclusiones y posibilidades de desarrollo del estudio, se ha demostrado que el contacto de MVs con células de epitelio corneal induce alteraciones en la transcripción de genes síntesis de las cadenas sacarídicas de GAGs. P. aeruginosa es un patógeno comúnmente conocido, cuyas vesículas son capaces de producir altecaso de S. epidermidis, considerado un microorganismo comensal, pero también responsable de enfermedades infecciosas, sus vesículas provocannes. Tanto las vesículas de S. epidermidis como
PROYECTO II:
Figura 5. Resumen de las diferencias en expresión de genes de PGs y GAGs inducidas por EVs de Pseudomonas aeruginosa. Se representa la diferencia en ciclos cada gen frente al –log10 del valor diferentes familias de genes aparecen remarcadas por distintos símbolos. (SLRPs: Small leucin rich proteoglycans; KS: queratán sulfato; Ha: ácido hialurónico).
de P. aeruginosa producen principalmente una sobreexpresión de aquellos genes relacionados con subexpresados están mayoritariamente implicados en la síntesis de proteínas centrales de PGs. Estos resultados conducen a plantear el estudiolas corneales, y sus implicaciones en patogénesis, respuesta inmune y regeneración corneal. También abren la posibilidad del empleo de EVs como encapsuladoras de fármacos. Esta tecnología se está desarrollando actualmente en patologías de otros tejidos, pero no existe ningún estudio sobre patologías oculares.
APLICACIÓN DE NANOVESÍCULAS COMO MÉTODO DIAGNÓSTICO Y TERAPÉUTICO DE PATOLOGÍAS DE SUPERFICIE CORNEAL. ESTIMULACIÓN DE LOS FACTORES DE VIRULENCIA DE PATÓGENOS
OCULARES INDUCIDA POR EXOSOMAS PRODUCIDOS POR CÉLULAS CORNEALES epitelio corneal y la capa acuosa de la lágrima se in- acuosa de la lágrima está integrada por numerosos componentes, incluídos exosomas liberados por
las células epiteliales. Los exosomas son nanovenm, que desempeñan papeles esenciales en la comunicación intercelular. Este trabajo abordó el aná-
la capacidad de los microorganismos de penetrar la capa de mucina e iniciar el proceso infeccioso, comenzando por la adherencia a las células epiteliales, y la posterior invasión.
La base de la capacidad infecciosa de los microorganismos patógenos se encuentra en la disponibili-
dad de una serie de factores de patogenicidad cuya activación permite funciones como adherencia, invasión, evasión del sistema inmune o toxicidad.
El objetivo concreto de este estudio fue la determinación del efecto de los exosomas producidos por el epitelio corneal sobre la activación de factores de patogenicidad de microorganismos infectivos. Para
células epiteliales corneales (Figura 6,A).

Los exosomas se adicionaron a cultivos Pseudomonas aeruginosa, y se analizó la transcripción degenicidad (Figura 7)

Los resultados mostraron que los exosomas corneales inducen la expresión de varios genes cohoras. La expresión aumenta tras 16 horas.
Para determinar si la alteración observada era debido a los exosomas como estructura completa o a
su contenido molecular, los exosomas se fragmentaron por sonicación (Figura 6,B), y las bacterias fueron tratadas con esos extractos (Figura 8)

Figura 8. Pseudomonas aeruginosa inducidos por exosomas de células epiteliales corneales sonicados tras 2 y 16 horas.
A tiempos de exposición largos (16 horas), los extractos fueron capaces de inducir la expresión, pero a tiempos cortos (2 horas) no lo hicieron, incluso produjeron un efecto inhibidor sobre algunos genes.
Estos datos demuestran que los exosomas inducen la expresión de factores de patogenicidad por la bacteria, lo hacen a tiempos cortos, y la inducción es dependiente de la estructura intacta del
propio exosoma y no únicamente de su contenido molecular.
De modo análogo, se llevó a cabo un estudio utilizando un microorganismo Gram positivo, Staphylococcus epidermidis. En esta ocasión, la expresiónnicidad se analizó de forma dinámica a distintos tiempos tras el contacto con los exosomas corneales (Figura 9).

Figura 9. Transcripción detores de patogenicidad de Staphylococcus epidermidis inducidos por exosomas de células epiteliales corneales.
De los resultados anteriores, se puede concluir que los exosomas liberados por las células epiteliales corneales inducen la expresión de factores de patogenicidad en microorganismos sin necesidad de contacto con las células. Además, el efecto observado es dependiente de la estructura de los exosomas intactos.teriormente en ningún sistema en nuestro conocimiento, y abre la posibilidad de utilizar el bloqueo de los exosomas en la lágrima como factor antimicrobiano inhibidor de infecciones.
Investigación Básica
Este grupo de investigación se fundamenta en el abordaje multidisciplinar e innovación tecnológica con el objetivo de desarrollar nuevas vías de tratamiento que mejoren el pronóstico de enfermedades neurodegenerativas que afectan a la retina.
Cuenta con dos líneas de investigación, que a su
Línea de investigación: Estudio de la capacidad terapéutica de nuevas estrategias de tratamiento en enfermedades retinianas. Acoge 3 proyectos:
- Fisiopatología del glaucoma.
- Aplicación terapéutica del plasma rico en factores de crecimiento.
- Fotobiomodulación en glaucoma.
Línea de investigación: Innovación tecnológica para la neuroprotección de las enfermedades neurodegenerativas.
- Una ventana a la neuroprotección: Fotobiomodulación a través de la retina (FOTORENE).
- Healthy lighting II.
Investigadores principales junto al Prof. Jesús Merayo Lloves:
Equipo Investigador:
Investigadores:

Dra. Susana del Olmo Aguado
Dra. Carla Martín Cueto. Dr. Andrés Fernández-Vega Cueto-Felgueroso.
Dr. Ignacio Rodríguez Uña.
Dr. Pedro Pablo Rodríguez Calvo.
Colaborador externo:
Dr. Amador Menéndez Velázquez.
El glaucoma es una neuropatía óptica asociada a la degeneración de los axones de las células ganglionares de la retina, que causa una pérdida de campo visual irreversible. En la etiología de la enfermedad, la edad, es uno de los principales factores de riesgo asociado, aunque existen otros factores como una alta presión intraocular (PIO), la genética u otras patologías previas, como alta miopía o síndrome exfoliativo.
La malla trabecular (MT) es una estructura clave en la regulación de la PIO, ya que es responsable del drenaje del humor acuoso desde la cámara anterior del ojo hacia el canal de Schlemm. Es un tejido con aspecto poroso constituida por tres capas de tejido conjuntivo, formadas, a su vez, principalmente radialmente y están revestidas por células endoteliales. Además, las células de la capa más interna, adyacente al canal de Schlemm, están inmersas en fundamentalmente proteoglicanos e hialuronano, otorgándole a esta capa una arquitectura más compleja y que será la que genere una mayor resistencia a la salida del humor acuoso.
Las células de la MT presentan una elevada actividad metabólica y fagocítica, indispensables para la
correcta eliminación de desechos, presentes en el humor acuoso, y llevar a cabo la remodelación del tejido. El envejecimiento, produce la disminución en la regeneración de las células de la MT y por tanto un desequilibrio en su metabolismo. Se produce un incremento de especies reactivas del oxígeno (ERO) que deriva en estrés oxidativo.
Entre las múltiples respuestas que produce el estrés oxidativo se produce una respuesta inmunitaria atraen otros factores como el factor de crecimientoración del tejido dañado en la MT.lares la producción y deposición de constituyentes in vitro desarrollado en anualidades anteriores, en el que observa un incremento de marcadores relatipo I y tipo IV. Como consecuencia se produce un aumento en la rigidez de la malla provocando un humor acuoso. Además, diversos estudios han determinado que este factor es capaz de aumentar la producción de ERO en células de la MT, creando un
ciclo de retroalimentación positiva que desencadenará el daño en las propias células.
Para contrarrestar el efecto de las ERO y el estrés oxidativo, las células presentan diversos mecanismos de defensa entre los que se encuentra la vía antioxidante Keap1/Nrf2/ARE. Nrf2 es el regulador principal, con un importante papel en la prevención -
lo in vitro
un incremento de proteínas, Nrf2 y Keap-1, a nivel nuclear, así como un aumento de la expresión del gen KEAP1
Esta proteína se encuentra asociada a Nrf2 y regula su traslocación al núcleo para heterodimerizarse
y unirse a las regiones de elemento de respuesta antioxidante (ARE). Este proceso da lugar a la transcripción de enzimas antioxidantes, como es el caso de la hemo-oxigenasa 1 (HO-1), tal como indica la regulación al alza de la expresión del gen HMOX1, y la proteína detectada en las células a las que se les -
to de la expresión de Keap-1 en el tiempo. Por el contrario, Nrf2 presenta unos niveles de expresión génica a la baja, que concuerda con otros estudios donde se han detectado niveles bajos de expresión de Nrf2 en células de malla trabecular de pacientes con glaucoma.

(verde) y Keap-1 (rojo). Los núcleos celulares están marcados con DAPI (azul). Las imágenes muestran tres tiempos de estu-
Además, se observa un cambio en la localización
subcelular de la proteína, que pasa de ser, mayoritariamente citoplasmática a las 24 horas de in-
modo, se observa que la vía antioxidante se activanuida detectada podría indicar una posible alteración subyacente de este sistema antioxidante en la patología glaucomatosa.
El plasma rico en factores de crecimiento (PRGF) es un producto derivado de la sangre, autólogo, con
está siendo estudiado para la protección de la retina con evidencias clínicas favorables hasta la fecha (Sánchez-Ávila et al, 2019). Además, la analogía del humor acuoso con el plasma hace del PRGF una estrategia terapéutica interesante a nivel de la MT.
El empleo del PRGF en el modelo in vitro en células de la malla trabecular reduce la expresión
expresión intracelular de colágeno tipo I y colágeno tipo IV, así como la deposición extracelular de ambos tipos.
Los proteoglicanos son moléculas extracelulares constituidas principalmente por la unión de una cadena de aminoácidos y uno o varios glicosaminoglicanos sulfatados (GAG). Éstos son polímeros nonas de monosacáridos y grupos sulfato cuyas cargas negativas permiten una gran asociación a moléculas de agua, aportando una elevada hidratación a la matriz extracelular. Los tipos más comunes de glicosaminoglicanos en los proteoglicanos son: condroitín sulfato, dermatán sulfato, heparán sulfato y queratán
sulfato. Por ello, los proteoglicanos se pueden agrupar en diferentes familias, en función del tipo de GAG que presenten en su estructura, en: 1. Lecticanos, que presentan una cadena de condroitín sulfato. 2. Pequeños proteoglicanos ricos en leucina (SLRPs), que presentan una o varias cadenas de condroitin sulfato/dermatán sulfato o queratán sulfato.
cano y Asporina), clase II (Lumicano, Queratocano, Fibromodulina, PRELP y Osteoadherina), clase IIIdroadherina, Nyctalopin y Tsukushi) y clase V (Podocan y Podocan- Like 1).
Los SLRPs intervienen en la regulación del colágeen la organización de la matriz extracelular. Algunoscidad de unión a diversos factores de crecimiento presentes en el PRGF. Los estudios realizados, hasta la fecha, muestran que el tratamiento con PRGF
de la deposición de la matriz extracelular. De este modo, podría ser de utilidad en tratamiento del glauhumor acuoso.

Figura 2. Expresión génica de SRLPs. GAPDH fue empleado como control endógeno. One-way ANOVA, test de comparaciones multiple de
Investigación Básica
PROYECTO III:
La fotobiomodulación consiste en modular la energía luminosa y emplearla para estimular respuestas
realiza en la actualidad, bien por láseres de baja energía o por luces tipo LED, con longitudes de onda de la luz situadas en el espectro rojo y el rojo cercano al infrarrojo. Son diversos los estudios que muestran los efectos terapéuticos de la luz roja en diversas áreas médicas destacando las relacionadas con enfermedades del sistema nervioso central. Los mecanismos de acción de la fotobiomodulación aún no han sido completamente elucidados, pero se conocen algunos de ellos, como es la interacción directa a nivel mitocondrial que desencadena un incremento del potencial de membrana mitocondrial y el gradiente de protones, así como la síntesis de ATP, y la síntesis de ARN y de proteína en la mitocondria, lo que se traduce en un incremento de la supervivencia celular.
Se ha descrito que el tratamiento con fotobiomodulación acelera la cicatrización de heridas, reduce el la función vascular. A nivel ocular, los primeros resultados clínicos que hay están enfocados en el tratamiento de la DMAE con resultados que muestran el
Además, el uso de la fotobiomodulación como estrategia neuroprotectora presenta otras ventajas respecto a los tratamientos actuales y están relacionadas con las vías de tratamiento. Los pacientes
con DMAE o glaucoma son pacientes crónicos que requieren de un tratamiento permanente. Algunos de esos tratamientos requieren de procedimientos invasivos repetitivos, no exentos de efectos secundarios que, a menudo, provocan una tasa elevada de abandonos por parte de los pacientes. Las características inherentes de la radiación electromagnética, y más concretamente del espectro rojo, permite que la luz penetre en los tejidos e incida en su diana sin la necesidad de procedimientos invasivos, mejorando la calidad de vida de los pacientes. Por todo ello, el desarrollo de una estrategia neuroprotectora basada en la fotobiomodulación es de gran interés en oftalmología.
Estudios previos del grupo de investigación han mostrado el efecto neuroprotector de la fotobiomodulación con luz roja en retina en modelos in vivo de glaucoma. No obstante, como se ha indicado anteriormente, la malla trabecular es otra de las estructuras diana de interés en dicha patología. Por ello, durante este periodo, este proyecto se ha centrado en analizar el efecto de dos dispositivos de luz roja in vitro en células de la malla trabecular que el grupo dispone. Los resultados obtenidos hasta la fecha muestran la reducción, a nivel génico y proteico, de los mar-
pronunciada con el empleo de uno de los dispositivos en todos los casos estudiados.
La promoción de una vida sana y del bienestar a todas las edades es esencial para el desarrollo sostenible. Los avances logrados en las últimas décadas la esperanza de vida. Sin embargo, esto conduce a deben abordarse en la actualidad. Uno de los retos más importantes para la sociedad en los próximos años es el envejecimiento activo y saludable. Una esperanza de vida superior a los 80 años implica la necesidad de abordar las cuestiones pendientes de preservar la calidad de vida, prevenir la dependencia y reducir el impacto socioeconómico y de desigualdad de género asociado al cuidado de las personas mayores y a la aparición de enfermedades neurodegenerativas.
Entre las enfermedades neurodegenerativas, la enfermedad de Alzheimer (EA) es la principal causa de deterioro cognitivo y demencia en personas mayo-
emocional y física, la demencia por EA puede causar discapacidad funcional y pérdida de independencia. Entre los retos que plantea el desarrollo de intervenciones terapéuticas para la EA, la búsqueda de terapias que puedan tener un impacto en las fases preventivas de la enfermedad se ha convertido en una prioridad. Por otra parte, la patología de la EA no se limita al cerebro, sino que también se encuentra en la retina, actuando como un biomarcador de etapa temprana para el diagnóstico
no invasivo de la EA. De hecho, cada vez hay más pruebas de que las manifestaciones retinianas de la EA comparten muchas similitudes con las del cerebro de la EA.
En esta línea, varios estudios han demostrado una relación entre los cambios en las poblaciones celu-das. Dado que el ojo constituye una extensión del cerebro, la búsqueda de estrategias para desvelar -
nal entre las cortezas prefrontales y la retina se convierte en un elemento esencial a explorar más a fondo.
Recientemente, se ha observado que la fotobiomodulación aplicada vía pupilar puede mejorar la supervivencia de las células ganglionares de la retina y transcranealmente conseguir una mejora cognitiva en condiciones de neurodegeneración, a través de la mejora de la función mitocondrial entre otras, planteando así la posibilidad de una regulación bidireccional del eje retina-cerebro. En base a esto, FOTORENE propone el desarrollo experimental de un sistema de fotobiomodulación con aplicación retiniana y frontal, y su traslación a humanos en estadios tempranos de neurodegeneración de la EA. En concreto, FOTORENE se está desarrollando para y mejorar la degeneración de la retina ligada a esta enfermedad, mediante fotobiomodulación aplicado a la conexión bidireccional retina-córtex prefrontal.
Investigación Básica
PROYECTO V:
punto de vista energético. La Unión Europea, entre
2012 prohibió la fabricación de las bombillas incanLas luminarias LED han ido cubriendo ese hueco y
Desde el punto de vista energético, son mucho más tipos de fuentes lumínicas. Se ha calculado que, si todas las luminarias diferentes al LED existentes en 2011 se reemplazasen por LEDs, se reduciría la emisión de dióxido de carbono en 270 millones de toneladas por año, con el consiguiente impacto
palmente a luminarias tipo LED, se ha incrementado
exponencialmente. Los hábitos de vida actuales esya son diversos los estudios que indican una mayor prevalencia de patologías oculares, como por ejemplo miopía o síndrome de ojo seco, donde la reduc-cial son un factor de riesgo asociado. Además, otros
diferentes longitudes de onda de la luz producen diferentes respuestas biológicas celulares. En este que permiten modular diferentes longitudes de onda de la luz para obtener una iluminación más sostenible con la salud ocular. Para ello, se ha analizado
celular de epitelio pigmentario de la retina, observando cómo se mantiene la viabilidad celular y la integridad de la estructura, mediante el análisis de la expresión de marcadores fundamentales para la monocapa celular.
La Unidad de Genética Ocular, Nutrición y Salud
Visual centra su actividad investigadora en las principales causas de ceguera irreversible que afectan a las células de la retina, como son el glaucoma, la degeneración macular asociada a la edad y las oclusiones vasculares, así como la relación entre la nutrición y la salud visual, con objeto de potenciar el envejecimiento saludable. El carácter multidisciplinar de esta Unidad, integrada por investigadores de la FIO y del CSIC, con formación en diversas especialidades, permite abordar las patologías oculares más prevalentes con múltiples “visiones”.
Cuenta con tres líneas de investigación, que a su vez incluyen cuatro proyectos:
Líneas de Investigación: Metalómica en enfermedades oculares. Acoge 2 proyectos:
- Alteración de la homeostasis del zinc en un modelo celular de epitelio pigmentario de la retina.
Investigadores principales:
- Alteración en la homeostasis de los metales y la expresión génica durante la degeneración del epitelio pigmentario de la retina.
Línea de investigación: Metabolismo de lípidos y envejecimiento. Cuenta con un proyecto en marcha:
- Estudio multiómico de un modelo de envejecimiento del epitelio pigmentario retiniano
Línea de investigación:dativo en los procesos de señalización del EPR. Acoge el siguiente proyecto:
- Alteración en la concentración de metales en las vesículas extracelulares secretadas por un modelo celular de epitelio pigmentario de la retina en condiciones de estrés oxidativo.

Dr. Héctor González Iglesias (Colaborador IPLA-CSIC)

Dra. Lydia Álvarez Fernández

Dra. Montserrat García Díaz
Investigación Básica
Equipo Investigador:
Dña. Ana Álvarez Barrios.
D. Jorge García Álvarez.
Dña. Alicia Villa Vázquez (Becaria Severo Ochoa-en colaboración con la Universidad de Oviedo).
Dr. Luis Fernández-Vega Cueto-Felgueroso.
Dra. Beatriz Fernández-Vega Sanz.
Dr. Andrés Fernández-Vega Cueto-Felgueroso.
Dr. Álvaro Fernández-Vega González.
Colaboradores externos:
Prof. Imre Lengyel.
Prof. Rosario Pereiro.
Prof. José Ignacio García Alonso.
Dra. Beatriz Fernández García.
Dr. Pablo Rodríguez González.
A continuación, se resumen los resultados más relevantes obtenidos durante el año 2023 fruto del
LÍNEA DE INVESTIGACIÓN
avance en las líneas de investigación y publicados
METALÓMICA EN ENFERMEDADES OCULARES
PROYECTO I: ALTERACIÓN DE LA HOMEOSTASIS DEL ZINC EN UN MODELO
CELULAR DE EPITELIO PIGMENTARIO DE LA RETINA
La homeostasis de los metales se considera un assujeta a cambios con la edad y podría estar involu-
crada en la patogénesis de la degeneración macular asociada a la edad (DMAE). Los metales biológicamente activos como Zn, Cu y Fe tienen funciones
la célula. La dishomeostasis puede desencadenar citotoxicidad, agregación aberrante de proteínas, con su consiguiente pérdida de función, y contribuy apoptosis. Esto sugiere que existe un poderoso sistema homeostático que controla los niveles de estos metales.
La concentración de Zn en el epitelio pigmentario de la retina (EPR) disminuye con la edad junto con la disminución de las proteínas que regulan su homeostasis, las metalotioneínas (MTs), y de las proteínas transportadoras que controlan la entrada de Zn a la célula, ZIP2 y ZIP4. Estos hallazgos sugieren que la homeostasis del Zn en la retina se ve afectada durante el envejecimiento. Así, la alteración en el equilibrio de este elemento podría ser un factor de riesgo para el desarrollo de DMAE, considerandopósitos extracelulares sub-EPR, característicos de esta patología (drusas), sufren agregación patogénica promovida por metales.
En el contexto de la DMAE, los modelos celulares, capaces de reproducir la formación de depósitos extracelulares en condiciones controladas en el laboratorio, son clave para analizar los cambios en la homeostasis de metales, como el Zn, y su relación con la aparición de estos depósitos a lo largo del tiempo de cultivo. En este trabajo, se ha llevado a cabo el estudio de la expresión génica (transcrip-
ma dirigido) y la determinación de la concentración de los metales (metaloma) de un modelo celular de EPR cultivado en transwell, para mejorar la com-
prensión de los cambios homeostáticos del Zn durante la maduración del cultivo. En este modelo in vitro, las células fetales humanas de EPR culti-
menos 4 semanas, dan lugar a una monocapa de EPR maduro y producen depósitos extracelulares con similitudes con las drusas. El seguimiento de los cultivos se realizó durante 2 meses y la toma de muestras para los distintos análisis se llevó a cabo
Los cultivos celulares se caracterizaron, a lo largo del tiempo, en base a su fenotipo celular, la fun-
de EPR, la polarización de la monocapa celular y la formación de depósitos extracelulares (Figura 1). Transcurridos 14 días de cultivo, las células comenzaron a adquirir la morfología típica de EPR, en adoquín, y la pigmentación celular. La función barrera, valorada a través de la medida de la resistencia eléctrica transepitelial (TEER) alcanzó los valores máximos pasado 1 mes manteniéndose los valores relativamente elevados a los 2 meses de cultivo. La presencia y localización de las proteínas claudina 19 (CLDN19) y zonula occludens 1 (ZO-1), proteínas de membrana relacionadas con la formación de las uniones estrechas intercelulares, fue analizada por proteína ZO-1 se detectó en las membranas celulares a los 10 días de cultivo y no presentó cambios durante los 2 meses de experimento. Por el contrario, la CLDN19 no apareció hasta los 21 días en las membranas celulares, aumentado su presencia en ellas de manera gradual con el tiempo de cultivo. Además, se ha observado la presencia de depósitos extracelulares, concentrados, mayoritariamente, en la periferia del cultivo celular (Figura 1, B)



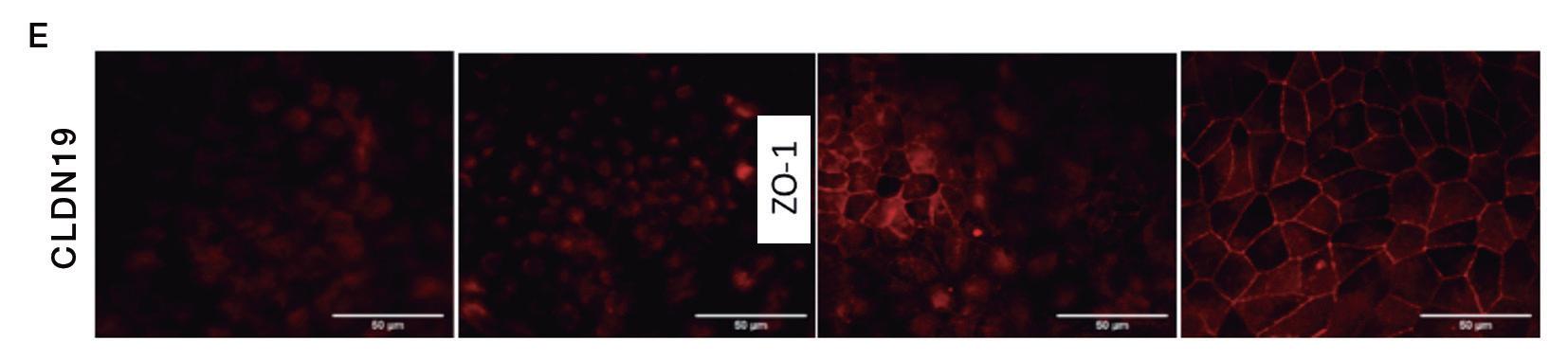
Figura 1. Caracterización del modelo celular de EPR. A: Representación esquemática del modelo celular de EPR en sistema transwell. B: Imagen de microscopía óptica del cultivo celular a los 38 días de cultivo, mostrando la pigmentación, la morfología
El análisis del transcriptoma mediante secuenciación del ARN (RNASeq), mostró que el modealgunas implicadas en el ciclo visual (RGR, LRAT,sión génica de estos marcadores comienza ya a los 10 días, pero sufre un fuerte incremento a los
La polarización de los cultivos de EPR se comprobó a nivel de proteína, mediante inmunotinción de las se localizó preferentemente en la zona basal de la membrana celular mientras que la señal de CLDN19 se observó mayoritariamente en las regiones apical y lateral de las membranas celulares.
El análisis de la expresión génica de los cultivosdos de manera diferencial (DEGs) a los distintos tiempos y reveló que los procesos biológicos más relacionados con: (1) el establecimiento y mantenimiento del EPR (términos GO: “ciclo celular”, “migración celular”, “adhesión celular” y “diferen-las, especialmente proteínas (términos GO: “fosforilación”, “fosforilación de proteínas” y “procesos de oxidación-reducción”); (3) funciones básicas del EPR maduro (términos GO: “transporte transmembrana” y “transducción de señales intracelulares”); y (4) comunicación con otras estructuras de la retina (términos GO: “guía de axones”, “desarrollo del sistema nervioso” y “desarrollo de proyecciones neuronales”) (Figura 2)
Genética ocular, nutrición y salud visual

2.
número de DEGs anotados en el término GO en relación con el número total de genes anotados en ese término GO en la especie.
Como se ha mencionado anteriormente, la DMAE se caracteriza por la acumulación de moléculas en el espacio extracelular, formando depósitos subEPR. En este trabajo, se realizó un seguimiento de la proteína APOE, uno de los principales componentes de las drusas, mediante secuenciación del ARN e inmunotinción (Figura 3). La proteína APOE se localizó en el citoplasma celular desde los 10tivo, se detectaron señales muy intensas en el espacio extracelular, que podrían estar relacionadas con depósitos extracelulares. La secuenciación del ARN reveló que los niveles de expresión génica más elevados se observaron en los cultivos de 21 días, reduciéndose a los niveles basales (10 días)

Figura 3. Inmunolocalización y análisis de la expresión génica de APOE. A: Inmunolocalización de APOE (verde) asociado al cito-
Los cambios en la localización de la proteína APOE parecen estar indicando que la formación de estos depósitos extracelulares coincide con una reducción de los niveles de expresión génica de APOE mecanismo para evitar la excesiva producción de esta proteína. A partir de los datos del transcriptoma se analizó también la expresión en el tiempo de el metabolismo del Ca. Así, se observó que los gerelacionada con frizzled (FRZB) y la trombospondi-paración con los de 10 días). La sobreexpresión de estos genes, junto con el descenso en la expresión de biglicano (BGN), podría estar relacionado con el
depósito de esférulas de hidroxiapatita (HAP), cuya presencia se ha descrito en las drusas.
La edad afecta también a la maquinaria de defensa antioxidante, suponiendo un riesgo para el desarrollotivos celulares de EPR respecto al daño oxidativo, se analizó la expresión génica de diferentes enzimas antioxidantes, incluyendo superóxido dismutasa (SOD),2O2 presentes en el medio de cultivo. Los resultados obtenidos muestran un aumento de la expresión de dos isoformas de la SOD (SO1 y SO2), CAT, tres isoformas
cantes de enzimas antioxidantes y el aumento observado en los niveles de H2O2 en los medios de cultivo a oxidativo con el tiempo del cultivo.
El estudio del metaloma se realizó mediante espectrometría de masas con plasma acoplado inde Na, Mg, K, Ca, Cu y Zn tanto en las fracciones citosólicas como en los pellets (fracción insoluble) de los cultivos celulares.
El Zn es el metal más abundante de la retina siendo sus niveles especialmente elevados en el EPR. En relación con este metal, en este trabajo se realizó el seguimiento de los niveles de Zn con el tiempo y se analizaron los cambios en los niveles de expresión génica de las metalotioneínas (MTs), principales reguladoras del Zn, y de las proteínas transportadoras responsables de la entrada y salida de este elemento en la célula. Los niveles de Zn en la fracción ci-
(Figura 4, A)
En cuanto a los niveles de expresión génica de las los distintos tiempos de cultivo; mientras que la exa los 21 días de cultivo, se produjo un incremento de la proteína MT2A, determinados por ELISA, au-
días de cultivo, alcanzando valores más bajos que los observados a los 10 días de cultivo (Figura 4, B). Esta reducción de los niveles de MT2A coincide con la disminución de Zn en el citoplasma celular a
Por último, en relación con el Zn, se analizaron los niveles de expresión génica de los transportadores de Zn. Tanto de los encargados de exportar el Zn

Figura 4.na total, en el caso de la fracción citosólica y ng/g proteína total, en el caso de la fracción asociada a membranas). B: Niveles de la proteína MT2A en el citoplasma celular. Datos representados como concentración (ng/mL). Las barras de error indican la desviación
Investigación Básica
al espacio extracelular o introducirlo en los orgánulos, ocasionando así un descenso del Zn citoplas-nes SLC30), como de los encargados de la entrada del Zn al citoplasma desde el espacio extracelular o desde los orgánulos celulares (importación), los
de la expresión de ambos tipos de transportadores, lo que podría afectar a la concentración de Zn citoplásmico.
en la célula se mantiene en unos niveles no tóxicos gracias a la regulación llevada a cabo por proteínas de unión al Zn, como las MTs, y los transportadores
de Zn. Con la edad y la DMAE, se produce un descenso en los niveles de Zn, producido, posiblemente, por una alteración en este sistema homeostático. Se sabe que los niveles de Zn disminuyen con la edad en el EPR. En consonancia con esto, en este trabajo se observa un descenso en los niveles de Zn y de la -
servan diferencias de expresión en los distintos transportadores de Zn que pueden contribuir a la dishomeostasis de Zn observada durante la acumulación de depósitos sub-EPR.
En cuanto a las alteraciones del resto de metales (Figura 5), se observó un incremento, con el tiempo de cultivo, de Cu, Mg y Na, en la fracción asociada a membranas y de K y Na en la fracción citosólica.

Figura 5.teína total, en el caso de la fracción citosólica y ng/g proteína total, en el caso de la fracción asociada a membranas). Las barras de
El Cu es un elemento esencial que participa en funciones biológicas como la respiración celular y está parcialmente regulado por las MTs y SOD, siendo un cofactor esencial en la actividad de algunos enzimas antioxidantes. En este trabajo hemos observado un aumento en los niveles de expresión génica de SOD y en los niveles de Cu en la fracción del pellet celular, pero no en la fracción citoplasmática. Se sabe que SOD1 y SOD3 utilizan Cu y Zn como cofactores, actuando como moléculas antioxidantes. También se
elevados de especies reactivas de oxígeno y desarrollan un fenotipo similar al de la DMAE.
La sobreexpresión de SOD observada en nuestro -
buyendo al control intracelular del Cu evitando la alteración de los niveles de este elemento en las fracciones citosólicas del cultivo celular. El Na celular está muy regulado en condiciones normales al estar implicado en el transporte de numerosas moléculas, osmoregulación y eliminación de productos metabólicos. El elevado aumento en los niveles de
de la homeostasis de este metal.
La edad afecta a la homeostasis del Zn en la retina, siendo este desajuste un posible factor de riesgo para la progresión de la DMAE. Los datos obtenidos en este estudio (Figura 6)
alteraciones en los niveles de Zn y MTs, un incremento en el estrés oxidativo y variaciones en los niveles de Cu, Na, Mg en un cultivo celular de células de EPR que producen depósitos sub-EPR. El modelo celular se mantuvo durante dos meses en cultivo, conservando características propias del EPR como la pigmentación, la morfología en mosaico, valores de TEER elevados, las uniones estrechas y la polarización celular.
En resumen, nuestro modelo celular de EPR es un modelo de DMAE temprana que expresa proteínas
neuroepiteliales a las células, y presenta elevación de los niveles de enzimas antioxidantes y aparición de depósitos extracelulares sub-EPR, con el tiempo. El análisis metalo-transcriptómico aporta evidencias de una alteración de la homeostasis del Zn, acompañada por cambios en proteínas de unión al Zn y sus transportadores, junto con alteraciones de otros metales, durante la formación de los depósitos sub-EPR.

Investigación Básica
Para más información:

Como se mencionó anteriormente, la edad es un factor de riesgo de muchas enfermedades oculares, principalmente aquellas caracterizadas por el deterioro progresivo de la retina, como ocurre durante la DMAE, una de las principales causas de ceguera irreversible. La progresión de esta enfermedad afecta principalmente a la estructura y función de las células del EPR, responsable de la nutrición de la retina neuronal. La degeneración del EPR durante la DMAE desencadena la formación de depósitos extracelulares bajo el EPR conocidos como drusas, conteniendo lípidos, minerales y agregaciones aberrantes de proteínas.
Durante el envejecimiento, la homeostasis de los metales se altera, lo que contribuye a la toxicidadción, el plegamiento incorrecto y deposición anormal de proteínas y la apoptosis celular. El papel de los metales en la función y enfermedad del sistema visual es actualmente desconocido. En este estudio se ha analizado la posible relación entre las alteraciones en las concentraciones celulares de los metales, la degeneración progresiva del EPR durante 4 meses y la aparición de características moleculares similares a la DMAE, desde un enfoque multidisciplinar. Para ello se han combinado técnicas analíticas como la espectrometría de masas para -
cuenciación del ARN (RNASeq) para la obtención de la expresión génica (transcriptoma), y técnicas de biología celular clásica, como los ensayos de inmunocitoquímica para la determinación de proteí-lares.
En el trabajo desarrollado en el proyecto 1 de esta memoria, establecimos un modelo de células de EPR capaz de reproducir la formación de depósitos extracelulares con características similares a las de las drusas. Su seguimiento, de 2 meses de duración, proporcionó evidencias de diferenciación celular hasta un epitelio maduro, así como deposición temprana de material extracelular. Además, la aparición de depósitos extracelulares coincidió con alteraciones en la homeostasis del Zn, así como en la expresión de proteínas citosólicas de unión a este metal y de sus proteínas transportadoras, lo que sugiere una homeostasis alterada del Zn durante la maduración del EPR y la acumulación anormal de proteínas. Sin embargo, el papel de la homeostaprogresiva del EPR aún es desconocido.
Así, el objetivo de este trabajo fue profundizar en el conocimiento sobre la relación entre la homeostasiscando posibles cambios relacionados con el enve-
jecimiento y con posible relevancia para la DMAE. Para ello, se estudiaron los cambios metalo-transcriptómicos en un modelo celular de EPR durante su degeneración progresiva, realizando un seguimiento de más de 4 meses. Las muestras celulares utilizadas para los distintos análisis fueron tomadas a los 21, 91 y 133 días.
Nuestros cultivos se diferenciaron, adquiriendo las características fenotípicas típicas de un epitelio maduro, como la pigmentación celular o la forma
celular en adoquín (Figura 1, B-D). El aumento de la resistencia eléctrica transepitelial, demostró la adquisición de la función barrera de los cultivos.
ARN (RNASeq), que las células expresaban genes nativo, incluidos genes relacionados con el ciclo
MT1F, cuya expresión disminuyó durante la progresiva degeneración del cultivo.
Degeneración progresiva de células del EPR en cultivo: formación de depósitos extracelulares, pérdida de pigmentación y enriquecimiento de procesos asociados a la degeneración
La morfología celular cambió dramáticamente con el tiempo de cultivo, con pérdida progresiva de la pigmentación y de la forma celular en adoquín típica del EPR (Figura 7). La despigmentación de las
células del EPR se ha descrito en ojos humanos de de melanina que sus homólogos de 20 a 30 años. Por otro lado, los depósitos extracelulares se comenzaron a observar después de 14 días en cultivo (Figura 7, A). La degeneración se produjo a diferentes ritmos en las distintas zonas del cultivo celular, siendo la periferia y los bordes los más afectados (Figura 7, E y F), mientras que, en la mayoría de los casos, las células centrales sobrevivieron con buen 4 meses en cultivo.

A nivel proteico, la inmunotinción de la proteína transmembrana BEST1 reveló su presencia en la membrana celular a los 21 días de cultivo y, en menos medida a los 91, pero desapareció después de 133 días (Figura 8, A) la reducción de la expresión de los genes del ciclo visual y de la biosíntesis de melanina, la degeneración o de-diferenciación del cultivo de EPR. Las proteínas de unión estrecha intercelular CLDN19 y ZO-1 mostraron niveles y localización adecuados
a los 21 días. La proteína ZO-1 permaneció en las membranas de las células del EPR incluso después de que se perdieran las uniones intercelulares a los 133 días (Figura 8, B). Además, se observaron algunas señales de CLDN19 en las membranas celulares de células del EPR de 91 días, mientras que no se detectó CLDN19 después de 133 días. (Figura 8, C), lo que demuestra la pérdida de las uniones intercelulares y, por consiguiente, de la función barrera epitelial, después de largos periodos de cultivo.
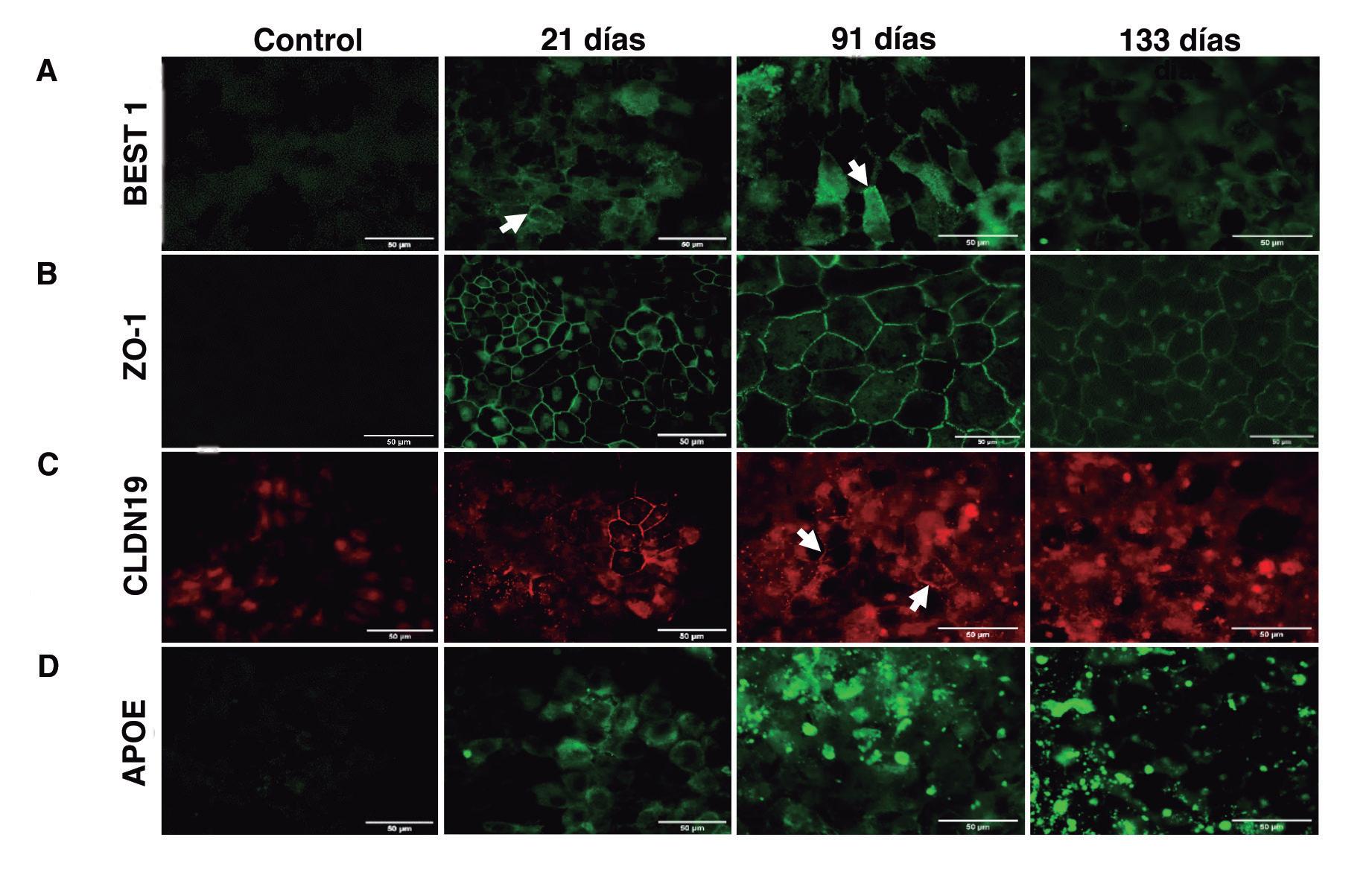
La aparición de depósitos extracelulares en la mácula es una de las principales características clínicas de la DMAE, donde la acumulación progresivaca y puede alterar el intercambio de nutrientes y productos de desecho entre el EPR y los vasos sanguíneos de la coroides, participando, en última instancia, en la degeneración progresiva de las células del EPR. La capacidad de las células en cultivo para formar depósitos extracelulares se evaluó mediante el seguimiento de la proteína APOE, secretada por el EPR, uno de los principales componentes de las drusas y que facilita la acumulación de lípidos. La APOE se detectó en el citoplasma de las células del EPR a los 21, 91 y 133 días en
cultivo, pero además observamos señales intensas de esta proteína en el espacio extracelular a los 91 días y, más prominentemente, a los 133 días en cultivo, probablemente pertenecientes a depósitos extracelulares (Figura 8, D).
Por otro lado, mediante el análisis de los resultados diferencialmente (DEGs) entre las distintas edades de los cultivos. El alineamiento de los DEGs con la base de datos Gene Ontology (GO) dio lugar a
afectados con el envejecimiento (21 vs 133 días en cultivo), que se pueden atribuir a (1) el mantenimiento del EPR (término GO: “adhesión celular”);
(2) funciones básicas del EPR maduro (término GO: biomoléculas (términos GO: “fosforilación”, “proce-duccional de proteínas”); (4) comunicación con otras estructuras de la retina (términos GO: “guía del axón”sis (términos GO: “regulación negativa del proceso
apoptótico”, “regulación positiva del proceso apoptótico” y “proceso apoptótico”). La alteración de procesos como “migración celular”, “organización de la actina del citoesqueleto”, “regulación positiva de la migración celular”, “organización de la matriz extracelular” y “vía de señalización Wnt” podría indicar la aparición de transición epitelio-mesenquima (EMT) en el cultivo celular (Figura 9)

Figura 9.dos entre los 21 y los 133 días en cultivo. Cada proceso biológico se representa mediante una burbuja, su tamaño representa el representa la relación entre el número de DEGs anotados en el término GO en relación con el número total de genes anotados en ese término GO en la especie.
Transición epitelio-mesénquima durante la degeneración del EPR
Dada la alteración de algunos procesos biológicos asociados con la transición epitelio-mesénquina (EMT) durante la degeneración del EPR, estudia-
ceso (Tabla 1). Tras 133 días en cultivo, los genes (CDH1), P-cadherina (CDH3), ocludina (OCLN) y conexina (GJA1) sucompatible con EMT, mientras que se observó el (DSP). Por el contrario, la expresión de genes asociados con células mesenquimales como N-cadherina (CDH2), ciclina D1 (CCND1)
(FN1), vimentina (VIM) y el factor de crecimiento transformante beta 2 (TGFB2) aumentó a los 133 días en cultivo en comparación con su expresión a los 21 y 91 días. Además, mediante microsco-
los genes TRPM1 y TRPM3 (miembros 1 y 3 de la subfamilia M de canales catiónicos de potencial receptor transitorio), esenciales para el mantenimiento de la diferenciación y el bloqueo de EMT se regularon negativamente después de 133 días en cultivo.

Aunque el análisis de los procesos biológicos alsugieren la aparición de EMT, con el envejecimiento -
cionalmente a nivel de proteína y preferiblemente con un enfoque unicelular, ya que la heterogeneidad de las células en cultivo podría enmascarar los resultados del análisis.
Genética ocular, nutrición y salud visual
Considerando que los cultivos celulares, en sus esde EPR degenerado, estudiamos los niveles de Ca, Na, Mg, P y Cu en muestras de las fracciones solubles en agua (citosol) e insolubles (membranas y núcleo) de los cultivos celulares a los 21, 91 y 133 días, mediante ICP-MS.
Los cambios más llamativos corresponden al incremento en los niveles de Sodio en el citoplasma de los
cultivos con el tiempo (Figura 10, B), lo que sugiere una dishomeostasis de este metal en las últimas etapas de los cultivos. Estos datos, junto con la observación del descenso en la expresión de varios genes
Na+/K+-ATPasa entre los 21 y 133 días en cultivo, sugieren que el aumento de Na dentro de las células del EPR en degeneración podría estar relacionado con el deterioro de la bomba Na+/K+-ATPasa.
Curiosamente, se ha descrito que algunos factores de transcripción asociados con la expresión delan negativamente la expresión de genes de la Na+/ K+-ATPasa.

Figura 10. Niveles de metales en el citosol y la fracción membranosa de las células del EPR a los 21, 91 y 133 días en cultivo. Los datos se representan como concentración del citosol; y ng/g de muestra, en el caso de las membranas). Las barras de error representan la desde dos factores).
En cuanto a los niveles de Mg disminuyeron signi-
días en comparación con los 91 días, sin mostrar diferencias con respecto a los 21 días. Asimismo, se observó una disminución en la fracción membranosa desde los 21 a los 91 y a los 133 días en cultivo (Figura 10, C). El Mg, el segundo catión intracelular más abundante, sirve como cofactor de múltiples enzimas, particularmente aquellas involucradas en
afecta a la bomba Na+/K+-ATPasa, que necesita esta molécula para llevar a cabo su función trans-
ducir a un aumento de iones Na+ y una disminución de iones K+ en el interior de las células. Esto estaría en consonancia con el incremento en los niveles de Na observado en los cultivos celulares de 133 días, comentado anteriormente.
Con respecto al P, su concentración aumentó en la fracción hidrosoluble a los 91 y 133 días con respecto a lo observado a los 21 días y disminuyó sig-
días a los 91 y 133 días (Figura 10, D). Curiosamente, los depósitos sub-RPE contienen esférulas de hidroxiapatita, es decir, fosfato cálcico, que proporcionan anclaje para las proteínas y enriquecimiento de fosfolípidos en las drusas. Los crecientes niveles citoplasmáticos de P observados durante la degeneración del EPR podrían contribuir a la formación anormal de depósitos extracelulares.
Por último, aunque los niveles de Cu en la fracel tiempo, se observó una disminución progresiva fracción membranosa (Figura 10, E). En relación con el desequilibrio en los metales, se estudiaron los cambios en la expresión genética de los enzimas antioxidantes que requieren metales como cofactores, es decir, superóxido dismutasa (SOD), ca-
la degradación del cultivo hubo una disminución en de todas las isoformas de SOD (SOD1, 2 y 3), CAT, expresión aumentó hasta los 91 días (Tabla 2). La regulación negativa de la expresión génica de estas -
dica una disminución de la capacidad antioxidante de las células del EPR durante su degeneración y probablemente una menor tolerancia al estrés oxidativo. Por ejemplo, la disminución en la expresión del gen CAT de las células del EPR en degeneración (a los 133 días) podría estar relacionada con la reducción observada en la actividad de la CAT durante el envejecimiento y la DMAE. De manera -
liza Cu como cofactor, muestran niveles elevados de especies oxidativas y desarrollan un fenotipo similar a la DMAE, mientras que la eliminación de la SOD produce lesiones patológicas similares a las observadas en la forma seca de la DMAE.

En resumen, este estudio ha contribuido al a compresión del papel de los elementos esenciales durante la degeneración progresiva del EPR in vitro La dishomeostasis de los metales y metaloproteínas observada podría estar asociada con el deterioro de las defensas antioxidantes, el aumento del
Para más información:

estrés oxidativo y la degeneración del EPR durante el envejecimiento y la DMAE. Sin embargo, los cultivos de EPR de cuatro meses de edad mostraron células diferenciadas y en buen funcionamiento junto con procesos apoptóticos y células sometidas a EMT.
METABOLISMO DE LÍPIDOS Y ENVEJECIMIENTO
PROYECTO III:
ESTUDIO MULTIÓMICO DE UN MODELO DE ENVEJECIMIENTO DEL EPITELIO PIGMENTARIO RETINIANO
En este trabajo se realizó un estudio multiómico, combinando el análisis transcriptómico con el metabolómico, en un modelo celular de epitelio pigmentario de la retina (EPR) mantenido en cultivotudio fue ampliar el conocimiento sobre las bases moleculares responsables de la formación de los depósitos extracelulares y la posterior degeneración celular, sucesos que ocurren en el EPR durante la progresión de la DMAE.
Se establecieron cultivos de células fetales humanas de EPR en sistemas transwell y se tomaron las muestras para llevar a cabo los distintos análisis a
cultivos presentaron las características típicas de un EPR maduro (Figura 11), forma celular en adoquín y pigmentación, además, la inmunotinción de la proteína de las uniones estrechas intercelulares, ZO-1, y los elevados valores de resistencia eléctrica transepitelial (TEER) demostraron que las células establecieron fuertes uniones entre sí y los cultivos desarrollaron la función barrera típica de los epitelios. Estos rasgos distintivos de EPR, comienzan a perderse a las 17 semanas de cultivo, siendo este
lado, a las 4 semanas observamos también la formación de depósitos extracelulares, conteniendo hidroxiapatita y APOE, que fueron aumentando en tamaño y número con el tiempo de cultivo.

Figura 11. Caracterización del modelo celular de EPR. A, Imágenes de microscopía óptica de contraste de fases en los que se observa la pigmentación celular y la morfología en mosaico (“cobblestone”); B, Inmunotinción para la proteína ZO-1 (verde) marcador de las uniones estrechas típicas de los epitelios; C, Inmunotinción para las proteínas ApoE (verde) y MT (rojo) y tinción para hidroxiapatita (maesquema del sistema de cultivo de EPR en transwell.
Mediante técnicas de secuenciación del ARN (RNAAseq) se analizó el transcriptoma de los cultivos ce-
primer lugar, se analizaron los genes asociados con el EPR (Tabla 3) y se observó que los genes DCT, TYRP1, TYR, SERPINF1, OTX2 y MITF presentaban una mayor expresión a las 4 semanas de cultivo,
mientras que, la expresión de RGR, RPE65 y RLBP1 aumentó hasta las 17 semanas y la expresión de BEST1, RDH5 y LRAT
cultivo, la expresión de todos los genes relacionados con el EPR disminuyó drásticamente, indicando así la de-diferenciación celular de los cultivos.
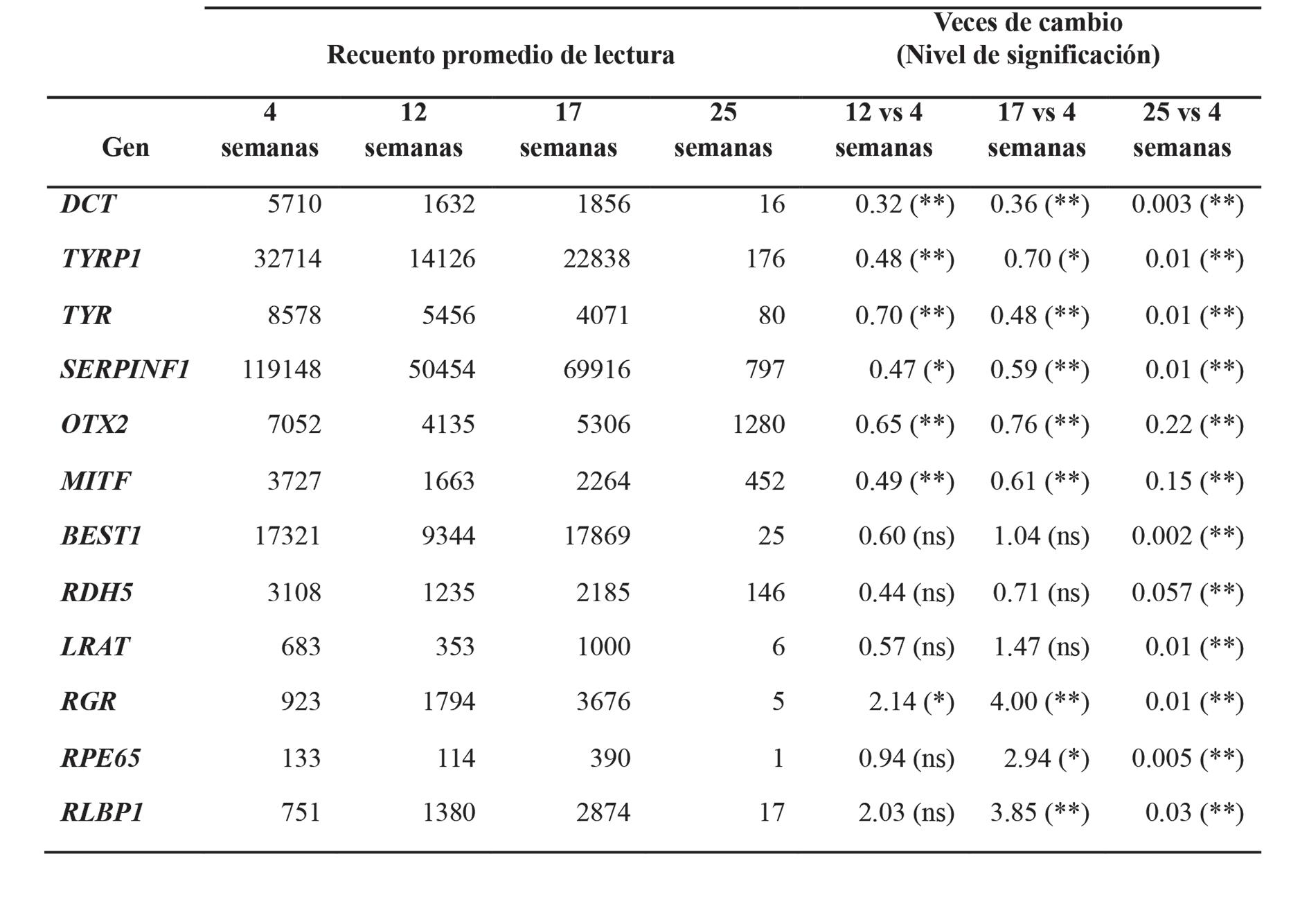
con el desequilibrio oxidativo, se realizó el análisis transcriptómico de los genes relacionados con la defensa antioxidante celular, incluyendo los genes SOD, CAT, GPX y PRDXcipales familias de enzimas antioxidantes (Tabla 4) de SOD1 y SOD2 disminuye con el tiempo mientras que la de SOD3 aumenta hasta las 17 semanas, dis-
ducción de su expresión con el tiempo de cultivo,-
sentaron un incremento de la expresión con el tiempo. Estos enzimas requieren un cofactor metálico, como Cu, Zn, Mn o Se, para realizar correctamente su función celular. El análisis de la expresión génica de las metalotioneínas (MTs), principales reguladoras de la homeostasis del zinc, y los transportadores de zinc mostró alteraciones de la expresión, con elres exportadores de zinc (familia SLC30) mostraron niveles de expresión más bajos que los genes de importación de zinc (familia SLC39mento. Además, la expresión génica de MT2A, la MT más abundante en las células de EPR, mostró un
Investigación Básica
Tabla 4. -

Por otro lado, mediante el análisis de enriquecimienprocesos biológicos más afectados con el tiempo (Figura 12, A). La alteración de procesos biológicos como, “adhesión celular”, “migración celular”, “diferenciación celular”, “organización de la matriz extracelular”, “regulación de la forma celular” y “organización del citoesqueleto de actina”, apuntan a alteraciones en la monocapa celular formada por las células del
aparición de EMT. Esta observación está en consonancia con los datos de expresión individual de los genes asociados a la transición epitelio-mesénquima (EMT).
Interesantemente, otros procesos biológicos alteestán asociados con el transporte de moléculas, especialmente de iones, a través de las membranas celulares, la respuesta al estrés, los lípidos y la acumulación de calcio (Figura 12, B)

Figura 12. tiempo de cultivo. El tamaño de cada burbuja (proceso biológico) muestra la cantidad de DEGs (genes expresados diferencialmente)
mente enriquecidos asociados con el transporte de moléculas, la respuesta al estrés, los lípidos y la acumulación de calcio.
La alteración observada en procesos biológicos relacionados con el trasporte de moléculas, y más concretamente de iones, está en consonancia con los resultados obtenidos por nuestro grupo en trabajos previos, en los que observamos dishomeostasis de metales y alteraciones en la expresión génica de proteínas de unión a metales y proteínas transportadoras de iones, asociadas a la degeneración del EPR in vitro. También es de resaltar la alteración de procesos biológicos relacionados con lípidos, ya que numerosos estudios han mostrado la asociación entre la DMAE y el metabolismo y transporte de lípidos. Por otro lado, las alteraciones en procesos biológicos relacionados con el Ca, con el tiempo de cultivo, podrían estar asociadas a la formación de depósitos extracelulares, ya que las esférulas de hidroxiapatita (fosfato cálcico), descritas en las drusas, inducirían la agregación de lípidos y proteínas.
Para tener un mejor conocimiento de los cambios sufridos por los cultivos de EPR a nivel del metabolismo celular, se realizó un análisis metabolómico
con el tiempo de cultivo. Se consideran metabolitos aquellas moléculas de pequeño tamaño que son de las reacciones del metabolismo.
de los cultivos celulares a los distintos tiempos se llevó a cabo empleando un equipo de cromatografía líquida (LC) asociado a un espectrómetro de masas (IM-QTOF-MS) perteneciente a la plataforma metabolómica del IPLA-CSIC. Para este tipo de análisis se requiere la ionización de la muestra, que se llevó convenientemente las fases móviles. De esta manera se detectaron un total de 634 metabolitos en el de componentes principales (PCA) reveló que, los más se diferenció de los demás (Figura 13)

13. metabolómico en los modos de ionización positivo (A) y negativo (B). Los componentes principales 1, 2 y 3 (PC1, PC2 y PC3) podrían -
Para realizar los análisis posteriores se eligieron los resultados obtenidos empleando el modo de ionización positiva, ya que con él se detectaron más metabolitos alterados con el tiempo que con el modo negativo. El análisis de los metabolitos signi-
procesos biológicos más alterados con el tiempo de los cultivos (Figura 14), destacando la alteración del metabolismo de los lípidos, más concretamente de los fosfolípidos, apoyando los datos obtenidos a través del análisis de la expresión génica diferencial.

manera que se seleccionaron aquellos metabolitos
<0.001) y cuya concentración cambió con el tiempo más de 16 veces (fold-change > 16) y se realizó un análisis de clusterización jerárquica (Figura 15) Este análisis permitió estudiar la evolución de los metabolitos en función del tiempo de cultivo. Se encontraron tres grupos de metabolitos individuales con diferentes patrones asociados con el tiempo:
(1) metabolitos que disminuyen pronto en el tiempo de cultivo, a partir de las 12 semanas, incluidos S-glutationil-L-cisteína, adenosina y varios fosfolípidos de la familia de las fosfatidiletanolaminas, fosfatidilcolinas y fosfatidilserinas; (2) metabolitos que disminuyen a partir de las 17 semanas de cultivo, incluidos 2-fenilacetamida, fosforilcolina, adenina, 2-hidroxi-dAMP y palmitoil N-isopropilamida; y (3) metabolitos que aumentan con el tiempo, hasta las
GlcCer(d16:1/18:0) y triacetina.

Figura 15.
Kruskal-Wallis con corrección de Benjamini-Hochberg y solo se representaron aquellos con valor de p <0,001 y fold-change > 16. Los datos representan el promedio entre réplicas. Se destacan los grupos de metabolitos de mayor relevancia.
Investigación Básica
A -
ciones de metabolitos individuales con el tiempo de ser investigado. Por ejemplo, el metabolito Glc-
alteración del metabolismo de los lípidos despuéstener interés como biomarcadores de la degeneración del EPR. La alteración del metabolismo de losgías neurodegenerativas. En la retina, se ha estableprocesos, como la supervivencia y muerte neuronal, la proliferación y migración de células neuronales y
crucial en la aparición y progresión de las enfermedades de la retina. Por último, se ha descrito que los
Finalmente se realizó un análisis de enriquecimento integrando los datos transcriptómicos y metaalteradas durante el proceso de degeneración del modelo celular de EPR utilizado en este trabajo. En se corresponde con el metabolismo de los gliceroimportancia de este tipo de metabolismo durante la degeneración del EPR in vitro.

16.semanas en comparación con las células de 4 semanas. Los genes y metabolitos no detectados en los cultivos aparecen en gris. El
En resumen, las células de EPR en cultivo pierden muchas de sus características a partir de las 17 semanas (morfología, pigmentación, uniones estrechas, bajos valores de TEER) y producen depósitos extracelulares con similitudes a las drusas (presencia de hidroxiapatita y ApoE). Los cambios en la expresión génica parecen indicar la des-diferenciación de las células, la transición epite-
lio-mesénquima, el estrés celular y alteraciones del metabolismo lipídico (también observado a nivel metabolómico). Este estudio multiómico, en un modelo celular de DMAE temprana puede aportar un valioso conocimiento sobre los mecanismos moleculares que subyacen a la degeneración del EPR y en el descubrimiento de biomarcadores de DMAE.
Genética ocular, nutrición y salud visual
LÍNEA DE INVESTIGACIÓN
Investigación Básica
INFLUENCIA DEL ESTRÉS OXIDATIVO EN LOS PROCESOS DE SEÑALIZACIÓN DEL EPR
PROYECTO IV: ALTERACIÓN EN LA CONCENTRACIÓN DE METALES EN LAS VESÍCULAS EXTRACELULARES SECRETADAS POR UN MODELO CELULAR DE EPITELIO PIGMENTARIO DE LA RETINA EN CONDICIONES DE ESTRÉS OXIDATIVO
Las vesículas extracelulares (VEs) son partículas membranosas secretadas por las células que contienen ADN, ARN, lípidos y proteínas, implicadas en la señalización entre células y en la eliminación de desechos celulares. Según su biogénesis y tamaen exosomas, microvesículas y cuerpos apoptóticos. Los exosomas son VEs formadas en el citosol celular con tamaños típicamente inferiores a 200 nm, mientras que las microvesículas son de mayor tamaño (200 a 1000 nm) y se forman mediante la gemación de la membrana celular. Los cuerpos apoptóticos pueden alcanzar hasta varias micras de tamaño y se forman en el proceso de muerte celular programada por fragmentación celular.
Las VEs han ganado popularidad en la última década en el campo de la investigación biomédica, no sólo por su uso potencial como portadores de fármacos, sino también por su posible utilizacióncamente, los exosomas son una subpoblación de VEs con un interés en investigación particularmente
la señalización intercelular y la secreción. Por tanto, una alteración en el equilibrio homeostático celular puede manifestarse a través de la actividad secretora celular. La actividad secretora de las células
lo que muestra su relación con la actividad metabólica interna celular. En particular, el estudio de la actividad secretora de las células en condiciones de estrés oxidativo es importante para patologías como las enfermedades neurodegenerativas, ya
que las formas tempranas de dichas enfermedades están asociadas con el incremento del estrés oxidativo y la dishomeostasis metabólica.
El estrés oxidativo afecta de forma importante al ojoterior, es decir, la retina neurosensorial y el epitelio pigmentario retiniano (EPR), cuyo daño oxidativo se exacerba durante el envejecimiento. El EPR es una monocapa de células que forma parte de la barrera entre las células de la retina y el torrente sanguíneo para el transporte de nutrientes y la eliminación de desechos. La disfunción del EPR inducida por estrés oxidativo contribuye a la patogénesis de enfermedades oculares, incluida la DMAE, lo que sugiere una estrecha relación entre la actividad secretora del EPR y la aparición de esta enfermedad. Además, se ha descrito que algunas de las proteínas encontradas en las drusas (depósitos extracelulares en la región basal del EPR, característicos de la DMAE) también están presentes en los exosomas, lo que indicaría la estrecha relación entre la actividad secretora de las células y el potencial de los exosomas para ser utilizados como biomarcadores de enfermedades.
El EPR contiene una amplia variedad de enzimas antioxidantes que requieren metales para su actividad, incluidos Fe, Cu y Zn, por lo tanto, la dishomeostasis metabólica inducida por estrés oxidativo de las células del EPR puede alterar su actividad secretora afectando la composición metálica de los exosomas. Para llevar a cabo este estudio, se utilizó una línea celular EPR humano (HRPEsv) para
Investigación Básica
el establecimiento de un modelo celular de EPR in vitro. Los cultivos celulares fueron tratados con una (2 metilpropionamidina) (AAPH), durante 24h, para lograr condiciones de estrés oxidativo. Tras la puesta a punto del protocolo de aislamiento de los exosomas y del análisis de muestras de bajo volumen
mediante ICP-MS, se realizó la determinación del Fe, Cu y Zn endógeno en los exosomas. Debido a las importantes limitaciones técnicas que conlleva este tipo de análisis, éste es el primer estudio publicado relacionado con la determinación de elementos endógenos en exosomas secretados por una línea celular.
Evaluación del estrés oxidativo inducido por AAPH en la composición metálica de exosomas aislados de cultivos celulares de HRPESV
Se investigaron los cambios en las concentraciones de Fe, Cu y Zn en exosomas de células HRPEsv no tratadas (control, CT) y tratadas con AAPH durante 24h, mediante análisis por ICP-MS. Para
ello, se analizaron 3 réplicas biológicas de los exosomas aislados de los medios de cultivo de cada condición (tratados y CT). La Tabla 5 recopila las concentraciones de Fe, Cu y Zn determinadas en exosomas del medio de cultivo derivado de células HRPEsv control y tratadas con AAPH. El contenido de proteína total en las suspensiones de exosomas mostró valores similares para ambas condiciones, lo que hace posible una comparación directa de la concentración de metales entre las muestras de exosomas de ambas condiciones.
Tabla 5. Concentraciones de Fe, Cu y Zn determinadas mediante ICP-MS en exosomas de medios de cultivo de células HRPEsv control (CT) y tratadas con AAPH. Se midieron tres réplicas biológicas (R1, R2 y R3) para cada condición y en todos los casos se realizaron tres réplicas instrumentales. Los p valores se obtuvieron mediante la prueba t para muestras independientes (t no parea-

Como se muestra en la Tabla 5, no se observaron
concentraciones de Fe y Cu entre los exosomas derivados de los cultivos CT y los de los cultivos tratados con AAPH. Curiosamente, los niveles de Zn dentro de los exosomas mostraron un aumen-
veces, p <0,001) en los exosomas de los cultivos sometidos a condiciones de estrés oxidativo en comparación con los de los cultivos control. En un estudio previo de nuestro grupo de investigación, observamos que el tratamiento con AAPH a corto in vitro regulaba negativamente los niveles de proteínas de unión a Zn, lo que podría estar relacionado con el papel protector del Zn contra la muerte de las células del EPR inducida por estrés oxidativo. El estrés oxidativo también parece promover la secreción de exosomas de células de EPR in vitro. En general, los niveles más elevados de Zn observados en los exosomas secretados por cultivos en condiciones de estrés oxidativo pueden estar condicionados a la disminución de los niveles intracelulares de Zn, lo que podría implicar un nuevo mecanismo de eli-
Para más información:

minación del Zn intracelular que requiere más investigaciones. En un estudio previo con un modelo celular de EPR capaz de generar depósitos extracelulares con similitudes con las drusas características de la DMAE, observamos una disminución -
plasma celular, tras 2 meses de cultivo, coincidiendo con la formación de los depósitos. Todos estos datos concuerdan con la disminución observada del Zn en el EPR con la edad y la DMAE, lo que sugiere un papel potencial de la homeostasis alterada del Zn en esta enfermedad.
En resumen, en este trabajo se ha conseguido determinar con éxito, por primera vez, los niveles de metales endógenos en exosomas secretados por un cultivo celular. El incremento en los niveles de Zn encontrados en los exosomas secretados por las células bajo condiciones de estrés oxidativo resalta la importancia de la homeostasis de este metal en las células del EPR. Las células responden a esta situación de estrés probablemente activando sus mecanismos antioxidantes a través de cambios tanto de la actividad intracelular como secretora.
Investigación Traslacional
El objetivo principal del grupo de Medicina Regeempleado para trasplante, para su empleo como herramienta terapéutica y de testeo de productos de uso humano.
El principal reto de investigación consiste en ofrecer nuevas soluciones terapéuticas a las necesidades clínicas no cubiertas en oftalmología. Una de las principales necesidades radica en la escasez deciente para cubrir con la actual demanda clínica. Es por ello, que una línea de investigación está enfoca-
otro lado, la creciente preocupación sobre la seguridad de los productos de uso humano hace que todo producto que entre en el mercado europeo deba comunicar adecuadamente los potenciales peligros que pueda suponer, haciendo de obligada evaluación la irritación ocular y las lesiones oculares graves. En este contexto, el desarrollo de tejido ar-
vital para la evaluación de la toxicidad de productos farmacéuticos.
en marcha:
- Pre-validación de epitelios humanos reconstruidos para su utilización como método alternativo a la experimentación animal en la evaluación de los peligros para la salud humana de los productos químicos (SAFECHEM).
- Desarrollo y validación de métodos cruelty-free basados en epitelios humanos reconstruidos para (FRhEE).
- Cultivo de células epiteliales de la cápsula anterior del cristalino, como alternativa a las células endoteliales corneales, para el tratamiento de enfermedades del endotelio corneal.
- Modelos de cultivo celular in vivo para el tratamiento de lesiones epiteliales.
- Fabricación de Medicamentos de Terapia Avanzada (Terapia Celular Endotelial) en mini salas blancas.
Investigadores principales junto al Prof. Jesús Merayo Lloves:


Dra. Natalia Vázquez Moreno
Investigación Traslacional
Equipo Investigador:
Dr. Manuel Chacón.
Dra. Mairobi Persinal.
D. Sergio Alonso.
Dr. José F. Alfonso.
Dra. Begoña Baamonde.
Dr. Carlos Lisa.
Dr. Luis Fernández-Vega Cueto-Felgueroso.
Dra. Belén Alfonso.
Dña. Laura Martínez.
PROYECTO I:
PRE-VALIDACIÓN DE EPITELIOS HUMANOS RECONSTRUIDOS PARA SU UTILIZACIÓN COMO MÉTODO ALTERNATIVO A LA EXPERIMENTACIÓN ANIMAL EN
LA EVALUACIÓN DE LOS PELIGROS PARA LA SALUD HUMANA DE LOS PRODUCTOS QUÍMICOS (SAFECHEM)
El proyecto SAFECHEM pretende desarrollar una metodología de evaluación acorde a las exigencias de la Organización para la Cooperación y Desarrollo Económicos (OECD) para la evaluación de productos químicos en modelos de epitelio corneal reconstruido y epidermis reconstruida, así como desarrollar nuevos modelos de epitelio reconstruido de notable interés en toxicología y con ello, establecer las bases de nuevos métodos alternativos a la experimentación animal en la evaluación de los peligros para la salud humana de productos químicos. Durante la presente anualidad se han desarrollado modelos de epidermis reconstruida que se han utilizado para estudiar el potencial corrosivo de productos químicos de aplicación tópica. Para ello, se evaluaron 30 productos químicos de referencia por duplicado en 3 lotes de tejido reconstruido. Brevemente, el protocolo consistió en la colocación de de medio de cultivo en la parte basal y la exposición por duplicado, por la parte apical y durante 3
evaluar, con el objetivo de detectar sustancias causantes de corrosión cutánea (OECD TG 431). Como control negativo se empleó tampón fosfato salino y como control positivo se utilizó ácido acético glacial. Tras los periodos de exposición, los compuestos aplicados son retirados por decantación y los modelos son lavados en solución salina tamponada. Seguidamente los modelos fueron incubados mg/mL. El MTT es una sal amarillenta de tetrazolio que es reducida a un precipitado azulado de formazán por la succinato deshidrogenasa mitocondrial de las células viables. El precipitado de formazán -
de viabilidad celular fue calculado en relación a los valores del control negativo y las sustancias aplica-
EU/CPL: No categoría) en aquellos modelos que
Investigación Traslacional
Corrosiva (Categoría EU/CPL: Categoría 1). Para
De este modo, aquellas sustancias corrosivas cuyo
mientras que aquellas con un porcentaje de viabicomo Subcategoría 1B/1C.
Los resultados obtenidos mostraron una concor-
27 de los 30 productos evaluados, estableciendo
otro lado, en cuanto a la capacidad predictiva, se
modelo desarrollado cumple con los actuales requerimientos y estándares para ser utilizado como método alternativo para la evaluación de la corrosión cutánea.

DESARROLLO Y VALIDACIÓN DE MÉTODOS CRUELTY-FREE BASADOS EN EPITELIOS HUMANOS RECONSTRUIDOS PARA LA IDENTIFICACIÓN DE PELIGROS PARA LA SALUD HUMANA (FRHEE)
El proyecto FRhEE pretende validar un método demicas que no requieren etiquetado por irritación ocular/daño ocular severo (Categoría EU/CPL: No categoría) utilizando el modelo QobuR-RhCE. Además, el proyecto pretende desarrollar un médiscriminación entre daño ocular grave (Categoría 1); irritación ocular (Categoría 2); y sustancias quí-
do (No categoría) basado en la evaluación de la impedancia. Además, el proyecto pretende desarrollar nuevos modelos de RhE que puedan servir como herramienta útil para detectar la toxicidad oral y vaginal de nuevos productos. Por último, el proyecto pretende explorar las interacciones entre los modelos epiteliales reconstruidos y la microbiota.
Durante la presente anualidad, se ha desarrollado un protocolo de ensayo para la evaluación de la capacidad de un producto químico líquido de producir irritación ocular/daño ocular severo mediante la evaluación de los efectos citotóxicos y las modila diferenciación entre compuestos de Categoría 1, Categoría 2 y compuestos sin categoría.
Para ello, se prepararon modelos de epitelio reconstruido similar a la córnea (RhCE) utilizando células limbares aisladas de anillos cornoesclerales humanos normales (modelo QobuR-RhCE). Estos modelos se sometieron a un ensayo de tiempo hasta la
ría). Brevemente, la impedancia se evaluó en cada modelo utilizando un espectroscopio de impedan-
sens) a diferentes frecuencias (de 1 Hz a 1 MHz) antes de la exposición química. A continuación, químicos de ensayo diluidos en agua destilada al volvieron a evaluar inmediatamente mediante EIS. A continuación, los modelos se incubaron a 37 °C y se volvieron a evaluar mediante EIS a las 4 y 24 horas de la exposición. Se utilizó agua destilada, acetato de metilo y ácido láctico como control negativo, positivo (categoría 2) y positivo (categoría 1), res-
Investigación Traslacional
pectivamente. Los datos de impedancia obtenidos a diferentes tiempos se utilizaron para evaluar el cambio en la capacitancia de los modelos expuestos a los diferentes productos químicos en relación con sus valores iniciales. A partir de las variaciones de capacitancia, se desarrolló un método de predic in vivo de las sustancias químicas de ensayo y se analizó la capacidad predictiva del método propuesto.
Los resultados obtenidos muestran que el método -
Sin Categoría (no irritantes). En el caso de las sussustancias químicas se categorizaron como categocomo categoría 1 se categorizó como categoría 2. Los resultados de este estudio sugieren por tanto que un método de ensayo de tiempo hasta toxicidad basado en mediciones de impedancia tiene eldos por la OCDE para la evaluación del daño corneal y posee una mayor capacidad predictiva que los métodos convencionales utilizados en modelos de RhCE basados en la viabilidad celular. Esta nueva herramienta puede ser una alternativa útil al ensayo de Draize para evaluar la irritabilidad potencial de las sustancias químicas y los productos aplicados al ojo.
PROYECTO III:
CULTIVO DE CÉLULAS EPITELIALES DE LA CÁPSULA ANTERIOR DEL CRISTALINO, COMO ALTERNATIVA A LAS CÉLULAS ENDOTELIALES CORNEALES, PARA EL TRATAMIENTO DE ENFERMEDADES DEL ENDOTELIO CORNEAL
Ocular de la FIO colabora con el Centro Comunitario de Sangre y Tejidos de Asturias (CCST) y con el IOFV, en el empleo de los tejidos no utilizados en el trasplante clínico, para obtener cultivos celulares de las diferentes estirpes celulares con potencial terapéutico.
Para una correcta función visual, la luz debe atravesar la córnea y contribuir a su difracción sobre la retina. En condiciones normales, la homogénea distribución
córnea su transparencia y curvatura para una correcta visión. Sin embargo, el estroma no es capaz por sí mismo de cumplir este propósito sin la ayuda del endotelio corneal, el cual controla la deshidratación del estroma y por tanto el correcto alineamiento y el mantenimiento de la función corneal. Si el endotelio corneal falla en su función, la visión se empobrece y en casos severos, se requiere del reemplazo del tejido mediante una queratoplastia.
A pesar del éxito generalizado de las queratoplastias endoteliales, el número de corneas donadas es mucho menor que el número de pacientes con necesidad de trasplante corneal, cifrándose en 12,7 millones las personas en lista de espera para un trasplante, y esta situación se espera que empeore debido al envejecimiento de la población.
Con el objetivo de solventar la escasez de tejido para trasplante y hacer accesible los tratamientos endoteliales a los pacientes, la expansión in vitro de células endoteliales corneales se ha mostrado como un tratamiento prometedor. Sin embargo, la expansión de células endoteliales corneales procedentes de endotelios corneales no está libre de limitaciones. Por un lado, las células endoteliales corneales no tienen capacidad de división cuando se encuentran en su nicho biológico en el ojo humano, lo que limita enormemente su capacidad de expansión in vitro. Por otro lado, el cultivo y expansión continuado de las células endoteliales corneales conduce muy frecuentemente a una pérdida de su función y su morfología, pasando de presentar una morfología típicamente hexagonal, a una morfología fusiforme.
Este proyecto pretende desarrollar un sistema de cultivo de células epiteliales de la cápsula anterior del cristalino, como alternativa a las células endoteliales corneales, para el tratamiento de enfermedades del endotelio corneal.
Para la obtención de los cultivos de células epiteliales de la cápsula anterior del cristalino, el protocolo realizado consistió en una disección mecánica de la cápsula anterior del cristalino y su posterior cultivo mediante la técnica de explante. Para ello, se enuclearon las córneas del globo ocular y se extrajo el cristalino. A continuación, el cristalino se situó con la cara anterior hacia arriba en una placa Petri que contenía PBS y se diseccionó la cápsula anterior. Posteriormente, la cápsula anterior se lavó con PBS para con la técnica de explante, colocándola en un pocillo
de una placa Petri p24 (2cm2 de cultivo compuesto por: DMEM / F12 (2:1) suplede Crecimiento (PRGF), 200 mg/L de cloruro cálcico,
Todos los cultivos se llevaron a cabo en una incucambiando el medio de cultivo cada dos-tres días.
La caracterización de los cultivos celulares obtenidos se realizó mediante técnicas de microscopía de
nalidad Zonula Ocludens (ZO-1) y bomba Na+/K+ ATPasa y, por último, mediante un análisis de expresión génica diferencial utilizando secuenciación de próxima generación de ARN (RNAseq).
Los resultados obtenidos mostraron que las células epiteliales de la cápsula anterior del cristalino son tinción positiva para los marcadores fenotípicos del endotelio corneal (ZO-1 y bomba Na+/K+ ATPasa). Asimismo, los cultivos de las células epiteliales de la cápsula anterior del cristalino compartieron un
genes, con cultivos de células endoteliales corneales, no encontrándose diferencias estadísticamente
los marcadores de funcionalidad AQP1, ATP1A1, CD200, CDH2, GPC4 y TJP1.
En conclusión, las células endoteliales corneales y el epitelio de la cápsula anterior del cristalino comparten similitudes sustanciales en la expresión de genes y proteínas, lo que respalda la hipótesis de utilizar las células epiteliales de la cápsula anterior del cristalino, como alternativa a las células endoteliales corneales, para el tratamiento de enfermedades del endotelio corneal. Además, la expansión de las células epiteliales de la cápsula anterior del cristalino se ha realizado con un medio de cultivo libre de factores xenogénicos, que facilitaría la traslación clínica de los resultados obtenidos.
Investigación Traslacional
PROYECTO IV:
-
ner a disposición de la salud de los pacientes, una herramienta terapéutica para el tratamiento de la in vivo de células epiteliales corneales, simulando la técnica SLET (Simple Limbal Epithelial Transplantation, por sus siglas en inglés).
La técnica SLET, consiste en obtener una pequeña biopsia de tejido limbar del ojo contralateral sano, trocearla y adherir los fragmentos del tejido limbar, con un pegamento comercial, a una membrana am afectado, colocando posteriormente una lentilla. Se trata de una técnica, que al utilizar muy poco tejido
ciencia límbica en el ojo donante, pero que, además, al no incluir el cultivo celular, se considera un acto quirúrgico y no un Medicamento de Terapia Avanzada, reduciendo los costes de la terapia, mientras que mantiene la misma tasa de éxito de los Medicamentos de Terapia Avanzada, utilizados para el
Para la realización del proyecto, el equipo investigador ha desarrollado previamente tres herramientas que facilitan la terapia del cultivo in vivo que se plantea en este proyecto. En primer lugar, un método propio de trasplante de células epiteliales viables, basado en adhesivos tisulares, con capacidad para conservar el potencial regenerativo de las células epiteliales trasplantadas. En segundo lugar, un protocolo de descelularización de distintos tejidos, para obtener matrices nativas acelulares, sin alterar el se ha demostrado la capacidad sellante de los adhesivos tisulares desarrollados en proyectos previos.
Este proyecto plantea, que la técnica de cultivo de células epiteliales in vivo, utilizando el método de trasplante y los adhesivos tisulares desarrollados por el grupo de investigación, podría ser utilizado en la práctica clínica para el tratamiento de lesiones epiteliales, de forma similar a la técnica SLET. En esta situación, sería el organismo vivo al que se trasplante, el “biorreactor” encargado de mantener el crecimiento y diferenciación celular, regenerando así los tejidos dañados.
Durante el año 2023, se han realizado estudios preliin vivo de células epiteliales corneales, utilizando los adhesivos tisulares desarrollados, en estudios in vitro simulando la técnica SLET. Para la realización de los estudios in vitronado por el Centro Comunitario de Sangre y Tejidos (CCST), en base al acuerdo marco de colaboración entre el CCST y la FIO. El tejido limbar se cortó en microinjertos de aproximadamente 2 mm2 que se situaron en el centro de cada uno de los pocillos de una placa Petri p12 (4 cm2). A continuación, se aña-
dos a cada microinjerto por duplicado y se cubrieron con medio de cultivo, cultivándose dos microinjertos de limbo sin adhesivo como grupo control. Se realizó un seguimiento diario mediante microscopia de contraste de fases, y a los 7 y 14 días se realizaron fotografías para calcular el área de crecimiento des-ron con metanol frío durante 10 minutos y se realizó el 4 ‘,6-DiAmidino-2-FenilIndol (DAPI), capturándose cinco fotografías de campos aleatorios, utilizando Finalmente, se contaron las células con tinción poutilizando el software ImageJ (NIH, Bethesda, MD, stem de células positivas para el DAPI.
Los resultados obtenidos hasta el momento han demostrado que las células limbares han sido capaces de proliferar desde los microinjertos, no encontránen el área de crecimiento desde el microinjerto, ni en stem entre los cultivos realizados con los diferentes adhesivos desarrollados y los cultivos realizados con la metodología de cultivo convencional. Estos prometedores resultados parecen indicar, que la técnica de cultivo de células epiteliales in vivo, utilizando los adhesivos tisulares desarrollados por el grupo de investigación, podría ser utilizado en la práctica clínica para el tratamiento de lesiones epiteliales, de forma similar a la técnica SLET, a falta de la realización de los estudios in vivo que demuestren la seguridad y
Investigación Traslacional
PROYECTO V:
La producción de Medicamentos de Terapia Avanzada debe hacerse bajo las directrices de un Sistema de Calidad Farmacéutico, cumpliendo las Normas de Correcta Fabricación y en una sala blanca con estrictas condiciones ambientales (área de trabajo Clase A en un entorno Clase B). Este sistema de trabajo encarece estos medicamentos, que de por sí tienen una producción muy poco rentable, ya que se trata de una producción limitada a unos pocos pacientes y a un solo lote por unidad de fabricación.
Una alternativa que reduciría el coste de las instalaciones es producir los Medicamentos de Terapia Avanzada en un sistema aislado del medio externo. En los últimos años, el grupo de investigación ha
blanca, reduciendo de este modo, los costes de diseño, construcción y mantenimiento, respecto a una sala blanca convencional. Asimismo, se ha re dactado todo el Sistema de Calidad Farmacéutico de acuerdo a las Normas de Correcta Fabricación adaptado a esta instalación.
Durante el año 2023, se establecieron los requisi tratamiento experimental desarrollado por el grupo de investigación, la inyección de células endotelia

les corneales en cámara anterior, para su fabricación en la mini sala blanca. Para ello, se redactó el Procedimiento Normalizado de Trabajo (PNT) de Producción y la Guía de Fabricación, acorde a las Normas de Correcta Fabricación, que permite la producción de células endoteliales corneales expandidas in vitro dentro de la mini sala blanca. Además, se realizó la producción de un primer lote del medicamento desarrollado (células endoteliales corneales expandidas in vitro), siguiendo la Guía de Fabricación redactada, en la que se puso de mani-to, siendo necesario únicamente ajustar la cantidad del material fungible previsto. Posteriormente, se realizaron tres lotes del medicamento desarrollado, de Producción de Células Endoteliales Corneales y en la Guía de Fabricación. Los resultados obtenidos, en los parámetros monitorizados, mostraron que todos los lotes cumplieron con los parámetros de control de proceso y de control de producto es-
En conclusión, se ha podido realizar la producción del Medicamento de Terapia Avanzada desarrollado en el interior de la mini sala blanca, siguiendo las Normas de Correcta Fabricación que requiere la fabricación de medicamentos de uso humano.
El Instituto Oftalmológico Fernández-Vega dedica una parte importante de sus recursos a la investigación clínica, consciente de su importancia diferencial para la propuesta de valor que realiza al sector oftalmológico a nivel mundial. Su trabajo y trascendencia en esta área es posible gracias a la gran cantidad de pacientes, más de 100.000, que recibe cada año. A continuación se detallan los investigadores y proyectos involucrados en este apartado.
Investigadores Principales:

Prof. Luis Fernández-Vega Sanz.
El director médico del Instituto Oftalmológico Fernández-Vega es Licenciado en Medicina y Cirugía por la Universidad Autónoma de Madrid, Especialista en Oftalmología. Doctor en Medicina y Cirugía (Premio Extraordinario). Fue el Catedrático de Oftalmología más joven de España (1982). Completó su formación con numerosas estancias en el extranjero en distintos Servicios. Durante 3 años colaboró con el Dr. Castroviejo en toda su actividad clínica y quirúrgica. Desde el año 83 hasta 2022 fue Jefe del Servicio de Oftalmología del Hospital Universitario Central de Asturias. Es autor de más de 200 publicaciones de la Especialidad, varios capítulos de libros, numerosas presentaciones en Congresos Nacionales e Internacionales y ha impartido conferencias en casi todas las Universidades del país. Cuenta con numerosos premios de la Especialidad, destacando el Arruga y el Castroviejo. Es Académico de Número por la Academia Médico-Quirúrgica Española y por la Real Academia de Medicina del Principado de Asturias, miembro de las Sociedades Oftalmológicas más importantes del mundo, Presidente de Honor de la Sociedad Española de Cirugía Ocular Implanto-Refractiva, (SECOIR, que presidió entre 1996 y 2000). Fue
Cuenta con numerosas distinciones, tanto vinculadas a su trayectoria profesional médica como en el ámbito personal, en el que ha ocupado relevantes posiciones. Entre ellas, la Medalla de Asturias, Medalla de Honor de los Cursos de la Granda, Medalla de Oro de la Cámara de Comercio de Oviedo, Medalla de Oro de la Universidad de Oviedo, y en mayo de 2023
S.M. el Rey le impuso la Gran Cruz de la orden del Mérito Civil. Ha sido Presidente de la Fundación Princesa de Asturias (2018-2022), y miembro
Técnica hasta el año 2017. Desde el año 2018 es miembro del Jurado del Premio de la Concordia.

Prof. Jesús Merayo Lloves.
Director del Instituto Universitario Fernández-Vega. Doctor en Medicina y Médico Especialista en Oftalmología. Alta especialidad (Fellowship) en Inmunología Ocular y Uveítis (Universidad de Harvard, USA) y Cirugía Refractiva (FOSCAL-UNAB, Colombia). Diplomatura en Óptica y Optometría (USPCEU, Madrid) y Máster en Dirección de Empresas (EAP. Mala Universidad de Oviedo.


Dr. José F. Alfonso Sánchez.
Licenciado en Medicina y Cirugía por la Universidad Complutense de Madrid (UCM) en 1981, doctor en Medicina y Cirugía 1987 por la misma universidad y especialista en Oftalmología (1988) en el Hospital Universitario Central de Asturias. Profesor titular de Oftalmología en la Universidad de Oviedo desde 1991. Premios Arruga y Castroviejo, presidente de la Sociedad Española de Cirugía Implanto Refractivacialista en córnea y cristalino, es autor de innumerables publicaciones de SECOIR y sobre cirugía refractiva del cristalino de la SEO, y líder de opinión en los principales congresos nacionales e internacionales de su especialidad durante los últimos 30 años. Inventor de la endoqueratoprótesis Endo-K para los trasplantes de córnea. Actualmente es coordinador de Investigación Clínica y director de la Unidad de Córnea y Cristalino del Instituto Oftalmológico Fernández-Vega.
Dr. Luis Fernández-Vega Cueto-Felgueroso.
Licenciado en Medicina y Cirugía por la Universidad Complutense de Madrid. Doctor en Ciencias de la Salud y Biomedicina por la Universidad de Oviedo: Premio extraordinario por la Tesis sobre queratocono y anillos intracorneales. Título en Cirugía refractiva y cataratas de ESCRS-EBO por el European Board of Oftalmology.
Oftalmología Barraquer, (Barcelona) y Clínica Oftalmológica del Caribe (Barranquilla). También realizó varios Fellowship ocular, córnea, cristalino y cirugía refractiva en la Universidad de
Hospital NHS Foundation Trust (Londres); y en Córnea, Catarata y Cirugía Refractiva en Bascon Palmer Eye Institute (Miami).
especialidad, capítulos de libros, así como de numerosas presentaciones en congresos nacionales e internacionales. Ha sido autor principal en el libro “Comunicación solicitada” de la Sociedad Española de Oftalmología 2023 sobre segmentos de anillo intracorneales. Cuenta con numerosos premios por ponencias en distintos congresos y otros reconocimientos, como el prestigioso galardón internacional Peter Barry Fellowship de la Sociedad Europea de Cirugía Refractiva y Catarata (ESCRS). Es miembro de las Sociedades Oftalmológicas nacionales e internacionales más importantes. Fue Presidente y Co-Fundador de la Asociación de Jóvenes Oftalmólogos Españoles (AJOE) dependiente de la Sociedad Española de Oftalmología (SEO), entre los años la Unidad de Córnea y Cristalino del Instituto Oftalmológico Fernández-Vega y es vocal de la SEO por Asturias desde septiembre de 2023.
Córnea:
ILE871-P001.
A Real Word Evidence (RWE) ambispective study (Regitri) to Access outcomes of Vivity and Vivity Toric
Investigador Principal: Dr. José F. Alfonso Sánchez.
Promotor: ALCON Research.
KOWA K-321-301.
A Double-Masked, Randomized, Placebo-Controlled, Parallel-Group, 12-Week Administration With TwoWeek Gradual Dose Taper Phase and 38-Week Follow-Up Phase, Phase 3 Study to Investigate the Safety Corneal Dystrophy.
Investigador Principal: Dr. José F. Alfonso Sánchez.
Promotor: Kowa Research Institute, Inc.
CELOPHIN.
Ensayo clínico en fase II para conocer la factibilidad y seguridad del uso de células troncales mesenquiafectación ocular.
Investigador Principal: Prof. Dr. Jesús M. Merayo Lloves.
Promotor: Instituto de Investigación Sanitaria de la Fundación Jiménez Díaz.
REC0559-B001.
Investigador Principal: Prof. Dr. Jesús M. Merayo Lloves.
Promotor: Recordati Rare Diseases.
Investigación Clínica
PRGF ANIRIDIA.
Estudio observacional del Plasma rico en factores de crecimiento (PRGF) en pacientes con aniridia con-
Investigador Principal: Prof. Dr. Jesús M. Merayo Lloves.
Promotor: Instituto Oftalmológico Fernández-Vega.
RGN-NK-303.
SEER-3: Estudio en fase 3, multicéntrico, aleatorizado, paralelo, con doble enmascaramento y contro-
Investigador Principal: Prof. Dr. Jesús M. Merayo Lloves.
Promotor: ReGenTree, LLC.
21E1007.vis ® Total Multi versus Systane Balance on the treatment of ocular dryness associated with meibomian gland d ® ysfunction.
Investigador Principal: Prof. Dr. Jesús M. Merayo Lloves.
Promotor: Horus Pharma.
Investigadores Principales:

Dr. Álvaro Fernández-Vega Sanz.
Licenciado en Medicina y Cirugía por la Universidad Autónoma de Madrid. Especialista en Oftalmología en el Hospital Clínico de San Carlos, donde realizó una estancia de dos años en el departamento de Retina. Superespecialidad en Retina y Vítreo en el Centro Médico de San Juan de Puerto Rico y en el Eye Foundation, Kansas City, USA. También ha
Sabio en Madrid. Ha realizado estancias en el Departamento de Retina del Bascom Palmer Clinic of Miami, el Wills Eye Hospital of Philadelphia, el Eye Center of Duke University en Durham, en los Departamentos de Retina del Manhattan Eye and Ear, Massachussetts Eye and Ear, Retina Foundation and Retina Associates of Boston y la Clínica del Dr. Steve Charles en Menphis. Actualmente, es el Director de la unidad de Retina y Vítreo del Instituto Oftalmológico Fernández-Vega. Es miembro de las Sociedades Oftalmológicas más importantes, tanto nacionales como internacionales, como la Sociedad Española de Oftalmología, la Schepens International Society of Retina o la American Academy of Ophthalmology y fue socio fundador y miembro de la primera junta directiva de la SERV (Sociedad Española de Retina y Vítreo). Es investigador principal de 19 ensayos clínicos multicéntricos y realiza anualmente múltiples presentaciones en congresos nacionales e internacionales, así como numerosas publicaciones en revistas y libros de la especialidad. Destaca el titulado “Traumatología Ocular”, por encargo de la Sociedad Española de Oftalmología, junto con otros oftalmólogos nacionales e internacionales, entre los que destacan muchos de los doctores del Instituto Fernández-Vega. Es responsable y director de uno de los cursos de retina médica y quirúrgica más prestigiosos de este país, auspiciado por el IOFV y que se imparte cada cuatro años.

Dra. Beatriz Fernández-Vega Sanz.
Licenciada en Medicina y cirugía por la Universidad de Oviedo, 1986. Especialista en oftalmología. Doctora en Medicina por la Universidad de Oviedo. Súperespecialidad en Retina y Vítreo en el Instituto Oftalmológico Fernández-Vega. Miembro de la Sociedad Española de Oftalmología, Sociedad Italiana de Oftalmología y Sociedad Española de Retina y Vítreo. Participa como subinvestigadora en diversos estudios multicéntricos. Autora de múltiples trabajos y publicaciones en revistas médicas nacionales e internacionales. Defendió su tesis doctoral en 2020 titulada: “Estudio de factores de riesgo vascular en patologías retinianas”. Departamento de Biología y morfología celular de la Universidad de Oviedo: bases morfologías y funcionales de la neurología
Investigación Clínica

Dr. Álvaro Fernández-Vega González.
Licenciado en Medicina y Cirugía por la Universidad Complutense de Madrid. Especialista en Oftalmología por el Centro de Oftalmología Barraquer de Barcelona. Cuenta con varios Máster por la Universidad Autónoma de Barcelona: en Patología y Cirugía de la Mácula, Vítreo y Retina; en Diagnóstico y Tratamiento de la Catarata y el Glaucoma; y en
Su formación se completa con varios títulos de Fellow centrados en la especialidad de retina: Título de Fellow of the European Board of Ophthalmology (FEBO-París). Fellowship en Retina Clínica en el University of Illinois Hospital at Chicago. Fellowship en Retina Médico-Quirúrgica del Programa de Formación de Expertos en Retina de la Sociedad Española de Retina y Vítreo en el Hospital de Bellvitge de Barcelona. Fellowship en Cirugía de Vítreo-Retina en St. Michael´s Hospital of Toronto.
de libros de la especialidad y más de 30 ponencias en congresos nacionales e internacionales.
Miembro de La Sociedad Española de Oftalmología (SEO), La Sociedad Española de Retina y Vítreo (SERV), de The American Society of Retina Specialist (ASRS) y de The American Academy of Ophthalmology (AAO). Miembro de la Junta de la Sociedad Española de Retina y Vítreo (SERV) como vocal por Asturias. En la actualidad forma parte de la Unidad de Retina y Vítreo del Instituto Oftalmológico Fernández-Vega ejerciendo como especialista en retina médico-quirúrgica y es vocal de la SERV por Asturias.
Retina: MYOPRED.
Investigación Principal: Dr. Álvaro Fernández-Vega Sanz.
Promotor: Viros-Hanusch Hospital (ESCRS).
RHONE GR41987.
inpatients with diabetic macular edema. Protocol Nº GR1987, Eurodract Nº 2020-000402-29
Investigación Principal: Dr. Álvaro Fernández-Vega Sanz.
Promotor: Roche.
My Light CSOK583A12301.lar age related macular degeneration.
Investigación Principal: Dr. Álvaro Fernández-Vega Sanz.
Promotor: ROCHE.
Avonelle-X GR42691. in patients with neovascular age-related macular degeneration.
Investigación Principal: Dr. Álvaro Fernández-Vega Sanz.
Promotor: Roche.
COAST-OPTHEA OPT-302-1005.
travitreal OPT-302 neovascular age-relatd macular degeneration (Namd).
Investigación Principal: Dr. Álvaro Fernández-Vega Sanz.
Promotor: OPTHEA.
ALTERA ALT-L9-03.
Safety of ALT-L9 Versus Eylea in patients with neovascular age related macular degeneration (nAMD).
Investigación Principal: Dr. Álvaro Fernández-Vega Sanz.
Promotor: Altos Biologics.
Helix HLX04-o-wAMD.
A Phase 3, Two-part (Open-label Followed by Randomized Double-masked Active Controlled) Study to
Investigación Principal: Dr. Álvaro Fernández-Vega Sanz.
Promotor: Shangai Henlius Biotech Inc.
Investigación Clínica
Investigadores Principales:


Dr. Pedro Pablo Rodríguez Calvo.
Licenciado en Medicina y Cirugía. Especializado en Oftalmología en el Hospital General de Asturias
Miembro de la Sociedad Española de Oftalmología y de la Sociedad Española de Glaucoma. Superespecialidad en Cirugía de Catarata y Glaucoma. Actualmente desarrolla su trabajo en las unidades de Glaucoma, Cirugía Refractiva y Cataratas del Instituto Oftalmológico Fernández-Vega.
Responsable de la Unidad de Glaucoma del Instituto Oftalmológico Fernández-Vega.
Investigador principal en la Línea de Investigación Clínica de Glaucoma de la Fundación de Investigación Oftalmológica.
Dr. Ignacio Rodríguez Uña.
Licenciado en Medicina en la Universidad Complutense de Madrid (2009). Especialista en Oftalmología (Hospital Clínico San Carlos de Madrid, 2014). Doctor en Medicina (2016), recibiendo el Premio Extraordinario de Doctorado.
Máster en Investigación en Ciencias de la Visión (2012) y Máster
“European Board of Ophthalmology” (2014).
Alta Especialidad (“Fellowship”) en Glaucoma en 2016 (Nottingham University Hospital, Reino Unido). Miembro de las Sociedades Oftalmológicas nacionales e internacionales más importantes.
especialidad y varios capítulos de libros, con un índice h de 8. Ha recibido varias becas de investigación y ha sido galardonado con varios premios nacionales de investigación.
Actualmente es Colaborador de Honor (Acreditado para Profesor Ayudante Doctor) de la Universidad de Oviedo.

Dr. Andrés Fernández-Vega Cueto-Felgueroso.
Licenciado en Medicina y Cirugía por la Universidad Complutense de Madrid. Especialista en Oftalmología en el Centro de Oftalmología Barraquer (Barcelona). Máster de Segmento Anterior del globo ocular: Diagnóstico y tratamiento de la catarata y glaucoma por la Universidad Autónoma de Barcelona. Premio Extraordinario de Doctorado, Doctor Cum Laude con Mención Internacional en Ciencias de la Salud por la Universidad de Oviedo. Tesis Doctoral sobre glaucoma y neuroprotección. Cuenta con varios títulos de Fellow: por el European Board of Ophthalmology (FEBO–Paris). Fellowship clínico-quirúrgico de glaucoma por la Universidad de Oviedo. Fellowship clínico-qui-
Foundation Trust (Londres). Ha realizado también estancias formativas clínico-quirúrgicas de glaucoma y cataratas en Swiss Visio (Lausana) y en Hospital Germans Trias i Pujol (Badalona),ca del Caribe (Barranquilla).
la especialidad, varios capítulos de libros y libros completos, así como numerosas presentaciones a congresos tanto nacionales como internacionales. Ha recibido importantes Becas de investigación, entre las que destaca la Beca de la Sociedad Española de Cirugía Ocular Implanto-Refractiva (SECOIR). Es miembro activo de las Sociedades Oftalmológicas nacionales e internacionales más importantes y ha sido Presidente de la Asociación de Jóvenes Oftalmólogos Españoles (AJOE) dentro de la Sociedad Española de Oftalmología (SEO). En la actualidad desarrolla su trabajo en el equipo de la Unidad de Glaucoma del Instituto Oftalmológico Fernández-Vega.
Glaucoma: LT4030-301.
comatous Patients.
Investigador Principal: Dr. Pedro Pablo Rodríguez Calvo.
Investigador Asociado: Dr. Ignacio Rodríguez Uña.
Promotor: Thea.

La actividad clínica y de investigación del Instituto Oftalmológico Fernández-Vega genera una alta capacidad docente, que se materializa en los estudios de grado y post-grado realizados el Instituto Oftalmológico Fernández-Vega, la Fundación de Investigación Oftalmológica, en colaboración con la Universidad de Oviedo y otras Instituciones Académicas.
Aunque somos conscientes del coste que conlleva la formación, desde la FIO, se apuesta de forma estratégica por ella, ya que es la clave para mantener el cuidado de los pacientes y la actividad investigadora en niveles de excelencia.
Coordinadora de Docencia: Dra. Begoña Baamonde Arbaiza.
Cursan prácticas alumnos de la Asignatura de Oftalmología de la Facultad de Medicina, dentro de las Asignaturas Proyectos I, Proyectos II y Proyectos III, así como en la especialidad de Oftalmología.
Tutor de la Asignatura: Prof. Jesús Merayo Lloves.
2022-2023
Dña. Eva Rubín Sánchez.
Dña. Laura Alonso Fernández.
Dña. Celia Rodríguez Busta.
Tutor de la Asignatura: Prof. Jesús Merayo Lloves.
2023-2024
Dña. Eva Rubín Sánchez.
Dña. Laura Alonso Fernández.
Dña. Celia Rodríguez Busta.
2022-2023
Dña. Lucía Trevejo Burgoa.
Dña. Ana María Mironishnichenico Ortega.
Dña. Marta Nicieza Fernández-Vega.
Dña. Alicia Ortega Martín.
Dña. Patricia Menéndez Iglesias.
Dña. Eva Rubín Sánchez.
Dña. Laura Alonso Fernández.
Dña. Celia Rodríguez Busta.
Tutor de la Asignatura: Prof. Jesús Merayo Lloves.
2023-2024
Dña. Lucía Trevejo Burgoa.
Dña. Ana María Mironishnichenico Ortega.
Dña. Marta Nicieza Fernández-Vega.
Dña. Alicia Ortega Martín.
Dña. Patricia Menéndez Iglesias.
Dña. Eva Rubín Sánchez.
Dña. Laura Alonso Fernández.
Dña. Celia Rodríguez Busta.
2022-2023
Dña. Sofía Martínez Rodríguez.
Dña. Isabel Asensi Miranda.
Dña. Irene Villaverde Álvarez.
Dña. Cristina Fernández-Peña.
Los alumnos de la Asignatura de Oftalmología, procedentes de la Universidad de Oviedo, que han realizado prácticas de Medicina en el Instituto Oftalmológico Fernández-Vega, bajo la supervisión de los Dres. Luis Fernández-Vega Cueto-Felgueroso, José F. Alfonso Sánchez y Prof. Jesús Merayo Lloves, durante el curso lectivo 2022-2023 son los siguientes:
2023-2024
Dña. Estela del Mar Pividal Nicolás.
Dña. Lucía del Río Monteserín.
D. Ismael Sánchez González.
D. Ignacio de la Vega Morán.
Dña. Katia Pérez García-Jove.
D. Francisco Sabio Díaz.
D. Saúl Teijeiro Suárez.
Dña. Isabel Valdés González.
Dña. Regina Friederike Münch.
Dña. Johanna Pérez González.
D. Marcos Seivane Álvarez.
D. Miguel Vigil Blanco.
Dña. Laura Naves Mendívil.
Dña. Carla Pérez Pérez.
Dña. Miriam Seul.
D. Alex Vigil Carrera.
Dña. Olena Nechepayeva.
Dña. Teresa Quirós Díez.
Dña. Eva Sevilla Salto.
Dña. Carmen Vigil García.
D. Iván Noval Gaite.
D. Sergio Ramos Martín.
Dña. Nuria Simón Santos.
Dña. Isabel Vigil López.
Dña. Claudia Núñez Fernández.
Dña. Sara Ramón Rodríguez.
Dña. Aida Sotomayor Centeno.
Dña. Soledad Villar Velasco.
Dña. Laura Ordóñez Cifuentes
Dña. Isabel de la Riera Suárez
Dña. Julia Suárez Meana.
Dña. Sara Vázquez Fernández.
Dña. María Palacios Chimeno.
Dña. Claudia Riesco Suárez.
D. Eloy Suárez Menéndez.
D. León Vázquez Garzón.
D. David Pastor Fernández.
Dña. Henar Rodríguez González.
Dña. Mar Suárez Rodríguez.
Dña. Annika Katharina Weber.
Dña. Alba Menéndez Vázquez.
D. Lorenzo Pañeda Fernández.
Dña. Aurora del Acebo Rodríguez Pouso.
D. Shaked Cohen.
Dña. Alba González Prieto.
D. Felipe Murillo Plaza.
Dña. Lucía Rodríguez Secades.
Dña. Cristina del Valle Mateos.
D. Javier Costas García.
Dña. Ana Gutiérrez Piñón.
Dña. Laura Muñiz Seva.
D. Pedro Alejandro Rubín González del Valle.
Dña. Alba Vázquez Fernández.
D. Daniel Díaz Villanueva.
D. Alberto Hernández Gala.
Dña. Paula Irene Muñiz Álvarez.
Dña. María Ruiz del Peso.
Dña. Laura Fernández Cueto.
Dña. Virginia de la Iglesia Estévez.
Dña. María del Carmen Piñera Sánchez.
Dña. Rukaia Nur Sabagh Kourdi.
Dña. Imane Zouhri.
Dña. Lucía Álvarez Muñiz.
D. Iker Fernández Gómez.
Dña. Lorena Larfeuil Fernández.
Dña. Paulina Ponikiewska.
Dña. Noa Sanmartín Franco.
Dña. Sofía Álvarez Santamarina.
D. Pablo Llorente Rodríguez.
Dña. María Teresa Potysz Rodríguez.
D. Julio Santa Cruz García.
Dña. Claudia Alvargonzález Fernández .
Dña. Marta Fernández-Miranda López.
Dña. Loreto López Candás.
D. José Pérez García.
Dña. Elvira Santos Trelles.
D. Diego Argüelles Vicente.
Dña. Inés Fervienza Marquiegui.
D. Jorge Martín Díaz.
Dña. Sara Pérez Álvarez.
Dña. Gabriele Stella.
D. Kristian Heiko Friedrich.
D. Raúl Martín González.
Dña. Laura Rodríguez Cabricano.
D. Pedro Susacasa Fernández-Pello.
Dña. Olivia Leigh Blake.
D. Roberto Galletta.
D. Guillermo Meana Baamonde.
D. Víctor Manuel Rodríguez Carvajal.
D. Daniel Suárez Fernández.
D. Guzmán Calzado Díez.
Dña. Pierina Katherin Garagatti Romaldo.
Dña. Andrea Mella Bermúdez
Dña. Sonia Rodríguez Díaz.
D. Manuel Sánchez Suárez.
Dña. Raquel Coalla Menéndez.
Dña. Viena Gil Menéndez.
Dña. Sara Menéndez Pérez.
D. Pablo Rodríguez Gómez.
Dña. Demelsa Taboada Iglesias.
Los Prácticas Clínicas Extraordinarias Universidad de Oviedo: D. Cristoph Lukas Reger y Dña. Lluliana Ríos Acebedo
D. Nicolás Carrillo ha realizado un Internado Médico en el Instituto Oftalmológico Fernández-Vega a través de un convenio entre la Universidad de Oviedo y la Universidad de Bucaramanga en Colombia.
Además de la formación a los futuros médicos en oftalmología, el IOFV y la FIO acogen la asignatura de “Prácticas de Empresa” de varios grados entre
Biotecnología, Biomedicina, del Máster en Ciencias Analíticas y Bioanalíticas y del Máster en Biomedicina y Oncología Molecular de la Universidad de Oviedo y de otras Universidades de fuera de la comunidad o extranjeras:
2022-2023
Dña. Alicia Villa Vázquez, Grado de Biotecnología, Universidad de Oviedo.
Tutora: Dra. Lidia Álvarez Fernández.
D. Adrián González Fernández, Grado de Biotecnología, Universidad de Oviedo.
Tutor: Dr. Manuel Chacón Rodríguez.
D. Carlos López Portugués, Máster Ciencias Analíticas y Bioanalíticas, Universidad de Oviedo.
Tutora: Dra. Lidia Álvarez Fernández.
D. Miguel Rodríguez Monjardín, Grado Biología, Universidad de Oviedo.
Tutor: Dr. Ignacio Alcalde Domínguez.
Dña. Sara Cardín Gutiérrez, Grado Biología, Universidad de Oviedo.
Tutora: Dra. Natalia Vázquez Moreno.
2023-2024
D. Diego Martín Fernández, Grado de Biotecnología, Universidad de Oviedo.
Tutora: Dra. Lidia Álvarez Fernández.
Realizaron Prácticas Complementarias de verano las alumnas Dña. Sofía Martínez Rodríguez, bajo la tutoría del Prof. Jesús Merayo, así como Dña. Lorena Larfeuil Fernández, cuyos tutores han sido los Dres. Álvaro Fernández-Vega Sanz y Álvaro Fernández-Vega González.
D. Nicolás Carrillo ha realizado un Internado Médico en el Instituto Oftalmológico Fernández-Vega a través de un convenio entre la Universidad de Oviedo y la Universidad de Bucaramanga en Colombia.
2023-2024
Dña. Noa Sanmartín Franco, Grado en Medicina.
Tutor: Dr. Ignacio Rodríguez Uña.
Dña. María del Carmen Ponte de la Mata, Grado en Medicina.
Tutor: Dr. Ignacio Rodríguez Uña.
Dña. Sofía Recuero Guerra, Grado en Medicina.
Tutores: Prof. Jesús Merayo y Dr. Álvaro Meana
Dña. Cecilia Milán Malnero, Grado en Medicina.
Tutor: Prof. Merayo.
Dña. Lorena Larfeuil Fernández, Grado en Medicina.
Tutores: Prof. Merayo y Dr. Álvaro Fernández-Vega González.
2022-2023
Dña. Raquel Arias Blanco, Grado en Biología.
Tutores: Dra. Susana del Olmo y Dr. Luis Quirós.
Dña. Sheila Lorenzo Sánchez, Grado en Biología.
Tutores: Dra. Susana del Olmo y Dr. Luis Quirós.
Dña. María González Fernández, Grado en Biotecnología.
Tutora: Dra. Lidia Álvarez Fernández.
Dña. Sofía Recuero Guerra, Grado en Medicina.
Tutor: Prof. Jesús Merayo Lloves.
La alumna Dña. Adora Husseini, estudiante de Medicina de la Universidad de Auckland, Nueva Zelanda, realizó una Rotación Clínica en el Instituto
Oftalmológico Fernández-Vega bajo la tutoría de los Dres. Álvaro Fernández-Vega Sanz y Javier Fernández-Vega Sanz.
Alumnos del Programa de Doctorado en Ciencias de la Salud Línea de Investigación de “Oftalmología y Ciencias de la Visión”
D. Álvaro Fernández-Vega Sanz, D. Álvaro Fernández-Vega González, D. Carlos Fernández-Vega González, Dña. Belén Alfonso Bartolozzi, Dña. Mairobi Persinal Medina, Dña. Susy Pachon Cunha, D. Pedro Pablo Rodríguez Calvo, D. José Ignacio Blázquez García, Dña. Nancy Jurado Guano, Dña. Lucía Cárcaba García, D. Vitto Romano, D. Ricardo -
nos, Dña. Cristina Sánchez Fernández, Dña. Silvia Berisa Prado, Dña. Eva Villota Deleu, Dña. Aranzazu Poo López, D. Alberto Barros Suárez, Dña. Heidi Carolina Calderón Gutiérrez, D. Javier Lozano Sanroma, Dña. Julia Dugnol Menéndez, D. Manuel Chacón Rodríguez, D. Juan Queiruga Piñeira, Dña. María Rueda Mansilla, D. Manuel Álvarez Prada, Dña Belén Sánchez Cañal, D. Jorge García Álvarez, D. César Carriazo Escaf, Dña. Luisa Anaya Admadé.
Coordinador en la Comisión Académica de la Línea de Investigación de Oftalmología y Ciencias de la Visión: Prof. Jesús Merayo Lloves.
Miembros de la línea de investigación y directores de tesis:
COORDINADOR: Prof. Jesús Merayo Lloves.
PROFESORES: Prof. Luis Fernández-Vega, Dr. José F. Alfonso Sánchez, Dra. Begoña Baamonde Arbai-
nández, Dr. Ignacio Alcalde, Dr. Luis Fernández-Vega Cueto-Felgueroso, Dr. Ignacio Rodríguez Uña.
7 de julio, “Prevención y corrección de los defectos de refracción en el trasplante laminar anterior profundo”, Defensa Pública de Tesis Doctoral, Dña. Belén Alfonso Bartolozzi.
TRIBUNAL: Prof. Jesús Merayo Lloves (Universidad de Oviedo), Presidente; Dr. Luis Manuel Quirós Fernández, Universidad de Oviedo, Secretario; Dr. Javier Mendicute del Barrio (Universidad del País Vasco), Vocal; Dra. Rosario Touriño Peralba (Universidad de Santiago de Compostela), Vocal; Dra. Lucía Ibares Frías (Instituto Oftalmológico Fernández-Vega), Vocal.
Directores de Tesis: Prof. Luis Fernández-Vega Sanz y Dra. María Begoña Baamonde Arbaiza (Instituto Universitario Fernández-Vega).
Tutor: Prof. Jesús Merayo Lloves (Universidad de Oviedo).
16 de octubre, “Desarrollo de nuevos modelos de tejido reconstruido in vitro, como método alternativo a la experimentación animal en la evaluación de peligros para la salud humana”, Defensa Pública de Tesis Doctoral, D. Manuel Chacón Rodríguez.
TRIBUNAL: Dr. Miguel Holgado Bolaños (Universidad Politécnica de Madrid), Dr. Luis Manuel Quirós Fernández (Universidad de Oviedo), Secretario; Dr. Matthias Titeux (French Institute of Health and Medica Research), Vocal; Dra. Ana Abadessa (Center for Research in molecular medicine and chronic diseases), Vocal; Dr. Iván Fernández Vega (Universidad de Oviedo), Vocal.
Director de Tesis: Prof. Jesús Merayo Lloves (Universidad de Oviedo)
1 de diciembre, “Desarrollo de dos Medicamentos de Terapias Avanzadas para el tratamiento de les Defensa Pública de Tesis Doctoral, Dña. Mairobi Persinal Medina.
TRIBUNAL: Prof. Damián García Olmo (Universidad Autónoma de Madrid), Prof. Luis Manuel Junquera Gutiérrez (Universidad de Oviedo), Secretario; Dra. Verónica García Díaz (Universidad de Valladolid), Vocal; Dr. Iván Fernández Vega (Universidad de Oviedo), Vocal; Dra. Mª Dolores Montalvo Parra (Universidad de Anahuac), Vocal.
Directores de Tesis: Dra. Sara Mª Gómez Llames (CIBER de Enfermedades Raras, ISCIII) y Prof. Jesús Merayo Lloves (Universidad de Oviedo).
“Alumnos Programa de Doctorado en Biología Molecular”
Alumno: D. Sergio Alonso Alonso.
Directores: Prof. Jesús Merayo Lloves, Dr. Alvaro
“Alumnos Programa de Doctorado en Análisis Químico, Bioquímico y Estructural y Modelización Computacional”
Alumno: Dña. Alicia Villa Vázquez
Directores: Dras. María Lydia Álvarez Fernández y Beatriz Fernández García.
LA UNIVERSIDAD DE OVIEDO
Los profesores e investigadores del IUFV colaboran con la Asignatura de Innovación y transferencia tecnológica en Neurociencias.
Ha realizado su Trabajo de Fin de Máster con nosotros:
2021-2022
Trabajo Fin de Máster: D. Abraham Tejedor Agustiño.
Título: Neurobiología del envejecimiento ocular en un modelo de ratón. Papel del TRPM8 en la función visual.
Coordinador de la Asignatura: Prof. Jesús M. Merayo Lloves.
Profesores: Prof. Jesús Merayo Lloves, Dra. Susana del Olmo Aguado, Dra. Carla Martín Cueto, Dr. Ignacio Alcalde Domínguez, D. Manuel Chacón.
Ha realizado su Trabajo de Fin de Máster con nosotros:
2023-2024
Dña. Diana Albino, Máster en Biotecnología Biomédica, Universidad de Bolonia, a través de un acuerdo de movilidad con la Universidad de Oviedo.
Director:
Cirugía Aditiva.
Máster profesionalizador clínico y de investigación (equivalente a los fellowship en el sistema de E.E.U.U.) que pretende dar una alta especialización al oftalmólogo en la investigación traslacional, prevención, diagnóstico y tratamiento médico quirúrgico cirugía refractiva.
ciente en el manejo de la patología de la subespecialidad.
Este máster está destinado a oftalmólogos con in-
Córnea, Cristalino y Cirugía Refractiva con vocación investigadora y docente.
Alumnos del Máster:
Dña. Rosa Elena Alvarado Villacorta (2022-2023).
D. Víctor Hugo Serna Villegas (2023-2024).
Directores: Prof. Luis Fernández-Vega Sanz y Dr. José F. Alfonso Sánchez.
Coordinador: Prof. Jesús M. Merayo Lloves.
Máster en Optometría Clínica.
Máster profesionalizador clínico y de investigación (equivalente a los fellowship de EEUU) que pretende subespecializar al Óptico-Optometrista para que pueda integrarse en equipos multidisciplinares de las clínicas oftalmológicas o departamentos oftalmológicos.
tricas como ayuda al manejo integral del paciente oftalmológico y que pueda desarrollar la aplicación del
Está destinado a ópticos-optometristas con interés en la optometría clínica y con vocación investigadora y docente.
Alumnos del Máster: Dña. Irene Cenicero Paredes (2022-2023).
Dña. Cristina Presa Díez (2023-2024).
Dña. Lara Argüelles Prendes (2023-2024).
Dña. Elba Castro Vila (2023-2024).
Directores: Prof. Luis Fernández-Vega Sanz y D. Javier Lozano Sanroma.
Coordinador: Prof. Jesús M. Merayo Lloves.
Máster en Enfermería Oftalmológica.
Máster profesionalizador clínico y de investigación (equivalente a los fellowship de EEUU) que pretende subespecializar al DUE (Diplomado Universitario en Enfermería) para que pueda integrarse en equipos multidisciplinares de las clínicas oftalmológicas o departamentos oftalmológicos.
-
tes en la aplicación de conocimientos oftalmológicos como ayuda al manejo integral del paciente oftalmológico dentro y fuera del quirófano, y que pueda subespecialidad.
Alumnos del Máster: Dña. Teresa Hernández Hernández (2022-2023).
Dña. Elena González López (2023-2024).
Directores: Prof. Jesús Merayo Lloves y D. Avelino Ojanguren Fernández.
Coordinador: Prof. Jesús M. Merayo Lloves.
Máster en Retina y Vítreo.
Máster profesionalizador clínico y de investigación (equivalente a los fellowship del sistema de EE.UU.) que pretende subespecializar al oftalmólogo en la investigación traslacional, prevención, diagnóstico y
tratamiento médico quirúrgico en el área de vítreo-retina.
ciente en el manejo de la patología de la subespecialidad.
Alumnos del Máster: D. Nicolás Sánchez Maluf (2022-2023).
Dña. Rosa Elena Alvarado Villacorta (2023-2024).
Directores: Prof. Luis Fernández-Vega Sanz y D. Álvaro Fernández-Vega Sanz.
Coordinador: Prof. Jesús M. Merayo Lloves.
Máster en Glaucoma.
Máster profesionalizador clínico y de investigación (equivalente a los fellowship del sistema de EE.UU.) que pretende subespecializar al oftalmólogo en la investigación traslacional, prevención, diagnóstico y tratamiento médico quirúrgico en el área de glaucoma.
ciente en el manejo de la patología de la subespecialidad.
Alumno del Máster:
Dña. Belén Alfonso Bartolozzi (2022-2023).
Dña. María Elena Simancas Montoto (2023-2024).
Directores: Prof. Jesús Merayo Lloves y Dr. Ignacio Rodríguez Uña.
Coordinador: Prof. Jesús M. Merayo Lloves.
Máster en Terapias Avanzadas y Medicina Regenerativa.
El Máster tiene una duración de 9 meses organizado con un total de 60 créditos ECTS.
MÓDULO 1: Marco regulatorio, bioseguridad y control de calidad en ATMP.
MÓDULO 2: Metodología básica de los cultivos celulares y las técnicas de terapia génica, terapia celular e ingeniería tisular.
MÓDULO 3: Implicaciones de las ATMP en los modelos de negocio, limitaciones éticas y protocolos de investigación y transferencia tecnológica.
MÓDULO 4: Trabajo de investigación.
Conocer el marco regulatorio europeo y nacional en el área de terapias avanzadas “advanced therapy medicinal products (ATMP), conocer las buenas prácticas de laboratorio, bioseguridad y riesgos en ATMP, y control de calidad en ATMP.
Conocer la metodología básica de los cultivos celulares y las técnicas de terapia génica, terapia celular e ingeniería tisular.
Conocer las implicaciones de las ATMP en los modelos negocio, limitaciones éticas y protocolos de investigación y transferencia tecnológica.
Saber realizar un proyecto y trabajo de investigación en ATMP.
Alumnos del Máster:
Dña. Laura María Martínez López (2022-2023).
Dña. Cristina Sánchez Fernández (2023-2024).
Directores: Prof. Jesús Merayo Lloves y Dr. Álvaro
Coordinador: Prof. Jesús M. Merayo Lloves.
Curso de Experto Universitario en Cirugía con Segmentos Intracorneales.
Curso de experto universitario que pretende formar al oftalmólogo experto en córnea y cirugía del segmento anterior en las técnicas de cirugía aditiva de la córnea para la corrección ortopédica y refractiva de las ectasias corneales (queratocono, degeneración marginal pelúcida de la córnea, ectasias iatrogénica, traumática y otras).
Además, el oftalmólogo, podrá formarse en investigación traslacional en queratocono y técnicas de
patología susceptible de ser tratada con cirugía aditiva de la córnea.
Alumnos del curso:
Dña. Belén Alfonso Bartolozzi (2022-2023).
Dña. Verónica Isabel Mora Bautista (2023-2024).
Directores: Dres. José F. Alfonso Sánchez y Luis Fernández-Vega Cueto-Felgueroso.
Coordinador: Prof. Jesús M. Merayo Lloves.
Curso de Experto Universitario en Cirugía con Lentes Fáquicas Epicapsulares.
Curso de experto universitario que pretende formar al oftalmólogo experto en córnea y cirugía de lentes fáquicas epicapsulares.
Alumnos del curso:
Dña. Rosa Elena Alvarado Villacorta (2022-2023).
Dña. Verónica Isabel Mora Bautista (2023-2024).
Directores: Prof. Jesús Merayo Lloves y Dr. Carlos Lisa Fernández.
Coordinador: Prof. Jesús M. Merayo Lloves.
Curso de Experto Universitario en Inmunología Ocular y Uveítis.
Curso de experto universitario que pretende formar al oftalmólogo experto en el diagnóstico y manejo de la patología inmunológica y uveítis.
Alumnos del curso: D. Iván Menéndez Valle (2022-2023).
Dña. Verónica Isabel Mora Bautista (2023-2024).
D. Carlos Freddy Arellano Ávila (2023-2024).
Director: Prof. Jesús M. Merayo Lloves.
Coordinador: Prof. Jesús M. Merayo Lloves.
Curso de Experto Universitario en Donación, Extracción, Manipulación y Gestión de Tejidos Oculares.
Curso de experto universitario que pretende formar al oftalmólogo experto en Donación, Extracción, Manipulación y gestión de Tejidos Oculares.
Alumnos del curso: D. Nicolás Sánchez Maluf (2022-2023).
Dña. Rosa Elena Alvarado Villacorta (2023-2024).
Directora: Dra. Begoña Baamonde Arbaiza.
Coordinador: Prof. Jesús M. Merayo Lloves.
ASIGNATURAS DEL PROGRAMA DE FORMACIÓN CONTINUADA EN CIENCIAS DE LA VISIÓN.
1. Seminarios de Investigación.
Coordinador de la Asignatura: Dr. Ignacio Alcalde Domínguez.
· “Fabricación de hidrogeles para la integración de fármacos para el tratamiento de enfermedades de la retina”. 16 de octubre. Ponente: Dª. Elena Ibeas Moreno (CIMUS-Universidad de Santiago de Compostela).
· engineering: From “hard” to “soft”. 17 de octubre. Ponente: Dra. Anna Abbadessa (CIMUSUniversidad de Santiago de Compostela).
2. Sesiones Clínicas.
Coordinador de la Asignatura: Dr. José F. Alfonso Sánchez.
· “Metodología de la Investigación: Revisiones Cochrane”. 16 de enero. Ponente: Dra. Rosa Alvarado Villacorta (Instituto Universitario Fernández- Vega).
· “Nutrición y Salud Visual”. 30 de enero. Ponente: Dr. Héctor González Iglesias (CSIC).
·talmólogo para el Diagnóstico”. 13 de febrero. Ponente: Dr. Daniel Heinrich (Instituto de Investigaciones Oftalmológicas Ramón Castroviejo).
· “Cirugía de Glaucoma fuera de nuestras Fronteras”. 20 de febrero. Ponente: Dr. Andrés Fernández-Vega Cueto-Felgueroso (Instituto Universitario Fernández-Vega).
· Macular Diabético”. 27 de febrero. Ponente: Dra. Maribel López Gálvez (Instituto Universitario Fernández-Vega).
· “Casos Clínicos Retina”. 20 de marzo. Ponente: Dr. Álvaro Fernández-Vega González (Instituto Universitario Fernández-Vega).
· 17 de abril. Ponente: Prof. Jesús Merayo Lloves (Instituto Universitario Fernández-Vega).
· “Motivos de Lensectomía precoz”. 24 de abril. Ponente: Dr. José Fernándo Alfonso Sánchez (Instituto Universitario Fernández-Vega).
· “Gonioscopía”. Pablo Rodríguez Calvo (Instituto Universitario Fernández-Vega).
· “Actualización en Lentes de Contacto Aplicada a la Mejora de la Atención Oftalmológica en la Práctica Diaria”. 22 de mayo. Ponente: D. Ignacio Serrano Peláez (Instituto Universitario Fernández-Vega).
· “Rehabilitación Visual en el Servicio de Oftalmología Hospitalaria: Casos Clínicos”. 12 de junio. Ponentes: Dres. Santiago Marín y Teresa Calderón (Universidad de Oviedo).
· “Actualización ARVO 2023”. 19 de junio. Ponente: Dr. Ignacio Alcalde Domínguez (Instituto Universitario Fernández-Vega).
· “SECOIR 2023”. 26 de junio. Ponente: Dr. José Fernando Alfonso Sánchez (Instituto Universitario Fernández-Vega).
· Lensectomía Precoz en Pseudoexfoliación Capsular”. 9 de octubre. Ponente: Ramón Cobián Tovar (Clínica Oftalmológica Cobian Martos).
·lar (la FIO: Pasado, Presente y Futuro)”. 16 de octubre. Ponente: Dra. Natalia Vázquez Moreno (Instituto Universitario Fernández-Vega).
· “Membrana PRGF+Membrana Amniótica”. 23 de octubre. Ponente: Dra. Belén Alfonso (Instituto Universitario Fernández-Vega).
· “Qué Hay de Nuevo en Control de Miopía”. 30 de octubre. Ponente: D. Óscar Freijeiro González (Instituto Universitario Fernández-Vega).
· “Cirugía de la Catarata en Lentes Fáquicas”. 13 de noviembre. Ponente: Dr. José Fernando Alfonso Sánchez (Instituto Universitario Fernández-Vega).
· “Síndrome MAPE”. 20 de noviembre. Ponente: Dr. Javier Fernández-Vega Sanz (Instituto Universitario Fernández-Vega).
· “DMAE y sus tratamientos”. 27 de noviembre. Ponente: Dr. Nicolás Sánchez Maluf (Instituto Universitario Fernández-Vega).
· “Glaucoma y alta miopía”. 18 de diciembre. Ponente: Dr. Ignacio Rodríguez Uña (Instituto Universitario Fernández-Vega).
Sábado, 18 de marzo.
Conferencias:
“Biomecánica Corneal: de la Investigación a la Práctica Clínica”.
Ponente: Dr. Alfonso Arias (Madrid), Comunicación: “Conjuntivitis Gonocócica. A partir de dos casos clínicos”.
rre, C. Alonso Álvarez.
“Escleras azules como parte del diagnóstico diferencial del Síndrome de Stickler-Marshall. Un caso clínico”.
Ponentes: Dres. E. Teslenko, C. Costales Álvarez, S. Macías Franco, P. Rozas Reyes (Oviedo).
Sábado, 21 de octubre de 2023.
Conferencia:
“La Imagen Multimodal en DMAE. Valor Clínico de los Signos en el Espectro de las Enfermedades”.
Coordinador de la Asignatura: Dra. Susana del Olmo Aguado.
1. “Tratamiento de la Disfunción del Endotelio Corneal mediante Terapia Celular”. 30 de noviembre. Ponente: D. Sergio Alonso.
2. “Exosomas derivados de Stem Cell Estromales Corneales en el tratamiento de enfermedades corneales y retinianas”. 22 de febrero. Ponente: Dra. Natalia Vázquez.
3. “Caracterización celular de los modelos in vitro de patologías oculares”. 19 de abril. Ponente: Dra. Susana del Olmo.
4. “Actualización en protección y regeneración 21 de junio.
Dr. Ignacio Alcalde.
4. Seminarios Regionales de Oftalmología.
Coordinador de la Asignatura: Dr. Luis FernándezVega Cueto-Felgueroso.
Ponentes: Dres. R. Dolz Marco, R. Gallego Pinazo (Valencia).
Comunicación:
“Vídeos de Cirugía Vítreorretiniana poco Frecuentes. Ponente: Dr. J. Castro Navarro.
Sábado, 16 de diciembre.
Conferencias:
“Selección Personalizada de la Lente Intraocular”.
Ponente: Prof. Luis Fernández-Vega Sanz (Oviedo).
Comunicaciones:
“Actualización en el manejo de las endoftalmitis”.
Ponentes: Dres. N. Velasco de Cos, J. Sánchez Rodríguez (Oviedo), L. Alonso Menéndez.
“Glaucoma y Enfermedad Periodontal: Una Revisión Sistemática y Meta-análisis”.
Ponentes: Dres. J. Gálvez Olortegui y C. Burgueño Montañés (Oviedo).
VI Curso de Retina y Vítreo.
El VI Curso de Retina y Vítreo se celebró en Oviedo los días 2 y 3 de junio, con el objetivo de realizar la puesta al día en los últimos avances de esta especialidad.
Dirigido por los Dres. Álvaro Fernández-Vega Sanz, Álvaro Fernández-Vega González y M.ª Isabel López Gálvez, está incluido en el Programa de Formación Continuada en Ciencias de la Visión de la Universidad de Oviedo, y sirvió para ponerse al día en los últimos avances y novedades de la especialidad de retina, tanto médica como quirúrgica.
Para ello, constó de tres grandes apartados: la mañana del viernes día 2, dedicada a retina quirúrgica y ese mismo día por la tarde, destinado a retina méexpusieron casos clínicos complicados.
Coordinador: Dr. José F. Alfonso.
El IOFV realiza formación de médicos residentes de oftalmología y recibe periódicamente a oftalmólogos en formación para realizar estancias cortas. La acción formativa es de especial importancia en subespecialidades, donde la oferta de formación en los sistemas públicos de salud es muy limitada. Aunque esta oferta formativa tiene especial dedicación a los MIR de los hospitales de Asturias, también está abierta a
les formativos.
Dña. Carla Arteaga Enríquez. COMPLEJO HOSPITALARIO UNIVERSITARIO DE CANARIAS.
Unidad de Cirugía de Córnea y Cristalino.
Dña. Sandra Gómez Perera. HOSPITAL DE BRAGA, PORTUGAL. Unidad de Cirugía de Córnea y Cristalino.
D. Carlos Neves Cruz. HOSPITAL DE BRAGA, PORTUGAL. Unidad de Cirugía de Córnea y Cristalino.
Dña. Almudena Milans del Bosch. HOSPITAL CLÍNICO SAN CARLOS. Unidad de Cirugía de Córnea y Cristalino.
Dña. Marta Sofía Rodrigues Correia. CENTRO HOSPITALAR DE LISBOA OCCIDENTAL. Unidad de Cirugía de Córnea y Cristalino.
D. Vitor Miranda. CENTRO HOSPITALAR DE ENTRE O DOURO E VOUGA, PORTUGAL. Unidad de Cirugía de Córnea y Cristalino.
D. Christophe Leite Pinto. HOSPITAL DE BRAGA, PORTUGAL. Unidad de Cirugía de Córnea y Cristalino.
Dña. Katarzyna Roguska.
Unidad de Cirugía de Córnea y Cristalino.
Dña. Sofía Teresa Padilla Alanis.
Unidad de Cirugía de Córnea y Cristalino
Dña. Dayana Rosales Durán. HOSPITAL DRA. ELISA MOLINA STAHL, GUATEMALA.
Unidad de Cirugía de Córnea y Cristalino.
D. Francisco Serdoura Alves. INSTITUTO DE OFTALMOLOGÍA GAMA PINTO, PORTUGAL.
Unidad de Cirugía de Córnea y Cristalino.
D. Carlos Renato de Brito Correia.
HOSPITAL PEDRO HISPANO, ULSM.
Unidad de Cirugía de Córnea y Cristalino.
D. Diogo Bernardo Matos.
HOSPITAL SANTA MARÍA, LISBOA, PORTUGAL.
Unidad de Cirugía de Córnea y Cristalino.
Dña. Elia de Esteban Maciñeira.
COMPLEJO HOSPITALARIO UNIVERSITARIO SANTIAGO DE COMPOSTELA.
Unidad de Cirugía de Córnea y Cristalino.
Dña. Clara Álvarez de Toledo. OFTALVIST BARCELONA.
Unidad de Cirugía de Córnea y Cristalino.
Dña. Verónica Mora Bautista.
Unidad de Inmunología Ocular y Uveítis.
PROFESORADO
Profesores de la Universidad de Oviedo, del Instituto Oftalmológico Fernández-Vega y de la Fundación de Investigación Oftalmológica.
D. Rodrigo Robalo Curado Vilares. CENTRO HOSPITALAR UNIVERSITARIO SAN JOAO, PORTUGAL.
Unidad de Cirugía de Córnea y Cristalino.
D. Manuel Rodrigues Vera. HOSPITAL UNIVERSITARIO CENTRAL DE ASTURIAS.
Unidad de Cirugía de Córnea y Cristalino
Dña. Alba González Corte. HOSPITAL UNIVERSITARIO CENTRAL DE ASTURIAS.
Unidad de Cirugía de Córnea y Cristalino.
Dña. Alejandra Quispe Ramírez.
Unidad de Inmunología Ocular y Uveítis.
D. José Kelvin Gálvez Olortegui.
HOSPITAL UNIVERSITARIO CENTRAL DE ASTURIAS.
Unidad de Cirugía de Córnea y Cristalino.
La Fundación de Investigación Oftalmológica colabora con la docencia de Médicos Internos Residentes en Oftalmología del HOSPITAL UNIVERSITARIO CENTRAL DE ASTURIAS, cediendo sus quirófanos experimentales para sus prácticas quirúrgicas.


Nacionales.
TÍTULO DEL PROYECTO: Consorcio Estatal en Red para el desarrollo de Medicamentos de Terapias Avanzadas (CERTERA).
ENTIDAD FINANCIADORA: Instituto de Salud Carlos III, MICINN, Unión Europea, Next Generation, Fondos del Plan de Recuperación, Transformación y Resiliencia.
REFERENCIA: CERT22/00037.
IMPORTE: 417.010,00 € (TOTAL CONSORCIO).


TÍTULO DEL PROYECTO: Pre-validación de epitelios humanos reconstruidos para su utilización como método alternativo a la experimentación animal en la evaluación de los peligros para la salud humana. SAFECHEM.
ENTIDAD FINANCIADORA: Ministerio de Ciencia, Innovación y Universidades, Agencia Estatal de Investigación, Unión Europea (FEDER).
IMPORTE: 108.900 €.
TÍTULO DEL PROYECTO: Estudio de la metalostasis en enfermedades neurodegenerativas asociadas al envejecimiento empleando nuevas estrategias analíticas.
ENTIDAD FINANCIADORA: Ministerio de Ciencia, Innovación y Universidades, Agencia Estatal de Investigación. Unión Europea (FEDER).
REFERENCIA: PID2019-107838RB-I00.
DURACIÓN: 01/07/20-01/07/2023.
TÍTULO DEL PROYECTO: Fabricación de Medicamentos de Terapias Avanzadas (Tejidos Corneales Bioingenierizados) según el sistema de producción A en D: aisladores en entornos modulares y portátiles.
ENTIDAD FINANCIADORA: Instituto de Salud Carlos III, Gobierno de España, Ministerio de Ciencia e Innovación, Unión Europea (FEDER).
REFERENCIA: DTS21/00102.
DURACIÓN: 01/01/2022-30/06/2024.
IMPORTE: 48.400 €.
TÍTULO DEL PROYECTO: RICORS TERAV-Red de Terapias Avanzadas-Redes de Investigación Cooperativa Orientadas a Resultados en Salud (RICORS).
ENTIDAD FINANCIADORA: Instituto de Salud Carlos III, Gobierno de España, Ministerio de Ciencia e Innovación. Unión Europea (Next Generation). Plan de Recuperación y Resiliencia.
REFERENCIA: RD21/0017/0033.
DURACIÓN: 01/01/2022-31/12/2024.

TÍTULO DEL PROYECTO: Desarrollo y Validación de métodos cruelty-free basados en epitelios humanosdad de Oviedo e Instituto Oftalmológico Fernández-Vega.
ENTIDAD FINANCIADORA: Ministerio de Ciencia e Innovación, Gobierno de España, Unión Europea-NextGenerationEU, Plan de Recuperación, Transformación y Resiliencia, Agencia Estatal de Investigación.
REFERENCIA: PLEC2022-009463.
IMPORTE: 221.291,49 €

TÍTULO DEL PROYECTO: Una ventana a la neuroprotección: Fotobiomodulación a través de la retina (FOTORENE). Colaboran FIO, Universidad de Oviedo e Instituto Oftalmológico Fernández-Vega.
ENTIDAD FINANCIADORA: Ministerio de Ciencia e Innovación, Gobierno de España, Unión Europea-NextGenerationEU, Plan de Recuperación, Transformación y Resiliencia, Agencia Estatal de Investigación.
REFERENCIA: PLEC2022-009464.

nos y Sistemas-Redes de Investigación Cooperativa Orientadas a Resultados en Salud (RICORS).
ENTIDAD FINANCIADORA: Instituto de Salud Carlos III, Gobierno de España, Ministerio de Ciencia e Innovación. Unión Europea (Next Generation). Plan de Recuperación y Resiliencia.
REFERENCIA: RD21/0002/0041.
DURACIÓN: 01/01/2022-31/12/2024.

TÍTULO DEL PROYECTO: Desarrollo y Validación de métodos cruelty-free basados en epitelios humanosdad de Oviedo e Instituto Oftalmológico Fernández-Vega.
ENTIDAD FINANCIADORA: Ministerio de Ciencia e Innovación, Gobierno de España, Unión Europea-NextGenerationEU, Plan de Recuperación, Transformación y Resiliencia, Agencia Estatal de Investigación.
REFERENCIA: PLEC2022-009463.
IMPORTE: 48.140,40 €

TÍTULO DEL PROYECTO: Una ventana a la neuroprotección: Fotobiomodulación a través de la retina (FOTORENE). Colaboran FIO, Universidad de Oviedo e Instituto Oftalmológico Fernández-Vega.
ENTIDAD FINANCIADORA: Ministerio de Ciencia e Innovación, Gobierno de España, Unión Europea-NextGenerationEU, Plan de Recuperación, Transformación y Resiliencia, Agencia Estatal de Investigación.
REFERENCIA: PLEC2022-009464.

TÍTULO DEL PROYECTO: Ayudas en concurrencia competitiva para el mantenimiento de actividades de investigación y grupos de investigación de Institutos Universitarios de investigación y grupos de investigación de la Universidad de Oviedo para el ejercicio 2023
ENTIDAD FINANCIADORA: Universidad de Oviedo.
IMPORTE: 6.000 €
Vicerrectorado de Investigación
Universidad de Oviedo
Nacionales.
TÍTULO DEL PROYECTO: Desarrollo y Validación de métodos cruelty-free basados en epitelios humanosdad de Oviedo e Instituto Oftalmológico Fernández-Vega.
ENTIDAD FINANCIADORA: Ministerio de Ciencia e Innovación, Gobierno de España, Unión Europea-NextGenerationEU, Plan de Recuperación, Transformación y Resiliencia, Agencia Estatal de Investigación.
REFERENCIA: PLEC2022-009463.
IMPORTE: 73.768,92 €

TÍTULO DEL PROYECTO: Una ventana a la neuroprotección: Fotobiomodulación a través de la retina (FOTORENE). Colaboran FIO, Universidad de Oviedo e Instituto Oftalmológico Fernández-Vega.
ENTIDAD FINANCIADORA: Ministerio de Ciencia e Innovación, Gobierno de España, Unión Europea-NextGenerationEU, Plan de Recuperación, Transformación y Resiliencia, Agencia Estatal de Investigación.
REFERENCIA: PLEC2022-009464.

Regionales.
TÍTULO DEL PROYECTO: RetiCoQ: Coenzima Q10 para el tratamiento neuroprotector de oclusiones vasculares de la retina.
ENTIDAD FINANCIADORA: Gobierno del Principado de Asturias, Instituto de Desarrollo Económico del PrinUnión Europea a través del Fondo Europeo de Desarrollo Regional (FEDER).
DURACIÓN: 11/2022-30/11/2024.
IMPORTE: 84.412,77 €

TÍTULO DEL PROYECTO: Aplicación de nanovesículas como método diagnóstico y terapeútico de pato-
ENTIDAD FINANCIADORA: Gobierno del Principado de Asturias, Instituto de Desarrollo Económico del PrinUnión Europea a través del Fondo Europeo de Desarrollo Regional (FEDER).
REFERENCIA: IDE/2022/000641.
DURACIÓN: 10/2022-30/11/2024.

PROYECTO: “Antioxidantes frente a la neurodegeneración”.
ENTIDAD FINANCIADORA: 100% Natural.
REFERENCIA: NBR2022-02.
DURACIÓN: 01/12/2022-31/12/2023.
PROYECTO: “Healthy lighting II”.
ENTIDAD FINANCIADORA: Normagrup Technology, S.A.
REFERENCIA: NBR2021-01.
DURACIÓN: 01/10/2021-31/12/2023.
A lo largo del año, la FIO y el IUFV se esfuerzan por divulgar los resultados de su trabajo a través de diversos canales. Destacan especialmente las comunicaciones en congresos, tesis doctorales y tra-
de comunicación. A continuación, vemos la divulgación realizada en el año 2023.
28 DE FEBRERO: DÍA MUNDIAL DE LAS ENFERMEDADES RARAS
Uveítis y retinosis pigmentaria: entre las enfermedades raras “no tan raras” que trata el Instituto Oftalmológico Fernández-Vega.
La base genética es muy habitual en las enfermedades raras (y suele haber antecedentes familiares), pero no solo se presentan en edades tempranas sino que pueden debutar también en adultos.
Debido al alto volumen de consultas y a las unidades de alta especialización dentro de la oftalmología, aunque son patologías poco prevalentes, se cuenta frecuentemente con numerosos casos que sirven para tener una masa crítica y experiencia sobre las enfermedades raras oftalmológicas.
Las enfermedades raras oculares desempeñan un papel importante en la pérdida de la visión y la ceguera. Pero, además, al producirse en edades tempranas y desarrollarse en las etapas más productivas de la vida, afectan de forma muy especial a la calidad de vida de los pacientes y sus familias. Conocer más acerca de estas patologías contribuye a desarrollar un diagnóstico precoz, recomendar medidas preventivas para que las enfermedades ralenticen su progresión, ayudar a instaurar tratamientos que permitan preservar la función del órgano de la visión e impulsar la investigación para hallar tratamientos más efectivos.
El Instituto Oftalmológico Fernández-Vega está muy sensibilizado con estas patologías. Debido al alto volumen de consultas que recibe y al carácter referencial o de segunda opinión de las mismas, aunque se trate de enfermedades raras se ven nu-
merosos casos. El Instituto cuenta con unidades esatienden a los pacientes con uveítis; unidad de córnea que atiende a pacientes con diferentes tipos de queratocono o de ; unidad de oftalmología pediátrica para las enfermedades raras infantiles; y unidad de retina para las clásicas enfermedades raras oculares como la retinosis pigmentaria. Estas unidades clínicas se complementan, en algunas ocasiones, con estudios genéticos.
En el ámbito de la investigación, un grupo del Instituto Universitario Fernández-Vega coordinado por el Dr. Álvaro Meana forma parte del Centro de Investigación Biomédica en Red de Enfermedades Raras (CIBERER) con aportaciones originales en el tratamiento de enfermedades raras que afectan a la piel y otros epitelios (quemados, epidermólisis bullosa, síndrome de Kindler, etc.) con terapias avanzadas.
Desde la Fundación de Investigación Oftalmológica y el Instituto Universitario Fernández-Vega, su director el Prof. Jesús Merayo, coordina los estudios de ocular de la red de investigación orientada a resulta-
Salud Carlos III, que contemplan patologías como tipos de queratocono, conjuntivitis crónicas cicatrizantes y otras patologías consideradas como enfermedades raras. “Generalmente, estas patologías se detectan en una revisión oftalmológica, cuando se percibe que el paciente no ha respondido a los tratamientos iniciales o la patología ha progresado pese a ellos”, comenta el Prof. Jesús Merayo.
De igual modo, se colabora con asociaciones de pacientes en este ámbito. Así, en 2022 arrancó un estudio con la Asociación Española de Aniridia para el tratamiento del ojo seco asociado a esta enfermedad con fármacos de medicina regenerativa. El estudio se concluirá en este año 2023 y servirá de base para -
También se colabora con otras asociaciones de pacientes como la degea, donde el Instituto Universitario Fernández-Vega participará en su reunión anual en 2023.
Algunas enfermedades raras oculares.
En cuanto a su origen, las enfermedades raras oculares pueden darse en las diferentes estructuras de los ojos, pero desde el Instituto Oftalmológico Fernández-Vega recuerdan que también pueden estar originadas en otros órganos vitales y afectar igualmente a la salud ocular. Entre ellas se encuentran:
Retinosis pigmentaria: es un grupo de enfermedades genéticas que afectan de forma primaria a los bastones y conos y al epitelio pigmentario de la retina y producen la degeneración y pérdida de dichos fotorreceptores. Los síntomas iniciales son ceguera nocturna, mala adaptación a los contrastes de luz y oscuridad y pérdida progresiva del campo visual.
Uveítis: es una de las tres primeras causas prevenibles de ceguera en el mundo. Su origen puede deberse a múltiples factores, como infecciones o procesos autoinmunes, y, aunque suelen afectar únicamente al ojo, también pueden vincularse a trastornos sistémicos como algunas enfermeda-
que pueden afectar a la cámara anterior del ojo, a la cavidad vítrea o al segmento posterior.
Ictiosis: esta enfermedad cutánea se caracteriza por la aparición de escamas gruesas y secas en puede llegar a afectar a producir alteraciones en riesgo de secuelas y pérdida visual.
Aniridia congénita: es una enfermedad genética caracterizada por la ausencia parcial o total del iris. Sus síntomas más habituales son baja visión, fotofobia y deslumbramiento. Además, puede originar otros problemas como cataratas, glaucoma o estrabismo.
son un grupo de enferme-gen genético. Pueden afectar al epitelio, estromales no tienen manifestaciones sistémicas, se presentan con diferentes opacidades de la córnea y tienen una progresión lenta.
Vasculitis retiniana:ción de los vasos sanguíneos de la retina. Puede producirse como un fenómeno aislado, estar asociada a enfermedades oculares raras o a otras enfermedades sistémicas. Es la tercera causa más común del glaucoma neovascular, un tipo de glaucoma secundario especialmente grave que puede causar dolor, enrojecimiento, pérdida sigdeformación de la pupila.
El Instituto Universitario Fernández-Vega trabaja en el desarrollo de un
El equipo investigador está desarrollando untraoculares que transforma la luz potencialmente nociva en una longitud de onda más supervivencia celular.
hasta las fases más avanzadas, se recomiendan revisiones periódicas sobre todo a personas mayores de 40 años, aquellas con antecedentes familiares de glaucoma y pacientes con miopía alta o magna.
En el marco del Día Mundial del Glaucoma, el Instituto Universitario Fernández-Vega comparte sus avances en neuroprotección, una estrategia que busca proteger las células ganglionares de la retina para que mantengan su funcionalidad. De esta manera, se logra prevenir, reducir o retrasar la pérdida de campo visual que produce el glaucoma, principal causa de ceguera irreversible en el mundo y que en España afecta a medio millón de personas, es decir,
“En el glaucoma, la luz que penetra en el ojo incide directamente en las células ganglionares de la retina, que también se ven afectadas por la enfermedad”, explica el Dr. Andrés Fernández-Vega Cueto-Felgueroso, especialista de la Unidad de Glaucoma del Instituto Oftalmológico Fernández-Vega. “Nuestro grupo de investigación, que estudia los efectos que pueden tener en la retina las diferentes longitudes de onda de la luz, ha observado que modulando una respuesta terapéutica adecuada”.
En este sentido, el Instituto Universitario Fernández-Vega está trabajando, de la mano de invesneuroprotector para gafas y lentes que selecciona qué porcentaje de luz “dañina” se desea reducir y células unos mecanismos que favorecen la super-
vivencia celular. “Dado que el espectro de luz interacciona con órganos celulares implicados en el envejecimiento de las células, los pacientes con glaucoma, enfermedad relacionada con el envejeci-
que desarrollamos sobre la modulación de la luz. Las investigaciones realizadas sugieren que podríafas convencionales e incluso a lentes intraoculares”, explica la Dra. Susana del Olmo, investigadora principal del proyecto.
Importancia de las revisiones periódicas.
El glaucoma se caracteriza por la ausencia de síntomas hasta las fases más avanzadas, donde se presenta una pérdida repentina de la visión, fuertes dolores en el ojo y enrojecimiento ocular, entre otros. Dado que los daños son irreversibles, es fundamental un diagnóstico precoz que permita actuar a tiempo con un tratamiento adecuado y evitar que siga aumentando.
En palabras del Dr. Andrés Fernández-Vega Cueto-Felgueroso, “el principal reto que nos presenta el glaucoma es que se trata de una patología silenciosa e irreversible. Aunque disponemos de herramientas terapéuticas que pueden conseguir frenar su avance, es fundamental el diagnóstico precoz a través de las revisiones periódicas, especialmente en población mayor de 40 años, familiares de pacientes de glaucoma y personas con miopía alta o magna, quienes cuentan con un mayor riesgo de desarrollar esta enfermedad”.
“En el Instituto Oftalmológico Fernández-Vega -añade- tenemos la gran suerte de contar con tecnologíascluso en fases iniciales, lo que supone una gran herramienta para detectar y abordar esta patología ocular”.
La Fundación de Investigación Oftalmológica avanza en implantes intracorneales para tratar el queratocono
El queratocono es una enfermedad degenerativa de la córnea que consiste en un aumento progresivo de su curvatura, pasando de una forma esférica a una cónica.
El Instituto ha profundizado en los subtipos de queratocono, que requieren de un implante de segmentos intracorneales diferentes.
Esta enfermedad, hereditaria en una parte importante de los casos, suele aparecer en la infancia o adolescencia y se detecta por la necesidad frecuente de cambio de la graduación de las lentes, el frotamiento ocular compulsivo y la disminución de agudeza visual.
El queratocono es una patología ocular degenerativa que hace que la córnea pase a tener una forma cónica. Para devolverle su forma y mejorar la calidad de vida y visual de los pacientes, es necesario profundizar en la investigación de los diferentes fenotipos de queratocono y en la personalización de su cirugía. En el marco del Día Mundial del Queratocono, que se celebra el 10 de noviembre, el Instituto Oftalmológico Fernández-Vega informa de los avances que está realizando a través de diversos estudios clínicos llevados a cabo por la Fundación de Investigación Oftalmológica (FIO), que patrocina.
“Uno de los tratamientos quirúrgicos más frecuentes del queratocono es el implante de segmentos intracorneales, unos anillos transparentes de polimetilmetacrilato (PMMA), material inerte totalmente biocompatible, que se colocan en el espesor de la córnea mediante el uso del láser de femtosegundo para reforzarla, cambiar su geometría y devolver el tejido a su forma original”, informa el Dr. Luis Fernández-Vega Cueto-Felgueroso, experto en esta patología y autor de una reciente publicación promovida por la Sociedad Española de Oftalmología, en este ámbito. “En la FIO y en el Instituto Universitario Fernández-Vega, estamos trabajando en cada uno de los fenotipos de queratocono, pues requieren de un implante de segmentos intracorneales di-
Síntomas y factores de riesgo.
Entre los signos de alerta de esta enfermedad in-
la pérdida paulatina de la vista, la visión borrosa, la distorsión de imágenes, la irritación, el dolor ocular y un aumento de la sensibilidad a la luz brillante y al resplandor.
El queratocono es una enfermedad hereditaria en muchas ocasiones, según la Sociedad Española de Estrabología y Oftalmología Pediátrica hasta en un 1. Suele aparecer en la infancia o adolescencia y se detecta gracias a la necesidad
frecuente de cambio de la graduación de las lentes y el frotamiento ocular compulsivo.
“La única medida preventiva es evitar frotarse los ojos”, apunta el Dr. Luis Fernández-Vega Cueto-Felgueroso, del Instituto Oftalmológico Fernández-Vega, que añade, además, que “la rápida progresión antes de los 18 años hace que el diagnóstico precoz sea fundamental para valorar las distintas alternativas de tratamiento e incidir en los factores de riesgo, especialmente si existen antecedentes familiares de la enfermedad”. En su opinión, “una detección temprana permite establecer estrategias en los diferentes fenotipos del queratocono y se puede evitar un trasplante de córnea en el futuro”.
Pese a aparecer en edades tempranas, aproxima-1 y, aunque es una patología progresiva, en algunos casos puede llegar a estabilizarse o incluso a detenerse a partir de los 30 o 40 años.
Entre los factores de riesgo del queratocono, se encuentran el frotamiento ocular, el eccema, el asma y la alergia2. Entre los factores secundarios asociados a la aparición del queratocono, se encuentran la sobreexposición a los rayos ultravioleta, los pequeños traumatismos persistentes en el ojo, el uso de lentes de contacto inapropiadas o el abuso de
ocular. También existen factores hormonales y patologías sistémicas que conllevan alteraciones del colágeno, tales como el síndrome de Ehlers-Danlos o la Osteogénesis imperfecta, y es frecuente que el queratocono se asocie a la trisomía 21 (síndrome de Down).
Diagnóstico y tratamiento.
Para lograr un buen diagnóstico de estos problemas oculares, es necesario hacer una exploración general y pruebas como la topografía corneal y la incorporación de marcadores genéticos.
Una vez detectada la enfermedad, el tratamiento dependerá del momento del diagnóstico y del grado de evolución. En cualquier caso, para evitar la progresión, como indica el Dr. Luis Fernández-Vega, es indispensable que el paciente evite el frotamiento -
En cuanto a las opciones quirúrgicas, hasta hace unos años, la única era el trasplante de córnea para aquellos pacientes intolerantes al uso de lentes de
contacto o en los que el queratocono se encontrara en estado avanzado. Actualmente, esto se puede retrasar o incluso evitar gracias a los últimos avances realizados en el implante de anillos intracorneales. Además, otros tratamientos quirúrgicos existentes son el crosslinking y la trans-PRK. En casos avanzados, se optaría por un trasplante lamelar (por capas), en lugar de uno de espesor completo (penetrante) como los que se hacían antiguamente.
Referencias:
1. QUERATOCONO. Sociedad Española de Estrabología y Oftalmología Pediátrica. Tomado de: https://www.estrabologia.org/patologias/queratocono/
2. Santodomingo-Rubido, J., Carracedo, G., Suzaki, A., Keratoconus: An updated review. Contact Lens and
Una técnica empleada en investigación oftalmológica predice la irritación en un modelo de piel humana reconstruida sin necesidad de experimentación animal.
La Fundación de Investigación Oftalmológica (FIO) participa en un estudio publicado en la revista Biosensors que busca sustituir potencialmente el uso de ensayos con animales en Dermatología para evaluar la irritación de las sustancias químicas.
La técnica utilizada, llamada espectroscopia de impedancia electroquímica, se ha empleado en modelos humanos reconstruidos ideados y desarrollados por investigadores de la FIO.
compuestos irritantes en un ensayo no invasivo, lo que representa una mejora con respecto a los métodos actuales y allana el camino para implementar esta nueva herramienta en ensayos regulados destinados a sustituir la experimentación animal.
Los modelos de epidermis humana reconstruida buscan acabar con la experimentación animal para el ensayo de la irritación cutánea. Sin embargo, a medida que avanza el uso de estos modelos, también aumenta su complejidad, por lo que surgen nuevos retos, como la necesidad de metodologías que permitan evaluar los estados celulares de forma no invasiva y sin marcadores. La Fundación de In-
vestigación Oftalmológica (FIO) , auspiciada por el Instituto Oftalmológico Fernández-Vega, ha liderado un estudio cuyos resultados se han publicado en la revista Biosensors1, que emplea la espectroscopia de impedancia electroquímica (EIS, por sus siglas en inglés) para desarrollar un método capaz de predecir la irritabilidad de la piel humana con mayor sensiactuales.
“La espectroscopia de impedancia electroquímica ya ha demostrado ser útil en la evaluación de la irritación ocular/daño ocular grave en modelos de epitelio corneal humano reconstruido”, señala el Prof. Jesús Merayo Lloves, director del Instituto Universitario Fernández-Vega (IUFV). “Ahora, hemos visto que esta técnica también podría constituir un valor añadido a las estrategias de ensayo in vitro en Dermatología y sustituir potencialmente a los ensayos con animales”, añade el Dr. Álvaro Meana, coordinador de la investigación.
Una técnica de utilidad en diferentes campos.
En los últimos años, la EIS se ha consolidado como una de las técnicas analíticas más populares en la investigación de materiales y se utiliza en una gran variedad de áreas y análisis, destacando la Oftalmología. Por ello, y gracias a su experiencia, los investigadores de la FIO fueron los encargados de desarrollar y probar esta técnica en un modelo de epidermis
biopsias de piel anónimas obtenidas de donantes de órganos fallecidos.
En 2023 se leyeron 3 tesis, fruto del trabajo realizado en el Programa de Doctorado en Ciencias de la Salud, Línea de Investigación de “Oftalmología y Ciencias de la Visión”.
“Prevención y corrección de los defectos de refracción en el trasplante laminar anterior profundo”.
Defensa Pública de Tesis Doctoral, Dña. Belén Alfonso Bartolozzi.
“Los avances que estamos realizando en la FIO con esta técnica nos llevaron a pensar que, aplicando diferentes compuestos de prueba, también podría utilizarse en otras especialidades para evaluar el estado y las variaciones en modelos de epidermis humana reconstruida”, explica el Dr. Manuel Chacón, inves-
car compuestos irritantes en un ensayo no invasivo, lo que representa una mejora en cuanto a la sensibi-
con los métodos actuales, que se basan en la viabilidad celular, y allana el camino para implementar esta nueva herramienta en ensayos regulados destinados a sustituir la experimentación animal.
“En cualquier caso, es necesario seguir investigando para validar el uso de esta técnica en otros modelos y para comprenderla plenamente como herramienta de análisis”, concluye la Dra. Natalia Vázquez, investigadora de la FIO participante en el estudio.
Referencias:
1. Improved Tool for Predicting Skin Irritation on Reconstructed Human Epidermis Models Based on Electrochemical Impedance Spectroscopy. Biosensors 2023, 13(2), 162; https://doi.org/10.3390/bios13020162
TRIBUNAL: Prof. Jesús Merayo Lloves (Universidad de Oviedo), Presidente; Dr. Luis Manuel Quirós Fernández, Universidad de Oviedo, Secretario; Dr. Javier Mendicute del Barrio (Universidad del País Vasco), Vocal; Dra. Rosario Touriño Peralba (Universidad de Santiago de Compostela), Vocal; Dra. Lucía Ibares Frías (Instituto Oftalmológico Fernández-Vega), Vocal.
Directores de Tesis: Prof. Luis Fernández-Vega Sanz y Dra. María Begoña Baamonde Arbaiza (Instituto Universitario Fernández-Vega).
Tutor: Prof. Jesús Merayo Lloves (Universidad de Oviedo).
16 de octubre, “Desarrollo de nuevos modelos de in vitro, como método alternade peligros para la salud humana”.
Defensa Pública de Tesis Doctoral, D. Manuel Chacón Rodríguez.
TRIBUNAL: Dr. Miguel Holgado Bolaños (Universidad Politécnica de Madrid), Presidente; Dr. Luis Manuel Quirós Fernández (Universidad de Oviedo), Secretario; Dr. Matthias Titeux (French Institute of Health and Medica Research), Vocal; Dra. Ana Abadessa (Center for Research in molecular medicine and chronic diseases), Vocal; Dr. Iván Fernández Vega (Universidad de Oviedo), Vocal.
Director de Tesis: Prof. Jesús Merayo Lloves (Universidad de Oviedo).
A continuación se apuntan los estudiantes que han
grado con nosotros:
Curso 2023-2024 (trabajos en curso).
Dña. Noa Sanmartín Franco. Grado en Medicina.
Tutor: Dr. Ignacio Rodríguez Uña.
Dña. María del Carmen Ponte de la Mata. Grado en Medicina.
Tutor: Dr. Ignacio Rodríguez Uña.
Dña. Sofía Recuero Guerra. Grado en Medicina.
Tutores: Prof. Jesús Merayo Lloves y Dr. Álvaro
Dña. Cecilia Milán Malnero. Grado en Medicina.
Tutor: Prof. Jesús Merayo Lloves.
Dña. Lorena Larfeuil Fernández. Grado en Medicina.
Tutores: Prof. Jesús Merayo Lloves y Dr. Álvaro Fernández-Vega González.
1 de diciembre, “Desarrollo de dos Medicamentos de Terapias Avanzadas para el tratamiento de le-
Defensa Pública de Tesis Doctoral, Dña. Mairobi Persinal Medina.
TRIBUNAL: Prof. Damián García Olmo (Universidad Autónoma de Madrid), Presidente; Prof. Luis Manuel Junquera Gutiérrez (Universidad de Oviedo), Secretario; Dra. Verónica García Díaz (Universidad de Valladolid), Vocal; Dr. Iván Fernández Vega (Universidad de Oviedo), Vocal; Dr. Mª Dolores Montalvo Parra (Universidad de Anahuac), Vocal.
Directores de Tesis: Dra. Sara Mª Gómez Llames (CIBER de Enfermedades Raras, ISCIII) y Prof. Jesús Merayo Lloves (Universidad de Oviedo).
Curso 2022-2023 (trabajos realizados).
Dña. Raquel Arias Blanco. Grado en Biología.
Tutores: Dra. Susana del Olmo Aguado y Dr. Luis Quirós Fernández.
Dña Sheila Lorenzo Sánchez. Grado en Biología.
Tutores: Dra. Susana del Olmo Aguado y Dr. Luis Quirós Fernández.
Dña. María González Fernández. Grado en Biotecnología.
Tutora: Dra. Lidia Álvarez Fernández.
Dña Sofía Recuero Guerra. Grado en Medicina.
Tutor: Prof. Jesús Merayo Lloves.
Alumno: Jorge García Álvarez.
Máster Universitario en Ciencias Analíticas y Bioanalíticas por la Universidad de Oviedo.
Coordinador de la asignatura: Prof. Jesús M. Merayo Lloves.
Directores: Prof. Jesús Merayo Lloves, Dra. Susana del Olmo Aguado, Dra. Carla Martín Cueto, Dr. Ignacio Alcalde Domínguez, Dr. Manuel Chacón.
Alumno: Dña. Diana Albino.
Máster en Biotecnología Biomédica, Universidad de Bolonia, a través de un acuerdo de movilidad con la Universidad de Oviedo.
Director:
Alumno: Dña. Alicia Villa Vázquez.
Máster Universitario en Ciencias Analíticas y Bioanalíticas, Universidad de Oviedo.
Directoras: Dras. Lydia Álvarez y Beatriz Fernández.
Alumno: D. Jorge García Álvarez.
Máster Universitario en Ciencias Analíticas y Bioanalíticas, Universidad de Oviedo.
Directores: Rodas Sánchez.
Alumno: D. J. Miguel Sánchez Martín.
Máster Universitario en Ciencias Analíticas y Bioanalíticas, Universidad de Oviedo.
Directores:lez-Iglesias.
Investigación básica:
Autores: Laura Carrero, Desireé Antequera, Ignacio Alcalde, Diego Megías, Lara Ordóñez Gutiérrez, Cristina Gutiérrez, Jesús Merayo-Lloves, Francisco Wandosell, Cristina Municio, Eva Carro.
Título:
accumulation in the retina.
Revista: Int J Mol Sci.
Autores: Javier Lozano-Sanroma, Alberto Barros-Suárez, Ignacio Alcalde, Ronald M. Sánchez-Ávila, Juan Queiruga-Piñeiro, Luis Fernández-Vega Cueto-Felgueroso, Jesús Merayo-Lloves.
Revista: Medicina.
(87/167), Medicine, General & Internal.
Autores: Laura Carrero, Desireé Antequera, Ignacio Alcalde, Diego Megías, Joana Figueiro-Silva, Jesús Merayo-Lloves, Cristina Municio, Eva Carro.
Título: Disturbed circadian rhythm and retinal degeneration in a mouse model of Alzheimer’s disease.
Revista: Acta Neuropathol Commun. (2023).
Autores: Alberto Barros, Javier Lozano-Sanroma, Juan Queiruga-Piñeiro, Luis Fernández-Vega Cueto-Felgueroso, Eduardo Anitua, Ignacio Alcalde, Jesús Merayo-Lloves.
Título: Recovery of corneal innervation after treatment in Dry Eye Disease. A Confocal Microscopy study.
Revista: J Clin Med.
Autores:
Título: B. Editorial: Zinc in health and disease management.
Revista: Front Nutr. 2023 Jul 10;10:1242840. doi: -
Autores: Álvarez-Barrios A, Álvarez L, Artime E, García M, Lengyel I, Pereiro R, González-Iglesias
Título: Altered zinc homeostasis in a primary cell culture model of the retinal pigment epithelium.
Revista: Front Nutr. 2023 Apr 17;10:1124987. doi: 10.3389/fnut.2023.1124987. PMID: 37139441; PMCID: PMC10149808.
Autores: Menero-Valdés P, Chronakis MI, Fernán-mann B, Pereiro R.
Título: Determination of Proteins: Evaluation of the Cellular Stress Response.
Revista: Anal Chem. PMC10483461.
Autores: Álvarez-Barrios A, Álvarez L, Pereiro R,
Título: Elemental mass spectrometry to study metallo-transcriptomic changes during the in vitro degeneration of the retinal pigment epithelium.
Revista: Anal Bioanal Chem. 2023 Jul 29. doi: 10.1007/s00216-023-04880-8. Epub ahead of print.
Autores: -
Título: Relationship between Trace Elements and Inhibitors in Medullary Thyroid Carcinoma.
Revista: Biol Trace Elem Res. 3232. doi: 10.1007/s12011-022-03431-z. Epub 2022
Autores: Martínez-García J, Fernández B, Álva-reiro R.
Título: Determination of endogenous trace elevitro model of human retinal pigment epithelium
Revista: Talanta. 2023 Oct 1;263:124693. doi: 10.1016/j.talanta.2023.124693. Epub 2023 May 22.
Autores: Menero-Valdés P, Lores-Padín A, Fernández B, Quarles CD Jr, García M, González-Iglesias
Título: proteins in individual ARPE-19 cells by single cell and laser ablation ICP-MS using iridium nanoclusters as label.
Revista: Talanta. 10.1016/j.talanta.2022.123974. Epub 2022 Sep 29.
Autores: Alonso-Alonso S, Vázquez N, Chacón M, Caballero-Sánchez N, Del Olmo-Aguado S, Suárez C, Alfonso-Bartolozzi B, Fernández-Vega Cueto-Felgueroso L, Nagy L, Merayo-Lloves J, Meana A.
Título:neic free culture medium.
Revista: Sci Rep. 2023 Nov 9;13(1):19492. doi: 4.6. Q2, (22/73) Multidisciplinary Sciences.
Autores: Alcalde I, Sánchez-Fernández C, Del Olmo-Aguado S, Martín C, Olmiere C, Artime E, Quirós LM, Merayo-Lloves J.
Título:mer Enhances Corneal Nerve Regeneration and
Revista: Polymers (Basel). Q1, (16/86), Polymer Science.
Autores: Anitua E, Muruzabal F, de la Fuente M,ves J.
Título: PRGF Membrane with Tailored Optical
Plasma Rich in Growth Factors: In Vitro Model of Retinal Pigment Epithelial Cells.
Revista: Int J Mol Sci.
Autores: Manuel Chacón, Natalia Vázquez, Sergio Alonso-Alonso, Mairobi Persinal-Medina, Sara Llames, Marta Pevida, Ignacio Alcalde, Jesús Merayo-Lloves, Álvaro Meana.
Título: Improved tool for predicting skin irritation on reconstructed human epidermis models based on electrochemical impedance spectroscopy.
Revista: Biosensors. (2023). 13:162. doi: 10.3390/
Chemistry, analytical; Q1 (11/63) Instruments & Instrumentation; Q2 (48/107) Nanoscience & Nanotechnology.
Autores: Fernández-Vega Cueto-Felgueroso L, Vega F, Guerra-Velasco R, Millán MS, Madrid-Costa D, Alfonso JF.
Título: -
Revista: J Refract Surg.
Autores: Ibares-Frías L, Fernández-Vega Cueto-Felgueroso L, Alfonso-Bartolozzi B, Poo-López A, Madrid-Costa D, Alfonso JF.
Título: Long-Term Follow-Up of a 150° Arc-Length Intrastromal Corneal Ring Segment Implantation
Revista: Curr Eye Res.
Autores: Fernández-Vega Cueto-Felgueroso L,fonso JF, Melles GRJ.
Título: Spontaneous corneal clearance after graft
Revista: Arch Soc Esp Oftalmol (Engl Ed). 2023 Mar;98(3):170-174. doi: 10.1016/j.oftale.2022.11.006. Epub 2023 Feb 2. PMID: 36738920.
Autores: Madrid-Costa D, Fernández-Vega Cueto-Felgueroso L, Azor-Morón JA, Vega F, Millán MS, Alfonso JF.
Título:
Intraocular Lens: Optical Assessment With Corneas of Increasing Spherical Aberration.
Revista: J Refract Surg.
Feb 1. PMID: 36779468.
Autores: Cunha-Pachon S, Rodríguez-Una I, Rodríguez-Calvo PP, Garcia M, Lozano-Sanroma J, Álvarez-Prada M, Merayo-Lloves J, Alfonso JF.
Título: with a central hole on structural tests measure-
Revista: Eur J Ophthalmol. 2023
Autores: Juan Queiruga-Piñeiro, Alberto Barros, Javier Lozano-Sanroma, Andrés Fernández-Vega Cueto-Felgueroso L, Ignacio Rodríguez-Uña, Jesús Merayo-Lloves.
Título: Assessment by Optical Coherence Tomography of Short-Term Changes in IOP-Related Structures Caused by Wearing Scleral Lenses.
Revista: J. Clin. Med. 2023, 12(14), 4792; https:// doi.org/10.3390/jcm12144792 Submission received: 21 June 2023 / Revised: 12 July 2023 / Accepted: 18 July 2023 / Published: 20 July 2023.
Autores: Rodríguez-Una I, Fernández-Vega Cueto-Felgueroso A, Rodríguez-Calvo PP, García M, Fernández-Vega Cueto-Felgueroso L, Cobián-Tovar R, Merayo-Lloves J, Alfonso JF.
Título: Early lensectomy in patients with pseuoutcomes.
Revista: J Glaucoma. 2023;32:93-100.
Autores: Rodríguez-Calvo PP, Rodríguez-Uña I, Fernández-Vega Cueto-Felgueroso A, Sánchez-Ávila RM, Anitua E, Merayo-Lloves J.
Título:vant Agent in Non-Penetrating Deep Sclerectomy.
Revista: J Clin Med. 2023;12:3604.
Autores: Queiruga-Piñeiro J, Parra-Rodríguez T, Rodríguez-Una I.
Título: Long-term complications of cosmetic iris implants.
Revista: BMC Ophthalmol. 2023;23:8.
Autores: Biarnés M, Ventura-Abreu N, Rodríguez-Una I, Franquesa-Garcia F, Batlle-Ferrando S, Carrión-Donderis MT, Castro-Domínguez R, Millá E, Muniesa MJ, Pazos M.
Título: comparison of three clustering algorithms derived from machine learning.
Revista: Eye (Lond). 2023.
Autores:guez-Una I, Serrano-Gomez S, Prada AM, Galvis V.
Título: Agreement and Reproducibility of Anterior Chamber Angle Measurements between CASIA2
Revista: J Clin Med. 2023;12:6381.
Autores: Sánchez M, Suárez L, Banda G, Barreiro-Alonso E, Rodríguez-Uña I, Rubín JM, Cantabrana B.
Título: Age-associated polyamines in peripheral blood cells and plasma in 20 to 70 years of age
Revista: Amino Acids.
Autores: Jaumandreu L, Antón A, Pazos M, RoA, Díez-Álvarez L, Rebolleda G, Muñoz-Negrete FJ.
Título: Glaucoma progression. Clinical practice guide.
Revista: Arch Soc Esp Oftalmol (Engl Ed).
Autores: Alfonso-Bartolozzi B, Fernández-Vega Cueto-Felgueroso L, Fernández-Vega Sanz, L, Martínez-Alberquilla I, Madrid-Costa D, Alfonso JF.
Título: Triple procedure: A Stepwise Combinationract Surgery.
Revista: Cornea. 2023, Aug.18, doi: 10.10197/ ICO.0000000000003364
Autores: Alfonso-Bartolozzi B, Martínez-Alberquilla I, Baamonde B, Fernández-Vega Cueto-Felgueroso L, Alfonso JF, Madrid-Costa D.
Título: Refractive surgery after deep anterior lamellar keratoplasty: a review of the literature.
Revista: Int Ophthalmol.
Autores: Romano V, Madrid-Costa D, Alfonso JF,
Pagano L, Romano MR, Virgili G, Fernández-Vega Cueto-Felgueroso, L.
Título: Recommendation for Presbyopia-Correcting Intraocular Lenses: A Delphi Consensus Statement by the ESASO Study Group.
Revista: Am J Ophthalmol.
Autores: Lisa Fernández C, Alió Del Barrio J, Álvarez-Rementería Capelo L, Cano Ortiz A, Castaño Manotas A, Fernández-Vega Cueto-Felgueroso L, J, López-Marín Espigares I, Monteiro T, Pastor Pascual F, Pérez Izquierdo R.
Título: State of refractive surgery with Visian ICL posterior chamber phakic lens in Spain.
Revista: Arch Soc Esp Oftalmol (Engl Ed). 2023 Feb;98(2):98-104. doi: 10.1016/j.oftale.2022.06.018.
Autores: Vinciguerra R, Fernández-Vega Cueto-Felgueroso L, Roberts CJ, Poo-López A, Eliasy A, Merayo-Lloves J, Elsheikh A, Madrid-Costa D, Lisa C, Alfonso JF.
Título: on in vivo corneal biomechanics in keratoconus: 1-year results.
Revista: Cataract Refract Surg. 2023
Autores: Alfonso-Bartolozzi B, Fernández-Vega Cueto-Felgueroso L, Lisa C, Palacios A, Madrid-Costa D, Alfonso JF.
Título: Ten-Year Follow-up of Posterior Chamber Phakic Intraocular Lens with Central Port Design in patients with low- and normal-vault.
Revista: Cataract Refract Surg. 2023 Dec 12. doi: 10.1097/j.jcrs.0000000000001379. Online ahead of
Autores: Lozano-Sanroma J, Barros A, Alcalde I, Sánchez-Ávila RM, Queiruga-Piñeiro J, Fernández-Vega Cueto-Felgueroso L, Merayo-Lloves J.
Título: Impact of Plasma Rich in Growth Factors (PRGF) Eye Drops on Ocular Redness and Symptomatology in Patients with Dry Eye Disease.
Autores: Luis Fernández-Vega Cueto-Felgueroso, Gonzalo García de Oteyza Delbès.
Título: “Segmentos de anillo intracorneales”.
COMUNICACIONES EN CONGRESOS
Nacionales:
VII Curso de actualización Secomir de Secoir. Toledo. Enero 2023.
Revista:
Autores: Alfonso-Bartolozzi B, Fernández-Vega Cueto-Felgueroso L, Poo-López A, Lisa C, Madrid-Costa D, Alfonso JF.
Título: Intrastromal Corneal Ring Segments Im-plasty for Astigmatism Correction: Mid-term and Long-term Follow-up.
Revista: Cornea. 2023 Aug 1;42(8):962-969. doi: 10.1097/ICO.0000000000003110. Epub 2022 Aug 24.PMID: 36036677.
Autores: Alfonso JF, Fernández-Vega Cueto-Felgueroso L, Lisa C, Alfonso-Bartolozzi B, Palacios A, Madrid-Costa D.
Título: Clinical and Aberrometric Outcomes of a New Implantable Collamer Lens for Myopia and Presbyopia Correction in Phakic Patients.
Revista: J Refract Surg.
Comunicación Solicitada en el Congreso SEO 2023.
Prologada por el profesor Luis Fernández-Vega Sanz, la publicación cuenta con más de 40 capítulos y contenidos aportados por especialistas internacionales, si bien más de la mitad está liderada por los doctores del Instituto Fernández-Vega.
VI Curso Cirugía del glaucoma. Madrid. Febrero 2023.
XVII Congreso de la Sociedad Española de Glaucoma. Madrid. Marzo 2023.
26 Congreso de la Sociedad Española de Retina y Vítreo SERV. Valencia. Marzo 2023.
XXV Facoelche. Elche. Febrero 2023.Febrero 2023.
V Reunión de usuarios EVO ICL Staar. Madrid. Marzo 2023.
I Curso Teórico-Práctico de topo-tomografía corMarzo 2023.
XX Reunión anual SESOC. Madrid. Marzo 2023.
Congreso de la Sociedad Oftalmológica de la Comunidad Valenciana. Valencia. Marzo 2023.
Abril 2023.
38 Congreso de la Sociedad Española de Cirugía Ocular Implanto Refractiva (SECOIR). Málaga. Mayo 2023.
V Jornadas Interautonómicas SEMERGEN. Ribadesella. Mayo 2023.
Retina Ibérica 2023. Barcelona. Mayo 2023.
XX Taller de Glaucoma. Baiona. Mayo 2023.
XXX Congreso de la Sociedad Española de Estrabología y Oftalmología Pediátrica (SEEOP). Valencia. Mayo 2023.
IV Curso de actualización de Retina y Vítreo. Oviedo. Junio 2023.
XXXII Congreso de la Sociedad Española de Cirugía Ocular y Orbitaria. Tenerife. Junio 2023.
Congreso de la Sociedad Canaria de Oftalmología. Junio 2023.
Congreso Bausch & Lomb Therapeutics: Curso de queratoplastia. Madrid. Junio 2023.
99 Congreso de la Sociedad Española de Oftalmología. Sevilla. Septiembre 2023.
Forum Arruzafa. Córdoba. Octubre 2023.
Lifelong learning. Curso del Atlántico 2023. Pontevedra. Octubre 2023.
Encuentro ARI. Alicante. Noviembre 2023.
Encuentro Staar Surgical. Madrid. Diciembre 2023.
Internacionales:
35° Congreso de la Asociación Panamericana de Oftlamología (PAAO). Buenos Aires (Argentina). Marzo, 2023.
Congreso ARVO 2023 (The Association for Research in Vision and Ophthalmology). Nueva Orleans (EEUU). Abril 2023.
Congreso de la European Society of Ophthalmology SOE 2023. Praga. Junio 2023.
European Cornea Conference. Suiza. Junio 2023.
III Congreso de Córnea de Colombia. Cartagena. Agosto 2023.
41 encuentro de la European Society of Cataract & Refractive Surgeon (ESCRS). Viena. Septiembre 2023.
EVER (European Association for Vision and Eye Research) Annual Meeting. Valencia. Octubre 2023.
American academy of Ofthalmology. San Francisco. Noviembre 2023.
Congreso de la Sociedad Española de Cirugía Ocular Implanto Refractiva (SECOIR). Mayo 2023. Póster titulado “¿Es posible la neuroprotección basada en lentes intraoculares?”. Andrés Fdez-Vega, Susana del Olmo-Aguado, Amador Menéndez-Velázquez, Jesús Merayo-Lloves, Ignacio Rodríguez-Uña y Jose F. Alfonso.ces 2023. Rosa Alvarado
La Fundación de Investigación Oftalmológica pertenece a varias estructuras estables de investigación, lo que potencia la visibilidad y alcance de los proyectos en los que participa. A continuación se detallan dichas estructuras.
ISPA (Instituto de Salud del Principado de Asturias).
La Fundación de Investigación Oftalmológica es centro asociado y de pleno derecho al Instituto de Salud del Principado de Asturias, en virtud de la resolución del Instituto de Salud Carlos III.
La Fundación de Investigación Oftalmológica trabaja conjuntamente con elneral de Actuación centrado en alimentación y salud visual, desde el año 2022.
RICORS ENFERMEDADES INFLAMATORIAS.
Redes de Investigación Cooperativa Orientadas a Resultados en Salud (RICORS). INSTITUTO DE SALUD CARLOS III. Ref.: RD21/0002/0041. Periodo:
BIOBANCO DEL PRINCIPADO DE ASTURIAS.
Plataforma ISCIII de apoyo a la I+D+I en Biomedicina y Ciencias de la Salud INSTITUTO DE SALUD CARLOS III. Ref.: PT20/00161. Periodo: 2020-2023.
UNIDAD DE BIOBANCO Y BIOMODELOS DEL PRINCIPADO DE ASTURIAS (UBBPA).
Plataforma ISCIII de apoyo a la I+D+I en Biomedicina y Ciencias de la Salud
REFERENCE SITE ASTURIAS FOR ACTIVE & HEALTY AGEING.
Comisión Europea. European Innovation Partnership on Active and Healthy Ageing (EIP on AHA).
Fundación de Investigación Oftalmológica
Instituto Universitario Fer nández-Vega
Avda. Dres Fer nández-Vega, 34
33012 Oviedo Asturias España
Tfno.: 985 240 141
investigacion@fer nandez-vega.com
www.fer nandez-vega.com
Con la colaboración de: Instituto Oftalmológico Fer nández-Vega