














Prof.
Președintele

Președintele

















Prof.
Președintele

Președintele




un nou membru al grupului Eppendorf


Test imunologic pentru screeningul cancerului pulmonar





În laboratoarele Synevo se efectuează peste 2000 de investigaţii diferite: alergologie, anatomie patologică, biologie moleculară, biochimie, genetică, hematologie, imunologie, markeri (cardiaci, endocrini, osoşi, tumorali), serologie, microbiologie şi toxicologie.
Synevo este parte a Diviziei de Servicii de Diagnostic Medicover prezentă la nivel internațional prin intermediul unei rețele formate din 118 de laboratoare, 892 de centre de recoltare și 27 de clinici, active în mai mult de zece țări.
La finalul anului 2023, Synevo România administra o rețea națională de 21 laboratoare și 176 de centre de recoltare a probelor biologice, amplasate în zone ușor de accesat din 78 de localități. Peste 1.500 de angajați sunt implicați în deservirea a mai mult de 2,1 milioane de clienți unici anual, prin realizarea a peste 19,3 milioane de teste anual.


„Pregătirea permanentă face parte din natura profesiei de medic – profesia noastră este o continuă provocare și tocmai de aceea - o plăcere în același timp”
Interviu cu Prof. Univ. Dr. Minodora Dobreanu
„Pe lângă teorie și practică, cred că tinerii medici au cel mai mult nevoie de mentori“
Interviu cu doamna Dr. Daniela Jitaru
Validarea loturilor noi de reactivi - cerință a bunelor practici de laborator, provocare pentru personalul laboratorului
Dr. Georgeta Hanganu
Evoluția spre laboratorul ecologic
Dr. Ing. Albert Zsolt Barabas
Mutațiile genei PIK3CA asociate cancerului mamar și altor tipuri de cancer
Biolog Medical Principal Dr. Ecaterina Tataru, Biolog sp. Carmina-Diana Bucaleț
Complexitatea plurifactorială a diagnosticului hemato-morfologic
Asist. Univ. Dr. Cristian Barta
Optimizarea diagnosticului precoce al PE: Perspective și metode de screening în primul trimestru de sarcină
As. Univ. Dr. Antoanela Curici
Genetica în cancerul de prostată - schimbări de paradigmă în medicina de precizie a secolului XXI
Prof. Univ. Dr. Alin Cumpănaș
Abordarea diagnosticului și a clasificării bolilor de sânge Chimist Medical Principal Valeriu Găman





Copierea fără acordul scris al editurii a oricăror elemente de grafică sau conținut editorial apărute în revistele editurii sunt considerate furt de proprietate intelectuală și intră sub incidența legii. Trimite email pe adresa redactie@finwatch.ro, solicită un abonament la revista Medical Market și primești 10 puncte EMC. Consultant medical: Dr. Aurora Bulbuc, medic primar Medicină de

Editor Calea Rahovei, nr. 266-268, Sector 5, București, Electromagnetica Business Park, Corp 01, et. 1, cam. 4






Stimată doamnă Prof. Univ. Dr. Minodora Dobreanu, în calitate de Președinte al acestui eveniment de referință pentru profesioniștii din domeniul medicinei de laborator și nu numai, vă rugăm să ne spuneți pe ce participare mizați?
Avem în acest an înscriși, până la ora actuală, 550 de participanți din întreaga țară, medici specialiști și primari, rezidenți și desigur, biologi, biochimiști, chimiști care lucrează în laboratorele medicale și clinice, publice și private. Sunt sigură însă că, vor fi și participanți înscriși on-site ca în fiecare an și că numărul de participanți finali va fi mai mare. Suntem încântați de numărul în creștere de la an la an al tuturor participanților și mai ales al tinerilor în formare.
Programul științific al conferinței este susținut de lectori de prestigiu de la universitățile de medicină din țară, precum și de la institutele de cercetare și societățile de profil, cu care colaborarea s-a perpetuat de-a lungul anilor.
Ca în fiecare an, vom avea expoziția de aparatură, reactivi și materiale de laborator; în acest an și-au anunțat participarea 25 de companii.
„Pregătirea permanentă face parte din natura profesiei de medic –profesia noastră este o continuă provocare și tocmai de aceea - o plăcere în același timp”
Interviu realizat cu Prof. Univ. Dr. Minodora Dobreanu, Coordonator al Laboratorului de Imunologie al CCAMF din cadrul UMFST “George Emil Palade”, Tg. Mureș, Șeful Laboratorului de analize medicale al SCJU Tg.Mureș, Președintele Conferinței Naționale a Asociației de Medicină de Laborator din România, cu participare internațională, desfășurată în perioada 15 – 17 mai la Eforie Nord.
Care sunt principalele teme de interes și ce speakeri renumiți aveți ca invitați anul acesta?
Principalele teme care vor fi dezbătute în conferința din acest an sunt:
• Green labs - tranziție sustenabilă în cadrul laboratoarelor medicale
• Conformitatea testelor dezvoltate în laborator cu cerințele EU-IVDR –Implicații pentru laboratoarele de diagnostic
• Controlul de calitate și managementul laboratoarelor
• Considerații privind etapa postanalitică: intervale de referință și limite de decizie clinică
• Biomarkeri în patologia cardiovasculară
• Metode avansate în hemato-oncologie
• Progrese în imunologia transplantului
• Gestionarea responsabilă a diagnosticului în testarea moleculară
• Automatizarea totală în microbiologie
• Ghiduri profesionale În cadrul conferinței vor fi prezenți lectori internaționali, reprezentanți ai organizațiilor internaționale de profil:
• Prof. Tomris Ozben, președinte IFCC, EFLM past president, reprezentant EFLM
• Prof. Tommaso Trenti, Modena, președintele Societății Italiene de Medicină de Laborator
• Prof. Bernd Kaina, Institutul de Toxicologie din Mainz, Germania
• Prof. Sanja Stankovic, Serbia
• Carlos Garces, președintele Societății de Medicină de Laborator din Chile De menționat că avem în acest an și români din diaspora (Canada și Grecia), precum și un grup numeros de colegi din Republica Moldova.
În fiecare an AMLR încurajează tinerii colegi, de aceea vă rugăm să ne spuneți ce ați pregătit pentru ei în cadrul programului acestui eveniment.
În ultimii ani am acordat o mai mare atenție colegilor în formare, iar în acest an avem în mod special pentru ei o secțiune specială EFLM Young Scientist Group –oportunități oferite de EFLM pentru tinerii specialiști. Deasemeni, tot în cadrul conferinței va avea loc anunțarea celor 24 de participanți la Școala de vară AMLR 2024 pentru rezidenți.
Și nu în ultimul rând, va pot comunica reluarea sesiunii de granturi de cercetare a AMLR.
Lansăm în acest an un pachet consistent de ghiduri, pentru componentele preanalitică și analitică ale procesului de testare:
a. Recoltarea sângelui venos periferic, – adoptare a Recomandării comune EFLM-COLABIOCLI v1, traducere publicată în numărul RRML din ianuarie 2024
b. Recoltarea sângelui capilar și efectuarea frotiului periferic
c. Hemostaza – traducere adoptare d. Analiza urinii
e. Investigarea în DL – joining committee EFLM-EAS
Acestea sunt adresate desigur tuturor profesioniștilor, nu numai acelora în formare, și vor fi disponibile pe site-ul asociației, respectiv au fost/vor fi publicate în revista RRML.
Ce progrese în domeniile de vârf ale medicinei de laborator s-au înregistrat în ultima perioadă?
Laboratoarele clinice produc o cantitate imensă de informații, dintre care rezultatele pacienților sunt doar o parte. În ultima perioadă vorbim tot mai mult de concepte cum ar fi:
• Automatizarea totală în laborator (TLA)
• Teste moleculare POC
• Inteligența Artificială în Laboratorul Medical (IA)
Inteligența artificială și învățarea automată (machine learning) nu sunt concepte totalmente noi pentru laboratoarele clinice, dar în zilele noastre au noi conotații și devin mai integrate în viața noastră profesională.
Au fost propuși algoritmi care pot monitoriza activitățile de laborator în timp real pentru a identifica anomalii, erori sau inconsecvențe. Inteligența artificială joacă un rol crucial nu numai în controlul calității și detectarea erorilor în medicina de laborator, ci și în monitorizarea și optimizarea diferitelor procese. Acest lucru asigură acuratețea și fiabilitatea rezultatelor testelor, îmbunătățind în cele din urmă asistența și siguranța pacienților.
Există însă provocări importante pe care laboratoarele trebuie să le rezolve înainte ca inteligența artificială avansată să poată fi utilizată în activitatea de rutină: necesitatea de a colecta date de calitate și de a gestiona costurile asociate cu personalul și infrastructura pentru a dezvolta instrumente software și algoritmi; siguranța că datele de laborator generate sunt cât mai robuste posibil, deoarece performanța instrumentelor de inteligență artificială va avea calitatea rezultată din cea a pachetelor de date colectate. Considerații etice: nu sunt încă disponibile recomandări general acceptate privind bunele practici pentru consimțământul pacienților și protecția vieții
private în colectarea și utilizarea datelor pentru inteligența artificială biomedicală; lipsa de familiarizare cu noua tehnologie poate fi o barieră în selectarea soluțiilor IA adecvate.
Specialiștii în medicina de laborator, prin acuratețea rezultatelor, au o contribuţie decisivă, influențând astfel luarea deciziilor medicale. Cum vedeţi, în acest context, rolul pregătirii permanente a medicului de laborator?
Pregătirea permanentă face parte din natura profesiei de medic – profesia noastră este o continuă provocare și tocmai de aceea - o plăcere în același timp. Avem șansa unei specialități în care cercetarea aduce progrese remarcabile într-un timp extrem de scurt (de exemplu în România în ultimii 30 de ani am trecut de la munca manuală la laboratorul totalmente automatizat -TLA). Este nevoie insă să ne adaptăm, să invățăm să utilizăm de exemplu inteligența artificială (un concept care câștigă tot mai mult teren) în folosul pacientului și pentru a ne imbunătăți activitatea de zi cu zi. Cunoștintele de informatică medicală și biostatistică sunt foarte importante – iar dacă nu ne sunt la indemână, va fi nevoie să atragem specialiști în informatică și a-i specializa pentru acest domeniu.

Interviu realizat cu doamna Dr. Daniela Jitaru, Președinte al AMLR.

În calitate de Președinte al Asociației de Medicina de Laborator din România, vă rugăm să ne comunicați care este strategia AMLR pentru acest an. Ce proiecte aveți în desfășurare?
În calitate de Președinte al Asociației de Medicina de Laborator din România (AMLR), strategia pentru acest an se concentrează pe aducerea medicinei de laborator din România la standarde europene și internaționale, lucru care presupune îmbunătățire permanentă a protocoalelor și intergrarea de noi tehnologii, pentru a crește eficiența, calitatea și precizia în punerea diagnosticului paraclinic. Avem în desfășurare proiecte care promovează:
1. Utilizarea tehnologiei avansate în diagnosticul de laborator și colaborări cu instituții de cercetare pentru a îmbunătăți standardele de practică.
2. Inovație și colaborare internațională (premii acordate de AMLR pentru cele mai bune lucrări prezentate de tineri și pentru cea mai merituoasă activitate).
3. Școala de vară pentru rezidenții de medicina de laborator.
4. AMLR este membru European Federation of Clinical Chemestry and Laboratory Medicine (EFLM) și International Federation of Clinical Chemestry and Laboratory Medicine (IFCC), permițând tinerilor medici de laborator și rezidenți să participe direct la proiecte dezvoltate de aceste organisme europene și internaționale. De exemplu, doamna Monica Dugăeșescu - este membră în grupul de lucru Young Scientist al EFLM și va prezenta la Conferința AMLR de la Eforie Nord, oportunitățile oferite de EFLM pentru tinerii medici și cercetători.
5. Implementarea programului de controale de calitate interlaboratoare cu participarea unui număr mare de laboratoare din țară.
Vă rugăm să ne spuneţi care sunt metodele de stimulare și susţinere a tinerilor medici ai acestei specialităţi? Aveţi stabilite anumite programe în acest sens?
Pentru stimularea și susținerea tinerilor medici, AMLR oferă programe de mentorat, burse, cursuri de specializare. Aceste inițiative sunt menite să îi ajute să se dezvolte profesional și să aducă inovații în domeniu.
O altă idee pe care mi-ar plăcea să o dezvolt este cea de „schimburi de experiență” între laboratoare, deși acesta este un program ce necesită o implementare complexă.
Dar pe lângă teorie și practică, cred că tinerii medici au cel mai mult nevoie de mentori, mentori care să îi sprijine în parcursul și dezvoltarea lor în timpul rezidențiatului și ulterior specialității, dacă nu chiar din facultate. S-ar putea că cel/cea care te-a convins să urmezi/termini o facultate să fi fost de fapt un mentor, pe care nu l-ai regăsit ulterior în sistem.
Organizarea unor evenimente care să privească orientarea în carieră și perspectivele în cariera de medic de laborator este un alt mod prin care AMLR ar putea să îi sprijine pe tinerii medici.
Mai mult, cred că putem organiza programe de „Cum să fii un mentor pentru tinerii medici” pentru medicii îndrumători ai rezidenților. Nu toți ne naștem mentori, dar asta nu înseamnă că nu putem să încercăm să fim.
Vorbiţi-ne, vă rugăm, despre implicarea societăţilor partenere in activitatea AMLR, cât și despre participarea internaţională a AMLR?
Colaborăm cu diverse societăți partenere naționale și internaționale, suntem membri ai European Federation of Clinical Chemestry and Laboratory Medicine (EFLM) și International Federation of Clinical Chemestry and Laboratory Medicine (IFCC), astfel încât putem asigura un schimb constant de cunoștințe și re-
surse ceea ce îmbunătățește calitatea cercetării și a practicii medicale în România.
La final, am dori să ne spuneți câteva cuvinte despre implicarea dumneavoastră în proiectele de cercetare medicală în domeniul biologiei moleculare și al programelor naționale de sănătate.
Împreună cu profesioniștii medici, biologi, biochimiști din laboratorul nostru, care sunt de un înalt profesionalism și competență, suntem implicați activ în cercetarea medicală, și ne concentrăm pe noile tehnologii din biologia moleculară cum este secvențierea de nouă generație, și participăm la programe naționale de sănătate care vizează îmbunătățirea diagnosticului și tratamentului pentru diverse boli oncologice (sunt coordonator al Subprogramului de diagnostic și de monitorizare a afecțiunilor hematologice maligne prin imunofenotipare, examen citogenetic și FISH și examen de biologie moleculară la IRO Iași). Aceste proiecte sunt vitale pentru avansarea medicinii de laborator și pentru îmbunătățirea sănătății populației prin dezvoltarea și implementarea unor teste de prevenție și screening prin tehnici moderne de biologie moleculară și imunofenotipare.
Având în vedere că diagnosticul de laborator este un domeniu în permanentă și într-o evoluție rapidă, perfecționarea și actualizarea cunoștințelor este esențială pentru a ține pasul cu noile tehnologii și metode de diagnostic. Acest lucru e valabil în toate domeniile, mai ales având în vedere noile evoluții în materie de inteligență artificială.
Inteligența artificială va fi implementată în medicină la fel cum au fost implementate și sistemele digitale, computere, baze de date, etc. Dar, menționăm că aceasta nu va înlocui medicii ci, va ajuta domeniul medical, mai ales în ceea ce înseamnă automatizarea proceselor de laborator, Rolul specialistului va rămâne crucial în interpretarea corectă a rezultatelor și în influențarea deciziilor clinice.
În timp ce nu trebuie să ne facem griji că vom fi înlocuiți, trebuie să ne menținem pregătiți la nivel tehnologic și științific pentru inovațiile în domeniu.
Import și distribuție echipamente și dispozitive de diagnostic clinic in vitro, sisteme de sterilizare,
reactivi și consumabile de laborator, care poartă marcajul european de conformitate CE.
Service autorizat și mentenanță echipamente
SENSITITRE, sistem automat pentru testarea sensibilității la antibiotice
prin determinarea directă a concentrației minime inhibitorii (CMI)
Este utilizată metoda de referință, respectiv metoda diluțiilor în bullion; Panelurile de lucru conțin antibiotice într-o gamă largă de diluții, permițând obținerea de rezultate corecte și, deci, o foarte bună gestionare a infecțiilor, inclusiv a celor critice; Inocularea plăcilor se face automat, la fel citirea și interptretarea rezultatelor;
Toate caracteristicile și performanțele echipamentelor SENSITITRE conduc la obținerea de rezultate corecte, fiind evitate costurile suplimentare implicate de necesitatea retestărilor sau a testelor de confirmare.

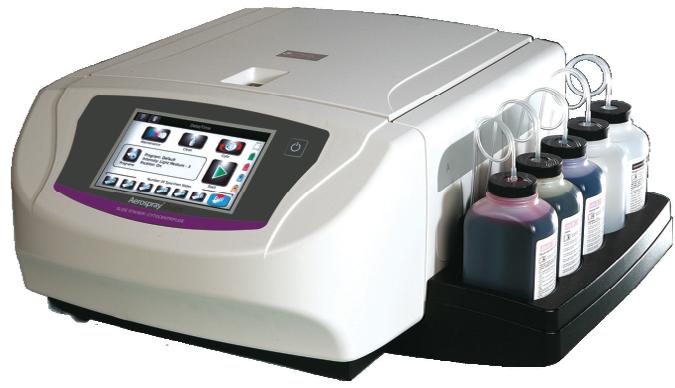
Aerospray Gram



Sistem automat de colorare lame/citocentrifugă
Conceput pentru colorarea Gram automată a frotiurilor pentru diagnosticarea in vitro;
Tipuri de probe: fluide biologice, exsudate, medii de cultură;
Utilizează o tehnologie patentată care presupune pulverizarea colorantului proaspăt direct pe lamă, evitându-se contaminarea încrucişată sau contactul frotiului cu reactivii deja utilizaƫi;
Programe de colorare standard sau personalizate de utilizator; Livrat cu 2 carusele de 12 lame, opƫional fiind disponibil şi carusel de 30 lame; Ciclu de colorare rapid, 5 minute pentru caruselul de 12 lame (144 lame/oră);
Consum redus de colorant, max. 2 ml/frotiu;
La finalul ciclului de colorare lamele ies gata uscate, putând fi observate direct la microscop;
Compatibil cu Analizorul Digital de Morfologie Celulară CellaVision®;
Opƫional poate fi utilizat ca citocentrifugă cu 8 locuri.
Acoperire națională
Pentru specificațiile tehnice și o prezentare detaliată a acestor echipamente, vă rugăm să luați
În conformitate cu cerințele prevăzute în OMS nr. 329 din martie 2018 privind aprobarea normelor de bună practică cu privire la standardele și specificațiile pentru implementarea sistemului de calitate în unitățile sanitare care desfășoară activități în domeniul transfuziei sanguine, articolul 6.3.9. prevede ca: „fiecare lot de reactivi trebuie validat pentru a demonstra că este corespunzător utilizării preconizate în cadrul sistemului de testare utilizat.”

AMedic Director, Centrul de Transfuzie Ploiești
ceastă cerință este impusă având în vedere o realitate de necontestat, aceea că reactivii de laborator inclusiv, materialele de control sunt expuse multor variabile ce apar, din cauza condițiilor din timpul transportului și a condițiilor de depozitare, până se ajunge la destinația finală, în laborator. Mulți factori pot afecta performanța unui nou lot de reactivi, factori ce pot cauza modificări unui material critic, sau modificări stabilității reactivilor.
Producătorii de reactivi aplică diferite operațiuni dedicate pentru a valida loturile noi, înainte de eliberare, dar de la eliberarea loturilor noi de la producători și ajungerea până la laborator se pot întâmpla multe. Producătorii încearcă de asemenea, să minimizeze variația de la lot la lot, dar din păcate transportul face să apară diferite modificări. Deteriorarea reactivului în timpul transportului sau depozitării (sau chiar calibrarea incorectă) a noului lot de reactivi, face obligatorie validarea loturilor noi.
Validarea loturilor de reactivi noi, prin comparare cu loturile de reactivi care sunt deja in folosire, este o practică uzuală, ce este efectuată pentru a se obține asigurarea, că în ciuda condițiilor de mediu variabile, nu există diferențe semnificative clinic, în rezultatele obținute,
chiar dacă sunt utilizate loturi diferite de reactivi. Verificarea lot cu lot și validarea loturilor noi este necesară pentru a preveni utilizarea loturilor de reactivi care nu conduc la rezultatele conforme, dorite.
Asigurarea consistenței de la lot la lot este critică, mai ales atunci când un analit este utilizat pentru urmărirea pe termen lung a pacienților, ca în cazul markerilor tumorali, când mici modificări ale rezultatului concentrației unui marker, pot impune efectuarea unor teste de laborator suplimentare sau modificarea tratamentului pacientului.
De asemenea pentru donatorii de sânge, mici variații intre loturile de reactivi de măsurare a valorii hemoglobinei înainte de donare, pot determina acceptarea la donare a unui potențial donator cu valoare a hemoglobinei sub limita de eligibilitate, acest fapt având impact nedorit pe donator (risc de anemiere) sau pe componentul sanguin rezultat din donare (risc de a avea cantitate de hemoglobină sub standard în pungă, cu rezultat necorespunzător la controlul de calitate). La fel, la testarea donărilor de sânge, mici variații intre loturile de reactivi pentru testarea maladiilor transmisibile prin sânge (pentru HIV 1&2, HCV, HBS, HTLV 1&2, Lues), realizata prin metoda ELISA, poate determina obținerea unui rezultat negativ la o probă situata în zona gri, sau chiar la o probă reactivă, (sau viceversa) ceea ce implicit determină creșterea riscului de transmitere a unei infecții prin sânge, pacienților cu tratament transfuzional.
Nu există criterii de acceptare sau criterii de respingere convenite, general va-
labile, pentru loturile noi de reactivi. Este la latitudinea echipei de management al laboratorului să determine ce procedură este optimă și acceptabilă pentru a ajunge la scopul propus. Decizia trebuie să se bazeze pe performanța istorică a testului, având în vedere variabilitatea biologică și utilizarea clinică a testului. Până în prezent nu există un protocol sau ghid standardizat care să ajute laboratoarele să facă validarea loturilor noi.
In practică validarea loturilor noi presupune două etape. Prima etapă constă în identificarea, stabilirea unui număr de parametri de luat în seamă; aceștia includ diferența maximă acceptabilă, între cele două loturi de reactivi; această diferență fiind acceptabilă, dacă se estimează că nu va avea un impact clinic nedorit. Diferență critică în imprecizia metodei, puterea statistică dorită pentru detectarea modificărilor semnificative de la lot la lot, aceste informații sunt utilizate pentru a determina numărul de probe care trebuie testate și limitele de acceptare sau respingere. A doua etapă presupune verificarea noului lot de reactiv prin testarea unui număr determinat de probe de pacienți pe ambele loturi, calcularea diferențelor medii de concentrație între rezultatele obținute cu loturile verificate și analizarea acceptabilității noului lot.
Validarea lotului nou de reactivi se face, prin rularea lotului nou în paralel cu lotul vechi de reactivi, iar rezultatele obținute, trebuie să se încadreze în intervalul de acceptabilitate definit. Pentru testele ELISA ar trebui rulate un minim de 3 probe de pacient (negative, pozitive cu valori joase, pozitive cu valori ridicate)


Furnizor de reactivi, echipamente,
şi service pentru laboratoarele de biologie moleculară şi imunologie, aplicând o politică bazată pe calitatea înaltă a produselor şi serviciilor precum şi flexibilitatea în întâmpinarea nevoilor clienţilor.
Distribuitor exclusiv în România pentru:
CoDx Box™ (RT-PCR instrument) The CoDx Box™ is cutting-edge magnetic induction technology powering the most advanced qPCR cycler ever, manufactured for Co-Diagnostics by Bio Molecular Systems, the original team behind Rotor-Gene 6000™, X-Tractor Gene™ and CAS-1200™.


Logix Smart ABC (Influenza A_B, SARS-CoV-2)
LogixSmart SARS-CoV-2 DS
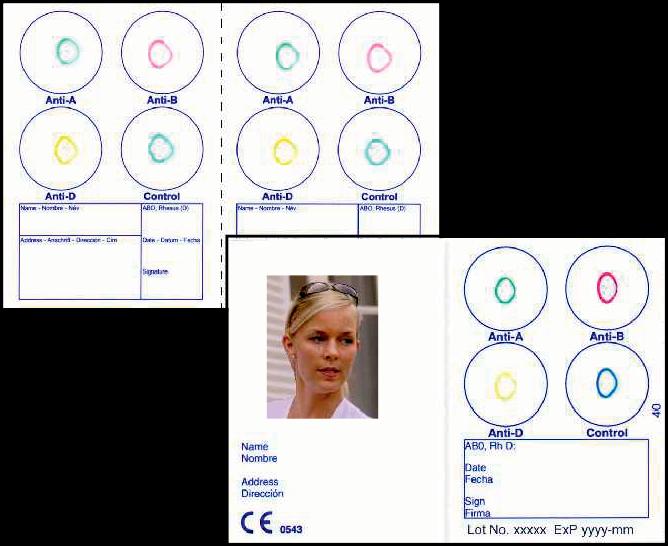
ELDON CARD 2521 can easily be divided into two single cards
ELDON ID CARD with your photo. The card can be folded to the format of a credit card.



BIO SUPPLY DEVELOPMENT SRL
București, Sector 3, Str. Vlad Dracu, Nr. 11, Bl. C14, Ap. 58
Tel.: / FAX: 021.322.85.98 E-mail: office@biosupply.ro










BIO SUPPLY DEVELOPMENT oferă o gamă variată de kit-uri și consumabile pentru HLA, secvenţiere, RT-PCR pentru detecţia patogenilor (virusuri, bacterii, fungi și paraziţi) și tehnologia Hi-Res Melting (teste pentru scanarea genelor pentru: cancer, metabolism, markeri cardiaci, hemostază, enzime de transport metabolizante de medicamente, flavine conţinând monooxygenaze, glutathione-S-transferaze, neuronale, familia „solute carrier”. De asemenea comercializează teste pentru monitorizarea gradului de curăţenie în spitale (săli de operaţie, ATI, saloane) cu ajutorul testelor bazate pe tehnologia ATP (Hygiena International-UK).

dacă sunt disponibile, sau un panel probe dintr-o serie anterioară, care să fie testate în paralel atât pe lotul vechi cât și pe lotul nou. Pentru testele calitative, un minim de 3 probe de pacienti sunt rulate în paralel atât pe loturile vechi cât și pe loturile noi. Rezultatele obținute ar trebui să fie reproductibile în cele 2 loturi. Pentru testele cu rezultate exprimate cantitativ, un minim de 10 probe de pacienti și/sau un numar de minim 10 probe de material de control, sunt rulate în paralel atât pe loturile vechi cât și pe loturile noi. Rezultatele obținute trebuie să fie reproductibile în cele două loturi.
Materialele de control folosite în laborator, provenind din loturi noi trebuie de asemenea validate, procedand identic ca și la reactivi. Acestea sunt testate în paralel (lotul nou de material de control cu lotul vechi) pentru a se obține asigurarea că media valorilor furnizate de lotul nou, este similară cu cea a lotului vechi, și se află în intervalele specificate de produ-
cător. Datele obținute în timpul testării paralele ar trebui apoi utilizate pentru a stabili intervalele controlului de calitate pentru fiecare laborator individual.
Personalul implicat în efectuarea validării lotului nou este: directorul de laborator, responsabilul cu asigurarea calității, responsabil cu controlul calității, șeful de departament, personalul de laborator. Directorul laboratorului și responsabilul cu asigurarea calității ar trebui să aprobe datele rezultate din testarea paralelă a controlului de calitate înainte ca noul control să fie pus în funcțiune. Cateva exemple pot fi ilustrative.
Validarea lotului nou de material de control pentru hemoleucograme - în mod ideal noul lot de controale ar trebui să fie rulat în paralel cu vechiul lot de controale de 2 -3 ori pe zi, timp de 5 zile, înainte de expirarea/terminarea vechiului lot. Media noului lot de control și deviația standard pentru noul lot de control vor fi
calculate. Daca valorile vor fi apropiate de valorile lotului vechi, lotul nou de material de control, va fi aprobat pentru a intra în uz, de șeful de laborator și responsabilul cu asigurarea calității.
Validarea lotului nou de material de control pentru biochimie - noul lot de control ar trebui să fie rulat în paralel cu vechiul lot înainte de a expira, de a se termina. Noul control trebuie efectuat cel puțin de 10 de ori în 3 - 5 zile, sau pe o perioadă mai lungă de timp. Se calculează media și deviația standard pentru noul lot de controale, iar dacă diferențele nu sunt semnificative și valorile sunt acceptabile, conform unor criterii bine stabilite anterior, acestea trebuie să fie aprobate de directorul de laborator sau responsabilul cu asigurarea calității, înainte ca noul control să fie pus în funcțiune.
Deși sunt o povară suplimentară pentru laborator, mai ales atunci când sunt necesare multe încercări pentru a obține un lot de reactiv acceptabil, laboratoarele trebuie să își planifice din timp resurse pentru asemenea evaluări. Laboratoarele trebuie să se asigure din timp pentru varianta nedorită, în care loturile noi de reactivi nu sunt acceptabile, iar producătorii au disponibilitate de a furniza alte loturi. Trebuie luat în calcul ca validarea lotului nou, să se facă atât timp cât încă mai există suficiente teste din lotul vechi de reactivi.
O procedură tipică pentru validarea noului lot de reactivi implică compararea rezultatelor pentru un grup de probe de pacienți lucrate atât pe loturile vechi și pe loturile noi. Este posibil însă de multe ori ca un lot arternativ la noul lot, care nu întrunește criteriile de acceptabilitate pentru validare, să nu fie disponibil imediat la producător. O variantă care poate fi luată în considerare pentru back-up, fiind trimiterea probelor pentru testare la un laborator partener, dacă loturile noi nu trec validarea și nu sunt acceptabile.
Deși pare o cerință a bunelor practici dificil de implementat, consumatoare de resurse financiare și de timp, care necesită prezența unui personal format, validarea loturilor noi de reactivi este o etapă obligatorie în asigurarea calității testării în laborator.

Poluarea este una dintre cele mai importante subiecte abordate la scară mondială, iar unul dintre factorii de poluare este și gestionarea deșeurilor generate de către laboratoarele medicale. Despre posibilitatea minimizării impactului asupra mediului prin eliminarea deșeurilor din laboratoarele medicale, stăm de vorbă cu Dr. Ing. Albert Zsolt Barabas, CEO Transylvania Innovation
Pentru început, ne puteți explica de ce acest echipament este esențial pentru laboratoarele medicale?
Laboratoarele medicale generează o cantitate substanțială de deșeuri periculoase, care poate avea un impact sever asupra mediului și sănătății, dacă nu sunt tratate corespunzător. Metodele tradiționale de eliminare, cum ar fi incinerarea, afectează mediul prin emisiile de poluanți. Echipamentul nostru oferă o soluție la fel de eficientă dar mai prietenoasă cu mediul pentru neutralizarea deșeurilor lichide biologice la locul producerii. Această abordare nu doar că elimină poluarea produsă prin incinerare, dar reduce și poluarea generată prin transportul deșeurilor periculoase. Organizația Mondială a Sănătății a subliniat importanța reducerii acestor emisii din cauza impactului asupra mediului. Această tehnologie este o piatră de temelie în tranziția către ceea ce numim “Green Laboratories”.
Ce probleme specifice abordează acest echipament?
Problemele principale includ provocările operaționale și costurile asociate cu gestionarea și transportul deșeurilor către locurile de incinerare. În plus, apar riscuri privind biosiguranța prin manipularea și stocarea deșeurilor lichide în laboratoare. Sistemul nostru oferă o soluție care elimină necesitatea de manipulare a deșeurilor lichide și dependența de serviciile externe de gestionare a deșeurilor, facilitând astfel crearea unor laboratoare mai sigure și mai sustenabile.
Puteți să conturați nevoile care au stat la baza dezvoltării acestei tehnologii?
Dezvoltarea a fost motivată de nevoia unei metode mai sigure și mai prietenoa-
se cu mediul de eliminare a deșeurilor medicale, în special în țările cu economii în tranziție, unde majoritatea deșeurilor medicale sunt gestionate necorespunzător. Soluția noastră abordează nevoia urgentă din domeniul sanitar de gestionare eficientă a deșeurilor, o soluție care respectă standardele de biosiguranță și mediu, fiind în același timp economic viabilă.
Cum rezolvă echipamentul aceste probleme?
Echipamentul nostru, dezvoltat cu fonduri EEA și Norway Grants, utilizează un proces în mai multe etape care neutralizează eficient componentele periculoase din deșeurile lichide biologice, minimizând astfel impactul asupra mediului. Este compact, potrivit pentru laboratoarele medicale de toate dimensiunile și funcționează continuu pentru a asigura o neutralizare constantă a deșeurilor. În plus, senzorii de ultimă generație și monitorizarea bazată pe cloud facilitează mentenanța predictivă și generarea unor rapoarte de conformitate care atestă respectarea standardelor.
Ce face ca acest sistem să fie o alternativă mai bună față de soluțiile existente?
Comparativ cu incinerarea, sistemul nostru reduce semnificativ poluarea, devenind un instrument esențial pentru laboratoarele care își propun să devină mai sustenabile. Este rentabil, reduce amprenta ecologică asociată cu gestionarea deșeurilor și asigură conformitatea cu reglementările de sănătate și de mediu. Tehnologia noastră este proiectată pentru instituțiile medicale care doresc să fie sustenabile, reprezentând un pas important în atingerea statutului de laborator ecologic. În final, cum vedeți viitorul gestionării deșeurilor în laboratoarele medicale?
Viitorul aparține soluțiilor sustenabile, bazate pe tehnologie, care se adaptează la nevoile în schimbare ale instituțiilor medicale, minimizând impactul asupra mediului. Pe termen mediu va crește orientarea către sisteme integrate de gestionare a deșeurilor care nu sunt doar eficiente și conforme, dar contribuie și la efortul global de reducere a poluării și protejare a sănătății publice.



Abstract: One of the main leading mortality causes in women, breast cancer exceeds over 374,000 deaths per year in developed countries. Cancer is a very heterogeneous disease with very hard to predict outcome and with an important need to find targeted therapies. Therefore, prediction of a patient’s prognosis is a major challenge. Over 70-80% of breast cancers are estrogen-receptor positive and are candidates for endocrine therapy. However, a great proportion of those tumors are either resistant to treatment, or may be recurrent. Identification of patients likely to suffer relapse despite endocrine therapy can be facilitated through analysis of genetic factors associated with poor outcome. To find an appropriate treatment, in addition to histopathological diagnosis and immunohistochemistry tests, molecular biology tests identify mutations in oncogenes involved in breast cancer, which represent therapeutic targets. The PIK3CA pathway is very frequently altered in human cancers, especially in breast cancer and colorectal cancer, as latest studies showed.


Una dintre principalele cauze ale mortalității la femei, cancerul mamar depășește peste 374.000 de decese pe an în ţările dezvoltate. Este o boală eterogenă cu rezultat foarte greu de prezis și pentru care este foarte important să se gasească oterapie ţintită. Prin urmare, predicția exactă a prognosticului unui pacient este oprovocare majoră. Peste 70-80% dintre cancerele mamare sunt estrogen-receptor pozitive și sunt candidate pentru terapia endocrină. Cu toate acestea, o proporție semnificativă a acestor tumori sunt fie rezistente la tratament, fie sunt recurente. Identificarea pacienților care pot suferi recidive în ciuda terapiei endocrine poate fi facilitată prin analiza factorilor genetici asociați cu prognostic nefavorabil. Pentru găsirea unui tratament adecvat, în completarea diagnosticului histopatologic și a testelor imunohistochimice, testele de biologie moleculară identifică mutații la
nivelul oncogenelor implicate în cancerul mamar, care reprezintă ținte terapeutice. Calea PIK3CA este foarte frecvent alterată în cancerele umane, în special în cancerul mamar și cancerul colorectal, după cum au arătat studii recente.
Introducere
In general, decizia terapeutică în cancerul mamar se bazează pe diagnosticul histopatologic și testele imunohistochimice la nivelul țesutului tumoral inclus în bloc de parafină (FFPET), prin care se evidențiază statusul receptorilor specifici: ER (Estrogen Receptor), PR (Progesterone Receptor) si ERBB2, cunoscut mai ales sub denumirea de HER2 (Human Epidermal Growth Factor Receptor 2).
Pe masură ce cercetarea și întelegerea biologiei tumorilor mamare avansează, numărul de molecule disponibile ca terapie țintită oferă oportunitatea unui tratament care să aibă o șansă de răspuns crescută faţă de tratamentul clasic, bazat pe chimioterapie, care nu este individualizat și adaptat fiecărui tip de tumoră (deci fiecărui pacient). Acest demers necesită dezvoltarea de noi biomarkeri de încredere și de tehnologii adecvate.
Pentru a realiza un profil genetic cât mai complex al cancerului mamar există teste genetice complexe bazate pe CGH (hibridizare genomică comparativă), microarray sau secvențierea unui panel complex de gene - NGS. De exemplu, prin microarray se pot identifica trăsături distincte de expresie ale acestor tumori, cu scopul de a prezice cu acurateţe
cât mai mare riscul de recidivă. Cu toate acestea, astfel de tehnici sunt costisitoare și nu sunt disponibile pe scară largă pentru testarea de rutină. Prin urmare, este important să se verifice importanța prognostică a acestor gene, pentru a selecta un panel de teste relevante clinic, dar care să poată fi utilizate de rutină, cu cost redus (low-cost).
Un exemplu de astfel de genă este PIK3CA, care codifică subunitatea catalitică p110 a fosfatidilinozitolului 3-kinazei (proteina codificată de gena PIK3CA este prescurtată ”PI3-Kinaza subunitatea alfa” sau “PI3K-alpha”). Odată activată, enzima declanșează o serie de reacții, începând cu o cascadă de fosforilare care se termină cu activarea căii de semnalizare AKT. Această cale este esențială pentru dezvoltarea glandei mamare și s-a dovedit a fi implicată în proliferarea și diferențierea celulară, repararea ADN, dar și sinteza proteinelor. De ce să testăm mutaţiile genei PIK3CA?
Calea PIK3CA este foarte frecvent alterată în mai multe tipuri de cancer, în special în cancerul mamar. Noi studii clinice testează acest biomarker în cancerul colorectal. Mai multe mutații ale genei PIK3CA reprezintă un eveniment important în inițierea și progresia tumorii, mutațiile PIK3CA activatoare regăsindu-se la aproximativ 30 - 40 % dintre pacienții cu cancer mamar HR+/HER2-. Identificarea acestora este un pas important în tratamentul pacientului, fiind eligibil


Cu seria PlasmaQuant MS, Analytik Jena Germania oferă ICP-MS care depășește toate așteptările în materie de fiabilitate, precizie, debit și îndeplineste toate cerințele pentru manipularea probelor, robustețe și conformitate.
Nivelul inegalabil de sensibilitate al PlasmaQuant MS vă oferă avantaje analitice care se reflectă în eficiență și costuri mai mici per probă.
Designul patentat al aparatului asigură cele mai mici limite de detecție și o calitate analitică consecventă pentru timpii de integrare extrem de scurți și factori de diluție ridicați cu cele mai mici costuri de funcționare.
Robust - stabilitate pe termen lung independent de matrice.
Debitul mai mare al probei reduce semnificativ costul per probă. Acesta consumă cu până la 50% mai puțin gaz argon, adică aproximativ 10 l/min. Combinația dintre puterea de detectare, viteza, consumul redus de argon și debitul mare se traduce printr-un cost semnificativ mai mic pe probă analizată.



RT PCR qTOWERiris vă echipează laboratorul pentru a vă satisface nevoile actuale și viitoare în qPCR, ca un sistem cu adevărat deschis: sunteți liberi să alegeți ceea ce este necesar pentru dvs. - de la consumabile, kituri, până la configurația cu 6 sau mai multe module de culoare. Pentru liniștea dumneavoastră, vă puteți baza pe un sistem conceput pentru utilizare pe termen lung, care funcționează liniștit și fără probleme, oferind precizie uniformă în fiecare godeu.
Extractoare automate pentru 16, 32 și 96 poziții, producător Analytik Jena.
Kituri pentru izolarea manuală a acizilor nucleici CEIVD și RUO, dintr-o gamă variată de materiale inițiale.
Kituri pentru izolarea automată a acizilor nucleici pentru extractoarele Analytik Jena și alte extractoare de pe piață.
Kituri Elisa pentru boli neurodegenerative: Alzheimer și Parkinson.
Kituri de RT PCR CE IVD pentru hepatita B, C și D. Reactivi de cercetare.
pentru terapia țintită cu anumite molecule aprobate. Încă din anul 2019, FDA a aprobat o primă terapie țintită pentru pacienții PIK3CAmut HR+/HER2−. În prezent, în versiunea cea mai recentă a NCCN (National Comprehensive Cancer Network) sunt incluse două combinații terapeutice, ambele recomandate în a doua linie de tratament/ sau ulterioară –prima combinație se recomandă pacienților cu mutație PIK3CA cu status HR+/ HER2-, iar cea de-a doua este indicată acelorași pacienti, dar care prezintă mutații activatoare PIK3CA sau AKT1, sau alterări PTEN.
Prezența mutațiilor în gena PIK3CA este asociată cu un prognostic bun pentru pacienții cu cancer mamar. Acest fapt a fost studiat atât la pacienți în stadiu incipient, dar și în stadiu avansat.
Testele genetice – gold standard în testarea mutațiilor genei PIK3CA
În testarea genetică a markerilor moleculari asociați cu diverse tipuri de cancere, metodele de testare alese variază în funcție de markerul molecular testat, în funcție de tipul de mutaţie/mutații posibile.
În cazul genei PIK3CA, metodele de testare de elecţie sunt PCR sau NGS (secventiere de noua generatie - Next Generation Sequencing), iar preferabil, atunci când este posibil, secvențierea de nouă generatie a unui panel de gene mai complex (NGS bazat pe ADN).
Tehnica PCR este o tehnică de bază în biologia moleculară, care nu amplifică toată gena, ci doar regiuni specifice țintite, în care apar mai frecvent anumite mutații. Sensibilitatea și specificitatea acestei tehnici este crescută, fiind utilă în detectarea mutațiilor cunoscute, dar nu identifică mutații noi ale genei, altele decât cele detectabile de către kitul respectiv. Există mai multe tehnici bazate pe PCR care se utilizează în detecția mutațiilor genei PIK3CA, printre care tehnici clasice, precum: PCR-RFLP, ARMS-PCR etc., dar foarte frecvent în laborator se utilizează tehnica Real-Time PCR, cu avantaje precum: timpul de lucru mai scăzut comparativ cu tehnica NGS, dar și protocolul mai accesibil și mai scurt.
În ultima perioadă au fost dezvoltate și perfecționate mai multe kituri comerciale care detectează prin această metodă anumite mutații ale genei PIK3CA. Avantajul major al acestei tehnici este ra-
portul eficacitate - cost, pe lângă o bună capacitate de detecție a anumitor mutații frecvente, țintite, pentru care au fost construiți primerii respectivi.
Majoritatea mutațiilor genei PIK3CA apar la nivelul exonilor 9 și 20 ai genei. Cele mai frecvente mutații PIK3CA sunt mutații de tip “hotspot”, mai exact 8090% dintre pacienții cu mutație în gena PIK3CA prezintă una dintre variantele următoare: E542K, E545K (în exonul 20 al genei), respectiv H1047R si H1047L (în exonul 9 al genei).
Detecția mutațiilor genei PIK3CA poate fi realizată fie din țesut inclus în bloc de parafină (preferabil), fie din plasmă (biopsie lichidă). În cazul în care țesutul nu este suficient se poate apela la testarea ADN tumoral circulant din plasmă/biopsie lichidă, cu mențiunea că această metodă este una cu sensibilitate mai scăzută comparativ cu testarea din ţesut. Dacă rezultatul testării din plasmă este pozitiv, acesta este relevant clinic și se poate iniția tratamentul țintit, recomandat de ghidurile internaționale de specialitate. Dacă însă rezultatul este negativ, ghidurile recomandă testarea din țesut (rebiopsiere, dacă este posibil).
Tehnicile curente de preparare a probelor și extracție de ADN întâmpină încă dificultăți în ceea ce privește: cantitatea de țesut rămas după efectuarea testelor de diagnostic și imunohistochimice, precum și procentul de celule tumorale rămase, cantitatea scăzută de acizi nucleici obținută, dar mai ales calitatea țesutului inclus în parafină – fiind esențială respectarea unor bune practici în laboratoarele de anatomie patologică în vederea conservării calității țesutului inclus.
Factorii care pot influența foarte mult rezultatul testelor moleculare sunt: parțiala degradare (fragmentare) a moleculelor de ADN din materialul biologic testat și/sau prezența de inhibitori. Cauze posibile ale degradării (fragmentării) moleculelor de ADN: necroza intratumorală, timpul ischemic mare (intervalul mare de timp între excizie și punerea piesei în fixator), subfixarea, soluția de fixare folosită și timpul de fixare necorespunzător.
Referinţe:
1. NCCN Guidelines, versiunea 2.2024 - www.nccn. org/home
2. Andre F, Ciruelos E, Rubovszky G, et al. Alpelisib for PIK3CA-mutated, hormone receptor-positive advanced breast cancer. N Engl J Med 2019;380:1929-1940.
3. Olga Martínez-Sáez & all - Frequency and spectrum of PIK3CA somatic mutations in breast cancer, Breast Cancer Research volume 22, Article number: 45 (2020)
4. Ieva Keraite, Virginia Alvarez-Garcia & all - PIK3CA mutation enrichment and quantitation from blood and tissue; Scientific Reports volume 10, Article number: 17082 (2020)
5. Singer, Christian F., et al. „Estrogen receptor alpha gene amplification is an independent predictor of long-term outcome in postmenopausal patients with endocrine-responsive early breast cancer.” Clinical Cancer Research 28.18 (2022): 4112-4120.
6. Blackwood, Owain, and Rahul Deb. „Multidisciplinary team approach in breast cancer care: benefits and challenges.” Indian Journal of Pathology and Microbiology 63.Suppl 1 (2020): S105-S112. Taylor, Cath, et al. „Benefits of multidisciplinary teamwork in the management of breast cancer.” Breast Cancer: Targets and Therapy (2013): 79-85.
În ultimii ani, testele de genetică au devenit un motor care a propulsat cercetarea în oncologie la alt nivel. Faptul că de la un an la altul se descoperă noi terapii personalizate, țintite, și că abordarea terapiei în oncologie este cu totul schimbată faţă de acum un deceniu, nu poate reprezenta decât un mare avantaj pentru pacienţii oncologici, atât de încercaţi. Terapia ţintită oferă oportunitatea unui tratament cu șansă de răspuns crescută faţă de tratamentul clasic. În acest sens, găsirea de noi biomarkeri moleculari, precum și identificarea celor mai potrivite metode de testare reprezintă cheia care va contura mult mai clar profilul genetic al pacienților oncologici și modul diferitelor tumori de a răspunde la terapie


READY TO USE CARTRIDGES
Patologia hematologică este una dintre entitățile diagnostice cele mai complexe, necesitând interconectarea multidisciplinară a mai multor discipline, precum genetica, biologia moleculară și citometria în flux. În acest context, morfologia ocupă un loc aproape paradoxal, ca vârf de lance, esențial în diagnostic. Paradoxal, întrucât pare să sfideze paradigma generală în evoluția diagnosticului medical din ultimul secol, tendință evidentă, mai ales, în domeniul paraclinic: adeseori tehnicile de diagnostic noi tinad să le înlocuiască absolut pe cele anterioare. Astfel, în epoca diagnosticului molecular, morfologia, tehnică cu o vechime de peste un secol, își păstrează rolul cheie în navigarea complexitații bolilor hematologice. Interesant de menționat, de asemenea, este viitorul metodei, care urmează un tipar de integrare în utilizarea inteligenței artificiale și a metodelor de „deep learning”. Acest articol propune revitalizarea elementelor particulare ce mențin statutul indispensabil al morfologiei în diagnosticul hematologic și evidențierea profunzimii, evidentă la fiecare nivel al analizei, în ciuda aparentei penurii metodologice.

Colorația
Medic specialist
Medicină de laborator, UMF „Carol Davila”, București
Tehnica prezintă ca fundament colorarea elementelor celulare, cu scopul aprecierii caracteristicilor structurale specifice fiecărei etape de maturație, un concept simplu în esență, însă cu un mecanism fizio-chimic deosebit de complex. Colorația practicată uzual în laboratoarele de hematologie se bazează pe perfecționarea metodei dezvoltate de Paul Ehrlich în anul 1879, o combinație între coloranții acizi și bazici, care i-au permis pentru prima dată, descrierea în amănunt a leucocitelor circulante și a precursorilor hematopoietici medulari. 10 ani mai târziu, protozoologul Dmitri L. Romanowsky, cu scopul de a analiza paraziții malarici intra-eritrocitari, a creat un amestec de albastru de metilen și eozină pentru a obține rezultatul cromatic care îi poartă numele (efectul Romanowsky). Colorația Romanowsky este o denumire generală a combinației de coloranți azure B/ albastru de metilen policromatic (o variantă ce conține produșii de oxidare ai albastrului de metilen) și eozină. Câteva variante ale acestui tip de colorare utilizate pe larg în lumea medicală sunt: Giemsa, Leishman și Wright. Acești doi coloranți, albastru, respectiv portocaliu intens, atunci când sunt aplicați
substratului biologic de interes, creează un spectru cromatic cu aceste două nuanțe la extremități, o gamă variabilă de roșu, albastru și culori intermediare subtile. Imaginea finală este dependentă de proprietățile electro-chimice ale elementelor celulare asupra cărora se aplică. Substratul bazic, componenta de culoare albastră (agentul activ principal numit ”azure B”), este vizibilă în forma de maximă puritate fie în citoplasma plasmocitelor, fie în citoplasma intens bazofilă a eritroblaștilor imaturi. Substratul acid, componenta de culoare portocalie (elementul principal fiind ”eosin Y”) este vizibilă în forma nativă în granulațiile din citoplasma granulocitului eozinofil.
Colorarea componentelor celulare este conceptual reductibilă la un mecanism de schimb ionic. Anionii colorați ai eozinei Y neutralizează ionii încărcați pozitiv ai proteinelor, în timp ce cationii azure B neutralizează sarcina negativă a ionilor componenți ai biopolimerilor precum ADN și ARN. Astfel, moleculele cationice de culoare albastră interacționează cu substanțele acide precum ARN-ul citoplasmatic (grupările fosfat conferă o sarcină globală negativă), fapt care explică, de exemplu, nuanța intens bazofilă a eritroblaștilor imaturi. Moleculele anionice, acide, din eosina Y vor interacționa cu substratul bazic regăsit din abundență în proteina bazică majoră, componentă a granulațiilor eozinofilului, sau a hemoglobinei. Interacțiune care fundamentează aspectul microscopic acidofil al granulațiilor eozinofilice, respectiv al eritrocitului matur. În acest
context, efectul Romanwsky se referă la caracteristici tinctoriale nou-apărute, ale unor componente celulare individuale, precum cromatina nucleară. Movul roșiatic caracteristic al nucelului, care nu este atribuibil în mod direct niciunuia dintre cei doi coloranți cheie, este născut din interacțiunile electro-chimice complexe care au loc la contactul cu structurile celulare țintă: în nucleu, molecula de azure B creează legături cu grupările fosfat anionice, în timp ce molecula de eozină Y interacționează cu structurile nucleare cationice. Important de menționat este faptul că mecanismul exact de formare ale acestor colorații intermediare este încă dezbătut în literatură. Aceste fenomene metacromatice sunt vizibile și în cadrul formării granulațiilor citoplasmatice. În cazul granulocitului bazofil, afinitat granulațiilor pentru colorantul albastru îi oferă o colorație diferită de cea a structurii de bază, astfel dezvoltă o tinctorialitate de roșu intens întunecat, aproape negru, în timp ce granulațiile primare ale seriei granulocitare, în ciuda afinității pentru azure B, se colorează roșu intens (de unde și denumirea de granulații primare azurofile.
Avantajul principal al colorației Romanwsky, comparat cu colorații care conțin elemente asemănătoare din punct de vedere al dinamicii chimice, precum hematoxilin-eozina (H&E, colorant roșu, acid, respectiv albastru, bazic), este tiparul specific policromatic: eritrocite și granulații eozinofile roșii, citoplasma albastră a limfocitelor, cromatina nucleară mov intens, granulații azurofile și neutrofile.




H&E diluată corespunzător, poate oferi un rezultat asemănător, însă granulațiile eozinofilelor și neutrofilelor se colorează în aceeași culoare cu citoplasma, iar citoplasma limfocitelor devine albastru-mov. Astfel, distincția între citoplasmă și granulații, respectiv între nucleu și citoplasma bazofilă devine semnificativ mai dificilă.
Principii de examinare morfologice
Forma și dimensiunea
Dimensiunea și forma celulei, deși elemente nespecifice, pot oferi indicii importante. Modelul general este de scădere a dimensiunii, concomitent cu maturația, astfel celulele imature tind să fie de talie crescută. Seria roșie respectă acest tipar în totalitate, proeritroblastul primul element din serie, având talia cea mai mare (14-19 µm), în timp ce eritrocitul matur are dimensiunea de 6-8 µm. Excepția de la această regulă este seria megakariocitară, unde maturizarea este direct proporțională cu creșterea în dimensiune. Limfocitele și monocitele au tendința de a-și menține dimensiunea pe tot parcursul procesului de maturație. Forma (regulată, neregulată, rotundă sau piriformă) poate indica, de exemplu, apartenența la seria eritroidă, precursorii eritrocitari având în mod obișnuit forma rotund-ovalară. Plasmocitul are nucleul rotund, formă ovală, însă cu un pol alungit; poate fi descrisă ca fiind piriformă (uneori apar descrise și cu aspect de ”cometă”).
Aceste două caracteristici au semnificație secundară în ierarhia caracteristicilor care fundamentează identificarea celulară, din cauza gradului sporit de heterogenitate în diferitele contexte fizio-patologice. Drept exemplu, o greșeală frecventă, este clasificarea limfocit contra monocit, pe pur criterii volumetrice. În ciuda faptului ca monocitul este în mod uzual de talie mai mare, comparativ cu limfocitul, un limfocit atipic își poate modifica substanțial atât dimensiunile cât și forma. Limfocitele care apar în infecțiile virale, precum Epstein-Barr, tind să fie extrem de neregulate și de talie mare, crescând astfel riscul de a fi clasificate incorect.
Caracteristici nucleare
Raportul nucleo-citoplasmatic este supraunitar în etapele timpurii ale maturației, progresiv raportul se inversează, odată cu scăderea în dimensiune a nucleului, sinergic cu maturația și creșterea cantitativă a citoplasmei. Excepția de la această regulă este limfocitul matur tipic, unde nucleul rămâne dominant.
Dimensiunea, forma și poziția nucleului oferă informații cruciale referitoare la identitatea celulei. Seria granulocitară este definită parțial prin forma nucleului – neutrofilul segmentat și nesegmentat, poziția variind semnificativ pe parcursul etapelor de dezvoltare. În cazul progenitorilor eritroizi, forma și poziția nucleului este reprezentativă: forma este perfect rotund-ovalară (în literatură apar descriși precum ”desenați cu compasul”), dispus central. Anomalii care se îndepărtează de acest model devin clasificabile drept displazie. De asemenea, în cazul plasmocitelor, combinația de nucleu perfect rotund cu dispoziție periferică, este un indicator esențial al celulei examinate.
Cromatina
Una dintre detaliile cruciale în analiza morfologică este aspectul cromatinei. Cromatina reprezintă materialul genetic, nivelul situat anterior constituirii cromozomului, înalt condensat, sub forma unor structuri filamentare sinuoase. După cum a fost menționat anterior, limbajul folosit pentru a descrie structura cuprinde elemente vizuale și tactile, însă aspectul cromatinei este indicatorul principal al stadiului de maturație celular. Cromatina laxă, relaxată, deschisă, delicată este înalt caracteristică unei celule imature, în care” prioritatea” este reprezentată de sinteza de noi acizi nucleici necesari diviziunii. Această cromatină activă metabolic, cu structură omogenă, poartă denumirea de eucromatină. Celulele în care predomină tendința de proliferare în gradul cel mai mare sunt cele blastice (mieloblaști, monoblaști etc.). În contrast cu acest aspect, celulele mature, în cazul cărora mitoza nu mai este posibilă, au aspectul cromatinian asemănător unei rețele dense, fără spații vizibile în interiorul structurii. Acest element poartă numele de heterocromatină, vizibil cel mai clar în nucleul picnotic al eritroblastului oxifil, înainte de expulzie, sau în nucleul neutrofilului segmentat. Celulele în curs de maturație vor avea un aspect în care coexistă în grade diferite cele două extremități ale tiparului nuclear. Nucleolul
cel mai important, al blaștilor. În cazul mieloblaștilor, monoblaștilor și eritroblaștilor, nucleolul este clar vizibil, bine delimitat de structura cromatiniană adiacentă (în literatură poartă numele de nucleol ștampilat,” stamped nucleoli”). Blaștii de linie limfoidă au nucleolul mult mai fin, adesea unic, palid, foarte greu de distins, spre deosebire de blaștii din seria mieloidă.
Citoplasma
Citoplasma este sediul tuturor proceselor celulare, de asemenea un indicator puternic al vârstei și activității metabolice a celulei. Elementele imature tind să aiba citoplasma redusă cantitativ, intens bazofilă, fapt ce reflectă cantitatea semnificativă de ribonucleoproteine, deci sinteza intensă de proteine. Drept exemplu, citoplasma abundentă, albastru intensă a plasmocitului indică activitatea dominantă din domeniul citoplasmatic: sinteza imunoglobulinelor. În celulele mature citoplasma tinde să fie palidă, aproape necolorată în cazul neutrofilului segmentat sau slab bazofilă, în cazul limfocitului. Granulațiile
We do cra ing analy cal solu ons in the way you need both clinical and industrial analysis: human, animal, food & beverage, environmental and bioprocesses.
Granulațiile sunt prin definiție prezente în cadrul seriei granulocitare, dar și în monocite și limfocite, cu diferențe funcționale importante. În cadrul seriei granulocitare, caracteristicile tinctoriale ale granulațiilor au permis clasificarea morfologică în cele trei componente: neutrofile, bazofile și eozinofile. În cadrul acestei serii există două tipuri de granulații: primară (azurofile) și secundare (specifice).
Varianta primară, numită și azurofilă, datorită afinității pentru componenta azure B a colorantului, începe să fie produsă în cantități mici în stadiul de mieloblast, dar își atinge zenitul cantitativ la stadiul de promielocit târziu. Conținutul lor este dominat de mieloperoxidază și hidrolaze acide. Granulațiile primare, prin procesul de metacromazie prezintă culoarea roșu-intens, cel mai clar vizibilă în cadrul promielocitului.
Nucleolul este sediul sintezei ribozomale și a procesului de transcriere ARN, fiind astfel firesc să fie cel mai vizibil în nucleul celulelor imature, cu metabolismul prioritizat în direcția proliferării. Aceste elemente structurale pot fi vizibile cel mai frecvent în nucleii proeritroblaștilor, promielocitelor și
Teoria clasică emite ipoteza că pe parcursul maturației granulațiile primare își pierd treptat colorația, devenind invizibile, dar rămân prezente în celula matură; această ipoteză a fost infirmată, odată cu dezvoltarea microscopiei electronice. Granulațiile primare nu dispar, ci își alterează proprietățile metacromatice, de la roșu deschis la roșu inchis, schimbare cauzată de modificarea conținutului. Doar granulațiile azurofile sunt constant
Clinical analysis

BA400 Analizor automat biochimie turbidimetrie și modul ISE

Veterinary analysis

iPRO Procesator automat de imunofluorescenţă

Food & Beverage analysis
Y15 Analizor automat enologie


vizibile la microscopul optic (au dimensiuni de 500-800 nanometri), în timp ce granulațiile secundare nu sunt observabile (200-300 nm, sub rezoluția microscopului optic). Deși granulațiile specifice nu sunt vizibile în mod direct, datorită numărului foarte mare, conferă o nuanță acidofilă fundalului citoplasmatic.
Granulațiile monocitare au dimensiunea de 200 nm, invizibile individual, însă creează aspectul caracteristic citoplasmatic slab bazofil, cu o usoară nuanță de gri, descris ca aspect „prăfuit” sau de „sticlă pisată”. Frotiul de sânge periferic (FSP)
FSP este o unealtă indispensabilă în evaluarea pacientului hematologic, dar nu exclusiv. Preparatul sanguin poate fi un indicator excelent al unor diagnostice specifice sau poate direcționa diagnosticul diferențial. Informația medicală care poate fi extrasă din investigație este semnificativă, mai ales raportată la resursele necesare efectuării tehnicii, costul redus oferind accesibilitate crescută în mai multe scenarii clinice. Există numeroase motive întemeiate pentru care medicul clinician poate solicita un frotiu de sânge periferic, printre care se menționează: investigarea citopeniilor, semne și simptome care indică o posibilă limfo- sau mieloproliferare (precum splenomegalia), suspiciunea de coagulare vasculară intradiseminată, suspiciunea unei infecții bacteriene sau parazitare, investigația unei anemii, trombocitopenii, etc. Cele mai frecvente utilizări ale frotiului de sânge periferic sunt: evaluarea anemiilor, trombocitopeniilor și identificarea limfoamelor și a leucemiilor. Anemiile
În cazul pacienților anemici, FSP este solicitat ca urmare a examenului clinic și a parametrilor modificați din hemogramă. Analizoarele automate moderne oferă parametri progresiv mai dezvoltați, alături de diferite histograme și diagrame de dispersie („scatter plot”), care înlocuiesc parțial elemente ce anterior, erau descrise exclusiv din analiza frotiului. Drept exemplu sunt parametrii precum RDW (”red blood cell distribution width”) corespunzători anizocitozei, NRBC (procentul de eritroblaști) și IG% (procentul de granulocite imature), elemente care pot cuantifica tabloul leuco-eritroblastic. În pofida abundeței informaționale de noutate, există elemente vizibile strict la analiza frotiului, printre care diferitele tipuri de poikilocitoză sau incluziile eri-
trocitare (corpi Howell-Jolly, punctații bazofile, corpi Pappenheimer). În cazul anemiilor hemolitice FSP este deosebit de valoros, prezența unor criterii morfologice specifice reușind să direcționeaze puternic diagnosticul către etiologia de bază. În funcție de gradul și tipul poikilocitozei se pot suspiciona cu probabilitate crescută, drept exemplu, eliptocitoza ereditară sau ovalocitoza ereditară, întâlnite în deosebi la populațiile de sorginte asiatic. Drepanocitele orientează diagnosticul către siclemie. Sferocitoza poate apărea atât în forma congenitală, cât și în hemolizele cu substrat imunologic. Microsferocitele (eritrocite de dimensiune mai mică decât a sferocitelor, hipercrome real, cu paloarea centrală pierdută) se pot observa, adițional față de anemiile hemolitice autoimune, în arsuri severe și anemii hemolitice microangiopatice, cele din urmă având o semnificație clinică importantă, întrucât unele forme necesită îngrijire urgentă (CID- coagularea intravasculară diseminată, PTT- purpura trombotică trombocitopenică, SHU- sindromul hemolitic uremic). Crucial în diagnosticul patologiilor mai sus menționate este, de asemenea, vizualizarea schizocitelor (fragmente eritrocitare), observabile de asemenea în hemolizele de natură mecanică. Anemiile în care eritrocitele se distrug printr-un mecanism oxidativ (precum în G6PDdeficitul de glucozo-6-fosfat-dehidrogenază, anomalii în șuntul pentozo-fosfaților sau agenți oxidativi exogeni) au un aspect specific pe FSP; tipul de eritrocit numit keratocit sau „blister cell”.
Anemiile macrocitare prezintă de asemenea caracteristici morfologice extrem de utile în diagnosticul diferențial. Printre cauzele frecvente de macrocitoză sunt hemoliza acută și sângerile. În acest caz pe frotiu există aspectul de policromazie, indus de reticulocitoză.
Deficitul de folat sau B12 are ca rezultat în sângele periferic aspectul de macro-ovalocitoză și de neutrofile hipersegmentate. În cazul în care anemia este severă pot apărea schizocite și/sau dacriocite. Macrocitoza non-megaloblastică din contextul patologiilor hepatice sau a etilismului poate fi diferențiată de cauza nutrițională prin prezența macrocitelor (spre deosebire de macro-ovalocite), absența neutrofilelor hipersegmentate și poikilocitoza cu stomatocite numeroase.
În cadrul diagnosticului diferențial al macrocitozei la pacientul vârstnic se încadrează și sindromul mielodisplazic (SMD). Printre semnele morfologice în SMD sunt menționate: macrocitoză care poate coexista în unele cazuri cu o populație eritrocitară hipocromă microcitară, aspect numit dimorfism; poikilocitoză, corpusculi Pappenheimer, neutrofile hipogranulare, pseudo-pelgerizate, anizocitoză trombocitară cu trombocite gigante, unele hipogranulare și tabloul leuco-eritroblastic.
În anemiile microcitare se pot observa componente precum: populație dimorfică și corpusculi Pappenheimer în cadrul anemiilor sideroblastice, și punctații bazofile în cazul intoxicațiilor cu plumb și talasemii. În cazul feripriviilor severe pot fi vizualizate anulocite (eritrocite cu paloarea centrală dominantă).
Anomalii în cuantificarea numerică a trombocitelor
Trombocitopenia cuantificată în analizorul automat necesită întotdeauna confirmarea morfologică, deoarece cauzele posibile pentru falsa trombocitopenie nu pot fi excluse decât prin observație directă: satelitism plachetar, aglutinarea trombocitară și prezența trombocitelor gigant sau a macrotrombocitelor. Trombocitoza nu poate fi ignorată, în egală măsură, întrucât poate fi artefactuală (analizorul a numărat particule mici precum fragmente eritrocitare, bacteriene, fungi etc.) sau cu componentă malignă, precum în sindroamele mieloproliferative cronice (SMPC). În SMPC, în plus față de anizocitoza trombocitară cu macrotrombocite, este crucial de cuantificat numeric corespunzător neutrofilul bazofil, granulocit care adeseori este sub-apreciat la numărătorile automate.
FSP în neoplaziile hematologice Adesea malignitățile hematologice sunt diagnosticate pe frotiu. Trebuie investigate morfologic toate leucocitozele, monocitozele, limfocitozele și citopeniile neexplicate, alături de orice avertisment (”flag-urile”) semnalat de către analizorul automat. În ciuda faptului ca diagnosticul hematologic complet include etape cu complexitate avansată, precum imunofenotipare, citogenetică și/sau FISH (hibridizare fluorescent in-situ), unele dintre aceste patologii au aspecte morfologice tipice, specifice, care permit caracterizarea și identificare cu relativ mare precizie pe FSP. Text integral pe: revistamedicalmarket.ro


Global Hemostasis
Citrated: K, KH, RT, FF
Citrated: K, KH, RT, FF (07-601)
Kaolin TEG1
Kaolin TEG with Heparinase2
RapidTEG3
TEG Functional Fibrinogen4
PlateletMapping®
Mapare plachetara
Mapare plachetara ADP (07-615)
TEG PlateletMapping5
scădere a costurilor Oncologie, Transplant, Obstetrică
Trombelastograful computerizat TEG® 6s
Trombelastograful computerizat TEG® 6s este destinat analizării elasticității cheagului de sânge prin măsurarea proprietăților mecanice de la de inițierea formării până la lizarea acestuia fiind sensibil la toate interacțiunile dintre componentele celulare și plasmatice (factori de coagulare și fibrinoliză).
Analiză cu activarea căii intrinseci. Această trasare generată de trombină identifică caracteristicile hemostatice subiacente și riscul de sângerare sau tromboză.
Elimină efectul heparinei în proba de testare. Utilizat împreună cu Kaolin standard TEG, evaluează prezența heparinei sistemice sau a heparinoidelor.
Analiză cu activarea atât a căii intrinseci cât și a celei extrinseci care accelerează procesul de coagulare în vederea obținerii cât mai rapide a proprietăților și caracteristicilor de coagulare.
Un test activat pe cale extrinsecă care utilizează un inhibitor puternic de GPIIb/IIIa plachetar pentru a restricționa funcția plachetară în vederea izolării contribuției fibrinei în coagulare. Utilizat împreună cu Kaolin TEG se poate evalua contribuția relativă a trombocitelor și a fibrinei la tăria globală a cheagurilor.
Include o urmărire specifică a receptorului de trombină și a receptorului trombocitar (ADP/AA). Identifică nivelul inhibării și agregării plachetare, utilizând Kaolin TEG (care reprezintă potențialul hemostatic de bază al pacientului) ca și control.
PROBĂ
Sânge integral citrat
1 Test c
1 Test cantitativ in-vitro care se folosește la monitorizarea pacienților ce prezintă tulburări ale coagulării.
2 Idem
2 Idem 1 pentru pacienți heparinizați.
3 Se folose tratamente cu anticoagulante heparinice, diferen

Sânge integral heparinat
Departamentele pentru care utilizarea TEG® 6s aduce un plus calității actului medical și o scădere a costurilor asociate sunt: Urgențe, ATI, Chirurgie cardio-vasculară, Ortopedie, Neurologie, Oncologie, Transplant, Obstetrică-Ginecologie, Transfuzii, Neonatologie și Pediatrie.
3 Se folosește când este necesară determinarea rapidă (5 – 10minute) a tăriei cheagului de sânge (intervenții chirurgicale, tratamente cu anticoagulante heparinice, diferențierea între coagulopatie și sângerare mecanică).
4 Se folose ambiguită
4 Se folosește pentru a determina și identifica coagulopatiile asociate fibrinogenului (nivelul de fibrinogen, eliminarea ambiguităților asociate tăriei maxime a cheagului, anormalitate genetică legată de fibrinogen, diagnosticare CID).
5 Se folose de hemostaza de bază a pacientul factorilor de risc în evenimentele trombotice, pentru determinarea eficacității terapiei antiplachetare precum și a rezistenț ei trombocitelor la terapie.

5 Se folosește când este necesară monitorizarea strictă a nivelului de inhibare al funcției plachetare de către anticoagulante față de hemostaza de bază a pacientului, pentru identificarea potențialilor factori generatori ai sângerărilor, pentru ierarhizarea factorilor de risc în evenimentele trombotice, pentru determinarea eficacității terapiei antiplachetare precum și a rezistenț ei trombocitelor la terapie.




Preeclampsia (PE) este o tulburare multisistemică ce afectează 2-8% dintre femeile însărcinate și una dintre principalele cauze ale morbidității și mortalității materne și perinatale, mai ales atunci când debutul este precoce. La nivel global, 76.000 de femei și 500.000 de nou-născuţi mor în fiecare an din cauza acestei patologii1.

MMedic primar Medicină de Laborator, Director medical Synevo România
ajoritatea cazurilor de preeclampsie apar la femeile aflate la prima sarcină. În plus, unele afecţiuni medicale asociază un risc mai mare de preeclampsie, precum Hipertensiunea arterială, diabetul zaharat și bolile renale. Preeclampsia se poate dezvolta după săptămâna 20 de sarcină și până la 48 h postpartum; cel mai frecvent fiind însă diagnosticată după 32 de săptămâni de gestaţie. Boala declanșată timpuriu (< 32 săptămâni) este însoţită de un risc perinatal și complicaţii materne mai mari2;3
Deși mecanismul patogenic al preeclampsiei nu este complet elucidat, se consideră că manifestările clinice ale bolii sunt rezultatul răspunsului matern la placentația anormală4. Numeroase studii diferite au arătat că gravidele afectate de PE prezintă un dezechilibru între factorii plasmatici solubili antiangiogenici și cei proangiogenici, acesta conducând la o disfuncție endotelială generalizată. Factorii proangiogenici circulanți secretați de placentă includ VEGF (factorul de creștere a endoteliului vascular) și PIGF (factorul de creștere placentar), în timp ce factorii antiangiogenici sunt reprezentați de sFlt-1 (tirozin kinază-1 fms solubilă sau receptorul 1 pentru factorul de creștere a endoteliului vascular VEGFR-1) și sEng (endoglina solubilă). VEGF și PIGF promovează angiogeneza prin interacţiunea cu familia de receptori ai VEGF. Deși ambii factori sunt produși de placentă, în
sarcină se înregistrează creșteri semnificativ mai mari de PIGF. Astfel, în sarcina normală concentraţiile serice de PlGF cresc în primele două trimestre și scad pe măsură ce sarcina se apropie de termen, acest factor asigurând funcţionarea adecvată a placentei. Mai mulţi cercetători au demonstrat că nivelurile serice de PlGF au inregistrat scăderi în trimestrul II de sarcină la femeile care au dezvoltat ulterior preeclampsie.
Placenta reprezintă elementul central pentru preeclampsie. În cursul dezvoltării normale a acesteia, citotrofoblastul de origine fetală invadează arterele spiralate materne transformându-le din vase de rezistenţă de calibru mic în vase de capacitanţă de calibru mare, apte să furnizeze o perfuzie adecvată a placentei. În cursul procesului de invazie vasculară citotrofoblastul trece de la un fenotip epitelial la unul endotelial. În preeclampsie însă citotrofoblastul nu adoptă un fenotip endotelial, invazia fiind limitată la decidua superficială.
Concentrațiile de PlGF sunt scăzute în primul trimestru al unei sarcini necomplicate și cresc începând cu săptămânile 11- 12, atingând un vârf în săptămâna 30, după care încep să scadă. Acest comportament este în contrast cu concentrațiile serice ale sFLT-1, care crește spre finalul sarcinii. Această divergență fiziologică dintre nivelurile factorilor angiogenici apare pe măsură ce biodisponibilitatea
PlGF scade, datorită legării la sFLT-1. Concentrațiile normale de PlGF variază cu vârsta gestațională, având o limită inferioară a valorilor normale (definită la a 5-a percentilă) variind de la un vârf de aproximativ 141 pg/ml (la aprox 30 de săptămâni de gestație) până la valori de 23 pg/ml (la termen).
Factorul de creștere placentară (PlGF) este un biomarker din ce în ce mai important în predicția, diagnosticarea și tratamentul preeclampsiei. Astfel, s-a demonstrat că valorile sale serice și urinare sunt scăzute, atât în momentul diagnosticării preeclampsiei, cât și cu mult înainte de debutul acestui sindrom. Deficiența de PlGF se datorează probabil unei cauze combinate, între scăderea expresiei PlGF și reducerea PlGF liber, datorită legării de sFLT-1, care este foarte crescut, la gravida afectată. La începutul sarcinii, concentrațiile de PlGF sunt mai mici la femeile care vor dezvolta ulterior preeclampsie, comparativ cu gravidele sănătoase, dar nivelurile sFLT-1 nu sunt diferite, ceea ce sugerează că expresia PlGF în placentă este scăzută. Cu toate acestea, spre finalul sarcinii, există o interrelație între nivelurile în creștere ale sFLT-1 total (fracțiunea sa liberă și cea legată de VEGFR sau PlGF) și niveluri mai scăzute de PlGF liber. Acest lucru sugerează că în a doua jumătate a sarcinii, concentrațiile scăzute de PlGF apar în principal din cauza sechestrării PlGF de către excesul de sFLT1. PlGF circulant scăzut este probabil atât o consecință a evenimentelor anormale timpurii în procesul de placentație, cât și un factor care contribuie la o creștere anormală, continuă, în a doua jumătate a
sarcinii. Ipoteza că PlGF este un indicator al unei placentații anormale este susținută de observația că femeile care nu au dezvoltat preeclampsie în cursul sarcinii, dar dau naștere unor nou-născuți cu greutate mai mică, comparativ cu vârsta lor gestațională, au valori scăzute ale PlGF, la începutul sarcinii.
Recunoașterea diferențelor dintre concentrațiile circulante ale factorului angiogenic, în sarcinile preeclampsice și fiziologice, a dus la investigarea valorii sale, la femeile care necesită o monitorizare atentă a sarcinii. Odată stabilit diagnosticul de preeclampsie, exclusiv delivrența placentei poate ameliora această stare.
La femeile însărcinate care vor dezvolta preeclampsie, PlGF este scăzut în primul trimestru, cu mult înainte ca boala să se manifeste clinic. Algoritmul predictiv, realizat la 11-13 săptămâni de gestație, propus de Fetal Medicine Foundation, folosește o combinație de informații materne, valoarea presiunii arteriale medie, a indicelui de pulsatilitate a arterei uterine și valorile serice ale biomarkerilor PAPP-A și PlGF. Acest algoritm detectează aproximativ 95% dintre femeile cu preeclampsie cu debut precoce sau tardiv, cu o rată de fals-pozitivitate de 10%.
De asemenea, s-a constatat că PlGF este un biomarker util pentru predicția riscului de sindrom Down. În medie, PlGF seric este scăzut, în cazul unor sarcini afectate de sindromul Down. Amploarea scăderii este mai mare în primul trimestru decât în al doilea trimestru, unde nivelurile se apropie de cele din sarcinile neafectate. Prin urmare, PlGF poate fi utilizat ca și biomarker suplimentar pentru sindromul Down, în cadrul programele de screening de prim trimestru, pentru identificarea sarcinilor cu risc crescut. Adăugarea PlGF la modelele de screening are potențialul de a îmbunătăți rata de detecție în mod semnificativ, reducând în același timp și rata de fals pozitiv.
Mai mult, un număr semnificativ de studii indică faptul că un PlGF seric scăzut sau în scădere, este asociat cu un risc semnificativ crescut de restricție a creșterii fetale (FGR) și/sau a nașterii unui făt mort. Datele publicate arată faptul că nivelurile scăzute de PlGF pot fi utile pentru predicția FGR asociate cu, sau în locul greutății fetale estimate (estimated fetal weight - EFW) efectuată prin ultrasonografie, sprijinind astfel deciziile din cadrul managementul clinic. PlGF este un biomarker important pentru predicția morții fetale, în sarcina timpurie, iar performanța de predicție se îmbunătățește pe măsură ce sarcina progresează.8
Determinarea PLGF
în ser se recomandă pentru:
• screening-ul preeclampsiei în asociere cu date clinice și parametri biochimici - în trimestrul I de sarcină.
• screening pentru evaluarea riscului de sindrom Down - în primul trimestru de sarcină.
• diagnosticul de preeclampsie și predicția, pe termen scurt, a apariției preeclampsiei - în trimestrul II și III de sarcină.
1. Liona C. Poon, Andrew Shennan, Jonathan A. Hyett, Anil Kapur, Eran Hadar, Hema Divakar, Fionnuala McAuliffe, Fabricio da Silva Costa, Peter von Dadelszen, Harold David McIntyre, Anne B. Kihara, Gian Carlo Di Renzo, Roberto Romero, Mary D’Alton, Vincenzo Berghella, Kypros H. Nicolaides, Moshe Hod The International Federation of Gynecology and Obstetrics (FIGO) Initiative on Preeclampsia (PE): A Pragmatic Guide for First Trimester Screening and Prevention, nt J Gynaecol Obstet. 2019 May ; 145(Suppl 1): 1–33. doi:10.1002/ijgo.12802.
2. Wu P, van den Berg C, Alfirevic Z, O’Brien S, Röthlisberger M, Baker PN, Kenny LC, Kublickiene K, Duvekot JJ. Early Pregnancy Biomarkers in Pre-Eclampsia: A Systematic Review and Meta-Analysis. Int J Mol Sci. 2015 Sep 23;16(9):23035-56.
3. American College of Obstetricians and Gynecologists. Task Force on Hypertension in Pregnancy. Hypertension in pregnancy. Report of the American College of Obstetricians and Gynecologists’ Task Force on Hypertension in Pregnancy. Obstet Gynecol 2013;122:1122–31.
4. Li L, Zheng Y, Zhu Y, Li J. Serum biomarkers combined with uterine artery Doppler in prediction of preeclampsia. Exp Ther Med. 2016 Oct;12(4):2515-2520.
5. Placental growth factor and pre-eclampsia- K Chau,1,2,3,* A Hennessy,1,3,4 and A Makris1,4,5,6- J Hum Hypertens. 2017 Dec; 31(12): 782–786. Published online 2017 Aug 24. doi: 10.1038/ jhh.2017.61- www.ncbi.nlm.nih.gov/pmc/articles/PMC5680413/
6. Placental growth factor testing for pre-eclampsia- Deesha Patela and Angela Yuliab,⁎ Case Rep Womens Health. 2022 Jan; 33: e00387. Published online 2022 Jan 22. doi: 10.1016/j.crwh.2022. e00387 www.ncbi.nlm.nih.gov/pmc/articles/PMC8802869/
7. PlGF Immunological Impact during Pregnancy- by Loredana Albonici ,Monica Benvenuto,Chiara Focaccetti ,Loredana Cifaldi,Martino Tony Miele,Federica Limana ,Vittorio Manzari and Roberto Bei-International Jurnal of Molecular Science www.mdpi. com/1422-0067/21/22/8714/htm
8. Delfia Xpress DELFIA® Xpress- PlGF 1-2-3 prospect reactivi-versiune noiembrie 2021



Genetics in prostate cancer - paradigm shifts in precision medicine of the 21st century
Diagnosticul și tratamentul cancerului de prostată au cunoscut schimbări substanțiale în ultimele decenii. După demonstrarea hormonosensibilității cancerului de prostată de către Huggins și Hodges, introducerea dozării antigenului prostatic specific (PSA), terapia hormonală de deprivare androgenică, dezvoltarea și îmbunătățirea tehnicilor de prostatectomie radicală (deschisă, laparoscopică, robotică), metodele moderne de imagistică (scintigrafia, rezonanța magnetică nucleară, tomografia cu emisie de pozitroni), biopsia prostatică ecoghidată, fusion și RMN ghidată precum și medicația adresată cancerelor prostatice hormonorezistente și/sau metastatice au contribuit în mod semnificativ la îmbunătățirea impresionantă a diagnosticului și rezultatelor tratamentului pacienților cu cancer de prostată, anticipând transformarea cancerului de prostată dintr-o boală incurabilă într-o boală cronică, cu care se poate trăi o lungă perioadă de timp.

Clinica de Urologie, UMF „Victor Babeș“, Timișoara
Privind însă datele studiilor publicate în ultimii ani, putem constata că, odată depășită euforia pionieratului cu evoluții aparent spectaculoase, rezultatele consistente obținute în diagnosticul și tratamentul cancerului de prostată au fost însoțite și de abordări care s-au dovedit a fi suboptimale:
• au fost incluși frecvent în programe de screening pacienți la care acest lucru nu era necesar
• a fost subestimat screeningul la persoanele mai tinere și aparent sănătoase
• au fost supratratate cazuri low-risk și subtratate cancere high-risk iar valoarea prag a PSA de 4 mg/ml nu a
reprezentat niciodată o limită care să confere siguranță diagnostică ci, cel mult, o bornă de orientare
Stratificarea cancerelor de prostată în grupe de risc (nomogramele Partin, MSKCC, Briganti, CAPRA, NCCN) se face în funcție de PSA, stadiul tumoral, examenul histopatologic, volumul tumoral și densitatea PSA, având ca rezultat un procent de aproximativ 30% de cazuri la care se face upstaging/ downstaging-ul, respectiv upgrading/ downgrading-ul, conform unui studiu recent publicat în European Urology. Cu toate acestea, mortalitatea prin cancer de prostată a scăzut cu peste 50% față de etapa pre-PSA iar medicina secolului XXI, orientată spre terapii personalizate, face pași importanți bazându-se pe progresele deja înregistrate, eliminând abordările greșite/ suboptimale și integrând elementele moderne de diagnostic și tratament. Odată cu încheierea proiectului de secvențiere a genomului uman (19902003, cu ultimele 8% din genele ADN
secvențiate în 2022), evaluarea genetică a cancerelor, în general, și a cancerului de prostată în particular a cunoscut o dezvoltare consistentă. Astfel, dacă înainte de 2016, ghidurile NCCN (National Comprehensive Cancer Network) menționau în capitolul dedicat cancerului ovarian și a celui de sân că gena BRCA ar putea fi implicată în cancerul de prostată ereditar, din 2016 se recomanda screeningul precoce al pacienților cu istoric familial de cancere BRCA 1/2 pozitive iar din 2018 ghidurile NCCN pentru cancerul de prostată iau în considerare testarea genetică a liniei germinale pentru mutațiile BRCA la persoanele cu risc (istoric familial, vârstă tânără la debut, cancer metastatic). Din 2022 această testare are valoare de recomandare la cazurile cu risc.
Se consideră că 20-30% dintre cancere au o componentă genetică. Astfel, sunt definite în prezent • cancerele prostatice ereditare (1015% din totalul cancerelor), la care






• mutația/mutațiile genetice ereditare sunt dovedite (genele BRCA, HOXB13, sindromul Lynch etc)
• cancerele familiale (15-20%) – fără mutații genetice (încă) identificate dar cu agregare familială clară , la care patogeneza poate să implice factori genetici/epigenetici și condițiile de viață
• cancerele sporadice (70-80%) – fără componentă ereditară
Anamneza pacienților cu cancer de prostată ar trebui să includă în mod obligatoriu și evaluarea de risc familial pentru boală cu determinism genetic: vom întreba asupra rudelor de grad unu, de ambele sexe precum și asupra rudelor de gradul doi (bunici, unchi, mătuși, veri pe linie maternă și paternă), ne vom interesa de istoricul familial de cancer de prostată și de sân, ovar, endometru, pancreas, colon, gastrointestinal și leucemie. De asemenea, este importantă în anamneza familială vârsta de apariție a cancerelor în familie precum și vârsta eventualelor decese prin cancer. În plus, este important de evaluat prin anamneză dacă a fost vorba de cancere agrsive sau nonagresive, metastatice sau nonmetastatice, cu sau fără chimioterapie.
Testele genetice actuale utilizate în cancerul de prostată se împart în două mari categorii: testele liniei germinale (pentru mutațiile genetice moștenite de la genitori) și testele genetice somatice (din celulele tumorale). Majoritatea genelor liniei germinale testate sunt gene de recunoaștere și reparație a leziunilor ADN rezultate în faza de replicare (BRCA, ATM, MSH, HOXB13 etc.)
În funcție de grupa de risc, Ghidurile NCCN din 2023 recomandă testarea genetică a liniei germinale
(cel puțin pentru mutații ale BRCA) la pacienții low-risk cu istoric familial încărcat sau la cei cu cancer intraductal sau cribriform precum și la toți pacienții cu risc intermediar sau crescut (17% dintre aceștia s-au dovedit a avea una sau mai multe mutații genetice cu risc, cel mai frecvent mutațiile BRCA). Mutațiile BRCA se asociază cu un risc de 2-6 ori mai mare de a dezvolta cancer de prostată, cu un risc de 8-9 ori de a dezvolta cancer de prostată sub 65 ani comparativ cu pacienții cu non-mutații, risc mai mare de cancer agresiv (Gleason 8+, N+, metastaze). Există studii care au arătat că în cazul pacienților cu cancer de prostată în program de supraveghere activă, riscul de upgrading este de 42% la purtătorii de mutații BRCA față de 23% la ne-purtători. Prin urmare, se poate aștepta ca pe viitor testarea genetică a liniei germinale (statusul de ne-purtător de mutații) să reprezinte un criteriu de includere în supravegherea activă.
Testarea genetică somatică (din materialul tumoral) evaluează peste 300 de gene, TMB (tumor mutation burden) sau MSI (microsattelite instability) precum și DNA liber circulant (cfDNA).
În prezent, dincolo de evaluarea riscului potențial de a dezvolta cancer de prostată/forme agresive ale acestuia, există deja implicații terapeutice:
• mutațiile genelor de recunoaștere și reparare a leziunilor ADN (ATM, BRCA 1, BRCA 2) sunt favorabile tratamentului cu inhibitori PARP (olaparib) sau chimioterapiei cu produși pe bază de platină
• genele de mismatch repair (MSH 2, MSH6, MLH1, PMS2) creează premisele unui răspuns favorabil la imunoterapia cu checkpoint inhibitors
Evaluarea mutațiilor genetice este una laborioasă, care beneficiază de programe complexe informatice și de computere dedicate performate, fiind necesare analize a zeci de mii de secvențe de baze, repetate de mai multe ori pentru e evita erorileTestarea genetică prin metoda NGS – next generation sequencing este obligatorie pentru a obține rezultate de calitate, în contrast cu testele ieftine care pot oferi rezultate incomplete sau eronate. Este important ca pacienții să fie informați asupra acestor aspecte și să aleagă să efectueze teste genetice de calitate, chiar dacă aceasta implică costuri semnificativ mai mari.
În concluzie, progresele recente în genetică și implicațiile acestora în cancerul de prostată vor trebui:
• să ne facă mai atenți la evaluarea istoricului familial al pacienților cu cancer de prostată, pentru a identifica pacienții la care vom recomanda testarea genetică (linia germinală sau somatică) în funcție de istoricul familial și histologia tumorii
• să ne permită să definim mai bine grupele de risc și alegerea tratamentului corespunzător
• să alegem, în echipa multidisciplinară (împreună cu oncologul, radioterapeutul, anatomopatologul, radioimagistul și geneticianul) tratamentul adecvat – un pas spre medicina de precizie și medicina personalizată
• nu în ultimul rând, consider că este rolul nostru, al urologilor, ca așa cum am popularizat și am reușit să implementăm dozarea PSA, să informăm pacienții, medicii de familie și colegii din alte specialități despre importanța evaluării factorilor de risc genetic și a importanței acestuia în succesul tratamentului cancerului de prostată.
Astăzi, mai mult ca oricând, importanța diagnosticării precise și timpurie este clar înțeleasă. Călătoria de la recoltarea sângelui până la obținerea rezultatului final al testului, necesită cel mai înalt nivel de implicare, eficiență și expertiză a personalului din laborator. Pentru a vă sprijini în acest sens, Roche a dezvoltat soluții integrate inovatoare, renumite pentru calitate și excelență.



cobas® pure integrated solutions
Până la 870 teste SWA/oră
Volum de testare mic spre mediu
cobas® pro integrated solutions
Până la 4400 teste SWA/oră*
Volum de testare mediu spre mare
cobas® mobile solution
Companionul dumneavoastră digital al sistemelor cobas®
Același meniu de teste, cel mai amplu din industrie1 cu peste 230 parametri
Aceleași tehnologii. Rezultate consecvente
Pachete de reactivi partajate Timpi de incubare de 9/18/27 minute
Mentenanță automată Efort minim din partea operatorului: cobas pure: 5 min/zi cobas pro: 8 min/zi1
Cele mai mari stabilități din industrie1
Autocalibrare prin tehnologia cobas® Autocal
Cele mai mici volume de probă necesare în medie1
Listă de încărcare predictivă
Tehnici unice de prevenire a contaminării
Accesați broșura Accesați broșuraBabesia
Malaria
Anemie
Teste moleculare
Teste moleculare și screening donatori
Screening donator (Parte din meniul de testare Roche Blood Safety Solutions)
Testul GAAD ca adjuvant în diagnosticarea carcinomului hepatocelular (HCC) în stadiu incipient
Sprijinirea misiunii noastre de a STOPA boala hepatică cronică.
HCC - un ucigaș silențios
Numărul cazurilor de carcinom hepatocelular (HCC) este în creștere, în special în țările dezvoltate.1 HCC afectează aproape exclusiv pacienții cu boală hepatică cronică,2 fiind cea mai frecventă formă de cancer hepatic, cu aproximativ 90% din cazuri, fiind și a treia cauză principală de deces prin cancer.3,4,5
Adesea, HCC devine simptomatic abia în stadiile avansate, a căror rată de supraviețuire la 5 ani este sub 5%, ceea ce înseamnă că numărul în creștere al pacienților cu cancer hepatic progresează tacit spre o șansă de supraviețuire mai redusă.1
Trebuie să diagnosticăm HCC mai devreme. În realitate, în grupurile cu risc ridicat, screeningul bianual a redus cu 37% mortalitatea prin HCC.6 Cu o sensibilitate și specificitate ridicate pentru diferențierea HCC în stadiu incipient și a bolii hepatice cronice benigne, algoritmul GAAD ajută la diagnosticarea HCC (incipient și toate stadiile).
Stadiile timpurii ale HCC - sensibilitatea de diagnosticare a diferitelor metode
Utilizarea GAAD pentru a amplifica semnele din stadiul timpuriu
Deși ecografia este un instrument de supraveghere utilizat pe scară largă, cu utilitate clinică dovedită în HCC, atunci când este utilizată singură, are o sensibilitate mult mai scăzută în diagnosticul în stadiu incipient decât atunci când este asociată cu GAAD.7
GAAD are o specificitate de 94,6% și o sensibilitate de 73,1% și 77,4% pentru detectarea HCC în stadiul incipient și, respectiv, toate stadiile.
Rezultatele unui studiu de cercetare sprijinit de Roche au arătat că asocierea dintre GAAD și ecografie conduce la o sensibilitate de 88,5% pentru detectarea HCC în stadiul incipient și de 92,5% pentru toate stadiile de HCC.8
GAAD, un algoritm simplu, dar sofisticat și de impact
Combinând patru tipuri de date despre pacient, GAAD indică probabilitatea ca pacientul să aibă HCC.
Interpretarea scorului GAAD
GAAD calculează un scor al factorului de risc 0-10, care se traduce prin probabilitatea ca pacientul să dezvolte HCC.†
Un scor mai mic de 2,57 indică un rezultat negativ
Un scor mai mare de 2,57 indică un rezultat pozitiv și un risc crescut de HCC
Sex Vârstă AFP
Avantajele cheie ale GAAD
Încredere
Scor de risc ușor de înțeles și exact, o valoare limită validată clinic
†GAAD se va interpreta în asociere cu alte metode, în conformitate cu alte constatări diagnostice și informații clinice, iar valorile testelor trebuie calculate din aceeași probă
Asistență clinică
Amplificați semnele HCC în stadiu incipient, ajutând profesioniștii din domeniul sănătății să ia decizii clinice mai eficiente
Integrare în fluxurile dumneavoastră de lucru existente
Automatizare
Integrare în navify® Algorithm Suite, ceea ce permite un flux de lucru complet automatizat
GAAD se integrează direct în fluxul dumneavoastră curent de lucru cu navify® Algorithm Suite.
Cadru medical clinician/asistent
Ser/Plasmă (Probă de sânge)
Specialist de laborator
GAAD Algorithm
Îmbunătățiți detecția HCC!
Algoritmul de diagnostic este gata de utilizare acum, scanați aici pentru a afla mai multe.
MC-RO-01265
Date pacient: Vârstă, sex
Biomarkeri Elecsys: AFP, PIVKA-II
Sprijin în diagnosticarea HCC
Urmărire, evaluare și tratament (dacă este cazul)
Algorithm Suite
Bibliografie:
1. Fitzmaurice T et al. The burden of primary liver cancer and underlying etiologies from 1990 to 2015 at the global, regional, and national level: Results From the Global Burden of Disease Study 2015. JAMA Oncol 2017;3:1683-1691.
2. Bartosch B. Hepatitis B and C Viruses and Hepatocellular Carcinoma. Viruses 2010;2:1504.
3. El-Serag HB et al. Surveillance for hepatocellular carcinoma: in whom and how? Ther Adv Gastroenterol 2011;4: 5–10. 4. Llovet JM et al. Hepatocellular carcinoma. Nat Rev Dis Prim 2016;14:2:16018.
5. Ferlay J. et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods. Int J Cancer. 2019 Apr 15;144(8): 1941-1953.
6. Zhang BH et al. Randomized controlled trial of screening for hepatocellular carcinoma. J Cancer Res Clin Oncol 2004;130: 417-22.
7. Tzartzeva. ,et al. Surveillance Imaging and Alpha Fetoprotein for Early Detection of Hepatocellular Carcinoma in Patients With Cirrhosis: A Meta analysis. Gastroenterology. 2018 May;154(6):1706-1718.e1.
8. Chung-Feng Huang et al. The clinical utility of Elecsys GAAD score the diagnosis of hepatocellular carcinoma. Poster presented at: APASL Single Topic Conference on Hepatocellular Carcinoma; 2022 June 23-25; Taipei, Taiwan.
Termenul de boli mieloproliferative (MPDs – myeloproliferative disorders) a fost propus pentru prima oară de William Damashek în 1951 pentru a descrie un grup de tulburări dobândite, maligne, caracterizate printr-o proliferare excesivă a celulelor hematopoietice și fibroblaștilor în măduva osoasă.
Chimist Medical Principal
Valeriu GămanPrin definiție, bolile mieloproliferative cronice (BMPC) reprezintă un grup heterogen de afecțiuni a căror origine o reprezintă expansiunea clonală a celulei stem hematopoietice pluripotente, având ca rezultat supraproducția unuia sau mai multor elemente figurate din sânge. Clasic, BMPC cuprind patru entități clinice: leucemia mieloidă cronică (LMC), policitemia Vera (PV), trombocitemia esențială (TE) și metaplazia mieloidă cu mielofibroză (MMM). Aceste boli specifice se diferențiază prin tipul celular predominant implicat. Astfel, LMC (LGC) se caracterizează printr-o producție excesivă de granulocite; în PV apare o supraproducție de eritrocite iar în TE de trombocite. MMM se caracterizează prin prezența fibrozei medulare și a hematopoiezei extramedulare în ficat și splină (tabelul 1).
În 1999, noua clasificare a OMS extinde lista neoplasmelor mieloide la șapte entități care includ și: leucemia neutrofilică cronică, leucemia eozinofilică cronică / sindromul hipereozinofilic (HES) și boli mieloproliferative neclasificate. Clasificarea OMS din 2008 înlocuiește termenul de boli mieloproliferative (eng. CMPD) cu neoplasme mieloproliferative (eng. MPN). În plus, au fost revizuite criteriile de diagnostic tradiționale, mai ales cele de genetică și biologie moleculară. 1. Leucemia mieloidă cronică
Leucemia mieloidă cronică sau Leucemia granulocitară cronică (LGC) este o boală mieloproliferativă caracterizată
prin creșterea marcată a granulocitelor în sângele periferic, incluzând neutrofile cu forme imature, eozinofile și bazofile și, de asemenea, hiperplazie granulocitară marcată în măduva osoasă. A fost prima boală umană în care patogeneza a putut fi urmărită direct pe o anomalie cromozomială specifică, cromozomul Ph1 (1960 – Școala de medicină de la Universitatea Pensylvania, Philadelphia), care poate fi identificat în aprox. 90 - 95% dintre pacienții cu caracteristici ale LGC.
LGC este ccaracterizată prin trei faze: faza cronică, faza accelerată și faza blastică. Cei mai mulți pacienți, cca. 85%, sunt diagnosticați în faza cronică, timp în care boala rămâne stabilă pentru mai mulți ani și, în general, răspunde la tratamentul
Tabelul 1. Caracteristici biologice diferențiate ale BMPC
convențional de chimioterapie. Progresia LGC la faza accelerată sau blastică, în absența terapiei, apare de obicei la 3 – 5 ani de la debut.
Faza accelerată este anunțată de o varietate de semne și simptome ale progresiei bolii, care includ: stare febrilă inexplicabilă, scădere semnificativă în greutate, leucocitoză progresivă, agravarea splenomegaliei, dureri osoase și articulare, sângerări, tromboze și infecții.
Faza blastică (numită și criză sau transformare blastică) reprezintă conversia LGC intr-o formă agresivă de leucemie acută, mult mai greu de tratat.
Cel mai important test de laborator este hemograma, care include: • Numărătoarea leucocitelor (frecvent
LMC/LGC PV TE MMM
Hemoglobina N / ușor scăzută Crescută marcat N / ușor scăzută Ușor scăzută
WBC (x109/L) > 50 12 – 25 Variabil, adesea mediu crescut Variabil, de obicei ușor crescut timpuriu
Trombocite (x109/L) Variabil, ușor crescut 450 – 800 600 – 2500 450 – 1000, scăzut în boala avansată
NRBC Uzuale Rare Rare Uzuale
FAL Moderat scăzută De obicei ușor crescută N N / moderat crescută
Măduva osoasă Hiperplazie mieloidă marcată
Hipercelularitate, depozite de fier ușor scăzute
Hipercelularitate, megakariocite crescute marcat
Fibroză, moderat uscată, marcat crescută
Fibroză Fără / ușor crescută Fără / ușor crescută Fără / moderat crescută Moderat / marcat crescută
Splenomegalie 60 – 80% 80% 40 – 50% 80 – 99%
Cromozom Ph (gena de fuziune BCR-ABL)
Pozitiv Negativ Negativ Negativ
Mutația JAK2 (V617TF) Negativ
Pozitiv (65 – 97%) Pozitiv (23 – 57%) Pozitiv (35 – 57%)
Studii speciale Biologie moleculară, FISH, PCR citogenetică, Eritropoietina (nivel scăzut), hematocrit crescut
Teste funcționale trombocitare (anormale) Rezonanță magnetică, imagistica măduvei osoase
Legendă: WBC = celule albe (leucocite), NRBCs = celule roșii nucleate, FAL = fosfatază alcalină leucocitară, FISH = hibridizare fluorescentă in situ, PCR = polymerase chain reaction, Ph = Philadelphia, JAK = Janus kinase gene. Intervale de referință: WBC = 5 – 11 x 109/L, trombocite = 150 – 450 x 109/L
Profesionalism. Empatie.
Analize medicale de laborator, din toate domeniile de diagnostic clinic. Suport. Încredere.
Hematologie
Biochimie
Toxicologie
Microbiologie
Boli Autoimune și Imunologie
Alergologie
Markeri Endocrini/Hormoni
Boli Infecțioase
Markeri Tumorali
Biologie Moleculară
Anatomie Patologică
Markeri Virali
Genetică
Oncogenetică
Citogenetică

www.analizeonline.ro
www.clinica-sante.ro
Tabelul 2. Caracteristici de laborator ale LGC
Sânge periferic
Leucocitoză cu neutrofilie cu forme imature pe linia mieloidă
Bazofilie/Eozinofilie
Trombocitoză
Anemie
Blaști < 10% în faza cronică
Scor FAL scăzut
LDH și acid uric crescute
Vitamina B12/transcobalamina crescute
peste 100 000/μL la 50% din bolnavi), care reflectă leucocitoză cu neutrofilie și bazofilie.
• Neutrofilele includ toată seria granulocitară, în toate gradele de maturație ale granulocitului de la segmentate/nesegmentate la mieloblaști ocazionali (sub 10%). Prezența unui procent mai mare de mielocite decât metamielocite mai mature este o constatare caracteristică. Unele granulocite sunt hipersegmentate. Majoritatea precursorilor neutrofilelor par morfologic normali, deși în boală pot fi observate celule ocazionale cu anomalie pseudo-Pelger-Huet.
• Procentul de bazofile este de 10 – 15% iar în unele situații poate depăși 40% (LGC cu bazofile); bazofilele cresc în faza accelerată și transformarea blastică. Bazofilele crescute sunt invariabil observate în LGC, astfel încât, dacă numărul absolut de bazofile nu este crescut, un diagnostic de LGC ar trebui pus serios la îndoială. Bazofilia poate preceda cu câțiva ani celelalte observații hematologice (tabelul 2).
• Creșterea numărului absolut de eozinofile și monocite este prezentă de obicei, dar nu are semnificația critică pentru diagnostic pe care o are bazofilia.
• Trombocitoza este prezentă în aprox. 50% din cazuri și este de obicei moderată (mai puțin de 1 000 000/μL). Scăderea numărului de trombocite este mai puțin frecventă, cel puțin în faza cronică, unde poate ajunge uneori la valori de 5 – 7 000 000/μL. Anizocitoza trombocitară este frecventă. În anumite faze de boală pot apare micromegacariocite sau nuclei de megacariocite în sângele periferic (la cca. 25% din pacienți).
• Anemia normocitară este, de obicei, prezentă și moderată. Severitatea anemiei este proporțională cu creșterea leucocitozei și este datorată eritroblas-
Măduva osoasă
Hiperplazie mieloidă
Blaști < 10% în faza cronică
Displazie minimă sau deloc
Megacariocite crescute
Mielofibroză moderată sau ușoară
Monocitoză < 3%
topeniei. Anizocitoza și poikilocitoza eritrocitară sunt moderate, dacriocitele fiind o expresie a hematopoiezei extramedulare cu mielofibroză.
La acestea se adaugă obligatoriu studii genetice care pot confirma diagnosticul: cromozomul Ph1 prezent (în 90 –95% din cazuri) în precursorii mieloizi, în limfocitele B și, uneori, în limfocitele T; BCR-ABL pozitiv în peste 95% din cazuri, mai ales în cele cu Ph negativ la debut.
Constatarea unei hiperleucocitoze cu devierea la stânga a seriei granulocitare alături de splenomegalie orientează diagnosticul către LGC (LMC). Un diagnostic de certitudine în LGC cere detecția translocației t(9;22)(q34.1;q11.2) și/sau gena de fuziune BCR-ABL detectate prin tehnici citogenetice de rutină.
Diagnosticul diferențial se face față de reacțiile leucemoide (infecții bacteriene sau tumori solide) unde leucocitoza cu deviere la stânga a formulei leucocitare este ușoară (mieloblaștii practic nu apar) iar scorul FAL este crescut. Diferențierea LGC față de celelalte boli mieloproliferative cronice poate întâmpina greutăți după cum vom vedea în continuare.
2. Policitemia Vera
Policitemia Vera (PV) sau policitemia rubra vera este o anomalie cronică a celulei stem hematopoietice caracterizată prin proliferarea necontrolată a celulelor eritroide, granulocitare și megacariocitare. A fost descrisă de Vasquez în 1892 și Osler în 1903 ca fiind o boală cronică caracterizată prin cianoză, policitemie și splenomagalie.
Criteriile de diagnostic pentru PV includ, în ordine:
• Creșterea volumului eritrocitar (măsurat cu hematii marcate cu 51Cr) (> 36 cc/kg la bărbați și > 32 cc/kg la femei)
• Absența cauzelor policitemiei secundare
• Splenomegalie
• Trombocitoză (50% din pacienți). Pot apare trombocite gigant cu forme bizare hipogranulare
• Leucocitoză (până la 80% din cazuri)
• Valori normale (rar) sau scăzute ale eritropoietinei
• Scor FAL crescut în 70% din cazuri
• NRBC, poikilocitoza adesea prezente
• Măduva osoasă prezintă hiperplazie, creșterea eritropoiezei și mielopoiezei, creșterea megacariocitelor, fibroză. În 2008 OMS a stabilit noi criterii de diagnostic:
• Criterii majore care includ, printre altele, Hgb > 18,5 g/dL la bărbați și > 16,5 g/dL la femei (cel mai important) sau Hgb / Hct > 99% din intervalul de referință în funcție de sex, vârstă sau altitudinea de reședință (false poliglobulii), în absența vreunui tratament cu fier, saturația cu oxigen a sângelui arterial > 92% precum și prezența mutației JAK2V617F sau a unei mutații similare.
• Criterii minore care includ date despre măduva osoasă (mieloproliferare), nivelul de eritropoietină scăzut, colonii eritroide endogene.
Diagnosticul de PV necesită îndeplinirea fie a unor criterii majore și a unui criteriu minor, fie a primului criteriu major și a 2 criterii minore.
Cele mai importante date de laborator în PV sunt reprezentate de creșterea numărului de eritrocite, a hemoglobinei (Hgb) și a hematocritului (Hct > 58% la bărbați și 52% la femei), însoțite de o trombocitoză moderată (în 60% din cazuri) și leucocitoză (în 40% din cazuri).
Obs. Trebuie acordată atenție MCV, deoarece în PV, absența fierului poate încetini, dar nu opri producția continuă de globule roșii microcitare. Un hematocrit normal cu microcitoză marcată este practic diagnosticul pacienților cu PV, cu eritropoieză cu deficit de fier secundară pierderii de sânge gastrointestinal, care este frecventă la pacienții cu PV.
De menționat că agregarea trombocitară la ADP, epinefrină, colagen este diminuată, sugestiv în PV, iar nivelul plasmatic de beta-tromboglobulină și factor plachetar 4 este crescut.
Screeningul coagulării oferă teste normale (APTT, PT, TT și Fbg). Cînd hematocritul este crescut > 55% este necesară o rectificare a raportului anticoagulant (citrat) / sânge venos având în vedere re-


Portofoliul nostru este acum complet
Meriți să ai echipamente de laborator de top pentru a te asigura că operațiunile de separare decurg fără probleme. Scopul nostru este să îți oferim soluții care să se potrivească perfect cu cerințele tale: de la microcentrifuge și centrifuge benchtop, la centrifuge de mare viteză și ultracentrifuge. Portofoliul nostru larg oferă acum soluții complete în domeniile biologiei moleculare, biochimiei și biologiei celulare.




Transferi adesea probe între diferite tipuri de recipiente și îți dorești soluții mai eficiente și sigure?
Pipeta noastră, Move It, cu spațiere ajustabilă a vârfurilor, îți ușurează și accelerează procesul de pipetare a mai multor probe simultan. Designul său unic, fără tubulatură internă interconectată, îmbunătățește precizia și durabilitatea, asigurând în același timp siguranța ta și a probelor.
ducerea volumului plasmatic, ceea ce se poate reflecta, în particular, într-o valoare APTT prelungită. Corecția cantității de citrat se face după formula:
V(100 – Hct)
C = , unde C = anticoagulant în ml, V = volum de sânge, Hct = hematocrit. 595 – Hct
Diagnosticul diferențial între PV primară și policitemia secundară poate să nu fie întotdeauna așa simplu. Spre deosebire de policitemie, PV este o panmielopatie și este, de obicei, asociată cu trombocitoză și leucocitoză.
3. Trombocitemia esențială
TE (trombocitemia primară, trombocitemia hemoragică) este o boală clonală a celulei stem, caracterizată prin trombocitoza persistentă (în absența altei boli mieloide cronice sau altei cauze de trombocitoză reactivă) asociată cu funcție trombocitară anormală și risc hemoragic. Descrisă în 1920 de Gugliemo și de Epstein și Goedel în 1934, abia în 1960, trombocitemia esențială a fost certificată ca o entitate de boală separată pe o bază clinicopatologică.
Ghidul de diagnostic elaborat la mijlocul anilor ꞌ70 include:
• Trombocitoză > 600 x 109/L (în general mai mare de 1000 x 109/L)
• Măduvaă osoasă cu hiperplazie megacariocitară
• Absența unor cauze identificabile de trombocitoză reactivă
• Absența cromozomului Ph
• Hemoglobina ≤ 13 g/L sau volum eritrocitar normal
• Absența unei fibroze medulare semnificative
• Eșecul de a răspunde la suplimentele orale de fier.
În 2008 OMS a stabilit noi criterii majore pentru diagnosticul TE fiind necesară îndeplinirea tuturor celor patru elemente ale algoritmului:
1. Număr de trombocite ≥ 450 x 109/L
2. Proliferare megacariocitară cu morfologie matură și mari. Lipsa / proliferare redusă granulocite sau celule roșii
3. Nu se regăsesc criterii pentru diagnosticul LMC, PV, sindroame mielodisplazice sau alte neoplasme mieloide
4. Demonstrarea prezenței mutației JAK2V617F sau a altor markeri clonali și lipsa dovezilor pentru trombocitoza reactivă.
Frotiul de sânge periferic în TE pre-
zintă caracteristici evidente precum o trombocitoză marcată cu trombocite variind ca mărime până la celule gigant. Pe lângă anizocitoză (corelată cu indicele PDW), trombocitele pot fi agregate, cu ganulație anormală și pot apare fragmente de megacariocite. Examenul citomorfologic este obligatoriu pentru a corecta erorile ce apar la numărătoarea automată a trombocitelor.
O anemie ușoară, normocitară și normocromă poate fi prezentă la 50% din pacienți cu valori ale Hgb până la 10 g/ dL. Sângerările recurente ale mucoasei sau gastrointestinale duc la anemie feriprivă, cu valori ale MCV și MCHC scăzute. Morfologia eritrocitară include poikilocitoză cu acantocite, celule în țintă, prezența corpilor Howell-Jolly și corpi Pappenheimer. Leucocitoza poate fi prezentă (valori ≤ 50 x 109/L) cu neutrofilie dar valori moderate ale eozinofiliei și bazofiliei. Rareori apar celule roșii nucleate sau granulocite imature.
Cu toate că analiza funcției trombocitare are rezultate adesea anormale (agregare, factor 3 plachetar, adezivitate) acest fapt nu este suficient pentru diagnosticul diferențial. TE trebuie diferențiată de trombocitoza reactivă care poate avea diverse cauze (hemoragie acută, postoperator, postsplenectomie, boli maligne, infecții/ inflamații cronice, abuz de medicamente anemie hemolitică, anemie feriprivă etc.).
4. Metaplazia mieloidă cu mielofiboză
MMM sau mielofibroza idiopatică (MFI) a fost descrisă de Heuck în 1879 la un pacient de 24 ani cu fatigabilitate severă de un an, anemie severă, leucocitoză cu granulocite imature și hepatosplenomegalie marcată. Autopsia a arătat osteoscleroză severă și hematopoieză extramedulară. MFI a fost catalogată ca boală mieloproliferativă în 1951.
MMM este caracterizată printr-o triadă clasică:
1. Fiboză medulară, la început zonală și mai târziu larg răspândită, care poate fi însoțită sau nu de scleroză osoasă
2. Hematopoieză extramedulară sau metaplazie mieloidă la nivelul splinei și ficatului, cu risc moderat/major de splenomegalie și hepatomegalie
3. Leucoeritroblastoză și poikilocitoză cu dacriocite în sângele periferic.
La aceste elemente de diagnostic au mai fost adăugate absența creșterii masei
eritrocitare, absența cromozomului Ph și excluderea unor dezordini sistemice. În plus, un diagnostic de osteomieloscleroză care necesită prezența modificărilor sclerotice detectate radiologic în oasele lungi ale scheletului axial.
Actualizarea acestor criterii de către OMS a dus la elaborarea a patru criterii clinice, legate de gradul de anemie, splenomegalie, leucoeritroblastoză ș.a. și a unui criteriu patologic care implică mieloproliferarea megacariocitară și granulocitară și relativa reducere a precursorilor eritroizi și a stabilit stadiile fibrozei medulare, criterii față de care se stabilesc stadiile MMM.
Datele de laborator pun în evidență o anemie normocitară, normocromă (50 – 90% din pacienți) cu un procent scăzut (25%) de pacienți care prezintă o anemie severă (Hgb ≤ 8 gL), cu cauze multifactoriale. Anizocitoză cu poikilocitoză eritrocitară (dacriocite) și eritroblaști. Numărul de reticulocite este frecvent crescut. Leucocitoză moderată (la 50% din pacienți), uneori cu leucopenie (15%). Devierea la stânga a formulei leucocitare este mai puțin pronunțată dacât în LGC. Apar trombocite gigant cu anomalii de granulație iar în periferie pot apare nuclei de megacariocite sau micromegacariocite circulante. Datorită fibrozei medulare amprenta-aspirat este deseori albă. Diagnosticul diferențial se face față de alte boli din spectrul mieloproliferărilor cronice. Spre exemplu, din punct de vedere clinic, stadiul prefibrotic mimează TE. De asemenea, un procent de 15 – 20% din pacienți cunoscuți cu PV suferă o tranziție către mielofibroză, cu anemie marcată și splenomegalie progresivă. Trebuiesc avute în vedere și alte afecțiuni care pot produce mielofibroze secundare precum unele boli autoimune (lupus eritematos, sclerodermie) sau mielomul multiplu.
Bibliografie selectivă
4. Mut Popescu Delia - Hematologie clinică. Ed. Medicală, 1999
5. Lupu Anca Roxana - Bazele hematologiei clinice. Ed. MAST, 2003
6. Cecil Textbook of Medicine, Ed. Wyngarden, Smith Binnet, Ed. Saunders, 1992
7. Hoffman R., Benz EJ., Shatil SJ. et al – Hematology-Basic Principles and Practice, second edition.
8. Petrov L., Cucuianu A. – Manual de hematologie clinică, Casa Cărții de știință, 1994
9. Harrison – Principles of Internal Medicine, Mc. Graw Hill Inc., 1900



















Un act medical de cea mai bună calitate este dependent şi de aparatura şi consumabilele medicale utilizate. De aceea, la MedAZ vă punem la dispoziție o ofertă generoasă de produse şi consumabile
consumabile medicale şi de laborator cu experiență. Echipa noastră vă oferă tot suportul necesar pentru achiziționarea produselor de
Asigurăm calitatea şi diversitatea produselor, prețuri accesibile şi oferte avantajoase.
Suntem atenți la nevoile şi la dorințele tale şi venim în sprijinul actului medical cu o gamă variată de produse şi consumabile medicale de calitate excepțională. Răspundem cu promptitudine
soluții pentru reuşita în activitatea desfăşurată.
L a MedAZ – consumabile medicale de la A la Z, găsiți, aşa cum sugerează şi numele, consumabile medicale de la A la Z. Fie că
sutură, produse chirurgicale, măşti de protecție, halate medicale, recipiente pentru prelevarea şi depozitarea probelor biologice, seringi, ace sau branule, aici găsiți soluția integrată. Dispunem de consumabile medicale pentru orice fel de spațiu, domeniu medical.
Asigurăm promptitudine în preluarea comenzilor, tot suportul de care ai nevoie la alegerea produselor şi realizarea comenzii, disponibilitatea produselor, seriozitate şi profesionalism.
Vă invităm să consultați portofoliul nostru de produse pentru a vă convinge de calitatea şi diversitatea produselor noastre şi vă aşteptăm cu drag comenzile.




1000 teste fotometrice/oră, până la 1.200 de teste/oră cu ISE
Modul ISE integrat
HbA1c din sânge integral
Scoatere automată dopuri la bord
D e z i n f e c ț i e U V


• Spălarea automată cu ultrasunete a sondei pentru probă
• Îndepărtarea automată a bulelor din flaconul de reac�vi

Posibilitate de integrare cu CL 2600i ⇒ Sistem Modular M980

Modul automat ESR integrat într-un analizor hematologic, cu autoloader
Generează ambele rezultate CBC și ESR într-un singur test în decurs de 1,5 min.
NOU: parametru de măsurare: RETICULOCITE
Parametri hematologici u�li : PLT -I, PLT-H, PLT-O, NRBC, IPF, LFR, MFR.
Analizor Automat Biochimie Sediul central: Hunedoara. B-dul Dacia, Nr. 28A, Jud. Hunedoara Sediul secundar: București. Piața Alba Iulia, Nr. 7, Sector 3









Armonie cu utilizatorul •
Suprafata optimizata



Modular �i sea/obi/ •

Spafiu ergonomic

Longevitatea sistemului




