REMEDIACIÓN DE MICOTOXINAS EMERGENTES

MEDIANTE UN PRODUCTO

Las micotoxinas son metabolitos secundarios producidos por especies fúngicas en alimentos y piensos, principalmente Aspergillus, Fusarium y Penicillium sp.
Por lo general, la mayoría de la gente piensa en seis micotoxinas principales que contaminan los piensos:
Aflatoxinas
Deoxinivalenol (DON)
Toxina T-2
Fumonisinas
Ocratoxinas
Zearalenona
Los principales efectos de estas toxinas sobre el rendimiento y la salud de los animales de producción son conocidos y existen directrices reglamentarias sobre los niveles umbral de estas toxinas en los alimentos y piensos.

Las pruebas y los informes sobre la prevalencia de micotoxinas en los piensos han aumentado en los últimos años, pero muchas siguen sin detectarse
Sin duda, un tema cada vez más preocupante son las MICOTOXINAS EMERGENTES
Al igual que el DON, la toxina T-2 y la zearalenona, las micotoxinas emergentes también son producidas habitualmente por diversas especies de Fusarium
2
en los piensos con las micotoxinas principales (GruberDorninger, C. et al., 2017; Ekwomadu, T. I. et al., 2020).
Las investigaciones señalan que las micotoxinas emergentes se están convirtiendo rápidamente en co-contaminantes prevalentes en granos para piensos (maíz, trigo, cebada, etc.) que contienen otras micotoxinas de Fusarium (Gruber-Dorninger, C. et al., 2017; Ekwomadu, T. I. et al., 2020; Jestoi, M., 2008).

Por ejemplo, un estudio reciente reveló que el maíz recogido en todo EE.UU. contenía un promedio de 7,5 micotoxinas y que el 90,3% y el 97,1% de las muestras contenían DON y micotoxinas emergentes, respectivamente (Shike J, 2020a).
Recientemente, un estudio sobre el maíz llevado a cabo por PATENT CO DOO., Serbia, en 2022, también demostró una mayor ocurrencia de micotoxinas emergentes en el maíz.
Para más información leer Mayor prevalencia de Fumonisinas y Ácido fusárico en el maíz cosechado en 2022
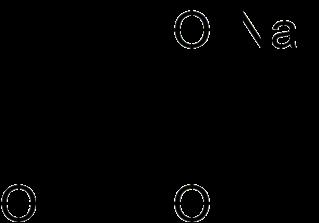
Micotoxinas emergentes - Los sospechosos habituales Ácido fusárico
El ácido fusárico (FA) es una micotoxina producida por especies de Fusarium que ha demostrado tener efectos sinérgicos (mayor toxicidad e impacto potencial en el ganado) en combinación con:
Tricotecenos (toxinas de Fusarium, incluyendo DON, toxinas T2/HT2, etc.)
Fumonisinas
Zearalenona
Aflatoxinas

3
Figura 1. Estructura química del ácido fusárico.
Enniatinas
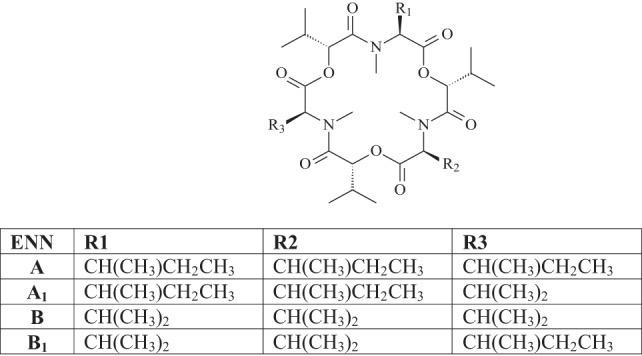
Las enniatinas (ENNs) son producidas por múltiples mohos Fusarium, incluyendo F. avenaceum, F. oxysporum y F. tricinctum.


Hasta la fecha, se han identificado 29 ENNs diferentes en granos de cereales, de los cuales ENN A, A1, B y B1 son los detectados con mayor frecuencia.
La toxicidad de las ENNs deriva de sus propiedades ionóforas que les permite transportar cationes a través de las membranas, alterando así los niveles fisiológicos de iones (Gruber-Dorninger, C. et al., 2017).
Aunque las ENNs son tóxicas in vitro, las investigaciones sugieren que se metabolizan rápidamente in vivo, lo que limita su toxicidad (Jestoi, M., 2008).
A CH(CH3)CH2CH3 CH(CH3)CH2CH3 CH(CH3)CH2CH3
A1 CH(CH3)CH2CH3 CH(CH3)CH2CH3 CH(CH3)2
B CH(CH3)2 CH(CH3)2 CH(CH3)2
B1 CH(CH3)2 CH(CH3)2 CH(CH3)CH2CH3
4
ENN R1 R2 R3
Figura 2. Estructura química de las enniatinas.
Beauvericina

Al igual que las ENNs, la toxicidad de la beauvericina (BEA) se deriva de su naturaleza ionófora
Producida por F. proliferatum y F. verticillioides se ha observado que BEA co-ocurre con:
ENNs en trigo
Fumonisina B1 en maíz
DON, zearalenona y toxina T-2 en cebada (Jestoi, M., 2008)
Aunque se ha observado que la BEA se acumula en la yema de huevo, los pollos de engorde alimentados con dietas que contienen 2,5 ppm, no han mostrado una disminución significativa en el rendimiento (GruberDorninger, C. et al., 2017; Ramos et al., 1996).
5
Figura 3. Estructura química de la beauvericina.
Moniliformina
La moniliformina es una micotoxina altamente polar producida por muchas especies de Fusarium, así como por Penicillium melanoconidium, inhibiendo las enzimas del ciclo del ácido tricarboxílico (TCA), alterando así el metabolismo celular.
El músculo cardiaco es la principal diana de la MON in vivo y las aves de corral expuestas a la MON presentan daños cardiacos, deterioro de la función inmunitaria y disminución del rendimiento.
En general, en comparación con otras micotoxinas emergentes, se espera que la MON tenga una mayor toxicidad aguda (Jestoi, M., 2008).

6
Figura 4 Estructura química de la moniliformina.
MycoRaid - Un aliado eficaz contra las micotoxinas emergentes

MycoRaid es un producto premium de remediación de micotoxinas desarrollado por PATENT CO para la biorremediación de micotoxinas polares y no polares.
El siguiente informe muestra los resultados de adsorción (pH 3,0) y desorción (pH 6,5) de MycoRaid para micotoxinas emergentes.
Metodología Análisis de adsorción
Para probar la eficacia de MycoRaid frente a las micotoxinas emergentes, se añadieron 100 mg del producto de remediación de micotoxinas a tubos Falcon de 15 ml (tubos de prueba) con:
10 ml de tampón fosfato 0,1 M ajustado a pH 3,0.
2 ppm de las micotoxinas emergentes analizadas:
MON, FA, ENN A, ENN A1, ENN B, ENN B1, o BEA.
Para medir las pérdidas debidas a uniones inespecíficas y eliminar los picos exógenos, se preparó un control añadiendo 10 ml de solución tampón fosfato 0,1 M a pH 3 y el producto de remediación de micotoxinas a un tubo Falcon separado.
Los tubos se colocaron en un agitador rotatorio durante 30 o 60 minutos a 37 °C. Tras la incubación, las muestras se centrifugaron (muestra de ensayo y muestra de control) a 4200 rpm durante 5 minutos.
Las muestras y los controles se analizaron por LC-MS/MS utilizando una alícuota de la solución original de micotoxinas tamponada a pH 3 como patrón para cada micotoxina.
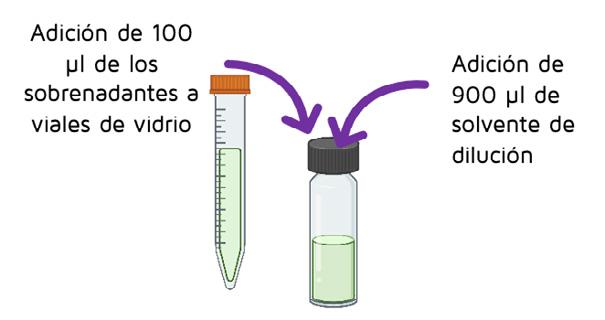
Se llevaron 100 µl del sobrenadante a un vial de vidrio y se añadieron 900 µl de disolvente de dilución (50% acetonitrilo:50% agua y 0,1% ácido fórmico).
7
Análisis de adsorción














TUBOS DE PRUEBA CON
• 10 ml 0,1 M tampón fosfato (pH 3)
• 2 ppm MON 10 ml 0,1 M tampón fosfato (pH 3)
• 2 ppm FA
• 10 ml 0,1 M tampón fosfato (pH 3)
• 2 ppm ENN A 10 ml 0,1 M tampón fosfato (pH 3)
• 2 ppm ENN A1

10 ml 0,1 M tampón
0 mg MycoRaid
l 0,1 M tampón
0 mg MycoRaid
l 0,1 M tampón
0 mg MycoRaid
• 10 ml 0,1 M tampón fosfato (pH 3) 100 mg MycoRaid


2.INCUBACIÓN Y CENTRIFUGACIÓN DE LOS TUBOS ESTÁNDAR, DE PRUEBA Y DE CONTROL
30-60 min a 37 oC
l 0,1 M tampón
1
100 mg MycoRaid
4200 rpm durante 5min
3.PREPARACIÓN PARA EL ANÁLISIS LC-MS/MS
Adición de 100 µl de los sobrenadantes a viales de vidrio
Adición de 900 µl de solvente de dilución
4.DETECCIÓN DE MICOTOXINAS EN MUESTRAS DE PRUEBA, CONTROL Y ESTÁNDAR MEDIANTE LC-MS/MS
MUESTRAS DE SOLUCIÓN ESTÁNDAR DE MICOTOXINAS
• 10 ml 0,1 M tampón fosfato (pH 3)
• 2 ppm ENN BEA
10 ml 0,1 M tampón NN BEA
0 mg MycoRaid
MUESTRAS DE PRUEBA DE MYCORAID MUESTRA CONTROL
8
Análisis de desorción
Para determinar la tasa de desorción de las muestras, se eliminó el sobrenadante de los tubos Falcon de prueba y de control restantes, y se resuspendieron los pellets del producto de remediación de micotoxinas en 4 ml de solución amortiguadora de pH 6,5.
Los tubos se colocaron en un agitador rotatorio durante 30 minutos a 37 °C y, tras la incubación, las (muestras de ensayo y de control se centrifugaron a 4200 rpm durante 5 minutos.
Se llevaron 500 µl del sobrenadante a un vial de vidrio, donde se añadieron 500 µl de disolvente de dilución (ácido fórmico al 0,2% en acetonitrilo).
A continuación, se pipeteó aproximadamente 1 ml de los sobrenadantes en viales de muestra para el análisis por LC-MS/MS, y las muestras de prueba y los controles se analizaron por LC-MS/MS.
Análisis de desorción

1.PREPARACIÓN DE MUESTRAS
2.INCUBACIÓN Y CENTRIFUGACIÓN DE LOS TUBOS DE PRUEBA Y DE CONTROL
Resuspensión de los pellets con 4 ml de solución tampón a pH 6,5

4.DETECCIÓN DE MICOTOXINAS EN MUESTRAS DE PRUEBA, CONTROL Y ESTÁNDAR MEDIANTE LC-MS/MS
3.PREPARACIÓN PARA EL ANÁLISIS LC-MS/MS
Adición de 500 µl de los sobrenadantes a viales de vidrio
Adición de 500 µl de solución de dilución

9
30 min a 37 oC 4200 rpm durante 5min
TUBOS DE PRUEBA CON MYCORAID TUBO CONTROL
Cálculos
La eficacia de unión del producto de remediación de micotoxinas se determinó midiendo la concentración de cada micotoxina en la solución y calculando el porcentaje (%) de micotoxina unida.
Determinación de la tasa de ADSORCIÓN de micotoxinas (%)
La eficacia de unión del producto de remediación de micotoxinas se determinó midiendo la concentración de micotoxinas en la solución y calculando el porcentaje (%) de micotoxinas unidas.
Adsorción (%) = (valor HPLC de control-valor HPLC de muestra) x100 (valor HPLC de control)
Determinación de la tasa de DESORCIÓN de micotoxinas (%)
Para calcular la tasa de desorción de micotoxinas:
1. En primer lugar, se determinó la cantidad de cada micotoxina unida a la arcilla (µg) calculando la diferencia entre la concentración inicial de micotoxinas a pH 3,0 (m pH 3,0 inicio) y la concentración final de micotoxinas a pH 3,0 (m pH 3,0 fin):
Cantidad de micotoxina ligada a la arcilla (µg) =m pH 3,0 inicio- m pH 3,0 fin donde:
• m pH 3,0 inicial: cantidad de cada micotoxina en los tubos Falcon con una concentración inicial de 20 µg (2ppm)
• m pH 3,0 final: cantidad de cada micotoxina en los tubos Falcon a pH 3,0 tras 60 minutos de incubación (µg)
2. En segundo lugar, se calculó la tasa final de desorción de micotoxinas mediante la siguiente fórmula:
Micotoxina desorbida (%) = (m DES pH 6.5-m DES pH 6.5 CONTROL) x100 (Cantidad de micotoxina ligada a la arcilla)

Resultados
La eficacia global de MycoRaid frente a las micotoxinas emergentes se muestra en la Figura 1
Se calculó utilizando los datos de adsorción y desorción y los resultados demuestran su capacidad efectiva de unión a micotoxinas.
10
Los resultados de la Figura 1 demuestran que MycoRaid puede eliminar eficazmente el 56% de MON, el 89% de BEA y más del 95% de ácido fusárico y enniatins.
CONCLUSIONES
Debido a la falta de información sobre la toxicidad y la prevalencia de las micotoxinas emergentes, es difícil evaluar su papel en la salud y el rendimiento de los animales.
Sin embargo, es probable que las micotoxinas emergentes co-ocurran con las principales micotoxinas que contaminan los cereales utilizados en la producción ganadera y, por lo tanto, debe adoptarse una estrategia de remediación para reducir su transferencia de los animales a los seres humanos.

11
% Eficacia MonilforminaÁcidofusárico EnniatinaB Beauvericin EnniatinaB1 EnniatinaA EnniatinaA1 100 Micotoxinas analizadas 80 60 40 56 97 97 97 99 99 89 20 10 0
Figura 1. Eficacia de MycoRaid frente a las micotoxinas emergentes.
REFERENCIAS
Gruber-Dorninger, C. et al. (2017). Emerging mycotoxins: beyond traditionally determined food contaminants. J Agri Food chem, 65: 7052-7070.
Ekwomadu, T. I. et al. (2020). Variation of Fusarium free, masked, and emerging mycotoxin metabolites in maize form agriculture regions of south Africa, Toxins, 12(149); doi:10.3390/ toxins12030149.
Jestoi, M. (2008). Emerging Fusarium-mycotoxins fusaproliferin, beauvericin, enniatins, and moniliformin – a review. Critical Reviews in Food Science and Nutrition, 48:1, 21-49.

Shike, J. (2020a) Continue testing for Mycotoxins, Pork Business. Available at: https://www. porkbusiness.com/news/hog-production/continue-testing-mycotoxins
Raj, J. et al. (2023). Higher prevalence of Fumonisins and Fusaric acid in 2022 harvested corn, Mycotoxinsite. Available at: https://mycotoxinsite.com/higher-prevalence-fumonisins-fusaric-acid-2022-harvested-corn/?lang=en
Ramos, A.J., Fink-Gremmels, J., and Hernández E. (1996). Prevention of toxic effects of mycotoxins by means of nonnutritive mycotoxin remediation product compounds. J. Food Protection, 59(6):631-641.
12






























