40 minute read
evaluaCión del ConfliCto de ConservaCión la aCuiCul
Evaluación del conflicto de conservación: ¿La acuicultura de ostras entre mareas inhibe el comportamiento de búsqueda de alimento de las aves playeras migratorias?
La conservación está cada vez más en conflicto con las actividades humanas debido al crecimiento de la población humana mundial, particularmente en áreas que albergan especies amenazadas.
Los conflictos a menudo impiden la implementación efectiva de las medidas de conservación necesarias y también tienen implicaciones para la desigualdad social, el uso de recursos y el desarrollo económico. La acuicultura de moluscos bivalvos se considera comúnmente una de las formas de producción de proteínas menos impactantes en todo el mundo, pero, en algunos lugares, puede interferir con las actividades esenciales de especies amenazadas, como la ecología de escala de las aves playeras migratorias. Aquí evaluamos el impacto de la acuicultura de ostras como se practica en la bahía de Delaware (Nueva Jersey, EE.UU.) sobre la presencia y el comportamiento de búsqueda de alimento de especies migratorias de aves playeras de interés para la conservación. Realizamos recuentos y observaciones de comportamiento de aves playeras en un 4. Un tramo de 8 km de la bahía de Delaware y probó el efecto de las estructuras y actividades acuícolas reguladas sobre la presencia de aves playeras en relación con varios factores ambientales. También evaluamos las diferencias en las tasas de picoteo promedio para cada especie dentro y fuera de las áreas de acuicultura, y examinamos múltiples factores que influyen en las tasas de alimentación de cada especie. Para todas las especies, encontramos que el cuidado de las ostras redujo la probabilidad de presencia de aves playeras en un 1-7%, mientras que las estructuras de acuicultura desatendidas no tuvieron un impacto detectable.
Las tasas de alimentación fueron influenciadas principalmente por las condiciones ambientales, particularmente la presencia de competidores (gaviotas u otras aves playeras) y el sustrato de alimentación. Ninguna de las especies focales alteró sustancialmente su presupuesto de tiempo o tasas de alimentación en presencia de la acuicultura de ostras cuidada o desatendida.
La conservación está cada vez más en conflicto con las actividades humanas debido al crecimiento de la población humana global, especialmente dentro de regiones que albergan un gran número de especies amenazadas o son puntos críticos de biodiversidad global (Jackson y Wangchuk 2001, Harvey et al. 2008, Marini et al. 2009). Estos conflictos a menudo impiden la implementación efectiva de las medidas de conservación necesarias y, debido a que a menudo tienen implicaciones para la desigualdad social, el uso de recursos y el desarrollo económico, se consideran uno de los problemas más intratables en biología de la conservación (Redpath et al. 2013). Además, existe una expansión humana continua en las áreas costeras, lo que aumenta la posibilidad de que aumenten las tasas de aparición de tales conflictos (Lockwood y Maslo 2014). Aquí evaluamos el impacto de la acuicultura de ostras entre mareas sobre la presencia y el comportamiento de alimentación de un conjunto de aves playeras que son motivo de preocupación para la conservación (Andres et al. 2012). Las aves playeras son migrantes de larga distancia que se alimentan de invertebrados de hábitats intermareales en múltiples sitios de escala en su camino hacia sus áreas de reproducción. Si las personas que migran no logran suficientemente repostaje, pueden retrasar restante movimientos migratorios (más de migración) o llegará el caldo de cultivo en tan malas condiciones enérgica que su éxito reproductivo se reduce (Inger et al. 2010, Morrison et al., 2013, Shoji et al. 2015). Estos mismos entornos intermareales ricos en recursos apoyan la producción de ostras de valor comercial con bajos insumos, lo que sostiene una creciente industria acuícola local (Jarvinen 2000). Un paso central en la búsqueda de soluciones compartidas es construir una base de evidencia en torno a los resultados de demandas conflictivas sobre este recurso compartido (Redpath et al. 2013). La bahía de Delaware, ubicada a lo largo de la costa del Atlántico medio de los EE. UU., Incluye varios hábitats críticos para aves residentes y migratorias, lo que llevó a su designación como Humedal Ramsar de Importancia Internacional, Área Importante para las Aves de Audubon y su inclusión dentro de las aves playeras del hemisferio occidental Reserve Network y el Programa Nacional de Estuarios de la Agencia de Protección Ambiental de EE. UU. Las playas intermareales y las marismas de la bahía de Delaware son sitios de parada críticos para varias especies de aves playeras en declive a nivel mundial, incluida la subespecie rufa del nudo rojo Calidris canutus rufa, la rojiza Arenaria interpres, el sanderling C. alba y la lavandera semipalmeada C. pusilla. Estas especies visitan la bahía de Delaware durante su migración de primavera hacia el norte desde sus zonas de invernada y dependen en gran medida de los huevos ricos en lípidos depositados por los cangrejos herradura (Limulus polyphemus) en desove para ganar suficiente peso para completar su migración y comenzar su temporada de reproducción en el Ártico (Clark et al. 1993, Botton et al. 1994, Duijns et
al. 2017). Los cangrejos de herradura huevos de depósito sobre una ventana de 3 a 7 semanas cada resorte (Smith et al. 2002), y el momento de estas migraciones de aves playeras típicamente les permite tomar ventaja de esta fuente de alimento con energía recompensar durante el período breve de su parada (Tsipoura y Burger 1999, Niles et al. 2014). Los nudos rojos se clasificaron como en peligro de extinción en Canadá en 2007, y amenazados bajo la Ley de Especies en Peligro de EE. UU. En 2015 debido a múltiples amenazas (McGowan et al. 2015, Wikelski y Tertitski 2016). Un factor importante que contribuye a la recuperación de la población del nudo rojo es la abundancia de huevos de cangrejo herradura en la bahía de Delaware (Baker et al. 2004, McGowan et al. 2011, Loveland y Botton 2015). Mientras nudos rojos han recibido la mayor atención conservación, varios playeros adicionales dependen en gran medida de los huevos de cangrejo herradura durante su escala en la bahía de Delaware (Gillings et al. 2007, Mizrahi y Peters 2009, pero ver a Tucker et al. 2019) y también han experimentado disminuciones notables que se han asociado con la reducción de huevos de cangrejo herradura (Haramis et al. 2007). La acuicultura es el segmento de la agricultura de más rápido crecimiento en el mundo, y la producción ahora equivale a la producción pesquera a nivel mundial (FAO 2018). La acuicultura comercial de ostras intermareales (en adelante, ostras) se practica en muchos continentes y es una industria floreciente en los EE. UU., Con la producción en algunos estados apenas comenzando a estabilizarse después de una década de crecimiento exponencial (Hudson 2018). A diferencia de otras formas de acuicultura, ostricultura típicamente no requiere la adición de alimentos, fertilizantes, antibióticos o pesticidas, por lo que es una fuente relativamente ambientalmente benigna de proteínas de la dieta (Hilborn et al. 2018). Las estructuras utilizadas para cultivar ostras pueden funcionar como arrecifes artificiales que inicialmente están poblados de ostras y posteriormente colonizados por una amplia gama de especies que incluyen algas, invertebrados y vertebrados, tanto móviles como sésiles (Dealteris et al. 2004). El cultivo de ostras generalmente involucra sistemas de rejillas y bolsas (o caballetes) que se colocan directamente en los llanos de arena intermareales con pequeñas alteraciones directas al sustrato o al área circundante. La sobrecolonización de algunos organismos provoca incrustaciones que pueden ralentizar el crecimiento y reducir la supervivencia de las ostras. Por lo tanto, se requiere el mantenimiento de rutina de las bolsas de ostras (generalmente mediante lavado a presión) para evitar que las incrustaciones impidan el flujo de agua a las ostras. La pérdida o degradación del hábitat ave costera intermareal es una causa significativa de ave costera migratoria declina globalmente (Stillman et al. 2005, Murray et al. 2014, Piersma et al. 2016, Studds et al. 2017, Weiser et al. 2017). En algunas áreas, se ha demostrado que el cultivo intensivo de mariscos agota los recursos de presas (Stillman et al. 2001, Goss ‐ Custard et al. 2004). Donde la cosecha directa no se produce, las prácticas de la ostricultura pueden afectar las poblaciones de aves playeras a través del desplazamiento de las aves playeras del recinto primer forrajeo (Gittings y O'Donoghue 2012, Szabo et al. 2016). Bastidores también podrían excluir físicamente aves costeras de zonas de alimentación entre y debajo de ellos (Kelly et al. 1996), o las actividades que tienden (es decir, la limpieza, la cosecha) podrían también potencialmente generar suficiente perturbación para excluir conductualmente aves tanto desde dentro de la huella del sistema bastidor, así como el área circundante (Kelly 2001, Forrest et al. 2009). Es posible que las aves playeras no abandonen el área por completo, sino que experimenten tasas de alimentación reducidas debido a la alteración del hábitat bentónico (Connolly y Colwell 2005), mayor vigilancia y otros comportamientos de evitación de depredadores de las aves forrajeras (Thomas et al. 2003) o hacinamiento de aves desplazadas por el bastidores y cultivadores (Kelly 2001). En algunas condiciones, las aves pueden simplemente evitar los criaderos de ostras cuando hay otro hábitat de alimentación adecuado cerca (Burger y Niles 2017). Alternativamente, ostricultura podría impactar positivamente aves costeras mediante el aumento de la disponibilidad de los taxones presas bentónicas u otro (Escapa et al. 2004), o por las ostras cultivadas (o las especies de invertebrados utilizando bastidores de ostras) que sirve con sus mismos recursos presa (Caldow et al. 2003, Žydelis et al. 2009). De hecho, algunos estudios han demostrado un aumento de la búsqueda de alimento de las aves playeras alrededor de las operaciones de acuicultura intermareal (Hilgerloh et al. 2001, Connolly y Colwell 2005, Lehnen y Krementz 2013). Por último, el cultivo de ostras puede considerarse una industria neutral en la que el uso del hábitat y las tasas de alimentación no se ven afectados (Hilgerloh et al. 2001). Aquí evaluamos el impacto del cultivo de ostras como se practica en operaciones de sacos y rejillas intermareales de la bahía de Delaware sobre la presencia y el comportamiento de alimentación de nudos rojos, pilares rojizos, lavanderas semipalmadas y arenillas. Nuestro enfoque en el comportamiento de búsqueda de alimento refleja la necesidad de que estas aves playeras obtengan rápidamente suficientes reservas de energía para el resto de su migración. Las alteraciones del comportamiento suelen ser señales de alerta temprana de cambios perjudiciales en las tasas demográficas clave, incluida la reproducción y la supervivencia (Greggor et al. 2016). Específicamente preguntamos si la presencia y las tasas de alimentación de estas aves playeras en las planicies de marea se alteran debido a la presencia de ostras o actividades de cuidado de ostras. La menor presencia de aves playeras en el hábitat intermareal cerca de los sitios de cultivo de ostras en relación con las áreas sin cultivo de ostras sugeriría que las aves playeras evitan los criaderos de ostras y / o las actividades de cuidado. Por el contrario, una presencia igual o mayor de aves playeras en el hábitat intermareal cerca de la ostras puede sugerir que las aves playeras se sienten atraídas por las áreas de acuicultura (es decir, los bastidores proporcionan microhábitat para los invertebrados bentónicos; Erbland y Ozbay 2008 ) o que las aves playeras que llegan a la bahía de Delaware están tomando más riesgos (al alimentarse cerca de criaderos de ostras o productores de ostras) debido a que sus reservas de energía se agotaron después de la migración (Houston y McNamara 1982, Myers 1983 ). En el último caso, la cuantificación de las diferencias en las tasas medias de picoteo como un índice de la energía de búsqueda de alimento podría proporcionar más información sobre el impacto general del cultivo de ostras en las aves playeras que utilizan el hábitat intermareal para reabastecerse de combustible en las escalas.

Métodos
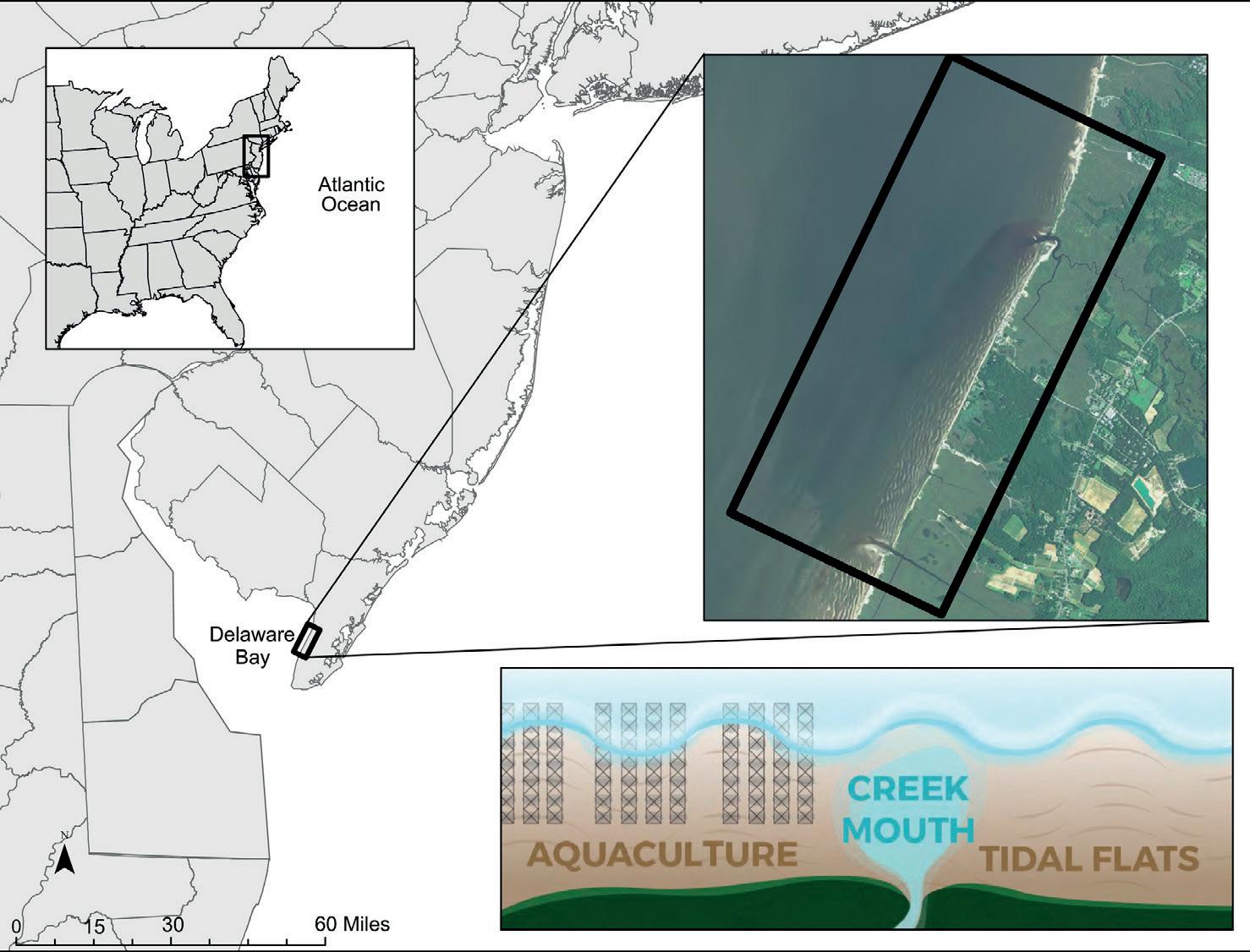
En 2016 y 2017, se realizaron observaciones de comportamiento de búsqueda de alimento nudos rojos, vuelvepiedras rojizos, Calidris pusilla, y sanderlings a través de 4,8 km de largo de la bahía de Delaware, EE.UU. extiende desde Kimbles playa al sur de Green Creek (Fig. 1). Separamos el área de estudio en tres zonas distintas, según las condiciones de los hábitats intermareales que se extienden perpendicularmente a la costa: zonas de acuicultura, desembocaduras de arroyos y marismas. Clasificamos las zonas de acuicultura como hábitats intermareales que se extienden ~ 90 m en cada dirección cardinal desde el borde de un sistema de rejillas y bolsas, que sigue la definición reglamentaria de tales zonas según lo designado por el Servicio de Pesca y Vida Silvestre de los Estados Unidos (USFWS 2016). Nuestra área de estudio incluyó cinco zonas de acuicultura distintas (que representan el 13% del área total de estudio), que incluían arrendamientos privados y otros estantes atendidos dentro de la Zona de Desarrollo de Acuicultura del Departamento de Protección Ambiental de Nueva Jersey. Clasificamos las desembocaduras de arroyos como áreas de drenaje de arroyos de marea rodeadas de bancos de arena y bancos de arena; el área de estudio contenía cuatro desembocaduras de arroyos. Clasificamos las áreas intermareales restantes como marismas sin acuicultura. Las desembocaduras de los arroyos se consideran un hábitat de alimentación de alta calidad para las aves playeras migratorias debido al intercambio de nutrientes de los arroyos de marea y la acumulación de huevos de cangrejo herradura (Botton et al. 1994), lo que sirve como línea de base para comparar las tasas de alimentación dentro de la acuicultura. zonas y otros hábitats intermareales.
Conteos de bandadas de aves playeras
Del 4 de mayo al 5 de junio en ambos meses de estudio, realizamos tres conteos diarios (2 h por conteo) de toda el área de estudio para determinar el número y la ubicación de las bandadas de aves playeras presentes. Los conteos de aves playeras ocurrieron diariamente entre las 06: 00-21: 00 y fueron programados para capturar la marea baja, definida como el período de 2.5 horas a cada lado de la marea baja predicha diaria. Es durante este tiempo que los ostreros quedan expuestos al agua y, por lo tanto, están presentes en el paisaje y pueden ser detectados por las aves. También abarca el intervalo de tiempo de 4 h (2 h a cada lado de la marea baja) cuando el personal de cultivo de ostras está legalmente autorizado a iniciar y completar todas las actividades de cuidado. Por recuentos, Las zonas de hábitat intermareal se subdividieron en segmentos de 30 m que se extendían perpendicularmente
FIGURA 1 El estudio se llevó a cabo a lo largo de un tramo de 4,8 km de la bahía de Delaware, Nueva Jersey, EE. UU., Que se extiende desde la playa de Kimbles al sur hasta Green Creek. Las observaciones ocurrieron en tres zonas distintas (acuicultura, desembocadura del arroyo, planicie de marea), según las condiciones de la zona intermareal que se extiende perpendicular a la costa. Las zonas de acuicultura incluían áreas de amortiguamiento que se extendían ~ 90 m en cada dirección cardinal desde el borde de un sistema de cesta y bolsa de ostras.
desde la línea media de la marea alta hasta ~ 100-200 m en la sección norte más estrecha hasta ~ 375 m en las porciones más anchas de la sección sur. Esta subdivisión permitió una resolución más alta para determinar, para cada especie de aves playeras, una probabilidad de presencia para una ubicación de censo determinada. Para cada bandada observada, estimamos el número de individuos por especie. Registramos la distancia desde el borde de la bandada hasta la estructura de acuicultura más cercana. Dentro de las zonas de acuicultura, registramos si los individuos se encontraban entre los bastidores de un sistema de ostión y, de no ser así, a qué distancia del bastidor se alimentaban (<15 m, 15-30 m, 30-60 m, 60-90 m, o> 90 m); 2003, Koch y
Paton 2014). También notamos si la estructura de acuicultura más cercana estaba siendo atendida en el momento de la prospección. Consideramos una estructura a cuidar cuando los productores de ostras estaban físicamente presentes dentro de las zonas de acuicultura. Las restricciones vigentes durante el período de estudio se detallan en el dictamen biológico del USFWS (USFWS 2016).
Generalmente, estas regulaciones permitían que la tendencia ocurriera durante las cuatro horas centradas alrededor de la marea baja hasta cinco días a la semana. Las operaciones de atención generalmente involucraban de 1 a 10 productores de ostras y 0 a 2 vehículos todo terreno accediendo a un sistema de rejillas y bolsas y consistían en clasificar las ostras entre las bolsas, lavar a presión el material incrustante de las bolsas y conducir vehículos todo terreno a través de las marismas. Para comparar la magnitud relativa de los impactos potenciales del cultivo de ostras con las condiciones ambientales, también recopilamos datos sobre un conjunto de métricas que se hipotetizaban para influir en la presencia de aves playeras (Apéndice S1 : Tabla S1). Debido a que el momento de la llegada de las aves playeras a las zonas de reproducción se escalona temporalmente y varía cada año, registramos el día del año calendario para cada registro de prospección. Contabilizamos las posibles diferencias en la idoneidad del hábitat al registrar el tipo de línea costera adyacente (duna, marisma Spartina, Phragmites, bosque o mamparo) de cada segmento del estudio (es decir, el riesgo de depredación puede ser mayor en áreas de vegetación densa; Yasué 2006). También notamos la presencia de aviones de bajo vuelo que pasaron sobre el segmento en el que se ubicaron las aves durante el conteo (hay un aeropuerto de avión de bandera en la parte sur del área de estudio), y si los humanos y / o perros pasaron dentro 100 m del segmento en estudio, la presencia de cualquiera de las perturbaciones puede hacer que las aves playeras se abstengan de buscar comida cerca e influir en nuestros datos entre los segmentos de la prospección (Burger et al. 2007 , Weston y Stankowich 2013 ). Finalmente, para incorporar las influencias potenciales de los competidores en la presencia de aves playeras dentro de los segmentos de la encuesta, contamos el núme-


ro total de especies de aves playeras no objetivo (es decir, no una de nuestras cuatro especies focales) y gaviotas presentes en un segmento de la encuesta en el momento de los conteos del censo. En particular, las gaviotas risueñas (Leucophaeus atricilla) son un depredador común de los huevos de cangrejo herradura en la bahía de Delaware (Botton 1984 , Karpanty et al. 2006 ). Realizamos un ANOVA del tamaño de las bandadas observadas dentro de cada zona de hábitat intermareal para evaluar si había diferencias significativas en el tamaño de las bandadas para cada especie. Debido a que estábamos específicamente interesados en el efecto del cuidado de las ostras en el tamaño de la bandada, separamos las observaciones dentro de las zonas de acuicultura en función de si el cuidado se estaba produciendo o no en el momento de la observación. Para los ANOVA estadísticamente significativos, realizamos pruebas de diferencia significativa honesta (HSD) por pares de Tukey para identificar las diferencias entre las zonas de hábitat y / o el estado de tendencia. Antes del modelado estadístico, estandarizamos todos los datos de las covariables dividiendo los valores de las covariables por dos desviaciones estándar de la media de un predictor respectivo. Hacerlo permitió la interpretación de todos los coeficientes de regresión de la misma manera que las entradas binarias (Gelman 2008). Construimos 23 modelos a priori para probar tanto las relaciones univariadas como las relaciones aditivas de las diversas covariables (Apéndice S1: Tabla S2) y los ejecutamos usando una formulación bayesiana de modelos lineales mixtos generalizados en R usando el paquete rjags (Plummer 2014). Para todos los modelos, incluimos el año y el segmento de la encuesta como efectos aleatorios para tener en cuenta la falta de independencia temporal en los datos de recuento (es decir, se realizaron tres recuentos de cada segmento de la encuesta en un día determinado y se realizaron múltiples recuentos del mismo segmento en un año de estudio dado). Para probar la bondad general de ajuste de las diversas formulaciones del modelo, usamos valores P bayesianos (Kéry y Schaub 2011). Ejecutamos nuestro conjunto de modelos candidatos y los clasificamos según el criterio de información de desviación (DIC), una medida de precisión predictiva de los modelos bayesianos (Speigelhalter et al. 2002). Consideramos que el mejor modelo para cada especie es el que tiene el valor DIC más bajo. Cuando varios modelos dentro de un conjunto de modelos específicos de especies dadas arrojaron un ΔDIC <10, promediamos los coeficientes de regresión utilizando el paquete BMA en R.
Observaciones del com portamiento de aves pla yeras en busca de alimento
Después de cada conteo, realizamos tres períodos simultáneos de 45 min de observaciones de bandadas de alimentación separadas que habíamos observado. Usando una cámara de video conectada a un telescopio de 60 ×, seleccionamos individuos focales dentro de bandadas observadas de especies objetivo para registrar comportamientos durante un período de 45 s desde una distancia discreta (> 150 m). Nuestro estudio se diseñó para capturar las diferencias en el comportamiento de búsqueda de alimento a escala de aves individuales, en lugar de las respuestas a nivel de bandada a las posibles perturbaciones (es decir, la frecuencia de los sofocos). Dimos prioridad a los nudos rojos debido a su estado de conservación legal (enumerados a nivel federal), seguidos de los pilares rojizos, los playeros semipalmeados y las lilas. Si el individuo, durante su comportamiento típico de búsqueda de alimento, se movió temporalmente fuera de la vista (es decir, detrás de otro individuo o vegetación), Continuamos con la observación si volvía a verse en 20 sy estábamos seguros de que era el mismo pájaro. En los casos en los que el individuo permanecía fuera de la vista durante períodos de tiempo más prolongados, o no podíamos reconocer definitivamente al mismo individuo, abortábamos el intento de observación. Las observaciones duplicadas de los mismos individuos en un día dado eran poco probables porque la bandada estaba lo suficientemente dispersa para que pudiéramos realizar un seguimiento de los individuos focales durante nuestro período de observación, o la bandada era lo suficientemente grande como para que la probabilidad de seleccionar la misma ave focal durante dos o más observaciones fue extremadamente pequeña. abortamos el intento de observación. Las observaciones duplicadas de los mismos individuos en un día dado eran poco probables porque la bandada estaba lo suficientemente dispersa para que pudiéramos realizar un seguimiento de los individuos focales durante nuestro período de observación, o la bandada era lo suficientemente grande como para que la probabilidad de seleccionar la misma ave focal durante dos o más observaciones fue extremadamente pequeña. abortamos el intento de observación. Las observaciones duplicadas de los mismos individuos en un día dado eran poco probables porque la bandada estaba lo suficientemente dispersa para que pudiéramos realizar un seguimiento de los individuos focales durante nuestro período de observación, o la bandada era lo suficientemente grande como para que la probabilidad de seleccionar la misma ave focal durante dos o más observaciones fue extremadamente pequeña. Para cada observación, registramos la zona de hábitat intermareal en la que se alimentaba el individuo focal (acuicultura, planicie de marea, desembocadura del arroyo). Como se indicó anteriormente, observamos si el sistema de estanterías de cultivo de ostras más cercano al individuo focal estaba siendo atendido activamente. Para examinar la influencia potencial de las condiciones del hábitat en las tasas de picoteo, registramos la ubicación de alimentación de cada individuo focal (playa, marisma, bajío, lodazal o agua abierta), sustrato de alimentación sobre el que se movía (barro, turba, arena, línea de o bolsa de ostras), y la velocidad del viento asociada con la observación del individuo focal (ver Apéndice S1: Tabla S1 para descripciones de variables predictoras). Finalmente, notamos la ubicación del individuo focal dentro de la bandada (borde, centro o solitario) y el número total de aves playeras y gaviotas (por separado) en la bandada en la que se alimentaba el individuo focal. Descargamos videos usando VLC Media Player 2.2.6 (VideoLAN, videolan.org) y reproducimos cada muestra a un cuarto de velocidad (para maximizar la precisión del conteo) para documentar la actividad del individuo focal en cada grabación y retener solo la marea baja. observaciones. La resolución de nuestros videos fue adecuada para evaluar el comportamiento de búsqueda de alimento; sin embargo, no pudimos determinar de manera confiable el éxito de la captura y, por lo tanto, no medimos la eficiencia de búsqueda. Durante la marea alta, los criaderos de ostras y las planicies de marea están completamente inundados y, por lo tanto, no son utilizados por las aves forrajeras y no están disponibles para actividades de cuidado. Preparamos un presupuesto de tiempo de alimentación para cada individuo focal observado durante la búsqueda de alimento durante la marea baja, anotando el tiempo de la secuencia de 45 s en que cada individuo participó en la búsqueda (sondeando el suelo, picoteando materia orgánica o escaneando el suelo en busca de presas); estar alerta (pararse erguido, escanear visualmente los alrededores u observar una ame-
naza percibida específica), correr o alejarse de una amenaza aparente (discernible en caminatas de corta distancia entre episodios de picoteo) y volar (de una amenaza percibida). En la mayoría de los casos, el observador mantuvo la vista de los individuos focales que se sonrojaron y regresaron a la misma área para reanudar la búsqueda de alimento. Cuando el individuo focal abandonó por completo la ubicación inmediata de alimentación, el observador lo registró volando hasta que concluyó el período de muestreo de 45 s. El tiempo dedicado a cualquier actividad adicional, Calculamos la tasa de picoteo (picotazos) de cada individuo durante el período de observación como un índice de la tasa de alimentación. Debido a que no fue posible documentar definitivamente las capturas exitosas de presas en muchas de las muestras de video, no cuantificamos la eficiencia de la búsqueda de alimento. Usamos un análisis de varianza unidireccional (ANOVA) y el HSD de Tukey para evaluar las diferencias en las tasas de picoteo promedio para cada especie dentro de cada zona de hábitat, con una significancia evaluada en el nivel ‐ = 0.05. Realizamos regresión lineal múltiple usando la función glm usando la familia de Poisson en R para explicar la variación en la tasa de picoteo promedio para cada especie (R Core Development Team 2013). Desarrollamos 29 modelos candidatos a priori que contienen variables explicativas solas o en varias combinaciones (Apéndice S1: Tabla S3). Debido a que las playas de la bahía de Delaware están cerradas al público durante el período de escala migratoria, registramos <5 observaciones de humanos caminando con o sin perros; por lo tanto, excluimos estas variables del análisis de regresión. Para probar la bondad del ajuste, calculamos el coeficiente de determinación múltiple para el modelo global para cada especie (Apéndice S1: Tabla S4), y usamos el Criterio de información de Akaike (AICc) clasificar modelos candidatos (Burnham y Anderson 2002). Para reducir el sesgo de selección del modelo y la incertidumbre, promediamos todos los modelos que arrojaron un ΔAIC c <2 utilizando el paquete modavg en R y calculamos estimaciones de parámetros basadas en promedios ponderados de las estimaciones de parámetros en los modelos principales (Burnham y Anderson 2002 , Burnham et al. 2011 ).
R e s u l t a d o s Predictores de la pre sencia de aves playeras
La abundancia de aves playeras para todas las especies varió considerablemente dentro de cada segmento de estudio y durante el período de estudio, con tamaños de grupo que van desde uno a ~ 3700 individuos. Debido a que las zonas de acuicultura comprendían solo el 13% del área total de estudio, las comparaciones directas del número total de observaciones de aves playeras entre zonas de hábitat intermareal (áreas de acuicultura, marismas y desembocaduras de arroyos) no fueron informativas. Sin embargo, el porcentaje del total de observaciones para cada especie objetivo dentro de las zonas de acuicultura osciló entre el 21% para los arenillos y el 24% para los playeros semipalmeados, que es más alto que si las aves playeras se distribuyeran al azar en el área de estudio. Para los nudos rojos, no encontramos diferencias significativas en el tamaño de la parvada entre los hábitats, independientemente de las actividades de cuidado (gl = 5, F = 0.935,P = 0,458). Para los cambios de piedra rojizos, el tamaño de las parvadas fue significativamente mayor en las desembocaduras de los arroyos que en las áreas de acuicultura y en las planicies de marea (P <0.01) , independientemente de si el cuidado se estaba produciendo cerca. Para los playeros semipalmeados, encontramos que el tamaño de las parvadas fue significativamente mayor en las desembocaduras de los arroyos que en los llanos cuidados (P <0.01) y las áreas de acuicultura no atendidas ( P <0.01), así como en los llanos de marea ( P <0.01) . Dentro de las zonas de acuicultura, registramos consistentemente más observaciones de aves cerca de los estantes desatendidos que cuando se producía el cuidado de las ostras (Figura 2). Observamos todas las especies focales alimentándose entre los estantes durante las operaciones de cuidado en raras ocasiones (2-9% de todas las observaciones de las cuatro especies dentro de las zonas de acuicultura). Para todas las especies focales, las aves se observaron con mayor frecuencia entre el sistema de rejilla y la línea de pleamar. Los modelos mejor clasificados para todas las especies incluyeron la tendencia como un predictor significativo de presencia dentro de un segmento de prospección (Apéndice S1: Tabla S5). En ausencia de cuidado, la probabilidad de presencia dentro de un segmento dado de toda el área de estudio fue generalmente baja, variando desde ~ 17% para los nudos rojos y lilas hasta ~ 50% para los playeros semipalmeados (Fig. 3). Cuando se tendía el estante más cercano, la probabilidad de presencia en encuestas asociados se redujo en 1,6 a 7,0% dependiendo de las especies (Fig. 3 ; Apéndice S1: Tabla S6). El número total de aves playeras también predijo fuertemente la presencia de nudos rojos, turbios rojizos y arenques dentro de un segmento de prospección, con tamaños de efecto que van desde 1.240 (CI 0.974, 1.283) para los arenillos a 3.529 (CI 3.164, 3.904) para los rojizos (Apéndice S1): Tabla S6). Los tamaños del efecto del número total de aves playeras sobre la presencia de especies fueron positivos y un orden de magnitud mayor que para la presencia de cuidados (impacto negativo) en todos los casos. El número de gaviotas también fue uno de los principales factores de predicción de la presencia de playeros semipalmeados dentro de los segmentos de la prospección (0,165; IC 0,063, 0,267).

FIGURA 2 Representación gráfica de la cantidad total de observaciones de aves playeras migratorias objetivo dentro de los 90 m de los criaderos de ostras desatendidos y cuidados a lo largo de Delaware Bayshore, 2016–2017. El tamaño del círculo y el sombreado es un indicador del tamaño de la parvada. La posición del círculo representa la ubicación general de la parvada (al frente, a lo largo del costado o detrás de las rejillas) dentro de cada categoría de distancia (no dibujada a escala). El tamaño y el sombreado del círculo indican el tamaño de la parvada. Las observaciones de aves dentro del espacio ocupado por el sistema de estanterías se incluyen en la categoría de distancia de 0 a 15 m. La distancia de 90 m a lo largo de la costa está en o cerca de la línea de marea alta. Las distancias más cercanas a la bahía estuvieron expuestas durante períodos de tiempo más cortos.

FIGURA 3 Probabilidad de presencia de (a) nudos rojos, (b) piedras de giro rojizas, (c) arenillas y (d) playeros semipalmados de un segmento de prospección dado a lo largo de toda nuestra área de estudio en función del cuidado de las ostras. Las probabilidades se derivan de la conversión de los coeficientes de regresión (incluidos los intervalos creíbles del 95%) de los modelos de regresión lineal bayesiana mejor clasificados (escala logit). Presupuestos de tiem po y tasas de alimentación
Durante el período de estudio, retenemos 856 observaciones de alimentación (tasa de picoteo) en las cuatro especies. La mayoría de nuestras observaciones fueron de nudos rojos en busca de alimento (N = 507) y turbinas rojizas ( N = 231), con menos observaciones de playeros semipalmeados ( N = 99) y arenillas ( N = 19). En promedio, los individuos de todas las especies pasaron la mayor parte (86,4-95,3%) del tiempo dentro de nuestros registros buscando alimento activamente (Fig. 4). No encontramos diferencias significativas en el tiempo que los individuos dedicaron a buscar alimento entre las bocas de los arroyos, las planicies de marea y las zonas de acuicultura (nudos rojos, P = 0,816; tonos rojizos, P = 0,624; playeros semipalmeados, P = 0,936; sanderling, P = 0,667). Los individuos de todas las especies gastaron <14% en otros comportamientos (Apéndice S1: Tabla S7). Encontramos diferencias notables en los presupuestos de tiempo entre especies. Por ejemplo, los nudos rojos registrados y los playeros semipalmeados pasaron muy poco tiempo participando en conductas de vigilancia o huyendo. En cambio, cuando estas espeFIGURA 4 cies mostraron signos de perGráfica de densidad que ilustra el tiempo que turbación, volaron y dieron los nudos rojos (REKN), los turbios rojizos vueltas brevemente antes de (RUTU), los liñadores (SAND) y los playeros regresar al mismo lugar o vosemipalmeados (SESA) pasaron alimentán- lar lejos de nuestros sitios de dose durante cada observación, 2016 y 2017. observación. Por el contrario, los tonos rojizos volaron con menos frecuencia en respuesta a una perturbación aparente, pasando más tiempo huyendo. Los Sanderlings parecían menos sensibles a las perturbaciones, pero el tamaño de nuestra muestra era pequeño. Nudos rojos alimentó en significativamente más altas tasas de cerca de la acuicultura tendido en comparación con los planos de marea (Fig. 5). En contraste, los turbios rojizos se alimentaban a una tasa significativamente menor en las zonas de acuicultura cuidadas en comparación con cuando estaban cerca de las desembocaduras de los arroyos. Las tasas de picoteo de la lavandera semipalmeada fueron similares en todos los hábitats.
Factores que influyen en las tasas de alimentación de las aves playeras
Los modelos de regresión para los nudos rojos, los playeros semipalmeados y las lilas arrojaron un único modelo superior entre el conjunto de candidatos (Apéndice S1: Tabla S8). Las velocidades del viento más altas afectaron negativamente las tasas de alimentación de los nudos rojos (−0,16, IC del 95% - 0,26, −0,06) y las lilas (−0,44, IC del 95% - 0,64, -0,24); la presencia de gaviotas aumentó ligeramente las tasas de alimentación del nudo rojo (0,004, IC del 95% 0,003, 0,006; Apéndice S1: Tabla S9). Los playeros semipalmeados, por el contrario, mostraron tasas de alimentación ligeramente reducidas en presencia de gaviotas (−0.02, IC 95% - 0.04, −0.01). Para estas especies, la proximidad o la condición de tendencia de un criadero de ostras no influyó en la tasa de alimentación, como se demuestra por la ausencia de estas covariables dentro de los mejores modelos (Apéndice S1: Tabla S8). La tasa de forrajeo de Ruddy Turntone fue influenciada por múltiples factores, incluida la velocidad del viento, la zona del hábitat, la ubicación de forrajeo y el sustrato de forrajeo. En relación con las desembocaduras de los arroyos, los pilares rojizos se alimentaban a tasas más altas en las marismas y las zonas de acuicultura (Apéndice S1: Tabla S9). Los lodazales (charcos poco profundos de agua que deja la marea) y la línea de naufragio tuvieron claros impactos negativos en las tasas de alimentación, pero los resultados de otras ubicaciones de alimentación y sustratos, respectivamente, fueron equívocos. De acuerdo con los nudos rojos, los playeros semipalmeados y los liñadores, la distancia a un criadero de ostras y su estado de cuidado no influyeron en las tasas de forrajeo de los rojizos (Apéndice S1 : Tabla S9).
Discusión
Los hábitats intermareales de la bahía de Delaware son un excelente ejemplo de casos en los que las actividades humanas simplemente ocupan, y no alteran, los mismos espacios utilizados por
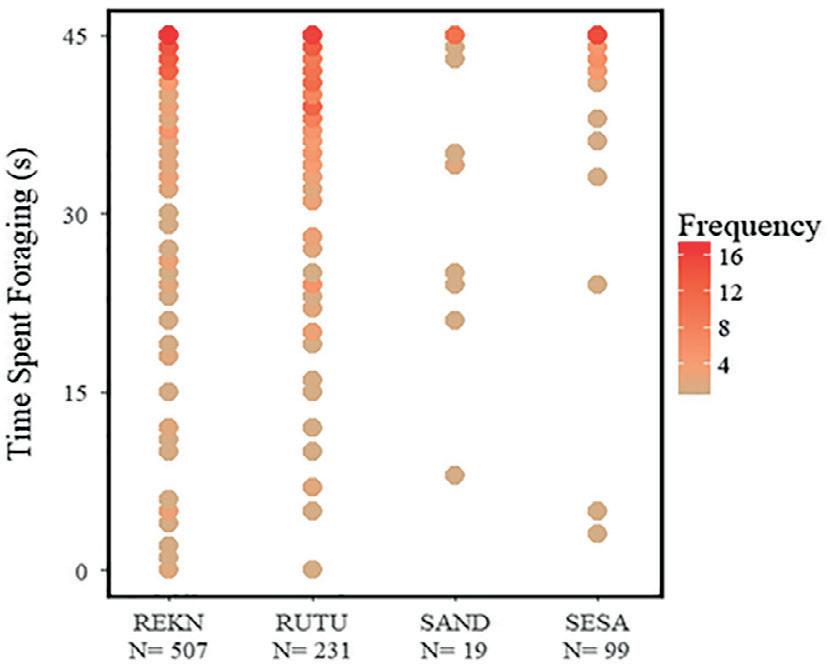
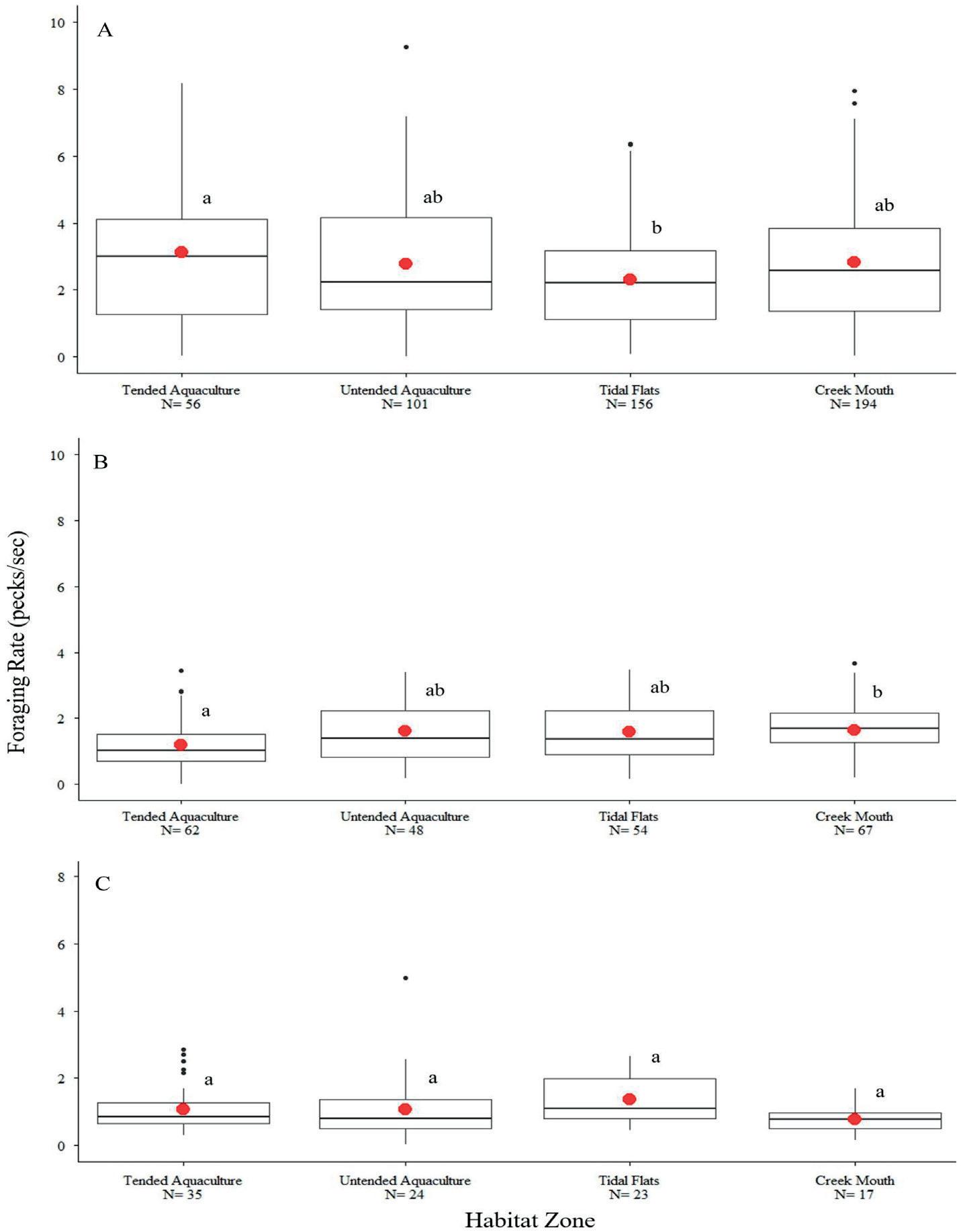
FIGURA 5 Diferencias en las tasas medias de picoteo de (A) nudos ro jos, (B) turbios rojizos y (C) playeros semipalmeados que se alimentan en desembocaduras de arroyos, llanuras de marea y sitios de acuicultura sin vigilancia y cuidados durante la marea baja.
especies de interés para la con- Durante nuestros períodos de servación (Burger y Niles 2017), estudio de 7 semanas, tanto las lo que hace que los impactos gaviotas como las aves playeras ecológicos sean sutiles y difí- explotan intensamente el recurso ciles de cuantificar. Mostramos de huevos de cangrejo herradura aquí que las estanterías de cul- pulsado (Shuster y Botton 1985, tivo de ostras, ubicadas lejos de Burger y Gochfeld 1991 b, Niles las principales áreas de forrajeo et al. 2014 ). Por lo tanto, es insegún lo prescrito en las medidas tuitivo y consistente con otros de conservación, tienen poca estudios que las bandadas más influencia en la distribución de grandes de aves playeras resultaaves playeras migratorias a lo rían en una mayor probabilidad largo de la Bahía de Delaware. de que estuvieran presentes indiLas actividades de cuidado de viduos de una especie focal. Noostras reducen la probabilidad sotros no examinamos herradura de presencia entre un 1,6% y abundancia de cangrejo huevo o un 7%; sin embargo, estas leves la densidad debido a la intensireducciones en la probabilidad dad encuesta requiere para lograr de presencia son considerable- resultados significativos (Smith mente menores que los efectos et al. 2002, Munroe et al. 2017), del número de gaviotas y aves pero Munroe et al. ( 2017 ) no enplayeras dentro de la misma contraron un impacto perceptiárea. Este resultado es consis- ble de los soportes de ostras en la tente con Burger et al. (2018), actividad del cangrejo herradura. que también identificó el total de Además, la abundancia de aves aves playeras como un predictor playeras fue mayor en el área significativo de la presencia de entre los mostradores de ostras nudo rojo, piedra angular rojiza, y la línea de marea alta, probalavandera semipalmeada y are- blemente porque es aquí donde nillo en la bahía de Delaware. los nidos de cangrejos herradura ocurren en altas densidades y donde los huevos exhumados tienden a acumularse en la superficie de la playa (Botton et al. 1994, Nordstrom et al., 2006). Esta zona intermareal también está expuesta durante el mayor período de tiempo durante cada ciclo de mareas. Por lo tanto, nuestros hallazgos apoyan otros estudios que relacionan la distribución de aves playeras migratorias con la densidad de huevos de cangrejo (Karpanty et al. 2006). El hecho de que las aves playeras no eviten sustancialmente los criaderos de ostras y solo se vean moderadamente afectadas por las actividades de cuidado no confirma un impacto neutral del cultivo de ostras en las poblaciones vulnerables de aves playeras. Los migrantes de larga distancia reducen sus órganos digestivos para los vuelos migratorios, dejándolos solo de 10 a 12 días para duplicar el peso corporal antes de que deban completar su migración al Ártico (Baker et al. 2004). Las aves llegan a la bahía de Delaware físicamente estresadas y dependen en gran medida de los huevos de cangrejo herradura como fuente de alimento para ganar la masa corporal necesaria para continuar con la migración (Jehl 2007, Mizrahi y Peters 2009, Andres et al. 2012). Por lo tanto, pequeñas diferencias en la probabilidad de presencia no indican por sí mismas una falta de impacto. Más bien, la respuesta a una perturbación depende en gran medida de la gravedad percibida de la amenaza (riesgo de mortalidad) y el costo de responder, medido en alimentos o energía perdidos (Frid y Dill 2002, Yasué 2005). La presencia de individuos a pesar de una alteración hace que parezcan tolerantes a la alteración, pero puede ser el resultado de una mala condición corporal que conduce a una toma de decisiones más arriesgada (Houston y McNamara 1982). Los individuos suelen ser más sensibles a las perturbaciones humanas si están en buenas condiciones corporales porque pueden permitirse gastar energía (Burger y Gochfeld 1991 a, Gill et al. 2001, McGowan et al. 2002). En contraste, las personas con estrés energético pueden dar prioridad a las ganancias de energía sobre la evitación de depredadores, ya que pueden incurrir en un costo significativo (y potencialmente insuperable) de abandonar un sitio de alimentación (Yasué 2005, Yasué et al. 2008). Alternativamente, los individuos abandonarán un sitio de alimentación más rápidamente si se dispone de otros hábitats de alimentación adecuados (Fretwell 1972,
Yasué 2005). Por lo tanto, para que nuestras observaciones no reflejen ningún costo para toda la población de escala, los individuos presentes en sitios con cultivo de ostras deben alimentarse a tasas iguales a las de otros hábitats de alimentación adecuados que no sean de cultivo de ostras. Las especies que observamos no alteraron sustancialmente sus tasas de búsqueda de alimento en presencia de ostras de cestas y bolsas atendidas o desatendidas. En cambio, descubrimos que las tasas de alimentación estaban principalmente influenciadas por las condiciones ambientales, en particular la presencia de competidores (gaviotas u otras aves playeras) y el sustrato de alimentación. A pesar de alguna importancia estadística menor entre las zonas de hábitat y las actividades de cuidado, las tasas de picoteo promedio fueron generalmente consistentes independientemente de si las aves se alimentaban cerca de los criaderos de ostras, los llanos de marea o las desembocaduras de los arroyos. Estos patrones fueron consistentes en todos los individuos independientemente de su ubicación en la parvada, lo cual es importante dado que un grupo de animales aparentemente tolerantes puede consistir en individuos menos sensibles más cercanos a la perturbación e individuos más sensibles más alejados (Samia et al.2016). El efecto más perceptible del cuidado se observó en los pilares rojizos, que se alimentaban a tasas más bajas en las zonas de acuicultura cuidadas que en las desembocaduras de los arroyos, que se consideran el hábitat principal de alimentación. Sin embargo, los individuos de piedra angular se alimentaron a tasas estadísticamente similares dentro de las planicies de marea sin acuicultura, y no hubo diferencias en el tiempo dedicado a buscar alimento en las zonas de hábitat durante la marea baja. En particular, los individuos de nuestras especies focales de aves playeras pasaron la mayor parte de su tiempo involucrados en comportamientos de alimentación, con pocas diferencias en la vigilancia o huir (caminando o volando lejos de una perturbación) entre las zonas de hábitat. La evidencia presentada aquí sugiere que el cultivo de ostras entre mareas en su densidad actual y con las zonas de amortiguamiento actuales puede co-utilizar con éxito estas áreas intermareales ricas en recursos con aves playeras migratorias. Sin embargo, el grado en que este uso conjunto puede representar una falta de impacto en las poblaciones de aves playeras, independientemente de la escala de las operaciones de cultivo de ostras, espera dos aportes informativos. Primero, la ingesta energética resultante de nuestras tasas de alimentación observadas debe ser lo suficientemente grande como para que los individuos sobrevivan el resto de su migración hacia el norte y puedan iniciar la reproducción. No pudimos determinar de manera confiable el éxito de captura de los individuos que buscan alimento, que podrían ser mayores o menores cerca de las operaciones de cultivo de ostras. El porcentaje de personas que alcanzan el umbral de masa ha variado mucho durante los últimos 15 años, probablemente debido a múltiples factores; por lo tanto, los efectos potenciales del cultivo de ostras en el aumento de peso de las aves playeras siguen siendo desconocidos y podrían variar si existen diferencias significativas en la eficiencia de captura de presas, aunque las tasas de alimentación no se vean afectadas esencialmente. En segundo lugar, el cultivo de ostras a lo largo de Delaware Bayshore se encuentra actualmente en bajas densidades. Nuestras observaciones sobre el uso de aves playeras y las tasas de alimentación de las áreas intermareales alrededor de los estantes de cultivo de ostras pueden deberse a esta huella actualmente pequeña de cultivo de ostras. El conocimiento de cómo cambian los impactos al aumentar la intensidad o la cobertura espacial del cultivo de ostras será fundamental para determinar el umbral de densidad en el que las poblaciones de aves playeras se ven afectadas demográficamente.2002, Studds et al. 2017).
Conclusiones
En comparación con otras formas de producción de proteína animal, el cultivo de ostras es una de las empresas de menor impacto para alimentar a una población humana en rápida expansión (Hilborn et al. 2018), y proporciona muchos beneficios ambientales, incluida la filtración de agua, la eliminación de nitrógeno y el aprovisionamiento de cerca de -shore hábitat similar a los arrecifes de ostras naturales (Coen et al. 2007, Dumbauld et al. 2009, Maslo 2014 ). Como contribuyente importante a la seguridad alimentaria mundial y al crecimiento económico, es casi seguro que el cultivo de ostras seguirá siendo una industria comercial en crecimiento. Al mismo tiempo, las poblaciones mundiales de aves playeras migratorias continúan disminuyendo en todo el mundo debido a múltiples causas antropogénicas (Piersma y Lindström 2004, Sutherland y col. 2012). El grado en que las prácticas de cultivo de ostras entran en conflicto con la conservación de las aves playeras migratorias depende de la identificación y dirección de los impactos, y de la capacidad de determinar si es necesario y alcanzable un equilibrio en las compensaciones entre la producción de alimentos y la conservación biológica. Nuestros resultados sugieren que tal compensación es posible para la bahía de Delaware en los niveles actuales de cultivo de ostras, y nuestros datos pueden guiar el trabajo adicional para ampliar la investigación a la dinámica de toda la población.
Expresiones de gratitud
El financiamiento para este trabajo fue proporcionado por el Premio Sea Grant de Nueva Jersey # NJSG ‐ 6610‐0003 en un proyecto inicialmente concebido y propuesto por L. Calvo, Especialista en Extensión de Acuicultura de NJSGC. El Programa de Manejo y Conservación de Vida Silvestre de Rutgers proporcionó apoyo adicional. Los autores agradecen al Servicio de Pesca y Vida Silvestre de los Estados Unidos, al Programa de Especies en Peligro y No Caza de Nueva Jersey y a la Oficina de Pescadores de Mariscos de Nueva Jersey por su apoyo y comentarios durante el proyecto. Reconocemos la cooperación de los productores de ostras que operan dentro del área de estudio, así como los esfuerzos de varios técnicos de campo para la recolección de datos. Los datos generados durante el proyecto se cargarán en el Repositorio Digital Dryad. Bushek fue apoyado parcialmente por el proyecto USDA NIFA Hatch NJ32114 y a través de Rutgers NJAES, y Burger recibió el apoyo parcial del Instituto Nacional de Alimentos y Agricultura del USDA (Proyecto Hatch Multiestado 1008906 [W ‐ 3045] a través de NJAES [Hatch NJ12233]) y la Universidad de Rutgers. Agradecemos a Matthew Danihel, Michelle Hartman y Eric Graber por su ayuda con este proyecto, y a Conor McGowan por una crítica de un borrador anterior.
Autores:
Brooke Maslo J. Curtis Burkhalter, David Bushek, Tanner Yuhas, Brian Schumm, Joanna Burger & Julie L. Lockwood. E-mail: brooke.mas lo@rutgers.edu | orcid. org/0000-0003-3847-3164 Ecología, Evolución y Re cursos Naturales, Rutgers, Universidad Estatal de Nueva Jersey, Nuevo Brunswick, Nueva Jersey, 08901 EE. UU. © 2021 Sociedad Ecoló gica de América. Reser vados todos los derechos.