
40 minute read
школа фармацевта
Advertisement
АНАТОМІЯ ТА ФІЗІОЛОГІЯ СЛІЗНОГО АПАРАТУ ОКА
Як відомо з курсу нормальної анатомії, слізний апарат складається зі слізних залоз і слізних проток. Слізна залоза розташована нижче верхнього зовнішнього краю орбіти (саме тут і утворюються сльози), а її виходи відкриваються у верхній частині кон’юнктивального мішка. Слід зазначити, що у кон’юнктиві є додаткові слізні залози [1]. Завдяки морганням сльози покривають поверхню кон’юнктиви та рогівки тонким шаром, утворюючи слізну плівку, однією з функцій якої є безперервне змащування поверхні ока та захист рогівки та кон’юнктиви від пересихання. Рідина накопичується у внутрішньому куточку ока в слізному басейні, а звідки стікає в ніс.
Слізна плівка створює гладку заломлюючу поверхню, яка необхідна для якісного оптичного зображення. Сльози доставляють поживні речовини до рогівки, видаляють катаболіти та вимивають мертві клітини і бактерії. Ферменти слізної плівки мають протимікробну дію і захищають очі від алергенів, потенційних збудників запалення та забруднюючих речовин.
БІОХІМІЯ СЛІЗ
Слізна плівка має тришарову структуру: ліпідний, водний та муциновий шар [1]. Ліпідний шар зменшує випаровування водного, який завдяки розчиненим у ньому речовинам знижує поверхневий натяг. Водний шар становить приблизно 98% від загального складу слізної плівки. Важливою функцією муцинового шару Генрі Модслі, британський психіатр є утворення глікопротеїнового компонента. Глікокалікс — захисна оболонка на клітинній поверхні та основний внутрішній компонент муцинового шару. Над глікокаліксом розташований так званий зовнішній шар муцину товщиною 0,5 мкм, вкритий водним шаром. Наявність муцинового шару важлива для стійкості водного шару.
Як відомо, хімічний склад наших сліз складний (таблиця) і змінюється залежно від причини, яка їх зумовила.
Базальні сльози виділяються постійно в невеликих кількостях, змочуючи рогівку і захищаючи очі від пилу і бактерій.
Рефлекторні сльози — це реакція організму на хімічні подразники, сторонні частинки тощо.
Емоційні сльози — це реакція організму на фізичний біль або стрес. Вони містять специфічні гормони пролактин і адренокортикотропний гормон у набагато вищій концентрації, ніж базальні і рефлекторні. Вчені встановили, що існує нейронний зв’язок між слізними залозами і ділянками головного мозку людини, відповідальними за емоції.
Таблиця. Біохімічний склад сльози [1, 2]
Біохімічний компонент сльози Функція та значення
Лізоцим Гідролізує глікозидні зв’язки клітинних стінок (бактеріолітичний бактерій. Його кількість збільшується до 40 рофермент) ків, а потім починає зменшуватися Лактоферин Має протимікробну дію — зв’язує вільне залізо, необхідне для росту та виживання мікробів, має протизапальну активність Ліпокаліни Регулюють в’язкість сліз, інактивують вірусну ДНК та заліза хелат, що важливо для бактерій. Антимікробні пептиди мають широкий спектр дії проти бактерій, грибів та вірусів Фактори росту Мають здатність регулювати проліферацію, диференціювання, ріст, розвиток епітеліальних клітин, загоєння рани рогівки та кон’юнктиви
Матричні металопротеїнази
Руйнують всі види позаклітинних білків. Беруть участь у проліферації клітин, міграції, диференціюванні, ангіогенезі та апоптозі Імуноглобуліни Мають властивість зв’язуватися з високою специфічністю та спорідненістю до антигенів мікроорганізмів і, таким чином, відіграють важливу роль в імунній системі Цитокіни Можуть спричиняти ріст, диференціювання, хемотаксис та цитотоксичність Ангіотензин II Важливий вазоактивний фактор, що впливає на регенерацію поверхні рогівки, слізних проток, епітеліальні структури та секрецію сліз
СИНДРОМ СУХОГО ОКА: ЕТІОПАТОГЕНЕЗ ТА КЛІНІЧНА КАРТИНА
Суб’єктивно захворювання проявляється дискомфортом, відчуттям чужорідного тіла, стомленістю, сухістю, тиском, різями і печінням в очах, світлобоязню, болем при нанесенні крапель, а також наявністю липкого слизу в кон’юнктивальному мішку, утрудненням руху і прилипанням повік до поверхні ока, порушенням зору, головним болем тощо [2]. Суб’єктивні труднощі часто більш виражені, ніж об’єктивна картина, в якій переважають почервоніння кон’юнктиви, наявність в ній виразок через тертя, порушення формування слізної плівки, її нестабільність або аномальний склад. Згодом на поверхні ока відбуваються патологічні зміни і утворюються дрібні потертості, які поступово можуть призвести до хронічного запалення рогівки та кон’юнктиви [3].
Основними причинами недостатнього об’єму слізної плівки є запалення очей, гормональна дисфункція, пов’язана з менопаузою (низький рівень естрогенів), порушення роботи слізних залоз, пухлини, вікове переродження. Виявлено також зв’язок із деякими системними захворюваннями (синдром Шегрена, рубцевий пемфігоїд, ревматоїдний артрит, алергія, інфекції) та травмами (опіки) очей. Крім того, може бути наслідком хронічного кон’юнктивіту, алергії, дефіциту вітаміну А [4].
Синдром сухого ока може виникнути внаслідок застосування деяких лікарських засобів: пероральних препаратів проти акне, контрацептивів, діуретиків, нейролептиків, бетаблокаторів, антигістамінних засобів. Окрім того, синдром може виникати при використанні контактних лінз, у період вагітності,
Із початку досліджень вірусу SARS-CoV-2 стало відомо, що для прикріплення до клітини-мішені він, як і його родич — вірус SARSCoV, використовує рецептори ангіотензинперетворювального ферменту (АПФ ІІ). Роль «ключа», що знаходить потрібний рецептор АПФ ІІ, грає S-білок вірусу, з якого побудовані «шипи» на поверхні вірусної частинки. Але це лише перший етап. На другому — оболонка вірусу має розкритися, щоб генетичний матеріал потрапив усередину клітини. Для цього потрібно розщепити S-білок в певних місцях, і цю роботу для вірусу «люб’язно» виконують наші власні клітинні ферменти-протеази*. Схоже, саме вони у SARS-CoV і SARSCoV-2 відрізняються і це, відповідно, визначає, в які саме клітини може потрапити збудник.
Протеази, що допомагають SARS, є лише в легеневій тканині, тоді як ферменти, необхідні для активації SARS-CoV-2, схоже, наявні скрізь — у всіх клітинах людського організму, тому SARS-CoV-2 теоретично може проникати в будь-яку тканину. Так, наразі вчені вивчають версію, згідно з якою деякі особливості патогенезу COVID-19 пов’язані з ураженням коронавірусом судинного ендотелію.
Однією з протеаз, що допомагають вірусу потрапити в клітину, є фурин, субтилізиноподібна ентдопептидаза (пропротеїнконвертаза), що бере участь в активації деяких клітинних білків. Фурин вирізає зайві шматки із білків-попередників і перетворює їх у біологічно-активні продукти — ферменти, гормони, фактори росту та диференціювання, рецептори, білки плазми крові, ферменти системи зсідання крові тощо. Фурин грає важливу роль у розвитку таких процесів, як проліферація та міграція клітин, підтримка гомеостазу, ембріогенез. Але у фурину є й «темний бік»: він долучається до розвитку низки патологій, зокрема серцевосудинних, онкологічних, нейродегенеративних захворювань, а також пов’язаний із активацією та вірулентністю багатьох бактеріальних і вірусних патогенів. У біохіміків навіть є термін — «фуринозалежні хвороби». І на сьогодні є підстави вважати, що COVID-19 — фуринозалежна хвороба.
Такі властивості фурину зробили з нього потенційну мішень для фармакотерапевтичних впливів. Уже створено та випробувано численні інгібітори фурину, які теоретично можуть попереджувати розвиток тих чи інших патологій. Поки жоден інгібітор не просунувся далеко у випробуваннях за участі людей та не був схвалений. Але ситуація із COVID-19 може активізувати такі дослідження.
Окрім фурину, коронавірусу SARS-CoV-2 допомагає потрапити в клітину ще один фермент — трансмембранна серинова протеаза 2 (TMPRSS2). Наразі його також розглядають як можливу мішень для терапевтичних впливів при COVID-19. * Bestle D., Heindl M.R., Limburg H. et al. TMPRSS2 and furin are both essential for proteolytic activation and spread of SARS-CoV-2 in human airway epithelial cells and provide promising drug targets // bioRxiv 2020.04.15.042085. https://doi. org/10.1101/2020.04.15.042085
у разі тривалого перебування в сухому приміщенні, після тривалої роботи на комп’ютері, а також у курців або тих, хто багато часу проводить у басейні з хлорованою водою.
Сухе око також може бути спричинено різними видами рефракційних процедур на рогівці: лазерна корекція зору (LASIK, PRK), коли знімається тонкий шар рогівки [5].
ВИБІР ПРЕПАРАТІВ ДЛЯ ЛІКУВАННЯ СИНДРОМУ СУХОГО ОКА
Якщо розвиток синдрому сухого ока є наслідком місцевого або системного захворювання, проводять етіотропне лікування основної патології [2–5]. Для лікування легких формах призначають препарати штучних сліз [3].
Зазначимо, що для захисту очних крапель від мікробної контамінації використовують різні консерванти (бензалконію хлорид, цетримід, полігексанід, хлоргексидину глюконат, полідронію хлорид, хлоробутанол, PURITE, Polyquad), які в окремих випадках можуть спричинити побічні ефекти. Для препаратів без консервантів використовують спеціальні системи дозування (наприклад, механічна система дозування COMOD). Рідина всередині флакона знаходиться у гнучкому герметичному мішечку і не контактує з навколишнім повітрям. Вміст залишатиметься стерильним протягом 6 міс використання без необхідності додавання консервантів.
У деяких випадках в терапії синдрому сухого ока використовують краплі з глюкокортикостероїдами (метилпреднізолоном, дексаметазоном) та емульсії циклоспорину, але лише за призначенням лікаря [2].
У новітній клінічній практиці у терапії синдрому сухого ока застосовують розчини гіалуронової кислоти з цитратними буферами [4]. Гіалуронова кислота здатна зв’язувати та утримувати воду, а цитрат не утворює важкорозчинних сполук з кальцію фосфатом.
Крім того, застосовують препарат ліпофільного перфторгексилоктану, який захищає поверхню слізної плівки та замінює функцію ліпідного шару [6]. Інші препарати містять гіпромелозу з декспантенолом, карбоксиметилцелюлозу з вітаміном А або Е, натрію гіалуронат, ретинолу пальмітат, гіалуронову кислоту з ектоїном, різні варіанти гелів. Стерильні тампони, пристрої та маски для нагрівання повік тощо.
Одним з інноваційних лікарських засобів є потрійної дії з ліпідами, що стабілізуює ліпідний компонент і зменшує випаровування, гіалуронат та гліцерин забезпечують ефективне змочування та підтримку водного компонента, карбомер подовжує та покращує змащування шляхом зв’язування з муциновим компонентом.
В окремих випадках застосовують аутологічні сироватки, виготовлені з крові пацієнта. Комплексна дія низки речовин, що містяться в ньому (фактори росту, антиоксиданти, поживні речовини та вітаміни), здатні прискорити загоєння уражень рогівки.
Одним з направлень хірургічного лікування є пластика слізних шляхів з використанням імплантатів (часткова бічна тарсорфорія або корекція деформації), використання покривних офтальмо-плівок для загоєння уражень рогівки [2].
Інші можливості включають нанесення мастильних гелів або використання терапевтичних контактних лінз.
Крім того, для відновлення закупорених слізних залоз показані масаж, фізіотерапія тощо. При запаленні країв повік застосовувати місцеві або системні антибіотики тетрациклінового, фторхінолонового чи левоміцетинових ряду у формі крапель [2–5]. Також варто регулярно прасувати постіль, змінити подушки, пірини, які можуть бути інфіковані кліщем роду Demodex. Cльози зустрічі Сльози від сонячного світла


Сльози співчуття
У 2017 р. в США бестселером стала книгафотоальбом Розалін Фішер «Топографія сліз». У книзі представлені захоплюючі абстрактні картини, які містять зображення сліз людини під мікроскопом. Фото з особистого сайту авторки
http://www.rose-lynnfi sher. com/tears.html



Сльози піднесеності
Зараз почастішали звернення відвідувачів аптек зі скаргами, що пов’язані із синдромом сухого ока. В рамках фармацевтичної опіки фармацевт повинен рекомендувати таким відвідувачам звернутися до офтальмолога.
Бажаємо вам тільки сліз від щастя! Будьте здорові!
Руслан Редькін, канд. фарм. наук, Нінель Орловецька, канд. фарм. наук, Оксана Данькевич, канд. фарм. наук
Список літератури знаходиться в редакції
Чарівне літо без гострого болю



Для виробництва серотоніну, відомого як «гормон щастя», необхідне сонячне світло — саме тому влітку життя здається нам трішки чарівним. Проте навіть у цю чудову пору року медичні працівники не перестають стикатися із ситуаціями, що потребують екстреного знеболювання (головний, зубний, м’язовий, посттравматичний біль тощо)

КОЛИ ПРИЗНАЧАЮТЬ НПЗП?
При вираженому больовому синдромі, що потребує негайного лікування, або у випадках, коли причину болю усунути неможливо, необхідна симптоматична терапія. Важливу роль у лікуванні больового синдрому різного походження відіграють нестероїдні протизапальні препарати (НПЗП) — засоби першої лінії для купірування болю, який виникає внаслідок тканинного пошкодження та запалення [1].
Оскільки фармакологічні властивості цих лікарських засобів різні, то першочерговим завданням є вибір препарату з урахуванням профілю його ефективності та безпеки [2].
ЯКИЙ НПЗП НАЙБІЛЬШЕ ПІДХОДИТЬ ДЛЯ ЕКСТРЕНОГО ЗНЕБОЛЮВАННЯ?
Одним з найкращих препаратів для екстреного знеболювання за співвідношенням ефективність/безпека є кеторолаку трометамін — саме такий висновок було зроблено після призначення різних НПЗП (метамізол натрію, диклофенак, парацетамол) пацієнтам терапевтичних та хірургічних стаціонарів [3, 4].
Кеторолаку трометамін застосовують у 58 країнах світу, де профіль його безпеки ретельно вивчають вже 30 років [2]. Безпеку препарату було переконливо продемонстровано у широкомасштабних рандомізованих контрольованих дослідженнях та метааналізах [5, 6].
Кеторолак — ефективний анальгетик, який відмінно зарекомендував себе при зубному болю та мігрені, гострому болю у попереку, нирковій та жовчній кольці, а також у багатьох інших ситуаціях, коли потрібне швидке та надійне знеболювання, а застосовувати наркотичні анальгетики неможливо або недоцільно [3].
За силою анальгетичної активності кеторолак перевершує багато НПЗП (диклофенак, ібупрофен, кетопрофен та ін.) [4], а також має помірні протизапальні властивості та жарознижувальную дію [4]. КЕТАНОВ ® : ПЕРЕВІРЕНО В УКРАЇНІ
Одним з добре відомих у нашій країні препаратів кеторолаку трометаміну є Кетанов®, що виробляє в Європі (Румунія) компанія «КК Терапія АТ», а поставляє в Україну — ТОВ «Ранбаксі Фармасьютікалс Україна» (група компаній SUN PHARMA).
Кетанов® застосовують в Україні з 2000 р., що дозволило вітчизняним фахівцям накопичити значний досвід щодо його використан ня [2].
У клінічних дослідженнях підтверджено: Кетанов® у стандартних дозах (до 40 мг на добу) і при короткочасному застосуванні (до 5 діб) має сприятливий профіль безпеки, що разом із доведеною знеболювальною активністю робить його препаратом вибору для усунення гострого болю, у тому числі у післяопераційний період та після серйозних травм [1, 2].
Зокрема, ефективність та профіль безпеки Кетанову підтверджено на клінічних базах Дніпропетровської державної медичної академії, Тернопільського державного медичного університету ім. І.Я. Горбачевского, кафедри загальної стоматології Національної медичної академії післядипломної освіти ім. П.Л. Шупика, а також у травматологічному відділенні Львівської міської лікарні швидкої допомоги тощо. [2].
ЗБЕРІГАННЯ ТА ВІДПУСК
За умовами зберігання та відпуску кеторолаку трометамін не відрізняється від багатьох інших НПЗП (його відпускають за рецептом так само, як диклофенак та німесулід). Кеторолаку трометамін пригнічує синтез простагландинів і є ненаркотичним анальгетиком периферичної дії, який не включено до «Переліку наркотичних засобів, психотропних речовин і прекурсорів») [7].
Кеторолаку трометамін не зв’язується з опіоїдними рецепторами, а отже, не спричиняє побічного ефекту на ЦНС, у тому числі не пригнічує дихальний центр, не зумовлює звуження зіниць і не спричиняє залежності та звикання [1, 3].


ЯК ЗАСТОСОВУВАТИ КЕТАНОВ ® ?
Кетанов® забезпечує відносно швидке (через 30 хв) та доволі тривале (4–6 год) знеболювання. У разі необхідності препарат можна приймати удома самостійно, але за рецептом лікаря [4].
Дорослим та дітям старше 16 років Кетанов® призначають по 10 мг кожні 4–6 год за необхідності. Не рекомендовано застосовувати препарат у дозах, що перевищують 40 мг на добу. Таблетки бажано приймати під час або після їди.
З метою мінімізації побічних ефектів препарат слід застосовувати у найнижчій ефективній дозі протягом найкоротшого періоду часу, необхідного для контролю симптомів. Максимальна тривалість лікування не повин на перевищувати 5 днів.
Література
1. Зайченко А.В., Супрун Э.В. Клиническая фармакология кеторолака. Что нового? Аптека. 2016; 11 (1032). 2. Вікторов А.П. та ін. Кеторолаку трометамін: ефективність та безпека при медичному застосуванні.
Ліки України. 2008; 2 (118): 2-7. 3. Каратеев А.Е. Кеторолак в клинической практике. Неврология, нейропсихиатрия, психосоматика. 2011; 3 (4):81-89. 4. Супрун Э.В. Современный взгляд на оценку соотношения эффективность/безопасность кеторолака. Аптека. 2016: 45 (1066). 5. Maslin B. еt al. Safety Considerations in the Use of
Ketorolac for Postoperative Pain. Curr Drug Saf. 2017; 12 (1):67-73. 6. Forrest J.B. et al. Ketorolac, diclofenac, and ketoprofen are equally safe for pain relief after major surgery. Br. J.
Anaesth. 2002 Feb; 88 (2):227-33. 7. Постанова Кабінету Міністрів України від 06.05.2000 р. № 770 «Про затвердження Переліку наркотичних засобів, психотропних речовин і прекурсорів».
У науковій пресі одночасно з’явилися дві статті, головним «героєм» яких виступає препарат акалабрутиніб (acalabrutinib). Він є інгібітором ферменту, що міститься в імунних клітинах та бере участь у формуванні імунної відповіді, зокрема, викиді цитокінів та гістаміну. Акалабрутиніб схвалений до застосування при деяких злоякісних хворобах крові, але, згідно з новими даними, він може також знижувати ризик надактивної імунної відповіді як при коронавірусній хворобі COVID-19, так і при анафілактичних реакціях
Акалабрутиніб — інгібітор тирозинкінази Брутона, ферменту, що відіграє важливу роль у дозріванні та функціонуванні В-лімфоцитів, бере участь в опосередкованій IgE-активації опасистих клітин, а також активації макрофагів, яка призводить до вивільнення останніми прозапальних цитокінів.
Відомо, що тяжкий перебіг коронавірусної хвороби COVID19 часто пов’язаний із «цитокіновим штормом» — надмірною реакцією імунної системи, що є руйнівною для тканин організму. У пацієнтів з тяжкою формою COVID-19 було виявлено підвищену активність ферменту тирозинкінази Брутона та збільшену продукцію інтерлейкіну-6 у моноцитах. У журналі Science Immunology 5 червня 2020 р. було опубліковано* результати дослідження, в якому 19 госпіталізованих із тяжкою формою COVID-19 протягом 10–14 діб отримували акалабрутиніб. У більшості пацієнтів, часто вже на 1–3-й день лікування, спостерігали поліпшення оксигенації, зниження рівня маркерів запалення (С-реактивного білка та інтерлейкіну-6) та лімфопенії. Автори дослідження відзначають добру переносимість акалабрутинібу у хворих на COVID-19 та вважають за необхідне проведення більш масштабних рандомізованих досліджень впливу інгібіторів тирозинкінази Брутона на надлишковий викид цитокінів.
Зменшення вираженості надто активних імунних реакцій також є вкрай важливим для пацієнтів з алергічними захворюваннями, перш за все тих, хто схильний до розвитку анафілаксії. У роботі, опублікованій 2 червня 2020 р. в Journal of Clinical Investigation**, на модельній системі анафілаксії (генетичномодифіковані миші) було виявлено, що незворотні інгібітори тирозинкінази Брутона попереджають опосередковану IgE дегрануляцію опасистих клітин та продукцію цитокінів, а також блокують індуковане алергеном звуження бронхів. Однократне введення акалабрутинібу або інших інгібіторів тирозинкінази Брутона повністю попереджало анафілактичні реакції, опосередковані IgE. Автори дослідження вважають, що ці засоби можуть радикально полегшити стан пацієнтів з алергічними хворобами. Їх доцільно застосовувати не тоді, коли анафілактична реакція вже почала розвиватися (як адреналін), а профілактично — у ризикованих ситуаціях для зниження ймовірності виникнення анафілактичних реакцій (у відрядженнях, подорожах, під час прийому антибіотиків або проходження курсу антигенспецифічної імунотерапії). * Roschewski M., Lionakis M.S., Sharman J.P. et al. Inhibition of Bruton tyrosine kinase in patients with severe COVID-19 // Science Immunology, 05 Jun 2020, 5 (48): eabd0110. DOI: 10.1126/sciimmunol. abd0110 ** Dispenza M.C., Krier-Burris R.A., Chhiba K.D. et al. Bruton’s tyrosine kinase inhibition eff ectively protects against human IgE-mediated anaphylaxis // Journal of Clinical Investigation, June 2, 2020. DOI: 10.1172/JCI138448
Через пандемію коронавірусної хвороби COVID-19 проблема стійкості бактерій до антибіотиків пішла з перших шпальт ЗМІ разом із іншими медичними викликами сучасності. Тим часом через бактеріальні інфекції, нечутливі до антимікробної терапії, щорічно помирають близько 700 тис. осіб, і вчені продовжують вивчати механізми та чинники антибіотикорезистентності, аби уповільнити її катастрофічне поширення.
Навколо нас повно вільної бактеріальної ДНК, зокрема такої, що містить гени стійкості до антибіотиків. Це переважно плазміди — кільцеві фрагменти, здатні до автономної реплікації. Особливо багато вільної бактеріальної ДНК можна знайти у медичних закладах, кишечнику людини, стічних водах тощо. Ці фрагменти ДНК можуть потрапляти в інші бактерії і там експресуватися. Це називається горизонтальним переносом генів, а сам процес проникнення чужорідної ДНК в бактерію — природною трансформацією.
Група дослідників із Університету Квінсленда (Австралія) вивчала фактори, які спричиняють потрапляння генів стійкості до антибіотиків із середовища у бактерії. Вони дослідили in vitro, як впливають на процес трансформації бактерій популярні безрецептурні та рецептурні лікарські засоби, що не є антибіотиками. Як об’єкт вони обрали поширеного збудника госпітальних інфекцій — бактерію Acinetobacter baylyi — і виявили, що 5 із 6 протестованих ними ліків значно посилюють процес бактеріальної трансформації бактерії та набуття нею стійкості до антибіотиків. До цих засобів належать три НПЗП (ібупрофен, напроксен і диклофенак), гіполіпідемічний засіб гемфіброзил та бета-блокатор пропранолол.
Для суттєвого посилення перенесення ДНК всередину бактерії знадобилися достатньо високі концентрації НПЗП, але гемфіброзил та пропранолол посилювали стійкість A. baylyi до антибіотиків у вельми низьких концентраціях, таких, які можна виявити, наприклад, у стічних водах.
Механізм даного явища, на думку авторів, полягає в тому, що ці ліки спричиняють продукцію реактивних форм кисню, які пошкоджують мембрану бактерій. Це може вбити бактерію (ці ліки якоюсь мірою чинять антибактеріальну дію), але в більшості випадків це просто збільшує проникність мембрани та спрощує входження всередину бактерії екзогенної ДНК, зокрема генів резистентності до антибіотиків. Додавання у середовище речовин, які нейтралізують активні форми кисню, припиняло процес трансформації та набуття A. baylyi антибіотикорезистентності.
Коли частина бактерій набула нових ознак шляхом горизонтального переносу генів, вона може отримати переваги, що сприятимуть її виживанню (для цього бактерії власне і «практикують» обмін генами). * Wang Y., Lu J., Engelstädter J. et al. Non-antibiotic pharmaceuticals enhance the transmission of exogenous antibiotic resistance genes through bacterial transformation // ISME J., Published 18, May 2020. https://doi.org/10.1038/s41396-020-0679-2
ПРАКТИКА
Діареєю зазвичай називають підвищення частоти випорожнень (більше 3 разів на добу), але найважливішою ознакою діареї є більш високий, ніж в нормі, вміст води у фекаліях: незалежно від етіології в патогенезі будь-якої діареї лежить порушення транспорту води і електролітів у травному каналі. Діарея може мати як інфекційне, так і неінфекційне походження, бути гострою або хронічною
При перших проявах гострої діареї слід виключити з раціону гостру та жирну їжу, цільне молоко, сирі овочі та фрукти, алкоголь. Натомість необхідно збільшити споживання рідини (вода, чай, морс, овочеві відвари, розчини для пероральної регідратації) для попередження зневоднення.
До групи протидіарейних ЛЗ належать препарати для патогенетичної (ентеросорбенти, електроліти, антиперистальтичні засоби, пробіотики, ферменти) та етіотропної (протимікробні засоби) терапії.
КИШКОВІ ПРОТИМІКРОБНІ ЗАСОБИ*
Протимікробні ЛЗ призначають у разі вираженої діареї, посилення проявів інтоксикації та за наявності симптомів ураження товстої кишки (біль, метеоризм, тенезми з рідкими випорожненнями із домішками крові та слизу). Антибіотики (фторхінолони, препарати пеніцилінового, тетрациклінового ряду, цефалоспорини тощо) призначає лікар з урахуванням чутливості збудника. За можливості перевагу слід надавати протимікробним ЛЗ, що діють виключно в просвіті кишечнику та не чинять системної дії. • Ніфуроксазид. Похідне нітрофурану, у середньотерапевтичних дозах проявляє бактеріостатичну активність, у вищих — бактерицидну. Після перорального прийому практично не адсорбується з травного тракту. Ніфуроксазид ефективний щодо більшості збудників кишкових інфекцій, зокрема деяких стафілококів та представників родини
Enterobacteriaceae: Yersinia spр., Escherichia spр., Citobacter spр., Enterobacter spр.,
Klebsiella spр., Salmonella spр. У терапевтичних дозах практично не впливає на нормальну мікробіоту товстого кишечнику та не спричиняє розвитку резистентних штамів. При вірусних інфекціях травного тракту ніфуроксазид попереджає розвиток бактеріальних ускладнень. • Бактеріофаги — це віруси, які специфічно вражають бактерії певних штамів або видів, розмножуються всередині бактеріальних клітин та руйнують їх шляхом лізису. Не порушують нормальну кишкову мікробіоту, стимулюють місцевий неспецифічний імунітет. При кишкових інфекціях застосовують перорально і в клізмі. Полівалентні бактеріофаги містять специфічні фаги до основних бактерій-збудників кишкових інфекцій, поширених у популяції. Перед лікуванням рекомендовано визначити фагочутливість збудника захворювання.
ЕНТЕРОСОРБЕНТИ*
Ентеросорбенти зв’язують у травному тракті токсичні речовини, метаболіти бактерій, надмолекулярні структури і клітини, завдяки чому захищають біологічні тканини від механічних та хімічних агресивних факторів, зменшують вираженість оксидантного стресу та запалення, поліпшують показники кишкового мікробіоценозу. Використовують в лікуванні секреторних діарей і вираженого метеоризму. При осмотичній діареї, спричиненій порушенням перетравлювання та всмоктування, ентеросорбенти не показані, адже вони можуть посилити синдром мальадсорбції.
Ентеросорбенти здатні зменшувати ефективність ЛЗ, які застосовують одночасно з ними, тому ентеросорбенти приймають за 1–1,5 год до або після прийому інших ЛЗ. Застосування ентеросорбентів може призводити до дегідратації та дисбалансу електролітів, особливо у дітей, тому їх рекомендовано застосовувати разом із регідратантами. При застосуванні у високих дозах можуть спричиняти виникнення закрепу. • Вугілля активоване (забарвлює випорожнення у чорний колір). • Діосмектит (подвійний силікат алюмінію та магнію). Має високу обволікальну здатність щодо слизової оболонки травного тракту, підвищує її резистентність до подразників. • Метилкремнієва кислота. Адсорбує середньомолекулярні токсичні речовини із вмісту кишечнику та крові (через мембрани капілярів ворсинок слизової оболонки кишечнику), обволікає слизову

оболонку травного тракту та захищає її від ерозивних процесів. Кремнію діоксид. Ефективно сорбує речовини білкової природи та патогенну мікрофлору, слабко сорбує низькомолекулярні сполуки, такі як мінеральні речовини і вітаміни. Обволікає слизову оболонку кишечнику та захищає її від колонізації мікроорганізмами. Блокує дію стимуляторів секреції рідини в кишечнику.
РЕГІДРАТАНТИ*
Містять іони натрію, калію, хлору, гідрокарбонату, цитрату, а також глюкозу, сахарозу або декстрозу. Відновлюють водно-електролітний баланс при діареї та блюванні, попереджають ацидоз. Не мають протипоказань і побічних ефектів. Пероральна регідратація має бути першим заходом, проведеним в домашніх умовах при діареї, найбільш ефективна вона при застосуванні з перших годин захворювання. Неприпустиме додавання цукру в розчини для пероральної регідратації (підвищується осмолярність розчину і, як наслідок, посилюється діарея). При тяжкому зневодненні (зменшення маси тіла понад 9% у дітей, анурія) регідратацію спочатку проводять в/в препаратами для регідратації, а пероральні розчини призначають для продовження терапії.
ЗАСОБИ, ЯКІ ЗМЕНШУЮТЬ МОТОРИКУ ТРАВНОГО ТРАКТУ*
Антиперестальтичну дію чинять холінолітичні засоби, що інгібують моторику та зумовлюють м’язову релаксацію кишечнику, збільшують час проходження вмісту кишечником, знижують частоту дефекації. Якщо протягом 48 год не відмічено клінічного поліпшення, слід припинити застосування антиперистальтичних ЛЗ та звернутися до лікаря.
При діареї інфекційного ґенезу зниження пропульсивної перистальтики може сповільнити елімінацію мікроорганізмів, ускладнити перебіг і поглибити інтоксикацію. Антиперистальтичні ЛЗ не рекомендовані при гарячці, вираженій інтоксикації, кривавій діареї, за підозри на запальну діарею. При виникненні закрепу або при здутті живота прийом антиперистальтичних препаратів необхідно негайно припинити.
• Лоперамід
Агоніст периферичних опіоїдних рецепторів у стінці кишечнику, інгібує вивільнення ацетилхоліну та простагландинів, що знижує пропульсивну перистальтику тонкого кишечнику і частоту дефекації при діареї. Підвищує тонус анального сфінктера, зменшує імперативні потяги до дефекації.
• Лоперамід + симетикон
Симетикон має піногасильні властивості і зменшує вираженість симптомів, пов’язаних з діареєю, в тому числі метеоризм, абдомінальний дискомфорт, здуття та спазми.
ПРОТИДІАРЕЙНІ МІКРООРГАНІЗМИ*
При діареї відбувається порушення складу, чисельності та функцій нормальної кишкової мікробіоти. Для їхнього відновлення, а також пригнічення росту патогенних мікроорганізмів застосовують: пробіотики — препарати, що містять живі культури бактерій; пребіотики — речовини, які стимулюють ріст і розвиток власної нормальної мікробіоти; синбіотики — препарати, що містять пре- і пробіотики. Пробіотики можуть чинити імуномодулювальну дію. Відновлення функцій нормальної кишкової мікробіоти пришвидшує усунення наслідків діареї.
Пробіотики не застосовують одночасно з ферментними препаратами і антацидами. Пробіотики не можна запивати гарячими напоями, вживати одночасно з алкоголем. • Lactobacillus spp. та/або Bifi dobacterium spp.
Є представниками нормальної кишкової

Якщо гостра діарея супроводжується такими симптомами, пацієнт обов’язково має звернутися до лікаря: • гарячка; • блювання; • тривалість діареї більше 48 год; • тяжкий загальний стан; • часта болюча дефекація; • випорожнення з домішками слизу або крові; • ознаки зневоднення (сухість у роті, спрага, сухість шкіри, олігурія)
мікробіоти. Створюють кисле середовище, що пригнічує ріст патогенних і умовно-патогенних бактерій, синтезують бактеріоцини; стимулюють імунітет і місцевий імунітет у кишечнику; запобігають адгезії патогенних мікроорганізмів до стінки кишечнику.
Saccharomyces boulardii
Стримують зростання патогенних і умовнопатогенних мікроорганізмів та грибів; виробляють протеазу, що розділяє бактеріальні токсини і відповідні рецептори ентероцитів; зменшують секрецію води та солей; стимулюють неспецифічний імунний захист; чинять трофічний ефект відносно слизової оболонки тонкого кишечнику. Стійкі до антибіотиків, тому їх можна призначати одночасно з ними.
Bacillus clausii
Інгібують ріст патогенних і умовнопатогенних мікроорганізмів у травному тракті шляхом колонізації вільних екологічних ниш, конкуренції за адгезію к клітинам епітелію, синтезу антимікробних субстанцій та ферментів.
Escherichia coli
Виділяють антимікробні субстанції (мікроцини), активні проти патогенів. Стабілізують слизовий бар’єр та інгібують інвазію патогенів у слизову оболонку товстого кишечнику.
Продукти обміну E. coli, Streptococcus faecalis, L. acidophilus, L. helveticus
Продукти обміну непатогенних кишкових мікробів (виробників молочної кислоти та кишкових симбіонтів) сприяють збереженню фізіологічних функцій слизової оболонки кишечнику та відновленню нормальної мікробіоти. Створюють сприятливі умови для поліпшення всмоктування електролітів (натрій, хлор). Сприяють росту ацидофільної анаеробної кишкової флори, яка є антагоністом патогенів. Не рекомендовано застосовувати їх з молоком або молочними продуктами.
ФЕРМЕНТИ*
Ферментні препарати застосовують при осмотичній діареї, пов’язаній із порушенням функції травних ферментів, або в складі комплексної терапії при діареї інфекційного ґенезу. Ферментні препарати можуть містити пепсин шлункового соку, ферменти підшлункової залози тварин (протеази, амілази, ліпази), ферменти мікробіологічного (ліпаза, мультиензимний комплекс гриба Aspergillus oryzae) та рослинного (папаїн) походження.
Підготувала Тетяна Ткаченко, канд. біол. наук
* Повний перелік протипоказань, побічних реакцій та взаємодій дивіться в інструкціях для медичного застосування відповідних лікарських засобів
ЛІКУВАННЯ ГОСТРОЇ ДІАРЕЇ
Кишкові інфекції — це велика група захворювань з ознаками загальної інтоксикації організму, які уражають шлунковокишковий тракт. Для групи кишкових інфекцій характерна локалізація збудника у різних органах травного каналу, але виділяється він з екскрементами людини і тому домінуючим є фекально-оральний механізм передачі. Циркуляція збудника відбувається по колу: організм теплокровного хазяїна — об’єкти природного середовища — теплокровний хазяїн. До нашого організму бактерії-збудники найчастіше потрапляють із зіпсованими та неякісними харчовими продуктами, зараженою водою, під час купання у забруднених водоймах, через брудні руки і предмети побуту.
ЯКІСНИЙ АНТИМІКРОБНИЙ ЗАСІБ — ПЕРШЕ І ГОЛОВНЕ
Якщо інфекцію не лікувати, патогенні бактерії залишаються в організмі людини. Це небезпечно як для самого хворого, так і для оточуючих. Патогенні бактерії можуть спричинити розвиток хро
нічних захворювань, або людина стає бактеріоносієм і джере
лом зараження оточуючих. Ось чому при лікуванні дуже важливо бути впевненим в елімінації патогенних збудників. Саме тому вибір

якісного антимікробного препарату перш за все має значення для швидкого лікування та запобігання поширенню інфекції.
ШВИДКА ДІЯ ПРИ ДІАРЕЇ
Ніфуроксазид Ріхтер створює високі концентрації виключно в просвіті кишечнику. Широкий спектр антибактеріальної активності і місцева дія зумовлюють вибір цього лікарського засобу для лікування кишкових інфекцій. Для більш швидкої дії ніфуроксазиду має значення ступінь мікронізації. Оскільки ніфуроксазид — це майже нерозчинна субстанція, кількість мікронізованих часток дозволяє швидкому поширенню діючої речовини на більшу площину кишечнику і більш ефективному знешкодженню збудників.
НІФУРОКСАЗИД РІХТЕР — ЕФЕКТИВНІСТЬ ДОВЕДЕНО
Ніфуроксазид Ріхтер виробляють в Європейському Союзі (ТОВ «Гедеон Ріхтер Польща»). В Україні він застосовується понад 25 років. Терапевтична цінність цього лікарського засобу доведена в клінічних дослідженнях, проведених саме у нашому регіоні, враховуючи поширеність і особливості місцевих збудників гострої кишкової інфекції. Згідно з результатами досліджень визначено, що після 6-денного курсу лікування патогенні мікроорганізми зникають у 100% хворих, про що свідчать дані контрольного бактеріального аналізу випорожнень пацієнтів.









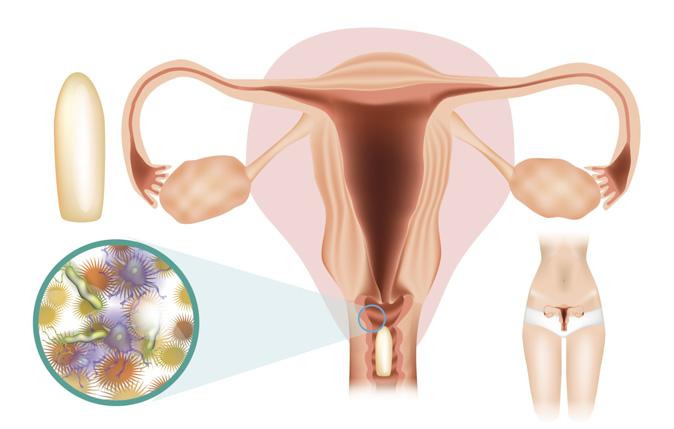
Територія аптеки: відвідувачка з вагінітом
Вагініти є широко поширеною проблемою і одним з найбільш частих приводів звернення як до акушера-гінеколога, так і до фармацевта. Серед різноманітних варіантів вагінальної інфекції безперечними лідерами вважають вульвовагінальний кандидоз (ВВК) і бактеріальний вагіноз (БВ), які виявляють відповідно у 17–39 і 22–50% жінок із патологічними вагінальними виділеннями [1, 2]




ЗБУДНИКИ ПОШИРЕНИХ ВАГІНІТІВ
Збудником ВВК є Candida albicans (близько 80–90% випадків) [2]. У 24–45% випадків діагностують ВВК у поєднанні з БВ — захворюванням, при якому в екосистемі піхви переважають не лактобацили, а асоціація гарднерел, мікоплазм та представників роду анаеробних бактерій Mobilincus [3].
Поєднання ВВК і БВ потребує одночасного лікування обох інфекцій. Але навіть за відсутності клінічних та лабораторних ознак ВВК лікування БВ антибіотиками може призвести до розвитку симптомів кандидозу у разі попередньої колонізації піхви грибами [2].
Пам’ятка провізору
До симптомів вагініту належать: зміна кольору, запаху і кількості вагінальних виділень; свербіж або печіння у піхві; дискомфорт або біль під час статевого контакту; дискомфорт при сечовипусканні тощо. Диференційна діагностика вагінітів є непростим завданням, але за особливостями вагінальних виділень можна припустити тип вагініту: при БВ виділення мають сірувато-білий колір і неприємний рибний запах, особливо виражений після статевого контакту, тоді як при ВВК виділення густі, білі, «сирні», а основним супутнім симптомом є свербіж.
ЗАСОБИ ДЛЯ ЛІКУВАННЯ БВ
Існує два основних шляхи лікування БВ. Перший передбачає застосування метронідазолу або його похідних з групи 5-нітроімідазолів (орнідазол). Зазвичай метронідазол призначають у дозі 500 мг двічі на добу протягом 7 днів або у формі 0,75% гелю 5 г інтравагінально один раз на добу впродовж 5 днів. Кліндаміцин застосовують у формі крему інтравагінально протягом 7 днів. Як альтернативу можна призначати кліндаміцин перорально в дозі 300 мг двічі на добу протягом 7 днів або у формі супозиторіїв один раз увечері 3 доби поспіль. Безперечно, найбільш прийнятною для жінок є найкоротша схема лікування, яка передбачає 3-денний курс кліндаміцину у формі супозиторіїв.
При застосуванні кліндаміцину у формі вагінального крему тривалість лікування становить 3–7 діб.
Перорально 5-нітроімідазол або кліндаміцин рекомендують призначати тільки у разі неефективності інтравагінальної терапії.
Отже, незважаючи на порівняну ефективність метронідазолу та кліндаміцину, останній має очевидні переваги в лікуванні рецидивного БВ завдяки ширшому спектру дії на мікроорганізми. Ефективність 3-денного курсу вагінальних таблеток кліндаміцину порівняна з такою інших курсів терапії, але короткочасність лікування забезпечує більшу прийнятність для жінок [2].
Пам’ятка провізору
Слід пам’ятати про ризики погіршення неврологічного статусу пацієнток з тяжкими, хронічними або гострими неврологічними захворюваннями при застосуванні метронідазолу. Під час лікування метронідазолом не слід вживати алкоголь (можливе виникнення тахікардії, нудоти, блювання, відчуття жару, спастичного болю в епігастральній ділянці, головного болю). Застосування кліндаміцину може призвести до посиленого росту нечутливих мікроорганізмів, зокрема дріжджів. Рекомендовано з обережністю призначати кліндаміцин у формі вагінальних супозиторіїв жінкам із запальними захворюваннями кишечнику, зокрема, із хворобою Крона або неспецифічним виразковим колітом. Застосування кліндаміцину, як і інших антибактеріальних засобів, може спричинити діарею, а в деяких випадках — псевдомембранозний коліт, який може бути як помірнім, так і загрозливим для життя
ЗАСОБИ ДЛЯ ЛІКУВАННЯ ВВК
Терапія ВВК є досить важким завданням: вона залежить від клінічної форми захворювання й стану організму та має суттєві відмінності щодо способу введення лікарських речовин, дози і тривалості лікування. Основ
ною метою терапії є перш за все ерадикація збудника інфекції за умови відсутності негативного впливу препаратів на організм жінки [4].
З метою лікування ВВК використовують протигрибкові препарати для місцевого або системного застосування, зокрема, антимікотики полієнового ряду (натаміцин, ністатин, амфотерицин В); імідазолового ряду (клотримазол, кетоконазол, сертаконазол, еконазол, омоконазол, міконазол, біфоназол, гінезол тощо); тріазолового ряду (флуконазол, ітраконазол); інші препарати (хлорнітрофенол, препарати йоду тощо) [5].
Пам’ятка провізору
Натаміцін у формі песаріїв можна застосовувати у період вагітності або годування груддю, оскільки він не всмоктується через шкіру або слизові оболонки.
Кетоконазол у формі супозиторіїв не застосовують у І триместрі вагітності.
У II–III триместрі та у період годування груддю препарат призначають лише тоді, коли очікувана користь для жінки перевищує потенційній ризик для плода або дитини.
Міконазол у формі крему не застосовують при захворюваннях шкіри, що спричинені вірусами герпесу.
Під час лікування клотримазолом (таблетки вагінальні) слід припинити годування груддю.
Флуконазол у формі капсул не застосовують у період вагітності та годування груддю

МІСЦЕВО АБО СИСТЕМНО?
Основним принципом терапії гострого (неускладненого) ВВК є застосування препаратів місцевої дії.
При повторному епізоді ВВК лікування проводять у пролонгованому режимі або посилюють одноразовим застосуванням системного антимікотика. Лікування неускладненого захворювання дає позитивний результат у 90% випадків навіть за призначення одноразової дози пероральних або короткого курсу місцевих антимікотиків [4].
Перевагами місцевих засобів є створення високих концентрацій діючої речовини безпосередньо в осередку ураження. При цьому значно зменшується ймовірність формування резистентності, а відсутність системного ефекту знижує ризик розвитку побічних ефектів. Крім того, препарати місцевої дії швидше спричиняють клінічний ефект, що є додатковою перевагою при виражених клінічних симптомах захворювання.
Крім того, перевагою системних антимікотиків є їхній розподіл у різних органах і тканинах, що дозволяє впливати на збудник незалежно від його локалізації в організмі без похибок, можливих під час місцевого лікування. Важливою перевагою системних антимікотиків порівняно з місцевими інтравагінальними формами є зручність використання [3]. Щодо віддалених наслідків проведення системної терапії, то вони пов’язані з більш низькою частотою рецидивів [2].
Пам’ятка провізору
Комбіновані препараті метронідазолу та міконазолу у формі вагінальних супозиторіїв не сумісні з алкоголем протягом курсу терапії та впродовж 2 діб після його завершення через можливість виникнення реакцій з боку центральної нервової системи. Також їх не застосовують у І триместрі вагітності, а годування груддю слід припинити (можна відновити через 1–2 доби після закінчення лікування)
ЛІКУВАННЯ БВ ТА ВВК
З огляду на складності виявлення причини БВ та прогнозу перебігу ВВК, оптимальним режимом терапії може стати призначення кліндаміцину (що перекриває широкий спектр некультивованих анаеробів) у вигляді місцевої терапії та флуконазолу як засобу для профілактики і лікування ВВК. Найбільш прийнятним варіантом можна вважати триденний курс кліндаміцину з одноразовим прийомом флуконазолу [2].
Для лікування неспецифічних вагінітів та БВ, особливо хронічних і часто рецидивуючих форм, доцільно використовувати комбіновані місцеві засоби. Зокрема, результати клінічного дослідження свідчать про ефективність комбінованого препарату метронідазолу та міконазолу нітрату порівняно зі стандартними схемами терапії [6].
Також для лікування вагінітів різного походження застосовують препарати у формі капсул, що містять суміш лактобактерій та молочнокислого стрептокока, які відіграють важливу роль у збереженні та нормалізації мікробного балансу слизової оболонки піхви, запобігають розвитку патогенної та умовно-патогенної мікрофлори та сприяють самоочищенню піхви від умовнопатогенної флори.
Підготувала Олександра Демецька, канд. біол. наук Література
1. Мгерян А.Н. Вульвовагинальный кандидоз: эффективность терапии клотримазолом. Эффективная фармакотерапия. 2019;15 (26): 36-41. 2. Кузнецова И.В. Бактериальный вагиноз и вульвовагинальный кандидоз: оптимальные схемы лечения больных с сочетанной инфекцией.
Российский вестник акушера-гинеколога. 2013;13 (3):42-46. 3. Прилепская В.Н., Байрамова Г.Р. Вульвовагинальный кандидоз – современные пути решения проблемы. Трудный пациент. 2006;12. 4. Сергиенко М.Ю. Современные стандарты терапии вульвовагинального кандидоза. Здоровье женщины. 2015;6 (102). 5. Страчунский Л.С., Белоусов Ю.Б., Козлова С.Н.
Антибактериальная терапия. Практическое руководство. – М., 2000. – 189 с. 6. Голяновський О.В., Мехедко В.В., Будченко М.А.
Сучасні підходи до лікування бактеріального вагінозу та змішаних неспецифічних вагінітів.
Health of women. 2017;8 (124):89-95.
EX TEMPORE






Нінель Орловецька, канд. фарм. наук, Оксана Данькевич, канд. фарм. наук, Руслан Редькін, канд. фарм. наук, Національний фармацевтичний університет, Харків


Закони часу все далі і далі відсувають від нас події, факти, імена видатних діячів медицини, важкі уроки і досвід, здобутий дорогою ціною. Досвід з надання медичної допомоги та лікування поранених і хворих у роки Другої світової війни уже став незабутньою історією. Високий рівень розвитку вітчизняної трансфузіології багато в чому забезпечений дослідженнями видатних трансфузіологів, таких як П.Л. Сельцовський (1898–1961) — талановитий клініцист, Заслужений діяч науки. Після закінчення із золотою медаллю гімназії вступив до медичного факультету Московського університету. З 1924 р. працював ординатором хірургічного відділення губернської лікарні м. Орел. У 1929 р. вступив до О.О. Багдасаров, О.К. Гаврилов, М.Г. Карташевський, І.С. Колесніков, аспірантури при 2-му Московському медичному І.Р. Петров, П.Л. Сельцовський, А.М. Філатов, В.М. Шамов, С.С. Юдін інституті. Його вчителями і наставниками були видатні представники і багато інших. Зусиллями цих лікарів у роки війни було врятовано вітчизняної медичної науки: О.М. Бакулев, О.О. Богомолець, А.В. Мартимільйони людських життів. нов, С.І. Спасокукоцький. Завдяки лікарському таланту він зміг за 10 роУ системі лікування поранених велике значення надавалося ранній трансфузійній терапії, спрямованій на поповнен ня гострої крововтрати при пораненнях шляхом переливання крові. У 1943–1945 рр. на фронті одночасно з використанням крові почали широко застосовувати плазму і комбіновані кровозамінники — трансфузин, рідини І.Р. Петрова, В.І. Попова, П.Л. Сельцовського. Однак введення плазмозамінних розчинів, дія яких спрямована на нормалізацію кровообігу, виявилось недостатньо ефективним у боротьбі із шоком.Тому вчені продовжили роботу зі створення ків пройти шлях від аспіранта до професора, працював у хірургічних клініках і в Центральному інституті гематології і переливання крові. У 1936 р. Сельцовський створив власний глюкозоцитратний рецепт консервування та зберігання крові до 20 діб, що дозволило в роки війни забезпечувати консервованою кров'ю медичні установи Західного фронту. У 1942 р. створив власний рецепт протишокової рідини. У 1944–1953 рр. вчений був головним хірургом Військово-повітряних сил. З 50-х років минулого століття активно вивчав проблеми патогенезу та лікування перитоніту і питання антибіотикотерапії. Все життя П.Л. Сельцовський велику увагу приділяв підготовці наукопротишокових розчинів. вих кадрів, опублікував понад 120 наукових робіт, у тому числі 7 мо
Протишокові рідини можна розділити на три групи: нографій і 2 підручники. Нагороджений орденом Червоного Прапо• прості, що містять солі, глюкозу і спирт етиловий; ра, орденом Вітчизняної війни I і II ступеня, двома орденами Червоної • складні, що містять глюкозу, спирт етиловий, броміди і наркотики; Зірки і багатьма медалями • складні, що містять глюкозу, спирт етиловий, броміди, наркотики і плазму крові. Готують протишокові рідини за правилами приготування ін’єкційних
Згідно з цією класифікацією до першої групи належить протишорозчинів (див. статті «Фармацевт Практик» 2017 р. № 3 і № 5). кова рідина ЦОЛІПК за прописом П.Л. Сельцовського. Концентрація спирту етилового у протишокових рідинах стано
Механізм лікувального ефекту глюкозо-спиртових розчинів вить до 33%. Додавання спирту залежить від умов приготування зводиться до нормалізації процесів збудження і гальмування у цента здійснюється двома способами: тральній нервовій системі та усунення потоку нервово-больових 1. Необхідну кількість спирту додають до приготовленого провідчуттів. Останнє досягається шляхом уведення таких речовин, як: стерилізованого розчину. • спирт етиловий, який має знеболювальну, снодійну дію, а також 2. Спирт додають у розчин до його стерилізації. підвищує окиснювально-відновні процеси; Під час приготування спиртових розчинів флакони слід заповню• броміди і наркотики (натрію бромід, морфіну гідрохлорид, барвати на ¾ об’єму, а при стерилізації розчин не повинен контактувати бітал, уретан тощо), що зумовлюють сон та оберігають клітини з пробкою. мозку від виснаження.
РІДИНА П.Л. СЕЛЬЦОВСЬКОГО
ФАРМАКОЛОГІЧНА ДІЯ ПРОТИШОКОВИХ РОЗЧИНІВ
Протишокові розчини (поліглюкін, реополіглюкін, желатиноль, декстран): • підвищують артеріальний тиск; • збільшують масу циркулюючої крові (на короткий термін. У цьому відношенні більш ефективні протишокові розчини з гіпертонічною концентрацією); • нормалізують функції центральної і вегетативної нервової систем; • відновлюють хімізм крові та тканин




СКЛАД Rp.: Natrii chloridi 7,0 R
Kalii chloridi 0,2
Magnesii sulfatis 0,04
Glucosi 54,0
Spiritus aethylici 96% 80 ml
Liquoris Wejbeli 3,3 ml
Aquae pro injectionibus ad 1000 ml
М. Sterilisa!
D.S. Внутрiшньовенно крапельно
Відважують натрію хлорид



Додають калію хлорид та магнію сульфат у колбу



Додають частину води для ін’єкцій


Додають стабілізатор у колбу


Доводять водою для ін’єкцій до позначки та віддають на аналіз



Поміщають натрію хлорид у колбу




Відважують глюкозу
Перемішують до розчинення речовин




Відмірюють спирт етиловий
Фільтрують розчин у флакон для відпуску



Відважують калію хлорид та магнію сульфат


Поміщають глюкозу у мірну колбу


Відмірюють стабілізатор Вейбеля


Додають спирт етиловий у колбу


Перевіряють розчин на відсутність механічних домішок



— Гострий середній отит (ГСО) і біль у вухах, яким він традиційно супроводжується, виникає у третини пацієнтів із патологією ЛОРОльга Полторак органів, — пояснює Ольга Полторак, провізор аптеки № 2 ПП «Ольга» (м. Тульчин).
Захворювання зумовлює запалення слизової оболонки барабанної порожнини, слухової труби і осередку соскоподібного відростка. Проте недуга не виникає без причини, зазвичай їй передує гостра інфекція чи алергічні захворювання верхніх дихальних шляхів — гострі назофарингіт, риносинусит, вдихання тютюнового диму чи інші екзогенні чинники. Це й може призвести до порушень функцій слухової труби та, як наслідок, — до розвитку запалення в середньому вусі.
У 40–50% випадків основним етіологічним чинником розвитку ГСО є Streptococcus pneumoniae, у 30–40% — Haemophilus infl uenzae. Також гострий отит можуть спричиняти різні мікроорганізми (бактерії) і грибкові збудники, у 10% випадків — віруси (аденовірус, риновірус, вірус грипу).
Раніше основною причиною середніх отитів вважали дитячі інфекції (кір, скарлатина, дифтерія), які зумовлювали бурхливий перебіг і гнійно-деструктивний характер запалення. Найчастіше запальний процес спричиняв високовірулентний гемолітичний стрептокок. Але тепер, незважаючи на зниження частоти дитячих інфекцій, захворюваність на середній отит фактично не змінилася. ГСО вважають одним із найпоширеніших захворювань у дитячому віці.
Наприклад, у США 42% рецептів на пероральні антибіотики для дітей виписують саме з приводу середніх отитів. Майже 75% дітей за перші 7 років життя хоча б раз занедужують на ГСО. Також дані статистики свідчать, що до року життя 62,4% дітей хворіють на середній отит однократно, а 17,3% — три рази і більше.
Причиною розвитку сенсоневральної туговухості у дорослих у 25,5% випадків є перенесений раніше ГСО або хронічний гнійний середній отит.
Однак не завжди біль у вусі може бути ознакою серйозного захворювання. Наприклад, у багатьох людей вуха болять після прогулянки під час вітряної погоди. Це можна пояснити тим, що внаслідок дії пориву вітру на вушну раковину утворюєть
ФАРМАЦЕВТ ПРАКТИК 06_2020
WWW.FP.COM.UA


ся болючий синець і шкіра навколо ділянки ураження набуває синюватого кольору. У такому випадку не потрібно ніякого лікування, оскільки з часом біль мине сам собою.
Не менш поширеним чинником є так зване вухо плавця. Якщо у зовнішній слуховий прохід постійно потрапляє вода, вона розм’якшує шкіру і провокує набряк. Що частіше таке повторюється, то вища ймовірність розвитку зовнішнього отиту.
Іноді біль, відчуття закладеності і шум у вухах можуть свідчити про надмірне утворення вушної сірки, яка закупорює вушний прохід. Натомість відчуття сухості у вухах є ознакою недостатньої кількості сірки.
БІЛЬ У ВУХАХ ТЕРПІТИ НАЙВАЖЧЕ
Лікування у разі ГСО призначає лікаротоларинголог індивідуально і відповідно до однієї із трьох стадій захворювання у кожному випадку.
Беручи до уваги, що на кожному із етапів основним симптомом є біль у вусі, сила і вираженість якого залежать від рівня запалення, використання анальгетиків вважають необхідною умовою терапії ГСО. Зазвичай призначають нестероїдні протизапальні препарати (таблетки, капсули, розчини) або місцево-анестезувальні лікарські засоби у формі вушних крапель, якщо існує високий ризик розвитку побічних ефектів внаслідок застосування НПЗП.
Водночас антибактеріальні вушні краплі рекомендують лише у разі перфоративних форм отиту, оскільки через неуражену барабанну перетинку ані антибіотики, ані антисептики не проникають. Також варто пам’ятати про ототоксичність вушних крапель, які містять аміноглікозиди.
Основним методом лікування отитів є емпірична антимікробна терапія. Не всі форми ГСО потребують антибіотиків, але таке лікування знижує ризик розвитку мастоїдиту та інших ускладнень.
До прикладу, тривалість курсу антибіотикотерапії у разі ГСО у США становить 10–14 днів, у Великобританії — 5 днів, у Нідерландах — 6–7 днів. В Україні стандартним вважається 7-денний курс лікування антибіотиками, а в неускладнених випадках середнього отиту — 5-денний.
Якщо антибіотикотерапія виявилася неефективною, варто шукати причини. Серед них називають неадекватне дозування препарату; недостатню всмоктуваність; низьку комплаєнтність; низьку концентрацію препарату в осередку запалення.
Окрім того, варто нагадати про ті антимікробні лікарські засоби, які не варто використовувати у лікуванні отиту. Насамперед це тетрациклін, лінкоміцин, гентаміцин і ко-тримоксазол. Доведено, що ці препарати малоактивні стосовно S. pneumoniaе і H. infl uenzae і проявляють побічні ефекти. Зокрема ко-тримоксазол небезпечний ризиком розвитку синдромів Лайелла і Стівенса — Джонсона, гентаміцин — ототоксичністю.










