

EKG in der Notfallmedizin

Grundlagen – Auswertung – Therapie
2., vollständig überarbeitete Auflage
Ralf Schnelle
Liebe Leserin, lieber Leser,
wir freuen uns, dass Sie sich für dieses Buch entschieden haben. Es wird Ihnen Schritt für Schritt und trotzdem unterhaltsam die Bandbreite der EKG-Diagnostik im Rettungsdienst nahebringen. Die in Verbindung stehenden Rahmenbedingungen in Form von Gesetzen, Verordnungen, Vorschriften sowie von medizinischen Fachinformationen und Normen sind naturgemäß einem steten Wandel unterworfen. Über unser Online-Portal informieren wir Sie über aktuelle Änderungen, die den Inhalt dieses Buches betreffen. Zu Ihrer persönlichen Registrierung nutzen Sie bitte den auf dieser Seite abgedruckten Zugangscode. Unter
www.skverlag.de/portal
können Sie sich damit anmelden.
Wir wünschen Ihnen viel Spaß bei der Lektüre.
Ihr Team des S+K-Verlags
Ihr persönlicher Zugangscode:
EKG-Lineal für Sie inklusive:
Diesem Buch liegt ein EKG-Lineal bei, mit dem Sie die EKG-Interpretation üben können. Wie dieses Lineal am besten angewendet wird, erfahren Sie auf der hinteren Umschlagseite dieses Buches.
mm/s: 3 x RR
mm/s: 6 x
Inferiore Wand ABC (DE) Fr. Rh. QRS Breite P Überl... Q R Zuwachs QRS Details QT Zeit etc. ST und T
Vorderwand





Inferiorer STEMI: Rechtsherzbeteiligung? Vr4 ableiten!
Ralf Schnelle
EKG in der Notfallmedizin Grundlagen – Auswertung – Therapie
EKG in der Notfallmedizin
Grundlagen – Auswertung – Therapie
2., vollständig überarbeitete Auflage
von Ralf Schnelle
Verlagsgesellschaft Stumpf + Kossendey mbH, Edewecht 2024
Anmerkungen des Verlags
Der Autor und der Verlag haben höchste Sorgfalt hinsichtlich der Angaben von Therapie-Richtlinien, Medikamentenanwendungen und -dosierungen aufgewendet. Für versehentliche falsche Angaben übernehmen sie keine Haftung. Da die gesetzlichen Bestimmungen und wissenschaftlich begründeten Empfehlungen einer ständigen Veränderung unterworfen sind, ist der Benutzer aufgefordert, die aktuell gültigen Richtlinien anhand der Literatur und der medizinischen Fachinformationen zu überprüfen und sich entsprechend zu verhalten.
Die Angaben von Handelsnamen, Warenbezeichnungen etc. ohne die besondere Kennzeichnung ®/™/© bedeuten keinesfalls, dass diese im Sinne des Gesetzgebers als frei anzusehen wären und entsprechend benutzt werden könnten.
Der Text und/oder das Literaturverzeichnis enthalten Links zu externen Webseiten Dritter, auf deren Inhalt der Verlag keinen Einfluss hat. Deshalb kann er für diese fremden Inhalte auch keine Gewähr übernehmen. Für die Inhalte der verlinkten Seiten ist stets der jeweilige Anbieter oder Betreiber der Seite verantwortlich.
Zugunsten der Lesbarkeit ist in diesem Buch vereinzelt nur die männliche oder weibliche Sprachform gewählt worden. Alle personenbezogenen Aussagen gelten jedoch stets für Personen beliebigen Geschlechts gleichermaßen.
Bibliografische Information der Deutschen Nationalbibliothek
Die Deutsche Nationalbibliothek verzeichnet diese Publikation in der Deutschen Nationalbibliografie; detaillierte bibliografische Daten sind im Internet über http://dnb.dnb.de abrufbar.
Alle Rechte, insbesondere die der Übersetzung, des Nachdrucks, der Entnahme von Abbildungen oder Textteilen, vorbehalten. Einspeicherung in elektronische Systeme, Funksendung, Vervielfältigung in jeder Form bedürfen der schriftlichen Zustimmung des Autors und des Verlags. Auch Wiedergabe in Auszügen nur mit ausdrücklicher Genehmigung.
EKG in der Notfallmedizin
Ralf Schnelle
© Copyright by Verlagsgesellschaft Stumpf + Kossendey mbH, Edewecht 2024
Satz: Bürger Verlag GmbH & Co. KG, Edewecht
Titelbild: Ralf Schnelle
Abbildungsnachweis: Die in diesem Buch abgedruckten Fotos und Grafiken wurden nahezu vollständig vom Autor zur Verfügung gestellt. Angaben zu weiteren Bildautoren finden sich direkt in den entsprechenden Bildunterschriften bzw. im Literaturverzeichnis.
Druck: Tolek Sp. z o.o., 43-190 Mikolów (Polen)
ISBN 978-3-96461-067-6
Vorwort
An die geneigte Leserin, den geneigten Leser,
ich freue mich, dass Sie dieses Buch gefunden haben – oder geschenkt bekommen haben, noch besser. Bereits die erste Auflage dieses Buches hat eine große Verbreitung erfahren, ich sah es oft in Schulen und sogar im Rettungswagen. Für diese zweite Auflage habe ich das Buch nun vollständig überarbeitet. Ich hoffe, damit einerseits denen (weiterhin) gerecht zu werden, die ein einfaches EKG-Buch in ihrer Hand halten möchten, das man auch als EKG-Novizin oder -Novize verstehen kann. Andererseits soll es auch für diejenigen hilfreich sein, die sich durchaus in die Tiefen der Thematik einarbeiten möchten. Der Begriff „EKG-Nerd“ für Fortgeschrittene in der Kunst der EKG-Interpretation ist aus meiner bescheidenen Sicht eher freundlich gemeint. Dass zwischen diesen beiden Extremen ein fließender Übergang besteht, ist selbstverständlich. Dafür sorgt das bekannte „lebenslange Lernen“.
Das bewährte Prinzip des Buches ist in der neuen Auflage gleich geblieben. Es beginnt mit Grundlagen der EKG-Kunde: Wie entsteht das elektrische Feld im Herzen, das wir an der Körperoberfläche ableiten? Welche Ableitungstechniken gibt es? Wie sollte ein normales EKG aussehen? Mit solchen Fragen muss sich ein Anfänger in der EKG-Kunde zunächst ein-
mal intensiv beschäftigen. Dazu lernt er das Konzept der Vektoren kennen. Wenn man das verinnerlicht hat, lassen sich viele EKG-Details ganz einfach verstehen. Auch der Übergang von einem einfachen EKG-Befund zu einer äußerst komplexen Fragestellung ist fließend. Eine EKG-Expertin stellt sich möglicherweise die konkrete Frage, welche Befunde noch als Normalvariante und welche Zacken und Wellen bereits als dringend krankheitsverdächtig gelten müssen. Sie wird in den weiterführenden, in dieser zweiten Auflage neu sortierten Kapiteln mit sehr großer Wahrscheinlichkeit Antworten auf ihre Fragen finden. Vielfach habe ich im Rahmen von Aus- und Fortbildungen im rettungsdienstlichen und auch ärztlichen Umfeld gemerkt, dass EKG-Fragen zunehmend auch sehr in die Tiefe gehen. Dieses Buch soll für alle nicht nur ein Lernbuch sein, sondern gerade auch ein Nachschlagewerk für solches Detailwissen. Ich habe versucht, alle für die präklinische und innerklinische Notfallmedizin relevanten Aspekte des EKG in hoffentlich für alle verständlicher Form zusammenzufassen. Wie bisher ist bei ausgewählten Themen auch die Therapie eingeflossen, was andere EKG-Bücher nicht bieten. Ich habe dabei versucht, nicht nur zu kopieren, was in den bekannten Algorithmen steht, sondern auch das Kleingedruckte aus vielen Leitlinien, Lehrbüchern und verlässlichen Internetquellen und damit ärztliches Erfahrungswissen einzubeziehen.

Angesichts der Komplexität vieler Themengebiete kann es sein, dass man erschrickt, wenn man als Anfänger die Kapitel über zum Beispiel die verschiedenen Krankheitsbilder aufschlägt. Muss ich das alles lernen? Du meine Güte, ist das wirklich so kompliziert? Die gute Nachricht lautet: Nein. Man kann über das EKG nicht alles wissen. Aber man muss wissen, wo man nachschlagen kann. Stück für Stück muss man sich dieses Gebiet der Medizin erarbeiten, wenn man mit akut kranken Menschen zu tun hat. Ich habe vor über 40 Jahren begonnen, rettungsdienstliche EKG zu schreiben und auch auszuwerten. Bereits als Rettungssanitäter hatte ich Mitte der 1980er Jahre ein 5-Pol-Kabel auf dem RTW und konnte zwölf Standardableitungen dokumentieren. Zu damaligen Zeiten gab es noch viel Gegenwind: „Ein 12-KanalEKG braucht man doch nicht außerhalb der Klinik“ und so weiter. Heute ist das glücklicherweise anders: Da weist auch schon die angehende Notfallsanitäterin im zweiten Jahr ihrer Ausbildung den erfahrenen Hausarzt darauf hin, dass bei diesen seltsamen ST-Strecken-Veränderungen ergänzende EKGAbleitungen geschrieben werden müssen. Und der erfahrene Hausarzt weiß zwar schon extrem viel, für notfallmedizinisches Spezialwissen mag aber auch ihm dieses Buch als Nachschlagewerk empfohlen sein.
„Spezielle EKG-Diagnostik lernen brauchen wir doch gar nicht mehr in Zeiten der künstlichen Intelligenz. Die wird uns doch alles abnehmen.“ Das stimmt sicherlich in ganz vielen Bereichen, auch der Notfallmedizin und auch bei der Deutung von EKG-Kurven. Die KI in der EKG-Interpretation ist schon recht weit. Aber ganz allein, ohne die gute Ausbildung von uns Menschen und unsere täglich größer werdende mensch-

liche Erfahrung, wird sie auf absehbare Zeit die EKG-Interpretation nicht vollständig übernehmen. Die KI bei der EKGAuswertung sinnvoll einzusetzen, wird für uns alle aber bald zum Alltag werden. Apropos KI: Dieses Buch wurde explizit nicht mit und mithilfe von KI erstellt. Hinweisen möchte ich allerdings auf die Tatsache, dass ich einige EKG aus optischen Gründen grafisch nachbearbeitet habe. Dabei blieb die medizinische Aussagekraft jeweils selbstverständlich unverändert.
Ein großer Dank gebührt all denen, die mich in vielen Fachgesprächen oder auch im Rahmen von Fortbildungen immer wieder mit Fragen gelöchert und mir dadurch gezeigt haben, wo die elektrokardiografischen Knackpunkte sind. Das sind zum Beispiel die vielen lieben Kolleginnen und Kollegen u. a. aus „meinen Rettungsdienst-Bereichen“ Mühlacker und Stuttgart, den Bildungseinrichtungen der DRK-Landesschule Baden-Württemberg sowie allen anderen, die ich schon für EKG-Fortbildungen besuchen durfte. Meinen Kollegen Hendrik Sudowe und Peer Knacke bin ich äußerst dankbar für die sorgfältige Durchsicht mit zahlreichen wichtigen Hinweisen und Vorschlägen, genauso allen im Verlag Stumpf + Kossendey, ganz besonders Sandra Reker. Und nicht zuletzt meiner Familie für ihr Verständnis, dass ich für dieses Projekt häufiger am Rechner als auf Spaziergängen oder bei der gemeinsamen Vogelbeobachtung war.
Ich wünsche allen Leserinnen und Lesern ganz viel Erfolg auf dem Weg zum EKG-Expertenstatus und freue mich schon jetzt auf zahlreiche Zuschriften mit Fragen und Hinweisen, falls sich trotz sorgfältiger Arbeit doch der eine oder andere Fehler eingeschlichen haben sollte.
Ihr Ralf Schnelle

Die systematische Auswertung eines EKG 5
In der Notfallmedizin kann man ein EKG nicht immer ganz so sorgfältig betrachten wie sonst in der Medizin. So darf man die Bestimmung des Lagetyps gern auch mal vernachlässigen, wenn man die Hauptdiagnose erkannt hat (z. B. STEMI) und die Patientin sowieso in ein Krankenhaus bringt. Wenn sie die Mitfahrt verweigert, muss man aber deutlich sorgfältiger sein, um sie richtig aufklären zu können, was eventuell los ist. Wie immer in der Notfallmedizin hat sich das Vorgehen nach Checkliste bewährt.

Es gibt verschiedene Schemata zur Auswertung eines EKG. Das hier vorgeschlagene (Tab. 5.1) ist selbstverständlich das allerbeste (Scherz). Zu einer solchen standardisierten Auswertung eines Notfall-EKG gehört immer die Patientenbeurteilung (SAMPLE- und ABCDE-Schema). Jemand mit Brustschmerz und Infarktanamnese oder jemand mit Digitalismedikation muss anders bewertet werden als der junge Kollege, der sich ohne Grund ein EKG ableitet. Die Bewusstseinslage sowie die Atemwege (A), die Belüftung der Lungen (B) und der Kreislauf (C) gehören ebenso überprüft wie weitere neurologische Aspekte (D) sowie weitere körperliche Befunde (E). Erst dann folgt die genaue Betrachtung des EKG. In Reanimationssituationen gelten andere Regeln. Hier wird man nach Feststellen von Bewusstlosigkeit und fehlenden Lebenszeichen zu reanimieren beginnen und rasch eine EKGAbleitung anstreben, bei der es zunächst nur um die Fragen geht, ob ein defibrillationswürdiger Rhythmus (VF/VT), eine Asystolie bzw. welche Form einer pulslosen elektrischen Aktivität (PEA) besteht.
Es ist sinnvoll, jedes EKG in einer standardisierten Weise auszuwerten.

Die ersten drei EKG-Aspekte betreffen wichtige Eckdaten, mit denen man z. B. bei kritischen Tachykardien schon alles Wesentliche beschreiben kann: Frequenz, Rhythmus und QRS-Breite. Die wichtigsten Tachykardien kann man mit diesen drei Informationen nämlich schon voneinander abgrenzen. Deshalb beginnen wir nach der Feststellung des Patientenzustandes die eigentliche EKG-Auswertung immer mit diesen Aspekten. Die Herzfrequenz wird oft vom Gerät angezeigt, das sich aber manchmal täuscht und z. B. T-Wellen mitzählt. Probleme gibt es auch bei Arrhythmien. Auf einem
Tab. 5.1: Standardisierte Auswertung eines Notfall-EKG. Die ersten vier Aspekte können bei Tachykardien eine zunächst ausreichende Diagnose ermöglichen.
‒ Wie geht es dem Patienten?
‒ Herzfrequenz
‒ Rhythmus
‒ QRS-Breite
‒ P-Wellen (Aussehen und Überleitung auf die Kammern)
‒ Q-Zacken
‒ R-Zacken-Zuwachs in den Brustwandableitungen
‒ S-Zacken bzw. alle weiteren QRS-Komplex-Details
‒ ST-Strecke und T-Welle
‒ Zeiten (PQ- und vor allem die QT-Zeit)
‒ Weiteres
EKG-Ausdruck kann man die Herzfrequenz recht einfach bestimmen. In Abbildung 5.1 ist eine schöne Methode zur orientierenden Bestimmung der Herzfrequenz gezeigt, die Runterzählmethode. Man sucht sich einen QRS-Komplex, der auf einer fett gedruckten Linie liegt, und überprüft dann den RR-Abstand, also wann der nächste QRS-Komplex kommt. Dabei springt man in Gedanken in definierten Schritten weiter und zählt die Zahlen 300 – 150 – 100 – 75 – 60 – 50 – 43 mit, die man dafür natürlich auswendig kennen muss. Wenn der nächste QRS-Komplex nach der 150, aber bereits vor der Zahl 100 kommt, so muss die Herzfrequenz dazwischen liegen. So kann man auch die Frequenz von P-Wellen bestimmen, falls diese von der Ventrikelfrequenz abweichen sollte. Ganz bedeutsam ist dabei die Kenntnis der Schreibgeschwindigkeit, also des Papiervorschubs. Bei 50 mm/sec muss man in Zentimeterschritten weiterspringen, bei 25 mm/sec reichen 5-mm-Schritte, was den fett gedruckten Kästchen des EKG-Papiers entspricht. Nach fünf Schritten, also bei der Zahl 60, ist man dann 50 mm bzw. 25 mm weit gekommen, passenderweise gehört zu einem RR-Abstand von einer Sekunde auch die Herzfrequenz 60/min.
Bei extremen Tachykardien darf man sich auch z. B. eine Sekunde markieren, also einen Abschnitt von 50 oder 25 mm EKG-Papier. Die Zahl der RR-Abstände in diesem Abschnitt multipliziert mit 60 ergibt die Herzfrequenz. Man darf nicht die Zacken in diesem Abschnitt zählen, das könnte eine zu viel sein. Es kommt auf die „Hüpfer von R-Zacke zu R-Zacke“ an. Diese entsprechen einem zentralen Puls. Bei einem unregelmäßigen EKG empfiehlt sich, einen 6-Sekunden-Abschnitt herbeizunehmen. Nehmen wir als Beispiel eine absolute Arrhythmie bei Vorhofflimmern, denn hier wechselt der RRAbstand von Schlag zu Schlag. In einem abgemessenen 6-secAbschnitt zählt man nun die RR-Zwischenräume aus (Hüpfermethode). Die gefundenen RR-Abstände multipliziert man mit 10. Wer Kopfrechnen kann, ist bei solchen komplexen Berechnungen nun klar im Vorteil. Apropos: Ein Mathematiker kann bei einem regelmäßigen EKG auch aus dem RRAbstand (gemessen in ganzen Sekunden) die Herzfrequenz f [1/min] berechnen, und zwar nach der Formel f = 60/RR [sec]. Im Zusammenhang mit dem Thema Rhythmus gibt es mehr Aspekte als die Unterscheidung zwischen regelmäßig und unregelmäßig. Wir unterscheiden 1. rhythmisch, 2. im Prinzip rhythmisch (z. B. mit einzelnen Extrasystolen) und 3. absolut arrhythmisch. Ein eigentlich regelmäßiger Rhythmus kann gerade bei jungen Menschen beim Atmen schneller (Einatmung) und wieder langsamer (Ausatmung) werden. Das liegt am Einfluss des vegetativen Nervensystems. Da sprechen wir von einer respiratorischen Sinusarrhythmie und bewerten das als einen Normalbefund. Selbstverständlich kann – gerade bei Älteren – eine Sinusarrhythmie auch Ausdruck einer Krankheit sein. Dann gibt es regelmäßige Herzrhythmen, die ab und zu von Extrasystolen unterbrochen werden, entweder von supraventrikulären (SVES) oder von ventrikulären (VES). Deren Bedeutung ist immer abhängig von ihrer Häufigkeit und der Grunderkrankung (→ Extrasystolie: Kap. 11.1.1). Ein dritter, wichtiger Rhythmusbefund ist der einer absoluten Arrhythmie. Bei einer solchen ist gar keine Regelmäßigkeit mehr erkennbar. Die allerhäufigste Ursache hierfür ist Vorhofflimmern. Dieses kann
MERKE


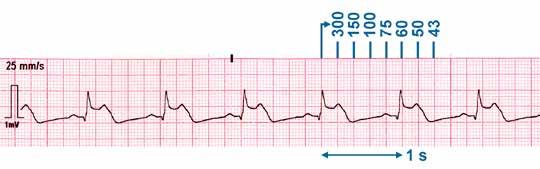



Abb. 5.1a: Bestimmung der Frequenz bei regelmäßigem EKG: Man sucht eine Struktur, die auf einer Linie liegt. Bei einem Papiervorschub von 50 mm/sec nimmt man von dort 1-cm-Schritte und zählt die abgebildeten Zahlen runter bis zur nächsten Struktur.
Abb. 5.1b: Bei 25 mm/sec zählt man entsprechend nur 5-mm-Schritte. Man zählt also den Abstand runter, hier den von QRS-Komplexen, und hat die Herzfrequenz. Im ersten EKG ist sie irgendwo zwischen 100 und 150/min, im zweiten EKG bei 43/min.
Abb. 5.1c: Die Kenntnis, wie breit eine Sekunde ist, hat man durch den angegebenen Papiervorschub. Das kann helfen: Ein Schlag pro Sekunde heißt 60/min.
Abb. 5.1d: Bei Tachykardien eignet sich diese Technik: Man zählt, wie oft das Herz pro Sekunde schlägt, wobei man nicht den ersten und letzten QRS mitzählen darf, sondern nur die Hüpfer zwischen zwei Komplexen („Hüpfermethode“).
Abb. 5.1e: Man kann auch 6 sec oder alternativ 3 sec auf dem Papier markieren und zählt die Hüpfer in diesem Zeitraum. Der Rest ist höhere Mathematik.
Abb. 5.1f: Das eignet sich besonders bei unregelmäßigen EKG, hier eine absolute Arrhythmie bei Vorhofflimmern. In 6 sec passen 8,5 Hüpfer, ergibt nach Adam Riese 85/60 sec, also 85/min.
in Einzelfällen gelegentlich pseudorhythmisch aussehen, gerade bei hohen Herzfrequenzen. Dann erkennt man die Arrhythmie nur bei sehr genauem Hinsehen (und besonders gut bei eingeschaltetem Systolenton). Manchmal gibt es bei Patienten mit Sinusrhythmus auch so viele SVES, dass (nur) das Bild einer absoluten Arrhythmie entsteht, aber P-Wellen klar abgrenzbar sind. P-Wellen schließen Vorhofflimmern aus. Ein Wechsel zwischen verschiedenen Rhythmen, z. B. zwischen Sinusrhythmus und absoluter Arrhythmie bei Vorhofflimmern, ist selbstverständlich auch denkbar (→ Vorhofflimmern: Kap. 11.2).
Bei der Betrachtung eines EKG lohnt nach Analyse von Frequenz und Rhythmus als nächster Schritt die Betrachtung der QRS-Komplex-Breite. Wie gesagt können damit bei ausgeprägten Arrhythmien schon ausreichend Rückschlüsse gezogen werden. Eine Tachykardie muss in der Notfallmedizin gar nicht exakt weiter spezifiziert werden, wenn man bei einem instabilen Patientenzustand z. B. eine regelmäßige Tachykardie mit breitem QRS-Komplex erkannt hat und die Entscheidung zur Kardioversion fällen kann. Aber auch bei nicht tachykarden EKG lohnt es sich, die Breite der QRS-Komplexe genauer zur Kenntnis zu nehmen. Bei einem sonst auf den ersten Blick nicht sonderlich auffälligen EKG kann z. B. eine QRS-Verbreiterung ein wichtiger Hinweis auf z. B. eine Intoxikation oder eine Elektrolytentgleisung sein (→ breite QRS-Komplexe: Kap. 7.5).
Bei einer detaillierteren EKG-Interpretation betrachtet man anschließend die einzelnen Abschnitte in zunächst alphabetischer Reihenfolge. Dadurch erhöht sich die Wahrscheinlichkeit, dass nichts Entscheidendes übersehen wird. Man sucht die P-Wellen, bei denen Aussehen und der Zusammenhang mit den QRS-Komplexen bewertet werden. Die Form der P-Wellen kann wichtige Zusatzinformationen geben, die Überleitung auf die Kammern ist bei AV-Blockierungen gestört (→ mehr zu P-Wellen: Kap. 6, → AV-Blockierungen: Kap. 11.4.2).

Abb. 5.2: Artefakte. Auf diesem Streifen sind nur drei QRSKomplexe abgebildet (markiert), der Rest besteht aus elektrischen Impulsen, die durch einen Hirnschrittmacher (gibt’s!) verursacht wurden.
Die konkrete Suche nach Q-Zacken identifiziert so manchen Herzinfarkt, noch bevor wir eine ST-Strecken-Analyse vorgenommen haben. Breite und tiefe Q-Zacken entstehen durch den Verlust von Muskelmasse bei ST-Hebungsinfarkten. Über einer Narbe verschwindet der Kammervektoranteil, der sich als schön aufsteigende R-Zacke zeigen würde. Naturgemäß sind sie bei ganz frischen Ereignissen noch nicht zu sehen (→ Cabrera-Stadien: Kap. 9.3.1). Nach Q kommt R und bei diesem Buchstaben geht es konkret um den R-Zuwachs in den Brustwandableitungen. Das langsame Anwachsen der QRS-Komplexe dort entspricht der Annäherung an die Vektorschleife. Auch hier geht es unter anderem um dort abgelaufene Infarkte. Ein Muskelverlust führt dort zu Q-Zacken, zu einem fehlenden R-Zuwachs oder auch mal zu einem abrupten R-Verlust von einer zur nächsten Ableitung. Immer muss man voraussetzen, dass die Elektroden von V1 – V6 in richtiger Höhe und in einer ordentlichen Reihe angeordnet wurden. Beim Aspekt S weiß man zuerst nicht, warum man konkret nach S-Zacken suchen soll. Muss man auch gar nicht: Man nimmt den Buchstaben S einfach als Anlass, allgemeine QRS-Aspekte zu betrachten. Das beginnt mit dem Lagetyp und geht nahtlos weiter mit anderen Details: Bestehen Schenkelblockbilder, Hypertrophiezeichen, Delta-Wellen oder andere Auffälligkeiten (→ QRS-Auffälligkeiten: Kap. 7)?
Nach QRS kommt die Betrachtung der Endstrecken (STStrecken und T-Wellen), die wir gemeinsam inkl. eventueller U-Wellen beurteilen. Da gilt es angesichts vieler möglicher Veränderungen, genau hinzuschauen (Kap. 8).
Mit den T-Wellen endet vielleicht eine Herzaktion, aber noch nicht die EKG-Diagnostik! Man darf nicht vergessen, die Zeiten auszumessen. Um die PQ-Zeit haben wir uns beim Thema P-Wellen-Überleitung schon gekümmert. Nun geht es besonders um die QT-Zeit (vgl. u. a. Kap. 4.5). Die QRS-Breite ist auch eine messbare Größe, wurde aber schon betrachtet. Eine Gesamtschau über das EKG erfasst zuletzt noch weitere Einzelaspekte wie z. B. Schrittmacherspikes oder Muskelzittern. Muskelartefakte sind nicht die einzigen externen Faktoren, die ein EKG erheblich verändern können. Auch durch elektrische Störfelder, von Hochspannungsleitungen über Sendemasten bis hin zu Heizdecken, sind vielfältige Artefakte möglich (Abb. 5.2). Artefakte sind Kunstprodukte, also EKG-Befunde, die nicht vom Patienten kommen, sondern eine technische oder externe Ursache haben.
Am EKG in Abbildung 5.3 soll die EKG-Auswertung beispielhaft vorgenommen werden: Der 56-jährige Patient hatte vor einer Woche länger anhaltend starke Brustschmerzen und war jetzt kollabiert. ABC und D sind inzwischen stabil. Die Frequenz wird mit 76/min richtig vom Gerät angezeigt, das EKG ist rhythmisch, die QRS-Komplexe sind mit knapp 0,1 sec noch schmal, die Erregungsausbreitung läuft also regulär über die Tawara-Schenkel. An normalen P-Wellen vor jedem QRS sieht man, dass es sich um einen Sinusrhythmus handelt. Der P-Vektor zeigt nämlich nach links unten. Die P-Welle ist weder verbreitert noch überhöht. Die PQ-Zeit ist mit 0,19 sec noch normal. Bei der Suche nach Q-Zacken wird man in den Ableitungen I und aVL fündig. Wie auch in V6 sind diese noch nicht signifikant großen Q-Zacken für sich genommen unverdächtig. Sie sind Ausdruck einer nor-

Abb. 5.3: Beispiel für die Auswertung eines rettungsdienstlichen EKG (vgl. Text)
malen Septumerregung. Allerdings befinden sich hier auch Q-Zacken an der Vorderwand. Sie ersetzen den dort normalen R-Zuwachs, der an dieser Stelle fehlt. Nach einer kleinen r-Zacke in V1 (manchmal bezeichnet man bei der EKGBewertung kleine Zacken bewusst mit kleinen Buchstaben) sieht man fast einen kompletten R-Verlust von V2 – V4. Ein fehlender R-Zuwachs spricht für verloren gegangene Muskelmasse über der Vorderwand. Beginnend bei V4 kommen dann noch R-Zacken. Hinsichtlich des gesamten QRS-Komplexes besteht in den Extremitätenableitungen eine grenzwertige Niedervoltage. Die Ableitung aVF ist plus-minusnull: Hier besteht ein Linkslagetyp. Weder Rechts- noch Linksschenkelblockzeichen sind erkennbar. Die ST-Strecken sind bereits in den Extremitätenableitungen nicht normal: In Ableitung I und aVL ist die Form von ST konvexbogig aufgebuckelt, auch wenn formal keine ST-Hebung vorliegt. ST geht
dort über in negative T-Wellen. Vor allem in Ableitung III und ein wenig auch in Ableitung aVF ahnt man ein Spiegelbild dieser Veränderungen. In den Brustwandableitungen allerdings ist es viel deutlicher: Mit V1 wäre man noch halbwegs zufrieden, von V2 bis V5 – also dort, wo Muskelmasse fehlt –ist ST am J-Punkt minimal angehoben und verläuft konvexbogig (aufgebuckelt) in terminal negative T-Wellen übergehend. Die QT-Zeit ist mit 0,39 ms (um 110 %, QTc 440 ms) nur gering verlängert.
Zusammenfassend besteht ein normofrequenter Sinusrhythmus mit den Zeichen eines Vorderwandinfarktes (STEMI) im Stadium I – II. Das passt zu den thorakalen Schmerzen vor einer Woche. Inwieweit die grenzwertige periphere Niedervoltage Ausdruck eines Perikardergusses sein kann (Kollaps!), muss die Ultraschalluntersuchung klären (→ STEMI: Kap. 9.3).
9.1 Allgemeines zum ACS
9.1.1 Definitionen
Der Begriff koronare Herzkrankheit (KHK) ist veraltet. Diese Erkrankung der arteriellen Blutgefäße des Herzens in der Form eines stabilen Dauerzustands nennt man heute chronisches Koronarsyndrom (CCS). Ausgelöst wird sie durch atherosklerotische Veränderungen der Koronararterien (Herzkranzgefäße). Klassische Risikofaktoren sind Diabetes mellitus, Bluthochdruck, Fettstoffwechsel- bzw. Fettverteilungsstörungen sowie Rauchen. Das Thema Vererbung ist ebenfalls sehr bedeutsam.
Ablagerungen in der Gefäßwand wachsen langsam und chronisch. Erst wenn diese „Plaques“ die Koronararterie kritisch einengen, spürt der Betroffene die typischen Beschwerden. Als stabile Angina pectoris (wörtl.: Brustenge) bezeichnet man eine Symptomatik der koronaren Minderdurchblutung, die im zeitlichen Verlauf nicht schlechter wird. Ein klassischer Auslöser für akut verlaufende Verschlechterungen ist die Ruptur, also das Einreißen der Deckplatte einer Plaque, mit nachfolgender Thrombose. Wir nennen alle solchen Situationen, bei denen jemand neu auftretende oder stärker als bekannt auftretende Symptome hat, akutes Koronarsyndrom (ACS). Das ist formal zunächst eine Arbeitsdiagnose, bei der wir eine koronare Minderdurchblutung vermuten. Sobald wir die Situation einer der Formen dieses Krankheitsbildes zuordnen können, benennen wir eine der drei ACS-Entitäten
– instabile Angina pectoris
– NSTEMI (Nicht-ST-Hebungsinfarkt)
– STEMI (ST-Hebungsinfarkt).
Der Begriff NSTE-ACS steht dabei für die ersten beiden Formen, die ST-Strecken sind hier nicht angehoben. Eine instabile Angina pectoris (A. p.) ist dadurch gekennzeichnet, dass keine relevante Muskelmasse abstirbt, anders gesagt, dass die Herzenzyme im Verlauf der nächsten Stunden nicht signifikant ansteigen. Sie unterscheidet sich von der stabilen A. p. dadurch, dass die Patientin entweder in Ruhe oder unter Belastung bereits früher als sonst Beschwerden hat oder dass es stärkere Beschwerden sind als üblich. Das EKG kann verändert, aber auch normal sein. Zur näheren Differenzierung von Symptomen kann die OPQRST-Anamnese dienen, auf die hier aber nicht näher eingegangen werden soll. Ein NichtST-Hebungsinfarkt (NSTEMI) (Non-ST-Elevation Myocardial Infarction) geht mit einem Anstieg von Herzenzymen (z. B. Troponin) einher, Herzmuskelzellen sterben hierbei ab. Eine Troponinmessung im Rettungsdienst ist bislang unüblich und erscheint aktuell nicht zwingend erforderlich. Wichtig ist aber Folgendes: Wir müssen rasch erkennen, wenn ein einzelnes Blutgefäß akut verschlossen ist. Offiziell bereits innerhalb der ersten zehn Minuten nach Erstkontakt mit dem Patienten. Einen Gefäßtotalverschluss nennen manche Notfallmediziner heute okklusiven Myokardinfarkt (OMI) und beziehen auch vergleichbar gefährliche Situationen ein. Ein solcher Befund muss so rasch es geht interventionell behandelt werden. Früher hat man häufig lysiert, also Gerinnsel
auflösende Medikamente gespritzt. Heute geschieht die Wiedereröffnung des Blutgefäßes (Rekanalisation) in der Regel im Rahmen einer Herzkatheterintervention. Ein wichtiges EKG-Phänomen eines okklusiven Infarktes sind ST-Hebungen. Ein OMI ist also ein STEMI, eben ein ST-Hebungsinfarkt, und zwar aktuell, vor kurzem oder akut drohend. Sobald wir bei ACS-Patienten signifikante Hebungen sehen, benennen wir das als STEMI. Eine betroffene Patientin muss dann so schnell es geht in ein Herzkatheterlabor. Wer nicht schon weiß, dass bei einem STEMI ein Vektor in Richtung Herzinfarktgebiet zeigt, der mag kurz einen Ausflug ins Kapitel 9.4 machen. In der Abbildung 9.7 wird erklärt, warum es bei einer Gefäßtotalokklusion zu ST-Hebungen kommt.
Ein ACS ist nicht ausgeschlossen, wenn ein EKG völlig unauffällig ist. Und die klinischen Symptome müssen immer in die Interpretation einbezogen werden.

Man unterscheidet offiziell ganz verschiedene Arten von Herzinfarkten. Der Klassiker ist – wie angesprochen – die akute Thrombose bei Plaqueruptur. Wenn z. B. im Rahmen einer Schocksituation ein vorübergehender Sauerstoffmangel zu einem Troponinanstieg führt, dann ist das auch ein Herzinfarkt, aber mit einer ganz anderen Pathophysiologie. Man muss wissen, dass in einem ACS oft Dynamik ist. Es gibt Gefäßokklusionen, die sich spontan wiedereröffnen (Reperfusion). Dann war das nur vorübergehend ein STEMI, danach erfüllt die Situation wieder alle Kriterien eines NSTEMI. Vor allem bei jüngeren Frauen kommen nicht selten Koronardissektionen vor. Es gibt Gefäßspasmen, die sich auch wieder lösen können, und Fälle mit einer minimalen Restdurchblutung, was den EKG-Verlauf erheblich beeinflussen kann. Bei einem anderen Patienten beginnt das ACS ohne Hebungen und bei Klinikaufnahme zeigt das EKG plötzlich einen STEMI. Wir sehen: Der Übergang von A. p. über NSTEMI zum STEMI kann fließend sein und manche Infarkt-ST-Hebungen gehen von allein wieder zurück. Jeder ACS-Patient ist potenziell bedroht! Mehr Details wollen wir hier bewusst nicht diskutieren, sie können an anderer Stelle nachgelesen werden. Vieles findet sich in Leitlinien zum STEMI (Ibanez et al. 2017) und zum NSTE-ACS (Collet et al. 2021). In der europäischen ACS-Leitlinie werden die beiden Entitäten gemeinsam behandelt (Byrne et al. 2023a und 2023b). Über weitere spezielle ACS-Aspekte wie einen MINOCA-Infarkt oder Ähnliches kann man dort und in anderer Literatur viel nachlesen (Thygesen et al. 2018).
An dieser Stelle ein Statement zu dem Fall, dass man „mit der Diagnose daneben liegt“. Sollten wir bei einem Rettungsdiensteinsatz oder in der Notaufnahme einmal unnötigerweise einen STEMI-Alarm geben, so macht das grundsätzlich nichts. Das passiert selbst Erfahrenen, sagen wir in ungefähr 10 % der Fälle. Im weiteren Verlauf wird das Herz-
MERKE
katheterteam alarmiert und sich, eventuell gar von zu Hause aus, auf den Weg machen und das Katheterlabor besetzen. In neun von zehn Fällen zu Recht. Bei jedem zehnten Fall meint dann die Diensthabende, sie und auch ihr Mitarbeiter seien zu Unrecht alarmiert worden. Diesen Patienten hätte man auch am nächsten Morgen (oder gar nicht) kathetern können. Beim nächsten Mal würde womöglich gefordert, dass wir mit einem STEMI-Patienten zunächst in die Notaufnahme kommen sollen. Dort würde man die Diagnose dann noch einmal kontrollieren. Diese Vorgehensweise ist bekanntlich mancherorts ein Klinikstandardverfahren. Hierunter leiden aber die verbleibenden 90 % der Patienten, bei denen wir im Rettungsdienst die STEMI-Diagnose richtigerweise gestellt haben! Daher ist solches entschieden abzulehnen. Wenn wir im Rettungsdienst einen STEMI diagnostizieren, dann gilt das zunächst als STEMI (Scholz 2015). Mit allen Konsequenzen. Das Katheterteam hat sich sofort auf den Weg zu machen. Andernfalls geht für die große Mehrheit der Fälle, in denen wir recht haben, wertvolle Zeit verloren. Time is Myocardium. Sollten sich Kliniken bzw. Herzkatheteristen mit diesem Gedanken nicht anfreunden, mögen sie Telemetriesysteme für alle eingesetzten Rettungsmittel etablieren, dann könnten sie als Experte bereits früh das EKG selbst betrachten.
9.1.2 Die Blutversorgung des Herzens
Für das Verständnis von Herzinfarkten ist es hilfreich, sich auch ein wenig mit den das Herz versorgenden Blutgefäßen zu beschäftigen (Abb. 9.1). So manche Komplikation kann man vorhersagen, wenn man die Zusammenhänge kennt. Bei der Interpretation von Infarkt-EKG müssen wir die Sache dreidimensional betrachten, also räumlich: Einen STEMIHerzvektor gibt es nur in der jeweils betroffenen Region des Herzens. Entsprechend sind die klaren Infarktzeichen auch nur in den EKG-Ableitungen zu finden, deren Ableitungsvektoren in die betroffene Richtung zeigen. Die dorthin führende Koronararterie ist dann verschlossen. Die Blutversorgung erreicht nicht nur die ständig aktive Arbeitsmuskulatur des Herzens, sondern auch das Reizleitungssystem. Untereinander bilden die Koronararterien zahlreiche Kollateralen aus, die meist aber nicht ausreichen, einen Gefäßverschluss komplett zu kompensieren. Weil es drei wesentliche Äste gibt, unterscheidet man Eingefäß-, Zweigefäß- und Dreigefäßerkrankungen sowie Hauptstammstenosen. Es kommt eben darauf an, welche Gefäße betroffen sind. Die Koronarversorgung ist übrigens von Mensch zu Mensch unterschiedlich ausgebildet. Mal überwiegt das eine, mal das andere Blutgefäß, gelegentlich gibt es auch bedeutsame Zusatzäste („Diagonaläste“). Der Hauptstamm der linken Koronararterie teilt sich normalerweise nach etwa 1 cm in einen Ast, der vorn zwischen den Ventrikeln herunterzieht (Ramus interventricularis anterior, RIVA = Left Anterior Descending, LAD), sowie einen Ast, der links um die Seitenwand nach hinten zieht. Dieser wird Ramus circumflexus (RCX) oder auch Left Circumflex Coronary Artery (LCX) genannt, salopp auch „CX“. Die Abkürzungen sind recht kompliziert, zumal sie in Englisch oder in Lateinisch benannt werden können. Die rechte Herzkranzarterie (RCA) zieht bei vielen Menschen um das

Abb. 9.1: Schemazeichnung der Koronararterien. Die linke Koronararterie beginnt als Hauptstamm, der sich in die große Vorderwandarterie RIVA/LAD und die „Circumflexa“ (RCX/ LCX/„CX“) aufteilt. Die rechte Koronararterie (RCA) versorgt wesentliche Anteile des Reizleitungssystems, speziell auch der AV-Überleitung.
rechte Herz und dann weit hinunter zur „Unterwand“. Dieser dem Zwerchfell aufliegende Abschnitt des Herzens wird vielfach auch als Hinterwand des Herzens bezeichnet, RCAInfarkte also als „Hinterwandinfarkte“. Darauf kommen wir gleich noch einmal zu sprechen. Für uns ist Folgendes wichtig: Bei einem weit oben sitzenden Infarkt der rechten Koronarie werden auch größere Anteile des rechten Ventrikels unterversorgt. Viele hiervon betroffene Patienten haben einen auffallend niedrigen Blutdruck. Interessanterweise ist die Pumpfunktion bei solchen Infarkten mit Rechtsherzbeteiligung abhängig von einer guten Vorlast. Gerade bei solchen Infarkten muss man auch mit Bradykardien rechnen, denn sowohl der Sinus- als auch der AV-Knoten werden üblicherweise von der RCA versorgt. Das His-Bündel bekommt dagegen Blut von beiden Seiten. Die linke Koronarie erreicht den größten Teil des linken Ventrikels, u. a. die Seiten- und Vorderwand. Hauptstammstenosen und hochsitzende LAD-Stenosen führen entsprechend zu ausgedehnten Septum- bzw. Vorderwandinfarkten.
9.1.3 EKG-Einsatz bei ACS-Patienten
Gerade beim Thema ACS kommt der EKG-Diagnostik eine riesengroße Bedeutung zu (Wagner et al. 2009). In den folgenden Kapiteln wird immer wieder auf Spezialfälle hingewiesen, bei denen man bei Missachtung von Empfehlungen vielleicht wichtige Erkenntnisse verpassen könnte. Im schlimmsten Fall könnte man einen bestehenden oder drohenden Infarkt übersehen. Das Verzögern oder gar Vorenthalten der entsprechenden Therapie kann ziemlich schaden. Folgende Empfehlungen sind wesentlich: Innerhalb von zehn Minuten nach Erstkontakt zu einem möglichen ACS-Pati-
enten muss ein 12-Kanal-EKG geschrieben und ausgewertet sein. Eine Telemetrie kann hilfreich sein, wenn einem nicht schon ohne Expertenrat die Diagnose klar ist. Die EKG-Technik muss stimmen. Beispielsweise sollten keine Filtertasten gedrückt werden, die das EKG glätten und somit ungenau machen können. Eine falsche Positionierung der EKG-Elektroden kann zu Fehlinterpretationen führen. Ergänzende Ableitungen müssen dokumentiert werden, falls dies therapeutische Konsequenzen haben könnte. Also nicht, wenn z. B. ein anterolateraler Infarkt bereits klar erkannt wurde. In Vr4 ist dann nichts zu erwarten und einen Blick auf V7 – V9 brauchen wir dann auch nicht mehr. Ein Blick auf die echte Hinterwand ist aber bei diagnostischer Unsicherheit zwingend (→ zu den Spezialableitungen: Kap. 3.1). Es lohnt immer, Verlaufs-EKG zu schreiben. Das Abmontieren eines Diagnostikkabels ist bei potenziell kritischen Patienten immer falsch. Eine kontinuierliche Rhythmusüberwachung ist wegen der Möglichkeit gefährlicher Arrhythmien wichtig. Das betrifft auch den Transport im Treppen-
haus. Ein Systolenton muss immer eingeschaltet sein. Schon ein nur kurz andauernder AV-Block muss nämlich erkannt und dokumentiert werden. Solche Befunde tragen auch zur Diagnosefindung bei und beeinflussen therapeutische Entscheidungen. Bei frischen ST-Hebungsinfarkten sollte man nicht zögern, die Defi-Elektroden bereits aufzukleben. Das erspart Stress bei plötzlichem Kammerflimmern. Vielfach ergibt es Sinn, diese Defi-Elektroden gleich anterior-posterior anzubringen, weil dies nicht nur eine Defibrillation bzw. Kardioversion ermöglicht, sondern auch die empfohlene Position für eine Schrittmachertherapie ist. Vor allem bei großen Infarkten, speziell solchen der rechten Koronararterie, drohen nämlich AV-Blockierungen.
Bei frischem STEMI DefiElektroden kleben!

9.2 NSTE-ACS:
Angina
pectoris und NSTEMI
Wir hatten bereits festgestellt, dass die Grenzen zwischen den verschiedenen Unterformen eines ACS nicht immer scharf sind. So können vorübergehende Gefäßspasmen auftreten und sich sogar Gefäßverschlüsse wiedereröffnen. Auch die Embolisation von Thrombusteilen in periphere Gefäßanteile kann eine Rolle spielen. Das könnte ein Grund dafür sein, dass das erste EKG bei vielen Infarkten nicht auffällig ist, wie es in der älteren Literatur oft beschrieben wird. Zum Zeitpunkt des ersten EKG hatte der ACS-Patient vielleicht ja „nur“ Angina pectoris. Und hierbei kann das EKG sogar völlig unauffällig sein.
Bei einem NSTEMI kommt es zu einer Myokardnekrose mit Troponinanstieg. Dabei ist das betroffene Gefäß nur vorübergehend oder unvollständig verschlossen, oder es liegt eine zur Verhinderung eines STEMI gerade noch ausreichende Kollateralversorgung vor. Die Nekrose umfasst nicht die gesamte Wand des Infarktareals. ST-Hebungen (STEMI) fehlen ebenso wie signifikante Q-Zacken. Früher nannte man NSTEMI deshalb auch Non-Q-Wave-Infarkte oder auch „Schichtinfarkte“. Wie schon diskutiert, kann man bei Infarkten aber häufig keine klare Trennlinie zwischen STEMI und NSTEMI ziehen.
Zurzeit gilt folgende Leitlinienaussage (Byrne et al. 2023a): Eine sofortige Angiografie und (je nach Befund) eine entsprechende Intervention ist bei NSTE-ACS mit sehr hohem Risiko („very high risk“) indiziert. Das sind konkret Fälle mit Kreislaufinstabilität, Herzinsuffizienz, Schock, einer unter Therapie wiederkehrenden oder sich nicht bessernden Schmerzsymptomatik sowie weiteren Komplikationen, z. B. kritischen Arrhythmien. Auch sind ischämiebedingte EKG-Veränderun-

Abb. 9.2: Beispiel für einen NSTEMI. Der 60-jährige Patient hatte eine Hauptstammstenose (60 %) sowie eine subtotale langstreckige proximale RIVA-Stenose. Beachte die negativen T-Wellen in V3 und V4!
MERKE
10.5 Die Tako-Tsubo-Kardiomyopathie
Die Tako-Tsubo-Kardiomyopathie ist eine besondere Herzmuskelerkrankung, bei der akut (und meist innerhalb von Wochen reversibel) eine Pumpfunktionsstörung von Herzmuskelabschnitten auftritt, ohne dass ursächlich eine koronare Durchblutungsstörung oder eine Entzündung vorliegt. In der typischen Form ist die Herzspitze ballonartig aufgetrieben. Den Namen hat die Krankheit von ähnlich geformten japanischen Tintenfischfallen. Inzwischen kennt man auch Formen mit anderen Lokalisationen an beiden Ventrikeln. Das Krankheitsbild heißt auch „Syndrom des gebrochenen Herzens“ oder Stress-Kardiomyopathie und betrifft Frauen deutlich häufiger als Männer. Etwa 2 % aller ACS-Patienten haben diese Krankheit. Die Pathophysiologie ist komplex, eine unter Stress verstärkte Katecholaminausschüttung und Gefäßfunktionsstörungen werden diskutiert. Auslöser sind meist negative Stresssituationen (Überfall, Unfall, schwere neurologische Erkrankungen), aber auch positive Ereignisse wie ein Lottogewinn. Akut können – wie beim Herzinfarkt – gefährliche Komplikationen auftreten. Symptomatik und EKG entsprechen einem akuten Koronarsyndrom. Man kann ST-Hebungen, T-Negativierungen, QT-Verlängerungen oder Q-Zacken finden, gelegentlich ist das EKG sogar unauffällig. Eine Unterscheidung von Herzinfarkten ist im Rettungsdienst eventuell sonografisch möglich (Herz-Echo), ansonsten erst innerklinisch, auch mit Herzkatheter. Wir behandeln betroffene Patientinnen zunächst wie bei einem STEMI.
Ein spannendes EKG mit Eigennamen ist das Phänomen Pickelhaubenzeichen (Spiked-Helmet Sign, SHS) (Grautoff et al. 2023, Crinion et al. 2020, Smith et al. 2015b). Dabei kommt es zu einem bogenförmigen Verlauf von ST-Strecke und T-Welle, was möglicherweise Folge einer Adrenalinausschüttung in Stresssituationen bei kritisch Kranken sein könnte. Das erinnert an Tako-Tsubo. Die Repolarisation ist verlängert und läuft noch ab, wenn schon der nächste QRSKomplex beginnt. Im EKG sieht man eine Grundlinie, die auf und ab läuft, was sich mit den QRS-Komplexen derart verbindet, dass es an das Bild preußischer Pickelhauben erinnert (Abb. 10.9). Abfallend erhöhte ST-Strecken erinnern an das Brugada-EKG und können auch bei Herzinfarkten so aussehen. Die gesamte Pathophysiologie dieses Phänomens ist noch nicht geklärt.

Abb. 10.9: Darstellung, wie ein Pickelhaubenzeichen aussehen kann.
10.15 WPW-Syndrom (Präexzitationssyndrom)
Der Begriff Präexzitation bedeutet wörtlich „vorzeitige Erregung“. Damit ist gemeint, dass bei dieser (angeborenen) Erkrankung Teile der Herzkammern aufgrund einer besonderen Reizüberleitung früher als normal erregt werden. Ein Muskelbündel stellt dabei einen Kurzschluss zwischen Vorhofmuskulatur und Ventrikeln dar, man nennt das auch akzessorische Bahn (Abb. 10.26). Normalerweise dürfte eine Reizweiterleitung nur über das His-Bündel erfolgen, das Bindegewebe der Klappenebene müsste ansonsten komplett isolieren. Es kann bei Vorliegen von zwei solchen Leitungsbahnen zu kreisenden Erregungen kommen, was sich als
Tachykardie zeigt. Dieses Krankheitsbild wird nach seinen Erstbeschreibern auch WPW-Syndrom (Wolff-ParkinsonWhite-Syndrom) genannt. Es ist gar nicht selten, etwa einer von 500 Menschen ist betroffen. Tiefer gehende Detailkenntnisse über Unterformen und die unterschiedlich benannten akzessorischen Bahnen sind für den Rettungsdienst entbehrlich. Das LGL-Syndrom gilt inzwischen nicht einmal mehr als Krankheit. Manche akzessorischen Bündel leiten übrigens nur in eine Richtung und manche besonders schnell. Dadurch kann ein Experte im Einzelfall die Situation mal so und mal so bewerten. Expertenrat einzuholen, ist nie eine Schande!

Abb. 10.26: Schematische Darstellung eines Präexzitationssyndroms (WPW). Ein akzessorisches Bündel (schwarzer Pfeil) ermöglicht, dass Teile der Ventrikel vorzeitig erregt werden können, was Delta-Wellen erkennbar macht (weinroter Pfeil, EKG 1). Ein WPWSyndrom kann auch (dauernd oder intermittierend) verborgen sein und keine Delta-Wellen zeigen (EKG 2). Häufig sind regelmäßige Schmalkomplextachykardien (EKG 3), selten Breitkomplextachykardien (EKG 4). Vorhofflimmern kann ein FBI-EKG hervorrufen, in dem einzelne Wellen auch über das AV/His-Bündel-System in die Kammern gelangen können (EKG 5).

Abb. 10.27: Zufallsbefund eines Präexzitationssyndroms (WPW) bei einem beschwerdefreien jungen Mann, hier evtl. in Verbindung mit Schenkelblockierungen. Verkürzung der PQZeit, Delta-Wellen (in einzelnen Ableitungen rot markiert), dadurch QRS-Verbreiterung
Was man von einem WPW-Syndrom im EKG sieht, hängt ganz davon ab, wo sich das akzessorische Bündel befindet und welche Leitungseigenschaften es hat. Im Ruhe-EKG ist das Hauptcharakteristikum eine Delta-Welle (Abb. 10.27). Dieser Begriff steht für einen vorzeitigen Beginn des QRS-Komplexes, passend zur Pathophysiologie. Ein Delta-Herzvektor kommt zu einem Zeitpunkt zustande, zu dem im Normalfall noch die PQ-Strecke weiterlaufen würde. Wie immer zeigt der Vektor vom vorzeitig erregten Areal zum noch unerregten Myokard. Man kann aus der Delta-Welle auf ihre Lokalisation schließen. Bei gestörter Erregungsausbreitung sind gemäß dem eisernen EKG-Gesetz dann auch sekundäre Erregungsrückbildungsstörungen zu erwarten (→ eisernes EKGGesetz: Kap. 8). Die EKG-Veränderungen können auch intermittierend auftreten. Dann sieht man zwischendurch ein völlig normales EKG und bei der nächsten Kontrolle vielleicht ein stark verändertes Bild. Sollte die Präexzitation nur bei einzelnen Herzschlägen auftreten, können die QRS-Komplexe dann von ventrikulären Extrasystolen (VES) nicht immer abgegrenzt werden. Diese könnten schließlich rein zufällig zu dem Zeitpunkt einschlagen, wo kurz zuvor die Vorhoferregung – sprich P-Welle – zu Ende war. Lange EKG-Streifen können hier eventuell helfen. Manchmal erkennt man dann Phasen mit demselben Bild über mehrere Herzschläge, was ein
WPW-Syndrom mit intermittierend auftretenden Delta-Wellen sehr wahrscheinlich macht. Differenzialdiagnostisch muss man an Pseudo-Delta-Wellen denken. Solche sehen aus wie WPW, sind es aber nicht. Das kann bei Schrittmacherrhythmen passieren, oder wenn bei einem Ersatzrhythmus die Reizbildung im oberen Septum erfolgt und der Verlauf der QRS-Vektoren dann eben ein solches Bild ergibt. Folgende Aspekte sind in einem echten
WPW-EKG zu finden:
– Delta-Welle (evtl. nur intermittierend)
– dadurch Verkürzung der PQ-Zeit
– und QRS-Verbreiterung (Verwechslung mit Schenkelblockierungen möglich)
– und sekundäre ERBS
– bei tief negativen QRS-Komplexen in den rechtspräkordialen Ableitungen Ähnlichkeit zum Linksschenkelblock
– dann kann man auch ST-Hebungen in den rechtspräkordialen Ableitungen sehen (Verwechslung mit Infarkt möglich)
– Negative Delta-Wellen in den Abl. II, III und aVF können wie Infarkt-Q-Zacken aussehen.
Patienten mit WPW-Syndrom leiden möglicherweise unter tachykarden Rhythmusstörungen (→ vgl. im Einzelnen auch Kap. 11). Zunächst eine Auflistung verschiedener Möglichkeiten, die Erklärung kommt danach:
– regelmäßige Schmalkomplextachykardie (orthodrome Leitung) = AVRT
– regelmäßige Breitkomplextachykardie (antidrome Leitung)
– regelmäßige Breitkomplextachykardie durch funktionellen Schenkelblock bei orthodromer Leitung = normale AVRT mit Schenkelblock
– Vorhofflattern mit 1:1-Überleitung über das akzessorische Bündel (regelmäßige Breitkomplextachykardie)
– Vorhofflimmern mit unregelmäßiger Breitkomplextachykardie (FBI-EKG).
Durch eine Kombination von Präexzitation und anderen Anomalien sind sogar noch mehr pathophysiologische Möglichkeiten gegeben. Die bei WPW-Patienten häufigste Tachykardie ist eine vollkommen regelmäßige Reentry-Tachykardie, bei der es – durch Extrasystolen ausgelöst – urplötzlich (paroxysmal) zum Kreisen der Depolarisationswelle kommt. Meist handelt es sich um die orthodrome Form einer kreisenden Erregung (gr. ortho = richtig). Dabei läuft die Erregung durch das richtige Bündel in die Kammern, also via His-Bündel. Das führt natürlich zu schmalen QRS-Komplexen (EKG 3 in Abb. 10.26). Eine Delta-Welle fehlt, denn die Kammern werden komplett normal erregt. Die Depolarisationswelle nimmt dann den Weg durch das akzessorische Bündel von unten nach oben zurück in die Vorhöfe. Bei dieser in etwa 95 % der Fälle vorliegenden orthodromen Tachykardie zeigt sich im EKG eine regelmäßige Schmalkomplextachykardie mit Frequenzen meist zwischen 150 und 230/min. Die WPW-Form wird AVRT abgekürzt, ohne N. Mit N (= Node) wäre es eine AVNRT mit kreisender Erregung im AV-Knoten-Gebiet (→ mehr zu Schmalkomplextachykardien: Kap. 11.3.2).
11.1 Allgemeines zu Rhythmusstörungen
In den folgenden Unterkapiteln betrachten wir zunächst Extrasystolen. Zu diesen kommt es in den Vorhöfen inkl. AVKnoten (supraventrikulär) oder irgendwo in den Herzkammern (ventrikulär), wenn eine der Zellen des elektrisch aktiven Systems zwischendurch Lust auf eine Spontanentladung bekommt und diese dann als Depolarisationswelle über die Muskulatur weiterläuft. Wenn eine Erregung nicht im Sinusknoten, sondern an irgendeinem anderen Ort entsteht, nennt man das „ektop“. Für das Verständnis von Rhythmusstörungen ist es wichtig, eine Trennung zwischen Extrasystolen und Ersatzsystolen zu machen, weshalb sie jeweils ein eigenes Unterkapitel haben. Wenn irgendwo ein Problem in der Herzelektrik besteht, vielleicht weil der Taktgeber oben einmal ausfällt oder weil sein Reiz aufgrund einer Blockade nicht nach unten weitergeleitet werden kann, dann dient eine Spontanentladung der Überbrückung, bis das Problem beendet ist. Ein solcher Ersatzschlag ist also sehr wichtig. Aufgrund der Eigenschaften des elektrischen Systems sind sogar Ersatzrhythmen möglich. Je tiefer im Herzen, umso langsamer laufen solche Ersatzrhythmen normalerweise. Das liegt an der dort viel langsamer ablaufenden Spontanentladung der Zellen. Wenn diese zum Zuge kommen, weil von oben keine Depolarisationswelle ankommt, dann sind die erzeugten Ersatzrhythmen üblicherweise regelmäßig.
Ein weiteres Phänomen beim Thema Arrhythmien sind kreisende Erregungen. Es kann passieren, dass sich in irgendwelchen Strukturen des Reizleitungssystems ein „Kreisverkehr“ etabliert. Dann läuft die Depolarisationswelle einmal herum und trifft auf Gewebe, in dem die Refraktärzeit bereits wieder vorbei ist, die Zellen also den Reiz problemlos weitergeben können. Diese „Wiedereintritte“ kommen recht schnell, das Ergebnis im EKG sind sogenannte Reentry-Tachykardien Auch solche sind vom Prinzip erst einmal regelmäßig, wie Autos, die sich durch einen Kreisverkehr bewegen. Allerdings können solche im Herzen kreisenden Erregungen sich in viele Kreise aufspalten, dann entsteht ein unregelmäßig werdendes elektrisches Gewitter, die Vorhöfe oder Kammern flimmern. Manchmal passiert es auch, dass eine Erregung eine weitere anstoßen kann. Man nennt das Triggerung. Beim Spezialfall Torsade-de-pointes-Tachykardie ist das der Fall. Mit etwas Grundlagenwissen kann man die verschiedenen Arrhythmien recht gut einordnen. Irgendwann kann man dann intuitiv erkennen, was los ist. Das Sortieren von Rhythmusstörungen ist nicht ganz einfach, sodass wir bestimmte Themen in einem und gleichzeitig in einem zweiten Kapitel wiederfinden werden.
11.1.1 Extrasystolen
Im Prinzip können überall in dafür geeigneten Fasern des Reizleitungssystems spontane Entladungen erfolgen und Depolarisationswellen auslösen. Man nennt Extrasystolen, die oberhalb (lat. supra) der Kammern (Ventrikel) entstehen supraventrikuläre Extrasystolen (SVES). Das beste Erkennungszeichen ist, dass die im Normalfall folgenden QRSKomplexe schmal sind. Jedenfalls meistens. Das liegt daran,
dass die Erregungswelle – vom Ort der Ektopie ausgehend –irgendwann in den AV-Knoten/His-Bündel-Bereich einbiegt und von dort den normalen Weg herunter in die Herzkammern nimmt. Im Unterschied dazu entstehen ventrikuläre Extrasystolen (VES) irgendwo im System der Herzkammern, typischerweise in den Purkinje-Fasern. Von dort muss sich die Welle quer durchs Myokard kämpfen. Das führt zu deformierten und breiten QRS-Komplexen. Mehr dazu gleich.
Die Ursache von Extrasystolen zu erfassen und eine prognostische Bewertung abzugeben, ist schwierig. Sie treten sowohl bei Herzgesunden auf, können aber auch Anzeichen für lebensgefährliche Erkrankungen sein. Sollen wir also bei Erkennen von Extrasystolen gleich einen Rettungshubschrauber anfordern und ein Intensivbett in der nächsten Uniklinik reservieren? Selbstverständlich nicht. Sie sind grundsätzlich im klinischen Gesamtkontext einzuordnen. Wenn keine schlimme Erkrankung zugrunde liegt, sind sie zunächst einmal harmlos. Extrasystolen sind bei Senioren und bei Elektrolytentgleisungen häufiger, insbesondere bei einer bestehenden Hypokaliämie. Infektionen, Entzündungen, Medikamente, die Psyche sowie Drogen und Genussgifte beeinflussen ihr Auftreten (Meesmann 2021). Eher bedenklich stimmen folgende Faktoren: Eine strukturelle oder elektrische Herzerkrankung, eine extreme Häufung der Extrasystolie und auch Extrasystolen, die aus mehreren Orten kommen oder sehr früh einfallen. Ebenfalls eher ungünstig ist die Lage, wenn Extrasystolen unter Belastung mehr werden und natürlich, wenn bereits einmal höhergradige Arrhythmien auftraten. Die Einzelfallbewertung geschieht durch Spezialisten, wobei auch das Aussehen der Extrasystolen und daraus abgeleitet ihr Ursprung im Herzen einbezogen werden (Mathew et al. 2021). Auch SVES dürfen nicht unterschätzt werden, auch wenn von ihnen keine direkte Gefahr ausgeht. Eine Häufung kann aber z. B. Vorbote von Vorhofflimmern sein.
Das frühe Einfallen von Extrasystolen geht mit einem verminderten Auswurf einher. Nach einer Extrasystole gibt es häufig eine postextrasystolische Pause, die dann eine vermehrte diastolische Füllung der Ventrikel und einen stärkeren Blutfluss durch den nächsten Herzschlag bewirkt. Viele Patienten, aber nicht alle, spüren deshalb ihre Extrasystolie in Form von „Herzstolpern“. Nicht nur bei einer starken Häufung von ansonsten ungefährlichen (aber unangenehmen) Extrasystolen, sondern auch bei einer erhöhten Gefährdung, kommt zur Behandlung eine Katheterablation in Betracht. In Abbildung 11.1 sind die Charakteristika von supraventrikulären Extrasystolen erkennbar. Der Ursprung der dort in Orange markierten SVES liegt hier in den unteren Anteilen der Vorhöfe, daher zeigt der Vorhofvektor nach oben und führt zu einer negativen P-Welle, im Gegensatz zu den vom Sinusknoten ausgehenden positiven P-Wellen. Nicht nur eine anders aussehende P-Welle, sondern auch eine verkürzte PQ-Zeit ist typisch für SVES. Die Überleitung via AV-Knoten in die Kammern kommt einfach früher, wenn die Depolarisationswelle in der Nähe des AV-Knotens entsteht. Dass die QRS-Komplexe normal aussehen, ist die Regel. Bei genauem
Die wichtigsten EKG-Aspekte bei Reanimationspatienten sind recht schnell zu lernen, wie jede Auszubildende im RettSan-Kurs weiß: VF/VT-Rhythmen werden i. d. R. durch ein Kreisen der elektrischen Erregung verursacht. Zu ihrer Beseitigung sind Elektroschocks indiziert. Alles andere gehört auf die andere Seite, zu den Non-VF/VT-Rhythmen. Bei der Asystolie sind gar keine Herzkammeraktionen sichtbar, bei der pulslosen elektrischen Aktivität (PEA) fehlt bei vorhandenen QRS-Komplexen ein nachweisbarer Kreislauf. Die PEA verdient unbedingt eine genauere Betrachtung: Man darf diese unterteilen in eine echte PEA, bei der sich zwar elektrisch etwas tut, bei der das Myokard hieraus allerdings keine Pumpleistung zustande bringt. Das ist quasi eine Entkopplung zwischen Herzelektrik (EKG) und -mechanik (Puls). Früher gab es dafür den Begriff der elektromechanischen Entkopplung. Eine Pseudo-PEA liegt dagegen vor, wenn das Herz auch zu einer Pumpleistung in der Lage ist, klinisch aber eine Pulslosigkeit und Reanimationspflicht bestehen. Das bedeutet, der Kreislauf ist durch irgendwelche Umstände so massiv gestört, dass wir reanimieren müssen. Das EKG kann dabei sogar einigermaßen normal aussehen. Ein Beispiel hierfür ist ein extrem verlaufender anaphylaktischer Schock.
Die Abbildung 12.1 zeigt drei Abschnitte aus dem EKGSpeicher eines 44-jährigen Patienten mit Vorderwand-STEMI. Während der Übergabe kam es zu beobachtetem Kammerflimmern (Pfeil 1), das auch sofort bemerkt wurde. Der Patient verlor im Verlauf das Bewusstsein, 15 sec nach Pulsverlust sind Artefakte erkennbar, erklärlich durch einen zerebralen Krampfanfall. Dieser ließ nach 4 – 5 sec nach, begann im Verlauf aber erneut. Diese Symptomatik passt zur frühen Phase eines Kreislaufstillstands (und einer Synkope). Möglicherweise unterhielt auch eine irgendwann begonnene Herzmassage diese hypoxischen Krämpfe. Diese wurde erforderlich, weil aufgrund von Problemen erst nach 75 sec defibrilliert werden konnte (Pfeil 2). Ist man sofort bereit für eine Defibrillation, erübrigen sich meist die nicht nebenwirkungsfreien Thoraxkompressionen. Die Schockabgabe erfolgte „manuell“, eine AED-Software könnte unter Krämpfen aufgrund der Artefakte keine Defibrillation empfehlen! Sofort nach (der insgesamt immer noch frühen) Schockabgabe erfolgte eine Analyse: Im EKG sah man hinreichend viele QRS-Komplexe, viele davon sicher aus den Kammern. Pulse waren sofort tastbar, rasch stabilisierte sich das EKG, und auch der Patient wurde wieder wach. Der weitere Verlauf inklusive Katheterintervention war unkompliziert. In kritischen Situationen, z. B. bei einem bewusstlos gewordenen Patienten mit Schnappatmung, geht es bei der EKG-Analyse nur um eine Frage: Schockbarer Rhythmus oder
nicht? Die große Mehrzahl der außerklinisch vom Rettungsdienst angetroffenen Reanimationspatienten muss nicht elektrisch therapiert werden: Im Jahr 2021 hatten 78,1 % einen Non-VF/VT-Rhythmus, der Anteil Asystolie betrug 55,9 %, der Anteil PEA 22,2 %. Ein VF/VT-Rhythmus wurde in 21,1 % der Fälle gesehen (Deutsches Reanimationsregister 2022). Ein Kammerflattern ist im Vergleich zu Kammerflimmern statistisch sehr selten, in älteren Daten kam auf 50 Fälle von Kammerflimmern nur knapp eine pVT (Fischer et al. 2013). Kammerflimmern ist trotz dieser Zahlen der klassische Auslöser des plötzlichen Herztodes. Der auf VF/VT entfallende Anteil ist nämlich deutlich höher, wenn die EKG-Diagnose besonders rasch erfolgt, schneller als wir es in der Rettungsdienstpraxis schaffen. In AED-Studien sah man das in 59 – 65 % der Fälle (Koster et al. 2010). Man darf insgesamt von etwa 70 % ausgehen (Ludhwani et al. 2022).

Abb. 12.1: Für den Patienten eine Synkope, für das Team ein Kreislaufstillstand. Zusammenstellung von drei Rhythmusstreifen eines 44-jährigen Patienten mit STEMI (vgl. Text)
Beginnen wir mit einer kurzen Übersicht, was es alles gibt, um dann ausgewählte Substanzen näher zu beleuchten, denen wir auch in der Akutmedizin begegnen. Die historische Einteilung von (zur Tachykardiebehandlung eingesetzten)
Antiarrhythmika in vier Klassen nach Vaughan Williams ist für den Rettungsdienstpraktiker nicht ganz so wichtig, denn in dieser Auflistung fehlen manche Medikamente, selbst im Rettungsdienst verwendete Substanzen.
Die Wirkmechanismen, also wie Antiarrhythmika die komplexe Herzelektrik beeinflussen, sind vielgestaltig: Manche blockieren den schnellen Natriumeinstrom an der Zell-
Tab. 14.1: Eine Auswahl antiarrhythmischer Substanzen und ihr zugehöriges Hauptwirkprinzip
Antibradykarde Medikamente
‒ Atropin Parasympathikolyse (Vagushemmung)
‒ Isoprenalin bzw. Orciprenalin Sympathomimese (u. a. Erregung von Beta1-Rezeptoren)
‒ Adrenalin (Epinephrin)
‒ Dopamin
‒ Aminophyllin bzw. Theophyllin Adenosinantagonismus
‒ Glukagon Sympathomimese (via cAMP-Erhöhung)
‒ Kalzium Membranstabilisierung
Antitachykarde Medikamente
‒ Ajmalin Natriumkanal-Blockade, Aktionspotenzial (AP) verlängernd
‒ Procainamid Natriumkanal-Blockade, AP verlängernd
‒ Lidocain Natriumkanal-Blockade, AP verkürzend
‒ Flecainid Natriumkanal-Blockade, AP nicht beeinflusst
‒ Propafenon Natriumkanal-Blockade, AP nicht beeinflusst
‒ Metoprolol Beta-Rezeptoren-Blockade
‒ Amiodaron komplex, u. a. Kaliumkanal-Blockade
‒ Ibutilid komplex, u. a. Kaliumkanal-Blockade
‒ Diltiazem Kalziumkanal-Blockade (Kalziumantagonismus)
‒ Verapamil Kalziumkanal-Blockade (Kalziumantagonismus)
‒ Adenosin u. a. Blockade der AV-Überleitung
‒ Digitalis Blockade der Natrium-Kalium-Pumpe
‒ Magnesium Kalziumantagonismus, Membranstabilisierung
‒ Ivabradin If-Kanal-Hemmung
membran, der bei der Depolarisation wichtig ist. Andere wirken hemmend auf Beta-Rezeptoren oder auf Kaliumkanälchen (Repolarisationsverlangsamung) oder es werden die Kalziumkanäle in der Zellmembran blockiert. Viele antibradykarde Notfallmedikamente helfen durch eine Beeinflussung von Parasympathikus bzw. Sympathikus. Die pharmakologischen Einzelheiten sind recht komplex und im Detail auf rhythmologischer Expertenebene bedeutsam. Interessierte seien auf spezielle Fachliteratur verwiesen.
Einerseits ist die Anwendung von Antiarrhythmika relativ klar geregelt. In Leitlinien werden Vorgaben zu Indikation und Dosierung gemacht. Man kann also quasi „nach Kochbuch“ arbeiten, eine korrekte Diagnose der Rhythmusstörung vorausgesetzt. Andererseits ist die Gabe von herzrhythmusbeeinflussenden Medikamenten bei vielen Patienten sehr komplex, speziell wenn vorbestehende Erkrankungen (WPWSyndrom, Herzinsuffizienz …), akute Veränderungen (Elektrolytentgleisung …), die Dauermedikation (Wechselwirkungen …) und auch mögliche Unverträglichkeiten beachtet werden müssen. Dem Notarzt bzw. einer Notfallsanitäterin ist also große Sorgfalt anzuraten.
Vor der Gabe eines Antiarrhythmikums sind Standards abzuarbeiten, wie die Erhebung einer Anamnese (mind. SAMPLE) sowie eine möglichst umfassende EKG-Dokumentation. Auf ein 12-Kanal-EKG soll nur in akut bedrohlichen Fällen verzichtet werden. Bei instabilen Patientinnen wird statt eines medikamentösen Therapieversuchs einer Elektrotherapie (Kardioversion/Defibrillation/Schrittmachertherapie) der Vorzug gegeben.
Auf eine Kombination verschiedener Antiarrhythmika, z. B. wenn eines nicht ausreichend wirkt, sollte man als Nicht-Kardiologe grundsätzlich verzichten. Eine Ausnahme stellt hier Adenosin dar, das aufgrund seiner extrem kurzen Halbwertszeit innerhalb weniger Minuten wieder komplett abgebaut ist. Ein weiterer Grundsatz ist, im Zweifelsfall Telefonrücksprache mit der Zielklinik zu halten. Man soll sich niemals scheuen, einen solchen Expertenrat einzuholen.
Bei der Anwendung von Antiarrhythmika ist mit verschiedenen Nebenwirkungen zu rechnen. Antibradykarde Medikamente können selbstverständlich zu Tachykardien führen, z. B. zu einer Breitkomplextachykardie mit noch erhaltenem Bewusstsein. Das Spektrum reicht bis zum Kammerflimmern, das wiederum oft einfacher zu behandeln ist. Bei antitachykarden Medikamenten muss man am ehesten mit einer negativen Inotropie rechnen, also mit einer Schwächung der Herzkraft, und mit Bradykardien. Der Begriff Proarrhythmogenität beschreibt das Problem, dass Antiarrhythmika paradoxerweise auch Herzrhythmusstörungen auslösen können.
MERKE
Antiarrhythmika nur mit Bedacht geben, v. a. Kombinationen verschiedener Antiarrhythmika können sehr gefährlich sein!

14.1 Antibradykarde Medikamente
Die Liste antibradykarder Notfallmedikamente ist relativ überschaubar. Spontan denkt man nur an Atropin und Adrenalin, die auch in fast allen Fällen ausreichend sind. Im Folgenden seien über diese zwei Substanzen hinaus noch weitere Pharmaka erwähnt, an die wir in Einzelfällen denken sollten. In der Aktualisierung der Reanimationsleitlinien von 2021 gab es zur Behandlung von Bradykardien keine wesentlichen Neuerungen (Soar et al. 2021b). Sie beschränken sich auf wenige Kernaussagen und verweisen auf eine amerikanische Bradykardieleitlinie von 2018 (Kusumoto et al. 2019). Das Grundprinzip der Bradykardiebehandlung wird auch bei der medikamentösen Therapie in Kapitel 11.4.4 detailliert beschrieben.
Formal soll man zunächst mit Atropin beginnen, wobei man alternative Medikamente erwägen kann, unter anderem Adrenalin. Man muss bedenken, dass Atropin als Vagushemmer nur Bradykardien beheben kann, die sich in den Vorhöfen bzw. im Bereich des AV-Knotens abspielen. Die Anwendung ist bei höhergradigen AV-Blockierungen nicht erfolgversprechend. Bei einem Mobitz-Block kann die Blockade sogar schlimmer werden, wenn die Vorhoffrequenz gesteigert wird. Beta-mimetisch wirksame Katecholamine wie Adrenalin können hier helfen.
14.1.1 Atropin
Bei einem Patienten mit symptomatischer Vorhofbradykardie, z. B. einer Sinusbradykardie oder einem AV-Knotenrhythmus, kann durch Vagusblockade eine Frequenzsteigerung erreicht werden, die die Beschwerden dann rasch bessert. Der Nervus vagus erreicht die Vorhöfe, also die Strukturen des Herzens, an denen solche Bradykardien ihre Ursache haben. Als Initialtherapie wird hierfür Atropin empfohlen. Atropin ist ein Parasympatholytikum (Vagusblocker), konkret werden die Muskarinrezeptoren blockiert, die am Endorgan –also auch den Herzvorhöfen – die Parasympathikuswirkungen vermitteln. Eine Verlangsamung der Vorhoffrequenz bzw. Verschlechterung der AV-Überleitung kann dadurch aufgehoben werden. Innerhalb von 1 – 2 min nach intravenöser Gabe steigt die Herzfrequenz spürbar an. Auch die Nebenwirkungen von Atropin lassen sich durch diese Parasympatholyse sehr gut erklären. Patientinnen spüren neben Herzklopfen vor allem einen trockenen Mund. Wegen einer möglichen Pupillenerweiterung sind Sehstörungen und ein Anstieg des Augendrucks bei Glaukompatienten vorstellbar. Die Darmgeräusche werden schwächer. Atropin kann einen Harnverhalt auslösen. Diese anticholinergen Nebenwirkungen sind v. a. bei Atropinvergiftungen und -überdosierungen bedeutsam. Die Halbwertszeit von Atropin liegt etwa bei zwei Stunden (Kusumoto et al. 2019).
Atropin wird auch als Antidot bei Vergiftungen mit cholinerger Symptomatik eingesetzt. Zu beachten ist hierbei, dass die Vergiftung auch an Nikotinrezeptoren stattfindet (Lähmungen!), wo Atropin nicht ansetzt!
Die Dosierung von Atropin ist im Prinzip einfach, bei genauerem Hinsehen aber doch komplex. Es gibt verschie-
dene Ampullen, z. B. mit 0,5 mg oder auch mit 1 mg Wirksubstanz. Die Ampullen mit z. B. 100 mg/10 ml sind nur für Vergiftungen gedacht und müssen selbst bei diesen verdünnt werden! Verwechslungen müssen streng vermieden werden. Die klassische Dosierung bei Erwachsenen mit Bradykardie beträgt je nach Leitlinie 0,5 mg oder 0,5 – 1,0 mg i. v., bei Bedarf alle 3 – 5 min wiederholt bis maximal 3 mg (Kusumoto et al. 2019, Soar et al. 2021a). Bei dieser Maximaldosierung ist von einer kompletten Vagusblockade auszugehen.
Für die Atropingabe bei Kindern im Rahmen einer Intubation empfiehlt die AHA in ihren Reanimationsleitlinien nun 0,02 mg/kg KG. Früher gab es wegen der Sorge paradoxer Wirkungen noch eine Minimaldosierung („nicht weniger als 0,1 mg geben“). Diese wurde nun gestrichen. Das Problem einer paradoxen Bradykardie ist nicht so groß wie eine mögliche Überdosierung bei sehr kleinen Kindern (Topjian et al. 2020, Prakash und Mullick 2017). Für die Vermeidung einer Bradykardie werden in der Literatur bei der genannten Indikation auch 0,01 – 0,02 mg/kg KG Atropin ohne Minimaldosis empfohlen (Prakash und Mullick 2017). Zur Behandlung einer Bradykardie bei Kindern ist anzumerken, dass immer zuerst ABC-Basismaßnahmen erfolgen müssen, denn vielfach ist eine Hypoxie ursächlich! Dann kann Atropin sogar schaden, weil es den myokardialen Sauerstoffverbrauch erhöht. Ähnlich kann es bei katecholaminabhängigen Arrhythmien sein, z. B. bei einem Tako-Tsubo-Syndrom (Van de Voorde et al. 2021). Bei erhöhtem Vagotonus wird bei Kindern Atropin in einer Dosierung von 0,02 mg/kg KG empfohlen. Eine einmalige Wiederholung ist möglich, eine Minimaldosierung von 0,1 mg und eine Maximaldosierung von 0,5 mg sind hier noch benannt (Topjian et al. 2020).
Auf das Thema Minimaldosierungen muss weiter eingegangen werden. Auch bei Erwachsenen wird berichtet, dass eine Dosierung unterhalb von 0,5 mg i. v. vorübergehend eine Bradykardie verstärken kann (paradoxe Wirkung). Das lässt sich auf verschiedene Weise erklären, z. B. durch eine anfängliche Wirkung auf spezielle Muskarinrezeptoren in parasympathischen Ganglien, die später durch die Wirkung an weiter peripher gelegenen Muskarinrezeptoren aufgehoben wird. Es ist sogar vorstellbar, dass diese Periode bei kritisch langsamer Herzfrequenz länger dauern könnte (Farkas 2017). Jedenfalls hat sich deshalb auch der klinische Standard entwickelt, eine Ampulle Atropin nicht besonders langsam, sondern eher zügig zu injizieren.
Die amerikanische Bradykardieleitlinie zitiert Literatur zu möglichen Atropinnebenwirkungen (Kusumoto et al. 2019). In einer Dosierung von 0,5 – 2,0 mg wirkt es meist gut, es gebe aber ein minimales Risiko, dass eine Bradykardie verschlechtert werden kann. Eine Verschlechterung einer bestehenden Ischämie wird ebenso erwähnt, sogar Kammerflimmern.
Atropin soll bei Herztransplantierten explizit nicht gegeben werden. Bei diesen sind die Vagusfasern durchtrennt. Hier ist die Wahrscheinlichkeit für eine paradoxe Bradykardie (AV-Blockierungen, Sinusarrest) deutlich größer (Kusumoto et al. 2019, Soar et al. 2021a). Eine Alternative ist dann Theo-
Übungs-EKG 2

Abb. 16.2a: Übungs-EKG 2
Kasuistik zu EKG 2
RTW-Einsatz nachts um 3.45 Uhr, Einsatzstichwort „unklar internistisch“, lokales NEF durch anderen Einsatz gebunden. Bei Eintreffen sitzt die 80-jährige Patientin im Morgenmantel im Wohnzimmer. Sie sei erwacht, musste zur Toilette und habe beim Aufstehen einen starken Schwindel verspürt, der immer noch bestehe. Ihr Ehemann befürchtet einen Herzinfarkt, weil sie so blass sei und schwitze und sich bereits einmal übergeben musste. Auf Fragen nach thorakalen Beschwerden sind keine klaren Aussagen der Patientin zu erhalten, „ihr sei ziemlich schlecht“. Auch eine Eingrenzung des Schwindels fällt schwer. Sie wirkt krank, ist in der Tat etwas blass und schwitzt.
ABCDE:
A frei, B suffizient, 20 Atemzüge/min, Lunge frei, SpO2 97 % bei Raumluft, C Radialispuls normal tastbar, absolut regelmäßig um 70/min, Kapillarfüllung in etwa 1 sec, Halsvenen normal, Blutdruck 180/100 mmHg beidseits, D keine fassbaren Pathologika, BZ 125 mg/dl, leichte Knöchelödeme bds.
SAMPLE:
An den vergangenen Tagen und am Abend sei laut Ehemann nichts Besonderes passiert. Keine Allergie, Medikamentenplan mit ASS („Herz“), Candesartan („Blutdruck“), Amlodipin („Blutdruck“), Simvastatin („Cholesterin“), ein Antidepressivum („Erschöpfung“). In der Vorgeschichte ein kleiner Schlaganfall vor drei Jahren ohne Folgen, ein Hypertonus, Herzerkrankungen werden verneint, sonst keine weiteren Besonderheiten. Aktuell nur ein Schluck Wasser, sonst nüchtern.
Fragen:
Was zeigt dieses EKG?
– Wie geht es der Patientin?
– Herzfrequenz
– Rhythmus
– QRS-Breite
– P-Wellen (Aussehen und Überleitung auf die Kammern)
– Q-Zacken
– R-Zacken-Zuwachs in den Brustwandableitungen
– S-Zacken = alle weiteren QRS-Komplex-Details
– ST-Strecke und T-Welle
– Zeiten (PQ- und vor allem die QT-Zeit)
– Weiteres.
Gibt es Hinweise auf einen Herzinfarkt? Sollte aktuell bezüglich des EKG irgendetwas geschehen?
Das vorliegende „EKG-Gesamtpaket für die Notfallmedizin“ ist in erster Linie für den Rettungsdienst geschrieben. Das beginnt bei Rettungssanitätern, die das Thema von Grund auf lernen wollen. Sie finden unter anderem, wo (ganz genau) die Elektroden angebracht werden müssen, und sie werden lesen, warum die Zacken mal so und mal anders aussehen. Dieses Buch zeigt mit zahlreichen Fachzeichnungen, EKG-Kurven, Fotos und nicht zuletzt OLAF-Cartoons, wie man sich die vielfältigen EKG-Befunde erklären kann. Angehende Notfallsanitäterinnen werden strukturiert durch die gesamte Notfall-Elektrokardiografie geführt und lernen, wie man den Rechts- vom Linksschenkelblock unterscheidet und wie genau das mit der Ableitung Vr4 ist. Auch langjährig erfahrene Notärztinnen werden vieles wiederentdecken, was vor Jahren im Studium mal unterrichtet wurde. Im ausführlichen Index finden sie alle Themen, die
den Akutmediziner interessieren: Was inferiore von echten Hinterwandinfarkten unterscheidet, welche Arrhythmien bei WPW-Syndromen drohen und wie genau eine Hyperkaliämie im EKG aussieht. Wie zeigt sich eine Lungenarterienembolie? Was sind OsbornWellen? Wie differenziert man zwischen Infarkt-STHebungen und denen bei einer frühen Repolarisation? Was sind Brugada-EKG und Wellens-Zeichen?
Und was hat es eigentlich mit dem eisernen EKG-Gesetz auf sich? Erläutert wird auch, wie man eine SVT beendet, wie Adrenalin bei einer kritischen Bradykardie dosiert werden muss und wie der Träger eines ICD defibrilliert werden sollte. Dies alles kommt aus der Feder eines erfahrenen Notarztes, der vor über 30 Jahren als Rettungssanitäter anfing, EKG abzuleiten und auszuwerten. Für die 2. Auflage hat er den Text umstrukturiert, Erklärungen zu Krankheitsbildern erweitert und diskutiert die aktuellen Leitlinien.

Grundlagen – Auswertung – Therapie
ISBN 978-3-96461-067-6 www.skverlag.de
Autor:
Ralf Schnelle
