

kemi 1 SYNTES
Anders Henriksson
Annika Johansson
Erik Zetterberg
1 Den gudomliga konsten 6
Vad är kemi? 7
Risker vid laboratoriearbete 16
Redovisning av experiment 18
Sammanfattning 19
Övningsuppgifter 20
2 Kunskap om materia 22
Materia och filosofi 23
Utblick: Alkemisterna 25
Den moderna kemins födelse 26
Atommodeller 29
Utblick: Marie Curie och radioaktiviteten 30
Masstal och atomnummer 36
Radioaktiva isotoper 37
Några viktiga begrepp 40
Sammanfattning 46
Övningsuppgifter 48
3 Periodiska systemet 52
Grundämnen grupperas 53
Elektronernas betydelse 56
Utblick: Huvudnivåer och undernivåer 58
Periodiska systemet berättar 60
De åtta huvudgrupperna 64
Utblick: En kemisk industri på 1700talet 69
Utblick: Arsenik i Gangesdeltat 73
Utblick: Solens helium upptäcktes först 77
Utblick: Materia i ett kosmiskt kretslopp 78
Sammanfattning 79
Övningsuppgifter 80
4 Atomer håller ihop 82
Jonbindning i salter 83
Kovalent bindning i molekyler 92
Utblick: En giftig form av syre 95
Utblick: Grafit i blyertspennor/ Diamanterna som försvann 98
Olika grundämnen i samma molekyl 99
Utblick: Polära kovalenta bindningar i sammansatta joner 109
Namn på kemiska föreningar 110
Bindningar mellan molekyler 111
Metallbindning 116
Utblick: Järnframställning 118
Sammanfattning 120
Övningsuppgifter 121
5 Reaktionsformler och kemiska beräkningar 124
Bakgrund 125
Från ordformel till teckenformel 126
Salter och reaktionsformler 129
Räkna med atommassenheten 132
Räkna med substansmängd 134
Utblick: Storheter och enheter 135
Föreningars sammansättning 141
Räkna med reaktionsformler 144
Blandningars halt 147
Något om gasers egenskaper 152
Sammanfattning 156
Övningsuppgifter 157
6 Organisk kemi – kolväten och några ämnesklasser 164
Kolföreningarnas kemi 165
Kolväten 166
Utblick: Global uppvärmning och kolväten 181
Alkoholer 185
Karboxylsyror 194
Sammanfattning 202
Övningsuppgifter 204
7 Syror och baser 206
Kemi till vardags 207
Syror och sura lösningar 207
Baser och basiska lösningar 220
Neutralisation 223
Syrabasjämvikter 224
pH 225
Syrabastitrering 231
Buffertsystem 236
Utblick: Sur nederbörd frigör metalljoner 239
Sammanfattning 240
Övningsuppgifter 242
8 Lite mer om kemiska reaktioner 246
Energi ut eller energi in? 247
Utblick: Specifik värmekapacitet 250
Entalpi 253
Överkurs: Spontant eller ickespontant? 256
Sammanfattning 258
Övningsuppgifter 259
9 Oxidation och reduktion 260
Redoxreaktioner 261
Utblick: Enummer/Antioxidationsmedel 268
Utblick: Svartkrut 268
Galvaniska element 269
Utblick: Galvaniska element till vardags 278
Korrosion 279
Utblick: Rostfritt stål 283
Utblick: Rena metaller är instabila 283
Elektrolys 284
Utblick: Blyackumulatorn 287
Sammanfattning 288
Övningsuppgifter 289
10 Analytisk kemi 292
Att avslöja innehållet 293
Gravimetriska analyser 294
Titreranalyser 295
Kromatografi 299
Sammanfattning 302
Övningsuppgifter 303
Svar och lösningar 304
Register 344
Bildförteckning 350
Grundämnenas namn, tecken, atomnummer och atommassor 352
Periodiska systemet omslagets främre insida
Elektronegativitetsvärden för ämnen i det periodiska systemets huvudgrupper omslagets bakre insida
Elektrokemiska spänningsserien omslagets bakre insida





4 Atomer håller ihop
Detta kapitel berör följande centrala innehåll i ämnesplanen
• Kemiska bindningar och deras inverkan på organiska och oorganiska ämnens kemiska och fysikaliska egenskaper.
• Kemins betydelse för vetenskap, individ och samhälle med exempel från historiska och aktuella händelser.
• Modeller som beskrivning av verkligheten. Modellers och teoriers giltighet samt det experimentella arbetets betydelse för deras utveckling över tid.
Mål att nå med hjälp av detta kapitel
• Kunskaper om kemins begrepp, modeller och teorier samt om kemiska samband.
• Förmåga att använda kunskaper i kemi för att analysera och tolka samband, granska information och kommunicera med ett naturvetenskapligt språk.
• Kunskaper om kemins betydelse för utveckling inom vetenskap och samhälle.
Jonbindning i salter
Alkalimetallernas och halogenernas atomer kan lätt få ädelgasstruktur genom att avge respektive uppta en elektron. Därför reagerar alkalimetaller lätt med halogener. Under en sådan reaktion överförs en elektron från alkalimetallernas atomer till halogenatomerna. Detta visas i bilden nedan där alkalimetallen natrium (Na, atomnummer 11) reagerar med halogenen klor (Cl, atomnummer 17). Som nämnts tidigare är natrium ett fast ämne (en metall) och klor en gulgrön gas. När ämnena har reagerat återstår ett vitt pulver av natriumklorid (koksalt).
Efter elektronövergången från natrium till klor är atomerna laddade. Natriumatomerna har kvar sina 11 protoner, medan antalet elektroner har minskat till 10. Detta underskott på en negativ enhetsladdning (och därmed överskott på en positiv enhetsladdning) markeras i formeln för natrium genom att den nu skrivs som Na+. Laddade atomer (och atomgrupper) kallas joner. Na+ är alltså en natriumjon.
Kloratomerna, som vardera fick en extra elektron under reaktionen, blev på motsvarande sätt negativt laddade p.g.a. överskott på elektroner. De blev kloridjoner, Cl –. Om namnet på en jon har ändelsen id, som i klorid, betyder det att jonen har negativ laddning.




Kristaller av natriumklorid (koksalt)
4.1 Vad är en jon?
Dessa atommodeller visar hur många elektroner som finns i respektive skal (K2 betyder 2 e – i K-skalet, L8 betyder 8 e – i L-skalet osv.). När natrium reagerar med klor bildas natriumklorid som består av natriumjoner (Na+) och kloridjoner (Cl –). Genom elektronövergången från natriumatomer till kloratomer har båda jonslagen uppnått ädelgasstruktur (8 valenselektroner). Natriumatom (Na) Kloratom (Cl) Natriumjon (Na+) Kloridjon (Cl –)


Till vänster: Kol är unikt genom sin förmåga att bilda olika strukturer. Diamanten i ringen består av kolatomer som binds med starka kovalenta bindningar. Varje kolatom delar elektronpar med fyra andra kolatomer, vilket ger en stabil struktur där atomerna når ädelgasstruktur. Denna stabilitet gör diamant till ett av de hårdaste materialen som finns.
Klorgas
Natrium

Jonbindning
Cl–

Jonbindning

uppstår då positivt och negativt laddade joner attraherar varandra.
Na+
4.2 Definiera jonbindning och jonförening.


Två modeller som visar hur jonerna är bundna till varandra i en kristall av natriumklorid, NaCl. Natriumjonerna är grå och kloridjonerna är gröna. I den övre modellen syns tydligt hur jonerna är bundna till varandra, men storleksskillnaden mellan dem syns inte. Det gör den däremot i den undre modellen.
Eftersom natriumjoner och kloridjoner har olika laddning attraherar de varandra. Därför förenas jonerna och bygger upp så kallade kristaller (saltkorn) som i experimentet på föregående sida. I kristallerna är jonerna ordnade så att varje positivt laddad jon omges av negativt laddade joner, medan de negativt laddade jonerna har positivt laddade joner som grannar.
Joner som förenats bildar en jonförening och denna hålls ihop genom jonbindning. Ett annat namn för jonförening är salt. Natriumjoner och kloridjoner ingår i saltet natriumklorid. I andra salter finns andra joner.
Natriumklorid kan betecknas Na+Cl –. I formler för jonföreningar är det vanligare att utelämna laddningarna och formeln skrivs därför NaCl. I jonföreningarnas formler ska den positivt laddade jonen stå främst.
Det framgår inte av formeln NaCl att kristallerna innehåller många natriumjoner och kloridjoner. Formeln visar bara att saltet har en natriumjon för varje kloridjon.

Närbild av en kristall av natriumklorid (koksalt).
Saltet magnesiumklorid
Magnesiumatomer (Mg) måste avge två elektroner för att få ädelgasstruktur. Då bildas magnesiumjoner (Mg2+) som har överskott på två positiva enhetsladdningar.
Vi tänker oss att magnesium reagerar med klor. Det behövs två kloratomer för att ta emot elektronerna från en magnesiumatom. I det bildade saltet magnesiumklorid finns därför dubbelt så många kloridjoner som magnesiumjoner. Det framgår av formeln för magnesiumklorid som är MgCl2. Nedsänkta siffror i formler skrivs efter atomslaget eller atomgruppen de avser. Talet 1 skrivs inte ut i formler.

Förhållandet mellan antalet magnesiumjoner och kloridjoner i magnesiumklorid MgCl2 är 1: 2.

Metaller bildar salter med ickemetaller
För metallatomer som har få valenselektroner är det lättast att uppnå ädelgasstruktur genom att avge valenselektronerna och bilda positivt laddade joner. Hos ickemetallerna, som har många valenselektroner (undantaget väte), erhålls ädelgasstruktur lättast genom att elektroner upptas. Då bildas joner med negativ laddning. När metaller kommer i kontakt med ickemetaller förenas alltså ”elektrongivare” med ”elektrontagare” och då kan jonföreningar, dvs. salter, bildas. Därför är utgångspunkten att kemiska föreningar mellan metaller och ickemetaller är salter.
GRUPP 1
H+ vätejon
H– hydridjon
Li+ litiumjon
Na+ natriumjon
K+ kaliumjon
Rb+ rubidiumjon
Cs + cesiumjon
Be 2+
berylliumjon
Mg2+ magnesiumjon
Al 3+ aluminiumjon
Ca 2+ kalciumjon
Sr 2+ strontiumjon
Ba2+ bariumjon
N 3–nitridjon O 2–oxidjon
S 2–sulfidjon
GRUPP 18
fluoridjon Cl
kloridjon Br
bromidjon I
jodidjon
Formler och namn hos några vanliga atomjoner inom det periodiska systemets huvudgrupper.
4.3 Vad är en atomjon?

Negativa joner
Hydroxidjon OH –
Cyanidjon CN –
Sulfatjon SO4 2 –
Sulfitjon SO3 2 –
Nitratjon NO3 –
Nitritjon NO2 –
Karbonatjon CO3 2 –
Fosfatjon PO4 3 –
Positiv jon
Ammoniumjon NH4+
Några sammansatta joner.
4.4 Förklara vad en sammansatt jon är. Ge exempel.
Atomjoner
Joner som bildas av ett enda grundämne kallas atomjoner. Av periodiska systemet framgår vilka laddningar dessa har om de tillhör någon av huvudgrupperna, se systemet ovan. (För grundämnena i det periodiska systemets undergrupper är det inte så enkelt att det enbart går att följa oktettregeln för att bestämma en jons laddning.)
Positivt laddade atomjoner har samma namn som respektive grundämne med tillägget jon, t.ex. natriumjon. Namn på negativt laddade atomjoner har alltid ändelsen id, ofta kopplad till respektive grundämnes namn. Undantag: N3– heter nitridjon, O2– heter oxidjon och S2– heter sulfidjon. Väteatomer kan bilda såväl positivt som negativt laddade joner. Den positivt laddade jonen (H+) saknar elektron och kallas vätejon. Den negativt laddade jonen (H –) heter hydridjon. Denna har två elektroner, dvs. samma elektronstruktur som ädelgasen helium.
Sammansatta joner
Förutom atomjoner finns det sammansatta joner. Dessa består av mer än ett grundämne. I en sammansatt jon binder de ingående atomerna till varandra med kovalenta bindningar. Ett exempel är karbonatjonen (CO3 2 –) som innehåller en kolatom och tre syreatomer (se figuren överst på nästa sida). Karbonatjoner ingår i bl.a. saltet kalciumkarbonat (CaCO3). Kalksten består av detta salt.
I tabellen till vänster finns namn och formler för några viktiga sammansatta joner. Namn på sammansatta joner med negativ laddning innehåller ofta stavelsen id, at eller it före jon.

Karbonatjonen består av en kolatom (svart) och tre syreatomer (röda). De fyra atomerna i karbonatjonen innehåller tillsammans 30 protoner och 32 elektroner. Därför har hela jonen laddningen 2–.
Hur stor laddning kan en jon ha?
För halogener är det lätt att bilda joner eftersom deras atomer bara behöver uppta en elektron för att få ädelgasstruktur.
Grundämnena i grupp 16 (t.ex. syre och svavel) behöver uppta två elektroner för att få ädelgasstruktur. Detta är svårare eftersom den andra av dessa elektroner ska fångas av en jon som fick laddningen 1– då den första elektronen upptogs. Denna negativa laddning tenderar att repellera den andra elektronen.
För att en jon ska få laddningen 3 – krävs att den tredje elektronen kan upptas av en jon som har laddningen 2–. Därför bildas sällan joner med så stor negativ laddning som 3 –. Nitridjonen (N3–) är ett av undantagen.
Motsvarande gäller för bildning av positivt laddade joner. Alkalimetallerna (grupp 1) bildar lätt joner eftersom de bara behöver avge en elektron för att få ädelgasstruktur. För de alkaliska jordartsmetallerna (grupp 2) är det svårare. De behöver avge två elektroner och den andra av dessa ska lämna en jon som blev positivt laddad då den första elektronen försvann (positiva laddningar attraherar elektroner).
För att en jon ska få laddningen 3+ krävs att den tredje elektronen som avges ska lämna en jon med laddningen 2+. Detta sker sällan. Aluminiumjonen (Al3+) är en av få joner med så stor laddning som 3+.
Orsaken till att vissa atomer kan avge eller uppta mer än en elektron är att jonerna som då bildas kan ingå i stabila kemiska föreningar. Energikostnaden för att bilda joner måste täckas av energivinsten som erhålls då atomerna reagerar och binds samman i jonföreningar.
4.5 Hur förhåller sig radien på en atomjon i förhållande till motsvarande atom?
Grundämnen bildar joner olika lätt
Går vi nedåt i det periodiska systemets grupper ökar jonradien eftersom antalet elektronskal ökar. Vi har redan nämnt att atomer med stor radie binder valenselektronerna lösare än vad atomer med liten radie gör (se sidan 59). I grupperna 1 och 2 är därför de nederst placerade ämnena mest benägna att reagera och bilda positiva joner. För atomer som upptar elektroner under kemiska reaktioner är det tvärt om. Bland t.ex. halogenerna har grundämnet fluor (överst i gruppen) lättast för att reagera med andra ämnen och bilda jonföreningar.
Hur lätt grundämnen bildar joner påverkas också av den laddning jonerna får. Enligt texten på föregående sida krävs minst energi för att bilda joner med liten positiv eller liten negativ laddning. Inom en period är därför det grundämne som bildar joner med laddningen 1+ mer reaktionsbenäget än grundämnet som bildar joner med laddningen 2+. På motsvarande sätt är grundämnet som bildar joner med laddningen 1– mer reaktionsbenäget än grundämnet inom samma period vars joner får laddningen 2–.
Atomjoners storlek
En positivt laddad atomjon bildas genom att en atom avger sina valenselektroner. Jonen får alltså färre elektronskal än vad den oladdade atomen hade. Därmed får den också mindre radie. Ju fler protoner hos atomen eller jonen desto hårdare drar atomkärnan i elektronerna och atomen eller atomjonen blir mindre.
Som väntat har negativt laddade atomjoner större radie än oladdade atomer av samma grundämne. De negativa jonerna har ju bildats genom att en eller flera elektroner har tagits upp.



En jämförelse mellan storleken på atomer och atomjoner hos några grundämnen som tillhör period 3 i det periodiska systemet.
Jonbindningars styrka
Jonbindning är exempel på en stark kemisk bindning. Jonföreningar har därför höga smält och kokpunkter. Exempelvis är smältpunkten för natriumklorid 801°C. Ju starkare jonbindning desto högre smält och kokpunkt. Bindningens styrka påverkas av jonernas laddning och storlek.
Stor laddning (som hos t.ex. Al3+ och N3–) medför att attraktionskraften mellan jonerna är stor, vilket innebär att jonbindningen är extra stark.
Är jonerna små, dvs. om de har liten radie, kan de packas tätt intill varandra. Detta bidrar också till extra stark jonbindning.
För att ett salt ska smälta måste det tillföras så mycket energi (värme) att jonbindningar bryts och att jonerna blir mer eller mindre fritt rörliga i förhållande till varandra (se bilden på sidan 44). Därför har salter med starka jonbindningar extra höga smältpunkter. Som exempel kan nämnas att magnesiumoxid (MgO) har högre smältpunkt än kalciumoxid (CaO).
Magnesiumjoner (Mg2+) har sina elektroner fördelade på K och Lskalet, medan kalciumjoner (Ca2+) har elektroner i K, L och Mskalet. Magnesiumjonerna är alltså minst och binds därmed starkare till oxidjonerna än vad kalciumjonerna gör.
Vad är saltvatten?
Det som händer när ett salt löses i vatten är att kristallernas joner omsluts av vattenmolekyler och frigörs från varandra (detta sker på grund av speciella egenskaper hos vattenmolekylerna som vi kommer till längre fram). På så sätt kommer jonerna att ”simma” var för sig i vattnet. Vi säger att de blir hydratiserade. De enskilda jonerna är naturligtvis för små för att synas och därför är en saltlösning helt klar. Vissa salter (t.ex. natriumklorid) är lättlösliga i vatten och andra (t.ex. silverklorid) är i det närmaste olösliga.


4.6 Vad avgör styrkan hos en jonbindning?

Upplösning i vatten



Natriumklorid löses i vatten. I den kemiska formeln betyder (s) att ämnet är i fast form (latin ”solidus” = fast) och (aq) att jonerna är i vattenlösning (latin ”aqua” = vatten).
Cl
Fast natriumklorid leder inte elektrisk ström.


En vattenlösning av natriumklorid leder elektrisk ström.



Konduktivitetsmätare, instrument för mätning av ledningsförmåga i t.ex. sjövatten.
Förmåga att leda elektrisk ström

Ledningsförmåga
4.7 Förklara varför ett salt i vattenlösning eller i smält form leder ström, men inte i fast form.
I bildserien ovan undersöks den elektriska ledningsförmågan hos fast natriumklorid, smält natriumklorid och en vattenlösning av natriumklorid. Vi ser att fast natriumklorid saknar ledningsförmåga.
Att en jonförening i fast form inte leder elektrisk ström beror på att jonbindningarna är så starka att jonerna sitter fast i saltkristallerna. Därmed saknas laddade partiklar som kan vandra i ett elektriskt fält.
I en smält jonförening och i en vattenlösning är det annorlunda. Där är jonerna tillräckligt fria för att kunna vandra i ett elektriskt fält. I försöken med natriumklorid sluts den elektriska kretsen då kloridjoner vandrar mot den positivt laddade elektroden och natriumjoner mot den negativt laddade elektroden.
Ledningsförmågan hos en saltlösning ökar med mängden salt som finns löst i vattnet. Därför kan ledningsförmåga (konduktivitet) användas som ett mått på en lösnings salthalt.
V
Smält natriumklorid leder elektrisk ström.
Att skriva formler för jonföreningar
Med hjälp av det periodiska systemet kan du räkna ut olika atomjoners laddningar. Du har också nytta av att kunna formler och laddningar för de sammansatta joner som finns i tabellen på sidan 86. Med denna kunskap kan du lätt skriva korrekta formler för flertalet jonföreningar som ingår i den här kursen. Det som gäller är att jonföreningen saknar nettoladddning, dvs. summan av positiva och negativa laddningar är noll. Antalet joner markeras med nedsänkta siffror efter ämnet det berör. Tänk också på att låta joner med positiv laddning stå främst i formlerna.
EXEMPEL
Formler för salter
Skriv formeln för följande salter a kalciumoxid b aluminiumoxid c aluminiumhydroxid
Lösning:
a Kalciumoxid innehåller kalciumjoner och oxidjoner. Med hjälp av det periodiska systemet vet vi att kalciumjoner tecknas Ca2+ och oxidjoner tecknas O2 –. Eftersom ett salt är elektriskt neutralt ska dess formel innehålla lika många positiva som negativa laddningar. Formeln blir alltså CaO.
b Aluminiumoxid innehåller jonerna Al3+ och O2 –. För att formeln ska få lika många positiva som negativa laddningar får vi hitta det minsta talet som är jämnt delbart med såväl 2 som 3. Detta tal är 6. Tar vi två Al3+ och tre O2 – kommer formeln att innehålla sex positiva och sex negativa laddningar. Formeln blir alltså Al2O3
c Aluminiumhydroxid innehåller aluminiumjoner Al3+ och hydroxidjoner OH –. Av laddningarna framgår att saltet måste innehålla tre hydroxidjoner för varje aluminiumjon. Formeln blir Al(OH)3 Här är parentesen om hydroxidjonerna viktig. Utan den skulle trean gälla för enbart väteatomerna.
Svar: a CaO b Al2O3 c Al(OH)3
Litium reagerar med syre
Skriv namn och formel för det ämne som bildas då litium reagerar med syre.
Lösning: Eftersom litium är en metall och syre en ickemetall kan vi utgå från att det bildas en jonförening. Litium bildar litiumjoner (Li+) och syre bildar oxidjoner (O2–) och tillsammans bildar de litiumoxid. Det behövs två litiumjoner för varje oxidjon för att föreningen ska bli elektriskt neutral och formeln blir Li2O.
Svar: Litiumoxid, Li2O
Natriumhalogenid och smältpunkt
Skriv formeln för den natriumhalogenid som har högst smältpunkt.
Lösning: En halogenid är en negativt laddad jon som bildats av en halogenatom (grupp 17).
Om vi väljer den minsta av dessa joner, dvs. fluoridjonen (F –), får vi starkast jonbindning och därmed högst smältpunkt.
Svar: NaF
4.8 I vilken typ av partiklar finns kovalenta bindningar?
4.9 Vad innebär en kovalent bindning?
Kovalent bindning i molekyler
När en metall reagerar med en ickemetall är dragkampen om valenselektronerna så ojämn att metallatomerna helt förlorar en eller flera elektroner till ickemetallernas atomer. Då bildas joner och jonföreningar.
När ickemetaller reagerar med varandra är dragkampen om elektronerna så jämn att det inte sker någon fullständig elektronövergång. Istället förenas atomerna och delar med sig av sina valenselektroner så att de får gemensamma elektronpar och därigenom uppnår varje atom ädelgasstruktur. Då uppstår molekyler.
Det är de gemensamma elektronparen som binder samman atomerna i en molekyl. En sådan kemisk bindning kallas kovalent bindning eller elektronparbindning. ”Kovalent” betyder ”samma värde”. Namnet antyder att elektroner delas mer eller mindre lika mellan de förenade atomerna. I den kovalenta bindningen kan ett, två eller tre elektronpar delas vilket ger en enkel, dubbel eller trippelbindning.
Molekyler av endast ett grundämne
Vi ska inleda med att studera molekyler som består av en enda sorts atomer.
Vätemolekyler
En väteatom har bara en elektron. För att få ädelgasstruktur (som helium) behöver den två. Det uppnås om två väteatomer förenar sig med varandra och låter sina elektroner kretsa kring båda atomkärnorna. Då bildas en tvåatomig vätemolekyl, sammanhållen med en opolär kovalent bindning (elektronerna delas lika mellan atomerna).
Vätemolekylens gemensamma elektronmoln är tätast mellan atomkärnorna. På så sätt attraherar elektronmolnet de båda kärnorna så att atomerna håller ihop. Denna typ av bindning mellan atomer kallas kovalent bindning (eller elektronparbindning).
Det är störst chans att vätemolekylens elektroner befinner sig mellan de båda atomkärnorna. Elektronmolnet är med andra ord tätast mellan atomkärnorna. Därmed koncentreras negativ laddning dit, vilket attraherar de båda positivt laddade atomkärnorna. Det är denna sammanhållande kraft som utgör den kovalenta bindningen.
Normalt förekommer allt väte i molekylform eftersom detta tillstånd är mycket stabilt. Kovalent bindning är stark kemisk bindning och därför krävs förhållandevis mycket energi för att skilja på vätemolekylernas atomer.
Formler och modeller
Varje elektronpar som ger upphov till en kovalent bindning i en molekyl symboliseras med två prickar när vi ritar en elektronformel. I en så kallad strukturformel visas den kovalenta bindningen istället med ett streck mellan atomerna. Vätemolekylens strukturformel är H – H.
I en summaformel framgår endast summorna av ingående atomslag. Summaformeln för vätemolekylen är H2.
Bilden nedan visar modeller av molekyler (där väteatomer alltid är vita). Modellerna är så kallade kalottmodeller eller består av kulor och stavar. I de senare motsvarar varje stav ett gemensamt elektronpar, dvs. en kovalent bindning.

Kalottmodell

Två modeller av en vätemolekyl.
Modell med kulor och en stav

Halogenmolekyler
Även halogenerna fluor, klor, brom och jod består av tvåatomiga molekyler, nämligen F2, Cl2, Br2 och I2. En ensam halogenatom har sju valenselektroner, men i molekylform råder ädelgasstruktur. Hur detta går till framgår av nedanstående elektronformel där vi använder klor som exempel. I en elektronformel är valenselektroner markerade med punkter.
Klormolekylens atomer har vardera sex egna och två gemensamma valenselektroner. Därmed har båda atomerna uppnått ädelgasstruktur, dvs. åtta valenselektroner.
Till höger visas fyra halogenmolekylers strukturformler. Alla hålls samman av en opolär kovalent bindning. Elektronerna delas lika mellan atomerna.
Elektronformel
HStrukturformel
H2 H H : H
Summaformel
Tre sätt att skriva vätemolekylens formel.
4.10 Vad visar en strukturformel?

F F Cl Cl Br Br I I
Halogenmolekylernas strukturformler. Varje molekyl har en enkel kovalent bindning. Observera att i en strukturformel sätts oftast endast de valenselektroner som deltar i en bindning ut.
N N

I kvävemolekylen finns en trippelbindning.


78 % av luft är kväve (blå molekyler) och 21 % är syre (röda molekyler). Båda gaserna består av tvåatomiga molekyler.
4.11 Vad är skillnaden mellan en enkel, dubbel och trippelbindning?
Kvävemolekyler
En kväveatom har fem valenselektroner och behöver ytterligare tre för att få ädelgasstruktur. Därför slår sig kväveatomer ihop två och två och delar på tre elektronpar enligt nedanstående formel.
N + N N N
Kväveatom Kväveatom Kvävemolekyl
I den kovalenta bindningen i en kvävemolekyl ingår tre stycken elektronpar. Dessa markeras med tre streck i strukturformeln som i figuren till vänster. En sådan bindning kallas trippelbindning. Den är mycket stark, vilket innebär att kvävemolekyler är stabila. De är inerta och reagerar ogärna med andra ämnen.
Syremolekyler
Även syre bildar tvåatomiga molekyler (O2). Eftersom syreatomer har sex valenselektroner kan vi anta att atomerna i O2 har två gemensamma elektronpar, dvs. en dubbelbindning. Utvecklas detta vidare någon stans? Ofta lär man ju ut att syrgas har dubbelbindning. Det känns som detta väcker nyfikenhet men saknar ett svar. Finns svaret så kanske det är en hänvisning som saknas.
Tvåatomiga molekyler i periodiska systemet
De vanligaste grundämnena som bildar tvåatomiga molekyler är fördelade i det periodiska systemet på ett sätt som ser ut som en uppochnedvänd hockeyklubba med väte som den tillhörande pucken.

123456789 10 111213141516 17 18
1 H He
2 LiBe
BC NOF Ne
3 NaMg AlSi PS Cl Ar 4K CaSc Ti V CrMn Fe CoNiCuZnGaGeAsSe Br Kr
5 RbSr Y ZrNbMo Tc RuRh Pd AgCdInSnSb Te I Xe
6 Cs Ba Hf Ta W ReOsIrPtAuHg Ti PbBi Po At Rn
7 FrRaRfDbSgBhHsMtDsRgCnNhFlMc Lv Ts Og
LaCePrNdPmSmEuGd Tb DyHoEr Tm Yb Lu Ac Th Pa U NpPuAmCmBkCfEsFmMdNoLr

Atomer som bildar tvåatomiga molekyler markerade i svart i det periodiska systemet. De rödfärgade skulle troligtvis bilda tvåatomiga molekyler om de kunde, men de är så kortlivade att det är svårt att undersöka om de gör det innan de sönderfaller.
UTBLICK
En giftig form av syre
Förutom vanliga syrgasmolekyler (O2) finns en form av syre som kallas ozon. Molekylerna i ozon består av tre syreatomer (O3). Ordet ozon härstammar från det grekiska ordet ozein som betyder lukta. Du har säkert känt lukten av denna giftiga gas nära laserskrivare och kopieringsutrustning. Det energirika ljuset i dessa apparater kan nämligen omvandla vanligt syre till ozon. Därför ska laserskrivare och kopiatorer användas i väl ventilerade utrymmen. Ozon bildas även genom elektriska urladdningar och till följd av luftföroreningar (i form av kväveoxider) från förbränningsmotorer i t.ex. bilar. Det senare är ett allvarligt miljö och hälsoproblem.
Ozon är giftigt därför att det reagerar mycket lätt med bl.a. organiska ämnen i levande varelser. Misstanken är att det ozon som trafiken ger upphov till skadar Sveriges skogar och jordbruksprodukter för miljardbelopp varje år.
Skyddar mot UV-strålning
Ozon som bildas nära jordytan är skadligt. Vi är däremot beroende av att det finns ozon på hög höjd i atmosfären. Där fungerar det som jordens ”solglasögon” och skyddar oss mot skadlig UVstrålning från solen.
Det ozon som finns naturligt på hög höjd i atmosfären bildas då UVstrålning från solen påverkar syrgasmolekyler. Trots att dessa ozonmolekyler förekommer sparsamt och är mycket spridda bland övriga luftmolekyler, talar vi om atmosfärens ozonskikt. Om vi kunde ta ner och samla alla atmosfärens ozonmolekyler i ett lager närmast jordytan, skulle ozonskiktet bara bli ca 3 mm tjockt.
Ända sedan 1970talet har forskarna uppmärksammat att atmosfärens ozonskikt är tunnare än normalt. Det beror på att vissa föroreningar sprids upp i atmosfären och bryter ner ozon snabbare än det hinner nybildas. Bland dessa föroreningar har främst lätta gaser som innehåller klor och som gemensamt kallas freoner (eller CFCgaser) uppmärksammats.
En enda freonmolekyl kan förstöra den ena ozonmolekylen efter den andra utan att själv förbrukas.
Tidigare ansågs att freonerna var helt ofarliga. De användes till bl.a. kylmedium i kylskåp, som avfettningsmedel och som drivgas i sprayflaskor. Freonerna är stabila ämnen med mycket lång ”livslängd”. Efter att en internationell överenskommelse som kallas Montrealprotokollet trädde i kraft 1989 förbjöds i princip användning av freoner. Det ledde till en långsam återhämtning av ozonskiktet, men pga freonernas långa livslängd kan det ta uppskattningsvis till ca år 2070 innan ozonskiktet har återhämtat sig helt.
över havet (km)



Ozonmolekyl ”Ozonskikt”
En ozonmolekyl består av tre syreatomer. Det mesta av atmosfärens ozon finns 15 – 30 km över havsytan.
Fosfor och svavel
Fosfor och svavel bildar molekyler med fler än två atomer och i dessa ingår enbart enkelbindningar. Som bilderna nedan visar består t.ex. vit fosfor (se sidan 72) av tetraederformade molekyler och svavel i fast form innehåller ringformade molekyler med åtta atomer. Vit fosfor och svavel ska egentligen betecknas P4 respektive S8. I reaktionsformler med dessa grundämnen brukar dock siffrorna för atomtalen utelämnas.

En

Molekylmodell av diamant.

Molekylmodell av grafit.
Kol bildar jättemolekyler
Grundämnet kol förekommer som diamant och grafit. Dessutom har modern forskning lärt oss att kolatomer även kan bilda andra strukturer som kallas fullerener, kolnanorör respektive grafen. Vanligt kol förekommer också ofta i amorf (oregelbunden) form som t.ex. i vanlig grillkol.
I diamant är varje kolatom bunden till fyra andra kolatomer i ett tetraederformat mönster. Eftersom en kolatom har fyra valenselektroner får den ädelgasstruktur då den delar elektronpar med sina fyra atomgrannar. Denna stabila struktur gör diamant till ett extremt hårt ämne. Det är dessutom en bättre värmeledare än många metaller. Det beror på att vibrationer (i form av värmerörelser) lätt sprider sig i de rigida (stela) jättemolekylerna. Hårdheten och värmeledningsförmågan utnyttjas då diamant används till borrkronor i t.ex. berg och tandläkarborrar. Friktionsvärmen som bildas vid borrning leds effektivt bort av diamanten.
Diamant är en dålig elektrisk ledare. Det beror på att materialet saknar rörliga elektroner. Alla valenselektroner deltar ju i kovalenta bindningar. Det kan också nämnas att det finns en sällsynt form av diamant med hexagonal struktur som kallas lonsdaleit. Den uppstår vid vissa meteoritnedslag.
I grafit bildar kolatomerna plana skikt där varje atom binder endast tre andra atomer med kovalent bindning. Därmed har varje kolatom en valenselektron över. Dessa ”fria” elektroner bildar ett elektronmoln som är gemensamt för skiktet. Det är dessa fritt rörliga elektroner som gör att grafit kan leda elektrisk ström.
Vit fosfor (P4).
svavelmolekyl (S 8).

I grafit finns även svaga kemiska bindningar (van der Waalsbindning, se sidorna 112–113) som verkar mellan de olika skikten. Genom att dessa bindningar är svaga kan skikten glida mot varandra. Detta utnyttjas i ritkol och i blyertspennor som innehåller grafit. När en penna förs mot ett papper skalas kolskikt av och bildar ett streck.
Bland annat träkol, sot och aktivt kol förekommer i amorf form. Det innebär att kolatomerna har bundit till varandra på ett ostrukturerat sätt. Det amorfa kolet har inga skikt som grafit och därför finns det inte heller fria elektroner. Amorft kol leder alltså inte ström.
År 1985 upptäckte forskare att kol även kan bilda ihåliga strukturer som döptes till fullerener. Den mest kända av dessa består av 60 kolatomer och liknar en fotboll.
Forskningen på fullerener ledde till upptäckten av kolnanorör år 1991.
Dessa kan liknas vid enkla kolskikt från grafit som har rullats till rör.
Diametern hos ett kolnanorör är endast några nanometer (1nm = 1 · 10–9 m).
Kolnanorören visade sig ha unika egenskaper. De tillhör de absolut starkaste kända materialen och de har extremt god ledningsförmåga för både värme och elektrisk ström. Därför kan de få stor betydelse i framtiden, t.ex. när det gäller att skapa starka och lätta material. Förhoppningen är att även kunna utveckla extremt små och snabba processorer till datorer med hjälp av kolnanorör.
År 2010 gick Nobelpriset i fysik till forskare som hade isolerat enstaka kolskikt från grafit. På så sätt skapade forskarna för första gången det material som heter grafen. Detta är mycket hållbart, trots att det bara består av ett enda atomskikt. Grafen är dessutom böjligt, genomskinligt och det har mycket bra elektrisk ledningsförmåga. Detta öppnar unika möjligheter till framtida användningsområden.
Denna diamant kommer från en gruva i Brasilien. Diamant kan även tillverkas på konstgjord väg, men det krävs då mycket högt tryck och hög temperatur.

Molekylmodell av amorft kol.

Molekylmodell av fulleren.

Molekylmodell av kolnanorör.

Molekylmodell av grafen.
4.12 Beskriv uppbyggnaden av grafit.

Grafit i blyertspennor
Ordet grafit kommer av grekiskans graphein som betyder skriva. Stiftet i en blyertspenna består av finmalen grafit med tillsats av lera. Genom att variera andelarna grafit och lera framställs stift med olika hårdhetsgrader.
Ordet blyerts har lånats från tyskan där Bleierz betyder blymalm. De första ”blyertspennorna”, som framställdes i Italien på 1400talet, var tillverkade av bly. När grafit senare började användas i blyertspennor uppfattades denna som en blymalm. Därför behölls namnet, trots att moderna blyertspennor inte innehåller något bly.
Diamanterna som försvann
På 1700talet gjorde paret Lavoisier (se sidan 26) experiment med det hårda materialet diamant. De lyckades förbränna diamanter med hjälp av stora brännglas. Under förbränningen försvann diamanterna spårlöst. De lämnade inte ens någon aska efter sig. Det enda som bildades var den luktfria och osynliga gasen koldioxid. Paret Lavoisier visste att denna gas bildas då kol förbränns. De insåg därmed att diamanterna bestod av grundämnet kol som reagerade med luftens syre och bildade koldioxid under förbränningen.
Lavoisier lyckades förbränna diamant med hjälp av denna utrustning som innehöll två stora brännglas.
Olika grundämnen i samma molekyl
Vi ska nu studera molekylföreningar som består av mer än ett grundämne. Vi börjar med vatten.
Den märkliga vattenmolekylen
Knallgas är en blandning av vätgas och syrgas. Om knallgas antänds reagerar de båda grundämnena med varandra under en våldsam explosion. Det som händer är att väte och syre förenas till vattenmolekyler och en mycket stor mängd energi avges.
I figuren nedan beskrivs knallgasexplosionen på tre olika sätt, med ordformel, med molekylmodeller och med teckenformel. Eftersom väte och syre förekommer som tvåatomiga molekyler måste vi utgå från dessa. Vi vet också att vattenmolekylen har formeln H2O. Den innehåller alltså två väteatomer och en syreatom.
För att bilda en vattenmolekyl behövs atomer från en vätgasmolekyl och en halv syrgasmolekyl. Det finns dock inte halva molekyler. Därför utgår vi från en hel syrgasmolekyl och låter denna reagera med två vätgasmolekyler. Då bildas två vattenmolekyler (2 H2O).



Varför bildas vattenmolekyler?
Vi har sagt att väte och syre förekommer som tvåatomiga molekyler eftersom detta tillstånd är mer stabilt (har lägre energi) än då atomerna förekommer var för sig. Trots detta reagerar vätgasmolekyler med syrgasmolekyler och bildar vatten. Det beror på att vattenmolekylerna är ännu stabilare och representerar en ännu lägre energinivå.
Skillnaden i energimängd hos de olika tillstånden är den energimängd som frigörs under knallgasreaktionen och som orsakar explosionen.
Knallgas, dvs. en blandning av väte och syre, reagerar under bildning av vatten.
Väte + Syre
Vatten
2 H2 + O2
2 H2O +
HH

Elektronformel
Molekylmodell med sammanfogade bollar
Molekylmodell med kulor och stavar
HH H2O
Strukturformel
Summaformel
Olika sätt att återge en vattenmolekyl.
4.13 Vad menas med elektronegativitet?
4.14 Vad är skillnaden mellan opolär och polär kovalent bindning?

Varför har H 2 O en syreatom och två väteatomer?
En syreatom har sex valenselektroner. Den saknar därmed två elektroner för att få ädelgasstruktur. En väteatom har en valenselektron och behöver ytterligare en för att få ädelgasstruktur (likt helium). Detta innebär att syreoch väteatomer kan få ädelgasstruktur om de bildar vattenmolekyler där en syreatom får gemensamma elektronpar med två väteatomer. Det framgår av elektronformeln i figuren till vänster.
Polära kovalenta bindningar
Syre har atomnummer 8. En syreatom har alltså 8 protoner och 8 elektroner, varav 6 valenselektroner. Det innebär att atomen innanför valenselektronerna har nettoladdningen 6+ (8 p+ i kärnan och 2 e – i Kskalet). Det är denna laddning som attraherar valenselektronerna som befinner sig i Lskalet.
En väteatom attraherar en valenselektron med endast laddningen 1+ (kärnan består av 1 p+).
Uppstår en kovalent bindning mellan en syre och en väteatom attraheras det gemensamma elektronparet mest av syreatomen på grund av dess större positiva nettoladdning innanför valenselektronerna. Det ämne som är bäst på att attrahera valenselektroner sägs vara det mest elektronegativa. Syre är alltså mer elektronegativt än väte.
Den kovalenta bindningen mellan syre och väte kallas polär eftersom de gemensamma elektronerna är förskjutna mot syret (det gemensamma elektronparet kretsar mer kring syreatomen än kring väteatomen). Därmed får syret en svag negativ laddning och vätet en svag positiv laddning. Sådana svaga laddningar anges med δ respektive δ+ i formler och molekylmodeller (δ = delta).
Alla kovalenta bindningar är polära kovalenta bindningar om de binder samman olika sorters atomer.

Väteatom Syreatom
Summa 6+
Väteatomens elektron attraheras av atomkärnan som har laddningen 1+. I syreatomen attraheras valenselektronerna av nettoladdningen 6+. Syre är mer elektronegativt än väte.
Mellan väteatomen och syreatomen råder polär kovalent bindning. Det gemensamma elektronparet (punkterna) attraheras mest till syreatomen så att den blir svagt negativt laddad. Väteatomen blir då svagt positivt laddad.
Vattenmolekylen är en dipol
Som en följd av att vattenmolekylens atomer binds med polära kovalenta bindningar, och att vattenmolekylen är osymmetrisk, blir hela molekylen en dipol (di = två). Det innebär att molekylen har två elektriska poler, en negativ pol (δ) och en positiv pol (δ+) enligt bilden till höger.
På grund av laddningarnas inverkan orienterar sig dipolmolekyler i förhållande till varandra som i nedre bilden till höger. Kraftverkan mellan laddningarna gör att dipolmolekylerna kan bindas till varandra genom så kallad dipoldipolbindning
Fluor, syre och kväve är de grundämnen vars atomer har störst attraktionskraft på valenselektroner (de är de mest elektronegativa grundämnena). När dessa atomer delar elektroner med väteatomer blir därför dipolkaraktären extra kraftig. Det medför att molekyler som innehåller väte bundet till fluor, syre eller kväve attraherar varandra starkare än vad andra dipolmolekyler gör. Denna speciella och extra starka bindning mellan dipolmolekyler kallas vätebindning. På sidan 114 förklaras vätebindning mer ingående.
Vätebindningar förekommer mellan vattenmolekyler som ju består av syre och väte. Dessa förhållandevis starka bindningar mellan molekylerna är orsak till vattnets ytspänning. Tack vare denna kan t.ex. ett rakblad av järn ligga på en vattenyta utan att sjunka. På nästa uppslag presenteras fler egenskaper hos vatten som beror på att molekylerna är dipoler och på vätebindningarna.








Tack vare ytspänningen kan rakbladet ligga på vattenytan utan att sjunka.
Vattenmolekylen är en dipol.

Molekyl
Dipoldipolbindning
Dipol-dipolbindning mellan dipolmolekyler.
4.15 Förklara vad som menas med a) en dipol b) dipoldipolbindning
4.16 Vilka molekyler kan ge upphov till vätebindningar?



Ytspänning
Vattenmolekyler binds förhållandevis starkt till varandra med vätebindningar. Därför kan vatten bilda större och rundare droppar än flertalet andra vätskor.


Hög kokpunkt
I vulkaniskt aktiva områden kan marken vara så varm att källvatten kokar. Vattnets kokpunkt (100 °C) kan jämföras med kokpunkten hos t.ex. svavelväte (H2S) som är – 61°C. Vattnets höga kokpunkt beror på vätebindningarna mellan vattenmolekylerna. I svavelväte förekommer inga vätebindningar.









Vätebindning



Påverkas av laddning
Ballongen har gnuggats mot nylon och fått ett överskott på elektroner, dvs. blivit minusladdad. Eftersom olika laddningar attraherar varandra vänder varje molekyl i vattenstrålen sin plusladdade sida mot ballongen. Därmed kan ballongen attrahera vattenmolekylerna så att vattenstrålen böjs.

Tyngst i flytande form
Sänks temperaturen under 0°C får vattenmolekyler så liten värmerörelse att vätebindningarna orkar hålla dem i en regelbunden och förhållandevis gles struktur (den infällda bilden). Så uppstår is. Genom att strukturen är gles har is lägre densitet än flytande vatten. Därför flyter is. Flertalet andra ämnen har störst densitet i fast tillstånd.
Bra på att lösa salt
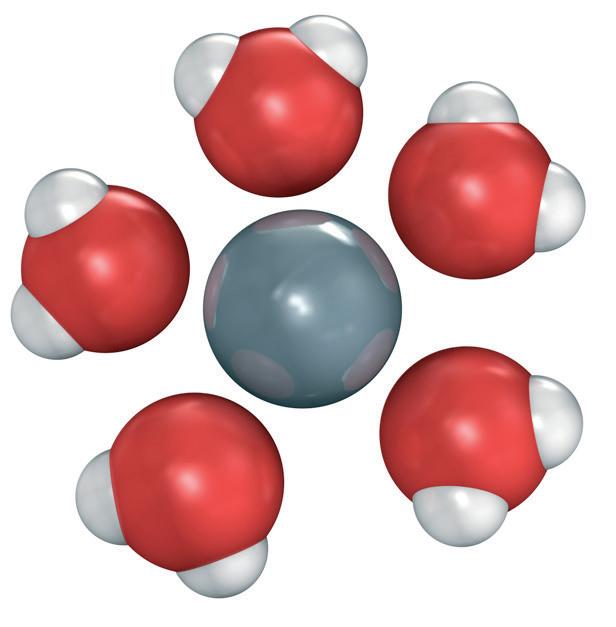
Nedan visas en hydratiserad natriumjon, dvs. omgiven av vattenmolekyler. Genom att vattenmolekylerna
är dipoler attraheras de av joners laddningar. Detta gör att vatten har god förmåga att frigöra joner från saltkristaller och isolera dem från varandra. Därför löser sig många salter förhållandevis lätt i vatten.








Molekylernas form
C HH H H
Metanmolekylens elektronformel.
C
Metanmolekylens strukturformel.
Vi ska nu jämföra vattenmolekylen med andra molekyler som innehåller polära kovalenta bindningar. Detta för att se vad som bestämmer formen på en molekyl och för att förstå varför t.ex. vattenmolekylen är osymmetrisk.
Metan
Metan (CH4) är en gas vars molekyler innehåller en kolatom och fyra väteatomer. Kolatomen har fyra valenselektroner och får därmed ädelgasstruktur då den ”lånar” de fyra väteatomernas elektroner. Detta framgår av elektronformeln till vänster. Under elektronformeln ser du metanmolekylens strukturformel med atomernas gemensamma elektronpar markerade som streck. Strecken symboliserar även molekylens polära kovalenta bindningar (kol är mer elektronegativt än väte). Trots att bindningarna är polära är inte metanmolekylen en dipol. Det beror på att molekylen är symmetrisk så att dess positiva och negativa laddningars ”tyngdpunkter” sammanfaller med varandra.
4.17 Varför är metanmolekylen ingen dipol?
HH H H C H H H H

Tetraedrisk struktur
Eftersom lika laddningar repellerar varandra orienterar sig metanmolekylens bindningselektroner så att de fyra elektronparen befinner sig så långt från varandra som möjligt. Därför antar molekylen formen av en tetraeder, dvs. en pyramid med en triangulär bas så att alla sidor är likadana. (se de tredimensionella modellerna nedan).
Eftersom metanmolekylen har en tredimensionell struktur, gör vi en förenkling när vi ritar strukturformeln i ett enda plan som i figuren till vänster. För att återge den mer korrekta, tredimensionella strukturen används symbolerna som du kan se till höger i bilden nedan. Där visas den bindning som ligger i papprets plan med en heldragen linje. De streckade linjerna symboliserar bindningarna som sträcker sig bakom papprets plan (bort från dig) och den svarta triangeln visar bindningen som når framför papprets plan (mot dig).


Tetraeder Modell med kulor och stavar

Tredimensionella modeller av en metanmolekyl.
”Tredimensionell” strukturformel
Ammoniak
Ammoniak (NH3) är en gas vars molekyler består av en kväveatom och tre väteatomer. Kväveatomen har fem valenselektroner och behöver ytterligare tre för att uppnå ädelgasstruktur. Därför innehåller ammoniakmolekylen just tre väteatomer som binds till kväveatomen med polära kovalenta bindningar.
Kväveatomens båda obundna valenselektroner tar också plats genom att de repellerar övriga elektronpar. Därför har ammoniakmolekylen formen av en pyramid likt en metanmolekyl. Ammoniakmolekylen har dock väteatomer i endast tre av pyramidens fyra hörn. Det fjärde hörnet upptas av det fria elektronparet.
Eftersom ammoniakmolekylen är osymmetrisk (”tyngdpunkten” för de positiva och negativa laddningarna sammanfaller inte) är den en dipol med negativ laddning förskjuten mot den starkt elektronegativa kväveatomen. Mellan ammoniakmolekyler förekommer dessutom vätebindningar (jämför med vattenmolekylen på sidan 101).

elektronpar

Åter till vattenmolekylen
I en vattenmolekyl omges syreatomen av fyra par valenselektroner, varav två par ingår i bindningar till väteatomer (se elektronformeln nedan). De fyra elektronparen repellerar varandra på samma sätt som i metanmolekylen och därför är även vattenmolekylen ”pyramidformad”. I två av pyramidens fyra hörn saknas dock atomer. Pyramidformen förklarar varför vattenmolekylens väteatomer är osymmetriskt placerade.

elektronpar

4.18 Varför är en ammoniakmolekyl osymmetrisk?
Tre modeller av en ammoniakmolekyl. I modeller med kulor och stavar är kväveatomer blå och väteatomer vita. Ammoniakmolekylen är en dipol eftersom den har polära kovalenta bindningar och är osymmetrisk.
4.19 Förklara varför vattenmolekylen inte är linjär.
Tre modeller av en vattenmolekyl. Vattenmolekylen är en dipol.

En koldioxidmolekyl återgiven som elektronformel, strukturformel och modell med kulor och stavar.
4.20 Hur kan koldioxidmolekylen vara linjär?
Koldioxid är exempel på en linjär molekyl
En koldioxidmolekyl (CO2) består av en kolatom och två syreatomer. Kolatomen har fyra valenselektroner och syreatomerna har sex valenselektroner. Atomerna uppnår ädelgasstruktur genom att kolatomen har fyra gemensamma elektroner med vardera syreatomen (se elektronformeln till vänster).
Om vi ritar de gemensamma elektronparen som streck (polära kovalenta bindningar) ser vi att de båda syreatomerna binds till kolatomen med dubbelbindningar. Koldioxidmolekylen är linjär eftersom det inte finns några fria par av valenselektroner på den centrala kolatomen som påverkar formen (som hos t.ex. syreatomen i vattenmolekylen på föregående sida).
Syre är mer elektronegativt än kol och därför leder laddningsförskjutningen till att kolatomen har överskott på positiv laddning och syreatomerna överskott på negativ laddning i koldioxidmolekylen. Laddningsfördelningen är dock symmetrisk eftersom molekylen är linjär med kolatomen i centrum. Det innebär att ”tyngdpunkterna” för de positiva och de negativa laddningarna sammanfaller. Därmed är koldioxidmolekylen ingen dipol.
Mer om elektronegativitet
På sidan 100 kom vi fram till att en atoms elektronegativitet, dvs. dess förmåga att attrahera valenselektroner, påverkas av nettoladdningen innanför valenselektronernas sfär. Hos t.ex. fluor attraheras valenselektronerna av laddningen 7+ och hos syre av laddningen 6+ (se vänstra bilden nedan). Fluor är mer elektronegativt än syre.
Förutom laddningsförhållanden har även atomers radie betydelse för elektronegativiteten. Jämförs atomer i samma grupp är de minsta atomerna mest elektronegativa eftersom de har sina valenselektroner närmast kärnan (se högra bilden nedan).

Fluoratom
Summa 7+
Syreatom
Summa 6+

Litiumatom
Summa 1+
Natriumatom
Summa 1+
Två atomer i samma period. Fluoratomen är mest elektronegativ.
Två atomer i samma grupp. Litiumatomen är mest elektronegativ.

Svagast attraktionStarkast attraktion
Svagast attraktionStarkast attraktion

En atoms förmåga att attrahera ett elektronpar i en polär kovalent bindning påverkas av atomens nettoladdning innanför valenselektronerna och av atomens storlek.
Elektronegativitetsvärden
Ofta behöver olika grundämnens elektronegativitet kunna jämföras. Därför har ett system med elektronegativitetsvärden konstruerats. I tabellen nedan finns elektronegativitetsvärden för grundämnena i det periodiska systemets huvudgrupper.
Det är inte förvånande att alkalimetallerna (i grupp 1) utgör de minst elektronegativa ämnena. De vill ju hellre avge sin valenselektron än att attrahera nya elektroner. Eftersom elektronegativiteten dessutom avtar med atomernas storlek är cesium Cs (tillsammans med francium som ej är med i tabellen) det minst elektronegativa ämnet.
Fluoratomerna har störst elektronegativitet eftersom de är minst bland de atomer som attraherar valenselektroner med maximal nettoladdning, dvs. 7+. Ädelgaserna (grupp 18) har inte tilldelats elektronegativitetsvärden eftersom de är obenägna att attrahera eller stöta bort elektroner. Skalan som anger elektronegativitetsvärdena är relativ och utgår från väte som referenspunkt. Elektronegativitetsvärdena kan variera något när atomerna ingår i molekyler.
GRUPP 1
Elektronegativiteten ökar
Elektronegativitetsvärden för ämnen i det periodiska systemets huvudgrupper.
4.21 Vilket är det mest elektronegativa grundämnet?
Typ av bindning Jonbindning
Ämnesexempel

Polär kovalent bindningKovalent bindning
Natriumklorid, NaClVäteklorid, HClKoltetraklorid, CCl4 Klor, Cl2




Elektronegativitetsvärden Na 0,9 Cl 3,0H 2,1 Cl 3,0C 2,5 Cl 3,0Cl 3,0 Cl 3,0
Skillnad i elektronegativitet 2,1 0,9 0,5 0
Typ av ämne


JonföreningMolekylförening, osymmetrisk, dipol




Molekylförening, symmetrisk, ingen dipol


Molekylförening, ingen dipol

Samband mellan bindningens karaktär och skillnad i elektronegativitet mellan ingående atomslag.

Oskarp gräns mellan kovalent bindning och jonbindning
Polär kovalent bindning kan sägas vara kovalent bindning med ett visst inslag av jonbindning. Kovalent bindning och jonbindning är med andra ord ”extrema” bindningstyper, mellan vilka polära kovalenta bindningar utgör mellanformer (se tabellen ovan).
Ju större skillnad det är mellan två grundämnens elektronegativitet, desto större blir inslaget av jonbindning mellan dessa ämnen i en kemisk förening. Det framgår av tabellen nedan där olika vätehalogenider (väte i förening med grundämnen i grupp 17) jämförs.
Då en metall och en ickemetall förenas brukar jonbindningsinslaget bli så stort att föreningen anses vara en jonförening.

Vätehalogenid
Skillnad i elektronegativitet mellan ingående atomslag
Vätefluorid, HF Väteklorid, HClVätebromid, HBrVätejodid, HI
Inslag av jonbindning 43 % 17 % 13 % 7 %
Inslag av jonbindning i vätehalogenider. Halogenidatomernas elektronegativitet avtar med växande atomradie (dvs. nedåt i det periodiska systemet). Därför är skillnaden i elektronegativitet störst mellan väte och fluor och därför har vätefluorid (HF) störst jonbindningsinslag.
UTBLICK
Polära kovalenta bindningar i sammansatta joner
I tabellen på sidan 86 finns exempel på sammansatta joner. Atomerna i dessa joner binds till varandra med polära kovalenta bindningar. De sammansatta jonerna kan därmed sägas vara elektriskt laddade molekyler. En sammansatt jon är laddad därför att den innehåller olika antal protoner och elektroner. För att belysa detta tittar vi närmare på en negativ och en positiv sammansatt jon.
Nitratjonen NO3 -
I bilden nedan visas nitratjonens elektronformel. Det framgår att såväl kväveatomen som syreatomerna omges av åtta valenselektroner (de har ädelgasstruktur) och att de fyra atomerna har 24 elektroner tillsammans. Syre tillhör grupp 16 i det periodiska systemet medan kväve tillhör grupp 15. Oladdade kväveatomer har alltså fem valenselektroner medan oladdade syreatomer har sex valenselektroner. Därmed skulle en oladdad förening av en kväveatom och tre syreatomer ha fem plus tre gånger sex valenselektroner, dvs. 23 valenselektroner, men jonen har 24 för att få ädelgasstruktur. Det är överskottet på en elektron som orsakar nitratjonens laddning (1–).

Nitratjon. Klammern markerar att laddningen gäller hela jonen.
Ammoniumjonen NH 4 +
En kväveatom har fem valenselektroner. Endast tre av dessa ingår i bindningar till väteatomer i en ammoniakmolekyl (NH3). Två av valenselektronerna är alltså fria. Dessa har markerats med punkter i formeln för ammoniak i bilden nedan.
Ammoniakmolekylen är en dipol (se sidan 105). Därmed har den en negativt laddad sida som kan attrahera t.ex. en positivt laddad vätejon (H+), dvs. en proton. När detta sker binds vätejonen till ammoniakmolekylen med hjälp av kväveatomens fria elektroner. Därmed uppstår en polär kovalent bindning mellan kväveatomen och det tillkommande vätet. Denna bindning är speciell genom att båda elektronerna i bindningen härstammar från endast en av de förenade atomerna.
När ammoniakmolekylen upptar en proton (H+) under bildning av en ammoniumjon får denna laddningen +1.

Vätejon
Ammoniakmolekyl
En ammoniakmolekyl upptar en vätejon, dvs. en proton, under bildning av en positivt laddad ammoniumjon.
Ammoniumjon
1 mono
2 di

3 tri
4 tetra
5 penta
6 hexa
7 hepta
8 okta
9 nona
10 deka
Grekiska räkneord.
Namn på kemiska föreningar
Vid formelskrivning och namngivning av oorganiska föreningar kan nedanstående regler följas. (Namngivning av organiska ämnen behandlas i kapitel 6.)
1. Formeln och namnet på en jonförening som består av två jonslag inleds med den positivt laddade jonen. Består en förening av en metall och en ickemetall skrivs metallen först. Består en förening av två ickemetaller kommer det grundämne som står först i följande uppräkning främst (i princip kommer det minst elektronegativa ämnet först):
B, Si, C, P, N, H, S, I, Br, Cl, O, F
2. När en kemisk förening består av endast två grundämnen läggs ändelsen id till ämnet som står sist. Jonföreningar som innehåller sammansatta joner har ofta ändelserna id, at eller it (se tabellen på sidan 86).
3. Olika kemiska föreningar kan bestå av samma grundämnen (t.ex. CO och CO2). Därför måste deras namn berätta hur många atomer av varje sort som finns i föreningarna. Till detta används grekiska räkneord.
I ämnenas namn uttalas räkneorden framför de atomslag de gäller. I ämnenas kemiska formel däremot, skrivs räkneordens motsvarande siffra efter de atomslag de gäller. Som exempel kan nämnas att CO heter kolmonoxid (mono = 1) och CO2 heter koldioxid (di = 2). Namnen berättar att molekylerna innehåller en respektive två syreatomer. Ofta utesluts räkneordet mono. Det heter t.ex. inte monokoldioxid, även om detta hade varit en korrekt benämning på CO2.
I namn på jonföreningar med ämnen från huvudgrupperna eller sammansatta joner behövs oftast inte de grekiska räkneorden eftersom jonladdningarna avslöjar förhållandet mellan de ingående jonslagen. Ingår däremot övergångsmetaller behövs räkneorden mestadels.
Utöver de namn som följer regelverket förekommer trivialnamn (t.ex. vatten och ammoniak) som inte säger något om den kemiska sammansättningen. Det är tillåtet att använda trivialnamn om det inte finns risk för missuppfattningar.
Molekylföreningar
CO kolmonoxid
CO2 koldioxid
H2O diväteoxid
CCl4 koltetraklorid
NO kvävemonoxid
N2O dikväveoxid
NO2 kvävedioxid
Några molekyl- och jonföreningars formler och namn.

N2O5 dikvävepentaoxid
P4O10 tetrafosfordekaoxid
Jonföreningar
NaCl natriumklorid
Al2O3 aluminiumoxid
Jonföreningar med sammansatta joner
CaCO3 kalciumkarbonat
Al(OH)3 aluminiumhydroxid
Na2SO4 natriumsulfat
NH4NO3 ammoniumnitrat
”Byggstenarna” i ett fast ämne (t.ex. jonerna i en saltkristall) hålls på plats av kemiska bindningar. Värmerörelserna är begränsade till vibrationer kring de bestämda platserna.
Bindningar mellan molekyler
Ett ämnes ”byggstenar”, t.ex. joner eller molekyler, har så kallad värmerörelse. Ju varmare ett material är desto snabbare rör sig dess byggstenar. Är värmerörelsen långsam hålls byggstenarna väl samlade av kemiska bindningar och ämnet kan då bilda fasta kristaller. I en kristall är varje byggsten bunden till en viss plats och byggstenens värmerörelse är begränsad till vibrationer kring de bestämda platserna.
Om ett fast material värms ökar rörelsen hos dess byggstenar. Därmed minskar sammanhållningen mellan byggstenarna som kan börja glida omkring och byta plats med varandra. Det är vad som händer då ett fast material övergår till vätska. Består materialet av ett rent ämne smälter detta vid en bestämd temperatur som vi kallar ämnets smältpunkt. Är de kemiska bindningarna mellan ämnets byggstenar starka, krävs hög temperatur innan dessa frigörs från varandra. Starka bindningar medför alltså hög smältpunkt.
Även i vätskor är partiklarnas rörlighet begränsad. Först i gasform är värmerörelsen så stor att attraktionskrafterna mellan ämnets byggstenar kan försummas. Det krävs naturligtvis mest värme för att förånga de vätskor vars byggstenar har störst attraktionskraft på varandra. Även kokpunkt är ett mått på hur starkt beståndsdelarna i ett ämne binds till varandra.
Jonbindning är stark kemisk bindning och därför har jonföreningar höga smält och kokpunkter. Som exempel kan nämnas att natiumklorid har smältpunkten 801 °C och kokpunkten 1 473 °C.
Diamant och grafit består av kolatomer som är förenade med kovalenta bindningar i väldigt stora molekyler. Även kovalent bindning är stark. Det framgår av att såväl diamant som grafit har en smältpunkt på ca 3 600 °C och en kokpunkt på ca 4 800 °C.
Flertalet ämnen som består av molekyler har dock låga smält och kokpunkter. Det beror på att molekylerna utgör ”fristående byggstenar” i dessa ämnen och att bindningarna mellan molekylerna är svagare än jonbindning och kovalent bindning. I beskrivningen av vattnets egenskaper på sidorna 112 – 114 kommenteras dipoldipolbindning och vätebindning. Det är två av bindningstyperna som förekommer mellan molekyler. En tredje typ är van der Waalsbindning. Låt oss nu titta lite närmare på dessa tre intermolekylära (latin inter = mellan) bindningstyper.
Modell av avdunstning från en vätska (t.ex. vatten). De molekyler som har störst värme rörelse kan lämna vätskan och bilda en gas över vätskeytan. Vätskans temperatur sjunker i samband med avdunstningen. Det beror på att det är molekylerna med störst värmerörelse (de mest energirika molekylerna) som lämnar vätskan.
4.22 Hur påverkas ett ämnes kokpunkt av de intermolekylära bindningarnas styrka?
Kokpunkt (°C)
NO –152
O2 –183

Dipol-dipolbindning
Vi har konstaterat att en molekyl som består av minst två olika grundämnen och som är osymmetriskt byggd är en dipol (sidorna 104–108). Vatten H2O, väteklorid HCl och kvävemonoxid NO är alltså exempel på dipolmolekyler.
Vi har också nämnt att dipolmolekyler gärna orienterar sig så att närliggande molekyler vänder sina olikladdade sidor mot varandra (se bild på sidan 101). Då uppstår s.k. dipoldipolbindning mellan molekylerna eftersom de olika laddningarna attraherar varandra.
I tabellen till vänster visas kokpunkterna för kvävemonoxid NO, syrgas O2 och kvävgas N2. Både syrgas och kvävgas har lägre kokpunkt än kvävemonoxid. Det beror på att syrgas och kvävgasmolekyler är ickedipoler och därför saknar dipoldipolbindning, medan kvävmonoxid är en dipol.
Kvävemonoxid NO är en dipol och har högre kokpunkt än syre O2 och kväve N2
Kokpunkt (°C)

He–269
Ne–246
Ar –186
Kr –153
Xe –108
Rn –62
N2 –196 Ädelgasernas kokpunkter.
Att vi använder det långa ordet dipoldipolbindning beror på att dipolmolekyler inte bara attraherar varandra utan även joner. Vi ska alltså kunna skilja på dipoldipolbindning och jondipolbindning. På sidan 249 visas hur vattenmolekyler binds till joner genom jondipolbindning.
Van der Waalsbindning
Molekylföreningar som är ickedipoler (t.ex. metan CH4, klor Cl2, kväve N2 och syre O2) förekommer också som vätskor eller i fast form om temperaturen är tillräckligt låg. Det finns alltså någon form av sammanhållande kraft (om än svag) som också verkar mellan molekylerna i dessa ämnen. Denna attraktionskraft är den så kallade van der Waalsbindningen Låt oss titta närmare på klormolekyler för att se hur van der Waalsbindning uppstår. Följande text är kopplad till bilden mitt på nästa sida. Där visas klormolekyler vars elektronmoln har markerats med grön färg. I klormolekylen under 1B är elektronerna jämnt fördelade i molnet. Eftersom elektronerna är i rörelse inom ett elektronmoln kan de vid ett visst tillfälle vara fler på en av molekylens sidor än på den andra. Då är laddningsfördelningen i molekylen ojämn. Detta tillstånd råder hos klormolekylen under 1A. Medan denna ojämna laddningsfördelning varar, hinner molekylen påverka sina grannar. Bland annat repelleras elektroner i molekylgrannen närmast den negativt laddade sidan. På så sätt blir även molekylgrannen en tillfällig dipol, varpå molekylerna kan attrahera varandra som under 2A och 2B. Det är denna attraktion som utgör van der Waalsbindningen. Den är svagare än dipoldipolbindning mellan permanenta dipolmolekyler.
Van der Waalsbindning hos ädelgaser Ädelgaser förekommer som enskilda atomer. Även hos dessa varierar laddningsfördelningen och ger upphov till van der Waalsbindning. Variationerna uppstår lättare i stora elektronmoln än i små. Van der Waalsbindningen blir därför mer uttalad ju större atomerna är och därför ökar kokpunkten med atomnumret inom gruppen ädelgaser (se tabellen till vänster).
Van der Waalsbindning i t.ex. motorolja
I stora molekyler finns många elektroner och därmed stor chans till ojämn elektronfördelning. Stora molekyler har dessutom större ”kontaktytor” mellan varandra än vad små molekyler har, vilket leder till fler interaktioner. Detta förklarar varför van der Waalsbindningens styrka (och därmed kokpunkten) ökar med molekylstorleken hos de organiska ämnena i tabellen till höger.
Motorolja består av kolväten, precis som ämnena i tabellen. Kolvätena i motorolja har dock längre molekyler (fler kolatomer) och kokar därför vid högre temperaturer än tabellens ämnen. Genom att variera storleken på molekylerna i motoroljan kan van der Waalsbindningarnas styrka anpassas så att oljan är lagom trögflytande inom det temperaturintervall där den ska användas.

Van der Waalsbindningar




Denna molekyl är tillfälligt polariserad på grund av att många elektroner råkar befinna sig långt till höger.
Denna molekyl är ännu inte polariserad, men dess elektroner repelleras av molekylen till vänster.




Den vänstra molekylen ovan har påverkat den högra som också blivit polariserad. Detta ger upphov till van der Waalsbindning (den röda pilen).
Van der Waalsbindning mellan tillfälligt polariserade klormolekyler Cl2

Namn Kokpunkt (°C)
metan –162
etan –89
propan –42
butan 0
pentan 36
Kokpunkt hos några organiska ämnen som består av enbart kol och väte.


En spis av metall och gasen butan (C4H10) som brinner.
4.23 Vilka olika intermolekylära bindningar finns det?
Vätebindning
Både vatten H2O och divätesulfid (svavelväte) H2S består av dipolmolekyler. Trots detta är vattnets kokpunkt 100 °C och divätesulfidens kokpunkt –61 °C. Skillnaden i kokpunkt beror på att attraktionskraften mellan vattenmolekylerna är extra stark dipoldipolbindning, så kallad vätebindning, medan det bara förekommer vanlig, svagare, dipoldipolbindning i divätesulfid. Vätebindning är den starkaste intermolekylära bindningsformen.
Följande tre faktorer medverkar till att vätebindningar finns:
• Den starka dipolverkan som uppstår då väte binds till något av de tre mest elektronegativa atomslagen, nämligen kväve N, syre O eller fluor F.
• Fria par av valenselektroner på andra kväve, syre eller fluoratomer som kan attrahera den positiva laddningen hos väteatomer i förening med kväve, syre eller fluor.
• Att väteatomer är små och kan komma ”nära” andra atomer.
Vattnets höga kokpunkt
4.24 Varför har vatten så hög kokpunkt?
Bilden nedan visar vätebindningar i ammoniak NH3, vätefluorid HF och vatten H2O. Kväveatomen i ammoniak har bara ett fritt elektronpar, vilket begränsar antalet vätebindningar mellan molekylerna. I vätefluorid begränsas antalet vätebindningar av att molekylerna innehåller endast en väteatom. En vattenmolekyl däremot har två väteatomer och på dess syreatom finns två fria elektronpar. Därmed kan väteatomerna och de fria elektronparen utnyttjas maximalt till vätebindningar. Det förklarar varför vatten har en mycket hög kokpunkt i förhållande till sin molekylstorlek. (Kokpunkten är för ammoniak –33 °C och för vätefluorid 20 °C.)

Fritt elektronpar
Vätebindningar i ammoniak, vätefluorid och vatten.
Löslighet i vatten
Molekylerna i heptan (som bl.a. ingår i bensin) består av endast kol och väte och är dessutom symmetriska (se bilden nedan). Därmed kan det inte bildas vätebindningar mellan bensinens molekyler och vatten, vilket bidrar till att bensin inte löser sig i vatten. Molekylerna i ”vanlig alkohol” (etanol) innehåller däremot en syreatom som binder en väteatom och bildar en så kallad OHgrupp. Detta gör molekylen osymmetrisk vilket resulterar i en dipol som kan binda till vatten med vätebindningar. Etanolen blir löslig i vatten, lika löser lika. Innehåller alkoholen fler än fem kol påverkar OHgruppen inte symmetrin lika mycket utan alkoholen blir en ickedipol och olöslig i vatten.

Heptan (ingår i bensin)
Ylle absorberar vatten
Etanol (”vanlig alkohol”)
Vätebindningar bidrar till att vissa textilfibrer har extra god förmåga att absorbera vatten. Molekylerna i t.ex. ylle (som består av proteinmolekyler) innehåller rikligt med syre och kväveatomer som kan binda vatten (t.ex. fukt från kroppen) genom vätebindningar. Därför känns ylleplagg sällan fuktiga mot huden. Vissa konstfibrer som t.ex. polyeten kan däremot inte bilda vätebindningar och kan därför upplevas som fuktiga.


Bensin är en blandning av heptan och andra liknande ämnen. Dessa är olösliga i vatten. Alkoholen etanol kan däremot lösas i vatten tack vare sin OH-grupp.
4.25 Hur kommer det sig att ullmaterial är bra på att absorbera vatten?
Yllekläder är lämpliga i kallt klimat. De har god förmåga att isolera mot kyla och kan tack vare vätebindningar absorbera fukt från kroppen.
4.26 Förklara uppbyggnaden av en metallbindning.
Metallbindning
Metaller leder elektrisk ström och är ofta hårda, hållfasta och formbara. En smed kan hamra järn till olika former och vissa metaller valsas till tunna plåtar eller dras ut till långa vajrar. Detta är möjligt tack vare den bindningsform som förenar metallatomer och som kallas metallbindning
Bilden nedan till vänster visar hur metallbindning uppstår. I den fasta metallen är atomerna ordnade i ett regelbundet mönster och därför benämns en bit fast metall ibland som ”metallkristall” (inte att förväxla med saltkristall hos jonföreningar). Alla atomerna omges av ett gemensamt elektronmoln till vilket varje atom har bidragit med en eller flera valenselektroner (antalet är olika för olika metaller). Dessa obundna elektroner, s.k. delokaliserade elektroner tillhör inte någon speciell atom utan rör sig fritt mellan alla atomerna i metallen. Eftersom atomerna har lämnat elektroner till det gemensamma elektronmolnet, kan de ses som positivt laddade partiklar omgivna av negativ laddning. Det är den gemensamma negativa laddningen från de delokaliserade elektronerna (elektronmolnet) som svarar för sammanhållningen i metallen, dvs. för metallbindningen.
Flertalet metaller har hög smältpunkt, vilket tyder på att metallbindning är stark kemisk bindning. Metallbindningens styrka påverkas av bl.a. hur många elektroner varje atom lämnar till det gemensamma elektronmolnet. I t.ex. magnesium (grupp 2) bidrar varje atom med två valenselektroner och i natrium (grupp 1) bidrar varje atom med en valenselektron. Magnesium har därför starkare metallbindning än natrium, vilket återspeglas i magnesiummetallens högre smältpunkt.
Det är förekomsten av obundna elektroner som gör att metaller är goda ledare för elektrisk ström. Elektrisk ström är laddningar i rörelse och när en metall leder ström är det just elektroner som förflyttar sig.
I en metallkristall (i ett stycke fast metall) omges atomerna (grå) av ett gemensamt elektronmoln (grönt).
I en metall kan olika atomskikt glida längs varandra utan att metallen spricker. Metallen är böj- och formbar.




Metallers hållfasthet
Metallbindning är inte riktad mellan speciella atomer. Därför kan ett hårt tryck eller slag mot en metall förskjuta olika atomlager i förhållande till varandra utan att metallen brister (se bilden nere till höger på föregående sida). Detta gör att metaller är mer eller mindre böj och formbara. Som en jämförelse kan du studera den vänstra bilden nedan som visar hur en saltkristall påverkas av tryck och slag. Saltkristallen spricker eftersom jonlagren inte kan förskjutas utan att joner med lika laddningar kommer nära varandra och därmed repellerar varandra.
Ofta är legeringar (blandningar av metaller) hårdare och mindre formbara än de ingående metallerna var för sig. Anledningen till detta framgår av den högra bilden nedan. Där visas koppar (röda atomer) med inblandning av tenn (grå atomer). I denna legering (som kallas brons) ligger atomerna oregelbundet därför att de har olika storlek. Därmed är det svårt att få olika atomskikt att glida längs varandra.
Här formas järn. Metaller är mer eller mindre böjoch formbara. 1 2 3
4.27 Varför är metaller formbara?
Saltkristaller är ofta spröda och spricker om vi slår på dem. Det beror på att en förskjutning i en saltkristall får joner med lika laddningar att hamna mitt för varandra, varpå jonbindningar bryts.
Brons är en legering av koppar (röda atomer) och tenn (grå atomer). I legeringen kan inte skikt av metallatomer glida längs varandra på samma sätt som i en ren metall. Brons är hårdare än koppar och tenn var för sig.

Malmtransporten i Kirunagruvan sker med fjärrstyrda tåg.
Järnframställning
Kemiska föreningar och fria grundämnen som ingår i den fasta jordskorpans bergarter kallas gemensamt för mineral. De viktigaste mineralen för järnframställning är hematit Fe2O3 som bildar blodstensmalm och magnetit Fe3O4 som bildar svartmalm. Ordet malm används om sådana bergarter som bryts för utvinning av metaller. Sveriges största järnfyndigheter finns i Lappland och i det mellansvenska gruvdistrikt som kallas Bergslagen. Bilden på nästa sida visar hur de brytvärda malmkropparna troligen bildats.
Från järnmalm till råjärn
Järnmalmen som bryts i en gruva innehåller inte enbart det järnhaltiga mineralet. Därför måste detta anrikas (koncentreras). Det sker på olika sätt. Magnetit, som är magnetiskt, kan t.ex. urskiljas från krossat berg med hjälp av stora magneter.
Syret som ingår i järnoxiden, dvs. i magnetiten
eller i hematiten, tas bort i en masugn. Järnmineralet tillsätts överst i ugnen tillsammans med kalksten och kol. Kalkstenen bidrar till att samla oönskade ämnen (slaggprodukter). Kolet förbränns och ger värme. I en masugn kan det bli ca 2 000 grader varmt. Kolet har även till uppgift att reagera med syret i järnoxiden under bildning av koldioxid. När gasen koldioxid lämnat smältan återstår råjärn
Råjärn blir stål
Råjärn är lämpligt som gjutjärn eftersom det utvidgar sig när det stelnar och fyller därmed ut gjutformarna ordentligt.
R åjärn innehåller 3 – 4 % kol och spricker därför lätt vid försök att smida det. Att råjärnet är mindre formbart än rent järn beror på att kolatomerna skapar oordning bland järnatomerna så att atomskikten får svårt att glida längs varandra. (Motsvarande gäller för legeringar. Se sidan 117.)
UTBLICK
Minst hälften av råjärnets kol måste avlägsnas för att metallen ska kunna smidas och valsas.
Kolmängden kan minskas genom att blåsa in syrgas i en ugn med smält råjärn. Då reagerar kolet med syret under bildning av koldioxid.
Kolfattigt järn (med endast 0,05 – 1,5 % kol) kallas stål (eller kolstål). Är kolhalten lägre än 0,05 % kallas produkten järn. Stål är hårdare än rent järn på grund av sitt inslag av kol.
Egenskaperna hos stål kan varieras genom att legera det med andra metaller. Vissa legeringar kan t.ex. motstå korrosion (rostangrepp). Ett vanligt rostfritt stål innehåller 18 % krom och 8 % nickel.
Järnhaltig mineral






En masugn är ofta 15 – 20 meter hög.

Många av Bergslagens malmkroppar bildades för ca två miljarder år sedan. Då var stora delar av Sveriges yta täckta av hav och här rådde vulkanisk aktivitet. På bilden ser vi hur havsvatten trängde ner i sprickor i berggrunden under havet. Vattnet värmdes kraftigt då det närmade sig vulkanernas magmahärdar och kunde då lösa t.ex. järnhaltiga mineraler ur berggrunden. Där vattnet åter strömmade ut ur berggrunden kyldes det, varpå mineralerna fälldes ut (blev fasta kristaller). På så sätt bildades med tiden malmkroppar på dessa ställen.










Varm luft
Råjärn
Slaggprodukter
Varm luft
Kol Kalksten
Magma
Malmkropp Havsvatten
SAMMANFATTNING
Kapitel 4
• Laddade atomer och atomgrupper kallas joner
• Ett salt består av joner som är förenade genom jonbindning. Joner med stor laddning och liten radie bildar extra starka jonbindningar.
• Formeln för ett salt avslöjar förhållandet mellan ingående jonslag. I t.ex. magnesiumklorid MgCl2 finns det dubbelt så många kloridjoner som magnesiumjoner.
• Smält salt och vattenlösningar av salter leder elektrisk ström.
• Följande grundämnen förekommer som tvåatomiga molekyler: H2, F2, Cl2, Br2, I2, O2, N2.
• En kolatom har fyra valenselektroner och därför utgår som regel fyra kovalenta bindningar från varje kolatom i en molekyl. Detta är fallet i diamant och i organiska molekyler.
• Den kovalenta bindning som finns mellan atomer av samma sort kallas opolär kovalent, medan den mellan olika sorters atomer är så kallad polär kovalent bindning.
• En ickedipol är en molekyl som hålls samman av polära kovalenta bindningar, men där molekylen är symmetrisk t.ex. metan, CH4.
• Vattenmolekylen är en dipol. Det beror på att syre och väte har olika elektronegativitet samt att vattenmolekylen är osymmetrisk.
• Dipolmolekyler binds till varandra genom dipol-dipolbindning. I bl.a. vatten förekommer extra stark dipoldipolbindning som kallas vätebindning. Denna bidrar bl.a. till vattnets ytspänning och till ämnets jämförelsevis höga kokpunkt. Vätebindning är den starkaste intermolekylära bindningsformen.
• Den svagaste intermolekylära bindningsformen kallas van der Waalsbindning. Den uppstår då atomer eller molekyler blir tillfälliga dipoler till följd av svängningar i deras elektronmoln.


• När en jonförening namnges sätts den positiva delen först. Är den negativa delen en atomjon slutar dess namn oftast på -id, medan de sammansatta jonerna har särskilda namn. Ingår övergångsmetaller, som kan variera i jonladdning, måste detta oftast anges med t.ex. de grekiska räkneorden. För molekylföreningar används de grekiska räkneorden för att tydligt tala om hur många atomer som ingår i föreningen.
• I en metall bidrar alla atomer med valenselektroner till ett gemensamt elektronmoln som håller samman metallen, s.k. metallbindning.
• En legering är normalt hårdare och mindre formbar än de ingående metallerna var för sig.
Förklaras på sidan
4.28 Skriv namn och kemisk formel för de jonslag som ingår i (E/C/0)
a) natriumklorid
b) kaliumbromid
c) kalciumklorid
d) magnesiumnitrid
e) aluminiumoxid
4.29 Skriv namn och kemisk formel för de jonslag som ingår i (0/C/A)
a) NaOH b) CaCO3
c) CuSO4 d) NH4Cl
e) Fe2O3
4.30 Namnge följande salter. (E/0/0)
a) NaF b) MgO
c) KOH d) Al2(SO4)3
e) NaNO2
4.31 Skriv formler för följande salter. (E/C/0)
a) kaliumbromid
b) aluminiumbromid
c) bariumsulfid
d) kalciumfluorid
e) magnesiumnitrid
f) ammoniumsulfat
4.32 Namnge nedanstående föreningar så att de inte kan förväxlas med någon annan förening. (E/C/A)
a) MnO2 b) Cr2O3
c) Cu2O d) Fe2(SO4)3
e) SnCl4 f) KCr(SO4)2
4.33 Skriv kemisk formel för följande föreningar. (E/C/0)
a) kvävedioxid b) kromtrioxid
c) kopparsulfat d) järndinitrat
4.34 Formlerna för ämnena Na2O och N2O liknar varandra. Vilket av följande alternativ är sant när du ska använda deras namn om du talar med någon som kan kemi? Motivera! (E/0/A)
a) Det räcker att säga de korta namnen natriumoxid och kväveoxid.
b) Jag behöver säga de mer fullständiga namnen dinatriumoxid och dikväveoxid.
c) Jag behöver säga det mer fullständiga namnet dinatriumoxid, medan det räcker att säga det kortare namnet kväveoxid.
d) Det räcker att säga det korta namnet natriumoxid, medan jag behöver säga det mer fullständiga namnet dikväveoxid.
e) Jag kan säga vilket jag vill, antingen de korta namnen natriumoxid och kväveoxid eller de mer fullständiga namnen dinatriumoxid och dikväveoxid.
4.35 Linus läser i Syntes Kemi 1 att natriumjoner och kloridjoner ingår i saltet natriumklorid. Han säger till Bengt ”Natrium och klor kan reagera, eftersom natrium vill ge bort en elektron och klor vill ta upp en elektron”. Bengt svarar att ”Magnesium och syre kan reagera, eftersom magnesium vill ge bort två elektroner och syre vill ta upp två elektroner”. Sedan undrar Linus ”Kan natrium och syre reagera? Natrium vill ju bara ge bort en elektron, medan syre vill ta upp två!”
Kan det bli någon reaktion mellan natrium och syre? I så fall, vad blir ämnets kemiska formel? (E/C/0)

4.36 När en elkabel dras över havsvatten, t.ex. för att få ström till en ö, kan det göras på två sätt. Antingen dras en kabel som innehåller två ledningar, så att det alltid finns plus och minus i ledningen, eller så dras en kabel som bara innehåller en kopparledning och vattnet utgör den andra ledningen, eftersom havsvatten leder ström. Figuren nedan visar hur det kan se ut. (E/C/A)

I kopparledningen är det elektroner som leder strömmen. Skissen nedan visar hur det fungerar i punkt 1 i figuren ovan.













Elektroner som kommer in från vänster påverkar det gemensamma elektronmolnet hos kopparn i ledningen och elektronerna där flyttar sig då åt höger, så att lika många elektroner kommer ut på högra sidan som det kom in elektroner på vänstra sidan.
Men hur leds strömmen i punkt 2 i bilden? Precis som du just sett för ledningen ovan, ska du rita en bild och förklara den!
4.37 Kim har ett ämne i form av ett vitt pulver och undrar om det finns något experiment som kan visa om det innehåller en jonförening. (E/0/A)
a) Föreslå ett enkelt experiment som undersöker om Kims ämne innehåller en jonförening.
b) Vilket resultat får du i ditt experiment om det är en jonförening i Kims ämne?
4.38 Vilka grundämnen förekommer i naturen som tvåatomära molekyler? (E/0/0)
4.39 Vätgas, H2 och kvävgas, N2 är båda molekyler som hålls ihop med kovalenta bindningar. (E/C/0)
a) Vad skiljer uppbyggnaden åt?
b) Vilken är minst reaktiv och varför?
4.40 Vätgas, H2, och väteklorid, HCl, är två små molekyler. (E/C/0)
a) Jämför dem vad gäller intramolekylära bindningar. Rita gärna.
b) Jämför dem vad gäller intermolekylära bindningar. Rita gärna.
c) Vilken tror du har lägst kokpunkt och varför?
4.41 Det finns ett ämne som heter koltetraklorid och som har formeln CCl4 (alla kloratomerna binder till kolatomen). (E/C/0)
a) Rita en elektronformel för koltetraklorid.
b) Rita en strukturformel för koltetraklorid.
c) Vilken tredimensionell form har en koltetrakloridmolekyl?
d) Vilken typ av kemisk bindning finns mellan atomerna i koltetraklorid?
e) Är koltetrakloridmolekylen en dipol?
Motivera svaret.
f) Koltetraklorid är en vätska vid rumstemperatur. Beskriv ett experiment som skulle kunna visa om koltetraklorid
är en dipol eller inte.
4.42 Germaniumtetrahydrid, GeH4 , är en av de mest användbara föreningarna med germanium. Den används vid tillverkning av elektronik. Det är en färglös, mycket giftig och brandfarlig gas.
Utgå från ovanstående information, periodiska systemet, din kunskap om andra ämnen och det som står i kapitlet för att svara på frågorna. (E/C/A)
a) Är germaniumtetrahydrid en molekylförening eller en jonförening?
b) Vilka intramolekylära bindningar finns det i germaniumtetrahydrid?
c) Vad är det som gör att germaniumtetrahydrid är en gas vid rumstemperatur?
4.43 Varför har metallen kalium lägre smältpunkt än metallen kalcium? (0/C/0)
4.44 Många saker är gjorda av järn eller stål. Vad materialet kallas beror på halten av kol. På en hemsida läser Miriam att om kolhalten är mindre än 0,5 % kallas det för järn, om kolhalten är mellan 0,5 % och 2 % kallas det stål och om kolhalten är större än 2 % kallas det gjutjärn eller ibland tackjärn. Dessutom läser Miriam att järn är mjukt, stål är hårdare och bra att smida och att gjutjärn och tackjärn är hårt, men också sprött, dvs. att det lättare kan spricka. Därför kan inte gjutjärn och tackjärn smidas.
a) Hjälp Miriam att avgöra om det är rimligt att halten kol kan påverka hårdheten, sprödheten och smidbarheten på det sätt som står på hemsidan. Använd ett kemiskt resonemang till detta! (E/C/A)
b) Järn och stål kan också rosta. Miriam läser vidare att det först brukar bildas rödrost som till stor del består av Fe2O3. Så småningom bildas hydroxider som t.ex. FeOOH om det finns tillräckligt med vatten. ”Rost har verkligen inte samma hållfasthet som järn eller stål!”, tänker Miriam, ”Det är mycket sprödare, men varför då?”.
Ge en förklaring med hjälp av kemiska bindningar till varför rost är sprödare än järn och stål! (0/C/0)
c) Ett sätt att skydda mot rost är att måla stålet med en skyddande färg. Då kan det också bli snyggt. Ett annat sätt att göra stålet snyggt skulle kunna vara att täcka det med färgat tyg, tänker Miriam. ”Men hjälper det mot rost också?”, funderar hon.
Svara på Miriams fråga om stål kan skyddas mot rost genom att täckas med tyg. Motivera med ett kemiskt resonemang! (E/C/A)
kemi 1 SYNTES
Syntes kemi 1 är ett läromedel för gymnasieämnet Kemi nivå 1 (100 p).
I denna fjärde upplaga har innehållet genomgått en översyn och den löpande texten har försetts med kortfattade ”marginalfrågor ” med fokus på begrepp och viktig fakta. Övningsuppgifterna i slutet av varje k apitel är omarbetade och har kompletterats med fullständiga lösningar. Dessutom finns på utvalda ställen QR-koder kopplade till simuleringar av moment som kan behöva extra illustrationer som stöd för inlärningen.
Innehållet behandlar
• det naturvetensk apliga arbetssättet
• kemin i ett idéhistoriskt perspektiv
• det periodisk a systemet
• hur kemisk bindning präglar ämnens egensk aper
• hur reaktionsformler skrivs och kemiska beräkningar utförs
• syror och baser
• oxidation och reduktion
• analytisk kemi



Författare till Syntes kemi 1 är Anders Henriksson,
Annika Johansson och Erik Zetterberg. Alla tre har mångårig erfarenhet av undervisning i kemi på gymnasienivå.
