UMC Utrecht Hersencentrum Nederlandstalige editie | mei 2018 | NewScientist.nl
TOPWETENSCHAP VOOR EEN BETERE BEHANDELING
een uitgave van
Samen investeren in de toekomst Bij het zoeken naar slimme en duurzame oplossingen voor maatschappelijke vraagstukken vervult de wetenschap een sleutelrol. De Universiteit Utrecht en het UMC Utrecht leveren via de strategische onderzoeksthema’s Kind- en Jeugdontwikkeling en Life Sciences een belangrijke bijdrage aan concrete vraagstukken over opvoeding en gezondheid. We willen onze impact vergroten door deze vraagstukken aan te pakken vanuit verschillende wetenschappelijke disciplines, in samenwerking met maatschappelijke partners, patiënten, ouders en kinderen.
www.uu.nl/jeugd “Utrecht heeft een unieke plek binnen het hersen- en taalonderzoek in Nederland. Samen kunnen we ontrafelen hoe het jonge brein zich ontwikkelt en ontdekken wat er misgaat bij ontwikkelingsstoornissen.” Prof. dr. Jeroen Pasterkamp, hoofdonderzoeker van het thema De 1001 eerste cruciale dagen in het leven van een kind
www.uu.nl/lifesciences “Utrecht is koploper in het ontwikkelen van van miniatuur organen uit menselijk weefsel, oftewel organoïden. Deze modellen geven ons beter inzicht in de behandeling van ernstige aandoeningen en bieden unieke kansen voor het ontwikkelen van nieuwe geneesmiddelen.” Prof. dr. Madelon Maurice, trekker van het Utrecht Platform voor Organoïden onderzoek
vooraf Special ht UMC Utrec rum t n Hersence
Meer informatie over het UMC Utrecht Hersencentrum vind je op www.umcutrecht.nl/hersencentrum
Focus op het brein
Jeroen Pasterkamp
Frank Miedema
Voorzitter UMC Utrecht Hersencentrum
Lid Raad van bestuur UMC Utrecht
In het UMC Utrecht Hersen centrum is alle kennis en expertise rond zorg, onderwijs en onderzoek op het gebied van hersenen in het UMC Utrecht gebundeld. Alles met als doel: topwetenschap voor een betere behandeling. Wat is daarvoor belangrijk? Samen optrekken met patiënten, zoals bij Project Mine. Maar ook samenwerken, onderling en internationaal. Talent stimuleren. De meest geavanceerde technologieën gebruiken, zoals zichtbaar wordt in het werken met beeldvorming en brain organoids. Meer voorbeelden? Daarover leest u meer in deze special.
Het Hersencentrum vormt een van de speerpunten van het UMC Utrecht. Dat betekent een jarenlange focus en investering op dit vlak. Het is breed, van psychiatrie en neurologie tot translationele neurowe tenschappen. Het Hersen centrum wordt hierin omringd door waardevolle partnerinstellingen op het Utrecht Science Park. Juist door vanuit die breedte samen te werken, levert dat een toegevoegde waarde voor de patiënt, voor het onderzoek en voor de maatschappij. Deze special staat vol met prachtige voorbeelden daarvan.
In de reguliere edities van New Scientist schrijven we over de meest uiteenlopende vakgebieden en onderwerpen: van natuurkunde via de quantumcomputer en DNA naar robotisering. In deze special, die tot stand is gekomen in samenwerking met het UMC Utrecht, hebben we een focus: het brein. En soms is dat prettig, omdat we op deze manier in staat zijn de diepte in te gaan. In Utrecht wordt baanbrekend breinonderzoek gedaan en een keur aan wetenschappers komt aan het woord om te vertellen hoe hun ideeën de wereld veranderen. Lees het verhaal over brain organoids, de levende mini-breintjes van menselijke cellen. Met collega Marleen Hoebe bezocht ik Manon Benders, hoogleraar neonatale neurologie in het Wilhelmina Kinderziekenhuis, de expert op dit gebied. Het onderzoek dat zij doet met vroeggeboren kinderen is fascinerend en kan in de toekomst de levens van kwetsbare kinderen veranderen. Ik wens u veel leesplezier. Jim Jansen
hoofdredacteur jim@newscientist.nl @jimfjansen (Twitter)
Volg ons ook op Twitter twitter.com/ U_Hersencentrum
Twitter twitter.com/ U_BCRM (engelstalig)
Facebook facebook.com/ umcutrechthersencentrum UMC Utrecht Hersencentrum | New Scientist | 3
inhoud
26
08
Interview 08 Ludo van der Pol Eindelijk is er een medicijin voor kinderen met spinale spieratrofie. Genezing betekent dat niet, wel een leven dat een stuk aangenamer is. Neuroloog Ludo van der Pol over zijn werk en zijn patiënten.
Reportage 26 Brain organoids Levende mini-breintjes van menselijke cellen bieden een kans om meer te weten te komen over aandoeningen als alzheimer, ALS en schizofrenie.
20 Manon Benders Neonatoloog Manon Benders doet hersenonderzoek bij baby’s. Doel? Weten hoe vroeggeboren kinderen zich ontwikkelen.
4 | New Scientist | UMC Utrecht Hersencentrum
Feature 14 Gedachtekracht Mensen met een locked-in-syndroom zitten gevangen in hun brein. Onderzoekers ontwikkelen brein-computer interfaces waarmee ze weer kunnen communiceren. 30 Dit doen zij Vier gedreven wetenschappers op zoek naar de beste antwoorden op hun vragen 32 Superscanner Wereldwijd zijn er maar een paar van en het UMC Utrecht heeft er een: een 7 Tesla MRI-scanner. Wat kan er met zo’n superscanner?
18
COLOFON KLANTENSERVICE 088 - 700 2777 of vanuit België: 0031 88 700 2777 voor contact over het lidmaatschap, bestellingen, wijzigingen en vragen. Of mail naar klantenservice@newscientist.nl of kijk op newscientist.nl/faq Nederland Postbus 11249, 3004 EE Rotterdam t.n.v. Veen Media, Utrecht België Postbus 102, 2910 Essen t.n.v. Veen Media, Utrecht Tarieven 11 nummers per jaar, incl. porto Lidmaatschap € 92,85; jongeren € 68,50; Europa € 121,42; buiten Europa € 141,22 Losse nummers € 8,50 (excl. verzendkos ten) Een lidmaatschap wordt tot wederopzegging aangegaan, tenzij anders vermeld.
COVERFOTO: BRAM BELLONI
20 Interview ‘We willen uiteindelijk via hersenscans voorspellen hoe vroeggeboren kinderen zich gaan ontwikkelen’
In beeld 06 Ingezoomd Zacht weefsel in kaart met diffusie-MRI 12 Inzicht Werken aan ALS. 18 Virtueel winkelen Naar de supermarkt gaan kan voor mensen met ALS of een psychose lastig zijn. Ze hebben moeite met drukte. De virtuele supermarkt biedt hulp.
Column 35 Column Zeker, je moet oppassen met big data, vindt Jim van Os, maar je moet er vooral ook de vruchten van plukken.
Hoofdredactie Jim Jansen Redactie Jaap Augustinus (beeldredactie), Emmeke Bos, Yannick Fritschy, George van Hal, Marleen Hoebe, Joris Janssen, Wim de Jong (eindredactie), Aafke Kok Tel +31-(0)88-700 2931 Mail redactie@ newscientist.nl (voor persberichten), info@ newscientist.nl (uitsluitend voor vragen aan redactie), lezersservice@veenmedia.nl (voor vragen en wijzigingen in lidmaatschap) Post Postbus 13288, 3507 LG Utrecht Bezoek Herculesplein 96, 3584 AA Utrecht Aan dit nummer werkten mee Pepijn Barnard, Bram Belloni, Bart Braun, Bob Bronshoff, Marieke Buijs, Monique Kitzen, Maaike Putman, Jolein de Rooij Basisontwerp Sanna Terpstra (Twin Media bv) Vormgeving Miranda de Groot (Twin Media bv) en Pascal Tieman Brandmanager Martine Verheij (martine.verheij@veenmedia.nl) Marketing Milou Snelleman Sales Value Zipper (info@valuezipper.nl +31-(0)20-2105463) Sr. accountmanager B2B Alex Sieval (alex.sieval@veenmedia.nl) Productiemanager Sonja Bon Druk Habo DaCosta bv Distributie Aldipress (NL), AMP (BE) ISSN 2214-7403 De uitgever is niet aansprakelijk voor schade als gevolg van druk- en zetfouten. COPYRIGHT Deze Nederlandstalige New Scientist is een maandelijkse uitgave van Veen Media onder licentie van Reed Business Information Ltd. De inhoud is deels eerder gepubliceerd in de Engelstalige New Scientist © 2018 Reed Business Information Ltd. Alle andere kopij © 2018 Veen Media. Het logo en overige handelsmerken van New Scientist zijn eigendom van Reed Business Information Ltd. Niets uit deze uitgave mag op enigerlei wijze worden overgenomen of in een geautomati seerd gegevensbestand worden opgenomen zonder schriftelijke toestemming van de uitgever. De uitgever heeft ernaar gestreefd de auteursrechten van de illustraties volgens de wettelijke bepalingen te regelen. Zij die menen nog zekere rechten te kunnen doen gelden, kunnen zich wenden tot de uitgever. Deze editie is gemaakt in samenwerking met UMC Utrecht Hersencentrum.
UMC Utrecht Hersencentrum | New Scientist | 5
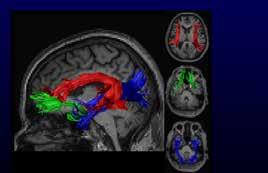
INGEZOOMD
‘We ontwikkelen nieuwe methoden om met diffusie-MRI zacht weefsel, zoals de hersenen, beter in kaart te brengen,’ zegt Alexander Leemans, natuur kundige en werkzaam als universitair hoofddocent bij het UMC Utrecht. ‘Het diffusieproces geeft informatie over de eigenschappen van het onderliggend weefsel en kan onder andere gebruikt worden om ziektes te bestuderen. Enerzijds proberen we met nieuwe MRI opnames het diffusieproces nauwkeuriger te meten, anderzijds kunnen we met onze nieuwe algorit mes de opgenomen diffusie-informatie beter verwerken om zodoende deze weefsels duidelijker te karakteriseren. De langetermijndoelstelling van ons onderzoek is, naast het vroegtijdiger stellen van een diagnose, meer inzicht te krijgen in de oorzaken en het verloop van specifieke ziekten, zodat er nog gerichter behandeld kan worden. Ik doe dit onderzoek in het PROVIDI Lab binnen het UMC Utrecht. Ik ben gezegend met een excellent team van jonge onderzoekers (PhD studenten en postdocs) die dezelfde drive hebben als ik. Maar ik werk hierbij bijna altijd samen met anderen buiten mijn eigen onder zoeksgroep, zowel binnen het UMC Utrecht (andere divisies) als nationaal en internationaal.’
MAAIKE PUTMAN
Beeldvorming
interview Ludo van der Pol
‘Voor het eerst kunnen we ingrijpen’
Ludo van der Pol werkt al achttien jaar met SMA-patiënten. Zij hebben een erfelijke aandoening waardoor hun spieren steeds verder afbreken en waar geen medicijn tegen bestaat. Tot nu dan. Door Bart Braun Beeld: Bram Belloni
‘B
ij de ernstigste gevallen van spinale spieratrofie, in het Engels afgekort tot SMA, merkt de moeder al tijdens de zwangerschap dat het mis is. In het derde trimester neemt de beweeglijkheid van het kind af. Kinderen met SMA zijn floppy babies: ze worden heel slap. Dat zie je op zich wel bij meer neurologische aandoeningen, maar wat typisch is voor SMA is een patroon: het zijn heel alerte baby’s, in combinatie met bewegingsarmoede. Het kindje is ogenschijnlijk normaal geboren, en een paar weken later was het ten dode opgeschreven. Wij artsen konden ze helemaal niets bieden. ‘SMA wordt onderscheiden in vier verschillende typen. Hoe eerder je het krijgt, hoe ernstiger de verschijnselen. Bij pasgeboren baby’s spreken we van type 1. Zij zullen nooit kunnen zitten en het merendeel haalt het derde levensjaar niet. Kinderen met type 2 zullen nooit leren lopen. Type 3 geldt als de ‘milde’ vorm, maar is helemaal niet mild. De een kan nog tientallen jaren lopen, de ander eindigt voor zijn twintigste in een rolstoel. Type 4, waarbij je pas na je dertigste symptomen ontwikkelt, is relatief zeldzaam. ‘Patiënten met SMA missen het gen smn1, dat codeert voor een eiwit dat SMN heet, dat in allerlei lichaamscellen nodig is. Het klassieke verhaal is dat zonder SMN de zenuwcellen in je ruggenmerg die je spieren aansturen, de zogeheten motorneuronen, afsterven. Omdat je spieren niet meer geprikkeld worden, verpieteren die vervolgens. Inmiddels weten we dat het
eiwit ook een rol speelt in de spieren zelf en dat ook andere weefsels een tik krijgen als SMN er niet is. Hartcellen bijvoorbeeld, en de cellen die betrokken zijn bij je suikerhuishouding. De cellen van je motorische zenuwstelsel zijn alleen het meest gevoelig, dus het verlies daarvan viel het meeste op.’
Ziekteverloop
Naar een normale school De dochter van Yuxia Jiang, Caroline, heeft SMA. ‘Een kind met SMA vraagt fysiek en mentaal veel van je als ouder. Door de spierproblemen kan Caroline weinig zelf en moet ik haar overal bij helpen. Mentaal ben je er continu mee bezig. Het verloop van de ziekte is moeilijk te voorspellen, dat levert veel zorgen op. De toekomst is niet altijd iets om naar uit te kijken. Ik ben ontzettend blij en dankbaar voor de hulp vanuit het ziekenhuis. De artsen en onderzoekers tonen veel medeleven en doen hun uiterste best om ons te helpen, om ervoor te zor-
gen dat onze dochter straks naar een normale school kan gaan. Dat raakt me echt. Caroline krijgt nu een fulltime behandeling met nusinersen. Daardoor kan ze alweer beter haar armen en hoofd optillen, ze kan zelfs een beetje staan met mijn hulp. We zijn altijd bereid samen te werken als onderzoekers onze input nodig hebben. Er worden alweer nieuwe medicijnen ontwikkeld, dus we hopen dat die straks hier beschikbaar zijn. Ondanks alles proberen we positief te blijven, met alle nieuwe wetenschappelijke ontwikkelingen.’
10 | New Scientist | UMC Utrecht Hersencentrum
‘Als je proefdieren genetisch aanpast en het gen smn1 weghaalt, sterven de dieren allemaal nog voor de geboorte. Je kunt niet zonder dat eiwit. De reden dat SMApatiënten het in eerste instantie wel overleven, is dat mensen een verwant gen hebben, smn2. Omdat niet iedereen evenveel kopieën van dat gen heeft en niet ieder exemplaar van dat gen in evenveel eiwit resulteert, zitten er zulke grote verschillen in het ziekteverloop tussen patiënten. ‘Sinds december 2017 mogen we het medicijn nusinersen voorschrijven aan SMA-patiënten met type 1 en 2 en een gedeelte van de type 3-patiënten. In de praktijk krijgen vrijwel alleen kinderen van vijf jaar en jonger nu het medicijn. De werkzame stof is een kort stukje DNAachtig materiaal, dat het afschrijven van het smn2-gen beïnvloedt. Dat zorgt ervoor dat er meer SMN2-eiwit wordt gemaakt. ‘Die injectie betekent niet dat een zieke patiënt in een kerngezond kind verandert; zulke medicijnen bestaan er niet voor aangeboren afwijkingen. Bij baby’s betekent het: overleving. Ook is de motorische ontwikkeling beter: ze kunnen motorische mijlpalen bereiken, zoals zitten. Hoe het vervolgens verder gaat, weten we nog niet. Ook bij oudere kinderen zien we dat ze beter leren bewegen, bijvoorbeeld een verbetering van de armfunctie, en dat er geen achteruitgang meer is van de dingen die ze al konden. Het is geen genezing, maar het is een enorme stap vooruit. Je kunt het leven echt een stuk aangenamer maken voor deze kinderen.’
Echt een verschil
‘Nog belangrijker is dat dit medicijn een proof of concept is: dit type medicijnen kan ontwikkeld worden, en werkt. Er bestond al twaalf jaar een enzymvervangend medicijn voor de ziekte van Pompe, maar sindsdien is nusinersen het eerste vergelijkbare middel dat echt een verschil maakt. Nu betekent de diagnose niet meer einde oefening; we kunnen ingrijpen.
interview
‘Het is enorm belangrijk om met mensen zelf in gesprek te gaan: wat vinden júllie dat er echt toe doet?’ ‘Het middel is op dit moment nog heel duur. Een patiënt heeft het zijn hele leven nodig. De discussie over hoe duur een medicijn mag zijn, gaat over grenzen en kostenefficiëntie. Die wordt niet alleen voor deze aandoening gevoerd, maar we zullen het steeds vaker tegenkomen, want dit is de 21steeeuwse geneeskunde. We moeten als samenleving zelf bepalen wat we willen, en hoe we dat dan aan elkaar vertellen. ‘Spinale spieratrofie en taaislijmziekte zijn twee erfelijke aandoeningen die relatief veel voorkomen – er zijn een paar honderd SMA-patiënten in Nederland en ongeveer 1500 mensen met taaislijmziekte. Dat maakt die twee ziekten tot dossiers die bepalend zullen zijn voor hoe we met de rest omgaan. On the bright side: omdat dat de twee meest
voorkomende erfelijke aandoeningen zijn, hebben we daarmee dus ook meteen de grootste kostenpost gehad.’
Patiëntenverhalen
‘Het Spieren voor Spieren Kindercentrum/ SMA-expertisecentrum hier in het UMC Utrecht, waar ik het hoofd van ben, bestaat sinds 2010. De ouders van patiënten klaagden dat het te lang duurde voor ze bij de juiste behandelaars terechtkwamen, en de stichting Spieren voor Spieren wilde dat er een gespecialiseerde plek voor deze patiënten zou komen. Zij kwamen uiteindelijk hier in Utrecht terecht. Hoe we begonnen? Door eerst maar eens patiënten te zien. Dat verhaal over celletjes en genetica is heel belangrijk en levert nu een
behandeling op, maar een ziekte echt begrijpen, dat vergt meer patiëntenverhalen. Wij hadden het voorrecht dat veel mensen ons hun verhaal wilden vertellen. We hoorden ook veel dingen die voor ons nieuw waren. ‘De vakliteratuur over SMA hield bijvoorbeeld op bij de leeftijd van 18 jaar. Uit de vraaggesprekken die wij voerden, bleek dat de achteruitgang in de volwassenheid verder gaat, dramatisch zelf. Mensen worden steeds afhankelijker van anderen. Als je zo jong stopt, zie je pubers die weliswaar het loopvermogen verloren waren, maar die zichzelf nog voort konden bewegen in de rolstoel. Maar je schrikt als je diezelfde mensen dan op middelbare leeftijd tegenkomt en hoe hulpbehoevend ze dan zijn. ‘Allereerst brengt zulk onderzoek de behoefte aan nieuwe therapieën in kaart. Wat het ook verhelderde: spieren is één, maar uithoudingsvermogen is twee. Het probleem is vaak dat SMA-patiënten nog wel een vork vast kunnen houden, maar dat ze na twee happen moeten stoppen. In ons onderzoek richten we ons op wat er precies gebeurt en wat je eraan kunt doen. We hebben net een onderzoek afgerond naar een medicijn – goedkope medicatie, die je gewoon als pil inneemt – dat het uithoudingsvermogen zou kunnen verbeteren.’
Angstgevoelens
‘Zulk onderzoek, vanuit de vragen van de patiënten zelf, draagt heel erg bij aan wat zij willen. Het is enorm belangrijk om met mensen zelf in gesprek te gaan: wat vinden júllie nou zelf dat er echt toe doet? Waar loop je nou tegenaan? Wat kunnen wij doen waardoor de zon voor jou wat meer gaat schijnen? Die dialoog houden we jaarlijks, met behulp van het Prinses Beatrix Spierfonds. Veel van ons onderzoek wordt op die manier vormgegeven. Het gaat over kauwen, over eten, maar ook over psychische noden. Hoe kijken mensen tegen je aan? Wat is je stemming? Heb je veel angstgevoelens? ‘We overleggen met psychologen, fysiotherapeuten, logopedisten en andere mensen die je als neuroloog niet altijd even vaak spreekt. Het gebeurt nog veel te vaak dat een patiënt komt om de dokter een plezier te doen. Zo’n situatie waarin de dokter tevreden terugblikt op het gesprek, terwijl de patiënt het idee heeft dat-ie met lege handen weggaat. Wij doen in elk geval ons best om het andersom te doen.’ UMC Utrecht Hersencentrum | New Scientist | 11
inzicht
ALS ALS (Amyotrofische Laterale Sclerose) is een ziekte waarbij motorische zenuwcellen afsterven. Hierdoor raken mensen de controle over hun spieren kwijt. Op dit moment is er nog geen genezing mogelijk. Project MinE en het vervolg TryMe proberen de genetische oorzaken van ALS te achterhalen en medicijnen te ontwikkelen die de ziekte kunnen stoppen.
Mensen 1.500 mensen in Nederland lijden aan ALS. Elk jaar sterven 500 mensen aan ALS, maar komen er ook 500 patiënten bij.
Levensverwachting De levensverwachting bij ALS is 3 tot 5 jaar na de diagnose. De meeste mensen zijn tussen de 40 en 60 jaar als ze ziek worden.
Ziekte De ziekte tast de motorische zenuwcellen aan, waardoor patiënten verlamd raken. De meeste mensen overlijden nadat hun ademhalingsspieren ermee ophouden.
Verzameling Ondertussen blijkt dat ALS niet één ziekte is, maar een verzameling van verschillende ziektes die allemaal leiden tot afsterving van de zenuwcellen.
12 | New Scientist | UMC Utrecht Hersencentrum
Genetisch Bij 10% van de patiënten is de ziekte genetisch. Maar ook bij de andere patiënten zijn genen aan te wijzen die een rol spelen bij het ontstaan van ALS. Uit tweelingonderzoek is gebleken dat de ziekte voor 65% in de genen ligt. De overige 35% zijn omgevingsfactoren. Wat die precies zijn, is nog niet bekend.
INFOGRAPHIC: PEPIJN BARNARD TEKST: EMMEKE BOS BRON: PROJECTTRYME.EU, PROJECTMINE.COM
Project MinE
10.000
22.500
Project MinE wil het DNA van 22.500 mensen analyseren om zo de genetische oorzaken van ALS op te sporen. Zo kan een medicijn ontwikkeld worden dat ALS bij de oorzaak aanpakt.
Op dit moment zijn ruim 10.000 DNA-profielen opgehaald.
7.500 controle personen 15.000 ALSpatiënten
Elk DNA-profiel is 100 GB. Om alle profielen te analyseren, wordt de rekenkracht ingezet van supercomputer SURFsara op het Science Park in Amsterdam. Op dit moment zijn er 20 ALS-genen gevonden. Door Project MinE komen hier steeds meer ALS-genen bij.
Project TryMe Met project TryMe hopen wetenschappers de medicijnen te vinden die de ALS-genen uitschakelen. Zo wordt ALS in de toekomst hopelijk een ziekte waar je oud mee kunt worden.
2%
Patiënten worden op basis van hun DNA ingedeeld in groepen. Zo wordt duidelijk welke behandeling werkt bij welke genetische afwijking.
Deelnemers houden hun eigen gezondheid bij met behulp van wearables: draagbare technologie die bijvoorbeeld hun stappen telt, ademhaling registreert of slaappatroon bijhoudt.
25%
Project TryMe wil dat 25% van de ALS-patiënten mee kan doen met medicijnenonderzoek. Momenteel is dat nog maar 2%.
De toekomst Genen worden via transcriptie omgezet in mRNA. Bij translatie van het mRNA wordt een eiwit gemaakt. Mogelijke medicijnen kunnen dit proces op twee plaatsen stoppen. 1 Medicijnen kunnen aan het ALS-gen op het DNA ‘plakken’ waardoor het geen schadelijke eiwitten meer kan aanmaken.
2 Medicijnen kunnen de eiwitten uitschakelen waarvoor de ALS-genen coderen.
Medicijn
ALS-gen
ALS-gen Transcriptie
Transcriptie mRNA
mRNA Translatie
Translatie Eiwit
Eiwit
ALS symptomen
Medicijn
ALS symptomen
UMC Utrecht Hersencentrum | New Scientist | 13
Uit het brein bevrijd Patiënten met een locked-in-syndroom beschikken vaak over goede cognitieve capaciteiten, maar zitten vanwege een verlamming opgesloten in hun brein. Onderzoekers van het Hersencentrum van het UMC Utrecht ontwikkelen brein-computer interfaces waarmee deze mensen weer kunnen communiceren.
Door Jolein de Rooij Beeld: Bram Belloni
D
e grote, onlangs overleden natuurkundige Stephen Hawking was tevens de beroemdste ALS-patiënt ter wereld. Aan het einde van zijn leven gebruikte de ontdekker van de Hawkingstraling zijn wangspieren om zinnen, woorden en letters te selecteren en deze door een spraakcomputer te laten uitspreken. Hawking liep echter groot risico om uiteindelijk ‘volledig locked-in’ te raken. In anticipatie op dit lot werkte hij begin deze eeuw samen met onderzoekers van Intel aan een systeem dat de hersenactiviteitspatronen achter gezichtsuitdrukkingen vertaalt in acties. Dit systeem zou nooit van de grond komen. Hawking zal daarom met grote interesse kennis hebben genomen van de prestaties van een onderzoeksteam van het UMC Utrecht. In 2016 haalde dit team onder leiding van hoogleraar Nick Ramsey het wereldnieuws met een systeem dat patiënten met locked-in-syndroom (LIS) dag en nacht zelfstandig thuis kunnen gebruiken 14 | New Scientist | UMC Utrecht Hersencentrum
om een verzorger op te roepen en te communiceren. Een 58-jarige ALS-patiënte leerde met het systeem ‘hersenkliks’ te maken, waarmee ze letters kan selecteren op een scherm dat aan haar elektrische rolstoel is vastgemaakt. Dat doet ze door te proberen met haar duim de top van haar ringvinger aan te raken. Ook al resulteert dat niet in een echte handbeweging, het systeem vangt het motorische signaal op en genereert vervolgens een klik op het scherm. ‘Het mooiste is dat ik weer naar buiten kan en dat ik kan communiceren,’ zei deze eerste gebruiker in 2016 tegen New Scientist.
Geen toeters en bellen
Het team werkt sindsdien volop aan nieuwe en verbeterde methoden om hersenactiviteit te vertalen in allerlei nuttige acties voor mensen die de controle over hun spieren zijn kwijtgeraakt. Patiënten met een lockedin-syndroom hebben een verlamming die zo ernstig is dat ze zich vrijwel niet meer kunnen bewegen. Praten is onmogelijk geworden. ‘Veel mensen denken dat het leven met zo’n ernstige beperking niet de moeite waard is,’ zegt onderzoeker
Mariska van Steensel. ‘Frans en Zweeds onderzoek heeft echter aangetoond dat de kwaliteit van leven van deze mensen vaak verbazingwekkend hoog is. Het vermogen tot communiceren is daarbij wel heel belangrijk.’ BCI’s vormen een mogelijke weg daartoe. Een BCI is een apparaat dat hersensignalen direct omzet in een actie. In de BCI die het team van Ramsey ontwikkelde, zijn de elektroden rechtstreeks op de hersenen geplaatst. Dat gebeurt via enkele gaatjes in de schedel. Zo zijn de kwaliteit van het hersensignaal en de betrouwbaarheid van het systeem het hoogst. Twee stripjes met vier elektroden sturen signalen naar een versterker die onder de huid van de borstkas is ingebracht en die de signalen draadloos doorstuurt naar een computer. ‘De onderzoeksgroep van Ramsey behoort tot de wereldwijde pioniers op BCI-gebied,’ zegt Femke Nijboer, universitair hoofddocent in de gezondheids-, medische en neuropsychologie aan de Universiteit Leiden. ‘De groep combineert heel fundamenteel onderzoek met heel praktisch onderzoek en is methodologisch sterk. Het mooie aan het BCI-systeem dat ze ontwikkeld hebben, is dat de patiënte uit het eerste experiment in 2016 het systeem tot op de dag van vandaag gebruikt. Het voldoet dan ook aan de belangrijkste eisen die gebruikers stellen aan dit soort systemen: geen draden, geen toeters en bellen, maar wel heel praktisch in gebruik.’ De ALS-patiënte roept haar verzorger met het BCI-systeem, communiceert ermee en kan het apparaat ook gebruiken om een ander kanaal op haar televisie te kiezen. Dit is allemaal mogelijk doordat ze na een intensieve trainingsperiode erin geslaagd is met gedachtekracht een ‘hersenklik’ te produceren die in vrijwel 90 procent van de gevallen betrouwbaar is. Van Steensel: ‘Momenteel zit ze ongeveer op drie letters per minuut.’ Inmiddels oefent ook een tweede persoon met het systeem. UMC Utrecht Hersencentrum | New Scientist | 15
brein-computer interface
fMRI als voorspeller Het succes van het Utrechtse onderzoeksteam is het resultaat van ruim een decennium lang onderzoek naar human brain mapping. Ramsey: ‘Hersenfuncties zijn vrij ruimtelijk op de hersenen georganiseerd. Verschillende gebiedjes doen verschillende dingen.’ Zo hebben afzonderlijke lichaamsdelen in de hersenen een eigen ‘controlecentrum’ dat verantwoordelijk is voor het aansturen en voelen van beweging. Om posities op het hersenoppervlak te vinden die speciaal geschikt zijn voor BCI, moesten veel verschillende hersengebieden worden onderzocht en had het team behoefte aan een reguliere stroom vrijwilligers. Die vonden ze dankzij de medewerking van epilepsiepatiënten die in het UMC Utrecht voor diagnostische doeleinden tijdelijk elektrodes geïmplanteerd kregen onder hun schedel, rechtstreeks op de hersenen. ‘Jarenlang hebben we epilepsiepatiënten gevraagd om, voordat ze hun implantaten kregen, in de MRI-scanner te gaan liggen,’ zegt Van Steensel. ‘We vroegen hen vervolgens een taak uit te voeren, zoals het maken van een bepaalde handbeweging.’ Met een speciale techniek, functionele MRI (fMRI), werd hun hersenactiviteit zichtbaar gemaakt in een driedimensionaal beeld. ‘Je ziet dan een bepaald plekje aan de oppervlakte van de hersenen oplichten.’ 16 | New Scientist | UMC Utrecht Hersencentrum
Wanneer de diagnostische meet-elektroden geplaatst waren, vroeg het team de proefpersonen om de taak te herhalen. ‘Zo testten we of fMRI een betrouwbare techniek is om te voorspellen op welke plaats de sterkste veranderingen in het elektrisch hersensignaal optreden bij het uitvoeren van een bepaalde taak. Dat bleek inderdaad het geval. Ook vroegen we proefpersonen om een soort spel te doen, waarbij ze deze hersensignalen gebruikten om een balletje te laten bewegen op een computerscherm. Op die manier konden we onderzoeken in hoeverre patiënten controle hadden over het signaal dat ze konden versturen vanaf een bepaald hersengebied.’
Slimme signaalverwerking
Om de eerste thuis-BCI ter wereld te ontwikkelen maakte het team een aantal slimme keuzes. Zo concentreerde het team zich op een aantal hersengebieden aan de buitenkant van het brein waarvan de activiteit relatief gemakkelijk te interpreteren is. Dat geldt bijvoorbeeld voor het handgebied. Het team zocht daarnaast naar hersenfuncties die onder controle staan van onze wil. ‘Je wilt uiteindelijk een signaal kunnen detecteren waar je mensen met een ernstige beperking mee kunt helpen,’ zegt Ramsey. ‘Dat betekent dat de patiënt het signaal goed moet kunnen aansturen en dat ruis zoveel mogelijk moet worden onderdrukt.’
Dat signaal moet bovendien uiterst betrouwbaar zijn. Ramsey: ‘Onze grootste uitdaging is het voorkomen van valse positieven. Je wilt ervoor zorgen dat als iemand juist niet wil klikken, het systeem niet onterecht alsnog een klik detecteert.’ Dat blijkt behoorlijk lastig, omdat de hersenen volgens Ramsey ‘heel onstuimig’ zijn. ‘Ze reageren overal op,’ zegt hij. ‘De motorische schors wordt bijvoorbeeld al actief zodra je iemand anders ziet bewegen of zelfs maar aan bewegingen denkt. We hebben daarom aardig wat trucs moeten uithalen om de activiteit die wel expres gegenereerd wordt eruit te filteren.’ Daar komt nog eens bij dat de biofeedback die de gebruiker tijdens de trainingsperiode krijgt, ervoor zorgt dat het signaal verandert. ‘Daardoor moeten we vervolgens ook de signaalverwerking weer bijschaven. De plaatsing van een BCI brengt dus echt een interactie op gang tussen mens en machine.’
Praten op gedachtekracht
Inmiddels werkt het team ook aan andere manieren om LIS-patiënten te helpen communiceren. ‘In toekomstige versies van de BCI willen we mensen nog meer controlemogelijkheden bieden’, zegt Van Steensel. ‘Dat willen we doen door optimaal gebruik te maken van de rijke organisatie van de hersenen. Het handgebied is daarvoor bijvoorbeeld heel geschikt, omdat het relatief groot is. Dat maakt het gemakkelijker om
verrijzen. ‘BCI’s kunnen mogelijk in de toekomst ook bij beroertes uitkomst bieden. Meestal vindt een hersenbloeding in slechts één hemisfeer van het brein plaats. Vervolgens verlies je aan één kant van je lichaam bepaalde functies, omdat de banen of de grijze stof in de corresponderende hersenhelft beschadigd zijn. Er zijn echter aanwijzingen dat je aan de gezonde kant van de hersenen veel informatie kunt uitlezen over wat de gewonde kant van de hersenen tevergeefs probeert. De kans bestaat dat mensen in de toekomst na een beroerte dankzij BCI’s een deel van hun verloren functies kunnen terugkrijgen.’
De minste moeite
verschillende bewegingen van elkaar te onderscheiden.’ Ramsey: ‘Je kunt het hersenoppervlak beschouwen als een soort scherm waarop je kunt zien wat de persoon op dat moment wil doen.’ Zo slaagde het team van Ramsey er in 2016 in om vier verschillende gebaren uit het Amerikaanse gebarentaalalfabet te onderscheiden van elkaar, dankzij slimme signaalverwerkingsmethoden en fijnmazige breinimplantaten
willen, is de hersensignalen die opgewekt worden door hardop in het hoofd te praten, één op één doorsturen naar een spraakcomputer.’ De potentiële toepassingsmogelijkheden lijken schier eindeloos. Zo slaagde een onderzoeksteam onder leiding van hoogleraar Robert Gaunt van de Universiteit van Pittsburgh er in 2016 in om een 28-jarige man via een BCI niet alleen een robotarm
‘Wat we willen, is hersensignalen die opgewekt worden door hardop in het hoofd te praten, één op één doorsturen naar een spraakcomputer’ – opnieuw bij epilepsiepatiënten. Daarnaast richten de onderzoekers zich op de hersengebieden die onder meer de tong, lippen, kaken en de stemband aansturen. In 2017 beschreef Ramsey hoe hij bij drie verschillende epilepsiepatiënten uit hersensignalen de vier verschillende fonemen p, k, a en u kon herkennen. Dit onderzoek zal er op termijn mogelijk toe leiden dat verlamde personen met gedachtekracht via een computer leren spreken. ‘Ik denk dat het nog wel tien jaar duurt voordat we dat zo goed kunnen dat we het zullen proberen toe te passen bij verlamde patiënten,’ zegt Ramsey. ‘Wat we het allerliefste zouden
te laten bewegen, maar ook aanraaksensaties te laten ervaren vanaf zijn kunstmatige vingers. Dit soort systemen zijn momenteel nog te zwaar en onpraktisch voor dagelijks gebruik. ‘Maar in de verre toekomst – ik denk dat over dertig jaar nog optimistisch is – wordt het waarschijnlijk mogelijk om bij de zenuwaanhechting van spieren kleine computertjes ter grootte van rijstkorrels te plaatsen waarmee verlamde personen hun eigen spieren opnieuw kunnen aansturen,’ aldus Ramsey. Maar ook op de kortere termijn ziet Ramsey al veelbelovende toepassingsmogelijkheden voor BCI’s aan de horizon
Veel mensen met een locked-in-syndroom schrikken nu nog terug voor de hersenoperatie die nodig is voor de plaatsing van een BCI. ‘Die angst is begrijpelijk,’ zegt Van Steensel. ‘Het enige wat deze mensen immers nog hebben is hun denken. Dan is het een hele grote stap om ook nog eens een hersenoperatie te laten uitvoeren.’ Femke Nijboer: ‘Het reële risico is veel minder groot dan mensen denken. De plaatsing van een BCI is behoorlijk vergelijkbaar met dat van een cochleair implantaat (een systeem dat rechtstreeks met de gehoorzenuw communiceert), dat als veel normaler wordt beschouwd.’ Het onderzoeksteam van Ramsey werkt ondertussen in samenwerking met ingenieurs van het Italiaanse Consiglio Nazionale delle Ricerche (CNR) aan fijnmaziger implantaten en kleinere en meer krachtige versterkers. ‘Operaties zullen in de toekomst op alle fronten nóg veel minder invasief worden,’ aldus Ramsey. Zo zijn er plannen om implantaten niet rechtstreeks op de hersenen, maar op het hersenvlies te plaatsen. Dat is het sterke vlies tussen de schedel en het brein in. ‘Dan heb je het dus niet eens meer over een hersenoperatie.’ Tegelijkertijd doet het team voortdurend onderzoek naar de wensen van potentiële gebruikers. Van Steensel: 'Dit soort hulpmiddelen kan alleen een succes worden wanneer de doelgroep er echt wat aan heeft. Daarom is het een intrinsiek onderdeel van al onze onderzoeken om samen met gebruikers te bekijken wat met de minste moeite het beste werkt.’ UMC Utrecht Hersencentrum | New Scientist | 17
Door oogbewegingen te meten, brengen onderzoekers in kaart waar patiĂŤnten naar kijken. Warme, rode kleuren geven aan dat iemand lang naar dit punt heeft gekeken. Blauw betekent minder kijktijd.
18 | New Scientist | UMC Utrecht Hersencentrum
Met behulp van een VR-bril test onderzoeker Tanja Nijboer de virtuele omgeving zelf uit.
Naar de super Patiënten met een beroerte, psychose of ALS hebben vaak moeite met drukke situaties. Een bezoekje aan de supermarkt kan al lastig zijn. De virtuele supermarkt biedt hulp. Door Aafke Kok
M
ensen met een van deze ziektes kunnen in een supermarkt bijvoorbeeld moeite hebben om producten te vinden. In de virtuele supermarkt maakt onderzoeker Tanja Nijboer de omgeving steeds net iets drukker. Hoe passen patiënten hun strategieën aan in een drukkere supermarkt ten opzichte van controle-proefpersonen? Het antwoord op die vraag kan helpen bij het stellen van diagnoses. In de toekomst wil Nijboer de virtuele supermarkt ook inzetten om behandelingen aan te passen aan de specifieke problemen waar patiënten tegenaan lopen. UMC Utrecht Hersencentrum | New Scientist | 19
interview Manon Benders
‘Het leven begint niet bij de geboorte, maar al in de buik’ Het Wilhelmina Kinderziekenhuis van het UMC Utrecht heeft de meeste expertise op het gebied van neonatale neurologie in Nederland. Dit kinderziekenhuis behoort tot een van de negen Nederlandse gespecialiseerde geboortecentra. Wij spraken hoogleraar Manon Benders over hersenonderzoek bij baby’s vóór de geboorte, bij vroeggeboren kinderen, toekomstig stamcelonderzoek en de zachte kant van het onderzoek.
interview
Wat ziet u op de hersenscans?
‘In het laatste trimester van de zwangerschap ontwikkelt het brein zich van een gladde versie tot een gekronkelde versie, net als de hersenen van volwassenen. Deze ontwikkeling gebeurt in tien weken. Dat is megasnel, erg bizar. ‘Bij baby’s die te vroeg geboren worden, vanaf vierentwintig weken, is het brein nog helemaal glad. Hun hersenontwikkeling gebeurt bij ons in de couveuse. Hierin zijn de omstandigheden heel anders en het proces kan verstoord worden door de medicijnen
Tekst: Marleen Hoebe en Jim Jansen Fotografie: Bob Bronshoff
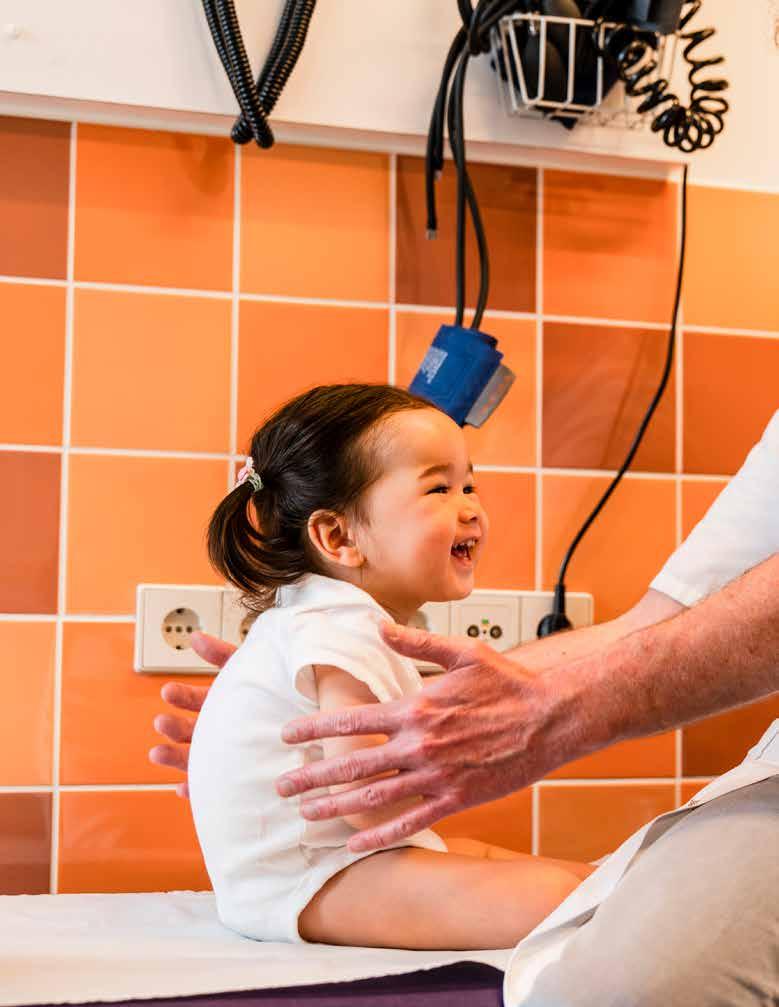
Hoe kunt u hersenonderzoek doen bij baby’s?
‘Ik ben een jaar in Genève geweest waar ik een speciale toepassing op een MRItechniek leerde van een neonatoloog die op dat moment de meeste ervaring had bij pasgeborenen. Met deze techniek kun je de grootte en rijpheid van het brein meten na de geboorte. Door deze kennis ben ik in staat geweest om hier een onderzoeksgroep op te bouwen. We onderzoeken nu samen met gynaecologen ook de hersenen van de baby’s vóór de geboorte. Het leven begint namelijk niet bij de geboorte, het kindje leeft en ontwikkelt zich al in de buik. We leggen de spoelen van de MRI-scanner op de buik van de moeder. Dan zie je het hele kind. De hersenen kunnen we zo heel gedetailleerd onderzoeken.’ Hebben pasgeboren baby’s geen last van de MRI-scanner?
‘Er kleven geen risico’s aan het MRI-onderzoek, omdat een magnetisch veld wordt gebruikt en geen straling. De scanner maakt wel veel lawaai, maar de pasgeboren baby’s krijgen een drievoudige gehoorbescherming. Eerst krijgen ze gele doppen op de oren, daaroverheen een koptelefoon en als laatste een akoestische hoed die een derde van het geluid wegvangt. Daarom blijven die kinderen gewoon slapen.’ 22 | New Scientist | UMC Utrecht Hersencentrum
te rechtvaardigen. We willen weten hoe ze zich ontwikkelen. De kinderen zien we na ontslag terug vanaf de uitgerekende datum van veertig weken, bij zes maanden, vijftien maanden, drieënhalf jaar, vijfenhalf jaar en acht jaar. We volgen de motorische en psychologische ontwikkeling. Hierbij kijken artsen ook naar het aantal ziekenhuisopnames en de kwaliteit van leven. Soms bouwen die artsen zo’n goede band op met de ouders, dat ze later worden uitgenodigd voor het afstuderen of een huwelijk van patiënten.’
‘Bij baby’s die te vroeg geboren worden, is het brein nog helemaal glad’ die ze krijgen, of de beademing waaraan ze liggen. ‘Je ziet dat de hersenen van de vroeggeboren baby’s een stuk kleiner zijn dan die van gezonde baby’s. Er zit vaak veel vocht en water omheen. Als je de schedelomtrek zou meten, dan lijkt het net alsof ze even grote hersenen hebben als gezonde baby’s, maar dat is niet zo. Op latere leeftijd zien we bij een groot deel van die kinderen problemen in hun ontwikkeling, zoals gedrags-, leer- of psychiatrische problemen. De hersenen lopen achter. Het is de vraag of ze die achterstand uiteindelijk inlopen en of we die ontwikkeling kunnen beïnvloeden. Daar doen we nu veel onderzoek naar.’
Ziet u later nog ernstige problemen bij vroeggeboren kinderen?
Hoe onderzoekt u of vroeggeboren baby’s hun achterstand inhalen?
‘We houden in Nederland een grens aan voor vroeggeboren baby’s. Voor vierentwintig weken vangen we baby’s niet actief op, omdat ze dan zo’n geringe overlevingskans hebben en later een grote kans hebben op ernstige problemen. De helft van de baby’s die rond de vierentwintig weken
‘Het is voor ons een must om baby’s na behandeling weer te zien, om te kijken hoe het met ze gaat. Alleen als je dat weet, is zo’n intensieve en ingrijpende behandeling
‘De vraag is wat ernstig is. Heel veel kinderen houden wel problemen, zoals ADHD. Maar veel mensen met ADHD hebben een prima leven. Een groot percentage van de kinderen heeft ook kenmerken van autisme. Die kinderen gaan uiteindelijk minder vaak een relatie aan of hebben geen baan. Ze hebben soms meer moeite om zich staande te houden in de maatschappij. Soms kom je schrijnende gevallen tegen, zoals kinderen met ernstige meervoudige handicaps. Dit is gelukkig de minderheid.’ Kunnen die schrijnende gevallen worden voorkomen?
altijd met een team van dokters, verpleegkundigen en eventueel andere specialisten. Daarbij nemen we mee hoeveel ingrijpende behandelingen er nog moeten gebeuren. De uiteindelijke beslissing doen we altijd in samenspraak met de ouders. De ouders krijgen uitvoerige uitleg over wat ze kunnen verwachten. Als ouders goed geïnformeerd zijn, dan komen we er eigenlijk altijd wel samen uit. ‘Soms zijn de beslissingen heel moeilijk. Toen ik zwanger was van mijn tweede kind werd ik gebeld vanuit Tilburg, terwijl ik zelf rond de vierentwintig weken zwanger was. Ze hadden daar een pasgeboren baby van drieëntwintig weken die heel levendig was en ze vroegen of we die toch niet wilden behandelen. Dan zeg je nee, terwijl je zelf een baby rond dezelfde leeftijd in je buik hebt. Afschuwelijk is dat.’
CV
Vanwaar dan toch die interesse in vroeggeboren kinderen met een moeilijke ontwikkeling?
Manon Benders Geboren 24 januari 1969 te Hellevoetsluis 1999 promotie geneeskunde, Universiteit Leiden 2003 – 2008 academische positie neonatologie, Wilhelmina Kinder ziekenhuis Utrecht 2006 – 2007 academische positie, Université de Genève, Zwitserland 2009 – 2015 staflid neonatologie, Universitair Medisch Centrum Utrecht 2014 consultant en klinisch onderzoeker, King’s College London, Groot-Brittannië 2015 – heden hoogleraar neonatologie, Universitair Medisch Centrum Utrecht
geboren wordt, overleeft het. Hierna gaat per week zwangerschap het overlevingspercentage omhoog met 10 procent. Na vijfentwintig weken heb je een grotere kans dat de baby het overleeft. ‘De baby’s onder de vierentwintig weken worden wel geboren, maar niet behandeld op de intensive care. We kijken altijd of de intensieve zorg die het kind nodig heeft, maar voor schade kan zorgen, de situatie
overbrugt naar beter. Als je weet dat kinderen ernstig gehandicapt kunnen worden, vinden we niet dat we moeten behandelen. Dat doe je ook uit liefde, om ernstig lijden te voorkomen.’ Hoe besluiten jullie om te stoppen met de behandeling?
‘Als de verwachting is dat de toekomst er somber uit gaat zien, nemen we het besluit
‘Ik wist al vroeg in het tweede jaar van mijn studie geneeskunde dat ik neonatoloog wilde worden. Toen mocht ik mee naar een bevalling van een tweeling van zesentwintig weken. Dit vond ik zo fascinerend, dat ik dacht: dit werk wil ik doen. Ik was geïnteresseerd in de breinontwikkeling van pasgeborenen met een moeilijke of te vroege start.’ Wat is er de afgelopen jaren binnen de neonatologie ontdekt?
‘Neonatologie is een vrij jong vak. Vroeger werd neonatologie door gynaecologen uitgevoerd. Pas in de jaren 70-80 heeft het vakgebied zijn beloop gekregen. In Nederland is het nu prachtig geregeld. Moeders die dreigen te vroeg te bevallen, worden naar een van de negen gespecialiseerde centra overgeplaatst. Dit betekent dat je gelijk de juiste opvang voor het kind en de moeder hebt. ‘Er zijn enorme stappen gemaakt. De grootste doorbraak was vlak voor de eeuwwisseling, met surfactant, het medicijn voor longontplooiing dat zorgt voor een grote overlevingskans bij baby’s met heel onrijpe UMC Utrecht Hersencentrum | New Scientist | 23
zieke longen. Het medicijn dat we voor de geboorte aan moeders geven voor de longrijping van de baby is ook een belangrijke stap. Hierdoor hoeven de baby’s minder lang aan de beademing en is er minder kans op hersenbloedingen. ‘We waren eerst erg bezig met de technische aspecten van het vak. Nu gaan we de zachte kant op. We zijn meer bezig met het comfort van de baby’s, of ze pijn ervaren of stress. Verder willen we ouders veel meer betrekken in de zorg. We gaan nu op de Neonatale Intensive Care Unit (NICU) van acht bedjes in één grote ruimte over naar single rooms. Dan kunnen de ouders erbij blijven. We denken dat dit voor ouders en kinderen beter is. Ik denk dat we zo nog meer winst kunnen boeken.’ Wat wilt u nog meer bereiken met uw onderzoek?
‘We willen uiteindelijk via de hersenscans voorspellen hoe kinderen zich gaan ontwikkelen. Daarom is het zo belangrijk dat we de kinderen op de lange termijn terugzien, zodat we vroeg weten welke factoren 24 | New Scientist | UMC Utrecht Hersencentrum
‘We hebben nu toestemming om stamcellen te geven aan pasgeboren baby’s met herseninfarcten’ en welke hersenstructuren een rol gaan spelen. Dan kunnen we eerder beginnen met behandelen. Nu kunnen we al voorspellen hoe het met de cognitie zal gaan op jonge schoolleeftijd, doordat we de netwerkverbindingen tussen verschillende hersengebieden kunnen bekijken. Maar het leven bestaat uit veel meer dan alleen een goed IQ. ‘Ik denk wel dat we het niet alleen in de beeldvorming gaan vinden. De kinderen
liggen bij ons aan allerlei meetapparatuur. Alles wordt bijgehouden: de hersenactiviteit, de hartslag, de ademhaling per minuut, elke verstoring in het zuurstofgehalte, laboratoriumuitslagen, radiologie-uitslagen, elke poepluier, wanneer ze de fles krijgen, hoe vaak ze spugen, of ze stress ervaren, hoe vaak ze aandacht van hun ouders krijgen en nog meer dingen die de verpleegkundigen observeren. Deze (big) data willen we combineren met de hersenscans, de hersenfilm-
interview
pjes die met EEG worden gemaakt en de ontwikkeling op lange termijn. Hiervoor hebben we slimmere mensen dan dokters nodig. Natuurkundigen en wiskundigen kunnen de data wel gebruiken voor een voorspellingmodel. Het liefst willen we een systeem maken dat een seintje geeft als een kind te veel of te weinig van iets krijgt. ‘Verder zijn stamcellen de toekomst. Die gaan naar de plek waar schade is, echt een soort magic. Ze herstellen weefsel dat kapot is. Dit geldt voor hersenschade, zieke longen en misschien wel voor kapotte darmen bij kinderen die ernstige darmproblematiek hebben. We hebben nu toestemming van de ethische commissie om stamcellen te geven aan pasgeboren baby’s met herseninfarcten. ‘As we speak zijn we ook bezig met een grote Europese aanvraag. We willen samen met andere onderzoekers verschillende groepen pasgeborenen met stamcellen behandelen, zoals te vroeg geboren kinderen met longproblemen. Ons deel zal gaan over stamcelbehandeling bij baby’s met hersenschade na ernstig zuurstofgebrek rondom de geboorte. Het is nog niet zeker of we deze
aanvraag nu krijgen, maar we verwachten wel dat binnen tien jaar stamcelbehandeling voor verbetering in de zorg van pasgeborenen zal zorgen.’ Hoe gaat het verder met de neonatologie-expertise hier in het UMC Utrecht?
‘We hebben net officieel de erkenning gekregen dat onze kliniek de meeste expertise heeft op het gebied van neonatale neurologie in Nederland. Deze erkenning krijg je op basis van verschillende dingen die je levert, zoals zorg, onderwijs en onderzoek. Hier komen vaak buitenlandse artsen om te leren over de hersenen van pasgeborenen. ‘We willen de kennis graag overbrengen en ook weer van anderen leren. Daarom willen we samen met collega-instituten uit Edinburgh, Londen, München en Toronto verschillende expertise samenbrengen. Daarnaast heb je door samenwerking een grotere en meer gevarieerde patiëntenpopulatie, waardoor we meer vraagstukken kunnen beantwoorden. We kunnen zo patiëntenpopulaties vergelijken.’
‘Elke dokter moet eigenlijk in een paar verschillende ziekenhuizen werken’ Heeft u zelf ook van buitenlandse ziekenhuizen geleerd?
‘Ja, ik heb uitstapjes naar andere plekken in de wereld gemaakt om mijn kennis binnen de neonatale neurologie te vergroten en hier te kunnen toepassen. Elke dokter moet eigenlijk in een paar verschillende ziekenhuizen werken. Anders doe je het altijd zoals je het in je eigen ziekenhuis geleerd hebt. In een ander ziekenhuis ga je zien dat meerdere wegen naar Rome leiden, want in elk ziekenhuis wordt alles weer een beetje anders gedaan. Maar belangrijker is dat je dingen die elders beter gaan kunt meenemen naar je eigen ziekenhuis. Die kruisbestuiving moet iedereen doen.’ UMC Utrecht Hersencentrum | New Scientist | 25
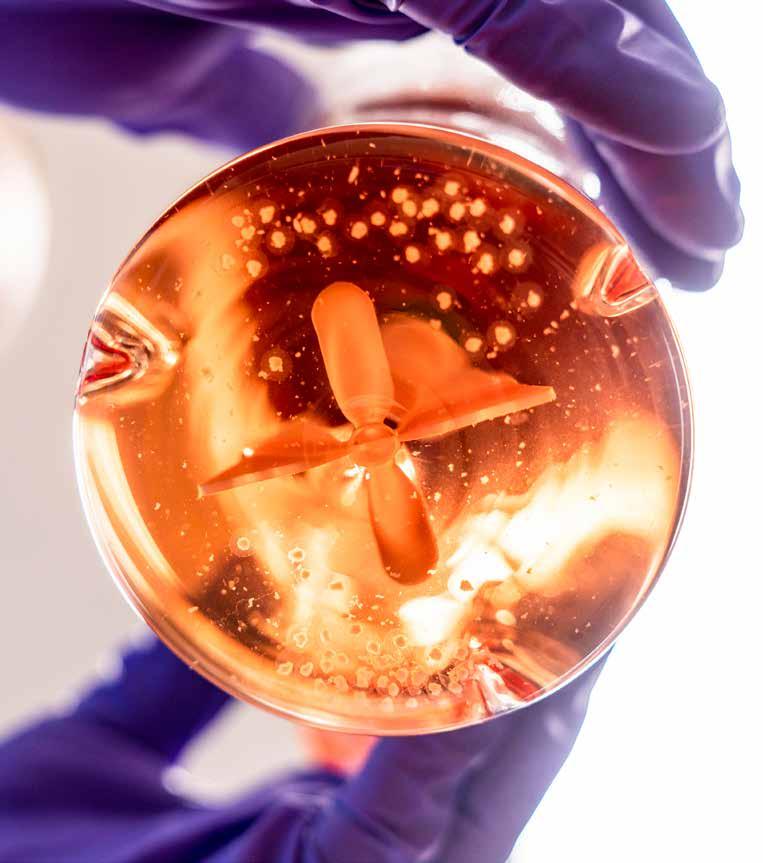
Home made Brain organoids zijn geen échte hersenen, ze zijn niet te gebruiken als vervangend orgaan bij hersenschade. Maar de gekweekte levende mini-breintjes van menselijke cellen bieden wel een unieke kans om de dynamiek in hersencellen uit te pluizen. Door Marieke Buijs Beeld: Bram Belloni
N
eurowetenschapper Paul Ormel schiet een witte labjas aan en wurmt z’n handen in paarse latex handschoenen. Voor de zekerheid nog een spriets alcohol eroverheen. Nu kan hij bakje ‘#2 22/11/18 ProLabb’ uit een schommelende stellage in de warmhoudkast vissen. Het doorzichtig plastic schaaltje ziet er bedrieglijk alledaags uit als omhulsel van een allerminst alledaagse creatie. Daar, in een dun laagje doorzichtig roze vloeistof, drijven ze. Vier minibreintjes. Mat, bleekroze klonters van ruwweg een halve centimeter doorsnee, met onwillekeurige kuiltjes en uitstulpingen. Het zijn brain organoids. Piepkleine breinstructuren van menselijke cellen. Door mensen bedacht en gecreëerd. Tot wasdom gekomen dankzij ingenieuze moleculaire trucs in het high-tech equivalent van een menselijke baarmoeder; voedselrijke vloeistof die zorgvuldig op lichaamstemperatuur wordt gehouden. Dit zijn de creaties die wetenschappers moeten helpen uitvogelen hoe het brein zich ontwikkelt en waar het misgaat bij aandoeningen als alzheimer, ALS en schizofrenie.
26 | New Scientist | UMC Utrecht Hersencentrum
Uit het lab In de zomer van 2013 gaat er een siddering door de wereld van het hersenonderzoek. Biotechnoloog Madeline Lancaster en haar collega’s beschrijven in het prestigieuze vakblad Nature dat ze minibreintjes hebben weten te kweken in het lab. Voor hoogleraar translationele neurowetenschappen Jeroen Pasterkamp van het UMC Utrecht is meteen duidelijk dat dit een doorbraak betekent. Hij begint met de inrichting van een lab voor het creëren en vooral ook bestuderen van brain organoids. Na de opstart- en ontwikkelfase lopen nu de eerste experimenten naar schizofrenie en ALS, en binnenkort gaat ook een organoidstudie naar alzheimer van start. Het menselijk brein is een verzameling van een kleine 90 miljard zenuwcellen, die ieder naar schatting 7000 communicatieverbindingen maken met andere cellen. Dat onvoorstelbaar complexe informatienetwerk speelt een rol in alles wat we doen; van wandelen tot discussiëren in de kroeg en van in slaap vallen tot mijmeren. Een cruciaal orgaan. En daarom goed opgeborgen, drijvend in schokabsorberende her-
senvloeistof en verpakt in een dikke laag bot, de schedel. Zowel die complexiteit als de grondige verpakking stellen wetenschappers voor een lastig parket. Hoe ontdek je waar het spaak loopt wanneer iemand geheugenproblemen ontwikkelt of wanneer loop of spraak verstoord raken? Even een kijkje nemen, het weefsel betasten of onder de microscoop leggen, gaat zo maar niet. Hersenonderzoekers hebben in de loop van eeuwen een arsenaal aan noodgrepen opgebouwd om toch inzicht te krijgen in het complexe orgaan. Zo worden de hersenen van overledenen onder de loep genomen, maken wetenschappers met behulp van de fMRI-scanner beelden van het levende brein in actie en zijn de genenpakketten van muizen en ratten verbouwd om knaagdieren met bijvoorbeeld alzheimerachtige verschijnselen te creĂŤren en bestuderen. Al die methoden bieden waardevolle inzichten, maar kennen ook tekortkomingen. Zo is de resolutie van de hersenscanner niet hoog genoeg om echt op celniveau te zien wat er gebeurt en is een ziektemodel UMC Utrecht Hersencentrum | New Scientist | 27
brain organoids
voor ALS in een muis uiteindelijk toch niet helemaal hetzelfde als ALS in een mens. Medicatie die in muismodellen van ALS veelbelovend lijkt, blijkt vaak toch niet te werken bij menselijke patiënten.
Kleiner dan echt Promovendus Ormel houdt nu een veelbelovende uitbreidingsset van de wetenschappelijke gereedschapskist tussen zijn vingers. ‘Voor het eerst hebben we een driedimensionale structuur van levend menselijk hersenweefsel in een petrischaaltje, waarmee we de hersenen van een levende patiënt nabootsen en die we op microscopisch niveau kunnen bestuderen,’ aldus de neurowetenschapper. Ook mooi: de organoids zijn ontstaan vanuit het bouwplan dat de cellen zelf in hun DNA bij zich dragen. Ze nemen in zekere mate dus hun natuurlijke vorm aan. Laat er geen misverstand over bestaan: brain organoids zijn geen échte hersenen. Ze zijn niet te gebruiken als vervangend orgaan voor mensen met hersenschade – iets wat in het geval van een labgekweekte blaas bijvoorbeeld wel gebeurt. Je kunt ze ongeveer als volgt zien. Stel je geeft honderd peuters ieder het Duplo-pakket van een ridderkasteel en laat de kinderen daarmee hun gang gaan. De resulterende bouwwerken verhouden zich ongeveer tot het bedoelde kasteel zoals de brain organoids tot het menselijk brein. De een lijkt wat meer dan de ander, maar bij de meeste bouwwerken zijn de belangrijkste elementen wel aanwezig. In de brain organoids zijn bijvoorbeeld de structuren van de hippocampus te zien, een hersengebied betrokken bij leren en navigatie en ook de cortex is zichtbaar, de buitenste hersenschors, verantwoordelijk voor onder meer impulsbeheersing en planning. Maar de hersengebieden zitten niet consequent op de juiste plek en sommige onderdelen ontbreken. Bovendien zijn de organoids vele malen kleiner dan het echte brein. Er lopen geen bloedvaten doorheen en dus is de moeizame verspreiding van voedingsstoffen een beperkende factor voor groei en onderhoud. Zonder die voedselvoorziening naar de binnenste cellen van de organoid blijven de hersentjes relatief klein – al bevatten ze binnen die paar millimeter alsnog miljoenen cellen. Met dagelijkse verzorging overleven ze zo’n tweehonderd dagen in het lab. 28 | New Scientist | UMC Utrecht Hersencentrum
Waardevol venster Ondanks hun geringe omvang bieden de minibreintjes een unieke kans om de dynamiek in hersencellen uit te pluizen. Bijvoorbeeld in het geval van ALS, waarnaar Pasterkamp onderzoek doet. Bij die motorische aandoening sterven de hersencellen die verantwoordelijk zijn voor de aansturing van de spieren. Het gevolg: de patiënt kan steeds minder goed lopen en verliest geleidelijk de kracht in spraak en ademhaling tot hij of zij na een paar jaar overlijdt. Er is een aantal genetische afwijkingen bekend die mensen een sterk verhoogde kans op ALS geven. Maar de grote vraag is: hóé leidt zo’n mutatie tot het afsterven van de aansturingscellen? En hoe zou je dat proces een halt toe kunnen roepen? De vergelijking tussen brain organoids gemaakt van cellen van ALS-patiënten met organoids op basis van gezonde cellen, biedt Pasterkamp een waardevol venster op het ziektemechanisme. Die vergelijking wordt deels gemaakt in een verduisterde kamer, een paar deuren naast het lab met de warmhoudkasten voor de organoids. In het halfduister staan twee grote microscopen, verbonden aan indrukwekkende computerschermen. Op verschillende momenten in de ontwikkeling van de ALS- en controle-organoids nemen Pasterkamp en zijn collega’s de breintjes onder de loep. Stap één daarbij is het ontkleuren. Door de vetten uit het weefsel te onttrekken, verandert de mat roze materie in een doorzichtige, gelatinepuddingachti-
ge substantie. Binnen die doorzichtige weefsels kleuren de onderzoekers alleen die cellen aan waarin ze geïnteresseerd zijn, bijvoorbeeld alle microglia, de opruimcellen van de hersenen. Vervolgens leggen ze de organoids onder een microscoop, die in de loop van uren laagje voor laagje het weefsel scant en al die laagjes vervolgens digitaal op elkaar plakt tot een 3D-afbeelding van het organoid in extreem hoge resolutie. Op die afbeeldingen zoomen de onderzoekers in: wat gebeurt er in het weefsel op celniveau? Hoe zien bijvoorbeeld de synapsen, de contactpunten tussen hersencellen, eruit? Zijn die nog intact of worden die aangevallen door de opruimcellen in het brein, zoals bij ALS lijkt te gebeuren? Parallel daaraan analyseren de wetenschappers wat er intern gebeurt in de hersencellen. Worden er bepaalde genen afgelezen voor de productie van eiwitten wanneer het spaak loopt in de ALS-organoid? Genen die niet actief zijn in de gezonde organoids? Pasterkamp: ‘Als we aan de ene kant ongeregeldheden zien in de 3D-opnames van de ALS-organoids en anderzijds afwijkingen in de eiwitproductie in die organoids, dan krijgen we een idee van de moleculaire mechanismen die ten grondslag liggen aan de verstoringen op celniveau.’
Aanpakken Met de afwijkende eiwitten die Pasterkamp op die manier identificeert, moet je een beetje mazzel hebben, vertelt hij. ‘Soms
zijn dat eiwitten waar je de functie van kent. En een enkele keer blijkt dat een functie te zijn waarvan je ook al weet hoe je daarop in kunt grijpen. Als de afwijkende eiwitten bijvoorbeeld een rol spelen in het besturen van de ion-kanalen die bepalen of een zenuw geactiveerd raakt, dan kun je daar meteen met anti-epileptica op ingrijpen.’ Dat brengt de hoogleraar tot het volgende wondertje van de organoids. In plaats van het opzetten van dure en riskante medicijnonderzoeken bij echte patiënten, kun je een potentieel nieuw medicijn eerst testen op de organoids in het petrischaaltje. Gaan die zich ‘normaler’ gedragen wanner je wat anti-epileptica in hun badje druppelt? Pasterkamp: ‘Je kunt meteen zien wat het effect van medicatie is. Dat kan een indicatie geven welke stoffen de moeite van verder onderzoek bij mensen waard zijn.’ Ook voor onderzoek naar psychische stoornissen bieden organoids soelaas. Hoogleraar gliabiologie Elly Hol heeft zich toegelegd op het ondergeschoven kindje in het brein: de gliacellen. Deze cellen zijn
net zo talrijk als zenuwcellen, maar vielen oorspronkelijk minder in de smaak bij hersenonderzoekers omdat hun activiteit moeilijker meetbaar is. Hun naam alleen al is omineus; glia is oud-Grieks voor ‘lijm’, lang werden ze gezien als het cement dat de hersencellen ondersteunt. Inmiddels blijkt dat ze wel degelijk een actieve rol spelen. Ze doen mee in de chemische communicatie tussen cellen, helpen signaaloverdracht versnellen en zijn verantwoordelijk voor het opruimen van afvalstoffen. Hol vermoedt dat de cellen een cruciale rol spelen in alzheimer, waar ze het gros van haar onderzoek aan wijdt, en in schizofrenie, waar ze een onderzoeksuitstapje naar maakt als begeleider van het promotieonderzoek van onder andere Paul Ormel. Bij de complexe ontwikkelingsstoornis schizofrenie staan gliacellen onder verdenking. Schizofreniepatiënten hebben periodes van ernstig verstoord waarnemen en denken, ze horen bijvoorbeeld stemmen die hun handelen becommentariëren. Dat zou weleens samen kunnen hangen met
verstoring van een van de wonderlijke vormingsprocessen in het brein. Tijdens leren en ontwikkeling in de jeugd ontstaan talloze verbindingen tussen hersencellen. Die verbindingen zijn een soort probeersels van het brein. Sommige blijken zinvol – ze helpen bijvoorbeeld bij het nieuw aangeleerde oplossen van differentiaalvergelijkingen – worden vaker gebruikt en beklijven. Andere blijken weinig nut te hebben, raken in onbruik en worden tenslotte ‘gesnoeid’ door de opruimerige microglia. Bij schizofreniepatiënten blijken veel verbindingen verdwenen. Wellicht wordt dat veroorzaakt door overijverige opruimcellen die – misschien als gevolg van miscommunicatie – te veel verbindingen wegsnoeien en een soort kortsluiting veroorzaken, is de gedachte. Analoog aan het uitpluizen van de verschillen tussen brain organoids van ALS-patiënten en gezonde mensen, doen Hol en Ormel eenzelfde verkenning naar de verschillen op cel-, gen- en eiwitniveau die te zien zijn tussen organoids van patiënten met schizofrenie en die van gezonde mensen.
UMC Utrecht Hersencentrum | New Scientist | 29
Dit doen zij Van samenwerken met patiënten tot onderzoek op celniveau: het UMC Utrecht Hersencentrum heeft een rijke variatie aan wetenschappers. Allemaal zijn ze op zoek naar de allerbeste antwoorden op hun vragen, zoals ook deze vier gedreven onderzoekers. Door Aafke Kok Beeld: Bram Belloni
30 | New Scientist | UMC Utrecht Hersencentrum
Frank Meye Translationele neurowetenschappen
Breinverandering bij vreetbuien Als reactie op stress gaan mensen, maar ook dieren, veel suiker en vet eten. ‘Vooral bij obesitas, eetstoornissen en mensen met impulsief gedrag zoals bij ADHD vormen vreetbuien een pro bleem,’ aldus Frank Meye. De behoefte aan ‘slecht’ eten gaat gepaard met ver anderingen in de communicatie tussen verschillende hersengebieden die betrokken zijn bij de verwerking van beloning. Dat is wat Meye onderzoekt. Daarvoor gebruikt hij muizen die aan sociale stress onderworpen zijn en daar door vreetbuigedrag vertonen. Van die muizen bekijkt Meye het hersenweefsel. Met behulp van elektrodes meet hij daarin de elektrische signalen waar zenuwcellen mee communiceren. Hoe meer ze communiceren, hoe sterker de verbinding. Meye kijkt naar verschillen in die verbindingssterkte tussen gestreste muizen en controlemuizen. Hij bestu deert bijvoorbeeld verbindingen met dopamineneuronen, een belangrijke groep cellen in het beloningscircuit van het brein. Vervolgens kan Meye in levende mui zen specifieke zenuwcellen aansturen en dan het eetgedrag van muizen bestuderen. Dat doet hij met opto- of chemogenetica, waar mee hij zenuwcellen ‘aan’ of ‘uit’ zet door respectievelijk licht of speciale virussen. Zo probeert hij de link tussen veranderin gen in het brein en vreetbuigedrag te achterhalen. Uitein delijk hoopt hij hiermee te begrij pen hoe we die hersenveranderin gen tegen kunnen gaan, om zo vreetbuien te verminderen.
Natalia Petridou Beeldvormingstechnieken
Begrip van fMRI
Marjolijn Ketelaar Revalidatiegeneeskunde
Samen met patiënten Voor een onderzoek rond cerebrale parese (CP), een aangeboren hersenbeschadiging, betrok Marjolijn Ketelaar twaalf tieners met CP als ambassadeurs bij haar studie. Zij dachten bijvoorbeeld mee over onderzoeksvragen – patiënten hebben vaak een heel andere kijk op wat echt belangrijk is in het onderzoek naar hun ziekte. Ketelaar keek met haar team onder andere naar problemen van jon geren met CP in het onderwijs. Naast wetenschappelijke publicaties leidde dat ook tot producten die ze samen met de jongeren maakte, zoals een poster voor docenten met uitleg over CP, om onbegrip over de ziekte weg te nemen. Dat is nou echte patiëntparticipatie, niet zomaar een vinkje op een checklist van onderzoekers. ‘Echt samenwerken met patiënten, van begin tot eind, leidt tot veel beter onderzoek,’ aldus Ketelaar. Ze probeert het belang van patiëntparti cipatie ook bij haar collega’s door te laten dringen. Zo droeg ze bij aan de ontwikkeling van een hulpmiddel voor onderzoekers om gewenste betrokken heid in elke stap van het onderzoek te bespreken. Ook organiseerde ze een congres met steeds niet één maar twee voorzitters: een onderzoeker of arts naast een patiënt, of ouder van een patiënt. Daardoor blijft de vraag ‘voor wie doen we het eigenlijk?’ centraal staan.
Om de werking van de hersenen te begrijpen, maken veel onderzoekers gebruik van fMRI-scanners. In de plaatjes die ze daarmee maken lichten hersenge bieden die actief zijn op. Ook in de kliniek wordt deze techniek veelvuldig gebruikt. ‘Maar fMRI meet de activiteit van de hersenen op een indirecte manier,’ aldus Natalia Petridou. Eigenlijk meet je er de eigenschappen van bloed doorstroom in hersendelen mee. Het idee is dat die bloeddoorstroom verband houdt met de activatie van zenuwcellen. Die hebben immers zuurstof uit het bloed nodig om iets te kunnen doen. ‘Maar hoe die koppeling tussen bloed en zenuwcellen precies werkt, is niet bekend,’ zegt Petridou. Zij hoopt dat uit te vinden. Ze bouwt modellen die moeten voor spellen hoe bepaalde hersengebieden werken. Die modellen test ze vervolgens uit. Daarvoor gebruikt ze de 7 Tesla MRI-scanner, een scanner met een supersterk magneetveld. Petridou ont wikkelt methodes om daarmee zeer gedetailleerde plaatjes van het brein te maken. Daarnaast gebruikt ze speciale camera’s om heel precies veranderingen in de bloedbaan te bestuderen. Ook doet ze metingen met elektrodes in het brein. Uiteindelijk hoopt Petridou hier mee de link tussen bloed en zenuwcel len te begrijpen, en haar bevindingen in te zetten voor beter gebruik van fMRI.
Jan Veldink Neurogenetica
Gentherapie Jan Veldink ziet als arts wekelijks ALS-patiënten. ‘Nu is hun levensver wachting drie tot vijf jaar, en het huidige medicijn kan dat tot maximaal zes maanden verlengen,’ zegt Veldink. Dat hoopt hij te veranderen met zijn onder zoek. Het met crowdfunding opgerichte Project Mine brengt DNA van 22.500 patiënten in kaart. De teller staat nu op 10.000. Door DNA te vergelijken, vonden onderzoekers nu al vijf nieuwe plekken in het DNA die betrokken zijn bij het ontstaan van ALS. Dat kan een insteek zijn voor nieuwe behandeling, zoals gentherapie. Daarbij richten medi cijnen zich op het eiwit van een gen dat uit het onderzoek naar voren komt, of blokkeren zo’n gen direct. Maar ALS ontstaat niet alleen door genetische afwijkingen. Daarom kijkt Veldink ook naar het omhulsel van DNA, waar levensstijlfactoren als dieet en stress invloed op hebben. Op basis van het DNA-omhulsel kan Veldink ALSpatiënten in nieuwe subgroepen indelen en zo de interactie met levensstijl mee nemen. De aanknopingspunten voor nieuwe therapieën zijn veelbelovend, maar om dat deze therapieën een kleine subgroep van patiënten bedienen, is het lastig bedrijven te vinden voor verdere ontwik keling. Toch blijft Veldink hoopvol, ‘vooral vanwege de enorme stijging in aandacht voor ALS van de laatste jaren.’ UMC Utrecht Hersencentrum | New Scientist | 31
Brein in beeld Het brein is ons ingewikkeldste en minst begrepen orgaan. Dat maakt het bijna verbazingwekkend dat het bij de meeste mensen prima functioneert. Toch kan er ook veel misgaan. Gelukkig hebben we tegen woordig MRI-scanners waarmee we het brein tot in detail kunnen bekijken. MRI-scans zijn onmisbaar bij het achterhalen of alzheimer, vaatschade of een combinatie van beide achter dementieklachten schuilgaat. BRAM BELLONI
Door Joris Janssen
H
ij staat in een speciale vleugel van het UMC Utrecht: een van de krachtigste MRI-scanners ter wereld in een klinische omgeving ‒ een omgeving waar patiënten er direct mee geholpen kunnen worden, in tegenstelling tot een pure onderzoeksomgeving. Voor twee neurologen is dit apparaat een zegen voor hun onderzoek. Geert Jan Biessels onderzoekt er patiënten mee die dementie hebben als gevolg van schade aan kleine bloedvaatjes in de hersenen. Kees Braun gebruikt de scanner bij de behandeling van kinderen en volwassenen met moeilijk behandelbare epilepsie. Twee verschillende takken van sport, met als overeenkomst dat technologische vooruitgang bij het in beeld brengen van de hersenen betere behandelingen belooft. Wie denkt aan dementie, denkt al gauw aan de ziekte van Alzheimer. Bij deze ziekte brengen ziekmakende eiwitten schade toe aan de hersenen, waardoor onder meer geheugenproblemen ontstaan. Vaak is dit echter maar een deel van het verhaal. Bij negen op de tien mensen die op latere leeftijd alzheimer ontwikkelen, speelt nog een ander probleem mee: schade aan kleine haarvaatjes in de hersenen. Soms is dit 32 | New Scientist | UMC Utrecht Hersencentrum
soort vaatschade zelfs de hoofdschuldige achter dementie-achtige symptomen. In dat geval krijgen patiënten de diagnose vasculaire dementie. Alles bij elkaar genomen is vaatschade verantwoordelijk voor grofweg een derde van alle dementieklachten. De helft komt door alzheimerachtige processen en het overige deel komt voor rekening van een vergaarbak aan andere aandoeningen. Hoewel het niet de bekendste vorm is, hebben heel veel mensen met dementie dus in meer of mindere mate te maken met de vasculaire variant.
Kleine vaatjes ‘Het onderzoek naar dementie door vaatschade loopt enorm achter ten opzichte van het onderzoek naar dementie door alzheimer,’ zegt Geert Jan Biessels, hoofd algemene neurologie en leider van de onderzoeksgroep Vascular Cognitive Impairment aan het UMC Utrecht. ‘Dat is zonde, want de kans om er iets aan te doen, is heel reëel.’ Deze achterstand is voor een deel het gevolg van achterblijvende investeringen, maar er is ook een praktische oorzaak. Tot voor kort was het onmogelijk om de boosdoeners achter de aandoening goed in beeld te brengen: de kleine haarvaatjes die het brein van bloed voorzien. Schade aan deze vaatjes tast de verbindingen in de
Schade aan kleine haarvaatjes in de hersenen is verantwoordelijk voor grofweg een derde van alle dementieklachten. BRAM BELLONI
hersenen aan, waardoor het ‘glasvezelnetwerk’ van het brein niet meer lekker werkt. ‘Vergelijk het met het streamen van een serie of film op Netflix, terwijl je een trage verbinding hebt,’ legt Biessels uit. ‘Bij mensen met deze vorm van dementie is het niet zo dat ze heel veel fouten maken of dingen echt niet meer weten, het kost alleen veel meer tijd om de informatie op te halen.’ Scans die uit de gemiddelde MRI-scanner komen rollen, zijn niet gedetailleerd genoeg om de kleine haarvaatjes in de hersenen te kunnen weergeven, laat staan afwijkingen of schade in deze vaatjes. Het enige dat deze scans tonen is het gevolg van de schade: vlekken in het glasvezelnetwerk door kleine bloeduitstortinkjes of herseninfarctjes. Dit brengt twee grote beperkingen met zich mee. Zo kunnen de vlekken ook een andere oorzaak hebben dan schade aan de kleine bloedvaten. Puur en alleen de aanwezigheid van vlekken hoeft dus helemaal niet te betekenen dat iemand daadwerkelijk vasculaire dementie heeft. Daarnaast betekent het dat je de aandoening pas in zijn eindstadium kunt aantonen, wanneer die al veel schade heeft aangericht. Het in beeld brengen van de kleine haarvaatjes in de hersenen kan helpen bij het sneller aantonen van het probleem en kan fundamenteel onderzoek mogelijk maken naar manieren om de ziekte in een vroeg stadium aan te pakken.
UMC Utrecht is uniek En dit is waar de krachtige 7 Tesla MRIscanner om de hoek komt kijken. Een MRI-scanner maakt plaatjes van structuren in het lichaam door met een sterk magnetisch veld en radiopulsen waterstofatomen in beweging te brengen. Wanneer de atomen vervolgens tot rust komen, geven ze een signaal af. Dit signaal kun je opvangen en omzetten in een plaatje. Verschillende soorten weefsel in het lichaam bevatten verschillende hoeveelheden waterstofatomen. Dit creëert een contrast, waardoor je op de plaatjes het verschil kunt zien tussen bijvoorbeeld bloed, vet en orgaanweefsel. Hoe sterker de magneet, hoe sterker het contrast dat je ermee kunt bereiken. De sterkte van een magneet wordt aangegeven in Tesla. De meeste MRI-scanners in ziekenhuizen hebben een magneet van 1,5 of 3 Tesla. De magneet in de MRI-scanner van het UMC Utrecht is een tikkeltje sterker.
Die heeft een sterkte van, zoals de naam al doet vermoeden, 7 Tesla. Toen het UMC Utrecht de scanner in 2007 kreeg, bestonden er wereldwijd maar twintig van deze apparaten. Inmiddels is dat aantal iets gestegen, maar de meeste van deze scanners staan in onderzoeksinstituten. De MRIscanner in Utrecht is uniek vanwege zijn sterkte én omdat hij in een klinische omgeving staat, waardoor inmiddels al heel veel patiënten met de scanner zijn onderzocht. Met een vele malen sterkere magneet kun je contrasten zien die anders onzichtbaar blijven. ‘We kunnen nu ineens de doorbloeding zien van hersenvaatjes zo dun als een wenkbrauwhaar,’ zegt Biessels. ‘We kunnen zien hoe de doorbloeding varieert tijdens de hartcyclus en daarmee hoe stijf de vaatjes zijn.’ Door dit grotere contrast kunnen Biessels en zijn collega’s voor het eerst de link leggen tussen de beschadigingen die op andere scans te zien
‘We kunnen ineens de doorbloeding zien van hersenvaatjes zo dun als een wenkbrauwhaar’ zijn en onderliggende afwijkingen in de kleine haarvaatjes. ‘We kunnen de ziekte van de vaatjes nu voor het eerst beschrijven in termen van die vaatjes zelf.’ Op dit detailniveau het brein onder de loep kunnen nemen, is een uitkomst voor veel meer hersenaandoeningen dan alleen vasculaire dementie. Ook voor hoogleraar kinderneurologie Kees Braun is het een uitkomst. Hij behandelt kinderen met zogeheten moeilijk behandelbare epilepsie en onderzoekt hoe betere beeldvorming van het brein kan helpen bij een efficiëntere behandeling. Epilepsie is een aandoening waarbij ongewild en aanvalsgewijs elektrische ontladingen ontstaan in zenuwcellen in de hersenen. Het resultaat is een soort kortsluiting, die onder meer kan leiden tot schokken, verminderd bewustzijn en problemen met praten of met zien, afhankelijk van waar in het brein de kortsluiting optreedt. In grofweg twee derde van de gevallen kunnen medicijnen de symptomen bijna helemaal wegnemen. Voor het andere deel van de patiënten bieden medicijnen geen soelaas. Deze patiënten krijgen de UMC Utrecht Hersencentrum | New Scientist | 33
mri-scanner
Het menselijk oog alleen is niet meer genoeg voor het interpreteren van hersenscans. Slimme software helpt artsen en onderzoekers bij deze lastige taak.
diagnose ‘moeilijk behandelbare’ epilepsie, de variant waar Braun en zijn collega’s zich vooral op focussen.
Kwetsbaarheid Een mogelijke oplossing voor patiënten met moeilijk behandelbare epilepsie is het ondergaan van een operatie. Als je weet waar de bron van de aanvallen zit, kun je die bron verwijderen of ontkoppelen van de rest van het brein, mits de bron niet in een hersengebied zit dat zo belangrijk is dat de neurochirurg er beter vanaf kan blijven. In sommige, ernstige gevallen kunnen chirurgen bij jonge kinderen zelfs een hele hersenhelft ontkoppelen. Een voorwaarde voor dit soort operaties is dat de bron van de epilepsie lokaal is. Er moet heel duidelijk een specifiek hersengebiedje aan te wijzen zijn waar het probleem zit. Als er door het hele brein ongewilde elektrische ontladingen voorkomen, bijvoorbeeld door een genetische aanleg, heeft een operatie geen zin. Een lokale bron van elektrische ontladingen kan verschillende oorzaken hebben. ‘Het kan bijvoorbeeld een tumor zijn, een infarct, een litteken, een ontsteking of een aanlegfoutje – een stukje niet goed aangelegde hersenschors,’ zegt Braun. ‘Dan kan een operatie helpen. Het kunnen stellen van zo’n diagnose is dus heel belangrijk. Beeldvorming met een MRI-scanner is daarbij cruciaal.’ Hoe beter scans het probleemgebied kunnen visualiseren, hoe groter de kans 34 | New Scientist | UMC Utrecht Hersencentrum
van slagen van een operatie. Dat geldt vooral voor aanlegfouten van de hersenschors, een aandoening die in medische termen focale corticale dysfasie heet. ‘De technieken om die plaatselijke kleine afwijkingen zichtbaar te maken, zijn de afgelopen decennia steeds beter geworden,’ zegt Braun. ‘We kunnen daardoor een steeds betere selectie maken van mensen die in aanmerking komen voor een operatie. We boekten al mooie vooruitgang met de vorige generaties scanners, maar ons onderzoek laat zien dat de detectiekans met de 7 Tesla-MRI-scanner met nog eens 20 procent toeneemt.’ Zowel voor het epilepsieonderzoek van Kees Braun als het dementieonderzoek van Geert Jan Biessels geldt echter dat krachtiger scanners maar een deel van het verhaal zijn. Een groot deel van de vooruitgang zit hem ook in het slimmer kijken naar de scans. In het onderzoek van Braun zorgen nieuwe statistische technieken er bijvoorbeeld voor dat computers steeds beter afwijkingen in het brein kunnen aanwijzen. Braun: ‘Een computer kan de scan van een patiënt vergelijken met de scans van een grote groep gezonde mensen en toont dan de gebieden in het brein van de patiënt die significant anders zijn dan die van de controlegroep. Zo kan de computer je een afwijking laten zien die je met het blote oog gemist had.’ Ook het veld van de vasculaire dementie heeft veel baat bij het statistisch combine-
Een groot deel van de vooruitgang zit hem ook in het slimmer kijken naar de scans
ren van grote hoeveelheden gegevens. Biessels hoopt dat een mede door hem opgestart internationaal samenwerkingsproject binnenkort de eerste ‘kwetsbaarheidskaart’ van de hersenen oplevert. Hierin zijn de gegevens van zo’n duizend patiënten uit Azië en Europa gecombineerd tot een kaart die aangeeft hoe groot de gevolgen zijn van schade in specifieke plekken in het brein. ‘Voorheen keken we alleen naar de totale hoeveelheid schade, maar dat is te simpel. Een beschadiging op kritieke punten heeft veel grotere gevolgen. Met die kaart kunnen we straks zien op welke plekken schade de meeste impact heeft.’
Platform ontwikkelen Ook statistische technieken uit – gek genoeg – de hoek van elektriciteitsbedrijven zorgen voor een betere kijk op de staat van iemands brein. Biessels: ‘Die bedrijven zijn erg geïnteresseerd in wat er gebeurt als er bijvoorbeeld een vrachtwagen tegen een elektriciteitsmast aanrijdt. Ligt het hele netwerk dan op zijn gat, of niet? Er zijn allerlei maten ontwikkeld die aangeven hoe robuust en efficiënt een netwerk is. Die kunnen wij hier ook toepassen, om te kijken hoe het met hersennetwerken gesteld is.’ In het onderzoek met hersenscans zijn steeds meer disciplines betrokken en zien steeds meer internationale samenwerkingsverbanden het levenslicht. ‘We duwen de scanner echt tot zijn grenzen,’ zegt Biessels. ‘Dat levert zo veel gegevens op dat je ze met het blote oog niet meer kunt beoordelen. Je zit zo op de grens van de menselijke waarneming, dat je computertechnologie nodig hebt om de scans betekenisvol te maken. Behalve een klinisch team dat bezig is met de patiënt, werken we daarom
opinie column Jim van Os Voorzitter divisie Hersenen UMC Utrecht
Oppassen ja, maar het zijn mooie dingen
E samen met een team natuurkundigen dat kan lezen en schrijven met die machine en met een team computerwetenschappers dat helpt bij de interpretatie van de gegevens. Bovendien maken we onderdeel uit van een internationaal netwerk waarin veel kennis wordt gedeeld.’ Ook in het onderzoeksveld van moeilijk behandelbare kinderepilepsie is internationale samenwerking belangrijk. Braun is trots op de coördinerende rol die het UMC Utrecht heeft in het Europese Referentie Netwerk (ERN) EpiCARE, dat zich bezighoudt met complexe en zeldzame epilepsievormen. ‘Hierin ontwikkelen we onder meer een standaard voor de beeldvorming bij epilepsie, zetten we een internationaal panel op van onderzoekers dat ingewikkelde scans online gaat beoordelen en willen we een platform ontwikkelen waarmee ook andere Europese centra gebruik kunnen gaan maken van de beste statistische methoden bij het interpreteren van scans.’ De toekomst van beeldvorming in het hersenonderzoek is er een van uitzoomen en inzoomen. Op grote schaal komen steeds meer verschillende vormen van expertise bij elkaar en is er steeds meer gelegenheid voor experts om hun kennis op internationaal niveau te delen. Die experts kunnen dan weer bogen op de vooruitgang op kleine schaal, waarop sterkere magneten een steeds beter beeld geven van ons brein. Kleine afwijkingen in het brein ontsnappen steeds minder vaak aan de vele ogen die inmiddels bij elke scan, direct of indirect, meekijken. Dit opent de deur naar een persoonlijke behandeling voor elke patiënt, gebaseerd op de oorzaak van zijn of haar aandoening. ‘We kunnen ons eindelijk gaan richten op de kern van de ziekte in plaats van op het eindstadium,’ concludeert Biessels.
en ervaren epidemioloog kan op basis van een onderzoek met duizend mensen, gebruikmakend van eenvoudige tabulaties, een heel eind komen in het voorspellen van, bijvoorbeeld, mortaliteit in een cohort study bij oudere mensen. Dit is een vorm van machine learning waarbij de relatieve human-tomachine-decision-making-effort nog vrij zwaar leunt op het humane. Anders wordt het bij de toepassing van een zogenaamd neuraal netwerk ‘deep learning’-algoritme dat met minimale menselijke input diabetische retinopathie leerde ontdekken in ‘big data’-opnamen van de retina bij ongeveer een miljoen mensen. Om maar te zwijgen van Google, dat een neuraal netwerk ontwikkelde dat zonder enige menselijke hulp het spel Go leerde spelen. eHealth is een empowerende vorm van elektronische dataverzameling die het mogelijk maakt dat mensen als het ware hun eigen dokter worden. Gezondheidsparameters als hartritme, spiertonus, hersengolven, bloeddruk, bloedsuiker, optimisme en darmperistaltiek kunnen door de persoon zelf continu worden gemonitord in het kader van diagnose, behandeling en prognose van ziekte. eHealth zal zo een majeure bron van big data worden in de gezondheidszorg, die uit de elektronische medische dossiers kan worden gehaald. Zo werden in Israël de elektronische medicatievoorschriften van ongeveer 750.000 patiënten bij elkaar gebracht en onderzocht met een algoritme dat speurde naar onregelmatigheden. Bij 15.000 patiënten werden – mogelijk levensgevaarlijke – fouten gedetecteerd. De volgende stap: een nationaal big data systeem dat in real time het voorschrijfgedrag
van artsen analyseert en controleert. Grote Amerikaanse zorgverzekeraars als Geisinger en Kaiser Permanente zijn zich aan het heruitvinden als DNA grootaandeelhouders die de genetische variatie van miljoenen klanten analyseren in relatie tot hun elektronische dossiers. Over vijf jaar hebben wellicht 250 miljoen mensen wereldwijd hun DNA hebben gedeponeerd in dergelijke analyseerbare databases. Wordt u zenuwachtig bij de gedachte aan zoveel ‘big datageweld’? Terecht. Maar er kunnen ook goede dingen uit voortkomen, als we samen regels hanteren die veilig gebruik mogelijk maakt.
Wordt u zenuwachtig bij de gedachte aan zoveel ‘big datageweld’? Terecht
MARTIN OUDSHOORN
UMC Utrecht Hersencentrum | New Scientist | 35
Steun ons unieke expertisecentrum We weten nog lang niet alles over hersenziekten, daar is nog veel wetenschappelijk onderzoek voor nodig. In het UMC Utrecht Hersencentrum werken de beste professionals op het gebied van zorg en onderzoek samen om behandelmogelijkheden te verbeteren. Help mee en steun hun onderzoek! VriendenUMCUtrecht.nl/hersencentrum