
10 minute read
Salive – moyen de diagnostic d’avenir

Prof. Dr Hady Haririan Vienne
Fonctions physiologiques de la salive Avec environ 11,5l/jour, l’être humain produit une quantité considérable d’un liquide corporel qui remplit diverses fonctions. La majeure partie de la salive est produite dans les glandes salivaires appariées, à savoir la glandula parotis, la glandula submandibularis et la glandula sublingualis. Or, de nombreuses petites glandes salivaires de la muqueuse buccale contribuent également à la production de salive. La salive est principalement utilisée pour humidifi er les muqueuses, pour faire glisser les aliments lors de la déglutition ou pour les prédigérer. La salive agit également comme tampon, protégeant les dents de l’acide, et évacue mécaniquement les bactéries et leurs produits métaboliques.
Débit salivaire Un excès de salive fait désespérer les professionnels dentaires lorsqu’il s’agit de créer des conditions sèches pour les restaurations, mais ne constitue pas un problème par ailleurs. Cependant, une production excessive de salive peut être due à un refl ux ou à des facteurs locaux tels que des prothèses mal ajustées. Pour déteminer le débit salivaire au repos, la procédure Navazesh (1) peut s’appliquer par exemple: le patient doit s’asseoir droit, les yeux ouverts et la tête légèrement inclinée vers le bas, et laisser couler la salive dans un gobelet gradué (de préférence muni d’un entonnoir). L’opération dure 5 minutes et les patients ne doivent pas déglutir. La quantité recueillie peut être lue en ml et divisée par 5 pour calculer le débit de salive au repos par minute (tableau 1).
La sécheresse de la bouche a de nombreuses origines Si les patients se plaignent de sécheresse buccale, d’une langue collante et brûlante et de problèmes de mastication en présence d’aliments secs, il y a une forte probabilité qu’une xérostomie en soit à l’origine. Les causes de la xérostomie sont complexes, il est donc important de les rechercher dans l’anamnèse. Si les patients ont également les yeux secs, une maladie autoimmune, le syndrome de Sjögren par exemple, peut en être la cause. Dans la plupart des cas, cependant, ce sont des médicaments comme les antidépresseurs ou les antihypertenseurs qui limitent l’écoulement de la salive, en particulier chez les patients âgés (tableau 2), en plus des patients qui subissent une radiothérapie de la tête et de la gorge. L’irrigation et les sprays peuvent améliorer la situation, mais ne constituent généralement qu’un remède à court terme. Récemment, les comprimés adhésifs qui sont introduits dans le
Salive Physiologique
Oligosialie (fl ux salivaire restreint) 0,3 ml/min 0,5 ml/min

Xerostomie (fl ux salivaire très restreint)
Médicaments Maladies systémiques Maladies des glandes salivaires
Antiasthmatiques Antiacides Antihypertenseurs
Psychopharmaceutiques Syndrome de Sjögren
Sclérodermie Sarcoïdose Lupus

Démence Déshydratation Oreillons
Parotidite Calculs salivaires Mucocèles Déplacement des canaux salivaires Tumeurs
Tableau 2: Principales causes de la baisse du début salivaire/de la sécheresse buccale.
Autres causes

Dépression Etats anxiogènes Stress Radiothérapie
vestibule et qui libèrent du xylitol et du carbonate de calcium sur une longue période semblent prometteurs.
Diagnostic salivaire en général La salive est déjà utilisée comme moyen de diagnostic dans de nombreux domaines, en particulier en criminologie, où l’ADN est déterminé à partir des résidus de salive sur les cigarettes jetées ou les verres trouvés sur les lieux du délit. La présence de drogues est également déterminée sur ces échantillons. La méthode s’emploie déjà couramment pour la détection d’amphétamines ou de cocaïne (2). En médecine humaine, le diagnostic salivaire est déjà utilisé pour la détection précoce de diverses tumeurs telles que le cancer du sein, le cancer intestinal ou le cancer épidermoïde (3). La nature non invasive du diagnostic salivaire par rapport aux échantillons de sang peut également être mise à profi t pour le dépistage du VIH, comme au moyen du test Ora Quick® disponible dans le commerce, avec sensibilité et spécifi cité élevées. Ce test s’emploierait également pour les professionnels de la médecine et des soins dentaires, par exemple après une blessure par piqûre de seringue.
La salive comme milieu de transmission des microorganismes Pour les professionnels de la médecine et des soins dentaire, la salive dans les aérosols est une source potentielle d’infection. Par exemple, le virus d’EpsteinBarr, la tuberculose, les méningocoques, l’Helicobacter pylori, la syphilis et l’herpès peuvent être transmis. Chez les patients, en particulier ceux qui présentent une parodontite, la question de savoir si le partenaire peut encore être embrassé est toujours posée. Comme pour les caries, les bactéries seules ne suffi sent pas à rendre malade. Le contrôle personnel de la plaque dentaire, les habitudes alimentaires et le système immunitaire peuvent les tenir en échec ou créer un environnement favorable aux caries ou aux bactéries parodontales et à leur virulence. Un groupe de recherche hollandais a montré que seuls des baisers intimes avec la langue, au moins 9 fois par jour pendant 10 secondes, conduisaient à une population plus importante de bactéries échangées. On estime qu’environ 80 millions de bactéries sont échangées avec le partenaire au travers d’un baiser avec la langue (4).
Diagnostic de la salive dentaire En médecine dentaire, le recours au diagnostic salivaire reste encore très accessoire. De simples tests d’évaluation du risque de caries par détermination des bactéries n’ont pas réellement fait de percée et ne sont guère utilisés dans la pratique. Depuis des années, il n’existe qu’un seul un test aMMP8 pour la parodontite qui, selon une déclaration de 2015 de la Société allemande de médecine buccodentaire DGZMK/DGParo, serait plutôt indiqué dans une autre discipline que la médecine dentaire, hante les étagères. Selon les connaissances actuelles, le diagnostic clinique à l’aide d’une sonde parodontale ne sera toujours pas remplacé par un tel test.
Futurs tests salivaires envisageables pour la parodontite Des études cliniques ont montré que la détermination des bactéries, par exemple les germes parodontopathogènes via la salive, a du poten
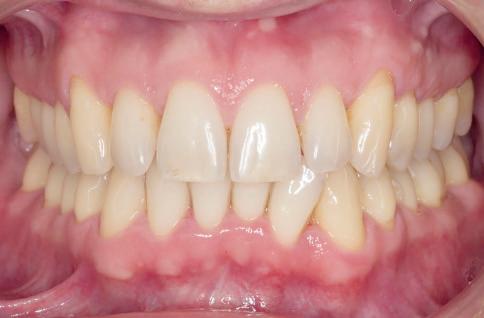


2
Photo 1 et 2: Patient avec parodontite de stade
III, grade C. Bien que le patient soit allé régulièrement en prophylaxie, la parodontite n’a longtemps pas été diagnostiquée. Un test salivaire aurait permis de sensibiliser davantage le patient. En médecine dentaire, l’évaluation de l’ISP et le traitement consécutif de la parodontite auraient pu prévenir la perte massive d’attachement à un stade précoce.
© MedUni Wien
tiel et pourrait être pertinente à l’avenir en combinaison avec d’autres biomarqueurs de la salive pour le diagnostic parodontal (5). En raison de la multiplicité des facteurs de maladie parodontale, les preuves scientifi ques suggèrent qu’un certain nombre de marqueurs salivaires potentiels de la parodontite soient combinés, car il semble peu probable qu’un seul marqueur puisse distinguer les patients sains des patients affectés. Ces «biomarqueurs candidats» pour le dépistage de la parodontite vont des médiateurs infl ammatoires aux peptides antimicrobiens trouvés en concentrations élevées dans la salive chez les patients souffrant de parodontite. Les marqueurs salivaires possibles de la parodontite sont, par exemple, MIP1 alpha, l’interleukine1 beta ou l’interleukine6 (6). Les enzymes sécrétées par les granulocytes neutrophiles semblent aussi prometteuses que les marqueurs du métabolisme osseux (7, 8). La calprotectine et le peptide intestinal vasoactif pourraient également faire partie du groupe de biomarqueurs pour la détection et le suivi des maladies parodontales (9, 10).
La salive ne doit pas tomber entre de mauvaises mains Dans de nombreux pays, il est possible de faire effectuer des tests d’évaluation du risque afi n de calculer les probabilités de maladies en utilisant un échantillon de salive. De tels tests existent également pour découvrir l’origine de ses ancêtres. Des renseignements génétiques qui pourraient comporter des informations de nature délicate sont ainsi collectés. Par exemple, une prédisposition génétique à certaines maladies peut être calculée – des informations qui, si elles étaient entre les mains d’un futur employeur ou d’une compagnie d’assurance maladie privée, pourraient conduire au refus d’un contrat de travail ou d’un contrat d’assurance pour la personne concernée. Ce risque de discrimination a été réglementé aux ÉtatsUnis dans la loi appelée «Genetic Infor mation Non discrimination Act (GINA)», qui vise à protéger la population contre l’utilisation abusive de ses informations génétiques.
Conclusion Le diagnostic salivaire en tant que méthode non invasive est déjà couramment utilisé dans divers domaines. Qu’il s’agisse d’analyses médicolégales, de tests de dépistage de drogues ou du calcul de la probabilité d’une maladie et, en fi n de compte, d’enregistrement dans diverses bases de données de donneurs pour des greffes de moelle osseuse. La médecine dentaire s’est fortement orientée au cours du siècle dernier vers la noninvasivité et des diagnostics plus précis. Reste à espérer qu’à l’avenir le diagnostic salivaire jouera un rôle croissant dans la détection précoce des maladies générales (tumeurs, diabète) comme dans la détection des maladies buccodentaires (parodontites, cancers).

3


BIBLIOGRAPHIE
1. Navazesh M, Kumar SK, University of Southern California School of D. Measuring salivary fl ow: challenges and opportunities. J Am Dent Assoc. 2008;139 Suppl:35S40S. 2. Drummer OH. Drug testing in oral fl uid. Clin Biochem Rev. 2006;27(3):14759. 3. Li Y, St John MA, Zhou X, Kim Y, Sinha U, Jordan RC, et al. Salivary transcriptome diagnostics for oral cancer detection. Clin Cancer Res. 2004;10(24):844250. 4. Kort R, Caspers M, van de Graaf A, van Egmond W, Keijser B, Roeselers G. Shaping the oral microbiota through intimate kissing. Microbiome. 2014;2:41. 5. Haririan H, Andrukhov O, Bertl K, Lettner S, Kierstein S, Moritz A, et al. Microbial analysis of subgingival plaque samples compared to that of whole saliva in patients with periodontitis. Journal of periodontology. 2014;85(6):81928. 6. de Lima CL, Acevedo AC, Grisi DC, Taba M, Jr., Guerra E, De Luca Canto G. Hostderived salivary biomarkers in diagnosing periodontal disease: systematic review and metaanalysis. Journal of clinical periodontology. 2016;43(6):492502. 7. Kaufman E, Lamster IB. Analysis of saliva for periodontal diagnosisa review. Journal of clinical periodontology. 2000;27(7):45365. 8. Kinney JS, Morelli T, Braun T, Ramseier CA, Herr AE, Sugai JV, et al. Saliva/pathogen biomarker signatures and periodontal disease progression. Journal of dental research. 2011;90(6):7528. 9. Haririan H, Andrukhov O, Pablik E, Neuhofer M, Moritz A, RauschFan X. Comparative Analysis of CalciumBinding MyeloidRelated Protein8/14 in Saliva and Serum of Patients With Periodontitis and Healthy Individuals. Journal of periodontology. 2016;87(2): 18492. 10. Haririan H, Andrukhov O, Bottcher M, Pablik E, Wimmer G, Moritz A, et al. Salivary Neuropeptides, Stress and Periodontitis. Journal of periodontology. 2017:115.
4


Photo 3 et 4: Patient avec parodontite de stade III, grade C. Les signes cliniques de parodontite sont visibles tant pour le patient que pour les professionnels. Le dépistage primaire de la parodontite au moyen d’un test salivaire ne serait guère signifi catif. Un test salivaire pourrait s’utiliser dans de tels cas pour le traitement de soutien parodontal afi n de contrôler la stabilité et la progression.

© MedUni Wien
L’auteur Prof. Dr Hady Haririan, PhD, MSc Après des études de médecine dentaire à Graz, a effectué des études de doctorat et une formation post grade en parodontologie à l’Université de médecine de Vienne. En 2019, habilitation avec spéciali sation dans le diagnostic salivaire. De 2009 à 2019, travaille au service de préservation dentaire et de parodontologie de la Clinique dentaire universitaire de Vienne. Dirige depuis 2020 le Service de parodontologie à l’Université privée Sigmund Freud de Vienne en Autriche. Membre du comité de la Société autrichienne de parodontologie, occupe actuellement le poste de secrétaire général.
Correspondance: Univ.Prof. Dr. Hady Haririan, PhD, MSc Leiter Parodontologie Sigmund FreudPrivatuniversität Freudplatz 3 1020 Wien hady.haririan@med.sfu.ac.at






