Российский фармрынок Аналитика по итогам 1-3 кв. 2022 года
"Российский фармрынок сравнительно без болезненно прошёл острую фазу кризисно го периода, отчасти за счёт того, что он обеспечивает прежде всего потребности системы здравоохранения, а значит име ет гуманитарное значение и остаётся вне большинства мер санкционного давления, отчасти за счёт очень активной работы представителей отрасли. В очень короткие сроки удалось переориентировать логисти ческие потоки, наладить работу с новыми партнёрами и заместить те направления, которые ранее были ориентированы на евро пейских поставщиков. Активно развивается и процесс импортозамещения в отношении готовых ЛП, в связи с тем, что отдельные производители из Европы и США отказались от активного продвижения, их очень быстро начали вытеснять из информационного про странства, что уже начинает сказываться на рыночной доле в рамках конкретных кон курентных групп, в т.ч. это легко заметить по разнице между динамикой в отношении поставок в Россию импортных препаратов и активностью российского производства. Причём последствия данного процесса для

Беспалов Николай
директор по развитию RNC Pharma
рынка ещё нельзя оценить в полной мере, тут будет наблюдаться отсроченный эф фект. Кстати, поставки сырья тоже очень сильно активизировались, причиной тут стало как наращивание объёмов производ ства, так и формирование запасов сырья, для закупки которого сейчас очень благопри ятные условия - рубль серьёзно укрепился по отношению к доллару и евро, а значительная часть сырья закупалась за валюту. Инфляция на фармрынке, да и в экономи ке в целом, тоже нормализуется, после ве сенних пиков на уровне 15% в отношении ЛП, которые фиксировались в марте, по итогам октября индекс цен наблюдается на уровне порядка 10,3%. Цены вряд ли вернутся к до кризисным показателям, но стабилизация налицо, и этот факт, очевидно, будет вли ять на показатели спроса. Чудес в отноше нии активности поведения потребителей ждать, конечно, не приходится. Покупатель ская активность будет сокращаться вслед за снижением или стагнацией доходов насе ления. Но стагнация при прочих равных всётаки лучше падения, так что тут прогноз на будущий год скорее позитивный.

12 pharmprom.ru ФАРМАЦЕВТИЧЕСКИЙ РЫНОК
По информации представленной аналитической компанией RNC Pharma® в 3-м квартале 2022 года:

• натуральный объём поставок иностранных готовых лекарственных препаратов в Россию сократился на 6,9%, ассортимент также скорректировался в сторону снижения;

• натуральный объём поставок АФИ
1 НОЯБРЯ, 2022
ИМПОРТ ЛП В РОССИЮ
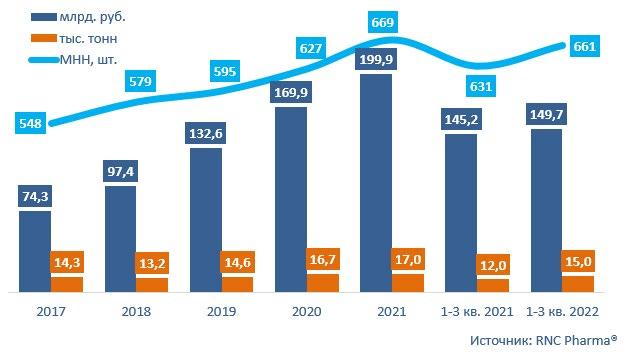
Общий объём поставок гото вых лекарственных препаратов в Россию по итогам периода с янва ря по сентябрь 2022 года составил 607,7 млрд. руб. (в ценах с учётом стоимости таможенной очистки, включая НДС), без учёта поставок из стран ЕАЭС. Динамика отно сительно аналогичного периода 2021 года при проведении расчё тов в рублях составила 9,4%. Отгрузки in-bulk в денежном выражении демонстрируют рост на уровне 22,4%. Натуральные объёмы поставок по обеим товарным категориям при этом падают, ввоз готовых ЛП за год сократился на 6,9% в упаковках и на 8,6% в минималь ных единицах дозирования (МЕД). Всего было поставлено 1,24 млрд. упаковок, что эквивалентно 23,9 млрд. минимальных единиц. От грузки in-bulk потеряли за год 38%, всего с начала текущего года было ввезено порядка 1 млрд. МЕД нерасфасованных препаратов. Работа участников внешнеэко номической деятельности по ито
гам сентября 2022 года какими-то явными успехами или неудачами не отличалась, отгрузки готовых ЛП в рублёвом выражении вырос ли на 9% относительно сентября 2021 года, всего было поставлено ЛП на сумму порядка 72 млрд. руб. Ввоз нерасфасованных препа ратов вырос на 16%, а общий объ ём отгрузок исчислялся суммой 17,8 млрд. руб. В текущем году заметные из менения происходили в отноше нии ассортимента, поставляемых в Россию препаратов. Сказались и санкционные ограничения и чист ка продуктовых портфелей, по скольку в условиях подорожавшей логистики и роста конкуренции со стороны российских производите лей отгрузки отдельных товарных позиций стали не целесообразны, коррективы вносит также локали зационный процесс. В отношении поставок гото вых лекарственных ЛП общее ко личество отгружаемых торговых наименований в январе-сентябре 2022 г. достигло 2073 торговых марок, это на 27 позиций меньше, чем за аналогичный период 2021 г.
Максимальные рублёвые объ ёмы в периоде сравнения прихо дились на Гардасил («МСД»), Тре сиба («Ново Нордиск») и Зепатир («МСД»). Два последних препара та были локализованы в России и поставляются сейчас в виде inbulk, а что касается Гардасила, то на протяжении 2021 года ввози лись очень значительные объёмы, сопоставимые с суммарными по ставками данного препарата за последние 10 лет.
Максимальную динамику по группе готовых лекарственных препаратов показывает Солирис («Алексион»), за год отгрузки пре парата выросли в 2,7 тыс. раз (в рублях), впрочем, препарат в се редине 2020 года был исключён из Госреестра и сейчас поставляется по специальной процедуре в сле довых количествах. Второй результат с точки зре ния рублёвой динамики у препа рата Коселуго («АстраЗенека»), за год объёмы отгрузок выросли в 785 раз, препарат получил РУ в конце 2021 года и сейчас речь идёт о выходе на рабочие режимы поставок.
13 pharmprom.ru партнер
номера
на
• поставки импортных ветпрепаратов показали максимальную динамику за год; • натуральный объём производства лекарственных препаратов в России сократился, рублёвая динамика не превысила уровень инфляции.
вырос
25%;
Динамика объёмов поставок ЛП в Россию (кроме отгрузок из стран ЕАЭС) за 2017-2021 гг. и 1-3 кв. 2022 г., цены выпуска в свободное обращение (включая таможенную очистку и НДС)
В группе нерасфасованных препаратов общее количество от гружаемых в Россию торговых марок по итогам января-сентября 2022 г. сократилось на 18 шт., сей час речь идёт о поставках 201 наи менования. В прошлом году макси мальные объёмы из этих 18 позиций приходились на Дюфалак («Эбботт») и Джадену («Новартис»), оба они сейчас локализованы в России по полному циклу производства лек. форм на собственных предприятиях указанных компаний. Абсолютным рекордсменом с точки зрения рублёвой динамики поставок в анализируемом перио де стал препарат Гемлибра («Рош»), отгрузки относительно январясентября 2021 г. выросли в 68,5 раз. Упаковка препарата осуществля ется на московском предприятии «Добролек» группы «Фармэко».
ИМПОРТ АФИ В РОССИЮ
За период с января по сентябрь
с учётом стои мости таможенной очистки, вклю чая НДС).

Прирост относительно анало
гичного периода 2021 года при проведении расчётов в россий ской валюте зафиксирован на
уровне 3,1% – это один из абсо лютных минимумов за последние 12 лет, меньшую динамику отрасль показывала только в 2016 году, тогда показатель составлял 1,3%. Натуральные объёмы при этом не просто растут – здесь зафиксиро ван абсолютный рекорд, отгрузки фармсубстанций выросли на 25%. Всего за первые 9 месяцев те кущего года в нашу страну поста вили порядка 15 тыс. тонн фарма цевтического сырья. Разница в динамике стоимост ного и натурального показателя объяснялась дефляцией на рын ке фармацевтического сырья, так индекс цен в анализируемом пе риоде, рассчитанный по формуле Ласпейреса относительно янва ря-сентября 2021 года составил -2,1%, цены на АФИ сокращаются уже несколько месяцев подряд на фоне ревальвации рубля. В частности, в сентябре 2022 года индекс цен составил -11,4%. В сентябре 2022 г. долгосрочную динамику объёмов поставок фар мацевтических субстанций нельзя назвать рекордной даже на фоне показателей текущего года, ру

блёвый объём отгрузок сократил ся на 13%, всего было отгружено АФИ на 15,4 млрд. руб. Показатель прироста в отно шении натурального объёма тоже смог взять относительно невысо кую планку, здесь фиксируем 22% при проведении расчётов в тон нах, в текущем году были примеры гораздо более активных поставок, скажем в январе 2022 г. отгрузки выросли на 83%, а в августе 2022 г. прирост достигал 73%. Ассортимент отгружаемых в нашу страну наименований фар мацевтического сырья по итогам января-сентября 2022 г. составлял 661 МНН, это на 30 позиций боль ше, чем по итогам аналогичного периода прошлого года.
Из числа наименований, по ставки которых в текущем году были приостановлены, макси мальные денежные объёмы при ходились ранее на фосампрена вир (поставлялся в интересах «ПСК Фарма») и алтеплазу («Берингер Ингельхайм»). В натуральном выражении ли дировали хлоргексидин (ввозился в интересах 3-х компаний, макси мальные объёмы приходились на «Тульскую ФФ») и натрия лактат («Фармвилар»).
14 pharmprom.ru
2022 года в Россию было ввезено активных фармацевтических ин гредиентов (АФИ) на сумму 149,7 млрд. руб. (в ценах
ФАРМАЦЕВТИЧЕСКИЙ РЫНОК
Максимальную рублёвую ди намику поставок по итогам ян варя-сентября 2022 года про демонстрировал ривароксабан, поставки данной позиции вырос ли за год в 6,8 тыс. раз. Вообще отгрузки данного МНН начались ещё в 2019 году, но речь шла о поставках граммовых коли честв, которые едва ли могли ис пользоваться в производственных целях. В рамках анализируемого периода речь идёт о вполне про мышленных объёмах, поставки осуществлялись из Китая и Индии, при этом покупателями выступали сразу 4 компании, основной объ ём был выкуплен «Берёзовским фармацевтическим заводом». В натуральном выражении максимальный прирост поставок был зафиксирован у МНН ксило метазолин (рост в 597 раз), но тут речь шла о низкой базе 2021 года, данная позиция практически не ввозилась в Россию в прошлом году. Объём существенно опережает поставки и предыдущих лет, хотя в 2010 и 2015 годах поставки были даже больше. Сейчас отгрузки велись в инте ресах 6 разных компаний, основ
ной объём был выкуплен компа нией «Фармстандарт».
ИМПОРТ ВЕТЕРИНАРНЫХ
ЛП В РОССИЮ
Поставки ветеринарных ЛП в Россию за период с января по сен тябрь 2022 г. исчислялись суммой 28,1 млрд. руб. (в ценах с учётом стоимости таможенной очистки, включая НДС). Динамика поста вок относительно аналогичного периода 2021 г. вышла в замет ный плюс, здесь фиксируем 5,1% в рублях. Натуральный показатель прироста тоже в плюсе, отгрузки выросли на 7,6%, всего за первые 9 месяцев текущего года в нашу страну было ввезено 24,4 млн. упак. вет. ЛП. Ситуация в отношении ввоза кормовых добавок выглядит за метно хуже, здесь и денежный и натуральный объёмы показывают отрицательную долгосрочную ди намику, на уровне -2,3% в рублях и -12,1% в тоннах. Общий объём поставок за анализируемый пери од по данной товарной группе до стигал 110,3 тыс. тонн, стоимостью порядка 31,8 млрд. руб.
Итоги 3-го квартала 2022 года в отношении поставок вет. ЛП были без преувеличения выдаю щимися, более того, они фактиче ски и определяли общий резуль тат работы отрасли с начала года. Так относительно 3-го квартала 2021 года рублёвый объём поста вок вырос на 32,3%, а динамика в упаковках достигала 28,4%. В от ношении поставок кормовых до бавок 2-й и 3-й кварталы 2022 г. выдались довольно сложными, сказывались санкционные огра ничения в отношении логистики. Если не считать результатов авгу ста 2022 г. отгрузки планомерно снижались, так что относительно 3 кв. 2021 г. рублёвые объёмы упали на 14,4%, а снижение общего тон нажа достигло 6,4%.
Общие итоги работы как в от ношении вет. ЛП, так и по группе кормовых добавок за январьсентябрь 2022 г. серьёзно разли чались по типам животных. Для вет. ЛП, долгосрочная динамика поставок продукции для сельско хозяйственных животных (СХЖ) достигала 6,1% (в рублях), тогда как в категории мелких домашних животных (МДЖ) отгрузки вырос ли всего на 2%.

15 pharmprom.ru
партнер номера
Динамика объёмов поставок фармакопейных и технических АФИ в Россию (кроме отгрузок из стран ЕАЭС) за 2017-2021 гг. и 1-3 кв. 2022 г., цены выпуска в свободное обращение (включая таможенную очистку и НДС)
Интересно, что отгрузки ино странных кормовых добавок раз вивались с точностью до наоборот, тут рублёвые объёмы продукции для МДЖ выросли на 62,5%, а по ставки продукции для сельского хозяйства сократились на 10%.

Общая номенклатура поставок вет. ЛП в Россию по итогам янва ря-сентября 2022 г. составила 504 торговых марки, это на 106 пози ций меньше, чем годом ранее. Из числа препаратов, отгрузки кото рых в рамках анализируемого пе риода не осуществлялись, макси мальные объёмы приходились на препараты Импровак («Зоэтис») и Цеправин DC («МСД»), оба предна значены для лечения СХЖ. Максимальную рублёвую ди намику в группе ветеринарных лекарственных препаратов отно сительно января-сентября 2022 года продемонстрировали: вак цина Прогрессис от «Сева Санте анималь» (рост в 785 раз) и седа тивный препарат Роматар («Био вета»), отгрузки которого выросли в 338 раз, оба не являются нович ками российского рынка, просто в 2021 году их отгрузки фиксирова лись на рекордно низких уровнях.
Ассортимент, отгружаемых в Россию кормовых добавок также переживает период серьёзного сокращения, в январе-сентябре 2022 года в нашу страну постав лялась 451 торговая марка, это на 152 наименования меньше, чем годом ранее. Из числа выпав ших из поставок позиций макси мальные объёмы приходились на Биоплекс и Оптиген («Оллтек»). А среди продуктов, показавших мак симальную динамику отгрузок в анализируемом периоде отметим торговые марки: Нормаминовит от компании «Алповет» (рост в 151 раз) и Эксеншиал от «Орффа Эдди тивс» (рост в 45,7 раз). Оба наиме нования поставлялись в Россию и ранее, динамика связана с низкой базой 2021 года. РОССИЙСКОЕ ПРОИЗВОДСТВО ЛП Общий объём выпуска готовых ЛП в России за период с января по сентябрь 2022 г. исчислялся суммой 528,1 млрд. руб. (в ценах отгрузки производителей, с учё том НДС), динамика относительно
аналогичного периода 2021 г. при проведении расчётов в россий ской валюте была зафиксирова на на уровне 22%. Натуральный объём произведённой продукции в рамках отчётного периода до стиг 3,09 млрд. упак., а показатель долгосрочной динамики был от мечен на уровне 3,6%. При про ведении расчётов в минималь ных единицах дозирования (МЕД) показатель прироста не превы шал динамику в упаковках, здесь фиксируем 2,6%, всего за первые 9 месяцев текущего года фарм производители, локализованные в России, отгрузили на рынок 59 млрд. МЕД. Итоги работы участников рынка по итогам сентября 2022 г. выра женными рекордами не блистали, денежный объём производства относительно сентября 2021 г. продемонстрировал прирост на уровне 13,7%, всего было произве дено ЛП на сумму 54,6 млрд. руб. Натуральная динамика уходит в минус в упаковках (-2%), но при этом демонстрирует хоть и не большой, но положительный по казатель прироста в минималь ных единицах, здесь фиксируем

16 pharmprom.ru
ФАРМАЦЕВТИЧЕСКИЙ РЫНОК Динамика объёмов поставок ветеринарных ЛП и кормовых добавок в Россию (кроме отгрузок из стран
гг. и 1-3 кв. 2022 г., цены выпуска в свободное обращение (включая таможенную
ЕАЭС) за 2017-2021
очистку и НДС)
+0,5%, всего было выпущено 328,9 млн. упак. или 6,35 млрд. МЕД. Общие итоги работы отрасли по итогам 3-го квартала тоже ока зались скромными, долгосрочная динамика денежного объёма вы пущенной продукции была ниже уровня инфляции, на уровне 9,8%, натуральные объёмы сократи лись на 1,1% в упаковках. За минувший год заметно из менилась структура производи мых на территории России ЛП, по следние месяцы отрасль активно наращивала выпуск ОТС препара тов, при этом доля данной группы существенно выросла, в анали зируемом периоде она составила 54,4% (в упаковках), против 50,6% в январе-сентябре 2021 г. Если проводить расчёты в ми нимальных единицах лидируют с точки зрения объёмов выпу ска всё-таки производители Rxпрепаратов (55,2% в январе-сен тябре 2022 г.), но и здесь их доля сокращается, годом ранее она до стигала 56%. Общее количество торговых марок ОТС препаратов, произве

дённых в январе-сентябре 2022 г. достигло 939 шт., это на 65 позиций больше, чем годом ранее. Абсо лютный максимум с точки зрения натуральной динамики отгрузок (в упаковках) продемонстрировал Висмута трикалия дицитрат (рост в 43,4 раза), в анализируемом пе риоде препарат выпускался 2 ком паниями, но максимальный вклад в динамику обеспечила компа ния «Озон» из Самарской области. Второй результат демонстрирует препарат Винилин, созданный ещё в первые месяцы Великой Отече ственной войны, при этом объём производства препарата увели чился в 21,4 раза. Продукт выпу скается сразу на 5 предприятиях, но максимальные объёмы и ос новной вклад в динамику обеспе чил «Усолье-Сибирский химфарм завод». Замыкает тройку препарат Мирамед от бийской компании «Эвалар» (рост в 20,7 раз), про дукт был одним из первых джене риков антисептика Мирамистин («Инфамед») и сейчас занимает уверенное третье место в рамках соответствующей конкурентной
группы, в т.ч. отнимая долю у ори гинального препарата. Ассортимент Rx-препаратов за год вырос на 86 торговых ма рок и по итогам января-сентября 2022 г. насчитывал 1 739 позиций. Максимальную динамику в упаковках продемонстрировал Левинокс («Гротекс»), отгрузки препарата выросли за год в 42,7 раза (в упаковках), в основном это связано с эффектом низкой базы, производство препарата старто вало только в сентябре прошлого года. Второй с точки зрения ди намики результат показал подза бытый с «ковидных» времён Эта нол медицинский от «ГК Росбио» (рост в 40 раз). Впрочем, это не какая-то глобальная тенденция, у препарата на рынке порядка 15 прямых аналогов и общие объ ёмы производства препаратов этилового спирта сократились за год на 11% (в упаковках). Замыка ет тройку лидеров Кемерувир от иркутского «Фармасинтез», пре парат показал рост в 35 раз, но это связано с низкими объёмами выпуска в 2021 году.
собственных
контрактных площадках) за 2017-2021 гг. и 1-3 кв. 2022 г. в натуральном (упаковки) и денежном выражении (RUB, включая НДС)

17 pharmprom.ru
партнер номера Объём производства ЛП в России (включая выпуск ЛП иностранных фармкомпаний на
и
Ко дню Всемирного дня борьбы с пневмонией компания «Петровакс Фарм» рассказала о многолетнем опыте в области борьбы с пневмококковой инфекцией. Локализация полного цикла производства готовых лекарственных форм высокотехнологичной пневмококковой вакцины позволяет поставлять необходимое количество доз для широкого использования в рамках Национального календаря профилактических прививок для защиты детей от пневмококковой инфекции и снижения младенческой смертности от пневмонии.
11 НОЯБРЯ, 2022
невмония — острое респираторное инфекци онное заболевание, вызывающее поражение легочной ткани. Она может развиться в лю бом возрасте, однако самыми уязвимыми группа ми являются маленькие дети (до 5 лет), пациенты с хроническими заболеваниями и взрослые старше 65 лет. Согласно статистике ВОЗ, пневмония явля ется причиной смертности 14% детей в возрасте до 5 лет. Наиболее распространенным возбудите лем заболевания является бактерия Streptococcus pneumoniae. Максимально эффективно бороться с пневмокок ковой инфекцией позволяет вакцинопрофилактика. Именно поэтому в 2011 году биофармацевтические компании «Петровакс Фарм» и Pfizer заключили
соглашение о начале сотрудничества по производ ству полного цикла готовой лекарственной формы (ГЛФ) конъюгированной 13-валентной вакцины про тив пневмококковой инфекции на производствен ном комплексе «Петровакс Фарм» в Московской об ласти. На протяжении более 10 лет данная вакцина успешно применяется в 126 странах — по оценкам, ее включение в иммунизационные программы для детей позволило предотвратить 175,2 млн случаев заболевания и 625 тыс. смертей во всем мире. Проект стал пилотным в области импортозаме щения вакцин в России и показал, что производство одного из самых

18 pharmprom.ru
ФАРМАЦЕВТИЧЕСКОЕ ПРОИЗВОДСТВО П
иммунобиологических препаратов на локальном предприятии может быть успешным. Петровакс Фарм — опыт создания российского производства инновационных вакцин
сложных
GMP и полностью налажено ее масштабное производство. Для российской фармацевти ческой промышленности этот проект стал первым в области импортозамещения высокотех нологичных вакцин, который по зволил локализовать производ ство одного из самых сложных иммунобиологических препара тов. Сумма совместных инвести ций в производство превысила 1 млрд руб.


Лариса Духина Директор завода «Петровакс Фарм»

"19 pharmprom.ru партнер
пациентов социально
ми препаратами. В рамках
вакцины
номера Реализация проекта — яр кий пример международного со трудничества в области транс фера технологий и обеспечения
значимы
проекта была пере дана технология производства
по полному циклу ГЛФ в соответствии со стандартами
(за весь цикл каждая серия вакцины проходит более 3500 различных те стов контроля качества). С 2014 года 13-валентная пневмококковая


20 pharmprom.ru ФАРМАЦЕВТИЧЕСКОЕ ПРОИЗВОДСТВО В процессе реализации проекта на производ ственной площадке «Петровакс Фарм» было уста новлено уникальное оборудование, внедрены си стема обеспечения качества и методы контроля качества, соответствующие всем стандартам ми ровой биофармацевтической промышленности. На заводе осуществляются все стадии производства, включая приготовление готовой лекарственной формы (формуляция), первичную упаковку (розлив в
шприцы), вторичную упаковку и вы
контроль качества
конъ югированная вакцина поставляется для Националь ного календаря профилактических прививок РФ (НКПП РФ). Суммарный объем поставок для НКПП РФ за 8 лет составил более 30 млн доз. За этот период достиг нуты значимые результаты по снижению смертно сти от пневмонии среди детей первого года жизни: по сравнению с довакцинальным периодом мла денческая смертность снизилась на 56%, показана 55% эпидемиологическая эффективность иммуни зации против пневмококковой инфекции в отноше нии внебольничных пневмоний любой этиологии у детей, своевременно вакцинированных на первом году жизни.
одноразовые
пускающий
партнер номера

Лариса Духина Директор завода «Петровакс Фарм»

Наша вакцина уже много лет успешно применяется для профи лактики пневмококковой инфекции c 2-х месяцев жизни. Она включает в себя до 90% серотипов, являющихся причиной инвазивных пневмококковых инфекций, в том числе устойчивых к лечению антибиотиками, и успешно используется в реальной кли нической практике у детей первых лет жизни и у лиц с хронической патологией и с нарушениями иммунитета.

21 pharmprom.ru
"

На заводе «Медсинтез» открылся цех по производству биотехнологических субстанций для репродуктивного здоровья женщин
в сотруд ничестве с компанией «АйВиФарма» производит первый российский препа рат рекомбинантного фолликулостимулиру ющего гормона (ФСГ) для лечения бесплодия человека - Примапур®. «Завод Медсинтез» производит субстанцию этого препарата и готовую лекарственную форму в предзапол ненной одноразовой шприц-ручке. С открытием нового цеха по производ ству биотехнологических субстанций у за вода появляются новые производственные мощности для обеспечения отечественной медицины современными востребованными препаратами. Так мощность производства препарата ФСГ на заводе составляет до 30 грамм субстанции, до 1 млн одноразовых шприц-ручек в год. «Завод Медсинтез» готов обеспечить годовую потребность в препара тах ФСГ в России на 200%. Оценить уровень сверхсовременного производства на «Заводе Медсинтез» при были представители Правительства Россий ской Федерации, Министерства здравоохра нения Свердловской области, Министерства промышленности и науки Свердловской об ласти, а также ведущие специалисты России в области здравоохранения и репродуктив ного здоровья. Полномочный представитель Президента РФ в Уральском Федеральном округе Влади мир Якушев ознакомился с производством
года «Завод
Владимир Якушев Полномочный представитель Президента РФ в Уральском Федеральном округе

что препа раты для репродуктивного здоровья будут всегда в наличии.

23 pharmprom.ru партнер
19
самой
C
импортозамеще
репродуктивное
номера 21 НОЯБРЯ, 2022
ноября 2022 года на «Заводе Медсинтез» состоялось торжественное открытие цеха по производству биотехнологических субстанций для репродуктивного здоровья женщин, обладающего
высокой мощностью производства препарата ФСГ в мире.
2018
Медсинтез»
завода, отметив уровень
ния и вклад в
здоровье граждан нашей страны. Сегодня мы можем смело говорить о том, что медицинский кластер на Среднем Урале пополнился еще одной эффективной связкой. Биотехнологии «Медсинтеза» и «АйВиФармы» образу ют синергию с высокопрофессиональ ными специалистами клиник «Мать и Дитя». Таким образом, отечествен ные лекарственные препараты для репродуктивного здоровья женщин уже доступны и продолжают разраба тываться. Профессионалы в области здравоохранения и тем более пациен ты могут быть уверены,
"
Препарат ФСГ российского производства необходим сегодня в целях оказания высокотехно логичной медицинской помощи в РФ на пути преодоления репро дуктивных проблем населения. В рамках Федерального закона от 21 ноября 2011 г. № 323-ФЗ "Об ос новах охраны здоровья граждан в Российской Федерации" реа лизуется широкое обеспечение граждан доступным лечением бесплодия с помощью процедуры экстракорпорального оплодот ворения (ЭКО). Препарат Прима пур® прошел все стадии разра ботки и выпуска на территории Российской Федерации, приме няется при лечении бесплодия с помощью методов ЭКО и входит в список жизненно необходимых лекарственных препаратов. Заместитель министра здра воохранения Свердловской обла сти Андрей Шастин на открытии цеха оценил вклад завода в ре шение государственной задачи по демографическому развитию страны.
На сегодняшний день уже вы пущено 25 промышленных серий препарата Примапур®.
Лекарственное средство ис пользуется более чем в 80% ме дицинских центрах, специализи рованных на лечении бесплодия человека по всей России. Терапию препарата российского ФСГ полу чили уже более 30 тысяч женщин: проведено более 30 тысяч циклов ЭКО с использованием препарата Примапур® и рождено более 10 тысяч детей. «Завод Медсинтез» первым в России начал выпускать удобную для пациентов лекарственную форму ФСГ в виде одноразовых шприц-ручек, что является по требительским преимуществом и позволяет препарату достойно конкурировать с крупнейшими зарубежными производителями. Шприц-ручка препарата Прима пур® зарегистрирована



24 pharmprom.ru ФАРМАЦЕВТИЧЕСКОЕ ПРОИЗВОДСТВО
в
в качестве меди цинского изделия. Данная форма Сейчас очень важно дать помощь тем семьям, которые не могут завести детей. Сохранение и увеличение населения России крайне важная задача. И тот препарат, который производится на этом заводе, является ключевым для обеспечения проце дуры экстракорпорального оплодотворения.
внутри страны, мы становимся абсолютно независимыми и получаем более доступную цену на препарат с качеством мирового уровня. " Андрей Шастин Заместитель министра здравоохранения Свердловской области
Росздравнадзоре
До не давнего времени на рынке присутствовали только импортные препараты, что делало нас зависимы ми. Развернув производство
партнер номера

выпуска наиболее востребова на и удобна для пациентов. Решая вопросы импортоза мещения, на предприятии ве дутся научно-исследователь ские и опытно-конструкторские работы по подготовке к произ водству и других гормональных препаратов, необходимых при проведении процедуры ЭКО. Но вые лекарственные препараты хорионического гонадотропина человека и антагониста гонадо тропин-рилизинг-гормона че ловека сейчас находятся на ста дии предварительных работ до подачи на регистрацию в Минздрав России. В данный момент особенно актуально производ ство таких препаратов на тер ритории Российской Федерации, чтобы обеспечить доступность методов лечения ЭКО и беспе ребойность поставок лекарств в медцентры нашей страны.

Александр Петров Председатель совета директоров «Завода Медсинтез»
Первый препарат, который мы локализовали в этом цехе, это препарат Примапур® – фолликуло стимулирующий гормон человека, который приме няется при процедурах ЭКО. Сейчас мы разрабаты ваем хорионический гонадотропин человека (ХГЧ) и препарат цетрореликс, который также применя ется при процедурах ЭКО, что позволит создать полный цикл этих препаратов. Я думаю, в 2025 году мы сможем вывести их на рынок.

25 pharmprom.ru
"
Главный специалист по ЭКО ГК «Мать и дитя», к.м.н., главный врач женского центра клиники «Мать и дитя» в Кунцево Дилором Камило ва отметила, что препарат Прима пур® доказал свою эффективность и безопасность за время примене ния в клинической практике. Врач-репродуктолог, заведу ющая отделением ЭКО клиниче ского госпиталя «Мать и дитя» Тю мени Мария Ганихина рассказала, что с помощью этого препарата за последние три года у их пациенток появилось на свет около тысячи детей. Академик РАН, д.м.н., профес сор, генеральный директор, член совета директоров группы ком паний «Мать и дитя» Марк Курцер отметил высокое качество пре парата и ежегодное увеличение спроса на Примапур®.


"Марк Курцер Академик РАН, д.м.н., профессор, генеральный директор, член совета директоров группы компаний «Мать и дитя»

26 pharmprom.ru
ФАРМАЦЕВТИЧЕСКОЕ ПРОИЗВОДСТВО
Мы провели третью фазу клинических испыта ний и увидели, что препарат очень хорошего каче ства, с отсутствием побочных эффектов. Ежегод но удваивается использование этого препарата.
Высокотехнологическое россий ское производство на «Завод Медсин тез» обеспечивает высокий уровень качества и безопасности выпускаемых лекарственных средств. При этом, отечественное производ ство лекарств не зависит от колебаний курсов валют, а значит предлагает вы годные цены на готовые препараты в сравнении с импортными аналогами. Особенно это важно для потреби телей в сегодняшних условиях непро стой экономической ситуации. Производство препаратов для ре продуктивного здоровья помогает решать не только тактическую задачу страны - импортозамещение, но и стра тегическую - обеспечение лекарствен ной безопасности России, кроме того, эти препараты могут выходить и на ми ровые рынки, считает депутат Государ ственной



27 pharmprom.ru партнер номера
РФ,
по охране здоровья Александр Петров. В России примерно 570 заводов, произво дящих лекарственные препараты и около 10 площадок, которые производят субстанции, то есть сырье для производства. Это серьез ное производство на Урале и настоящий эле мент национальной системы лекарственной безопасности. " Александр Петров депутат Государственной Думы РФ, член комитета по охране здоровья
Думы
член комитета

Новые производственные мощности завода «Полисинтез»
29 АВГУСТА, 2022
продукта
Бизнес в сфере производства биологически активных
добавок (БАД) становится все более привлекательным. Если ранее на российском рынке БАДы были продукцией исключительно зарубежного производства, то сегодня нишу активно заполняют отечественные компании. Этот процесс ускорился на волне ухода с рынка иностранных компаний. Играет важную роль и изменение отношения потребителей к этой продукции: люди стремятся поддержать свой организм дополнительными микроэлементами, а БАДы перестали восприниматься «непонятной химией». Какие этапы придется пройти, если попытаться оказаться на гребне волны и задаться идеей запуска своего производства биологически активных добавок?
Самое главное, что должен по нимать будущий производи тель, — производство БАДов начинается задолго до создания производственного комплекса или производственной линии. Все эти процессы выстраиваются вокруг продукта. Поэтому первый этап производства — создание идеи бу дущего продукта: • исследование потребитель ского спроса, мировых трендов;
• разработка самого продукта: подбор поставщиков сырья и соз дание формул;

• решение юридических во просов по регистрации бизнеса и регистрации продукции. И уже только после этого мож но приступать к:
• поиску подходящего по кри териям помещения;
• закупке необходимого обо рудования для производства про дукта; • организации производствен ного комплекса в соответствии со всеми требованиями. Сфера производства и распро странения биологически актив
ных добавок сегодня регламенти руется Техническим регламентом Таможенного союза (ТР ТС) — к этому документу собственнику бизнеса придется неоднократно обратиться на каждом из обо значенных этапов, чтобы понять, какие требования нужно будет соблюсти при открытии своего предприятия.
Разберем каждый из этапов подробнее.
32 pharmprom.ru ЭКСПЕРТНЫЙ МАТЕРИАЛ
Олеся Баль Исполнительный директор ООО «НЛ Континент» (ТМ NL International)
28 ОКТЯБРЯ, 2022
Источник: Деловой журнал "Инвест-Форсайт"

ПРОГАДАТЬ Как понять, что будет востре бовано, чтобы бизнес сразу по сле создания не «улетел в трубу»? Разумеется, необходимо прове сти глубокое исследование рынка в той сфере производства, где вы планируете работать. Чтобы полу чить полноценную картину, в сво ей практике мы изучаем мировой опыт, опираемся на данные по ставщиков сырья, которые ищут и разрабатывают новые компонен ты, формы и технологии обработ
ки и выпуска БАДов, заказываем исследования сторонних анали тических агентств. Если у вас уже есть сформированная клиентская база — очень важно собирать обратную связь именно с них. К примеру, у NL более 5 млн заре гистрированных клиентов и дис трибьюторов во всем мире, для нас обратная связь наших партне ров — важнейший инструмент в работе. Определившись с тем, что нуж но рынку и клиентам, приступаем к разработке будущих продуктов.
СЫРЬЕ СЫРЬЮ РОЗНЬ Задача № 1 — найти подходя щих поставщиков сырья. Сырье — это основа любого продукта. А БАДы по своей сути — это сырье в его чистом виде, поэтому от носиться к выбору нужно макси мально серьезно.
Важнейшая характеристика сырья — место произрастания, поскольку эндемичность его про исхождения, как правило, обеспе чивает самую высокую биологи ческую активность.

33 pharmprom.ru партнер номера
НЕ
Приведу пример: природное место выращивания артишока — страны Средиземноморья, где климатические показатели позволяют собирать сырье стабильно высокого качества. По этому мы закупаем экстракт артишока только у европейских производителей. Если мы выбираем облепиху, то лучшее сы рье — алтайское: здесь можно получить экологически чистые ягоды и листья облепихи без техногенной нагрузки. А мята за купается нами только у компании Martin Bauer, использующей для выращивания единственный сорт этого растения в одном и том же месте с определенными
как по показателям безопасности, так и по по казателям качества и происхождения. В документах должно быть зафиксировано, из каких семян было выращено сырье, в каком регионе, как это сырьё собиралось и перерабатывалось. К поставщикам витаминов и минералов схожие требова ния: это должны быть проверенные партнеры с продукцией в формах, обеспечивающих сохранность, биодоступность, рас творимость и возможность использования в любых видах пи щевых продуктов. При этом сегодня ситуация поменялась: мы работаем как с проверенными поставщиками, которые не ушли с рынка, так и с новыми партнерами. Проблемы разработки БАДов сейчас сопряжены с поиском нового сырья, со стоимостью на сырье и изменившимися логистическими процессами.



34 pharmprom.ru
климатическими параметра ми. Это дает возможность получать для
наилуч шее сырье от партии к партии. При этом важно, чтобы характеристики каждого вида
рья из любой точки мира были подтверждены
документами
ЭКСПЕРТНЫЙ МАТЕРИАЛ
производства
сы
необходимыми
ОТКУДА ВЗЯТЬ ФОРМУЛЫ?
Итак, мы договорились о поставках сырья, а что дальше? Необходимо разра ботать формулы продукции. И здесь есть три пути: купить готовые формулы, иметь технолога пищевой промышленности на производстве или пойти дальше, создав партнерство с лабораторией для разра ботки уникальных продуктов. NL — сетевая компания, для нас важно, чтобы наш про дукт был уникальным и отличался от ана логов на FMCG-рынке. Поэтому для себя мы выбрали последний путь: разработкой БАДов и продуктов функционального пита ния для нашей компании занимается наш стратегический партнер UltraNovation R&D laboratory. В создании продуктов, прежде всего, важно

COVID-19 и его лечения обу словили высокую востребованность пре биотиков, пробиотиков и мономинералов. Сегодня тема «иммунно» уже менее акту альная, люди предпочитают БАДы широ кого профиля действия: витаминно-мине ральные комплексы широкого действия, омега-3, коллаген, антистресс-комплексы.
В целом в процессе разработки БАДов важно учи тывать доступную сегодня сырьевую базу, тенденции развития рынка, новые научные данные и технологии. Мы изучаем возможность разработки и запуска новых форм компонентов с максимальной усвояемостью и эффективностью, отслеживаем новые технологии про изводства биологически активных веществ и БАД, ко торые повышают биодоступность активных компонен тов, что позволяет усилить их эффективность. Для этого сотрудники компании и R&D лаборатории посещают от раслевые конференции и ярмарки, а также оперативно изучают результаты последних публикуемых научных исследований.
ЮРИДИЧЕСКИЕ ТОНКОСТИ После создания продукта идет процесс получения свидетельства о государственной регистрации. Несмо тря на то, что БАДы — это не лекарственные препараты, контроль качества у них не менее серьезный, нежели у фармацевтической продукции. В соответствии с зако нодательством Российской Федерации и Евразийского экономического союза биологически активные добавки являются специализированной пищевой продукцией и подлежат обязательной государственной регистрации. Свидетельство о государственной регистрации в РФ вы дает Федеральная служба Роспотребнадзора (в других странах ЕАЭС выдают разные службы).


35 pharmprom.ru партнер
номера
ориентироваться на потребности клиентов и отслеживать их изменения. Так,
во время пандемии
например,
специфика заболевания
В первую очередь необходимо подтвердить качество и безопас ность заявляемого продукта в аккредитованных лабораториях, далее изготовляются и предо ставляются образцы, результаты исследований, вся документация на продукт и сырье на экспертизу. После прохождение экспертизы подается второй комплект доку ментов уже в ФС Роспотребнадзо ра для получения Свидетельства о государственной регистрации. Процедура является многосту пенчатой и занимает достаточно много времени. После получения свидетель ства о государственной реги страции все сведения вносятся в единый реестр свидетельств о го сударственной регистрации, дан ные находятся в свободном до ступе, и каждый желающий может
точки зрения экономии ресурсов. Так как БАДы являются специ ализированными пищевыми про дуктами, требования к помеще
нию в сфере производства БАД стандартные — как для любого пищевого предприятия, согласно ТР ТС. Помимо исправно работа ющих водоснабжения, канализа ции и вентиляции, среди основных требований — соблюдение прин ципа поточности как в маршрутах перемещения людей на производ стве, так и в потоках сырья, полу фабриката и готовой продукции, которые не должны пересекать ся. Это в равной степени касается как больших предприятий, так и малых. Даже если вы принимае те решение запустить лишь одну линию производства, помещение необходимо будет найти довольно больших размеров — около 3000 кв. м — и с четким разделением на зоны хранения сырья, производ ства готовой продукции, смены одежды, приема пищи и так далее. А ЧТО ПРОИЗВОДИМ?
Выбор оборудования напря мую зависит от понимания, какие именно БАДы, в каких формах выпуска (капсулы, стики, банка) и каких объемах мы планируем производить. Так, стандартный список единиц, который потребу ется для одной линии производ ства биологически активных до бавок в капсулах и упакованных в последующем в коробки, будет выглядеть следующим образом:
• участок смешивания (весы, измельчитель, вибросито емко сти для перемешивания и смеси тель),
• участок фасовки смеси в капсулы (капсулятор, обеспыле ватель),
• участок упаковки капсул в блистера (блистерпак),
• участок упаковки блистеров в картонные пачки (картонажная машина, весовые контроллеры).

Если же вы решили произво дить БАДы в банках, то вам не потребуется блистерпак и карто нажная машина, здесь нужна ба ночная линия. Дополнительно можно оза ботиться более высокой степе нью безопасности продукции, приобретя рентген-детектор и металлодетектор и другую уз коспециализированную техни

36 pharmprom.ru
Все документы компания получает до момента серийного производства продукта. ВНУШИТЕЛЬНЫЕ РАЗМЕРЫ При выборе помещения у бу дущего собственника бизнеса есть два пути: задаться вопросом постройки собственного здания под производство или найти по мещение в аренду. В 2014 году мы приняли решение пойти вторым путем, так как это было более рен табельно с
с ним ознакомиться, проверить, есть ли у того или иного продук та необходимые документы.
ЭКСПЕРТНЫЙ МАТЕРИАЛ
номера ку. Для нас это оборудование обязательное, производство NL сертифицировано по междуна родному стандарту ISO 22000, и это необходимый критерий без опасности выпускаемой продук ции. Однако это оборудование дорогостоящее, и на старте таких затрат можно избежать: для со блюдения базовых требований к безопасности продукции будет достаточно пары просеивателей и металлоуловители на линии производства — на входе сырья и перед капсулированием. Следующий критерий выбора оборудования — его производи тельность. При этом лучше за кладывать производительность на 20% выше, чем планируется, потому что любое оборудование это стандартный набор железяк, а продукты на каждом предприятии свои и обладают определенными

свойствами. Реальную нагрузку и скорость, необходимую для про изводства именно вашего продук та, вы сможете оценить только в момент массового запуска. Нельзя здесь забыть и о пун ктах ТР ТС, касающихся обо рудования: оно должно быть изготовлено из материалов, соот ветствующих требованиям к про изводству пищевых продуктов. Также важны конструктив ные и эксплуатационные харак теристики техники. Для каждого продукта они свои. Среди обя зательных требований, помимо упомянутых выше материалов, разрешенных для производства пищевой продукции, также воз можность производить их мойку и (или) очищение и дезинфекцию, рабочие поверхности технологи ческого оборудования и инвен таря, контактирующие с пищевой
продукцией, должны быть выпол ненными из неабсорбирующих материалов.

Если говорить про эксплуа тацию, то оборудование должно быть удобным в обслуживании: к нему должен быть доступ, все узлы должны быть расположены так, чтобы можно было их легко ремонтировать, мыть и т.д. СМОТРИМ В СТОРОНУ АЗИИ
И конечно, приходится учиты вать реалии нашего времени: если ранее все смотрели в сторону ев ропейского оборудования, то те перь намного разумнее обратить взгляды на технику из Китая: не возникнет проблем с проведени ем оплаты, поставкой самого обо рудования, поставкой запчастей. Качество техники здесь не хуже,
37 pharmprom.ru
партнер
важно лишь приобретать его на крупных заводах, которые дают гарантии и несут ответственность, и договариваться о доставке че рез проверенных поставщиков. ПРОЦЕСС ПРОИЗВОДСТВА
Когда, наконец, завершены все подготовительные процессы, можно приступать к самому про изводству. В производственном комплексе NL в Новосибирске он выглядит следующим образом. Первый этап — навеска. Сырье поступает к оператору, смеши вание ингредиентов происходит строго по технологической кар те. Точность дозировки каждого ингредиента в одной капсуле до стигается системой многоступен чатого введения компонентов с постоянным контролем на высо коточном оборудовании. В зави симости от продукта таких ступе ней может быть 3–5, а может — и 10. Именно это позволяет равно мерно распределить микродозы по каждой капсуле.
Натуральное сырье может со держать крупные микрогранулы, поэтому смесь проходит через специальное вибросито для до полнительной очистки. После все компоненты загружаются в ем кость смесителя специальным вакуумным загрузчиком. Вручную распределить вита мины, минералы и другие полез ные вещества так, чтобы каждая капсула имела заданные пропор ции, невозможно.
Однородность массы достига ется за счет длительного враще ния во всех плоскостях в специ альном смесителе, в результате чего смесь становится 100% од нородной. После готовая смесь посту пает на участок капсулирования, здесь смесь будущих БАД дозиру ется в капсулы. Далее капсулы по ступают на упаковочную линию. В зависимости от формы выпуска это могут быть блистеры, стики или банка.

Производственный комплекс NL оснащен собственной лабо
раторией по контролю качества. Все сырье перед поступлением на производство обязательно про ходит испытание на физико-хи мический, микробиологический показатель, а также на такие показатели безопасности, как: тяжелые металлы, пестициды, микотоксины и антибиотики. На личие лаборатории на производ стве — не обязательное условие для производства БАДов, но так же будет являться дополнитель ным гарантом безопасности про дукта. Достаточно опираться на документы поставщиков сырья, при необходимости все входящее сырье можно дополнительно про верить в независимой лабора тории, но это дороже и удлиняет сроки по получению результатов исследований.
Вторым этапом проверки вы пуска готовой продукции является проверка на стадии производства. Каждый полуфабрикат прохо дит испытание на соответствие требованиям. Помимо показате лей безопасности, на всех этапах проводится и органолептический контроль — проверка цвета, вку са, внешнего вида и консистенции. Будь то сырье, смесь в стиках или капсула — в каждом цикле произ водства отдел контроля качества делает забор материала и срав нивает его с эталонным образцом. Только после получения удовлет ворительных результатов полуфа брикат допускается на фасовку и упаковку. После того как продукт упако ван, мы проводим последнюю вы борочную проверку и по итогам отпускаем продукт в реализацию. ПОВЫШЕННЫЕ ТРЕБОВАНИЯ
Для подтверждения безопас ности выпускаемой продукции компания может пройти допол нительную сертификацию на уже созданном производстве. Так, например, в 2019 году NL впер вые получила сертификат ISO 22000 — соответствие междуна родной системе менеджмента в области безопасности пищевой продукции. Наличие сертифика та означает, что вся продукция,

38 pharmprom.ru
ЭКСПЕРТНЫЙ МАТЕРИАЛ
весь путь продукта — от того, из какого сырья он сделан, до того, как его упаковали, — безопасны для потребителя в соответствии с международными стандартами. Подтверждающий аудит пред стоит проходить каждый год. В этом направлении мы сотрудни чаем с SGS — ведущая незави симая мировая компания по ин спекции, проверке, испытаниям и сертификации. Также в этом году мы прошли аудиторскую проверку для сер тификации по стандартам GMP — Good Manufacturing Practice. А также имеем сертификат «Ха ляль», который подтверждает, что компания соответствует ис ламским требованиям в вопросе производства продукции. Это не обязательные условия для произ водителя, но они несут в себе ряд маркетинговых преимуществ. Еще одна возможность для производителей БАД — это про ведение клинических испы таний. Они также не являются обязательными для вывода БАД
на рынок, однако продукт с под твержденными свойствами бо лее привлекательный. Дополнительно производите ли стараются выделить свой про дукт. Для того чтобы подтвердить все заявленные свойства продук та на упаковке, так называемую маркетинговую, «этикеточную информацию», продукту необхо димо пройти добровольную сер тификацию. В России существует всего несколько центров, где не зависимые эксперты проводят специальные

в два раза: с 3 млрд ру блей за 2021 год до 2,5 млрд руб. за первые два квартала 2022 го. По данным аналитического агент
ства Tebiz Group, российское про изводство БАДов находится в тренде роста с 2017 года, и мы как производитель и дистрибьютор прогнозируем его дальнейшее развитие — доля импортных то варов будет сокращаться в поль зу внутренних производителей, на российском рынке появляется много отечественных игроков, в том числе небольших компаний. Стимулирует внутреннее про изводство и возрастающий ин терес к биологически активным добавкам со стороны платеже способных потребителей моло дого возраста. Люди в России все больше понимают, что для того, чтобы чувствовать себя и выгля деть хорошо в 50 лет, нужно на чинать следить за состоянием своего организма уже в 25. Так, на основании исследований пор трета потребителя внутри ком пании мы отметили, что покупа тельский возраст существенно снизился — сегодня ядро нашей аудитории составляют люди в возрасте 30+.

39 pharmprom.ru партнер номера
дополнительные исследования и тесты. РОССИЙСКИЙ РЫНОК БАДОВ СЕГОДНЯ Насколько перспективно се годня производство БАД, можно оценить по выручке компаний, только за последний год выручка NL International в данном сегмен те выросла
11 МАЯ, 2022
нённости
сфере, хотя в
многих странах мира предполагаются патенты на полезную модель и промышлен ный образец. Исторически, разработки вра чебных микстур в Средние века и позже проводились в лаборатори ях и подвалах врачей, аптекарей, алхимиков и представляли собой разрозненный характер. Процесс разработки шел не быстро, усло вия разработки оставляли желать лучшего, проверка эффективности если и проводилась, то бессистем но. Поэтому, естественно, в случае хоть какого-то успеха и даже при зрачной надежды на помощь раз работанной микстуры, счастливый
разработчик ревностно охранял свой рецепт и не выдавал его нико му, иногда даже унося его с собой в могилу. Конечно, обществу (государ ству), в том числе и страдающим пациентам, такая ситуация не была выгодна ни в каком контексте – при секретных разработках и ре цептурах страдало все: качество, безопасность, быстрота разра ботки, развитие знаний в области. Общество хотело знать секретные рецепты, а разработчики не хотели терять с таким трудом полученный источник заработка, ведь тогда каждый мог бы повторить рецепт. И общество (государство) на шло выход – ввести привилегии – патенты, которые могли бы дать разработчику монополию на свой секретный рецепт, но при этом разработчик должен был бы рас крыть способ его производства и все ингредиенты.
Таким образом, у фармацев тических разработчиков сфор мировалась сделка с обществом (государством). Общество (госу дарство) выдает разработчикам монополию на определенный срок на новые изобретения, а разра ботчик, чтобы ее получить должен рассказать всю информацию по изобретению, так чтобы любой та кой же разработчик мог повторить его разработку. С тех пор менялись условия выдачи, сроки действия патентов, вводились новые правила моно полии и исключения из правил, но одно оставалось неизменным –разработчик имел право на моно полию на свою новую лечебную микстуру.

Сейчас на разработку лекар ственных препаратов тратятся миллионы долларов, десятки лет и человеческие ресурсы. Часто фар мацевтические компании продол

40 pharmprom.ru
ЭКСПЕРТНЫЙ МАТЕРИАЛ КАК ОБЩЕСТВО ПРИШЛО К ПАТЕНТАМ? В контексте
рассматриваемой статьи приводится информация и идет повествование о патенте на изобретение, в силу распростра
в фармацевтической
РФ и
Патенты в фармацевтике Анна Лапа Главный специалист по интеллектуальной собственности АО «Генериум»
на изобретения ограничивается 20 годами. Для фармацевтической области во многих странах, в том числе в России, можно продлить патент максимально на 5 лет, если регистрация препарата в регуля торных органах затянулась.

Поэтому на весь срок действия патента (20 лет + возможность продления на 5 лет) в стране полу чения патента разработчик будет иметь следующие исключитель ные права: • право использования изо бретения (может сам использо вать свое изобретение), • право распоряжения (может продать или сдать в аренду изо бретение) и • право запрета на использо вание другим лицом без его со гласия (может подать в суд иск на нарушителя и потребовать де нежных компенсаций). Есть некоторые исключения, когда изобретение можно исполь зовать без разрешения разработ чика, например, для проведения научного исследования, экспери мента, использование изобрете ния для личных, домашних и се мейных нужд.
НА ЧТО СЕЙЧАС МОЖНО ПОЛУЧИТЬ ПАТЕНТ В ФАРМАЦЕВТИЧЕСКОЙ ОБЛАСТИ? Запатентовать в качестве изо бретения можно далеко не все (п.1 ст. 1350 ГК РФ): В качестве изобретения ох раняется техническое решение в любой области, относящееся к продукту (в частности, устрой ству, веществу, штамму микро организма, культуре клеток рас тений или животных) или способу (процессу осуществления дей ствий над материальным объ ектом с помощью материальных средств), в том числе к приме нению продукта или способа по определенному назначению. При этом продукт, способ или применение продукта/способа должны быть новыми, иметь изо бретательский уровень и быть

41 pharmprom.ru партнер номера
ЧТО СЕЙЧАС ДАЮТ ПАТЕНТЫ НА ИЗОБРЕТЕНИЯ ДЛЯ ФАРМАЦЕВТИЧЕСКИХ КОМПАНИЙ? Для понимания как действует
право, нужно прежде всего понимать,
патенты дей
-
патентов
жают тратить ресурсы на иннова ционные разработки и благодаря тому, что в процессе разработки будут получены патенты на изо бретения.
патентное
что
ствуют территориально
по стра нам, и срок действия
промышленно применимым. Раз работчик не может запатентовать ацетилсалициловую кислоту, она известна давно. Таким образом, чаще всего фармацевтические разработчики патентуют в качестве продукта –активные вещества, состав пре парата, лекарственные формы, дозы лекарственного препарата, комбинации веществ и т.д.; в ка честве способа – способ получе ния активных веществ, комбина ций, лекарственных форм, способ введения препарата и т.д.; в каче стве применения – показания к применению препарата. Для каждого конкретного пре парата в зависимости от особен ностей разработки и применения прорабатывается своя стратегия патентования, так как разработка не всегда посвящена новой мо лекуле, а может касаться усовер шенствованию и решению про блем в отношении уже готового лекарственного средства. На пример, разработка пероральной формы при наличии препарата в виде раствора для инфузий на рынке.
На данный момент, фарма цевтическая отрасль в силу сво их особенностей регулирования, требований безопасности и эф фективности, необходимости по стоянного поиска новых разра боток для спасения и улучшения жизни пациентов нуждается в тщательной патентной защите и работе патентного права, иначе мы можем вернуться в Средние века к микстурам из слоновой ко сти от всех показаний. Для каждого конкретно го препарата в зависимости от особенностей разработки и
ки формируется патентный порт фель, состоящий из патентов на различные изобретения (патент на активное вещество, патент на композицию препарата, патент на применение препарата для лече ния определенного заболевания и т.д.) в разных странах мира. В течение действия указанных па тентов другие фармацевтические компании в зависимости от того какое именно защищено изо бретение не могут вывести дже нерик, биоаналог, биобеттер или улучшенный препарат на рынок.
ВЛИЯЮТ ЛИ ПАТЕНТЫ
В ФАРМАЦЕВТИКЕ НА САМОЧУВСТВИЕ
ПАЦИЕНТОВ?
Часто можно услышать резко негативное отношение к патен там в фармацевтике, в том чис ле и обвинения в намеренном ухудшении здоровья пациентов, вплоть до летального исхода. Обычно это связано со следую щими утверждениями:
Монополизировать в фарма цевтике – это негуманно, все должно быть для людей и ради людей
онный препарат, вы платите не за разработку купленного препа рата, вы платите за все попытки разработать этот препарат, за все провалы на пути разработчиков и другие препараты фармацевти ческой компании, которые так и не вышли в свет по разным при чинам, начиная от неэффектив ности, заканчивая токсичностью. За плечами одного удачного пре парата стоят тысячи провален ных на разных стадиях. И если риск фармацевтических компа ний не будет никак окупаться, то в разработки новых высокотех нологичных препаратов никто не будет вкладываться.

Компания патент получила в нашей стране и не регистриру ет, не продает препарат
касать ся усовершенствованию и реше нию проблем в отношении уже го тового лекарственного средства. Например, разработка перораль ной формы при наличии препара та в виде раствора для инфузий на рынке. Таким образом, для каждого препарата по мере его разработ
Абсолютно согласна с эти ут верждением, но, к сожалению, в нашем мире, за все нужно пла тить ресурсами. Ведь, никто не будет разрабатывать препарат бесплатно, каждый из сотрудни ков хочет получать зарплату в срок. Никто не будет поставлять оборудование и реактивы для разработки препарата бесплатно. Никто не будет арендовать поме щения под лаборатории, заводы, офисы бесплатно. Список небес платных действий в фармацевти ке бесконечен, это одна из самых рисковых в плане инвестиций в инновации и самых дорогостоя щих сфер. И именно патенты дают инвесторам надежды на возврат инвестиций и прибыль. Другой вопрос о стоимости препарата. В аптеках часто про визоры слышат о завышенных ценах и беспределе с этим свя занным. Но, покупая инноваци
Компаниям-оригинаторам вы годно ввести как можно быстрее препарат в различные страны, пока действует патентная моно полия и начать продавать препа рат, ведь именно тогда его лиди рующая функция на рынке будет неоспоримой. Патентная монополия дей ствует недолго, всего 20 лет (с возможностью продления одного из патентов, но не более чем на 5 лет), и срок действия по всем странам истекает приблизитель но в одно время. За это время компания должна довести все испытания препарата до конца, зарегистрировать препарат во всех интересующих странах, най ти партнеров и начать вводить в оборот на рынке. Не самая легкая задача. В итоге, у компаний оста ется 5-7 лет для продаж. Бывают случаи, когда компа ниям невыгодно вводить в оборот той или иной страны препарат, на пример, из-за отсутствия пациен тов. В этом случае компании либо не получают патент на территории невыгодной страны, либо получа ют, но не поддерживают и он че рез некоторое время становится недействительным. В тех редких случаях, когда компания ведет себя недобро совестно, и, получая патенты, не собирается вводить препарат в оборот, в законодательстве РФ су
42 pharmprom.ru
при менения прорабатывается своя стратегия патентования, так как разработка не всегда посвящена новой молекуле, а может
ЭКСПЕРТНЫЙ МАТЕРИАЛ
ществует механизм принудитель ной выдачи лицензии на препарат.
ЧТО СКРЫВАЕТСЯ
ПОД ПОНЯТИЕМ «ВЕЧНОЗЕЛЕНЫЕ ПАТЕНТЫ»?

Происхождение стратегии «evergreening patent (вечнозе леного патента)» приписывают Даниэлю Вазелле, председателю совета директоров компании Но вартис, сама по себе стратегия представляет собой уловку на гра ни законности: состав препарата, у которого заканчивается патент, подвергается незначительному изменению, соответственно пре парат получает новую формулу, а с ней и новый патент, который сменяет предыдущий с истекшим сроком действия. Таким образом, данная страте гия подразумевает, что один пре парат с одним патентным порт фелем, где патенты постепенно начинают заканчивать срок сво его действия, сменяют на другой препарат, немного видоизменен ный, но все равно другой препа рат, с другим патентным портфе лем, более свежим. Стратегия не подразумева ет, что первый препарат нельзя будет выпускать, просто первый препарат будет уже устаревшим, а инновационная компания про двинула новый «усовершенство ванный» препарат на рынок. Но все чаще в СМИ и от кол лег можно услышать мнение, что «вечнозелеными патентами» яв ляются совсем другие патенты. Если запатентовано активное вещество препарата, то вечнозе леными патентами начинают на зывать любые другие патенты на указанный препарат, например, на фармацевтическую компози цию. И дженериковые компании сетуют, что им нельзя «один-водин» повторить оригинальный препарат, чтобы быстро и без лишних затрат зарегистрировать препарат, не хочется же придумы вать новую фармацевтическую композицию. Вот здесь и начинаются глав ные битвы, потому что джене риковые компании хотят быстро
скопировать и только ищут воз можности для этого, при этом оригинальные компании, кото рым, естественно, не нравится сдавать позиции быстро и часто за каждым патентом стоят мил лионы долларов затрат. С одной стороны, обществу хочется пре паратов дешевле, так как с вы ходом дженериков на рынок, стоимость которых значительно ниже оригинальных препаратов, и стоимость оригинального пре парата снижается; с другой сто роны, общество заинтересовано в оригинальных препаратах и по ощрении вложений в разработки препаратов. Поэтому называть патенты «вечнозелеными» и упрекать ори гинальные компании в излишней монополизации довольно пре ждевременно, но вот пресекать недобросовестное поведение (если такое имеется) со сторо ны любых компаний, когда они пользуются лазейками в законо дательстве, можно и нужно, на пример, инициируя процесс анну лирования патента. СПАСЕТ ЛИ РОССИЙСКУЮ ФАРМОТРАСЛЬ ПРИНУДИТЕЛЬНОЕ ЛИЦЕНЗИРОВАНИЕ И ПАРАЛЛЕЛЬНЫЙ ИМПОРТ? Что такое принудительное лицензирование в фарме?
Это, когда правообладатель патента, по тем или иным причи нам недобросовестно себя ведет с монополией, которое ему вы дает государство страны патента, тогда Правительство страны или Суд выдает лицензию другому лицу до устранения недобросо вестного поведения. Например, запатентовал препарат, а препа рат не регистрирует и ввозить не собирается, или ввозит, но очень маленькими партиями, которые в разы не покрывают потребности общества. Чаще всего данный механизм предпочитают использовать в по следний момент и в самых край них случаях, так как на приме
рах многих стран доказано, что использование принудительной лицензии сильно подрывает ин ститут защиты прав разработ чиков и существенно ухудшает инвестиционный климат страны. Т.е. государству и обществу, если смотреть в перспективу, невы годно выдавать принудительные лицензии. На данный момент в РФ есть предпосылки к использованию механизма принудительного ли цензирования, но только если возникнет дефектура по какомулибо из зарубежных препаратов и не найдется аналогов препарату.
Что такое параллельный им порт в фармацевтике?
Если оригинальный препарат был зарегистрирован и офици ально введен фармацевтической компанией в другой стране, то по механизмам параллельного им порта препарат может быть вы куплен импортером в этой стране и ввезен в другую страну для по лучения разрешения импортером на этот оригинальный препарат и последующей продажи. Такой механизм параллель ного импорта введен не для всех стран и не для всех про дуктов, так как таит и плюсы, и минусы. Из плюсов часто на зывают доступность препара тов и дешевизну, из минусов - появление подделок и зависи мость от качественной транс портировки. А появление подделок и ненадлежащие условия транспортировки в такой чув ствительной области как фарма цевтика - чревато причинению вреда здоровью и жизни людей. В РФ сейчас разрешен парал лельный импорт отдельных про дуктов, список продуктов и кон кретных брендов определяется Минпромторгом. Пока в данный список не попадали фармацевти ческие препараты, но на послед нем заседании Межведомствен ной комиссии были выявлены потенциально дефектурные пре параты, так что вполне возможно, что ситуация может измениться и список параллельного импорта дополнен.
43 pharmprom.ru
партнер номера
22 ОКТЯБРЯ, 2022


44 pharmprom.ru
ЭКСПЕРТНЫЙ МАТЕРИАЛ «Стоит придумать что-нибудь оригинальное, как тут же появляются сотни подделок»! Меры противодействия подделкам лекарств на уровне производителей и дистрибьюторов
Фальсифицированные лекарства про изводятся, распространяются и продают ся по всему миру. Предотвращение, вы явление и реагирование на них является постоянной проблемой общественного здравоохранения для государств-членов ВОЗ. Во введении к Приложению 7 к се рии технических докладов ВОЗ №1025 «Надлежащая практика хранения и дис трибьюции лекарственных средств» говорится о том, что некондиционная и фальсифицированная продукция пред ставляет собой серьезную угрозу для здоровья и безопасности населения. В этой связи важно защитить цепь поставок от попадания в нее такой про дукции. Для этого необходимо соблю дение надлежащих условий хранения, транспортировки и распространения продукции, что является целью Правил
надлежащей дистрибьюторской прак тики (Good Distribution Practice, GDP). В пояснениях по составлению досье про изводственной площадки, включенных в Часть III Правил надлежащей производ ственной практики (Good Manufacturing Practice, GMP), написано, что используе мый формат досье должен включать в себя меры, предпринимаемые при подо зрении или выявлении контрафактной, фальсифицированной продукции, в том числе нерасфасованной продукции (на пример, неупакованных таблеток), ак тивных фармацевтических субстанций или вспомогательных веществ. В этой статье рассматриваются меры противодействия подделкам, которые могут и должны предпринимать произ водители и дистрибьюторы лекарствен ных средств.

Константин Морозов Специалист по GMP, аудитор фармацевтических предприятий
«Папа, еще раз повторяю:довольно торговать подделкамиэто чистая уголовщина!» (из фильма «Как украсть миллион»)
«Пре ступники, которые наживаются на пандемии COVID-19, манипулируя страхами населения и пользуясь увеличением спроса на лекарства и средства индивидуальной за
щиты, ставят под угрозу жизнь и здоровье людей» [1]. По информации Пресс-центра МВД России, в течение послед них двух лет очевидна тенденция к увеличению количества пре ступлений в фармацевтической сфере, обусловленная пандемией COVID-19. Официальный предста витель МВД России Ирина Волк рассказала, что в 2022 году со трудники российской полиции приняли участие в очередном этапе международной операции «Пангея», целью которой явля
ется объединение усилий в про тиводействии преступлениям, связанным с интернет-торговлей незарегистрированными, фаль сифицированными и недоброка чественными лекарствами, био логически активными добавками и медицинскими изделиями. В операции, которая проводится уже пятнадцатый год, принимают участие более 100 стран, задей ствуются правоохранительные и контролирующие ведомства, а координатором выступает Наци ональное центральное бюро Ин
45 pharmprom.ru
партнер номера
ВВЕДЕНИЕ Два года тому назад панде мия вызвала всплеск контрабан ды поддельными лекарствами и товарами. Гада Вали, Исполни тельный директор Управления по наркотикам и преступности в ООН
on Drugs
заявила:
(the United Nations Office
and Crime, UNODC)
терпола МВД России. Проводится мониторинг ситуации с продажей фальсификата, выявление крими нальных фармацевтических сетей и пресечение их деятельности, выстраивание дальнейшей ли нии борьбы с указанными видами преступлений [2]. В середине 2022 года в ин тервью «Известиям» глава Росздравнадзора Алла Самойлова на вопрос о ситуации с подделкой лекарственных препаратов отве тила так: «Если мы посмотрим ди намику за последние пять лет, то общее количество забракованных серий лекарств - недоброкаче ственных, контрафактных, фаль сифицированных - уменьшилось в четыре раза» [3].
Сначала давайте разбе рем разницу между терминами «фальсификация» и «контра факт».
Согласно пункту 4 статьи 1252 Гражданского кодекса Россий ской Федерации (ГК РФ), в случае, когда изготовление, распростра нение или иное использование, а также импорт, перевозка или хра нение материальных носителей, в которых выражены результат интеллектуальной деятельности или средство индивидуализации, приводят к нарушению исключи тельного права на такой резуль тат или на такое средство, такие материальные носители считают ся контрафактными и по решению суда подлежат изъятию из оборо та и уничтожению без какой бы то ни было компенсации, если иные последствия не предусмотрены ГК РФ [4]. Термин «фальсификация», свя занный с намеренным искаже нием или изменением характе ристик и свойств товара, в ГК РФ отсутствует. Контрафактная про дукция всегда одновременно яв ляется и фальсифицированной, а фальсифицированная продукция может не являться контрафакт ной. При этом часто используе мый неправовой термин «под делка» может относиться как к фальсифицированной, так и к контрафактной продукции. Среди основных понятий, ис пользуемые в Федеральном за коне от 12.04.2010 г. № 61-ФЗ
«Об обращении лекарственных средств», приведены следующие формулировки:
• «контрафактное лекарствен
ное средство» - лекарственное средство, находящееся в обороте с нарушением гражданского за конодательства; • «фальсифицированное ле карственное средство» - лекар ственное средство, сопровожда емое ложной информацией о его составе и (или) производителе [5]. В Правилах GDP Евразийского экономического союза приведено более полное определение поня тия «фальсифицированное лекар ственное средство»: • Фальсифицированное ле карственное средство - лекар ственное средство, противоправ но и преднамеренно снабженное недостоверной информацией о его составе и (или) производите ле, а также о поставках, включая записи и документы, затрагиваю щие использованные каналы дис трибьюции [6]. В Приложении 7 к серии тех нических докладов ВОЗ № 1025 определение понятия «фальсифи цированный препарат» еще более детализировано: • Фальсифицированный пре парат» (falsified product) это пре парат, в отношении которого преднамеренно и/или мошенни ческим образом было допущено искажение данных в отношении его подлинности, состава или происхождения. Такое предна меренное/мошенническое иска жение относится к любой замене, фальсификации или незаконному воспроизведению зарегистри рованного препарата, или к про изводству препарата, не явля ющегося зарегистрированным. «Подлинность» (identity) относит ся к названию, маркировке или упаковке, или к документации, подтверждающей аутентичность зарегистрированного препара та. «Состав» (сomposition) отно сится к любому ингредиенту или компоненту препарата в соот ветствии с применимыми спец ификациями, утвержденными/ признанными национальным уполномоченным органом. «Про исхождение» (source) относится
к идентификации, включая назва ние и адрес держателя регистра ционного удостоверения, произ водителя, импортера, экспортера, дистрибьютора или предприятия розничной торговли, в зависимо сти от обстоятельств [7].

МЕРЫ ПРОТИВОДЕЙСТВИЯ ПОДДЕЛКАМ ЛЕКАРСТВ
На сегодняшний день вопро сам противодействия подделкам лекарственных средств уделяют внимание многие международ ные организации, особенно Все мирная организация здравоох ранения (ВОЗ). С момента своего создания в 2012 году Механизм государств-членов по неконди ционной/поддельной/ложно маркированной/фальсифициро ванной/контрафактной (НПЛФК) медицинской продукции (Member State mechanism on substandard/ spurious/falselylabelled/falsified/ counterfeit (SSFFC) medical products) стал глобальным фо румом, на котором государствачлены собирают, координируют, принимают решения и организу ют свою деятельность по противо действию подделкам. С тех пор он предоставляет странам совмест ные, инклюзивные и прозрачные средства совместной работы для решения этой постоянной и рас пространенной проблемы. Поня тие «медицинская продукция» (medical products), которое ВОЗ использует в докладах, включает в себя лекарственные препараты, вакцины и средства для диагно стики in vitro.
По мнению ВОЗ, не существует универсального решения, которое позволяло бы эффективно проти водействовать мерам, видам де ятельности и формам, поведения, приводящим к созданию НПЛФК медицинской продукции. Для этого требуется многоуровневый подход, сочетающий в себе стра тегии предупреждения, выявле ния и реагирования и предусма тривающий координацию усилий, обмен информацией и профессио нальную подготовку в целях укре пления национального или регио нального органа регулирования и системы здравоохранения [8].
46 pharmprom.ru ЭКСПЕРТНЫЙ МАТЕРИАЛ
нения проверять подлинность ме дицинской продукции. Подобные элементы видны невооружен ным глазом, и при этом их слож
но или дорого воспроизводить. Ниже приведены примеры таких элементов защиты: • Меры контроля несанкцио нированного вскрытия - напри мер, наклейки с микропросечками для контроля вскрытия; наклей ки VOID (ВСКРЫТО) для контроля вскрытия; виниловые этикетки, разрушающиеся на мелкие фраг менты (по типу «яичной скорлу пы») и пр.
• Голограммы
• Элементы с оптически меня ющимися характеристиками
• Цветопеременные защитные
краски и пленки
• Нестойкие краски • Защитная графика
• Стираемые элементы • Открытое использование не явной технологии. Неявные (скрытые) маркеры (covert, or hidden markers) долж ны позволять национальным и/ или региональным органам ре гулирования и держателям ре гистрационных удостоверений (а также, при необходимости, другим участникам цепи поста вок, обладающим знаниями о таких технологиях) идентифи цировать медицинскую продук цию НПЛФК. Пациенты обычно не знают об их применении и не имеют средств для их проверки. Неявный защитный элемент дол жен с трудом поддаваться об наружению и копированию при отсутствии специальных знаний, а подробная информация о нем должна предоставляться только непосредственно работающим с ним лицам. В случае утечки или обнародования таких данных ценность большинства неявных элементов защиты уменьша
партнер номера Далее мы рассмотрим раз личные меры противодействия подделкам, которые могут быть приняты производителями и дис трибьюторами лекарственных средств. ПРИМЕНЕНИЕ СРЕДСТВ И ТЕХНОЛОГИЙ АУТЕНТИФИКАЦИИ Добавление 2 к докладу пя того совещания Механизма го сударств-членов по НПЛФК медицинской продукции представ ляет «Имеющиеся технологии аутентификации в интересах предотвращения появления на рынке и выявления НПЛФК ме дицинской продукции» (Available authentication technologies for the prevention and detection of SSFFC medical products). Аутентификация медицин ской продукции и ее упаковки нередко предполагает исполь зование целого ряда защитных элементов, отличающихся как технической сложностью, так и необходимым уровнем понима ния продукции. Производителям доступно большое множество технических средств аутенти фикации - от простых и при этом эффективных вплоть до весьма изощренных и крайне защищен ных. В большинстве случаев такие средства могут размещаться на одном или более элементах упа ковки, но некоторые из них могут даже внедряться в саму продук цию, путем ее непосредственной маркировки или введения фи зических или химических мар керов в лекарственную форму. В доступной литературе эти средства подразделяются на че тыре основных группы: • явные или видимые элемен ты защиты; • неявные или скрытые маркеры; • криминалистические/хими ческие методы; • модели и технологии отсле живания и прослеживания. Назначение явных (видимых) элементов защиты (overt, or visible features) заключается в том, чтобы дать возможность пациен там и специалистам здравоохра
• Цифровые водяные знаки
• Скрытые метки
• Микротекст или микропе чать
• Графика с защитой от копи рования или сканирования
• Защитные волокна или нити
• Лазерная маркировка
• Метки на штанц-формах
• Материалы основы
• Ароматические добавки. Для научного подтверждения подлинности продукции суще ствует широкий спектр кримина листических/химических мето дов (forensic/chemical techniques) - высокотехнологичных решений, требующих проведения лабора торных тестов или применения специализированных тестовых комплектов на местах. Все они без исключения относятся к скрытым технологиям, но отличаются тем, что предполагают использование научной методологии для аутен тификации элементов защиты. Важно обеспечивать, чтобы соот ветствующие маркеры/метки не влияли на целостность продук ции и не обладали токсичностью. Ниже приведены примеры таких методов:
• Химические метки
• Биологические метки
• ДНК-метки
• Изотопные соотношения
• Микрометки.
В документе ВОЗ преимуще ства и недостатки этих трех групп представлены виде таблицы (см. Таблица 1).
Модели и технологии отсле живания и прослеживания про дукции (track and trace/traceability models and technologies) в соче тании с технологиями аутенти фикации помогают обеспечивать целостность медицинской про дукции. На глобальном уровне некоторые государства-члены приняли нормативные положения в сфере прослеживания медицин ской продукции, которые в на стоящее время применяются или готовятся к применению; другие страны либо анализируют альтер нативные подходы, либо еще не рассматривали этот вопрос [8]. В России обязательность мар кировки лекарственных препара тов и работа Федеральной госу

47 pharmprom.ru
ется или даже сводится к нулю. Ниже приведены примеры таких маркеров: • Невидимая печать • Непроявленные изображе ния или трехмерная глубокая пе чать • Внедренное изображение • Водяные знаки или филигра ни
Просто онаружить и проверить
Потенциально
скопировать Иногда не требуют одобрения регулирующих органов Требуется строгая секретность (принцип "минимальной необходимой осведомленности")
Повышенный риск подделки, если применяются поставщиками компонентов Легко наносятся и сменяются
Могут сдерживать попытки преступников незаконно воспроизвести оригинальную продукцию
Упаковка может использоаться или наполняться повторно
Могут создавать ложное ощущение защищенности
Можно легко наносить и сменять
Могут легко поддаваться копированию, если общеизвестны или широко применяются
Могут также включать скрытые элементы для удостоверения подлинности Таблица 1 Преимущества и недостатки.

матизированные решения для отслеживания движения подле жащей обязательной маркировке продукции, не могут быть един ственными мерами противодей ствия подделкам лекарственных средств. На решение этой зада чи также направлены стандар ты надлежащих практик (Good Practices, GxP). СОБЛЮДЕНИЙ ТРЕБОВАНИЙ GMP В ряде разделов Правил GMP Евразийского экономического союза, утвержденных
должны предпринимать, в том числе для минимизации возможности из готовления фальсифицированных лекарственных
48 pharmprom.ru ЭКСПЕРТНЫЙ МАТЕРИАЛ дарственной информационной системы мониторинга движе ния лекарственных препаратов от производителя до конечного потребителя с использованием маркировки (ФГИС МДЛП) регла ментируется Федеральным за коном от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств» и Постановлением Пра вительства РФ от 14.12.2018 г. № 1556 «Об утверждении Положения о
мониторинга движения лекарственных
Решением Совета Евразийской экономиче ской комиссии от 3 ноября 2016 года № 77, предусмотрены меры, которые производители
средств
системе Требования к закупке исход ных и упаковочных материалов 5.27. В рамках фармацевтиче ской системы качества должны быть задокументированы вы бор, квалификация, утверждение и поддержание статуса постав ЯВНЫЕ (ВИДИМЫЕ) СРЕДСТВА ЗАЩИТЫ СКРЫТЫЕ ТЕХНОЛОГИИ ПРЕИМУЩЕСТВА НЕДОСТАТКИ ПРЕИМУЩЕСТВА НЕДОСТАТКИ Могут проверяться пациентами и работниками здравоохранения Требуют разъяснительной работы с сотрудниками
препаратов для медицинского применения» [5, 9]. Средства и технологии ау тентификации, включая авто
[10].
здравоохранения и пациентами (не всегда понятны) Повышение степени защиты за счет дополнительныз скрытызх элементов
Более защищенные решения усложняют и удорожают поставки
легко
Могут повышать эстетическую привлекательность продукции
номера щиков исходных материалов на ряду с закупками и приемкой. 5.45. Закупке и контролю пер вичных и печатных упаковочных материалов, а также обраще нию с ними следует уделять та кое же внимание, как и исходным материалам. Производитель должен быть защищен от таких ситуаций, когда изготовители поддельных лекар ственных средств могут обратить ся к поставщикам исходных и упа ковочных материалов и обманом заставить их принимать заказы на эти материалы. Для того, чтобы не
допустить попадания материалов в чужие руки, в контракты между производителем и поставщиками должны быть включены соответ ствующие положения по безопас ности и конфиденциальности. Эффективной мерой является запрет на сотрудничество по ставщиков печатных упаковоч ных материалов с привлечением третьих сторон, во избежание потери конфиденциальной ин формации. Спецификации на исходные и упаковочные материалы, со держащие конфиденциальную информацию, и макеты для пе

чати должны разрабатываться, согласовываться, храниться и передаваться с учетом мер без опасности. Следует уделить внимание хра нению и использованию средств аутентификации поставщиками материалов.
Требования к хранению и ис пользованию материалов
5.46. Особое внимание следует уделять печатным материалам. Их следует хранить в безопас ных условиях, исключающих до ступ посторонних лиц.
49 pharmprom.ru партнер
КРИМИНАЛИСТИЧЕСКИЕ / ХИМИЧЕСКИЕ ТЕХНОЛОГИИ ПРЕИМУЩЕСТВА НЕДОСТАТКИ Высокотехнологичны и надежно
от копирования Дороже других
защищены
тенологий Обеспечивают положительную идентификацию Могут открыто обрнародоваться
5.52. При поступлении про дукции и упаковочных материа лов на участок упаковки следует проверить их количество, иден тичность и соответствие ин струкциям по упаковке.
5.56. Особые меры предосто рожности должны соблюдаться при использовании разрезанных этикеток и нанесении штампов вне линии упаковки.
5.61. При существенном или необычном расхождении, уста новленном во время составле ния баланса между количеством нерасфасованной продукции, печатного упаковочного мате риала и числом произведенных единиц готовой продукции, сле дует провести расследование и установить причину этого рас хождения до выдачи разрешения на выпуск.
Печатные упаковочные матери алы должны храниться в запертых помещениях и использоваться безопасным образом. Материа лы, на которые информация и/или переменные данные о серии были нанесены вне линии упаковки (на пример, этикетки или картонные пачки), должны храниться в запе чатанных контейнерах. Видимые элементы защиты (такие как защитные этикетки, на клейки с голограммами и другие средства проверки подлинности) должны храниться в запертых по мещениях с ограниченным досту пом, с ними следует обращаться с максимальной осторожностью. Детали производства и ис пользования упаковочных ма териалов, а также используемой технологии аутентификации (в частности, скрытые элементы за щиты) должны быть известны только ограниченному числу лиц. Четкое составление материаль ного баланса может, в частности, позволить обнаружить возможное хищение материалов или продук ции для последующей подделки. Необходимо четко соблюдать процедуры по отбору, передаче, использованию и уничтожению проб материалов и продукции, а также по хранению контрольных и архивных образцов.
Требования к хранению и ути лизации отклоненных, отозван ных или возвращенных материа лов или продукции
3.23. Для хранения отклонен ных, отозванных или возвра щенных сырья, материалов или продукции должны быть предус мотрены изолированные зоны.
5.62. После завершения опе раций по упаковке любые остав шиеся упаковочные материалы с нанесенным на них номером се рии должны быть уничтожены с последующим документальным оформлением. Возврат на склад немаркированных упаковочных материалов производят в соот ветствии с утвержденной про цедурой. 5.66. Отклоненные матери алы и продукция должны иметь четкую маркировку и храниться раздельно в зонах с ограничен ным доступом. Они подлежат возврату поставщику, пере работке (если это допустимо) или уничтожению. Любые выпол ненные действия должны быть оформлены документально и ут верждены лицами, имеющими со ответствующие полномочия.
5.70. Возвращенная с рын ка продукция, над которой был утрачен контроль со стороны производителя, должна быть уничтожена, за исключением случаев, когда нет сомнений, что ее качество является удовлет ворительным.
8.28. Отозванная продукция должна быть идентифицирована и храниться отдельно в безопас ном месте до принятия решения о том, как с ней поступить. Изготовители поддельных ле карственных средств могут не только копировать оригинальную продукцию, но и повторно исполь зовать не утилизированные про изводственные отходы. Производитель должен кон тролировать уничтожение за бракованных материалов и про дукции (в том числе контрольных и архивных образцов), а также отслеживать уничтожение ма териалов, возвращенных по ставщикам. Эффективной мерой

является видеозапись процесса уничтожения. Перед заключением договора на утилизацию, произ водитель должен провести аудит организации, осуществляющей утилизацию, чтобы подтвер дить, что она соответствует предъявляемым требованиям, в том числе по безопасности. Необходимо отслеживать уничтожение макетов для печа ти, печатных форм, штанц-форм чтобы предотвратить их несанкци онированное использование. Требования к обработке и расследованию претензий, в том числе дефектов качества
7.16. Любые записи, относящи еся к оценке качества продукции, в случае предъявления претен зий, предполагаемого несоот ветствия требованиям или при расследовании в случае предполо жения о фальсификации продук ции должны быть доступны за казчику и точно определены в его соответствующих процедурах.
8.6. Особое внимание следу ет уделять установлению того, относится ли претензия или по дозреваемый дефект качества к фальсификации.
Если на любом этапе работы с претензией возникнет подозре ние, что продукт является фаль сифицированным, то необходимо сообщить об этом в отдел без опасности компании.
Отбор образцов
При подозрении на фальсифи кацию необходимо осуществить отбор образцов. Отбор должен сопровождаться заполнением до кументов, в которых необходимо подробно описать, кем, где, когда и как эти образцы были получены. Образцы должны быть надежно упакованы и отправлены в под разделение качества компаниипроизводителя для проведения экспертизы.
Регистрация
Всем поступившим на экспер тизу образцам необходимо при
50 pharmprom.ru ЭКСПЕРТНЫЙ МАТЕРИАЛ
своить уникальный номер. Этот номер должен использоваться в дальнейших коммуникациях, вно ситься в контрольные листы, жур налы для оборудования и/или по мещений.
Меры предосторожности

Персонал должен предпри нять меры предосторожности во время оценки полученных образцов, поскольку их содер жимое может содержать ток сичные и сильнодействующие вещества. Поэтому в обязатель ном порядке сотрудники должны использовать средства индиви дуальной защиты (респиратор, защитные очки, перчатки и пр.). Экспертизу нужно проводить в спе циально отведенном месте для предотвращения контаминации и/ или перепутывания продукции, и в то время, когда не выполняются другие операции, связанные с кон тролем качества продукции, про изводимой компанией.
Проведение экспертизы образцов
Сотрудники компании, знако мые с методами и особенностями производства, должны провести экспертизу упаковки. В качестве эталонных используются хра нящиеся у производителя кон трольные и архивные образцы. При проведении экспертизы мо гут применяться разные инстру менты, такие как увеличительное стекло, микрометр, цифровой фо тоаппарат и пр. В первую очередь необходимо оценить вторичную (или третич ную, если это применимо) упа ковку, затем первичную упаковку. Упаковки нужно сохранять, чтобы не уничтожить доказательства. Разрушающий контроль (лабора
ется проверочный лист, в кото рый необходимо внести как мож но больше информации, добавить примечания и сделанные фото графии. Отчет по результатам экс пертизы должен включать всю документацию, относящуюся к расследованию и содержать толь ко факты - недопустимо включе ние в него предположений и не подтвержденных фактов. Информирование
При подтверждении фальси фикации компания должна напра вить официальное уведомление в компетентные органы. При не обходимости и по согласованию с юридическим отделом, может быть подано заявление в правоох ранительные органы. Все заинтересованные ком петентные органы должны быть своевременно проинформиро ваны в случае подтвержденного дефекта качества лекарствен ного средства или исследуемого лекарственного средства (в том числе выявления фальсификации), который может привести к отзы ву продукции или необычному со кращению поставок. СОБЛЮДЕНИЕ ТРЕБОВАНИЙ GDP В большинстве разделов Пра вил GDP Евразийского экономи ческого союза, утвержденных Решением Совета Евразийской экономической комиссии от 3 но ября 2016 года № 80, упоминаются меры, которые должны быть при няты дистрибьюторами для ми нимизации риска проникновения фальсифицированных лекарствен ных средств в цепь реализации [6]. Руководящие указания, изло женные в Приложении 7 к серии технических докладов ВОЗ № 1025 «Надлежащая практика хранения и дистрибьюции лекарственных средств» (TRS 1025 - Annex 7: Good storage and distribution practices for medical products), опублико ванном в 2020 году, также могут использоваться в качестве ин струмента для предупреждения
дистрибьюции фальсифицирован ной продукции [7]. Система качества Система управления каче ством включает в себя, в том чис ле действия, необходимые для невозможности фальсификации лекарственных средств в про цессе хранения и (или) транспор тировки (п. 6).
В Приложении 7 к серии тех нических докладов ВОЗ № 1025 уточняется, что система качества должна включать процедуры, способствующие обнаружению и правильному обращению с про дукцией, в отношении которой имеется подозрение, что она не кондиционная и/или фальсифици рованная (п. 20.1).
Персонал
К обязанностям ответствен ного лица относится, в частности принятие решений относитель но фальсифицированных лекар ственных средств (п. 21).
Обучение
Дополнительно обучение должно включать аспекты иден тификации продукции и предот вращения попадания в цепь по ставки фальсифицированных лекарственных средств (п. 25).
Помещения
Лекарственные средства, в отно шении которых не принято оконча тельное решение об обращении или обращение которых приостановле но, должны быть изолированы либо физически, либо с применением электронной системы, обеспечива ющей эквивалентное разделение. Данное требование относится, на пример, к любой продукции с подо зрением на фальсификацию. Любая фальсифицированная продукция должна быть немедленно физи чески изолирована и размещена в специально выделенной зоне, от деленной от других лекарствен ных средств, пригодных для дис трибьюции (п. 32, п. 102).
51 pharmprom.ru
партнер номера
ко после неразрушающего
Документация Все
проверки не обходимо задокументировать Обычно при экспертизе заполня
торный анализ) проводится толь
кон троля (экспертизы упаковки).
проведенные
Оценка поставщиков
При подписании договоров с новыми поставщиками и про ведении проверки поставщика с целью подтверждения его компе тентности, надежности и соответ ствия установленным требовани ям, особое внимание необходимо также уделять такому фактору, как предложения по поставке ле карственных средств, наиболее подверженных фальсифицирова нию (п. 68).
Претензии, возврат, подозре ния в фальсификации и отзыв лекарственных средств из обра щения
Все подозрения в фальсифика ции должны быть документально оформлены и проанализированы в соответствии с установлен ными процедурами (п. 88). В Приложении 7 к серии тех нических докладов ВОЗ № 1025 добавлено, что необходимо под держивать записи, подтвержда ющие проведение расследования и предпринимаемые действия, такие как уничтожение продук ции (п. 20.4).
Оценка возвращенных ле карственных средств должна осуществляться до принятия ре шения об их одобрении для по вторной поставки, для успешной борьбы с фальсификацией долж ны быть согласованные дей ствия всех участников цепи ре ализации (п. 89).
В случае если при рассмотре нии претензии предполагается наличие фальсифицированных лекарственных средств, про изводитель и (или) держатель регистрационного удостовере ния должны быть уведомлены об этом незамедлительно (п. 91). Лекарственные средства, ко торые ранее были отгружены, могут быть возвращены в кате горию пригодных для поставки только в том случае, если, среди прочих выполнено следующее ус ловие: отсутствуют основания полагать, что данные лекар ственные средства фальсифи цированы (п. 96).
Фальсифицированные лекар ственные средства
Дистрибьютор должен неза медлительно информировать уполномоченный орган государ ства-члена, а также держателя регистрационного удостовере ния лекарственного препарата о случае выявления фальсифици рованного продукта или о нали чии подозрений в такой фальси фикации.
Данная информация должна быть зафиксирована докумен тально в соответствии с уста новленными процедурами с со хранением всех исходных данных, и в ее отношении должно быть проведено расследование (п. 101).

Все операции с фальсифици рованными лекарственными средствами должны быть доку ментально оформлены, с сохра нением записей (п. 103).
Транспортировка
Дистрибьютор, поставляющий лекарственные средства, обязан осуществлять транспортировку в условиях, которые включают за щиту от фальсификации (п. 121).
В Приложении 7 к серии тех нических докладов ВОЗ № 1025 также изложены дополнитель ные шаги при приемке, отгрузке и аутсорсинговой деятельности, которые направлены на то, что бы избежать попадания на рынок фальсифицированной продукции. Упаковка и грузы, не соответ ствующие критериям приемки, должны маркироваться, отдельно храниться и рассматриваться в особом порядке. Это же относится к продукции, в отношении кото рой имеется подозрение на фаль сификацию (п. 18.7). Записи по отгрузке должны содержать информацию, доста точную для обеспечения просле живаемости продукции. Такие записи, в частности, поддержи вают проведение расследования случаев обнаружения фальсифи цированной или потенциально фальсифицированной продукции (п. 18.35). Договор между Заказчиком и Подрядчиком должен, среди про
обязательства всех вовлеченных организаций в отношении принятия мер по предупреждению попадания в цепь дистрибьюции некондици онной и фальсифицированной продукции (п. 19.2).
чего
НЕМНОГО О БРАТЬЯХ НАШИХ МЕНЬШИХ
Не следует забывать, что фальсифицированные ветери нарные препараты могут стать причиной гибели как животных, так и людей.
Опасность фальсификации ле карственных средств для ветери нарного применения достаточно высока и экстраполируется на общественные отношения в сфере обеспечения здоровья и безопас ности населения. Последнее может быть под вергнуто угрозе в случаях воз никновения эпизоотий, остано вить распространение которых с помощью поддельных препара тов невозможно; при использова нии в пищу продуктов животного происхождения, полученных от скота, потреблявшего фальсифи цированные ветеринарные пре параты, и пр. [11].
В сентябре этого года проект Приказа Минсельхоза России «Об утверждении Правил надлежа щей дистрибьюторской практики лекарственных препара тов для ветеринарного применения» был размещен для публичного обсуждения на фе деральном портале проектов нормативных правовых актов https://regulation.gov.ru/ [12]. Если документ будет одобрен, то он вступит в силу 1 сентября 2023 года и будет действовать до 12 марта 2024 г. Среди прочего в доработан ном по итогам обсуждений тексте проекта говорится о том, что ком пания должна принимать необ ходимые меры для минимизации риска проникновения фальсифи цированных лекарственных пре паратов для ветеринарного при менения в цепь реализации. Однако некоторые меры, пре дотвращающие фальсификацию, в тексте документа описаны недо
52 pharmprom.ru ЭКСПЕРТНЫЙ МАТЕРИАЛ
охватывать
статочно полно, в том числе в свя зи с отсутствием в нем отдельных разделов, посвященных управ лению качеством, помещениям и оборудованию. Производство фальсифициро ванных лекарственных средств, а также ввоз в Российскую Федера цию фальсифицированных лекар ственных средств, недоброкаче ственных лекарственных средств, контрафактных лекарственных средств запрещены Федеральным законом от 12.04.2010 г. № 61-ФЗ
ССЫЛКИ:
«Об обращении лекарственных средств» [5].
***
Представленный материал подготовлен с использованием данных, актуальных на 19.10.2022. В случае получения новых или до полнительных данных статья может быть обновлена. По словам Анн Брассер, кото рая с января 2014 по январь 2016 года была Председателем Пар ламентской ассамблеи Совета
Европы, подделка лекарств явля ется грубым нарушением закона. Производство или продажа ле карственных средств, которые оказываются бесполезными или, что еще хуже, наносят прямой вред нашему здоровью, может ускорить наступление смерти и продлить или осложнить серьез ную болезнь [13].
Мы все должны стараться ра ботать так, чтобы остановить этот коварный вид преступной деятельности!
1. Новости ООН / Темы / Здравоохранение / Пандемия COVID-19 вызвала всплеск контрабанды поддельными лекар ствами и товарами.
URL: https://news.un.org/ru/story/2020/07/1381641 (дата обращения 19.10.2022)
2. МВД МЕДИА / Главная / Новости / Официально / Ирина Волк: Российские полицейские приняли участие в очеред ном этапе международной полицейской операции Интерпола «Пангея».
URL: https://mvdmedia.ru/news/official/irina-volk-rossiyskie-politseyskie-prinyali-uchastie-v-ocherednom-etapemezhdunarodnoy-politseyskoy-/ (дата обращения 19.10.2022)
3. Известия / Рубрики / Общество / «Льготники до конца года точно будут получать свои лекарства».
URL: https://iz.ru/1346828/valeriia-nodelman/lgotniki-do-kontca-goda-tochno-budut-poluchat-svoi-lekarstva (дата об ращения 19.10.2022)

4. Электронный фонд правовых и нормативно-технических документов / Гражданский кодекс Российской Федера ции, часть четвертая (с изменениями на 14 июля 2022 года).
URL: https://docs.cntd.ru/document/902019731 (дата обращения 19.10.2022)
5. Электронный фонд правовых и нормативно-технических документов / Федеральный закон от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств» (с изменениями на 14 июля 2022 года).
URL: https://docs.cntd.ru/document/902209774 (дата обращения 19.10.2022)
6. Евразийский экономический союз / Решение Совета Евразийской экономической комиссии от 03.11.2016 г. № 80 «Об утверждении Правил надлежащей дистрибьюторской практики в рамках Евразийского экономического союза».
URL: https://docs.eaeunion.org/docs/ru-ru/01411930/cncd_21112016_80 (дата обращения 19.10.2022)
7. WHO / Publications / Overview / TRS 1025 - Annex 7: Good storage and distribution practices for medical products. URL: https://cdn.who.int/media/docs/default-source/medicines/who-technical-report-series-who-expert-committee-onspecifications-for-pharmaceutical-preparations/trs1025-annex7.pdf?sfvrsn=9b8f538c_2&download=true (дата обраще ния 19.10.2022)
8. WHO / EB140/23 / Доклад пятого совещания Механизма государств-членов по некондиционной/поддельной/лож но маркированной/фальсифицированной/контрафактной медицинской продукции. URL: https://apps.who.int/iris/bitstream/handle/10665/273275/B140_23-ru.pdf?sequence=1&isAllowed=y (дата обраще ния 19.10.2022) 9. Электронный фонд правовых и нормативно-технических документов / Постановление Правительства РФ от 14.12.2018 г. № 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения» (с изменениями на 31 января 2022 года). URL: https://docs.cntd.ru/document/552002750 (дата обращения 19.10.2022) 10. Евразийский экономический союз / Решение Совета Евразийской экономической комиссии от 03.11.2016 г. № 77 «Об утверждении Правил надлежащей производственной
с фальсификацией меди цинской продукции и сходными преступлениями, угрожающими здоровью населения (Конвенция «МЕДИКРИМ», СДСЕ № 211).
URL: https://www.edqm.eu/documents/52006/62332/handbook-for-parliamentarians-medicrime-russian.pdf/2c7b72039134-26ac-6b6f-08688c025a4e?t=1623781237994 (дата обращения 19.10.2022)
53 pharmprom.ru партнер номера
практики Евразийского экономического союза». URL:
11. Иликбаева
в ст. 238.1 Уголовного кодекса Российской Федерации // Теория и практика общественного развития, 2018, № 5. URL:
(дата обращения 19.10.2022) 12. Федеральный портал проектов нормативных правовых актов / Проект Приказа Минсельхоза России
Правил надлежащей дистрибьюторской
применения».
обращения
13.
/ Пособие для парламентариев по Конвенции Совета Европы о борьбе
https://docs.eaeunion.org/docs/ru-ru/01411921/cncd_21112016_77 (дата обращения 10.10.2022)
Е.С. Фальсифицированные лекарственные средства для ветеринарного применения как компонент предмета преступления, предусмотренного
http://teoria-practica.ru/rus/files/arhiv_zhurnala/2018/5/law/ilikbaeva.pdf
«Об утверж дении
практики лекарственных препаратов для ветеринарного
URL: http://regulation.gov.ru/p/131144 (дата
21.11.2022)
EDQM / Documents
После получения данных по стабильности
лекарственных средств следует верно
интерпретировать полученные результаты. Необходимо сделать выводы о сроке годности и сформулировать требования к условиям хранения
и транспортировки. Следует учитывать какие режимы хранения
допустимо указывать по требованиям ЕАЭС, в каких случаях возможен выбор нестандартных условий.
7 ОКТЯБРЯ, 2022
Выбор верной формулировки условий хранения важен для обеспечения качества лекарственных средств на протяжении срока годности, а также по зволяет предотвратить сложности, которые могут возникнуть при транспортировке и хранении. Нередко встречаются следующие ошибки при выборе условий хранения: • Безосновательное сужение интервала усло вий хранения. Ограничения «не выше 25°С», «15-25°С» часто не обоснованы реальной необходимостью, обуслов ленной стабильностью препарата. Данные условия повышают вероятность выхода за рамки обозначенного интервала при транспорти ровке и хранении, в то время как для многих пре паратов это не оказывает негативного влияния на качество.

Вместо этих формулировок во многих ситуациях уместно использовать фразы: «хранить при темпе
ратуре не выше 30 °С» или «не требует особых усло вий хранения». • Выбор нестандартных (с точки зрения тре бований ЕАЭС) интервалов (напр., 8-15°С), • Указание избыточных ограничений, использо вание неуместных (с точки зрения требований ЕАЭС) формулировок (например: «хранить в сухом, защи щенном от света месте»). В данной статье будут рассмотрены основные требования ЕАЭС к заявляемым температурным ре жимам хранения лекарственных препаратов: • алгоритм выбора стандартных условий хранения; • связь заявляемых условий хранения с резуль татами изучения стабильности; • возможность указания нестандартных условий хранения. Также в статье приведены условия хранений
54 pharmprom.ru
ЭКСПЕРТНЫЙ
МАТЕРИАЛ
из рекомендаций ВОЗ и USP
Температурные условия хранения лекарственных препаратов ПРОБЛЕМЫ ВЫБОРА УСЛОВИЙ ХРАНЕНИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
(фармакопеи США).
по выбору условий хранения описаны в ЕАЭС в Приложении 2 руководства «Требования к иссле дованию стабильности фармацевтических субстанций и лекарственных препаратов Евразийского экономиче ского союза» (утверждено Решением № 69, вступило в силу с 14.11.2018) [1]. Данное приложение составлено на основе документа EMA Declaration of Storage Conditions for Medicinal Products Particulars and Active Substances (CPMP/QWP/ 609/96 Rev. 2) [2] и почти идентично перво источнику. В таблице 1 приведен перечень основных руководств, содержащих информацию по выбору условий хранения лекарственных средств. Требования ЕАЭС [1] в отношении только температур ных условий хранения аналогичны требованиям ГФ 14 [5] и ICH Q1 F [4].


55 pharmprom.ru партнер
ЛИТЕРАТУРА
Часть 1. Общие требования к выбору условий хранения. Варианты хранения и алгоритм их выбора для препаратов, подлежащих хранению при комнатной температуре ЕАЭС Требования к исследованию стабильности фармацевтических субстанций и лекарственных препаратов Евразийского экономического союза (утверждено Решением № 69). Приложение 2. Требования к указаниям относительно условий хранения лекарственных препаратов и фармацевтических субстанций. ЕС EMA: Declaration of Storage Conditions for Medicinal Products Particulars and Ac tive Substances CPMP/QWP/
2 РФ ГФ 14. Стабильность
testing of active phar maceutical ingredients and finished pharmaceutical products ВОЗ Good storage and distribution practices for medical products. WHO Technical
1025 - Annex 7, 2020. США USP<659> Packaging and Storage Requirements
Таблица 1. Перечень руководств по изучению стабильности, содержащих рекомендации по выбору условий хранения лекарственных
номера Юлия Спирина Руководитель группы трансфера ЗАО «ФармФирма «Сотекс»
Рекомендации
609/96 Rev.
и сроки годности лекарственных средств. ОФС.1.1.0009.18 ICH, ВОЗ ICH Q1F : представлено руководством ВОЗ: Annex 10, WHO Technical Report Series 1010, 2018 Stability
Report Series, No.
(2020)
средств.
От чего зависит выбор фор мулировки условий хранения?
• От типа условий проведения долгосрочного исследования ста бильности (комнатная темпера тура, холодильник, морозильная камера).
• От климатических зон, в ко торых планируется реализовы вать ЛС.
• От наличия результатов при ускоренных или промежуточных условиях (если применимо).
КЛИМАТИЧЕСКИЕ ЗОНЫ И УСЛОВИЯ ИЗУЧЕНИЯ СТАБИЛЬНОСТИ
Страны мира поделены на кли матические зоны, в зависимости от среднегодовой температуры и влажности. В зависимости от того к какой климатической зоне относится страна, даны рекомендации по условиям проведения долгосроч ной стабильности, информация представлена в 69 решении (при ложение 1), базовый документ, бо лее актуальный (обновлен в 2021 году) – это рекомендации ВОЗ [2].
ВАЖНО: От климатической зоны может за висеть: • выбор условий проведения долгосрочной стабильности • алгоритм выбора условий хранения: - для I-II климатических зон описан в 69 решении [1] и реко мендации EMA [3]
- для III-IV климатических зон описан в ICH Q1 F [4] и руководстве для стран Азии [7]
Долгосрочные условия изуче ния стабильности.
Условия, при которых будут про водиться долгосрочные исследова ния, определяются климатической зоной, для которой предназначен лекарственный препарат, и выби раются заявителем. Выбранные условия исследований должны соответствовать условиям и про должительности хранения, транс портировки и последующего при
I
Умеренный климат
II Субтропический или средиземноморский климат
III
IV A
IV B
Жаркий и сухой климат
Жаркий и влажный климат
Жаркий и очень влажный климат
Таблица 2. Климатические зоны [1]
менения с учетом климатических условий местности, для продажи на территории которой предназначен лекарственный препарат [1].

Для всех стран ЕАЭС для про ведения долгосрочной стабиль ности рекомендованы условия 25°C и 60%.
Но тем не менее, есть возмож ность проведения исследований в более жестких условиях. Исследо вания в неблагоприятных услови ях могут быть альтернативными условиям исследований при тем пературе 25±2°C и относительной влажности 60±5% или температу ре 30±2°C и относительной влаж ности 65±5%. [1].
Таким образом, для стран ЕАЭС при изучении долгосрочной ста бильности возможно применение одного из следующих вариантов условий: • температура 25±2°C и отно сительная влажность 60±5% • температура 30±2°C и отно сительная влажность 65±5%.
Условия ускоренной и проме жуточной стабильности
Данные условия применимы не для всех режимов хранения (например, отсутствуют для пре паратов, которые необходимо хранить в морозильной камере). Температура и влажность не зависят от климатической зоны, в которой планируется реализация препарата.
• Ускоренные условия: темпе ратура 40±2°C и относительная влажность 75±5%
• Промежуточные условия: температура 30±2°C и относи тельная влажность 65±5%.
Ускоренное изучение стабиль ности необходимо не только для того, чтобы обеспечить возмож ность экстраполяции ограничен ного набора данных долгосроч ной стабильности.
Данные, полученные при уско ренных и, если необходимо, при промежуточных исследованиях, могут быть использованы для оценки кратковременных откло нений от указанных в маркировке условий хранения (это может про изойти при транспортировке) [1].
ВАЖНО: Результаты исследований в условия ускоренной и промежу точной стабильности влияют на формулировку условий хранения. Другие условия изучения стабильности
Кроме перечисленных усло вий, дополнительно могут быть необходимы стрессовые исследо вания стабильности (в том числе фотостабильность), но на форму лировку температурных условий хранения эти исследования не оказывают влияния.
56 pharmprom.ru ЭКСПЕРТНЫЙ МАТЕРИАЛ
КЛИМАТИЧЕСКАЯ ЗОНА ОПИСАНИЕ
ВАЖНО:
Также может быть необходимо проведение изучения стабильно сти по схеме циклы охлаждение/ нагрев и/или замораживание/на грев. Необходимость проведения таких исследований напрямую не указана в 69 решении, но косвен но обозначена в приложении 2.
Данный тип исследований упо минается в ICH Q1F [4]. Результаты могут оказывать влияние на формулировку усло вий хранения.
УСЛОВИЯ ХРАНЕНИЯ ДЛЯ ПРЕПАРАТОВ, ПОДЛЕЖАЩИХ ХРАНЕНИЮ
ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ

Варианты условий хранения Выбранные условия исследо ваний должны соответствовать условиям и продолжительности хранения, транспортировки и по следующего применения с учетом климатических условий местно
для продажи на территории которой предназначен лекар ственный препарат [1].
В руководстве ЕАЭС перечисле ны следующие варианты условий хранения при комнатной темпе ратуре: • Указания отсутствуют (на этикетке). В общей характери стике лекарственного препарата и инструкции по медицинскому применению (в листке-вкладыше)
должно быть следующее указа
ние: "Для данного лекарственного препарата не требуются специ альные условия хранения"
• "Хранить при температуре не выше 30°C"
• "Хранить при температуре не выше 25°C".
Дополнительно могут понадо биться предостережения "Не хра нить в холодильнике" или "Не за мораживать". При описании условий хране
термины, как "условия окружаю щей среды" или "комнатная тем пература" [1].
Алгоритм выбора условий хранения
Описание условий хранения должно быть основано на оцен ке стабильности лекарственного препарата. Оценка фармацевтических субстанций и лекарственных пре паратов, подлежащих хранению при комнатной температуре, на чинается с поиска некоторого значимого изменения в условиях ускоренных и, если применимо, промежуточных исследований и продолжается путем анали за тенденций и вариабельности данных долгосрочных исследо ваний. [1].
Логика выбора условий хра нения заключается в следующем: если препарат успешно перено сит временное повышение тем пературы (6 месяцев при 40°С, 12 месяцев при 30°С), то нет необхо димости в строгих ограничениях верхней температуры хранения (напр., не выше 25°С).
Как раз одна из целей прове дения исследований в ускорен ных условиях это оценить вли яние повышенных температур на стабильность лекарственных средств.
Если препарат не стабилен даже при 30 °С (либо данные от сутствуют), то только тогда необ ходимо применить формулиров ку «хранить при температуре не выше 25 °С).
Следует обратить внимание, что этот подход применим только для I-II климатической зоны. Об этом более подробно написано в исходном документе EMA. дан ный текст не вошел в руководство ЕАЭС.
Средняя кинетическая тем пература включает годовые ко лебания, то есть более низкие и более высокие температуры зим ний и летний сезоны.
Таблица 3. Влияние исследований при разных условиях на формулировку температурных условий хранения.
57 pharmprom.ru
партнер номера
ТИП УСЛОВИЙ ВЛИЯНИЕ РЕЗУЛЬТАТОВ НА ФОРМУЛИРОВКУ ТЕМПЕРАТУРНЫХ УСЛОВИЙ ХРАНЕНИЯ Минимальный перечень условий изучения стабильности Долгосрочные условия ДА Ускоренные условия ДА Дополнительные условия (могут понадобиться в определенных ситуациях) Промежуточные условия ДА (если применимо) Условия для изучения стрессовой стабильности НЕТ Условия для изучения фотостабильности НЕТ Цикл замораживания (охлаждения)/нагрев ДА сти,
ния нельзя использовать такие
Таким образом, хранение при постоянной температуре 25°C во время исследований стабильно сти в реальном времени охваты вает фактическое температурное воздействие, которое может воз никнуть в условиях окружающей среды по всей Европе, включая отклонения в реальном времени от 25°C [3].
Алгоритм принятия решения, основанный на данной рекомен дации, и информации в таблице 4, представлен на рисунке 1.
ВАЖНО:
Можно заявить условия хране ния «не выше 30 °С» при наличии данных долгосрочного хранения
при 25 °С, если данные подкрепле ны успешными результатами из учения стабильности в промежу точных (при 30°С ).
Может внести сомнения в воз можность применения такого подхода фраза из ГФ 14 «Долго срочные испытания необходимо проводить при постоянных верх них (наиболее высоких) показа телях температура и относитель ной влажности установленного режима хранения в течение всего предполагаемого срока годности (периода до проведения повтор ных испытаний)» [5]. Но вероятнее всего эта фраза перешла из более старых версий,
в руководствах ЕАЭС, ICH, ВОЗ, EМА она отсутствует. Вместо этого ука зано: «выбранные условия иссле дований должны соответствовать условиям и продолжительности хранения, транспортировки и по следующего применения с учетом климатических условий местно сти, для продажи на территории которой предназначен лекар ственный препарат» [1].
Более того, в ГФ 14 представ лена таблица, аналогичная та блице 4, что опровергает смысл информации из ГФ 14, что должны совпадать верхняя температура заявленного режима хранения и температура долгосрочных ис следований.
и относительная влажность)
Долгосрочные исследования при (25±2)°C и (60±5)% и ускоренные при (40±2)°C и (75±5)%
Долгосрочные исследования при (30± 2)°C и (65±5)% и ускоренные при (40±2)°C и (75±5)%
Долгосрочные исследования при (25±2)°C и (60±5)% и промежуточные при (30±2)°C (60±5)% или (65±5)%
Долгосрочные исследования при (30±2)°C и (65±5)%
Указание в информации о лекарственном препарате *

отсутствует <2>
нет <2>
"Хранить при температуре не выше 30°C"
Дополнительное указание в информации о лекар ственном препарате <1> (при необходимости)
"Не хранить в холодильнике" или "Не замораживать"
"Не хранить в холодильнике" или "Не замораживать"
"Не хранить в холодильнике" или "Не замораживать"
"Хранить при температуре не выше 30°C"
"Не хранить в
58 pharmprom.ru ЭКСПЕРТНЫЙ МАТЕРИАЛ
ДЛЯ I-II КЛИМАТИЧЕСКИХ ЗОН
Условия проведения исследова ний, при которых подтверждена стабильность (температура
или
Долгосрочные исследования при (25 ± 2) °C и (60 ± 5)% "Хранить при температуре не выше 25 °C" "Не хранить в холодильнике" или "Не замораживать" Таблица 4. Информация о лекарственном препарате, подлежащая указанию в маркировке, в зависимости от условий проведения исследований стабильности лекарственного препарата [1] <1> В зависимости от лекарственной формы и свойств лекарственного препарата может возникнуть опасность снижения качества вследствие физических изменений при воздействии низких температур. Также в некоторых слу чаях низкие температуры могут оказывать воздействие на упаковку. В этом случае может потребоваться дополни тельная информация о лекарственном препарате, подлежащая указанию в маркировке. <2> В общей характеристике лекарственного препарата и инструкции по медицинскому применению (в листкевкладыше) должно быть следующее указание: "Для данного лекарственного препарата не требуются специальные условия хранения". * в исходном документе [3] «Required labelling statement» - информация, которая должна быть на этикетке
холодильнике"
"Не замораживать"
При выборе режима хране ний следует обратить внимание на то, какие граничные значения температурного режима допусти мы (максимальная и минималь ные температуры). При режимах «не выше 25°С», «не выше 30°С» минимальная допустимая темпе ратура хранения +2°С [5,6]. Транс портировка таких препаратов мо жет проводиться при температуре 2-8°С. Также есть вероятность, что потребитель может хранить пре парат в холодильнике. ВАЖНО: В некоторых случаях следует провести дополнительные иссле дования стабильности для под тверждения того, что препарат действительно стабилен во всем температурном диапазоне режи ма, включая самую нижнюю тем пературу интервала (+2°С) При планировании таких работ нужно определить условия иссле дования, длительность, количе ство серий, контролируемые па раметры спецификации. По результатам исследования может быть необходимо включе ние ограничений в условия хране ния, например «не охлаждать».
Условия проведения исследований, при которых подтверждена стабильность (температура и относительная влажность)
Долгосрочные исследования при (25±2)°C и (60±5)% и ускоренные при (40±2)°C и (75±5)%


















Долгосрочные исследования при (25±2)°C и (60±5)% и промежуточные при (30±2)°C (65±5)% (не успешные результаты при ускоренных условиях)
Рекомендуемые указания на этикетке

"Хранить при температуре не выше 25°C"
"Хранить при температуре не выше 25°C"
59 pharmprom.ru партнер номера
ДЛЯ III-IV КЛИМАТИЧЕСКИХ ЗОН
Долгосрочные
не выше 30°C" Долгосрочные исследования при (30±2)°C и (75±5)% и ускоренные при (40±2)°C и (75±5)% "Хранить при температуре не
Таблица 5. Информация о лекарственном препарате, подлежащая указанию в маркировке, в зависимости от условий проведения исследований стабильности лекарственного препарата – информация для IV климатической зоны [4] ЛС стабильно при ускоренном хранении (40 °С)? Да Нет ЛС стабильно при 30 °С (промежуточные или долгосрочные условия)? Не требует особых условий хранения* Да Нет Хранить при t не выше 25 °C Хранить при t не выше 30 °C * выбор данной формули ровки не зависит от тем пературы (25 или 30°С) долгосрочного изучения стабильности. Рис. 1 Алгоритм выбора условий хранения для препаратов, подлежащих хранению при комнатной температуре
исследования при (30±2)°C и (65±5)% и ускоренные при (40±2)°C и (75±5)% "Хранить при температуре
выше 30°C"
Особенности выбора условий хранения для разных климатиче ских зон
Так как страны ЕАЭС относят ся I-II климатическим зонам, то принципы определения условий хранения, представленные в тре бованиях ЕАЭС [1], могут быть не применимы для препаратов, пла нируемых к обращению в III-IV кли матических зонах, в этом случае следует обратиться к информации, представленной в документах ВОЗ [4] и Руководству по изучению ста
бильности, для препаратов, пред назначенных для реализации в странах Азии [6]. Руководство ВОЗ [4] содер жит рекомендации по изменению формулировки условий хранения, которая была выбрана для реа лизации во II климатической зоне (на примере условий, основанных на регуляторных требований ЕС, Канады, США), на формулировку, приемлемую для реализации в IV климатических зоне. Для IV климатической зоны ре комендовано выбирать для про
ведения долгосрочных исследо ваний температуру 30°С, но тем не менее допустимо использование результатов долгосрочной ста бильности, проведенной при 25°С для препаратов, планируемых к реализации в IV климатической зоне с учетом ограничений (4,6). При наличии данных долгосроч ной стабильности при 25°С можно заявить только условия хранения «не выше 25°С» даже в случае на личия успешных результатов в ус ловиях ускоренного или промежу точного изучения стабильности.
Препарат не требует специальных условий хранения (или аналогичная формулировка без упоминания температурных условий) (ЕС)
сформулированы условия хранения
Зона II + ускоренное хранение (препарат стабилен при долгосрочных условиях, нет значительных изменений при ускоренных условиях)
Рекомендованные ВОЗ условия для хранения для препаратов, реализуемых в IV климатической зоне
"Хранить при температуре не выше 25 °C"
Таблица 6. Фрагмент таблицы по рекомендациям трансформации формулировок хранения для целей реализации в IV климатической зоне [4].
исследованию стабильности фармацевтических субстанций и лекарственных препаратов Евразий ского экономического союза (утверждено Решением № 69).
2. Stability testing of active pharmaceutical ingredients and finished pharmaceutical products: Stability conditions for WHO Member States by Region. Appendix 1 - Annex 2, WHO Technical Report Series 953, 2018 (Update March 2021
3. EMA Declaration of Storage Conditions for Medicinal Products Particulars and Active Substances (CPMP/QWP/ 609/96 Rev. 2)
4. ICH Q1F .Annex 10, WHO Technical Report Series 1010, 2018 Stability testing of active pharmaceutical ingredients and finished pharmaceutical products 5. ГФ 14. Стабильность и сроки годности лекарственных средств. ОФС.1.1.0009.18
6. WHO Technical Report Series, No. 908, 2003 Annex 9 Guide to good storage practices for pharmaceuticals 7. ASEAN Guideline on Stability Study Drug Product R2

60 pharmprom.ru ЭКСПЕРТНЫЙ МАТЕРИАЛ
1. Требования к
ЛИТЕРАТУРА: Условия хранения, одобренные для II климатической зоны Пример данных по стабильности, на основе которых

охранение качества лекар ственных препаратов пред ставляет одну из главных задач на всех уровнях цепей по ставок: от производителя до ко нечного потребителя, приобрета ющего лекарственные препараты для лечения и профилактики бо лезней. Большая роль в сохране нии качества отводится надле жащим условиям хранения, как в субъектах обращения, так и при перемещении между ними, ко торые неизбежно сопровождают их доставку от места производ ства до аптечных (медицинских) организаций, в том числе внутри конкретного субъекта. Правила надлежащей практики хранения и перевозки лекарственных пре паратов [1] не разделяют требо

вания по температурному режиму к условиям хранения или транс портирования, так как эти условия должны поддерживаться на за данном производителем уровне на протяжении всего времени до ведения лекарственных препара тов до потребителя, независимо от того хранится лекарственный препарат на складе, или переме щается в транспортном средстве. Одним из главных факторов, влияющих на отклонение темпе ратуры хранения от заявленной производителем в ходе транс портирования, является откры вание дверей изотермического фургона в ходе процесса погрузки и разгрузки. На рисунке 1 пока зан типичный случай отклонения максимальной и минимальной
температуры внутри изотермиче ского фургона в ходе проведения квалификации.
Мы видим, что существенные изменения температуры в изо термическом фургоне главным образом происходят в момент от крытия дверей: как при плановых испытаниях (OQ), так и при загруз ке или выгрузке лекарственных препаратов (PQ).



Повлиять на такие отклоне ния температуры можно в местах непосредственной загрузки/вы грузки изотермического фургона, а именно: • на этапе загрузки/выгрузки

62 pharmprom.ru
С
препарата; • на этапе загрузки/выгрузки у дистрибьютора. ЭКСПЕРТНЫЙ МАТЕРИАЛ К вопросу валидации процесса погрузки и/или разгрузки лекарственных средств 1 НОЯБРЯ, 2022 Сергей Грейбо доцент Сеченовский университет Ольга Филиппова профессор Сеченовский университет Василий Беляев доцент Сеченовский университет Николай Спиридонов Специалист по метрологии и валидации АО "Сантэнс Сервис"
у производителя лекарственного
Рисунок 1 Отклонения критической температуры в фургоне транспортного средства в ходе проведения квалификации
1. Проведение квалификации функционирования (OQ), в том числе плановые открытия дверей изотермического фургона.

2. Следование к месту загрузки транспортного средства.
3. Загрузка изотермического фургона лекарственными препаратами.
4. Следование к месту выгрузки.
5. Разгрузка.
6. Следование автомобиля к месту стоянки.
7. Максимальная допустимая температура.
8. Максимальная температура в изометрическом фургоне.
9. Минимальная допустимая температура.
10. Минимальная температура в изотермическом фургоне.
В настоящей статье рассма триваются особенности этапа за грузки/выгрузки изотермического фургона на складе дистрибьюто ра лекарственных средств. В ходе верификации процесса транспор тировки были выявлены факторы, влияющие на стабильность тем пературного режима внутри изо термического фургона. Организа ция должна определить ключевые процессы, которые подлежат вали дации, к ним относятся любые про цессы, которые способны повлиять на показатели качества лекар ственного средства, либо изменить их стабильность [2,3,4]. И наруше ние требуемой температуры при погрузке/выгрузке изменяет ста бильность лекарственных средств, подпадает под этот критерий.
Если говорить о таком процес се на складе организации опто вой торговли, то можно выделить несколько основных его характе ристик: • устройство площадок; • организация работ; • численность и тип техниче ских средств; • количество задействованно го персонала; • квалификация персонала; • варианты использования оборудования; • способ хранения; • варианты загрузки транс
порта. А так как процесс транспорти ровки – это комплекс параллель

но или последовательно выпол няемых операций по разгрузке,
приёмке, хранению, доработке и отпуску товаров, то время его вы полнения является главной его переменной. Если рассматривать грузовую единицу, как термодинамическую систему, то при хранении такой грузовой единицы в условиях по стоянной температуры (в интер вале температур), ее собственная температура будет стремиться к температуре окружающего воз духа, подлежащего в соответ ствии с требованиями [1-5] стро гому контролю. Если такую грузовую единицу быстро перенести в помещение с температурой, сильно отлича ющейся от исходной, то потре буется некоторое время, чтобы температура грузовой единицы
63 pharmprom.ru партнер
номера
Рисунок 2 Актуальность температуры для нарушения стабильности лекарственного препарата
• помещения
• грузовой единицы
• заводской упаковки
• третичной упаковки
• вторичной упаковки
• первичной упаковки
• активного вещества лекарственного препарата, от которого зависит его терапевтические свойства Последовательность нагрева (теплопере дачи) в теплом помещении показана красной стрелкой.
сравнялась с температурой окру жающей среды. Причем скорость изменения температуры грузо вой единицы, заводской упаковки, первичной упаковки, активного действующего вещества (влия ющего на терапевтическое дей ствие данного лекарственного препарата) будет различной. При этом по сравнению с температу рой помещения (по которой мы делаем вывод о нарушении усло вий хранения) медленнее всего будет меняться температура ак тивного вещества (интересующая нас температура) (Рисунок 2). Поэтому, если мы обоснуем время сохранения температуры активного вещества в допусти мых пределах, при существую щих характеристиках процесса, то это даст нам высокую степень уверенности в том, что данный процесс, соответствует заданным требованиям и его использование обеспечит сохранение качества лекарственного препарата при загрузке (выгрузке) транспортно го средства. Ниже рассмотрен процесс определения максимальной про должительности процесса по грузки/выгрузки, обеспечива ющий сохранение температуры лекарственного препарата в пре делах, которые установил произ водитель.
Формирование грузовой единицы Перемещение лекарственных средств при загрузке/выгрузке производиться в грузовых едини цах. Вопрос формирования грузо вой единицы достаточно сложный. Именно от него зависит время со хранения требуемой температуры при несоответствии температу ры окружающей среды условиям хранения. Для этого необходимо сформу лировать основные требования к формированию грузовых единиц.
1. Теплоемкость материала грузовой единицы, должна быть не выше теплоемкости лекар ственных препаратов, для кото рых валидируется время сохра нения температуры. Особенно это затруднительно для организаций оптовой торговли, оперирующей разнообразной линейкой торго вых наименований лекарствен ных препаратов. 2. Порядок пакетирования гру зовой единицы (варианты пакети рования) должен быть зафиксиро ван стандартными операционными процедурами (инструкциями). Ис пытания делаются для каждого варианта или для варианта, кото рый обеспечивает максимальную теплопередачу. Например, мини мальное количество лекарствен
ных препаратов, характеристика материала упаковки, многослой ность стрейч пленки и др.
3. Относительная однородность теплоемкости лекарственных пре паратов, составляющих грузовую единицу. Лекарственные препа раты с большей теплоемкостью, должны находиться в середине формируемого объема грузовой единицы. Соблюдение выполнения дан ных требований в реальных усло виях работы оптовых поставщиков лекарственных средств представ ляется весьма затруднительным, а зачастую невыполнимым.


Во-первых, определять тепло емкость лекарственного препа рата придётся самостоятельно или прибегнуть к специализиро ванному поставщику этой услуги. Такой характеристики нет в реги страционном досье, а если и есть, то только на первичную упаковку; нас же интересует заводская упа ковка или их группа.
Во-вторых, проводить испыта ния для каждого варианта форми рования грузовой единицы доста точно проблематично, особенно для организации оптовой торговли. В-третьих, практически невоз можно определить прогнозируе мое соотношение лекарственных препаратов с разной теплоем костью, формирующие грузовую

64 pharmprom.ru
ЭКСПЕРТНЫЙ МАТЕРИАЛ
единицу, время сохранения темпера туры которой мы определяем. Выход из этого положения можно найти в формировании грузовой еди ницы из пустых коробок. Это самый критический, минимальный вариант загрузки. Любой лекарственный пре парат, помещенный в коробку, будет являться аккумулятором холода, спо собствующим повышению теплоем кости данной грузовой единицы. Некоторые специалисты пред лагают воспользоваться недобро качественными лекарственными препаратами для формирования гру зовой единицы, но это подходит про изводителям лекарственных средств, имеющим небольшую линейку про изводимой продукции. Кроме того, существуют спорные моменты тако го использования. Закон об обраще нии лекарственных средств говорит о том, что «недоброкачественные лекарственные средства, фальсифи цированные лекарственные средства подлежат изъятию из обращения и уничтожению» [4], а значит запреще но их хранение и перевозка, поэтому использование недоброкачественных лекарственных средств для этой цели представляется незаконным.
Рисунок 3 Расположение коробов на паллете


Пример проведения испытаний При испытаниях грузовая единица формировалась так, как показано на рисунке 3. Кроме того, внутри грузовой единицы размещались приборы контроля температуры, для периодической фик сации температуры (с интервалом 1 минута) на протяже нии всех испытаний.

65 pharmprom.ru
номера
партнер
На рисунке 4 коробки с размещенны ми внутри приборами контроля температуры обозначены красным цветом (по углам грузовой единицы и по центру объема). Испытания проходили в два этапа: 1. измерение температуры наружной оболочки грузо вой единицы с помощью тепловизора в ходе проведения испытаний; Рисунок 4 Схема расположения приборов контроля температуры внутри грузовой единицы Коробки с размещенными внутри приборами контроля температуры обозначены красным цветом. Пустые коробки – синим цветом.
Рисунок 5 Порядок проведения испытания • а) изображение с тепловизора в холодильной камере: температура грузовой единицы и окружающих предметов однородна • б) изображение с тепловизора сразу после перемещения грузовой единицы в теплое помещение • в) изображение с тепловизора после нахождения грузовой единицы в теплом помещении
2. расшифровка и анализ показаний датчиков кон троля температуры внутри коробок уже после завер шения испытаний. Последовательность испытаний схематично пока зана на рисунке 5. С помощью тепловизора убеждаемся, что сформи рованная грузовая единица достаточно выдержана в холодильной камере. На рисунке 5(а) видно, что тем пература отображается одним цветом как на грузо вой единице, так и окружающих предметах холодиль ной камеры.

На рисунке 5(б) и 5(в), вне холодильной камеры (температура 20°C) видно, что грузовая единица с те чением времени приобретает температуру окружаю щей среды.
Анализ показаний тепловизора и датчиков внутри грузовой единицы поможет узнать время, когда тем пература лекарственных препаратов, формирующих грузовую единицу, станет критической. Тем самым можно определить время, на которое допустимо раз мещать данную грузовую единицу без нарушения температуры хранения в теплом помещении. • На первом этапе изменения температуры нагрев внешней
измеренияточке М3, составляет почти 2,5°C в минуту! Принцип действия тепловизора основан на приеме инфракрасного спектра излучения, исходящего от на гретого объекта, т.е. самой оболочки, а нас интересует в большей степени температура активного вещества лекарственного препарата, который будет распола гаться внутри коробок. Для этого у нас предусмотре ны приборы контроля, распложённые в соответствии со схемой на рисунке 4.

Анализ графика приборов контроля температуры внутри коробок показал следующие результаты, пред ставленные на рисунке 7.

66 pharmprom.ru
ЭКСПЕРТНЫЙ МАТЕРИАЛ
заводской упаковки для транспортирования (Рисунок 6) в самом критическом месте
Рисунок
Точки измерения
6
температуры тепловизором в ходе испытания Обозначены точки измерения температуры тепловизором
Рисунок 7 График максимальной температуры внутри грузовой единицы Максимальная температура, регистрируемая в грузовой единице Максимальная допустимая температура
партнер номера В рассматриевымом случае темпера тура внутри пустых коробов сохраняется в допустимых пределах еще 9 – 10 минут после перемещения грузовой единицы из холодильной камеры в помещение с ком натной температурой. Этот период можно использовать для уточнения времени погрузки/выгрузки лекарственных препаратов при заданных характеристиках процесса или использо вать для повторных испытаний, переме щая грузовую единицу на установленный период, тем самым уточняя данные, ко торые потом лягут в основу стандартных операционных процедур и инструкций. Таким образом, для процесса погруз ки/разгрузки можно обосновать время, которое позволит с высокой степенью уверенности утверждать, что при суще ствующих характеристиках процесса он соответствует заданным требованиям, и температура лекарственного препарата останется в допустимых пределах.
1. Приказ Минздрава от 31 августа 2016 г. № 646н «Об утверждении правил надлежащей практики хранения и пере возки лекарственных препаратов для медицинского применения».
2. Приказ Минпромторга от 14 июня 2013 года № 916 «Об утверждении Правил надлежащей производственной прак тики».
3. Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. N 77 "Об утверждении Правил надлежа щей производственной практики Евразийского экономического союза".

4. Решение совета ЕЭК от 3.11.2016 года № 80 «Об утверждении Правил надлежащей дистрибьюторской практики в рамках ЕЭС». 5. Приказ Минздрава от 31.08.2016 года № 706н «Об утверждении правил хранения лекарственных средств». 6. Федеральный закон от 12.04.2010 N 61-ФЗ «Об обращении
ЛИТЕРАТУРА: ФАРМПРОМ Информационное продвижение и реклама на интернет портале Отраслевые новости Экспертные статьи Анонсы событий Баннерная реклама Email маркетинг Медиа партнерство pharmprom.ru
лекарственных средств».
11 ОКТЯБРЯ, 2022 gxpcenter.ru


сфере обращения лекарственных средств каждый год происходят новые вызовы и изменения, и 2022 год не стал исключением. Мы попросили экспертов фармацевтической отрасли и ведущих лекторов Учебного Центра «GxP», обуча ющего центра для специалистов фарма цевтических компаний, поделиться сво им видением самых актуальных вопросов фармацевтической индустрии, сделать акценты на последних изменениях зако нодательства, а также рассказать, как непрерывное обучение, актуализация знаний и обмен опытом между специали стами помогает бороться со сложно стями и держать на плаву

68 pharmprom.ru ЭКСПЕРТНЫЙ МАТЕРИАЛ
Анна Тихонова Директор по равитию учебного центра "GxP", преподаватель департамента права цифровых технологий и биоправа НИУ ВШЭ В
фармацевтическую отрасль.
обладают уникальным
отечествен ную
Наши эксперты
опы том работы в сфере, являются публику ющимися авторами и спикерами тема тических конференций, что доказывает их погружение в современную повестку фармацевтической отрасли.


































































































