
2 minute read
3.19. Cultivo de protoplastos
106
CAP ´ ITULO 3. SECCI ´ ON DEL EXPLANTE
Advertisement
Desinfecci´on del material
Lavar con agua y jab´on las inflorescencias procedentes del clon Tani (BB).
Sumergirlas en alcohol al 70 % por 5 minutos.
Transferir las inflorescencias a una soluci´on de hipoclorito de sodio al 5 % por 60 minutos.
Enjuagar el material cinco veces en agua destilada est´eril en cabina de flujo laminar.
Abrir cuidadosamente las inflorescencias y aislar las anteras eliminando el filamento.
Sembrar las anteras en el medio de cultivo establecido en condiciones as´epticas.
Transferir los cultivos a incubaci´on a 28◦ C ±.
(a) (b)
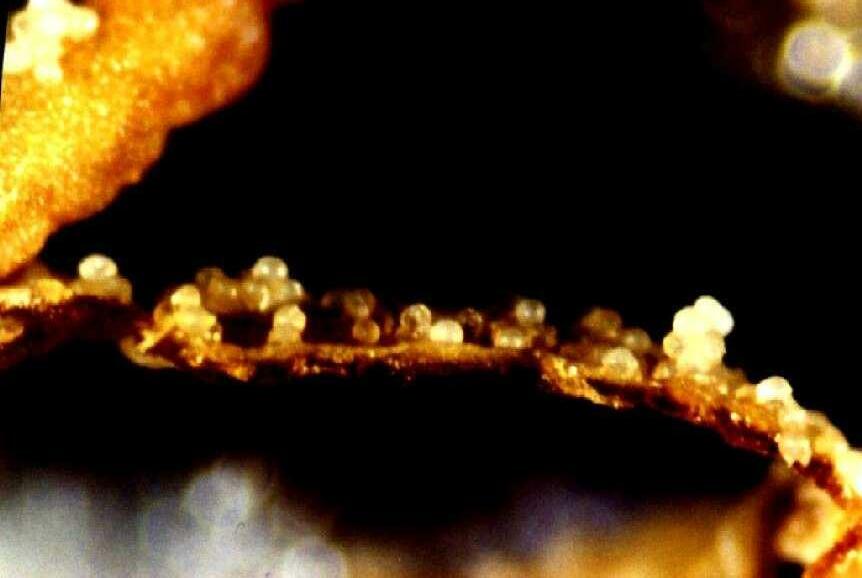
Figura 3.44. a.Inflorescencia del clon Tani (BB). b.Desarrollo de estructuras globulares haploides despu´es de cuatro semanas de cultivo del clon Tani (BB) (Perea, 1997).
El protoplasto puede definirse como la parte de la c´elula vegetal que est´a delimitada e incluida dentro de la pared celular la cual puede ser plasmolisada y aislada por eliminaci´on mec´anica o enzim´atica.
3.19. CULTIVO DE PROTOPLASTOS 107
Los protoplastos son considerados como una herramienta fundamental para la investigaci´on en biolog´ıa fundamental y aplicada. La ausencia de una pared celular r´ıgida (obst´aculo f´ısico-qu´ımico) y la completa exposici´on de la membrana celular convierten a los protoplastos en un sistema ideal para la investigaci´on en procesos de transporte y divisi´on celular, fusi´on som´atica, morfog´enesis, mutag´enesis, selecci´on y transformaci´on gen´etica. En fitopatolog´ıa, se utilizan para estudiar la etiolog´ıa de los virus, su absorci´on, procesos infectivos y replicaci´on.
Los protoplastos pueden ser obtenidos de cualquier parte de la planta cultivada en condiciones in vitro o ex vitro; tambi´en se obtienen de callo, ´apices de ra´ız o tallo, p´etalos, n´odulos, frutos, polen. sin embargo, la fuente m´as utilizada en la actualidad corresponde al mes´ofilo de ho jas j´ovenes.
El aislamiento de protoplastos depende, en gran medida, del tipo y de la concentraci´on de las enzimas utilizadas. Las dos enzimas esenciales son la celulasa y la pectinasa, que degradan espec´ıficamente el componente celul´osico y pect´ınico de la pared celular. Algunos tejidos tambi´en requieren hemicelulasas adicionales para una correcta digesti´on de la pared. Todos los preparados enzim´aticos incluyen impurezas, como nucleasas y proteasas, que pueden tener un efecto negativo sobre la viabilidad celular. Las enzimas son pH dependientes (4-6) y su temperatura ´optima de actuaci´on es de 40 a 60◦C (Keller et ´al., 1973). Debido a la fragilidad osm´otica de los protoplastos, es necesario controlar perfectamente el potencial osm´otico de la soluci´on enzim´atica, de la soluci´on de lavado y de la soluci´on de recuperaci´on y cultivo de los protoplastos. Para lograrlo se utiliza sorbitol, manitol, sacarosa, glucosa, y cloruro c´alcico en diferentes concentraciones. La pr´actica est´aorientada al aislamiento de protoplastos mediante el m´etodo mec´anico y el m´etodo enzim´atico y su posterior observaci´on al microscopio.
Para la manipulaci´on de los protoplastos se consideran diferentes etapas:
Primera etapa: obtenci´on, preparaci´on y desinfecci´on del material vegetal.
Segunda etapa: eliminaci´on de la pared celular mediante enzimas l´ıticas, en soluci´on de alto potencial osm´otico.







