NYTT BLANDESETT FOR BCG-medac
TIL BEHANDLING AV
IKKE-MUSKELINVASIV BLÆREKREFT

KLIKK
LUERLOCK
Utvalgt sikkerhetsinformasjon
Kontraindikasjoner:
Overfølsomhet overfor virkestoffet eller overfor noen av hjelpestoffene, immunsuppresjon eller kongenitale eller akvirerte immundefekter, aktiv tuberkulose, tidligere strålebehandling av blæren, amming, skal ikke instilleres før 2 til 3 uker etter TUR, blærebiopsi eller katetertraumatisering, blæreperforasjon som kan resultere i en økt risiko for alvorlige infeksjoner i hele kroppen, akutt urinveisinfeksjon.
Advarsler og forsiktighetsregler: BCG-medac skal ikke brukes til subkutan, intradermal, intramuskulær eller intravenøs administrasjon eller vaksinasjon. Det kan representere en utfordring å skille en BCG-infeksjon fra en BCG-immunreaksjon, da symptomene innledningsvis er svært like. I motsetning til dette er en forbigående systemisk BCG-reaksjon en svært vanlig bivirkning som må differensieres. De kliniske tegnene og symptomene på begynnende BCG-infeksjon/-reaksjon er feber > 39,5 °C i minst 12 timer, feber > 38,5 °C i minst 48 timer og forverret allmenntilstand. Typiske tegn på infeksjon er utvikling av miliær pneumoni, granulomatøs hepatitt, abnormiteter i leverfunksjonstest (særlig forhøyet alkalisk fosfatase), organdysfunksjon (annet enn urogenitalsystem) med granulomatøs inflammasjon ved biopsi over tid. Ved mistanke om systemisk infeksjon må lege som er spesialist på infeksjonssykdommer konsulteres. BCG-infeksjon kan potensielt være dødelig. Infeksjon i urinveiene skal utelukkes før hver instillasjon av BCG i blæren. Hvis en inflammasjon i urinrøret blir oppdaget under BCG-behandling, skal behandlingen avsluttes inntil en igjen får negativ bakteriekultur fra urin, og behandling med antibiotika er avsluttet. Muligheten for alvorlig systemisk BCG-infeksjon med behov for anti-tuberkulosebehandling må tas i betraktning før BCG-behandlingen starter, særlig hos eldre pasienter og pasienter med nedsatt leverfunksjon. I tilfelle mistanke om systemisk infeksjon bør en rådføre seg med en lege som er spesialist på smittsomme sykdommer. BCG-infeksjon kan potensielt være dødelig.
Bivirkninger: Svært vanlige: cystitt og betennelse (granulom) i blæren, asymptomatisk granulomatøs prostatitt, forbigående systemisk BCG-reaksjon (feber < 38,5 °C, influensalignende symptomer, inkludert illebefinnende, feber, frysninger, generelt ubehag, myalgi), kvalme, hyppig vannlating med ubehag og smerte, fatigue. Vanlige: diaré, abdominalsmerter, myalgi, urininkontinens, feber > 38,5 °C.
BCG-medac, (BCG (Bacillus Calmette-Guérin) bakterier avledet fra Mycobacterium bovis-stamme), pulver og væske til intravesikalsuspensjon, ATC-kode: L03A X03. Indikasjoner: Behandling av ikke-invasiv urotelial blærekreft (karsinom): kurativ behandling av karsinom in situ. Profylaktisk behandling av rekurrens av: urotelial karsinom begrenset til mucosa: Ta G1-G2 hvis multifokal og/ eller rekurrent tumor, Ta G3, urotelial karsinom i lamina propria, men ikke i blærens muskulatur (T1), karsinom in situ. Dosering: BCG-behandling skal starte ca. 2 – 3 uker etter transuretral reseksjon (TUR) eller blærebiopsi, og uten katetertraumatisering, og gjentas med en ukes mellomrom i 6 uker. Dette bør oppfølges med vedlikeholdsterapi, i det minste for tumorer med middels og høy risiko. Refusjon: H-resept. Reseptgruppe C. Pakninger og priser: 3 sett (hettegl. + pose), 6 500,30 kr. (priser og refusjon oppdateres hver 14. dag). Basert på preparatomtale: 10.2024. medac, e-mail: info@medac.no, tel +47 90 63 81 04, Postbox 84, 1312 Slependen, Norge. Sist endret: 10/2024.

TEMAER I 2025:
Nr. 1. Plastikkirurgi
Nr. 2. Bryst- og endokrinkirurgi
Nr. 3. IBD
Nr. 4. Nevrokirurgi
INNLEVERINGSFRISTER:
Kirurgen nr 2-25: 24. april
Kirurgen nr 3-25: 24. august
Kirurgen nr 4-25: 24. oktober
Kirurgen ønsker å være en nasjonal plattform for kirurgi ved å inspirere til faglig kompetanseheving, bedre utdanning og opplæring av unge kirurger, samt øke interessen for kirurgisk forskning.
UTGIVER
Norsk Kirurgisk Forening
Pb 17 Kjelsås, 0411 Oslo
ISSN 1504-88 88
REDAKSJON Tobias Hauge (redaktør) OUS Ullevål tobias@kirurgen.no
Marte Bliksøen (redaksjonsmedlem) OUS Rikshospitalet marte@kirurgen.no
Saira Mauland Mansoor (redaksjonsmedlem) Vestre Viken Bærum sykehus saira@kirurgen.no
Ingvar Rognum (redaksjonsmedlem) Vestre Viken Bærum sykehus ingvar@kirurgen.no
David Hui (redaksjonsmedlem) OUS Rikshospitalet david@kirurgen.no
LAYOUT, PRODUKSJON OG ANNONSESALG WebPress
Tlf.: 22 76 00 00 john@webpress.no www.webpress.no





Sentral lymfadenektomi ved høyresidig tykktarmskreft er trygt og gjennomførbart både åpent og laparoskopisk
Intranasal prosedyresedasjon til barn med deksmedetomidin og ketamin – et trygt og nyttig verktøy
Kostnader ved behandling av abdominale aortaaneurismer og karotisstenoser – erfaringer fra Haukeland universitetssjukehus og St. Olavs hospital
MALTHES LEGAT

EN SAK HAR SOM REGEL MER ENN ÉN SIDE
Selv om det nye året så vidt har kommet i gang, har kirurger generelt og OUS spesielt, virkelig vært utsatt for medienes søkelys. Flere alvorlige saker er tatt opp, både i forbindelse med avdeling for traumatologi ved OUS Ullevål, gastrokirurgisk avdeling ved samme sykehus og nå sist en samarbeidsavtale mellom plastikkirurgisk avdeling ved OUS og Bærum sykehus. Alle tre saker burde og kanskje kunne vært håndtert annerledes, men det er også viktig å minne om at mediene aldri framstiller alle sider ved en sak. Foruten å informere samfunnet om en sak skal de skape debatt og ikke minst skal det de informerer om og skaper debatt om, selge. Det er ikke sånn at det alltid er én part som har rett og den andre parten som tar feil. Det er heller ikke sånn at det å utpeke enkeltpersoner til syndebukker i riksmediene er særlig konfliktskapende. Personlig synes jeg det faktisk er direkte ufint. Et velfungerende samarbeid krever to parter som begge kan gi og ta.
Det nye året bringer også med seg endringer for Kirurgen. Vi ønsker å ha mer fokus på originalartikler, det være
seg alt fra små kasuistikker til forskningsarbeid. I dette nummeret kan dere blant annet lese om et spennende prosjekt ved Skien sykehus hvor de har brukt intranasal medisinering for sedasjon av barn.
Jeg ønsker også å minne om den pågående skrivekonkurransen som ble utlyst i forrige nummer av Kirurgen. Vi deler ut fire billetter til et skrivekurs som går av stabelen 16. og 17 juni i Oslo hvor foredragsholderne er redaktører i NEJM, Gastroenterology, Annals of Internal Medicine og vårt eget Tidsskriftet. Dette er en førsteklasses kurs som du ikke vil gå klipp av! Har kan du lære av de beste! Billetter kan vinnes ved å skrive en kasuistikk for Kirurgen med frist 01.04.24, se annonse side 57 i dette bladet.
Tema for dette nummeret er rekonstruktiv plastikkirurgi. Her venter dere mange spennende artikler om utfordrende kasus som virkelig viser hvordan kirurgi kan endre livet til enkeltpersoner. Jeg ønsker dere alle en riktig god leseopplevelse!
TOBIAS HAUGE , REDAKTØR
TOBIAS @ KIRURGEN.NO




KIRURGEN SØKER NYTT REDAKSJONSMEDLEM!
Ønsker du å bli kjent med kirurger fra hele landet? Ønsker du å øke din fagkunnskap om alt fra gastrokirurgi til ortopedi og nevrokirurgi? Ønsker du å arbeide i det eneste norske fagtidsskriftet som når ut til alle Kirurger? Da søker vi deg!
KVALIFIKASJONER:
• Være under utdanning eller ferdig spesialist innenfor en kirurgisk, ortopedisk eller nevrokirurgisk spesialitet
• Være nøyaktig, spørrende, interessert i faget og kunne holde tidsfrister.
• Ha et ønske om å videreutvikle Kirurgen til et enda bedre tidsskrift enn hva det er i dag
Høres dette ut som deg?
Ta kontakt med redaktør, Tobias Hauge, epost: tobias@kirurgen.no
Confidence with Signia™ and Tri-Staple™ technology
Confidence with Signia™ and Tri-Staple™ technology
The intelligent performance of Signia™ with Tri-Staple™ technology provides better staple formation across sizes and delivers distinct advantages compared to the da Vinci SureForm™* robotic stapler.1,†
The intelligent performance of Signia™ with Tri-Staple™ technology provides better staple formation across sizes and delivers distinct advantages compared to the da Vinci SureForm™* robotic stapler.1,†
Fired staple comparison
Fired staple comparison
Test tissue thickness SureForm™* stapler (indicated tissue thickness)
Test tissue thickness SureForm™* stapler (indicated tissue thickness)
Black (2.30–4.00 mm)
Signia™ linear stapler with Tri-Staple™ technology (indicated tissue thickness)
Signia™ linear stapler with Tri-Staple™ technology (indicated tissue thickness)

Staple formation reference
Staple formation reference
Extra thick
2.80–3.2 2mm Black (2.30–4.00 mm) Black (2.29–3.00 mm)
Extra thick
2.80–3.2 2mm
Thick
Thick

2.50–2.80 mm Green (2.00–3.30 mm)
2.50–2.80 mm
Green (2.00–3.30 mm)

Medium/Thick 1.90 mm Blue (1.50–2.40 mm)
Medium/Thick 1.90 mm
Blue (1.50–2.40 mm)

More security1,†
More security1,†
114% greater staple line security across staple sizes1,†
114% greater staple line security across staple sizes1,†
Black (2.29–3.00 mm)


Optimally formed staple
Optimally formed staple

Undercrimped staple
Undercrimped staple
(1.50–2.29 mm)
Purple (1.50–2.29 mm)


Functional closure
Functional closure
Better performance under pressure1,†
Better performance under pressure1,†
Signia™ with Tri-Staple™ black staple lines can withstand 20% greater leak pressure1,† than SureForm™* black staple lines
Signia™ with Tri-Staple™ black staple lines can withstand 20% greater leak pressure1,† than SureForm™* black staple lines
Less bleeding1,†,‡
Less bleeding1,†,‡
Signia™ with Tri-Staple™ tan staple lines are 37% less likely to bleed1,†,‡ than SureForm™* white staple lines
Signia™ with Tri-Staple™ tan staple lines are 37% less likely to bleed1,†,‡ than SureForm™* white staple lines
Meet clinical challenges with confidence. Visit https://www.medtronic.com/covidien/en-gb/surgical-stapling-innovation.html
Contact your Medtronic representative today to experience the Signia™ stapler with Tri-Staple™ technology.
Contact your Medtronic representative today to experience the Signia™ stapler with Tri-Staple™ technology.
Meet clinical challenges with confidence. Visit https://www.medtronic.com/covidien/en-gb/surgical-stapling-innovation.html
†When fired in indicated porcine tissue thickness. Preclinical testing may not be indicative of clinical performance. ‡P-value of 0.061, statistical significance seen at 10-minute time point.
†When fired in indicated porcine tissue thickness. Preclinical testing may not be indicative of clinical performance.
‡P-value of 0.061, statistical significance seen at 10-minute time point.
1. Based on internal report #RE00498029, Competitive evidence final report — Signia™ with Tri-Staple™ technology vs. Intuitive’s da Vinci robotic stapling system with SureForm™* SmartFire technology. ©2024 Medtronic. Medtronic, Medtronic logo, and Engineering the extraordinary are trademarks of Medtronic. ™* Third-party brands are trademarks of their respective owners. All other brands are trademarks of a Medtronic company. emea-st-2400048-signia-and-tri-staple-vs-sureform-ad--emea-14451623
1. Based on internal report #RE00498029, Competitive evidence final report — Signia™ with Tri-Staple™ technology vs. Intuitive’s da Vinci robotic stapling system with SureForm™* SmartFire technology.
©2024 Medtronic. Medtronic, Medtronic logo, and Engineering the extraordinary are trademarks of Medtronic.
™* Third-party brands are trademarks of their respective owners. All other brands are trademarks of a Medtronic company. emea-st-2400048-signia-and-tri-staple-vs-sureform-ad--emea-14451623
Foto: Arkady Rutkovskiy

MARI - LIIS KALJUSTO , LEDER NKF
MARI - LIIS.KALJUSTO @ OUS - HF.NO
HØR HVA VI SIER
IKKE MISFORSTÅ DET DERE TROR DERE HØRER
Den 15. januar 2025 gikk styret i NKF ut med en advarsel i Dagens Medisin om den kritiske situasjonen traumeavdelingen på OUS befinner seg i (1). Denne saken ble ytterligere belyst i en reportasje på Dagsrevyen den 18. januar 2025. Med rette har den nå blitt løftet til politisk nivå, og vi håper på en løsning.
NKF har ingen mening om hvordan løsningen bør se ut, men det er avgjørende at traumefunksjonen ved OUS ivaretas, og at alle kirurger har akseptable arbeidsvilkår. Som leder i NKF er det min plikt å løfte denne saken –både for traumeoverlegene ved OUS og for pasientene de behandler.
Det overrasker meg at mange ser gode arbeidsvilkår som en begrenset ressurs – som om bedre forhold for én gruppe må gå på bekostning av en annen. Det er sykehusledelsens ansvar, ved alle landets sykehus, å sørge for at alle kirurger har forsvarlige arbeidsforhold.
NKF fordeler ikke skyld og kommer ikke med konkrete
løsningsforslag – vi belyser kun situasjonen ved traumeavdelingen på OUS for å sikre at den blir håndtert.
De imponerende rekonstruksjonene i dette nummeret av Kirurgen inspirerer. De viser hvordan man kan skape noe fantastisk med svært begrensede ressurser – muskellapper, hud, blodårer og bein. Ved å flytte disse kan man rekonstruere et ansikt, skape noe nytt og funksjonelt.
Det er nettopp det traumekirurgien trenger: ikke en kosmetisk justering, men en større rekonstruksjon som sikrer funksjonen. Med de ressursene som finnes, og uten at systemet selv stritter imot når nødvendige endringer må gjøres. La oss håpe at den postoperative perioden – rehabiliteringen og rekonvalesensen – går så komplikasjonsfritt som mulig. For selv store rekonstruksjoner går som regel bra dersom det håndteres av et kompetent team.
Mari-Liis Kaljusto
Leder NKF

Synlig og effektiv fettfjerning med den milde kraften til vann
Med WAL-metoden (Water Assisted Liposuction) kan du målrettet fjerne uønskede fettavleiringer med maksimal presisjon og forme kroppen slik du ønsker. Denne minimalt invasive prosedyren kan utføres både under lokalbedøvelse og full anestesi.
Fettets kraft – naturlig volum og forsterkning med vannstråleassistert fettsuging WAL-metoden sikrer en skånsom og presis prosess for både fetthøsting og overføring. Ved å bruke vannets kraft kan vi forsiktig separere og samle sunne fettceller, noe som bevarer kvaliteten deres og øker sjansene for overlevelse etter overføringen.
WAL
Hovedbruksområder:
• Fettransplantasjon
• Fettsuging
• Hydro-disseksjon
• Regenerativ medisin (SVF)
God fettkvalitet er avgjørende, og overlevelsesraten for fettcellene er høyest med vannassistert fettsuging ved bruk av Body-jet fra HumanMed.
Les mer på: https://www.humanmed.com/en/
Har du spørsmål eller andre henvendelser?
Ta kontakt med Produktsjef Mia Samira Steen. E-post: mia.samira.steen@mediq.com
Lipocube Nanocube er et engangsverktøy som brukes til å bearbeide fettvev hentet fra pasienten selv. Det omdanner fettvevet til forskjellige størrelser – milli, mikro og nanofett – avhengig av hvor dypt det skal injiseres.

KAN KIRURGI MØTE MAGI? REKONSTRUKSJON ETTER
TRAUME – MER ENN BARE SYING
INGER KARIN FUGLESTEG
AVDELING FOR PLASTIKK- OG REKONSTRUKTIV KIRURGI, OUS
KORRESPONDANSE: INFUGL @ OUS - HF.NO

INGER KARIN FUGLESTEG
Plastikkirurgi består av to hovedretninger; rekonstruktiv plastikkirurgi og estetisk plastikkirurgi. De to hovedretningene skiller seg fra hverandre når det gjelder hensikten og målet med den kirurgiske behandlingen.
Likevel er det jo slik at utseende opptar de fleste av oss, og vi vil gjerne fremstå i best lys. Dette gjelder også pasienter som har vært gjennom store inngripende traumer der utseende har endret seg og påvirket eget selvbilde og psykisk helse. Derfor er det alltid et delmål å sikre et så godt estetisk resultat som mulig, i tillegg til rekonstruksjonen.
Ansiktstraumer er typiske skader som blir svært synlige for omverden. Rekonstruksjonsmulighetene er varierte, og gjør at man kan tilby løsninger, selv om utgangspunktet etter traumet er omfattende. Ved fascialis pareser er det viktig å identifisere skaden på tidlig tidspunkt, samt henvise til riktig instans raskt, da tidsvinduet for direkte kirurgi er relativt kort!
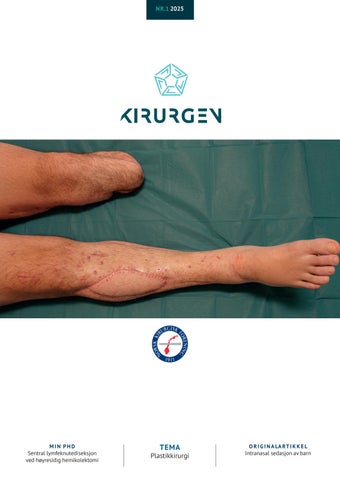
Kirurgien vi utfører speiler verden vi lever i. Når trusselbildet i verden endrer seg, samt krig i Europa, er kunnskap om rekonstruksjon etter krigskirurgi mer aktuelt enn på lang tid. Erfaringer fra underekstremitetstraumer er god kunnskap å bygge videre på når vi får nye utfordringer med rekonstruksjon av gamle krigsskader. MEDEVAC posten på Ullevål har høstet verdifulle erfaringer i behandlingen av traumepasienter fra Ukraina. Forsidebildet viser en pasient som er amputert i hjemlandet, der vi har klart å bevare den andre underekstremiteten.
I nord utføres det militære øvelser og ingen har større erfaringer fra frostskader her til lands enn Plastikkirurgisk avdeling i Tromsø nettopp grunnet utenlandske soldater på trening i kalde nord. Oppdatert viten på feltet deles med oss i denne utgaven.
Rekonstruktiv plastikkirurgi er et spennende fag, der vi har hele kroppen som arbeidsfelt. Vi er derfor vant å samarbeide med mange ulike fagfelt, da tverrfaglig samarbeid er viktig i rekonstruksjonen for å tilby pasienten best mulig behandling. Et glimrende eksempel på slikt samarbeid kan du lese om i kasuistikk av thoraxpasient.
Dette nummeret av Kirurgen gir et innblikk i vårt mangfold og jeg håper det kan gi økt kunnskap om rekonstruktiv plastikkirurg som fagfelt.
Stor takk til alle bidragsytere!
God lesing!
REKONSTRUKTIV PLASTIKKIRURGI
Plastikkirurgi (gresk - plastos, som betyr formet, modellert) er spesialiteten som fokuserer på rekonstruksjon og estetikk. Disse to entitetene har ofte vært adskilt i sin forståelse og bidratt til forvirring, selv blant helsepersonell, men overlapper i betydning og klinisk praksis. Lapp er vev som flyttes fra et sted til et annet sted på kroppen. Denne artikkelen forsøker å gi en forklaring på muskellapper og perforatorlapper. Begge disse hovedgruppene får blodforsyning fra én eller flere definerte arterier med deres tilhørende vener. Disse arteriene kalles stilk eller pedikkel.
VEDAD MESIC
AVDELING FOR PLASTIKK- OG REKONSTRUKTIV KIRURGI, OUS
KORRESPONDANSE: VEDMES @ OUS - HF.NO
Den moderne plastikkirurgi ble født under første verdenskrig med Sir Harold Gillies (1882-1960), en new zealandsk ØNHkirurg som behandlet soldater med alvorlige og omfattende ansiktsskader (1). Som den største pionéren for ansiktsrekonstruksjon banet han vei for den estetiske kirurgien vi kjenner i dag. Rekonstruktiv kirurgi berører mange andre kirurgiske spesialiteter og fagområder (onkologi, traumatologi, medfødte tilstander med mer) hvor formålet er å bevare og/eller gjenopprette funksjon og utseende.
TIMING AV KIRURGI
Det diskuteres fortsatt hvor fort rekonstruksjon bør utføres, spesielt i traumatologi. Dr. Marko Godina (194386), en slovensk plastikkirurg, som gjennom sitt kliniske arbeid postulerte at rekonstruksjon med frie lapper på underekstremiteter burde gjøres innen 72 timer (2). Etter denne tidsfristen økte komplikasjonsraten betydelig. Studier har vist at denne perioden trygt kan utvides opp til 10 dager uten å nevneverdig påvirke komplikasjonsraten eller kompromittere resultatet (3,4). Dette har gitt større fleksibilitet i en travel klinisk hverdag med faktorer som
begrensede ressurser og operasjonskapasitet. Introduksjon av vakuum-assistert sårbehandling (VAC) har vært viktig i denne venteperioden. Det er bred enighet om viktigheten av infeksjonsfrihet og velutført revisjon før en dekningsprosedyre.
REKONSTRUKTIVE METODER
Den rekonstruktive stigen (Figur 1) har tradisjonelt veiledet kirurger ved valg av rekonstruksjonsmetode, hvor man avanserer fra nivå til nivå, basert på sårets kompleksitet, og følger prinsippet med å bruke den minst krevende teknikken. Fra den enkleste løsningen med sekundær tilheling til den mest avanserte med fri vevsforflytning og mikrokirurgi. Mellom disse ytterpunktene finnes direkte lukking (primær eller sekundær), hudtransplantasjon, bruk av lokale lapper, vevsekspansjon og regionale lapper. I løpet av de siste tiårene har trenden blitt å velge den metoden som egner seg best for den enkelte pasient, defekt og med fokus på det estetiske og funksjonelle resultatet det man i litteraturen og klinikken beskriver som «den rekonstruktive heisen» (5,6).
HUDTRANSPLANTASJON
Hudtransplantater består enten av full eller delvis tykkelse av huden. De beskrives som frie graft, men har ingen egen vaskulær forsyning og er avhengig av neovaskularisering fra sårsengen på sin nye lokalisasjon (7). Sårsengen må være vaskularisert og infeksjonsfri. Transplantater kan derfor ikke legges direkte på ben, brusk eller sener. De skal heller ikke legges på nevrovaskulære strukturer. Paratendon, perikondrium, muskelfascie og muskel er gode sårsenger. Subkutant fettvev kan også være et alternativ (8). De innehar forskjellig donorsted-profil med hensyn til lokalisasjon og tilheling. De har en rolle også ved avansert rekonstruksjon siden de dekker muskellapper og donordefekter der det er nødvendig.
MUSKEL- LAPPER
Musklene i kroppen har ulik arteriell forsyningsmåte og kan kategoriseres. Mathes-Nahai klassifisering beskriver fem typer basert på antall pedikler og hvilke som er dominante (9). Dette er et viktig verktøy i forbindelse med kirurgisk planlegging og høsting av en lapp. Muskellapper kan høstes isolert eller med hudøy (myokutane) (Figur 2). Muskelen må dekkes med et delhudstransplantat. Hudøy kan brukes for å dekke defekt, men også for å monitorere sirkulasjon. Denne teknikken er muskelofrende og valg av donorsted er meget viktig. Den kan oppleves som gammeldags, men har likevel fortsatt verdi. For eksempel kan m. latissimus dorsi dekke veldig store defekter. Noen muskellapper høstes tynne og alle (non-innerverte) gjennomgår atrofi, noe som er fordelaktig på krevende områder, for eksempel på fotryggen hvor det trengs minst mulig fylde.
PERFORATOR- LAPPER
Perforatorlapper har revolusjonert rekonstruktiv kirurgi og sammen med mikrokirurgi utviklet hverandre (10,11). Disse lappene, bestående av hud og fett, baseres på perforatorer som utgår fra et dypt karsystem, og som på ulike måter penetrerer muskulatur og forsyner huden i sitt respektive angiosom (Figur 3) (12).
Perforatorlapper kan inkludere muskelfascien (fasciokutane) eller kun bestå av hud og under



FIGUR 3. Perforatorlapper (med ulike karforløp) - Illustrert av Selma Evenstad
FIGUR 1. Den rekonstruktive stigen og heisen - Illustrert av Selma Evenstad
FIGUR 2. Muskellapp (uten hudøy) - Illustrert av Selma Evenstad
“Perforatorlapper har revolusjonert rekonstruktiv kirurgi”
Eksempel på lapp
Bruksområde (stilket lapp)
Bruksområde (fri lapp)
Annet
M - Latissimus Dorsi (LD) Defekter på thorax og mamma Store defekter (for eksempel på legg) Kan dekke store flater (20-40 cm)
M - Gastrocnemius Defekter i kneregionen og proksimale legg
M - Gracilis
P - Deep inferior epigastric perforator (DIEP)
Defekter i perineum (inkludert skrotum)
Defekter på abdomen, lyske, perineum (inkludert skrotum)
P - Anterolateral thigh (ALT) Defekter på nedre trunkus (inkludert perineum)
P - Radialis
Defekter på distale overekstremitet (fra albue til hånd)
Vanligvis ikke brukt - MSAP (medial sural artery perforator) som alternativ
I hode-hals-regionen (for eksempel reanimasjon ved facialisparese)
Minimal donormorbiditet hos non-idrettsutøvere
Funksjonelt muskel-transplantat, tynn lapp
Bryst (for eksempel etter ablatio)* Gir samtidig bukplastikk
Defekter på ekstremiteter og i hodehals-regionen*
Store donordefekter kan lukkes direkte (8 x 25 cm)
Defekter i hode-hals-regionen* Tynn lapp som kan inkludere sene og ben
TABELL 1: Eksempler på noen muskel- og perforantlapper og noen av dets bruksområder, delt inn etter om lappen bruke som en stilket eller en fri lapp. M = muskellapp. P = perforatorlapp. *arbeidshest
hudsfett (kutane) (13). Denne teknikken er muskelsparende og gir betraktelig lavere donorstedmorbiditet (14). Et godt eksempel på dette er introduksjon av "deep inferior epigastric perforator" (DIEP)-lappen som brukes ved brystrekonstruksjon, hvor man tidligere brukte den myokutane rectus abdominis-lappen med vertikal eller transversal hudøy (VRAM/TRAM). Rectus-muskulaturen kan på denne måten spares og pasienten unngår assosierte komplikasjoner (for eksempel svak bukvegg, brokk, deformiteter).
BRUKSOMRÅDE
Muskel- og perforatorlapper kan brukes på to måter: regionalt, som stilkede lapper hvor de flyttes med intakt blodforsyning og stilkens lengde bestemmer forflytningsavstanden, eller som frie lapper, hvor blodforsyningen deles og reetableres på ny lokalisasjon (med mikrokirurgi og karanastomosering) (15). Det finnes i tillegg benlapper (for eksempel fra radius, scapula og fibula). Noen av disse høstes med og andre uten hudøy. Man kan inkludere nerver i vevsforflytning der det trengs på recipientstedet.
Valg av lapp avhenger av mange faktorer og er en krevende beslutning. I den kliniske hverdagen har man noen lapper man benytter oftere, såkalte «arbeidshester» og ofte er beslutningen noe enklere. Defektens størrelse,
dybde, type og lokalisasjon er primære ting å ta stilling til. Hovedprinsippene er å eliminere dødrom og erstatte «likt med likt» så godt som mulig. Valg av donorsted er viktig, spesielt ved bruk av muskellapper og medfølgende funksjonstap. Videre vil pasientens karakteristika påvirke valget. Hos en pasient med aterosklerotiske eller skadede kar vil man, for å unngå anastomoserelaterte komplikasjoner, foretrekke en stilket fremfor fri lapp.
Det finnes utallige donorsteder for muskel- og perforatorlapper. Eksemplene i tabell 1 illustrerer variasjonen og hvordan de kan brukes til ulike formål avhengig om de er stilket eller frie.
KONKLUSJON
Rekonstruktiv plastikkirurgi er et felt i stadig utvikling (16). Fra enklere teknikker som hudtransplantasjon til avanserte mikrokirurgiske lappeplastikker, er fokus rettet mot funksjon og estetikk. Forståelsen av disse ulike metodene er avgjørende for å kunne tilpasse behandlingen for den enkelte pasient.
REFERANSER : Se bakerst i nettutgaven på kirurgen.no
Rask testosteronsuppresjon. Rask gjenopprettelse av testosteron ORGOVYX® (relugoliks)

For behandling av voksne pasienter med fremskreden hormonsensitiv prostatakreft2
*
ADT= Androgen Deprivation Therapy
*Behandling av avansert hormonavhengig prostatakreft. Refusjonskoder: ICPC Y77: Ondartet svulst i prostata. ICD C61 Ondartet svulst i blærehalskjertel. Vilkår 9: Behandlingen skal være instituert i sykehus, sykehuspoliklinikk eller av spesialist i vedkommende disiplin.


Referanser: 1. Shore ND, et al. N Engl J Med. 2020;382(4):2187–2196. 2. Preparatomtale Orgovyx (relugoliks), seksjon 4.1 og 5.1. www.felleskatalogen.no.
Dette legemidlet er underlagt særlig overvåking. Orgovyx (relugoliks) 120 mg filmdrasjerte tabletter, ATC-nr.: L02BX04, Reseptgruppe: C. Reseptbelagt. Indikasjon: Behandling av voksne pasienter med fremskreden hormonsensitiv prostatakreft. Dosering og administrasjonsmåte: Behandling med Orgovyx skal startes og overvåkes av spesialleger med erfaring innen medisinsk behandling av prostatakreft. Behandling med Orgovyx skal innledes med en startdose på 360 mg (tre tabletter) på den første dagen, etterfulgt av en dose på 120 mg (én tablett) som tas én gang daglig på omtrent samme tid hver dag. Orgovyx kan tas med eller uten mat. Tablettene bør tas med litt væske etter behov, og skal svelges hele. Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Advarsler og forsiktighetsregler: Androgen deprivasjonsterapi kan forlenge QT-intervallet. Hos pasienter med en historie med eller risikofaktorer for QT-forlengelse samt hos pasienter som samtidig får legemidler som kan forlenge QT-intervallet, må man nøye evaluere samtidig bruk av Orgovyx med legemidler kjent for å forlenge QT-intervallet, eller legemidler som kan indusere torsades de pointes, slik som klasse IA (f.eks. kinidin, disopyramid) eller klasse III (f.eks. amiodaron, sotalol, dofetilid, ibutilid) antiarytmika, metadon, moksifloksacin, antipsykotika osv. Hjerte- og karsykdom slik som myokardinfarkt og slag har blitt rapportert for pasienter som fikk androgen deprivasjonsterapi. Derfor bør alle risikofaktorer for hjerte- og karsykdom tas med i beregningen. Redusert bentetthet kan forekomme. Redusert bentetthet, hos pasienter med ytterligere risikofaktorer, kan føre til osteoporose og økt risiko for benfraktur. Overvåkning av leverfunksjon hos pasienter med kjent eller mistenkt leversykdom er tilrådelig under behandling, da det er observert lette forbigående økninger i ALAT og ASAT. Forsiktighet ved alvorlig nedsatt nyrefunksjon. Eksponeringen for relugoliks hos pasienter med alvorlig nedsatt nyrefunksjon kan være økt med opptil 2 ganger. Det må utvises forsiktighet hos pasienter med alvorlig nedsatt nyrefunksjon ved administrasjon av en 120 mg dose med relugoliks én gang daglig. Effekten av Orgovyx skal overvåkes via kliniske parametere og nivåer av prostataspesifikt antigen (PSA) i serum. Interaksjoner: P-gp-hemmere: Samtidig administrasjon av Orgovyx og orale P-gp-hemmere anbefales ikke. Legemidler som er orale P-gp-hemmere inkluderer visse legemidler mot infeksjon (f.eks. azitromycin, erytromycin, klaritromycin, gentamicin, tetracyklin), antimykotika (ketokonazol, itrakonazol), antihypertensiva (f.eks. karvedilol, verapamil), antiarytmika (f.eks. amiodaron, dronedaron, propafenon, kinidin), antianginale legemidler (f.eks. ranolazin), cyklosporin, humant immunsviktvirus (hiv)- eller hepatitt C-virus (HCV)-proteasehemmere (f.eks. ritonavir, telaprevir). Hvis samtidig administrasjon med orale P-gp-hemmere én eller to ganger daglig er nødvendig, skal Orgovyx tas først og den orale P-gp-hemmeren tas 6 timer senere, og pasientene skal overvåkes hyppigere for bivirkninger. Alternativt kan behandling med Orgovyx avbrytes i opptil 2 uker for en kort behandlingsperiode med en P-gp-hemmer. Hvis behandling med Orgovyx avbrytes i mer enn 7 dager, skal administrasjon av Orgovyx gjenopptas med en startdose på 360 mg på den første dagen etterfulgt av 120 mg én gang daglig. Kombinerte P-gp- og sterke CYP3A-induktorer: Samtidig administrasjon av Orgovyx med kombinerte P-gp- og sterke CYP3A-induktorer anbefales ikke. Legemidler som er kombinerte P-gp- og sterke CYP3A4-induktorer inkluderer den androgene reseptorinduktoren apalutamid, visse antikonvulsiva (f.eks. karbamazepin, fenytoin, fenobarbital), legemidler mot infeksjon (f.eks. rifampicin, rifabutin), johannesurt (Hypericum perforatum), hiv- eller HCV-proteaseinduktorer (f.eks. ritonavir) og ikke-nukleoside reverstranskriptaseinduktorer (f.eks. efavirenz). Hvis samtidig administrasjon er nødvendig, skal Orgovyx-dosen økes. Etter seponering av den kombinerte P-gp- og sterke CYP3A-induktoren skal den anbefalte dosen Orgovyx gjenopptas én gang daglig. Fertilitet, graviditet og amming: Legemidlet er ikke indisert for kvinner i fertil alder. Det skal ikke brukes hos kvinner som er eller kan være gravide eller som ammer. Bivirkninger: Noen mindre vanlige bivirkninger kan være alvorlige, og lege kontaktes umiddelbart dersom symptomer på urtikaria eller angioødem utvikles (kan forekomme hos opptil 1 av 100 personer). De vanligste bivirkningene under behandling med relugoliks er fysiologiske effekter av testosteronsuppresjon, inkludert hetetokter (54 %), muskel- og skjelettsmerter (30 %) og fatigue (26 %). Andre svært vanlige bivirkninger inkluderer diaré og forstoppelse (12 % hver). Svært vanlige: Karsykdommer: hetetokter. Gastrointestinale sykdommer: diaré, forstoppelse. Sykdommer i muskler, bindevev og skjelett: muskel- og skjelettsmerter. Generelle lidelser og reaksjoner på administrasjonsstedet: fatigue. Vanlige: Sykdommer i blod og lymfatiske organer: anemi. Endokrine sykdommer: gynekomasti. Psykiatriske lidelser: insomni, depresjon. Nevrologiske sykdommer: svimmelhet, hodepine. Gastrointestinale sykdommer: kvalme. Hud- og underhudssykdommer: hyperhidrose, utslett. Lidelser i kjønnsorganer og brystsykdommer: redusert libido. Undersøkelser: vektøkning, økt glukosed, økt triglyserid, økt blodkolesterol. Mindre vanlige: Hjertesykdommer: myokardinfarkt. Hud- og underhudssykdommer: urtikaria, angioødem. Sykdommer i muskler, bindevev og skjelett: osteoporose/ osteopeni. Undersøkelser: økt aspartataminotransferase, økt alaninaminotransferase. Ikke kjent frekvens: Hjertesykdommer: forlenget QT-tid. Pakningsstørrelser og pris: Orgovyx Filmdrasjert tablett, 120 mg: 30 stk. flaske: 1674,6 kr. Blå resept: Ja. Refusjonsberettiget bruk: Behandling av avansert hormonavhengig prostatakreft. Refusjonskoder: ICPC Y77: Ondartet svulst i prostata. ICD C61 Ondartet svulst i blærehalskjertel. Vilkår 9: Behandlingen skal være instituert i sykehus, sykehuspoliklinikk eller av spesialist i vedkommende disiplin. Basert på SPC godkjent av DMP/EMA: 10/2024. Innehaver av markedsføringstillatelse: Accord Healthcare S.L.U., World Trade Center, Moll de Barcelona, s/n, Edifici Est 6ª planta, 08039 Barcelona, Spania. Tel: +34 93 301 00 64. Les preparatomtale (SPC) for ytterligere informasjon, se www.felleskatalogen.no NO-Onc-Org-01440
REKONSTRUKSJON AV UNDEREKSTREMITETER ETTER TRAUME
Rekonstruksjon av underekstremiteter etter traume er en kompleks kirurgisk utfordring som har utviklet seg betydelig de siste tiårene. Frie lapper har på mange måter revolusjonert rekonstruksjon i underekstremiteter, og redusert antall amputasjoner ved omfattende skader.
HARIS MESIC
AVDELING FOR PLASTIKK- OG REKONSTRUKTIV KIRURGI, OUS
KORRESPONDANSE: HARIS MESIC - UXMESH @ OUS - HF.NO
I et moderne samfunn preget av høyt tempo og økt fysisk aktivitet, er risikoen for underekstremitetsskader og alvorlighetsgraden betraktelig høyere enn tidligere. Isolerte underekstremitetsskader er ikke nødvendigvis livstruende, men involverer ofte komplekse brudd og bløtvevsskader med betydelig innvirkning på pasientens mobilitet og livskvalitet. Behandlingen av slike skader krever omfattende plastikkirurgisk rekonstruksjon for å gjenopprette både funksjon og estetikk, helst til nivået før skaden (1).
SAMARBEID MELLOM ORTOPEDI OG PLASTIKKIRURGI
I mange tilfeller vil ortopediske og plastikkirurgiske team jobbe tett sammen for å gi best mulig behandling for pasienter med komplekse traumer som involverer både åpne benbrudd og bløtvevsdefekter (2). Hver pasient krever en individuell tilpasset behandling. Ortopeder har hovedansvaret i den initiale behandlingsfasen, men det er avgjørende at plastikkirurger involveres tidlig i prosessen. Dette for å sikre tilstrekkelig sårrevisjon, samt å bistå med planlegging av ortopedens snittføring og plassering av osteosyntesematerialet for å forebygge hindringer ved senere rekonstruktiv kirurgi.
STABILISERING OG AKUTT BEHANDLING
Den første fasen etter et traume fokuserer på å stabilisere pasienten og hindre livstruende komplikasjoner. Dette kan innebære å stoppe blødning, stabilisere brudd med ekstern fiksasjon, og sørge for at pasienten har tilstrekke
lig blodtilførsel, oksygenering og smertelindring. Deretter utføres kirurgisk sårrevisjon. Denne prosessen involverer grundig fjerning av dødt, iskemisk og kontaminert vev fra såret, samt fremmede partikler, for å fremme tilheling og redusere risikoen for infeksjon. Sårrevisjon utføres ved hjelp av mekanisk fjerning, hydraulisk irrigasjon og kirurgisk reseksjon. Det er avgjørende at sårrevisjon utføres så tidlig som mulig, helst innen seks timer etter skadetidspunktet. Dersom tidsrammen ikke kan overholdes, må behandlingen utføres så fort som mulig, med inklusjon av profylaktisk antibiotikabehandling (Figur 1).
VURDERING OG PLANLEGGING
Etter at pasienten er stabilisert og sårrevisjon er utført, må skadens omfang vurderes grundig. Dette inkluderer blant annet diagnostikk med røntgen- og CT-bilder for å kartlegge beinbrudd, bløtvevsskader og nerve og blodkarinvolvering. Basert på resultatene av disse undersøkelsene lager det kirurgiske teamet en plan for rekonstruksjonen.
REPARASJON AV BEIN OG LEDD
Ortopediske kirurger er primært ansvarlige for behandling av bein, ledd, og sener (3). Ved et beinbrudd er første mål å stabilisere beinstrukturene. Ved leddskader kan det være nødvendig å rekonstruere eller erstatte skadde ledd, for eksempel med kunstige proteser, eller ved bruk av ben og brusktransplantasjoner for å gjenopprette normal leddfunksjon.



FIGUR 1: Sårrevisjon
1A: Åpen tibiafraktur (Gustillo 3B).
1B: Revisjon av bløttvev og hud.
1C: Dekning med ALT fri lapp.
Pasienten har gitt samtykke til bruk av bildene.
REKONSTRUKSJON AV BLØTVEV OG HUD
Etter at ortopeder har fullført eventuelle reparasjoner av bein og ledd, starter rekonstruksjonen av bløtvev og hud. Ved store huddefekter kan hudtransplantasjoner være en god løsning. Dette kan innebære å bruke hud fra andre områder på pasientens kropp, men forutsetter eksisterende sirkulasjon i sårbunnen. De fleste store skader medfører blottlegging av vitale strukturer, som da krever innhenting av sirkulært vev. I disse tilfellene bruker man lokale og frie lapper.




FIGUR 2: Lokale lapper
2A: Sårdefekt over en akillessene.
2B: Ferdig preparert perforatorlapp, klar til rotasjon inn i den primære defekten.
2C: Resultat en uke postoperativt. Donorstedet er lukket direkte.
2D: Resultatet etter ett år.
Pasienten har gitt samtykke til bruk av bildene.
Fordelen med lokale lapper er at de beholder sin blodtilførsel fra området de er hentet fra, noe som sikrer at de kan overleve i det nye området, uten at man trenger mikrokirurgisk tilkobling av arterier og vener (4). Men lokale lapper brukes kun for mindre defekter, da det er begrenset med donorvev på underekstremiteten nedenfor kneet. Dessuten påfører det ytterligere skade lokalt i et allerede traumatisert område (Figur 2).



FIGUR 3: Amputasjon
3A: Amputasjonsstump med delhudstransplantat og ustabilt arr.
3B: Opptegning for kirurgisk reseksjon (15x7cm).
3C: Disseksjon av mottagende kar og sensorisk nerve for tilkobling.
3D: Opptegning for ALT fri lapp fra høyre lår.



3E: Lapp sydd inn i defekt etter tilkobling av anastomoser (arterie og vene) og sutur av nerve for sensibilitet.
3F: Langtidsresultat (etter 18 måneder) med stabil lapp som tåler bruk av protese.
Pasienten har gitt samtykke til bruk av bildene.



4: Kne
4A: Ung kvinne med høyenergiskade mot kne med eksponert kneledd og stor bløttvevsdefekt.
4B: Donorsted fra rygg. Lappen er basert på a. circumflexa scapulae (kombinert scapular og parascapular lapp)
Frilapprekonstruksjon er mer utfordrende da det krever mikrokirurgisk kompetanse, men det gir større fleksibilitet når det gjelder utvalget av vevstype og størrelse på lapper, og det sikrer at kirurgen kan finne den beste «matchen» for ulike typer sårdefekter (5). Frie lapper har på mange måter revolusjonert rekonstruksjon i underekstremiteter, og redusert antall amputasjoner ved omfattende skader (Figur 3). Dessuten har de gitt den mest tidseffektive behandlingen da det sjeldent krever mer enn ett inngrepet – et viktig moment fra både et pasientog samfunnsperspektiv.
Selv når amputasjon er uunngåelig, kan plastikkirurgers bidrag være avgjørende for å bevare adekvat stumpelengde (6). Dette er essensielt for å kunne tilpasse en funksjonell protese, samt unngå behov for ytterligere forkortning av ekstremiteten. Langvarig bruk, feiltilpasset protese og nedsatt sensibilitet kan resultere i kroniske sår eller ustabile arr. I slike tilfeller kan frilappkirurgi være nødvendig for å dekke sårene og optimalisere pasientens evne til å bruke protese og hindre behovet for ytterligere reamputasjon.

4C: Lapp sydd inn i defekt.
4D: Pasient hadde full funksjon ved 12 måneders kontroll.
Pasienten har gitt samtykke til bruk av bildene.
REKONSTRUKSJON I HENHOLD
TIL ANATOMISKE OMRÅDER
De mest utfordrende områdene for rekonstruksjon er kne, legg og fot/ankel, på grunn av komplekse biomekaniske funksjoner, høy belastning og et intrikat nettverk av blodkar, nerver og sener (7). I tillegg er hud- og muskelbelegg tynnere og mer utfordrende å rekonstruere på en estetisk tilfredsstillende måte.
Kne: Reparasjon av kneskader byr på mange utfordringer for ortopeder. Forutsetningen for et godt resultat er adekvat bløtvevs og huddekning med tilstrekkelig sirkulasjon til de affiserte skjelettstrukturene. Noen ganger ender rekonstruksjonen med et suboptimalt resultat og kan kreve sekundære inngrep, som for eksempel ytterligere reparasjon av kneleddstrukturer eller innsetting av kneprotese. Derfor må snittføring, samt valg av lapper og mottakende kar for tilkopling være nøye vurdert i planleggingsfasen (Figur 4).
Legg: Leggen er den meste utsatte delen av underekstremiteten ved traumer (8). Når tibia er skadet, er stabili
FIGUR



5A: Pasient med omfattende bimaleollar fraktur og eksponert tibia.
5B: Lateral defekt på ankel med blottlagte ekstensorsener.
5C: Frie lapper høstet fra begge lår.
5D: Tilkobling av lapper. Lapp 1 er koblet til tibialis anterior stilk.
Lapp 2 er koblet til stilken til lapp 1 (seriekobling).
sering avgjørende ettersom tibia bærer kroppens vekt. Høyenergiskader resulterer ofte i åpne beinbrudd og omfattende bløtvevsødeleggelse. Det er ikke sjeldent at blodårene blir skadet primært ved traumer, men det kan også skje sekundært, som følge av kirurgisk behandling. Det er derfor viktig å vurdere kartilstand, både med tanke på bevaring av sirkulasjon distalt i legg og fot, og som tilkoblingssted for fri lapp. To måter å minimere ytterligere iatrogen skade på, er å koble frilapp til stumpen på den allerede skadde arterien, eller velge endetilside anastomose dersom man bruker intakte arterier. Dette er særlig relevant hos unge pasienter som potensielt kan utvikle aterosklerotisk sykdom senere i livet (Figur 5).
Fot og ankel: Det er essensielt at foten forblir stabil og



5E: Resultat etter rekonstruksjonen.
5F: Tilfredsstillende rekonstruksjon både funksjonelt og estetisk.
Pasienten har gitt samtykke til bruk av bildene.
tåler trykket fra daglige aktiviteter. Skade kan forstyrre gangfunksjonen og føre til problemer som smerte, ubalanse eller biomekaniske forstyrrelser. Fotsålen er spesielt utfordrende, da den bærer kroppens vekt under gange, løping og ståing. Fotsålen har tykkere hud tilpasset trykk og friksjon, og denne huden er vanskelig å erstatte. Fotryggen er like stor utfordring med tynn hud og minimal subkutan fylde over vitale strukturer (Figur 6).
REHABILITERING OG OPPFØLGING
Når den kirurgiske behandlingen er fullført, begynner den viktige fasen med rehabilitering. Dette inkluderer fysioterapi for å gjenopprette styrke, fleksibilitet og koordinasjon, for å hjelpe pasienten til å bli så selvstendig som mulig. Beintilhelingsstatus og progresjon sjekkes
FIGUR 5: Legg
5C 5E





FIGUR 6: Fot
6A: Knusningsskade, forårsaket av tung stein, med multiple frakturer av fotbein og bløtvevsskade.
6B: Sårrevisjon, beingraft til defekt i 1. metatars og osteosyntese av bein.
6C: Tilkobling av lappen til arteria og vena plantaris medialis.
ved regelmessige kontroller. Ortopediske hjelpemidler kan bli aktuelt på sikt for å oppnå best mulig funksjon.
Rehabilitering etter alvorlige skader av underekstremiteter er en langvarig og krevende prosess. Det må understrekes at behandlingen tar flere måneder, og pasienten må tydelig orienteres fra start for å sikre aktiv deltakelse og motivasjon.
KONKLUSJON
Pasientens langsiktige behandlingsutfall avhenger først og fremst av skadeomfanget. Imidlertid kan en godt planlagt rekonstruktiv behandlingsplan, supplert med et effektivt rehabiliteringsprogram, vesentlig redusere konsekvensene av skaden. Rekonstruksjon av underek
6D: Donorsted etter høsting av fri lapp med bevart dyp fascie og intakt muskulatur. Huden lukkes direkte.
6E: Postoperativt resultat.
Pasienten har gitt samtykke til bruk av bildene.
stremiteter har som mål å gjenopprette mobilitet og funksjon, forhindre infeksjoner og minimere kosmetiske skader.
Det er essensielt at plastikkirurger er involvert fra starten av behandlingen. Sammen med ortopeder utgjør disse spesialistene et tverrfaglig, kirurgisk team som kan gi helhetlig behandling og sikrer best mulig utfall for pasienter utsatt for alvorlige traumer i underekstremiteten.
REFERANSER : Se bakerst i nettutgaven på kirurgen.no
6A 6B
6C
6D
6E
REKONSTRUKSJON AV PLEUROKUTANT VINDU OG
FYLLING AV PLEURAHULE ETTER
POST- PNEUMONEKTOMIEMPYEM
Kirurgi i brystkassen kan ha alvorlige komplikasjoner med mutilerende følgetilstander. Vi presenterer en pasient med et pleurokutant vindu etter post-pneumonektomiempyem som ble vellykket lukket med samtidig fylling av hulrommet i høyre thoraxhalvdel. Han var primært operert for et kardialt endotelialt sarkom.
CHRISTIAN KORVALD 1, ERIK HELGELAND 2, SIGURD BIRKELAND 2
1 AVDELING FOR PLASTIKK OG REKONSTRUKTIV KIRURGI, OSLO UNIVERSITETSSYKEHUS
2 THORAXKIRURGISK AVDELING, OSLO UNIVERSITETSSYKEHUS
KORRESPONDANSE: CHRISTIAN KORVALD – CKORVALD @ OUS - HF.NO
BAKGRUNN
Pasienten er en mann som i mars 2011, 47 år gammel, ble operert for et antatt myxom i venstre atrium ved Thoraxkirurgisk avdeling (TKA) ved Rikshospitalet. Histologi viste imidlertid høygradig malignt endotelialt sarkom og han ble postoperativt behandlet med cytostatika. Tre måneder etter primæroperasjon ble det gjort radikaloperasjon av atriesarkomet med fjerning av høyre lunges underlapp og deler av venstre atrium med samtidig rekonstruksjon ved bruk av et pulmonalt homograft. Man oppnådde frie marginer. I 2016 hadde han residiv og ble operert med fjerning av resterende venstre atrium og aurikkel, mitralklaff samt aortarot. Rekonstruksjon med autolog perikardpatch i mitralannulus, mitralprotese og aorta homograft. I april 2023 avdekkes nytt residiv i overgang venstre atrium og høyre lungehilus. Resterende høyre lunge ble da fjernet, samt rester av venstre atrium og lymfeknuter. Postoperativt tilkom et empyem og bronkopleural fistel i høyre thoraxhule som i juli 2023 ble drenert ved anleggelse av et stort pleurokutant vindu lateralt på høyre thorax, gjennom musculus latissimus dorsi. Den bronkopleurale fistelen ble dekket med transponert omentum majus i februar 2024 og residiverte ikke etter dette.
Våren 2024 hadde han fortsatt tegn på infeksjon og/eller rest av tumorvev i området for mitralklaffen ved PET-CT. Den åpne pleurahulen på høyre side ble skylt og skiftet
med fuktige kompresser to til tre ganger per uke. Han hadde stadige febertopper og generelt noe nedsatt allmenntilstand. Thoraxkirurg tenkte at det over tid ville bli indikasjon for et nytt inngrep i mediastinum, men at risikoen for postoperativ infeksjon var for stor med den åpne kontaminerte høyre lungehulen. Plastikkirurg ble derfor kontaktet med tanke på å lukke det pleurokutane vinduet og tilhørende hulrom.
PREOPERATIV VURDERING
Som plastikkirurg er man generelt veldig tilbakeholden med å lukke inne kontaminerte hulrom eller fremmedlegemer. Hos den aktuelle pasienten så man også betydelig signal ved PET-CT i hele pleura på høyre side, spesielt i nedre dorsale del, som stedvis kunne minne om lukkede infiserte hulrom. Musculus latissimus dorsi (LD) var trolig også delvis skadet ved anleggelse av det pleurokutane vinduet. Det ville derfor bli vanskelig å utnytte LD på standard måte som donor av vev for å fylle inn i nedre del av pleurahulen siden det pleurokutane vinduet var anlagt midt i der man vanligvis høster hudfettlappen som kan brukes som volum. I tillegg lå det pleurokutane vinduet såpass lavt på thorax at en «vanlig» LDlapp ikke ville få tilstrekkelig stilket lengde til å kunne tres helt inn i pleurahulen. Siste CT med kontrast viste at ventrale descenderende gren av arteria thoracodorsalis sannsynligvis var intakt i forkant av fistelen. Vi planla derfor en alternativ muskelsparende LDlapp der kun fremre del


av muskelen løftes og den tilhørende fasciokutane lappen høstes fra ventrolaterale del av thorax samt abdominalt i retning navle ved å følge sannsynlig angiosom for perforatorer tilhørende descederende gren av thoracodorsaliskarene (1). Figur 1 viser pasienten preoperativt og design av denne lappen. Pasienten var slank og det var lite sannsynlig at denne lappen kunne fylle hele thoraxhulen. For øvre del av thoraxhulen planla vi derfor i tillegg en lapp av musclulus pectoralis major stilket på arteria og vena thoracoacromiale (2).
OPERASJON
Primo juni opereres han med team bestående av plastikk- og thoraxkirurg. Man startet i sideleie, først med thoracoskopi, og åpnet membraner nedad dorsalt i pleurahulen. Det var ikke puss ved åpning av lommer sett ved PET-CT. Videre ble hele hulen rubbet godt med kompresser og diatermiskrubb før omfattende skylling med saltvann. Latissimuslappen ble løftet etter plan og viste god blodsirkulasjon helt ut i hudspissen av lappen. Den fasciokutane lappen og åpningen rundt det pleurokutane vinduet ble deepitelialisert og skjøvet inn i pleurahulen sammen med muskelstilken. Huden ble lukket tensjonsfritt over. To silikondren nummer 18 ble lagt inn på hver side av lappen, i tillegg til et vanlig thoraxdren i egen åpning ovenfor. Han ble så snudd over i ryggleie. Gammelt arr over sternum ble åpnet med underminering av hud over hele høyre musculus pectoralis major. Muske
len ble deretter løftet fra thorax. På grunn av trange forhold, måtte vi ha et hjelpesnitt i fremre aksillærfold for å komme til muskelfestet samt nerve og karstilk. Muskelen ble denervert og stilket helt på arteria og vena thoracoacromiale. Deretter ble brusket del av costa 2 fjernet for åpning inn til pleurahule. Pleura var 5-10 mm tykk og stiv, og måtte delvis eksideres. Muskelen ble så tredd inn i øvre pleurahule og hud lukket tensjonfritt i aksillefold og på sternum over et subcutant dren. Alle dren ble holdt aktive for å skape undertrykk og drenasje i pleurahulen.
Postoperativt forløp
Ingen postoperative komplikasjoner av betydning inntraff de første 30 dagene, utover smerte i skulder («frozen shoulder») på høyre side som plaget ham i flere måneder. Dren ble seponert etter 14 dager, og han ble utskrevet til hjemmet cirka en måned postoperativt. Figur 2 viser pasienten postoperativt etter fire måneder.
C-reaktivt protein (CRP) falt fra topper på mellom 150-180 mg/L i juni til et stabilt lavere nivå på under 20 fra slutten av juli og helt ned til 6-7 mg/L i midten av oktober. Han var i løpet av sommeren aktiv, gikk turer og hadde god matlyst og generelt god allmenntilstand, utover skuldersmertene. Røntgen thorax og blodprøver ble kontrollert ukentlig på TKA. Han fikk kontinuerlig behandling med vankomycin og ceftriaxon mot mistenkt proteseendokarditt samt fragmin som tromboseprofylakse. Både CT- og
FIGUR 1: Preoperativt liggende bilde som viser pleurokutant vindu med inneliggende kompress. Sorte streker antyder fremre kant av m. latissimus dorsi. Sorte punkter viser steder med godt perkutant dopplersignal. Plan for lappeplastikk er påtegnet i etterkant. (Bilde brukt med tillatelse av pasienten).


FIGUR 2: Peroperative bilder. A) Avkuttet musculus latissimus dorsi og deepitelialisert hud-fettlapp sett litt skrått bakfra. B) Samme lapp løftet før den tres inn i thorax. Donorsted lukket subcutant. (Bilder brukt med tillatelse av pasienten).



FIGUR 3: A) Røntgen thorax før operasjon. Røntgentråd og skygge i høyre thorax fra kompressene som til enhver tid lå inne. B) Røntgen thorax fire måneder etter operasjon. C) Coronalt snitt fra CT fire måneder postoperativt. Musculus latissimus dorsi sees delvis utenpå thorax og trukket inn i fistelgangen. Videre er den mørkere slyngete strukturen fettvev fra den fasciokutane lappen. Thorax er ellers fylt opp med samme tetthet som muskulatur, trolig er mye av det man ser deler av musculus pectoralis major. (Bilder brukt med tillatelse av pasienten).


FIGUR 4: Postoperative bilder av pasienten. A) Skrått forfra ser man vel tilhelede arr og et tydelig søkk der costa 2 ble fjernet for å gi plass til musculus pectoralis major. B) Sett skrått bakfra ser man en innbuktning der det pleurokutane vinduet lå og noe av costa ble fjernet for å anlegge dette. (Bilder brukt med tillatelse av pasienten).
røntgen thorax viste etter hvert fullstendig fylling av høyre pleurahule over tre måneder, med samtidig gradvis deviasjon av mediastimum mot høyre og opptrukket høyre diafragma (figur 3). Han rapporterte også betydelig bedring av tidligere svelgvansker samt økt appetitt. Ny PETCT ble tatt i starten av oktober og den viste tilbakegang av opptak i høyre pleurahule, men fortsatt tegn til høyt signal i området for mitralklaffen og rekonstruerte venstre atrium. I midten av oktober ble han brått mer tungpusten og det ble avdekket tumorresidiv som hemmet inflow til venstre ventrikkel via mitralklaffen. På vital indikasjon ble ha da operert med reseksjon av venstre atrium, aorta homograft og mitralprotese. Han ble så rekonstruert med ny mitralprotese, aorta homograft og pericardpatch som conduit fra venstresidige lungevener og til mitralprotesen. Postoperativt ble det anlagt ECMO-støtte. Det tilkom trombosering av venstre atrium og mitralprotese som ble forsøkt behandlet med actilyse. Han fikk videre lungestuvning og frisk blødning fra luftveiene. Behandling ble avsluttet og han døde tredje postoperative dag.
DISKUSJON
Etter pneumonektomi vil pleurahulen vanligvis fylles opp med vevsvæske som gradvis organiseres, og mediastimum vil over tid trekkes noe mot siden der lungen mangler. Infeksjon i pleurahulen etter pneumonektomi, som ved en bronkopleural fistel, kan være livstruende og krever definitiv drenasjebehandling av utløsende årsak. Dette ble gjort i det aktuelle tilfellet. Det åpentstående pleurokutane vinduet gav ham betydelig redusert livskvalitet (hyppige sårskift) og øket morbiditet (subfebril og nedsatt allmenntilstand). Lukking og fylling av pleurahulen reverserte dette uten residiverende infeksiøs komplikasjon.
En av plastikkirurgenes viktigste oppgaver er å skaffe dekning med hud, og helst underhud, der dette av ulike årsaker mangler. Hud og underhud er kroppens største organ, med beskyttelse av kroppens underliggende strukturer og organer som hovedoppgave. Ved skade, mekanisk eller fra infeksjon, er riktig reparasjon og regenerering nødvendig for å opprettholde homeostase (3). Et større udekket sår vil raskt kunne gi nedsatt allmenntilstand og funksjonsevne, og også forverre tilstanden til en allerede derangert pasient. Et åpent pleurokutant vindu og kontaminert pleurahule vil kunne gi lignende problem med kronisk pågående inflammasjonsprosess som ikke kan forbedres før vinduet lukkes, pleurahulen saneres og fylles med vaskularisert vev. Vi så en klar bedring i pasientens almenntilstand etter lukkingsprosedyren noe som igjen understreker viktigheten av slik behandling.
Hos den aktuelle pasienten ble to stilkede lapper utnyttet. I en serie på 47 pasienter med postpneumonektomiempyem av varierende volum viser Zhu og medarbeidere at det i minst 2/3 av tilfellene ikke er nok med kun én stilket lapp for å fylle pleurahulen (4). I fire tilfeller måtte de i tillegg til to stilkede lapper bruke en fri anterolateral lårlapp for å få nok volum. Frie mikrokirurgiske lapper gir større frihet til valg og design av fasciokutane og musculokutane vevslapper (4, 5), men de er mer teknisk krevende å utføre og krever mer utstyr (mikroskop). En viktig fordel med frie lapper er at donorsted kan velges, så ytterligere lokal morbiditet på/ved thorax unngås (for eksempel skuldersmerter). Ulempen kan være anastomoseproblemer postoperativt (trombose) og vansker med tilgang og revisjon når vevslappen ligger inne i pleura-/ empyemhulen. Vår pasient viste seg å trombosere lett. I tillegg ville det kanskje være vanskelig å bruke intercostal- og mammaria internakarene på grunn av pleurafortykkelsen. Samtidig var han såpass slank at ren fasciokutan anterolateral lårlapp uansett ikke ville kunne gi tilstrekkelig volum og måtte derfor uansett kombineres med lokal(e) stilket(e) lapp(er).
Zhu og medarbeidere forslår også 3D-rekonstruksjon av hulrommet som skal fylles med vevslapp(ene) for bedre preoperativ planlegging (4). Vi gjorde ikke dette, men trolig hadde det vært til god hjelp. Som røntgenbildene i figur 3 viser, var volumet som ble lagt inn primært på langt nær nok til å fylle hele hulrommet. De første to månedene så vi væskespeil på thoraxbildet, men med mediastinalt skifte mot høyre og opptrekk av diafragma forsvant dette over tre til fire måneder. Vi unngikk infeksjonsproblemer. Dette er sammenfallende med Zhu og medarbeidere som kun så postoperative infeksjonsproblemer hos dem som fikk residiv av bronkopleural fistel (4).
KONKLUSJON
Post-pneumonektomiempyem må dreneres og utløsende årsak behandles. Dette kan medføre et langvarig åpentstående pleurokutant vindu og medfølgende relativt høy grad av morbiditet. Vellykket lukking og fylling av hulrommet i thorax med vaskularisert vev er avgjørende for å reversere denne tilstanden.
Det er innhentet skriftlig samtykke fra pasienten om bruk av journalinformasjon og bilder.
REFERANSER :
Se bakerst i nettutgaven på kirurgen.no
BEHANDLING AV FROSTSKADER
OPPDATERING OG UTVIDET SPEKTRUM
Vi publiserte i KIRURGEN nr. 2-2020 en oversikt over moderne behandling av dype frostskader (1). Fra en tradisjonell "vente og se-strategi" har utviklingen beveget seg over til aktivt å forhindre unødvendig morbiditet ved bruk av trombolytisk og inflammasjonsdempende terapi. Nyere forskning presenterer et forsterket grunnlag for slik tilnærming. Andre modaliteter er også evaluert og funnet nyttige for å optimalisere behandling av slike skader.
THOMAS SJÖBERG, LOUIS DE WEERD
SEKSJON FOR PLASTIKK- OG REKONSTRUKTIV KIRURGI, UNN TROMSØ
KORRESPONDANSE: THOMAS SJÖBERG – THOMAS.SJOBERG @ UNN.NO
KULDESKADER («NON - FREEZING INJURY»)
Til forskjell fra frostskader, oppkommer kuldeskader i temperaturer over vannets frysepunkt, oftest 0° - 15° C, og alltid i kombinasjon med fukt (2). Skadene affiserer i all hovedsak føtter og ankler, såkalt skyttergravsfot, men i noen få tilfeller også overekstremiteter. Historiske eksempler på følgene av kuldeskader er særlig relatert til militære aktivitet, for eksempel i Falklandskrigen der opptil 64 % av soldatene oppgis å ha blitt rammet av kuldeskader (3). Også sivil aktivitet, slik som langvarige vandringer i vått fjellterreng, kan føre til kuldeskader (2). Fysiologisk opphav er ikke helt klarlagt, men skadet mikrosirkulasjon i huden og eventuelt i perifere nerver antas bidra til de langvarige plagene som pasienter ofte opplever (4).
Det kliniske bilde skiller seg ikke i betydelig grad fra frostskader. Vanligvis karakteriseres dog kuldeskader av fuktig hudoverflate og skadeutbredelse over en større overflate, slik som en hel fotsåle, imens frostskader heller er tørre og har et mer begrenset omfang (bilde 1-2) (5). Kuldeskader kan, på lik linje med frostskader, føre til blemmedannelse og åpne sår i akuttfasen, men da som regel på trykkutsatte steder slik som ved andre trykkskader. Etter initial oppvarming følger en fase over flere uker der vevet karakteriseres av hyperemi og økt smertefølelse. Endelig vil mange pasienter oppleve langvarige smerter og økt kuldefølsomhet som følge av kuldeindusert nevropati (4). Plagene reduseres vanligvis i løpet av 812 uker dersom vedkommende kan unngå ny kuldeeksponering. Objektivt påvises mere uttalt vasokonstriksjon og langsommere oppvarming etter kuldepåvirkning, sammenlignet med uskadet vev. Hyperhidrose og lokale forandringer på negler og hårvekst kan også forekomme (2).
Moderne behandling av kuldeskader følger samme strategier som for frostskader med akutt antiinflammatorisk lokal og systemisk behandling, ofte i kombinasjon med blodfortynnende acetylsalisylsyre (ASA) (6). Ett unntak er dog at man ikke anbefaler rask oppvarming i vannbad, uten heller langsom oppvarming i romtemperatur eller ved direkte hudtilhud kontakt, ettersom rask oppvarming er angitt å kunne forverre skadene (7). Iloprost

BILDE 1: Overfladisk kuldeskade av et typisk klinisk bilde med fuktig hudskade over hele fotsålene. Bilde av Mehmet Kataray, 2007.
Topografisk
Grad 1

Rødme distalt for DIP ledd uten cyanose. Liten risiko for amputasjon.

BILDE 2: Dyp frostskade i begge føtter. Misfarget område med tørr overflate og mere distinkt grense mot frisk hud er typisk for frostskader. Bildet gjengis med tillatelse fra pasienten.
gradering av frostskader etter oppvarming.
Grad 2

Cyanose i distale falanger.
Moderat risiko for amputasjon.
Grad 3

Cyanose i samtlige falanger.
Stor risiko for amputasjon.
Grad 4

Cyanose proksimalt for MCP-ledd Amputasjon er uunngåelig.
FIGUR 1: Klassifisering av frostskader, basert på Cauchy et al. (14). Høyere gradering er relatert til mere utbredt kuldeskade og større risiko for amputasjon. Publisert med tillatelse av forfatterne (1).
(et prostasyklinanalog) har vært brukt i kun et fåtall tilfeller, men med lovende resultater (8,9). Langvarige smertetilstander anbefales behandlet med amitriptylin, eventuelt i kombinasjon med gabapentin. I noen tilfeller vil nedkjøling av hyperemisk vev, for eksempel ved bruk av en vifte, kunne redusere plagene. De fleste vil kunne gjenoppta normal aktivitet i løpet av noen måneder selv om et mindretall kan pådra seg kronisk kuldeømfintlighet og derved permanente begrensninger med hensyn til aktivitet i kulde.
OPPDATERING I BEHANDLING AV DYPE FROSTSKADER («FROST INJURIES»)
Som tidligere presentert, baseres moderne behandling av dype frostskader på rask oppvarming og deretter oppstart med anti-inflammatorisk og, i noen tilfeller, trombolytisk behandling (1). Anti-inflammatorisk tablettbehandling ved ibuprofen 800 mg bør startes snarest mulig. I tilfelle begrensede skader (Cauchy grad 1, figur 1), vil det i mange tilfeller være nok med en kontinuert behandling ved ibuprofen 400 mg x 2 daglig i fire uker og ASA 75
Akutt behandling
• Oppvarming i vannbad med klorhexidin o 5%,100 ml/ 1 liter NaCl; 37 -40°; 30-60 minutter
• Tetanus profylakse på indikasjon
• Blodprøver: Hb, elektrolytter, LPK, CRP, myoglobin, CK, koagulasjonsstatus
• Ibuprofen 800 mg p.o.
• Klinisk vurdering av skadens karakter etter oppvarming
• Botulinum toksin A (BTXA) injeksjon rundt perifere blodkar (fingre/tær)
•
Overfladisk skade, grad 1 - 2
• Analgesi ved paracetamol + evt. opioider
• Fjern blemmer med klart innhold og dekk sårene med Aloe Vera krem
• Jelonet og luftig bandasje
• Høyleie av ekstremiteter
• Ibuprofen 400 mg x2
Dyp dermal skade, grad 3 – 4
• Cyanose og svekket kapillær sirkulasjon distalt for PIP ledder / IP ledd for dig 1
• Svekkede perifere pulser ved Doppler
Angiografi eller SPECT/CT hvis ikke kontraindikasjoner

Svekket perfusjon distalt ?
Nei
Ja + kontraindikasjoner til trombolyse
Vasodilatasjon ved Iloprost
• 6 timer daglig, inntil 5 dager etter skaden
Ja og innen 24 timer etter oppvarming uten kontraindikasjoner
Trombolyse ved tPa
• Maksimalt 12 timer
• Heparin infusjon parallelt
Angiografi repeteres daglig frem til normalisert perfusjon eller 48 timer uten bedring
Etterbehandling
• Lokal sårbehandling ± Aloe Vera
• Ibuprofen 400 mg x 2 p.o. i fire uker
• Paracetamol ± opioider etter behov
• Vitamin C 1g x 1 p.o. i seks uker
• ASA 75 mg x 1 i seks uker
• Evt. ledningsanestesi
• Hyperbar oksygenering på indikasjon
•
2: Algoritme for behandling. En noe modifisert versjon av tidligere publisert algoritme (1). ASA er inkludert i systemisk behandling i tillegg til ibuprofen og vitamin C. Publisert med tillatelse av forfatterne.
FIGUR
mg x 1 i seks uker etter skaden. Nytten av ASA er omdiskutert, men den blodfortynnende effekten har i enkelte studier vært gunstig for å redusere skadeomfanget (10). Vi anbefaler også bruk av askorbinsyre (vitamin C) 1g x 1 i seks uker for å motvirke effekten av frie radikaler som oppkommer som følge av reperfusjon etter oppvarming (11). Optimal sårbehandling er fremdeles ikke avklart. Væsken i eventuelle blemmer inneholder dog inflammatoriske komponenter og flere retningslinjer anbefaler derfor at blemmene fjernes slik at man kan iverksette lokal anti-inflammatorisk behandling med Aloe Vera gel eller salve under luftige og ikkekonstringerende bandasjer (12,13).
Ved dype skader, karakterisert av blemmer med blodig innhold eller mørkt, mumifisert bløtvev, anbefales systemisk behandling for å prøve å redusere skadeomfanget. Dette gjelder i all hovedsak Cauchy skadegrad 3-4, det vil si skader med utbredelse i en eller flere fingre/tær til, eller proksimalt for, PIP leddet (figur 2) (14). De vanligste modalitetene er bruk av trombolytisk behandling ved intravenøs eller intraarteriell tilgang eller intravenøs iloprostinfusjon. Nytten av systemisk behandling med iloprost er blitt verifisert i flere artikler siden vår forrige publikasjon og må nok anses å være prioritert foran trombolyse, som har en mere snever indikasjon med hensyn til aktuell pasientgruppe og tidsrom etter skaden (13). Fra februar 2024 er iloprost også blitt tilgjengelig i USA. Fra et rent praktisk ståsted er iloprostbehandling mindre resurskrevende, da slik behandling kan startes og gjennomføres uten like rigorøs overvåking av pasienten som ved trombolyse. Strategier for prehospital oppstart med iloprost er under utvikling da dette vil kunne være spesielt verdifullt i situasjoner med lang eller vanskelig transport til sykehus. Dosering av iloprost og gjennomføring av selve behandlingen har ikke endret seg. En noe oppdatert versjon av tidligere publisert behandlingsalgoritme er gjengitt i figur 2 (1).
Et antall publiserte kasuistikker og pasientserier har presentert resultat som antyder at hyperbar oksygenering (HBO) kan være nyttig for å redusere skadeomfanget ved frostskader (15). I en nyere studie fant Magnan et al. at kombinasjonen av iloprost og HBO resulterte i halvert antall amputasjoner sammenlignet med behandling ved iloprost alene (16). En stor utfordring er likevel begrenset tilgang til HBOterapi og relativt store krav med hensyn til utstyr og skolert personell.
Botulinumtoksin A (BTXA) kan brukes i forbindelse med akutt behandling av frostskader og for å behandle følge
tilstander (17). Rasjonale er at BTXA injisert i nærheten av perifere blodkar kan minke tendensen til spasmer i slike blodkar under kuldepåvirkning og derved bidra til bedre perifer sirkulasjon (18). Redusert vasospasme og bedret nervefunksjon er også påvist etter BTXA-behandling i relasjon til andre håndskader (19,20). Plastikkirurgisk seksjon på UNN har under flere år mottatt pasienter med kuldeskader, oftest relatert til militær aktivitet i indre Troms i forbindelse med vinterøvelser. BTXA-injeksjoner er da brukt som komplement til annen systemisk anti-inflammatorisk behandling i forbindelse med behandling av akutte skader (Cauchy grad 2-4, figur 2). Vanligvis vil en dose på 8 IE BTXA per finger/tå, injisert i subkutant rom midtvolart/plantart over MCP/MTP ledd være tilstrekkelig. I tilfelle injeksjon rundt større blodkar på håndledds eller ankelnivå vil ultralydveiledning være av stor verdi. I slike tilfeller har vi ofte brukt inntil 40 enheter per injeksjonssted. (Demonstrasjonsvideo på https://uit.no/research/dirg). Effekten av behandlingen vurderes basert på pasientens egen opplevelse av plager relatert til kuldepåvirkning eller aller helst objektivt ved bruk av for eksempel termografi (21). Langtidseffekten av BTXA-injeksjoner på kulderelaterte smerter og hypotermi er tidligere beskrevet (17). Gjentatte BTXA-injeksjoner kan gi langvarig og sågar permanent normalisering av perifer perfusjon i hender og føtter også ved oppstart lang tid etter opprinnelig traume.
Annen kompletterende behandling, som er tidligere omtalt og publisert i en rekke mindre studier, slik som regional nerveblokkade, systemisk terapi ved alfareseptorblokkerer eller pentoxifyllin er fortsatt ikke etablert som anbefalte modaliteter på grunn av manglende vitenskapelig dokumentasjon i tilstrekkelig omfang (13).
Denne oppdateringen presenterer i sammenfatning mer omfattende vitenskapelig grunnlag for å anbefale bruk av intravenøs iloprost som førstevalg ved dype frostskader, samt økt interesse og begynnende bevis for at også hyperbar oksygenering kan være nyttig for selekterte pasienter, der slik terapi er tilgjengelig. Injeksjon av Botulinumtoxin A for å redusere kuldeindusert karspasme virker også å kunne bidra til å redusere følgetilstander etter kulde og frostskader.
REFERANSER : Se bakerst i nettutgaven på kirurgen.no
NÅR TIDEN KREVER MER AV OSS – KRIGSKIRURGI I NORGE
Norge har bistått Ukraina i behandlingen av krigsskadde pasienter siden oppstarten av fullskalakrigen mellom Ukraina og Russland februar 2022. Fra januar 2023 samlet og sentraliserte man behandlingen av disse pasientene ved Medical Evacuation (MEDEVAC)- posten, Ullevål Sykehus. Rekonstruksjonene har gitt oss verdifulle erfaringer innen krigskirurgi.
INGER KARIN FUGLESTEG¹, HARIS MESIC¹, ERIK FORMANEK², SRIKUMAR MURUGAN 3, MOHAMED ABDELRAHMAN 3
¹AVDELING FOR PLASTIKK- OG REKONSTRUKTIV KIRURGI, OUS
² ORTOPEDISK AVDELING, SEKSJON FOR ORTOPEDISK TRAUMATOLOGI, OUS
3 UNIVERSITY OF KHARTOUM, SUDAN
KORRESPONDANSE: INGER KARIN FUGLESTEG – INFUGL @ OUS - HF.NO
BAKGRUNN
Mars 2022 ble det politisk besluttet at Norge skulle bidra i behandlingen av ukrainske pasienter. Siden den gang har Norge mottatt over 400 pasienter, hovedsakelig traume- og kreftpasienter (1). I europeisk sammenheng er det Norge og Tyskland som har bidratt mest i behandlingen av ukrainske MEDEVAC-pasienter (2).
HVILKE PASIENTER BEHANDLER VI?
Pasientene som meldes gjennom MEDEVAC-ordningen er de pasientene det er mest hensiktsmessig for det ukrainske helsevesenet å sende fra seg. Disse pasientene har fått initial behandling lokalt, hvor det i etterkant har oppstått komplikasjoner i form av infeksjoner (3). Ukentlig mottar vi en liste over aktuelle pasienter. Opplysningene om den enkelte pasient er sparsomme og mangelfulle før ankomst. Medfølgende journal stemmer oftest ikke og pasientene har heller ikke selv oversikt over de multiple inngrepene de har vært gjennom, ofte et tosifret antall. Fra februar 2023 til februar 2024 har vi behandlet 35 pasienter. Samtlige er menn, gjennomsnittsalder 39 år, med underekstremitetsskader fra krigshandlinger. Skademekanismen er som oftest droner eller artilleri. Alle pasientene vi har rekonstruert røyker. Infeksjon med
multiresistente mikrober er regelen heller enn unntaket. Til tross for opplevelser med vold over lang tid, ofte med tap av venner og familie, viser gruppen stor mental robusthet og samarbeidsevne.
ORGANISERING
MEDEVAC-posten har fire sengeplasser, tidligere seks, der to ortopeder har den daglige driften i tett samarbeid med mikrobiologer, infeksjonsmedisinere og plastikkirurger. Posten har også tilgang på blant annet tolketjeneste, psykolog, psykiater, sosionom og ernæringsfysiolog, noe som sikrer en helhetlig tilnærming i behandlingen. Posten administrerer en egen operasjonsstue, men ved mikrokirurgiske dekningsprosedyrer blir pasientene forflyttet til plastikkirurgisk sengepost ved Rikshospitalet grunnet tilgang til mikroskop og utdannet personell innen prosedyren.
Samtlige pasienter isoleres på grunn av multiresistente bakterier. Hensynet til multiresistente og ekstremresistente bakterier har vært en viktig rammefaktor for organiseringen av arbeidet da dette er ekstra ressurskrevende under oppholdet og i videre rehabilitering (Figur 1).

FORLØP
Pasientene blir ved ankomst screenet for multiresistente mikrober, tuberkulose og blodsmitte. I tillegg tas bildediagnostikk. Prinsippet for behandling er radikalt debridement, antibiotikabehandling og tidlig bløtdelsdekning. Radikalitet er avgjørende for å unngå gjentatte små sårrevisjoner som fører til forsinkelser i behandlingen og risiko for superinfeksjon med andre mikrober. Omfanget av skaden er ofte ikke åpenbart før første operasjon er gjennomført og denne legger grunnlaget for den videre tverrfaglige behandlingen.
De fleste pasientene gjennomgår langvarig (8-12 uker) intravenøs antibiotikabehandling i tillegg til lokal antibiotikabehandling. Gjennom lokal antibiotikabehandling kan man oppnå høyere lokal konsentrasjon enn det pasienten tåler av systemisk behandling.
Sårskift og revisjoner gjentas til makroskopisk og helst mikroskopisk rent sår der man ikke lenger får oppvekst av mikrober. Fordelene med gjentatte revisjoner veies fortløpende mot hvor viktig det er å oppnå tidlig dekning av såret med vitalt vev.
Etter sårrevisjon vil man i mange tilfeller stå igjen med én eller flere sårdefekter som ikke kan lukkes direkte, der osteosyntesemateriale eller vitale strukturer er eksponert. Det er vanskelig å dekke dette ved å mobilisere vevet lokalt grunnet fibrose etter uker til måneder med VAC-behandling og infeksjon. Da kreves tilføring av vaskularisert vev i form av stilket eller frie lapper.
I vårt materiale har tiden fra pasienten ankommer Norge til rekonstruksjon er utført, tatt mellom 15 og 161 dager, med et gjennomsnitt på 66 dager. Tid fra skade til rekonstruksjon har tatt mellom 60 og 414 dager, med et gjennomsnitt på 189 dager. Pasientene har i hovedsak vært inneliggende på MEDEVAC-posten. I noen tilfeller, for eksempel ved aktiv tuberkulose og langvarig soppbehandling, har pasientene i perioder vært inneliggende ved infeksjonsavdelingen ved OUS.
Vi ser at pasientene i den senere tid blir sendt tidligere fra Ukraina etter at skaden er påført enn i begynnelsen av krigen. Vi ser også en trend der vi oppnår infeksjonskontroll og utfører rekonstruksjonen tidligere enn det vi gjorde hos de første pasientene. Pasienten som ventet 161 dager før vi rekonstruerte, skyldtes at han ble behandlet
FIGUR 1: Illustrasjon av arbeid med pasient på MEDEVAC-posten. Arbeidet krever isolasjon og smittevernsutstyr. Pasienten har samtykket til publisering av bildet.







FIGUR 2: Bilder av lokal lapp + fri lapp.
2A: Pasient som er rekonstruert med stilket m. gastrocnemius med hudøy i Ukraina.
2B: Etter gjentatte debridement med fjerning av arr og infeksjon, er tidligere rekonstruksjon blitt vanskelig å lukke direkte. Det er på nytt blitt et dekningsproblem.
2C: Pasienten er rekonstruert med fri ALT bilateralt. Man kan se gjenværende del av tidligere rekonstruksjon.
Pasienten har samtykket til publisering av bilder.
FIGUR 3: Bruk av Masquelet-teknikk for å bevare benlengde.
3A: Sement-spacer under tidligere rekonstruksjon med fri lapp.
3B: Spacer er fjernet. Margnaglen er gjenværende.
3C: Rommet rundt naglen er fylt med beintransplantasjon fra hofte.
3D: Lappen er suturert tilbake. Plassering av karstilk er markert med tusj.
Pasienten har samtykket til publisering av bilder.
2A
2C 2B
3A
3C 3B
3D
for tuberkulose før vi startet med kirurgien. Dette reflekterer en helhetlig tilnærming i pasientbehandlingen.
DEKNINGSPROSEDYRER
Av pasientene i vårt materiale trengte 40 % (14 av 35) rekonstruksjon i form av frie eller lokale lapper, av og til i kombinasjon med delhudstransplantasjon. Vi benyttet stilkete lapper hos to av pasientene. Årsaken til at vi gjør stilkete lapper relativt sjelden er fordi denne løsningen ofte har blitt forsøkt i Ukraina, og derfor ikke er en opsjon når pasienten kommer til oss. Majoriteten av defektene blir derfor rekonstruert med frie lapper (Figur 2). Type lapp blir valgt ut fra hva vi tenker er mest hensiktsmessig for pasienten, donormorbiditet, og hva CT angiografi viser med tanke på skader på kar og gjenværende splinter i nær relasjon til kar.
Førstevalget ved behov for dekning med fri lapp er Anterolateral thigh (ALT). Vi har også benyttet parascapular lapp, lyskelapp og muculus latissimus dorsi ved noen rekonstruksjoner. Tre pasienter trengte flere lapper for å oppnå full dekning.
Det er utfordrende å preparere frem mottakerkar i et gammelt skadeområde. Disseksjon av arterier og vener i et slikt område krever forsiktighet og tålmodighet. Ofte ser vi at venene er av dårlig kvalitet med tromber etter den initiale skaden. Vi har 14 % (2 av 14) tap av lapp første året, den ene pasienten med havarert lapp hadde skyttergravsfot (referer Sjøbergs artikkel om frostskader). Begge pasientene ble dekket med nye frie lapper.
OSTEOMYELITT OG BLØTDELSDEFEKT
Osteomyelitt er en hyppig problemstilling som kan medføre partiell eller total fjerning av bein. Ved segmentalt tibia beintap kan Masquelet-teknikk benyttes for å bevare beinlengde. Dette er en tostegs ortopedisk prosedyre med stabilisering av bein og innleggelse av serpent-spacer i første seanse der plastikkirurgisk dekningsprosedyre, fri lapp, utføres dagen etter ved behov. I andre seanse, etter cirka seks uker, kan man erstatte spacer med fritt beingraft som blir vaskularisert av membranen dannet rundt tidligere spacer. Dette krever et samarbeid mellom ortoped og plastikkirurg da man må løfte tidligere rekonstruksjon med fri lapp. Incisjonen legges da i kanten av lappen, lengst unna stilken og tidligere anastomoseområde. Masquelet-teknikk ble benyttet hos 50 % av de rekonstruerte (Figur 3).
PASIENTENES FORVENTNINGER
Pasientene har store forventninger til hva vi kan tilby kirurgisk. De har ventet i uker til måneder på behandling utenlands og har til tider blitt forespeilet lokalt å bli helt bra etter en operasjon ved vår avdeling. Det er viktig å få en felles forståelse av situasjonen og hva vi kan tilby i løpet av de første dagene etter ankomst. I noen tilfeller vil amputasjon gi et mer forutsigbart forløp med et bedre funksjonelt resultat enn et forsøk på rekonstruksjon. Dette kommer ofte uventet på pasientene og de trenger grundig informasjon og modningstid. Vår amputasjonsrate i dette materialet er 8 % (4 av 35), der én av disse amputasjonene har blitt gjort grunnet infeksjonsresidiv etter først forsøk på rekonstruksjon.
Halvparten av de vi har rekonstruert har reist tilbake til Ukraina.
KONKLUSJON
Våre plastikkirurgiske erfaringer etter første året med rekonstruksjon av ukrainske pasienter ved MEDEVAC-posten viser at vi har bygd kompetanse innen rekonstruksjon av gamle krigsskader. Over tid ser vi at vi rekonstruerer tidligere i forløpet nå enn det vi gjorde i starten, med behov for færre revisjoner i forkant. Kirurgien er tidkrevende og komplisert.
Medevac-posten ved Ullevål har, ved siden av å være et viktig humanitært bidrag til Ukraina, gitt Norge verdifulle erfaringer innen rekonstruktiv kirurgi av krigsskader. Erfaringene viser viktigheten av sentralisering av pasientene, radikale første sårrevisjoner, kompleksiteten ved multiresistente infeksjoner og viktigheten av multidisiplinært samarbeid. Denne innsatsen understreker at selv i fredstid kan vi bidra til å bygge kirurgisk kompetanse som styrker helseberedskapen og forbereder oss på fremtidens utfordringer, både nasjonalt og internasjonalt.
REFERANSER :
Se bakerst i nettutgaven på kirurgen.no
REKONSTRUKSJON AV MELLOMANSIKT OG NESE ETTER SKADE
Rekonstruksjon etter alvorlig traume mot mellomansiktet kan være svært kompleks og innbefatter både skjelett- og bløtvevsoppbygning av maksille, orbita, nasoethmoidalregion, nesehule og nesens topografiske anatomi. Vi gir her en kort innføring i ulike metoder som kan brukes i et slikt rekonstruksjonsforløp og presenterer et pasienteksempel med omfattende ansiktsskade etter mineeksplosjon i starten av krigen i Ukraina. Skade på tannbærende kjeve (alveolarprosessen) og tannrehabilitering omtales ikke nærmere.
CHRISTINA STUEDAL 1, FREDRIK PLATOU LINDAL 2, KRISTIN EIDAL 1
1 AVDELING FOR PLASTIKK- OG REKONSTRUKTIV KIRURGI, OUS
2 KJEVE - OG ANSIKTSKIRURGISK AVDELING, OUS
KORRESPONDANSE: CHRISTINA STUEDAL – SBSTUC @ OUS - HF.NO
GENERELT OM REKONSTRUKSJON
AV SKJELETTET I MELLOMANSIKTET
Ved frakturert mellomansiktsskjelett uten større bentap, kan bruddene reponeres anatomisk og fikseres med titanplater og skruer.
Ved substanstap av ben, vil det være behov for å tilføre nytt ben og/eller kunstige implantater for å reetablere støtte og struktur i mellomansiktsskjelettet.
Bentransplantater kan høstes som frie avaskulære graft eller frie mikrovaskulære benlapper.
Ved mindre bendefekter, kan enkle transplantater fra for eksempel kalvariet, costa eller crista iliaca være aktuelt. Graftene må være begrenset i størrelse og omsluttes av friskt vaskularisert bløtvev, da de er avhengige av sirkulasjonen i det omgivende vevet for å overleve på
mottakerstedet. Dette gjelder ikke nødvendigvis kalvariebengraft, som er mer motstandsdyktig og kan tåle mer suboptimale omgivelser (1).
Frie mikrovaskulariserte benlapper kan brukes til større og kompliserte skjelettdefekter. En fri lapp høstes med sin «egen sirkulasjon»; en arterie og vene(r) som koples til mottakerkar i nærheten av defekten med mikrokirurgisk teknikk. De vanligste frie vaskulariserte benlappene som brukes til mellomansiktet er fibula-, crista iliaca- og scapulalapper.
Til benet mellomansiktsrekonstruksjon kan det også brukes syntetiske materialer, for eksempel titan og polyetylen (plast) implantater som må dekkes med godt sirkulert bløtvev. Det finnes standard utforminger og størrelser av slike implantater, for eksempel til orbitagulv eller kinnbensoppbygging (zygomaimplantater). Det har vært en
stor utvikling de siste årene innen 3D-planlagte pasienttilpassede (customized) implantater. Implantatene designes og printes ut fra pasientens bearbeidede CT-bilder, slik at implantatet passer nøyaktig til bendefekten(e) til aktuell pasient (Computer aided design (CAD)- Computer aided manufacturing (CAM)-teknikk)).
GENERELT OM REKONSTRUKSJON
AV BLØTVEV I MELLOMANSIKTET
De enkleste formene for rekonstruksjon ved bløtvevstap (sekundær tilheling og primær lukking) gir ved større defekter pasienten svært dårlig funksjon og estetikk. Vanlige eksempler er drag på nedre øyelokk (ektropion) og medfølgende lukkedeficit (og på sikt fare for synet), oralinkontinens med drag (opptrekk/nedtrekk) av leppen, blottede tenner/tannkjøtt og problemer med sikling, matinntak og tale.
Store bløtvevsdefekter i mellomansiktet (tap av hud, subcutis og muskler) må tilføres nytt bløtvev for å rekonstruere de anatomiske regionene, så som øyelokk, kinn, overleppe og nese.
Lokale og regionale lapper (vev i nærheten av defekten) som forflyttes til defekten er førstevalget hvis det er nok friskt vev tilgengelig, for eksempel rotasjonslapp fra laterale kinn og hals til dekning medialt i mellomansiktet (Mustarde-lapp). Det kan også være aktuelt å legge inn vevsekspandere for å øke arealet av tilgjengelig frisk hud som deretter forflyttes til defekten, men ved større kompliserte defekter brukes oftest frie vaskulære lapper høstet fra andre steder på kroppen slik som beskrevet over.
Det kan også være behov for kombinerte ben og bløtvevslapper (for eksempel fibulalapp med hudøy) og innerverte muskellapper med eller uten hudøy (for eksempel gracilis muskellapp med tilhørende nerve for dynamisk rekonstruksjon av leppe). Valg av lapp(er) i rekonstruksjonen hos den enkelte pasienten er avhengig av en rekke faktorer, blant annet fargematch, volum og tekstur. Lapper som forflyttes til ansiktet er alltid en utfordring, da lappen uansett høstested ellers på kroppen som regel vil fremtre voluminøs, blek og avvikende mot ansiktshuden for øvrig. Ofte trengs det robuste lapper med flere perforanter som vil tåle bretting og forming for tilpasning, og som kan høstes med en lang karstilk for å nå frem til anastomosestedet. Det vil være behov for flere seanser
med tilpasning av lappen i etterkant, inklusiv eventuelt tatovering for bedre fargematch.
De vanligste frie bløtvevslappene som brukes til hodet er underarmslapp (radialislapp), lårlapp (ALT-lapp), lapper fra scapularegionen, latissimus dorsi muskellapp, gracilis muskellapp og lapp fra leggen (MSAP-lapp). De vanligste stedene å kople lappene til ny blodforsyning (anastomosested) er temporalkarene foran øret, facialiskarene og thyroidea superiorkarene på halsen.
GENERELT OM REKONSTRUKSJON AV NESE
Rekonstruksjon av traumatisk delamputert/totalamputert nese gjøres vanligvis som en egen prosedyre etter midtansiktsrekonstruksjonen. Hos noen pasienter er det likevel aktuelt å starte neserekonstruksjonen samtidig med oppbygging av midtansiktet, da det brukes kombinerte frie lapper som skal dekke både kinn og nese.
Rekonstruksjon av nese innebærer en ny innside (nesehulens slimhinne/indre lining), ny projeksjon av nesen (neseskjelett) og ny utside (hud). Tapt neseskillevegg rekonstrueres ikke.
Ved mindre skade av nesen og omliggende vev, tilstreber man å bruke gjenværende neseslimhinne (mukosa) og/eller hud i nærheten av defekten som lokale lapper/ perforatorlapper til ny innside. Ved en total traumatisk neseamputasjon vil det oftest være bløtvevsskade i midtansiktet for øvrig, slik at lokalt bløtvev ikke er tilgjengelig for bruk i neserekonstruksjonen. Indre lining kan da rekonstrueres med en fri lapp, og mest egnet er tynne lapper av hud- og/eller fascie med lang karstilk for mulighet å tunnelere karstilken ut til temporalkarene eller ned til halskarene for anastomosering. Den vanligste frie lappen til innside nese er radialislappen som da «snus» med hudsiden inn i nesehulen, men for eksempel ALTlappen, som ren fascie- eller hudlapp, kan være et godt alternativ med mindre donormorbiditet (2,3).
Ny projeksjon av nesen støttes opp med bentransplantat festet kranialt når neseskilleveggen mangler helt. Oftest brukes ribbein/ribbebrusk og/eller kalvarieben (ytre cortex av skalleben), men ben fra fibula eller hofte kan også brukes. Ribbebrusk gir mer naturlig elastisitet i nedre del av nesen, men kan på sikt «krumme» seg («warping») og medføre skjev nese. Ribbein er mindre motstandsdyktig

BILDE 1: 32 år gammel kvinne med status 14 dager etter mineeksplosjon i starten av krigen i Ukraina vår 2022. Knusningsskade med multiple frakturer og bentap i maksille, kinnben, neseben og orbitagulv. Omfattende bløtvevstap i mellomansikt og nese. Pasienten har gitt samtykke til publisering av bildet.

BILDE 3: Rekonstruksjon av neserygg med kalvarieben. Rekonstruksjon av bløtvev i mellomansikt og ny innside til nese med fri sammensatt ALT-lapp fra høyre lår, hudlapp til kinn og fascielapp til innside nese. Pasienten har gitt samtykke til publisering av bildet.

BILDE 2: Rekonstruksjon av skjelettet. Platefiksering av høyre maksille og pasienttilpasset titanimplantat til maksille, kinnben og orbita venstre side. Pasienten har gitt samtykke til publisering av bildet.

BILDE 4: Rekonstruksjon av ytre nese med pannelapp. Donordefekt høyre side panne dekket med hudtransplantat og buttonert med allovynbandasje. To dopplerpunkt markert i synlig del av ALT-lappen for overvåkning postoperativt. Pasienten har gitt samtykke til publisering av bildet.
mot infeksjoner og resorpsjon og det er større risiko for donorstedmorbiditet (4,5,6,7,8,9). Kalvarieben vil medføre en «stiv nese» helt til nesetippen og oppleves mindre naturlig når man beveger på nesen, og nesen kan lettere frakturere ved nye traumer. Kalvariebenet er svært motstandsdyktig og kan tåle blottlegging og infeksjon, resorberes i veldig liten grad og krummer seg ikke med tiden.
Donormorbiditet ved høsting av kalvarieben er svært sjelden (1). Ørebrusk og ribbebrusk brukes til laterale neserygg, nesevinger og nesestolpe ved behov for støtte.
Til rekonstruksjon av huden på nesen er pannelappen gullstandard. Det er en stilket lapp basert på arteria trochlearis som kommer ut ved øvre mediale orbitakant og forløper opp i pannen. Pannehuden har god farge og teksturmatch med nesen. Lappen designes for å passe den nye nesen med nesestolpe og nesevinger, løftes fra pannen med tilhørende blodkar og svinges ned og formes til ny ytre nese. Donordefekten i pannen kan tilhele sekundært (granulere med arrvev), dekkes med hudtransplantat eller forbehandles med ekspandering av pannehuden slik at man kan lukke hele donordefekten etter høsting av lappen direkte. Stilken kuperes etter noen uker og tidsforløpet varierer med behov for flere seanser og justeringer før endelig funksjonelt og estetisk resultat (10,11).

AKTUELL KASUISTIKK
Pasienten er en 32 år gammel kvinne fra Ukraina med knusningsskade av midtansiktet, subtotal neseamputasjon og tapt syn på høyre øye etter mineeksplosjon i krigen våren 2022. Hun ble overført til Ullevål sykehus én måned etter skaden for initial stabilisering av maksille og orbita med platefiksering (ORIF- Open Reduction and Internal Fixation). Videre operasjoner ble utført på Rikshospitalet hvor ansiktsskjelettet ble rekonstruert med pasienttilpasset titanimplantat til venstre overkjeve, kinnben og øyehule. Innside av ny nese og bløtvevsdefekten i mellomansikt/kinn ble rekonstruert med en sammensatt fri ALTlapp fra høyre lår. Kalvariebengraft ble brukt til neseprojeksjon, og pannelapp til nesens utside. Senere har det vært flere seanser med kupering av pannelapp og korreksjoner. Skaden av høyre orbitainnhold medførte atrofi og blindt øye, og mediale øyevinkel var fastgrodd og caudalisert. For tilpasning av øyeprotese var det behov for justering av mediale øyevinkel og rekonstruksjon av øvre og nedre øyelokksfold (fornix), slik at skallprotesen kan ligge på det lille gjenværende øyeeplerudimentet (phthisis bulbi). Hun har senere fått tilbake noe arrdrag i mediale øvre øyelokk som er planlagt korrigert for bedre øyeåpning.
REFERANSER :
Se bakerst i nettutgaven på kirurgen.no

BILDE 5: Resultat etter kupering og korreksjoner av pannelapp til nese, tatovering av lapp i venstre kinn og periorbital rekonstruksjon høyre orbita med tilpasning av øyeprotese. Pasienten har gitt samtykke til publisering av bildet. Takk til anaplastolog Malene Grip for fremstilling av øyeprotesen.
HÅNDTERING AV TRAUMATISKE PERIFERE SKADER AV NERVUS FACIALIS
Traumatisk eller iatrogen skade av nervus facialis er en sjelden, men alvorlig skade. De vanligste årsakene er penetrerende skader som stikksår, kutt, skuddskader og utilsiktet skade under kirurgiske inngrep. Denne artikkelen fokuserer på akutte ekstrakranielle skader av nervus facialis, med mål om å øke bevisstheten rundt tilstanden, sikre tidlig diagnostikk og behandling, og dermed redusere risikoen for permanente sekveler.
ANNE MADELENE SAMDAL, ASTRID SCHJELDERUP BERNTSEN, ELISABETH VALIO SÆTNAN
AVDELING FOR PLASTIKK- OG REKONSTRUKTIV KIRURGI VED RIKSHOSPITALET OUS
KORRESPONDANSE: ELISABETH VALIO SÆTNAN – ELSAET @ OUS - HF.NO
Ekstrakranielle skader på nervus facialis defineres som skade på nerven etter at den har passert foramen stylomastoideum. Nervus facialis deler seg deretter i fem hovedgrener og danner rami temporalis, zygomaticus, buccalis, mandibularis og cervicalis (3) (Figur 1).
Skade på nervus facialis kan skje langs hele dens forløp, men den er mest utsatt i områdene hvor den ligger overfladisk. Den eksakte lokalisasjonen av nerven, i forhold til palpable landemerker, er variabel. For å unngå iatrogen skade er det viktig å være i riktig anatomiske sjikt (7).
Anatomiske områder hvor facialisgrenene ligger mer superfisielt er mer utsatt for skade (Figur 2). Det er viktig å informere pasientene om risiko for nerveskade både ved akutt rekonstruksjon etter skade og ved elektiv ansiktskirurgi. Som hovedregel rekonstrueres skader på nervens forløp lateralt for laterale canthus (Figur 1), mens grener lokalisert medialt for laterale canthus kan vurderes rekonstruert på individuelt grunnlag. Rekonstruksjon av nerven kan utføres med direkte sutur, interponat eller kobling til nervus massetericus eller nervus hypoglossus.
DIAGNOSTIKK
Tidlig identifisering av en skade på nervus facialis er avgjørende for behandlingsstrategi og prognose. Sekvelet pasienten sitter igjen med er avhengig av skademekanismen, alvorlighetsgraden og tidspunktet for intervensjon (2).
Diagnostisering av skade på nervus facialis baserer seg primært på en klinisk vurdering som inkluderer anamnese og klinisk undersøkelse. Den kliniske undersøkelsen omfatter både en statisk og en dynamisk evaluering der nervens funksjon vurderes systematisk. Evaluering av nervefunksjonen må utføres før administrasjon av lokalanestesi.
Ved den statiske undersøkelsen observeres asymmetrier i ansiktet med pasienten i hvile. Dette inkluderer inspeksjon av øyenbryn, posisjonen til nedre øyelokk, dybden av nasolabialfolden og plasseringen av munnvikene. I tillegg bør hevelse vurderes med palpasjon for å identifisere eventuelt ødem, hematom eller fluktuasjon.


FIGUR 1 og 2: Nervus facialis sin anatomi. Rød linje definerer laterale canthus hvor man på individuelt grunnlag kan vurdere rekonstruksjon av nervegrener lokalisert medialt for denne. Sirklene viser anatomiske områder hvor facialisgrenene ligger mer superfisielt og er mer utsatt for skade. Foto: Kari Samuelsen / Elen Sonja Klouman
Den dynamiske undersøkelsen har som mål å evaluere funksjonen til de affiserte nervegrenene. Temporalisgrenen innerverer musculus frontalis, musculus corrugator supercilii og musculus auricularis superior. Disse musklene styrer henholdsvis evnen til å heve øyenbryn, trekke øyenbrynene sammen og, hos noen, bevege øret. Zygomaticus-grenen innerverer musculi zygomatici major og minor. Disse musklene trekker munnvikene oppover og gjør det mulig å smile. Grenen innerverer også musculus obicularis oculi som går til øyelokkene og gjør det mulig å blunke og lukke øynene. Buccalis-grenen innerverer musculus buccinator som holder kinnene stramme samt assisterer under tygging og med å blåse ut luft. Denne grenen av facialisnerven innerverer også musculus orbicularis oris som kontrollerer leppenes form og bevegelse og er avgjørende for blant annet talefunksjonen. Den marginale mandibulære grenen innerverer musculus depressor anguli oris som trekker ned munnvikene, musculus depressor labii inferioris som trekker underleppen nedover, samt musculus mentalis som trekker haken opp. Cevicalis-grenen innerverer musculus platysma. For en systematisk dynamisk undersøkelse kan man be pasienten heve øyenbrynene, lukke
øynene, flekke tenner og smile med åpen munn. Bevegelsene som beskrevet over gir et bilde av både omfanget av og lokalisasjonen til nerveskaden.
For å få en objektiv vurdering av nervens funksjon benyttes ofte standardiserte verktøy. House-Brackmann grading scale (HBGS) er et av de mest anvendte systemene og graderer funksjonen fra I til VI (4). Sunnybrook Facial Grading Scale (SFGS) gir en mer detaljert vurdering av både statiske og dynamiske aspekter ved ansiktsfunksjonen. Begge skåringssystemene anses som nyttige for klassifisering av alvorlighetsgraden og for oppfølgingen (6). Foto og videodokumentasjon er verdifullt, spesielt for å evaluere endringer i ansiktsfunksjonen over tid.
I noen tilfeller kan supplerende diagnostikk være relevant. CT av ansiktsskjelettet er nyttig for å utelukke samtidig skjelettskade. MR kan benyttes for å vurdere bløtvevet og for mer nøyaktig lokalisasjon av nerveskaden. Elektronevrografi (ENG) kan benyttes for å evaluere nerveledningshastighet og skille mellom ulike typer nerveskader som nevrapraksi (forbigående blokkering av nerveledningen uten strukturell nerveskade), aksonot
“For en systematisk dynamisk undersøkelse kan man be pasienten heve øyenbrynene, lukke øynene, flekke tenner og smile med åpen munn.”



3–5: Iatrogen skade av den marginale mandibulære grenen, erkjent og forsøkt rekonstruert på annet sykehus uten funn av den distale enden. Proksimale nerveende ble lokalisert, merket med sutur og henvist innen 24 timer. Ved hjelp av NIM (bilde 3) ble distale ende identifisert og suturert i mikroskop (Bilde 4 og 5). Pasienten har gitt samtykke til publisering. Foto: Kari Samuelsen / Elen Sonja Klouman
FIGUR
Utredning og behandling av facialisskader - oppsummert
Preoperativ vurdering: Ved ansiktsskader skal funksjonen til nervus facialis alltid vurderes før administrering av lokalanestesi.
Oppfølging av usikker nerveskade: Ved mistanke om nerveskade av ukjent etiologi bør pasienten kontrolleres innen 24 timer for å bekrefte eller avkrefte skaden.
Tidlig behandling: Ved bekreftet nerveskade skal nervesutur utføres så tidlig som mulig og innen 72 timer etter skadetidspunktet. Dersom nervesutur ikke er mulig, bør nerven merkes med permanent sutur og pasienten henvises til et senter med spesialkompetanse innen facialiskirurgi.
Sekundær rekonstruksjon: Ved behov for sekundær rekonstruksjon kan pasienten henvises til facialis-teamet ved Avdeling for plastikk- og rekonstruktiv kirurgi ved Rikshospitalet for videre vurdering.
mese (skade på nervefiberen, men med intakt støttevev) og nevrotmese (fullt kontinuitetsbrudd). ENG kan også gi prognostisk informasjon om regenereringspotensialet. Elektromyografi (EMG) brukes for å vurdere muskelfunksjon og fastslå skadeomfanget på forskjellige nivåer av nerven (3,5).
Til tross for disse diagnostiske metodene anbefaler vi ikke rutinemessig bruk av andre undersøkelser enn CT ved mistanke om skjelettskade. Ved ekstrakranielle nerveskader er tidlig behandling, innen 72 timer etter skadetidspunktet, den viktigste prognostiske faktoren. Ytterligere diagnostikk vurderes kun på spesifikke indikasjoner (1). Dette er i tråd med vår kliniske praksis ved Oslo universitetssykehus, hvor fokuset er på å sikre rask og effektiv behandling innen 72 timer etter skadetidspunktet.
BEHANDLING
Behandlingen av skade på nervus facialis baseres på en helhetlig vurdering av pasientens situasjon, og den kan variere fra observasjon til akutt kirurgi og omfattende rekonstruksjon(er).
Ved milde eller midlertidige nerveskader, som nevrapraksi, er nøye observasjon første behandlingsvalg (1). Her foreligger det usikkerhet om skadens natur. I slike situasjoner anbefales en tidlig kontroll innen 24 timer for å bekrefte diagnosen og vurdere eventuell tilbakegang av paresen og/eller hevelsen. Dette gjelder også tilfeller hvor man er usikker på om lokalanestesi kan være årsak til den postoperative paresen.
Akutt innsettende parese etter traume med komplett funksjonstap gir mistanke om nevrotmese, og eksplorasjon bør vurderes med tanke på direkte nervesutur. Det
samme gjelder ved iatrogen nerveskade. Tidspunktet for kirurgisk intervensjon er avgjørende for prognose, og inngrepet bør gjennomføres innen 72 timer (1). Ved åpne sår med tilhørende nerveutfall bør eksplorasjon alltid utføres for å identifisere den affiserte nerven og dens nerveender. Distal nervestimulering, med bruk av blant annet NIM-systemet (intraoperativ nerve monitoreringsystem), er mulig innen 72 timer etter skaden og kan bidra til å lokalisere den distale nerveenden. Direkte nervesutur har bedre prognostiske utsikter enn ved bruk av nervegraft (1).
Nervesutur utføres ved hjelp av mikroskop. Alternativt kan lupebriller benyttes. Nervestimulator er et verdifullt verktøy under prosedyren. Direkte sutur utføres i epinevriet ved hjelp av enkeltstående monofilament suturer 9-0 eller 100. Skadede nerveender trimmes før sutur for å sikre optimal kontaktflate, men unødvendig forkortelse av nerven må unngås for å minimere tensjon. Dersom tensjon oppstår kan det være nødvendig å bruke et nervegraft som interponat, for eksempel fra nervus auricularis magnus eller nervus suralis.
Nervesutur er en prosedyre som bør utføres av en kirurg med erfaring innen perifer nervekirurgi og med god kjennskap til nervens anatomi. Dersom det skulle foreligge usikkerhet rundt behandlingen, skal den lokaliserte nerven merkes med trådsutur og pasienten henvises til sykehus med nødvendig kompetanse for videre vurdering og behandling.
REFERANSER : Se bakerst i nettutgaven på kirurgen.no
INNFØRING AV NY KIRURGISK TEKNIKK OG TEKNOLOGI
– IDEAL- RETNINGSLINJENE
KNUT MAGNE AUGESTAD MD, PHD
FØRSTEAMANUENSIS UNIVERSITETET I OSLO, OVERLEGE GASTROKIRURGISK AVDELING
AKERSHUS UNIVERSITETSSYKEHUS, LEDER KREFTKIRURGISK FORSKNINGSGRUPPE AHUS KORRESPONDANSE: K.M.AUGESTAD @ MEDISIN.UIO.NO
I julenummeret av "Kirurgen" (Kirurgen 4/24) var det en rekke tankevekkende artikler som gjelder forskning og kirurgi, blant annet den velskrevne artikkelen "Når er en kirurgisk metode etablert behandling?" ved Michael Bretthauer. Det påpekes at "det norske regelverket er mindre gjennomarbeidet og systematisert", og det er "uklart når en kirurgisk metode; et nytt kirurgisk utstyr eller en ny måte å gjøre et kirurgisk inngrep, er 'etablert' i forstand av at den kan og bør brukes i klinikken". For forskere kan det derfor være nyttig å forholde seg til internasjonalt etablert praksis for innføring av nye kirurgiske metoder, teknikker og utstyr, nemlig IDEAL-retningslinjene (Idea, Development, Exploration, Assement, Long Term study). Ved protokollutforming og kommunikasjon med etisk komite, bør det henvises til IDEAL-retningslinjene, der forskeren reflekterer over eget prosjekt, klassifiserer egen forskningen i henhold til IDEAL og redegjør for hvordan forskningen samstemmer med norsk lovverk og retningslinjer. Denne artikkelen gir en oversikt over IDEAL-retningslinjene og er basert på IDEAL-nettverkets hjemmeside (www.ideal-collaboration.net/home/) og aktuelle publikasjoner (1-3).
FAKTABOKS IDEAL- RETNINGSLINJENE – FORSKNINGSSPØRSMÅL (2)
IDEAL Stadium 1 – Idefasen: Hvorfor er det et behov for den nye kirurgiske teknikken – teknologien?
IDEAL Stadium 2a – utviklingsfasen: Er den nye kirurgiske teknikken-teknologien pålitelig? Må det gjennomføres forbedringer av teknikken –teknologien?
IDEAL Stadium 2b – utforskningsfasen: Er de sentrale forskningsspørsmål med tilhørende endepunkt evaluert? Trenger vi mer data før vi kan gjennomføre en randomisert studie?
IDEAL Stadium 3 – evaluering - sammenligning: Hva er resultatene for den nye kirurgiske teknologien – teknikken sammenlignet med etablert metode?
IDEAL Stadium 4 – langtidseffekter: Oppstår det noen uønskede hendelser eller komplikasjoner når man observerer teknikken – teknologien over tid?
For mer detaljert informasjon se www.ideal-collaboration.net/home/
STADIUM 0 – DET PREKLINISKE STADIUM ( PRE - IDEAL ) Det prekliniske stadiet beskriver utviklingen av en kirurgisk teknikk eller teknologisk nyvinning før det kan utprøves på mennesker (1). «Food and Drug Administration» (FDA) i USA og EU har utarbeidet et lovverk i forbindelse med godkjenning av ny kirurgisk teknologi, og IDEAL-retningslinjene er integrert i disse lovverkene (1, 2). Ved innføring av ny teknologi så anbefaler IDEAL at alle forskere starter med en «failure modes and effect analyses» (FIMEA), der forskeren selvkritisk og reflekterende utarbeider en risikoprofil for den nye teknikkenteknologien:
I. Systematisk gjennomgang og identifisering av alle mulige feil.
II. Hva vil skje hvis det oppstår en feil – hva er verstefallscenario?
III. Hva er sannsynligheten for at en feil oppstår?
IV. Kategoriser alvorlighetsgrad av mulige feil.
IDEAL anbefaler at man klassifiserer teknologien i tre
Ikke-invasiv
Ikke-kirurgisk
Invasiv
Ikke-invasiv teknologi
Kirurgisk Teknologi- instrument som avgir energi
Ikke-kirurgisk
Invasive instrument i kroppshulrom
Kirurgisk Kirurgiske instrument
Absorberbare implantat
Ikke-absorberbare implantat
nivåer og skiller mellom invasiv og ikkeinvasiv teknologi (Tabell 1). Teknikken og teknologien må systematisk evalueres med tanke på pasientsikkerhet og fra et klinisk perspektiv må det utredes om teknologien er hensiktsmessig å innføre. Forskeren og forskningsteamet må ha evne til å kritisk reflektere over læringskurven for innføring av den nye teknikken/teknologien. Sistnevnte er essensielt, da det finnes eksempler på ny teknologi og kirurgisk metode som er innført uten at man har evaluert aspekter rundt den kirurgiske læringskurven (4, 5). Det er velkjent fra den kirurgiske litteraturen at læringskurven, det vil si tiden og antall prosedyrer kirurgen bruker for å komme opp på et akseptabelt teknisk nivå (platåfasen), har har økt risiko for pasientkomplikasjoner og uønskede hendelser (6). For å forbedre tekniske ferdigheter og minske tiden og antall prosedyrer det tar før man når platåfasen, anbefales det at det kirurgiske teamet trener på simulatorer, på dyr eller lik, og får ekspertveiledning (7, 8).
IDEAL STADIUM 1 – IDEFASENFØRSTE UTPRØVING PÅ MENNESKER
Stadium 1 studier beskriver idefasen eller førstegangs utprøvning av teknologien – teknikken på mennesker (2, 3). Den nye kirurgiske metoden/teknologien må beskrives i detalj samt hvordan man har iverksatt preoperative, operative og postoperative overvåkning for å minimere pasientrisiko. Metodebeskrivelsen må inneholde en forklaring på hva du ønsker å gjøre, og PICO (patient, intervention, comparison, outcomes) sjekklisten kan være nyttig å bruke. Studiedesignet må beskrives, i de fleste tilfeller dreier det seg om utprøvning på et lite 0antall pasienter. Inklusjons og eksklusjonskriteriene må være detaljert beskrevet, og forskeren må ha en grundig diskusjon med etisk komité vedrørende nytten versus risikoen av teknikken – teknologien. Videre må sykehusets
Bandasjer, sårbarrierer, respiratorer, Klasse 1
Kirurgiske ultralydapparat Diatermi
Toraksdren Urinkatater
Staplere Nåleholdere
Invasive kateter
Klasse 2 og 3
Klasse 2 og 3
Klasse 2 og 3
Absorberbare suturer Klasse 2
Endovaskulære proteser
Ikke-absorberbare brokknett
Brystimplantat
Klasse 2 og 3
og det kirurgiske teamets erfaring beskrives, og hva slags opplæring som er gjennomført for å maksimere teamets kompetanse og minimere pasientrisiko.
Monitorering av studien av uavhengige eksperter (monitoreringskomité) må være på plass, slik at studien stoppes umiddelbart hvis den skulle utgjøre en fare for pasientsikkerheten. Forskeren må ha en klar plan for hvilke data man skal samle inn og hva som er endepunktet (hva skal måles) i studien. Alle uønskede hendelser og komplikasjoner må rapporteres på en transparent måte, både i sykehusenes meldesystem og i den endelige publikasjonen. Etter en IDEAL stadium 1 studie, skal forskeren/ kirurgen ha en klar formening om teknologien teknikkens nytte versus risiko og om det er hensiktsmessig å fortsette med videre utprøving.
IDEAL STADIUM 2A – FORBEDRING
AV METODEN -TEKNOLOGIEN
På dette stadiet ønsker forskeren å forbedre teknikken/ teknologien, og Stadium 2a studier bygger på resultater fra små «case series» gjennomført i Stadium 1 (2). Ved Stadium 2a er det som regel bare noen få pasienter og kirurger som er involvert på et sykehus. Forskeren må beskrive den opprinnelige teknikkenteknologien og hvilke forbedringer man har gjennomført, basert på erfaringer fra Stadium 1 studier. Som oftest vil det mest hensiktsmessige studiedesignet være en prospektiv kohortstudie utført på et sykehus. Protokollen må inneholde inklusjons- og eksklusjonskriterier. Etiske aspekter må diskuteres, og forskeren må ha en grundig diskusjon med etisk komité i forbindelse med godkjenning av prosjektet. Det må utarbeides en strukturert plan for innhenting av informert samtykke, og man må opplyse pasienten om at man ikke kan kvantifisere risiko for uønskede utfall,
TABELL 1. Klassifisering av kirurgisk teknologi som beskrevet av Marcus og medarbeidere (1)
fordi teknologien teknikken har begrenset evidens. Det må derfor opprettes en ekstern og uavhengig monitoreringskomité, som følger en moitoreringsplan slik at man på et tidlig stadium kan avdekke uønskede hendelser og avvik fra protokollen. Etter at man har gjennomført «utviklingsstudier» skal forskeren/kirurgen være i stand til å avgjøre om teknikken teknologien er ferdigutviklet og kan brukes på en hensiktsmessig måte. Man må også avgjøre om teknikken - teknologien kan evalueres i (IDEAL 2b studie).
IDEAL STADIUM 2B – UTPRØVING
AV TEKNIKKEN -TEKNOLOGIEN
I dette stadiet har man fått god erfaring med bruk av teknikken teknologien, og en større gruppe kirurger på flere sykehus behersker metoden. Man må nå avgjøre om og hvordan teknikkenteknologien kan sammenlignes med den beste eksisterende behandling. Erfaringer og data som samles inn i en IDEAL 2b studie skal brukes til å danne konsensus for en randomisert studie, der man inkluderer mange sentre og kirurger. En IDEAL 2b studie vil gi informative data på sikkerhetsprofilen for teknikken-teknologien, effektestimat til bruk i senere styrkeberegninger, informasjon om kirurgisk kvalitet og læringskurver, og en evaluering av sentrale endepunkter som kan brukes i en randomisert studie. Utprøvingsstudier kan også gi svar på om det er hensiktsmessig å gå videre med en randomisert studie, og en grundig evaluering av læringskurven (hvor mange prosedyrer er det behov for før man når et teknisk tilfredsstillende nivå –platåfasen) vil være nyttig. (9-11)
IDEAL STADIUM 3 – EVALUERINGSFASEN
I evalueringsfasen må man gjennomføre en grunnleggende sammenligningsstudie, vanligvis med eksiterende behandling. Dette må gjennomføres i rimelig tid etter at teknikkenteknologien er evaluert i Stadium 2b studier, for å unngå tap av «equipose». Eqiupoise, er som påpekt av Bretthauer, et begrep som betegner usikkert vedrørende om den nye teknikkenteknologien er bedre enn etablert behandling (12). På dette stadiet er det mest hensiktsmessige å evaluere dette i en multisenter randomisert studie, der flere kirurger og sentre er involvert. Igjen må det gjøres en grundig evaluering av læringskurven til deltagende kirurger, slik at man ikke ska
per unødvendig bias i studien ved å involvere kirurger med divergerende tekniske ferdigheter. Ved utarbeidelse av forskningsprotokoll må CONSORT-retningslinjene for randomiserte kontrollerte studier etterleves, spesielt CONSORT-retningslinjene for "ikke-farmakologiske" intervensjoner, deriblant kirurgiske randomiserte studier (13-15).
IDEAL STADIUM 4 – LANGTIDSRESULTATER
IDEAL-retningslinjene anbefaler å etablere kvalitetsregister for langtidsevaluering av ny teknikkteknologimetode. Ved hjelp av registerdata kan man fange opp, på et relativt tidlig stadium, uønskede hendelser, komplikasjoner og variasjoner mellom sykehus. Kvalitetsregister gjør det mulig å hente ut «real world data», og man kan gi kontinuerlig tilbakemelding til kirurger, noe som er viktig hvis det oppstår avvik. Tilsvarende kan produsenter av nytt kirurgisk utstyr (tabell 1) få tilbakemelding på avvik og feil. IDEAL anbefaler at man oppretter prospektive kvalitetsregister allerede på IDEAL 1 stadiet, det vil si i idefasen utprøvingsfasen.
KONKLUSJON
Implementering av ny kirurgisk teknikk og teknologi må gjennomgå en systematisk tilnærming og IDEALretningslinjene har et solid fotfeste internasjonalt og fortjener økt fokus i det norske kirurgikollegiet. Ny kirurgisk teknikk og teknologi blir ofte drevet frem av entusiastiske kolleger, etter å ha deltatt på kurs i utlandet. Det finnes flere eksempler på at implementeringen av ny kirurgisk teknikkteknologimetode har fått uønskede resultater for våre pasienter, og en bedre etterlevelse etter IDEAL-retningslinjene kan minimere risikoen. Det nåværende norske lovverket er derfor modent for en revisjon. Kunnskap om IDEAL-rammeverket er et viktig verktøy for den forskende kirurg, i forskningsprosjekter og for beslutningstagere ved innføring av nye kirurgiske metoder, og denne artikkelen gir en oppsummering av de viktigste prinsippene.
REFERANSER :
Se bakerst i nettutgaven på kirurgen.no


Selv etter 21 år, gir Mentor CPG™ brystimplantater enestående langsiktige forutsigbare resultater
MENTOR CPG™ brystimplantat er det eneste teksturerte implantatet hvor det er publisert 21 års data. Et implantat for deg som ønsker det beste.
• Lav rotasjonsrate: 1,5%

• BIA-ALCL: 0
• Kapsel kontraktur: 0,4%
• Ruptur: 1,3%
Valgt på nasjonal avtale av Sykehusinnkjøp HF


Langtidsresorberbare nett

Kirurgiske nett til styrking av bløtvev hvor det forekommer svakheter. Brystrekonstruksjon, brokk, defekter i bukveggen og styrking av muskelklaffer.
• Langtidsresorberbare nett som er 100% syntetiske
• Strikket med 2 ulike syntetiske resorberbare fibre
• Finnes i størrelsene: 10x15 cm, 15x20 cm og 20x30 cm
TRAUMATISK NESESKADE: EN GJENNOMGANG AV NESE -
FRAKTURER OG SEPTUMHEMATOM
Nesefraktur oppstår som følge av traume og kan gi symptomer som neseblødning, hevelse og pustevansker. Diagnosen krever en klinisk vurdering og behandlingen avhenger av bruddets alvorlighetsgrad. Rask intervensjon er særlig viktig ved komplikasjoner som septumhematom for å forhindre infeksjoner og deformiteter. God oppfølging sikrer optimal tilheling og reduserer risikoen for langsiktige konsekvenser.
JALA IMAD, KEVIN DARA, ELENA GULEVSKA*
ØRE - NESE - HALS AVDELING, AKERSHUS UNIVERSITETSSYKEHUS
KORRESPONDANSE: JALA IMAD – JALA.IMAD @ AHUS.NO
*Delt førsteforfattere
Nesefraktur defineres som brudd i nesebenet (os nasale) på grunn av traume. I noen tilfeller kan også neseskilleveggen bli affisert. Det er resultat av ulike traumemekanismer som for eksempel kan oppstå ved fall, direkte slag og penetrerende skader. Symptomer ved nesefraktur er blant annet neseblødning, pustevansker og endret utseende (1, 2). Kliniske funn kan være hevelse, neseskjevhet og septumhematom. Siden nesen er lokalisert sentralt i ansiktet, er den spesielt utsatt for traumer. En studie tyder på at skjemmende ansiktsskader kan ha alvorlige psykologiske og sosiale konsekvenser (3). Behandlingen av neseskader må først fokusere på livstruende tilstander som påvirker luftveiene og hemodynamikken, deretter er sekundære hensyn knyttet til funksjon og utseende viktig. De fleste neseskader krever ikke umiddelbar intervensjon med unntak av septumhematom, en sjelden, men alvorlig komplikasjon. Her er det særlig viktig med rask behandling for å unngå potensielt irreversible forandringer av nesens arkitektur.
ANATOMI
Nesens anatomi bestemmer dens funksjon og utseende. Ytre nese kan klinisk deles i flere enheter: beinpyramiden, øvre lateralbrusk, nedre lateralbrusk og neseskilleveggen. Neseskilleveggen er igjen delt inn i en brusket og benete del. Ytre nesens og nesekavitetens blodforsyning kommer fra grener utgående fra a. carotis interna. Lo
cus Kiesselbachii er et arterielt pleksus lokalisert fortil på neseskilleveggen dannet av aa. ethmoidalis anterior og posteriort (begge endegrener fra a. carotis interna) og a. sphenopalatina (endegren fra a. carotis externa). Dette plexus gir blodforsyning til neseskilleveggens brusk. For blodforsyning til septum se figur 1. Innervasjon av selve nesekaviteten og ytre nese skjer hovedsakelig via den femte hjernenerve n. trigeminus (V), spesielt dens to hovedgrener n. opthalmicus (V1) og n. maxillaris (V2). (4-6)
TRAUMEMEKANISME OG ETIOLOGI
Skader oppstår når vevets motstandsevne er mindre enn den påførte energien (ofte kinetisk) i forbindelse med traume. Det kan være i form av idrettsskader, trafikkulykker, fall, vold, eller yrkesskader (7). Tradisjonelt deles traumemekanisme i stump eller penetrerende type, og i de fleste tilfeller foreligger det en kombinasjon. For eksempel vil nesefraktur påført ved fall mot et skarpt bordhjørne være både en stump (kontusjon) og penetrerende (laserasjon) skade (1)
Septumhematom oppstår vanligvis sekundært til traume og kan være uni eller bilateral. Septumbrusken er avaskulær, meget tynn (2-4 mm) og mottar blodforsyning fra den tettsittende perikondrium. Under skade kan mukoperikondrium løsne fra brusken og forårsake ruptur av

FIGUR 1: Figur 1 viser en skjematisk oversikt over blodforsyning til neseskilleveggen, inkludert blodforsyning til Locus Kisselbachi. Figur tegnet av Jala Imad.

FIGUR 2: Figuren viser hvordan et septumhematom kan oppstå etter traume mot nesen. Til venstre viser figuren normal neseseptum i koronalt snitt, med intakt brusk og perikondrium. Midten illustrerer et direkte slag mot nesen, som kan føre til løsning av slimhinnen (mukoperikondrium) fra brusken. Det fører til utvikling av septumhematom, som kan ses helt til høyre i figuren. Blodet samler seg mellom slimhinnen og brusken, noe som kan føre til nekrose og kollaps av septumbrusken uten behandling. Figur tegnet av Jala Imad.
submukosale kar. Dette gir blødning og videre ansamling av blod mellom brusken og perikondriet, se figur 2. Dersom brusken i tillegg knekker kan dette spre seg til motsatt side og gi bilateralt hematom. Hematomet vil gjennom kompresjon og sekundær iskemi gi påfølgende nekrose av brusken. Bilateralt hematom, sammenlignet med unilateral, akselerer denne prosessen. Septumhematom kan også oppstå som en komplikasjon av kirurgi, for eksempel ved septumkorreksjoner, endoskopisk bihulekirurgi og reduksjon av nesemuslinger. Atraumatisk septumhematom sees sjeldent hos pasienter med blødningstendens eller som bivirkning av legemidler. (7)
FOREKOMST OG TALL FRA AKERSHUS
UNIVERSITETSSYKEHUS
Forekomsten av nesefrakturer og septumhematomer i Norge er ikke detaljert dokumentert i tilgjengelige nasjonale statistikker. Tall fra Akershus universitetssykehus
viser totalt 1770 registrerte tilfeller av nesefrakturer fra 2020 til 2025, inkludert 44 lukkede og 2 åpne nesebrudd, hvor resterende 1724 var klassifisert som nesefraktur uten nærmere spesifikasjon (tabell 1). Det ble også registrert 365 tilfeller under «Andre spesifiserte forstyrrelser i nese og bihuler», som inkluderer flere diagnoser, blant annet septumhematom. Variasjoner i kodingspraksis påvirker nøyaktigheten av disse tallene, noe som gjør det utfordrende å fastslå den eksakte forekomsten av septumhematomer og nesefrakturer, inkludert spesifiseringen mellom åpne og lukkede brudd.
DIAGNOSTIKK
Nesefraktur og septumhematom har ofte en traumatisk årsak, og anamnesen er sentral for å avdekke traumemekanismen. Denne informasjonen gir verdifull innsikt i skadeomfang og lokalisasjon og bør veilede den kliniske undersøkelsen.
Diagnosekode
Brudd i neseben 1724
264
255
395
396
296
19
Brudd i neseben;lukket 44 2020 6 2021 2 2022 4 2023 4 2024 24 2025 4
Brudd i neseben;åpent 2 2023 2
Totalt nesefrakturer 1770
Andre spesifiserte forstyrrelser i nese og bihuler 365 2020 37 2021 45
54 2023 70 2024 151 2025 8
TABELL 1: Oversikt over antallet nesefrakturer og diagnosekoden «andre spesifiserte forstyrrelser i nese og bihuler» på Akershus universitetssykehus de siste fem årene, fra 2020-2025.
Ved nesefraktur er den initiale kliniske undersøkelsen svært viktig. Få timer etter oppstått traume mot nesen vil det kunne utvikle seg hevelse over neseryggen som vanskeliggjør fullstendig inspeksjon. Det er likevel viktig å få et bilde av nesens deformitet, hematomer, misfarging i huden og hevelse. Pasientens nese skal inspiseres fra flere vinkler, inkudert forfra, lateralt fra begge sider og nedenfra, og man skal evaluere asymmetrier, depresjoner, protrusjoner, deviasjoner og step. I tillegg vil undersøkelse av nesetetthet være viktig for videre behandling. Ved bruk av et spekulum kan fremre rhinoskopi gi verdifull informasjon, spesielt om nesepassasje og septumhematom. Septumhematom kan gjenkjennes som en myk, fluktuerende hevelse over septum, og kan gjerne inspiseres ved hjelp av en bomullspinne eller et stumpt instrument mot septum og kjenne etter fluktuasjoner i vevet. Ved septumhematom skal pasienten vurderes av en ørenesehals lege innen 24 timer.
Ved usikker klinisk vurdering eller dersom pasienten har vært i en traumatisk ulykke hvor det kan være mistanke om andre ansiktsbrudd, bør CT ansiktsskjelett utføres. Det er viktig å poengtere at isolerte nesefrakturer ikke krever bildediagnostikk.
BEHANDLING
Ved nesefraktur vil behandlingen avhenge av frakturens alvorlighetsgrad. Når det har tilkommet hevelse vil det gjerne ta noen dager før hevelsen har gått ned og man kan reponere nesen. Dersom frakturen er minimalt dislosert, eller ikke i det hele tatt, vil en konservativ tilnærming være det mest riktige, med smertelindring som første prioritet. Ved større dislokasjoner utføres reponering for å rette opp kosmetiske skjevheter eller behandle nesetetthet som følge av frakturen. Dette bør gjøres innen 714 dager hos voksne, tidligere hos barn på grunn av deres raskere tilheling. Ved lukket nesefraktur reponeres nesen i lokalbedøvelse, enten gitt i bruddlinjen eller som nerveblokkade, med et elevatorium (figur 3). Ulike bruddlinjer vil kreve ulik intervensjon ved reponering. Kirurgisk intervensjon skal vurderes ved ustabile frakturer, betydelig dislokasjon, flerfragmenterte brudd, involvering av andre ansiktsstrukturer, åpne frakturer eller samtidig deformitet (1, 4, 10, 11).
Septumhematom ved nesefraktur krever akutt behandling og bør behandles innen 24 timer for å unngå komplikasjoner. Behandlingen vil i første omgang være kirurgisk incisjon og drenasje for å forhindre komplikasjoner som infeksjon eller nekrose av septumbrusken (figur 4) (1, 4). Det gjøres en horisontal incisjon i nedre del av septum, og incisjonen holdes åpent. Avslutningsvis tamponeres nesen for å gi kompresjon mot neseskilleveggen, og for å hindre at lommen fyller seg opp igjen.
KOMPLIKASJONER
Nesefrakturer kan føre til en rekke komplikasjoner som varierer i alvorlighetsgrad. Viktige komplikasjoner er større neseblødninger, som kan deles i fremre og bakre blødninger. De vanligste er kosmetiske deformiteter, som skjevhet i ytre nese, sadeldeformitet forårsaket av kollaps av nesebroen, og ujevnheter dersom bruddtilhelingen er dårlig. I tillegg kan pasienten oppleve respirasjonsproblemer som følge av nasal obstruksjon på grunn av arrdannelse eller skjevhet. Andre komplikasjoner inkluderer infeksjoner, posttraumatisk bihulebetennelse, eller i sjeldne tilfeller permanent tap av luktesansen dersom olfatoriske nerver blir skadet.
Septumhematom kan, dersom ubehandlet, føre til infeksjon og utvikling av en septal abscess, noe som øker risikoen for komplikasjoner som cellulitt eller spredning av infeksjon til omkringliggende strukturer. Grunnet lokalisasjon og venøs drenasje vil infeksjonen kunne spres intrakranielt og potensielt gi sinusvenetrombose. Videre kan brusknedbrytning oppstå, noe som kan resultere i perforasjon gjennom brusket septum.

FIGUR 3: Figuren viser stegene i reponering av en lukket nesefraktur. Til venstre i bildet en venstredeviert nese med brudd i benete del. Til midten bruker vi et elevatorium til å måle opp fra vestibulum nasi og opp til bruddlinjen. Elevatorium føres så inn i nesehulen og til like under bruddlinjen, til høyre i figuren, og reponering vil da gjøres ved å dytte frakturen på plass og med en finger på motsatt side. Dette gjøres enten i lokalbedøvelse eller med nerveblokkade. Figur tegnet av Jala Imad.




FIGUR 4: Behandling av septumhematom. Til venstre øverst et septumhematom på venstre side. Ved hjelp av et spekulum får vi bedre innsyn til hematomet, og ved hjelp av en skalpell blad nr 11 kan vi lage en horisontal incisjon i septum, se til høyre øverst. Deretter sprikes denne incisjonen og hematomet evakueres, se nederst til venstre. Til slutt tamponeres nesen med en salvetampong med Terra-Cortil salve, for å komprimere mot septum og hindre fylling av lommen. Figur tegnet av Jala Imad.
Både nesebrudd og septumhematom fører ofte til nasal stenose. Selv om forskning på dette området er begrenset, observeres det i klinisk praksis at pasienter med nesetraumer gradvis utvikler munnpusting som følge av nasal obstruksjon, noe som kan gi et klinisk bilde som minner om obstruktivt søvnapné syndrom (OSAS).
OPPFØLGING
Ved ukomplisert isolert nesefraktur settes det ikke opp rutinemessig kontroll etter initial vurdering og eventuell reponering. Dersom pasienten er utenfor tidsvinduet for reponeringsmulighet eller har funksjonelle plager som følge av bruddet, vurderes videre oppfølging.
Etter initial behandling av septumhematom er nøye oppfølging avgjørende for å sikre optimal tilheling og forhindre komplikasjoner. Umiddelbart etter drenering bør pasienten få antibiotikaprofylakse for å redusere risikoen for infeksjon. Valget av antibiotika før inkludere dekning mot gule stafylokokker, for eksempel Augmentin 400/125
mg x 3 eller Klindamycin 300 mg x 3 i totalt 7 dager, jamfør Antibiotikaveileder i sykehus (12). Videre er det viktig å vurdere behovet for tamponering eller annen form for kompresjon for å hindre reakkumulering av blod i septum. Pasienten bør informeres om å unngå aktiviteter som kan øke risikoen for reblødning eller traume mot nesen i opptil 6 uker. Kontrollundersøkelser bør planlegges innen 2448 timer etter prosedyren for å vurdere septums tilstand og sikre at det ikke er tegn til infeksjon eller ny hematomdannelse. Ytterligere oppfølging kan være nødvendig avhengig av pasientens symptomer og funn ved kontrollene. Dersom pasienten opplever økende smerter, feber eller andre tegn på infeksjon, bør pasienten kontakte helsepersonell umiddelbart.
REFERANSER :
Se bakerst i nettutgaven på kirurgen.no

ALL IN -25: HVORDAN GÅR DET MED DE SYKESTE PASIENTENE VI OPERERER?
Lite er kjent om hvordan det går med pasienter som gjennomgår akutte gastrokirurgiske inngrep i Norge. ALL IN-25 (Akutt laparotomi og laparoskopi i Norge 2025) er en prospektiv nasjonal observasjonsstudie som har som mål å fremskaffe kunnskap om mortalitet og komplikasjoner etter akutt gastrokirurgi gjennom å registrere alle inngrep i Norge i 2025.
ERLEND STRØNEN 1, PETER W. MONRAD - HANSEN 1, KJERSTIN HAVNES 2, TORUNN K. NESTVOLD 3
1 AVDELING FOR GASTRO - OG BARNEKIRURGI, ULLEVÅL SYKEHUS, OSLO UNIVERSITETSSYKEHUS HF
2 NORSK REGISTER FOR GASTROKIRURGI ( NORGAST ) OG UNIVERSITETSSYKEHUSET NORD - NORGE HF
3 KIRURGISK KLINIKK, NORDLANDSSYKEHUSET BODØ HF
KORRESPONDANSE: TORUNN K. NESTVOLD – TORUNN.KRISTIN.NESTVOLD @ NORDLANDSSYKEHUSET.NO
Det er høy mortalitet og komplikasjonsrate etter akutt gastrokirurgi (1), og i flere skandinaviske studier ligger 30-dagers mortalitet etter akutt laparotomi på 16-19% (24). Eldre pasienter har særlig høy mortalitet og komplikasjonsrate, der 1års mortalitet etter akutt gastrokirurgi kan være opp til 47% hos pasienter over 80 år (2, 3, 5).
I Norge har vi begrenset kunnskap om hvordan det går med pasienter som gjennomgår akutt gastrokirurgi. Re
PROSJEKTGRUPPE:
Geir Bøhler, Akershus universitetssykehus
Kjerstin Havnes, NORGAST
Ole Christian Kleven, Sykehuset Innlandet Lillehammer
Thomas Moger, Sykehuset Innlandet Lillehammer
Peter W. Monrad-Hansen, Oslo universitetssykehus Ullevål
Torunn K. Nestvold, Nordlandssykehuset Bodø
Erlend Strønen, Oslo universitetssykehus Ullevål
KONTAKT:
Spørsmål om prosjektet og deltagelse: Torunn.Kristin.Nestvold@nordlandssykehuset.no (Tlf: 95019528)
Spørsmål om registrering (teknisk): Siv.Fritzon@nordlandssykehuset.no (Tlf: 75598529) Kristin.Woll@unn.no (Tlf: 41844207)
trospektive studier gjort ved to større norske sykehus har bekreftet at utfall etter akutt laparotomi i Norge er på linje med internasjonale resultater (6, 7). Enkelte sykehus har egne kvalitetsregistre med oversikt over sine pasienter. Det er likevel ikke noe nasjonalt register som gir oversikt over resultater etter akutt gastrokirurgi i Norge.
I Norsk register for gastrokirurgi (NORGAST) registreres all større reseksjonskirurgi, også inngrep utført som øyeblikkelig hjelp, og registeret har nå 100% tilslutning og høy dekningsgrad på de obligatoriske inngrepene (8). Det er imidlertid en rekke akutte tilstander og gastrokirurgiske inngrep som ikke er obligatorisk å registrere i NORGAST, og det er opp til det enkelte sykehus om de finner det formålstjenlig å registrere inngrep utover det som er obligatorisk (9).
National Emergency Laparotomy Audit (NELA) registrerer prosessindikatorer og utfall for pasienter som gjennomgår akutt gastrokirurgi i England og Wales, og er trolig det mest omfattende registeret av sitt slag med nesten 28 000 pasienter inkludert i siste årsrapport (10). Registerets pasientrapporter inneholder resultater og konklusjoner, peker på utfordringer og problemområder,
og kommer med anbefalinger til forbedring. Fra registerets start og til sjette pasientrapport publisert i desember 2020, kunne man blant annet vise at nasjonal 30-dagers mortalitet hos pasienter som som gjennomgikk akutt laparotomi eller laparoskopi for gastrokirurgisk tilstand hadde falt fra 11,8 % i år 1 til 9,3 % i 2019 (11).
Vi er en gruppe gastrokirurger ved fire sykehus i Norge som sammen med registerkoordinator i NORGAST, har engasjert oss i problemstillingen og sett at NORGAST kan brukes som plattform for registrering av akutt gastrokirurgi i Norge. Fagrådet i NORGAST har godkjent å bruke registeret for innhenting av data. Det har mange fordeler å benytte NORGAST som registerløsning. Registeret er godt kjent i fagmiljøet, og alle aktuelle sykehus registrerer allerede i NORGAST. Eksisterende variabler i NORGAST er direkte relevante for dette prosjektet (12), og man vil uten å legge inn ytterligere variabler kunne fremskaffe nyttig kunnskap og besvare spørsmål som for eksempel observert mortalitet på nasjonalt plan, komplikasjonsfrekvens, reoperasjonsrate og ikke minst ulikheter i utfall mellom aldersgrupper.
ALL IN25 er en prospektiv nasjonal observasjonsstudie etter modell fra NELA, der all akutt gastrokirurgi i Norge i 2025 registreres i NORGAST. Vi ønsker å se om resultatene av akutte laparotomier og laparoskopier i Norge er sammenlignbare med resultatene fra andre land. Det primære endepunktet er 30-dagers mortalitet, det sekundære endepunktet er komplikasjoner innen 30 dager. Inklusjonskriteriene (Tabell 1) er lagt opp etter modell fra NELA (13), for blant annet å gjøre resultatene sammenlignbare med internasjonale tall. Vi inkluderer både inngrep utført per laparotomi og laparoskopi, i tråd med at en betydelig del av større akuttkirurgi i dag utføres laparoskopisk ved mange sykehus. Dette er også i samsvar med nåværende inklusjonskriterier i NELA.
Det er viktig å understreke at ALL IN25 ikke skal påvirke registreringen av obligatoriske inngrep i NORGAST. Obligatoriske inngrep skal registreres som tidligere, men gjennom ALL IN-25 inkluderes noen flere typer inngrep og diagnosegrupper enn i dag. For sykehus som allerede registrerer i NORGAST, tror vi ALL IN-25 vil medføre en begrenset mengde ekstra arbeid. Det er verdt å merke seg at det er større gastrokirurgiske inngrep som skal registreres i tråd med inklusjons og eksklusjonskriteriene til NELA (13), mens enkelte grupper som utgjør høye volum, men som har lav mortalitet og forholdsvis liten morbiditet, for eksempel appendektomier, er ekskludert.
Inklusjon:
Alder >18 år
Akutte indeksinngrep
Laparoskopi og laparotomi
Operasjon på ventrikkel, tynntarm, kolon og rektum
Gallestensileus
Akutte laparotomier med anleggelse av stomier (også avlastende)
Adheranseløsning ved obstruksjon
Tarmischemi (også der det ikke gjøres reseksjon)
Inneklemt brokk som medfører abdominal tilgang med reseksjon/ adheranseløsning
Eksklusjon:
Alder <18 år
Traume
Elektiv kirurgi (obligatoriske inngrep inkluderes i NORGAST på vanlig måte)
Reoperasjoner (forløp allerede inkludert i NORGAST på indeksinngrepet)
Pasienter som har annet obligatorisk NORGAST inngrep innenfor samme inklusjonsperiode
Akutte inngrep på øsofagus, milt, nyre, lever, galleblære og galleveier, pancreas og nyre/urinveier
Inngrep på appendix
Endoskopiske inngrep for å fjerne fremmedlegemer i colon/rektum
Avlastende stomier per laparoskopi (eller stomisnitt)
AAA og sekundære inngrep etter karkirurgi
Gynekologiske inngrep
Brokk der det ikke gjøres reseksjon/adheranseløsning
1
Vi har gjennom høsten i fjor invitert alle sykehus til å bidra med registrering i ALLIN 25. Så langt har 28 sykehus sluttet seg til prosjektet og mange er allerede i gang med registrering. Vi håper resterende sykehus som utfører akutt gastrokirurgi ønsker å bli med på denne nasjonale dugnaden. Vi har forsøkt å sende ut informasjon om deltagelse til alle sykehus, men ta gjerne kontakt om noen ikke har mottatt denne forespørselen og ønsker å delta (se ramme). ALL IN-25 har potensiale til å danne grunnlag for mange spennende prosjekter, ikke bare i 2025 men også i årene som kommer, og vi ønsker velkommen alle ideer og initiativ til hvordan vi kan dra nytte av data som samles inn.
REFERANSER : Se bakerst i nettutgaven på kirurgen.no
TABELL
SENTRAL LYMFADENEKTOMI VED
HØYRESIDIG TYKKTARMSKREFT
ER TRYGT OG GJENNOMFØRBART
BÅDE ÅPENT OG LAPAROSKOPISK
KRISTIN BENTUNG LYGRE
GASTROKIRURGISK AVDELING, HAUKELAND UNIVERSITETSSJUKEHUS.
GASTROKIRURGISK SEKSJON, HARALDSPLASS DIAKONALE SYKEHUS
KLINISK INSTITUTT 1, UNIVERSITETET I BERGEN
KORRESPONDANSE: KRISTIN.BENTUNG.LYGRE @ HELSE - BERGEN.NO
I mange år har det gastrokirurgiske miljøet diskutert omfanget av lymfadenektomi ved onkologisk høyresidig hemikolektomi. I 2016 begynte vi inklusjon i en randomisert studie mellom åpen og laparoskopisk høyresidig hemikolektomi for proksimal tykktarmskreft, hvor fokus var å gjøre en standardisert, sentral lymfadenektomi. Prosjektet er et samarbeidsprosjekt mellom Haukeland universitetssjukehus (HUS) og Haraldsplass Diakonale Sykehus (HDS). Begge sykehusene hadde siden 2011 hatt fokus på sentral lymfadenektomi i pågående prosjekter. Pasientene ble randomisert til åpen kirurgi ved HUS eller laparoskopisk kirurgi ved HDS. Tre kirurger ved hver institusjon ble plukket ut som studieoperatører. Minst en av dem var til stede under operasjonen, som oftest som hovedoperatør. Målet for omfanget av lymfeknutedisseksjonen var litt mindre for den laparoskopiske gruppen enn for den åpne gruppen (Figur 1). Det primære endepunktet var postoperative komplikasjoner i henhold til Clavien-Dindo (C-D) ≥ 2 (1). Hypotesen var at laparoskopisk operasjon førte til mindre komplikasjoner, men mindre onkologisk radikalitet. Sekundære endepunkt var blant annet lengde på gjenværende karstump av tumors forsynende kar (a. ileocolica) som en surrogatmarkør for sentral lymfadenektomi (2). I tillegg inkluderte studien en prospektiv biomarkørstudie hvor formålet var å utforske betydningen av sirkulerende tumor DNA (ctDNA) hos pasienter med høyresidig tykktarmskreft uten kjente metastaser ved diagnosetidspunkt (3).
Vi fant ingen forskjell i komplikasjoner mellom åpen og
laparoskopisk høyresidig hemikolektomi med sentral lymfadenektomi. Det var svært lite alvorlige komplikasjoner (C-D IIIb: åpen 7,9 % versus laparoskopisk 4,6 %, p-verdi: 0,341), og det var ingen anastomoselekkasjer i studien. De hyppigste komplikasjonene var blodtransfusjon (åpen 22,2 % versus laparoskopisk 15,4 %, p-verdi: 0,322) og postoperativ paralytisk ileus (åpen 15,9 % versus laparoskopisk 18,5 %, p-verdi: 0,698). Risikofaktoren for blodtransfusjon var preoperativ anemi. Det ble fjernet like mange lymfeknuter i begge grupper (gjennomsnitt ± standard error of the mean (SEM) åpen 31,9 ± 1,8 versus laparoskopisk 29,3 ± 1,3, p-verdi: 0,235). Vi fant ingen forskjell i lengde på gjenværende karstump (4,1 mm, p-verdi: 0,996). ctDNA kan påvises før operasjon hos pasienter med proksimal tykktarmskreft uten metastaser, og kan følges longitudinelt. Påvist ctDNA i første prøve etter gjennomført kirurgi er en markør for minimal residual sykdom, og predikerer residiv (100 % positiv prediktiv verdi) (Figur 2).
Hvorfor begynte du med forskning?
Jeg startet med forskning etter oppnådd klinisk spesialitet. Jeg var da klar for nye utfordringer, og hadde i løpet av utdanningen lært at forskning er, og skal være, en integrert del av vårt kliniske virke.
Hva har du lært av forskning?
Jeg har lært at forskning er grunnlaget for alt vi gjør. Det er en forutsetning for forbedring. Det er utrolig viktig med samarbeid på tvers av institusjoner og profesjoner. God logistikk er nøkkelen til suksess når en
skal gjennomføre en klinisk studie. Det er essensielt å kunne delegere arbeid til og engasjere andre yrkesgrupper. I tillegg har jeg lært utrolig mye om høyresidig tykktarmskreft. Det er med på å gjøre min kliniske hverdag mer spennende.
Kan du dra nytte av lærdommen i ditt kliniske virke?
Ja. Vi har vist at standardisert sentral lymfadenektomi ved høyresidig hemiokolektomi er trygt og gjennomførbart.
Det er også svært givende å bevege seg litt utenfor komfortsonen og jobbe med biomarkører og basale prinsipper i onkologi. Samarbeidet mellom fagfeltene molekylærbiolog og kirurg er uvurderlig, og helt nødvendig for å omsette teori til praksis.
Hvilke tips kan du gi kirurger som ønsker å begynne med forskning?
Finn et prosjekt som engasjerer deg! Jeg har funnet stor glede i å ha et prosjekt som er så tett knyttet til mitt kliniske virke. Velg din veileder med omhu jeg var så heldig å ha verdens beste veileder.





REFERANSER :
Se bakerst i nettutgaven på kirurgen.no





Duodenum
Pancreas
MCA
GTH SMV ICA
Duodenum
Pancreas
FIGUR 1. Skjematisk og peroperativ oversikt over den sentrale lymfeknutedisseksjonen ved åpen (a, c) og laparoskopisk (b, d) høyresidig hemikolektomi.
FIGURE 2. Bruk av ctDNA til å predikere risikoen for residiv.
INTRANASAL PROSEDYRESEDASJON TIL BARN MED DEKSMEDETOMIDIN OG KETAMIN
– ET TRYGT OG NYTTIG VERKTØY
Prosedyresedasjon til barn representerer en utfordring i norske sykehus. Barn med ulike skader må ofte gjennom smertefulle prosedyrer. Virkemidlene for å få gjennomført behandling har tradisjonelt vært enten å holde barnet med makt, gi sedasjon for eksempel med midazolam som kan ha uforutsigbar effekt eller overbehandling med narkose. For moderate skader har ingen av alternativene vært optimale. Med bakgrunn i denne problemstillingen innførte Sykehuset Telemark, som et nytt alternativ, intranasal sedasjon og smertelindring med deksmedetomidin og ketamin til sårstell av barn med brannskader. I denne kliniske oversikten redegjør vi, ved hjelp av egne resultater og tilgjengelig litteratur, for hvorfor vi anser denne metoden som skånsom, trygg og effektiv.
OLE ARVID FORSÅ ØSTERUD 1, TONE MYRLAND 1, ROLF BILBERG 2, MARGRETE DJUPEDAL 1
1. SYKEHUSET TELEMARK, SEKSJON FOR HÅND -, PLASTIKK- OG REKONTRUKTIV KIRURGI
2. SYKEHUSET TELEMARK, AVDELING FOR ANESTESIOLOGI
KORRESPONDANSE: OLE ARVID FORSÅ ØSTERUD – OLE.ARVID.FORSA.OSTERUD @ STHF.NO
Vårt materiale består av barn med brannskade, hvor kontaktskade i håndflaten er hyppigste skademekanisme, dernest skåldeskade. De fleste har mindre skader som ikke trenger kirurgi, men er avhengig av god konservativ behandling for å tilheles. Selv om det dreier seg om mindre skader, er det likevel smertefullt å få utført sårstell og bandasjeskift.
Vi opplevde at polikliniske bandasjeskift hos denne pasientgruppen var utfordrende. For å få gjennomført sårstell måtte barnet ofte holdes med makt, og det kunne være vanskelig å få utført prosedyren grundig nok. Alternativet var å legge barnet i narkose, noe som opplevdes som overbehandling og unødig bruk av ressurser. Sykehuset Telemark startet derfor våren 2023 et forbedringsprosjekt med hensikt å etablere et nytt behandlingsløp for å gi sedasjon og smertelindring til disse barna uavhengig av anestesipersonell. Hensikten var å unngå traumatisering av barnet, lette den emosjonelle påkjenningen for foreldrene, og legge forholdene bedre til rette for behandlende helsepersonell.
Formålet med denne kliniske oversikten er å informere om våre erfaringer med intranasal sedasjon med deksmedetomidin og ketamin. Basert på et litteratursøk har vi utarbeidet protokollen for vårt prosjekt, og artikkelen refererer til dette og til de erfaringene vi har gjort oss.
MEDIKAMENTER
Den ideelle prosedyresedasjon for barn bør ha enkel og smertefri administrasjon, raskt innslagspunkt, minimale bivirkninger, pålitelig smertelindring og lite behov for overvåkning.
Midazolam har vært mye brukt, men på grunn av veldokumenterte bivirkninger som postoperativ agitasjon og uro hos barn, har vi sett behov for et alternativ (1). I samarbeid med barneanestesilege utarbeidet vi en prosjektprotokoll basert på et artikkelsøk om intranasal sedasjon og barn. Protokollen tok utgangspunkt i bruken av den aktuelle legemiddelkombinasjonen i aldersspennet seks måneder til fire år. Vi inkluderte ikke barn under seks måneder i protokollen fordi vi ikke kunne finne litteratur hvor bruken var beskrevet.

Deksmedetomidin
Deksmedetomidin er en selektiv alfa2adrenoreseptor agonist. Ifølge Legemiddelhåndboken er intranasal administrasjon av deksmedetomidin en etablert og trygg metode for angstdemping og sedasjon ved mange sykehus i Norge og Norden. Bivirkningene er doseavhengige, og er i hovedsak bradykardi og hypotensjon. En fordel med deksmedetomidin sammenlignet med andre sedativer, er lav risiko for respirasjonsdepresjon (1). Sedasjonseffekten ligner naturlig søvn og pasienten vil våkne ved smertefulle stimuli (1). Derfor er deksmedetomidin alene ikke ideell som sedasjon ved smertefulle prosedyrer.
Ketamin
«Ketamin er et hurtigvirkende smertestillende legemiddel og anestesimiddel som gir dissosiativ anestesi. Ketamin antas å ha sin hovedvirkning via blokkering av NMDA reseptorer i hjernen og ryggmargen.» (2).
Ifølge Legemiddelhåndboken er ketamin velegnet «som analgesi/anestesi ved kortvarige, smertefulle prosedyrer, f.eks. skifting på brannskader eller reponering av bruddskader» (3). Ketamin er vanligvis brukt intramuskulært eller intravenøst.
Ketamin påvirker vanligvis ikke refleksene i farynks og larynks, og muskeltonus forblir normal eller øker noe. Ketamin er kardiovaskulær og respiratorisk stimulerende. Bivirkninger er hallusinasjoner som kan gi ubehagelig oppvåkning, kvalme, hypertensjon, takykardi og økt spyttsekresjon(4).
Kombinasjonsbehandling
Studier demonstrerer nytten av å kombinere deksmedetomidin og ketamin for prosedyresedasjon (1, 5, 6). Administrert i kombinasjon utøver de komplementære farmakologiske effekter. Deksmedetomidin reduserer takykardi, hypertensjon, økt spyttsekresjon og hallusinasjoner fra ketamin, mens ketamin kan forhindre bradyk
ardi og hypotensjon som er rapportert med deksmedetomidin (7).
Intranasal sedasjon og MAD
Intranasal administrasjon er enkelt å gjennomføre, ikke-invasivt og medfører lite ubehag. Medisinene virker raskt og har høy biotilgjengelighet på grunn av rikt vaskulært plexus i nesekaviteten som kommuniserer med det subaraknoidale rom via nervus olfactorius (6, 8).
MAD står for Mucosal Atomizer Device. Dette er en administrasjonsenhet som kobles på en ordinær sprøyte og leverer medikamentet i atomisert sprayform tilpasset nesemukosa. På denne måten kan legemidlene gis skånsomt og smertefritt, uten at det krever samarbeid om å ta medikamenter per os, rektalt eller via nålestikk.
GJENNOMFØRING
Pasienter under 4 år ble inkludert. Primærbehandlingen skulle være gjennomført, slik at det kun var behov for sårstell/vask, eventuelt lett sårrevisjon, og bandasjeskift. Barna fikk premedikasjon med paracetamol og ibuprofen en time i forkant av behandlingen. I etterkant av behandlingen lå barnet på et skjermet rom, overvåket med pulsoksymeter. Foreldrene satt sammen med barnet og barnesykepleier var tilgjengelig ved behov. Behandlingene ble gjennomført uavhengig av anestesipersonell, men kun når anestesipersonell var tilgjengelig ved sykehuset.
Sykepleier registrerte doser, innslagspunkt, effekt og varighet av medikamentene, og hvordan de opplevde behandlingssituasjonen. Foreldrene mottok et eget selvrapporteringsskjema. Her fikk de mulighet til å gradere hvordan de tolket barnets opplevelse av smerter og trygghet, og hvordan de selv opplevde behandlingen.
Plastikkirurg ble tilkalt slik at prosedyren startet omtrent 45 minutter etter administrasjon av deksmedetomidin (Figur 1).
FIGUR 1: Tidslinje behandlingsseanse
Pasientgrunnlag og dosetilpasning I perioden mai til november 2023 gjennomførte vi totalt 18 behandlinger med totalt 10 pasienter (Tabell 1). En pasient ble eksludert fra prosjektet grunnet åpenbar feiltolkning av foresattes selvrapporteringsskjema; data som presenteres gjelder altså 17 behandlinger av 9 pasienter.
Innledningsvis ble det gitt sedasjon med intranasal deksmedetomidin. Ved de to første behandlingene fikk pasientene 2 µg/kg, men vi erfarte at dette ikke var tilstrekkelig. Vi økte derfor første dose til 3 µg/kg. Etter denne justeringen var det ikke behov for supplerende dose ved de resterende behandlingsseansene.
Etter 30 minutter ble det gitt ketamin intranasalt. Ved de første fire behandlingsseansene fikk pasienten 1 mg/ kg. Ved to av disse tilfellene måtte man supplere med en ekstra dose, slik at totaldose ble 2 mg/kg. Vi tok deretter utgangspunkt i en startdose på 1,5 mg/kg. I ett behandlingstilfelle ble det supplert med 1,5 mg/kg, ved fem seanser 1,0 mg/kg.
Observasjoner
Effekten av både deksmedetomidin og ketamin ble observert av utførende barnesykepleier. Dette ble dokumentert i eget observasjonsskjema. Dokumentasjonsskjemaene er oppsummert i Tabell 2.
Pasienten med den største skaden på 6% TBSA hadde totalt fire behandlinger. Første gang hadde pasienten suboptimal effekt av både deksmedetomidin og ketamin. Ved de øvrige tre sårstellene er det oppgitt god effekt av begge medikamenter.
Det ble oppgitt god effekt av deksmedetomidin ved syv av behandlingene, og pasienten «sov lett» ved åtte av behandlingene. Det ble oppgitt god effekt av ketamin ved 15 av tilfellene, delvis effekt ved ett tilfelle og utilstekkelig effekt ved ett tilfelle. Det ble ikke observert noen uønskede hendelser i prosjektperioden. (Tabell 2)
Selvrapporteringsskjema
Behandlingen ble evaluert av foreldrene på vegne av pasienten etter gjennomføring. En pasient ble ekskludert grunnet åpenbar feiltolking av skjemaet. Foreldrene rapporterte at barna opplevde liten grad av smerte i forbindelse med behandlingen (1,9/10), høy grad av trygghet (8,3/10), og at de ble behandlet på en skånsom måte (1,2/10). Foreldrene oppga lite stress / psykisk ubehag (1,8/10) for sin egen del. (Tabell 3)
DISKUSJON
Vi er ikke kjent med at kombinasjonen av de aktuelle legemidlene er en integrert del av et poliklinisk tilbud andre steder i Norge. Noen sykehus har sett nytten av intranasal sedasjon, og benytter dette i andre sammenhenger og med andre medikamentkombinasjoner.
Intranasal deksmedetomidin og ketamin i kombinasjon i lave doser er enkelt og trygt, og kan derfor gjennomføres uavhengig av anestesipersonell, etter grundig opplæring av dedikert personale. Vi så også at behovet for å belaste operasjonsavdelingen med denne pasientgruppen kunne reduseres betydelig. Erfaringsmessig vet vi det går med mye tid til forberedelser og etterarbeid når barn skal behandles på operasjonsstue i narkose. En positiv bieffekt var at den totale ressursbruken med hensyn til personell, rom og utsyr som gikk med til å utføre et sårstell ble betraktelig redusert etter innføring av tiltaket.
Behandlingsimplikasjoner
Vi ser muligheter og nytte av å implementere tilbudet i andre situasjoner hvor medisinske prosedyrer gjennomføres på barn, både elektivt og akutt.
Det kan for eksempel dreie seg om følgende prosedyrer:
Kirurgi:
• reponering av mindre brudd og dislokasjoner
• pinnefjerning
• stell av mindre brannskader
• suturering av kuttskader
• stingfjerning
Annet:
• spinalpunksjoner
• radiologiske undersøkelser
• blodprøver og injeksjoner
• barn med kroniske tilstander som krever gjentatte prosedyrer/undersøkelser
Det er viktig å ha et bevisst forhold til hvilke begrensninger intranasal sedasjon har. Utifra protokollen vi har fulgt er det et behandlingsvindu på rundt 20 minutter. Utstyret må være klargjort og personell må være på plass. Det nokså korte tidsvinduet er en begrensning. Videre er den analgetiske effekten utfra vår protokoll begrenset til mindre og ikke svært smertefulle prosedyrer.
PASIENTGRUNNLAG
Antall pasienter 10
Antall behandlinger 18
Alder gj.snitt 16 mnd (11-22)
Alder median 14 mnd
Vekt gj.snitt 10,6 kg
TBSA gjennomsnitt 1,60 % (0,5-6)
TBSA median 0,5 %
TABELL 1. Deskreptive data over pasientmaterialet. TBSA = Total Body Surface Area (brukes for å angi omfanget av en hudskade, for eksempel ved brannskader)
TABELL 2: Oversikt over medikamenter gitt, dose og behandlingseffekt.
Spørsmål
1 Hvordan vil du gradere smertene ditt barn opplevde under sykehusbesøk?
2 Hvordan vil du gradere tryggheten ditt barn opplevde under sykehusbesøk?
3 Hvordan vil du gradere ubehaget du opplevde med å holde ditt barn under sykehusbesøk?
4 Hvordan vil du som foresatt gradere følgende påstand: Mitt barn ble behandlet på en skånsom måte?
5 Hvordan vil du som foresatt gradere følgende påstand: Mitt barn ble behandlet på en smertefri måte?
6 Hvordan vil du som foresatt gradere følgende påstand: Sykehusbesøket medførte ikke stress eller psykisk ubehag for meg?
ingen smerte 10= så vondt det går an å ha
enig 10=helt uenig
TABELL 3: Foreldrenes rapportering av barnets opplevelse med intranasal sedasjon ved hjelp av en visuell analog skala (VAS) fra 0-10.
Faglige implikasjoner
Hverken Norsk Legemiddelhåndbok eller Felleskatalogen omtaler bruken av ketamin for intranasal administrasjon. I Felleskatalogen nevnes heller ikke intranasal administrasjon av deksmedetomidin som et alternativ. En artikkel fra 2021 problematiserer at mangelen på omtale av aktuelle legemidler resulterer i utstrakt off-label bruk hos barn (9). Direktoratet for medisinske produkter bør vurdere muligheten for legge til denne administrasjonsruten og behandlingsindikasjonen i legemiddelteksten(e).
Vi ser muligheter for kompetansebygging for barnesedasjon hos pleiepersonalet og det kan være et nyttig verktøy i akutt og mottakslegenes verktøykasse.
KOSTNADER VED BEHANDLING AV
ABDOMINALE
AORTA ANE URISMER OG KAROTISSTENOSER
– ERFARINGER FRA HAUKELAND
UNIVERSITETSSJUKEHUS OG
ST. OLAVS HOSPITAL
CASPER AUGUST FRIELE FAYE, ESPEN GUBBERUD, VIDAR HALSTEINLI, ARNE SETERNES INSTITUTT FOR SIRKULASJON OG BILDEDIAGNOSTIKK, NTNU
KORRESPONDANSE: CASPER FAYE – CASPER.FRIELE.FAYE @ GMAIL.COM
Kirurgisk behandling av abdominale aortaaneurismer (AAA) og carotisstenoser er vanlig innen karkirurgi og behandlingen krever mye ressurser på en karkirurgisk avdeling. Hvordan kan ressursbruken optimaliseres og samtidig sikre best mulig behandling for pasientene? Resultatene som gjennomgås under ble også presentert på karkirurgisk seksjon, under frie foredrag, på Høstmøtet 2024 og vant pris for beste frie foredrag.
Jeg har nylig gjort en analyse av kostnader ved Haukeland universitetssjukehus (HUS) og St. Olavs hospital (SOHO) knyttet til den primære kirurgiske behandlingen av disse diagnosene som en hovedoppgave på medisinstudiet (1). Tallene er fra 2021 og er hentet fra sykehusenes Kostnad-per-pasient (KPP) modeller og en gjennomgang av utvalgte pasienters sykehusopphold. Denne hovedoppgaven har kun sett på kostnader knyttet til primærprosedyren. Kostnader knyttet til rehabilitering og reoperasjoner er ikke tatt med, noe som kan påvirke sammenligningen av de ulike sykehusene og behandlingsmetodene.
Ved kirurgisk intervensjon for AAA finnes det to hovedmetoder: endovaskulær stentgraftreparasjon (EVAR) og åpen kirurgi. Begge metodene har sine fordeler og utfor
dringer, men de påvirker ressursbruken på ulike måter. Hos pasienter ved SOHO var gjennomsnittlig kostnad for sykehusoppholdet relatert til en EVAR-prosedyre 233 855 NOK, mens den ved HUS var 189 318 NOK. For pasienter operert åpent var gjennomsnittlig kostnad ved SOHO 321 079 NOK, ved HUS var kostnaden 303 104 NOK. Hvorfor denne forskjellen? Svaret ligger i flere faktorer, men en av de mest betydningsfulle er liggetiden. Pasientene operert åpent hadde et lengre postoperativt sykehusopphold, i snitt mellom fem og syv døgn. Dette er hovedårsaken til kostnadsforskjellen mellom operasjonsmetodene. For alle AAApasientene samlet var liggetiden nesten to døgn kortere ved HUS enn ved SOHO som er noe av årsaken til forskjellene mellom de ulike sykehusene.
Materialkostnadene spilte også en rolle. Blant EVARpasientene var operasjonskostnaden med materialer den største utgiftsposten til forskjell fra gruppen operert åpent der det var liggetiden. Ved HUS ble det brukt færre stentgraftkomponenter, 0,7 færre stentgraftbein per EVAR-prosedyre sammenlignet med SOHO, noe som reduserte kostnadene med 12 100 NOK per pasient behandlet endovaskulært. Denne forskjellen kan skyldes ulik tradisjon knyttet til gjennomføring av prosedyren.
For karotisstenoser var bildet lignende. Kostnaden per pasient ved HUS var gjennomsnittlig 125 918 NOK, sammenlignet med 158 772 NOK ved SOHO. Igjen var kortere liggetid den vesentlige faktoren. Ved HUS var gjennomsnittlig liggetid 4,7 døgn mot 6,7 døgn ved SOHO.
Disse funnene peker på viktige forskjeller i praksis og organisering mellom de to sykehusene. Samtidig viser resultatene hvor stor betydning valg av teknikk og materiell kan ha for de samlede kostnadene. Det er imidlertid viktig å huske at tallene må tolkes med forsiktighet da forskjeller i pasientpopulasjon og rutiner for kostnadsberegning kan påvirke resultatene. Likevel gir analysen en verdifull pekepinn om hvordan ulike tilnærminger kan påvirke ressursbruken.
REFERANSER :
Se bakerst i nettutgaven på kirurgen.no

VINN BILLETTER TIL VITENSKAPELIG SKRIVEKURS MED
Kirurgen deler ut fire billetter til vitenskapelig skrivekurs hvor du kan lære fra redaktørene i de høyest rangerte internasjonale tidsskriftene! Kurset foregår 16-17. juni 2025 i Oslo (se annonse side 194 i Kirurgen 4-2024). Redaksjonen i Kirurgen vil plukke ut de fire beste pasientkasuistikkene sendt oss innen 01.04.25 og vinnerartiklene vil bli publisert i Kirurgen 2/2025.
Følgende krav til pasientkasuistikken stilles:
• MAKSIMALT 1250 ord.
• Inntil 5 illustrasjoner (flytskjema, bilder, figurer og tabeller)
• Det må i artikkelen presiseres at pasienten har samtykket til publikasjon.
Artikkelen sendes tobias@kirurgen.no innen 01.04.2025
BILDE 1: Undertegnede etter foredrag og prisutdeling

MESTRINGENS MESTERSKAP
Arne Seternes, karkirurg ved St. Olavs hospital i Trondheim og gastrokirurg Håkon Bolkan hadde i lengre tid fått inntrykk av et dalende engasjement for de kirurgiske fagene blant studenter.
Inspirert av konkurranser på jusstudiet i Oslo fikk Seternes ideen om å arrangere et studentmesterskap i kirurgi for medisinstudentene ved NTNU. Sammen med kirurgisk klinikk ved St. Olavs og Trondheim akuttmedisinske studentforening (TrAMS) ble mesterskapet realisert.
RUIYI LI OG ERLEND FRØLAND
TRONDHEIM AKUTTMEDISINSKE STUDENTFORENING ( TRAMS )
KORRESPONDANSE: RUIYI.LI04 @ GMAIL.COM
SELVFORSTERKENDE SPIRAL
Spesialiteter i kirurgiske fag opplever utfordring med rekruttering, eller høy turnover av ansatte (1). Hvis vi legger til grunn premisset om at interessen for kirurgi er dalende hos studenter, så er det egentlige problemet at dette på sikt kan føre til færre eller mindre dyktige kirurger.
Seternes’ idé bygger på en tanke om at konkurransersom tross alt er lek og moro vil gi studentene interesse for å trene mer på kirurgiske ferdigheter. Hvis man tre
ner, presterer man bedre, og det man presterer bra i, ønsker man som regel å gjøre mer av. Siden det er tungvint å trene i noe man ikke har tilgang til, og enda vanskeligere å starte med gode resultater uten trening så er det logisk at man må begynne med å skape interesse. Denne selvforsterkende spiralen kan da til syvende og sist spinne av seg selv.
STUDENTFRIVILLIG KOMPETANSE SELGER
For å realisere konkurransen og skape nødvendig interesse og engasjement tok Seternes kontakt med Trondheim
BILDE 1. Leder og fagansvarlig i TrAMS, hhv. Bergitte Vedøy (f.v.) og Brage Larsen fikk bli med på operasjon under planleggingen av mesterskapet (Foto: TrAMS).

“Det kan være gøy å høre kirurger stå og jazze sammen.
Det var ikke veldig gøy da de brukte en halvtime på det”
akuttmedisinske studentforening (TrAMS). TrAMS har knekt en eller annen kode når det kommer til organisering, kunnskaps- og frivillighetsledelse. Etter langvarig og strategisk arbeid er resultatene kurs og aktiviteter med høy kvalitet og kontinuitet, hvor de bruker sitt nettverk og drar inn høy kompetanse. Derfor har foreningen helt siden 2016 fått finansiering fra det medisinske fakultetet ved NTNU til å drifte en rekke kurs innen akuttmedisin som del av den timeplanfestede undervisningen for medisinstudenter i Trondheim. Kjerneverdiene og engasjementet til TrAMS strekker seg derimot lengre enn bare akuttmedisin, da foreningen også drifter sin egen kirurgi-, radiologi-, fjellmedisin-, pediatri-, og sosialkomité. En kombinasjon av evnen til å skape engasjement, kompetanse i å organisere store arrangementer, og lang historie med samarbeid med det medisinske fakultetet, gjorde at TrAMS, og spesielt TrAMS sin kirurgiske komité, ble det naturlige valget for Seternes å samarbeide med.
Anonym deltaker
STUDENTMESTERSKAPETS METODE OG OPPSETT
Etter nøye og god planlegging og forberedelser i åtte måneder, kunne Norges første studentmesterskap i kirurgi endelig arrangeres tidlig november 2024 (bilde 1 og 2).
Alle studenter fra og med 2. årstrinn kunne melde seg på mesterskapet. De påmeldte ble inndelt i ulike lag med fem studenter per team. I lagfordelingen ble det tilstrebet en noenlunde lik fordeling på tvers av årstrinn. Selve konkurransen gikk over tre runder.
Første og innledende runde var en teoretisk test som bestod av 62 spørsmål. Disse spørsmålene var laget av kirurger fra de ulike spesialitetene ved kirurgisk klinikk. Deltakerne hadde ett minutt på hvert spørsmål. De fem beste lagene gikk videre til runde to, som ble avholdt noen dager senere.
BILDE 2. Bakerste rad fra venstre: Arne Seternes, Frode Aasgaard, Tommy Johnsen, Trond Gjengstø, Magne Torsteinsen, Louis Reiten Jensen. Fremste rad fra venstre: Ruiyi Li, Bergitte Vedøy, William Lossius, Sara Konstanse Foss, Pernille Yttreeide, Brage Larsen.

BILDE 3. Det populære arrangementet ble både streamet og kommentert LIVE i auditoriet. Her blir deltaker Guri Sellevåg Aarø intervjuet etter egen innsats som hun oppsummerte med et tilfelle av akutt tremor. (Foto: Geir Otto Johansen, St.Olavs hospital/NTNU)
Før runde to - som var semifinalen i konkurransen - ble semifinalistene invitert til øvingskveld hos Nasjonal Kompetansetjeneste for Avansert Laparoskopisk Kirurgi (NSALK) i Trondheim. Der fikk de øve seg på alle teknikkene de ville få bruk for i semifinalen. Semifinalen bestod av fem praktiske øvelser. Øvelsene ble gjennomført i et auditorium med publikum til stede, det ble strømmet til storskjerm slik at publikum kunne se detaljene i både laparoskopiske øvelser som hinderløype og stabling av sukkerbiter, samt suturteknikk og åpning av abdomen på en hjemmesnekret modell med ballong. To studenter fungerte som «live»-kommentatorer (bilde 3). Hver deltaker fikk gjøre én oppgave hver, så lagene måtte fordele hvem som skulle gjøre hva. Laget som fikk mest poeng gikk til finalen.
Tredje og siste runde bestod av de samme fem øvelsene som i semifinalen, men på finaledagen måtte hver enkelt individuell utøver gjøre alle fem øvelsene. Den som stod igjen med høyest poengskår ble kåret til vinner av studentmesterskapet. Vurderingene var både basert på tid, presisjon, og estetikk og ble evaluert av spesialister innen kar, gastro, plastikk og mammaendokrinkirurgi.
EVALUERING
Arrangementet ble evaluert ved blant annet anonyme tilbakemeldinger fra deltakere, som ga mulighet for både

BILDE 4: Camilla Hjelle (i midten) i 2. klasse på medisinstudiet ved NTNU tok seieren i mesterskapet. Her flankert av TrAMS-leder Bergitte Vedøy (t.v.) og Leder for TrAMS sin kirurgiske komité (KirKom) Ruiyi Li. (Foto: Geir Otto Johansen, St.Olavs hospital/NTNU)
kvantitative og kvalitative analyser i etterkant. Som sitatet ovenfor viser kan studenter være «krevende kunder», med presis kritikk. En viktig faktor for å lykkes med å skape forbedring i undervisningstilbud og dermed øke interessen blant studenter er å ta slike tilbakemelding på alvor.
Det ble også innhentet erfaringer fra hjelpere på arrangørsiden. Det kan være vel så viktig at systemet og logistikken fungerer, som at det faglige innholdet er godt og tilpasset. Funnene fra alle undersøkelsene ble diskutert og vurdert i ettertid med forslag til endringer og forbedringer frem mot neste mesterskap. I all hovedsak var tilbakemeldingene veldig positive og fordelte seg stort sett 50/50 mellom en skår på 4 og 5, i en 5-punkt skala hvor 1 var «veldig dårlig/misfornøyd» og 5 var «veldig bra/fornøyd».
OG VINNEREN ER…
Hovedpremien i konkurransen var lisensjobb på kirurgisk avdeling (når mesteren får midlertidig lisens). I tillegg ble det trukket ut tre billetter til kirurgisk høstmøte i Oslo 2025 hvor transport og overnatting er dekket. Vinneren av mesterskapet ble Camilla Hjelle (bilde 4). Øvrige finalister var Øyvind Fjeldstad, Halvor Solheim, og Synne Aanesland Berge (Bilde 5). De tre som fikk billetter til kirurgisk høstmøte i Oslo 2025 var Camilla Hjelle, Pelle Bjørkheim Winsjansen og Selma Smidtsrød. Gratis billet

ter til kirurgisk høstmøte ble gitt av Kirurgisk Forening, reise-og oppholdsstipend gitt av B Braun og Ortomedic. I tillegg ga Intuitiv ved Espen Martinussen vinnerlaget og arrangørene opplæring i bruk av DaVinci roboten. Personlige sutursett til finalelaget ble gitt av B Braun/Æsculap og Endotech.
Mesterskapet har imidlertid skapt flere vinnere. Vinnere i form av å overvinne eller mestre nye utfordringer. Det bidrar til å skape engasjement. Flere studenter har fått øynene opp for kirurgi, og har meldt om økt interesse, noe som også kom frem under evalueringen. Tilsvarende har det kirurgiske faget vunnet ved å tiltrekke seg potensielle fremtidige talenter.
Vi ønsker å rette en stor takk til alle som bidro til planleggingen og gjennomføringen av mesterskapet. Takk til arbeidsgruppen ved Kirurgisk Klinikk, inkludert Håvard Nordgaard og Kjersti Ausen fra Plastikkirurgisk Seksjon, Alexander Wahba fra Thoraxkirurgisk avdeling, Ida Dragvoll fra Endokrinkirurgisk avdeling, Øystein Drivenes fra Barnekirurgisk avdeling, Dag Halvorsen fra Urologisk avdeling, samt Håkon A. Bolkan, William Lossius, Benjamin Rajabi, Per Even Storli, Erling Bringeland, Gjermund Johnsen og Tor Eivind Bernstein fra Gastrokirurgisk avdeling. Vi vil også takke Hilde Merete Klungerbo, Kirsten Rønning og Hanna Sulimahn ved NSALK.
En spesiell takk går til Tom Andre Vespestad og Ortomedic, og B Braun for premier. Vi setter også stor pris på støtten fra klinikksjef Torbjørn Dahl ved Kirurgisk Klinikk, fagdirektør Birger Henning Endreseth og Geir Otto Johansen fra Kommunikasjonsavdelingen ved St. Olavs hospital, samt medisinsk teknisk avdeling for kunstnerisk konstruksjon av vandrepremien.
Fra studentenes side var Ruiyi Li sentral i forkant og under gjennomføringen av mesterskapet, sammen med Bergitte Vedøy og Brage Larsen.
Deres innsats med veiledning, bidrag til teoretiske oppgaver og gjennomføring av øvelseskveldene har vært uvurderlig. Tusen takk!
STUDENTMESTERSKAP I KIRURGI
Se YouTube-filmen her
REFERANSER : Se bakerst i nettutgaven på kirurgen.no
BILDE 5. Vinneren Camilla Hjelle sammen med mesterskapets finalister på første rekke Øyvind Fjeldstad (f.v.) Halvor Solheim og Synne Aanesland Berge. Bakerste rekke, Tom Andre Vespestad, Arne Seternes, Håkon A.Bolkan, Gjermund Johnsen, Håvard Nordgård, Kjersti Ausen og Birger Hennig Endreseth.
What if there’s a smarter way?
LumenEye® X1 System består av:
• LumenEye® X1 endoskop
• Nettbrettskjerm med full HD
• Intuitiv CHiP-programvareplattform
• Bærbart etui og arbeidsstasjon
–
Brukes sammen med LumenEye® X1 Consumables.


Medivatus er stolt distributør for LumenEye® i Norge
LumenEye® X1 System: Fremtidens digitale endoskop
LumenEye X1 System gir HD-kvalitet på bilder og video av anorektum, noe som både forbedrer den diagnostiske nøyaktigheten og reduserer behovet for formell endoskopi.
USB-tilkobling gir rask dataoverføring, sikker lagring og deling av bilder og video, samt mulighet for raskere diagnostisering og tiltak for behandling.
medivatus.com

LumenEye® X1 kan brukes ved polikliniske undersøkelser, kreftreseksjon, anastomoseovervåkning og endoskopisk kirurgi.
Den intelligente utformingen gir en komfortabel og effektiv bruker- og pasientopplevelse.


ONKOKIRURGISK VÅRMØTE 2025 HOTEL VICTORIA, STAVANGER
Onkokirurgisk Vårmøte finner i år sted på Hotel Victoria i Stavanger 24-25. april i regi av Norsk Gastrointestinal Cancer Gruppe (NGICG) og Norsk Forening for Gastroenterologisk Kirurgi (NFGK). Vårmøtet starter med Akademiet et initiativ primært rettet mot unge forskere i starten av sin forskningskarriere. Akademiet starter torsdag kl. 09 og foregår frem til lunsj, med foredrag og faglige diskusjo
ner. Vårmøtets hovedprogram starter torsdag kl. 15 og avsluttes fredag kl. 14. Torsdag kveld er det felles middag for møtets deltakere. Årets program er variert og spennende, med relevante foredrag for alle spesialiteter involvert i behandlingen av GI cancer.
Velkommen til Stavanger 2425. april.
TORSDAG 24.04
15001505 Velkommen
15051615 KI
15051525 KI og persontilpasset medisin
15251540 AIbaserte prognostiske biomarkører 15401555 KI og radiologi: Utfordringer og muligheter
1555-1610 KI ved tolkning og beskrivelse av CT og MR lever 16101615 Diskusjon
1615-1630 Pause
1630-1730 Stråleterapi: Protoner – og fotoner 1630-1645 Protonterapi: Metode og indikasjoner 1645-1700 Planlagte/pågående stråleterapistudier ved GI cancer
1700-1715 Presentasjon av Protect - studien 1715-1730 Neoadjuvant behandling ved cancer recti 1730-1750 Pause
1750-1900 Intraarterielle modaliteter i behandling av GI kreft
1750-1810 SIRT Hva er det; indikasjoner og resultater 1810-1830 TACE Prinsipper, indikasjoner og resultater 1830-1850 HAI Indikasjoner og erfaringer
1850-1900 Diskusjon
2000 Middag
PROGRAM 24.-25. APRIL PÅMELDING
FREDAG 25.04
0845-0945
Nyheter fra handlingsprogrammene
0845-0855 Nytt fra leder av NGICG – Kolorektal 0855-0905 Nytt fra leder av NGICG – HPB 0905-0915 Nytt fra leder av NGICG – Øsofagus/ventrikkel 0915-0925 Diskusjon 0925-0945 «Fra min Phd»: BMI og GI cancer 0945-1015 Pause
1015-1130 Endoskopi: Organbevarende behandling 1015-1025 Endoskopisk behandling av øsofaguscancer i Norge 1025-1035 Endoskopisk behandling av øsofaguscancer – tekniske aspekter
1035-1040 Diskusjon
10401050 Organbevarende, lokal eksisjon av tidlig rektumcancer – kirurgens perspektiv 11501100 Organbevarende, lokal eksisjon av tidlig rektumcancer – endoskopørens perspektiv 1100-1120 SCAR og ETHOS studiene
1120-1130 Diskusjon
1130-1230 Lunsj
1230-1410
Liquid biopsy og GI cancer
1230-1245 Status/oversikt
1245-1300 Liquid biopsy: Tidlig diagnostikk av kolorektal cancer
1300-1315 Kolorektal cancer: ctDNA ved kurativ kirurgi 1315-1330 ctDNA ved lokalavansert og metastatisk PDAC
1330-1340 Diskusjon
1340-1400 Markører for tidlig cancer i øsofagus
14001410 Avslutning
STRATAFIX ™ knytefri sutur – 28 nye koder
Nå enda flere varianter av STRATAFIXTM

Vil du vite mer om våre suturer? Ring
eller besøk ortomedic.no.

Toveis STRATAFIX™ Spiral MONOCRYL™ Plus
• Antibakteriell teknologi på en større del av porteføljen
• Tilgang til flere lengder og farger
• Oppgradering av nåler med Multipass og Ethalloy
• Oppgradert forpakning med enklere åpning og bedre merking


OLAUG VILLANGER
LEDER LEGATSTYRET
KORREPONDANSE: OVILLANG @ OUS - HF.NO.
TILDELING AV MALTHESTIPEND 2024
• Dr. Alexander Malthes legat ble opprettet i 1920. Legatet ble overført til Norsk Kirurgisk Forening (NKF) i 2014, med en beholdning på 1,9 millioner kroner, da Oslo kirurgiske forening ble lagt ned.
• Formålet med Malthes legat er «å fremme norsk kirurgi i form av reisestipend, fortrinnsvis til engelsktalende land, for dyktige yngre leger til videre utdannelse.»
• Stipendet blir lyst ut i mange kanaler, blant annet tidsskriftet Kirurgen, sosiale medier og i samarbeid med Forening for unge norske kirurger (FUNK). I 2024 var det få søkere utenfor østlandsområdet. Legatstyret har vurdert søkere som har levert en beskrivelse av formålet med stipendet og med et budsjettforslag.
• Stipendmottakerne må levere en kort reiserapport, med angivelse av faglig utbytte egnet for publisering i Kirurgen, innen 1 måned etter gjennomført reise/kongress.
• Legatet med oppdatert status av investeringene i fond (Nordea) viser god avkastning.
STIPENDMOTTAKERE 2024:
1. Jacob Ghotbi, stipendiat og LIS generell kirurgi/gastrokirurgi OUS. Søker midler til deltagelse på E-AHPBA (Europeisk kongress for HPB kirurger) i Dublin juni 2025
2. Airazat Kazaryan, LIS generell kirurgi/gastrokirurgi OUS/ Kalnes. Søker midler til fellowship i kolorektalkirurgi ved St. Marks Hospital, London.
3. Maiken Wang, utdannet tannlege og snart ferdig med medisinstudium, ønsker videreutdannelse innen maxillofacial kirurgi. Søker midler til deltagelse ved European Association for Cranio Maxillo Facial Surgery Congress, Roma 2024.
4. Henrik Røkkum, LIS barnekirurgi OUS. Søkes midler til utdanningsbesøk 1-2 uker ved Wroclaw University of Medicine i Polen. Videreutvikling av thoracoskopisk behandling av øsofagusatresi og implementering av denne teknikken i OUS.
5. Signe Olsbø, stipendiat og LIS gastro/barnekirurgi OUS. Søker midler til deltagelse på Pediatric Colorectal Pelvic Reconstruction Meeting i Madrid 2024.
FELLOWSHIP I KOLOREKTAL KIRURGI VED ST. MARK’S HOSPITAL
I LONDON
Jeg heter Airazat Kazaryan. Jeg er nylig utdannet gastrokirurg med solid forskningsbakgrunn og jobber i dag som overlege og nestleder av en forskningsgruppe ved kirurgisk avdeling, Sykehuset Østfold. Her er min reiserapport fra et 7-ukers langt fellowship i kolorektalkirurgi ved St. Mark´s Hospital i London.
AIRAZAT M. KAZARYAN
GASTROKIRURGISK SEKSJON, KIRURGISK AVDELING, SYKEHUSET ØSTFOLD
KORREPONDANSE: KAZARYAN @ GMAIL.COM

Helt i begynnelsen av min kirurgiske karriere fikk jeg kjennskap til St. Marks hake uten å være klar over hvor denne betegnelsen kommer fra. I senere år, da jeg begynte å fordype meg mer i kolorektalkirurgi fikk jeg vite at navnet kommer fra St. Mark’s Hospital i London, som er verdenspionér innen kolorektalkirurgi. I 2022, under en disputas på Ahus, introduserte professor Dejan Ingnjatovic meg for dr. Danilo Miskovic, som den gang var «chair of surgery» ved St. Mark’s Hospital og er en av verdens fremste kolorektalkirurger – spesielt kjent for sitt mentorarbeid innen robotkirurgi. Vår kommunikasjon fortsatte under disutasmiddagen og vi fant mye felles i hverandre og dr. Miskovic fortalte meg om muligheten for å hospitere på St. Mark’s Hospital innen ordning «honorary clinical placement».
Å jobbe eller hospitere i utlandet for en periode er egentlig noe jeg alltid har kunnet tenke meg. Det at jeg fortsatt var i en utdanningsstilling, og i tillegg hadde barn i barnehagealder, gjorde at terskelen ble høy for å ta steget og sette i gang et slikt prosjekt. I 2024 tok jeg et avsluttende steg i gastrokirurgisk spesialisering, og så ble det klart at det høsten 2024 skulle passe ideelt med et opphold på St.
Artikkelforfatter (venstre) og Dr. Danilo Miskovic (høyre) på St. Mark’s Hospital, London
”Education is the most powerful weapon which you can use to change the world.’’
Nelson Mandela
Mark’s Hospital. I juni 2024 ble jeg akseptert og takket være økonomisk støtte og godvilje til å tilpasse arbeidsplan og bevilge fagpermisjon fra både forskningsavdelingen, gastrokirurgisk seksjon og kirurgisk avdeling, Sykehuset Østfold, ble det mulig for meg å dra. Jeg er spesielt takknemlig overfor dr. Peter Rancinger og professor Waleed Ghanima for deres tillit som gjorde et 7-ukers fellowship i London mulig. I tillegg er jeg takknemlig til Malthes Legat for reisestipend som gjorde det økonomisk mulig å dra.
St Mark’s Hospital ble grunnlagt i 1835 av Frederick Salmon som «The Infirmary for the Relief of the Poor afflicted with Fistula and other Diseases of the Rectum». Gjennom sin 190 års lange historie har sykehuset innehatt en verdensledende rolle i både kirurgisk og medisinsk behandling av kolorektale sykdommer.
I oktober 2024 ble jeg tatt godt imot ved St. Mark’s Hospital i London. Den kliniske hverdagen er organisert ganske likt som jeg var vant til i Norge. Imidlertid er pasientflyten og driften organisert noe annerledes. Hver enkelt overlege har sin egen driftsenhet med egen sekretær, egen poliklinikkliste og egne operasjonsdager. Operasjonsvolum og spektrum er betydelig større enn på alle kolorektale enheter jeg har jobbet på i Norge (Sykehuset Østfold, Ullevål sykehus og Ahus).
Jeg fulgte både dr. Miskovic, som var veilederen min under mitt fellowship, og andre overleger, samt leger i spesialisering på poliklinikk, visitt, MDT og operasjon. Det var meget lærerikt. Det var flere sjeldne inngrep, som jeg kun hadde kjennskap til gjennom litteratur eller ved å ha assistert et fåtall ganger, som jeg nå fikk observere daglig og bli godt kjent med. Jeg opplevde stor læringsgevinst ved å få observere og drøfte utfordrende kasuser med verdenskjente kolorektalkirurger, blant annet Danilo Miskovic, Elaine Burns, Phil Tozer, Sue Clark, Omar Faiz og Ian Jenkins.
Det er svært vanlig med «visiting fellows» ved St. Mark’s Hospital, både i forskning og klinikk. Jeg traff flere ko
lorektalkirurger fra kjente institusjoner verden rundt. Dette nettverket vil kunne være nyttig med tanke på framtidig faglig samarbeid og gjennomføring av multisenterstudier.
På slutten av oppholdet i London fikk jeg anledning til å være med på «Frontiers in Colorectal and Intestinal Diseases» et ypperlig møte hvor man får siste oppdateringer innen sykdommer, både fra det kirurgiske og det medisinske perspektivet.
I tillegg til et faglig påfyll ved St. Mark’s Hospital fikk jeg anledning til å møte koryfeer innen britisk kirurgi. Audiens hos professor Lord Ara Darzi, en pionér innen flere retninger i gastrokirurgien, blant annen robotkirurgi, og tidligere britisk helseminister, var et meget opplevelsesrikt møte. Det var også en stor ære å møte en tidligere kollega fra samarbeidet i the European Association for Endoscopic Surgery (EAES), professor Tan Arulampalam, som er en nåværende leder av forskningskomiteeni EAES og president i the Association of Laparoscopic Surgeons of Great Britain & Ireland.
Under oppholdet var det selvsagt også anledning for å fornemme London, som uten tvil er en av de mest spennende storbyene i verden. Fantastiske museer, storartet arkitektur og statelige parker var spesielt verdifullt å oppleve. Å besøke Oxford og Cambridge var også et uforglemmelig eventyr. Jeg fikk en ubeskrivelig følelse å være der hvor en betydelig del av kunnskapen er blitt født. Det fikk meg til å tenke på to kjente sitater: ”Education is the most powerful weapon which you can use to change the world.’’ - Nelson Mandela, og “Science is not only a disciple of reason but also one of romance and passion.” –Stephen Hawking.
Et fellowship i utlandet gir en fantastisk mulighet for faglig fordypning generelt og er lærerikt på alle måter. Det anbefales til alle som ønsker å utforske, utvikle og oppleve en bredere verden, både faglig, sosialt og kulturelt.
REISEBREV FRA JOHANNESBURG
Som generell kirurg ansatt i Forsvaret, må man være forberedt på å behandle hardt skadde pasienter. Så langt i min karriere har jeg ikke stått overfor mange penetrerende traumer. Med dette som bakgrunn, oppsøkte jeg muligheten for å hospitere i Sør-Afrika.
OLE SKAARA
FORSVARETS SANITET, SESSVOLLMOEN / OSLO UNIVERSITETSSYKEHUS, AKER
KORREPONDANSE: OLE SKAARA – OLE_SKAARA @ HOTMAIL.COM
Takk til Tina Gaarder (OUS) som ordnet hospiteringen via professor Moeyane Moeng ved Trauma Unit, Charlotte Maxeke Johannesburg Academic Hostpital (CMJAH), i ukene 47-49 2024.
CMJAH Trauma Unit er et «Level 1» traumesenter i et av Johannesburgs største offentlige sykehus. De har et eget mottak, en egen intensivavdeling og en dedikert sengepost. Her mottas i overkant av 15 000 traumer årlig, hvorav 2 500 kan kategoriseres som prioritet 1, altså kritisk skadde. Rundt 1 500 av disse er skuddskader, 4 000 knivstikk, 1 000 høyenergi bilulykker, og 1 000 fotgjengere truffet av kjøretøy. På en 24-timers vakt jeg var med på, kom det inn 24 prioritet 1 pasienter.
Jeg var med som assistent på operasjon, men mest tid tilbrakte jeg i mottaket som en ekstra ressurs i vaktlaget. I praksis drives det av to Medical Officers (tilsvarende LIS2) og en Registrar (tilsvarende LIS3 i generell kirurgi).
Mottaket er i en slags konstant unntakstilstand grunnet den endeløse tilstrømmen av pasienter. Det fremstår kaotisk når utstyr, inkludert kritiske medikamenter og håndskrevede papirjournaler, flyter rundt. De har ikke traumeteam som vi kjenner det; pasienter tas vanligvis i mot av en sykepleier og en lege. Etter hvert skjønner man at de gjør det beste de kan med det utgangspunktet de har, som dessverre er preget av betydelig underbemanning og ressursknapphet.
Jeg er veldig imponert over de unge legene som i praksis driver akuttmottaket alene. De gjør alt av undersøkelser og prosedyrer selv, fra å legge venefloner til å intubere

og håndtere kunstig ventilerte pasienter. På operasjonsstuen var det imponerende høyt tempo og kvalitet etter «damage control» prinsipper. I tillegg har avdelingen et høyt akademisk nivå.
For meg har oppholdet vært svært nyttig. Det er overhodet ikke all kunnskap og håndtering her som er direkte overførbart til norske forhold, men det er mye nyttig å lære som kirurg i feltsykehus, hvor vi også kan måtte gjøre tøffe prioriteringer ut i fra begrensede ressurser.
Takk til styret i Malthes legat som tildelte meg stipend for å gjennomføre reisen. Takk til Forsvarets sanitet som så potensialet i det faglige utbyttet. Og en spesiell takk til min kone Turid som ikke bare støttet, men oppfordret meg til å reise.
Fra kontoret til Trauma Unit CMJAH. Fra venstre: Dr. Mpai, Dr. Mufamadi, undertegnede, Thsepo (avdelingssekretær)
Belte etter bukkirurgi gir smertelindring og raskere mobilisering
ViraX2
Elastisk og stødig belte

Vira finnes med 2 eller 3 strammebånd
Egnet for brokk og store snitt i magen
Fleksibel og enkel å tilpasse
Gir kompresjon og effektiv støtte over overkroppen



Gjennom effektiv støtte og kompresjon bidrar våre postoperative belter til bedre restitusjon etter abdominal kirurgi. De er utviklet i dialog med fagpersoner for å møte helsevesenets spesifikke krav og ønsker. Designet fokuserer på menneskene som skal bruke dem, så alle beltene våre er enkle å bruke, tilpasningsdyktige og svært komfortable. Vi tilbyr flere beltemodeller med ulik høyde, kompresjonsgrad og materiale. Besøk no.nordicare.se for mer informasjon. For demo kontakt Helena Peters, helena@nordicare.se, +46 (0)705159120.


Use of Abdominal Binders after a Major Abdominal Surgery: A Randomized Controlled Trial
AbdoCare Fleksibelt belte ViraKing Ekstra stort belte ViraX3 Med 3 strammebånd LyftPlus Formet mageparti
ANNUAL EUROPEAN PEDIATRIC COLORECTAL PELVIC RECONSTRUCTION MEETING
23-26 OKTOBER 2024
SIGNE OLSBØ
AVDELING FOR GASTRO - OG BARNEKIRURGI, OSLO UNIVERSITETSSYKEHUS HF
KORREPONDANSE: SIGNOL @ OUS - HF.NO
Jeg har hatt gleden av å delta på det årlige europeiske møtet for pediatrisk kolorektal og bekkenrekontruksjon som ble avholdt i Madrid høsten 2024. Møtet startet med et praktisk kurs med fokus på operasjonsteknikk for anorektale misdannelser (for eksempel posterior sagittal anorektoplastikk) og Hirschsprung sykdom («pull-through»-operasjon). Vi fikk mulighet til å jobbe med modeller under veiledning og fikk tett og personlig oppfølging fra eksperter fra mange land. De resterende dagene var fylt med møter og forelesninger der vi fikk innsikt i det nyeste innen kolorektal barnekirurgi. Et høydepunkt for meg var presentasjonen av egen forskning om foreldres erfaringer med analblokking (bilde 1). Presentasjonen
ble godt mottatt og jeg fikk konstruktive og spennende tilbakemeldinger fra de andre deltakerne; det viste seg å være et tema med stor interesse blant kolleger i flere land. Mange fagpersoner delte erfaringer og synspunkter som har gitt meg nye ideer og inspirasjon til å fortsette forskningen på feltet.
Deltakelsen på denne konferansen har vært svært givende både faglig og personlig. Jeg vil takke Malthes Legat for å ha gitt meg muligheten til å delta på dette møtet. Mange nye ferdigheter og kontakter vil bidra positivt til mitt videre arbeid innen barnekirurgi.

Artikkelforfatter presenterer egen forskning om foreldres erfaringer med barn med anorektale misdannelser som gjennomgår analblokking
Curved Jaw, Single-Action

POWERSEAL Sealers/Dividers
Laparoscopic Portfolio
The Next Level of Advanced Bipolar Technology
· Confident vessel sealing.
· Multifunctional design.
· Ergonomic comfort.
The Choice Is Yours
· Three different jaw styles.
· Three shaft lengths.
· One common handle design.
For more information, please contact us or visit www.olympus.no

S10: REKONSTRUKTIV PLASTIKKIRURGI
1. Solish MJ, Roller JM, Zhong T. Sir Harold Gillies: The Modern Father of Plastic Surgery. Plast Reconstr Surg. 2023;152(1):203e-204e. doi:10.1097/PRS.0000000000010279
2. Godina M. Early microsurgical reconstruction of complex trauma of the extremities. Plast Reconstr Surg. 1986;78(3):285-292. doi:10.1097/00006534-198609000-00001
3. Lee ZH, Stranix JT, Rifkin WJ, et al. Timing of Microsurgical Reconstruction in Lower Extremity Trauma: An Update of the Godina Paradigm. Plast Reconstr Surg. 2019;144(3):759-767. doi:10.1097/PRS.0000000000005955
4. Karanas YL, Nigriny J, Chang J. The timing of microsurgical reconstruction in lower extremity trauma. Microsurgery. 2008;28(8):632-634. doi:10.1002/micr.20551
5. Bennett N, Choudhary S. Why climb a ladder when you can take the elevator?. Plast Reconstr Surg. 2000;105(6):2266. doi:10.1097/00006534-200005000-00062
6. Gottlieb LJ, Krieger LM. From the reconstructive ladder to the reconstructive elevator. Plast Reconstr Surg. 1994;93(7):1503-1504. doi:10.1097/00006534-199406000-00027
7. Khan AZ, Utheim TP, Byholt M, et al. Skin grafting. Hudtransplantasjon. Tidsskr Nor Laegeforen. 2022;142(8):10.4045/tidsskr.21.0671. Published 2022 May 23. doi:10.4045/ tidsskr.21.0671
8. Rose LF, Wu JC, Carlsson AH et al. Recipient wound bed characteristics affect scarring and skin graft contraction. Wound Repair Regen. 2015;23(2):287-296. doi:10.1111/ wrr.12267
9. Mathes SJ, Nahai F. Classification of the vascular anatomy of muscles: experimental and clinical correlation. Plast Reconstr Surg. 1981;67(2):177-187.
10. Hallock GG. Direct and indirect perforator flaps: the history and the controversy. Plast Reconstr Surg. 2003;111(2):855-866. doi:10.1097/01.PRS.0000040462.38363.C7
11. Kim JT, Kim SW. Perforator Flap versus Conventional Flap. J Korean Med Sci. 2015;30(5):514-522. doi:10.3346/jkms.2015.30.5.514
12. Yamamoto T, Yamamoto N, Kageyama T, et al. Definition of perforator flap: what does a “perforator” perforate?. Glob Health Med. 2019;1(2):114-116. doi:10.35772/ ghm.2019.01009
13. Lamberty BG, Cormack GC. Fasciocutaneous flaps. Clin Plast Surg. 1990;17(4):713-726.
14. Weum S, de Weerd L, Klein S et al. Behandling av bløtdelsdefekter med perforatorlapper [Soft tissue defects treated with perforator flaps]. Tidsskr Nor Laegeforen. 2008;128(3):313-315.
15. Vigen A, Almeland SK, Gunnarson G. Propellerlapp – et godt alternativ til tradisjonelle muskellapper. Kirurgen 2016
16. Neligan PC. The future of plastic surgery. Arch Plast Surg. 2022;49(1):1-2. doi:10.5999/ aps.2021.02278
S14: REKONSTRUKSJON AV UNDEREKSTREMITETER ETTER TRAUME
1. Lee ZH, Daar DA, Yu JW, Kaoutzanis C, Saadeh PB et al. Updates in Traumatic Lower Extremity Free Flap Reconstruction. Plast Reconstr Surg. 2023 Nov 1;152(5):913e-918e.
2. Steinberger Z, Therattil PJ, Levin LS. Orthoplastic Approach to Lower Extremity Reconstruction: An Update. Clin Plast Surg. 2021 Apr;48(2):277-288.
3. Burns JC, DeCoster RC, Dugan AJ et al. Trends in the Surgical Management of Lower Extremity Gustilo Type IIIB/IIIC Injuries. Plast Reconstr Surg. 2020 Jul;146(1):183-189.
4. Blough JT, Saint-Cyr MH. Propeller Flaps in Lower Extremity Reconstruction. Clin Plast Surg. 2021 Apr;48(2):173-181.
5. Pu LLQ. Free Flaps in Lower Extremity Reconstruction. Clin Plast Surg. 2021 Apr;48(2):201-214. doi: 10.1016/j.cps.2020.12.002.
6. Brown C, Ash M, Menon A et al. Incidence and Risk Factors for Secondary Surgery and Amputation After Lower Extremity Limb Salvage. Ann Plast Surg. 2025 Jan 1;94(1):7578.
7. Kozusko SD, Liu X, Riccio CA, Chang J, Boyd LC, Kokkalis Z, Konofaos P. Selecting a free flap for soft tissue coverage in lower extremity reconstruction. Injury. 2019 Dec;50 Suppl 5:S32-S39.
8. Hsu CC, Loh CYY, Wei FC. The Anterolateral Thigh Perforator Flap: Its Expanding Role in Lower Extremity Reconstruction. Clin Plast Surg. 2021 Apr;48(2):235-248.
S20: REKONSTRUKSJON AV PLEUROKUTANT VINDU OG FYLLING AV PLEURAHULE ETTER POST- PNEUMONEKTOMIEMPYEM
1. Hamdi M, Van Landuyt K, Monstrey S, Blondeel P. Pedicled perforator flaps in breast reconstruction: a new concept. Br J Plast Surg. 2004;57(6):531-9.
2. Benhamed L, Bellier J, Hysi I, Lopez B, Wurtz A. Harvest technique for pedicled intrathoracic transposition of pectoralis major muscle. Gen Thorac Cardiovasc Surg. 2012;60(8):546-8.
3. Choi B, Lee C, Yu JW. Distinctive role of inflammation in tissue repair and regeneration. Arch Pharm Res. 2023;46(2):78-89.
4. Zhu M, Yang Y, Shi Y, Zhang Y, Liu J, Lu N. A treatment protocol for chronic post-pneumonectomy empyema associated with bronchopleural fistula: A single-centre retrospective study. Int Wound J. 2023;20(3):725-31.
5. Tukiainen E. Chest Wall Reconstruction after Oncological Resections. Scandinavian Journal of Surgery. 2013;102(1):9-13.
S24: BEHANDLING AV FROSTSKADER – OPPDATERING OG UTVIDET SPEKTRUM
1. Sjøberg T, De Weerd L. Ny vår for behandling av dype frostskader. Tilgjengelig på: https://www.kirurgen.no/fagstoff/plastikkirurgi/ny-var-for-behandling-av-dypefrostskader/
2. Zafren K. Nonfreezing Cold Injury (Trench Foot). Int J Environ Res Public Health. 6. oktober 2021;18(19):10482.
3. Golden FSC, Francis TJR, Gallimore D, Pethybridge R. Lessons from history: morbidity of cold injury in the Royal Marines during the Falklands Conflict of 1982. Extreme Physiol Med. 8. august 2013;2:23.
4. Vale TA, Symmonds M, Polydefkis M, Byrnes K, Rice ASC, Themistocleous AC, mfl. Chronic non-freezing cold injury results in neuropathic pain due to a sensory neuropathy. Brain. 1. oktober 2017;140(10):2557–69.
5. Suito M, Yanagida T, Ohtsubo M, Tsunekawa K, Kikuchi N. Cold Environment-Associated Extremity Lesions or Severe Hypothermia Help Differentiate Between Frostbitten and Trench Foot (Immersion Foot). Int J Low Extrem Wounds. 4. oktober 2024;15347346241273138.
6. Zafren K, Hollis S, Weiss EA, Danzl D, Wilburn J, Kimmel N, mfl. Prevention and Treatment of Nonfreezing Cold Injuries and Warm Water Immersion Tissue Injuries: A Supplement to the Wilderness Medical Society Clinical Practice Guidelines. Wilderness Environ Med. juni 2023;34(2):172–81.
7. Ungley CC, Channell GD, Richards RL. The Immersion Foot Syndrome. Wilderness Environ Med Summer 2003;14(2):135-41
8. Ionescu AM, Hutchinson S, Ahmad M, Imray C. Potential new treatment for non-freezing cold injury: is Iloprost the way forward? BMJ Mil Health. 1. oktober 2017;163(5):361–3.
9. Tam A, Lyons T, Vennam S, Barnes R, Imray C. Early Use of Iloprost in Nonfreezing Cold Injury. Wilderness Environ Med. september 2022;33(3):344–7.
10. Heggers JP, Robson MC, Manavalen K, Weingarten MD, Carethers JM, Boertman JA, mfl. Experimental and clinical observations on frostbite. Ann Emerg Med. 1. september 1987;16(9):1056–62.
11. Oudemans-van Straaten HM, Spoelstra-de Man AM, de Waard MC. Vitamin C revisited. Crit Care Lond Engl. 6. august 2014;18(4):460.
12. Zeng WM, Parus A, Barnes CW, Hiro ME, Robson MC, Payne WG. Aloe vera —Mechanisms of Action, Uses, and Potential Uses in Plastic Surgery and Wound Healing. Surg Sci. 2020;11(10):312–28.
13. McIntosh SE, Freer L, Grissom CK, Rodway GW, Giesbrecht GG, McDevitt M, mfl. Wilderness Medical Society Clinical Practice Guidelines for the Prevention and Treatment of Frostbite: 2024 Update. Wilderness Environ Med. juni 2024;35(2):183–97.
14. Cauchy E, Chetaille E, Marchand V, Marsigny B. Retrospective study of 70 cases of severe frostbite lesions: a proposed new classification scheme. Wilderness Environ Med. desember 2001;12(4):248–55.
15. Robins M, Hendriksen S, Cooper JS. Hyperbaric Management of Frostbite. I: StatPearls [Internett]. Treasure Island (FL): StatPearls Publishing; 2024 [sitert 21. desember 2024]. Tilgjengelig på: http://www.ncbi.nlm.nih.gov/books/NBK448115/
16. Magnan MA, Gayet-Ageron A, Louge P, Champly F, Joffre T, Lovis C, mfl. Hyperbaric Oxygen Therapy with Iloprost Improves Digit Salvage in Severe Frostbite Compared to Iloprost Alone. Medicina (Mex). 22. november 2021;57(11):1284.
17. Norheim AJ, Mercer J, Musial F, Weerd LD. A new treatment for frostbite sequelae; Botulinum toxin. Int J Circumpolar Health. januar 2017;76(1):1273677.
18. Weum S, de Weerd L. Ultrasound-guided Sympathetic Block of the Radial Artery with Botulinum Toxin to Treat Vasospasm. Plast Reconstr Surg Glob Open 2018 Jul 12;6(7):e1836. doi: 10.1097/GOX.0000000000001836. eCollection 2018 Jul.
19. Regli IB, Strapazzon G, Falla M, Oberhammer R, Brugger H. Long-Term Sequelae of Frostbite—A Scoping Review. Int J Environ Res Public Health. 14. september 2021;18(18):9655.
20. Laarakker AS, Borah G. Botulinum Toxin A Salvage of Ischemic Hand Trauma. Plast Reconstr Surg. januar 2020;145(1):161–4.
21. Norheim AJ, Borud E, Mercer JBrian, De Weerd L, Weiss T, Wilsgaard T. Botulinum Toxin A in the treatment of frostbite sequelae – results from a blinded, early-phase, comparative trial. Int J Circumpolar Health. 31. desember 2023;82(1):2189556.
S 28: NÅR TIDEN KREVER MER AV OSS
– KRIGSKIRURGI I NORGE
1. Helse- og omsorgsdepartementet. Pressemelding. Regjeringen.no; 2024 Sep 24.
2. Dagens Medisin. Publisert 2004 Jun 5.
3. Holtan A. Pasienter til norske sykehus fra krigen i Ukraina. Tidsskriftet; 2023 May 9.
S32: REKONSTRUKSJON AV MELLOMANSIKT
OG
NESE ETTER SKADE
1. Wenko S, Eggensperger N, Kollar A et al.Midfacial reconstruction using calvarial split bone grafts.Arch Otolaryngol Head Neck Surg. 2005 Feb;131(2):131-136 doi:10.1001/ archotol.131.2.131
2. Knott PD, Seth R, Waters HH et al. Short-term donor site morbidity: A comparison of the anterolateral thigh and radial forearm fasciocutaneous free flaps. Head Neck. 2016 Apr;38 Suppl 1: E945-8. doi: 10.1002/hed.24131. Epub 2015 Jul 18. PMID: 25994936
3. Ranganath K, Jalisi SM, Naples JG et al. Comparing outcomes of radial forearm free flaps and anterolateral thigh free flaps in oral cavity reconstruction: A systematic review and meta-analysis. Oral Oncol. 2022 Dec;135:106214. doi: 10.1016/j.oraloncology.2022.106214. Epub 2022 Oct 24. PMID: 36302325.
4. Demirtas Y, Yavuzer R, Findikcioglu K et al. Fixation of the Split Calvarial Graft in Nasal Reconstruction. Journal of Craniofacial Surgery 17(1):p 131-138, January 2006. doi: 10.1097/01.scs.0000197388.89185.f0
5. Chenard KE, Teven CM, He TC et al.Bone Morphogenetic Proteins in Craniofacial Surgery: Current Techniques, Clinical Experiences, and the Futre of Personalized Stem Cell Therapy. J Biomed Biotechnol 2012 Nov 20;2012:601549. doi:10.1155/2012/601549
6. Gokdogan O. Bone grafting in maxillofacial trauma. Opinion in Otolaryngology&Head and Neck Surgery, 2022; 30 (4), 260-264. doi:10.1097/MOO.0000000000000809
7. Dermody SM, Lindsay RW, Justicz N. Considerations for Optimal Grafting in Rhinoplasty. Facial Plast Surg, 2023; 39 (06): 625-629 doi: 10.1055/a-2116-4566
8. Sahoo NK, Rangan M. Role of Split Calvarial Graft in Reconstruction of Craniofacial Defects. Journal of Craniofacial Surgery 23(4):p e326-e331, July 2012: doi: 10.1097/ SCS.0b013e31825434db
9. Samuel H. Osseous and Cartilaginous Nasal Reconstruction. Facial Plast Surg 2017; 33(01): 043-05. doi: 10.1055/s-0036-1597897
10. Smart RJ, Yeoh MS, Kim DD.Paramedian Forehead Flap, Oral and Maxillofacial Surgery Clinics of North America, Volume 26, Issue 3,2014,Pages 401-410,ISSN 10423699,ISBN 9780323320207, https://doi.org/10.1016/j.coms.2014.05.008.
11. Ramsey ML, Ellison CA, Hohman MH et al. Interpolated Flaps. 2024 Jan 29. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan–. PMID: 29262248.
S36: HÅNDTERING AV TRAUMATISKE PERIFERE SKADER AV NERVUS FACIALIS
1. Tzou, C.-H. J., & Rodríguez-Lorenzo, A. (Eds.). (2021). Facial Palsy: Techniques for Reanimation of the Paralyzed Face. Springer
2. Lee, L. N., Lyford-Pike, S., & Boahene, K. D. O. (2013). Traumatic facial nerve injury. Otolaryngologic Clinics of North America, 46(5), 825–839.
3. Mistry, R. K., Homan, M. H., & Al Sayed, A. A. (2023). Facial nerve trauma. In StatPearls. StatPearls Publishing.
4. House, J. W., & Brackmann, D. E. (1985). Facial nerve grading system. Otolaryngology–Head and Neck Surgery, 93(2), 146–147
5. Gordin, E., Lee, T. S., Ducic, Y., & Arnaoutakis, D. (2015). Facial nerve trauma: Evaluation and considerations in management. Craniomaxillofacial Trauma & Reconstruction, 8(1), 1–13
6. Mat Lazim, N., Ismail, H., Abdul Halim, S., Nik Othman, N. A., & Haron, A. (2023). Comparison of 3 grading systems (House-Brackmann, Sunnybrook, Sydney) for the assessment of facial nerve paralysis and prediction of neural recovery. Medeniyet Medical Journal, 38(2), 111–118.
7. Roostaeian, J., Rohrich, R. J., & Stuzin, J. M. (2015). Anatomical considerations to prevent facial nerve injury. Plastic and Reconstructive Surgery, 135(5), 1318–1327.
S40: INNFØRING AV NY KIRURGISK TEKNIKK
OG TEKNOLOGI – IDEAL RETNINGSLINJENE
1. Marcus HJ, Bennett A, Chari A, Day T, Hirst A, Hughes-Hallett A, et al. IDEAL-D Framework for Device Innovation: A Consensus Statement on the Preclinical Stage. Ann Surg. 2021.
2. Hirst A, Philippou Y, Blazeby J, Campbell B, Campbell M, Feinberg J, et al. No Surgical Innovation Without Evaluation: Evolution and Further Development of the IDEAL Framework and Recommendations. Ann Surg. 2019;269(2):211-20.
3. McCulloch P, Altman DG, Campbell WB, Flum DR, Glasziou P, Marshall JC, et al. No surgical innovation without evaluation: the IDEAL recommendations. Lancet. 2009;374(9695):1105-12.
4. Van Oostendorp SE, Belgers HJ, Hol JC, Doornebosch PG, Belt E, Oosterling SJ, et al. Learning curve of TaTME for rectal cancer is associated with local recurrence; results from a multicentre external audit. Colorectal Dis. 2021.
5. Persiani R, Agnes A, Belia F, D’Ugo D, Biondi A. The learning curve of TaTME for mid-low rectal cancer: a comprehensive analysis from a five-year institutional experience. Surg Endosc. 2021;35(11):6190-200.
6. Catchpole K, Perkins C, Bresee C, Solnik MJ, Sherman B, Fritch J, et al. Safety, efficiency and learning curves in robotic surgery: a human factors analysis. Surg Endosc. 2016;30(9):3749-61.
7. Wu S, Zhang J, Peng B, Cai Y, Li A, Liu L, et al. Coaching for improving clinical performance of surgeons: a scoping review. Updates Surg. 2025.
8. Thomaier L, Orlando M, Abernethy M, Paka C, Chen CCG. Laparoscopic and robotic skills are transferable in a simulation setting: a randomized controlled trial. Surg Endosc. 2017;31(8):3279-85.
9. Ferrari D, Violante T, Merchea A, Dozois E, Vierkant RA, Larson DW. A Method for Continuous Surgeon Improvement in Rectal Cancer: Risk-Adjusted Cumulative Sum. Ann Surg. 2024.
10. Chahal B, Aydin A, Amin MSA, Khan A, Khan MS, Ahmed K, et al. The learning curves of major laparoscopic and robotic procedures in urology: a systematic review. Int J Surg. 2023;109(7):2037-57.
11. Guend H, Widmar M, Patel S, Nash GM, Paty PB, Guillem JG, et al. Developing a robotic colorectal cancer surgery program: understanding institutional and individual learning curves. Surg Endosc. 2017;31(7):2820-8.
12. Freedman B. Equipoise and the ethics of clinical research. N Engl J Med. 1987;317(3):141-5.
13. Knobloch K. Surgical randomized-controlled trials and CONSORT 2010. Ann Surg. 2011;253(3):633-4; author reply 4-5.
14. Moher D, Hopewell S, Schulz KF, Montori V, Gotzsche PC, Devereaux PJ, et al. CONSORT 2010 explanation and elaboration: updated guidelines for reporting parallel group randomised trials. BMJ. 2010;340:c869.
15. Boutron I, Moher D, Altman DG, Schulz KF, Ravaud P, Group C. Extending the CONSORT statement to randomized trials of nonpharmacologic treatment: explanation and elaboration. Ann Intern Med. 2008;148(4):295-309.
S44: TRAUMATISK NESESKADE: EN GJENNOMGANG AV NESEFRAKTURER OG SEPTUMHEMATOM
1. Mayersak RJ. Initial evaluation and management of facial trauma in adults: UpToDate; 2024 [Available from: https://www.uptodate.com/contents/initial-evaluation-andmanagement-of-facial-trauma-in-adults.
2. Rohrich RJ, Adams WP, Jr. Nasal Deformities. Plastic and Reconstructive Surgery.106(2):266-73.
3. McCarty JC, Herrera-Escobar JP, Gadkaree SK, El Moheb M, Kaafarani HMA, Velmahos G, et al. Long-Term Functional Outcomes of Trauma Patients With Facial Injuries. J Craniofac Surg. 2021;32(8):2584-7.
4. K Y. Nese-bihule-anatomi: Nasjonal nettundervisning for øre-nese-hals og plastikkirurgi; 2024 [Available from: www.spesialisthelsetjenesten.no.
5. Friedrich P. Sobotta Atlas of Anatomy. 17th ed2023 2023-04-13.
6. IMAIOS. IMAIOS.com: IMAIOS; [Available from: www.imaios.com.
7. Gupta G, K M. Nasal Septal Hematoma. StatPearls: StatPearls Publising; 2023.
8. Helseinformatikk N. Septumperforasjon 2023 [Available from: https://nhi.no.
9. Folkehelseinstituttet. Skadebildet i Norge - Rapport 2019 2019 [Available from: https:// www.fhi.no/globalassets/dokumenterfiler/rapporter/2019/skadebildet-i-norge_rapport_2019.pdf.
10. Rohrich RJ, Adams WP, Jr. Nasal fracture management: minimizing secondary nasal deformities. Plast Reconstr Surg. 2000;106(2):266-73.
11. Truong TA. Initial Assessment and Evaluation of Traumatic Facial Injuries. Semin Plast Surg. 2017;31(2):69-72.
12. Helsedirektoratet. Antibiotika i sykehus - Infeksjoner i øre, nese, hals, tann og kjeve 2023 [Available from: https://www.helsedirektoratet.no/retningslinjer/antibiotika-i-sykehus/ infeksjoner-i-ore-nese-hals-tann-og-kjeve#postoperative-infeksjoner-ore-nese-halseller-kjeveomradet-etter-inngrep-gjennom-mucosa.
S48: ALL IN -25: HVORDAN GÅR DET MED DE SYKESTE PASIENTENE VI OPERERER?
1. Ng ZQ, Weber D. One-Year Outcomes Following Emergency Laparotomy: A Systematic Review. World J Surg. 2022;46(3):512-23.
2. Toftlund SA, Gogenur I, Thygesen LC. Descriptive study of all Danish patients undergoing emergency exploratory laparotomies in the period 2003-2014. Scand J Public Health. 2020;48(3):243-9.
3. Liljendahl MS, Gogenur I, Thygesen LC. Emergency Laparotomy in Denmark: A Nationwide Descriptive Study. World J Surg. 2020;44(9):2976-81.
4. Vester-Andersen M, Lundstrom LH, Moller MH, et al. Mortality and postoperative care pathways after emergency gastrointestinal surgery in 2904 patients: a population-based cohort study. Br J Anaesth. 2014;112(5):860-70.
5. Nally DM, Sorensen J, Valentelyte G, et al. Volume and in-hospital mortality after emergency abdominal surgery: a national population-based study. BMJ Open. 2019;9(11):e032183.
6. Aakre EK, Ulvik A, Hufthammer KO, et al. Mortality and complications after emergency laparotomy in patients above 80 years. Acta Anaesthesiol Scand. 2020;64(7):913-9.
7. Wangen E, Gillund EW, Reinholdtsen EM, et al. Emergency laparotomy at St Olav’s Hospital, Trondheim. Tidsskr Nor Laegeforen. 2023;143(6).
8. Norsk register for gastrokirurgi (NORGAST). Årsrapport 2023.
9. Vedtekter for Norsk register for gastrokirurgi – NORGAST. Universitetssykehuset Nord Norge HF 2024 https://www.norgast.no/
10. NELA Project Team. Ninth Patient Report of the National Emergency Laparotomy Audit. Royal College of Anaesthetists (RCoA) London 2024. https://www.nela.org.uk/Ninth-Patient-Report#pt.
11. NELA Project Team. Sixth Patient Report of the National Emergency Laparotomy Audit. Royal College of Anaesthetists (RCoA) London 2020. https://www.nela.org.uk/SixthPatient-Report#pt.
12. Lassen K, Nymo LS, Korner H, et al. The New National Registry for Gastrointestinal Surgery in Norway: NoRGast. Scand J Surg. 2018;107(3):201-7.
13. NELA Inclusion & Exclusion Criteria. https://www.nela.org.uk/Criteria#pt.
S50: SENTRAL LYMFADENEKTOMI VED HØYRESIDIG
TYKKTARMSKREFT ER TRYGT OG GJENNOMFØRBART BÅDE ÅPENT OG LAPAROSKOPISK
1. Lygre KB, Eide GE, Forsmo HM, Dicko A, Storli KE, Pfeffer F. Complications after open and laparoscopic right-sided colectomy with central lymphadenectomy for colon cancer: randomized controlled trial. BJS Open. 2023;7(4).
2. Lygre KB, Eide GE, Liedenbaum MH, Augland IMB, Haldorsen IS, Pfeffer F. Short and equal vascular stump length after standardized laparoscopic and open surgery with central lymphadenectomy for right-sided colon cancer. Br J Surg. 2024;111(1).
3. Lygre KB, Forthun RB, Hoysaeter T, Hjelle SM, Eide GE, Gjertsen BT, et al. Assessment of postoperative circulating tumour DNA to predict early recurrence in patients with stage I-III right-sided colon cancer: prospective observational study. BJS Open. 2024;8(1).
S52: INTRANASAL PROSEDYRE SEDASJON TIL BARN MED
DEKSMEDETOMIDIN OG KETAMIN – ET TRYGT OG NYTTIG VERKTØY
1. Frestadius A, Grehn F, Kildal M, al e. Intranasal dexmedetomidine and rectal ketamine for young children undergoing burn wound procedures. Burns. 2022;48(6):1445-51.
2. Ræder J. ketamin. I: Store medisinske leksikon; 2024. Tilgjengelig fra: https://sml.snl. no/ketamin
3. Legemiddelhåndbok N. Ketamin. I: Norsk Legemiddelhåndbok. 2016. Tilgjengelig fra: https://www.legemiddelhandboka.no/L22.3.1.4/Ketamin
4. Legemiddelindustrien. I: Felleskatalogen. 2022. Tilgjengelig fra: https://www.felleskatalogen.no/medisin/ketamin-abcur-abcur-631315?markering=0
5. Qiao H, Xie Z, Jia J. Pediatric premedication: a double-blind randomized trial of dexmedetomidine or ketamine alone versus a combination of dexmedetomidine and ketamine. BMC Anesthesiol. 2017;17(1):158.
6. Yang F, Liu Y, Yu Q, al e. Analysis of 17 948 pediatric patients undergoing procedural sedation with a combination of intranasal dexmedetomidine and ketamine. Paediatr Anaesth. 2019;29(1):85-91.
7. Tobias JD. Dexmedetomidine and ketamine: an effective alternative for procedural sedation? Pediatr Crit Care Med. 2012;13(4):423-7.
8. Fantacci C, Fabrizio GC, Ferrara P, al e. Intranasal drug administration for procedural sedation in children admitted to pediatric Emergency Room. Eur Rev Med Pharmacol Sci. 2018;22(1):217-22.
9. Brudvik C, Høivik T, Einen M, al. e. Barn med smerter underbehandles. Tidsskrift for Den norske legeforening. 2021;141.
S56: KOSTNADER VED BEHANDLING AV ABDOMINALE AORTAANEURISMER OG KAROTISSTENOSER – ERFARINGER FRA HAUKELAND UNIVERSITETSSJUKEHUS OG ST. OLAVS HOSPITAL
1. Faye CAF, Gubberud E, Halsteinli V, Seternes A. Kostnader for behandling av abdominale aorta aneurismer og carotisstenoser ved St. Olavs Hospital og Haukeland Universitetssjukehus [Hovedoppgave i Medisin] Trondheim: NTNU; 2024. https://ntnuopen. ntnu.no/ntnu-xmlui/handle/11250/3128504
S58: MESTRINGENS MESTERSKAP
1. Bartlett, Jonathan. Addressing the recruitment shortfall in surgery - How do we inspire the next generation?. Annals of Medicine & Surgery 25():p 30-32, January 2018. | DOI: 10.1016/j.amsu.2017.11.024
Curved Jaw, Single-Action

POWERSEAL Sealers/Dividers
Laparoscopic Portfolio
The Next Level of Advanced Bipolar Technology
· Confident vessel sealing.
· Multifunctional design.
· Ergonomic comfort.
The Choice Is Yours
· Three different jaw styles.
· Three shaft lengths.
· One common handle design.
For more information, please contact us or visit www.olympus.no

THE CARMYNE BLUE LINE

Indication: this medicinal product is for diagnostic use only. Carmyne is indicated in adults for the intra-operative detection of suspected ureteral injuries during abdominal and pelvic surgery.
Carmyne 40 mg – Plikttekst for Carmyne 40 mg «Indigokarmin» injeksjonsvæske, oppløsning Reseptgruppe C. Indikasjoner: Kun til bruk ved diagnostiske formål. Indisert hos voksne til intraoperativ påvisning av mistenkte ureterskader under abdominal kirurgi og bekkenkirurgi. Dosering: Anbefalt startdose er 1 ampulle på 5 ml ved langsom i.v. injeksjon. En andre ampulle kan injiseres 20 til 30 minutter etter den første injeksjonen, om nødvendig. Se SPC for spesielle pasientgrupper og administrasjonsmåte. Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Forsiktighetsregler: Kan forårsake en forbigående økning av blodtrykket og refleksbradykardi, spesielt hos pasienter under generell anestesi eller under spinalanestesi. Sjeldne idiosynkratiske reaksjoner med bradykardi og hypotensjon er også rapportert. Det er derfor nødvendig å overvåke hjertefrekvens og blodtrykk under og noen minutter etter injeksjonen. I.v. injeksjon bør stoppes ved følgende symptomer: bradykardi, takykardi, hypotensjon, hypertensjon, utslett eller erytem, luftveissymptomer som dyspné eller bronkospasme. Har ikke blitt studert hos pasienter med GFR <30 ml/min, og bør derfor ikke brukes hos disse. Kan forstyrre puls eller cerebrale oksymetrimålinger. Bør brukes med forsiktighet ved: høyt blodtrykk, lav hjertefrekvens, hjerte- og ledningsforstyrrelser, samtidig bruk av legemidler som induserer bradykardi eller påvirker blodtrykket eller produksjonen av nitrogenoksid, koronare lidelser på grunn av dets perifere vasokonstriktoreffekt. Bruk bør unngås hos pasienter med: hemodynamisk ustabilitet, ukontrollert hjertesvikt, allergiske reaksjoner i anamnesen. Graviditet, amming og fertilitet: Graviditet: Ingen data. Anbefales ikke under graviditet og hos fertile kvinner som ikke bruker prevensjon. Amming: Overgang i morsmelk er ukjent. Risiko for diende barn kan ikke utelukkes. Nytte-/risikovurdering må foretas. Bivirkninger: Svært vanlig: Bradykardi, hypertensjon (forbigående). Svært sjeldne: Anafylaktoide reaksjoner, AV-blokk, bronkial hyperreaktivitet, dyspné, hypotensjon, misfarging av hud, utslett og erytem, takykardi. Overdosering/ Forgiftning: En overdose kan indusere en hypertensiv krise og alvorlig bradykardi. Ved overdosering kan det vurderes behandling med en perifer vasodilator.
For mer informasjon, se Felleskatalogteksten eller preparatomtalen (SPC)Innehaver av markedsføringstillatelsen: SERB S.A., Belgia. Kontaktinformasjon: Telefon: 003227920500. E-post: safety@serb.eu. Basert på SPC godkjent av DMP/EMA: 19.06.2024. Pakninger og priser per 17.07.2024: Ampulle 10 × 5 ml. 4713,00 kr. (priser og ev. refusjon oppdateres hver 14. dag). Refusjon: Ingen refusjon. Utarbeidet 07/2024