2) Indeling van de materie.
Voor de chemie is het belangrijk materie in te delen naar zijn samenstelling.
Volgend schema geeft een rudimentaire indeling van de materie.
HETEROGENE STOF
is een stof die niet in alle punten dezelfde eigenschappen heeft
GROVE MENGSELS (v-v)
SUSPENSIE (v-vl)
EMULSIE (vl-vl)
SCHUIM (g-vl)
NEVEL, DAMP (vl-g)
ROOK (v-g)
MENGSEL
bestaat uit minstens twee verschillende soorten bestanddelen (stoffen) in een variabele samenstelling
ZUIVERE STOF
is een stof met een welbepaalde chemische samenstelling
COLLOÏDALE OPLOSSINGEN
overgangsvorm met deeltjesgrootte tussen 1 nm en 100 nm
HOMOGENE STOF
is een stof die in alle punten dezelfde eigenschappen heeft
ENKELVOUDIGE STOF
is een zuivere stof bestaande uit slechts één atoomsoort
SAMENGESTELDE STOF
is een zuivere stof bestaande uit meer dan één atoomsoort
Tabel 1: indeling van de materie op basis van zijn samenstelling
LEGERINGEN OPLOSSINGEN GASMENGSELS
METALEN NIET-METALEN EDELGASSEN
ANORGANISCHE VERBINDINGEN ORGANISCHE VERBINDINGEN
Colloïdale oplossingen : = 'schijnbare' oplossing = heterogeen, maar voor het oog niet zichtbaar wel met een microscoop. < > 'ware' oplossingen = homogeen : oplossingen van moleculen en/of ionen. Deze echte oplossingen zijn helder, gekleurd of kleurloos. Ze zijn nooit troebel.
Colloïden zijn deeltjes welke verdeeld zijn in een dispersiemiddel en onoplosbaar in het dispersiemiddel.Voorbeelden van colloïdale oplossingen : kleurstofoplossingen, detergentoplossingen, melk,...
3) Het begrip atoom.
Men kan het atoom omschrijven als het kleinste deeltje dat langs chemische weg (energie < 10eV) kan worden afgezonderd.
a. Samenstelling van het atoom - subatomaire deeltjes.
Een atoom bestaat uit een kern en elektronen; de kern is ook nog opgebouwd uit nucleonen. Men kan deze elementaire deeltjes, elektronen en nucleonen, kenmerken door een massa en een lading.
De elektronen zijn drager van de elementaire negatieve lading; de nucleonen zijn hetzij protonen, hetzij neutronen. Protonen dragen een elementaire positieve lading en de neutronen zijn elektrisch neutraal.
De elementaire elektrische lading bedraagt 1,6021892.10-19 Coulomb. Men noemt dit ook de elektronladingseenheid (e.l.e.).
In een atoom zijn er evenveel elementaire positieve ladingen als er elementaire negatieve ladingen zijn: een atoom is elektrisch neutraal. Naast een ladingseenheid bestaat ook een eenheid van massa. De geünificeerde massaeenheid (u of a.m.e) is het twaalfde deel van de massa van een koolstofatoom met twaalf nucleonen (12C): 1 u = 1,6605655.10-27 kg.
Een samenvatting wordt gegeven in tabel 2
Tabel 2 : subatomaire elementaire deeltjes gebruikt in de chemie; u is de geünificeerde massa-eenheid, e.l.e. is de elementaire ladingseenheid (= absolute waarde van de lading van een elektron).
Atoom elektronen nucleonen protonen neutronen massa kg 9,109534.10-31 1,6726485.10-27 1,6749543.10-27 u 0,00054858026 1,007276470 1,008665012
b. Atoomnummer en massagetal
Het aantal protonen in de kern bepaalt de atoomsoort of het element. Anders geformuleerd, een element bestaat slechts uit één atoomsoort.
Het atoomnummer is het getal dat aangeeft hoeveel protonen de kern bevat; het wordt voor en onder het symbool geschreven (vb. : 6C) maar het wordt niet verplicht vermeld; immers, het symbool zelf bepaalt eveneens het aantal protonen. Een atoom is echter slechts volledig bepaald indien zowel het aantal protonen als neutronen gekend zijn: een dergelijke atoom wordt ook nuclide genoemd (algemene benaming).
Het massagetal geeft de som aan van protonen en neutronen; het wordt voor en boven het symbool geschreven om een welbepaalde nuclide van een element aan te duiden.
De algemene voorstelling van een nuclide is dus:
met X: symbool van het element
Z: atoomnummer
A: massagetal
Het aantal neutronen N aanwezig in de kern wordt gevonden door: N = A – Z
Voorbeeld:
C 12
6 of 12C : dit is de voorstelling van een koolstofatoom waarvan de kern is opgebouwd uit 6 protonen en 6 neutronen.
c. Isotopen
Een groot aantal elementen bestaan in verschillende isotopische vormen: zij hebben wel hetzelfde aantal protonen maar een verschillend aantal neutronen; deze vormen noemt men de isotopen van een element. Isotopen zijn dus atomen van hetzelfde element die slechts van mekaar verschillen door het aantal neutronen. Isotopen vertonen nagenoeg geen verschil in chemische eigenschappen, de fysische eigenschappen verschillen soms in belangrijke mate.
Merk op: nuclide is de algemene benaming voor een atoom met welbepaalde A en Z; wanneer men echter spreekt over meerdere nucliden van hetzelfde element dan gebruikt men de benaming isotopen.
Voorbeeld:
1H, 2H en 3H zijn isotopen van waterstof. 16O is een nuclide.
4) Relatieve atoommassa (=RAM) en absolute atoommassa.
a. Relatieve atoommassa Ar van een nuclide X.
Het is het onbenoemd getal dat uitdrukt hoeveel maal de absolute massa van een nuclide groter is dan de eenheid, zijnde 1/12 van de massa van een 12C nuclide.
De relatieve atoommassa wordt meestal bepaald door massaspectrometrie.
Voorbeelden:
Nuclide
Relatieve atoommassa
23Na 22,9898
35Cl 34,9688
37Cl 36,947
b. Absolute atoommassa ma van een element Y.
De meeste elementen komen in de natuur voor als een mengsel van isotopen. De samenstelling van dit mengsel is doorgaans constant, i.e. onafhankelijk van de vindplaats op aarde.
Zo bestaat het element chloor steeds uit 75,53 % 35Cl en 24,47 % 37Cl (massa %). Een uitzondering op deze regel is het element boor, waarvan de isotoopsamenstelling varieert met de geografische vindplaats. De relatieve atoommassa van boor is dus ook veranderlijk.
Men moet met de isotoopsamenstelling rekening houden om de absolute atoommassa van een element te berekenen. De absolute atoommassa van een element is dus eigenlijk de "gewogen gemiddelde waarde" van absolute massa's van de samenstellende nucliden.
Voorbeeld: Chloor kent 2 isotopen met een abundantie van 75,5 % en 24.5% → afgerond ma (Cl) = [(34,9688.0,7553) + (36,947.0,2447)].1,6605655.10-27 kg = 35,453 . 1,6605655.10-27 kg. = gemiddelde waarde
c. Relatieve atoommassa Ar van een element Y.
Het is het onbenoemd getal dat uitdrukt hoeveel maal de absolute massa van een element groter is dan de eenheid.
Voorbeeld: Ar (Cl) = 35,453 = constant.
Wegens de veranderlijke isotoopsamenstelling schommelt de relatieve atoommassa van Boor tussen 10,82 en 10,84.
De waarden van de relatieve atoommassa's van de elementen vindt men in het periodiek systeem der elementen (Tabel van Mendeljev).
5) Elementen: symbolen en periodieke CLASSIFICATIE.
a.Periodiek Systeem : historiek
De rangschikking in het periodiek systeem zoals we dit nu kennen is de verdienste van de Russische professor Dimitri Mendeljev (1834 – 1907). Tot 1869 bestond geen systematische manier om de tot dan toe ontdekte chemische elementen te rangschikken. Mendeljev merkte op dat bepaalde groepen van elementen verwante eigenschappen bezaten. Hij rangschikte de elementen volgens stijgende atoommassa en stelde vast dat hun eigenschappen op een periodieke wijze terugkwamen.
Figuur 2 : geeft een aantal elementen weer gerangschikt volgens stijgende atoommassa. De elementen met gelijkaardige eigenschappen chemisch/fysisch) worden aangeduid in dezelfde kleur. Merk op dat deze kleuren op een periodieke wijze terugkeren. Het herkennen van dit ‘periodiek patroon’ lag aan de basis van het huidige periodiek systeem.
Figuur 2: Rangschikking van elementen volgens stijgende atoommassa; elementen met gelijkaardige eigenschappen worden in dezelfde kleur weergegeven
Deze observatie van terugkerende eigenschappen werd door Mendeljev samengevat in de ‘periodieke wetmatigheid’: ‘Worden de elementen gerangschikt volgens stijgende atoommassa, dan worden bepaalde eigenschappen periodiek herhaald’.
In een volgende stap werden alle gekende elementen door Mendeljev georganiseerd in een tabel bestaande uit een reeks rijen. In de rijen werden de elementen gerangschikt volgens stijgende atoommassa, maar de verschillende rijen werden zo onder elkaar geplaatst dat elementen met gelijkaardige eigenschappen terecht kwamen in dezelfde kolom (Figuur 3).
Figuur 3: Vereenvoudigd periodiek systeem
Merk op: in figuur 3 staat het element waterstof reeds op de alom gekende plaats. Voor Mendeljev was die positie niet zo vanzelfsprekend. Het element H hoort wat betreft chemische eigenschappen in het rechter deel van het periodiek systeem!
In 1869 waren nog niet alle chemische elementen gekend. De tabel van Mendeljev vertoonde bijgevolg gaten. Deze gaten lieten hem toe om het bestaan van nog niet ontdekte elementen alsook sommige eigenschappen van deze elementen te voorspellen!
b. Periodiek systeem: huidige versie
Het werk van Mendeljev in combinatie met de ontdekking van nieuwe chemische elementen heeft geleid tot het actuele periodiek systeem weergegeven in figuur 4. Dit periodiek systeem is karakteristiek opgebouwd uit horizontale rijen die periodes worden genoemd en verticale kolommen die groepen worden genoemd. De nummering van de periodes loopt van 1 tem 7; voor de nummering van de groepen wordt de combinatie van een Romeins cijfer met de letter A of B gebruikt. De elementen in groep A worden de hoofdgroepelementen genoemd. Voor de hoofdgroepelementen komt het groepsnummer overeen met het aantal valentie-elektronen (= elektronen in de buitenste schil). Het periodenummer komt overeen met het aantal schillen die elektronen bevatten. Een alternatief nummeringssysteem bestaat voor de groepen: deze loopt van 1 tem 18. Beide systemen staan vermeld in figuur 4.
4 : periodiek systeem
0p deze wijze ontstaan er 18 kolommen die verdeeld worden in 8 hoofdgroepen aangeduid met de letter A.
Hoofdgroepen : Ia-VIIa : metalen en niet-metalen. Sommige van deze groepen hebben een ‘naam’ :
IA : alkalimetalen (met uitz. van H) : gemakkelijke afgave van het ene valentie e- met de vorming van een éénwaardig + ion. Zijn hoog reactief en komen in de natuur steeds in gebonden toestand voor.
IIA : aardalkalimetalen : afgave van 2 valentie e- met vorming van een tweewaardig + ion.
Deze afgave gebeurt minder gemakkelijk dan voor een element uit groep IA en is bijgevolg minder reactief.
VIIA: halogenen. Komen in de natuur steeds diatomair voor : F2, Cl2, Br2, I2.
Zijn zeer reactief met vorming van een éénwaardig neg. ion.
Groep O : edelgassen, bezitten met uitzondering van He, 8 valentie-e- hetgeen een zeer stabiele elektronenconfiguratie blijkt te zijn. Men spreekt ook wel van de edelgasconfiguratie. Ze hebben nauwelijks neiging zich met andere elementen te binden, vandaar de naam edelgassen.
10 nevengroepen aangeduid met de letter B; ze vormen samen de transitiemetalen.
Figuur
De rijen noemen we perioden. De eerste periode bevat 2 elementen, de tweede en derde periode 8 elementen, de vierde en vijfde periode 18 elementen en de zesde (met de lanthaniden) en zevende (met de actiniden) periode 32 elementen.
Voor de A-groep elementen bevat het groepsnummer zeer nuttige informatie. Hieruit kan namelijk de lading worden afgeleid van het desbetreffende ion gevormd uit het beschouwde element, namelijk:
- Voor groep IA tem IVA: lading van het ion = groepsnummer;
- Voor groep VA tem VIIIA: lading van het ion = groepsnummer – 8
In het periodiek systeem kunnen 3 grote klassen worden onderscheiden op basis van hun fysische en chemische eigenschappen:
1)de metalen = groep elementen links en centraal in het periodiek systeem
Voorbeelden: natrium (Na), magnesium (Mg), koper (Cu) en lood (Pb).
Zij bezitten de volgende eigenschappen:
-De materialen opgebouwd uit deze elementen zijn goede geleiders van warmte en elektriciteit en vertonen doorgaans een glanzend voorkomen
-Als ionen komen zij vorm onder de vorm van kationen ; dit betekent dat het element vlot elektronen afstaat.
Binnen de groep van de metalen wordt een onderscheid gemaakt tussen:
-De alkalimetalen = elementen uit groep IA
-De aardalkalimetalen = elementen uit groep IIA
-De transitiemetalen = elementen uit centrale blok in periodiek systeem of Bblokelementen.
2)de niet-metalen = groep elementen die zich rechts bovenaan in het periodiek systeem bevindt. Voorbeelden zijn zuurstof (O), koolstof (C), fluor (F).
Zij bezitten de volgende eigenschappen:
-De materialen opgebouwd uit deze elementen zijn slechte geleiders van warmte en elektriciteit.
-Als ionen komen zij vorm onder de vorm van anionen ; dit betekent dat het element vlot elektronen opneemt.
Binnen de groep van de niet-metalen wordt een onderscheid gemaakt tussen:
- De koolstofgroep = elementen uit groep IVA
- De stikstofgroep = elementen uit groep VA
- De zuurstofgroep = elementen uit groep VIA
- De halogenen = elementen uit groep VIIA
- De edelgassen = elementen uit groep VIIIA
In de tabel van Mendeljev kan tussen de metalen en niet-metalen een diagonale traplijn worden onderscheiden lopend van boor (B) tot astaat (At). De elementen die liggen langs deze traplijn vormen de 3de klasse, namelijk deze van
3)de metalloïden of semi-metalen .
Voorbeelden zijn silicium (Si), germanium (Ge) en antimoon (Sb).
De materialen opgebouwd uit deze elementen zijn gekend als halfgeleiders omwille van een elektrische geleidbaarheid die ligt tussen deze van de metalen en niet-metalen.
Hun benaming semi-metalen wijst op het feit dat deze elementen eigenschappen bezitten verwant aan metalen én verwant aan niet-metalen.
c.Elementen en hun symbolen.
Een groep van isotopen (atomen met eenzelfde Z) vormt een element.
Het is belangrijk te beseffen dat binnen een element isotopen steeds met een bepaalde (constante) abundantie voorkomen.
Zo bestaat het element chloor steeds uit 75,5% van het isotoop 17 35Cl en 24,5% van het 17 37Cl . Anders gezegd, de abundantie van de beide isotopen is respectievelijk 75,5 % en 24,5 %.
Onderstaande tabel geeft de belangrijkste elementen met hun rangnummer Z, hun symbool en naam.
Z symbool naam Z
1 H waterstof 20 Ca calcium
2 He helium 24 Cr chroom
3 Li lithium 25 Mn mangaan
5 B boor 26 Fe ijzer
6 C koolstof 27 Co kobalt
7 N stikstof 28 Ni nikkel
8 O zuurstof 29 Cu koper
9 F fluor 30 Zn zink
10 Ne neon 35 Br broom
11 Na natrium 47 Ag zilver
12 Mg magnesium 48 Cd cadmium
13 Al aluminium 50 Sn tin
14 Si silicium 53 I jood
15 P fosfor 56 Ba barium
16 S zwavel 78 Pt platina
17 Cl chloor 79 Au goud
18 Ar argon 80 Hg kwik
19 K kalium 82 Pb lood
Tabel 3: belangrijkste elementen (te kennen)
Merk op :
Symbolische voorstelling van het element bestaat uit : -1 letter : steeds hoofdletter schrijven. -2 letters : eerste letter is steeds een hoofdletter ; tweede letters is steeds een kleine letter.
6) Bindingen : molecuul-ion-metaal.
Enkel de edelgassen komen voor als monoatomische gassen (vrije atomen). In alle andere zuivere stoffen komen de atomen in een welbepaalde verhouding (Dalton) en in gebonden toestand voor.
Zijn de krachten die de atomen samenhouden, tot stand gekomen door het delen van een gemeenschappelijk elektronenpaar dan noemen we de bindingen covalent en de verbindingen moleculen. Chloorgas (Cl2), stikstofgas (N2), water (H2O) en waterstofchloride (HCl) zijn enkele typische voorbeelden van (covalente) moleculen.
(http://exo.science.ru.nl/exoidee/view.php?pid=266)
Figuur 5: elke watermolecule bestaat uit 2 waterstofatomen en 1 zuurstofatoom wat leidt tot de chemische formule H2O
Een molecule is een combinatie van atomen, die zich gedragen alsof ze één geheel vormen (deeltje). Een molecule is elektrisch neutraal, in tegenstelling tot een ion. Een molecule heeft een stoechiometrisch kenmerk: de verhouding van de samenstel-lende atomen is vast.
Een molecule wordt voorgesteld door zijn formule, die de aard (symbolen) en het aantal (indices) van de samenstellende elementen weergeeft:
Ap Bq betekent dat de molecule bestaat uit p atomen A en q atomen B.
Dergelijke formule wordt ook brutoformule genoemd, omdat ze geen informatie geeft welke atomen met mekaar verbonden zijn of wat de geometrische structuur is.
Voorbeelden:
CO2 : de molecule is samengesteld uit koolstof (1 atoom) en zuurstof (2 atomen).
NaBr : de molecule bestaat uit natrium (1 atoom) en broom (1 atoom).
In de empirische formule daarentegen vindt men de meest eenvoudige verhouding van de samenstellende atomen terug.
Voorbeeld :
H2O2 is de brutoformule voor waterstofperoxide; HO is de empirische formule van deze molecule.
Uit de procentuele samenstelling van een molecule (experimenteel te bepalen) kan de empirische formule worden afgeleid. Door gebruik te maken van de molecuulmassa kan, uit de empirische formule, het exact aantal van elk atoomtype in de molecule worden bepaald. De combinatie: empirische formule + molecuulmassa is met andere woorden essentieel voor het opstellen van de brutoformule.
Zijn de krachten die de atomen samenhouden van elektrostatische aard (coulombkrachten) dan noemen we de bindingen ionair en de verbindingen zouten.
Keukenzout of natriumchloride is hiervan een typisch voorbeeld. Bovendien gaan in keukenzout de natrium-ionen (Na+) en de chloride-ionen (Cl-) zich op een regelmatige wijze in een 1/1 verhouding ordenen, wat leidt tot een ionrooster opgebouwd uit NaCl roostereenheden.
(http://www.aljevragen.nl/sk/atoombouw/ATM073.html)
Figuur 6: keukenzout komt voor als een ionrooster opgebouwd uit Na+ en Cl- in een 1/1 verhouding wat leidt tot de chemische formule NaCl
Ionen zijn positief of negatief geladen atomen of gebonden atoomgroepen. In het geval van atomen kan men zich gemakkelijk indenken dat winst of verlies van één (of meerdere) elektron(en) aanleiding kan geven tot de vorming van een negatief, respectievelijk positief ion.
Voorbeelden:
Cl-, CO3 2- anionen -> neg. geladen
Na+, NH4 + kationen -> pos.geladen
Bij metalen komt een interatomaire actie tot stand die tot stabiliteit leidt nl. de metaalbinding. .
Het eenvoudigste model om de binding tussen metaalatomen te beschrijven is het ‘elektronzee-model’. Volgens dit model is het metaal opgebouwd uit een roosterstructuur, een 3D-netwerk opgebouwd uit metaalkationen waartussen de valentie-elektronen vrij kunnen bewegen (zie figuur 7). Het continuüm van mobiele elektronen fungeert als het ware als een elektrostatische ‘lijm’ die de metaalkationen samenhoudt in het metaalrooster.
Figuur 7: elektronzee-model (http://wps.prenhall.com/wps/media/objects/3084/3158882/blb2305.html
Dit zeer eenvoudige model laat toe om de elektrische en thermische geleidbaarheid van metalen te verklaren op een kwalitatieve manier. De geleidbaarheid is volledig toe te schrijven aan het mobiele karakter van de elektronen in het rooster.
7) Relatieve molecuulmassa (=RMM) en absolute molecuulmassa.
Men kan op analoge wijze als in par. 4 de begrippen absolute en relatieve molecuulmassa afleiden.
De relatieve molecuulmassa is het onbenoemd getal dat de verhouding uitdrukt van de absolute waarde van de "gewogen gemiddelde massa" van de molecule en de massaeenheid:
Belangrijke opmerkingen:
- De uitdrukking "gewogen gemiddelde massa" duidt op het feit dat de natuurlijke isotoopsamenstelling van de samenstellende atomen van de molecule in rekening wordt gebracht.
- Mr = Ar
De relatieve molecuulmassa wordt in de praktijk berekend door de som te maken van de relatieve atoommassa's van alle samenstellende atomen.
Voorbeeld:
- de relatieve molecuulmassa van water is:
Mr(H2O) = 2.Ar(H) + 1.Ar(O) = 2x1,00797 + 1x15,9994 = 18,01534 (afgerond tot op 2 decimalen : 18,02)
8) De begrippen zuivere stof en mengsel.
Een zuivere stof kan worden gedefinieerd als een verzameling deeltjes met welbepaalde fysische en chemische eigenschappen, karakteristiek voor de zuivere stof. Zo heeft men als fysische eigenschappen: aggregatietoestand (functie van temperatuur en druk), geleidbaarheid, dichtheid, hardheid, ... De chemische eigenschap bij uitstek is de reactiviteit.
De elementaire deeltjes waaruit een zuivere stof is opgebouwd kunnen atomen zijn of moleculen.
Voorbeelden:
(1) Heliumgas (He, g) is een zuivere stof die bestaat uit heliumatomen; men stelt dit afgekort voor door het symbool van het element He.
(2) Gedistilleerd water kan men praktisch beschouwen als een zuivere stof die bestaat uit watermoleculen; elke molecule water bestaat uit één zuurstofatoom verbonden met twee waterstofatomen; voorstelling: H2O.
Bij normale voorwaarden van temperatuur en druk, zijn de meeste vloeibare of gasvormige zuivere stoffen samengesteld uit moleculen. Enkel de edelgassen zijn monoatomisch. Voor zuivere stoffen in de vaste toestand is de situatie iets complexer. Vele vaste stoffen in de anorganische of minerale chemie zijn ionische verbindingen. Zo bijvoorbeeld (Na+Cl-)n, gewoonlijk voorgesteld als NaCl. Andere hebben een metaalstructuur, zoals ijzer (Fe).
Men kan de zuivere stoffen verder indelen in enkelvoudige en samengestelde stoffen.
Een enkelvoudige stof is een zuivere stof waarvan de moleculen uit slechts één atoomsoort bestaan (homonucleair).
Voorbeelden: natrium, voorstelling Na neongas, voorstelling Ne waterstofgas, voorstelling H2 .
Een samengestelde stof is een zuivere stof waarvan de moleculen uit minstens twee atoomsoorten bestaan (heteronucleair). Een samengestelde stof wordt ook ‘verbinding’ genoemd.
Voorbeelden:
waterstofchloride, voorstelling HCl
natriumhydroxide, voorstelling NaOH.
Een zuivere stof kan bestaan in meerdere fasen: als gas, als vloeistof of vast = ‘aggregatietoestanden’
Een fase van een stof is een materievorm, uniform qua chemische samenstelling en qua fysische toestand. Men onderscheidt gasfase, vloeibare fase en vaste fase. De fase waarin een zuivere stof zich bevindt is afhankelijk van de temperatuur en de druk.
Sommige zuivere stoffen bestaan onder meerdere vormen (fasen genoemd) in de vaste aggregatietoestand. Zo zijn er twee fasen van koolstof, nl. grafiet en diamant. Men spreekt in dit geval van allotrope vormen. De allotrope toestand wordt, indien nodig, aangeduid na het symbool van de aggregatietoestand: C (s, grafiet) en C(s, diamant).
Materie doet zich algemeen voor als een mengsel van zuivere stoffen.
De individuele zuivere stoffen die deel uitmaken van een mengsel worden componenten genoemd.
Hier kan men ook nog de homogene mengsels en de heterogene mengsels onderscheiden.
Een homogeen mengsel heeft in elk punt dezelfde samenstelling.
Voorbeelden:
- lucht is gasmengsel, bestaande uit N2 (g), O2 (g), H2O (g) CO2(g) en nog enkele andere gassen in lagere concentraties.
- CO2 in water vormt een vloeibare oplossing
- Brons is een vaste oplossing (legering) van Cu en Sn.
Een homogeen mengsel bestaat steeds uit één enkele fase.
Een oplossing is een bijzondere vorm van een homogeen mengsel. Het betekent een homogeen mengsel beschouwd in de vloeibare fase waarbij een opgeloste stof en een oplosmiddel duidelijk te onderscheiden zijn.
De opgeloste stof wordt gedefinieerd als de component in ondermaat aanwezig; het oplosmiddel is steeds de component in overmaat aanwezig.
Voorbeeld:
De oplossing van CO2 in water is één fase met twee componenten, namelijk het oplosmiddel H2O (l) en de opgeloste stof CO2 (aq).
Een heterogeen mengsel heeft niet in alle punten dezelfde samenstelling.
Voorbeelden:
- een blok beton.
- een stuk graniet.
- CaCO3 (s), CaO (s) en CO2 (g) is een heterogeen mengsel bestaande uit drie fasen en drie componenten.
Merk op :
-de samenstellende atomen van een verbinding kunnen niet worden teruggewonnen zonder chemische transformatie (reactie); bij de mengsels is dit wel het geval.
Voorbeeld :
De elektrolyse (een chemische reactie) van water (2 H2O → O2 + 2 H2) zet water om in zijn samenstellende atomen;
Een destillatie (een fysische transformatie) van bv. zeewater geeft "zuiver water" en een aantal zouten.
-bij een mengsel is de samenstelling qua zuivere stoffen variabel; bij een verbinding is de samenstelling in atomen constant.
Samenvatting in tabel 1 – par. 2 zie indeling van de materie, pag. 5
9) Fysische en chemische verschijnselen
Elke zuivere stof wordt gekenmerkt door een aantal fysische eigenschappen zoals smeltpunt, kookpunt, elektrische geleidbaarheid, massadichtheid en door een aantal chemische eigenschappen zoals brandbaarheid, reageert met, enz.
Fysische verschijnselen zijn omzettingen waarbij enkel de fysische eigenschappen van de materie wijzigen. Zo is smelten van ijs een fysisch verschijnsel omdat bij de omzetting van ijs in water samen met de verandering van de aggregatietoestand een aantal fysische grootheden veranderen (soortelijke warmtecapaciteit van ijs is verschillend van die van water). Belangrijk te beseffen is dat er tijdens fysische processen geen verandering in de moleculaire samenstelling van de materie optreedt.
Chemische verschijnselen zijn omzettingen waarbij de samenstelling van de materie wijzigt. Zo is het verbranden van alcohol een chemisch verschijnsel omdat hierbij de alcohol omgezet wordt in koolstofdioxide en water. Hierbij is dus duidelijk een verandering in de moleculaire samenstelling van de materie opgetreden. Anders gezegd, uit de reagerende stoffen of reagentia ontstaan er nieuwe stoffen, de reactieproducten. Er treedt een reactievergelijking op.
10) Anorganische verbindingsklassen : nomenclatuur en eigenschappen.
a. Algemeen
De anorganische verbindingen worden ingedeeld in een aantal klassen.
Deze klassen kenmerken zich door een chemische functie. Dit is een atoom of atoomgroep die grotendeels verantwoordelijk is voor een aantal eigenschappen van de stof.
In de minerale scheikunde onderscheidt men als voornaamste chemische functies: de zuurfunctie, de basefunctie, de zoutfunctie en de oxiden (zuurvormende-, basevormende- en amfoteeroxiden).
Alle organische en anorganische stoffen kunnen benoemd worden met een systematische naam of IUPAC (=International Union of Pure and Applied Chemistry) benaming die gebaseerd is op hun samenstelling. ‘Vroegere’ benamingen volgens IUPAC zijn mogelijk, maar deze verouderde benamingen worden niet meer aanbevolen ! Daarnaast zijn bepaalde, veel gebruikte en algemeen aanvaarde triviale namen voor sommige stoffen ook toegestaan. Deze worden veel gebruikt en volgen de regels van de IUPAC niet.
- oxidatiegetal=OG (→oxidatietrap (O.T)=valentie=’waardigheid’) :
De kennis van het OG is belangrijk voor de naamgeving en het opstellen van de chemische formule van verbindingen.
In het algemeen geldt : dat in verbindingen van metalen met niet-metalen (ionverbindingen), het metaal een positieve valentie heeft en het niet-metaal een negatieve valentie.
Hoewel bij reacties tussen niet-metalen onderling geen ionbindingen worden gevormd, dus geen e- worden opgenomen of gestaan, kent men aan de atomen in de gevormde binding ook een valentie toe. Het atoom dat het sterkst E.N. is draagt een neg. valentie; het atoom dat het minst E.N. is een positieve.
Bv. : CO2 : C : valentie : +4 en elk O-atoom :-2
Het oxidatiegetal (OG) van een atoom in een samengestelde stof is dus de grootte van de lading die dit atoom reëel of denkbeeldig draagt.
Het OG kan genoteerd worden met :
- een Romeins Cijfer = notatie volgens Stock
- een Arabisch cijfer = notatie volgens Ewens-Bassett
Enkele algemene regels voor het bepalen van het OG in een verbinding :
- het OG van een niet gebonden element is nul. Dit geldt eveneens voor atomen in een molecuul uit gelijksoortige atomen. Wordt als volgt aangeduid :
Al, Cu, B, O2 , Cl2 0 ,...
- het OG van een monoatomisch ion = lading van dat ion.
Bv. : Na+ : valentie +1
O2- : -2
- alkalimetalen : steeds een valentie +1
- aardalkalimetalen : " +2
- de halogenen hebben een O.T. = a-1 in een binaire verb. (2elementen) wanneer ze gebonden zijn aan een minder elektroneg. element.
- zuurstof heeft doorgaans in al zijn verbindingen een valentie : -2.
Met uitzondering voor verbindingen peroxiden genaamd : -1.
Bv. : waterstofperoxide H2O2 : elk H-atoom : +1 ; elk O-atoom : -1
- waterstof heeft gewoonlijk een OG :+1 in zijn verbindingen. Behalve wanneer gebonden aan een minder elektroneg. element : a-1
- de algebraïsche som van de OG’s in een neutrale molecule = O
Stel voor CO2 : (+4) + 2.(-2) = O (CO2 = elektrisch neutraal).
- de algebraïsche som van de valenties in een polyatomisch ion = lading van dat ion.
Bv. NH4 + : x + 4.(+1) = +1 > x=-3 of de valentie voor N is in deze verbinding= -3
- indien de structuurformule van een verbinding gekend is kunnen we de O.T. van elk atoom in die verbinding bepalen.
Omgekeerd is het ook mogelijk om de structuurformule te tekenen indien de valenties van de samenstellende atomen gekend zijn.
Hieronder zijn de belangrijkste (niet alle!) OG voor de meest voorkomende elementen gegeven.
Figuur 7: de belangrijkste (niet alle!) OG voor de meest voorkomende elementen
Kennis van het OG is belangrijk bij het opstellen van de chemische formule en bij de naamgeving van een anorganische stof. Tip : memoriseer de elementen met slechts één mogelijke O.T. !
Voorbeelden :
- calciumoxide: OGCa = +II en OGO = -II ⇒ CaO -waterstofsulfide: OGH = +I en OGS = -II ⇒ H2S - ijzer(III)oxide
OGFe = +III en OGO = -II ⇒ Fe2O3
b.Enkelvoudige stoffen
De klasse van de enkelvoudige stoffen onderscheidt zich van de andere omdat enkelvoudige stoffen uit slechts één soort atomen bestaan.
Naam van de stof = naam van het element
Voorbeeld : He = helium; Fe = ijzer; Hg = kwik ; K=kalium
Er wordt steeds een hoofdletter genoteerd wanneer het element symbolisch uit één letter bestaat. Indien het element symbolisch geschreven wordt met 2 letters is de tweede letter steeds een kleine letter.
Wanneer enkelvoudige stoffen opgebouwd zijn uit moleculen worden ze voorgesteld door:
Naam van de stof = naam van het element met daarvoor een Grieks voorvoegsel dat het aantal atomen in een molecule aangeeft.
Voorbeeld : 02 = dizuurstof (zuurstofgas), O3 = trizuurstof (ozon), P4 = tetrafosfor (gele fosfor), S8 = octazwavel
Voorvoegsels: (te kennen)
1 = mono; 2 = di; 3 = tri; 4 = tetra; 5 = penta; 6 = hexa; 7 = hepta; 8 = octa
9 = nona ; 10 = deca
De metalen vormen het grootste deel van de elementen in het PS en worden gekenmerkt door volgende eigenschappen:
-ze zijn elektropositief (vormen gemakkelijk kationen)
-bij kamertemperatuur zijn het vaste stoffen (uitgezonderd Cs, Ga en Hg die vloeibaar zijn)
-ze hebben een typische metaalglans
-ze zijn mechanisch goed bewerkbaar
-het zijn goede geleiders voor warmte en elektriciteit
-ze vormen metaalroosters
De niet-metalen vormen een klein deel van de elementen in het PS en hebben als voornaamste kenmerken:
- ze zijn elektronegatief (vormen gemakkelijk anionen, uitgezonderd H)
- als vaste stoffen zijn ze vaak broos
- het zijn slechte geleiders voor warmte en elektriciteit
- bij kamertemperatuur zijn vele gasvormig of vloeibaar
- als gas vormen ze vaak diatomische moleculen
H2 diwaterstof of waterstofgas
O2 dizuurstof of zuurstofgas
F2 difluor of fluorgas
Br2 dibroom (vl)
S8 zwavel (schrijven meestal S)
N2 distikstof of stikstofgas
O3 ozon
Cl2 dichloor of chloorgas
I2 dijood (dampen)
P4 fosfor (schrijven meestal P) (te kennen)
De edelgassen vormen een aparte groep maar zijn principe ook niet metalen. Zij danken hun naam aan het feit dat ze een bijzonder lage chemische reactiviteit vertonen. Zij komen dan ook voor als atomen.
De halfmetalen of metalloïden vormen een overgang tussen de metalen en nietmetalen.
http://nl.wikipedia.org/wiki/Periodiek_systeem en http://www.lenntech.com/periodiek_systeem.htm zijn websites die heel wat interessante informatie over alle enkelvoudige stoffen bevatten.
c.atoomionen
Schrijfwijze: de positieve of negatieve lading van het ion wordt aangeduid door een cijfer rechts boven het symbool van het element gevolgd door het teken + of -:
Na+, Fe2+, Fe3+, Cl-, S2.
-Positieve atoomionen :
Benaming: voor positieve atoomionen voegt men de uitgang ion bij de naam van het element.
Indien meerdere oxidatiegetallen mogelijk wordt het desbetreffende oxidatiegetal weergegeven tussen haakjes met behulp van een Romeinse cijfer (notatie volgens Stock).
+ natriumion
2+
3+ ijzer(III)-ion
Het 1H+ ion noemt men het proton.
-Negatieve atoomionen (te kennen)
Voor de negatieve atoomionen gebruikt men de stam van de Latijnse naam van het element, gevolgd door de uitgang ide-ion
Cl- chloride-ion N3- nitride-ion
O2- oxide-ion H- hydride-ion
S2- sulfide-ion C4carbide-ion (C2 2-: carbideof acetylideion)
(te kennen)
Opmerking
Soms ontmoet men nog voor positieve ionen van elementen die in verschillende oxidatietoestanden kunnen voorkomen de Latijnse naam van het element eindigend op de uitgangen o of i respectievelijk voor het ion met het lagere en het hogere oxidatiegetal. Deze verouderde methode wordt evenwel afgeraden:
correct verouderd (niet te kennen)
Fe2+
Fe3+
Hg2 2+
Hg2+
ijzer(II)-ion ferro-ion
ijzer(III)-ion ferri-ion
dikwik(I)-ion mercuro-ion
kwik(II)-ion mercuri-ion
d.Radicalen en meeratomige kationen
Sommige neutrale radicalen hebben speciale namen eindigend op -yl. De naam van het radicaal wordt eventueel ook voor het overeenkomstige kation gebruikt.
radicaal kation
HO hydroxyl
CO carbonyl
NO nitrosyl NO+ nitrosyl-kation
NO2 nitryl NO2 + nitryl-kation
(te kennen)
Sommige belangrijke meeratomige kationen dragen bijzondere namen, zoals deze die ontstaan door additie van het proton (H+) aan neutrale moleculen: de oniumionen.
NH4 + ammonium-ion H3O+ oxonium-ion
PH4 + fosfonium-ion * H2F+ fluoronium-ion * (te kennen)
* niet te kennen
e. Meeratomige anionen
De volgende meeratomige anionen hebben namen die eindigen op -ide:
OH- hydroxide-ion HS- waterstofsulfide-ion
CN- cyanide-ion I3 - trijodide-ion
O2 2- peroxide-ion N3 - azide-ion
O2 - superoxideion S2- sulfide-ion (=te kennen)
Andere meeratomige (complexe) anionen kunnen beschouwd worden als zijnde afkomstig van zuurstofzuren en nemen een bijzondere plaats in.
Voor deze ionen wordt de naam afgeleid door toevoeging van de uitgang -aat aan de Latijnse stam van het centrale element. Het oxidatiegetal van het centrale atoom wordt aangegeven door tussen haakjes geplaatste Romeinse cijfers achter de uitgang -aat.
Deze systematische benaming mag men strikt toepassen, doch indien geen verwarring mogelijk is, gebruikt men steeds de verkorte gebruikelijke naamgeving:
*niet te kennen
anion gebruikelijke naam systematische naam *
SO4 2- sulfaation tetraoxosulfaat(VI)-ion
SnO3 2- stannaat(IV)-ion * trioxostannaat(IV)-ion
SnO2 2stannaat(II)-ion * dioxostannaat(II)-ion
Indien het zuurrestanion nog zure waterstofatomen bevat plaatst men het woord waterstof voor de naam. De vroeger gebruikte voorzetsels bi of hydrogenium worden afgeraden.
anion aanbevolen verouderd (=te kennen)
HSO4 - waterstofsulfaation
HCO3 - waterstofcarbonaation bicarbonaation
HPO4 2- (mono)waterstoffosfaation
H2PO4 - diwaterstoffosfaation (te kennen)
In sommige anionen, afkomstig van de courante oxozuren vermeld in een tabel verderop wordt het aantal zuurstofatomen (of het oxidatiegetal van het centraal element) op een triviale manier aangegeven door de uitgangen -aat of -iet en door de voorvoegsels per- en hypo-. In alle andere gevallen evenwel wordt de uitgangiet, voor de aanduiding van het anion met het centrale element in de lagere oxidatietoestand, afgeraden:
anion aanbevolen * verouderd *
SnO2 2- stannaat(II)-ion stannietion
PbO2 2- plumbaat(II)-ion plumbietion
*niet te kennen
f.Binaire verbindingen
Overzicht
Voor binaire verbindingen noemt men de naam van de elementen na elkaar.
De naam van het meest elektropositieve element blijft onveranderd en wordt eerst genoemd. Het andere element volgt met de Latijnse stam eindigend op de uitgangide. Het aantal voorkomende elementen wordt door een Grieks telwoord aangeduid.
Binaire verbindingen kunnen zowel covalente bindingen als ionaire verbindingen (binaire zouten) zijn. Opgelet : binaire zuren (= covalente bindingen) volgen bovenstaande regelgeving niet. Voor de regels van binaire zuren raadpleeg pag.39 in deze cursus. Voor binaire zuren worden geen Griekse telwoorden en ook geen Stocknotatie gebruikt !
*Multiplicatieve voorvoegsels1
1 mono1 5 penta 9 nona
2 di 6 hexa 10 deca
3 tri 7 hepta 11 undeca
4 tetra 8 octa 12 dodeca
(te kennen)
Stocknotatie is voor binaire bindingen eveneens mogelijk bij meerdere OG’s van het meest elektropositieve element, indien geen verwarring mogelijk is !
Voorbeelden van binaire covalente verbindingen :
Formule aanbevolen Mogelijk(=Stocknotatie)
CS2 koolstofdisulfide
SCl4 zwaveltetrachloride
N2O distikstof(mon)oxide
NO2 (*) stikstofdioxide
N2O4 (*) distikstoftetraoxide
Koolstof(IV)sulfide
Zwavel(IV)chloride
Stikstof(I)oxide
Niet mogelijk
Niet mogelijk
Er worden geen klinkers weggelaten volgens IUPAC.
* : N heeft in beide verbindingen O.G. : + IV : ‘verwarring’ -> geen Stocknotatie mogelijk.
Sommige verbindingen hebben een triviale naam:
H2O: water (Latijn: aqua), systematische naam: diwaterstofmonoxide *
NH3: ammoniak (Latijn: ammine), systematische naam: triwaterstofnitride*
*niet te kennen
1 De voorvoegsels kunnen weggelaten worden indien daardoor geen misverstand rijst.
1 Het voorvoegsel mono voor het eerstgenoemde element wordt bijna altijd weggelaten.
g.Oxiden
Een oxide is een binaire verbinding tussen een element en zuurstof. Alle elementen met uitzondering van de edelgassen vormen één of meerdere oxiden. De naam van het oxide bestaat uit de naam van het element, gevolgd door de uitgang “oxide”.
We onderscheiden :
Metaaloxiden (=base vormende oxiden) en niet-metaaloxiden (= zuur vormende oxiden)
-Metaaloxiden (=basische oxide) :
Voor metaaloxiden of basevormende oxiden laat men de naam van het atoom-ion volgen door de oxidatietoestand tussen haakjes (bij mogelijkheid van meerdere OG)en de uitgang -oxide (=Stocknotatie), ofwel kan men ook het systeem van Griekse telwoorden toepassen.
Heeft het metaal slechts 1 oxidatietrap dan worden (meestal) geen Griekse telwoorden gebruikt en wordt ook geen Romeins cijfer gebruikt voor het OG.
Regel : naam van het metaal + oxide.
Voorbeelden metaaloxiden :
oxide naam ofwel
MnO2 mangaan (IV) oxide mangaandioxide
Al2O3
Aluminiumoxide (geen Stocknotatie ! >
Al heeft slechts 1 OG)
Dialuminiumtrioxide (niet aanbevolen !!!)
Cu2O koper (I) oxide dikopermonoxide
CuO koper (II) oxide Koper(mon)oxide
FeO ijzer (II) oxide Ijzer(mon)oxide
Fe2O3 ijzer (III) oxide di-ijzertrioxide
Fe3O4
ijzer (II) di-ijzer (III) oxide (dubbeloxide) tri-ijzertetraoxide
Eigenschappen :
- Alle metaaloxiden zijn vaste stoffen.
- In chemische reacties is het oxide in staat het O2--ion af te staan, dat vervolgens met een proton reageert tot vorming van OH-. Dergelijke oxiden die in staat zijn een proton op te nemen noemt men basische oxiden.
Vb. :
CaO > Ca2+ + O2-
O2- + H2O ----> OH- + OH-
CaO + H2O > Ca2+ + 2 OH-
Bij het indampen van dergelijke oplossingen worden vaste verbindingen = hydroxiden = basen verkregen bv. Ca(OH)2 .
- metaaloxiden zijn over het algemeen slecht oplosbaar in water behalve natrium-, kalium-, calcium- en bariumoxide.
Indien ze oplossen vormen ze overeenkomstige hydroxidebasen :
+2OH 2Na O+H Na - + 2 2 → O
Ze lossen wel goed op in zuren.
- Niet alle metaaloxiden kunnen rechtstreeks uit reactie van metaal en zuurstof bekomen worden. Evenmin kunnen de meeste hydroxiden worden verkregen door het metaaloxide in contact met water te brengen en de verkregen oplossing in te dampen. Dit geldt slechts voor de oxiden van de alkali- en aardalkalimetalen. Een aantal oxiden kan worden bereid door verhitting van de overeenkomstige hydroxiden bv. : t↗
2 Fe(OH)3 (vast) → Fe2O3 (vast) + 3 H2O (damp)
-Niet metaaloxide (= zure oxide)
Het zijn zuurstofverbindingen met niet-metalen.
Voor de naamgeving zijn de afspraken identiek aan de binaire covalente bindingen cfr. puntje f pag. 30 en 31.
Het prefix mono wordt bijna nooit geschreven, tenzij er verwarring mogelijk is :
CO : koolstofmonoxide
CO2 : koolstofdioxide
Eigenschappen :
-De zure oxiden zijn meestal goed oplosbaar in water en vormen dan oxozuren:
Vandaar dat men ze ‘zure’ oxiden noemt.
-Worden verkregen door reactie met zuurstof. Bv. :
C + O2 → CO2 (overmaat zuurstof, bij een tekort ontstaat CO)
Bevat het oxide een O - O binding dan spreekt men van een peroxide.
Een anorganisch peroxide is een chemische stof waarin zuurstof als het (O–O)2−-ion voorkomt, in plaats van het meestal voorkomende O2−-ion. In een peroxide verbinding heeft O een O.T : -1
Vb. :
H2O2 : waterstofperoxide (=het eenvoudigste peroxide)
Na2O2 : natriumperoxide
Meestal bevat de verbinding daarnaast een alkali-of aardalkalimetaal.
Van ammoniak is ook een peroxide bekend: (NH4)2O2 =ammoniumperoxide
h.Amfotere oxiden en hydroxiden
Sommige metalen reageren zowel met zuren als met basen: het zijn amfotere elementen en men vindt ze in de tabel van MENDELJEV terug in de omgeving van de “traplijn”. De overeenkomstige oxiden en hydroxiden reageren eveneens zowel met basen als met zuren.
Amfotere hydroxiden zijn als hydroxiden weinig oplosbare verbindingen die echter in oplossing kunnen gebracht worden door toevoegen van zowel sterk zuur als sterke base.
Voorbeeld
• Al(OH)3(v) Al3+(aq) + 3 OH-(aq) toevoegen van sterk zuur (H+): er treedt neutralisatie op zodat het evenwicht naar rechts verschuift. Al(OH)3 gaat in oplossing. Alle hydroxiden gaan in oplossing door toevoeging van sterk zuur.
• toevoegen van sterke base (OH-): Enkel bij de amfotere hydroxiden treedt complexvorming op waardoor de hydroxiden ook in oplossing gaan in alkalisch milieu.
Al(OH)3(v) + OH-(aq) Al(OH)4 -(aq)
Andere voorbeelden:
Cr(OH)3(v) + OH- Cr(OH)4(aq)
Zn(OH)2(v) + 2 OH- Zn(OH)4 2(aq)
Sn(OH)2(v) + 2 OH- Sn(OH)4 2(aq)
Pb(OH)2(v) + 2 OH- Pb(OH)4 2(aq)
Andere weinig oplosbare hydroxiden zijn niet amfoteer en lossen bijgevolg niet op in sterk alkalisch midden: Mg(OH)2, Fe(OH)2, Fe(OH)3, Co(OH)2, Ni(OH)2, Cu(OH)2, Cd(OH)2, …
Bijkomende voorbeelden:
Al2O3 (s) + 6 HCl (aq) → 2AlCl3 (aq) + 3H2O (l)
Al2O3 (s) + 2 NaOH (aq) + 3H2O (l) → 2Na[Al(OH)4] (aq)
Sn (s) + 2NaOH + 2 H2O → Na2[Sn(OH)4] (aq) + H2 (g)
Sn (s) + 2HCl (aq) → SnCl2 (aq) + H2 (g)
Zn (s) + 2NaOH + 2 H2O → Na2[Zn(OH)4] (aq) + H2 (g)
i.Zuren
Volgens Arrhenius is een zuur een stof die in water (aq.) dissocieert met de vorming van oxoniumionen H3O+ en een negatief geladen zuurrest ion RHX + H2O ↔ H3O+ (aq) + R - (aq)
Eigenschappen van zuren :
- lossen meestal goed op in water.
- zijn meestal vloeistoffen met uitz. van HCl=gas, dat meestal voorkomt in een oplossing met water = zoutzuur-opl.
- kunnen in oplossing per molekuul één of meer H+ (H3O+) afstaan.
- de oplossing van een zuur heeft een pH tss. O en 7.
- de formule van een zuur begint met een H.
- zure oplossingen geven een typische kleur met zuur-base indicatoren bv. : kleuren lakmoespapier rood.
-Binaire zuren (=hydrozuren) bevatten geen zuurstof. De corresponderende zuurrest krijgt de uitgang “ide”.
Ze bestaan uit twee soorten atomen, nl. één of meer waterstofatomen en een zuurrest zonder zuurstofatomen.
Formule en benaming:
Waterstof wordt eerst geschreven, gevolgd door de zuurrest. In de naam onderscheidt men drie delen: waterstof + de stam van de Latijnse naam van het tweede element + de uitgang -ide.
Geen Griekse telwoorden; Geen Stocknotatie !
HF waterstoffluoride F - fluoride
HCl waterstofchloride of zoutzuur Cl - chloride
HBr waterstofbromide Br - bromide
HI waterstofjodide I - jodide
H2S waterstofsulfide S 2- sulfide
Ternaire zuren of oxozuren bevatten naast een centraal element ook zuurstofatomen. De meeste oxozuren en hun anionen hebben triviale namen. De corresponderende zuurrest krijgt de uitgang “aat”.
Of anders gezegd ze bestaan dus uit drie atoomsoorten: één of meer waterstofatomen en een zuurrest die zuurstofatomen bevat.
Ze worden gevormd uit de oxiden van niet-metalen en water = ‘zure’ oxiden + H2O
Vb. : H2O + CO2 → H2CO3 (CO2 is zuurvormend oxide)
+ N2O5→ 2 HNO3
+ SO3 → H2SO4
Opmerking : om te weten welk zuur gevormd wordt uit een niet-metaaloxide dient men oxidatiegetal van het niet-metaal te onderzoeken. Zowel in het oxide als in het overeenkomstige zuur komt het niet-metaal voor met hetzelfde oxidatiegetal.
Vb. : SO3 → S = +6 en H2SO4 → S = +6
Formule en benaming:
Men schrijft eerst de waterstofatomen gevolgd door de zuurrest (= niet metallisch ; = polyatomisch anion)
Geen Griekse telwoorden ; Geen Stocknotatie !
Men onderscheidt hier drie soorten benamingen:
- *de gebruikelijke (of triviale): deze is weinig of niet systematisch (men moet ze uit het hoofd leren).
-de rationele: deze is zeer systematisch en klinkt nogal ongewoon; biedt het voordeel dat men er de moleculeformule kan uit afleiden; wordt in de chemische literatuur meer en meer gebruikt. (niet te kennen)
-*de pseudo-binaire: is tamelijk systematisch en wordt veel gebruikt.
(*is te kennen)
HNO2
HNO3
Gebruikelijke
Pseudo-binaire
*Rationele
salpeterigzuur salpeterzuur
H2SO4 zwavelzuur
H2CO3 koolzuur
H2SO3 zwaveligzuur
HClO3 chloorzuur
HClO2 chlorigzuur
HClO hypochlorigzuur
H3PO4
H3PO3
H2CrO4
H2Cr2O7
Fosforzuur
Fosforigzuur
Chroomzuur
Dichroomzuur
* Niet te kennen
Waterstofnitriet
waterstofnitraat Waterstof-dioxosulfaat(III)
waterstof-trioxonitraat-(V)
Waterstofsulfaat diwaterstof-tetraoxosulfaat-(VI)
Waterstofcarbonaat diwaterstof-trioxocarbonaat-(IV)
Waterstofsulfiet diwaterstof-trioxosulfaat-(IV)
Waterstofchloraat waterstof-trioxochloraat-(V)
Waterstofchloriet waterstof-dioxochloraat-(III)
waterstofhypochloriet waterstof-oxochloraat-(I)
Waterstoffosfaat
waterstoffosfiet
waterstofchromaat
waterstofdichromaat
triwaterstof-tetraoxofosfaat-(V) triwaterstof-trioxofosfaat-(III)
diwaterstoftetraoxochromaat(IV) ///
Het Romeinse cijfer op het einde van de systematische naam is de oxidatietrap (O.T.) = OG van het niet-metaal.
Bijkomend :
Een aantal van bovenstaande oxozuren komen ook voor met één atoom zuurstof minder in hun zuurrest. Een dergelijk oxozuur wordt benoemt als "igzuur" en de corresponderende zuurrest krijgt de uitgang "iet".
HClO2 chlorigzuur ClO2 - chloriet-ion
H2SO3 zwaveligzuur SO3 2- sulfiet-ion
HNO2 salpeterigzuur NO2 - nitriet-ion
H3PO3 fosforigzuur PO3 3- fosfiet-ion
Fosforigzuur
Te kennen !
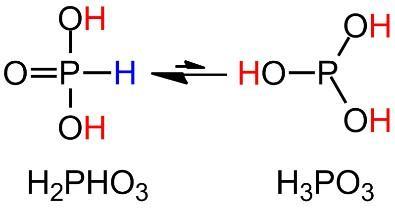
Fosforigzuur (H3PO3) is in principe het minder voorkomend tautomeer van fosfonzuur (H2PHO3) waarbij er één waterstofatoom rechtstreeks op het fosforatoom gebonden is.
Het voorvoegsels "per" wordt gebruikt om aan te duiden dat het zuur in zijn zuurrest één atoom zuurstof meer heeft dan het oxozuur.
HMnO4 permangaanzuur MnO4 - permanganaat-ion
HClO4 perchloorzuur ClO4 - perchloraat-ion
Te kennen !
Het voorvoegsels "hypo" wordt gebruikt om aan te duiden dat het zuur in zijn zuurrest één atoom zuurstof minder heeft dan het igzuur.
HClO hypochlorigzuur ClO - hypochloriet-ion
Te kennen !
Polyprotische zuren (=meerwaardige zuren) bevatten meerdere afsplitsbare waterstofatomen. Indien de zuurrest nog waterstofatomen bevat, plaatst men het woord "waterstof' voor de naam van het anion.
HS - waterstofsulfide-ion
HCO3 - waterstofcarbonaat-ion of bicarbonaat-ion
HPO4 2- monowaterstoffosfaat-ion
H2PO4 - diwaterstoffosfaat-ion
Te kennen !
Sommige zuren kan men opvatten als condensatieproducten van 2 overeenkomstige monozuren met verlies van water. Deze polyzuren krijgen de naam van het monozuur, voorafgegaan door een het voorvoegsel ‘di’.
zuur naam anion naam
H2SO4 zwavelzuur
H2S2O7 dizwavelzuur
H2SO3 zwaveligzuur
H2S2O5 dizwaveligzuur
H2CrO4 chroomzuur
H2Cr2O7 dichroomzuur
H3PO4 fosforzuur
*H4P2O7 difosforzuur (pyrofosforzuur)
* Niet kennen
-Thiozuren
SO4 2- sulfaat
S2O7 2- disulfaat(2-)
SO3 2- sulfiet
S2O5 2- disulfiet(2-)
CrO4 2- chromaat
Cr2O7 2- dichromaat(2-)
PO4 3- fosfaat
*P2O7 4- difosfaat(4-)
Andere zuren (en hun anionen) kan men opvatten als zijnde afgeleid van een oxozuur waarvan één of meerdere zuurstofatomen vervangen zijn door zwavel. Zulke zuren noemt men thiozuren.
Te kennen !
zuur naam anion naam
HSCN thiocyaanzuur
H2S2O3 thiozwavelzuur
SCN- thiocyanaat
S2O3 2- thiosulfaat
j.Basen
De best bekende basen zijn de hydroxidebasen: in water kunnen ze OH- -ionen afsplitsen.
NaOH → Na+ + OH-
Het hydroxide-ion (OH-) draagt een negatieve lading en is bijgevolg geschikt om een waterstofion of proton (H+) op te nemen van een protonendonor.
Basen worden gevormd uit basevormende oxiden met water :
Na2O + H2O → 2 NaOH ( met Na2O = basische oxide).
CaO + " → Ca(OH)2
Eigenschappen van basen :
- basen zijn vaste stoffen met uitz. van ammonia = NH4OH-oplossing = NH3-gas opgelost in water.
- de meeste zijn moeilijk oplosbaar in water. Goed oplosbaar zijn : NaOH, KOH, Ca(OH)2,...
- basen zijn verbindingen die OH- -ionen kunnen afsplitsen.
- basen geven eveneens een typische kleurreactie met zuurbase indicatoren bv. ze kleuren lakmoespapier blauw.
- de oplossing van een base heeft een pH tussen 7 en 14.
- de formule van een base eindigt op OH, met uitz. van aminebasen (bv. NH3).
Men onderscheidt gewoonlijk de volgende soorten basen :
-Hydroxidebasen
Ze bestaan uit een metaalkation en één of meerdere OH- -ionen.
Formule en benaming:
Men schrijft eerst het metaalkation gevolgd door de hydroxide.
De benaming bestaat uit de naam van het metaal gevolgd door hydroxide. Het metaal wordt gevolgd door zijn O.T., indien het meerdere oxidatietrappen kan bezitten (=Stocknotatie) oftewel kan men ook gebruik maken van Griekse telwoorden.
Voorbeelden :
Brutoformule Naam
Stocknotatie
NaOH natriumhydroxide Niet mogelijk ! Na heeft slechts 1 OG.
CuOH koperhydroxide Koper(I)hydroxide
Cu(OH)2 koperdihydroxide Koper(II)hydroxide
- Aminebasen
Ze bevatten een stikstofatoom dat door de beschikbaarheid van een elektronenpaar in de mogelijkheid is een proton op te nemen (zie het ammoniumion in de bespreking van de datief covalente binding (later)).
Base = protonacceptor (theorie Van Brönsted)
Benaming NH3: ammoniak of triwaterstofnitride * → ‘gas’
*niet te kennen
k. Zouten
-Een (normaal) zout bevat de zuurrest van het zuur en de baserest (metaalkation) van de base :
MmZn waarbij
M : symbool van het metaal
m : aantal aanwezige metaalatomen
Z : zuurrest
n : aantal aanwezige zuurresten
Voorbeelden:
NaCl uit Na[(OH)] + [H]Cl
Na2SO4 uit 2 Na[(OH)] + [H2]SO4
Na2CO3 uit 2 Na[(OH)] + [H2]CO3
Zouten ontstaan door :
* door neutralisatie van een zuur met een base : zuur + base → zout + water
Bv. : HCl + NaOH → NaCl + H2O
* reactie van een metaaloxide en een niet-metaaloxide :
Bv. : CaO + CO2 → CaCO3
* reactie van watervrije ammoniak en watervrij zuur :
Bv. : NH3 + HCl → NH4Cl
* een (onedel) metaal en een (sterk) zuur :
Bv. : Zn + HCl → ZnCl2 + H2
Formule en benaming:
Eerst de baserest, vervolgens de zuurrest. De benaming is gebaseerd op de benaming (pseudobinair of rationeel *) van het overeenstemmende zuur waarbij de naam waterstof vervangen wordt door de naam van de baserest. Indien de baserest (=metaalkation) in meerdere oxidatiestaten kan voorkomen wordt het oxidatiegetal aangegeven met een Romeins cijfer tussen haakjes (notatie volgens Stock) oftewel kan ook gebruik gemaakt worden van Griekse telwoorden .
*Niet te kennen.
Voorbeelden:
KCl kaliumchloride ( is afgeleid van een binair zuur : geen Stocknotie ; geen Griekse telwoorden. Kalium heeft slechts één OG)
Na2SO4 natriumsulfaat of (di)natrium-tetraoxosulfaat (VI)*
Ca3(PO4)2 calciumfosfaat of (tri)calciumtetraoxofosfaat (V)*
Hg(NO3)2 kwik(II)nitraat of kwikdinitraat of kwik(II)-trioxonitraat (V)*
KClO kaliumhypochloriet of kalium-oxochloraat (I)*
*Niet te kennen.
-Zuurzouten (=waterstofzouten) bevatten nog vervangbare H-atomen in het zout.
Zuurzouten waarbij slechts één H-atoom van het zuur vervangen wordt door een metaal noemt men soms primaire zouten.
Zuurzouten gevormd door het vervangen van twee waterstofatomen van het zuur = secundaire zouten.
Zuurzouten gevormd “ “ drie “ “ = tertiaire zouten.
Voorbeelden:
NaHCO3 : natriumwaterstofcarbonaat (natriumbicarbonaat)
NaHSO4 : natriumwaterstofsulfaat
Na3PO4 : tertiair natriumfosfaat of natriumfosfaat
-Dubbelzouten
In dubbelzouten zijn alle H-atomen vervangen door verschillende metalen.
Benaming : in dubbelzouten noemt men eerst de kationen, dan de anionen, telkens in alfabetische volgorde met uitzondering van waterstof. Het woord waterstof wordt steeds als laatste onder de kationen gerangschikt. De rangschikking kan in formules en in namen verschillend zijn. Hydraatwater wordt het laatst genoemd.
De aanduiding van het aantal ionen met Griekse telwoorden of het Stock-getal mag weggelaten worden als er geen verwarring mogelijk is.
KMgF3 kaliummagnesiumfluoride
KNaCO3 kaliumnatriumcarbonaat
MgNH4PO4.6H2O ammoniummagnesiumfosfaat-hexahydraat
Ca5F(PO4)3 calciumfluoridetrifosfaat
Cu2CO3(OH)2 kkoper(II)carbonaatdihydroxide3
3 Voor dergelijke basische zouten plaatste men vroeger het woord basisch vooraf (bvb. Basisch kopercarbonaat).
-Gehydrateerde zouten=hydraten
Bij het uitkristalliseren van zouten, kunnen deze water in het kristalrooster (ionenrooster) opnemen. Dit noemen we hydraatwater (=kristalwater). Op deze manier ontstaan zouten van het type MZ . x H2O = gehydrateerde zouten = hydraten.
De hoeveelheid opgenomen hydraatwater is uiteraard afhankelijk van het soort zout en van de voor handen zijnde uitkristallisatiemogelijkheden.
Vele zouten kunnen zelfs meerdere hydraten vormen. Van Na2CO3 (natriumcarbonaat) kennen we bv. naast het watervrije product de volgende hydraten :
- Na2CO3. H2O natriumcarbonaat monohydraat
- Na2CO3. 7H2O " heptahydraat
- Na2CO3.10H2O " decahydraat.
Het opgenomen water kan vaak aan het zout onttrokken worden door het boven het kookpunt van water te doen gloeien, waardoor het kristal uit elkaar valt. Hieruit kan de procentuele samenstelling aan hydraatwater bepaald worden : mhydraatwater.
% hydraatwater = X 100% m = massa in g mgehydrateerde zout.
Is verder de M.M. (=molaire massa in g/mol) van het gedehydrateerde zout gekend, dan kan hieruit de waarde van x=hydratatiegetal berekend worden :
M.M.gedehydrateerd zout X massa hydraatwater
x =
M.M.water X massa gedehydrateerde zout
Of x = aantal mol hydraatwater/ aantal mol gedehydrateerd zout
x= onbenoemd en wordt afgerond tot op een geheel getal.
Gebeurt het waterverlies gewoon aan de lucht dan spreekt men van verweren. Bv. Na2CO3.10H20
l.Complexen = coördinatieverbindingen.
Een complex is een verbinding opgebouwd uit een centraal metaalatoom of centraal metaalion dat wordt omringd door neutrale moleculen (dikwijls: H2O, NH3) of negatief geladen ionen :
(M(ligand)ligandgetal)totale lading
Het centraal atoom of ion is steeds een transitiemetaal.
De omringende moleculen of ionen worden liganden genoemd.
Het aantal liganden waaruit de complexe verbinding is opgebouwd wordt gedefinieerd als het coördinatiegetal (=ligandgetal) n. Dit bedraagt doorgaans 2 of 4 of 6.
Het complex is neutraal of geladen (positief of negatief); de lading van het complex = lading van het metaal + som van de lading van alle liganden.
Voorbeelden:
[Ag( ]+ 2 Ag+ NH3
[Ni( ]2- 4 Ni2+ CN-
[Cr 6 H2O
Nomenclatuur :
Voor de naamgeving van complexen wordt gesteund op onderstaande regels:
1. Maakt het complex deel uit van een zout, dan wordt het eerst kation genoemd en vervolgens het anion (zie ook naamgeving zouten). Alles wordt hierbij aan elkaar geschreven.
Voorbeeld:
K3[Fe(CN)6]: kaliumhexacyanoferraat (III)
kation anion : metaalcomplex : Fe3+ (metaalion)
CN- (ligand)
a. In de naamgeving van het complex deel worden eerst de liganden benoemd en vervolgens het metaalatoom (of metaalion). Alles wordt hierbij aan elkaar geschreven.
De naam van een negatief geladen ligand krijgt steeds de uitgang ‘o’ .
Onderstaande tabel geeft de naamgeving van enkele negatieve en neutrale liganden weer.
Formule
Ion
Ligand
F- Fluoride fluoro
Cl- Chloride chloro
Br- Bromide bromo
I- Jodide jodo
O2- Oxide oxo
H- Hydride hydrido of hydro*
OH- hydroxide hydroxo
O2 2- Peroxide peroxo**
HO2 - waterstofperoxide waterstofperoxo
S2- Sulfide thio
S2 2- Disulfide disulfido
HS- waterstofsulfide waterstofsulfido of mercapto
CO3 2- carbonaat carbonato
SO4 2- Sulfaat sulfato
O-NO2 - Nitraat nitrato
N-O2 Nitriet nitro (binding via N)
ONO- Nitriet nitrito (binding via O)
N-N2 - Azide azido of nitrido
CN- Cyanide cyano
CH3O- methoxide of methanolaat methoxo** of methanolato
CH3S- methaanthiolaat methylthio
CH3COO- Acetaat acetato
CH3OSOO- methylsulfiet methylsulfieto
(CH3)2N- dimethylamide dimethylamido
CH3CONH- aceetamide aceetamido
CO - carbonyl
H2O - aqua
NH3 - ammine
* Naast hydrido wordt soms ook hydro gebruikt om H- in coördinatieverbindingen. Hydro dient eigenlijk tot boorverbindingen beperkt te blijven.
** In de organische nomenclatuur worden de namen peroxy en methoxy gebruikt. Dit is echter niet toegestaan in de anorganische nomenclatuur.
Linkage-isomeren van coördinatieverbindingen: dit zijn stuctuurisomeren die een ligand bezitten dat op verschillende manieren (met telkens andere donoratomen) kan gebonden zijn aan het metaalion.
Voorbeelden:
[Co(NH3)5(NO2)]Cl2: hierbij bindt het vetgedrukte ligand via stikstof (nitroverbinding)
[Co(NH3)5(ONO)]Cl2: hierbij bindt het vetgedrukte ligand via zuurstof (nitritoverbinding)
SCN- : thiocyanato (binding via S) ; isothiocyanato (binding via N)
thiocyanato S-CN
isothiocyanato N=C=S
Neutrale liganden : H2O (aqua) ; NH3 (ammine) en CO (carbonyl)
b. Indien het complex bestaat uit meer dan 1 ligand, dan wordt het aantal van elk ligandtype weergegeven door het prefix: di (2), tetra (4) of hexa (6). Indien verwarring mogelijk is gebruikt men -bis(ligand);-tris,… De liganden worden geschreven in alfabetische volgorde; er wordt hierbij GEEN rekening gehouden met het prefix! Ook bij het schrijven van de chemische formule worden de verschillende liganden in alfabetische volgorde genoteerd.
Voorbeelden van complexen in zoutvorm :
K4Fe(CN)6 kaliumhexacyanoferraat(II)
K3Fe(CN)6 kaliumhexacyanoferraat(III)
[Co(NH3)5Cl]Cl2 penta-amminechlorokobalt(III)chloride
[Fe(en)2(NO2)2]SO4 bis(ethyleendiamine)dinitroijzer(III)sulfaat
Na2[Au(CN)3F2] natriumtricyanodifluoroauraat(III)
[Pt(CO)3H2O]Br2 aquatricarbonylplatina(II)bromide
c. Is het complex negatief geladen, dan krijgt de naam van het centraal metaalatoom/ion op de ‘aat’ uitgang.
Metaal ‘ -aat’-naam
titaan titanaat
vanadium vanadaat chroom chromaat
mangaan manganaat
ijzer ferraat
kobalt kobaltaat
nikkel nikkelaat
koper cupraat
zink zinkaat
zilver argentaat goud auraat
kwik mercuraat
tin stannaat lood plumbaat
d. Bestaat het complex uit een centraal metaalion dan eindigt zijn naam steeds met de lading van het ion. Dit wordt weergegeven met een Romeins cijfer, geschreven tussen ronde haakjes.
Voorbeelden van metaalcomplexe ionen :
[Cr(H2O)6]3+
[Co(NH3)6]3+
[Co(NH3)5NO2]2+
[Co(NO2)6]3-
(PtCl6)2-
[Fe(CN)6]4-
[Fe(CN)6]3-
[Pt(NH3)4Cl2]2+
BH4 -
Bemerk :
hexaaquachroom (III) -ion
hexaamminekobalt (III) -ion
pentaamminenitrokobalt (III) -ion
hexanitrokobaltaat (III) -ion
hexachloroplatinaat (IV) -ion
hexacyanoferraat (II) -ion
hexacyanoferraat (III) -ion
tetraamminedichloroplatina (IV) -ion
tetrahydridoboraat (III) -ion
-uitgang -AAT : voor een negatief geladen complex.
-vermelding ‘ion’ voor metaalcomplexe ionen.
2. De waterstofverbindingen afgeleid van de complexe anionen kunnen beschouwd worden als zuren en de naamvorming kan dan bestaan uit de naam van het anion gevolgd door het woord zuur. Bij voorkeur echter gebruikt men de naam alsof het om een verbinding van waterstof gaat:
H2PtCl6 waterstofhexachloroplatinaat (IV)
H4Fe(CN)6 waterstofhexacyanoferraat (II)
m. Empirische namen/handelsnamen.
Vele anorganische reagentia dragen empirische of handelsnamen die, mits zonder wetenschappelijke implicaties, alleen toegestaan zijn in populaire en industriële literatuur.
esprit de sel
zoutzuur HCl
bruinsteen
chilisalpeter
ongebluste kalk
gebluste kalk
2 kalk
3 maagzout (bakpoeder)
2
3
3
Engels zout* MgSO4.7H2O soda Na2CO3
hamerslag* Fe3O4 bijtende soda
potas K2CO3 vitriool H2SO4
*ter informatie, niet te kennen
n. Engelstalige benamingen. (te kennen)
O. Overzicht naamgeving anorganische verbindingen met uitz. van complexen.
Theoretische Opgaven.
1) Voor ouderdomsbepaling wordt gebruikt gemaakt van koolstofdatering. Hierbij wordt gebruikt gemaakt van het C-isotoop, 14C. Voor dit isotoop: bereken het aantal protonen, neutronen en elektronen.
2)Welk element bevindt zich in de 3de periode en de 2de groep, volgens de klassieke nummering in het PS. Indien dit element voorkomt als ion, wat is zijn lading ?
3)Tot welke groep en periode behoort het chlooratoom ? Hoe noemt men deze groep ? Hoeveel valentie elektronen bevat dit atoom ? Hoeveel elektronenschillen bevat dit atoom ? Hoeveel elektronen bevat een chloride ion en wat is de lading van dit ion ?
4) Geef de p.e.n.-formule voor het oxide ion ?
5)Welk atoom of ion bezit 56 protonen en 54 elektronen ?
6)Hoeveel elektronen bezit het ion met 24 protonen, 31 neutronen en een lading +7 ?
7)Zilver komt in de natuur voor onder 2 isotopen 107Ag met een nuclidenmassa van 106,906 en 109Ag met een nuclidenmassa 108,905. De atoommassa van Ag is 107,868. Wat is de abundantie van beide isotopen in natuurlijk Ag ?
8)Welk alkalimetaal bevindt zich in de periode van jood (jodium) ?
9)Wat is het element, uit de periode van magnesium, waarvan 2 atomen een zout vormen met magnesium. Geef tevens de brutoformule en de IUPAC naam van dit zout.
10) Bereken de RMM (tot op 2 decimalen) van MgSO4 . 7H2O
11) Zeg van volgende stoffen of het gaat om een samengestelde of een enkelvoudige zuivere stof : Na2S , Na2CO3 , N2 , Fe2O3 en He . Geef tevens de correcte benaming. (indien meerdere benamingen mogelijk, geef je alle mogelijkheden die gekend moeten zijn).
12) Geef de verbindingsklasse van volgende anorganische producten : Na2O, kaliumsulfaat , waterstofsulfaat , bijtende soda, calciumhydroxide, zoutzuur, calciumcarbonaat, natriumhypochloriet, H2O2, waterstofnitriet, ammonia, koper(II)sulfaat pentahydraat, azijnzuur, bruinsteen, natriumwaterstoffosfaat, [Cr(H2O)6]3+ , ammoniumdiwaterstoffosfaat en [PtCl2(NH3)2].
13) Geef de naam en chemische formule van alle mogelijke zouten die gevormd kunnen worden tussen de opgegeven kationen en de zuurresten van de gegeven zuren.
- Ca2+ en H2SO4
- Ammonium en azijnzuur (=organisch zuur)
- kalium- ion en zwaveligzuur
14)Bepaal het OG van elk atoom in onderstaande verbindingen en geef tevens de brutoformule van deze verbindingen.
-lood(IV)sulfide -salpeterzuur -natriumwaterstofsulfaat -kaliumdichromaat -bariumperoxide -broom -nitraat-ion -chloorgas -distikstofpentoxide
15) Meerkeuzevragen :
15.1 Welke bewering is juist ? Isotopen bezitten :
a)dezelfde atoomnummers en dezelfde atoommassa’s b)dezelfde atoomnummers en verschillende atoommassa’s c)verschillende atoomnummers en verschillende atoommassa’s d)verschillende atoomnummers en dezelfde atoommassa’s
15.2 Welke bewering is juist ? De RMM bedraagt
a) 15 voor ammoniak
b) 18 voor waterstofperoxide
c) 30 voor koolstofmonoxide
d) 98 voor zwavelzuur
15.3 Welke van de onderstaande verschijnselen betreft een chemische reactie ?
a) het condenseren van waterdamp.
b) het sublimeren van dijood
c) het bleken van textiel
d) het verdampen van vloeibare lucht.
15.4 Kaliumaluminiumsulfaat is een dubbelzout met drie ion soorten, twee positieve monoatomische en één negatief polyatomisch. Wat is de juiste formule van dit dubbelzout?
a) K3AlSO4
b) K3Al(SO4)2
c) KAl(SO4)2
d) KAlSO4
15.5 Bij welk ion is het aantal elektronen VERSCHILLEND van het aantal neutronen?
a) 14N3-
b) 34S2-
c) 3H-
d) 18O2-
Geef tevens de naam van het ion.
16) Bekijk de onderstaande 3 figuren van molecuulmodellen.
Schrijf voor elk figuur op:
a)Het aantal moleculen, met molecuulformules.
b)De namen van de stoffen.
c)Of het een zuivere stof is of een mengsel.
d)Of er één of meer ontleedbare of niet-ontleedbare stoffen aanwezig zijn.
Fig. 1
Fig. 2
3
17)Welke van de volgende elementen vormen gemakkelijk positieve en welke negatieve ionen en waarom? H, Be, B, F, S, Na, N, K, Al.
18) Lees het onderstaande tekstfragment.
Laser zet radioactief afval om Onderzoekers van het Rutherford Appleton Laboratory (Engeland) zijn erin geslaagd om met een grote laser ongeveer een miljoen atomen van jood-129 om te zetten in jood-128. Jood-129 is één van de radioactieve atoomsoorten die ontstaan bij het verbranden van uranium in een kernreactor. Het voordeel van de omzetting van jood-129 in jood-128 is de veel kortere halveringstijd van jood-128: al na 25 minuten heeft de helft van de jood-128 atomen z’n radioactiviteit verloren, terwijl dit bij jood-129 maar liefst 15,7 miljoen jaar duurt. naar: Technisch Weekblad
Fig.
Gevr. :
-Hoeveel protonen en hoeveel elektronen bevat een atoom jood-129? :
-Welke soort deeltjes zijn door de onderzoekers verwijderd met een laser ?
-Jood-129 is één van de producten die ontstaan bij het ‘verbranden van uranium’. Leg uit dat jood-129 geen verbrandingsproduct van uranium kan zijn.
19) Bij zeer lage temperatuur zijn de volgende stoffen allemaal vaste stoffen: natriumbromide, butaan, aluminium, methaan, bariumfluoride, zink en broom.
Gevr. :
-Geef de brutoformule van deze stoffen.
-In welk rooster (molecuul-)/ion-/metaalrooster) kristalliseren deze stoffen uit ?
-Welke van deze stoffen kunnen in vaste en vloeibare toestand elektrische stroom geleiden ?
-Welke deeltjes zorgen voor deze elektrische geleiding ?
20) Natriumsulfaat komt watervrij (=anhydrisch) voor en in de vorm van 2 hydraten.
-Wat wordt verstaan onder een hydraat ?
-Geef de brutoformule van de 3 verschijningsvormen. (Opzoeken !)
-Hoeveel bedraagt het hydratatiegetal bij beide hydraten ?
-Bereken het % hydraatwater in beide hydraten.
21) Geef van onderstaand metaalcomplexen in een tabel :
-het ligandgetal
-het centraal atoom/ion
-de ligand(en)
-de correcte naam
-het oxidatiegetal van al de aanwezige metalen
[Pt(NH3)4Cl2]2+; K4[Fe(CN)6] ; [CoN3(NH3)5]SO4
22) Geef de correcte brutoformule van de volgende metaalcomplexen :
-kaliumtetrafluorooxochromaat (V)
-tetrathioarsenaat(V)-ion
-hexaaquachroom(III)chloride
-pentaaquahydroxyaluminium(III)-ion
-natriumtetracarbonylkobaltaat(-I)
23) Geef de Engelstalige benaming/brutoformule voor :
-SO3 2-
-HClO
-nitric acid
-bicarbonate
-CH3COO-chlorous acid -peroxide
24) Vervolledig de volgende zinnen. Illustreer dit ook met een reactievergelijking.
a)Een hydroxide reageert met een zuur tot een................. en .....................................
-Reactievergelijking :.....................................................................................................
b)Een metaal (welk?) kan worden omgezet in een zout door een reactie met een...........
-Reactievergelijking :.......................................................................................................
c)Watervrije ammoniak reageert met een watervrij binair zuur tot .............................
-Reactievergelijking :.......................................................................................................
d)Een metaaloxide kan met koolstofdioxide reageren tot een....................................
-Reactievergelijking :.......................................................................................................
e)Een metaaloxide verkrijg je door de thermische ontleding van een...............................
-Reactievergelijking :........................................................................................................
f)Waterstofgas ontsnapt bij de reactie van sommige metalen (welke) met een........
-Reactievergelijking : ...................................................................................................
25) Vervolledig volgende reactievgln. en balanceer .
1 Mg + O2 →
2 Ca(OH)2 (thermische ontbinding) →
3 CuO + H2SO4 →
4 CaO + CO2 →
5 P2O5 + 3 H2O →
6 CaO + H2O →
7 Ca(OH)2 + HCl →
8 H2SO4 + CuO →
9 HCl + Zn →
10 MgO + HClO →