
01
side 16
Kreft, fysisk aktivitet og Pusterom
side 22
Fagmøtet på Lillehammer 2023
side 12
Levermetastaser – moderne behandling og bedre overlevelse
NSFs FAGGRUPPE AV SYKEPLEIERE I GASTROENTEROLOGI
2023
Fagtidsskrift for sykepleiere innen gastroenterologi Årgang 36

BESØK VÅR NYE HJEMMESIDE FOR PASIENTER MED ALLERGISK SPISERØRSBETENNELSE Skann QR-koden med kameraet på din mobil for å komme direkte til spiserørsbetennelse.com www.spiserørsbetennelse.com NO-NA-2200001 202201
UTGIVER:
NORSK SYKEPLEIERFORBUND, FAGGRUPPE AV SYKEPLEIERE I GASTROENTEROLOGI

FORRETNINGSADRESSE:
Tollbugata 22 0152 Oslo
ANSVARLIGE REDAKTØRER 2023-2025: Dag Olav Langeland gastroskopblad@gmail.com dagolavl@gmail.com
Tlf 46 66 96 96
Roy Cato Solheim rocasol@gmail.com
Tlf 99 54 80 03
REDAKSJONSKOMITÉ 2021-2023: Rebecca Jane Foreman rebeccajaneforeman@outlook.com
Tlf 93 83 60 31
Åshild Torgersen aashildtorgersen@lyse.net
Tlf 93 08 17 63
Maren Josefine Kvarsnes marenjosefine@hotmail.com
Tlf 99 50 30 63
Tone Mangerøy tonemangeroy@gmail.com
Tlf 95 06 93 50
Ingvild Johansen Grønhaug ingvildgronhaug@gmail.com
Tlf 90 74 74 32
Une Melby Hauge une_hauge@hotmail.com
Tlf 47 29 63 89
STYRETS SAMMENSETNING NSF/FSG 2023-2025:
Leder: Julie Hellan ledernsffsg@gmail.com
Tlf 40 28 37 94
Nestleder: Therese Rusten nestledernsffsg@gmail.com
Tlf 99 77 49 81
Nytt fra gastromiljøet
Valg under faggruppens generalforsamling 2023
Fagmøtet på Lillehammer 20232

Kurs/møter, NSF/FSG, Støttefond Oversikt kurs og kongresser 2023
NSF/FSG faggruppe av sykepleiere
Sekretær/Webansvarlig: Caroline Dille Båtnes sekretarnsffsg@gmail.com
Tlf 90939858
Kasserer: Sonja Margrethe Eriksen kasserernsffsg@gmail.com
Tlf 93674752
Programansvarlige: Merethe Lie Seglem programkomiteenfsg@gmail.com
Tlf 40 45 27 73
Marte Eide Jahnsen programkomiteenfsg@gmail.com
Tlf 91 76 64 26
Vararepresentanter: Kristin Kirkestuen kristin_b77@hotmail.com
Tlf 95 42 15 19
Liss Anita Tollefsen lissanita0@gmail.com
Tlf 90 17 38 10
MATERIELLFRISTER FOR REDAKSJONELT INNHOLD 2023:
Nr 2 – 2023 12/5
Nr 3 – 2023 27/10
MATERIELLFRISTER FOR ANNONSER 2023:
Nr 2 – 2023 19/5
Nr 3 – 2023 3/11
UTGIVELSESPLAN 2023:
Nr 2 – 2023 20/6
Nr 3 – 2023 5/12
ANNONSER, LAYOUT OG PRODUKSJON: Apriil Media AS E-post: media@apriil.no
Tlf 98 81 93 48
Innhold 05 07 08 10 12 16 20 22 36 36 22 16 Forsidefoto: Hege Stai Solum Redaktørene har ordet Leder Faglig Et kort historisk blikk på Morbus Crohn Digital egenregistrering for IBD – pasienter Levermetastaser – moderne behandling og bedre overlevelse
fysisk aktivitet
Pusterom
Kreft,
og
12
Mini ONE® gastrostomiport






Sikre koblinger på mellomstykkene, både ENFIT og HYBRID
Mellomstykke med vinklet kobling og y-port HYBRID
Bolus med enkelt endestykke
Wedel Jarlbergsvei 31, 1358 Jar
Tlf. 22 72 03, post@kvinto.no
www.kvinto.no
Mellomstykke med vinklet kobling og y-port

LaLy Walldesign
Redaksjonskomiteen
2021-2023
Hei alle sammen
Nå har vi akkurat tilbakelagt et vellykket og etterlengtet Nasjonalt Fagmøte på Lillehammer. Der var det mange entusiastiske og glade folk fra hele det store gastromiljøet i Norge. Et variert og godt sammensatt faglig program trakk til seg et rekordstort oppmøte av sykepleiere. Det er ingen tvil om at behovet for å møtes, og snakke sammen ansikt til ansikt i en slik sosial setting, ble benyttet i aller høyeste grad. Under middagene begge kveldene var det nesten ikke ørens lyd i lokalet. Det lover godt for fremtiden, når det er så mange engasjerte folk i samme miljø. I dette bladet kan dere som ikke hadde anledning til å delta på fagmøtet, lese referat derfra og likevel få et innblikk i noen av de gode foredragene disse tre dagene.
I fagartiklene denne gang kan dere lese om den historiske utviklingen til sykdommen Morbus Crohn. Deretter om dagens moderne tilnærming, hvor digitalisering har en viktig rolle i oppfølgingen av IBD-pasientene. Det er også en artikkel om levermetastaser, som tidligere var en diagnose med svært dårlig prognose og få behandlingsmuligheter, men som i dag har flere moderne behandlingsformer som gir bedre overlevelse. Fysisk aktivitet kan gi et «pusterom» for folk med kreft, dette er treningsrom som kan bidra til økt livskvalitet.

På Lillehammer ble det avholdt generalforsamling med valg i faggruppen. Resultatet av valget er presentert under Nytt fra fagmiljøet. For vår del er dette det siste bladet og vi vil takke alle som har bidratt. En spesiell takk til alle dere i redaksjonskomiteen, det har vært en fryd å samarbeide med dere! Takk også til styret, vi er glade for at dere har holdt trådene i en krevende tid uten naturlige møtepunkter. Nå overlates stafettpinnen til Bergen, og vi ønsker alle lykke til!





Takk for oss
Kirsti og Hege
 Redaktører 2021-2023 Kirsti Pleym Schumacher og Hege Stai Solum
Maren Josefine Kvarsnes IBD-poliklinikk og medisinsk sengepost, Lovisenberg Diakonale sykehus
Une Melby Hauge Medisinsk poliklinikk, Notodden sykehus
Tone Mangerøy Medisin 1 vest, Haukeland universitetssykehus
Rebecca Jane Foreman Gastromedisinsk poliklinikk, Stavanger universitetssykehus
Åshild Torgersen Gastrokirurgisk poliklinikk, Stavanger universitetssykehus
Redaktører 2021-2023 Kirsti Pleym Schumacher og Hege Stai Solum
Maren Josefine Kvarsnes IBD-poliklinikk og medisinsk sengepost, Lovisenberg Diakonale sykehus
Une Melby Hauge Medisinsk poliklinikk, Notodden sykehus
Tone Mangerøy Medisin 1 vest, Haukeland universitetssykehus
Rebecca Jane Foreman Gastromedisinsk poliklinikk, Stavanger universitetssykehus
Åshild Torgersen Gastrokirurgisk poliklinikk, Stavanger universitetssykehus
5 Redaktørene GASTROSKOPET • 1/2023
Ingvild Johansen Grønhaug Medisinsk undersøkelse, Haukeland
Endotech



For mer informasjon kontakt oss på endotech@endotech.no eller besøk vår nettside www.endotech.no
SHOW Short wire system fra Micro-tech
Kjære medlemmer!
Da er snart vinteren på hell, og det nærmer seg vår!
Årets store «happening» «Fagmøte på Lillehammer» ble i år endelig gjennomført i februar, etter 2 år med avlysning. Det var rekordstor påmelding, og vi håper og tror de som deltok fikk godt faglig utbytte og ny inspirasjon til videre arbeid innen gastrofaget. Håper dere som ikke fikk mulighet til å delta også kan ha litt nytte av referatene i denne utgaven av «Gastroskopet». Det var også hyggelige middager og sosiale sammenkomster på kveldene, som ga mulighet til å møte gamle kjente.
Under fagmøtet ble det også gjennomført generalforsamling med valg. Faggruppa drives på frivillig basis, og vi er helt avhengige av at noen ønsker å bidra til faggruppa. Jeg ønsker å takke alle dere som stilte til gjenvalg, dere som nå valgte å tre av, og dere som stilte til valg for første gang. Dere er så viktige for å få faggruppa til å gå rundt!
Det er nå endelig også åpnet for å kunne reise på utenlandskongresser. I starten av mars var faggruppas styre representert på ECCO, sammen med vår norske N-ECCOrepresentant, Hege Sydnes. Hege er også ansvarlig for programmet til «Nasjonalt IBD-sykepleiermøte», som avholdes i september. Vi håper å se mange av dere der.


Faggruppa vil også bli representert ved SADE i Bergen i mai, og ESGENA/UEGW i København i oktober. Husk at dere kan søke kongresstøtte dersom dere ønsker å delta på kongresser.
Avslutningsvis vil jeg rette en stor takk til våre redaktører for fagbladet, Kirsti Schumacher og Hege Stai Solum, som nå gir stafettpinnen videre. Dere har sammen med redaksjonskomiteen gitt oss 4 år med spennende lesestoff og nyttig informasjon gjennom «Gastroskopet».
Ønsker alle våre medlemmer en nydelig vår!
Hilsen
Julie Hellan



 Faggruppeleder NSF/FSG
Faggruppeleder NSF/FSG
Styremedlemmer
Sonja Margrethe Eriksen Kasserer
Merethe Lie Seglem Programkomité
Caroline Dille Båtnes Sekretær
Marte Eide Jahnsen Programkomité
Julie Hellan Styreleder
Leder 7 GASTROSKOPET • 1/2023
Therese Rusten Nestleder
Et kort historisk blikk på Morbus Crohn
I dag er Morbus Crohn en diagnose man ofte møter i det gastromedisinske miljøet. Men når begynte man å anerkjenne sykdommen som en diagnose og hva gjorde man før det? I denne artikkelen vil vi se nærmere på sykdommen Morbus Crohn i den medisinske historien og se på hovedtrekkene i utviklingen frem til i dag.

Oppdagelse og første beskrivelser Mb Crohns ble først anerkjent som en selvstendig sykdom separat fra ulcerøs kolitt i 1932 når Crohn, Ginzburg og Oppenheimer publiserte sin artikkel om det som de kalte «regional ileitt». Selv om det var først etter dette at man begynte å snakke om Crohns sykdom, så har sykdommen blitt beskrevet før dette. Det er ikke tvil om at Crohns sykdom har eksistert lenge før vi var i stand til å forstå og definere den. Det er flere rapporter som passer med Crohns fra tidligere litteratur, om det faktisk var Crohns vil vi aldri få vite. De kliniske og anatomiske beskrivelsene var ofte blandet med komplisert appendisitt, intestinal tumor eller infeksjon (som for eksempel intestinal turberkulose). Medisinske historikere som har gjennomgått gammel litteratur har funnet flere caser som man mistenker kan dreie seg om Crohns sykdom. Blant annet hos kongen av Frankrike, Ludvig den 13. (1601-1643), som ikke er like kjent som sin sønn Ludvig den 14. Ludvig den 13. sin sykehistorie bestod av flere kroniske gastrointestinale problemer, inkludert perianale abcesser, tarmslyng og kronisk diaré. Obduksjonen viste ulcerasjoner i både tynn- og tykktarm med fistler (Bornstein & Steinhagen, 2015).
En av de tidlige beskrivelsene kom fra Wilhelm Fabry (1560-1634), som i 1612 utførte en obduksjon på en gutt som hadde dødd som følge av vedvarende magesmerter og diaré. Under obduksjonen noterte Fabry at det ulcererte cøkumet var kontrahert og invaginert inn i ileum (Kirsner, 2001). Videre ble det beskrevet ulcerasjoner i distale ileum med påfølgende perforasjon, samt ødematøst mesenterium. Crohns sykdom ble beskrevet hos barn i 1830, med de ofte tilhørende komplikasjonene perianale og rektovaginale fistler. Rundt 1889 ble en ung kvinne obdusert, symptombildet bestående av diaré og vekttap. Obduksjonen viste sammenvokste slynger av tarm med kommunikasjon mellom cøkum og den sammenvokste tynntarmen. Den nedre delen av ileum var dilatert og hypertrofisk og ileocøkalklaffen var kontrahert til størrelsen av en svanefjærpenn
(Kirsner, 2001). Kanskje ikke den beskrivelsen man ville brukt i dag for størrelse, men vil tro det er trygt å anta at klaffen var svært trang.
Ved slutten av 1800-tallet og tidlig på 1900-tallet økte interessen for å undersøke anatomisk og mikroskopisk patologi i kirurgiske preparater. Dette ledet til identifikasjon og undersøkelser av ikke-maligne inflammatoriske masser i ileocøkalregionen. Mange store navn innenfor kirurgien, som Billroth, Bassini og Hartmann, refereres å ha beskrevet caser med kronisk fibrotisk eller ulcerativ ileocøkal sykdom, som ofte ble tenkt å være grunnet turberkulose (Bornstein & Steinhagen, 2015). Det er flere eksempler hvor det er beskrevet caser som kan være Crohns, men som ble tolket til å være turberkulose eller andre tilstander. Selv om det er sannsynlig at det kan ha vært Crohns, er det ikke lett å skille fra intestinal turberkulose, selv i dag (Bornstein & Steinhagen, 2015).
Crohn, Ginzburg og Oppenheimer
I 1932 ble artikkelen om «regional ileitt» av Crohn, Ginzburg og Oppenheimer publisert. Fremdeles er det kontroverser rundt bidragene til de forskjellige forfatterne. Ginzburg var kirurg, og fattet interesse for inflammatorisk granulomatøs sykdom i 1925 når han jobbet under dr A.A.Berg. Dr. Berg hadde operert mange pasienter med inflammasjon i tarm helt tilbake til 1920. Ginzburg fikk med seg Oppenheimer som jobbet som assistent på kirurgisk patologi, og sammen undersøkte de retrospektivt alle casene som involverte inflammasjon i tykk- eller tynntarmen. Under disse undersøkelsene fant de en gruppe på tolv pasienter som kun hadde sykdom i terminale ileum og dermed ikke passet inn i en velkjent patologisk prosess. De startet å undersøke denne gruppen nærmere, og søkte hjelp hos patologer. Det var denne gruppen som endte opp i publikasjonen i 1932, da med 14 caser hvor 2 var lagt til av gastroenterologen Burrill B. Crohn (Bornstein & Steinhagen, 2015; Mulder, Noble, Justinich & Duffin, 2014).
Av Tone Mangerøy, sykepleier, Medisin 1 vest, Haukeland universitetssykehus
Tone Mangerøy
GASTROSKOPET • 1/2023 8 FAGLIG
Det er flere kontroverser knyttet til samarbeidet mellom Crohn, Ginzburg og Oppenheimer og fortellingen fra de involverte er ulike. Men i følge Ginzburg startet det når Crohn ønsket å diskutere to pasienter av dr. Berg som han var involvert i. Crohn hadde blitt sendt til Ginzburg, da han aktivt forsket på disse pasientene. Dr. Berg hadde bedt om at Crohn skulle få en kopi av artikkelutkastet. Uten at Ginzburg hadde kjenskap til det, gjennomgikk Crohn artikkelen og presenterte den på et A.M.A. møte i New Orleans i 1932. Crohn fortsatte på artikkelen til Ginzburg og Oppenheimer, og sendte den inn for publikasjon uten å diskutere det videre med dem. Ginzburg mislikte Crohn, trudde at Crohn ønsket å presentere deres forskning som sin egen, og at det var årsaken til at deres navn manglet under presentasjonen i New Orleans. Det ble satt ned en komité for å vurdere om Crohn hadde gjort seg skyldig i akademisk uredelighet etter presentasjonen i New Orleans. Det er ikke tatt vare på noe referat, men ifølge Ginzburg ble hele saken satt til side med lovnad om delt forfatterskap på den endelige artikkelen (Bornstein & Steinhagen, 2015; Mulder et al., 2014).
Crohn selv presenterte saken som at det var han og dr. Berg som hadde drevet studien, men at Berg hadde avslått å være medforfatter. I stedet hadde han foreslått de yngre Ginzburg og Oppenheimer som medforfattere, siden de var involvert i forskning av intesinale granulomer (Bornstein & Steinhagen, 2015).
Etter publikasjonen av artikkelen i 1932 dukket navnet Crohn opp for sykdommen nesten umiddelbart. Crohn var førsteforfatter på artikkelen kun av alfabetiske grunner. De første artiklene som omtaler sykdommen som Crohns ble publisert i 1933, og i 1937 var det satt som sykdomsnavnet i the British Encyclopedia of Medical Practice. Siden er Crohns sykdom blitt akseptert universelt, bortsett fra i Polen hvor sykdommen blir referert til som Lésniowski-Crohns. Det for å hedre den polske kirurgen Lésniowski, som publiserte rapporter om det som trolig var Crohns sykdom i 1903 (Bornstein & Steinhagen, 2015).
Å forstå en ny sykdom (1932-1956)
I løpet av 30- og 50-tallet fant man ut at Crohns ikke bare var lokalisert i terminale ileum, men at det kunne oppstå i hele GI-tractus. Det kom beskrivelser om Crohns i øsofagus, magesekken, duodenum og jejunum. Disse oppdagelsene passet ikke med de opprinnelige navnene «regional ileitt» og «regional enteritt», og favoriserte eponymet Crohns for sykdommen i mangel på et mer presist medisinsk navn. I denne tidsperioden identifiserte man også Crohns hos eldre pasienter opp til 80 år, samt hos barn under 10 år. Skip lesions ble også identifisert i denne perioden av Charles Wells (Mulder et al., 2014).
Crohns ble mer kjent i den allmenne befolkningen når USAs president Dwight D. Eisenhower gjennomgikk operasjon for Crohns i 1956. Han hadde da vært plaget med magesmerter i årevis, men hadde kun nylig blitt diagnostisert med Crohns. Etter å ha hatt vedvarende smerte i nedre høgre kvadrant måtte president Eisenhower akuttopereres om natten grunnet tarmobstruksjon (Mulder et al., 2014). Åpenheten han viste rundt sykdommen gjorde at Crohns gikk fra å være en medisinsk kuriositet til en relativt kjent sykdom (Mulder et al., 2014).
Moderne æra (1957 à)
Etter andre verdenskrig fikk forskningen fart og det ble gjennomført en rekke RCT-studier i forhold til behandling av Crohns, samt studier i forhold til epidemiologien til Crohns. Hugh Evelyn Lockhart-Mummery publiserte i 1960 en artikkel som skilte Crohns i tykktarmen fra ulcerøs kolitt. Til å begynne med møtte tanken om at Crohns sykdom og ulcerøs colitt var to forskjellige sykdommer mye motstand. Selv langt ut i tiåret var det mange leger, inkludert dr. Crohn, som mente at Crohns ikke kunne affisere tykktarmen (Mulder et al., 2014).
Som ved ulcerøs kolitt har forståelsen av Crohns gått igjennom en revolusjon ved hjelp av fremskritt innen immunologi, genetikk og molekylær biologi. Det har ført til at man har fått ny innsikt i både genetiske risikofaktorer samt hjelp til å utvikle nye behandlingsmetoder. Resultatene av studier av genomet i forhold til kobling mot ulike sykdommer har gjort at man har kunnet gruppere pasienter inn i subgrupper med ulike sykdomsfenotyper. På sikt kan kanskje dette gjøre at man vil kunne forutsi hvilke pasienter som vil ha nytte av de ulike behandlingene (Mulder et al., 2014).
Farmakologisk behandling har også gjennomgått store fremskritt. Fra den spede begynnelse med kortikosteroider og fram til dagens biologiske legemidler. I tillegg til fremskritt innen farmakologien, har det også skjedd ting innen andre behandlingsmetoder, som ernæringsbehandling og kirurgi. Ernæringsbehandling har fått en større plass i løpet av de siste 35 årene. Det var først i 1974 at det ble notert at Crohns pasienter ble behandlet for malnutrisjon før kirurgi bedret sykdommen. Det å bruke ernæring som behandling har økt gjennom bruk av tilskudd, enteral ernæring og total parenteral ernæring, spesielt hos barn. Kirurgien har endret seg ved bruk av kikhullskirurgi, og andre minimale invasive teknikker har utviklet seg (Mulder et al., 2014).
Diagnostikken har også bedret seg betraktelig de siste 70 årene med introduksjonen av fiberoptisk koloskopi med biopsier og ileokoloskopi som har revolusjonert diagnostikken innen IBD. I 2001 godkjente FDA kapselendoskopi som gjør det mulig å undersøke hele GI-tractus. Bildediagnostikk har også kommet på banen i dette tidsrommet med både CT og MR som gjør det mulig å se forandringer knyttet til Crohns (Mulder et al., 2014).
Oppsummering
Det har skjedd svært mye siden Crohn’s ble annerkjent som en egen sykdom for 91 år siden. Og enda er det mye som forskes på i verden. Nye behandlinger står på trappene, både farmakologiske og andre.
Kilder
1. Bornstein, J. E. & Steinhagen, R. M. (2015). History of Crohn’s Disease. I A. Fichera & M. K. Krane (Red.), Crohn’s Disease Basic Principles (s. 1-13). Cham: Cham: Springer International Publishing.
2. Kirsner, J. B. (2001). Historical origins of current IBD concepts. World J Gastroenterol, 7 (2), 175-184. https://doi.org/10.3748/wjg.v7.i2.175
3. Mulder, D. J., Noble, A. J., Justinich, C. J. & Duffin, J. M. (2014). A tale of two diseases: The history of inflammatory bowel disease. J Crohns Colitis, 8 (5), 341-348. https://doi.org/10.1016/j.crohns.2013.09.009
GASTROSKOPET • 1/2023 9
Digital egenregistrering for IBD – pasienter
Lise Sveen Nandrup og Charlotte Bredesen har vært med på å innføre Digital egenregistrering hos IBD – pasienter på Bærum sykehus. Denne typen registrering er sikkert ny for noen, mens andre allerede bruker det. Kanskje er det også noen som skal til å innføre det på sin avdeling og som kan få noen nyttige tips. Gastroskopet ved Une Melby Hauge har snakket med Lise og Charlotte om prosessen.
Hva er digital egenregistrering?
Digital hjemmeoppfølging handler om å dreie tjenestene fra fysiske oppmøter på sykehuset til mer brukerstyrt og fleksibel oppfølging av pasientene ved hjelp av teknologiske løsninger. Med denne egenregistreringen får vi som behandlere en systematisk innsamling av pasientrapporterte data som et supplement til andre fysiske og biologiske undersøkelser. Vestre Viken har et samarbeid med CheckWare som tilbyr et system for digital egenregistrering av pasientrapporterte opplysninger.
Inklusjon skjer ved ordinær poliklinisk time og det er hovedsakelig IBD sykepleier som gir opplæring og følger opp egenregistreringen. Pasientene får en SMS-varsling hver fjerde måned med link direkte til symptomregistreringen via en sikker nettportal som har pålogging med bank-id. Systemet er implementert i Dips slik at all kartlegging automatisk blir lagt inn i journalsystemet.
Ved ikke-besvarte registreringer får vi også varsel og kan gjøre en vurdering av om det er behov for tiltak, for eksempel nye blodprøver eller avføringsprøver. IBD sykepleier kontakter pasienten for vurdering og avtale om videre oppfølging.
Hvorfor bør vi bruke dette?
Digital hjemmeoppfølging (DHO) skal bidra til trygge og helhetlige pasientforløp og likeverdige helsetjenester nærmere der pasientene er.
Behandler får umiddelbart inntrykk av pasientens symptomer som kan gi intervensjon så tidlig som mulig, men det er ikke en løsning for situasjoner som trenger øyeblikkelig hjelp. Ved at

symptomregistrering gjøres jevnlig hver fjerde måned får vi god oversikt og sikrer oppfølging av nødvendige prøver.
Hvem skal utføre digital egenregistrering?
Alle IBD-pasienter som er i stand til å håndtere den tekniske løsningen og kan ta stilling til spørsmålene kan inkluderes. Vi har valgt å gi tilbudet til alle våre pasienter med IBD uavhengig av diagnose eller behandling. I tillegg må brukere være i stand til å forstå eget ansvar i oppfølgingen.
På medisinsk poliklinikk har sykepleier og sekretær ansvaret for det administrative med registrering av koding.
Hva er fordelene med digital egenregistrering? Pasientene følges jevnlig og standardisert. Samtidig spares pasientene for unødvendig reisevei og fri fra jobb, skole og andre aktiviteter for å møte på konsultasjoner. Pasientene rapporterer inn sine symptomer og opplevelse av egen tilstand, noe som bidrar til at konsultasjoner i større grad planlegges etter pasientenes behov. Vi unngår unødvendige konsultasjoner som både er en merbelastning for pasientene og er en utfordring for vår kapasitet..
Finnes det noen ulemper?
Vi er fortsatt i startsfasen og det kreves enn så lenge noe mer tid til administrativt arbeid.
Selv om refusjonen sykehuset får fortsatt er bedre ved oppmøte, gir digital egenregistrering nye måter å jobbe smartere på. Administrasjon og kodeverk burde vært enklere og belønnet pasientstyrt oppfølging.
Ved Une Melby Hauge
GASTROSKOPET • 1/2023 10 FAGLIG
Une Melby Hauge
Hvordan gikk dere frem når dere skulle innføre digital egenregistrering?
Seksjonsoverlege utarbeidet egenregistreringsskjema med innspill fra de andre legene og pasientforeningen, og ordnet tillatelser til å bruke allerede kjente skjema. Vi utarbeidet en lokal prosedyre som beskriver inklusjon, opplæring og oppfølging. Vi har hele tiden hatt tett oppfølging med Checkware og godt samarbeid med systemansvarlig i Checkware.
Vi valgte oss ut en IBD - sykepleier som ansvarsperson. Denne sykepleieren fikk kurs og opplæring ledet av Checkware og er ressursperson for alle ansatte som er delaktig i bruk av denne oppfølgingen. Det tar tid å lære seg et nytt system, og opplæringen av ansatte ble gjennomført innimellom alt annet på travle arbeidsdager. Mye av læringen har kommet underveis med «prøving og feiling». Det er absolutt anbefalt å sette av god tid til opplæring for å unngå unødvendig bruk av ressurser i starten. Start med noen få pasienter for å bli trygg på systemet.
Oppstart og gjennomføringen av DHO ble utsatt på grunn av Covid-pandemien, men vi prioriterte dette arbeidet da vi fort så fordelene med digital oppfølging med alle konsultasjonene med fysisk oppmøte som ble utsatt eller avlyst i denne perioden. All gjennomgang og undervisning foregikk digitalt, noe som også var helt nytt for oss da.
Vi kom likevel i gang allerede i slutten av 2020, og har jobbet målrettet med å inkludere pasienter.
Møtte dere på utfordringer underveis i innføringsfasen?
Å starte nytt system og ny arbeidsmåte som kan være utfordrende i en til vanlig hektisk hverdag- hvor det ofte er enklest å gjøre som «vanlig» for det er kjent og trygt. Det er uvant ikke å sette pasientene opp til ny kontroll i timeboken, og noe usikkerhet i starten i forhold til om pasientene ville følge opp egenregistreringen.
Det har vært noen tekniske utfordringer underveis, men ingen som har fått vesentlige konsekvenser. Det er fortsatt noe ekstra administrativt i forhold til registrering i Dips da det pr i dag må registreres prosedyrekode tre ganger per år for at vi skal få refusjon for denne type oppfølging.
Har dere fått noen tilbakemeldinger fra pasienter?
Hva synes de?
Erfaringen er at pasientene er svært positive til denne type oppfølging, og vi ser økning i antall besvarelser. Foreløpig brukes ikke skjemaene tilstrekkelig når pasienten har behov for kontakt utenom avtalte konsultasjoner, men vi regner med at dette vil gå seg til når de blir mer vant med digital oppfølging.
Skal ordningen evalueres, eventuelt når og av hvem?
Vi har månedlige møter med systemansvarlig i sykehuspartner som er bindeleddet mellom Checkware og helseforetaket samt utveksling av erfaringer forløpende. Vi ønsker involvering fra brukere i videre forbedringsarbeid. Dette er planlagt i forbindelse med gevinstkartlegging som skal gjennomføres i 2023.
GASTROSKOPET • 1/2023 11
Lise Sveen Nandrup i midten, flankert av kollega Hege Marie Svendsen og Svein Oscar Frigstad som også har deltatt i innføringen av denne ordningen.
Levermetastaser –moderne behandling og bedre overlevelse
Introduksjon
I Norge er det omtrent 4000 pasienter som får kolorektal kreft hvert år, hvorav ¾ i tykktarm og rundt 1000 får kreft i endetarmen. Av alle med kolorektal kreft er det rundt 20-25% som har metastaser ved diagnosetidspunktet (såkalt synkrone levermetastaser), og av disse kan rundt 1 av 4 tilbys kirurgi for metastasene i leveren1. For de pasientene som opereres for kreft i kolon eller endetarm, så vil rundt 15-20% utvikle spredning i forløpet etter kirurgi. Det betegnes da som metakrone metastaser. Også blant de med metakron diagnose av spredning er det rundt 25% som kan tilbys kirurgi for levermetastaser. Sannsynligvis er det nok slik at for de med metakrone metastaser så forelå det spredningen på sykdomstidspunktet, men veksten er så langsom at de ikke oppdages før det har gått noe tid. Hvordan og hvorfor det er slik vet vi lite om, men økt forståelse for slike mekanismer gjennom forskning kan bidra til ny og mer effektiv behandling 2
Tidligere ble levermetastaser sett på som en sykdomstilstand med svært dårlig prognose og med få behandlingsmuligheter. Med moderne behandling er overlevelsen blitt mye bedre, selv om det fortsatt gjenstår mange utfordringer for de fleste pasientene. Det er faktisk anslått at med alle valg som i dag kan benyttes alene, sammen i regimer, i sekvenser, eller overlappende med hverandre (som kirurgi, cellegift, ablasjoner, immunterapi, og andre teknikker), så er det i alt over tusen behandlingskombinasjoner som kan vurderes for pasienter med levermetastaser 3. Det beror i at det er mange ulike strategier som kan kombineres – behandling før eller etter kirurgi; ulike typer cellegift før og etter; ulike tilvalg av behandling mot enkelte svulster; og, et vidt spenn av kirurgiske teknikker og muligheter. Her gis en kortfattet oversikt og innføring i dagens behandlingsprinsipper av levermetastaser.

Det er anslått at med alle valg av modaliteter, så er det i dag over 1000 behandlingskombinasjoner som kan vurderes for pasienter med levermetastaser
Forekomst av levermetastaser i Norge
I Norge er levermetastaser fra kolorektalkreft den vanligste forekommende svulsten i leveren. På verdensbasis er nok levercellekreft (HCC) vanligste svulst i leveren, men ettersom vi har en lav forekomst av hepatitt i Norge, så er også forekomsten av HCC i Norge liten sammenlignet med de fleste andre land. Det samme gjelder gallegangskreft (cholangiocarcinom) selv om trenden for denne er stigende. Levermetastaser er derfor den vanligste maligne svulsten i leveren i den norske befolkningen. På de fem norske sykehusene som utfører leverkirurgi, så opereres rundt 350 pasienter årlig for denne tilstanden4. Antallet blir noe høyere om man tar med de som også får ablasjonsbehandlinger, enten alene eller i kombinasjon.
Bedre behandling – bedre prognose
For ikke mange tiår siden så var prognosen for levermetastaser generelt sett dårlig. Forventet levetid fra diagnosen kunne være 6-8 måneder, og få overlevde ett år etter diagnose. Det har endret seg betydelig de siste 10-15 årene. I dag vil median overlevelse også for de som er i ren palliativ fase kunne være opp mot 4 år med den beste behandlingen tilgjengelig. Dette skyldes både bedre og mer effektiv kjemoterapi, og forskjellige kurer som kan gis. Videre er det blitt mange alternativer til bedre sykdomskontroll, som både tar nytte av systemeffekten (som cellegift, antistoffer og immunterapi), den regionale behandlingen (som ablasjonsteknikker) og lokal fjerning av svulstvev (som kirurgi). I dag vil omtrent halvparten som opereres for levermetastaser fortsatt være i live etter 5 år – og for flere vil det kunne bety god livskvalitet, selv om sykdommen skulle komme tilbake eller aldri forsvinne helt. Hos nær 20% så vil man kunne
Av Kjetil Søreide. epost: ksoreide@mac.com. Overlege, Gastrokirurgisk avdeling, Stavanger universitetssjukehus. Professor, Klinisk institutt 1, Universitetet i Bergen
Kjetil Søreide
GASTROSKOPET • 1/2023 12 FAGLIG
oppnå 10-års overlevelse, som også karakteriseres som kurasjon hos noen som aldri får tilbakefall. Man er i dag derfor villig til å strekke seg lengre for å kunne oppnå beste behandling, med mulighet for å oppnå god sykdomskontroll. Likefullt kan man ikke oppnå dette hos alle, og det er viktig å erkjenne balansen mellom det som en kan gjøre og det som er fornuftig å gjøre. Nesten 80% får tilbakefall, og det vanligste stedet er nye metastaser i lever, etterfulgt av lunger og i buk. Man må unngå å påføre pasientene en unødig belastning om det er liten eller ingen sannsynlig gevinst.
Hos nesten 20% så vil man kunne oppnå 10-års overlevelse
Diagnose og staging
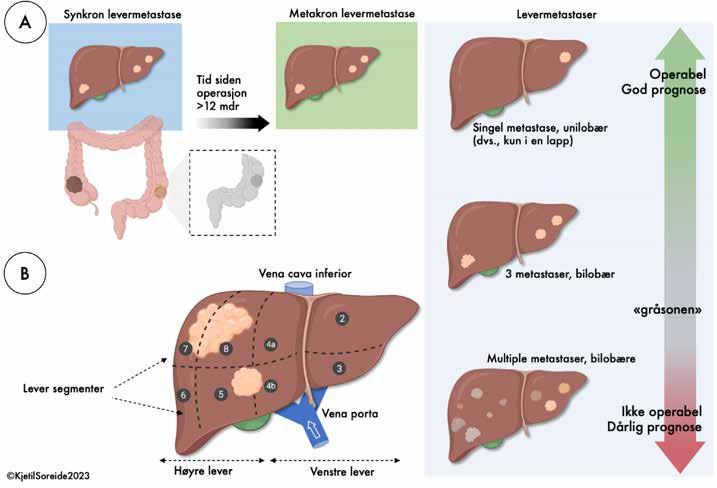
Så mange som 20-25% har levermetastaser som påvises samtidig (synkron levermetastase) med at pasienten får oppdaget kreft i tykk eller endetarmen, mens rundt 15% eller mer får påvist metastaser i forløpet etter gjennomgått kirurgi for tykk eller endetarmskreft. Risikoen for å ha metastaser ved diagnosetidspunktet – eller å utvikle metastaser i forløpet –er ikke likt fordelt for alle med kolorektal kreft. Risiko er knyttet til flere ulike faktorer, bl.a. til svulstens egenskaper, påvisning av vekstmønster i tarmen (for eksempel, dybdevekst, lymfeknuter, satelittsvulster, innvekst i blodkar, lymfeeller nerve-strukturer) og svulstens mutasjonsmønster. Spesielt svulstens gen-mutasjoner er blitt viktig å kartlegge, da stadig flere behandlingsmuligheter kan tilbys pasienter med levermetastaser 5-7 basert på de underliggende genforandringene hos den enkelte8, 9. I tillegg til en rekke andre faktorer (Figur 1), som høye verdier av tumormarkøren CEA i
blod, om det er synkron eller metakron diagnose av metastaser, og antallet metastaser (mer enn 3), størrelse (>5 cm), eller forekomst av metastaser i flere steder i leveren (unieller bilobær sykdom), og i hvilken grad pasienten tåler eller har respons på cellegiftbehandling.
Staging gjøres med CT, og for lever er det standard å gjøre MR med lever-spesifikk kontrast. MR med kontrast bidrar til påvisning av flere og mindre metastaser, og er mer nøyaktig i kartlegging av metastaser, spesielt også etter kjemoterapi. PET kan brukes selektivt hos noen pasienter, men er ikke en rutineundersøkelse i utredningen. PET kan være aktuelt hos noen, der man for eksempel trenger å kartlegge bedre om det foreligger sykdom andre steder i kroppen, eller der man er i tvil om man skal utføre komplisert behandling med stor risiko.
Forbehandling før leverkirurgi
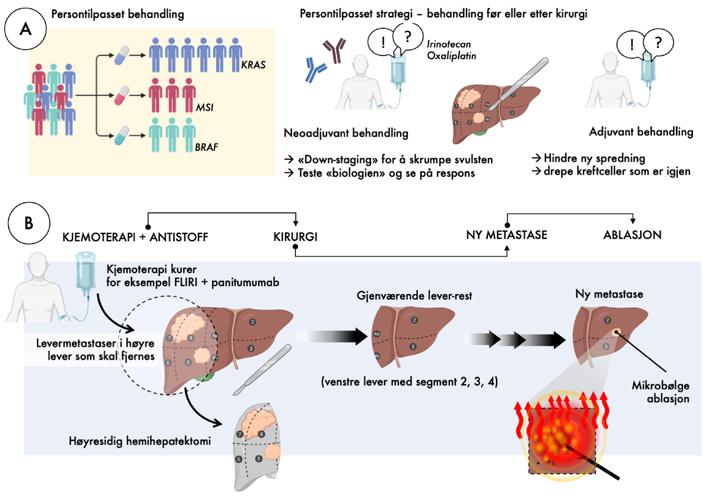
Det diskuteres i fagmiljøene hvorvidt en skal gi rutinemessig kjemoterapi før kirurgi, eller kun i noen tilfeller 10. Ved omfattende utbredelse og antall metastaser eller ved store metastaser så vil ofte en forbehandling være påkrevd for å få kontroll med sykdommen og gjøre kirurgi mulig («down-staging» eller skrumpe metastasene). Det kan også være aktuelt selv om det er få metastaser, når de sitter veldig tett på viktige strukturer som man ønsker å bevare, som levervener eller portagrener. Noen ganger er det nyttig å gi kjemoterapi først for å «teste» biologien til svulsten. Om man er usikker på gevinsten med omfattende behandling for metastasene, kan man først se at det ikke dukker opp nye svulster under
1 GASTROSKOPET • 1/2023 13
Figur
kjemoterapi, enten i leveren, lungene, eller i bukhulen. De pasientene hvor det skulle skje, har som regel ikke nytte av omfattende kirurgi, og der må man forsøke beste kjemoterapi. Noen ganger er det kun mulig å tilby palliasjon.
Cellegiftbehandling kan i dag kombineres med målrettede medisiner som angriper svulstens mutasjoner, og dette bidrar til at svulsten skrumper. Et eksempel er antistoff mot svulstens blodårer, såkalt anti-VEGF behandling (bevacizumab). Et annet er antistoff mot svulstens vekstfaktor, en såkalt EGFR-hemmer. Denne medisinen (EGFRhemmere) virker kun hos dem som ikke har påvist en KRAS mutasjon. KRAS mutasjon forekommer hos 30-40% av de med levermetastaser, og det er viktig å teste for dette, for ikke å gi medisin som ikke virker.
Det nyeste innen levermetastaser er immunterapi11. For noen få pasienter som har såkalt mikrosatelitt instabilitet i genene (mange, små spredte genfeil i genomet, kalt MSI), så vil behandling med immunsjekkpunkt-blokkere være effektivt, og disse er nå godkjent som førstevalg for de med metastastisk kolorektal kreft som er i palliativt stadium5, 6. Disse medisinene er foreløpig ikke godkjent i bruk for de som har en operabel sykdom.
Leverkirurgi
Leverkirurgi er den viktigste behandlingen for å kunne oppnå langtidsoverlevelse, og noen vil til og med bli kurert for levermetastaser, rapportert til 10-20% i ulike studier.
Det er viktig å kartlegge hvor i leveren metastasen eller metastasene sitter, og dertil brukes leverens ‘topografi’. Det vil si, metastasene beskrives nøye der de ligger i de ulike segmentene (for eksempel, segment VII og VIII i høyre lever; figur 2). Det må kartlegges om metastasene ligger nær levervenene som går mot hulvenen (vena cava) eller i nærheten av port-venene (vena porta på høyre eller venstre side, eller begge). Langs portvenene går også gallegangsstrukturene og leverarterien til høyre og venstre side. Ved en operasjon må man sikre at lever-vevet som står igjen har en god nok drenasje (til venene og for galleveiene) og en god nok blodforsyning (fra portalvenen og leverarterien), ellers risikerer man å utvikle leversvikt etter operasjon, noe som er relativt sjeldent, men kan være dødelig når det inntreffer.
Tidligere var man nøye på å ikke operere pasienter med for mange svulster, helst ikke over 4 metastaser. I dag er man i hovedsak opptatt av hvor mye friskt levervev som er igjen. Grensene mellom hva som er «operabel sykdom» og «inoperabel sykdom» er derfor i dag overlappet av en betydelig «gråsone» der det ikke er noe sikkert fasitsvar (Figur 1), men hvor man må gjøre flere vurderinger sammen med pasienten om hva som kan gjøres og hva som skal gjøres.
Kirurgene opererer på leveren ved å gjøre formelle reseksjoner eller såkalte kile-reseksjoner. Trenden er å utføre mest mulig kilereseksjoner der man kan for å spare levervev. Formelle reseksjoner betyr at man fjerner hele deler av leveren som er definert av segmenter, eller flere segmenter av leveren som hører sammen (for eksempel, segment II og III,
GASTROSKOPET • 1/2023 14 FAGLIG
Figur 2
som kalles en ‘venstre lateral reseksjon’ eller segment II/III reseksjon). Ved en høyresidig hemiheptektomi (figur 2), så vil segmentene V, VI, VII og VIII (S5, S6, S7, og S8) opereres bort. Da tas også høyre levervene til hulvenen (leverens venøse drenasje), og høyre portagrein med galleveier og leverarterie. Kun venstre lever står igjen (figur 2), og man må da forsikre seg om at man har tilstrekkelig volum slik at leveren klarer sine oppgaver – ellers vil man kunne gå i leversvikt, som kan være dødelig.
Vanligvis kan man fjerne opptil 70% av en frisk lever. Leveren har evnen til å hypertrofere (på folkemunne sies gjerne at «den vokser ut igjen»), som egentlig betyr at de gjenværende levercellene øker i volum og arbeidsevne, men ikke at det «vokser ut» nytt levervev. Har man gitt flere runder med cellegift eller har en annen leversykdom, bør det gjenværende lever-volumet være større (over 40%) for å sikre god nok funksjon i lever. Det finnes flere muligheter for å øke leverens evne til å vokse før en operasjon, en av dem er å tette portvene-grenen til den delen av leveren som skal bort (portvene-embolisering). Tetter man den høyre portvenen, så vil venstre siden av leveren vokse (hypertrofere) som en respons på at leveren på høyre side skrumper. Etter cirka 4 uker kan man da måle om det er nok levervev i den planlagte gjenværende rest til å kunne utføre operasjonen. Volummåling kan gjøres på mange ulike måter, men den vanligste måte er å måle volumet på CT av leveren, anslått i prosent. Man kan da anslå hvor mye av volumet av leveren som utgjøres av gjenværende lever-rest, og om man har et tilfredsstillende volum (som f.eks. 35%) så kan man utføre operasjonen. Det finnes flere ulike måter å kunne påvirke levervekst og volum, samt måter å vurdere dette på.
Andre behandlinger
Levermetastaser kan behandles med en rekke ulike andre teknikker i tillegg til vanlig cellegift og kirurgi. Disse har enten en systemisk effekt, en lokal virking, eller er en kirurgisk fjerning av metastasene. Systemisk effekt får man ved behandling som cellegift, antistoffer, eller immunterapi. Det finnes flere ulike kurer og varighet som kan benyttes i kombinasjoner, og en kan bytte behandling om man ikke får respons på ett valg og vil prøve neste valg.
De regionale eller lokale behandlingsalternativene er også økende i bruk. Mest brukt er såkalte ablasjons-teknikker (Figur 2B), hvor man fører en type nål/probe inn i leveren og «koker» metastasene enten med mikrobølger eller radiofrekvens-ablasjon (microwave ablation, MWA; eller radiofrequency ablation, RFA). Man kan kombinere kirurgi med ablasjon for å spare levervev. Man kan også gjøre ablasjon på nye metastaser om man tidligere har fjernet mye levervev (Figur 2B). Som en kurativ behandling, så er det en øvre størrelse for effekt av ablasjon, vanligvis på rundt 3 cm for å kunne behandle metastaser på denne måten. Det har også en betydning hvor i leveren metastasene er plassert, og hvor trygt man kan gjøre en slik ablasjon. Ablasjoner kan enten gjøres gjennom huden (perkutan ablasjon) ved hjelp av ultralyd, eller sammen med kirurgen på operasjonsbordet når leveren ligger tilgjengelig for dette (enten ved kikkhullskirurgi eller åpen operasjon). Det er oftest intervensjonsradiologene som utfører disse prosedyrene.
En rekke andre behandlinger er under utprøving, men ikke etablert som standard teknikker for alle pasienter. Noen nye teknikker som testes ut i Norge er blant annet såkalt «leverpumpe» som tilbys i en studie på Rikshospitalet. Leverpumpe utføres ved at man setter inn en kjemoterapipumpe med en tilgang direkte inn i leverarterien («hepatic artery infusion», HAI). Da får man gitt kjemoterapi rett inn i levervevet (og til metastasene), noe som kan være gunstig spesielt der det ikke er spredning andre steder i kroppen og man ønsker en direkte effekt. Hvor nyttig denne effekten er, testes for tiden i ulike studier.
En annen omdiskutert behandling for de som ikke kan opereres, men kun har sykdom i leveren, er levertransplantasjon. Dette utføres for noen helt få pasienter i Norge, under strenge kriterier, og kan være et alternativ der andre behandlingsmuligheter ikke finnes.
I tillegg er det muligheter for å sette kjemoterapi inn i svulstene ved hjelp av et kateter og blokkere blodforsyningen (TACE, transarteriell chemo-embolization) eller tilføre radioaktive partikler inn i leveren på en tilsvarende måte (SIRT), som alle er tilgjengelige men ikke utbredte muligheter. Men mulighetene i verktøykassen øker for pasienter med levermetastaser, og formålet er å bedre overlevelse for mange og oppnå varig sykdomsfri overlevelse for flest mulig.
Konklusjon
Levermetastaser kan i dag behandles med en rekke strategier og i en kombinasjon av flere ulike alternativ, hvor kirurgi er den metoden som gir best mulighet for langtidsoverlevelse. Opptil 20% kan være i live etter 10 år etter leverkirurgi for metastaser fra kolorektalkreft. Ny og mer målrettet behandling kan føre til at flere får glede av denne behandlingen i årene fremover.
Referanser:
1. Angelsen JH, Horn A, Sorbye H, Eide GE, Løes IM, Viste A. Populationbased study on resection rates and survival in patients with colorectal liver metastasis in Norway. Br J Surg 2017;104(5): 580-589.
2. Zaharia C, Veen T, Lea D, Kanani A, Alexeeva M, Søreide K. Histopathological Growth Pattern in Colorectal Liver Metastasis and The Tumor Immune Microenvironment. Cancers 2023;15(1): 181.
3. Raphael MJ, Karanicolas PJ. Regional Therapy for Colorectal Cancer Liver Metastases: Which Modality and When? J Clin Oncol 2022;40(24): 2806-2817.
4. Lassen K, Nymo LS, Olsen F, Brudvik KW, Fretland Å A, Søreide K. Contemporary practice and short-term outcomes after liver resections in a complete national cohort. Langenbecks Arch Surg 2019;404(1): 11-19.
5. Cervantes A, Adam R, Roselló S, Arnold D, Normanno N, Taïeb J, Seligmann J, De Baere T, Osterlund P, Yoshino T, Martinelli E. Metastatic colorectal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol 2023; 34(1): 10-32.
6. Morris VK, Kennedy EB, Baxter NN, Benson AB, 3rd, Cercek A, Cho M, Ciombor KK, Cremolini C, Davis A, Deming DA, Fakih MG, Gholami S, Hong TS, Jaiyesimi I, Klute K, Lieu C, Sanoff H, Strickler JH, White S, Willis JA, Eng C. Treatment of Metastatic Colorectal Cancer: ASCO Guideline. J Clin Oncol 2022: Jco2201690.
7. Hewitt DB, Brown ZJ, Pawlik TM. The Role of Biomarkers in the Management of Colorectal Liver Metastases. Cancers (Basel) 2022;14(19).
8. Veen T, Søreide K. Can molecular biomarkers replace a clinical risk score for resectable colorectal liver metastasis? World J Gastrointest Oncol 2017; 9(3): 98-104.
9. Søreide K, Watson MM, Hagland HR. Deciphering the Molecular Code to Colorectal Liver Metastasis Biology Through Microsatellite Alterations and Allelic Loss: The Good, the Bad, and the Ugly. Gastroenterology 2016;150(4): 811-814.
10. Søreide K. Time to halt perioperative chemotherapy for resectable colorectal liver metastasis? Br J Surg 2022;109(3): 242-243.
11. Kanani A, Veen T, Søreide K. Neoadjuvant immunotherapy in primary and metastatic colorectal cancer. Br J Surg 2021;108(12): 1417-1425.
GASTROSKOPET • 1/2023 15
Kreft, fysisk aktivitet og Pusterom

Kreft rammer mange personer i Norge hvert eneste år. Man vet at fysisk aktivitet kan bidra til å redusere risikoen for å utvikle kreft. I tillegg kan fysisk aktivitet under og etter kreftbehandling bidra til mindre tretthet og ubehag, samt gi økt livskvalitet. Aktiv mot kreft har derfor opprettet flere treningsrom som de kaller Pusterom, og som er et flott treningstilbud til kreftpasienter i Norge.
Kreft i Norge

I dag overlever tre av fire personer som får påvist kreft i Norge. Dette er dobbelt så mange som for 50 år siden. Likevel døde nesten 11 000 personer av kreft i 2020. Dette gjør kreft til den hyppigste dødsårsaken i den norske befolkningen. I 2020 fikk 35 515 personer påvist kreft. Av disse var 19 223 menn og 16 292 kvinner. De fire vanligste kreftformene i Norge er prostatakreft, brystkreft, lungekreft og tarmkreft. Minst ett av tre krefttilfeller har sammenheng med levevaner, som for eksempel mangel på fysisk aktivitet, dårlig kosthold og røyking. Det finnes ingen garanti mot å få kreft, men man kan redusere risikoen ved å ha sunne og gode levevaner.
Fakta om kreft
Det fins omkring 200 ulike kreftformer. Sykdomsforløp, behandling og overlevelse vil variere mellom de ulike kreftformene. Det som er felles ved alle kreftformer, er at det oppstår en skade i cellens arvestoff som fører til at cellene deler seg ukontrollert. Etter hvert vil det bli en opphopning av kreftceller i organet der veksten startet, en kreftsvulst. Dette kan påvirke funksjonen til organet som er rammet. Kreftcellene kan deretter spres til andre deler av kroppen via blod og lymfesystem. De fleste organer i kroppen kan bli rammet ved spredning, men ulike krefttyper har en tendens til å spre seg til bestemte organer. De vanligste behandlingsformene ved kreft i dag er cellegift,
Teks og foto: Maren Josefine Kvarsnes
Maren Josefine Kvarsnes
GASTROSKOPET • 1/2023 16
FAGLIG
kirurgi, stråling og immunterapi. Man kan også kombinere flere typer behandling. Alle disse behandlingene kan være tøffe for kroppen.
Kreft i fordøyelsesorganer
Ifølge kreftregisteret fikk 7328 personer påvist kreft i fordøyelsesorganer i 2021. Kreft i fordøyelsesorganer omfatter mange kreftformer, blant annet tarmkreft. Tarmkreft er et samlebegrep om kreft i tykktarm og endetarm. Dette er en av de vanligste kreftformene i Norge i dag. De siste 60 årene har forekomsten av tarmkreft tredoblet seg i Norge, og i 2021 fikk 4550 personer påvist tarmkreft. Norske kvinner er helt i verdenstoppen i antall nye tilfeller, og norske menn havner på en niende plass. Årsaken til dette er ikke kjent, men man har beregnet at ca. 45% av tarmkrefttilfellene i den vestlige verden kunne vært unngått med sunne levevaner. De aller fleste som får påvist tarmkreft i Norge er over 55 år gamle. Tarmkreft kan være vanskelig å oppdage fordi symptomene ofte kommer sent i forløpet, og de kan lett forveksles med vanlige mageplager. Derfor har mange pasienter fått avansert sykdom og kanskje spredning til andre organer før diagnosen stilles. Dette kan være vanskelig å behandle. I dag dør ca. 40% av de som får påvist tarmkreft innen 5 år fordi sykdommen ofte oppdages sent. Prognosen er derimot god dersom man oppdager tarmkreft tidlig. Over 95% av de som får påvist tarmkreft i den tidligste fasen er i live etter 5 år. Dette er bakgrunnen for at man i disse dager ruller ut et screeningprogram for tarmkreft i Norge. Tilbudet gis til alle det året de fyller 55 år.
Fysisk aktivitet og forebygging av kreft Med fysisk aktivitet menes bevegelse, altså det å bruke kroppen. Dette innebærer alt fra husarbeid til lek til gåturer til løping til styrketrening til konkurranseidrett. Med fysisk trening menes en systematisk påvirkning av kroppen over tid som endrer kroppens fysiske, psykiske og sosiale egenskaper som ligger til grunn for prestasjonsevne. Man må ikke nødvendigvis trene hardt og systematisk for å få helsegevinster. Litt fysisk aktivitet er bedre enn ingenting, og det er aldri for sent å begynne. Forskning viser at fysisk aktivitet kan redusere risikoen for tarmkreft og brystkreft. Fysisk aktivitet har sannsynligvis også en beskyttende effekt mot
flere andre kreftformer. Det er flere grunner til dette. Regelmessig fysisk aktivitet fører til et sunt nivå av hormoner. Man vet at høyt nivå av enkelte hormoner kan øke risikoen for kreft. Fysisk aktivitet fører vanligvis til økt forbrenning på grunn av økt muskelmasse. Dette reduserer risikoen for overvekt som er en kjent risikofaktor når det gjelder utvikling av kreft. Fysisk aktivitet fører til økt blodsirkulasjon og tarmbevegelse som gjør at skadelige stoffer fjernes raskere fra kroppen. Fysisk aktivitet styrker også immunforsvaret. Dette kan påvirke celleaktivitet på en gunstig måte og dermed redusere risikoen for kreft.
Fysisk aktivitet under og etter kreftbehandling Forskning viser at fysisk aktivitet kan bidra til å bedre livskvaliteten ved kreft, uansett hvor man er i behandlingsforløpet. Fysisk aktivitet og trening kan også være viktig når man er i utredningsfasen for kreft. Dette fordi pasientens fysiske form ser ut til å spille en rolle for hvor godt man tåler kreftbehandlingen. Under kreftbehandling er fysisk aktivitet og trening viktig fordi det blant annet kan redusere plager og bivirkninger, redusere tretthet, redusere fall i fysisk form og gi bedre søvnkvalitet. Etter endt kreftbehandling er fysisk aktivitet og trening viktig fordi man raskere kan gjenvinne fysisk og psykisk helse. Fysisk aktivitet og trening reduserer også risiko for ny kreftsykdom, reduserer senskader og reduserer risiko for tidligere død.
Aktiv mot kreft
Aktiv mot kreft er en privat stiftelse som ble etablert i 2007 av Grete Waitz og Helle Aanesen. Stiftelsen jobber for å få persontilpasset trening inn som en del av kreftbehandlingen i Norge. Stiftelsen får inntekter blant annet ved å etablere treningskonsepter for bedrifts- og privatmarkedet. Man kan derfor si at Aktiv mot kreft får inntekter ved hjelp av fysisk aktivitet for friske mennesker og bruker dem på fysisk aktivitet for kreftsyke. Aktiv mot kreft har flere bidragsytere, fadderbedrifter, støttespillere og samarbeidspartnere som gjør arbeidet mulig. I tillegg har de flere profilerte ambassadører, blant annet Yngvar Andersen, Bente Skari, Nils-Ingar Aadne og Abid Raja. Siden 2007 har Aktiv mot kreft samlet inn 250 millioner kroner. Disse pengene har gått til flere ulike prosjekter i Norge og i utlandet, blant annet etablering av

 Kunst på vegg
Kunst på vegg
GASTROSKOPET • 1/2023 17
Sosial sone
Pusterom, utdanning av instruktører, forskning på fysisk aktivitet og kreft, medisinsk teknisk utstyr og utdanning av kreftleger, kreftsykepleiere og stråleterapeuter i Etiopia.
Forskning
Aktiv mot kreft støtter forskning på effekt av fysisk aktivitet for kreftpasienter, både i Norge og internasjonalt. Dette er med på å gi viktig og ny kunnskap om effekten av fysisk aktivitet. Man får også kunnskap om hvilken type trening som gir best mulig effekt for ulike krefttyper og behandlinger. Aktiv mot kreft har bidratt med midler til flere studier, blant annet en studie ved Norges idrettshøgskole rettet mot prostatakreftpasienter. Bakgrunnen for denne studien er at hormonbehandling ved prostatakreft fører til redusert muskelmasse og dårlig blodsukkerregulering. Studien undersøker om trening kan motvirke dette. Aktiv mot kreft bidrar også med midler til en annen studie ved Norges idrettshøgskole. Denne studien er rettet mot kvinner som har blitt behandlet for brystkreft. Bakgrunnen for studien er at behandling for brystkreft kan gi seneffekter, som for eksempel økt risiko for hjerte- og karsykdommer. Studien undersøker om fem måneder med utholdenhetstrening kan redusere risikoen for dette. Studien undersøker også om tidligere gjennomgått brystkreftbehandling kan påvirke effekten av trening.
Pusterom
Pusterom er et moderne trenings- og aktivitetssenter for kreftpasienter. Her kan kreftpasienter trene før, under og etter kreftbehandling. Det kalles Pusterom fordi man kan øke pulsen og pusten, men også fordi man kan få et pusterom fra en vanskelig hverdag. I tillegg er det en møteplass og sosial arena for pasienter i samme situasjon. På Pusterommet får kreftpasienter kyndig treningsveiledning av fysioterapeuter og idrettspedagoger. Dette skjer gjennom egentrening eller gruppetrening. Det aller første Pusterommet ble åpnet på det nye kreftsenteret ved Ullevål sykehus i 2006, året før Aktiv mot kreft ble etablert. Siden dette har Aktiv mot kreft videreført arbeidet med å etablere Pusterom i samarbeid med
sykehusene. Stiftelsen gir sykehusene midler til drift de første tre årene, mot en garanti for at sykehusene viderefører driften fra det fjerde året. I dag finnes det 20 Pusterom rundt omkring i Norge, og målsetningen er å åpne Pusterom på alle norske sykehus. For å komme i gang med trening på Pusterommet må pasienten få henvisning fra lege. Pasienten må deretter ta kontakt med sitt nærmeste Pusterom for å få satt opp en førstegangssamtale. Deretter kan pasienten delta på gruppetimer, egentrening og digital trening.
Andre Pusterom
I 2015 ble det etablert et utendørs Pusterom som kalles «Pusterommet i skogen». Dette Pusterommet ligger i Gaustadskogen ved Rikshospitalet i Oslo. Dette er en aktivitetsløype i skogen som består av ulike aktivitetsposter. «Pusterommet i skogen» er åpen for alle og målet er at flest mulig skal ta i bruk løypa, både store og små, syke og friske. Det finnes også bålplasser i området som man kan benytte seg av før eller etter en tur i aktivitetsløypa. «UT Pusterommet» er et samarbeidsprosjekt mellom Aktiv mot kreft og Den Norske Turistforening. Dette er en forlengelse av de etablerte Pusterommene hvor aktiviteten foregår ute i naturen. Tilbudet består av egne lister med turforslag med utgangspunkt fra hvert enkelt Pusterom. Man bestemmer selv hvor mange turer man vil gjennomføre. Turene kan man gå alene eller sammen med andre. «Pusterommet på sjøen» ble etablert i forbindelse med Færderseilasen i 2017. Dette er et samarbeid mellom Aktiv mot kreft og Kongelig Norsk Seilforening. «Pusterommet på sjøen» er en konkurranseseilbåt som er tilgjengelig for brukere av Pusterommet noen dager i året. Her kan kreftpasienter prøve båten sammen med mannskap fra Kongelig Norsk Seilforening. Aktiv mot kreft håper også på å få etablert et Pusterom som de kaller «Pusterommet på badet» på Sagene Bad i Oslo.
Pusterommet LIVE og Pusterommet Hjemme
Det er også mulig å trene digitalt med Pusterommet gjennom «Pusterommet LIVE» og «Pusterommet hjemme». «Pusterommet LIVE» er digitale treningsøkter som sendes direkte fra et Pusterom. «Pusterommet hjemme» er videoer med komplette treningsøkter som man lett kan gjennomføre hjemme. Disse ligger lett tilgjengelig på hjemmesiden til Aktiv mot kreft. Det eneste utstyret man trenger for å gjennomføre disse treningsøktene er et par sko. Man kan velge økt og intensitet etter eget ønske og dagsform.
Pusterommet på Lovisenberg Diakonale Sykehus
Den 20. desember 2022 åpnet det 20. Pusterommet i Norge på Lovisenberg Diakonale Sykehus i Oslo. Dette Pusterommet er lokalisert på Medisinsk Poliklinikk og består av en stor gruppesal med moderne treningsapparater, eget spinningsrom og en sosial sone med kjøkken. Her er det gruppetimer flere dager i uken i tillegg til mulighet for egentrening. Timeplaner for alle Pusterommene finner man på hjemmesiden til Aktiv mot kreft.
Referanser www.kreftforeningen.no www.kreftregisteret.no www.aktivmotkreft.no www.fhi.no

GASTROSKOPET • 1/2023 18 FAGLIG
Spinningsal på pusterommet LDS
NÅ
godkjent ulcerøs kolitt!1
ved moderat til alvorlig aktiv
RINVOQ® (upadacitinib) er en peroral, selektiv og reversibel JAK-hemmer som er indisert til behandling av voksne pasienter med moderat til alvorlig aktiv ulcerøs kolitt som har hatt utilstrekkelig respons, mistet respons eller var intolerante overfor enten konvensjonell behandling eller et biologisk legemiddel1.
RINVOQ viktig sikkerhetsinformasjon1
Kontraindikasjoner
• Overfølsomhet overfor innholdsstoffene (se avsnitt 4.4 i SmPC).
• Aktiv tuberkulose eller aktive alvorlige infeksjoner.
• Alvorlig nedsatt leverfunksjon.
• Graviditet (prevensjon under behandling og i minst 4 uker etter siste dose).
Amming Skal ikke brukes ved amming.
Forsiktighetsregel RINVOQ bør brukes med forsiktighet hos pasienter med høy risiko for å utvikle dyp venetrombose eller lungeemboli.
Behandling skal ikke initieres ved
1. Absolutt lymfocyttall (ALC) <0,5 x 10 9 celler/l.
2. Absolutt nøytrofiltall (ANC) <1 x 10 9 celler/l.
3. Hemoglobin (Hb)-nivå <8 g/dl.
Vanligste bivirkninger (≥3% av pasientene) Øvre luftveisinfeksjoner (19,9%), økt CPK i blodet (7,6%), akne (6,3%), nøytropeni (6,0%), utslett (5,2%), herpes zoster (4,4%), hyperkolesterolemi (4,0%), follikulitt (3,6%), herpes simplex (3,2%) og influensa (3,2%).
Vanligste alvorlige bivirkninger Alvorlige infeksjoner.
Interaksjoner Sterke CYP3A4-hemmere- og induktorer: eksponeringen for upadacitinib henholdsvis øker og reduseres ved samtidig administrering.
RINVOQ utvalgt produktinformasjon1
Dosering: Anbefalt induksjonsdose av RINVOQ er 45 mg én gang daglig i 8 uker. Ved utilstrekkelig terapeutisk nytte innen uke 8, kan RINVOQ 45 mg én gang daglig fortsettes i ytterligere 8 uker. Anbefalt vedlikeholdsdose av RINVOQ er 15 mg eller 30 mg én gang daglig, basert på den enkelte pasientens tilstand, der den laveste effektive dosen bør vurderes. Eldre ≥ 65 år: Anbefalt vedlikeholdsdose er 15 mg én gang daglig. For anbefalt dose ved alvorlig nedsatt nyrefunksjon og samtidig bruk av CYP3A4 hemmere, se SPC.
Priser og pakninger: 15 mg x 28 stk. (blister) kr 9617,70. 15 mg x 98 stk. (blister) kr 33571,20. 30 mg x 28 stk. (blister) kr 19199,10. 45 mg x 28 stk. (blister) kr 28780,50.
For utfyllende informasjon om indikasjoner, dosering, kontraindikasjoner, forsiktighetsregler, bivirkninger, pris og refusjon, se Felleskatalogen1
Dette er et avtaleprodukt. RINVOQ er foreløpig ikke innført for indikasjonen ulcerøs kolitt. Forhandlinger pågår med Sykehusinnkjøp.
Dette legemidlet er underlagt særlig overvåkning for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Dette gjøres via meldeskjema som finnes på nettsiden til Statens Legemiddelverk: www.legemiddelverket.no/meldeskjema.

▼ NO-RNQG-220004 v2.0 februar 2023 AbbVie AS • Postboks 565 • 1327 Lysaker • Telefon +47 67 81 80 00. www.abbvie.no
Referanse: 1. RINVOQ SPC datert 10.11.2022, avsnitt 4.1, 4.2, 4.3, 4.4, 4.5, 4.6, 4.8 og 5.1.
Valg under faggruppens generalforsamling 10. februar
Vi vil gjerne presentere styre og redaktører for perioden 2023-2025. Alle i det tidligere styret stilte til valg på nytt, og det nye styret er derfor stort sett kjent for oss fra før.
Julie Hellan, Akershus Universitetssykehus, fortsetter som leder.
Therese Rusten, Bærum sykehus, fortsetter som nestleder.
Sonja Margrethe Eriksen, Drammen sykehus, fortsetter i styret, nå som kasserer.

Caroline Dille Båtnes, Namsos Sykehus, ny i styret, er sekretær.
Merethe Lie Seglem, Stavanger Universitetssykehus og Marte Eide Jahnsen, Akershus Universitets sykehus, fortsetter i programkomiteen.
Vara er Kristin Kirkestuen, Lillehammer sykehus og Liss Anita Tollefsen, Lovisenberg sykehus.
Redaktørene for Gastroskopet takket av etter fire år i vervet. De nye redaktørene er Roy Cato Solheim og Dag Olav Langeland fra medisinsk undersøkelse, Haukeland sykehus.
Vi ønsker alle sammen mye moro og lykke til i vervene!
 Redaktørene, fra v.: Roy Cato og Dag Olav
Redaktørene, fra v.: Roy Cato og Dag Olav
NYTT FRA GASTROMILJØET 20 GASTROSKOPET • 1/2023
Styret, fra v.: Sonja, Caroline, Merethe, Therese og Julie. Marte var ikke til stede.
VELPRØVD. ANVENDELIG. ETABLERT.
Konsentrasjon 50 mg/ml Lite injeksjonsvolum
Maks 5 sek injeksjonstid
Avtale møte? Skann QR-koden eller kontakt oss på

|
|
|
a.persia@medac.no eller +47 97 54 98 11

Metex® 7,5-30 mg injeksjonsvæske, oppløsning i ferdigfylt penn (metotreksat) Indikasjoner: metex® ferdigfylt penn er indisert til behandling av aktiv revmatoid artritt hos voksne pasienter, polyartrittiske former av alvorlig, aktiv, juvenil idiopatisk artritt, hvor respons på ikke-steroide antiinflammatoriske legemidler (NSAIDs) ikke har vært adekvat, moderat til alvorlig psoriasis hos voksne pasienter som er kandidater for systemisk behandling, samt kraftig psoriasisartritt hos voksne og mild til moderat Crohns sykdom, enten alene eller i kombinasjon med kortikosteroider, hos voksne pasienter som ikke reagerer på behandling eller som er intolerante overfor tiopuriner. Dosering: metex® ferdigfylt penn skal injiseres én gang per. uke. Bivirkninger: De mest relevante bivirkningene er hemming av det hematopoetiske system, samt gastrointestinale sykdommer. Pakningsstørrelser: Ferdigfylte penner som inneholder 0,15 ml (7,5 mg), 0,2 ml (10 mg), 0,25 ml (12,5 mg), 0,3 ml (15
0,5 ml (25 mg), 0,55 ml (27,5 mg) eller 0,6 ml (30 mg) oppløsning, er tilgjengelige i pakninger på 1 og 6 ferdigfylte penner.

ATC-kode: L04AX03. SPC Oppdateringsdato: 25.03.2022. Fullstendig preparatomtale: www.legemiddelverket.no / www.felleskatalogen.no.
ml (22,5

info@medac.no | www.medac.no
0,4
mg),
mg), 0,35 ml (17,5 mg),
ml (20
0,45
mg),
NO 288/012023 7,5 mg
0,15 ml 10 mg
0,20 ml 12,5 mg
0,25 ml 15 mg | 0,30 ml 22,5 mg | 0,45 ml 17,5 mg | 0,35 ml 30 mg | 0,60 ml 27,5 mg | 0,55 ml 25 mg | 0,50 ml 20 mg | 0,40 ml
Fagmøtet på Lillehammer 2023
Under følger et utvalg referater fra årets fagmøte, som hadde rekordoppslutning etter to år med avlysning. Vi er særlig glade for å referere fra foredragene til de mange sykepleierne som var svært gode. (Foredrag om sykepleierdrevet leverpoliklinikk og behandling av perianale fistler ble trykket i Gastroskopet i fjor, og er utelatt her).
Referater fra torsdag 9. februar
Hepatitt C-behandling i et historisk perspektiv.
Målsetting og utfordring knyttet til dagens behandling.
Ved Anita Vik og Marie Vågen, sykepleiere ved gastroenterologisk poliklinikk, Stavanger universitetssjukehus

Hepatitt C virus’ arvestoff ble oppdaget i 1988, kalt nonA nonB-hepatitt, og antistoffpåvisning ble mulig fra 1989. Sikker blodgiverscreening i Norge ble startet først i 1993.
Hepatitt C er en betennelse i lever forårsaket av hepatitt C-virus. Viruset deles i seks ulike genotyper, nummerert fra 1 – 6, og forskjellige genotyper dominerer i forskjellige deler av verden. Globalt dominerer type 1. I Norge har 50 % av pasientene genotype 1 og 40 % genotype 3.
Forekomst: 58 millioner på verdensbasis, med 1,5 millioner nye tilfeller årlig. I 2021 levde 3700 med hepatitt C i Norge. I Oslo har man funnet at 40-50 % av de som bruker sprøyter har hepatitt C. Antall meldte tilfeller av hepatitt C til MSIS har gått ned fra ca 3500 pr år i 2008 til ca 500 pr år i 2018, hvilket viser at færre blir smittet.
Flinke arrangører! Fra venstre: Therese Rusten, Siv Isaksen, Liss Anita Tollefsen, Merethe Lie Seglem, Sonja M. Eriksen og Julie Hellan (foto: Anita Jørgensen)
NYTT FRA GASTROMILJØET 22 GASTROSKOPET • 1/2023
Referent Kirsti P Schumacher
Smittevei:
Hepatitt C smitter via blod og ca 80 % smittes ved injeksjon av rusmidler eller annet brukerutstyr. Hos 15-20 % er smitteveien uklar.
Smitterisikoen er relativt lav. Perinatal smitte: 4-10 %. Ved stikk: 3-5 %. Seksuell smitteoverføring: svært lav risiko. Inkubasjonstiden er 4-12 uker
Akutt infeksjon er vanligvis asymptomatisk. Hos de som får symptomer opptrer ikterus hos 10-20 %, ellers er det influensaliknende plager, forstørret lever, forhøyede leverenzymer, avfarget avføring og mørk urin.
20-40 % blir spontant virusfri. Resten utvikler kronisk hepatitt C-infeksjon (HCV-infeksjon).
Mange er asymptomatiske. Resten har uspesifikke symptomer som tretthet, kvalme, anoreksi og smerter under høyre costalbue.
3-20 % utvikler levercirrhose etter 20 år, med symptomer som økt bukomfang, ascites, ikterus, kløe, vekttap og tap av muskelmasse, blødningstendens og blåmerker og GI-blødning. 25 % av disse utvikler hepatocellulært carcinom eller dekompensasjon innen 10 år. Omkring 4-5 får levertransplantasjon årlig.
Hvem bør teste seg?
-De som injiserer eller sniffer rusmidler og kan være utsatt for infisert brukerutstyr.
-Deltakere i LAR-behandling eller annen rusbehandling.
-Personer med HIV eller hepatitt B.
-Mottakere av blodprodukter før 1992.
-Innvandrere fra høyendemiske områder.
-Personer som har blitt utsatt for urene sprøyter eller kirurgiske instrumenter i helsevesenet.
-Barn født av mødre med HCV-infeksjon.
-Personer med forhøyet ALAT.
-Personer utsatt for sprøytestikk.
-Pasienter i dialyse.
-Personer som er tatovert hos ukjent/utrygg aktør.
-Personer som har hatt sex med personer med HCV.
-Innsatte i fengsler.
-Menn som har risikosex med menn.
-De som ønsker å teste seg.
Diagnostikk av HCV-infeksjon:
Hvis blodprøve er antistoff HCV-positiv, ta HCV RNA (PCRtest). Negativ HCV RNA betyr gjennomgått infeksjon. OBS! Ved nylig eksponeringsrisiko bør den gjentas etter 3-6 mndr. Positiv HCV RNA betyr smitteførende HCV-infeksjon. NB! Alle med gjennomgått HCV-infeksjon vil ha positiv HCV-antistoff på ubestemt tid.
Fibroscan brukes for å kartlegge fibrosegrad. Leverbiopsi brukes ikke lenger.
Behandling:
HCV-infeksjon er av FHI definert som en allmennfarlig smittsom sykdom, og kvalifiserer for gratis utredning og
behandling (uten egenandel) ved enten gastroenterologisk eller infeksjonspoliklinikk. Medikamentene foreskrives på H-resept av spesialist, helseforetakene betaler. Fastlege kan ikke foreskrive.
Historie: 1991: Interferon sc godkjennes i USA for behandling av HCV-infeksjon.
Slutten av 1990-2000-tallet: Interferon, ferdigfylte sc-sprøyter en gang pr uke i kombinasjon med ribavarintabletter dosert etter vekt/daglig.
Krevende og lang behandling (72-24 uker) med mange bivirkninger (depresjon, hårtap, humørsvingninger). Strenge kriterier for å få behandling (rusfri ett år, ordnede forhold). Tett oppfølging i spesialisthelsetjenesten for monitorering av virkning/bivirkning, tiltak mot bivirkninger og dosejusteringer.
Etter hvert: Interferon og ribavirin tilpasset genotype og virusmengde. Kortere behandlingstid, 48-12 uker. 40-50 % av de med genotype 1 ble friske, dvs oppnådde SVR (sustained virological response), og 70-90 % av de med genotype 2 og 3 ble friske (oppnådde SVR). De kunne likevel bli smittet på nytt.
2011: HCV proteasehemmere, de første direktevirkende antivirale medikamentene (DAA). Det ble gitt i kombinasjon med interferon og ribavirin og ga uakseptable bivirkninger.
2014: Paradigmeskifte med DAA: Sofosbuvir markedsført. 430.000,- for 12 uker, lite bivirkninger, forventet 90 % SVR. Fremdeles i kombinasjon med interferon/ribavirin.
Behandlingen var avhengig av fibrosegrad, pasientens alder og genotype. Genotype 1,4,5 og 6 fikk behandlingen, mens de med genotype 2 og 3 gikk til årlig oppfølging med blodprøver og fibroscan inntil de var gamle nok eller hadde nok fibrose til at de ble bedømt i behov av behandling. Pasientene opplevde det urettferdig.
2015-16: Flere nye DAA får markedsføringstillatelse. Behandlingen er kostbar.
2017: Interferon brukes ikke lenger
2018: Norge forplikter seg til WHO’s strategi for eliminasjon av virushepatitt. Helse- og omsorgsdepartementet kommer med Nasjonal strategi mot hepatitt 2018-2023.
Målsetting innen 2023: 90 % reduksjon av HCV-tilfeller. Ingen skal dø eller få dødelig sykdom på grunn av HCV-infeksjon.
1. februar 2018: Alle får tilgang til behandling med DAAmedikamentene. SVR > 95 %, lite bivirkninger. Betydelig reduksjon i pris grunnet markedsføring av flere nye medikamenter og anbudskonkurranser. Sykehusinnkjøp inngår avtaler med leverandør: LIS-avtaler.
Pasienter «på vent» ble hentet frem, og det var en behandlings topp i 2018-19. Gjeldende LIS-avtale er gyldig fra 01.04.2021 – 31.03.2024.
23 GASTROSKOPET • 1/2023
Situasjonen nå
Hepatitt C-behandlingen har gjennomgått en revolusjon og Norge kan bli et av de første landene i verden til å eliminere HCV-infeksjon. Vi er på god vei til å klare målet innen utgangen av 2023.
Samarbeid med tverrfaglig rusbehandling, LAR-prosjekter, fengsler, allmennpraksis og lavterskeltilbud/sprøyteutdeling identifiserer pasientene og muliggjør tidlig behandling i spesialisthelsetjenesten.
Det er opprettet to løp: Et tradisjonelt med utredning, behandling og oppfølging i spesialisthelsetjenesten, der utredningen er komplett og behandlingen genotypespesifikk.
For pasienten som ikke kan eller evner å følge et slikt løp er det opprettet et forenklet løp, der primærhelsetjenesten kontakter spesialist telefonisk og en pangenotypisk behandling gjennomføres i regi av og med oppfølging fra primærhelsetjenesten. Slik når man også de pasientene som ellers ikke ville møtt på sykehuset. Det gir kort tid fra diagnose til behandling, forenklet diagnostikk og oppfølging, og behandling der pasienten befinner seg. Hepatittsykepleier er tilgjengelig og må være fleksibel og kreativ for å finne gode løsninger. Obs! Dersom pasienten flytter til eller fra institusjon.
Det er viktig å identifisere pasienter som har utviklet cirrhose (risikogrupper: alkohol, DIA II...)
Fortolkning av leverstivhetsmåling:
LSM <10 Kpa: Avansert fibrose/cirrose kan utelukkes
• LSM <12 Kpa: Cirrose kan utelukkes med høy negativ prediktiv verdi
• LSM 10-14 Kpa: Avansert fibrose er sannsynlig
LSM >14 Kpa: Cirrose er sannsynlig
• LSM 20-25 Kpa: Klinisk signifikant portal hypertensjon er mulig
• LSM > 25 Kpa: Klinisk signifikant portal hypertensjon er sannsynlig (Høy risiko for dekompensering)
Fallgruver i behandling av hepatitt C: Interaksjoner
Avansert lever- og nyresykdom
Koinfeksjoner med hepatitt B og HIV
Tiltak for å nå målsettingen: Utdeling av rent brukerutstyr Informasjonsarbeid
Økt testaktivitet
Kommunen har ansvar for det forebyggende arbeidet.
Myter:
Fæl behandling, som cellegift.
Dyr behandling, har ikke råd.
Er så vanskelig å ta blodprøver. Orker ikke all stikkingen. Hepatitt C kan kapsles inn.
De med hepatitt C, men ellers fine blodprøver, trenger ikke behandling.
Fakta:
De med HCV RNA positive kan fortsette i alle typer yrker, med unntak av smittede helsearbeidere som utfører invasive inngrep.
Det finnes ingen vaksine mot hepatitt C.
Selv om en har fått behandling for hepatitt C og oppnådd SVR, kan en bli smittet på ny.
Selv om pasientene er i aktiv rus skal de få tilbud om behandling.
Det anbefales nå behandling for barn fra 3 års alder.
Take home message:
ALLE skal få tilbud om behandling.
Møter du en pasient med hepatitt C, sjekk status. Henvis inneliggende pasienter til behandlende avdeling på ditt sykehus.
Ta eventuelt kontakt med lavterskeltilbud i kommunen. MOTIVER TIL BEHANDLING!
Referanser:
• veileder-hepatitt-c-2022.pdf (legeforeningen.no)
• Hepatitt C - FHI
• Historie - Informasjon om hepatitt c (hepc.no)
• Nasjonal strategi mot hepatitter (regjeringen.no)
Hepatitt C - Oslo universitetssykehus (oslo-universitetssykehus.no)

NYTT FRA GASTROMILJØET 24 GASTROSKOPET • 1/2023
Fra Hands-on med Olympus. Foto: Hege S.Solum
Ulike operasjoner ved overvektskirurgi
Ved Bjørn Gersöne, overlege, avd. For gastroenterologisk kirurgi, Gjøvik sykehus
Definisjon: Sykelig overvekt er en livslang kronisk sykdom som krever livslang behandling.
1/3 av operasjonene utføres privat, 2/3 i det offentlige helsevesenet.
Resultatet er en median BMI på ca 30 etter 5 år.
Overvekt er bl.a. assosiert med diabetes type II, høyt blodtrykk og hjerte-/karsykdom.
Historisk:
900-tallet: en konge på 240 kg kunne ikke ri eller kjempe i krig. Legen sydde igjen munnen på kongen, slik at han var tvunget til ikke å spise.
1966: Første gastric bypassoperasjon (på grunn av kreftsykdom)
1994: Første laparoskopiske gastric bypass Fra 2000: Økende antall operasjoner, duodenal switch, introdusert gastric sleeve.
(kilde: A brief history of gastric bypass)
Virkningsprinsipper: Malnutrisjon og malabsorpsjon, avhengig av type operasjon.
Bakgrunnen er tre hypoteser: foreguthypothesis, hindguthypothesis, og sist incretin-anti incretinhypothesis.
Resultater:
1/3 går ned i vekt: 13 BMI-poeng ved gastric bypass. 11 BMIpoeng ved gastric sleeve.
Sykelig overvekt – kirurgisk behandlingslinje, utredning og oppfølging av pasientene.
Ved Janne Dalby Rostad, sykepleier, seksjon for sykelig overvekt, Gjøvik sykehus.
Årsaker til sykelig overvekt – en kronisk livslang sykdom
Tilgang (på usunn mat)
Sykdommer
Medisiner
Kriterier for henvisning til behandling:
BMI > 40
BMI > 35 med følgesykdommer som er relatert til overvekt, eller kan bedres/kureres ved vektnedgang: DIA II, høyt blodtrykk, søvnapnoe, leddplager relatert til overvekt, hjerte-/
Bedring i DIA hos 50-60 %, høyt blodtrykk hos ca 40 %, OSAS (obesitas sleep apnoe syndrome) hos 70 % og hyperkolesterolemi hos 60 %.
Vektutvikling: 3 av 10 har ikke ønsket effekt. Lavest vekt har de ca 2 år etter operasjonen, deretter går de opp i vekt igjen.
Gastric bypass: Restriktiv, mesteparten av magesekken er stengt av fra spiserøret, men produserer magesaft som skilles ut i duodenum, og metabolsk, tynntarmen syes opptil den nye, mindre magesekken. Duodenum anastomeres lenger ned på tynntarmen.
Gastric sleeve: hovedsaklig restriktiv. Magesekken syes sammen på langs, slik at den danner et rør.
Minibypass: En «kombinasjon» av sleeve og gastric bypass, der magesekken formes som en sleeve, og deretter anastomeres lenger ned på tynntarmen, slik som ved gastric bypass. Gir bare én anastomose.
SASI (sleeve-bypass): Reoperasjon etter gastric sleeve, for å lette på dumpingsymptomer. Gir til gjengjeld mer diaré.
Duodenal switch: brukes lite pga mye komplikasjoner og mye bivirkninger.
Metodevalg bestemmes av vekttap, forekomst av DIA, fremtidig barneønske, superobesitas, alder og samtidig sykdom som f.eks Mb Crohn.
Komplikasjoner er knyttet til anestesi eller operasjonen i seg selv: tromboemboliske hendelser, blødninger, tidlig ileus. Bivirkninger er vanlige og kan være alvorlige.
Pasientene kommer til kontroll etter 6 uker, 6 mndr og 1, 2, 5 og 10 år, og både sykepleier, klinisk ernæringsfysiolog og lokal kirurg er involvert.
karsykdom, PCOS.
BMI > 30 med vanskelig regulerbar diabetes
Refluksplager ved BMI > 32
Veiledende aldersgrenser: 25-60 år, nasjonalt: 18-60 år.
Skal ha prøvd annen konservativ behandling først.
Ved Gjøvik: 70 % behandles konservativt, 30 % behandles kirurgisk.
Videre kriterier for henvisning til operasjon:
Ikke alkoholmisbruk
Ikke medikamentmisbruk
Ikke alvorlig psykisk sykdom
Pasienten må være motivert og i stand til å samarbeide
Må gå ned i vekt preoperativt.
I henvisningen etterspørres en rekke data:
• Sosiale forhold
• Forekomst av fedme, diabetes, og hjerte-kar sykdommer
25 GASTROSKOPET • 1/2023
C T
hos førstegradsslektninger
• Forekomst av følgesykdommer (se over) relatert til overvekten
• Depresjon, angst
• Spiseforstyrrelser
• Vektutvikling (inklusive høyeste vekt)
Tidligere behandlingsforsøk
• Motivasjon for behandling
• Matvaner, aktivitetsnivå
• Oppdatert medikamentliste
Stimulantia
• Høyde, Vekt, BMI, livvidde, hoftevidde
• Blodtrykk
• Laboratorieundersøkelser:
Hb, LPK, CRP, Na, K, Kreatinin, Albumin, Urat, Bilirubin, ASAT, ALAT, GGT, FT4, TSH, HbA1C, Kolesterol, HDL, LDL, Vitamin D, fastende: Glucose, Triglyserider, Insulin og C- peptid
• Urinstix
EKG
• Spirometri
• RTG thorax
Behandlingsforløp mot eventuell overvektskirurgi:
Pasienten får ikke levere behandlingsønske før de har gjennomgått de obligatoriske kursene, og slik fått grundig informasjon om hva behandlingene innebærer.
Mestringskurset går over 6 kursdager à 4 timer og oppmøte er obligatorisk. En fraværsdag kan godkjennes.
Asacol® Tillotts Pharma
Antiinflammatorisk middel, aminosalisylsyrepreparat.
TABLETTER MED MODIFISERT FRISETTING 1600 mg: Hver tablett inneh.: Mesalazin 1600 mg, hjelpestoffer. Fargestoff: Gult og rødt jernoksid (E 172).
Indikasjoner: Ulcerøs kolitt. For behandling av mild til moderat akutt sykdom. For vedlikehold av remisjon. Dosering: Voksne: Dosen bør justeres iht. sykdommens alvorlighetsgrad og toleranse. Vedlikeholdsbehandling: 1600 mg 1 gang daglig. Akutt sykdom: Ved forverring kan dosen økes til 4800 mg 1 gang daglig eller fordelt på 2-3 doser. Ved remisjon bør dosen gradvis reduseres til vedlikeholdsdose. Fortsatt behandling bør vurderes nøye hos personer som ikke har respondert ved uke 8. Andre orale mesalazinformuleringer er tilgjengelige hvis en alternativ dose for vedlikeholdsbehandling anses å være mer hensiktsmessig. Glemt dose: Neste dose tas til vanlig tid. Spesielle pasientgrupper: Nedsatt lever-/nyrefunksjon: Se Kontraindikasjoner og Forsiktighetsregler. Barn og ungdom <18 år: Sikkerhet og effekt ikke fastslått. Eldre: Ikke studert. Gis med forsiktighet, og kun til eldre med normal eller mild til moderat nedsatt nyre- eller leverfunksjon. Samme dosering som for voksne. Administrering: Kan tas med eller uten mat. Skal svelges hele med et glass vann. Skal ikke tygges. Skal ikke knuses eller deles. Kontraindikasjoner: Overfølsomhet for innholdsstoffene eller salisylater. Alvorlig nedsatt lever- eller nyrefunksjon (GFR <30 ml/minutt/1,73 m2). Forsiktighetsregler: Blodprøver (differensial blodtelling, leverfunksjonsparametre som ALAT og ASAT, serumkreatinin) bør tas og urinstatus (dip-sticks) sjekkes før og under behandlingen iht. behandlende leges vurdering. Som en veiledning anbefales oppfølgingsprøver 14 dager etter behandlingsstart, og deretter ytterligere 2-3 prøver med 4 ukers intervall. Ved normale funn bør oppfølgingsprøver utføres hver 3. måned. Ved forekomst av ytterligere symptomer skal prøvene utføres umiddelbart. Nedsatt nyrefunksjon: Bør ikke brukes ved nedsatt nyrefunksjon. Mesalazinindusert nyretoksisitet bør mistenkes dersom nyrefunksjonen svekkes under behandlingen, og behandlingen skal seponeres umiddelbart. Nyrefunksjonen bør overvåkes før og gjentatte ganger under behandlingen. Nyrestein: Er sett, inkl. steiner som består av 100% mesalazin. Det anbefales å sikre tilstrekkelig væskeinntak under behandlingen. Alvorlige kutane bivirkninger (SCAR): SCAR, inkl. Stevens-Johnsons syndrom og toksisk epidermal nekrolyse (TEN), er rapportert. Behandlingen bør avbrytes ved første tegn/symptomer på alvorlige hudreaksjoner, slik som utslett, slimhinnelesjoner eller andre tegn på overfølsomhet. Bloddyskrasi: Er sett. Behandlingen skal seponeres umiddelbart ved mistanke om eller bevis på bloddyskrasi (tegn som uforklarlig blødning, blåmerker, purpura, anemi, vedvarende feber eller sår hals), og pasienten skal umiddelbart oppsøke medisinsk hjelp. Nedsatt leverfunksjon: Økte leverenzymnivåer er sett. Forsiktighet anbefales ved nedsatt leverfunksjon. Kardiale overfølsomhetsreaksjoner: Mesalazininduserte overfølsomhetsreaksjoner (myo- og perikarditt) er sett. Ved mistanke om kardial overfølsomhet, må preparatet ikke gis på nytt. Forsiktighet bør utvises ved tidligere myo- eller perikarditt grunnet allergisk bakgrunn uavhengig av årsak. Pulmonær sykdom: Pasienter med pulmonær sykdom, spesielt astma, bør følges opp nøye under behandlingen. Overfølsomhet for sulfasalazin: Pasienter som har fått bivirkningsreaksjoner ved sulfasalazinbehandling bør være under nøye medisinsk overvåkning. Behandling må seponeres umiddelbart ved akutte symptomer på intoleranse, f.eks. magekramper, akutte magesmerter, feber, alvorlig hodepine og utslett. Mage- og duodenalsår: Forsiktighet anbefales ved eksisterende mage- eller duodenalsår. Hjelpestoffer: Inneholder <1 mmol (23 mg) natrium pr. tablett, og er så godt som natriumfritt. Bilkjøring og bruk av maskiner: Ikke studert. Ingen/ubetydelig påvirkning. Interaksjoner: For utfyllende informasjon om relevante interaksjoner, bruk interaksjonsanalyse. Ingen interaksjonsstudier er utført. Mesalazin kan redusere den antikoagulerende effekten av warfarin. Forsiktighet anbefales ved samtidig bruk av mesalazin og kjente nefrotoksiske midler, inkl. NSAID og azatioprin, eller metotreksat, ettersom disse kan øke risikoen for renale bivirkninger. Ved samtidig behandling med azatioprin, 6-merkaptopurin eller tioguanin, bør det tas hensyn til mulig økning i myelosuppressive effekter av disse legemidlene. Livstruende infeksjon kan oppstå. Pasienten bør observeres nøye for tegn på infeksjon og myelosuppresjon. Hematologiske parametre, spesielt celletelling av leukocytter, trombocytter og lymfocytter, bør overvåkes regelmessig (ukentlig), spesielt ved oppstart av slik kombinasjonsbehandling. Graviditet, amming og fertilitet: Graviditet: Ingen adekvate data. Data fra et begrenset antall graviditeter indikerer ingen bivirkninger ved graviditet eller hos foster/nyfødt barn. I et enkelt tilfelle, etter langtidsbruk av en høy dose mesalazin (2-4 g, oralt) under graviditet, ble det rapportert nyresvikt hos en nyfødt. Dyrestudier på oral mesalazin indikerer ingen direkte eller indirekte skadelige effekter mhp. graviditet, embryo-/fosterutvikling, fødsel eller utvikling etter fødsel. Bør bare brukes under graviditet hvis mulig fordel oppveier mulig risiko. Amming: N-acetyl-5-aminosalisylsyre og i mindre grad mesalazin utskilles i morsmelk. Klinisk signifikans ikke fastslått. Begrenset erfaring. Overfølsomhets-
Innhold:
• Introduksjon - Bli kjent - Grupperegler
Hva er et sunt kosthold - hvilke muligheter for endring finnes
• Endringsprosessen - hva kreves av deg
• Kirurg – bakgrunn for behandling av overvekt, operasjon, komplikasjoner og bivirkninger
Psykolog - Hud/ hår - Følelser - Relasjoner
• 3 brukere forteller sin erfaring
• Selvhjelp
Fra 10 dgr e/operasjon anbefales livslangt tilskudd av:
2 multivitamin
Calcigran forte
B12 , (injeksjon el Behepan)
Jern (e/blodprøver)
Ursofalk første 6 mndr til de som ikke er cholecystectomert.
NSAIDs anbefales ikke til overvektsopererte. Graviditet frarådes de første 18 mndr etter operasjon.
Etterkontroller ved seksjonen, ved KEF eller sykepleier, etter 6 uker, 6 mndr, 1,2,5, og 10 år.
Kontroll hos fastlege 10 dgr e/operasjon for fjerning av sting og kontroll av medisiner. Anbefalt kontroll hver 6 mnd resten av livet. Gjennomgår vekt, blodprøver, generell status og tilskudd, samt hvordan du har det. Disse kontrollene bestiller pasientene selv.
reaksjoner som f.eks. diaré hos spedbarn kan ikke utelukkes. Bør derfor bare brukes under amming hvis mulig fordel oppveier mulig risiko. Hvis spedbarnet utvikler diaré, bør ammingen avbrytes. Fertilitet: Effekt på fertilitet er ikke sett.
Bivirkninger: Vanlige (≥1/100 til <1/10): Gastrointestinale: Dyspepsi. Hud: Utslett. Mindre vanlige (≥1/1000 til <1/100): Blod/lymfe: Eosinofili (som del av en allergisk reaksjon). Generelle: Brystsmerter, feber. Hud: Kløe, urticaria. Nevrologiske: Parestesi. Sjeldne (≥1/10 000 til <1/1000): Gastrointestinale: Diaré, flatulens, kvalme, magesmerter, oppkast. Hjerte/kar: Myokarditt, perikarditt. Hud: Lysoverfølsomhet. Nevrologiske: Hodepine, svimmelhet. Svært sjeldne (<1/10 000): Blod/lymfe: Bloddyskrasi, endrede blodverdier (aplastisk anemi, agranulocytose, pancytopeni, nøytropeni, leukopeni og trombocytopeni). Gastrointestinale: Akutt pankreatitt. Hud: Alopesi. Immunsystemet: Overfølsomhetsreaksjoner som allergisk utslett, legemiddelrelatert feber, erytematøs lupus-syndrom, pankolitt. Kjønnsorganer/bryst: Oligospermi (reversibel). Lever/galle: Endringer i leverfunksjonsparametre (økning i transaminaser og kolestaseparametre), hepatitt, kolestatisk hepatitt. Luftveier: Allergiske og fibrotiske lungereaksjoner (inkl. dyspné, hoste, bronkospasme, alveolitt, pulmonær eosinofili, lungeinfiltrasjon, pneumonitt), eosinofil pneumoni, interstitiell pneumoni, lungelidelse. Muskel-skjelettsystemet: Artralgi, myalgi. Nevrologiske: Perifer nevropati. Nyre/urinveier: Nefrotisk syndrom, nyresvikt (kan være reversibel ved tidlig seponering). Nedsatt nyrefunksjon inkl. akutt og kronisk interstitiell nefritt og nyreinsuffisiens. Ukjent frekvens: Generelle: Intoleranse mot mesalazin og/eller forverring av underliggende sykdom, økt CRP. Hud: Stevens-Johnsons syndrom, toksisk epidermal nekrolyse. Luftveier: Pleuritt. Muskel-skjelettsystemet: Lupuslignende syndrom med perikarditt og pleuroperikarditt som prominente symptomer, samt utslett og artralgi. Nyre/urinveier: Nyrestein. Undersøkelser: Redusert kreatininclearance, redusert vekt, økt SR, økt amylase, økt karbamid i blod, økt kreatinin i blod, økt lipase.
Overdosering/Forgiftning: Symptomer: Mesalazin er et aminosalisylat, og tegn på salisylattoksisitet inkluderer tinnitus, vertigo, hodepine, forvirring, søvnighet, pulmonært ødem, dehydrering som følge av svetting, diaré og oppkast, hypoglykemi, hyperventilering, forstyrrelse av elektrolyttbalanse og pH i blod, og hypertermi. Behandling: Konvensjonell behandling av salisylattoksisitet kan være fordelaktig ved akutt overdosering. Hypoglykemi, væske- og elektrolyttforstyrrelser bør korrigeres med passende behandling. Tilstrekkelig nyrefunksjon bør opprettholdes. Se Giftinformasjonens anbefalinger A07E C02 på www. felleskatalogen.no. Egenskaper: Virkningsmekanisme: Lokal antiinflammatorisk effekt på slimhinneceller i tykktarmen via mekanismer som ikke er fullstendig klarlagt. Hemmer LTB4-stimulert migrering av intestinale makrofager ved å hindre migrasjon av makrofager til betente områder. Produksjonen av proinflammatoriske leukotriener (LTB4 og 5-HETE) i makrofager i tarmveggen blir dermed hemmet. Aktiverer PPAR--reseptorer som motvirker nukleær aktivering av inflammatorisk respons i tarmen Absorpsjon: Frisetting av mesalazin starter ved pH >7, dvs. i terminal ileum og kolon. Biotilgjengelighet ca. 31% (tatt fastende). Cmax og AUC øker 1,5 ganger når en enkeltdose tas fastende sammenlignet med ikke-fastende (hos friske). Proteinbinding: Ca. 43% mesalazin og 78% N-acetyl mesalazin er bundet til plasmaproteiner. Fordeling: Gjennomsnittlig Vd er 12,1 liter/kg. Halveringstid: Median eliminasjons t1/2 av mesalazin er 20 timer (5-77 timer). Metabolisme: I tarmslimhinnen og leveren. Utskillelse: 60 timer etter administrering av en enkeltdose på 1600 mg gjenfinnes ca. 23% (tatt med mat), og 31% (tatt fastende), i urin. Pakninger og priser: 60 stk.1(blister) kr 964,50
Refusjon: 1Se A07E C02_2 i Refusjonslisten.
Sist endret: 08.06.2021
Basert på SPC godkjent av SLV/EMA: 20.05.2021
NYTT FRA GASTROMILJØET
ATC-nr.: A07E C02.
PM-Asa-NO-00066. THAU
Tabletten med høyest mesalazin-styrke
Dosering i 3 enkle trinn1
utvalgt sikkerhetsinformasjon2
Kontraindikasjoner Overfølsomhet for noen av innholdsstoffene eller for salisylater. Alvorlig nedsatt lever- eller nyrefunksjon. Forsiktighetsregler Blodprøver og urinstatus bør fastslås både før og under behandling. Bør ikke brukes hos pasienter med nedsatt nyrefunksjon. Behandling skal seponeres umiddelbart hvis det er mistanke om eller bevis på bloddyskrasi. Forsiktighet må utvises ved følgende tilstander: Svekket leverfunksjon, pulmonær sykdom spesielt astma, tidligere myo- eller perikarditt, eksisterende mage- eller duodenalsår og hos pasienter som tidligere har hatt bivirkninger av sulfasalaziner. Behandlingen bør avsluttes umiddelbart ved magekramper, akutte magesmerter, feber, alvorlig hodepine og utslett. Alvorlige kutane bivirkninger (SCAR), behandling bør avbrytes ved første tegn på og symptomer i form av alvorlige hudreaksjoner slik som utslett, slimhinnelesjoner eller andre tegn på overfølsomhet. Nyrestein: er sett, sikre tilstrekkelig væskeinntak.
Vanlige bivirkninger (≥1/100 til <1/10) Gastrointestinale: Dyspepsi Hud: Utslett
Ta kontakt med Ann-Elin Selbekk på tlf: 900 82 081 eller Ingunn Skeie på tlf: 900 60 952 Tillotts Pharma AB | Gustavslundsv. 135, 167 51 Bromma | Tel: +46 8-704 77 40 | nordicinfo@tillotts.com | www.tillotts.se
PM-Asa-NO-00066. THAU
Referanser: 1. ASACOL SPC avsnitt 4.2, sist oppdatert 20.05.2021. 2. ASACOL SPC avsnitt 4.3, 4.4 og 4.8, sist oppdatert 20.05.2021.
Høy Lav Moderat SYKDOMSAKTIVITET ved akutt sykdom opptil 3 tabletter en gang daglig som startdose
tabletter en gang daglig for å oppnå remisjon
2
1 tablett en gang daglig for å opprettholde remisjon
Referater fra fredag 10 februar
Norwegian IBD Study Group (NISG)

Referent: Rebecca Foreman
Petr Ricanek, overlege ved Lovisenberg diakonale sykehus.
Ignacio Catalan-Serra, Overlege PhD ved Levanger sykehus og NTNU, presenterte nettsiden Norwegian IBD Study Group (NISG), som nylig ble lansert, 14.januar 2022. NISG er opprettet av Interessegruppen for inflammatorisk tarmsykdom (IBD, som er underlagt Norsk gastroenterologisk forening (NGF), spesialistforening under Den norske legeforening (DNLF).
Robot kirurgi
Referent: Rebecca Foreman
Thomas Heggelund, overlege ved avdeling for gastrokirurgi, Akershus universitetssykehus.
Thomas Heggelund leverte en spennende presentasjon om robot kirurgi, hvor vi fikk se film av en rektumsamputasjon, gjort med denne teknikken. Den første roboten, Da Vinci, kom til Europa i 1999. Nå er det ca. 30 roboter i Norge.
I 2019 fikk Akershus den første roboten. Robotkirurgi kan brukes til å operere på colon, rektum, ventrikkel, brokk og cholecystektomier. Robotkirurgi er minimal invasiv metode
NISG skal være åpen for helsepersonell med interesse innen IBD for å fremme tverrfaglig nettverksbygging og samarbeid. Deres visjon er å være en kvalitetsbasert og uavhengig plattform innen undervisning og forskning, og målet er å forbedre livskvaliteten til mennesker som er rammet av IBD.
IBD i Norge har en stigende trend, og det antas at ca. 1% (50 000 mennesker) av den norske populasjonen vil ha en IBD-diagnose i 2030.
Ignacio oppfordret helsepersonell til å oppsøke nettsiden www.nisg.no. Den inneholder blant annet retningslinjer, forskning, foredrag og generell informasjon om IBD, som er til nytte for helsepersonell som jobber med denne pasientgruppen. I tillegg har nettsiden et eget pasientområde, som kan være til hjelp for pasient og pårørende.
og har en rekke fordeler som mindre smerter postoperativt og mindre risk for komplikasjoner.
Opplæring kreves før bruk, både i form av teorikurs og trening. Det trenes først på dyr, deretter mennesker.
Under operasjonen er det en hovedoperatør som styrer maskinen med hender og føtter. Dette er ergonomisk bedre for kirurgen, da de kan sitte under operasjonen og ha full bevegelighet av utstyret. Ved robotkirurgi har hovedoperatør også et bedre 3D bilde enn ved vanlig lapraskopi. Under operasjonen står assisterende operatør ved pasienten. Ved store komplikasjoner må det i noen tilfeller konverteres til lapratomi.
NYTT FRA GASTROMILJØET 28 GASTROSKOPET • 1/2023
Ivrige deltagere på Hands-on.
Etseskader og behandling
Referent: Une Melby Hauge

Kim Vidar Ånonsen, overlege ved Oslo Universitetssykehus, Ullevål.
Hovedandelen av pasienter med syreskader er barn som får det i seg ved uhell. Den voksne andelen av pasientene er ofte suicidale eller psykotiske, eller får i seg stoffene ved uhell eller “partytriks”.
Kaustiske væsker er sterke baser, inkludert alkalier, som for eksempel lut, natrium – og kaliumhydroksid. Disse stoffene gir “alkalisk skade”.
Korrosjon oppstår når man er i kontakt med etsende væsker, som syrer, baser, oksiderende stoffer, batterier osv.
Kaustiske vs. syreskader
Kaustiske stoffer er ofte faste eller tyktflytende, og gir bløte nekroser. De gjør størst skade i spiserøret, før de bufres i magesekken.
Syrer bufres ikke siden magesekken allerede har et surt miljø, og gir koagulasjonsnekroser.
“Licks the oesophagus and bites the pyloric antrum”.
Akutte tiltak er støttebehandling. Antidot skal ikke gis, da bufring (nøytralisering) gir varmeutvikling!
Pasienten bør ikke kaste opp, for å unngå re-eksponering av spiserøret. Metoklopramid (kvalmestillende) kan gis. Det skal ikke legges nasogastrisk sonde tidlig i forløpet, og pasienten bør ligge med hevet overkropp.
Dersom du ikke er kjemiker: Ring giftinformasjonen!
Dersom syrer og baser svelges i etsende konsentrasjon bør videre oppfølging skje på sykehus.
Tidlig behandling:
• Nasogastrisk sonde (dette er diskutabelt, og ikke rutinemessig).
Protonpumpehemmere (det finnes ingen gode studier på dette, men sannsynligvis ja).
• Ikke steroider.
• Bredspektret antibiotika - dekning gis av og til, men er ikke rutine.
• Det skal absolutt ikke legges strikturforebyggende stent!
Den tidlige utredningen består av laboratorieprøver, CT, endoskopi innen 24 timer (3 – 24 timer), og observere pasienten for å fange opp kliniske tegn til perforasjon.
Når etseskadene skal vurderes endoskopisk brukes Zargar, som er et endoskopisk graderingssystem.
Grad 0: Normale slimhinner
Grad 1: Ødem og rubor
Grad 2a: Overflatiske, lokaliserte ulcerasjoner, skjør slimhinne og blemmer.
Grad 2b: Cirkumferensielle og dype ulcerasjoner.
Grad 3a: Multiple, dype sår med små, spredte områder med nekroser.
Grad 3b: Utbredte nekroser.
Tidlig risikostratifisering utføres for å vurdere behov for konservativ behandling eller kirurgi.
CT – grad 1 (endoskopigrad 1 og 2a) - Tidlig utskrivelse.
CT – grad 2 (endoskopigrad 2b og 3a) - Tett monitorering
CT – grad 3 (endoskopigrad 3b) - Kirurgi.
Pasientene får jejunal ernæring, men kan få peroral så snart de kan svelge vann som normalt.
Komplikasjoner som blødninger og fistler er relativt sjeldne. Cirka 3 % får blødninger, 3 % får trakeoøsofageale fistler og 2 % får aortoøsofageale fistler. Senkomplikasjoner i form av strikturer kan ofte forutses. Strikturer opptrer sjelden hos pasienter med Zargar 1 og 2a, mens 50 – 80 % av pasientene med Zargar 2b og 3a får det. Da er det viktig å komme tidlig i gang med dilatasjonsbehandling, men ikke før det har gått tre uker.
Kjempesene komplikasjoner: Plateepitelcarcinom?
2414 mennesker fikk spiserørskreft i Helsinki i tidsrommet 1945 – 1970. 63 av disse hadde tidligere hatt lutskade i en gjennomsnittsalder av seks år. Det tok gjennomsnittlig 41 år fra skade til utviklet kreft.
Konklusjon:
Endoskopi og CT som tidlig utredning hos de potensielt alvorlige skadene.
• Strikturer kan ofte forutses. Ikke vent for lenge med å starte dilatasjonene.
Plasser etsende stoffer på øverste hylle!
29 GASTROSKOPET • 1/2023
Fra Hands-on med Avanos. Foto: Hege S. Solum
Radiologisk anleggelse av gastrostomitube
Referent: Une Melby Hauge
Dan Levi Hykkerud, radiolog ved seksjon intervensjon, Akershus Universitetssykehus.
Perkutan radiologisk gastrostomitube har siden 1980-tallet vist seg å være trygt og gi høy pasientkomfort. Inngrepet har høy teknisk suksess, resultatmessig omtrent som PEG, og inngrepet/ prosedyren er førstevalget mange steder.
Hovedgruppen av pasienter er nevrologiske (eks. Slag, ALS), øre - nese – halstumorer, mediastinale oppfyllinger og andre tilstander der enteral ernæring er vanskelig.
Endoskopisk perkutan gastrostomi (PEG) den mest brukte teknikken i dag, men gjennomlysningsveiledet teknikk, PRG (perkutan radiologisk gastrostomi) er et godt supplement, med nær 100 % suksessrate.
Sondeokklusjon, dislokasjon av sonden, perisondal lekkasje, overflatisk stomal infeksjon og liten blødning er små komplikasjoner som kan oppstå. Større komplikasjoner er abscess, tarmperforasjon, peritonitt, blødning og dyp stomal infeksjon.
Teknikker
Det legges ned en nasogastrisk sonde hvor man blåser
Sykepleierdrevet PEG poliklinikk på medisinsk undersøkelsesavdeling, Haukeland sykehus
Referent: Åshild Torgersen
Gro Vigdis Aas Børve, sykepleier ved Haukeland universitetssykehus
Medisinsk avdeling ved Haukeland universitetssykehus har hatt sykepleierdrevet PEG-poliklinikk i mange år. På 90-tallet ble det etablert en praksis med to sykepleiere tilknyttet denne poliklinikkvirksomheten. Bakgrunnen var at en så at pasienter med PEG, og helsepersonell som stelte og pleiet pasienter med PEG, hadde behov for å ha et sted å ta kontakt, for å få råd, veiledning og konsultasjon.
Antall PEG
I 2020 ble det registrert 82 endoskopiske PEG-innleggelser og i 2022, 102. I tillegg er det et antall PEG som blir lagt inn kirurgisk. Dette utgjør en stor andel pasienter med PEG.
opp ventrikkelen for så å stikke gjennomlysningsveiledet. Noen setter ned 300 – 500 ml. vann, slik at man kan stikke ultralydveiledet. Dersom man ikke kan legge ned nasogastrisk sonde, brukes et diagnostisk kateter (4 – 5 Fr.) alene eller guidet med hydrofil wire før man inflaterer ventrikkelen. Det brukes også ulike teknikker etter at man har stukket: Anleggelse av gastropeksi via ulike system, 1 – 3 suturer. • Ulike dilatorsett over stiv wire før “peel away sheet” hvor et ballongfiksert 14 – 18 Fr. ernæringskateter føres inn. Antegrad innleggelse er også mulig etter retrograd tilgang. En fører et kateter eller en wire ut av munnen og drar “endoskopisk” sonde ned og ut ved hjelp av en slynge eller tang.
14 French og oppover er å foretrekke. AHUS bruker 18 Fr. På Akershus universitetssykehus gjøres det på følgende måte:
Pasienten faster i seks timer for fast føde og fire timer for væske. Blødningsstatus tas og det legges ned en nasogastrisk sonde, dersom dette er mulig. Pasienten blir overvåket med EKG, saturasjon, respirasjonsfrekvens og blodtrykk. Så inflateres ventrikkelen for å se egnet punksjons sted under gjennomlysning før vask utføres.
AHUS har egen folder med informasjon om stell og bruk av sonden etter lokalt PEG-regime.
PEG-sonden kan tas i bruk fire timer etter inngrepet. Kanalen vil danne seg etter 1 – 2 uker.
Poliklinikken
Poliklinikken har sett et behov for oppfølging av pasienter med innlagt PEG og i dag er antall ressurssykepleiere på PEGpoliklinikk vokst til fem sykepleiere. Hver torsdag har en sykepleier satt av en dag med timelister for oppfølging av pasienter. Alle pasientene får en informasjonsmappe som forteller dem hvilken type PEG de har, gir dem informasjon om stell og bruk, samt telefonnummer inn til poliklinikken, for å ta kontakt ved behov.
Daglig kommer det henvendelser fra pasient, pårørende eller helsepersonell. Det er sekretær som tar imot henvendelser per telefon, noterer problemstillingen og viderefører denne til sykepleier. Er det en akutt sak, finner sekretær tid til at pasienten kan komme inn raskt. PEG-sykepleier får da satt av tid ved at kollegaer avløser PEG-sykepleierne fra annet arbeid, til å hjelpe pasienter som trenger hjelp med sin PEG. Informasjon og veiledning er en viktig del av funksjonen.
Vanlige oppgaver på PEG-poliklinikken
• Bytte av type sonde
• Fjerning av anker 14 dager etter anleggelse av bolussonde Skifte av bolussonde hver 4. måned.
Veilede andre helsepersonell
• Skifte av PSJ – percutan surgical jejunostomi
• Hjelpe pasienter som er plaget med lekkasje,
NYTT FRA GASTROMILJØET 30 GASTROSKOPET • 1/2023
I LIVE ELLER LEVE?
Revestive gir økt frihet1 63 % av pasientene som ble behandlet med Revestive fikk minst 20 %reduksjon fra baseline i ukentlig PN/IV-volum mot 30 % med placebo etter 6 måneder1
UTVALGT PRODUKT- OG SIKKERHETSINFORMASJON 2
REVESTIVE (teduglutid)
1,25 mg og 5 mg, pulver og væske til injeksjonsvæske, oppløsning
Indikasjon: Til behandling av pasienter ≥1 år med kort tarm-syndrom («short bowel syndrome», SBS). Pasienten bør være stabil etter en periode med intestinal adapsjon etter kirurgi.
Kontraindikasjoner: Overfølsomhet for tetrasyklinrester. Aktivt eller mistenkt malignitet. Malignitet i mage-tarmkanalen, inkl. lever- og gallesystemet samt pankreas i løpet av de siste 5 årene Forsiktighetsregler: En koloskopi med fjerning av polypper bør gjennomføres ved oppstart av behandling. Før behandlingsoppstart hos barn bør det tas prøver for okkult blod i avføringen, deretter årlige prøver. Ved symptomer relatert til galleblæren eller galleganger, bivirkninger i pankreas, gjentagende tarmobstruksjon skal behovet for fortsatt behandling med Revestive revurderes. Bør ikke brukes under graviditet og amming.
Hyppigst rapporterte bivirkninger: Abdominal smerte og distensjon, luftveisinfeksjoner (inklusiv nasofaryngitt, influensa, øvre luftveisinfeksjon og nedre luftveisinfeksjon), kvalme, reaksjoner på injeksjonsstedet, hodepine og oppkast. Pasienter med gastrointestinal stomi opplevde komplikasjoner med stomien.
Dosering: Preparatnavn og produksjonsnr. skal noteres i pasientjournalen. Behandling av voksne og barn skal startes opp under veiledning av helsepersonell med erfaring i behandling av hhv. SBS og pediatrisk SBS. Optimalisering og stabilisering av i.v. væske og ernæring bør være gjennomført før behandlingsstart. Voksne inkl. eldre >65 år: Hetteglass 5 mg: 0,05 mg/kg kroppsvekt 1 gang daglig. Forsiktig nedtitrering av daglig dose kan vurderes for å optimere toleransen av behandlingen. Rekonstituert Revestive gis som s.c. injeksjon i magen, ev. i låret hvis dette ikke er mulig. Skal ikke gis i.v. eller i.m. Barn og ungdom ≥1-17 år: 0,05 mg/kg kroppsvekt 1 gang daglig. Kroppsvekt >20 kg: Hetteglass 5 mg brukes.

Pakninger, priser og refusjon: 1,25 mg: 1 sett (28 hettegl. m/pulver + 28 ferdigfylte sprøyter m/oppløsningsvæske) kr. 110 579,10. H-resept. 5 mg: 1 sett (28 hettegl. m/pulver + 28 ferdigfylte sprøyter m/oppløsningsvæske) kr. 226537,10. H-resept.
Reseptgruppe: C.
For fullstendig preparatomtale, se Revestive SPC (godkjent 17.05.2022) www.legemiddelsok.no
REFERANSER
Jeppesen PB, Pertkiewicz M, Messing B, et al. Teduglutide Reduces Need for Parenteral Support Among Patients With Short Bowel Syndrome With Intestinal Failure. Gastroenterology. 2012;143(6):1473-81
2. Revestive SPC (godkjent 17.05.2022) avsnitt 4.1-4.6 og 4.8. Se www.legemiddelsok.no
1.
Takeda AS • Postboks 205 • 1372 Asker • Tlf. 800 800 30 • www.takeda.no • C-APROM/NO/REV/0060/14042 • Utarbeidet september 2022
sår hud og villkjøtt
• Skifte av kombinasjonssonder til både ventrikkel og tynntarm. Dette gjøres i samarbeid med radiograf, gastrolege og peg-sykepleier.
Etter hver konsultasjon skriver sykepleier et poliklinisk notat om hva som er gjort, samt koder konsultasjonen. Sekretær tar hånd om videre plan med evt. ny time med oppfølging på PEG-poliklinikken.
Innleggelse PEG, Push/Pull teknikk
Referent: Åshild Torgersen
Janna Kyllingstad, sykepleier ved gastroenterologisk poliklinikk, Stavanger universitetssykehus
Janna Kyllingstad har mange års erfaring fra gastromedisinsk poliklinikk og presenterte ulike stomisonder og teknikker for innleggelse. I Stavanger har de opparbeidet rutiner med gode pasientforløp, fra henvisning om innleggelse av ernæringssonde til pasienten har fått PEG.
Ulike typer gastrostomier
Gastrostomi er en åpning gjennom huden til magesekken, der det er ført en gastrostomisonde gjennom kanalen, for å kunne tilføre væske, ernæring og medisiner. Etter 6-8 uker er gastrostomien dannet og gastrostomisonden holdes på plass inne i magesekken med en ballong, eller en pute/plate. Det finnes ulike typer gastrostomier i mange ulike størrelse. Janna vektla viktigheten med å forstå og kunne forskjellen på en PEG, PEG-J og PEJ, der de sistnevnte ofte blir forvekslet og kan ha konsekvenser i forbindelse med bruk, stell og seponering. PEG står for Percutan Endoskopisk Gastrostomi og er en åpning gjennom bukveggen og inn i ventrikkelen. Tilsvarende åpning har en PEG-J, men forskjellen er at ernæringssonden strekker seg ned til jejenum. En PEJ står for Percutan Endoskopisk Jejunostomi og er en åpning gjennom bukvegg og inn til jejenum.
Indikasjon
Det er indikasjon for anleggelse av PEG hos barn og voksne med ernæringsproblem som på grunn av nevrologiske årsaker (f.eks. slag og ALS), strikturforandringer eller deformasjoner, akutt eller kronisk sykdom, samt på grunn av avlastning trenger ernæring via sonde. Pasienten skal ha forventet behov for enteral ernæring i mer enn 3-4 uker, og ha leveutsikter på mer enn 4 uker. Lege vurderer, i samarbeid med sykepleier, hva som er etisk riktig i hvert enkelt tilfelle.
Teknikker
Innleggelse av stomisonde gjøres enten kirurgisk, radiologisk eller endoskopisk i narkose ved hjelp av Pull eller Push teknikk.
Samarbeid
PEG-poliklinikken har et godt samarbeid med både medisinske og kirurgiske gastroleger, som kommer på tilsyn av pasienter der hvor det er behov. PEG-sykepleierne bruker ofte hverandre og går ofte sammen der hvor det er litt kompliserte caser.
PEG Pull-teknikk er en enkel metode og er standard i Stavanger på voksne. Teknikken gjøres via endoskop. Navnet «pull» er fordi sonden trekkes på plass magesekken opp mot bukveggen ved hjelp av en fast innvendig plate og regulerbar stoppeplate på utsiden. Det skal være en klaring på 0,5 cm mellom hud og plate.
En PEJ Pull-teknikk brukes sjeldnere og er teknisk mer krevende enn PEG innleggelse. Indikasjoner for en PEJ er gjennomgått kirurgi i øvre GI traktus eller obstruksjon i distale ventrikkel. En PEJ legges ofte kirurgisk.
Observasjoner umiddelbart etter pull-teknikk med innleggelse av gastrostomisonde er ødem, stabilitet, lekkasje og evt. vektoppgang. Pull sonden er enkel i bruk og kan ligge opptil 1 år, men kan etter 6-8 uker byttes til gastrostomiport.
Ved PEG push-teknikk (direkte anlagt PEG) lages stomien ved å «pushe»/blokke PEG direkte inn i ventrikkelen gjennom bukveggen. Metoden velges ved sykdom i munn, svelg eller spiserør og er standard på barn. Metoden passer også godt for oppegående og aktive voksne personer da den har en lavere profil. Push sonder holdes på plass av en vannballong i ventrikkelen og har en stoppeplate på utsiden som skyves ned til hudnivå. Sonden kan ligge opptil 8-9 måneder og byttes vanligvis hver 3-6 måned.
Push PEG med jejunalsonde brukes til pasienter med aspirasjons fare eller striktur som gir passasje hinder. Sonden har to kanaler; en kanal til ventrikkel med mulighet for å tømme og utlufte og en kanal til jejunum for ernæring. Sonden holdes på plass i ventrikkelen av en ballong med vann og må ikke roteres fra utsiden med fare for å dislosere.
Observsjoner etter anlagt push PEG er knappens/stoppeplatens avstand til hud, vann i ballongen, at ankerfestene/ bumperne er festet med selvoppløselig tråd og faller av etter 3-6 uker, samt hos barn er det vanlig at bumperne fjernes etter 14 dager.
Observasjoner etter PEG innleggelse
Smerter, økende buk omfang
Blødning og hevelse fra innstikkstedet
• Lavt BT, høy puls, klam
• Fallende Hb
Feber
NYTT FRA GASTROMILJØET 32 GASTROSKOPET • 1/2023
Hensyn etter innleggelse av PEG
• Tas i bruk etter 6 timer.
• Pasienten faster i 6 timer
Tørr bandasje skal ligge på 48 timer etter anleggelse av gastrostomi.
• Holdes sterilt i 48 timer
• Etter fire dager kan pasienten dusje, men må unngå å bade til stomikanalen er etablert (ca. fire til seks uker).
Komplikasjoner ved PEG
Abscess eller infeksjon rundt stomi som krever antibiotika
• Peritonitt
• Fri luft i buken
• Blødning Perforasjon eller skade av andre organer (tarm, lever, milt)
• Dislokasjon av sonde før kanalen er etablert
• Irritasjon og sår
Pasientforløp på SUS
I Stavanger legges det ca. 80-90 PEG per år. Det gjøres alltid i narkose, med et team bestående av to leger og to
PROM ved IBD: state of the art 2022
Referent: Maren Josefine Kvarsnes
Lars-Petter Jelsness-Jørgensen, sykepleier og rektor ved Høgskolen i Østfold.
Lars-Petter Jelsness-Jørgensen holdt et interessant innlegg om PROM ved Inflammatorisk tarmsykdom (IBD). PROM står for Patient Reported Outcome Measures. Dette kan
Therapeutic drug monitoring
Referent: Maren Josefine Kvarsnes
Jørgen Jahnsen, professor ved avdeling for gastromedisin ved Akershus universitetssykehus.
Jørgen Jahnsen holdt et spennende foredrag om Therapeutic drug monitoring (TDM) ved IBD. TDM er persontilpasset behandling med terapeutisk legemiddelmonitorering. Det brukes for å optimalisere effekt og sikkerhet av Infliksimab og andre TNF-alfahemmere hos pasienter med IBD. Man skiller mellom proaktiv og reaktiv TDM. Ved proaktiv TDM måler man legemiddelkonsentrasjon regelmessig for å holde serumnivået i terapeutisk vindu og for å oppdage antistoffer.
sykepleiere. Henvising av PEG innleggelsen blir fortløpende vurdert av lege mtp hastegrad, teknikk, antikoagulantia, PEG type og pasientens funksjonsnivå.
Det er utarbeidet et flytskjema med sjekklister for innleggelse av PEG, for å sikre gode pasientforløp før, under og etter innleggelsen av PEG. PEG sykepleier besøker pasienten dagen før og dagen etter innleggelsen av PEG-sonden. Etter 14 dager får pasienten telefonkonsultasjon med PEGsykepleier. I tillegg kan pasienten, pårørende eller helsepersonell ringe avdelingen dersom behov ved spørsmål, problemstillinger og videre plan.
Ønske om nasjonalt samarbeid
Avslutningsvis fremmer Janna et ønske om et nasjonalt forum for PEG, som kan gi et bedre samarbeid, hvor erfaringer kan utveksles og hvor en kan lære av hverandre. Kanskje kunne en utarbeidet nasjonale retningslinjer eller e-læring med opplæring og informasjon?
over settes til norsk som pasientrapporterte utfallsmål, altså pasientens egen opplevelse. PROM er en paraplybenevnelse som blant annet omhandler symptomvurdering, fysisk funksjon, fatigue og livskvalitet. PROM benyttes i økende grad i kliniske studier og i registre. Dokumentasjon av nytteverdi i klinisk praksis er begrenset, delvis på grunn av mangel på gode studier. De studiene som er gjort viser at bruk av PROM i klinisk praksis blant annet kan bedre kommunikasjon, bedre behandlingsopplevelsen til pasienten og gi tidligere og bedre håndtering av bivirkninger. Pasientene er generelt positive til PROM, men det må brukes riktig. Pasienten skal være i sentrum for utvikling og valg av PROM, også i klinisk praksis.
Dette kan forebygge behandlingssvikt og unngå overdosering. Ved reaktiv TDM måler man legemiddelkonsentrasjon for å løse et klinisk problem, for eksempel en for verring. I Norge har man gjennomført en studie som kalles The Norwegian Drug Monitoring trials (NORDRUM). I denne studien har man undersøkt om proaktiv TDM er bedre enn standard dosering av Infliksimab. Studien er delt inn i NORDRUM A og NORDRUM B. Ved NORDRUM A har man undersøkt bruk av TDM i induksjonsbehandling. Konklusjonen er at dette ikke førte til at flere pasienter oppnådde klinisk remisjon, men det var færre infusjonsreaksjoner ved bruk av proaktiv TDM i induksjonsbehandlingen. Ved NORDRUM B undersøkte man bruk av TDM ved vedlikeholdsbehandling. Konklusjonen er at proaktiv TDM ved vedlikeholdsbehandling er bedre enn standard dosering for å forebygge sykdoms forverring under vedlikeholdsbehandling.
33 GASTROSKOPET • 1/2023
Kommende kurs og konferanser 2023
APRIL
ESGE-days
20.04-22.04
Dublin, Irland
www.esgedays.org
MAI
SADE
23.05 - 24.05
Bergen, Norge
www.sade.dk
ERAS World congress
31.05 - 02.06
Lisboa, Portugal
www.erassociety.org
JUNI
EASL congress (European association for the study of the liver)
21.06 - 24.06
Wien, Østerrike
www.easlcongress.eu
European Pancreatic Club meeting
28.06 - 01.07
Alpbach, Tyrol
www.epc2023.eu NSF/FSG
NSF/FSG
NSF/FSG er en faggruppe av sykepleiere som jobber innen gastroenterologi.
Faggruppen ble opprettet i 1978 av sykepleiere som jobbet med endoskopiske undersøkelser. I dag jobber medlemmene innen alle felt av gastroenterologien, på medisinske og kirurgiske sengeposter, på gastrolab og poliklinikker. Fra 2004 har faggruppen vært en del av Norsk Sykepleierforbund.
Målet med faggruppen er å øke kunnskap om undersøkelses- og behandlingsmetoder, samt å stimulere til fagutvikling og sykepleieforskning innen gastroenterologi.
I februar hvert år arrangerer faggruppen Nasjonalt Fagmøte på Lillehammer. Dette er en fagkongress som går over tre dager. Årsmøte i faggruppen avvikles hvert annet år under Nasjonalt fagmøte. I september arrangerer vi nasjonalt IBDmøte for sykepleiere.
Medlemskapet koster kr. 300,- pr år og gir følgende fordeler:
- Medlemsbladet Gastroskopet tre ganger i året
- Redusert kongressavgift ved Nasjonalt fagmøte
- Økonomisk støtte til:
– Deltakelse på kongresser nasjonalt og internasjonalt,
– Videreutdanning i gastroenterologisk sykepleie
– Fagutviklingsprosjekter
– Forskning
Innmelding i faggruppen kan gjøres ved å sende SMS med kodeordet gastro til 02409 eller på faggruppens nettside: www.nsf.no/faggrupper/gastroenterologi. På nettsiden finnes også mer informasjon om faggruppen.
Følg oss på Facebook: NSFs faggruppe av sykepleiere i gastroenterologi
KURS OG KONFERANSER
34 GASTROSKOPET • 1/2023
EndoPreZyme
Anbefalt rengjøringsmiddel til manuell forvask, spar tid og penger
Til fleksible endoskop, endoskopitilbehør og termostabile (kirurgiske) instrument.
Utmerket rengjøringsevne
God rengjøring er nøkkelen til vellykket dekontaminering. Takket være enzymsammensetningen gir Olympus
EndoPreZyme optimal rengjøring i forkant av automatisk dekontaminering. Dette har støtte i omfattende testing. Det fjerner all smuss som er typisk i forbindelse med endoskopi, inkludert rester av kontrastvæske som blir brukt ved røntgenundersøkelser, antiskummiddel, anestetika som blir brukt i strupen, glidemiddel og hemostasespray.
Materialkompatibilitet
Det pH-nøytrale rengjøringsmiddelets materialkompatibilitet bidrar til at fleksible endoskop fra Olympus og alle andre ledende produsenter får lengre levetid.
Optimaliserte prosesser
Ved å redusere prosesstiden optimaliserer EndoPreZyme hele prosedyren. Med denne løsningen kan du hoppe over skylletrinnet i forkant av automatisk behandling i Olympus’ ETD-maskiner.

Brukervennlig
EndoPreZyme skummer lite. Dette gjør det lett å se instrumentene under manuell forvask. Doseringen kan tilpasses (5–15 ml/l) i forhold til hvor tilsmussete skopene/instrumentene er.
For mer informasjon om infeksjonsforebygging vennligst ta kontakt med: Kjetil Byfuglien, kjetil.byfuglien@olympus.com, Tlf 934 23 577 | Aksel Bonne Øyri, aksel.oyri@olympus.com, Tlf 482 19 599
Drengsrudbekken 12, 1383 Asker | www.olympus.no 103093
TID FOR
Entyvio er indisert til voksne med moderat til alvorlig aktiv ulcerøs kolitt eller Crohns sykdom som har hatt utilstrekkelig respons, mistet respons eller som var intolerante ovenfor konvensjonell behandling eller en TNFα-antagonist. Samt til voksne med moderat til alvorlig aktiv kronisk pouchitt som har gjennomgått proktokolektomi og bekkenreservoarkirurgi for ulcerøs kolitt med utilstrekkelig respons eller mistet respons på antibiotikabehandling1
SIKKERHET
Opptil 9 års sikkerhetsdata på IBD-pasienter2
GEMINI long-term safety (LTS) med 2243 pasienter med Entyvio-behandling viste:

• Lav forekomst av alvorlige og opportunistiske infeksjoner
• Ingen identifiserte tilfeller av PML (progressiv multifokal leukoencefalopati) blant pasienter behandlet med vedolizumab i de kliniske studiene.
• Infusjonsrelaterte reaksjoner forekom hos ≤5 % av pasientene
• Malignitetsforekomst var på samme nivå som for den generelle IBD-populasjonen
UTVALGT PRODUKT- OG SIKKERHETSINFORMASJON 1
Entyvio (vedolizumab)
Injeksjonsvæske, oppløsning i ferdigfylt penn 108 mg
Pulver til konsentrat til infusjonsvæske, oppløsning 300 mg
Sikkerhetsinformasjon:
• Kontraindikasjoner: Aktive alvorlige infeksjoner som tuberkulose, sepsis, cytomegalovirus, listeriose og opportunistiske infeksjoner som progressiv multifokal leukoencefalopati (PML).
• Forsiktighetsregler: Intravenøs vedolizumab skal kun administreres av helsepersonell med tilgang på utstyr for å handtere akutte overfølsomhetsreaksjoner inklusiv anafylaksi.
• Interaksjoner: Levende vaksiner, særlig levende orale vaksiner, skal brukes med forsiktighet.
• Graviditet og amming: Bruk under graviditet bør unngås, med mindre nytten klart oppveier potensiell risiko for mor og foster. Vedolizumab er påvist i human morsmelk, fordel av behandling for mor og potensiell risiko for spedbarnet skal vurderes.
• Hyppigst rapporterte bivirkninger: Infeksjoner (som nasofaryngitt, øvre luftveisinfeksjon, bronkitt, influensa og sinusitt), hodepine, kvalme, feber, fatigue, hoste, artralgi og reaksjoner på injeksjonsstedet (s.c. administrasjon).

Dosering: Intravenøs (300mg). Ulcerøs kolitt: 300 mg ved uke 0, 2 og 6, deretter hver 8. uke. Fortsettelse revurderes nøye hos pasienter som ikke viser effekt innen uke 10. Noen pasienter med redusert respons kan ha nytte av en økning i doseringsfrekvens til 300 mg hver 4. uke. Crohns sykdom: 300 mg ved uke 0, 2 og 6, deretter hver 8. uke. Pasienter uten respons kan ha nytte av en dose ved uke 10. Fortsett behandling hver 8. uke fra uke 14 hos responderende pasienter. Noen pasienter med redusert respons kan ha nytte av økt doseringsfrekvens til 300 mg hver 4. uke. Pouchitt: 300 mg ved uke 0, 2 og 6 og deretter hver 8. uke. Bør initieres parallelt med standardbehandling av antibiotika. Dersom ingen behandlingsfordel observeres innen 14 uker, skal seponering vurderes. Subkutan (108 mg): Etter god opplæring i s.c. injeksjonsteknikk kan en pasient eller omsorgsperson injisere s.c. hvis dette er hensiktsmessig. Ulcerøs kolitt og Crohns sykdom: Anbefalt vedlikeholdsbehandling, etter minst 2 i.v. infusjoner, er 108 mg annenhver uke. Den første dosen skal administreres i stedet for neste planlagte i.v. infusjon og deretter annenhver uke.
Pakninger, priser og refusjon: Pulver til konsentrat til infusjonsvæske: 20 ml (hettegl.) kr 27688,90. Injeksjonsvæske, oppløsning i ferdigfylt penn: 1 stk. (ferdigfylt penn) kr 6881,40. 2 stk. (ferdigfylt penn) kr 13726,60. 6 stk. (ferdigfylt penn) kr 41107,30. H-resept. Besluttet innført av Beslutningsforum 16.11.2015. Inngår i TNF BIO anbefalinger 2023-2024.
Reseptgruppe: C.
For fullstendig preparatomtale av Entyvio, se SPC. www.legemiddelsok.no
REFERANSER
1. Entyvio (vedolizumab) SPC (31.01.22) avsnitt 3, 4.1-4.6, 4.8 og 5.1.
2. Loftus E V, Feagan B G, Panaccione R, et al. Long-term safety of vedolizumab for inflammatory bowel disease. Aliment Pharmacol Ther. 2020:52(8): 1353–1365
Takeda AS • Postboks 205 • 1372 Asker • Tlf. 800 800 30 • www.takeda.no • C-APROM/NO/ENTY/0783/14204 • Utarbeidet februar 2023
9
ÅR





















 Redaktører 2021-2023 Kirsti Pleym Schumacher og Hege Stai Solum
Maren Josefine Kvarsnes IBD-poliklinikk og medisinsk sengepost, Lovisenberg Diakonale sykehus
Une Melby Hauge Medisinsk poliklinikk, Notodden sykehus
Tone Mangerøy Medisin 1 vest, Haukeland universitetssykehus
Rebecca Jane Foreman Gastromedisinsk poliklinikk, Stavanger universitetssykehus
Åshild Torgersen Gastrokirurgisk poliklinikk, Stavanger universitetssykehus
Redaktører 2021-2023 Kirsti Pleym Schumacher og Hege Stai Solum
Maren Josefine Kvarsnes IBD-poliklinikk og medisinsk sengepost, Lovisenberg Diakonale sykehus
Une Melby Hauge Medisinsk poliklinikk, Notodden sykehus
Tone Mangerøy Medisin 1 vest, Haukeland universitetssykehus
Rebecca Jane Foreman Gastromedisinsk poliklinikk, Stavanger universitetssykehus
Åshild Torgersen Gastrokirurgisk poliklinikk, Stavanger universitetssykehus









 Faggruppeleder NSF/FSG
Faggruppeleder NSF/FSG








 Kunst på vegg
Kunst på vegg



 Redaktørene, fra v.: Roy Cato og Dag Olav
Redaktørene, fra v.: Roy Cato og Dag Olav










