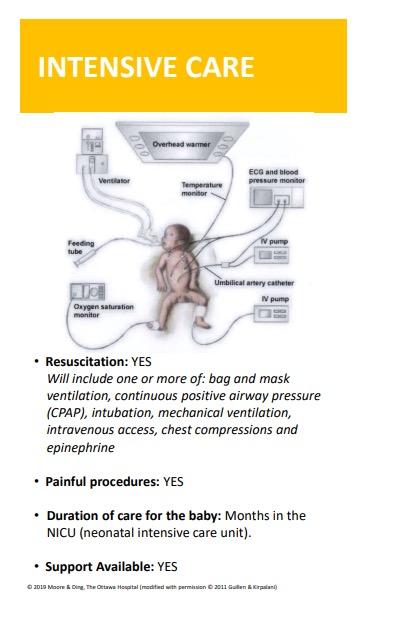
Nyfødtmedisin












Paidos-redaksjonen har dedikert årets tredje nummer av bladet til temaet nyfødtmedisin. Jeg leser alle utgaver av Paidos med interesse, men kan ikke underslå at jeg gleder meg særlig til denne. Som leder i NBF representerer jeg hele barne- og ungdomsmedisinen. Til daglig er det likevel nyfødtmedisin som er mitt fag. Derfor er det klinikeren i meg som vinner drakampen om innholdet i dette nummerets lederartikkel.
For knapt tre år siden byttet jeg arbeidssted og ble jeg tvunget å gå i møte med mitt eget selvbilde som doktor og fagperson. Gjennom mange år på OUS hadde min faglige identitet vært tett knyttet opp mot intensivmedisin og kritisk sykdom. På min nye arbeidsplass på Ahus ble jeg møtt av en annen hverdag. De medisinske utfordringene var annerledes enn det jeg var vant til. De var mildere - og innledningsvis var jeg litt i stuss over hvordan jeg skulle erobre yrkesstoltheten i landskapet av nyfødtteknisk nokså «flatt hav».
Fra et nytt ståsted er det gradvis blitt tydeligere for meg hvordan nyfødtmedisinens lyskastere stadig rettes mot et lite mindretall av fagets pasientpopulasjon. Møter og kongresser preges av en slagside av de samme temaene. Fokuset er på ekstrem prematuritet og komplikasjonene av dette; pulmonal hypertensjon, asfyxi og kirurgiske misdannelser. Vårt faglige blikk tiltrekkes uunngåelig av problemstillinger som befinner seg i ytterkant av hva vi medisinsk sett gjør mulig, og av harde endepunkter. I spennet mellom liv og død er det også lett å føle at vårt arbeid som leger har verdi og betydning. Når man jobber som nyfødtlege utenfor på de regionale avdelingene fylles hverdagen av andre utfordringer. De aller fleste av pasientene på Ahus har milde sykdomsforløp
og behov for enkle behandlingsmetoder. CPAP, ernæring, antibiotika og tid er tilstrekkelig for mange. Våre pasienters endepunkter er myke, kvaliteten og verdien av arbeidet vi legger ned er vanskeligere å måle. Med mindre alvorlige hendelser skjer er vårt arbeid sjelden gjenstand for revisjon eller benchmarking.

Bortenfor nyfødtfagets frontlinje kan det noen ganger oppleves som at vi beveger oss i et skyggeland der vår daglige dont er bagatellmessig og uviktig. Men selv om det er få pasienter med livstruende sykdommer på min avdeling vil en ikke ubetydelig andel av pasientene våre betale en pris for sin vanskelige start. Det samme vil deres familier. Også utenom regionale avdelinger må vi være bevisst på at vi forvalter fremtiden til umodne kropper og sårbare hjerner.
Hjernehelse står sentralt i alle deler av nyfødtmedisinen. Oppmerksomheten omkring begrepet er økende. Hjernehelse for lett og moderat premature handler ikke bare om forhindre infeksjoner og inflammatorisk skade. Det handler om å etterstrebe god tilvekst gjennom riktig ernæring, samt at barnets sanseopplevelser i nyfødtperioden skal muliggjøre utviklingen av sunne synaptiske forbindelser. Hvis vi på veien også skaper trygge og innsiktsfulle foreldre sikrer vi en best mulig start på barnas videre liv. Rammebetingelsene for god hjernehelse er ofte bedre på lokale nyfødtavdelinger enn på travle regionsykehus. Pasientene vi nå omtaler er ikke få, de er mange.
Livet utenfor regionsykehuset har lært meg at det er mange målestokker for kvalitet. De viktigste er sannsynligvis de vanskeligste å måle.

REVESTIVE (teduglutid) 1,25 mg og 5 mg, pulver og væske til injeksjonsvæske, oppløsning
Indikasjon: Til behandling av pasienter ≥1 år med kort tarm-syndrom («short bowel syndrome», SBS). Pasienten bør være stabil etter en periode med intestinal adapsjon etter kirurgi. Kontraindikasjoner: Overfølsomhet for tetrasyklinrester. Aktivt eller mistenkt malignitet. Malignitet i mage-tarmkanalen, inkl. lever- og gallesystemet samt pankreas i løpet av de siste 5 årene Forsiktighetsregler: En koloskopi med fjerning av polypper bør gjennomføres ved oppstart av behandling. Før behandlingsoppstart hos barn bør det tas prøver for okkult blod i avføringen, deretter årlige prøver. Ved symptomer relatert til galleblæren eller gal leganger, bivirkninger i pankreas, gjentagende tarmobstruksjon skal behovet for fortsatt behandling med Revestive revurderes. Bør ikke brukes under graviditet og amming. Hyppigst rapporterte bivirkninger: Abdominal smerte og distensjon, luftveisinfeksjoner (inklusiv nasofaryngitt, influensa, øvre luftveisinfeksjon og nedre luftveisinfeksjon), kvalme, reaksjoner på injeksjonsstedet, hodepine og oppkast. Pasienter med gastrointestinal stomi opplevde komplikasjoner med stomien.
Dosering: Preparatnavn og produksjonsnr. skal noteres i pasientjournalen. Behandling av voksne og barn skal startes opp under veiledning av helse personell med erfaring i behandling av hhv. SBS og pediatrisk SBS. Optimalisering og stabilisering av i.v. væske og ernæring bør være gjennomført før behandlingsstart. Voksne inkl. eldre >65 år: Hetteglass 5 mg: 0,05 mg/kg kroppsvekt 1 gang daglig. Forsiktig nedtitrering av daglig dose kan vurderes for å optimere toleransen av behandlingen. Rekonstituert Revestive gis som s.c. injeksjon i magen, ev. i låret hvis dette ikke er mulig. Skal ikke gis i.v. eller i.m. Barn og ungdom ≥1-17 år: 0,05 mg/kg kroppsvekt 1 gang daglig. Kroppsvekt >20 kg: Hetteglass 5 mg brukes.

Pakninger, priser og refusjon: 1,25 mg: 1 sett (28 hettegl. m/pulver + 28 ferdigfylte sprøyter m/oppløsningsvæske) kr. 110 579,10. H-resept. 5 mg: 1 sett (28 hettegl. m/pulver + 28 ferdigfylte sprøyter m/oppløsningsvæske) kr. 226537,10. H-resept. Reseptgruppe: C.
For fullstendig preparatomtale, se Revestive SPC www.legemiddelsok.no
Barn med SBS-IF trenger hjelp til å vokse og utvikle seg. Behandling med Revestive gir økt frihet til dette1 1. B.A. Carter, V. C. Cohran and C. R. Cole et al. Outcomes from a 12-Week, Open-Label, Multicenter Clinical Trial of Teduglutide in Pediatric Short Bowel Syndrome, J. Pediatrics, V 181, 2017 102-111 2. Revestive SPC (godkjent 17.05.2022) avsnitt 4.1-4.6 og 4.8. Se www.legemiddelsok.no
Jeg har prøvd å være bakvakt for første gang.
For første gang har jeg kikket rundt meg på morgenmøte rommet og innsett at den der store, skumle callingen skal henge på min frakk. Den som kjennes helt annerledes ut mellom fingrene enn den trygge, lille LIS-callingen. For aller første gang har jeg hatt med meg noen som skal lære noe av meg.
Jeg er på langt nær ordentlig overlege ennå. Jeg er fortsatt legespesialist i primærsjiktet og langt, langt og lengre enn langt bak i arverekken, men jeg har hatt mine første bakvakter, første henteoppdrag med kuvøsetransporten og første postdager med overlegefunksjon. Med det har jeg så vidt begynt å erkjenne at det skal komme en tid der det er meningen at jeg skal forvalte det store, formelle «medisinsk faglige ansvaret» på daglig basis.
Ikke nok med det, jeg skal også ta ansvar for at andre får en like flott, inspirerende og omsorgsfull inngang til faget som det jeg har hatt. Det ansvaret er nesten det skumleste, for etter et par runder med bakvaktscallingen har jeg innsett hvor takknemlig jeg egentlig er. At veiledning er noe som skjer hver eneste dag, ikke bare under veiledningstimen. Og at det kreves en hel avdeling for å veilede en LIS.
• Tusen takk overlegen, for at du holdt masken da jeg hadde gjort ekko opp-ned. Og speilvendt.
• Takk for alle epikriser du har rettet. Spesielt de med veldig fargerikt språk og én A4-side per liggedøgn.
• Takk for at du forventet noe av meg, selv da jeg var helt ny! Og for at du hadde humor og fleipet med at jeg var nederst i næringskjeden og kunne bli spist opp. Det gjorde det mindre farlig, samtidig som jeg følte meg anerkjent og verdifull.
• Takk for at du aldri presset meg ut i ting som var for vanskelig, men sa at «dette er du for liten til» og at det var forbeholdt de som tjente bedre enn meg.
• Takk for at du er så rolig når jeg caller fordi det virkelig haster og spør: «hvordan hjelper jeg deg best nå?» Det gjør at jeg klarer å bevare roen selv.
• Takk for at du gjemte deg bak døra da jeg tok imot en skikkelig prematur alene for første gang og du så at jeg mestret det. Selv om jeg kanskje tror jeg tisset på meg i heisgangen på vei dit.
• Takk for at du sa «det der skjer med alle, bare prøv en gang til du, Katrine» da jeg bommet med veneflonen. Da treffer man nemlig!
• Takk for at du gir så mange gode råd om livet og veivalgene i det! Fra trafikkreglene for fotgjengere (da du nesten kjørte på en vimsete utgave av meg på joggetur), til bilkjøp og respiratorbehandling.

• Tusen takk for at du la hånden din på hånden min da jeg intuberte for første gang og var i ferd med å trekke meg og sa «du tør!».
• Takk for at du responderte med «så flink du er!» da jeg ringte deg på bakvaktstelefonen bare for å juble at jeg hadde greid å legge en arteriekran helt alene. Selv om klokken var 03 om natten.
• Takk for alle de gangene du har blitt forsinket i polikli nikkprogrammet ditt fordi du har latt meg prøve selv med ekkoproben.
• Takk for at du ikke spurte om jeg «hadde lyst» til å intubere da jeg hadde fått skrekken, men sa at «nå skal vi gå og intubere».
• Takk for at du korrigerer meg når det er nødvendig – selv om jeg blir litt lei meg der og da.
• Takk for at du alltid er rolig og lytter når jeg har ringt og sagt at jeg tror jeg har gjort noe skikkelig feil. Og for at du sier at jeg aldri må være redd for å fortelle deg om det.
• Takk for alle løsningene du snekrer. Spesielt krakken min.
• Takk for at du er større, klokere og sterkere enn meg – og våger å være det.








Fagpressens redaktørplakat ligger til grunn for utgivelsen. Signerte artikler og innlegg står for forfatterens egen regning, og samsvarer ikke nødvendigvis med redaksjonens eller Norsk barnelegeforenings synspunkter. Paidos forbeholder seg retten til å oppbevare og publisere artikler og annet materiale også på internett.
• Sette fokus på viktige barnemedisinske tema
• Være et vindu for samfunn og media mot norsk barnemedisin
• Jobbe for økt interesse for barnehelse i et nasjonalt og internasjonalt perspektiv
• Være et medlemsblad for Norsk Barnelegeforening
ISSN: 1503-5360 Norsk barnelegeforening
Redaktør
Katrine Engen (Lillehammer) (paidos@barnelegeforeningen.no)

Erle Kristensen (OUS, vararedaktør)
Kari Holte (Kalnes)
Kristoffer Brodwall (Haukeland)
Ingelin Mamen (UNN Tromsø)
Kontaktpersoner
Ingrid Wæraas Rønning (Hammerfest)
Eirin Esaiassen (UNN)
Eva Brekke (Bodø)
Alexander Aalberg (Levanger)
Beate Horsberg Eriksen (Ålesund)
Anders Bjørkhaug (Førde)
Therese Visted (Haukeland)
Ida Hausken Haugann (Haugesund)
Jon Grøtta (Elverum)
Ina Hartløff Helland (Ahus)
Kristoffer Hochnovski (Drammen)
Randi Borghild Stornes (Skien)
Jon Skranes (Arendal)
Anne Kathrine Olsen (Kristiansand)
Henrik Underthun Irgens (Nettverket)
Layout, annonser og produksjon
Apriil Media AS media@apriil.no www.apriil.no Tlf. 988 19 348

Materiellfrister/utgivelse: Frister oppdateres på pedweb.no
Opplag: 1600
Antall utgivelser per år: 3 Paidos på nett: www.paidos.no
Abonnement 210 kr pr år/3 nr. Kan bestilles ved mail til: paidos@barnelegeforeningen.no
Ledestjernen. Intervjuet med Inger Elisabeth Silberg Katrine Engen
Avnavling av nyfødte - spiller vi på lag med fysiologien? B.H. Eriksen, J. Andresen, E. Sæther og K. Holte
Avnavlingspraksis og stabilisering med intakt navlesnor i Norge Beate Horsberg Eriksen (Ålesund) og Kari Holte
Samvalg - også i nyfødtmedisin? Janicke Syltern
De mest premature barna Internasjonal praksis og etiske grunnprinsipper Alexander Feidal-Nilsen1, Claus Klingenberg
Prematur fødsel og helseutfordringer på lang sikt Maria Vollsæter, Mette Engan, Mariann Haavik Lysfjord Bentsen, Hege Clemm og Kristoffer Brodwall,
Livløst barn på barselavdelingen Kristin Brække
Retinopati hos nyfødte – nye behandlingsmuligheter O.H. Haugen, T. Christoffersen, D.H. Engelsvold, E.C.S. Landsend, D. Austeng
Kommunikasjon ved overflytting av syke nyfødte Ingrid Nissen
Nettverket: Felles nordisk legemiddelmarked? Henrik Underthun Irgens
Forbedringer for premature lunger Ola Didrik Saugstad
Vindu mot verden: Nyfødte taper i krig og konflikt Monica Thallinger
Barne- og ungdomsavdelingen i Elverum Jon Grøtta
Sedativum. Hypnotikum. ATC-nr.: N05C H01
DEPOTTABLETTER 1 mg og 5 mg: Hver depottablett inneh.: Melatonin 1 mg, resp. 5 mg, lak tose, soyalecitin, hjelpestoffer. Fargestoff: 1 mg: Gult og rødt jernoksid (E 172), titandioksid (E 171). 5 mg: Gult jernoksid (E 172), titandioksid (E 171).
Dosering: Barn og ungdom 2-18 år: Anbefalt startdose er 2 mg. Ved utilstrekkelig respons bør dosen økes til 5 mg, maks. dose 10 mg. Data for opptil 2 års behandling er tilgjengelig. Pasienten bør overvåkes regelmessig (minst hver 6. måned) for vurdering av behandlingen. Etter minst 3 måneder bør legen evaluere behandlingseffekten og vurdere om behandlingen skal stanses om klinisk effekt uteblir. Ved lavere behandlingseffekt etter titrering til høyere dose, bør det først vurderes nedtitrering til lavere dose før behandling ev. seponeres. Glemt dose: Glemt tablett kan tas rett før leggetid, men deretter bør det ikke tas flere tabletter før neste planlagte dose.
Spesielle pasientgrupper: Nedsatt leverfunksjon: Erfaring mangler. Anbefales ikke ved nedsatt leverfunksjon. Nedsatt nyrefunksjon: Effekt er ikke undersøkt. Forsiktighet utvises. Barn 0-2 år: Bruk er ikke relevant til behandling av insomni. Administrering: Tas én gang daglig, 0,5-1 time før leggetid med eller etter mat. Tablettene kan puttes i mat, f.eks. yoghurt, appelsinjuice eller iskrem, for å gjøre det enklere å svelge og oppnå bedre compliance. Dersom tablettene tas med mat eller drikke, bør de tas umiddelbart slik at ikke blandingen blir stående. Svelges hele. Skal ikke deles, knuses eller tygges. Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Interaksjoner: For utfyllende informasjon om relevante interaksjoner, bruk interaksjonsanalyse. Interaksjonsstudier er kun utført hos voksne. Fluvoksamin øker melatoninnivået (17 × høyere AUC og 12 × høyere Cmax) ved å hemme metabolisme av CYP1A2 og CYP2C19. Kombinasjonen bør unngås. Samtidig bruk av alkohol kan redusere effekten på søvn, og bør unngås. Melatonin kan øke de sedative egenskapene til benzodiazepiner og ikke-benzodiazepinhypnotika, og kombinasjonen bør unngås. Samtidig bruk med tioridazin og imipramin bør unngås. Forsiktighet utvises ved samtidig bruk av 5eller 8-metoksypsoralen, som øker melatoninnivået ved å hemme metabolismen. Forsiktighet utvises ved samtidig bruk av cimetidin, en potent CYP1A2-hemmer, som øker melatoninnivået ved å hemme metabolismen. Forsiktighet utvises ved samtidig bruk av østrogen,
som øker melatoninnivået ved å hemme metabolismen av CYP1A1 og CYP1A2. CYP1A2-hemmere som kinoloner kan gi økt eksponering for melatonin. CYP1A2-induktorer kan redusere melatonin-nivået, og samtidig bruk kan kreve dosejustering. Røyking induserer CYP1A2-metabolisme, og do-sejustering kan kreves ved røykestart eller -stopp. NSAID tatt om kvelden kan undertrykke endo-gene melatoninnivåer i den tidlige delen av natten med opptil 75%. Om mulig bør administrering av NSAID unngås om kvelden. Beta blokkere kan undertrykke frigivelsen av endogen melatonin om natten, og bør derfor tas om morgenen. Graviditet, amming og fertilitet: Graviditet: Data mangler. Dyre studier indikerer ingen reproduksjonstoksisitet. Som et fore byggende tiltak anbefales det å unngå bruk under graviditet. Amming: Endogen melatonin er målt i morsmelk, og eksogen melatonin blir trolig overført til morsmelk. Effekt på nyfødte/sped barn er ukjent. Det må tas en beslutning om amming skal opphøre eller behandling avstås fra, basert på nytte-/risikovurdering. Fertilitet: Det er ikke sett effekt på fertilitet hos hverken hann- eller hunndyr. Egenskaper: Virkningsmekanisme: Melatoninreseptoragonist (MT1, MT2 og MT3), antas å bidra til søvnfremmende egenskaper, da disse reseptorene (hovedsakelig MT1 og MT2) er involvert i reguleringen av døgnrytme og søvn. Absorpsjon: Fullstendig hos voksne (kan reduseres med opptil 50% hos eldre). Biotilgjengeligheten er 15%. First pass-metabolisme 85%. Hos barn 7-15 år med insomni, ble Cmax (410 pg/ml) i saliva nådd innen 2 timer etter administrering av 2 mg etter en vanlig frokost. Hos voksne gitt 5 mg etter mat, ble Cmax (3,57 ng/ml) i plasma nådd innen 3 timer. Under fastende forhold var Cmax lavere (1,73 ng/ml) og Tmax tidligere (innen 2 timer). Proteinbinding: Ca. 60%, primært til albumin, α1-syreglykoprotein og lipoproteiner med høy tetthet. Halveringstid: 3,5-4 timer. Clearance innen 12 timer. Metabolisme: I lever via CYP1A-enzymer og muligens CYP2C19. Prepubertale barn og unge voksne metaboliserer melatonin raskere enn voksne. Utskillelse: Via urin. 2% uforandret. Pakninger og priser: 1 mg: 60 stk. (blister) 402322 kr. 515,00. 5 mg: 30 stk. (blister) 067780 kr. 750,90.
Basert på SPC godkjent av SLV/EMA: 18.02.2021
Indikasjoner: Slenyto® er indisert til behandling av insomni hos barn og ungdom i alderen 2–18 år med autismespekterforstyrrelser (ASD) og/eller Smith-Magenis syndrom (SMS), hvor søvnhygienetiltak ikke har vært tilstrekkelig. (3)
Forsiktighetsregler: Slenyto® kan forårsake døsighet. Derfor må legemidlet brukes med forsiktighet hvis det er sannsynlighet for at døsighet kan føre til sikkerhetsrisiko. Samtidig bruk av fluvoksamin, alkohol, bensodiazepiner/ikke-bensodiazepinhypnotika, tioridazin og imipramin anbefales ikke. (3)
Bivirkninger: De vanligste bivirkningene er søvnighet, fatigue, humørsvingninger, hodepine, irritabilitet, aggresjon og bakrusfølelse. (3)
Refusjonsberettiget bruk: Barn og ungdom 2-18 år: Behandling av insomni ved autismespekter forstyrrelser (ASD) og/eller Smith-Magenis syndrom, hvor søvnhygienetiltak ikke har vært tilstrekkelig. Refusjonskoder: ICPC P99: Autismespekterforstyrrelser, vilkår 251, 255. ICPC A90: Smith-Magenis syndrom vilkår, 251, 255. ICD F84: Gjennomgripende utviklingsforstyrrelser, vilkår 251, 255. ICD Q93: Monosomier og delesjoner fra autosomer, ikke klassifisert annet sted, vilkår 251, 255. Vilkår: 251: Refusjon ytes kun til barn og ungdom fra og med 2 år til og med 17 år. 255: Behandlingen skal være instituert av spesialist i barne- og ungdomspsykiatri eller barnesykdommer, eller sykehusavdeling med tilsvarende spesialitet. For mer informasjon se preparatets SPC.
Referanser:
1. Gringras, P., Breddy J., Frydman-Marom A., et al., Efficacy and Safety of Pediatric Prolonged-Release Melatonin for Insomnia in Children With Autism Spectrum Disorder. JAACAP 2017. 56 (11):948-957 ;
2. Schroder CM, Malow BA, Maras A et al. Pediatric Prolonged-Release Melatonin for Sleep in Children with Autism Spectrum Disorder: Impact on Child Behavior and Caregiver’s Quality of Life. Journal of Autism and Developmental Disorders (2019) 49:3218-3230.
3. Slenyto SPC 18.02.2021, pkt. 4.1, 4.2, 4.4, 4.5, 4.7, 4.8. www.legemiddelsok.no

Slenyto® (melatonin depottablett) er den eneste godkjente behandlingen ved insomni hos barn med autismespekterforstyrrelser og/eller Smith-Magenis syndrom (1,2)

58 minutter forlenget total søvntid versus 9 minutter med placebo (p=0,026). (3) Økt total søvntid førte til forbedring av barnets utagerende atferd (hyperaktivitet/uoppmerksomhet og atferdsskår), versus placebo (p=0,021). (2)
Forbedret adferd hos barna ga økt livskvalitet blant foreldre, versus placebo (p=0,01). (2)
Les mer på slenyto.no
(melatonin depottablett)


Ahus og OUS arrangerer Pediaterdagene 18. – 20. januar. På selveste Soria Moria gjør vi klart for et spennende program. Etter et års utsettelse gleder vi oss til å treffe nye og gamle barneleger.
Vi starter med to aktuelle forkurs om luftveisinfeksjoner og barnepalliasjon Onsdag ettermiddag er hovedtemaet fødselsasfyksi, med vekt på både moderne behandling og på forebygging. Torsdag utvider vi horisonten til «langsynt pediatri»; hvordan går det egentlig med barn med alvorlig sykdom når de blir ungdommer og voksne? Det er også satt av tid til interessegruppemøter og frie foredrag. Fredag har internasjonalt tilsnitt der vi har invitert leder for den ukrain ske barnelegeforeningen til å fortelle om barnehelse i krig og konflikt.
Gjengen som står i spissen for Pediaterdagene gleder seg - kommer du?
Interessegruppen i Nyfødtmedisin holder sitt møte under Pediaterdagene 2023 torsdag 19. januar kl. 1615 – 1815. Vi tilstreber som vanlig hybrid-løsning med mulighet for digital deltagelse. Temaet denne gangen er organ transplantasjon, og behovet for en revurdering av dødsdiagnostikken hos nyfødte for å åpne for at også denne aldersgruppen kan være organdonor i de tilfellene hvor det ønskes. Vi lover engasjerte innspill og spisskompetanse. Hold av datoen for en interessant diskusjon i fagmiljøet!
Bankmelk er vanlig ernæringsbehandling til syke nyfødte. Spørsmålet om hvorvidt muslimske barn kan motta donormelk eller ikke dukker opp fra tid til annen. Det kan være nyttig for barneleger å vite litt om hva Islam sier om dette. Her er det viktig å presisere at det vil foreligge kulturelle forskjeller.
Morsmelk er anbefalt som enteral ernæring til alle nyfødte. Bruk av bankmelk er assosiert med lavere forekomst av NEC og sen sepsis, samt bedre psykomotorisk utvikling. Upasteurisert morsmelk inneholder immunglobuliner og en rekke biologiske komponenter som er gunstig med tanke på inflammasjon og infeksjon.

Fra et islamsk perspektiv vil den som donerer morsmelk bli betraktet som fostermor («milk kinship») til mors melks-mottakende barn. Dette medfører at barnet som får morsmelken ikke senere kan gifte seg med barnet til «fostermo ren». I praksis er det umulig å sikre at dette ikke skjer, ettersom donor av morsmelken er anonym.
Det er enighet blant flere lærde i den vestlige del av verden, blant annet European Council for Fatwa and Research, om at man ikke skal fraråde bankmelk. Noen grupper innenfor islam mener også at du ikke blir betraktet som «fostermor» med mindre du faktisk ammer barnet selv.
Mange ønsker at en forsøker å minimere antall mors melkgivere til barnet. Dersom mor ikke ønsker eller kan amme barnet, kan en tilstrebe overgang til MME så snart dette er mulig. Fra et fysiologisk perspektiv vil det være mest gunstig for et prematurt barn å motta bankmelk, heller enn MME. Dette kan en informere foreldre om. Islam er altså ikke prinsipielt imot bruk av bankmelk. En minner om at det likevel vil være kulturelle og religiøse forskjeller hvordan en tolker «milk kinship» i praksis, men at dette er noe som har kommet mer i fokus i den muslimske verden de siste årene.

Siden februar har en tverrfaglig arbeidsgruppe jobbet med en kvalitetssikret nasjonal anbefaling for Tidlig varslingsskår-nyfødte (TVS-N). Arbeidet er forankret i Barnelegeforeningen og Kvalitetsutvalget (KU). Avdelingene rundt i landet har svært ulik praksis rundt hvilke undersøkelser og observasjoner som gjøres for å avdekke tegn til sykdom hos nyfødte. Dette fører til uønsket variasjon i oppfølging og behandling. Arbeidsgruppen har tatt utgangspunkt i TVS-N som er basert på Newborn Early Warning Trigger and Track (NEWTT) fra British Association of Perinatal Medicine. TVS-N ble tatt i bruk første gang på Ahus i 2015 og brukes per i dag i 13 sykehus/fødestuer. I siste møte i arbeidsgruppen ble erfaringer fra flere avdelinger presentert. Basert på disse, samt revidert NEWTT (NEWTT2) vil vi innen årsskiftet kunne publisere en revidert TVS-N og anbe faling for bruk. Anbefalingen vil publiseres i Veileder for nyfødtmedisin.

Lone Fiil Christensen
Victor Krohn
Lise Beier Havdal
Eva Rydland
Clara Sofie Bratholm
Lasse Wegener Lund
Fride Bysveen Lier


Linh Anh Nguyen
Heidi Brinchmann Eckholdt
Astrid Kleiven Worren
Arleta Bublevic (konvertert, LT)
Lena Christina Mjörndal (konvertert, SE)
Ingrid Voktor Svinvik
Nina Strand
Alexander Sussman
Ellen Fladmark
Vladislava Badnjar
Reni Chottayil Varghese
Merethe Molland Sørensen
Annette Olsen
Elisabeth Ørskov Rotevatn
Ingrid Dannevig Landsverk
Tone Eikrem Harr
Hildegunn Norbakken Granslo
Terje Høyvarde Clausen
Ninnie Helen Bakken Oehme
Einar Vie Sundal
Sverre Sigurd Johansen Lamens
Anne Holm Sørensen
Marianne Omdal
Caroline Willersrud
Elisabeth Tallaksen Ulseth
Ida Stenshorne
Martin Sørum Hotvedt
Merethe Krokaas
Astrid Merete Winsnes Lærum
Elisabeth Gonzalez Bjelland
Katalin Farago
Anna Partheil
Tema for neste Paidos blir «Lov og rett». Dødlinja er 7. februar. Har du tips til innhold, eller vil du gjerne skrive noe selv? Skriv til oss på e-post paidos@barnelegeforeningen.no
Paidos ønsker alle barneleger en riktig god jul og et godt nytt år!
Melatonin Unimedic Pharma Sedativum. Hypnotikum. ATC-nr N05CH01: 1 ml mikstur, oppløsning inneholder 1 mg melatonin. Hjelpestoffer med kjent effekt 1 mg metylparahydroksybenzoat. Hjelpestoffer Glyserol (E442) Sorbinsyre, Metylparahydroksybenzoat (E218) Natriumhydroksid (til pH-justering) Vann, renset. Indikasjoner: Kortvarig behandling av jetlag hos voksne, søvnforstyrrelser (insomni) hos barn og ungdom i alderen 6–17 år med ADHD der søvnhygienetiltak er utilstrekkelige. Dosering: Voksne med jetlag: Den anbefalte dosen er 1–5 mg én time før sengetid på bestemmelsesstedet. Anbefalt startdose: 2 ml (tilsvarer 2 mg). Maksimal anbefalt døgndose: 5 ml (tilsvarer 5 mg) i maksimalt 5 dager. Pediatrisk populasjon med ADHD: Anbefalt startdose: 1–2 ml (tilsvarer 1-2 mg) 30 til 60 minutter før sengetid. Dosen skal justeres individuelt til maksimalt 5 ml (tilsvarer 5 mg) daglig uansett alder. Laveste effektive dose skal etterstrebes. Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Forsiktighetsregler: Mulige langtidseffekter av melatonin har ikke vært tilstrekkelig undersøkt. Brukes med forsiktighet hos personer med epilepsi. Melatonin anbefales ikke til pasienter med autoimmune sykdommer. Dette legemidlet inneholder metylparahydroksybenzoat, som kan forårsake allergiske reaksjoner. Interaksjoner: Metaboliseres hovedsakelig via enzymetCYP1A2, bruk interaksjons-analyse for mer informasjon. Bivirkninger: Melatonin gir få og ingen alvorlige bivirkninger ved kortvarig bruk. Vanligst er fatigue, svimmelhet og hodepine. Graviditet, amming og fertilitet: På grunn av manglende data er Melatonin Unimedic Pharma ikke anbefalt under graviditet eller hos fertile kvinner uten prevensjon. Amming: Melatonin Unimedic Pharma skal ikke brukes ved amming. Fertilitet: mangler data. For farmakologiske egenskaper, se pkt. 5 i SPC. Utleveringsbestemmelse: Skal kun utleveres tilbruk på menneske. Reseptgruppe C Pakninger og priser: 100 ml glassflaske. kr 532,20 kr Refusjonberettiget bruk: Barn og ungdom 6 –17 år: Behandling av insomni ved ADHD, hvor søvnhygienetiltak ikke har vært tilstrekkelig. Refusjonskoder: ICPC P81: Hyperkinetisk forstyrrelse, vilkår 163, 254 ICD F90: Hyperkinetiske forstyrrelser. Vilkår 163, 254 Vilkår: 163: Refusjon ytes kun til barn og ungdom fra og med 6 år til og med 17 år. 254: Refusjon ytes kun til pasienter med kronisk og alvorlig insomni som har: 1) nedsatt funksjon på dagtid, som økt søvnighet, humørsvingninger, svekket kognitiv eller sosial fungering, økt ulykkesrisiko, fysisk ubehag, økt bekymring rundt søvnen, og i tillegg 2) minst tre dårlige netter per uke, eller døgnrytme som ikke lar seg normalisere.
Basert på SPC godkjent av SLV/EMA 12/2020.
Indikasjoner: Kortvarig behandling av jetlag hos voksne, søvnforstyrrelser (insomni) hos barn og ungdom i alderen 6–17 år med ADHD der søvnhygienetiltak er utilstrekkelige.

Forsiktighetsregler: Mulige langtidseffekter av melatonin har ikke vært tilstrekkelig undersøkt. Brukes med forsiktighet hos personer med epilepsi. Melatonin anbefales ikke til pasienter med autoimmune sykdommer. Dette legemidlet inneholder metylparahydroksybenzoat, som kan forårsake allergiske reaksjoner.
Bivirkninger: Melatonin gir få og ingen alvorlige bivirkninger ved kortvarig bruk. Vanligst er fatigue, svimmelhet og hodepine.
Refusjonberettiget bruk: Barn og ungdom 6 –17 år: Behandling av insomni ved ADHD, hvor søvnhygienetiltak ikke har vært tilstrekkelig. Refusjonskoder: ICPC P81: Hyperkinetisk forstyrrelse, vilkår 163, 254 ICD F90: Hyperkinetiske forstyrrelser. Vilkår 163, 254 Vilkår: 163: Refusjon ytes kun til barn og ungdom fra og med 6 år til og med 17 år. 254: Refusjon ytes kun til pasienter med kronisk og alvorlig insomni som har: 1) nedsatt funksjon på dagtid, som økt søvnighet, humørsvingninger, svekket kognitiv eller sosial fungering, økt ulykkesrisiko, fysisk ubehag, økt bekymring rundt søvnen, og i tillegg 2) minst tre dårlige netter per uke, eller døgnrytme som ikke lar seg normalisere.
1 (Melatonin Unimedic Pharma) innvilget forhåndsgodkjent refusjon etter blåreseptforskriftens §§ 2, jf. 1b, med hjemmel i legemiddelforskriften § 14-8. 2 SPC 2020-12-10



Det var en gang for lenge, lenge siden, da pediatrien fortsatt var ganske liten. Før surfaktanten hadde kommet og Lushkoen hadde gått. Den gangen luftambulansen var 330-skvadronens Sea King helikopter over Vestfjorden med en assistentlegefersking i femdelt vakt. Det var en gang en medisinerstudent som flettet hår, leste eventyr og fikk skjenn av strenge oversykepleiere for å være «for snill» med barna – og som nektet å høre på dem.
Tekst og foto: Katrine Engen, redaktør Paidos, legespesialist Lillehammer og PhD-stipendiat
Det er et ukjent antall barn, foreldre og kollegaer evig takknemlige for. Resultatet skulle bli kompromissløs omsorg gjennom fire tiår i nyfødtmedisinen. Selv kaller Inger Elisabeth Silberg dem «et eventyr».
«Der er alle lysene på Galtvort!»
En liten glassdør innfelt i bære konstruksjonen på kjøkkenet har tatt vare på de originale teglsteinene og trebjelkene som Fredrikstad er kjent for. Det knappe ti centimeter dype «Eventyrskapet» i huset bare et par hundre skritt fra togstasjonen fungerer som et bittelite utstillingsmonter, aller mest for barnebarnkunst. Spredt innimellom ligger noen små gaver og påminnelser om takknemlige møter gjennom 40 års doktorliv.
Hun hadde tenkt på den en stund. Den modnet gradvis i takt med vinteren, med våren og vindusutsikten fra 05.38-toget til Oslo. Avslutningen måtte komme før sommeren, ikke i mørketiden. Hun visste at den ville bli vemodig nok i seg selv. Etter førti år i «verdens beste jobb» er det uunngåelig med noen tårer. De er svar nok på min naive spørsmålsåpning om hvordan det har vært å jobbe på Rikshospitalet.
«Det har vært 40 år! Og jeg har vært helt fantastisk heldig!»
Det finnes ikke et fnugg av tvil om samtykkekompetansen hennes. Likevel er det innhentet komparentopplysninger fra Bodø til Fredrikstad, fra 1982 og tilbake igjen. Fra kollegaen som begynte å gråte da hun forstod at hun ikke skulle henge i frakken hennes mer, til han som ikke kan fatte at det er
nesten 40 år siden det startet. Det er fortellingen om et doktorliv viet til nyfødtmedisin og barnekardiologi, og om fremveksten av et helt fagfelt. Det er beretninger om en «fantastisk kliniker» og om en kollega som «nesten tror litt for godt om mennesker». Om hedersbetegnelsen «hel ved», og om en ufattelig raushet og omsorg. Det er historiene om en ustoppelig dedikert fagperson med beundringsverdig evne til å sette seg inn i komplekse problemstillinger – og som aldri uttaler seg før hun er sikker på dem. Om det å se pasienten med «mormorbriller» og en unik evne til å kommunisere med mennesker som har det vanskelig. Aller sterkest er spontanreaksjonen fra de to som savner «mor» på kontoret sitt.
Begynnelsen var det klisjéfylte «for lenge, lenge siden». Hun startet som pleieassistent like før medisinstudiet, da «gamle dager» på 60-tallet ble avløst av det hakket mer barnevennlige 70-tallet. Barna på Sophies Minde lå der i måneder og evigheter, immobilisert i hoftegips og ortopediske strekkapparaturer. Foreldre hadde visittid to timer i uka. De fleste bodde ikke i Oslo.
«De hadde jo som regel ingen valg disse barna. De var låst, bokstavelig talt, til det som ble bestemt over dem.»
Det var lite populært å la barna velge noe som helst, i hvert fall ikke farge på nattskjortene, og slett ikke om det resulterte i gutter i rosa nattskjorte. Dramatisering av helter fra Barne-TV var definitivt ikke godtatt. Spesielt ikke det å hoppe rundt og gestalte Romeo Clive og Kanutten.
Hun er født i 1951, oppvokst i Horten og var et pliktopp fyllende, lærevillig barn som tidlig forstod hvilken yrkes retning hun ønsket. Ekstrajobben som renholder på barsel gled raskt over i oppgaven med å stelle alle barna før mødrene
Det har vært 40 år!
Og jeg har vært helt fantastisk heldig.
fikk dem inn for amming etter datidens normerte fire timersintervaller. Veien gikk videre til medisinstudium i Oslo. Det var ikke det vanligste.
«Jentene var færre den gangen, vet du!»
De ble som regel utdannet til såkalt «mødrevennlige» yrker, videre til mødreeller til hissige formidlere av ukeskriftet «Sirene» eventuelt. Selv opplevde hun fotformsoldatene i Blinderns Sigrun Berg-uniformerte kvinnebevegelse litt i overkant hissige.
«Kvinnekampen var utrolig viktig, men formidlingsme toden var veldig sint! Akkurat det passet ikke for alle. Noen av oss ville utdanne oss på helt jevnbyrdige premisser og holde på med faget på like vilkår.»
Det gjorde hun utvilsomt. Hennes første barn ble født tre uker før embetseksamen. Turnus i Bodø og spesialisering til henholdsvis pediater og voksenkardiolog tok hun og mannen på omgang. 16 radikale permisjonsuker var oppfunnet først da nestemann kom i 1983. Barnehage og SFO eksisterte knapt.
«Vi lagde vår egen barnehage. Etter hvert ble det til SFO som kommunen overtok senere. Det var nok hakket mer samhold i disse ordningene enn i dag».

Det var solidaritet med sykehusarbeidende foreldre fremfor bøtelegging av forsinket henting. Yngstesønnen (ironisk nok anestesiolog) ble på et tidspunkt hentet i barnehagen av ambulansen da hun stod fast på nyfødt intensiv.
Det startet med et forsiktig bank på døren til avdelings overlege Helene Pande. Forespørselen om hvorvidt hun forstyrret avstedkom et kontant og ærlig «JA!» Muntlig assistentlegesøknad måtte gjentas uken etter før vikariatet i Bodø var et faktum. Det var ingen som spurte om man var klar for actionfylte hentinger av dårlige nyfødte med Sea Kingen. Over transportkuvøsen hang skiltet; «Ta det med ro! Dette har du gjort før!» Dessuten hadde man vakt.
«Jeg våget vel egentlig ikke å bli nyfødtmedisiner - men vi hadde jo ikke noe valg! Vi var mange timer unna Riks hospitalet, og det ble født unger på fødestuer langs hele
nordlandskysten. Jeg tenkte at dette er jeg nødt til å lære meg, ellers kommer jeg til å dø av skrekk!»
Nyfødtmedisinen var bobleCPAP med vannslanger i tåteflasker og ett pulsoksy meter på deling. De andre barna fikk oksygen til fargen tilsvarte det barnet som hadde det på seg. I Bodø ble man flink. Man ble trodd og fikk backing på vanskelige vurderinger, og det manglet ikke på dem. 1980-tallet var akuttpediatri slik dagens pediatere knapt har sett det.
«Meningokokksepsis. Det var helt forferdelig. Babyer! 3-4 åringer! Søskenpar! Mange døde. Og som oftest var de transportert fra langt utpå kysten et sted, slik at tiden hadde gått. Tiden jobbet jo mot oss.»
Barn med leukemi døde. De man ikke kunne transportere ble forsøkt behandlet der de var, og Bodø opererte diafragma hernier helt til langt utpå 80-tallet. Hun lærte seg de kliniske mønstrene – og ble kliniker.
«Det etablerte vel en gjenkjennelse av symptomer, funn og mønstre. Når det har skjedd noe inni hodet ditt, noe som sier at det ikke er i orden, da må det bare fortsette – for da er det ikke i orden!»
Etter ett år våget hun å melde seg inn i daværende Norsk Pediatrisk Selskab. Et personlig brev fra leder Alf Meberg ønsket velkommen; «i fellesskapet for barns beste!». Gradvis flyttet nyfødtmedisinen grenser.
«I Bodø var det forbudt å legge barn under 1000 g på respi rator. Hasse Bangstad og jeg jugde. Vi la fingeren på vekta til det ble 1010. Det skled over. Når du først har gjort det er det jo ingen som tar den av igjen. Det kunne jo komme kommen tarer; er den der over 1000 gram??»
Actionfylte Sea King-netter over Vestfjorden bar definitivt frukter. Etter åtte år i nordlendighet ble 130 flyavhengige mil litt for langt fra familie og venner. Kriteriet for bosted ble «kaffebesøkavstand», i ordets relativt vide definisjon. Familien landet i Fredrikstad. Ultimatumet var kort vei til sykehuset og kort vei til togstasjonen. Hun visste at hun en eller annen gang ville jobbe i Oslo. Etter noen år ved daværende Fredrikstad sykehus, på nyfødtavdeling og med pasientansvar for samtlige av Østfolds hjertebarn landet hun endelig – på Rikshospitalet.
Jeg tenkte at dette er jeg nødt til å lære meg, ellers kommer jeg til å dø av skrekk!
«Det var en slags utviklingstid i nyfødtmedisinen. Faget vokste frem og det kom helt nye muligheter som nødvendigvis gjorde at faget måtte satses på. Curosurf! Prostaglandin! Hjertekirurgi! Det var helt fantastisk»
Rikshospitalet lå fortsatt i Pilestredet de nettene de første barna fikk Curo surf. Hun husker de første vaktene med nyvinningen.

«Curosurf var nok det største. Det var virkelig helt fantastisk! Ola Didrik Saugstad lagde forskningsstudien Curosurf IV, der flere lokalsykehus var med i en multisenterstudie. Det betød at surfactantbehandling kom raskere ut på sentralsykehusene enn det ellers ville ha gjort».
Uten den ville det sannsynligvis tatt lenger tid. Nyvinninger må oftest utprøves sentralt før det før det blir etablert behandling. Det samme gjaldt Prostaglandinet.
«I starten var det litt sånn at dette var noe man bare trengte på Rikshospitalet. Det er selvfølgelig feil - de hadde jo kirurger!»
Hun er ikke i tvil om at faget gjennomgikk et paradigme skifte. Konsekvensene er blitt et annerledes fag å jobbe med for kollegaene som kommer etterpå. På godt og vondt.
«Det er blitt mye mer glede! Vi har mye mer å tilby. Samtidig er det blitt tøffere, vet du! Det er mer fokus på erstatnings saker, man er reddere for å gjøre feil. Det er blitt mer administrasjon og større avstander til de som bestemmer. Før var det litt mer sånn at dersom man trengte noe til avdelingen, så fikk man det.»
Hun har aldri klatret opp på en eneste barrikade, men agert
klart og tydelig på vegne av pasiente ne. Rikshospitalets noe vel i overkant «arealeffektive omgivelse» ble for få år siden supplert med noen enerom, primært tenkt brukt som isolater, etter kraftig påtrykk fra henne og kollegaene.
«Sånne tiltak krever mye. Det er ikke sånn du får for DRG og sånt - det tar lang tid for de som bestemmer å skjønne det, og gi handlingsrom til å gjøre det. Da må du ha pådrivere, og det har vi vært til tider. Hvis du sier ting med grundig dokumentasjon så blir du hørt».
Til dags dato har de ikke stått ubrukt. Hun håper nyfødt medisinen dreier i mer familiefokusert retning, og erkjenner at faget er blitt mer komplekst og sammensatt. Det å komme seg ut er en stående anbefaling. Datterens studietid i Australia ble bro til fire måneder på nyfødtavdelingen i Sydney. Senere dro hun til Philadelphia, utelukkende for å lære mer om BPD og pulmonal hypertensjon, fremdeles en alvorlig komplikasjon til prematur fødsel. Hun har tro på å komme seg ut av landet for å lære.

«Det trenger ikke nødvendigvis være så langvarig, men det må være strukturert. Man bør ha en plan for det, og et konkret mål».
Eventyret har gitt møter med mang en skjelven assistentlege i gruppe 1-tjeneste foran sin første natt med respiratoren. Minst like mange skjelvende bakvakter har møtt den rolige mormorstemmen gjennom telefonen.
«Hvis noen ber om hjelp – så skal de få det!» Man skal ikke sitte der ute og kjenne på at man maser eller klager eller ikke er flink nok.»

Hvis noen ber om hjelp – så skal de få det! Man skal ikke sitte der ute og kjenne på at man maser eller klager, eller ikke er flink nok.
Det å jobbe med unge kollegaer har inspirert henne - og både rekruttert og stressvaksinert førstereisdoktorer på Riks hospitalet.
«Det å få dem i siget, til å glede seg over noe, til å få dem flinkere, tryggere og gladere - det er jo det som er hele målet! Ikke minst er det kjempeviktig å få flinke folk til å ville ta med seg kunnskapen hjem igjen og til å jobbe utenfor Oslo. Jeg har hatt veldig glede over å se at andre får ting til. Det å se at de mestrer, blir tryggere og gleder seg over det. Å ha en LIS på hver side, å jobbe med unge mennesker – det har vært stimulans fra verden!»
Hun har ingen ambisjon om å henge i et horn på veggen.
«Det skal ikke merkes at man er borte! Kunnskapen må formidles. Hvis du bare kan få gitt det bort er målet oppnådd! Du kan ikke gå og håpe på at det ikke skal komme unger som ikke puster på din vakt. Det du er redd for må du øve deg på
Det gnistrer litt i øynene.
«Man kan ikke oppdra folk, men du kan kanskje smitte dem?»
Hun mener selv hun bare har møtt flotte mennesker
«Alle mennesker er mer enn det du ser! Alle har flere sider. Også må vi lete etter de gode!»
Engasjementet har hatt vesentlig R-faktor ikke bare i jobb sammenheng. Tre av tre barn er leger, henholdsvis ortoped, allmennpraktiker og anestesilege. De er grundig innprentet at de skal lytte til foreldrene, at friske barn spiser maten sin og har lyskepulser. Verken hun eller mannen har promotert legeyrket i nevneverdig grad, men hun tror de har observert at hun har trivdes. Egentlig har hun ikke pendlet, hun har bare «bodd i Fredrikstad og jobbet i Oslo» - med den togtimen det innebærer med strikking, lesing eller bare grubling hver vei. Hun har elsket det.
«Fellesskapet for barnets beste har vært der! Det har de aldri fått administrert bort, de som bestemmer.»
Pensjonistsommeren startet på Gardermoen, med fottur i Spania – deretter sykkeltur med ivrige barnebarn langs Kattegatsleden. Innen høsten var den gradvis glidd over i større og mindre prosjekter. Hun er mormor med duplo klosser på gulvet og sprinkelseng på stand-by. I mellom slagene har dukkehuset i hagen blitt både materielt og symbolsk oppgradert, med et bittelite vindu hentet fra det gamle Rikshospitalet i Pilestredet. Donasjonens opp havsmann skal forbli unevnt, i hvert fall i dette intervjuet. Fortsatt henger engasjementet igjen. Noen rutiner vil ikke helt slippe taket, selv med vissheten om at vaktcallingen er avlevert – for siste gang.
«Jeg våkner fortsatt hver morgen kl. 05 og hører toget kl. 05.38. Og sover videre».
 «Mor & barn» av Pernille Gulbrandsen & Iver. www. godeklode.no
«Mor & barn» av Pernille Gulbrandsen & Iver. www. godeklode.no
Fysiologibasert avnavling innebærer at navlesnoren holdes intakt inntil barnets lunger er luftfylte og lungekretsløpet perfundert. Bør vi ventilere nyfødte som ikke puster før navlesnoren kuttes?

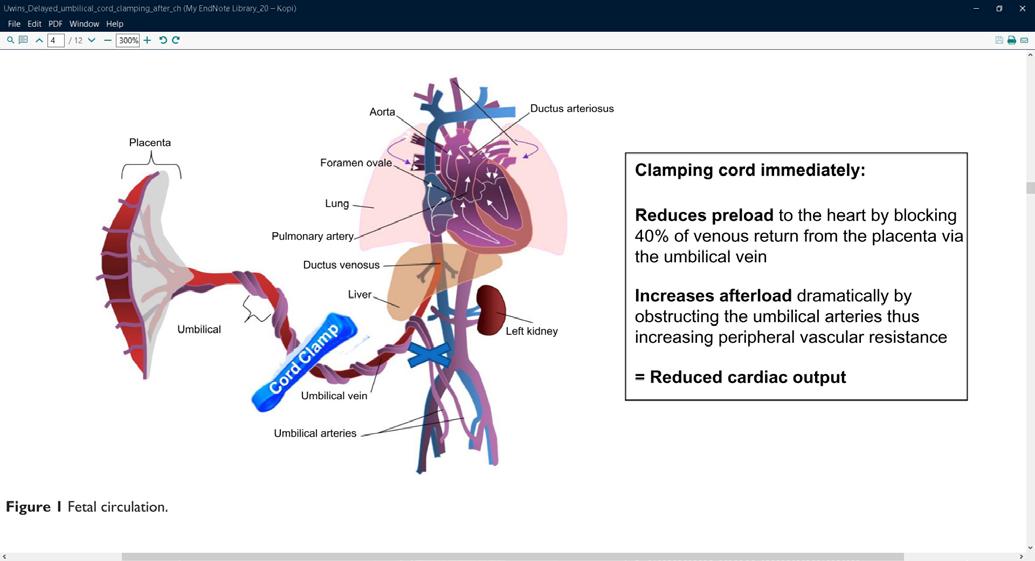
Fysiologi og hemodynamikk I de første minuttene etter fødselen skjer det store fysiologiske endringer i barnets respirasjon og sirkulasjon. Lungene tar over som gassutvekslingsorgan, og den vaskulære mostanden i lungearteriene synker som følge av økt oksygenkonsentrasjon. Når lungekarmotstanden faller, fylles lungene med blod som deretter strømmer via lungevenene tilbake til venstre hjerte halvdel (Fig.1). Dette sikrer god fylning (preload) til venstre ventrikkel som kan opprettholde et tilstrekkelig slagvolum. Slik unngår barnet store blodtrykksendringer (1, 2)
Dersom barnets lunger ikke fylles med luft, forblir lungekar motstanden høy, og det går lite blod til lungene. Avklemming av navlesnoren i denne situasjonen vil kutte blodforsyningen til barnet via navlevenen, og venstre ventrikkel får redusert fylning (preload), fordi manglende venøs retur fra placenta ikke kompenseres av økt venøs retur fra lungevenene. I tillegg øker motstanden i systemkretsløpet (afterload) på grunn av at navlearteriene er avklemt. Dette kan føre til kardiovaskulær instabilitet i de første, viktige minuttene av barnets liv og forstyrre transisjonsprosessen.
Intakt navlesnor inntil barnet har etablert pulmonal gassutveksling, gir mer stabil hemodynamikk med potensielt store gevinster, blant annet redusert risiko for hjerneblødning. Så lenge navlesnoren er intakt, kan noe gassutveksling fortsatt foregå gjennom placenta og beskytte mot asfyksi, selv om barnet er utenfor uterus.
Ulike definisjoner benyttes, men ofte defineres sen avnavling som avklemming av navlesnoren mer enn 60 sekunder etter at barnet er født. Begrepet «fysiologibasert avnavling» brukes når tidspunkt for avnavling ikke bestemmes av klokka, men avgjøres basert på kriterier om at barnet skal ha etablert pulmonal gassutveksling og fysiologiske tegn på tilfredsstillende omstilling til ekstrauterint liv (3), samt at navlesnoren har sluttet å pulsere og er hvit.
Sen avnavling er vist å være fordelaktig for både premature og fullbårne barn som ikke trenger umiddelbar resuscit ering. Metoden ble anbefalt av Aristoteles allerede 350 år før Kristus, og har blitt nevnt av diverse vitenskapsmenn gjennom historien. Umiddelbar avnavling ble først innført på 1950-tallet, delvis med bakgrunn i introduksjon av opitater som smertelindring til mor under fødsel, som kunne gi barnet redusert pusteaktivitet. På 1970-tallet ble tidlig avnavling vanlig som ledd i aktiv håndtering av etterbyrdsfasen (4, 5). Vanlige argumenter for tidlig avnavling har vært å unngå å forsinke resusciteringstiltak, samt frykt for at forsinket avnavling vil kunne føre til hypotermi, hyperbilirubinemi eller polycytemi (6)
Ny kunnskap om avnavling De siste 20 årene har det kommet en rekke publikasjoner som sammenligner sen og tidlig avnavling. Det er blant annet vist at 87% av føtoplacentært blod går til barnet når man venter med avnavling til etter at barnet har fått luft i lungene, mot kun 67% ved tidlig avnavling (7). Barn som har blitt avnavlet mer enn 3 minutter etter fødsel, har høyere hematokrit, mindre anemi og lavere forekomst av jernmangel (8). Forsinket avnavling gir også redusert forekomst av intraventrikulær blødning og nekrotiserende enterokolitt hos premature samt mindre behov for blodtransfusjoner (9). Ved sen avnavling er det vist bedre kognitiv utvikling ved 12 måneders alder, og bedre finmotorikk og sosial adferd ved 4 års alder (10). Kollegaer i Stavanger har publisert flotte data på hjertefrekvensutvikling etter normal vaginal forløsning og sen avnavling, og finner at pulsen stiger raskere og holder seg mer stabil postnatalt enn man har sett ved tidlig avnavling (11). Det er også vist klare effekter på stabilisering av perifer oksygenmetning hos terminfødte barn, med signifikant raskere stigning i SpO2 (12, 13). Videre er det vist at fysiologisk avnavling kan gi økt overlevelse hos premature barn (14).

Reduserer preload ved å blokkere 40% av venøs retur til hjertet via navlevenen
Øker afterload ved å obstruere navlearteriene. Dette fører til økt perifer karmotstand
Figuren viser mekanismer for ustabil hemodynamikk ved tidlig avnavling. Modifisert fra referanse 2, Uwins et al, med tillatelse.
WHO anbefaler at navlesnoren holdes intakt de første minutter etter fødsel hos alle nyfødte (6). I siste utgave av retningslinjer for nyfødtresuscitering fra 2021 foreslår ‘The European Resuscitation Council’ at avnavling bør utsettes i minst 60 sekunder, og helst til etter at lungene er luftfylte. Umiddelbar avnavling er fortsatt anbefalt hos kompromitter te barn som trenger resuscitering, men det åpnes for å starte gjenopplivingstiltak før avnavling der man har personell som er trent i denne settingen (15).
Innføring av sen avnavling av nyfødte som krever resusciter ing eller hjelp til transisjon, skaper nye logistikkutfordringer og praktiske vanskeligheter for resusciteringsteamet. Navlesnoren er kort, og pustehjelp må gis i fødestuen nær mor for å få til dette i praksis. Det er utviklet mobile «avnavlingsbord» som gjør dette lettere. Et britisk firma har lansert et lite, kompakt bord kalt «LifeStart» som kan trilles tett opptil fødesengen. Kollegaer i Nederland har utviklet Concord Birth Trolley, som er dyrere og mer plasskrevende, men har bevegelige svingarmer som muliggjør ulike plasseringer av barnet nær eller over mor (16). Varmetap er en fare ved manglende overvarme. Lifestart har varmemadrass og Concorde har muligheter for tilkobling av overvarme. Begge bordene har blitt brukt i studier helt ned til 23 ukers GA, hvor man har klart å opprettholde adekvat temperatur hos barna (18). Det er også mulighet for å stabilisere barnet nær mor med intakt navlesnor uten dedikerte avnavlingsbord (17, 18).
Ved keisersnitt er det fortsatt utfordrende å kombinere sen/ fysiologisk avnavling med ventilasjonsstøtte på grunn av
plassforhold, varmekonservering og manglende mobilt utstyr for å stabilisere eller resuscitere barnet tett opptil mor (19).





Det tar som kjent tid før nye metoder og ny kunnskap implementeres i nasjonale og internasjonale retningslinjer. Randomiserte, kontrollerte undersøkelser er vanskelige å gjennomføre når ny praksis allerede er i bruk. Resusciterings forskning, og særlig på spedbarn, er spesielt utfordrende med hensyn til etiske forhold. Mye tyder på at fysiologisk avnavling er gunstig for de fleste nyfødte, uavhengig av gestasjonsalder og forløsningsmetode.
Per i dag foreligger det for lite data til at resuscitering med intakt navlesnor er anbefalt som rutine i internasjonale retningslinjer (20). Det pågår imidlertid studier som for håpentligvis kan gi flere svar i årene som kommer. Kanskje vil fremtvinge endringer i måten mange av oss jobber på?
Fysiologibasert avnavling i Norge
I Norge var Ålesund tidlig ute med å innføre sen avnavling ved vaginale fødsler, og tidlig avnavling ble eliminert gjennom et kvalitetsforbedringsprosjekt (21). Det pågår for tiden en ny studie som omhandler stabilisering med intakt navlesnor ved keisersnitt (22).
Interessen for å starte stabiliseringstiltak på nyfødte før avnavling, er vekket hos flere: På neste side rapporterer vi om status og erfaringer i norske sykehusavdelinger.
Referanser: se www.paidos.no






Et kort spørreskjema ble sendt til alle norske nyfødt avdelinger. Vi fikk svar fra 20 sykehus!
Sen avnavling dominerer Svarene viser entydig at sen avnavling har funnet veien inn i norske sykehus, og en stor majoritet praktiserer avnavling tidligst etter 1 minutt hos friske barn. Mange angir at de har implementert prinsipper om fysiologibasert avnavling og styrer ikke etter klokka, men venter til barnet har skreket eller pustet og navlesnoren har sluttet å pulsere. Avnavling skjer tidligere ved keisersnitt enn ved vaginal forløsning (Figur 1 og 2), og vi antar at dette har praktiske og logistikkmessige årsaker.
Umiddelbar avnavling ved dårlig barn De fleste avdelinger praktiserer fortsatt tidlig avnavling når barnet har behov for pustehjelp. Flere har spesifisert at
umiddelbar avnavling er indisert ved asfyksi. Noen oppgir at tidlig avnavling er rutinen ved kjente rhesus- eller trombocyttanistoffer, tvillinger, maternell diabetes eller intrauterin vekstretardasjon.
Stabilisering med intakt navlesnor Interessen for å starte stabiliseringstiltak til nyfødte FØR avnavling, synes å være raskt økende (Figur 3). Ålesund og Førde har hatt mobile avnavlingsbord (LifeStartTM) i flere år allerede, Levanger anskaffet tilsvarende i 2020. I Ålesund praktiseres fysiologibasert avnavling hos alle barn født vaginalt, uavhengig av gestasjonsalder, forventet tilstand og ventilasjonsbehov. Førde og Levanger benytter LifeS tart-bordet bare ved vaginal fødsel og forventet dårlig barn. Haukeland rapporterer at de har hatt mobilt avnavlingsbord i rundt ett år. De bruker dette hovedsakelig til premature født vaginalt. Før de fikk spesialutstyr, trakk flere leger ofte et
vanlig asfyksibord tett inntil fødesengen for å kunne bistå med stabilisering av barnet før navlesnoren ble kuttet, AHUS og Bodø beskriver en tilsvarende praksis. Drammen og UNN har kjøpt LifeStart bord i 2022, og vil ta utstyret i bruk i løpet av høsten. Drammen vil i første omgang benytte dette ved vaginale forløsninger. UNN planlegger å introdusere transisjonshjelp med intakt navlesnor bare til premature <32uker, men uavhengig av forløsningsmetode. Fra Kristiansand meldes det at de skal prøve ut LifeStartbord i november. Skien skriver at de vil sette et mobilt avnavlingsbord på investeringslisten.

Skal, skal ikke? Etter å ha lest denne artikkelen, vil noen kanskje sitte igjen med en følelse av at: -Oi, vi er bakpå, vi må kjøpe avnavling bord snarest! Vi minner om at det pågår flere studier, og at mer kunnskap er på vei på dette feltet. Dersom man ønsker å endre praksis, er det selvfølgelig ikke nok å kjøpe et avnavlingsbord. Innføring av nye metoder i en akutt klinisk setting må være godt planlagt, og alt personell få god opplæring, helst med simulering før oppstart.

Innføring av nye metoder i en akutt klinisk setting må være godt planlagt, og alt personell må få god opplæring.
Ganske få av behandlingsvalgene vi tar i vårt daglige virke har dokumen tert betydning for senere helse og livskvalitet. Denne erkjennelsen gir grunn til å møte faglig uenighet med større åpenhet og nysgjerrighet.
En god medisinsk forskningsprotokoll skal ha en entydig definert problemstilling med en tydelig og testbar hypotese, og et klinisk relevant og presist målbart endepunkt innenfor en overskuelig tidshorisont.
Hvis dette var drømmen da du valgte nyfødtmedisin, har du kjøpt katta i sekken. Vårt fag er preget av langtrukne komplekse behandlingsforløp med sykdom i ett eller flere umodne organer i ulike utviklingsstadier. De fleste endepunktene vi bruker i vitenskapelige studier er ganske irrelevante for barnets langsiktige prognose og livskvalitet. Nyfødtlegene Keith Barrington og Peter Davis har nylig stilt spørsmål ved om BPD-diagnose ved 36 ukers postmenstruell alder overhodet representerer et meningsfullt endepunkt i forskning fordi den prediktive verdien med hensyn til lunge funksjon og livskvalitet senere i livet er lav (1).

Veldokumenterte, effektive behandlingstiltak kan telles på mindre enn du har fingre på to hender. Antenatale steroider, surfaktant ved RDS, hypotermi ved asfyksi og romluft fremfor 100% oksygen ved gjenoppliving er blant dem. I tillegg er det dokumentert at godt samspill mellom foreldre og barn og reduksjon av smerte og stress bedrer kognitiv funksjon og gir mer normale MR-funn flere år etter behandling.
Antibiotika virker, men 5-50 ganger flere får behandling enn de som faktisk har infeksjon Respiratorbehandling øker overlevelse ved lungesvikt, men hvem som behandles og hvor lenge varierer mye. Ingen har vist at livskvalitet eller lunge funksjon senere i livet påvirkes av hvordan vi styrer respirato ren. I mer enn 40 år har vi ment mye og sterkt om lukking av ductus arteriosus, men fortsatt er vi ikke i nærheten av sikker kunnskap om, når, hvem og hvordan vi skal lukke.
Sannsynligheten for at du blir kritisert for å ha gjort for mye, er i de fleste tilfeller lik null. Muligheten for å møte kritikk hvis du ikke har lagt til enda en ikke-dokumentert behandling er reell. Slik skaper vi en kultur for overbehandling. Sunn
skepsis til dårlig dokumentert behandling tolkes ofte som passivitet, noe ingen intensivmedisiner med respekt for seg selv ønsker å bli assosiert med.
Det syke barnet – et komplekst adaptivt system Vår evne og vilje til å se mening og sammenheng i alt som skjer er velutviklet, men ofte ser vi slike sammenhenger også når de slett ikke finnes (2). Vi glemmer det statistiske prinsipp som kalles regresjon mot middelverdien. Hvis en observasjon avviker mye fra referanseområdet på et måletidspunkt, er det mer sannsynlig at den neste målingen ligger nærmere referanseområdet enn at den avviker enda mer. Dermed er det fullt mulig at det vi oppfatter som en effekt av vår behandling egentlig bare reflekterer statistisk forventet normalisering.
Kan det være slik at vår enkle forståelse av årsak-virkning ikke fanger opp og reflekterer kompleksiteten i et system hvor et stort antall intervensjoner, fysiologiske responser og feedback-systemer påvirker hverandre på uforutsigbare måter? Kompleksitetsteori tar en slik tilnærming til det som kalles kom plekse adaptive systemer (3). Et sykt barn under intensivbehandling kan beskrives som et slikt system.
Når det er så vanskelig å påvise klinisk signifikante forskjeller av ductuslukking, steroidbruk eller ventilasjonsstrategi på overlevel se, lungefunksjon eller livskvali tet senere i livet, kan det skyldes et komplekst samspill mellom mange faktorer. En tolkning er at en mulig effekt nøytraliseres av hundrevis av andre tilsiktede og utilsiktede effekter av behand lingstiltak vi iverksetter gjennom et langt sykehusopphold.
Tekst: Atle Moen, nyfødtavdelingen Oslo universitetssykehusEn mer rasjonell og kritisk praksis Så hvordan kan vi legge til rette for en mer rasjonell og vitenskapelig basert klinisk praksis?
Vi bør innse begrensningene i vår egen evne til å forstå og resonnere logisk om komplekse problemstillinger når vår kunnskap om effekt av behandlingen er mangelfull. I komplekse systemer er det en betydelig risiko for å tenke seg til galt svar, også når sammenhengene umiddelbart fremstår som logiske.
Vi bør i større grad anvende føre-var-prinsippet når vi gir udokumentert behandling. Imidlertid står valget ofte mellom en udokumentert standard behandling og et udokumen tert alternativ.
Dersom klinikken ellers er tilfreds stillende, bør vi av og til stikke hendene dypt i lommene og motarbeide vårt instinkt om å korrigere alt som ligger utenfor et gitt referanseområde. Et avvik betyr ikke alltid at en korrigerende intervensjon er nødvendig eller nyttig for pasienten. Av og til er det tvert imot skadelig.
Vi bør videreutvikle populasjonsbaserte behandlingsregistre, samle og inkludere data fra langtidsoppfølging og søke flernasjonalt registersamarbeid. «Comparative effectiveness
research» sammenligner resultater mellom sentra og registre med samme profil. Det gir oss et bedre grunnlag for å utforme gode hypoteser om hvorfor noen har bedre resultater enn andre.
Test kjepphestene dine!
Vi bør utfordre egne kliniske kjepphester og teste dem i kontrollerte studier når antall pasienter er både stort nok og homogent nok. Det gjelder særlig i grupper av premature født etter 28 ukers gestasjonsalder og moderat syke barn født til termin. Da får man av og til noen interessante overraskelser (4). Dersom resultatet blir det samme, er en behandling med få intervensjoner kvalitativt bedre enn en med mange.
Vi bør innarbeide kontinuerlig forbedringsmetodikk i avdelingens daglige rutiner for å holde oversikt over egen praksis og behandlingsresultater. Dermed kan vi lettere vurdere effekt når vi endrer praksis, eller justere praksis om vi observerer en uønsket endring i resultater.
Et viktig skritt i retning av en mer kritisk og vitenskapelig tilnærming er å erkjenne hvor lite vi vet med sikkerhet, og i beste mening utfordre hverandre på hvorfor vi gjør som vi gjør. Kunnskap, kritisk sans og nysgjerrighet kombinert med evne til å se kliniske problemstillinger med nye øyne, er et godt sted å starte om vi ønsker å tilby bedre behandling til syke nyfødte.
Referanser: Se www.paidos.no
sunn skepsis til dårlig dokumentert behandling tolkes ofte som passivitet, noe ingen intensivmedisiner med respekt for seg selv ønsker å bli assosiert med.
Pasientmedvirkning er et viktig prinsipp i dagens helsevesen. Gjennom samvalg støtter vi pasienten frem mot en beslutning ved å bidra til å utforske egne verdier og preferanser. Hvor relevant er dette for oss som jobber med de aller minste pasientene? Konferansen «Samvalg i nyfødt medisin» samlet over 60 engasjerte nyfødtleger, -sykepleiere og samvalgskoordinatorer for å diskutere nettopp dette.


Lege-pasientforholdet har tradisjonelt vært basert på paternalisme, med pasientene som passive mottakere av helsehjelp. Prosessen fram mot aktiv pasientmedvirkning fikk et gjennombrudd på 1980- og 1990-tallet, da synet på relasjonen mellom pasient og behandler endret seg radikalt, og en rekke formelle pasientrettigheter ble innført.1 Dette har ledet fram til målsetningen i dagens Nasjonal helse- og sykehusplan 2020–2023. «Samvalg skal være det normale, ikke det spesielle i pasientens helsetjeneste»2. Ordet samvalg dukket opp i 2014 som norsk definisjon av «shared decisionmaking». Ordet betegner avgjørelser som tas av behandler og pasient i fellesskap - og prosessen for å komme dit.3
Under konferansen viste etiker Berge Solberg at samvalg står på et solid etisk, helsemessig og juridisk fundament, tuftet på sentrale verdier i vårt samfunn. Verdighet som aktelse for egen og andres fornuftsevne og vilje, og respekt for at vi mennesker er forskjellige. Lykken har best forutsetninger når forskjeller får utfolde seg, og god pasientbehandling må derfor ta høyde for pasientenes individuelle ønsker og verdier. Dette er vis dom vi har med oss fra gammelt av: «Den vet best hvor skoen trykker som har den på», noe moderne forskning bekrefter. Samvalg gir positive effekter for både pasient og behandler.4 Gjennom økt inkludering og eierskap til beslutninger, bidrar samvalg til å myndiggjøre og motivere pasienten. Samvalg er derfor både riktig, viktig og nyttig!
Samvalg – også til besvær? Hvis noen tar valg sammen, hvem har egentlig det siste ordet? Hva er forskjell på «samvalg» og såkalt «konsum erisme»? Betyr autonomi at pasienten kan diktere ønsket helsehjelp? Ikke ifølge Nasjonal helse- og sykehusplan 2020–2023: «Helsehjelpen skal være forsvarlig, og behandlingen som ønskes må være innenfor det som tilbys av helsetjenesten. Sam valg betyr ikke at pasienten alltid skal få etterkommet sitt ønske. Samvalgsprosessen skal imidlertid gi helsepersonell kunnskap om hva som er viktig for pasienten, og bidra til behandling som tar hensyn til pasientens livssituasjon.»2 En rimelig tolkning av begrepet blir da at pasienten har siste ord innenfor de valgmuligheter som legen setter opp.
Mange pasienter ønsker bare å bli ivaretatt på en omsorgsfull måte. Hva med de som ikke ønsker å velge? Sosiale og kulturelle forskjeller kan av og til fremstå som hinder for å delta i helserelaterte beslutninger. Samvalg innebærer også muligheten til å velge å overlate beslutningene til helsepersonell eller involvere pårørende.5 Forskning viser imidlertid at det kan være god omsorg å sette mennesker i stand til å stå ved roret i eget liv. I Samvalget er ikke målet at pasienten skal ta beslutninger alene - men at man går veien sammen.
Behandlingsvalg i nyfødtmedisinens «gråsone»
Forbedringer i alt fra teamarbeid til teknologiske hjelpe midler har heldigvis gjort oss bedre i stand til å hjelpe barn født ekstremt prematurt. Dessverre er ikke alle like heldige. Noen av de minste barna vil dø av umodenhet eller komplikasjoner etter timer, dager eller måneder med intensivbehandling, og noen vil overleve med senskader som vil påvirke dem resten av livet. Ved fødsel vet vi ikke hvem som vil klare seg til et «godt liv». En av medisinens fremste plikter er prinsippet om å ikke skade. Hvor små kan sjansene være før vi setter alle kluter til, og hvor store byrder
for barnet og familien kan vi forsvare? Og hvem skal ta det endelige valget?
På konferansen gjennomgikk barnelege og etiker John Lantos ulike alternativ. Paternalismen står fortsatt sterkt blant nyfødtleger, og kan støtte seg på gode argumenter. Legen har kunnskap, praktisk visdom og er vant til å stå inne for beslutninger. Dermed forventer foreldre at vi tar ansvaret for valget. Prinsippet er også nedfelt i våre nasjonale føringer fra konsensuskonferansen i 1998: i gråsonen (den gang definert som svangerskapsuke 23 og 24) skulle det gjøres individuell vurdering basert på vitalitet og ut fra den enkelte leges skjønn. Hensynet til familien skulle også tillegges vekt.6
Lantos fremhever imidlertid at foreldrene er de som står barnet nærmest, og er de som sammen med barnet skal leve videre med konsekvensene av den beslutningen som tas. Derfor bør deres verdier være førende når vi står overfor en valgsituasjon.7 I henhold til Veileder for beslutnings prosesser ved begrensning av livsforlengende behandling er det foreldre som skal motta informasjon og gi samtykke til behandling; «Foreldrene har rett til å være inkludert i avgjørelser omkring barnet, men kan ikke kreve behandling som behandlingsansvarlig ikke finner faglig forsvarlig, eller nekte behandling som behandlingsteamet finner er til barnets beste.(..) Jo mer usikkert beslutningsgrunnlaget er, jo større vekt bør foreldres verdier og oppfatninger til legges.»8 Dette taler for at foreldre bør få delta i et samvalg der det foreligger gråsoner. Imidlertid vil de færreste foreldre ha en gjennomtenkt mening i sekundet de skal bli foreldre til et ekstremt prematurt barn. Er det mulig å artikulere frem verdier når man står midt i en krise?
Samvalg i nyfødtmedisin – hvordan?
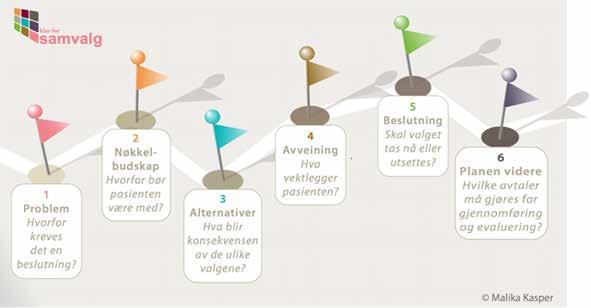
For å fremme samvalg, er det utarbeidet en strukturert metode bestående av seks steg, hvor både rekkefølge,
informasjonsdeling og kommunikasjon er avgjørende (Fig. 1).5 På helsenorge.no finner man kvalitetssikrede samvalgs verktøy for flere problemstillinger og diagnoser.9
Dette kan kanskje fungere i en poliklinisk konsultasjon, men hvordan er situasjonen ved truende fødsel på levedyktighetsgrensa? Sykepleier Katie Gallagher har forsket på foreldreperspektivet, og sett at måten vi kommuniserer og interagerer med forel dre kan påvirke deres evne til å takle en traumatisk livssituasjon. Foreldre ønsker klar og ærlig informasjon, samt å bli myndiggjort for å kunne foreta informerte valg på vegne av barnet sitt, også ved begrensning av livsforlengende behandling. Studien viste at det å legge frem ulike alternativ ga bedre kommu nikasjonsmessig resultat enn å komme med en entydig anbefaling basert på behandlingsteamets beslutning og begrunnet med «barnets beste».10
Nyfødtlege og etiker Dominic Wilkinson har vært sentral i utarbeidelse av retningslinjer for samvalg ved ekstrem prematur fødsel både i Storbritannia, Australia og Filip pinene. Han ba oss starte med å lytte: hva er foreldrenes forventninger, hva håper de på, og hva frykter de mest? Gjennom å presentere ulike alternativ innenfor det vi anser som forsvarlig, stille åpne spørsmål heller enn å pøse ut med statistikk, gi skriftlig informasjon og tilby flere samtaler kan vi bygge tillit og rede grunnen for samvalg.
Fig 2: Eksempler på «Decision aid-cards» fra Decision aid for anticipated extremely premature infants, Ottawa (gjengitt med tillatelse fra GE Moore) 10
sesjonen «Foreldrestemmer», der etiker Lars Ursin spilte utdrag fra intervjuer med foreldre til tre barn født ekstremt prematurt. Felles var behovet for åpen og ærlig informasjon, nærhet til barnet og involvering, samt et ønske om å bli møtt der de var i en krisesituasjon. Det er ikke bare behov for medisinske fakta, men også for etisk situasjonsavklaring. Hva er det lov å tenke, hva har andre foreldre tenkt i denne situasjonen, hva kan være gode og tillatelige valg? Ønsket grad av medvirkning i samvalg varierte fra å eie beslutningen, delta i felles beslutning og til ønsket om at legene skulle bestemme. Takk til foreldrene som delte tanker, tro og tvil så åpent!
Hvor går veien videre?
Den avsluttende paneldiskusjonen ledet av Ragnhild Støen og Berge Solberg fokuserte på fremtidens utfordringer. Deltakere var Beate Eriksen (Ålesund), Hans Jørgen Stensvold (Oslo), Claus Klingenberg (Tromsø) og Trond Marke stad (Bergen). Å gå sammen om å lage felles, nasjonalt informasjonsmateriale syntes være et godt sted å starte, og samvalgsverktøy kan gi nyttige innspill.5 Internasjonalt leder Canada an, og på hjemmesiden til The Ottawa Hospital Research Institute er det lenker til et tresifret antall samvalgsverktøy, deriblant «Decision aid for anticipated extremely premature infants» som inneholder både retnings linje, foreldreinformasjon og mange illustrasjoner som skal bidra til å sikre god kommunikasjon (Fig. 2). 11,12 Her ligger mye kunnskap og inspirasjon, både til innhold og metode.
Det å sette foreldre i stand til å delta i valg i gråsonen begynner med å erkjenne ubalansen i makt, kunnskap og erfaring. Vi bør ha innsikt i egne holdninger og motivasjon. Noen av oss er preget av stor behandlingsiver og prestisje, mens noen kan være i overkant pessimistiske. Foreldre trenger ulike typer informasjon. Dette fremkom tydelig i
Takk til alle som tok turen til Nidelven og bidro til gode diskusjoner, både faglig og sosialt. Vi ser fram til mer nasjonalt samarbeid!
Referanser: Se www.paidos.no
Det å sette foreldre i stand til å delta i valg i gråsonen begynner med å erkjenne ubalansen i makt, kunnskap og erfaring
Gaucher er en sjelden hematologisk sykdom som kan debutere med symptomer i tidlig barnealder. Vanlige symptomer som hepatosplenomegali, cytopeni, forsinket vekst og bensykdom, gjør at Gaucher kan være vanskelig å diagnostisere. Gaucher verifiseres med enzymanalyse og gentest. sanofi-aventis Norge AS Prof. Kohtsvei 5-17 P.O.Box 133, 1366

Di Rocco M., Andria G, Deodoto F et al. Early Diagnosis of Gaucher Disease in Pediatric Patients: Proposal for a Diagnostic Algorithm Pediatr Blood Cancer 2014;61: 1905–1909


Årlig fødes det på verdensbasis rundt 600 000 barn før uke 28 (1), definert som ekstremt premature barn. (2). I 2020 var 0.3 % av alle norske fødsler ekstremt premature (3). Disse barna har betydelig risiko for komplikasjoner som kan føre til død eller senskader (4). Risikoen øker ved lavere gestasjons alder, men påvirkes også av faktorer som kjønn, intrauterin tilvekst og perinatale infeksjoner (5;6)
Dagens behandlingsmuligheter aktualiserer en rekke etiske problemstillinger. Kanskje viktigst er hvilke barn som skal tilbys intensivbehandling og når en slik behandling eventuelt bør trekkes tilbake. Uten intensivbehandling vil de aller fleste ekstremt premature barn dø, men om alle de minste tilbys intensivbehandling vil det kunne gi overlevende med alvorlige senskader og lidelse.

I denne artikkelen presentere vi svar fra en spørre undersøkelse til nyfødtleger i 16 europeiske land om etiske valg ved behandling av premature barn født før uke 26. For å belyse etiske problemstillinger diskuteres svarene med utgangspunkt i de fire helseetiske grunnprinsippene; å gjøre godt, å respektere prinsippet om selvbestemmelse, å ikke skade og å være rettferdig (7).
Vi utarbeidet en nettbasert spørreundersøkelse (Survey Moneky) på engelsk med spørsmål om blant annet nedre grense for resuscitering av ekstremt premature, kriterier for behandlingsvalg og ansvarsfordeling mellom foreldre og leger ved behandlingsvalg rundt barn født før 26. svangerskapsuke. Undersøkelsen ble distribuert av siste forfatter våren 2022 via epost til erfarne nyfødtleger i 19 ulike europeiske land.
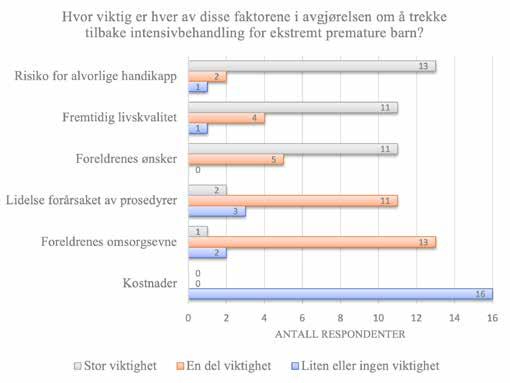
Vi fikk svar fra 16/19 (84%) land (tabell 1). Ni av responden tene var kvinner, og 13 av 16 hadde over 10 års erfaring med nyfødtmedisin. Den anbefalte nedre grense for resuscitering av EPB i ulike land varierte fra uke 22 til uke 24 (tabell 1). De tre viktigste faktorene ved vurderinger om å frastå fra å starte intensivbehandling var foreldrenes ønsker, gestasjons alder og risiko for alvorlig senskade, mens kostnader, kjønn og flerlinger var de minst viktige faktorer (Figur 2).
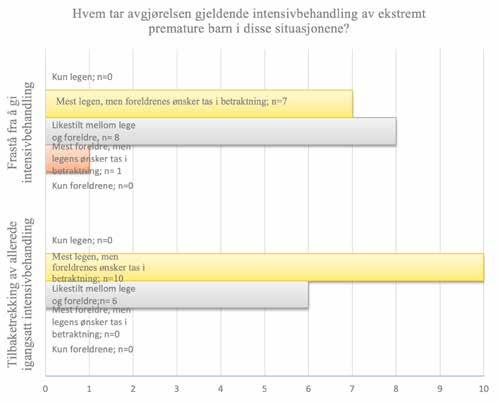
De viktigste faktorene ved vurderinger om å trekke tilbake intensivbehandling var risiko for alvorlige senskade, etter fulgt av fremtidig livskvalitet og foreldrenes ønsker, mens kostnader var den minst viktige faktoren (Figur 3). Ifølge alle respondentene ble både det å frastå fra og tilbaketrekking av intensivbehandling tatt i samråd mellom lege og foreldre,
men der legens innflytelse var større enn foreldrenes, spesielt ved avgjørelser om tilbaketrekking av behandling (Figur 4).
Utvalget i spørreundersøkelsen er relativt lite og vi har kun fra svar fra en nyfødtlege i hvert land. Imidlertid var respondentene leger med stor erfaring. Vi antar at praksis for nedre behandlingsgrense er representativt. De øvrige resultatene oppfattes mer subjektive, og vi vet ikke om de er representative for hvert land. Samlet skiller ikke resultatene seg vesentlig fra tidligere litteratur når det gjelder anbefalt nedre grense for resuscitering (8;9) og faktorer av betydning ved behandlingsvalg av ekstremt premature barn (10;11). Undersøkelsen danner derfor et godt utgangspunkt for å drøfte etiske problemstillinger rundt behandling av ekstremt premature barn.
Å respektere selvbestemmelse Pasientens selvbestemmelse ligger til grunn for tilnærmet all helsehjelp. Ekstremt premature kan ikke utøve selv bestemmelse. Det er omdiskutert hvilken rolle foreldre skal ha i behandlingsvalget (12) og ulike europeiske land har for skjellige tilnærminger til dette (9). I undersøkelsen fremkom det at foreldrenes ønsker tillegges stor vekt ved behandlings avgjørelser, men at hovedvekten av ansvaret fortsatt ligger hos legen. Det ansees som riktig at foreldre er involvert i behandlingsavgjørelser om sitt eget barn. Imidlertid oppstår noen utfordringer ved dette prinsippet. Selvbestemmelse forutsetter både forståelse av alternativene i en gitt situasjon, samt kapasiteten til å ta et valg. Begge deler kan være utfor drende å oppnå. Nyfødtmedisin er et komplisert fagfelt hvor det ofte råder stor usikkerhet om prognoser. Dette kan være til hinder for en god forståelse av alternativene. I tillegg har foreldrene til ekstremt premature ofte lite tid til å ta stilling til avgjørelser og mange beskriver situasjonen som et emosjonelt kaos (13). En kan derfor stille spørsmål ved grunnlaget for foreldrenes grunnlag for selvbestemmelse. Skal foreldre utøve selvbestemmelse på grunnlag av hva de anser er best for seg selv, hva de anser er best for barnet eller begge deler? Hva som vektlegges mest kan føre til ulike utfall. Å ikke skade
Prinsippet om å ikke skade innebærer at helsepersonell skal unngå å påføre pasienter skade eller lidelse. Intensivbehand ling av ekstremt premature innebærer smertefulle prosedyrer og påkjenninger for barnet. Majoriteten av respondentene tillegger dette kriteriet «en del viktighet». Smertefulle pro sedyrer kan være etiske vanskeligere å rettferdiggjøre siden pasientene ikke kan samtykke, og nytten av prosedyrene kan være vanskelig å bedømme. Likevel er det vanskelig å se for
Uke Antall Land Uke 22 6 Sverige, Finland, England, Skottland, Tsjekkia, Italia Uke 23 7 Norge, Danmark, Island, Tyskland, Sveits, Østerrike, Irland Uke 24 3 Slovakia, Belgia, Nederland
Figur 2. Vektlegging av faktorer når en AVSTÅR fra å starte intensiv behandling.

Figur 3. Vektlegging av faktorer ved tilbaketrekking av intensivbehandling
seg at prosedyrene ikke er rettferdiggjort om det fører til et godt liv for pasienten. Respondentene legger derimot langt større vekt på faktorene «risiko for alvorlig senskade» og «fremtidig livskvalitet». Siden det ikke er helsepersonellet selv som forårsaker skaden direkte inngår ikke dette i den tradisjonelle forståelsen av prinsippet om å ikke skade. Likevel kan nyfødtmedisinere føle på et ansvar for «ha skapt» et liv med mye lidelse, dersom en ekstremt prematur over lever med store senskader (14).
Å gjøre godt Gjøre-godt prinsippet ligger til grunn for all helsehjelp. Nyfødtmedisinere ønsker åpenbart å forhindre sykdom, lidelse og død. Men hva skjer når sykdom og lidelse ikke kan forhindres, og død er alternativet? Det kan være utfordrende å definere hva det vil si «å gjøre godt» i slike situasjoner. Kan det i noen tilfeller være «bedre» å dø, enn å leve med stor lidelse? Hva er egentlig god nok livskvalitet? Det er svært vanskelige faglige og etiske spørsmål som ikke bare er relevant innen nyfødtmedisin, men også i mange andre områder av den moderne medisinen. Nyfødtmedisinere må i hvert enkelt tilfelle vurdere muligheten for overlevelse opp mot risiko for senskade og lidelse. Samtidig innebærer intensivbehandling i seg selv lidelse, og forløpet er en stor påkjenning for hele familien. Avveiningen er på ingen måte enkel.
Rettferdighetsprinsippet innebærer blant annet like behandling av pasienter som individer og av pasientgrupper
Figur 4. Leger og foreldres rolle i ulike behandlingsavgjørelser.
som en helhet. Det kan stilles spørsmål ved ivaretakelsen av rettferdighetsprinsippet for ekstremt premature barn. Respondentene tillegger foreldrenes ønsker stor vekt. Majoriteten tillegger også foreldrenes omsorgsevne en del vekt. Det kan bety at to ekstremt premature med identiske prognostiske faktorer behandles ulikt på grunn av eksterne faktorer, i dette tilfellet foreldrene. Rent pragmatisk virker det naturlig at det må være slik, men er det rettferdig? I praksis er det nok slik at foreldreautonomien er sterkest når det er mest uklarhet om hva som er rett valg, men en bør være klar over at en sterk foreldreautonomi kan komme i konflikt med rettferdighetsprinsippet. Det kan også stilles spørsmål ved om ekstremt premature som gruppe likebehandles med andre pasientgrupper. Respondentene legger stor vekt på risiko for senskade og fremtidig livskvalitet ved behandlings avgjørelser. Gjøres slike vurderinger i like stor grad når en behandler andre pasienter, hvor overlevelse også kan medføre store senskade og lidelse? Hvis ikke må en begrunne hvorfor det er rett å forskjellsbehandle ekstremt premature.
Behandling av ekstremt premature medfører en rekke etiske problemstillinger. Nyfødtleger vil ofte måtte begrunne vanskelige behandlingsvalg og avgjørelser. En høy grad av bevissthet og kunnskap om helseetiske grunnprinsippene er nødvendig i arbeidet med de mest umodne for tidlige fødte barna.
Referanser: Se paidos.no!
Å bli født prematurt innebærer at finjustert vekst og utvikling som normalt foregår i tett samspill med mor i et skjermet og kontrollert intrauterint miljø i stedet må skje i en neonatal intensivavdeling. Dette har konsekvenser umiddelbart og på lang sikt.

En prematur fødsel er definert av WHO som før fullgåtte 37 av 40 svangerskapsuker. Rundt 15 millioner barn, ca. 12%, fødes prematurt hvert år, med store variasjoner mellom ulike land. Prematur fødsel er viktigste årsak til neonatal dødelighet, og frem til 5 års alder nest viktigste dødsårsak for barn.(1)
De siste tiårene har det vært en rivende utvikling i omsorgen for premature nyfødte. Dette har gitt betydelig øket over levelse, spesielt for de minste og mest umodne premature barna født på grensen til levedyktighet. I dag overlever mer enn 80% av barn født ekstremt prematurt, gitt tilgang til optimal medisinsk behandling. Flere behandlingsmuligheter har imidlertid både positive og negative sider. Økt overlevelse blant de mest umodne premature har kanskje også åpnet for et større panorama av skader på kort og lang sikt, og at flere barn overlever til et liv med langvarige helseutfordringer.(2)
Intrauterine livsbetingelser og tidlig barndom er viktig for senere helse. Konseptet betegnes Developmental Origins of Health and Disease, DOHaD. For et foster som befinner seg i andre trimester av svangerskapet kan ugunstige intrauterine forhold spille en stor rolle for utviklingen, og videre påvirke epigenetiske forhold. En ekstremt prematur fødsel represen terer et enormt miljøskifte. Både tidlig adaptasjon til livet ekstrauterint og intensiv behandling med alt det medfører av inflammasjon, infeksjon, hyperoksi og medikamenter kan ha direkte og indirekte helsemessige konsekvenser. Graviditet, fødsel og tidlig barndom er viktig når man skal kartlegge sykdom i livet, uansett alder.
Langtidsstudier av premature For øyeblikket følger vi i Prosjekt Ekstrem Prematuritet (www.helse-bergen.no/pep), en del av WestPaed Research
(www.westpaed.com), fire ulike kohorter av barn født ekstremt prematurt parallelt med terminfødte kontroller. De ble født i periodene 1982-85, 1991-92, 1999-2000 (PEP) og 2010-2018. Premature født på 1980-tallet ble født før tilgang til moderne nyfødtmedisinsk behandling, men noen få fikk antenatale kortikosteroider. Premature født på 1990-tallet hadde tilgang til antenatale steroider og surfaktant, bedre respiratortek nologi og overvåkingsmuligheter. Senere har det vært en kontinuerlig raffinering av nyfødtmedisinen, mer fokus på skånsom håndtering av luftveier, finjustert væskebehandling og tidlig ernæring, forebygging av infeksjoner, mer kropps kontakt og reduksjon av lys, lyd og smerte.
Hva har vi funnet?
Blant barn født i svangerskapsuke 23-25 hadde 17 % alvorlig, 15 % moderat og 43 % lett funksjonsnedsettelse. Tilsvarende tall ved uke 26-27 var henholdsvis 1 %, 7 % og 39 %, mens over halvparten hadde ingen funksjonsnedsettelse. Premature med lette funksjonsnedsettelser hadde doblet risiko for å skåre svakere på Strengths- and Difficulties Questionnaire (mental helse) ved 5 år, mens risikoen var 8 ganger høyere for dem med moderate og alvorlige funksjonsnedsettelser.(3, 4)
Psykisk helse, søvn og livskvalitet Rundt en tredjedel av de premature barna har psykiske helseutfordringer, omtrent 2 til 8 ganger høyere risiko. Hovedutfordringene er oppmerksomhetsvansker og vansker med sosial samhandling. Barna hadde overhyppighet av emosjonelle vansker, tvangstanker, tvangshandlinger og hyperaktivitet. Forekomsten av problemer minsker fra 5 til 11 år. Disponerende faktorer er lavere IQ og hørselsproble matikk (5). Premature barn hadde også høyere forekomst av autismespektersymptomer ved 11-årsalder. (6). Premature hadde økt forekomst av selvrapporterte mentale problemer som unge voksne. Andelen økte fra 18 til 25 års alder. Selvrapportert helserelatert livskvalitet er relativt lik som hos terminfødte, med unntak av det som angår fysisk funksjon. Ved 34 års alder rapporterer de premature lavere livskvalitet, spesielt for mental helse.(7)
Foreldre til premature rapporterte flere søvnvansker gjennom hele barnealderen. Mors røyking under svangerskapet, vekstretardasjon og hjerneblødning hos barnet var de viktigste assosierte faktorene. Premature barn med søvn problemer hadde høyere forekomst av atferdsvansker og respirasjonssymptomer (8).
Neonatale smerteopplevelser har vært assosiert med endret prosessering og persepsjon av smerte senere i livet. Vi fant at de premature hadde redusert smertetoleranse. Overraskende nok hadde de premature som var utsatt for flest smertefulle prosedyrer og det mest alvorlig nyfødtforløpet en smertere spons mest lik kontrollgruppen.(9)
Flere premature hadde påvisbare forandringer i hjernen ved funksjonell MR, i tillegg til andre funn ved oppgaveløsing. Hjerneaktiviteten hadde sammenheng med hvor godt de løste oppgavene, men ikke med skoleprestasjoner på nasjonale
prøver i 5. klasse. Skoleprestasjonene skilte seg ikke fra kontrollbarna (10).
Premature barn hadde doblet risiko for innleggelse i sykehus frem til 11 år, uavhengig av bronkopulmonal dysplasi eller lav gestasjonsalder. De rapporterte flere respirasjonssymptomer (11). Premature hadde rundt 10% lavere peak VO2, og forskjellene persisterte over tid, uavhengig av lungefunksjon og neonatale variabler. Peak VO2 var assosiert med fysisk aktivitetsnivå ved 18 år, men ikke ved 10 år, dette gir grunnlag for optimisme med tanke på effekt av fysisk trening hos premature. (12)
Premature hadde lavere lungefunksjon enn terminfødte hele veien fra barn til voksen. Forskjellene i lungefunksjon ser ut til å være mindre hos den yngste kohorten, hvilket kanskje kan tyde på at bedre nyfødtbehandling gir bedre lungefunksjon? Lungefunksjonen var mest nedsatt hos de vekstretarderte premature, uavhengig av gestasjonsalder. Lav lungefunksjon ved inngangen til voksenlivet gir økt risiko for bla. senere KOLS.(13, 14)
Unge voksne premature har en lavere flow-mediert dilatasjon av endotelet i brakialarterien målt ved ultralydundersøkelse etter avklemming med blodtrykksmansjett og administrasjon av nitroglycerin. Funnet indikerer øket kardiovaskulær risiko. (15)
De premature som fikk kirurgisk lukket PDA som nyfødte, rapporterte flere vansker med stemmen (heshet) og pusten under anstrengelse, og hadde høyere forekomst av stemme båndsparese ved 19 år, igjen assosiert med endringer i stemmekvalitet og luftveissymptomer ved fysisk aktivitet. Lukning av PDA var også assosiert med dårligere lunge funksjon (16).
Fysisk aktivitet og kroppssammensetning De premature barna var mindre fysisk aktive og hadde noe lavere beintetthet, samt mindre gunstig kroppssammen setning med mindre muskelmasse og mer fett. Nedsatt koordinasjonsevne, lavere mental score og atferdsvansker ved 5 år predikerte lavere fysisk utholdenhet ved 11 år (17, 18).
Prematur fødsel forstyrrer viktige prosesser for vekst og utvikling i mange organsystemer. Dette gir sykelighet umiddelbart etter fødsel, men også på lang sikt. Forløpet er heterogent, der lunge, luftveier og nevromotoriske funksjoner kanskje er mest synlig, men også søvn, mental helse og opplevd livskvalitet påvirkes. Kunnskap om dette er viktig i møte med de premature, både som barn og senere som voksne, for å kunne tilby kunnskap og hensiktsmessig behandling. Perinatal historikk og tidlig barndom er viktig ved evaluering av symptomer fra mange organsystemer også senere i livet. Konsekvenser av prematur fødsel gjennom et livsløp gjenstår å forstå.
Referanser: Se paidos.no!
nr. 40 (3) 2022 145
Etter at vi har hatt noen slike hendelser på vår føde-/ barselavdeling, er den skriftlige instruksen til foreldrene endret, slik at de gjøres oppmerksomme på problemstillingen.

Mange barneleger har opplevd alvorlige livløshetsanfall eller dødsfall hos nyfødte på barselavdelingen. Sudden unexpected postnatal collapse (SUPC) er heldigvis en sjelden hendelse, som kan forebygges med rette tiltak.
SUPC rammer tilsynelatende friske barn (Apgar >7) nær termin (> 35uker), som får et alvorlig anfall med respirasjons svikt og bradycardi de første timene eller dagene av livet. Ulike definisjoner forekommer, vanligst defineres SUPC som livløshetsanfall den første leveuken. Omtrent 1/3 skjer innen de første 2 levetimer, 1/3 fra time 2-24 og 1/3 dag 2-7.
I Sverige hadde man et cluster med SUPC-tilfeller, som resulterte i gjennomgang av litteraturen. En retrospektiv gjennomgang fra Stockholms-sykehusene publisert i 2013 estimerte forekomsten til cirka 38/100.000. Andre studier har rapportert forekomsten på ulike måter, så tallene har variert mellom 3-133/100 000.
SUPC kan ha sammenheng med at nyfødte barn ikke er helt kompetente til å holde frie luftveier det første døgnet. Derfor må man være spesielt oppmerksom på hvordan barnet ligger, og unngå kjente risikofaktorer. Barnet skal ikke sove i samme seng som foreldrene, og man skal unngå situasjoner hvor man ikke har oversikt over barnets posisjon. Dette er ikke nødvendigvis helt i overensstemmelse med oppfordringen om å være tett inntil barnet hele tiden, og foreldrene må informeres om at barnet er spesielt sårbart det første døgnet. Man har funnet at risikofaktorer er hud-mot-hudkontakt uten tilsyn, utslitt mor, at mor sovner med barnet ved brystet eller at hun distraheres av mobiltelefon.
Etter at vi har hatt noen slike hendelser på vår føde-/ barsel avdeling, er den skriftlige instruksen til foreldrene endret, slik at de gjøres oppmerksomme på problemstillingen. Pålitelige kilder (kolleger som nylig har født) rapporterer at budskapet ikke har blitt kommunisert tydelig nok av barnepleierne og jordmødrene på barsel.
God informasjon og rasjonelle rutiner SUPC kan antakelig unngås, med nødvendige tiltak. I enkelte land har man foreslått overvåkning med oksygenmetnings måler de første timene. Dette er veldig langt fra tradisjonen her i Norge. Pilotstudier fra USA og Australia har vist at metningsmålere er akseptabelt, og ikke oppfattes som et hinder for tilknytningen mellom mor og barn. Sjekklister for overvåkning av barnets puls, farge respirasjon og temperatur har ikke alltid vært lett å gjennomføre, det krever både mye pleieressurser og at man må forstyrre barnet ofte. Enkelte steder har forekomsten av SUPC-relaterte dødsfall falt ned til null etter intervensjon, noe som nok til dels skyldes at tiltakene økte oppmerksomheten.
Uansett er vi som barneleger nødt til å kjenne til fenomenet, og samarbeide med barselavdelingen for å opprettholde god informasjon og rasjonelle rutiner.
Referanser: Se paidos.no!

Prematuritetsretinopati (ROP) er blant de potensielt mest alvorlige komplikasjonene hos for tidlig fødte barn. Screening for ROP er av de mest kostnadseffektive tiltakene i medisinen. Nå gir nye behandlingsmetoder nye muligheter. Vi gjør her opp en kunnskapsstatus på de ulike behandlingsmetodene.
Tekst: Olav H. Haugen, Haukeland Universitetssjukehus, Terje Christoffersen, Universitetssykehuset Nord-Norge, David Hugo Engelsvold, Stavanger Universitetssykehus Erlend Christoffer Sommer Landsend, Oslo Universitetssykehus Ullevål, Dordi Austeng, St. Olavs hospital.
Ubehandlet kan ROP føre til total blindhet, og de minste premature har størst risiko. Globalt gir ROP alvorlig synshemning eller blindhet hos 30 000-40 000 barn årlig (1). I Norge undersøkes øyebunnen på alle premature født før uke 32 rutinemessig (2). ROP har en bifasisk utvikling; en vasokonstriksjonsfase og en påfølgende vasoproliferativ fase. I vasokonstriksjonsfasen skjer en nedregulering av vekstfak toren VEGF (vascular endothelial growth factor) på grunn av økt oksygennivå i blodet ved overgangen fra intrauterint til ekstrauterint miljø. Etter hvert som barnet vokser, øker meng den retinavev, og oksygentilbudet blir derfor utilstrekkelig. Ischemi i retinavevet fører til at VEGF reguleres opp igjen, og dermed dannes patologiske blodkar i overgangen mellom den vaskulære og avaskulære retina. Disse kan proliferere videre inn i glasslegemet og i verste fall føre til total netthinne løsning og blindhet.
Behandlingsmuligheter før og nå Laserfotokoagulasjon av retina har vært standard behand ling for ROP siden tidlig på 1990-tallet (3). Behandlingen destruerer det avaskulære retinavevet og reduserer dermed oksygenbehovet og ischemi. Laserbehandling er effektivt, men har også noen ulemper. Behandlingen krever narkose, laserapparat og en erfaren øyelege. I mange land er det begrenset tilgang til disse ressursene. Ved sentralt beliggende ROP må mye retinalvev destrueres, og det er risiko for at arrvevet trekker på sentrale deler av retina. Behandlingen disponerer også for sterk nærsynthet (4).
Det siste tiåret har antistoffbehandling med anti-VEGF vært en alternativ behandlingsmulighet ved ROP (5). Antistoffet injiseres i øyets glasslegeme. Den første publiserte studien viste at antistoffinjeksjon ga mindre behov for rebehandling
ved sentral ROP (sone 1, se figur 1), men ikke ved perifer ROP (6). Senere randomiserte studier har vist at anti-VEGF reverserer ROP-forandringene (figur 2), men samtidig gir det økt forekomst av residiv og større behov for rebehandling.
En trygg behandling Injeksjoner er mer invasivt og har høyere potensiale for kom plikasjoner enn laserbehandling. Infeksjon (endoftalmitt) er den mest fryktede. I tillegg kan det oppstå blødning i glass legemet og direkte skade av linsen. Imidlertid viser studier svært lav forekomst av prosedyrerelaterte komplikasjoner, godt under 1% (7-12). I flere land gjøres prosedyren mens barnet er våkent. I Norge er det vanlig at den gjøres under sedasjon eller i generell anestesi.
Behandlingseffekter og bivirkninger Det finnes foreløpig få studier av forskjell i visus mellom barn behandlet med laser og anti-VEGF. Det er vist mindre myopi utvikling ved injeksjonsbehandling enn ved laserbehandling (5), og to studier fant ingen forskjell i beste korrigerte visus målt ved fem års alder (13-14). Anti-VEGF-behandling synes også å gi mer normal foveautvikling sammenliknet med laser (15).
VEGF er en sentral vekstfaktor i angiogenesen. Helt fra den første randomiserte studien om anti-VEGF-behandling av ROP (6) har man vært bekymret for systemiske seneffekter. Bevacizumab (Avastin®), som globalt er det mest brukte anti-VEGF-medikamentet ved ROP, går over i blodsirkulasjo nen og gir redusert serumnivå av VEGF i opptil to måneder etter injeksjon i øyet (16). Bekymringen for systemiske effekter har vært særlig stor fordi anti-VEGF-medikamenter ble tatt i bruk på premature barn uten de vanlige faser av legemiddelutprøving. I ettertid er det kommet studier som
Figur 1. Sone 1 tilsvarer området omkring papillen, innenfor den lyse sirkelen (radius = 2x avstand papille-fovea centralis). Sone 2 er resten av den gule sirkelen (utenfor sone 1), mens sone 3 er det gjenværende sigdformede oransje området.
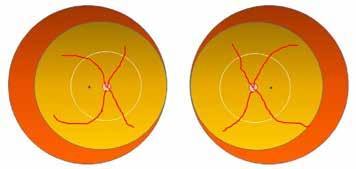
Laserbehandling
Figur 2A. Alvorlig prematuritetsretinopati. Barnet var født ekstremt for tidlig og retinopatien utviklet seg raskt fra den ene uken til den neste. De tynne pilene markerer grenselinjen mellom vaskularisert og ikke-vaskularisert retina oppad temporalt. De sentrale karene er uttalt dilaterte og slyngede som tegn på iskemi.

Figur 2B. Tre uker etter behandling med anti-VEGF i øyet; ingen synlig grenselinje, ingen karproliferasjoner, normalisering av retinalkarene. Barnets foresatte har samtykket til publisering av bildene. Foto: Dordi Austeng.
Effektivt
Liten risiko for residiv («one and done») Liten komplikasjonsrisiko ved selve behandlingsprosedyren
Ingen systemiske seneffekter
Anti-VEGF injeksjon
Effektivt
Kortvarig behandling
Kan utføres bedside (men helst i sedasjon eller narkose)
Tabell 1. Laserbehandling vs anti-VEGF injeksjon ved ROP – fordeler og ulemper.
har gitt mer kunnskap om sikkerhet og optimal dosering, men ennå er mye ukjent. Ut fra disse studiene ser det ikke ut til at behandlingen med anti-VEGF i nyfødtperioden har resultert i veksthemning eller alvorlige nevroutviklings forstyrrelser (17-18). Ranibizumab (Lucentis®) gir ikke reduksjon av VEGF i blodsirkulasjonen etter injeksjon i øyet (12,19), og dette er en viktig årsak til at barneoftalmologer i de nordiske land har valgt å bruke dette medikamentet (2,20). Man må imidlertid understreke at kunnskapsgrunnlaget ennå er begrenset, også for ranibizumab.
Introduksjonen av anti-VEGF-medikamenter har åpnet nye muligheter for behandling av ROP. Samtidig mangler man fortsatt kunnskap, spesielt om systemiske langtids effekter. Laserfotokoagulasjon ansees fortsatt som standardbehandling ved ROP. Injeksjon av anti-VEGF er indisert når ROP-forandringene er lokalisert i den mest sentrale del av retina (sone 1) og det foreligger proliferativ retinopati (stadium 3) og/eller tegn til ischemi. Både laserbehandling og anti-VEGFinjeksjon har fordeler og ulemper som må veies opp mot hverandre (Tabell 1). Fremtidig forskning vil forhåpentligvis gi bedre grunnlag for rett behandling av ROP.
Referanser: Se www.paidos.no
Langvarig behandling Teknisk krevende Krever generell anestesi Krever laserinstrument Destruerer retinavev, obs affeksjon av perifert synsfelt (særlig ved sone 1 retinopati)
Kan gi uheldige effekter på makula Økt risiko for myopiutvikling
Høyere risiko for residiv og rebehandling – behov for lengre oppfølging
Usikkerhet vis a vis risiko for seneffekter av anti-VEGF lokalt i retina NB systemisk
Norge er et langstrakt land. Tross bedre prenatal omsorg vil syke nyfødte bli født hjemme, på fødestuer, fødeavdelinger uten barneavdeling, eller ved lokal barneavdeling med behov for overflytting til en mer høyspesialisert nyfødtavdeling. For at barnet skal få best og raskest mulig behandling vil kommunikasjonen mellom lokal avdeling, transportteam og mottagende avdeling være avgjørende.
Tekst: Ingrid Nissen, St.Olavs hospital
Overflytting av syke nyfødte er ofte utfordrende og tidkrevende, spesielt for lokalavdelingen. Det vil være behov for akutt medisinsk behandling og konferering med annen avdeling med høyere kompetanse samtidig som man må planlegge overflytting og transport. I slike situasjoner er informasjonsformidling til ulike aktører ofte tidkrevende - tid man ikke har når man behandler en kritisk syk pasient.

I Trøndelag har vi siden 2017 brukt systematisk kommunikasjons verktøy og telefonkonferanse via AMK med lokalavdeling, luftambulanselege og bakvakt nyfødt.
Vi har regelmessig simuleringstrening rundt denne problem stillingen. Lokalavdeling har hatt egen simuleringstrening med akutt sykt nyfødt barn, for eksempel med alvorlig asfyksi. Bakvakt nyfødt St Olav kontaktes i telefonkonferanse sammen med luftambulanselege via AMK. Luftambulanselegen leder kommunikasjonen og bruker ISBAR som kommunikasjonsverktøy. Samtalen avsluttes med behandlingsråd til lokalavdelingen og avklaring om hvordan, hvem og når transporten kan effektueres. Debriefing for treningen er todelt, både lokalt for behandlings teamet, men også som egen debriefing av telefonkonferansen med alle involverte. Debriefing av telefonkonferansen foregår ved at alle involverte; lokal-, mottageravdeling, AMK og transportteam lytter til lydloggopptak fra AMK.
Evaluering av simuleringstreningene og regelmessig gjennomgang av reelle lydlogger har utvilsomt ført til en mer strukturert og effek tivisert kommunikasjon, bedre situasjonsforståelse og arbeidsflyt mellom alle involverte. Dette gir bedre pasientbehandling, fra lokalavdelingen til mottak ved St Olav hospital.
På bakgrunn fra denne erfaringen er det skrevet et kapittel i nyfødtveilederen som kanskje kan bidra til mer presis og effektiv kommunikasjon ved kritisk syke nyfødte som trenger overflytting.
Hvorfor ringer du? Hvorfor skal barnet overflyttes?
GA, spesielle forhold i svangerskapet Fødselstidspunkt
Fødselsmåte: vaginal/sectio Fødselsvekt, lengde og hodeomkrets Apgar Navlestrengsblodgass Mors fødselsnummer
AB – saturasjon, RF, ventilasjonsstøtte og settinger, oksygen, blodgass C – puls, kapillær fylningstid, blodtrykk D – nevrologi, sedasjon
E – temperatur, tilleggsundersøkelser f.eks. ekkokardiografiske funn/røntgenfunn avhengig av diagnose, medisiner
AB – tube, ventilasjonsstøtte, ev. innstillinger C – total væskemengde D – sedasjon
E – Kontinuerlig temperaturkontroll Premature vs. asfyksi
Tilleggsundersøkelser – rtg, ekko cor Innganger (CVK, NVK, NAK, PVK, PAK, sonde)
Medikamenter Antibiotika? Prostivas? Sedasjon?
Mottaker oppsummerer råd og tiltak gitt til avsender «Closed loop»: avsender gjentar råd og tiltak

Epidyolex is indicated for use as adjunctive therapy of seizures associated with Lennox-Gastaut syndrome (LGS) or Dravet syndrome (DS), in conjunction with clobazam, for patients 2 years of age and older.

Epidyolex is indicated for use as adjunctive therapy of seizures associated with tuberous sclerosis complex (TSC) for patients 2 years of age and older.1 *Including LGS drop seizures, DS convulsive seizures and TSC-associated seizures (focal and generalised) in children from 2 years, adolescents and adults.1 1. Epidyolex Summary of Product Characteristics, date approved 06/2021, section 4.1, 5.1, 9. Date of preparation: March 2022. VV-MED-27421.
Epidyolex «GW Pharma»
Diverse antiepileptika. ATC-nr.: N03 X24 (Cannabidiol)
MIKSTUR styrke: 100 mg/ml.: 1 ml inneh.: Cannabidiol 100 mg.
Indikasjoner: Brukes som tilleggsbehandling, sammen med klobazam, mot anfall forbundet med Lennox-Gastaut syndrom (LGS) eller Dravet syndrom (DS) hos pasienter ≥2 år. Tilleggsbehandling mot anfall forbundet med tuberøs sklerose-kompleks (TSC) hos pasienter ≥2 år.
Dosering: Behandling skal initieres og følges opp av lege med erfaring i behandling av epilepsi. Doseøkninger til mer enn 10 mg/kg/dag må gjøres basert på nytte og risiko og i samsvar med den fullstendige overvåkingsplanen. LGS og DS: Anbefalt startdose: 2,5 mg/kg to ganger daglig (5 mg/ kg/dag) i 1 uke. Vedlikeholdsdose: 5 mg/kg to ganger daglig (10 mg/kg/dag). Maksimaldose: 10 mg/kg to ganger daglig (20 mg/kg/dag). TSC: Anbefalt startdose: 2,5 mg/kg to ganger daglig (5 mg/kg/dag) i 1 uke. Vedlikeholdsdose: 5 mg/kg to ganger daglig (10 mg/kg/dag). Maksimaldose: 12,5 mg/kg to ganger daglig (25 mg/kg/dag).
Seponering: Dosen skal reduseres gradvis. 10% reduksjon per dag i 10 dager er undersøkt, men langsommere eller raskere nedtitrering kan være nødvendig. Glemt dose: Ved én eller flere glemte doser, skal disse ikke kompenseres for. Dosering gjenopptas ihht. behandlingsplan. Ved glemte doser i mer enn 7 dager skal det opptitreres til terapeutisk dose. Spesielle pasientgrupper: Nedsatt leverfunksjon: Forsiktighet utvises med moderat eller alvorlig nedsatt leverfunksjon (Child-Pugh B el. C) og lavere startdose, vedlikeholdsdose og maks. dose anbefales. Se SPC for doseringsanbefalinger. Nedsatt nyrefunksjon: Ingen erfaring ved terminal nyresykdom. Ikke kjent om cannabidiol kan fjernes ved dialyse. Barn: LGS og DS: Ikke relevant for barn <6 måneder. Sikkerhet og effekt hos barn ≥6 måneder til <2 år er ikke fastslått. TSC: Ikke relevant for barn <1 måned. Sikkerhet og effekt hos barn ≥1 måned til <2 år er ikke fastslått. Eldre: Ikke fastslått om personer >55 år har annen effekt enn yngre. Startdose bør være i nedre doseområde pga. høyere forekomst av nedsatt lever-, nyreeller hjertefunksjon og samtidig sykdom eller annen legemiddelbehandling. Annet: Behov for dosejusteringer av cannabidiol eller samtidig antiepileptika bør evalueres med tanke på interaksjoner. Administrering: Til oral bruk. Mat kan øke konsentrasjonen og dosene må derfor tas konsekvent enten med eller uten mat, med lik sammensetning, også under ketogen diett.
Kontraindikasjoner: Overfølsomhet overfor noen av innholdsstoffene. Transaminaser >3xULN og bilirubin > 2xULN.
Forsiktighetsregler: Hepatocellulær skade: Kan gi doserelatert økning av levertransaminaser, vanligvis i løpet av de første 2 mnd., men er sett opptil 18 mnd. etter behandlingsstart, særlig ved bruk av valproat. Klobazam kan også øke levertransaminaser. Dosejustering eller seponering av valproat eller dosejustering av klobazam skal vurderes. Økte transaminasenivåer på >3xULN sammen med bilirubin >2xULN uten alternativ forklaring, er en viktig prediktor på alvorlig leverskade og behandling må evalueres. Se SPC for informasjon om overvåkning av leverfunksjonen. Ved kliniske tegn eller symptomer på nedsatt leverfunksjon, skal serumtransaminaser og total bilirubin måles umiddelbart, og behandlingen avbrytes eller seponeres. Cannabidiol skal seponeres hos alle som får transaminaser >3xULN og bilirubin >2xULN, samt ved vedvarende forhøyning på >5xULN. Somnolens og sedasjon: Kan forekomme, vanligvis tidlig i behandlingen og kan forsvinne ved fortsatt behandling. Høyere forekomst ved samtidig bruk av klobazam. Kan potenseres av andre CNS-dempende midler, inkl. alkohol. Økt anfallsfrekvens: Kan forekomme, noe som kan kreve dosejustering av cannabidiol og/eller samtidig antiepileptika, eller seponering av cannabidiol ved negativt nytte/risikoforhold. Suicidal atferd og selvmordstanker: Er sett ved bruk av antiepileptika. Pasienter bør overvåkes for tegn på suicidal atferd og selvmordstanker, og hensiktsmessig behandling vurderes. Pasienter/ omsorgspersoner bør søke hjelp ved tegn på suicidal atferd og selvmordstanker. Vekttap: Kan forårsake vekttap eller redusert vektøkning, noe som kan gi redusert høydevekst. Sjekkes regelmessig. Inneholder etanol og benzylalkohol: Henholdsvis 79 mg/ml etanol og 0,0003 mg/ml benzylalkohol. Inneholder sesamolje: Kan i sjeldne tilfeller gi alvorlige allergiske reaksjoner.
Bivirkninger: Svært vanlige: Nedsatt appetitt, diaré, oppkast, fatigue, feber, somnolens. Vanlige: Kvalme, utslett, pneumoni, urinveisinfeksjon, økte leverenzymer, hoste, letargi, krampeanfall, aggresjon, irritabilitet, vekttap. Se felleskatalogtekst eller preparatomtale (SPC) for mer informasjon. Pakninger og priser: 100 ml: kr. 15544,90
Reseptgruppe: A Innehaver av markedsføringstillatelsen: GW Pharma (International) B.V. For mer informasjon, kontakt GW Pharma: info@gwpharm.com

Mangel på legemidler er et økende problem, og små markeder gir for liten inntjening til at industrien satser på våre særegne behov. Barn rammes spesielt. Et samlet nordisk legemiddelmarked vil kunne øke vår påvirkningskraft opp mot legemiddelindustrien.
Det er sjelden vi mangler legemidler når vi skal starte en behandling. Vi leger tenker ofte ikke over at det foregår et stort arbeid i kulissene for å sikre tilgangen. Dette arbeidet gjør legemiddelet tilgjengelig, men i noen tilfeller med pakninger fra Polen, Tsjekkia eller Hellas. Som oftest ser man hvilken styrke tabletten har, men hvis pakning og paknings vedlegg er på et fremmed språk blir det fort mer utfordrende å se om tabletten kan deles eller knuses. Informasjon om legemiddelet inneholder tilsetningsstoffer som vi ikke ønsker å gi til vår pasient blir også vanskelig å tolke. Mye av denne usikkerheten er vi som leger forskånet for, ofte takket være dyktige farmasøyter.
Samtidig har utviklingen vist at mangel på legemidler er økende og ofte mer langvarig enn før. Dette gjelder spesielt barneformuleringer, og i noen tilfeller velger industrien heller å avregistrere enn å holde produktet på markedet. For legemidler som tas inn på registreringsfritak er situasjo nen enda mer kritisk, siden industrien ikke er forpliktet til å varsle ved en mulig mangel. I slike tilfeller blir man ofte først klar over situasjonen når medisinhyllen er tom.
Nytt nordisk initiativ Det er derfor med glede vi nå ser at legemiddelmyndighetene i de nordiske landene har tatt initiativ til tettere samarbeid

for å sikre at flere legemidler blir tilgjengelig med offentlig godkjenning på det nordiske markedet. Oppmerksomheten er spesielt rettet mot formuleringer tilpasset barn. Regulatoriske myndigheter fra alle nordiske land var nylig samlet i Oslo for å diskutere mulighetene innenfor dagens regelverk. Klinikk og industri deltok på deler av møtet. Klinikkens største bekymring er de små gamle nisjeproduktene som er viktige for et lite utvalg av pasientene. Samtidig er det også bekymringsfullt at markedet for vanlig penicillin er svært lite og oftest begrenser seg til Norden. Industrien understreket at markeder med lite volum og dårlig inntjening er hoved årsaken til at produkter trekkes fra markedet.





Felles pakning
Hver for seg er de nordiske land små, men samlet vil et felles nordisk marked bli det sjette største i Europa. Felles nordisk pakning er en mulighet allerede i dag, men ville vært enklere dersom et elektronisk pakningsvedlegg på ønsket språk kunne erstatte det tradisjonelle pakningsvedlegget. Den nordiske befolkningens digitale kompetanse er god, slik at dette burde være mulig, men dagens lovverk tillater dette bare unntaksvis.

Muligheten for alternative finansieringsmodeller ble også løftet frem på møtet. Sverige har i en periode finansiert nye antibiotika ved å tilby industrien en fast, salgsuavhengig pris. Slik sikres tilgjengelighet, samtidig som man unngår et insentiv for unødig bruk av ny antibiotika. Ved hjelp av denne strategien har Sverige nå god tilgang på nye typer antibiotika, bare slått av USA og UK. Denne finansieringsmodellen burde kunne brukes til en del av pediatriens nisjeprodukter.
Klinikersamarbeid
Det er imidlertid klart at det ikke bare er de regulatoriske myndighetene som må jobbe for tilrettelegging av et felles nordisk marked. Nordens kliniske miljøer må samarbeide for å sikre at de produktene som til slutt blir tatt inn til et felles nordisk marked faktisk blir brukt. Denne utfordringen vil kunne løses ved at vi deler hverandres veiledere og oppslags verk, og har en felles forståelse for at man i størst mulig grad skal benytte legemidler som har markedsføringstillatelse for aktuelle indikasjon.
Hver for seg er de nordiske land små, men samlet vil et felles nordisk marked bli det sjette største i Europa.



Den første dosen surfaktant i Norge ble gitt på Rikshospitalet 1.juni 1987. Behandlingen ble først møtt med skepsis, men har sammen med økt forståelse og bruk av mer skånsomme ventilasjonsteknikker, vært viktig for å redusere mortalitet og langtidsskader hos premature. I år er det 30 år siden surfaktant ble registrert i Norge.
Tekst: Ola Didrik Saugstad, professorDa jeg begynte ved Rikshospitalets nyfødtavdeling i 1985, var alvorlig BPD dagligdags. Pasienter lå i uker og måneder med topptrykk opp mot 50 cm H2O på respiratoren og 100% O2 I 1980 viste Fujiwara og medarbeidere, som de første i verden, at surfaktantbehandling bedret oksygeneringen hos premature med RDS (1). På dette tidspunktet var jeg et år som post doc ved nyfødtavdelingen til University of California San Diego. Avdelingen lå langt fremme i surfaktantforskning, og jeg fikk med meg forskningskappløpet som ble startet av Fujiwaras studie. Jeg lurte på hvordan vi skulle få innført vidundermidlet i Norge.
Den første dosen
I 1986 fikk jeg høre at de to svenskene Bengt Robertson og Tore Curstedt planla en europeisk studie med surfaktant utvunnet av griselunger (Curosurf). Med støtte fra professorene Martin Seip ved Rikshospitalet og Sverre Halvorsen ved Ullevål sykehus, spurte jeg om å få være med. Forskningsykepleier Kari Gloppestad og jeg deltok på det første Curosurf-møtet i Amsterdam i april 1986. Det var ingen kommersielle interesser involvert. Vi brukte et år på arbeidet med å få svensk surfaktant godkjent for bruk i Norge.

Den 31. mai 1987 ble det født trillinger i gestasjonsuke 29 på Rikshospitalet. Trilling 3, Anders på 1115 gram, hadde RDS og fylte inklusjonskriteriene i studien. Den ferske assistentlegen Inger Elisabeth Silberg trakk randomiseringskonvolutten: Det ble surfaktant! Vi forsto at det var et historisk øyeblikk da jeg intuberte og satte den første surfaktantdosen i Norge. Oksygeneringen bedret seg raskt. Da røntgenbildet før og etter ble demonstrert neste dag, trodde ikke radiologen det var sam me pasient. De hvite lungene var blitt luftfylte på få minutter. Norske surfaktantfunn Snart skrev vi i «Tidsskriftet» om erfaringene med de 8 første pasientene og 6 kontroller. Fødselsvekt og gestasjonsalder var i gjennomsnitt 1215 g og 28,6 uker i surfaktantgruppen mot 1197 g og 28,8 uker i kontrollgruppen. I samsvar med de europeiske dataene (2) hvor dødeligheten ble redusert fra 51 til 31%, fant vi i vårt lille materiale en dødelighet på 50% i kontrollgruppen versus 38% i surfaktantgruppen. Tiden med behov for mer enn 40% oksygen ble redusert fra 19 dager hos kontrollene til 8,5 med surfaktant. Surfaktantpasientene fikk i snitt redusert FiO2 fra 0,91 til 0,40 i løpet av en time og videre til 0.38 etter ett døgn. Kontrollgruppen hadde en mindre endring de første 24 timene fra 0,94 til 0,82. Respiratortiden var imidlertid uendret, 16,6 versus 17,7 dager i de to gruppene (3). Neste skritt ble å delta i en europeisk multisenter-studie
der vi sammenlignet grisesurfaktant i høy og lav dose. Syv norske nyfødtavdelinger var med: Ahus, Bodø, Fredrikstad, Kristiansand, Rikshospitalet, Tønsberg og Ålesund. Selv om bare 43 norske barn ble rekruttert til studien, ble samarbeidet mellom de 7 avdelingene en viktig forløper for dagens nasjo nale interessegruppe i nyfødtmedisin. Som i den europeiske hovedstudien (4) fant vi i det norske materialet ingen forskjeller i utkomme mellom høy og lavdosegruppene (5). Standarddosen av Curosurf ble derfor satt til lavdosen, 100 mg/kg. Av 8 norske inkluderte med gestasjonalder < 26 uker eller fødselsvekt < 750 gram, var alle døde etter 46 dager. Det sier mye om utviklingen i behandlingen av disse minste i løpet av de siste drøyt 30 årene. Prinsipper for å skåne lungene Surfaktant er ikke det eneste fremskrittet som har skjedd innen metoder for å skåne skjøre, premature lunger siden 1980-tallet. Gradvis vokste en ny forståelse av mekanismer bak lungeskade frem. Dyrestudier viste at for høye volumer bare etter få ventilasjoner kunne overstrekke lungevevet (volutraume) (6). Utilstrekkelig ventilasjon med gjentatt sammenfall og reåpning av alveoler var også skadelig (atelektotraume). Det ble klart at respiratorbehandling bidro til inflammasjon og BPD-utvikling. Fra Danmark lærte Henrik Verder oss at premature helst burde puste selv på CPAP (7).
Populasjonen av svært for tidlig fødte endret seg i løpet av 20 år, 90% eller flere fikk nå antenatale steroider. Steroidene stimulerte til økt surfaktantproduksjon, og CPAP reduserte atelektasedannelse og inflammatoriske prosesser som bryter ned surfaktant. I 2012 viste et Cochrane review at det gikk bedre med små premature hvis man lot dem puste selv på CPAP og intuberte for å gi surfaktant bare ved tegn på alvorlig respira torisk distress (8). Dette virket nesten for fantastisk for oss som hadde jobbet med ekstreme respiratorinnstillinger!
Å intubere eller ikke intubere Selv med antenatale steroider er surfaktantproduksjonen lav hos ekstremt premature. Mange har lurt på om det finnes måter å gi surfaktant på samtidig som man minimaliserer faren for å påføre skade ved intubasjon og respirator. Mats Blennow i Stockholm introduserte akronymet INSURE (Intubation Surfactant Extubation). For drøyt 10 år siden presenterte Angela Kribs fra Køln gode resultater med LISA metoden (Less Invasive Surfaktant Administration), der surfaktant ble gitt gjennom et kateter i trachea mens barnet pustet selv på CPAP (9,10). En fersk metanalyse viser at LISA er bedre enn INSURE (11). Men også denne metoden krever laryngoskop og er traumatisk, enten man velger å gi smertelindring eller ikke i forbindelse med prosedyren. Forstøvet surfaktant er
blitt testet ut, så langt uten sikker effekt. Mer lovende er SALSA (Surfactant administration Laryngeal or Supraglottic Airways) hvor surfaktant blir administrert via larynksmaske (12).
De nyeste Europeiske retningslinjene for RDS som blir pu blisert i årskskiftet 2022/23 anbefaler at alle barn < 30 ukers gestasjonsalder som blir intubert for stabilisering, skal gis et naturlig surfaktant. LISA er foretrukket administrasjons metode for barn som puster selv på CPAP. Initialdosen av Curstedt og Robertsons grisesurfaktant er økt til 200 mg/ kg. Allerede ved FiO2 over 0,3 med CPAP trykk på 6 cm H2O anbefales det å gi første dose. Dose to og eventuelt tre kan gis hvis det er et vedvarende høyt oksygenbehov når andre årsaker enn RDS er ekskludert (13).
Alternativ respirasjonsstøtte CPAP er blitt førstevalget for respirasjonsstøtte til prema ture, og bør velges så sant det er mulig for barnet å puste selv. Alternative metoder for å unngå respirator prøves ut. De siste årene har utstyr for å gi synkronisert nasal intermit tendede overtrykksventilering (sNIPPV) blitt tilgjengelig. Til forskjell fra konvensjonell BIPAP som har vist seg vanske lig å synkronisere med barnets respirasjon, er sNIPPV ofte effektivt for å hindre intubasjon. High flow nasal cannulae (HFNC) brukes som alternativ til CPAP. Metoden gir mindre traumer i nesen, og er godt likt av sykepleiere og foreldre da barnets ansikt blir mer synlig. HFNC gir mindre forutsigbar PEEP, og det er fortsatt omdiskutert i hvilken grad metoden kan erstatte CPAP (13).
Motstand og fremskritt Innføringen av surfaktant ved Rikshospitalet møtte betydelig motstand. Det ble hevdet at surfaktant var farlig og kunne gi hjerneblødning. Vi ble også beskyldt for å jukse med data. Avdelingoverlegen var negativ, han mente surfak tant var for dyrt. Så sent som i 1994 skrev to kollegaer som var kritiske til innføringen av surfaktant: «Behandlingen med surfaktant er kommet for å bli. Det er imidlertid lite trolig at denne behandlingen på kort sikt vil føre til noen markert bedring i behandlingsresultatene» (14). I dag, 30 år etter surfaktant ble registrert i Norge, regner man med at 1 million dødsfall er avverget blant de 6-7 millioner nyfødte som globalt har blitt behandlet med Curstedt og Robertsons grisesurfaktant. Men historien stopper ikke her. Vi må følge med hele tiden for å få med oss nye innsikter og impulser. Bare sånn kan vi til enhver tid levere så god behandling som mulig til små premature i Norge.
Referanser: Se paidos.no!
Skademekanismer
Høye volumer
Høye trykk Atelektaser
Respirator
Egenrespirasjon på CPAP.
Infeksjoner Stor PDA
Unngå stress Lukke ductus
Færre og større alveoler med fortykket vegg som følge av kronisk inflammasjon
Vedvarende pulmonal hypertensjon og reaktive luftveier

Bronkopulmonal dysplasi (BPD) er kronisk lungesykdom hos premature. Grad av prematuritet betyr mye, men de siste 30-40 årene har brakt mye ny kunnskap om hvordan behandlingen, særlig i de første minuttene, timene og dagene etter fødsel, påvirker inflammasjonsprosesser i premature lunger. Røntgenbildene viser utvikling av BPD, og er gjengitt med velvillig tillatelse fra pasientens foreldre.
 Lungevevet fortsetter å vokse og utvikle seg slik at symptomene avtar når barnet vokser
Prenatale steroider Surfaktant Koffein
Lungevevet fortsetter å vokse og utvikle seg slik at symptomene avtar når barnet vokser
Prenatale steroider Surfaktant Koffein
De siste måneders hendelser i Ukraina har brakt krig nærmere trygge Norge. Like brutale kriger pågår i mange land over hele verden. Barn er de mest sårbare ofrene i krig, og de som får minst ressurser og helsehjelp.
Ett av seks barn i verden bor i konfliktsoner, 165 millioner i høyintensitetskonflikter. Antall FN-verifiserte drap på barn har økt med 300% siden 2010 (1). Syria, Irak, Jemen, Afgha nistan, Somalia og Den sentralafrikanske republikk er land hvor svært mange barn utsettes for krigens farer (1). Redd Barna rapporterer alarmerende tall.
Kriser i krigens kjølvann Tross inntrykk skapt av media, er størstedelen av helse behov og helsehjelp som ytes i krigsområder faktisk ikke traumerelaterte. I de fleste kriger pågår kamphandlinger i avgrensede tidsrom, mens krigføringens konsekvenser for hverdagen gjør livet vanskelig over lang tid. Ved akutte kriger og aktive krigshandlinger settes mye ressurser inn i behand ling av traumer og krigsskader av soldater og sivile. Bakteppet er nedprioriterte ressurser til behandling av kronisk syke, gravide, barn og nyfødte.
Dette har jeg bevitnet i Irak, Syria, Afghanistan og andre krigsområder, på oppdrag med Leger uten grenser. Et samfunn påvirket av krig, akutt eller over tid, har enorme udekkede behov for og mangler på helsehjelp
Mange områder har lidd av konsekvensene i årevis, og er såkalte kollapsede stater hvor innbyggernes grunnleggende behov ikke oppfylles. Helseinfrastruktur er blitt ødelagt i bombe- og rakettangrep, men også manglende vedlikehold er ødeleggende. Varer, medisiner og utstyr som er essensielt
for sykehusdrift kan mangle grunnet leveranse- og logistikk problemer. Engangsutstyr blir oppbrukt og flergangsutstyr ødelagt. Medisinteknisk utstyr repareres ikke. Tilgang på elektrisitet og vann er uforutsigbar, og kan være fraværende i lange perioder. Krigføring hindrer både privatpersoner og ambulanser i å nå frem til sykehus. Transport er kostbart, avstandene kan være lange, og check-pointer og veibomber er sikkerhetsmessige hindringer. I mange områder tar de krigførende partene over drift av helsestrukturer. Ekstern humanitær hjelp ved hjelpeorganisasjoner kommer ofte på banen med varierende organisering av nødhjelp, og med egen agenda og manglende koordinering, ofte begrenset hjelp til en spesiell avdeling på et sykehus som traumekirurgi. Angrep på helseinstitusjoner og sykehus har dessverre blitt en del av de moderne krigers taktikk. Dette er alvorlige brudd på internasjonal humanitær lov, og gjør det svært risikofylt være helsearbeider.
Kunnskap - en tapt ressurs Det er ikke uvanlig at utdannet helsepersonell flykter eller søker til tryggere områder. De som er tilbake, må kanskje ta oppgaver de er underkvalifisert for. Krigsområder preges av manglende medisinsk kunnskapsinfrastruktur, blant annet utdanning og kliniske guidelines. Mine unge legekolleger i Syria og Yemen hadde startet spesialistutdanning, men fått store deler av undervisning og praksis korrumpert på grunn av krigene.
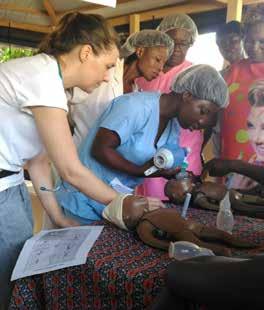
 Enkel nyfødtenhet satt opp på frontlinje traumesykehus Vest Mosul, Irak (Privat)
Enkel nyfødtenhet satt opp på frontlinje traumesykehus Vest Mosul, Irak (Privat)
Pasienter oppsøker helsehjelp for sent. Mødre har begrenset kunnskap om varseltegn på sykdom hos barnet, og ofte ikke tilgang på kvalifiserte råd. Hjemmefødsel er vanlig mange steder, og helsehjelp oppsøkes bare ved komplikasjoner. I noen land er morsmelkerstatning vanligere enn å amme. Det fører til feilernæring og alvorlige infeksjoner fordi melken ofte feildoseres og blandes med urent vann. Sepsis, diare, meslinger og nyfødttetanus er vanlig. En under identifisert og underkommunisert problemstilling er den høye forekomsten av antibiotikaresistens i krigsområder. Ukontrollert og uregulert antibiotikabruk driver frem utbredt resistens. På grunn av manglende diagnostiske muligheter, som laboratoriefasiliteter eller mulighet for dyrkningsunder søkelser, blir resistens sjelden oppdaget eller registrert. I tillegg har man begrenset og lite målrettet antibiotika tilgjengelig. På sykehuset der jeg arbeidet i Afghanistan had de vi en egen avdeling for nyfødte med tetanus – nokså hyppig forekommende på grunn av uvaksinerte mødre og avnavling med uren kniv. I hovedstadens største fødesykehus i Den sentralafrikanske republikk oppdaget jeg et stort utbrudd av multiresistent Klebsiella på nyfødtavdelingen (2). I Irak gjorde Leger uten grenser om sitt frontlinjesykehus med egen barneavdeling til spesialsykehus for antibiotikaresistens.
Pasienter opplever miljømessige utfordringer som utgjør stor helserisiko. Ødelagte hus og vannforsyninger fører med seg infeksjonssykdommer som diare, og støvrelaterte tilstander som astmaanfall. Barn med kroniske lidelser, som epilepsi, får ikke tilgang på sin faste behandling. Også ulykker og skader skjer i større omfang. Veier og biler er ødelagte. I Irak hadde IS lagt igjen boobie-traps: skjulte bomber som kan være festet til dørhåndtak eller leker, gjerne utplassert i forlatte boliger, for å utløses når eierne flyttet hjem.

Mødreomsorg og nyfødtomsorg hånd i hånd En av de største årsakene til nyfødtdødelighet i krigsområder er mangelfull eller ikke-eksisterende helsehjelp til gravide og fødende kvinner. Kvinner føder ofte hjemme under dårlig hygieniske forhold, og er forhindret fra å komme til sykehus. Mødredødelighet og nyfødtdødelighet henger tett sammen, og må håndteres deretter. Derfor skal enhver humanitær intervensjon i krigsområder inneholde tilgang
på akutt obstetrisk hjelp. Traumesykehus bør ha tilgang på sectiokyndige kirurger, og ansatte som kan håndtere akutt obstetrikk og syke nyfødte i etterkant.
Områder rammet av krig og konflikt er alle forskjellige og må betraktes kontekstuelt. Helsevesenet i Ukraina er av en annen kvalitet enn i Den sentralafrikanske republikk. På et stort offentlig regionssykehus sør i Helmand, Afghanistan opplevde vi enorm pågang av barn og nyfødte, og stadig overfylte avdelinger. I en kontekst hvor helsevesenet er svært marginalt og ressursfattig, kvalifisert helsehjelp er mangel vare og det pågår aktiv krigføring, er helsetilbudet begrenset. Kompliserte tilstander behandles «enkelt» på grunn av man gel på medisinskteknisk utstyr og kyndig personell. Ved et frontlinjesykehus i Vest-Mosul under frigjøringen av IS i 2017 fikk vi organisert inn medisiner, senger og medisinskteknisk utstyr for å sette opp en egen barneavdeling, da over 50% av pasientene var barn. Lokale irakiske spesialistleger ble ansatt, og behandling av høy medisinsk kvalitet ble ytt i en ekstrem kontekst under aktiv krigføring.
Innføring av standardisert tilnærming, protokoller og systematisk implementering kan bedre overlevelsen av barn og nyfødte i krigsområder, og det finnes flere gode programmer for dette. Eksempler er Helping babies breathe, HBB (3), Emergency triage assessment and treatment, ETAT (4), Interagency Field Manual on sexual and reproductive health in humanitarian settings (5).

Å bli født og vokse opp i krig frarøver millioner av barn mulighet for trygg start på livet og trygg oppvekst, og kan gi livslange traumer fysisk og psykisk. Det er de mest sårbare, nemlig nyfødte, barn og deres foreldre som lider mest under konsekvensene av brutale krigshandlinger. Barne- og nyfødtmedisin i krigsområder er underprioritert, uten tilgang på universell, trygg og effektiv høykvalitets helsehjelp. Neste gang du ser bilder av krigsskader og akuttmottak på TV, tenk på isberget av syke nyfødte og barn som forbigås i stillhet og ikke vises til omverdenen.
Referanser: se www.paidos.no
Barn med sepsis behandles med væske og antibiotika i Afghanistan. Sykepleier og M Thallinger (Privat)



Fiasp®
Fiasp®
Behandling av diabetes mellitus hos voksne, ungdom og barn i alderen 1 år og oppover.
Fiasp® gis ved subkutan administrering rett før måltidet starter (0 til 2 minutter før), med mulighet for administrering opptil 20 minutter etter at måltidet har startet.
Reseptgruppe, refusjonsvilkår og pris6,7
Insulinanalog, hurtigvirkende. ATC-nr.: A10A B05
Refusjonsberettiget bruk: Behandling av diabetes mellitus
Refusjonskoder
ICPC
Vilkår nr ICD
T89 Diabetes type 1 E10 Diabetes mellitus type 1
T90 Diabetes type 2 E11 Diabetes mellitus type 2
W85 Svangerskapsdiabetes E13 Andre spesifiserte typer diabetes mellitus E14 Uspesifisert diabetes mellitus O24.4 Diabetes mellitus som oppstår under svangerskap
Vilkår: Ingen spesifisert
Vilkår nr
Pakninger og priser: Fiasp®: 10 ml (hettegl.) kr 247,50. Fiasp® FlexTouch®: 5 x 3 ml (ferdigfylt penn) kr 439,00. Fiasp® Penfill®: 5 x 3 ml (sylinderamp.) kr 402,30. Fiasp® PumpCart®: 5 x1,6 ml (sylinderamp.) kr 244,50.
Priser per: september 2021
Hypoglykemi er en svært vanlig bivirkning (≥ 1/10) og kan forekomme dersom insulin dosen er for høy i forhold til insulinbehovet. Hypoglykemi kan inntreffe tidligere etter en injeksjon/infusjon med Fiasp sammenlignet med andre måltidsinsuliner på grunn av den tidligere innsettende effekten.
Hyperglykemi - Bruk av utilstrekkelige doser eller avbrytelse av behandlingen, særlig hos pasienter med behov for insulin, kan føre til hyperglykemi og diabetisk ketoacidose. Allergiske hudmanifestasjoner rapportert med Fiasp (1,8 % versus 1,5 % for kom parator) omfatter eksem, utslett, kløende utslett, urtikaria og dermatitt. Med Fiasp ble systemiske hypersensitivitetsreaksjoner (manifestert ved generalisert hudutslett og ansiktsødem) rapportert som mindre vanlige (0,2 % versus 0,3 % for komparator). Lipodystrofi (inkludert lipohypertrofi, lipoatrofi) og kutan amyloidose kan forekomme på injeksjonsstedet og forsinke lokal insulinabsorpsjon. Lipodystrofi på injeksjons-/ infusjonsstedet er rapportert hos pasienter som ble behandlet med Fiasp (0,5 % versus 0,2 % hos komparator). Kontinuerlig rotering av injeksjonssted innen et gitt injeksjon sområde kan bidra til å redusere eller forebygge disse bivirkningene
Annen samtidig sykdom, især infeksjoner og febertilstander, øker vanligvis pasientens insulinbehov.
Alder
Nyrefunksjon
Leverfunksjon
Hjertesvikt
Kan brukes hos voksne, ungdom og barn i alderen 1 år og oppover Erfaring med behandling hos pasienter ≥ 75 år er begrenset. Det er ingen klinisk erfaring med bruk av Fiasp hos barn under 2 års alder.
Kan brukes ved nedsatt nyrefunksjon Nedsatt nyrefunksjon kan redusere pasientens insulinbehov
Kan brukes ved nedsatt leverfunksjon Nedsatt leverfunksjon kan redusere pasientens insulinbehov
Anbefales ikke
Barn og ungdom <1år
Det er rapportert tilfeller av hjertesvikt når pioglitazon ble brukt i kombinasjon med insulin, spesielt hos pasienter med risikofaktorer for å utvikle hjertesvikt.
Les fullstendig preparatomtale før forskrivning Alle bivirkninger og uønskede medisinske hendelser som oppstår under behandling bør rapporteres til Statens Legemiddelverk eller Novo Nordisk
Referanser: 1. Fiasp® SPC avsnitt 5.1 (sist oppdatert 18.08.2021). 2. Fiasp® SPC avsnitt 5.2 (sist oppdatert 18.08.2021). 3. Fiasp® SPC avsnitt 4.2 (sist oppdatert 18.08.2021). 4. Fiasp® SPC avsnitt 4.8 (sist oppdatert 18.08.2021). 5. Fiasp® SPC avsnitt 4.1 (sist oppdatert 18.08.2021). 6. https://www.felleskatalogen.no/ medisin/blaarev-register/a10ab05-1 (Lest 21.09.2021). 7. https://www.felleskatalogen.no/medisin/fiasp-fiasp-flextouch-fiasp-penfill-fiasp-pumpcart-novonordisk-640799 (Lest 21.09.2021). 8. Fiasp® SPC avsnitt 4.2, 4.4, 4.8 og 5.2 (sist oppdatert 18.08.2021).
Nydalsveien 28 · Postboks 4814 Nydalen · 0484 Oslo www.novonordisk.no · Telefon: +47 22 18 50 51
Fiasp ® og NovoRapid ® er registrerte varemerker tilhørende Novo Nordisk A/S NO21FSP00009 21. sep. 2021Midt inne i det store barskogbeltet ligger Elverum og dersom Kjell Aukrust skulle beskrevet hvor Elverum ligger, ville han kanskje sagt, lett omskrevet fra Flåklypa: Femten mil nordover fra hovedstaden, litt øst og oppover, ligger Elverum – en liten by i skogen under himmelhvelvingen. Sjølberga med både barneavdeling og campingplass, lokalavis og eget håndballag.
Tekst og foto: Jon Grøtta, avdelingsoverlege
Tidligere besøkt: 2015; 33 (4) Østfold 2016; 34 (2) Tromsø 2017; 35 (3) Hammerfest 2017; 35 (4) St.Olavs hospital 2018; 36 (1) Kristiansand 2018; 36 (2) Bodø 2018; 36 (3) Førde 2019; 37 (1) Oslo 2019; 37 (2) Skien 2019; 37 (3) Ålesund 2020; 38 (1) Levanger 2020; 38 (2) Lillehammer 2020; 38 (3) Haukeland 2021; 39 (1) Arendal 2021; 39 (2) Haugesund 2021; 39 (3) Stavanger 2022; 40 (1) Ahus
Vi som jobber her er nok mest lik Ludvik i Flåklypa, og mindre lik Solan. Selvskryt er det lite av, mer krumming av nakken og hardt arbeid til barnas beste utfra små ressurser.
Barnelege Bjarne Smeby startet privat spesialistpraksis i Elverum i 1960. Etter hvert ble han tilknyttet sykehuset som spesiallege ved medisinsk avdeling, og da Olav Flesvig kom i 1980, kunne man begynne å planlegge egen barneavdeling. Mot slutten av 80-tallet kom dem første ass.legen, og etter hvert så mange at vi fikk et rent vaktsjikt med ass.leger, nå LIS-leger. I så måte er nok utviklingen i vår avdeling temmelig lik den som har vært ved de andre tidligere sentralsjukehusavdelingene.

Før barneavdelingen ble åpnet 1. september 1986, ble barn med behov for innleggelse lagt på barnestuer ved de indre medisinske avdelingene i Hamar, Elverum og Kongsvinger. Pediaterne var ansatt som spesialleger, og drev poliklinikk og hadde tilsyn på barnestuene. Dette var jo en ordning som ellers rundt om i landet og som etter hvert ikke lenger var framtidsrettet. Det var derfor stor glede da avdelingen ble åpnet, og ikke minst at man samtidig fikk egen nyfød avdeling. Vi har så bygget avdelingen sten på sten til i dag å være et barnesenter hvor alle barn og unge (0 – 18 år) innlagt ved sykehuset i Elverum ligger på barneavdelingen. Etter en

funksjonsfordeling mellom Hamar og Elverum på slutten av 90-tallet, blir barn med magesmerter over 5 år innlagt på gastrokirurgisk avdeling på Hamar, og de under 5 år hos oss. Dette er naturligvis ikke optimalt, men vi har lært oss å leve med denne fordelingen. Samarbeidet og støtten fra «store bror» OUS har i alle vår vært utmerket både når det gjelder det rent faglige og ikke minst i LIS-utdanningen.
Vi har i mange år hatt et godt samarbeid med barne avdelingen på Lillehammer med felles internundervisning digitalt hver onsdag. I tillegg har vi samarbeid i ferie avviklingen hvor vi stenger barneposten fire uker hver og bytter på å ha ansvaret for innleggelser.

I Sykehuset-Innlandet har vi som nevnt foran, to barne- og ungdomsavdelinger, en på Lillehammer og en i Elverum. Det er styrevedtak på å bygge et nytt Mjøssykehus i Moelv hvor det er tenkt at begge avdelingene skal samles til en avdeling i framtiden. Inntil det nye sykehuset står ferdig har vi imidlertid en krevende driftsperiode foran oss, ikke minst økonomisk og stor bekymring rundt rekruttering. Vi har en barne- og ungdomspopulasjon på ca 31500 og drøyt 900 fødsler som vi skal betjene med spesialisttjenester. Med bare 10 senger på barneposten og 5 på nyfødt sier det seg selv at det til tider er særdeles krevende med bare 7 overleger og 6 LISleger. Dette til tross har vi klart at en av overlegene har fullført sin PhD, og en til er snart ferdig med sin grad. Det største savnet foruten litt få overleger, er støttepersonell som sosio nom og psykolog. Selv om vi har BUP relativt nært geografisk, er det et ønske om egen barnepsykiater og psykolog tilknyttet avdelingen og poliklinikken.
Vi har en vidt spekter av diagnoser og grupper som får sin oppfølging hos oss. En svært allsidig poliklinikk med ca 5400 konsultasjoner i året samt ca 800 innleggelser. Vi ser at de senere årene har den polikliniske virksomheten blitt større og større til fordel for innleggelsene. Overlegene må beherske mange ulike fagfelt, selv om vi har ulike fagområder vi føler oss mer kompetente i. Med bare 7 overleger hvor den ene er fulltid i hab, blir generalisten den viktigste og ingen kan derfor dyrke sin spesialinteresse fullt ut.
Den desidert største pasientgruppen er barn og unge med diabetes som teller ca 100 pasienter. Vi var så heldige og fikk bli med i Barnediabetesregisteret sitt IQ-program for kvalitetsutvikling av diabetesomsorgen. Resultatet ble faktisk så bra at vi hadde laveste gjennomsnitts HbA1c i hele landet i 2020. Mottoet med høye og hårete mål var ikke bare en illusjon, men ble faktisk til virkelighet. Det var særdeles hyggelig å vise at det ikke alltid er de store ressursene som må til for å lykkes.
Veien videre De siste 10 årene har det vært to store beslutninger som har påvirket oss i ganske så stor grad. Først beslutningen om at det skulle etablerers en kvinneklinikk i SI og den ble lagt til Lillehammer. Det førte til færre innlagte på nyfødtintensiv.

Den andre beslutningen var da helseministeren bestemte at Kongsvinger sykehus skulle tilhøre AHUS. Med den beslutningen forsvant ca 20 – 25% av alle våre innleggelser i barneposten. Som en konsekvens av dette måtte vi redusere vårt sengetall til 10 og samtidig nedbemanne antall pleiere.
Vi som jobber her opplever likevel at vi har en god arbeids plass. Flere av overlegene har jobbet her i over 30 år, og det sier vel og sitt. En stor del av pleiepersonalet har og vært med oss lenge, ja noen sågar helt fra åpningen i 1986.
Fra å være en ganske gjennomsnittlig sentralsykehusavdeling på 1990-tallet, er vi i dag en avdeling som ser at det kan bli utfordrende å opprettholde spesialkompetanse over tid pga av lavere antall innlagte, både nyfødte og større barn. Dette gjelder særlig C-PAP behandling. På den andre siden ser vi at kompetansen og tilbudet øker i poliklinikken, spesielt på gastro med mab-behandlinger, diabetes og innen onkologi med utvidet tilbud både på kurer og intratekal behandling. Så tross mange og store utfordringer som vi har foran oss, ser vi likevel lyst på tilværelsen. Vi opplever en meningsfylt arbeidshverdag hvor vi ofte får tilbakemelding om at vi utgjør en forskjell i hverdagen for barna og familiene som går til oppfølging hos oss.

Basalinsulin til daglig injeksjon, som reduserer frekvensen av hyperglykemi med ketose1-3
God glykemisk kontroll er viktig hos barn og unge som er i kontinuerlig kognitiv utvikling.4
Hyperglykemi med ketose3

Sikkerhet og effekt er vist i en langtidsstudie hos barn i alderen fra 1 år til yngre enn 18 år. Frekvens, type og alvorlighetsgrad av bivirkninger i den pediatriske populasjonen indikerer ingen forskjeller sammenlignet med erfaringen i den generelle diabetespopulasjonen.
Insulin degludec, Tresiba® Insulin detemir, Levemir®

Antall tilfeller hyperglykemi med ketose per pasientår Figur utarbeidet av Novo Nordisk basert på figur 5 i ref. 3

Behandling av diabetes mellitus hos voksne, ungdom og barn fra 1 år.
Tresiba® administreres subkutant én gang daglig når som helst i løpet av dagen, fortrinnsvis på samme tidspunkt hver dag. Det skal alltid være minst 8 timer mellom injeksjonene. Det er ingen klinisk erfaring med fleksibilitet i doseringstidspunkt for Tresiba® hos barn og ungdom.
Reseptgruppe, refusjonsvilkår og pris 7,8
Insulinanalog, langtidsvirkende. ATC-nr.: A10A E06 C
Refusjonsberettiget bruk: Behandling av diabetes mellitus
Refusjonskode:
ICPC Vilkår nr
T89 Diabetes type 1 180, 181

T90 Diabetes type 2 244
ICD Vilkår nr
E10 Diabetes mellitus type 1 180, 181
E11 Diabetes mellitus type 2 244
Pakninger og priser:
Vilkår:
180 Refusjon ytes kun til pasienter som ikke oppnår behandlingsmålene til tross for optimal behandling med middels langtidsvirkende NPH-insulin på grunn av: - hyppige eller alvorlige nattlige følinger som skyldes insulinbruken - store blodsukkersvingninger som ikke gjør det mulig å oppnå akseptabel blodsukkerkontroll
181 Behandling skal kun startes av spesialist i indremedisin, barnesykdommer eller ved sykehusavdeling med tilsvarende spesialitet
244 Refusjon ytes kun til pasienter som til tross for optimal behandling med to daglige doser middels langtidsvirkende NPH-insulin har vedvarende utfordringer med hypoglykemier
Injeksjonsvæske, oppløsning i sylinderampulle: 100 enheter/ml: 5 × 3 ml (Penfill sylinderamp.) kr 618,00. Injeksjonsvæske, oppløsning i ferdigfylt penn: 100 enheter/ml: 5 × 3 ml (FlexTouch ferdigfylt penn) kr 750,70. 200 enheter/ml: 3 × 3 ml (FlexTouch ferdigfylt penn) kr 732,50. (Pris per mars 2022)
Hypoglykemi er en svært vanlig bivirkning (≥ 1/10) og kan forekomme dersom insulindosen er for høy i forhold til insulinbehovet.
Hyperglykemi Bruk av utilstrekkelige doser eller avbrytelse av behandlingen, særlig hos pasienter med behov for insulin, kan føre til hyperglykemi og diabetisk ketoacidose.
Lipodystrofi (inkludert lipohypertrofi, lipoatrofi) og kutan amyloidose kan forekomme på injeksjonsstedet og forsinke lokal insulinabsorpsjon. Kontinuerlig rotering av injeksjonssted innen et gitt injeksjonsområde kan bidra til å redusere eller forebygge disse bivirkningene. Reaksjoner på injeksjonsstedet kan forekomme. Disse er vanligvis milde og forbigående, og forsvinner normalt ved fortsatt behandling. Annen samtidig sykdom, især infeksjoner og febertilstander, øker vanligvis pasientens insulinbehov.
Kan benyttes uten dosejustering Anbefales ikke Alder Voksne, ungdom og barn fra 1 år Eldre (≥65 år): Måling av glukose må intensiveres hos eldre, og insulindosen justeres individuelt
Nyrefunksjon Kan brukes
Måling av glukose må intensiveres ved nedsatt nyrefunksjon, og insulindosen justeres individuelt Leverfunksjon Kan brukes
Måling av glukose må intensiveres ved nedsatt leverfunksjon, og insulindosen justeres individuelt Graviditet Kan brukes
Behandling med Tresiba® kan vurderes under graviditet hvis det er klinisk nødvendig
For ytterligere informasjon se fullstendig preparatomtale eller www.felleskatalogen.no
Barn under 1 år
Ingen klinisk erfaring
Referanser: 1. Tresiba® SPC, avsnitt 5.1 (sist oppdatert 13.01.2022). 2. Tresiba® SPC, avsnitt 4.2 (sist oppdatert 13.01.2022). 3. Thalange N, Deeb L, Iotova V, et al. Insulin degludec in combination with bolus insulin aspart is safe and effective in children and adolescents with type 1 diabetes. Pediatr Diabetes. 2015 May;16(3):164–76. 4. Liu S, Kuja-Halkola R, Larsson H, et al. Poor glycaemic control is associated with increased risk of neurodevelopmental disorders in childhood-onset type 1 diabetes: a population-based cohort study. Diabetologia. 2021;64(4):767-777. 5. Tresiba SPC, avsnitt 4.8 (sist oppdatert 13.01.2022). 6. Tresiba® SPC, avsnitt 4.1 (sist oppdatert 13.01.2022). 7. https://www.felleskatalogen.no/medisin/blaarev-register/a10ae06-1 (Lest 25.03.2022). 8. https://www.felleskatalogen.no/medisin/tresiba-novo-nordisk-589607 (Lest 25.03.2022). 9. Tresiba® SPC, avsnitt 4.2, 4.4, 4.6, 4.8, 5.1 og 5.2 (sist oppdatert 13.01.2022).
Du kan lese mer om Tresiba® på vår nettside: www.tresiba.no
Novo Nordisk Norway AS
Nydalsveien 28 Postboks 4814 Nydalen 0484 Oslo
Telefon: +47 22 18 50 51 www.novonordisk.no E-post: Kundeservice-norge@novonordisk.com
DOI: 10.1111/apa.16405
'

Millions of Ukrainian children have been internally displaced or fled to other countries because of the Russian war. A systematic review by Ludvigsson and Loboda provides valuable information on child healthcare in Ukraine and focuses on a wide range of studies on the specific health needs of the country's paediatric population.1 The review found that Ukrainian children often have poorer health and lower vaccination rates than children in other European countries. The review provides clinicians in host countries with useful guidance about the specific healthcare needs they can expect to see in these vulnerable refugees.

Sleep problems decreased from 6 to 24 months of age without later development problems


Valla et al. assessed sleep problems in 1555 Norwegian children. 2 They found that the prevalence of parent-reported infant sleep problems was 14.6% at 6 months, 7.4% at 12 months and 3.3% at 24 months of age. As well as showing a decrease with age, their study did not find any clear evidence of early sleep disturbance and later development problems.
Sleep duration was associated with reducing obesity in children aged 6–12 years
Longer sleep duration at baseline was associated with greater weight reductions one year after children aged 6–12 took part in a randomised obesity
intervention study in Norway.3 Kjetså et al. also found that higher family income and lower ages at baseline were associated with greater reductions in body mass index standard deviation scores, while higher ages were associated with decreased waist circumference. Longer screen time was associated with a trend towards greater increases in waist circumference. An editorial by Janson examines the value of sleep in children treated for obesity.4
Foreign body aspiration is a common reason for paediatric emergency visits and one of the most frequent causes of endobronchial obstructions in childhood. Chantzaras et al. conducted a systematic review on using flexible bronchoscopy to remove foreign bodies and found that it was successful in 87.1% of paediatric cases.5 Complications were low, most of the foreign bodies were organic materials and the majority were lodged in the bronchial tree. The authors concluded that flexible bronchoscopy may provide the first-line treatment for specific foreign body aspiration.
Ruhe et al. explored the experiences and needs of parents dealing with high-risk pregnancies and preparing for the possibility of caring for a preterm infant.6 They found that expectant parents used different coping strategies to handle the stress of a potential preterm birth, and this could switch from avoidance to being prepared. The authors concluded that neonatal intensive care units needed a customised intervention bundle for parents of preterm infants. However, they stated that the timing, and what content was appropriate, needed to be tailored to individual parents.
Acta Paediatrica. 2022;111:1294–1295.
DOI: 10.1111/apa.16451
A national Swedish study by Lundgren et al reported that the number of infants born before 24 weeks who survived to 40 weeks of postmenstrual age doubled from 2007 to 2018.1 However, neonatal morbidity rates did not change. The accompanying editorial by Markestad discusses decisions at the limit of viability,2 including a study of paediatric residents in Norway in 2017–2020. They were asked whether they would want life support to be started if their own infant was born at gestational ages of 22–26 weeks. None of 80 respondents favoured life support at 22 or 23 weeks, but 30% expressed uncertainty at 23 weeks. Even at 25 weeks, only 59% were in favour of life support and 34% were uncertain.
Theubo et al describe a hypothetical study in which the desire for methodological purity prompted researchers to give intramuscular injections to critically ill babies who had been randomised to a placebo arm.3 They criticise this practice because, in their view, it causes pain that harms babies without delivering any offsetting benefits. Lantos provides his view on the topic and discusses the moral risk of methodological purity in clinical research.4

Linnér et al randomised 91 infants born very preterm from 28+ 0 to 32 + 6 weeks of gestation in Norway and Sweden to either immediate skin-to-skin contact with a parent for the first six postnatal hours
or standard incubator care.5 They found that the 46 infants who received skinto-skin contact had better autonomic stability scores than the controls, based on their heart and respiratory rate, respiratory support, fraction of inspired oxygen and oxygen saturation.
Swedish guidelines recommend that vitamin D supplements should be given to all children under 2 years of age and to children under five with other risk factors, particularly dark skin. Trollfors found poor adherence when he studied how many children aged 0–4 years, attending an outpatient clinic in Gothenburg, Sweden, took the doses recommended by the Swedish guidelines.6 The study also showed that particularly girls from the Indian subcontinent, Middle East and Africa had the lowest levels levels of serum 25-hydroxy vitamin D.

Adders are the only poisonous snakes in the Nordic countries. Nurminen and Eskola analysed 109 paediatric adder bite cases in Finland's Lake District from 2006 to 2015.7 Most children were bitten on a lower limb, with minor symptoms, such as localised redness and swelling, and children over 8 years reported more pain. Antivenom treatment was rarely administered and then only in severe cases or if symptoms progressed. Figures: istockphoto
Acta Paediatrica. 2022;111:1470–1471. wileyonlinelibrary.com/journal/apa
nr. 40 (3) 2022 167
DOI: 10.1111/apa.16477

Afrodite Psaros Einberg and Björn Fischler provide an overview of what is known so far about the recently reported increases in paediatric hepatitis of unknown aetiology and describe nine Swedish cases in more detail.1
The Responses to Illness Severity Quantification scoring tool aims to identify which children admitted to hospital with severe acute malnutrition face the highest risk of mortality. Dahl et al evaluated the use of the tool in a Nigerian hospital and concluded that it identified high-risk malnourished children on admission and during their hospital stay.2 The tool may help healthcare professionals to prioritise patients and potentially improve survival. In the accompanying editorial, Hildenwall points out that this is particularly important in settings that manage high numbers of patients with limited resources and staff.3
characteristics in people with spina bifida.4 This showed that the majority had cognitive difficulties and that these manifested in problems with language, perception, memory, executive and attentional functions. These had a major impact on their daily life, which could affect medical adherence and responsibility and the ability to prevent secondary complications.

A national registry-based study by Mølholm Hansen et al compared infants born during the first year of the COVID-19 pandemic and the previous 4 years. The authors found that preterm live births and stillbirths were slightly lower in Denmark during the pandemic than in the pre-pandemic period, as they fell from 6.29% to 6.02% of all births.5 There were no clear differences in the subcategories of preterm births between the two periods.

Spina bifida is caused by incomplete closure of the neural tube during the first 3 weeks of pregnancy. A scoping review by Lindquist et al summarised the findings about cognitive
Last year, Acta Paediatrica co-sponsored a symposium called Neurobiology of Hatred and Paul Weindling gave a lecture on the painful, and sometimes deadly, experiments that Nazi doctors carried out on children during World War II. He reviews the evidence in this paper, by drawing on a biomedical research database that covers 28,655 victims who were subjected to 359 different medical experiments.6 Roelcke objected to some of Weindling's conclusions in a letter7 and Weindling has responded.8
Figures: 1-4: istockphoto.com, 5: wiki commons/Mengele medical experimentation block in Auschwitz
Acta Paediatrica. 2022;111:1656–1657.

DOI: 10.1111/apa.16519
This issue contains three different papers on COVID-19 vaccinations for children and adolescents. A review by Morello et al.1 concluded that the benefits of vaccinating children and adolescents against the virus that causes COVID-19 appeared to outweigh the risks of post-vaccination myopericarditis. In a different view, Abecasis states that the benefits of COVID-19 vaccination programmes for children may not outweigh the risks. 2 Meanwhile, an editorial by Wilkinson et al lists five interrelated issues that should be considered when deciding whether to provide COVID-19 vaccinations for children.3

A randomised trial by Mayne et al.4 studied preterm infants who received a maternal-driven, infantdirected reading intervention. The authors found that the infants made significantly greater conversational turns, by 36 weeks of postmenstrual age, than the control group, indicating improved early language interactions. In another paper in this issue, Lieberman et al.5 concluded that asking parents about babbling at 10 months produced valid answers, but did not predict language screening result 2 years later.

A retrospective study by Hautala et al.6 compared 78 waterbirths and 1623 matched conventional low-risk deliveries at a level-two hospital in Finland from September 2018 to March 2021. The authors report
that waterbirths decreased the need for maternal pain medication and favoured greater breastfeeding and earlier discharge.
A lack of stored iron, indicated by low serum ferritin, has been associated with various clinical symptoms. A significant increase in the frequency of ferritin measurements in children and adolescents was seen in Finland from 2018, with a 47-fold rise in 2019 compared to 2012, according to an observational study by Nikkilä et al.7 A simultaneous escalation in Google Search activity was also seen. The authors suggest that the increased public interest in ferritin measurements may have been driven by social media activity. In another paper in this issue, Ljungblad et al report that lower iron stores were associated with suboptimal gross motor scores in infants at 3–7 months of age.8

Six-year-old children had greater risks of functional gastrointestinal disorders if their parents had mental health conditions, in particular their mothers. The findings come from a large-scale study by Heuckendorff et al of 750,379 children born in Denmark from 2010 to 2011. The authors examined associations between children who were diagnosed with functional gastrointestinal disorders and their parents' mental health conditions.9
Figures: istockphoto
| Acta Paediatrica. 2022;111:1838–1839. wileyonlinelibrary.com/journal/apa
nr. 40 (3) 2022 169
DOI: 10.1111/apa.16545
Nakagawa et al. studied whether or not sleeping patterns in early infancy could predict poor development.1 The sleep and awake patterns of 35 Japanese infants were evaluated by recording them at home, using actigraphy. In addition, the mothers reported how well they crawled at 12 months of age, which is an indicator of good sensory motor development in infancy. The study indicated that short fragmented sleep in early infancy did not need to predict poor development. Another paper, by Drozd et al., summarised a number of reviews on the prevention and treatment of sleep problems in infants up to 1 year of age. 2


Morag et al. studied 50 infants exposed to masked adults during the COVID-19 pandemic.3 They found that longer exposure, of 2–9 hours a day, in the first year of life resulted in a lower expressive vocabulary than shorter exposure of 0–1 hour a day.3 Meanwhile, Taskila et al. report that children born very preterm, at less than 32 weeks of gestation, had more difficulties with receptive language abilities and word reading at 9 years of age than term-born children.4 The study also showed that foetal growth restriction and early neonatal morbidities were both associated with language difficulties.
The World Health Organization has listed honey as a potential treatment for coughs, but there is little evidence to support its use for coughs associated with upper respiratory tract infections (URTIs). Nishimura et al. conducted a multicentre, randomised study that focused on 161 patients aged 1–5 years with URTIs, who had been coughing for up
170 nr. 40 (3) 2022
to 7 days.5 They found no differences in the children's cough symptom scores and sleep quality when honey or a honey-flavoured placebo were used for 2 consecutive nights.


Liu et al. carried out a Swedish population-based cohort study of 1.47 million individuals to compare the academic performances of children with and without type 1 diabetes, attention deficit hyperactivity disorder (ADHD) or both. Children with these conditions were less likely to go to university, and their school performances were inferior to their peers.6 ADHD was the major contributor. The observations remained significant after adjusting for other common childhoodonset psychiatric and somatic comorbidities and familial factors.
It is challenging to diagnose children with unexplained fever. Nygaard et al. evaluated the use of positron emission tomography/ computed tomography (18FDG-PET/CT) to examine previously healthy children with unexplained fever.7 They found that 18FDG-PET/ CT was able to diagnose, or contribute to the diagnosis of, several diseases, such as tuberculosis and Langerhans cell histiocytosis. The challenges included false-negative results for inflammatory diseases and leukaemia and the inability to differentiate between complicated infections, malignancies and inflammation in cases with focal 18FDG uptake.
Figures 1-4: Istockphoto.com, 5: Nygaard et al7
Acta Paediatrica. 2022;111:2052–2053. wileyonlinelibrary.com/journal/apa
Revmatoid artritt: Voksne med revmatoid artritt (RA) i kombinasjon med metotreksat hos de som ikke oppnår tilstrekkelig effekt med metotreksat alene.
Autoinflammatoriske periodiske febersyndromer hos voksne, ungdom, barn og spedbarn (≥8 måneder med kroppsvekt ≥10 kg):
• Cryopyrinassosierte periodiske syndromer (CAPS) inkl. NOMID/CINCA , MWS og FCAS.
• Familiær middelhavsfeber (FMF), hvis hensiktsmessig i kombinasjon med kolkisin.
Stills sykdom: systemisk juvenil idiopatisk artritt (sJIA) og Stills sykdom i voksen alder (AOSD), med aktive systemiske trekk av moderat til høy sykdomsaktivitet, eller ved fortsatt sykdomsaktivitet etter behandling med NSAID eller glukokortikoider. Kan gis som monoterapi eller i kombinasjon med andre antiinflammatoriske legemidler og DMARD.
RA: Voksne inkl. eldre: Anbefalt dose er 100 mg 1 gang daglig
CAPS: Voksne inkl. eldre, ungdom og barn ≥8 måneder og ≥10 kg: Anbe falt startdose 1 2 mg/kg/dag.
FMF og Stills sykdom: Anbefalt dose 100 mg/dag ved kroppsvekt ≥50 kg. Ved kroppsvekt <50 kg justeres dosen etter kroppsvekt med startdose 1-2 mg/kg/dag. Hos barn med utilstrekkelig respons kan dosen økes opptil 4 mg/kg/dag.
Kineret skal gis subkutant i daglige injeksjoner.
Varenummer Styrke Pakning Pris/AUP Refusjon R.gr
418642 100 mg/0,67 ml 7 x 0,67 ml (ferdigfylt sprøyte) 2682,20 H-resept C
Rabattert pris; Kineret er med på LIS-anbud TNF-Bio 2006a
Swedish Orphan Biovitrum AS Dronning Eufemias gate 16, 0191 Oslo Tlf.: 66 82 34 00 mail.no@sobi.com www.sobi.no

Utvalgte advarsler og forsiktighetsregler
Skal ikke initieres ved nøytropeni
Skal ikke initieres ved aktive infeksjoner
Makrofagaktiveringssyndrom (MAS) kan oppstå ved Stills sykdom. MAS er sett hos pasienter med Stills som er behandlet med anakinra, årsakssammenheng er ikke fastslått
Samtidig behandling med TNF-α-antagonister anbefales ikke pga. økt risiko for alvorlige infeksjoner.
Legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS) er rapportert i sjeldne tilfeller, hovedsakelig hos SJIA pasienter.
Utvalgte bivirkninger Svært vanlig bivirkninger er reaksjon på injeksjonsstedet og hodepine. Vanlige: Nøytropeni, trombocytopeni og alvorlige infeksjoner.
For fullstendig oversikt over bivirkninger og forsiktighetsregler: se godkjent SPC på www.felleskatalogen.no
Håndtering av vanlige injeksjonsrelaterte bivirkninger For å unngå ubehag på injeksjonsstedet bør injeksjonssted varieres. Reaksjoner på injeksjonsstedet kan lindres ved nedkjøling av injeksjonssted før og etter injeksjon, romtemperering av injeksjonsvæske, og bruk av topiske glukokortikoider og antihistaminer etter injeksjon.
Reaksjoner på injeksjonsstedet fremkommer typisk innen de første 2 ukene av behandlingen og forsvinner innen 4–6 uker.
For mer informasjon: se www.felleskatalogen.no
eller scan QR-koden/ gå inn på www.kineret.no

Referanser: 1.Kineret SmPC. 2. Dinarello CA, et al. Nat Rev Drug Discov. 2012;11:633–652.
Figure: Adapted from McGonagle & McDermott, PLoS Medicine. 2006; 1245:1244, 1-20; Figure 1
Lindrer luftveissymptomer og reduserer luftveisinfeksjoner 1-2
Fremmer de gunstige bakteriene og reduserer de ugunstige. 3
Prebiotisk effekt med HMO 3-4
Bidrar til modningen av immunforsvaret. 5-6


Høsten 2022 lanseres Alfamino® Junior; aminosyrebasert spesialnæring tilpasset barn over 1 år. Alfamino® Junior inneholder HMO* som er gunstig blant annet for immunforsvaret og tarmfloraen til barnet. 2,4-6 *2’-fukosyllaktose (2’FL) og Lakto-N-neotetraose (LNnT) ikke fra morsmelk
Fremmer en adekvat tilvekst 7-8
Viktig informasjon: Alfamino® Junior er et næringsmiddel til spesielle medisinske formål til ernæringsmæssig kostholdsbehandling av alvorlig kumelkproteinallergi og/eller multiple matallergi og/eller malabsorption. Alfamino® Junior er ernæringsmessigt fullverdig og egnet som eneste kilde til ernæring. Brukes under medisinsk tilsyn.
Referanser: 1. Nowak-Węgrzyn A, et al. Clin Pediatr (Phila) 2015;54:264-72. 2. Vandenplas Y, et al. Nutrients. 2022 Jan 26;14(3):530. 3. Gold MS, et al. Nutrients. 2022 May 30;14(11):2297. 4. Berger B, et al. mBio. 2020 Mar 17;11(2):e03196-19. 5. Bode L. Glycobiology 2012:22(9):1147-62. 6. Plaza-Diaz J, et al. Nutrients, 2018. 10: p. 1038. 7. Vandenplas Y, et al. Abstract presented at ESPGHAN, Glasgow, 2019. 8. Corkins M, et al. Clin Med Insights Pediatr 2016;10:3–9.
Nestlé Health Science Postboks 683, Skøyen, 0214 Oslo www.nestlehealthscience.no