
48 minute read
SPRING GENETICS. Innovando la crianza sostenible en la acuicultura, mediante el más avanzado programa de cría y mejoramiento genético para tilapia en el mundo
Innovando la crianza sostenible en la acuicultura, mediante el más avanzado programa de cría y mejoramiento genético para tilapia en el mundo.
Spring Genetics es una empresa dedicada al mejoramiento genético de la Tilapia del Nilo, que apoya el desarrollo sostenible de la acuicultura global. Nuestro programa pretende mejorar las características comerciales más relevantes, como tasa de crecimiento, conversión alimenticia, resistencia a enfermedades, rendimiento de filete y rusticidad. Este programa está diseñado y supervisado por nuestra empresa hermana Akvaforsk Genetics. Nuestros genetistas son pioneros en el desarrollo de programas genéticos para la industria de la acuicultura, con experiencia en programas genéticos en todo el mundo.
Nuestro compromiso: Entregamos la mejor selección en stocks actualizados de reproductores para producir alevines y juve-

niles de alto desempeño. Estamos comprometidos a continuar nuestro trabajo líder en genética de tilapia, enfocado en rápido crecimiento, mayor supervivencia, máximo rendimiento en filete, Tasa Rendimiento Alimenticia (FCR) más eficiente, y resistencia a Strepcococcus agalactiae y Streptococcus ineae.
Conocimiento global para la mejora local: Al adquirir la genética de Spring Genetics, usted también accede a la experiencia, la tecnología y el conocimiento acumulados por Benchmark Genetics en todo el mundo. Benchmark Genetics es líder mundial en servicios de reproducción para diferentes especies de importancia acuícola en todo el mundo y ofrece una amplia gama de productos y servicios para la industria de la acuicultura
Genética: Amplio equipo internacional de expertos en selección genética y genómica con experiencia en programas genéticos de alto nivel, como el salmón atlántico en Noruega. Tecnología: Pionero en la selección de tolerancia a enfermedades, el programa Spring Genetics es uno de los más modernos del mundo, y utilizando tecnología de punta en selección genética obtenemos una selección más precisa para un desarrollo más eficiente.
Bioseguridad: Trabajamos con los más rigurosos programas de bioseguridad y vigilancia sanitaria en todas nuestras unidades de producción para ofrecer a nuestros clientes la mejor calidad de producto libre de patógenos.
Avances: Resistencia a S. agalatiae y S. ineae “Streptococcus iniae y S. agalactiae son dos importantes bacterias que afectan de manera grave la producción mundial de tilapia nilótica. Desde 2014, Spring Genetics ha sido pionera en los programas de mejora genética al implementar selección para sobrevivencia a ambos patógenos, esto ha sido posible gracias a pruebas de desa-
fío controlados que se realizan a hermanos y medios hermanos de peces candidatos en el núcleo genético. En un esfuerzo para implementar nuevas tecnologías que permitan una selección más precisa, Spring Genetics junto con Akvaforsk Genetics, realizaron estudios de asociación genómica para ambas variedades de Streptococcus, para estos estudios se han utilizado técnicas de biología molecular que reducen la complejidad del genoma conocidas como secuenciación de fragmentos aleatorios de doble digestión o ddRAD. Como resultado de este estudio, Spring Genetics implementará métodos de selección asistida por marcadores genéticos que le permitirán obtener valores de cría individuales y más precisos para ayudar a mejorar el desempeño de las tilapias de Spring Genetics” – Sergio Vela Avitúa, MSC, DVM. Asesor Científico Akvaforsk Genetics.
“Los trabajos de selección de resistencia a S. iniae y S. agalactiae, representan hitos importantes para el trabajo genético en tilapias. Estos trabajos serán continuados en la búsqueda de información sobre marcadores genéticos y allanarán el camino para la selección de anima-

les asistida por marcadores de estas características” – Dr. Morten Rye. Genetics.
PAM
Director div. Genética y Akvaforsk


El arte de delegar
Hay personas que piensan que nadie es capaz de realizar las cosas mejor que ellas y por lo general terminan haciendo todo, representando así un cuello de botella para la empresa, pues retardan algunas actividades o las van dejando de lado. Suscríbete

Salvador Meza*
Delegar es ceder la res- Delegar es un arte, y como tal, - Se revelan nuevas formas de hacer ponsabilidad de ciertas requiere de práctica, no depende de las cosas, que muchas veces pueden tareas a otras personas y habilidades innatas, sino de integrar resultar mejores de como se venían permitir que las realicen la delegación de tareas como parte haciendo. a su manera, obteniendo los mismos del estilo de liderazgo. Se debe o mejores resultados. delegar siempre, no cuando hay una - El líder obtiene tiempo para enfo-
Cuando el líder tiene las habili- crisis o un exceso de trabajo, más carse a situaciones o tareas que dades necesarias para asociar a su bien como una actividad regular añaden valor y hacen crecer a la equipo a las personas correctas, las dentro del proceso de desarrollo del empresa. que tienen o pueden desarrollar las equipo de colaboradores. habilidades para resolver las tareas Factores que impiden delegar que se les van a encomendar, obtie- Beneficios de delegar: tareas: ne una gran libertad para dedicarse Cuando la delegación y el reparto Hay algunas ideas, prejuicios y miea las actividades donde realmente de tareas y actividades es la práctica dos que impiden al líder delegar puede aportar mayor valor. De otra común en la administración de la funciones a sus colaboradores y forma, sin delegar, estará siempre empresa, se obtienen tres beneficios limitan su capacidad de gestión, son atado al desarrollo de las mismas tareas de siempre y no podrá hacer simultáneos: - Se desarrollan capacidades en el los siguientes: - “Si delego, no lo harán bien”. suscripciones@panoramaacuicola.com crecer la empresa nunca. personal de la empresa. Aquí hay que distinguir si esta
www.panoramaacuicola.com
idea se refiere a que; ¿no lo harán bien, o no lo harán como el líder lo hace? Cada persona tiene una forma particular de desarrollar un trabajo o una tarea, hay que tener la confianza en que los resultados van a ser iguales o mejores.
-“¿Y si lo hacen mejor que yo?”. Hay que tenerse confianza en sí mismo. Claro que puede haber personas que realicen mejor que nosotros determinados trabajos y tareas, esto sería un gran beneficio para la empresa, pero el trabajo de líder va más allá de hacer una o dos tareas, tiene más que ver con la visión general del departamento o de la gerencia en la que trabaja.
- “Si desarrollo a los colaboradores de mi equipo, cuando sepan más buscarán otro empleo” Si no hay forma de crecer en la empresa, esto puede ser verdad, pero al final es mejor trabajar con personas que se desafían a sí mismas constantemente y que tienen iniciativas propias y que están dispuestos a asumir nuevos retos, con el riesgo de que se vayan en algún momento, en lugar a empleados inmaduros, desmotivados que dependen del jefe para todo, y que pueden quedarse para siempre.
Pasos para delegar: 1.- Perder el miedo a delegar. Desactivar los hábitos del trabajo que puedan ser un obstáculo y activar otros que resulten potenciadores.
2.- Decidir qué delegar. Identificar en donde el líder aporta más valor a la empresa para hacerla crecer, y delegar todo lo demás.
3.- Decidir a quién delegar. Identificar a los colaboradores adecuados para cada tarea o trabajo.
4.- Explicar bien en qué consiste la tarea. Ser específico, establecer cómo se medirá el desempeño, cómo la tarea está ligada a los objetivos de la empresa, presupuesto, personas con las que se puede colaborar, nivel de autonomía y libertad para la toma de decisiones. 5.- Hacer seguimiento y apoyar. Establecer algún método para la supervisión que permita obtener retroalimentación sobre resultados en función de objetivos y basado en tiempos y fechas.
Recomendaciones para delegar eficazmente: - Enfocarse en los resultados, no en cómo se obtienen.
- Delegar la responsabilidad y otorgar autoridad. Se tiene que aprender de los errores, estos son oportunidades de crecimiento y mejora.
- Dejar que la tarea sea terminada por la persona a la que se le ha asignado. Si hay problemas, hay que apoyar, pero no retomar la tarea. PAM
Salvador Meza es Editor & Publisher de Panorama Acuícola Magazine y de Aquaculture Magazine.

Efecto de la dieta y frecuencia alimenticia sobre crecimiento, supervivencia y coloración de juveniles de pez payaso marrón (Premnas biaculeatus)
Por: Velasco Blanco1, G., N. Hernández López1, M.I. Abdo de la Parra1, L.E. Rodríguez Ibarra1
El comercio de peces marinos de ornato en el mundo está creciendo rápidamente, las diferentes especies de pez payaso, son de los organismos marinos más demandados en la acuariofilia (Wittenrich, 2007), por lo que su colecta en los arrecifes ha aumentado y las poblaciones en el medio natural se han reducido; de allí la importancia de reproducirlos en cautiverio (Lango et al., 2012).
En el Centro de Investigación en Alimentación y Desarrollo (CIAD) de Mazatlán, Sinaloa, se comenzó suscripciones@panoramaacuicola.com a trabajar con peces payaso desde Imagen 1.- Premnas biaculeatus (Pez payaso marrón). http://fishesofaustralia.net.au/images/thumbnailimage/PremnasAndyALewis.jpg el 2010, con el género Amphiprion, sin embargo, desde hace dos años www.panoramaacuicola.com se trabaja con Premnas biaculeatus, pez payaso marrón (Imagen 1), el cual es el único pez payaso que no forma parte del género Amphiprion y cuenta con una sola especie que se distribuye en el Indo-Pacífico (Madhu et al., 2012).
Es una especie sumamente territorial. Uno de los problemas a resolver durante su cultivo, es la alta mortalidad ocasionada por peleas debido a la agresividad de la especie, por lo que se probaron frecuencias alimenticias en juveniles de 1.32 Figura 1.- Porcentaje de supervivencia experimento frecuencia alimenticia. g y 3.87 cm, en promedio, con la finalidad de encontrar la frecuencia adecuada para reducir la agresividad y mejorar su crecimiento, desarrollo y supervivencia.
Se probaron 4 tratamientos por triplicado en peceras de 20 L, colocando 20 organismos por pecera, los cuales consistieron en alimentar una, dos, tres y cuatro veces por día ad libitum. Las peceras contaban con un sistema de flujo abierto de agua de mar, filtrada y pasada por luz ultravioleta (Imagen 2), diariamente Figura 2.- Crecimiento en los tratamientos de frecuencia alimenticia.


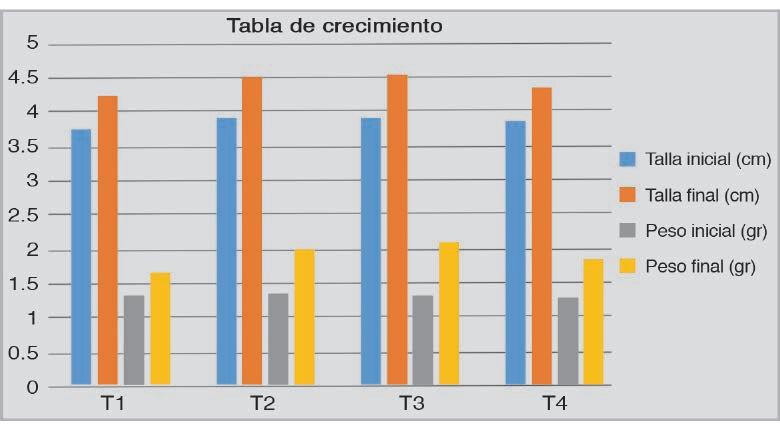
Imagen 2.- Sistema de peceras.


A
B

Imagen 3.- Coloración, peces alimentados con: A) Skretting, B) Otohime
se midió la salinidad y la temperatura, el experimento duro 6 semanas, las biometrías se realizaron cada dos semanas. Después de encontrar la frecuencia apropiada se probaron dos dietas comerciales (Skretting y Otohime) para encontrar la más adecuada para esta especie, alimentando tres veces al día ad libitum, peces payaso marrón, en peceras de 20 litros con 20 organismos cada una, por duplicado, durante 6 semanas.
Aunque en el tratamiento 4 del experimento de frecuencia alimenticia, se observó una mayor supervivencia y menos daños en aletas por peleas, no se encontraron diferencias significativas en la supervivencia (Figura 1), ni en el crecimiento (Figura 2), de los peces, entre los tratamientos.
Al probar las dos dietas comerciales, no se encontraron diferencias en crecimiento y supervivencia, pero si en coloración (Imagen 3).
Tanto Skretting como Otohime son dietas adecuadas para peces marinos, pero al ser el pez payaso marrón, un pez ornamental, lo que se desea es tener coloraciones vivas que llamen la atención, por lo que alimentar con Otohime dio buen resultado para mejorar la coloración con tonos de un naranja más intenso, además con esta especie se sugiere alimentar por lo menos 3 veces por día, para así tratar de disminuir la agresividad de estos peces en cautiverio.
PAM
1 Centro de Investigación en Alimentación y Desarrollo, A.C. Unidad Mazatlán. Mazatlán, Sinaloa, México. Fax (669) 9-89-87-01. Correo electrónico: gvelas@ciad.mx

Vacunación en tilapia mexicana, como uno de los detonantes de la producción sustentable en México, para la sustitución de productos asiáticos.
Si volteamos o analizamos otras industrias de producción animal (cerdo, pollo, res, etc.), la de la tilapia está prácticamente en el rezago en cuanto al empleo de técnicas en salud animal, por diferentes causas como: desconocimiento del productor, paradigmas, restricciones y desconocimiento de las instituciones de gobierno o la poca voluntad de estas hacia la industria de la tilapia.
Por: Juan Loustaunau Rodelo*
En México tenemos un gran desafío, la FAO visualiza que para el 2030 importaremos 56% más de pescado y que solo vamos a producir 42% más. Aunado a esto, se calcula que actualmente importamos lo equivalente a 300 mil toneladas de biomasa entre tilapia y pangasius, y en producción de tilapia (en deducción empírica entre los datos que algunos estados del país inflan y otros que no reportan, y consumos de alimento balanceado), estaremos cerca de producir 70 mil toneladas de tilapia de acuicultura y pesca en embalses en el 2018, si solo obtuviéramos una tercera parte del mercado de lo que importamos, produciríamos más del doble de lo actual; pero ¿cómo llegar a esa producción?
A través del Consejo Empresarial de la Tilapia Mexicana (CETMX) se han marcado líneas de acción a seguir para que la tilapia mexicana gane terreno en el mercado local a los pescados importados, combatiendo desde el punto de vista legal, regulatorio y técnico, donde existe una sinergia entre la seguridad alimentaria que busca el

nuevo gobierno con lo que pretende el CETMX; pronto se presentará esta iniciativa al nuevo gobierno. Otro de los grandes impulsores es el Consejo Mexicano de Promoción de los Productos de Pesca y Acuicultura (COMEPESCA) a través de su programa #PescaconFuturo, donde se distinguen los productos que se obtienen de forma sustentable para el consumidor, lo que ha permitido que la tilapia mexicana gane mercado. Pero aun así hay bastante por hacer en producción Suscríbete para tener mayor asertividad en el mercado y volumen.
Regularmente, en los foros de acuicultura o reuniones de productores nos preguntamos ¿qué necesitamos para hacer crecer la producción de tilapia en México? y así combatir la tilapia y pangasius asiáticos que entran a nuestro país y toda Latinoamérica. Hay varias respuestas muy puntuales, desde la perspectiva del proceso que le una de sus fortalezas en estos (cerdo, pollo, res, etc.), la de la damos al producto, la mercadotec- años de consolidación ha sido la tilapia está prácticamente en el nia y la parte técnica-eficiencia; en implementación de vacunas para rezago en cuanto al empleo de téceste escrito me permitiré escribir diferentes males que dañan a la nicas en salud animal, por diferenmi perspectiva de la última parte. industria y por ende la reducción tes causas como: desconocimiento
Lo importante sería, cómo cre- significativa del uso de antibióticos del productor, paradigmas, restriccer nuestra producción de una (más sustentables y asegurar ino- ciones y desconocimiento de las forma diferenciada a lo que se cuidad al consumidor final). instituciones de gobierno o la poca crítica de la producción asiática, la respuesta sería hacerlo desde un Escuchando pláticas de productores en Noruega, ellos no concivoluntad de estas hacia la industria de la tilapia.suscripciones@panoramaacuicola.com principio de una forma sustentable ben la industria del salmón sin la e inocua. Estoy convencido que el vacunar nuestra tilapia, contra vacunación, se habla de grandes eficiencias en sus costos (hasta Instituciones del gobierno ante la producción de tilapia y www.panoramaacuicola.com las bacterias puntuales que nos 30%) e incremento de produccio- marcos normativos estén atacando en nuestro sitio nos nes (Figura 1), aparte del sobre- El nuevo gobierno ha marcado permitirá incrementar nuestra pro- precio por la mercadotecnia de ser como una de sus prioridades la ducción a menor costo del actual y salmón noruego por sus BPA con seguridad alimentaria, en mi opide una forma sostenible, que nos las que trabajan. nión esta se debe dar de forma dará tres oportunidades al vender: Si volteamos o analizamos otras ordenada y autosuficiente como ofrecer un producto sustentable, industrias de producción animal país, donde el mexicano tenga garantizar el abasto con mayores volúmenes y ser más competitivos en costos, y por ende, mayor rentabilidad al productor. Por lo tanto, este esfuerzo extra de vacunar en el proceso de producción y en el capital de trabajo, se verá traducido en el resultado final del negocio y producción del país.

Uso de vacunas en otras industrias Una de las grandes industrias más consolidadas e innovadoras en la acuicultura es sin duda la del salmón, donde la mejora continua en sus procesos, automatización y salud animal están en constantes desafíos como campos de oportunidad para ser mejores, y

acceso a proteínas de gran calidad y que por salud se puedan consumir de forma continua, pero también a un precio accesible. En este caso es el pescado en general, pero debe ser un pescado que su producción pueda ser de forma sostenible, a gran escala e inocua, siendo el pez ideal la tilapia mexicana (mojarra mexicana).
Al impulsar la tilapia de una forma eficiente (regularmente no ha sido así), el nuevo gobierno “matará cuatro pájaros de un tiro”: asegura la seguridad alimentaria, impulsa la economía interna al generar más empleos en el país de forma integral en toda la cadena de la industria, mejora el acceso a proteínas sanas y desarrolla las comunidades rurales, ya que esta acuicultura puede hacerse de manera industrial o en pequeño. Pero, ¿qué se necesita hacer para que esto se dé, y no quede en un plan más?
Una de las cosas que debe hacer el nuevo gobierno es dar condiciones normativas y legales a la acuicultura: sanitarias a las importaciones, regulaciones esenciales a las producciones actuales en el país, tarifas especiales y legalidad clara a los acuicultores en uso de agua y electricidad, normatividad y sentido de urgencia para las vacunas, nuevos aranceles y condiciones a las importaciones. Para que esto se dé, debe haber una meta clara y la voluntad de los nuevos funcionarios o priorizarles a los que se queden trabajando en las instituciones correspondientes, todo esto impulsado por los funcionarios de alto nivel de la Secretaría de Agricultura y Desarrollo Rural (antes SAGARPA, ahora SADER) y la Comisión Nacional de Pesca y Acuacultura (CONAPESCA). Donde debe existir la voluntad, priorizando el bien del país, y no el de hacer política o solo “nadar de muertito” por seis años percibiendo un sueldo.
El dar las condiciones a la industria es más útil que el darles apoyos económicos a los productores, porque si existen las condiciones, los apoyos serán más asertivos y se traducirán en el aumento de la producción de tilapia en México, de otra forma será dinero mal aplicado.
Figura 2- Gráfica realizada por Acuícola Gemso-Sonora-JALR 2018

Como se mencionó anteriormente el uso de las vacunas va a ser sin duda lo que genere el aumento exponencial de la producción de tilapia de forma sustentable y sostenible en el tiempo. Pero, ¿cómo estamos actualmente en este tema en el país?: 1. Solo existe una licencia para una marca de vacunas y para una sola bacteria de un tipo. Lo bueno es que es la bacteria que más está afectando la tilapia en el país.
2. El promedio para dar los permisos por parte del Servicio Nacional
Estoy convencido que el vacunar nuestra tilapia, contra las bacterias puntuales que nos estén atacando en nuestro sitio nos permitirá incrementar nuestra producción a menor costo del actual y de una forma sostenible.

de Sanidad, Inocuidad y Calidad Agroalimentaria (SENASICA) a una vacuna tarda alrededor de dos años. Cuando ya se autorizó, la bacteria pudo ya haber mutado Suscríbete o estar ya otra nueva atacando la industria.
3. No existe un marco normativo para autovacunas en México. 4. En reuniones de SENASICA con productores de tilapia, SENASICA se ha manifestado en contra del uso de vacunas, creyendo que las BPA son suficientes para industrializar la tilapia.

¿Qué implica lo anterior?: 1. Que no exista el interés de los laboratorios potenciales en desarrollo de vacunas en el país para la tilapia, donde estos mismos laboratorios en caso de existir las condiciones invertirían más de lo que ya lo hacen en capacitación suscripciones@panoramaacuicola.com de los productores e investigación para potencializar las produccio nes a través de las vacunas, eviwww.panoramaacuicola.com tando perdidas costosas y ser más eficientes en costos.
2. Hace que los cultivos sean menos sostenibles al incrementar el uso de antibióticos en la tilapia, donde la bacteria se hace resistente al antibiótico.
3. Evita que exista una competencia entre laboratorios en tratar de ser mejores en precio y servicio de sus vacunas, y que los productores se enteren de sus bondades.
4. Evita que seamos competentes comparado con otros países y no tengamos acceso a uno de los factores que puede potencializar la producción en México de forma eficiente y sostenible como lo son las vacunas.
El que las condiciones actuales estén así, no indica que así debe de ser, por lo que seguiremos insistiendo ante las nuevas autoridades, para que el tema de vacunación se realice de una forma
Uno de los desafíos es también hacer ver al productor el beneficio del uso de vacunas, ya que de entrada puede parecer un alto gasto, por lo que es importante la capacitación, beneficios de meter las vacunaciones como parte de las BPA y sobre todo el que permitirá incrementar la producción a un costo menor final por kg. contra el kg. no vacunado.

ordenada, existan las normas para principalmente en tilapia mayor estar dentro del marco legal, pero con los tiempos que necesita la industria y no los funcionarios. de 150 gr. con temperaturas arriba de 29 grados centígrados debido a la bacteria Streptococcus tipo 1b Suscríbete y ahora 1a en algunas zonas del Productores ante este desafío país. El cambio climático también El primer paso del productor siem- está atacando con frentes fríos pre debe ser detectar donde radi- repentinos que causan inversiones can los problemas para poder ser térmicas agresivas en los embalses eficientes, formando una estra- y bajas temperaturas en estanques, tegia, implementar y controlar. que hace que un animal débil a Viéndolo desde este esquema causa de venir de situaciones de necesitamos saber qué bacteria estrés por causa de una bacteria, es la que ataca en el cultivo, por- existan mortalidades grandes, todo centaje y en qué temporada del lo anterior expuesto, se traduce año. Esto se hace con los análisis en pérdidas millonarias y en no continuos de bacterias en nuestra poder salir del estancamiento de granja, a través de los comités de producción y costos, y nos quesanidad acuícola y/o enviando de damos viendo cómo el mercado forma directa a laboratorios espe- de pescado importado sigue, sin cializados. Teniendo los resulta- poder hacer nada. dos, podemos hacer un análisis, La estacionalidad del para estar en posición de hacer una estrategia de vacunación para ficio del uso de vacunas, ya que Streptococcus está muy marcada, cómo ataca en cuanto sube la tem-suscripciones@panoramaacuicola.com los peces. En el caso propio lo de entrada puede parecer un alto peratura arriba de los 29 grados hicimos para Streptococcus agalactiae 1b, ya que salió predomigasto, por lo que es importante la capacitación, beneficios de meter centígrados en el agua y cómo beneficia cuando esta baja a 28 www.panoramaacuicola.com nante en nuestros estudios. Pero las vacunaciones como parte de grados centígrados o menos. En supongamos que hubiera sido las BPA y sobre todo el que per- cuanto sube de 29 °C el agua, a Streptococcus 1a la predominante, mitirá incrementar la producción a la 6ª semana de temperaturas altas tendría que haber sido con una un costo menor final por kg. con- continuas, los FCA empiezan a vacuna para este tipo, para la cual tra el kg. no vacunado. subir, duran 12 semanas los FCA actualmente no hay licencias en el El productor mexicano los últi- altos (en el caso de Sonora) y país, sin embargo, si hay en trámi- mos tres años ha sufrido ante los después de haber bajado la temte; este tipo de Streptococcus está cambios climáticos, impactando peratura de 29 grados centígrados afectando seriamente a los pro- con más días de altas temperaturas en el agua, cuando transcurren 6 ductores en Chiapas, sin acceso a en el agua, comparado con otros semanas empieza a bajar los FCA una vacuna. Haciendo un análisis años, esto ha permitido que las de nuevo (Figura 2). a los resultados nos aseguramos bacterias sean más agresivas y su ¿Cómo se traduce esto?: en que de que nuestra inversión en vacu- tiempo de ataque hacia los peces el S. agalactiae 1b ataca en los nas tendrá un efecto positivo en el sea más prolongado, ocasionando peces que son engordados arriba resultado final del negocio. 12 semanas promedio de condicio- de los 150 gr. con temperaturas
Uno de los desafíos es también nes que pueden hacer que los FCA arriba de los 29 °C y tendrán un hacer ver al productor el bene- suban, causado por mortalidades FCA muy alto al no ser vacuna-

dos con poca producción, y los peces por debajo de los 150 gr. Con la temperatura arriba de 29 °C tendrán mejor FCA, ya que se engordarán arriba de 150 gr. con temperaturas por debajo de los 29 °C. Sin embargo, la única forma de ser eficientes todo el año, es con el uso de la vacuna, si no serían ineficientes una tercera parte del año, y en lugares con climas más templados o tropicales con temperaturas en el agua más prolongadas en tiempo por arriba de los 29°C, el efecto podría ser peor.
Cuando las jaulas se vacunan para cosecha entre las 12 semanas donde es más agresiva la bacteria, y el desmarque entre vacunar y no, es mucho más amplio, tenemos los siguientes resultados de diferencia a favor de las jaulas vacunadas:
Como se puede observar el productor podría obtener un 44% más de producción con una eficiencia del 28% mejor por kilogramo cosechado – esto comparado contra jaulas no vacunadas en la época del año con mayor agresividad del Streptococcus-. Esta claramente demostrado que el futuro de esta industria para la mayor producción es vacunando.
Una de las soluciones respecto a la normatividad y licencias, para un camino más fácil es hacer autovacunas en sitio, ya hay granjas de maricultura que lo hacen, pero esto generaría una preocupación extra a los productores, los cuales deben estar enfocados en la engorda eficiente de su tilapia y obtener vacunas con el mayor estándar de calidad, sin embargo, al final puede ser una alternativa.
En conclusión, asegurando la producción con volumen, con costos eficientes y de manera sostenible, nuestra forma de mercadear se debe ir facilitando. Y nuestra mercadotecnia la podemos hacer a través de la sostenibilidad del producto y asegurar el no uso de antibióticos, con un sello muy distintivo frente al producto asiático y con abasto asegurado para ir sustituyendo porcentajes del pescado importado por el nacional. Existen más temas relacionados para que se dé esta sustitución, pero la vacuna es un tema medular para que esto suceda. ¿Quiénes se deben de encargar de esto?, la Madre Teresa de Calcuta decía: “Yo hago lo que tú no puedes, tú haces lo que yo no puedo, juntos hacemos grandes cosas”; esto me dice que unidos como equipo, los productores, gobierno y proveedores, buscando como bien común la industria de la tilapia y los beneficios que puede traer al país, debemos trabajar en forma coordinada, con voluntad, con un orden y bajo las leyes que nos rigen, pero sin descuidar los tiempos que la industria requiere.
PAM
*Ingeniero Industrial, GEMSO, Agronegocios Contacto: juan.loustaunau@acuicolagemso.com


Trucha arcoiris (Oncorhynchus mykiss).
Mejorando la cría de truchas en Perú con el Internet de las Cosas
Un proyecto de USD$2 millones mejorará la productividad y los ingresos de acuicultores en el lago Titicaca en Perú preservando la sostenibilidad.
El laboratorio de innovación del Grupo del Banco Interamericano de Desarrollo (BID), financiará un proyecto para mejorar la productividad de la acuicultura en el Lago Titicaca. El proyecto tendrá un financiamiento de más de USD$2 millones, lo cual permitirá que pequeños y medianos productores acuícolas incorporen los beneficios del Internet de las Cosas (IoT) en la cría de truchas arco iris (Oncorhynchus mykiss).
El proyecto será llevado a cabo por la Cooperativa de Ahorro y Crédito Abaco, las actividades específicas relacionadas con la acuicultura se implementarán a través de su subsidiaria: Piscifactorias de los Andes (Piscis), una empresa de procesamiento y cría de truchas arcoiris que opera en el área, en colaboración con Umitron, una empresa de tecnología para la acuicultura con sede en Singapur y Tokio que será el proveedor de la tecnología.
El mayor problema para los acuicultores en los últimos años es, que los precios de los ingredientes del alimento se han triplicado, lo cual genera costos de alimentación de hasta el 70% de la producción total. Por lo cual resulta sumamente importante lograr tener un equilibrio adecuado del suministro de alimento en cantidad y frecuencia.
Uno de los mayores desafíos El mayor problema para los globales actuales es, cómo suminis- acuicultores en los últimos años es, trar suficientes proteínas a países que los precios de los ingredientes emergentes sin causar más daños del alimento se han triplicado, lo ambientales. La Organización cual genera costos de alimentade las Naciones Unidas para la ción de hasta el 70% de la proAgricultura y la Alimentación (FAO, ducción total, además de las difipor sus siglas en inglés) estima que cultades medioambientales. Por lo la producción pesquera a través de cual resulta sumamente importante la acuicultura en América Latina y lograr tener un equilibrio adecuado el Caribe crecerá de 2,7 millones del suministro de alimento en cande toneladas en 2016 a 4,0 millones tidad y frecuencia, además en caso de toneladas en 2030. En el caso de sobrealimentación se genera de Perú, se proyecta que el incre- una baja calidad del agua. mento pasará de 100.000 toneladas Este proyecto pondrá a prueba en 2016 a 221.000 toneladas en una nueva solución tecnológica lla2030, es decir, un crecimiento del 120,9%. A pesar de que la producción mada “Umitron Cell”, la cual introduce y expande las prácticas del IoT y datos de la acuicultura para Suscríbete de la acuicultura continua a la alza, mitigar el riesgo de sobrealimense está quedando atrás en el uso tación, ayudando a mantener una de soluciones tecnológicas para buena calidad del agua, evitando optimizar los insumos y mejorar el riesgo de provocar mareas rojas. su productividad. Esto se debe a La solución tecnológica de que se continúa confiando en la alimentación desarrollada por experiencia y a que no es senci- Umitron, también tiene el potenllo adaptar soluciones tecnológicas cial para reducir el tiempo que los para trabajar en superficies acuáti- acuicultores necesiten pasar en las cas inestables o bajo el agua. jaulas para alimentar y controlar a

Este proyecto pondrá a prueba una nueva solución tecnológica llamada “Umitron Cell”, la cual introduce y expande las prácticas del IoT y datos de la acuicultura para mitigar el riesgo de sobrealimentación, ayudando a mantener una buena calidad del agua, evitando el riesgo de provocar mareas rojas.

Suscríbete
Lago Titicaca, Perú. Foto Emmanuel Dyan (CC by 2.0)

Foto obtenida de www.umitron.com sus peces, pudiendo monitorearlos y alimentarlos a través de forma remota.
El proyecto contempla la capacitación continua para los acuicultores de la región, acopañandolos en el proceso de familiarización y uso de la tecnología. Irene Arias, CEO del Laboratorio BID mencionó: “Estamos entrando en una nueva era para la acuicultura, trayendo nuevas tecnologías como IoT para aumentar los ingresos y la sostenibilidad de los acuicultores. Esperamos que los resultados iniciales del proyecto permitan adaptar Umitron Cell a otras especies de peces e incluso más allá de Perú a otros países de América Latina”.
Por su parte, Masahiko Yamada director general de Umitron dijo: “En nuestras operaciones diarias vemos los desafíos de la acuicultura desde diversas perspectivas: el nivel de tecnología, el suministro de alimentos estable y seguro, y la sostenibilidad económica y ambiental. Esos desafíos requieren una colaboración sin fronteras entre los sectores público y privado. Estamos encantados de comenzar este proyecto con el BID y Abaco para crear un futuro modelo exitoso. Esperamos que esta colaboración, impulsada por la tecnología, fomente la acuicultura sostenible y contribuya a la economía local y a resolver problemas globales”.
Este proyecto, conforma el primer paso en los planes de Umitron para desarrollar y respaldar tecnología para la acuicultura de América Latina.


Microsporidiosis hepatopancreática causada por Enterocytozoon hepatopenaei (EHP) en camarones de cultivo.
En el año 2017, Tang et al. (2017) confirmaron la presencia de EHP en camarones cultivados en Venezuela, lo que sugiere que este patógeno podría estar en diferentes sistemas de cultivo de camarón en otros países de Latinoamérica de tal manera que podría representar un riesgo latente para la producción de camarón en el continente.
Suscríbete
Por: Ing. Alexander Varela-Mejías1, Ing. Nelson Peña-Navarro2, pH.D Luis Fernando Aranguren Caro3 .
Resumen a nuevos territorios. Se presenta patógeno podría estar en diferentes La Microsporidiosis en el hepato- información de este patógeno, sus sistemas de cultivo de camarón en páncreas (MHP) es causada por efectos, diagnóstico y acciones que otros países de Latinoamérica de tal el Enterocytozoon hepatopenaei han sido aplicadas en Asia para su manera que podría representar un (EHP), que se aloja y replica dentro eventual control. riesgo latente para la producción de del citoplasma de las células epi- camarón en el continente. teliales de los túbulos hepatopan- Introducción creáticos. Esta enfermedad ha sido Evitar el ingreso de agentes infec- Agente causal detectada recientemente en el con- ciosos a los centros de producción Esta microsporidiosis en el hepatotinente Americano. MHP se carac- de camarones en América, ha sido páncreas (MHP) es causada por la teriza por retardar el crecimiento un desafío constante y con poco especie E. hepatopenaei, el cual es de los camarones y aumentar su éxito en los últimos años (Nunan et un hongo intracelular del phylum susceptibilidad hacia brotes de otras al., 2014; Tang et al., 2017). Durante Microspora, formador de esporas, enfermedades. En Asia, el EHP tiene la última década se ha reportado la que se aloja y replica dentro del una distribución geográfica reciente presencia en el continente america- citoplasma de las células epiteliales que incluye a China, Indonesia, Malasia, Tailandia y Vietnam. Para el no de diferentes patógenos exóticos, a pesar de implementar sistede los túbulos hepatopancreáticos (Han et al., 2018; Tang et al., 2016; suscripciones@panoramaacuicola.com continente americano, se confirmó mas de vigilancia y de incrementar Tourtip et al., 2009; Wiredu-Boakye en Venezuela. Para el diagnóstico los monitoreos requeridos para el et al., 2018). de EHP los métodos implementados han sido la histopatología, el PCR ingreso de animales, sus productos o sub productos a través de las fronEl EHP ha sido asociado en ocasiones con el llamado síndrome de www.panoramaacuicola.com convencional, PCR en tiempo real, teras (Varela-Mejías y Peña-Navarro, heces blancas (Aldama-Cano et al, la amplificación isotérmica de áci- 2017). 2018; Tang et al., 2016), pero estudos nucleicos, la hibridación in situ Recientemente, han sido publi- dios desarrollados en laboratorio y microscopía electrónica. cados casos positivos de enfer- no han sido capaces de confirmar
Durante los últimos años, el medades infecciosas en América consistentemente una correlación ingreso y establecimiento de pató- para agentes originarios de otras entre el agente y esta patología genos exóticos en los cultivos de regiones, incluyendo la necrosis (Tangprasittipap et al., 2013). Del camarón en América, se ha conver- aguda del hepatopáncreas (AHPND) mismo modo, EHP también ha sido tido en un problema recurrente. El (Nunan et al., 2014) y el nodavi- asociado a camarones que presenconstante movimiento de animales rus de la mortalidad encubierta tan el llamado Síndrome de crecivivos, como reproductores, nau- (CMNV) (Zhang et al., 2017). miento lento en Penaeus monodon, plios y larvas, así como sus produc- Adicionalmente, informes no ofi- cultivado en Asia (Biju et al., 2016), tos y sub productos, representan ciales hacían sospechar de la pre- pero podría tratarse de casos de una ruta de ingreso para nuevos sencia de EHP en América, pero no coinfecciones con otros agentes. agentes infecciosos. Su potencial de fue sino hasta el año 2017 que Tang Estudios realizados sobre el EHP propagación exige, la realización et al. (2017) confirmaron su pre- indican que esta especie, como de monitoreos minuciosos con el sencia en camarones cultivados en otros microsporidios, son incapaces fin de impedir o retardar el ingreso Venezuela, lo que sugiere que este de sintetizar eficientemente el ATP,
En estudios experimentales se logró demostrar que camarones pre-infectados de EHP son más susceptibles a dosis bajas de cepas del Vibrio parahaemolyticus causantes de la necrosis aguda del hepatopáncreas (AHPND). Esto indicaría que el EHP es un factor de riesgo para AHPND y otras posibles enfermedades causadas por patógenos entéricos (Aranguren et al., 2017).
Mediante bioensayos, se ha establecido que el mecanismo de transmisión del EHP, se puede producir en forma horizontal entre camarones (Tangprasittipap et al., 2013), directamente por vía oral (Rajedran et al., 2016), lo que significa que las infecciones pueden propagarse progresivamente a medida que el cultivo se desarrolla.
realizando únicamente el paso de la glucólisis pero sin proseguir con el proceso de la cadena respiratoria, del mismo modo, estos organismos carecen de la capacidad de sintetizar sus nucleótidos, lo que origina una fuerte dependencia energética y nucleotídica sobre las células del hospedero (Dean et al., 2018; Lukes & Husník, 2018; Wiredu-Boakye et al., 2018).
En estudios experimentales se logró demostrar que camarones preinfectados de EHP son más susceptibles a dosis bajas de cepas del V. parahaemolyticus causantes de la necrosis aguda del hepatopáncreas (AHPND). Esto indicaría que el EHP es un factor de riesgo para AHPND y otras posibles enfermedades causadas por patógenos entéricos (Aranguren et al., 2017).
Distribución En Asia, el EHP tiene una distribución geográfica reciente que incluye a China, Indonesia, Malasia, Tailandia y Vietnam (Ha, et al, 2010; Tang, et al., 2015; Rajedran et al. 2016; Sritunyalucksana et al. 2014). No obstante, no se puede descartar que haya estado presente en Malasia desde 1989 y en Australia desde el 1997 donde se reportaron microsporidios de similar morfología afectando células epiteliales en hepatopáncreas (Hudson, et al., 2001; Rajedran et al., 2016). Para el continente americano, se confirmó en Venezuela (Tang et al, 2017) y algunas investigaciones lo ubican en Centroamérica (Su et al, 2017), dato que no han sido confirmado oficialmente.
Especies afectadas Entre las especies susceptibles actualmente reportadas para este agente, se encuentran Penaeus monodon, P. vannamei y se sospecha que también afecta P. japonicus (Tang et al, 2016; Tangprasittipap et al., 2013; Tourtip et al., 2009), sin descartar que su rango se amplíe a otras especies de camarones.
Patogénesis Se han descrito diferentes etapas de desarrollo de este agente, el cual pasa por estadios con plasmodios esporogonales multinucleados, que darán lugar a las esporas (Jaroenlak et al., 2018; Tourtip et al., 2009). La reproducción se da por fisión binaria, las esporas maduras poseen forma oval, sus dimensiones de 0,7 x 1,1 µm, contienen un solo núcleo, presentan una vacuola posterior, un filamento polar con 5 o 6 vueltas, y un disco de anclaje unido a dicho filamento, el cual utilizan para inocular el esporoplasma a las células hospedadoras (Tourtip et al., 2009) y se adhiere al receptor de heparina del


1d

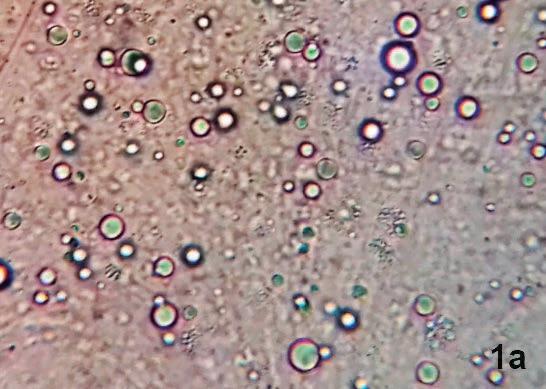
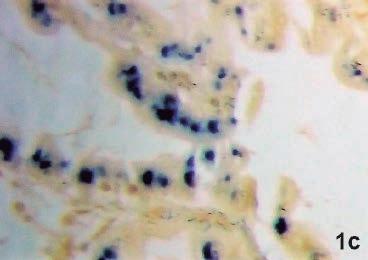
Figura 1. Muestras de hepatopáncreas afectados por EHP. 1a) muestra de tejido en fresco. Se observan esporas entre los restos tisulares. 1b) Sección de hepatopáncreas con tinción de Giemsa. Se observan algunos plasmodios multinucleados (Flecha), de forma irregular, dentro del citoplasma de células epiteliales. 1c) Hibridación in situ con sondas específicas para el EHP en sección de hepatopancreas, la coloración azul-negra denota reacción positiva para EHP en las células infectadas. 1d) Sección con tinción de H&E, con alta carga de esporas, basofílicas, dentro de los citoplasmas, en un P. vannamei. Ninguna de las secciones evidencia respuesta inflamatoria. Las imágenes 1b, 1c y 1d fueron capturadas de la colección de tejidos de la Universidad de Arizona.
camarón mediante la proteína de la Este hecho distintivo lo separa pared celular EhSWP1 (Jaroenlak de las especies de microsporidios et al., 2018). previamente descritas para camaLa espora del EHP es el estadio rones peneidos, los cuales requieinfeccioso, está rodeada por una ren de la presencia de hospederos pared subdividida en exospora y intermediarios, generalmente peces, endospora que le confiere resisten- para su propagación (Lightner, cia a agentes externos (Jaroenlak et al., 2018; Tang el al., 2016; Tourtip et al., 2009). 1996; Morales-Covarrubias, 2010). Esta capacidad de transmisión horizontal entre cohabitantes, impide Suscríbete Mediante bioensayos, se ha esta- su control mediante la exclusión blecido que el mecanismo de trans- de hospedadores intermediarios, misión del EHP, se puede producir estrategia que si ha demostrado en forma horizontal entre camaro- efectividad con otras especies de nes (Tangprasittipap et al., 2013), microsporidios (Cuéllar-Anjel, 2014; directamente por vía oral (Rajedran Morales-Covarrubias, 2010; Lightner, et al., 2016), lo que significa que 1996). las infecciones pueden propagarse progresivamente a medida que el Signos clínicos cultivo se desarrolla. Este hecho es Su principal signo clínico se eviconfirmado por Tang et al. (2016), dencia a nivel de estanque/piscina al provocar infecciones experimen- donde se observa una población suscripciones@panoramaacuicola.com tales mediante alimentación Per-os bimodal, con una dispersión de a camarones saludables con hepatopáncreas que contenían esporas talla grande donde se presentan CV (Coeficientes de variación) mayo-www.panoramaacuicola.com de EHP. También se han realizado res al 20%. Así mismo se puede infecciones a través de la cohabita- observar un bajo crecimiento con ción de camarones infectados con altos FCA (Factores de conversión animales sanos, transmitiéndose a alimenticia). A nivel individual, los través del agua (Salachan et al., camarones afectados presentan sig2017; Jaroenlak et al., 2016; Tang nos clínicos típicos de una infección et al., 2016). crónica incluyendo hepatopáncreas
Su principal signo clínico se evidencia a nivel de estanque/piscina donde se observa una población bimodal, con una dispersión de talla grande donde se presentan CV (Coeficientes de variación) mayores al 20%. Así mismo se puede observar un bajo crecimiento con altos FCA.
La estrategia primordial debe avocarse a impedir o retardar el ingreso del agente. Es imperativo establecer medidas preventivas, basadas en las buenas prácticas de cultivo (Cuéllar-Anjel, 2014).
pálido y atrofiado e intestinos vacíos o con contenidos entrecortados y debilidad (Han et al., 2018; Rajedran et al., 2016; Tang et al., 2015), esta clínica es inespecífica, por lo que carece de valor diagnóstico. Diagnóstico Suscríbete Para el diagnóstico de EHP los métodos implementados han sido la histopatología, el PCR convencional, PCR en tiempo real, la amplificación isotérmica de ácidos nucleicos (LAMP por sus siglas en ingles), la hibridación in situ y microscopía electrónica (Han et al., 2018; Liu et al, 2018; Rajendran et al., 2016; Tang et al., 2015; Tangprasittipap et al., 2013; Tourtip et al., 2009; VarelaMejías, 2018).
Entre los genes del EHP seleccionadas para diseñar los primers, se encuentran los que codifican para la 18SrRNA (Tang et al., 2015), el gen que codifica para la beta-tubulina (Han et al., 2018) y el gen que codi- Adicionalmente, Santhoshkumar como el uso de dietas frescas inclufica para una de las proteínas que conforman la pared de la espora (Su et al. (2016), indican que este hongo genera alteraciones en el hepatopányendo calamar y poliqueto que sean LPE y preferiblemente que proven-suscripciones@panoramaacuicola.com et al., 2017; Jaroenlak et al., 2016). creas de los camarones infectados, gan de zonas donde no exista preEn observaciones de campo, mediante análisis en fresco de tejipor medio de cambios bioquímicos asociados a alanina-transaminasa, la sencia de EHP. Los laboratorios de producción www.panoramaacuicola.com dos usando lente de 100X, han sido aspartato-transaminasa y fosfatasa larval deben intensificar las medidas posible detectar las esporas (Figura alcalina, considerados indicadores de bioseguridad, enfatizando en los 1a), brindando un diagnóstico pre- generales del daño en los tejidos. sistemas de cuarentena y vigilancia suntivo (Pitogo, C. com. personal), Por su parte, Rajendran et al. (2016), zoosanitaria, utilizando siempre anipero se requiere de una carga infec- señalaron la necesidad de realizar males LPE. Todo material que ingretiva alta, para facilitar su detección, más estudios sobre la transmisión, sa al laboratorio debe someterse a se debe estar familiarizado con el la infectividad y el umbral de carga procesos de monitoreo de origen y agente. Además la sensibilidad y parasitaria necesario para desarro- de recepción, la toma de muestras especificidad del método es mucho llar morbilidad en el camarón. debe ser constante y representativa, menor que las ofrecidas por otras utilizando métodos de alta sensibitécnicas. Tratamiento y control lidad, como el PCR, apoyados por
A nivel histopatológico, usan- La estrategia primordial debe avo- histopatología ante sospechas de do tinciones de rutina como H&E, carse a impedir o retardar el ingreso presencia. Del mismo modo, los aliGiemsa o Wright y mediante hibri- del agente. Es imperativo establecer mentos e insumos utilizados deben dación In-situ, las células epitelia- medidas preventivas, basadas en las ser de excelente calidad y biosegules del hepatopáncreas presentan buenas prácticas de cultivo (Cuéllar- ros (Suresh Kummari et al, 2018). plasmodios de forma irregular, mul- Anjel, 2014). El monitoreo y bio- Entre los posibles métodos para tinucleados (Figuras 1b, 1c, 1d), seguridad son esenciales, se debe el tratamiento y control del EHP, fuertemente basofílicos en diferen- establecer un control de tipo cua- Santhoshkumar et al. (2016) sugietes estadíos de desarrollo y esporas rentenario de todo material poten- ren dietas que contengan suplemenovoides, muy pequeñas, basofílicas cialmente riesgoso que ingrese a las tos antioxidantes y extractos vegetaen el citoplasma y en el lumen de regiones no afectadas, de modo que les hepatoprotectores. En estudios los túbulos hepatopancreáticos afec- se evite o retarde el ingreso del EHP desarrollados por Tang et al. (2016), tados (NACA, 2015; Varela-Mejías, (Suresh Kummari et al., 2018). se demostró la poca eficacia del 2018; Tourtip et al., 2009). No se En laboratorios de maduración agente antimicrobiano Fumagillin-B han reportado respuestas inflamato- se sugiere utilizar poblaciones libres para eliminar o reducir cargas del rias por parte de los hospedadores. de patógenos específicos (LPE), así hongo en camarones infectados con

EHP. Sin mencionar las implicaciones que conlleva el uso de fármacos no registrados o diseñados para la acuicultura.
En Asia se han realizado pruebas con diferentes grados de éxito para controlar o reducir los efectos del EHP, estos incluyen el tamizaje de los animales, la reducción de la materia orgánica en estanques, el uso de biorremediadores y probióticos, la desinfección de las instalaciones de los laboratorios con hidróxido de sodio al 2,5%, seguidos de acidificaciones a pH menores a 4,5 (Suresh Kummari et al., 2018).
Por su parte Aldama-Cano et al. (2018) realizaron pruebas de inhibición de extrusión del filamento polar con esporas purificadas, encontrando que las sustancias químicas que produjeron una inhibición del 100% fueron KMnO4 (15ppm, durante 15 minutos), cloro activo (40ppm durante 15 minutos), etanol al 20% durante 15 minutos, entre tanto que la formalina a 200 ppm por 24 horas produjo una reducción máxima del 95.33%.
En las zonas de producción se debe vigilar el factor de conversión alimenticia evitando su incremento, ya que este puede ser indicativo de la posible presencia del hongo, la tasa de crecimiento no debe ser menor a 0,85 g./semana y se debe evitar exceder la capacidad de carga de los estanques (NACA, 2015). La aplicación de óxido de calcio en los estanques ha sido reportada como beneficiosa, debido al incremento de pH que reduciría la presencia de esporas (Suresh Kummari et al, 2018; Sritunyalucksana et al, 2014), pero con un costo alto ya que recomiendan aplicaciones de hasta 6TM de óxido de calcio (CaO) por hectárea, limitando con ello su uso para sistemas cerrados e intensivos.
Conclusiones Desde el punto de vista de impacto, es importante recalcar que a pesar de que aún no se han demostrado letalidad directamente generada por el EHP, desafíos realizados, este microsporidio puede actuar como un factor de riesgo, incrementando la susceptibilidad de los camarones a infecciones por otras patologías como el AHPND (Aranguren et al., 2017), lo cual ha originado una gran preocupación por impedir el ingreso del EHP en zonas en las cuales aún no se ha detectado.
Como ocurre con otros patógenos, se debe tener especial cuidado en la realización de movimientos de animales vivos, ya sea a nivel local, como internacional. Es necesario realizar análisis que demuestren la ausencia del patógeno, antes de permitir su ingreso. Se debe disponer de técnicos de vigilancia sanitaria que monitoreen los cultivos en forma regular y debidamente capacitados para detectar la presencia del agente en forma temprana (Cuellar-Anjel, 2014; Varela-Mejías, 2018).
Es recomendable disponer de laboratorios que reúnan las condiciones, equipamiento y personal adecuados para realizar el diagnóstico; o tener acceso a laboratorios externos que brinden el servicio en caso de no disponer de técnicas moleculares o histopatológicas. Además de implementar planes de contingencia que faciliten la toma de decisiones en caso de detectarse el agente.
PAM
Agradecimiento al Laboratorio de Patología Acuática de la Universidad de Arizona, por permitir capturar imágenes de su colección histopatológica. 1Laboratorio SRY. Cd. Obregón, Sonora, México alexander.varela@gmail.com 2Universidad Técnica Nacional, Costa Rica. Sede del Pacífico npena@utn.ac.cr 3Laboratorio de Patología Acuícola. Universidad de Arizona lfarangu@email.arizona.edu
Bibliografía Aldama-Cano, D. J; Sanguanrut, P; Munkongwongsiri, N; Ibarra-Gámez, J.C; Itsathitphaisarn, O; Vanichviriyakit, R; Flegel, T.W; Sritunyalucksana, K; Thitamadee, S. 2018. Bioassay for spore polar tube extrusion of shrimp Enterocytozoon hepatopenaei (EHP). Aquaculture, 490: 156–161 Aranguren, L. F; Han, J. E; Tang, K. F. J. 2017. Enterocytozoon hepatopenaei (EHP) is a risk factor for acute hepatopancreatic necrosis disease (AHPND) and septic hepatopancreática necrosis (SHPN) in the Pacific white shrimp Penaeus vannamei. Aquaculture, 471: 37–42. Biju, N; Sathiyaraj, G; Raj, M; Shanmugam, V; Baskaran, B; Govindan, U; Kumaresan, G; Kannan Kasthuriraju, K; Sam Raj, T; Chellamma, Y. 2016. High prevalence of Enterocytozoon hepatopenaei in shrimps Penaeus monodon and Litopenaeus vannamei sampled from slow growth ponds in India. Dis. Aquat. Org. 120: 225–230. Cuéllar-Anjel, J. 2014. Parásitos en camarones. p. 197- 222. En V. Q. Morales y J. Cuéllar-Anjel (Eds.), (2a ed., pp. 21-98). Panamá: Guía Técnica - Patología e Inmunología de Camarones Peneidos. Organismo Regional Internacional de Sanidad Agropecuaria (OIRSA). 382pp. Dean, P; Sendra, K, M; Williams, T, A; Watson, A, K; Major, P; Nakjang, S; Kozhevnikova, E; Goldberg, A, V; Kunji, E, R, S; Hirt, R, P; Embley, T, M. 2018. Transporter gene acquisition and innovation in the evolution of Microsporidia intracellular parasites. Nat. Comm. 9:1709 Ha, N. T; Ha D. T; Thuy N. T; Lien, V. T. K. 2010. Enterocytozoon hepatopenaei parasitizing on tiger shrimp (Penaeus monodon) infected by white feces culture in Vietnam, has been detected. Agriculture and rural development: Sci. Technol. 12: 45–50. Han, J, E; Tang, K, F, J: Hyung Kim, J. 2018. Use of beta tubulin gene for phylogenetic analysis of the microsporidian parasite topenaei (EHP) and development of a nested PCR as its diagnostic tool. Aquaculture, 495: 899-902. Suscríbete Enterocytozoon hepaHudson, D. A; Hudson, N. B; Pyecroft, S. B. 2001. Mortalities of Penaeus japonicus prawns associated with microsporidian infection. Aust. Vet. J. 79: 504–505. Jaroenlak, P; Sanguanrut, P; Williams, B. A; Stentiford, G. D; Flegel, T. W; Sritunyalucksana, K; Itsathitphaisarn, O. 2016. A Nested PCR Assay to Avoid False Positive Detection of the Microsporidian Enterocytozoon hepatopenaei (EHP) in Environmental Samples in Shrimp Farms. PloS One, 11:(11). Jaroenlak, P; Wiredu Boakye, D; Vanichviriyakit, R; Williams, B; Sritunyalucksana, K; Itsathitphaisarn, O. 2018. Identification, characterization and heparin binding capacity of a spore-wall, virulence protein from the shrimp microsporidian, Enterocytozoon hepatopenaei (EHP). Parasites & Vectors, 11:177 Liu, Y, M; Qiu, L; Sheng, A, Z; Wan, X, Y; Cheng, D, Y; Huang. J. 2018. Quantitative detection method of Enterocytozoon hepatopenaei using TaqMan probe real-time PCR. J. Invertbr. Pathol. 151: 191–196 Lightner, D.V. 1996. A Handbook of shrimp pathology and diagnostic procedures for diseases of cultured penaeid shrimp [CD]. USA: World Aquaculture Society. Lukes, J; Husník, F. 2018. Microsporidia: A single horizontal gene transfer drives a great leap forward. Curr. Biol. 28(12): R695–R717. Morales-Covarrubias, M. S. 2010. Enfermedades del camarón: detección mediante análisis en fresco e histopatología. Editorial Trillas, México, D.F. NACA. 2015. Diseases of Crustaceans. Hepatopancreatic microsporidiosis caused by Enterocytozoon hepatopenaei (EHP). Disease Card. NACA / Government of Australia. Nunan, L; Lightner, D, V; Pantoja, C; Gomez-Jiménez, S. 2014. Detection of acute hepatopancreatic necrosis disease (AHPND) in Mexico. Dis. Aquat Org. 111: 81-86. Rajendran, K, V; Shivam, S; Ezhil Praveena, P; Sahaya Rajan, J; Sathish Kumar, T; Satheesha Avunje, V; Jagadeesan, S. V. A. N. V. Prasad Babu, Ashish Pande, A. Navaneeth Krishnan, S.V. Alavandi, K.K. Vijaya. 2016. Emergence of Enterocytozoon hepatopenaei (EHP) in farmed Penaeus (Litopenaeus) vannamei in India. Aquaculture, 454: 272–280. Salachan, P. V; Jaroenlak, P; Thitamadee, S; Itsathitphaisarn, O; Sritunyalucksana, K. 2017. Laboratory cohabitation challenge model for shrimp hepatopancreatic microsporidiosis (HPM) caused by Enterocytozoon hepatopenaei (EHP). BMC Vet. Res.13(1): 9. suscripciones@panoramaacuicola.com Santhoshkumar, S; Sivakumar, S; Vimal, S; Abdul Majeed, S; Taju, G; Haribabu. P; Uma, A; Sahul Hameed. A. S. 2016. Biochemical changes and tissue distribution of Enterocytozoon hepatopenaei (EHP) in naturally and experimentally EHP-infected whiteleg shrimp, Litopenaeus vannamei (Boone, 1931), in India. J. Fish Dis. 40(4): 529-539. Sritunyalucksana, K; Sanguarut, P; Vinu, P; Thutamadee, S; Flegel, T,.W. 2014. Urgent appeal to control spread of the shrimp microsporidian parasiwww.panoramaacuicola.com te Enterocytozoon hepatopenaei (EHP). NACA. Su, C, Hsieh; Y. C; Lu, W; Ma, L. J; Tsai, C. F; Chen, Y. M. 2017. The Diagnostic And Treating Strategies of EHP - An Example from A Chinese SuperIntensive Farming System. Presentation in the Asian-Pacific Aquaculture. World Aquaculture Society, Meeting. Kuala Lumpur. Suresh Kummari; Divya V. Haridas; Sevok Handique; Sam Peter; C.G. Rakesh; K.G. Sneha; B. Manojkumar; Devika Pillai. 2018. Incidence of Hepatopancreatic Microsporidiasis, by Enterocytozoon hepatopenaei (EHP) in Penaeus vannamei Culture in Nellore District, Andhra Pradesh, India and the Role of Management in its Prevention and Transmission. Int. J. Curr. Microbiol. App. Sci. 7(2): 2125-2134 Tang, K. F. J; Aranguren, L. F; Piamsomboon, P; Han, J. E; Maskaykina, I. Y; Schmidt, M. M. 2017. Detection of the microsporidian Enterocytozoon hepatopenaei (EHP) and Taura syndrome virus in Penaeus vannamei cultured in Venezuela. Aquaculture, 480: 17–21 Tang, K.F.J; Han, J.E; Aranguren, L.F; White-Noble, B; Schmidt, M.M; Piamsomboon, P; Risdiana, E; Hanggono, B. 2016. Dense populations of the microsporidian Enterocytozoon hepatopenaei (EHP) in feces of Penaeus vannamei exhibiting white feces syndrome and pathways of their transmission to healthy shrimp. J. Invertebr. Pathol. 140: 1-7 Tang, K. F. J; Pantoja, C. R; Redman, R. M; Han, J. E; Tran, L. H; Lightner, D. V. 2015. Development of in situ hybridization and PCR assays for the detection of Enterocytozoon hepatopenaei (EHP), a microsporidian parasite infecting penaeid shrimp. J. Invertebr. Pathol. 130: 37-41. Tangprasittipap, A; Srisala, J; Chouwdee, S; Somboon, M; Chuchird, N; Limsuwan, C; Srisuvan, T; Flegel, T, W; Sritunyalucksana, K. 2013. The microsporidian Enterocytozoon hepatopenaei is not the cause of white feces syndrome in whiteleg shrimp Penaeus (Litopenaeus) vannamei. BMC Vet. Res. 20139:139 Tourtip, S; Wongtripop, S; Stentiford, G; Bateman, K; Sriurairatana, S; Chavadej, J; Sritunyalucksana, K; Withyachumnarnkul, B. 2009. Enterocytozoon hepatopenaei sp. nov. (Microsporidia: Enterocytozoonidae), a parasite of the black tiger shrimp Penaeus monodon. Decapoda: Penaeidae): Fine structure and phylogenetic relationships. J. Invertebr. Pathol. 102: 21–29. Varela-Mejías, A. 2018. Patologías del hepatopáncreas en camarones marinos cultivados en América y su diagnóstico diferencial mediante histopatología. Revista AquaTIC, 50: 13-30. Varela-Mejías, A; Peña-Navarro, N. 2017. Transfronterización de enfermedades infecciosas en la camaronicultura. Una revisión. Rev. Repertorio Científico, 20(1): 1-11 Wiredu-Boakye, D; Jaroenlak, P; Prachumwat, A; Williams, T, A; Bateman, K, S; Itsathitphaisarn, O; Sritunyalucksana, K; Paszkiewicz, K, H; Moore, K, A; Stentiford, G, D; Williams, B, A, P. 2017. Decay of the glycolytic pathway and adaptation to intranuclear parasitism within Enterocytozoonidae microsporidia. Environ. Microbiol. 19(5): 2077–2089. Zhang, Q; Xu, T; Wan, X; Liu, S; Wang, X; Liu, X; Dong, X; Yang, B; Huang, J. 2017. Prevalence and distribution of covert mortality nodavirus (CMNV) in cultured crustacean. Virus Res. 233: 113–119.










