16 minute read
Columna Internacional IACLE
COLUMNA INTERNACIONAL IACLE
CURSO DE ACTUALIZACIÓN EN CONTACTOLOGÍA PARTE 82
Advertisement
CÓRNEA IV
Lic. Opt. Rubén Velázquez Guerrero, FIACLE Coordinador de IACLE México
La inervación corneal está organizada anatómicamente en cuatro niveles, desde los haces de nervios estromales penetrantes hasta las terminales de los nervios intraepiteliales.
Nervios estromales corneales
La anatomía de los haces nerviosos que entran radialmente en el estroma corneal es bastante similar entre los mamíferos, variando sólo en su número (6-8 en la rata, 15-40 en el gato o el perro, alrededor de 60 en el humano). Los nervios del estroma se ramifican inmediatamente después de entrar en la córnea y corren dentro del estroma como fascículos en forma de cinta encerrados por una lámina basal y células de Schwann. Los axones mielínicos incluidos en los nervios estromales (alrededor del 20 por ciento de las fibras nerviosas) pierden su vaina de mielina en un milímetro después de penetrar en el estroma (Imagen 1). Imagen 1. Las ramas distales de esta arborización se anastomosan ampliamente, formando el plexo del nervio estromal anterior, una red densa y compleja de haces nerviosos pequeños y medianos que se intersectan, y de axones individuales sin orientación preferente que se encuentran en la parte anterior del 25 al 50 por ciento del estroma corneal, dependiendo de la especie, siendo más densos en las capas anteriores.
Por el contrario, la mitad posterior del estroma humano y el endotelio corneal están desprovistos de fibras nerviosas sensoriales (Imagen

2).
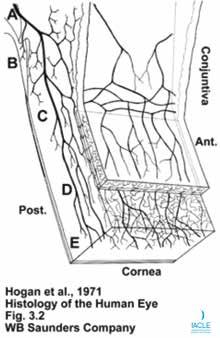
Imagen 2. • Los nervios limbales salen de los nervios intraesclerales y conjuntivales. Estos se originan de los nervios ciliares largos (A). • La inervación se extiende hacia la malla trabecular (B) y la córnea (C). • La córnea profunda (D) tiene pocos nervios. • La córnea adyacente a la membrana de Descemet (E) no tiene nervios.
Además de la inervación del nervio estromal, un pequeño número de pequeños fascículos nerviosos que se originan en el plexo límbico y de la conjuntiva, entran superficialmente en la córnea periférica para inervar las zonas perilímbica y corneal periférica.
Plexo nervioso subepitelial
En los seres humanos y los mamíferos superiores, la capa más superficial del plexo nervioso estromal anterior, situada en una estrecha franja del estroma inmediatamente debajo de

COLUMNA INTERNACIONAL IACLE
la membrana de Bowman, es especialmente densa y se denomina plexo nervioso subepitelial corneal, su densidad nerviosa es generalmente mayor en la córnea periférica que en la central. Se distinguen dos tipos anatómicamente distintos de haces de nervios.
Anatomía de los nervios sensoriales oculares Plexo subepitelial
Se forma una malla altamente anastomótica hecha de axones individuales y delgados fascículos nerviosos localizados inmediatamente debajo de la membrana de Bowman sin penetrarla hacia el epitelio corneal. El segundo tipo consiste en unos 400-500 haces curvilíneos de tamaño medio que penetran en la membrana de Bowman, principalmente en la córnea periférica e intermedia, se desprenden del revestimiento de células de Schwann, se doblan en un ángulo de 90° y se dividen, cada uno, en 2-20 fascículos nerviosos más delgados que continúan en el epitelio corneal como el plexo nervioso sub-basal. Un número relativamente bajo de nervios estromales penetra en la membrana de Bowman en la córnea central, que recibe la mayor parte de su inervación de los largos nervios sub-basales que entran en la córnea periférica directamente desde el plexo del limbo.
Plexo sub-basal
El plexo nervioso sub-basal en los humanos está formado por 5.000-7.000 fascículos nerviosos en un área de unos 90 mm2. Un haz de nervios sub-basal da varias ramas laterales, cada una de las cuales contiene de 3 a 7 axones individuales. Por lo tanto, se estima que el número total de axones en el plexo subbasal varía entre 20.000 y 44.000.
Los axones del nervio sub-basal pueden viajar hasta 6 mm entre las células epiteliales basales y su lámina basal, aproximadamente paralelos entre sí. La disposición de un haz de nervios estromales que se ramifica en múltiples fascículos nerviosos hijos paralelos constituye una estructura neuroanatómica única, característica de la córnea, y se denomina correa epitelial. Las correas epiteliales están constituidas por hasta 40 fibras nerviosas individuales sin mielina y con diámetro variable (0,05-2,5 micras). Las fibras nerviosas de las correas adyacentes se interconectan repetidamente de tal manera que ya no son reconocibles como correas individuales, formando finalmente un plexo nervioso relativamente homogéneo. La microscopía confocal in vivo ha demostrado que el plexo nervioso sub-basal forma un patrón espiral de fibras nerviosas en forma de verticilo, cuyo centro se denomina vortex. En los humanos se encuentra a 2 o 3 milímetros por debajo del ápice corneal. Los mecanismos que gobiernan la formación y el mantenimiento de este patrón espiral siguen siendo desconocidos. Sin embargo, como las células epiteliales de la córnea basal y los nervios sub-basales parecen migrar de forma centrípeta en tándem, es posible que las células epiteliales basales derivadas de las células madre de los limbos migren centrípetamente en forma de verticilo hacia el ápice corneal en respuesta a una guía quimiotrópica, a señales electromagnéticas y/o a presiones de la población; y los nervios sub-basales que ocupan los estrechos espacios intercelulares entre estas células migratorias serían arrastrados a lo largo de su trayectoria. Una posibilidad alternativa es que los nervios sub-basales desarrollen su orientación en forma de espiral, independientemente de la dinámica de las células epiteliales, proporcionando a su vez un andamiaje estructural que dirija la migración de las células epiteliales.
A pesar de su considerable ramificación, la mayoría de los haces de nervios estromales y subepiteliales pasan ininterrumpidamente a través del estroma para alcanzar el epitelio corneal y aparentemente no proporcionan inervación funcional al estroma. Sin embargo, una pequeña proporción de las fibras nerviosas de la córnea parecen viajar hacia abajo para terminar en el estroma como estructuras expandidas que se asemejan a las terminaciones nerviosas libres.
Terminales nerviosas intraepiteliales
Desde los nervios sub-basales que corren horizontalmente a través del epitelio basal, las fibras individuales se separan y giran 90° verticalmente como una profusión de axones terminales delgados, cortos y con cuentas que ascienden entre las células epiteliales, a menudo con una modesta cantidad de ramificación adicional, hasta las capas más superficiales del epitelio corneal. Las fibras intraepiteliales terminan como terminaciones
nerviosas libres, apareciendo como expansiones terminales prominentes y bulbosas que parecen morfológicamente homogéneas cuando se visualizan mediante microscopía óptica o electrónica, aunque la tinción inmunocitoquímica revela diferencias en la expresión de los neuropéptidos y otros neurotransmisores, lo que sugiere una heterogeneidad funcional. A nivel ultraestructural, las terminaciones nerviosas de la córnea contienen abundantes vesículas pequeñas y claras, tal vez llenas de aminoácidos excitantes, y vesículas grandes y densas que contienen neuropéptidos como el péptido relacionado con el gen de la calcitonina (CGRP), la sustancia P y/u otros péptidos. También contienen mitocondrias, partículas de glucógeno, neurotúbulos y neurofilamentos. Las terminales nerviosas están localizadas a lo largo de todas las capas del epitelio corneal, extendiéndose hasta unas pocas micras de la superficie de la córnea, pero siendo especialmente numerosas en las capas de las células aladas y basales. Ocasionalmente, las membranas de las células epiteliales que se encuentran frente a las terminales nerviosas muestran invaginaciones que pueden llegar a rodear completamente la terminal nerviosa. Esta íntima relación aumenta la posibilidad de un intercambio bidireccional de sustancias difusibles entre ambas estructuras. Los contactos íntimos también permiten a las terminaciones nerviosas detectar cambios en la forma o el volumen de las células epiteliales, como los producidos por la desecación o la hinchazón de la superficie ocular.
La densidad de inervación del epitelio corneal es probablemente la más alta de cualquier epitelio de superficie. Aunque el número real de terminaciones nerviosas de la córnea sigue siendo una cuestión de especulación, considerando que cada fibra nerviosa subbasal da al menos 10-20 terminales nerviosas intraepiteliales, es razonable especular que la córnea central humana contiene aproximadamente 3.500-7.000 terminales nerviosas/mm2 . Esta rica inervación proporciona a la córnea un sistema de detección altamente sensible, y se ha formulado la hipótesis de que la lesión de una sola célula epitelial puede ser suficiente para desencadenar la percepción del dolor. La densidad de las terminales nerviosas, y por lo tanto, la sensibilidad corneal, son mayores en la córnea central y disminuyen progresivamente al desplazarse hacia la periferia. Del mismo modo, la sensibilidad corneal y la densidad nerviosa disminuyen progresivamente en función de la edad y en presencia de varias patologías oculares.
Un axón estromal individual que entra en el limbo córneo-escleral se ramifica repetidamente y finalmente viaja a través de hasta tres cuartas partes de la córnea antes de terminarse.
Las fibras sensoriales varían en tamaño desde menos de 1 mm2 hasta tanto como 50 mm2 y pueden cubrir hasta el 25 por ciento de la superficie corneal. La extensa ramificación también explica el significativo solapamiento de los campos receptivos que se encuentran en los estudios electrofisiológicos de las fibras nerviosas de una sola córnea.
Desarrollo de los nervios de la córnea
La córnea carece de inervación sensorial hasta el quinto mes de gestación, cuando aparecen las terminaciones nerviosas. Durante el desarrollo, los axones sensoriales forman primero el anillo nervioso alrededor de la córnea (el plexo nervioso del limbo) y posteriormente los axones crecen de forma radial en el tejido corneal. Las señales moleculares que controlan el crecimiento de los nervios siguen siendo desconocidas, aunque varias moléculas de guía pueden regular el proceso. Las semaforinas derivadas de la córnea y del cristalino parecen mediar la repulsión inicial de los axones sensoriales del trigémino desde la córnea, induciendo así la formación adecuada de la malla del anillo nervioso pericorneal, y también contribuyen al posicionamiento de un subconjunto de proyecciones axonales en la fisura coroidea, que forman un plexo ventral desde el que posteriormente se suministra la vaina interior del iris. Una vez completado el anillo nervioso peri-corneal, los nervios sensoriales entran en la córnea como haces, en sitios uniformemente espaciados alrededor de toda su circunferencia y comienzan a extenderse radialmente dentro de la córnea, primero inervando su periferia y luego toda la superficie del estroma. La profundidad a la que los nervios entran en el estroma corneal se correlaciona con la zona de la córnea que van a inervar, de modo que los nervios estromales más profundos inervan casi toda la superficie corneal, mientras que
COLUMNA INTERNACIONAL IACLE
COLUMNA INTERNACIONAL IACLE
los nervios más superficiales que entran en el estroma más cercano al epitelio abastecen principalmente la periferia.
La separación uniforme entre los haces de nervios corneales durante la embriogénesis parece deberse a la liberación de factores neuro-repulsivos de los pioneros conos (en sentido de forma) de crecimiento al salir del anillo de nervios del limbo y entrar en el estroma corneal, manteniendo los haces de nervios que crecen relativamente rectos hacia el centro de la córnea como radios centrípetos y separados unos de otros. La extensión o inervación radial dentro de la córnea se produce por la bifurcación de los fascículos nerviosos en zonas sucesivas y concéntricas, lo que sugiere que la posición y orientación de los nervios intracorneales está determinada por el medio intracorneal y la migración de las células epiteliales.
La composición del estroma y los factores neurotróficos liberados por el epitelio corneal también participan en la regulación de la densidad nerviosa y la orientación de los nervios corneales durante el desarrollo.
Remodelación dinámica de la inervación corneal del adulto
Los nervios de la córnea se someten a una remodelación en la córnea del adulto a lo largo de la vida. Los haces de fibras de nervios estromales profundos mantienen una posición y configuración relativamente constante dentro de la córnea, mientras que el plexo del nervio sub-basal y especialmente las terminales de los nervios intraepiteliales, experimentan un amplio reordenamiento. El examen microscópico confocal in vivo en los ojos humanos revela que el plexo del nervio corneal sub-basal, es una estructura dinámica con un movimiento centrípeto lento pero continuo (5-15 micras/día), que cambia el plexo centrado en el verticilo en un período de 6 semanas. Las terminaciones nerviosas intraepiteliales están sujetas a cambios morfofuncionales más rápidos; su remodelación continua sigue a la reconfiguración a largo plazo del nervio sub-basal. El continuo desprendimiento de las células epiteliales de la córnea también influye fuertemente en el reordenamiento y la dinámica de las terminales de los nervios epiteliales.
La reorganización de las células epiteliales corneales diferenciadas, que migran hasta las capas más superficiales del epitelio corneal, induce cambios en la arquitectura de las terminaciones nerviosas intraepiteliales que se producen en menos de 24 horas. Se desconocen los mecanismos moleculares responsables de este continuo reordenamiento de los nervios corneales. Los nervios sensoriales de la córnea de los adultos conservan la capacidad de responder a la semaforización, que inhibe el brote de nervios tanto en los nervios transectados como en los intactos. En varias especies de mamíferos, la densidad terminal del nervio corneal disminuye con la edad, y esto puede ser la base de la disminución de la sensibilidad corneal registrada en los ancianos.
Regeneración de los nervios corneales lesionados
Los nervios de la córnea de los adultos conservan la capacidad de regenerar las lesiones posteriores. Sin embargo, después de un daño o una transección, la morfología y las propiedades funcionales de los nervios corneales cambian sustancialmente. Los procesos nerviosos distales al lugar de la lesión se degeneran, mientras que los muñones centrales empiezan a regenerarse, produciendo finalmente un patrón nervioso bastante diferente de la arquitectura original del nervio corneal. El proceso regenerativo tiene lugar en varias etapas. Cuando se cortan los nervios de la córnea, la zona denervada es invadida primero por brotes de fibras nerviosas adyacentes e intactas. Más tarde, el muñón central de los axones lesionados comienza a regenerarse, formando micro neurosis a partir de la cual comienzan a desarrollarse los nuevos brotes, mientras que las primeras ramas de las fibras intactas comienzan a degenerar. Puede ser que la interrupción en las terminales nerviosas lesionadas de la captación de moléculas de señal como el factor de crecimiento nervioso (FCN) producido por las células de la córnea, que son transportadas centrípetamente a lo largo del axón padre al soma de la neurona para regular la expresión génica, cause cambios morfológicos y funcionales en las neuronas en regeneración.
Las neuronas del ganglio del trigémino
Los estudios electrofisiológicos de las neuronas sensoriales oculares se han centrado

COLUMNA INTERNACIONAL IACLE
principalmente en los registros extracelulares de la actividad de los impulsos propagados en los axones periféricos de las neuronas del ganglio trigémino, en la mayoría de los casos las fibras nerviosas que inervan la córnea y la conjuntiva bulbar. Las neuronas sensoriales oculares que inervan la córnea y los tejidos uveales poseen en general axones mielinizados delgados (Aδ) que conducen potenciales de acción a velocidades de entre 3-15 m/s, o axones no mielinizados (C), que conducen a menos de 2 m/s. Un número reducido de neuronas con axones gruesos mielinizados (Aβ) proporcionan inervación al limbo, los párpados y la conjuntiva.
Fibras sensoriales de la córnea y la conjuntiva
Al igual que en otras partes del cuerpo, los niveles de respuesta de las terminaciones periféricas de los axones sensoriales a diferentes modalidades de estímulos físicos y químicos se han utilizado para distinguir diversas clases funcionales de fibras sensoriales que vierten en el interior de los diversos tejidos oculares.
Los nociceptores polimodales
Aproximadamente dos tercios de las fibras sensoriales que inervan la córnea y la conjuntiva bulbar se activan por estímulos físicos y químicos de intensidad dentro del rango nocivo o casi nocivo, incluyendo fuerzas mecánicas, calor, frío intenso, irritantes químicos exógenos y una gran variedad de moléculas endógenas liberadas por la lesión de los tejidos. En consecuencia, se denominaron nociceptores polimodales. La mayoría de ellos no poseen mielina, mientras que una pequeña parte, según las especies, pertenece al grupo de fibras nerviosas mielinizadas finas (Aδ). Sus campos receptivos son redondos u ovalados, suelen ser grandes, a menudo cubren hasta una cuarta parte o más de la córnea, y pueden extenderse varios milímetros más allá de la córnea hasta el limbo y la conjuntiva bulbar adyacentes. El gran tamaño y el extenso solapamiento de los campos receptivos adyacentes de nociceptores polimodales, junto con los mecanismos convergentes del sistema nervioso central, explican por qué los estímulos de la superficie corneal están mal localizados.
Los nociceptores polimodales de la córnea responden a sus estímulos naturales con una descarga continua e irregular de impulsos nerviosos a una frecuencia aproximadamente proporcional al magnetismo del estímulo, que persiste mientras se mantiene el estímulo, codificando así su intensidad y duración. Ocasionalmente, la descarga de los impulsos nerviosos sobrepasa la duración del estímulo (post-descarga). Todos los nociceptores polimodales responden a los estímulos mecánicos y a las temperaturas superiores a 39-40°C. Aproximadamente la mitad de las fibras polimodales del gato también desarrollan una respuesta de baja frecuencia con reducciones de la temperatura de la córnea por debajo de 29°C. Los nociceptores polimodales son excitados adicionalmente por muchos agentes químicos. Las soluciones ácidas (pH 6,5) o los chorros de gas que contienen concentraciones crecientes de CO2 (el ácido carbónico que se forma en la superficie de la córnea hace descender el pH local), evocan robustas descargas de impulsos en los nociceptores polimodales de la córnea. La sensibilidad de los nociceptores polimodales a la estimulación ácida con CO2 se ha utilizado para la estequiometría corneal. Un gran número de químicos endógenos (mediadores inflamatorios) también activan los nociceptores polimodales. La expresión de diferentes moléculas de transducción de membrana proporciona a los nociceptores polimodales la capacidad de responder a estímulos de diferente calidad.
Mecano-nociceptores
Alrededor del 15 al 20 por ciento de las fibras nerviosas que inervan la córnea responden sólo a fuerzas mecánicas de intensidad casi nula. Por consiguiente, fueron clasificadas como mecano-nociceptores. Todos los axones de esta clase de receptores están finamente mielinados (Aδ). Los campos receptivos son generalmente redondos y de tamaño medio, cubriendo alrededor del 10 por ciento de la superficie corneal. La fuerza requerida para activar los nociceptores mecánicos y polimodales de la córnea (es decir, su umbral mecánico) es alrededor de 0.6 mN - unas 10 veces menor que la fuerza requerida para activar las fibras equivalentes en la piel. Esto se debe posiblemente a la proximidad de las terminales de los nervios corneales a la superficie y a la ausencia de un epitelio superficial queratinizado en la córnea. Los mecanonociceptores disparan sólo uno o unos pocos
impulsos nerviosos en respuesta a estímulos mecánicos breves o sostenidos. Por lo tanto, los mecano-nociceptores corneales tienen una capacidad limitada para codificar la intensidad y la duración del estímulo, y probablemente sirven principalmente para señalar la presencia de estímulos mecánicos nocivos (contacto con la superficie corneal, cuerpos extraños, etc.), presumiblemente responsable de la aguda sensación de dolor producida por repentinas agresiones mecánicas.
Imagen 3.

Respuestas correctas al cuestionario del artículo “Córnea III” publicado en la revista
anterior: 1. c • 2. b
Cuestionario
1.- Observe detenidamente la foto superior y la foto inferior derecha de la imagen 3.
Considerando la lectura del artículo. ¿Cuál considera que sea la causa de la hiperemia? a) El lente está mal adaptado b) El lente estimula una zona de mayor inervación corneal c) El lente no tiene un adecuado borde 2.- Observe detenidamente la foto superior y la foto inferior izquierda de la imagen 3.
Considerando la lectura del artículo. ¿Considera que el diámetro del lente de la foto inferior izquierda cause el mismo grado de hiperemia? a) Sí b) No
Bibliografía
1. Levin, L. Nilsson S. Adler’s Phisiology of the eye. Eleventh edition. 2011. Saunders, Elsevier. 2. Módulo A1. Anatomy & Physiology of the Anterior Segment. Asociación Internacional de Educadores en Lentes de Contacto (IACLE). 3. Módulo 6 de la Asociación Internacional de Educadores en Lentes de Contacto.










