Introdução
Esta é a terceira edição do livro Neurologia Fundamental – Princípios, Diagnóstico e Tratamento que se destina primordialmente aos alunos de Medicina, mas, também, a todos os médicos interessados ou que pretendem aumentar os seus conhecimentos acerca das ciências neurológicas clínicas. Neles incluímos os médicos de família, os internistas, e, porque não, psiquiatras e neuropediatras.
Os leitores encontrarão, atualizadas, as principais patologias neurológicas, aquelas que devem ter presente quando lidam com um doente que padece de patologia do foro neurológico. Na realidade, as ciências neurológicas estão em contínua evolução, não só no que se refere a novas patologias como também a avanços substanciais no tratamento de outras previamente conhecidas.
Tendo em conta os objetivos primordiais do livro, os conhecimentos profundos das patologias neurológicas não se esgotam na sua leitura, determinando também a consulta de tomos mais específicos de cada patologia, de acordo com os conhecimentos do leitor, ou de outras fontes de informação.
O nosso agradecimento sincero a todos os colegas, neurologistas e neurocirurgiões, que se prontificaram a escrever os diversos capítulos e que emprestaram ao livro, com o seu saber um nível científico que deve ser realçado.
José M. Ferro José Pimentel Isabel Pavão Martins (coordenadores)
© Lidel –Edições Técnicas, Lda.
Figura 11.2 – Doente de 54 anos, com queixas de esquecimentos nos últimos três anos, recentemente manifesta sintomas e sinais parkinsónicos, e flutuações cognitivas notórias. Foi estabelecido o diagnóstico de demência com corpos de Lewy. O PET Scan cerebral (PiB) não tinha evidenciado alterações (não mostrado). O estudo cintigráfico DaTSCAN identificou redução da captação do transportador de dopamina (ioflupano) no estriado sobretudo à direita (setas).

Figura 11.3 – Doente de 65 anos, com alterações de comportamento. Foi estabelecido o diagnóstico de demência frontotemporal. A. A TC cranioencefálica evidenciou acentuada atrofia frontal e temporal, de predomínio direito. B. O PET cerebral (PiB) não assinalou depósitos corticais de amiloide cerebral (captação do radiofármaco subcortical e não-específica). C. O PET cerebral (FDG) identificou hipometabolismo frontal e temporal de predomínio direito (setas). Em relação aos biomarcadores do liquor, havia elevação da proteína tau total, porém a proteína tau hiperfosforilada e o péptido Aβ42 estavam normais.



Extratexto a cores Neurologia Fundamental XX
A B B
das áreas de linguagem alteram a capacidade de compreensão verbal, enquanto as suprassílvicas causam afasias com boa capacidade de compreensão de palavras (Figura 1.3).


Enquanto a compreensão de palavras depende sobretudo da via ventral e do lobo temporal esquerdo (Binder, 2017), já a compreensão de frases mais complexas requer processamento sintático e a participação da via dorsal e da parte mais posterior do complexo de Broca (Hickok e Poeppel, 2007; Price, 2010; Segaert et al., 2012). Assim, os doentes com lesões frontais esquerdas (afasia de Broca, por exemplo) podem ter dificuldades na compreensão do discurso, em tempo real, mesmo tendo um bom desempenho na prova de compreensão de palavras isoladas ou ordens simples.


Capacidade de repetição
Avalia-se pedindo ao doente que repita as palavras que lhe vamos dizendo. Iniciamos esta
prova com palavras curtas e familiares e prosseguimos com palavras mais longas ou frases (por exemplo, “sol”, “porta”, “sapato, “descoberta”, etc.). Podemos também solicitar ao paciente que repita pseudopalavras (isto é, uma sequência de sons pronunciáveis, mas que não fazem parte do léxico da língua portuguesa, como, por exemplo, “malico”, “lovitalhe”). Desta forma forçamos a pessoa a utilizar a via dorsal da linguagem, pois evitamos que ela consiga produzir a palavra pela compreensão. Para repetir pseudopalavras, temos de nos basear na memória fonológica (ou seja, a capacidade de reter por breves momentos uma sequência exata de sons sem sentido). A capacidade de repetição depende da integridade de várias estruturas da área de Wernicke (onde os sons são analisados e segmentados), da região parietal inferior (envolvida na memória fonológica), da área de Broca, onde se faz o planeamento do discurso e do feixe arqueado que as une (Forkel et al., 2020) (Figura 1.4). Quando uma
Funções cognitivas Neurologia Fundamental 5 © Lidel –Edições Técnicas, Lda.
A B
ou mais destas
compreensão Má compreensão
Figura 1.2 – Imagens de ressonância magnética funcional (RMf) de um participante saudável a nomear ações (A) e objetos (B). Notar as diferenças, na imagem da esquerda (nomeação de ações), a ativação é mais frontal, enquanto na imagem da direita (nomeação de objetos), a ativação é mais temporal.
Boa
Figura 1.3 – Localização da lesão e capacidade de compreensão na afasia. Fonte: © Refluo.
Figura 1.4 – Áreas envolvidas na repetição de palavras. Fonte: © Refluo.
Tabela 2.4 • Padrões de evolução do coma.
Exame neurológico Telencefálico- diencefálico inicial Diencefálico
III par – mesencefálico (só quando a herniação é lateral)
Padrão ventilatório Pausas, Cheynes-Stokes Roving Cheyne-Stokes Cheyne-Stokes ou taquipneia
Pupilas Diâmetro médio ou mióticas Mióticas Anisocória
Mesencefálico –protuberancial alto Protuberancial baixo-bulbar
Taquipneia Atáxico, em salvas, apneia
Diâmetro médio Mióticas
Reflexos pupilares Presentes Presentes Abolido na pupila midriática Abolidos Abolidos Posição e movimentos dos globos oculares Desvio conjugado roving Roving Estrabismo divergente Desvios oblíquos ausentes Ausentes
Reflexos oculocefálicos Presentes Presentes Paresia do III par Desconjugados ou abolidos Abolidos
Resposta motora Localização ou flexão do lado não-parético
Flexão normal Localização, flexão normal ou anormal
No doente em coma, os meios complementares de diagnóstico requisitados devem ser orientados segundo as etiologias que pretendemos excluir ou confirmar (Quadro 2.3).
Quadro 2.3 • Exames complementares no doente em coma.
X Suspeita/exclusão de lesão focal supra ou infratentorial:
TC
Ressonância magnética* (AVC e outras lesões do tronco cerebral, encefalite, trombose venosa cerebral, traumatismos cranianos com focos de contusão múltiplos ou lesão axonal difusa)
X Suspeita/exclusão de perturbação metabólica ou tóxica:
Gasimetria arterial
Hemograma, PCR
Ureia, creatinina
Ionograma, calcemia* e fosfatemia*
Transaminases, amoniemia*
INR, aPTT, D-dímeros
Provas de função tiroideia*
CK
Pesquisa de tóxicos no sangue ou urina
Eletroencefalograma (EEG)*
X Suspeita de infeção do SNC (meningite, encefalite) ou de hemorragia subaracnoideia:
Exame do líquido cefalorraquidiano (LCR)**
EEG***
X Suspeita de estado de mal epilético não-convulsivo:
EEG
* Em casos selecionados. ** Com exceção de doentes com diagnóstico evidente e emergente de meningite, deve ser precedida por TC para excluir lesão supra ou infratentorial, cuja herniação pode ser precipitada pela punção lombar. A punção lombar pode também causar rotura da cápsula de um abcesso cerebral. Na hemorragia subaracnoideia só deve ser realizada se a TC não tiver estabelecido o diagnóstico. *** Na suspeita/exclusão de encefalite.
PCR: proteína C reativa; INR: International normalized ratio; aPTT: tempo de tromboplastina parcial ativado; CK: creatina quinase.
Causas de coma
Extensão anormal Flexão dos membros inferiores ou sem resposta
As causas de coma estão resumidas no Quadro 2.4. Num SU, bem como nas enfermarias de um hospital, as causas mais frequentes de coma são as intoxicações, os comas diabéticos e por insuficiência de órgão. Seguem‑se a anoxia-isquemia secundária a paragem respiratória e/ou cardíaca, os traumatismos cranianos e as hemorragias intracerebrais.
Herniação
A herniação é a principal determinante neurológica da má evolução do doente em coma. Deve ser reconhecida precocemente, para que se possa intervir de imediato, reduzindo a pressão intracraniana por meios médicos e/ou cirúrgicos.
Sintomas e sinais
Os doentes em coma por lesão supratentorial têm, no início do quadro, sintomas e sinais focais. No exame neurológico, os reflexos do tronco cerebral estão intactos, nomeadamente os reflexos oculocefálicos e reflexos oculovestibulares. Se a lesão (ou lesões) que causa o coma não for ou não puder ser tratada, os doentes desenvolvem deterioração rostro-caudal, devida à herniação dos hemisférios cerebrais, através do orifício da tenda do cerebelo. Esta herniação causa compressão do tronco cerebral
Perturbações da consciência Neurologia Fundamental 26
Prova de Romberg
O doente está na posição de pé, com os pés ligeiramente afastados (colocar o sapato do observador entre os seus pés), durante um minuto. Mesmo com os olhos abertos, mas mais nitidamente se com eles fechados, poderão registar-se oscilações laterais ou ântero-posteriores sempre no mesmo sentido e regresso à posição primitiva, depois de um certo tempo de latência (Romberg vestibular); se as oscilações, com os olhos fechados, não têm tempo de latência nem sentido predominante, então deveremos estar na presença de uma lesão da sensibilidade propriocetiva, cordonal posterior (Figura 3.3).

Prova de Unterberger
O doente marca passo com as coxas bem elevadas, os membros superiores ao longo do corpo, e os olhos fechados, durante cerca de 60 segundos.




Nas lesões periféricas, ele pode rodar sobre si próprio na direção da lesão, enquanto nas centrais se observa um alargamento das oscilações laterais (Figura 3.4).
Marcha
Nas lesões vestibulares periféricas, a marcha desvia-se para o lado lesado mesmo com os olhos abertos.
Vertigem Neurologia Fundamental 34
Figura 3.3 – Prova de Romberg.
Figura 3.4 – Prova de Unterberger.
Figura 3.2 – Prova dos “braços estendidos”.
A ICHD-3 divide esta entidade em três tipos, de acordo com a frequência das crises: episódica infrequente (<12 dias por ano), episódica frequente (≥12 dias/ano e <15 dias/mês) e a cefaleia de tensão crónica (a cefaleia ocorre ≥15 dias por mês, por >3 meses, de tal modo que é diária ou quase diária) (ver critérios detalhados nos Quadros 4.5 e 4.6).
Etiopatogenia
A patogenia da cefaleia de tensão crónica é ainda pouco conhecida, mas nela parecem intervir fatores periféricos, musculares (tensão exagerada dos músculos epicranianos) e mecanismos centrais (maior sensibilidade à dor, por provável falência dos sistemas antinocicetivos naturais).
Cefaleia de tensão
A cefaleia de tensão é uma cefaleia com características um pouco inespecíficas, em geral difusa ou bilateral e descrita como uma sensação de aperto ou peso ligeiro persistente e incomodativo.
Terapêutica
A cefaleia de tensão episódica pode ser tratada de forma aguda com analgésicos ou anti inflamatórios, mas apenas se a dor for intensa, o que não é habitual. Já a terapêutica da cefaleia de tensão crónica é sobretudo preventiva, incluindo medidas farmacológicas (antidepressivos tricíclicos, relaxantes musculares) e não-farmacológicas (exercício, treino de relaxamento).
Quadro 4.6 • Critérios de diagnóstico da cefaleia de tensão crónica (ICHD-3).
A. A cefaleia ocorre em média ≥15 dias por mês, por > 3 meses (≥180 dias por ano), preenche os critérios de B a D
B. A cefaleia dura horas ou dias, pode ser contínua
C. A cefaleia tem, pelo menos, duas das seguintes quatro características:
1. Localização bilateral
2. Pressão ou aperto (não-pulsátil)
3. Intensidade ligeira ou moderada
4. Não é agravada por atividades físicas de rotina como caminhar ou subir escadas
D. Acompanha-se dos seguintes aspetos:
1. Apresenta só um dos seguintes sintomas: fotofobia, fonofobia ou náuseas ligeiras
2. Ausência de vómitos e de náuseas moderadas ou graves
E. Não é mais bem explicada por outro diagnóstico da ICHD-3
cefaleia por uso excessivo De meDicamentos
Alguns doentes com cefaleias crónicas (enxaqueca, cefaleia de tensão) consomem diariamente analgésicos, AINE, ergotamina e/ou triptanos, para o tratamento das suas crises. Com o consumo exagerado desses fármacos, desenvolvem tolerância, perda do efeito terapêutico e dependência. Esta situação torna as cefaleias intratáveis e sem resposta à terapêutica preventiva. Entra-se então numa espécie de espiral viciosa em que os doentes tendem a consumir cada vez mais fármacos para tentar obter algum alívio. Existem ainda doentes que têm tanto receio das crises que tomam a medicação em antecipação da crise, antes mesmo de chegarem a desenvolver dor.
Quadro 4.5 • Critérios de diagnóstico da cefaleia de tensão episódica (ICHD-3).
X Cefaleia tipo tensão episódica pouco frequente:
A. Pelo menos, 10 episódios de cefaleias ocorrendo em <1 dia por mês em média (<12 dias por ano) e preenchendo os critérios de B a D
B. A cefaleia dura desde 30 minutos a 7 dias
C. A cefaleia tem, pelo menos, duas das quatro seguintes características:
1. Localização bilateral
2. Em pressão ou aperto (não-pulsátil)
3. Intensidade ligeira ou moderada
4. Não é agravada por atividade física de rotina como caminhar ou subir escadas
D. Acompanha-se dos seguintes aspetos:
1. Ausência de náuseas e/ou vómitos
2. Apenas um dos seguintes sintomas estão presentes: fotofobia ou fonofobia
E. Não é mais bem explicada por outro diagnóstico da ICHD-3
X Cefaleia tipo tensão episódica frequente:
A. Pelo menos, 10 episódios de cefaleias que ocorrem em 1 a 14 dias/mês em média por mais de 3 meses (≥12 dias e <180 dias por ano), e preenchendo os critérios de B a D (idênticos aos expostos em cima)
Cefaleias Neurologia Fundamental 48
neurofisiológico pelas características do EEG, do eletromiograma (EMG) do mento e dos movimentos oculares:
X Sono NREM – Há três tipos de sono NREM com profundidade de sono crescente: N1, N2, N3. O EEG diferencia as três fases: N1: >50% de ritmo teta; N2: fusos ou complexos K; N3 - >20% de ondas delta;
X Sono REM – EEG: frequências mistas, de baixa amplitude, com surtos de atividade alfa; eletro-oculograma (EOG): movimentos oculares rápidos; EMG: atonia interferida por mioclonias.
A macroestrutura do sono resulta da classificação de épocas de 30 segundos numa destas fases, de acordo com critérios internacionais, definidos inicialmente por Rechtschaffen & Kales e progressivamente atualizados pela Academia Americana de Medicina do Sono (última versão de janeiro de 2020).
A microestrutura do sono avalia períodos de tempo mais curtos, incluindo microdespertares, características dos fusos ou da atividade de base do EEG.

Uma noite de sono é constituída por quatro a seis ciclos de sono, que são o conjunto das três fases de sono NREM e um período de REM (Figura 5.1).
O hipnograma é a representação gráfica das fases de sono de uma noite (Figura 5.1).
ABORDAGEM AO DOENTE COM PATOLOGIA DO SONO
Consultar a Figura 5.2. História
A história clínica é uma história das 24 horas.
Figura 5.1 – Hipnograma real. Ao longo de noite, os ciclos de sono vão-se modificando com mais N3 no início da noite e mais REM e N2 no final.
Figura 5.2 – Marcha de diagnóstico nas perturbações do sono. A anamnese deve ser corroborada pelo companheiro/a de quarto e, nalguns casos, por vídeos caseiros. O exame objetivo e os exames complementares são direcionados de acordo com a informação obtida pelos elementos anteriores.
Patologia do sono Neurologia Fundamental 54
clínica e
oBjetivo
exame
Ciclo do sono Vigília 1 2 3 REM R W N1 N2 N3
Neurofisiologia “Personalizada” Doente + Escalas Geral Testemunha Exame objetivo Exames Vídeo(s) Caseiro(s) Neurológico História Clínica
Teste de latências múltiplas do sono
O teste de latências múltiplas do sono (TLMS) é o método gold standard para detetar sonolência, medindo a capacidade ou tendência para adormecer. É utilizado no diagnóstico dos distúrbios centrais de hipersonolência, tais como a narcolepsia e a hipersónia idiopática e para confirmar a presença de SDE. Se negativo, o TLMS não exclui completamente SDE, por ser influenciado por fatores psicológicos e fisiológicos.

O TLMS consiste em quatro ou cinco provas (ou oportunidades de sestas) em circunstâncias protocoladas e com a duração de 20 minutos, intervaladas por períodos de duas horas. Em cada prova, é medido o tempo que o doente demora a adormecer (a latência do sono) e é calculada a média da latência do sono (LMS) de todas as provas. São ainda identificadas sestas nas quais se regista sono REM (sleep onset REM periods ou SOREMP). Os SOREMP fazem parte dos critérios de diagnóstico de narcolepsia mas a sua presença pode ter outras causas (privação de sono, atraso de fase, iatrogenia, etc.) (Figura 5.6).
Teste de manutenção de vigília
Um teste de manutenção de vigília (TMV) é uma medida validada da capacidade de ficar
acordado. É utilizado principalmente na avaliação da resposta terapêutica para ojectivar o risco de adormecimento (por exemplo, condutores profissionais ou trabalhadores que manuseiem máquinas ou substâncias perigosas com SAOS, tratados com ventiloterapia com pressão contínua positiva (continuous positive airway pressure – CPAP). O resultado deste exame deve ser integrado no contexto clínico. Tal como o TLMS, é constituído por várias provas (cada uma com 40 minutos de duração) intervaladas por períodos em que o doente tem de estar acordado. Neste caso, ao contrário do TLMS, é pedido ao doente que tente ficar acordado. Assim, a LMS neste exame mede objetivamente quanto tempo o doente consegue permanecer acordado.
Actigrafia
A actigrafia é usada para avaliar os ciclos de atividade e repouso ao longo de vários dias ou semanas, que é habitualmente um correlato robusto do número de horas de vigília/sono. Um actígrafo é um acelerómetro que mede a atividade motora e pode ter associados outros sensores, nomeadamente da luz ambiente, temperatura ou atividade de alguns músculos. É usado como um relógio no pulso no membro não dominante. A actigrafia é bastante útil na avaliação de diversas perturbações do sono,
Patologia do sono Neurologia Fundamental 59 © Lidel –Edições Técnicas, Lda.
Figura 5.6 – Exemplo de uma sesta de um teste de latências múltiplas de sono, demonstrando SOREMP (ver figura a cores em extratexto).
Figura 6.3 – AVC isquémico por oclusão do topo da artéria carótida interna esquerda. A. Tomografia computorizada cranioencefálica (TC-CE) sem contraste mostra hiperdensidade no trajeto da artéria cerebral média esquerda (seta). Nos planos axial (B) e coronal (C) da angio-TC não se visualiza fluxo na artéria cerebral média (seta). D. A angiografia cerebral confirma a interrupção do fluxo do contraste na porção distal da artéria carótida interna esquerda, confirmando a oclusão nesta artéria. E. Após trombectomia mecânica, restabeleceu-se a circulação no topo da artéria carótida interna, sendo agora bem visível a porção distal desta artéria, bem como as artérias cerebrais anterior e média esquerdas.


Terapêutica antitrombótica
Se o doente não tiver sido tratado com trombólise, deve administrar-se logo que possível, ácido acetilsalicílico, 500 mg, garantindo que não existe alergia a esta substância. Em casos de AIT ou AVC minor pode considerar-se iniciar antiagregação plaquetária dupla (ver na secção de prevenção secundária).
Se o doente tiver sido tratado com trombólise endovenosa, só se deve iniciar ácido acetilsalicílico 24 horas depois, e após a realização de TC-CE que exclua a ocorrência de transformação hemorrágica.
Nos doentes com cardiopatia de alto risco embolígeno, deve ponderar-se o início de anticoagulação tendo em consideração a gravidade do defeito neurológico, a extensão da lesão isquémica, ou a presença de transformação

hemorrágica. Em caso de AIT ou AVC minor com lesão isquémica cerebral pequena, poderá iniciar-se precocemente a anticoagulação; em situações de lesão mais extensa ou transformação hemorrágica, o seu início poderá ser adiado por uma a duas semanas.


Controlo dos parâmetros fisiológicos
A pressão arterial deve ser monitorizada. Não estão totalmente estabelecidos os valores limiares acima dos quais se deverá baixar a tensão arterial (TA). Recomenda-se que a TA seja mantida abaixo de 180/105 mmHg nos doentes submetidos a terapias de reperfusão, e abaixo de 180/110 mmHg antes do bólus de trombolítico. Nos restantes doentes, deve tratar-se apenas se for superior a 220/120 mm Hg,
Acidentes vasculares cerebrais Neurologia Fundamental 80
D E A B C
Tabela 7.2 • Diagnóstico diferencial entre síncope e crise convulsiva.
Clínica Síncope Crise epilética
Postura Ortostatismo Qualquer
Palidez e sudação Muito frequente Muito raro
Início Gradual Abrupto
Traumatismo Raro Frequente
“Abalos” convulsivos Podem ocorrer Frequente
Incontinência esfincteriana Rara Frequente
Inconsciência Segundos Minutos
Recuperação Rápida Lenta
Confusão pós-crítica Rara Frequente
Fatores precipitantes Frequente Raro
Tabela 7.3 • Diagnóstico diferencial entre crises epiléticas e perturbação funcional.
Clínica Crise tónico-clónica Perturbação funcional
Início Abrupto Gradual
Consciência Ausente Mantida
Assíncrona de movimentos dos membros Raro Frequente
Tentativa de agressão Ausente Frequente
Cianose Frequente Rara
Duração Breve Prolongada
Resistência ativa ao abrir das pálpebras Rara Frequente
Confusão pós-crítica Frequente Rara
EEG ictal Com alterações Sem alterações
vídeo para que o médico possa observar a semiologia do evento.
A investigação complementar tem como objetivo clarificar melhor o diagnóstico, o tipo e a etiologia da epilepsia, identificar eventuais comorbilidades, ajudando a planear a terapêutica mais adequada. Diferentes exames complementares podem ser pedidos de acordo com as especificidades de cada caso clínico. No entanto, o EEG deve, por regra, ser obrigatoriamente pedido, e, relativamente aos exames de imagem, a RM cerebral de alta definição (3 tesla) com protocolo para a epilepsia, é o exame de eleição. Na grande maioria das vezes, contudo, uma vez que a PCE passou anteriormente por um serviço de urgência, ela já realizou uma TC-CE. Embora a TC CE possa identificar muitas lesões epileptogénicas, como um AVC prévio, um foco de contusão ou um tumor cerebral, é importante saber que uma TC normal não exclui uma epilepsia
estrutural. De facto, muitas lesões epileptogénicas não são identificadas por TC CE, tais como a esclerose mesial, as displasias corticais ou outras alterações do desenvolvimento cerebral, ou ainda alguns tumores cerebrais.
eletroencefalograma
O EEG é o registo da atividade elétrica cerebral. Sendo um exame com elevada resolução temporal, é muito útil no diagnóstico de disfunção cerebral e na identificação de biomarcadores da epilepsia. Deve ter-se em conta que a grande maioria destes exames são intercríticos (isto é, não são realizados durante uma crise epilética) e ainda, que os elétrodos são colocados no couro cabeludo (a alguma distância, portanto, do córtex cerebral), e que o tempo de duração do traçado é relativamente curto (cerca de 30 minutos). Por essa razão, um EEG intercrítico normal
Epilepsia Neurologia Fundamental 88
Paresia radial
Este nervo é superficial na goteira umeral. É frequente a lesão a este nível se uma pessoa adormecer sobre uma superfície dura, ou sobre o espaldar de uma cadeira, sendo que tal situação é agravada pela extrema fadiga ou sedação (saturday night palsy). Clinicamente, observa-se mão pendente, com queixas sensitivas pouco relevantes. Em geral, a recuperação é espontânea em algumas semanas. O EMG pode ser importante para o diagnóstico diferencial e estimar o prognóstico.
Compressão do nervo cubital no cotovelo
É uma situação frequente, sobretudo em doentes com história de fratura do cotovelo. O doente queixa-se de parestesias no quarto e quinto dedos, dificuldade com os movimentos finos e, mais tarde, atrofia dos músculos intrínsecos da mão, em particular dos interósseos. O tratamento poderá ser conservador nos casos mais ligeiros, mas é cirúrgico nos outros.
Paralisia facial periférica (paralisia de Bell)
Corresponde a uma súbita paralisia de um lado da face, devido a uma inflamação de nervo facial ao longo do seu trajeto intrapetroso. Geralmente, ocorre uma dor inicial sobre a apófise mastoideia. O quadro clínico é caracterizado pelo defeito motor proporcionado no andar superior e inferior da hemiface. Pode ocorrer hipogeusia e hiperacusia se a lesão for mais proximal. É mais frequente em doentes diabéticos, após uma infeção viral das vias áreas superiores, na infeção pelo herpes-zóster e na sarcoidose.
Em mais de 50% dos casos, a recuperação total ocorre em algumas semanas ou meses, especialmente nos jovens. Em muitos casos, a recuperação é incompleta, sendo que raramente não ocorre. Como sequela, podemos observar a regeneração aberrante do nervo, causando movimentos sincinéticos entre o andar superior e inferior da hemiface, mioquímias e hemiespasmo facial.
O tratamento na fase aguda deve contemplar medidas de proteção e lubrificação da córnea. Está demonstrada a eficácia da corticoterapia nos primeiros dias de lesão (1 mg kg/dia
durante 6 dias, com redução gradual da dose durante 10 dias).
Mononeuropatias múltiplas
Este termo designa a lesão simultânea ou sequencial de troncos nervosos não-contíguos. Em cerca de 30% dos casos, está relacionada com uma vasculite (po-liarterite nodosa, artrite reumatoide) ou com outra causa de lesão dos pequenos vasos (diabetes, crioglobulinemia). Os quadros muito avançados com lesão de vários nervos podem ser difíceis de distinguir da PNP.
lesão Dos plexos
A inervação dos membros superiores e inferiores faz-se, respetivamente, através do plexo braquial e lombossagrado. Estas estruturas estão sujeitas a lesão: trauma, infiltração neoplásica ou inflamação de provável etiologia autoimune (plexites).
O plexo braquial é o mais frequentemente envolvido, quer por trauma (acidentes de motociclos, durante o parto) quer por inflamação (plexite ou síndroma de Parsonage-Turner). A plexite condiciona dor, rapidamente seguida de paresia e a recuperação é gradual. O EMG ajuda a estabelecer o diagnóstico e o prognóstico.
Polineuropatia
As PNP condicionam não só sintomas “negativos”, como “encortiçamento”, diminuição da sensibilidade, desequilíbrio da marcha, fraqueza muscular com paresia, disfunção erétil, como também estão na origem de sintomas “positivos”, como disestesias, dor nevrálgica (dor neuropática), hiperpatia, síndroma de pernas inquietas entre outros.
DOENÇAS DA PLACA NEUROMUSCULAR
As doenças da placa neuromuscular resultam da destruição, ausência ou disfunção de uma ou mais proteínas envolvidas na transmissão neuromuscular. A acetilcolina (ACh) é libertada pelos botões axonais distais das fibras motoras, fixando se nos recetores presentes numa zona diferenciada da membrana muscular (placa neuromuscular), onde existem recetores para esta molécula (AChR). A ativação dos recetores promove a despolarização do sarcolema, com a abertura dos canais de sódio. A ACh
Doenças neuromusculares Neurologia Fundamental 109 © Lidel –Edições Técnicas, Lda.
sobretudo postural e pode apresentar um componente cinético.
terapêutica
Tremor essencial
Há várias estratégias terapêuticas conhecidas. Uma delas é muitas vezes descrita logo pelo doente como eficaz, detetada por experiência prévia: a ingestão de bebidas alcoólicas melhora o tremor essencial. Dados os riscos implicados no consumo crónico, particularmente o desenvolvimento de tolerância e dependência, esta abordagem deve ser evitada. A escolha dos agentes terapêuticos farmacológicos depende da sensibilidade individual, mas também da localização e do tipo mais incomodativo de tremor. A evidência atual mais robusta indica o seguinte:
X Tremor das mãos – O propranolol, a primidona e o topiramato são os mais eficazes. Na prática clínica é usual associá-los quando a monoterapia perde eficácia. O alprazolam e o uso de toxina botulínica poderão ser úteis. Os casos graves de tremor poderão ser candidatos a cirurgia funcional ou terapia por ultrassons de alta frequência guiada por ressonância magnética;
X Tremor cefálico e da voz – A evidência disponível é fraca para as várias estratégias terapêuticas. No entanto, é habitual o uso dos mesmos agentes farmacológicos descritos para o tremor dos membros, incluindo toxina botulínica, muitas vezes em combinação e, por vezes, adicionado o clonazepam. A melhoria é, em regra, modesta.
Tremor específico de tarefa
O tremor mais frequentemente descrito é o da escrita. O propranolol, apesar de descrito como benéfico muitas vezes é ineficaz, e a injeção de toxina botulínica pode ser a única alternativa, embora aqui a eficácia seja também limitada.
Tremor isolado da voz e cefálico
A evidência disponível é fraca. Usualmente, tentam-se os mesmos agentes descritos para o
tremor essencial. Caso o tremor da voz ou cefálico tenham associado uma distonia laríngea ou cervical, a toxina botulínica poderá ser útil.
Tremor distónico
A informação é escassa e a evidência fraca. Para o tremor dos membros, a maior informação disponível é para o uso de anticolinérgicos. No entanto, o seu uso deve ser cauteloso pelos efeitos secundários associados, sobretudo defeito cognitivo nos indivíduos idosos. O propranolol e a primidona também foram usados em alguns estudos, mas com aparente menor eficácia. A dificuldade de diagnóstico diferencial entre tremor essencial e tremor distónico, e o perfil de segurança e a tolerabilidade dos diferentes fármacos, conduz a que o propranolol e a primidona sejam usados antes dos anticolinérgicos em muitos casos. Alguns casos de tremor distónico são particularmente sensíveis ao clonazepam. No caso do tremor axial (cefálico e voz), a aplicação de toxina botulínica parece ser a intervenção mais eficaz. Os casos de tremor distónico grave e com pouca resposta às intervenções farmacológicas, podem ser candidatos a cirurgia funcional dos gânglios da base.
PARKINSONISMO IATROGÉNICO introDução
Há muitos medicamentos que causam ou (des)mascaram um quadro de parkinsonismo, mais ou menos fruste. Independentemente do seu mecanismo de ação principal e da sua eficácia para a indicação da prescrição, há medicamentos que podem causar parkinsonismo quer por reação adversa tipo A ou previsível, ou tipo B ou inesperada (não decorrente do mecanismo de ação principal). Os sintomas mais frequentemente responsáveis pelo quadro de parkinsonismo iatrogénico são: tremor de repouso, rigidez, perturbação da marcha, bradicinesia, sialorreia, e tremor postural/intencional.
grupos farmacoterapêuticos mais implicaDos
Como grupo, os neurolépticos e antipsicóticos (antagonistas sobretudo D2) são os que mais causam parkinsonismo, a par com
Doenças do movimento Neurologia Fundamental 141 © Lidel –Edições Técnicas, Lda.
coluna induzida pelos movimentos de flexão extensão) e a nevralgia do trigémio no jovem.
A demência ocorre geralmente apenas em quadros muito avançados, mas existe frequentemente defeito cognitivo, que se manifesta como perturbação dos mecanismos de evocação e, sobretudo lentificação no processamento de nova informação, com repercussão na aprendizagem.
Não fazem parte da doença, obrigando a procurar outras etiologias, os defeitos neurológicos que traduzem envolvimento da substância cinzenta cortical (afasia, neglect, hemianopsia), ou subcortical (rigidez, tremor em repouso, discinesias), bem como aqueles outros traduzindo envolvimento do sistema nervoso periférico (atrofias musculares, fasciculações, defeito de sensibilidade simétrico com distribuição em meia e luva). As crises epiléticas apesar de não serem comuns na doença, são cerca de quatro vezes mais frequentes no doente portador de EM do que na população em geral.
Esclerose múltipla e incapacidade
A EM é uma doença extremamente imprevisível com prognóstico difícil de estabelecer individualmente. A incapacidade resulta quer do defeito cumulativo proveniente das sequelas dos sucessivos surto, quer, sobretudo, da ulterior evolução progressiva, a qual, na grande maioria dos casos, irá determinar a severa incapacidade que os doentes com EM poderão vir a experimentar. A incapacidade no doente com EM é avaliada por uma escala desenvolvida por John Kurtzke, denominada Expanded Disability Status Scale (EDSS). A EDSS é uma escala de meios pontos, variando entre 0 (exame neurológico normal) e 10 (morte por EM). Foi construída atribuindo ao exame neurológico de diferentes subsistemas funcionais (funções piramidais, funções cerebelosas, funções do tronco cerebral, funções sensitivas, funções esfincterianas, funções visuais, funções mentais) uma pontuação que traduz o grau de incapacidade do doente com EM. Uma das vantagens desta escala é estar amplamente difundida, outra é a imediata correspondência que se estabelece entre uma determinada pontuação e o perfil de desempenho motor do doente com EM. Assim, 6 corresponde ao doente com apoio unilateral de canadianas; 6,5 ao doente que utiliza apoio
bilateral e 7 ao doente confinado à cadeira de rodas, mas capaz de a conduzir e de se transferir. A EDSS tem, contudo, algumas limitações. Avalia fundamentalmente funções motoras, não tendo em linha de conta outros sintomas que podem igualmente ser muito incapacitantes e limitativos, como é o caso da fadiga. Pese embora a grande variabilidade individual, o tempo médio para atingir a pontuação de 5 (200 metros sem assistência) é de 10 anos; a pontuação de 6,5 (apoio bilateral constante) é de 15 anos e o 7 (cadeira de rodas) é de 29 anos.
Esclerose múltipla e gravidez
Sendo a EM uma doença do adulto jovem que atinge preferencialmente o sexo feminino, é natural que nos interroguemos sobre o efeito da gravidez na doença. Sabemos atualmente que o período de gravidez exerce um efeito protetor, havendo menos surtos durante a gestação. Pelo contrário, o puerpério é um período de maior suscetibilidade para surtos de exacerbação. Não há, contudo, qualquer evidência de que estes surtos sejam mais graves ou induzam mais sequelas do que quaisquer outros que a doente possa vir a experimentar durante todo o curso da enfermidade. Está hoje provado que doentes que tiveram várias gravidezes não estão mais incapacitadas do que aquelas que decidiram não procriar. O aconselhamento médico sobre a gravidez fica assim fundamentalmente dependente do grau de incapacidade que a doente tenha no momento em que deseje engravidar e da atividade da doença que pode obrigar a escalar terapêutica, o que não é de todo conveniente durante uma gravidez.
Diagnóstico
O diagnóstico definitivo de EM pressupõe demonstrar a existência de lesões da substância branca do SNC disseminadas no espaço e no tempo. Para tal há que recorrer a elementos clínicos (história de múltiplos episódios e exame neurológico, revelando alterações só passíveis de serem provocadas por lesões múltiplas no SNC), conjugados com os dados paraclínicos dos exames complementares (ressonância magnética encefálica e medular e potenciais evocados visuais, auditivos e somatossensitivos) e laboratoriais (imunoeletroforese do LCR).
Doenças desmielinizantes do sistema nervoso central Neurologia Fundamental 149 © Lidel –Edições Técnicas, Lda.
Observações
Indicação –Fase doença/ /apresentação
Elevada segurança a longo prazo Seguros na gravidez
EM –surto remissão, desde as fases iniciais
Terapêutica mais frequentemente utilizada em 1.ª linha para tratamento de EM surto remissão
Deve ser descontinuado e eliminado antes da gravidez
Aguarda-se a introdução em Portugal de novas moléculas S1P (ponesimod e ozanimod e siponimod) para tratamento de EM secundárias progressiva com surtos (continua)
EM –surto remissão, em 2.ª linha
Doenças desmielinizantes do sistema nervoso central Neurologia Fundamental
154
Denominação Nome comercial Via de administração Frequência Locais Gerais
Síndroma gripal após a administração Alterações da tiroide (tiroidites) hematológicas (anemia, linfopecia trombocitopenia) e hepáticas (hepatites), muito raras
Efeitos secundários Betaferon®
Regulador da resposta imunitária celular TH1 e TH2
Síndroma gripal muito frequente
Reações locais muito frequentes
Muito raras
Lipoatrofia e nódulos nos locais da injeção
Intolerância digestiva, Flushing facial e eritemas cutâneos, linfopenias (podem ser persistentes e graves em 5% dos casos)
Intolerância digestiva (rara) Hepatites tóxicas (mais frequentes nos primeiros 6 meses, obrigando a monitorização hepática mensal)
Linfopenias (frequentes); hipotensão e arritmia (bradicardias); edema macular; aumento da taxa de neoplasias cutâneas (basaliomas)
beta IFN beta 1b
3 x/semana
Subcutânea
Rebif ®
IFN 1a
De 2 / 2 semanas
Subcutânea
3 x/semana Aumento da população das células Tregs
Desconhecido
Inibe a rápida proliferação de linfócitos T e B por interferir com a síntese de novo da pirimidina
Sequestração de linfócitos ativos nos gânglios periféricos
Avonex®
Plegridy®
Intramuscular 1 x/Semana INF beta pegilado
Subcutânea
Copaxone®
Diário (2 x/dia)
Diário (1 x/dia)
Diário (1 x/dia)
Oral
Tecfidera®
Oral
Aubagio®
Oral
Gylenia®
Fingolimode
Acetato de glatirâmero
Fumarato de dimetilo
Teriflunomida
Inibidores dos recetores da esfingosina 1-fosfato (S1P)
Tabela 10.2 • Fármacos disponíveis em Portugal: as suas características farmacológicas, mecanismos de ação efeitos secundários e indicações nas diferentes formas da doença. Fármaco
Administração Grupo
Mecanismo de ação Interferão
e Extavia®
Subcutânea
Em dias alternados
Reações no local da injeção: nódulos; eritema, ulcerações (frequentes)
Quadro 11.3 • Demência com corpos de Lewy. Critérios de diagnóstico.
1. Característica central (essencial para o diagnóstico de DLB possível ou provável):

A. Demência, definida como declínio cognitivo progressivo de magnitude suficiente para interferir com as funções sociais ou ocupacionais
B. O defeito de memória proeminente ou persistente pode não ocorrer necessariamente nos estádios precoces da doença, mas é geralmente evidente com a progressão
C. Os defeitos em testes de atenção, funções executivas e capacidades visuoespaciais podem ser particularmente proeminentes
2. Características clínicas nucleares (as três primeiras destas características geralmente acontecem precocemente e podem persistir):
A. Cognição flutuante com variações marcadas na atenção e vigilidade
B. Alucinações visuais recorrentes tipicamente nítidas e detalhadas
C. Perturbação de comportamento do sono REM, que pode preceder o declínio cognitivo
D. Um ou mais aspetos sugestivos de parkinsonismo: bradicinesia, tremor de repouso, rigidez
3. Características clínicas sugestivas:
A. Sensibilidade marcada aos neurolépticos, instabilidade postural, quedas recorrentes, síncope, alteração disautonómica severa (hipotensão ortostática, incontinência urinária), alucinações de outras modalidades, ilusões sistematizadas, alterações comportamentais (apatia, ansiedade e depressão)
4. Biomarcadores indicadores de diagnóstico:
A. Redução da captação do transportador de dopamina nos gânglios da base demonstrada por SPECT/PET
B. Baixa captação na cintigrafia do miocárdio com metaiodobenzilguanidina (MIBG)
C. Confirmação em polisonografia de perturbação de comportamento do sono REM
5. Biomarcadores sugestivos de diagnóstico:
A. Preservação relativa das estruturas internas do lobo temporal na TC/RM
B. Redução da captação generalizada no SPECT/PET de perfusão, particularmente da atividade occipital
C. Alteração do EEG (atividade lenta posterior acentuada com flutuações e com ondas abruptas)
X Para o diagnóstico de DLB provável é necessário:
Duas ou mais características clínicas nucleares, com ou sem a presença de biomarcadores indicadores de diagnóstico
Apenas uma característica clínica nuclear, mas com um ou mais biomarcadores indicadores de diagnóstico
O diagnóstico de DLB provável não se pode basear unicamente em biomarcadores
X Para o diagnóstico de DLB possível é necessário:
Apenas uma característica clínica nuclear, sem evidência de biomarcadores indicadores de diagnóstico
Um ou mais biomarcadores indicadores, mas sem características clínicas nucleares
X O diagnóstico de DLB é menos provável:
A. Em presença de outras doenças médicas ou cerebrais (incluindo doença cerebrovascular evidenciada por sinais neurológicos focais ou em estudos de imagem) capazes de contribuir, no todo ou em parte, para o quadro clínico
B. Se o parkinsonismo é a única característica clínica nuclear e só surge no estádio de demência grave
Adaptado de McKeith et al., 2017.
Figura 11.2 – Doente de 54 anos, com queixas de esquecimentos nos últimos três anos, recentemente manifesta sintomas e sinais parkinsónicos, e flutuações cognitivas notórias. Foi estabelecido o diagnóstico de demência com corpos de Lewy. O PET Scan cerebral (PiB) não tinha evidenciado alterações (não mostrado). O estudo cintigráfico DaTSCAN identificou redução da captação do transportador de dopamina (ioflupano) no estriado sobretudo à direita (setas) (ver figura a cores em extratexto).
é um constituinte essencial dos corpos de Lewy, sendo que raramente a demência com corpos de Lewy é devida a mutações do gene da α sinucleína (SNCA).
Muito recentemente foi publicado um consenso que pode assistir o diagnóstico neuropatológico da doença.
Declínio cognitivo e demência Neurologia Fundamental 163
© Lidel –Edições Técnicas, Lda.
esquerda (seta). Ao meio: lesões vasculares lacunares (setas), e atrofia de predomínio subcortical. Direita: lesões isquémicas periventriculares (setas) e atrofia de predomínio subcortical. B. RM de doente com angiopatia amiloide. Esquerda: várias hemorragias corticais occipitais (setas; imagem ponderada em T2*). Direita: lesões isquémicas subcorticais e periventriculares (setas; imagem em FLAIR). C. RM de doente com enfarte estratégico talâmico (setas; à esquerda, imagem em FLAIR; à direita, imagem ponderada em T2).



Para que se possa fazer um diagnóstico de DV, é necessária a comprovação imagiológica de doença vascular cerebral, a existência de síndroma demencial e uma relação entre as duas, para além da exclusão de outras causas de demência. Existem vários critérios de DV e que têm diversas limitações, entre as quais o modelo neuropsicológico usado, muitas vezes influenciado pela doença de Alzheimer em que predomina o defeito de memória (Quadro 11.6). Nas últimas décadas, tem surgido evidência que
sustenta o conceito mais lato de defeito cognitivo de causa vascular, que engloba qualquer tipo de defeito cognitivo resultante da doença vascular cerebral, desde o defeito cognitivo sem critérios de demência à demência vascular. Esta entidade é consideravelmente mais útil no plano clínico que o de DV “tradicional”. Existem vários critérios de diagnóstico propostos para defeito cognitivo devido a doença vascular cerebral, que não sendo sobreponíveis e ainda não consensuais, designam de forma geral a mesma entidade. O critério de VASCOG (Sachdev et al., 2014) (Quadro 11.6) tem a vantagem de separar defeito ligeiro de defeito grave, baseado no DSM-5, e ainda entre doentes com AVC e doentes sem AVC. Em qualquer dos casos, a presença de doença vascular cerebral tem de ser adequadamente documentada.
terapêutica
A terapêutica da DV passa, em grande parte, pelas medidas de prevenção do AVC. Ainda que não exista evidência segura de que os doentes com DV “pura” beneficiem dos fármacos antidemenciais, a verdade é que na prática clínica muitos doentes, sobretudo idosos, terão patologia mista, degenerativa e vascular, e poderão beneficiar desses fármacos. Salientar se á que, uma vez iniciados estes fármacos, deve ser feita monitorização clínica atenta para avaliar efeitos secundários e eficácia da medicação.
O SEGUIMENTO CLÍNICO DO DEFEITO COGNITIVO OU DEMÊNCIA
Ao doente com defeito cognitivo ou demência deverá ser assegurado seguimento clínico (NICE guideline , 2018). Os aspetos específicos do tratamento das doenças mais frequentes que provocam demência já foram apontados anteriormente. É de salientar, como aspeto geral, que os sintomas comportamentais e psicológicos que acompanham as várias demências são muito frequentes e importantes pelo sofrimento que provocam no paciente e também no cuidador, e são estes sintomas que muitas vezes determinam a institucionalização do paciente.
Entre os sintomas psicológicos encontram-se os pensamentos delirantes, ilusões,
Declínio cognitivo e demência Neurologia Fundamental 167
A B C
© Lidel –Edições Técnicas, Lda.
Figura 11.4 – Várias imagens cerebrais de doentes com défices cognitivos de causa vascular. A. TC de doente com CADASIL devido a mutação do gene NOTCH 3. Esquerda: enfarte da artéria cerebral posterior
específica com aciclovir (10 mg/kg EV 8/8h durante 14-21 dias) está disponível para a encefalite herpética e deve ser iniciado perante suspeita do diagnóstico, a fim de evitar complicações e melhorar o prognóstico. O aciclovir também pode ser eficaz na encefalite por VZV; o ganciclovir e foscarnet são as terapêuticas recomendadas na encefalite a CMV.
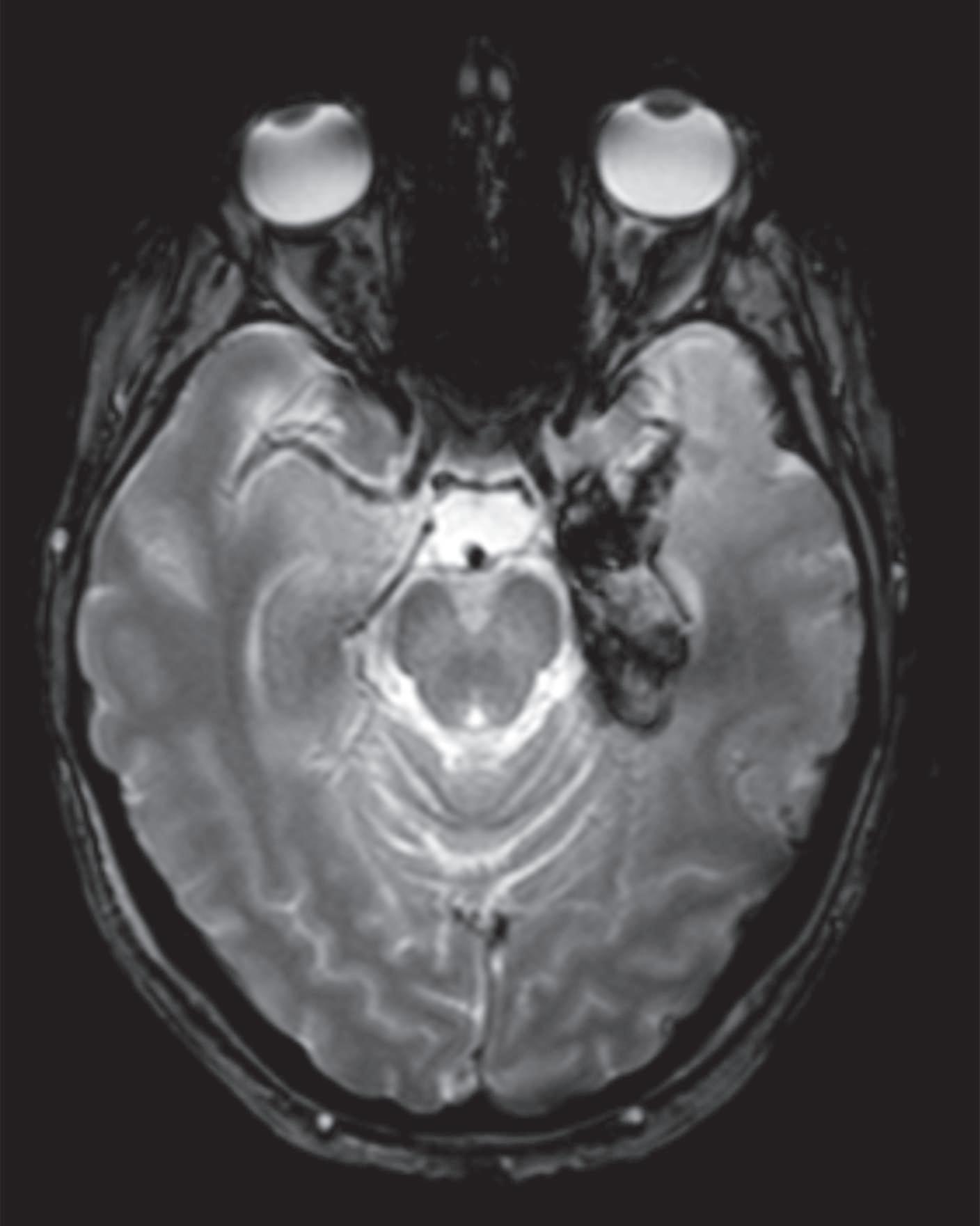
A encefalite herpética é a encefalite esporádica mais comum, associando-se a uma mortalidade e morbilidade importantes na ausência de tratamento atempado. A infeção ocorre primariamente, após exposição a secreções respiratórias ou saliva infetadas, ou por reativação do vírus latente no gânglio do nervo trigémeo. Atinge, predominantemente o lobo temporal mesial e a região orbitofrontal, podendo causar afasia, alterações comportamentais e mnésicas proeminentes. A RM CE caracteriza se por insuflação e hipersinal T2/FLAIR (fluid-attenuated inversion recovery)/DWI (diffusionweighted imaging), podendo desenvolver áreas de necrose hemorrágica (Figura 12.1). No entanto, em cerca 5% dos casos a RM-CE pode ser normal. O EEG revela geralmente lentificação da atividade de base e descargas periódicas nas regiões temporais uni
ou bilateralmente. O LCR pode ser normal na fase inicial mas, tipicamente, apresenta características de meningite viral, podendo conter eritrócitos e xantocromia pela presença de áreas hemorrágicas no parênquima cerebral. O diagnóstico é confirmado pela pesquisa do vírus no LCR por PCR. Este teste apresenta uma elevada sensibilidade (96%) e especificidade (99%), no entanto falsos negativos podem ocorrer, sobretudo se efetuado precocemente (< 48 horas) e na presença de produtos de degradação de hemoglobina no LCR. Quando a suspeita clínica se mantém, a terapêutica antiviral deve ser mantida, repetindo-se a PL entre os 3º-7º dias de doença.

Encefalite herpética
A encefalite herpética atinge o lobo temporal e a região orbitofrontal, causando afasia, alterações comportamentais e mnésicas. Associa-se a morbilidade e mortalidade elevadas, se não for tratada precocemente.
ABCESSOS INTRACRANIANOS



Os abcessos intracranianos são infeções graves e relativamente raras, exceto em doentes

Infeções do sistema nervoso central Neurologia Fundamental 177
© Lidel –Edições Técnicas, Lda.
A B C D E F
Figura 12.1 – Encefalite herpética. RM-CE mostra hipersinal e aspeto insuflativo em FLAIR da região temporomesial e ínsula à esquerda no D3 de doença (A-C); marcado aumento da extensão das lesões no D38 de doença com hipersinal em FLAIR na região temporomesial bilateralmente com maior extensão à esquerda e opérculo-insular (D, E), associado a componente hemorrágico na região temporal interna em T2* (F).
Tabela 12.5
• Principais doenças neurológicas oportunistas na infeção VIH. Doenças oportunistas Apresentação clínica Diagnóstico Tratamento
Meningite criptocócica (Cryptococcus neoformans)
Toxoplasmose (Toxoplasma gondii)
X Meningite fúngica (síndroma meníngea subaguda/crónica, hidrocefalia, disfunção pares cranianos, vasculite)
X Criptococomas parenquimatosos
X Encefalite focal (cefaleia, confusão, febre, sinais neurológicos focais, incluindo doenças do movimento, crises epiléticas)
X Encefalite difusa
X Soro: Ag
X TC/RM-CE: realce meníngeo, hidrocefalia, criptococomas
X LCR: pleocitose linfocítica, proteínas ↑, glicose N ↓ /normal; Gram tinta da china; Ag e cultura, PCR Cryptococcus
X RM-CE: ≥1 lesão nodular com realce em anel na transição SB-SC e GB
X Soro: IgG positiva
X LCR: serologia e PCR
X Biópsia: Exame anatomopatológico
X Indução: anfotericina B EV + flucitosina oral (2 semanas)
X Consolidação: fluconazol
400 mg/dia oral (8 semanas)
X Manutenção: fluconazol
200 mg/dia oral (1 ano)
X Tratamento: indução e manutenção: sulfadiazina + pirimetamina + leucovorina
X Profilaxia primária*: TMP/SMX (se CD4 <100/μL e IgG + soro)
Linfoma primário do SNC (Linfoma difuso de grandes células B associado a EBV, não-Hodgkin)
Leucoencefalopatia multifocal progressiva – LEMP ou PML (Vírus JC)
Infeção a citomegalovírus (CMV)
X Parênquima (cefaleia subaguda, defeito cognitivo, depressão da consciência, crises epiléticas, sinais focais, sinais de HIC)
X Leptomeníngeo (meningo-encefalite) com envolvimento de pares cranianos, meningorradiculite)
Doença desmielinizante SNC (defeito cognitivo e sinais neurológicos focais subagudos, crises epiléticas)
X Encefalite difusa (E)/focal (EF)
X Venticulite (V)
X Meningite assética (M)
X Polirradiculomielite (RM)
X Meningomielite (MM)
X Neuropatia multifocal
X Miosite
Infeção a Varicella zoster (VZV)
Tuberculose (Mycobacterium tuberculosis)
X Encefalite focal/difusa
X Meningite
X Mielite
X Vasculite: AVC isquémico
X Mono/polirradiculite
X Meningite subaguda/crónica
X Neuropatia múltipla de nervos cranianos
X Hidrocefalia
X Tuberculoma/abcesso cerebral ou espinhal
X Meningorradiculite ou radiculomielite
X Vasculite intracraniana/espinhal: AVC/AVM isquémico (artérias perfurantes/artéria espinhal anterior, respetivamente)
X Espondilite e abcessos paravertebrais
X RM-CE: lesões irregulares solitárias ou múltiplas com realce, frequente/ /na região periependimária, corpo caloso e periventricular (DD: toxoplasmose e abcessos cerebrais)
X LCR: células neoplásicas no exame citopatológico; PCR do EBV
X Biópsia: Exame anatomopatológico
X RM-CE: lesões assimétricas SB em T2/FLAIR, atingindo fibras U subcorticais, raro realce
X LCR e biópsia: PCR do vírus JC
X Biópsia: Exame anatomopatológico
X RM-CE: pode ter realce meníngeo (M e MM), ependimário (E e V), raízes e cauda equina (RM), lesão focal (EF), normal ou atrofia inespecífica
X LCR: pleocitose linfocítica (PMN na forma RM), glicose N-↓, proteínas N-↑; PCR do CMV
X RM-CE: áreas hiperintensas focais/ /difusas em T2/FLAIR, ± realce das lesões e meníngeo
X LCR: pleocitose linfocítica, PCR do VZV
X TC/RM-CE: Realce meníngeo base crânio, perimedular, raízes nervosas; Hidrocefalia; AVC periventriculares, tronco cerebral, intramedular; mielite; lesão expansiva, com edema adjacente e realce
X LCR: pleocitose PMN → linfocítica; exame direto BAAR, exame cultural, PCR do M. tuberculosis
X Biópsia: Exame anatomopatológico, exame cultural e PCR M. tuberculosis
X Terapêutica antirretroviral
X Radioterapia
X Corticoterapia
X Metotrexato + rituximab
Terapêutica antirretroviral
Ganciclovir EV (5 mg/kg 12/12h) + Foscarnet EV (90 mg/kg 12/12h) durante 21 dias
X Encefalite/meningite/mielite: aciclovir EV (10 mg/kg 8/8h) 14-21 dias
X Radiculite: valaciclovir oral (1000 mg 8/8h) 7-10 dias
X Antibacilares: isoniazida + rifampicina + pirazinamida + etambutol (+ piridoxina) (2 meses) → isoniazida + rifampicina (9-12 meses)
X ± Corticoterapia
Ag: antigénio; AVC: acidente vascular cerebral; AVM: acidente vascular medular; BAAR: bacilos ácido-álcool resistentes; CE: cranioencefálica; DD: diagnóstico diferencial; EBV: vírus Epstein-Barr; EV: endovenoso; FLAIR: Fluid-attenuated inversion recovery; GB: gânglios da base; HIC: hipertensão intracraniana; Ig: imunoglobulina; JC: vírus John-Cunningham; LCR: líquido cefalorraquidiano; PCR: polymerase chain reaction; PML: progressive multifocal leukoencephalopathy; PMN: polimorfonucleares; RM: ressonância magnética; SB-SC: substância branca-substância cinzenta; SNC: sistema nervoso central; TC: tomografia computorizada; TMP/SMX: trimetoprim/sulfametoxazol. ↓: reduzido; ↑: aumentado; N: normal *Na prática, os doentes iniciam profilaxia com TMP/SMX para prevenção de Pneumocystis jirovecci quando CD4 <200/μl, o que favoreceu a redução da incidência da toxoplasmose cerebral.
Infeções do sistema nervoso central Neurologia Fundamental 185 ©
–
Lidel
Edições Técnicas, Lda.
Quando um glioma se apresenta com multifocalidade, o valor de uma intervenção cirúrgica para excisão tumoral (excetuando biópsia lesional para caracterização histológica) é habitualmente limitado. Outro cenário em que poderá ser equacionada uma excisão de parte do tumor é quando há evidência de risco iminente de herniação e compromisso subsequente do tronco cerebral.
Atualmente, a intervenção cirúrgica, além de ser guiada pelo estudo pré-operatório de RM, com tratografia e eventualmente por monitorização intraoperatória, pode ser feita com administração pré-operatória de ácido 5-aminolevulínico (5-ALA) que é captado pelas células tumorais de tumores gliais de alto grau e metabolizado em porfirinas fluorescentes, que emitem fluorescência quando expostos intraoperatoriamente a luz azul. Esta técnica permite efetuar remoções mais extensas, permitindo aumento da sobrevida livre de doença aos seis meses. Contudo, não revela diferença estatisticamente significativa na sobrevida global dos doentes.
Além do tratamento cirúrgico, que deve ter como objetivo uma remoção o mais extensa possível, os gliomas de alto grau devem ser tratados com radioterapia e quimioterapia.
O protocolo de Stupp envolve uma fase inicial de radioterapia complementada com temozolomida, seguido de uma segunda fase de tratamento com temozolomida.
A abordagem com cirurgia citorredutora complementada com radioquimioterapia, permite melhoria da sobrevida global dos doentes com glioblastomas de quatro meses para cerca de 15 meses na maioria dos estudos.
Em casos de recorrência de gliomas de alto grau, a cirurgia continua a ser o tratamento de primeira linha caso seja expetável que se consiga efetuar uma remoção significativa da massa tumoral (de, pelo menos, 90% do volume tumoral) sem causar defeitos neurológicos major, em doentes com um Karnofsky performance status (KPS) superior ou igual a 70%, seguido de quimioterapia adjuvante.
Gliomas de alto grau
Os gliomas de alto grau têm um pico de incidência aos 65 anos. O prognóstico é desfavorável, com sobrevida estimada de dois a três anos para glioma grau 3 da OMS e de cerca de 15 meses para gliomas grau 4. O tratamento habitual é inicialmente cirúrgico e tem como objetivos: citorredução tumoral, redução do efeito de massa e diagnóstico histológico. O tratamento adjuvante consiste em radioquimioterapia. Quando um glioma se apresenta com multifocalidade, o valor de uma intervenção cirúrgica para excisão tumoral (excetuando biópsia para caracterização histológica) é habitualmente limitado.

MENINGIOMAS inciDência
Os meningiomas representam 20% de todas as neoplasias primárias intracranianas. A incidência varia entre 2 e 15 por 100.000. São mais frequentes no sexo feminino e diagnosticados sobretudo nas quinta e sexta décadas de vida.
localização
Os meningiomas são tumores extra-axiais que podem ocorrer em qualquer ponto ao
Neoplasias intracranianas Neurologia Fundamental 205 © Lidel –Edições Técnicas, Lda.
A B
Figura 13.3 – Glioblastoma, grau 4 da OMS. A. TC revelando tumor frontal de aspeto heterogéneo com área de necrose central, marcado edema e efeito de massa com acentuado desvio da linha média. B. RM T1 mostra glioblastoma dos núcleos da base. É evidente a captação de contraste à periferia e a zona mais central não captante, correspondendo a necrose.
à remoção total do tumor e excisão da dura de implantação e o grau V à simples biópsia.
Meningiomas da convexidade prestam-se habitualmente a remoções de grau I, enquanto tumores da base do crânio com envolvimento do seio cavernoso não podem ser removidos na totalidade, sob pena de incorrer em defeitos neurológicos graves permanentes. Nos tumores em que não é possível obter remoções totais, o uso de radiocirurgia ou radioterapia estereotáxica fracionada permite controlar o crescimento tumoral em número considerável de casos.

A radioterapia convencional está reservada para meningiomas atípicos e malignos que apresentam taxas de recorrência de 29 a 52% e 50 a 94%, respetivamente.
Antagonistas de recetores tumorais têm sido usados com algum sucesso nalguns tipos de meningiomas, nomeadamente em recidivas. A quimioterapia pode ter algum papel em meningiomas malignos após cirurgia e radioterapia.
Meningiomas
Os meningiomas representam 20% de todas as neoplasias primárias intracranianas e são mais frequentes no sexo feminino, sendo diagnosticados maioritariamente nas 5ª e 6ª décadas de vida. Classificam-se em três tipos principais: benignos (grau 1), atípicos (grau 2) e malignos (grau 3). A cirurgia é a modalidade terapêutica principal. O grau de remoção cirúrgica está relacionado com a taxa de recorrências.
METÁSTASES INTRACRANIANAS



As metástases cerebrais são os tumores intracranianos mais frequentes, desenvolvendo-se em 20 a 40% dos doentes oncológicos.
A ocorrência deste tipo de tumores continua a aumentar devido à sobrevida mais prolongada dos doentes com neoplasias sistémicas, porque a incidência de carcinoma do pulmão e de melanoma maligno continuam a crescer e porque os exames de imagem, nomeadamente a RM, têm maior sensibilidade para detetar lesões intracranianas. Um estudo populacional, oriundo da Suécia, revelou um aumento para o dobro da incidência anual de internamentos por metastização cerebral entre 1987 e 2006.
As neoplasias sistémicas que mais frequentemente metastizam para o cérebro são:
X Carcinoma do pulmão;
X Carcinoma da mama;
X Melanoma maligno;
X Carcinoma de células claras renais;
X Carcinoma colorretal.
O carcinoma do pulmão, sobretudo o de pequenas células, e o adenocarcinoma, apresentam a maior incidência de metástases cerebrais. Metade dos doentes apresenta lesões cerebrais únicas e a outra metade duas ou
Neoplasias intracranianas Neurologia Fundamental 208
Figura 13.5 – Meningioma do terço interno da grande asa do esfenoide. São evidentes a captação exuberante e homogénea de contraste e o marcado edema perilesional.
Para hérnias discais cervicais, uma discectomia cervical por via anterior com fusão (ACDF) é a cirurgia mais frequentemente realizada, com taxas de sucesso a 10 anos publicadas na literatura entre 85% e 95%.
Resultados
A maioria dos pacientes com cervicalgia e radiculopatia cervical melhora sintomaticamente, numa fase inicial, com tratamento conservador.
Em doentes com defeito neurológico ou radiculopatia intratável, a descompressão cirúrgica consegue, habitualmente, bons resultados.
Em doentes com mielopatia, a descompressão cirúrgica evita progressão da disfunção medular na grande maioria dos casos, mas a recuperação da função pré-mórbida é variável, dependendo da gravidade da lesão.
PATOLOGIA DEGENERATIVA LOMBAR
A patologia degenerativa da coluna lombar é muito prevalente e tem um grande peso socioeconómico sobre os sistemas de saúde em todo o mundo.
Manifesta-se maioritariamente com dor lombar (lombalgia) e é a segunda causa mais comum de incapacidade nos EUA na idade adulta.
canal estenótico lomBar
O canal estenótico lombar (CEL) decorre do estreitamento do canal raquidiano e atinge cerca de 80% da população com idade superior a 80 anos.
As alterações degenerativas que levam à formação de um CEL podem ocorrer no segmento central do canal raquidiano ou nos segmentos foraminais, comprimindo os nervos raquidianos, embora mais frequentemente seja visível uma conjugação de ambos.
O nível mais frequentemente envolvido numa estenose canalar é L4-L5 (Figura 14.2).
Hérnia Discal lomBar
Uma hérnia discal lombar (HDL) é uma protusão do disco intervertebral lombar no sentido
do canal vertebral, causando compressão dos nervos raquidianos lombares.
As hérnias discais lombares ocorrem mais frequentemente nos níveis L4-L5 e L5-S1.

Clínica e exame físico
A patologia lombar manifesta-se maioritariamente por dor lombar, muitas vezes acompanhada por quadros mais específicos como lombociatalgia ou claudicação neurogénica da marcha, de acordo com o tipo de compressão do saco tecal ou radicular.
Nos doentes com HDL, a lombociatalgia (“dor ciática”) é comum e consiste numa dor lombar com irradiação ao longo do membro inferior, num trajeto coincidente com a inervação do nervo ciático, ou alguma das suas raízes de L4 a S2.
A dor habitualmente agrava com a extensão ou rotação do tronco, e com a elevação do membro inferior em extensão (sinal de Lasègue), mas não agrava com a palpação local ao nível da coxa ou da perna, o que ajuda a distingui-la de patologia osteoarticular do membro inferior.
A compressão das raízes nervosas pode originar diminuição de força segmentar no membro inferior, bem como diminuição dos reflexos osteotendinosos correspondentes às raízes afetadas.
A compressão da raiz nervosa L5 (que ocorre habitualmente nas HDL L4-L5) pode causar défice motor na dorsiflexão do pé e do primeiro dedo, por vezes grave com steppage na marcha,
Doenças vertebromedulares Neurologia Fundamental 215 © Lidel –Edições Técnicas, Lda.
Figura 14.2 – Canal estenótico lombar L4-L5.






































