Istantanee di oncologia medica
Immunoterapia nel carcinoma cutaneo
a cellule squamose
avanzato: time is now


Istantanee di oncologia medica
avanzato: time is now

Moderatore
Paola Queirolo (Istituto Europeo di Oncologia, Milano)
Armando Santoro (Cancer Center UO Oncologia Medica ed Ematologia Humanitas Research Hospital)
Come si definisce un carcinoma cutaneo a cellule squamose avanzato (aCSCC)
Iris Zalaudek (Clinica Dermatologica, Università degli Studi, Trieste)
Cemiplimab primo inibitore di checkpoint immunitario nel carcinoma cutaneo a cellule squamose avanzato (aCSCC): dati di efficacia e di tollerabilità ad un più lungo follow-up
Paolo Bossi (Oncologia medica, ASST Spedali Civili, Università degli Studi, Brescia)
Dai clinical trial alla pratica clinica: sharing experience
Roberta Depenni (AOU Policlinico, Modena)
Report dal Simposio Satellite SANOFI-GENZYME/REGENERON
AIOM 2020 a cura di
Giovanni Mansueto
UOC Oncologia, Ospedale “F. Spaziani” – Frosinone
I carcinomi squamosi della cute (CSCC) rappresentano circa il 20-25% di tutti i tumori cutanei non melanomatosi. Nel nostro Paese i dati di incidenza di questa neoplasia non sono precisi per l’assenza di un registro nazionale delle neoplasie cutanee e soprattutto perché, riguardando spesso persone molto anziane, la diagnosi è solo clinica oppure non viene per niente effettuata. In base alle statistiche AIOM ed AIRTUM (2018/2019) è possibile stimare circa 11.000 casi in Italia, di cui circa il 5% in fase avanzata o metastatica. I principali fattori di rischio sono l’esposizione ai raggi ultravioletti (UV), l’età avanzata ed il fototipo chiaro. L’esposizione cronica cumulativa alle radiazioni UV (naturali ed artificiali) rappresenta il fattore di rischio
ambientale più importante per l’insorgenza di un CSCC e spiega anche il drastico aumento di incidenza con l’età. Nel 90% dei casi il tumore insorge su aree anatomiche cronicamente fotoesposte, come la regione testa/collo e la zona dorsale delle mani e degli avambracci. Il trattamento di scelta del CSCC è l’escissione chirurgica completa con controllo istopatologico dei margini di resezione, con un tasso di guarigione completa molto elevato (superiore al 90% dei casi).
Ad un follow-up di circa 10 anni, il tasso di recidive è pari al 4-5%, mentre i pazienti deceduti per progressione di malattia sono circa il 2%. Circa l’85% delle metastasi coinvolge i linfonodi loco-regionali, mentre le metastasi a distanza si localizzano più frequentemente nei polmoni, nel fegato, nel cervello, nella cute e nelle ossa.1 Nei pazienti in progressione dopo chirurgia primaria il re-intervento, la radioterapia e la chemioterapia hanno finalità esclusivamente palliative e non impattano sulla sopravvivenza.
Cemiplimab, anticorpo monoclonale umano antiPD-1, sta dimostrando di poter cambiare il corso del CSCC in fase avanzata/metastatica, poiché è attivo e ben tollerato anche in pazienti anziani, spesso fragili e con comorbilità. Appartiene alla classe delle immunoglobuline G4 (IgG4) e si lega al recettore PD-1 bloccandone l’interazione con i suoi ligandi PD-L1 e PD-L2.2 Il coinvolgimento di PD-1 attraverso i suoi ligandi, espressi dalle cellule presentanti l’antigene e potenzialmente anche dalle cellule tumorali e da cellule del microambiente tumorale, inibisce alcune funzioni delle cellule T come la proliferazione, la secrezione di citochine e l’attività citotossica. A partire da giugno 2020, cemiplimab è rimborsato in Italia per il trattamento dei pazienti con CSCC avanzato/metastatico (aCSCC) in progressione o non candidabili a chirurgia o radioterapia con intento curativo. Questo Simposio Satellite, che si è svolto all’AIOM di quest’anno con la sponsorizzazione di Sanofi-Genzyme/Regeneron, ci ha fatto conoscere meglio il farmaco ed i suoi positivi effetti a lungo termine nei pazienti con malattia avanzata.
Iris Zalaudek Clinica Dermatologica, Università degli Studi, Trieste
I carcinomi squamosi della cute (CSCC) costituiscono un gruppo eterogeneo (“ombrello”) di tumori a partenza dai cheratinociti, differenti tra loro per morfologia, caratteristiche biologiche, modalità di crescita e potenziale metastatico,3 definito da specifici fattori di rischio suddivisi in tre categorie (tabella 1):
1. clinici;
2. istopatologici;
3. legati al paziente.
La contemporanea presenza di almeno due tra questi fattori è significativamente associata ad una prognosi sfavorevole3 e perciò un paziente con queste caratteristiche avrà un’elevata probabilità di sviluppare una malattia avanzata, non operabile con intento radicale.
Il trattamento di scelta del CSCC è l’escissione chirurgica completa, lasciando un margine libero di almeno 4 mm nei pazienti a basso rischio e di almeno 6 mm in quelli ad alto rischio di recidiva (grado di raccomandazione positivo forte).1 La chirurgia radicale ha tassi di guarigione definitiva molto elevati, pari a circa il 90-95% dei casi.
Il carcinoma squamoso della cute viene definito localmente avanzato quando sussistono una o più di queste condizioni:
quando la chirurgia con intento radicale e la radioterapia non sono indicate per l’estensione di malattia (casi piuttosto rari), come nel caso di invasione dei tessuti profondi in alcune sedi particolari (ad esempio, palpebre, condotto auricolare interno);
1. FATTORI CLINICI
Sede
Tronco/arti: <2 cm
Testa/collo: <1 cm
Sede periorifiziale: NO
Tronco/arti: >2 cm
Testa/collo: >1 cm
Sede periorifiziale: SÌ
Margini Negativi Positivi
Tumore Primario Recidiva
Crescita rapida NO
2. FATTORI LEGATI ALL’ISTOLOGIA
SÌ
Grado di differenziazione Ben differenziato Scarsamente differenziato
Sottotipo acantolitico, adenosquamoso, desmoplastico NO
SÌ
Spessore tumorale – Livello di Clark <6 mm – Clark I-II-III >6 mm – Clark IV-V
Invasione oltre il grasso sottocutaneo NO
Invasione linfatica, vascolare, perineurale NO
3. FATTORI LEGATI AL PAZIENTE
Immunosoppressione NO
Precedente radioterapia o cute sede di infiammazione cronica NO
Sintomi neurologici NO
SÌ
SÌ
SÌ
SÌ
SÌ
quando la chirurgia e/o la radioterapia con intento curativo falliscono e compaiono (talvolta precocemente) delle recidive locoregionali, non ulteriormente trattabili con le stesse modalità; questi sono i casi che meglio stabiliscono l’importanza di discutere i casi in ambito multidisciplinare, poiché in questo modo si riesce a definire al meglio il potenziale outcome di ciascuna strategia;
quando la chirurgia di prima istanza e/o la radioterapia hanno una scarsa probabilità di cura, generalmente a causa della presenza di lesioni multiple senza limiti ben definiti e di comorbilità del paziente (immunosoppressione), che può favorire la crescita rapida e continuativa di queste lesioni e/o la comparsa di nuove.
In definitiva, ogniqualvolta si corra il rischio di alterare in senso negativo la qualità della vita di questi pazienti sarà opportuno prendere in considerazione il fatto di non sottoporli a trattamenti invasivi, valutando i notevoli effetti di una terapia ben tollerata come cemiplimab. I pazienti, perciò, dovranno essere correttamente informati sull’esistenza di un trattamento sistemico efficace per questa patologia, che dovrà essere proposto in tutti i casi in cui una strategia locoregionale non sia applicabile o venga rifiutata dal paziente per i rischi connessi alla sua applicazione. È molto importante, inoltre, promuovere la diagnosi precoce di queste neoplasie, perché si tratta spesso di pazienti anziani in cui le lesioni cutanee vengono considerate quasi normalmente compatibili con l’età e (a torto) poco pericolose, e perciò vengono tralasciate. L’aspetto della diagnosi precoce deve coinvolgere gli specialisti ma anche la popolazione generale, attraverso specifiche campagne di informazione. Inoltre, le problematiche relative alla definizione di malattia localmente avanzata ed ai criteri di scelta del trattamento locoregionale vs sistemico dovrebbero essere maggiormente stressati all’interno delle
linee-guida sui carcinomi cutanei, in modo tale da rendere il più possibile informati gli specialisti che si occupano di questa patologia. Sembra, infatti, mancare una conoscenza approfondita dell’efficacia di questi farmaci nei centri a più basso volume dove, peraltro, a volte non c’è collaborazione tra le figure di riferimento e si tende ad intervenire chirurgicamente con maggiore facilità rispetto ai centri ad alto volume.
Paolo Bossi
Oncologia medica, ASST Spedali Civili, Università degli Studi, Brescia
Fino allo scorso giugno, i pazienti con CSCC avanzato/metastatico non potevano giovarsi di terapie efficaci ed avevano una sopravvivenza mediana compresa tra 8 e 15 mesi.1 Con i regimi di chemioterapia contenenti platino le risposte obiettive erano in genere scarse e di breve durata (in media 4-5 mesi) ed il trattamento era spesso gravato da tossicità inaccettabili. Poiché EGFR è iperespresso nel 90% dei
tumori cutanei, anche alcuni inibitori di EGFR si sono dimostrati attivi nella malattia avanzata, ma sempre con risposte obiettive intorno al 15-20% dei casi, di breve durata (figura 1).4-9
Il razionale di utilizzo dell’immunoterapia nei carcinomi cutanei è senza dubbio legato alla presenza di un elevato carico mutazionale in questa patologia.10 Vi sono numerosi studi in corso in diversi ambiti, quali la terapia adiuvante/neoadiuvante e l’uso concomitante con la radioterapia, ma è sinceramente ancora presto per avere benefici concreti. Risultati molto importanti, invece, sono stati ottenuti nella malattia avanzata/metastatica, con un’alta percentuale di risposte obiettive ed una durata delle stesse molto più lunga rispetto alla chemioterapia ed agli inibitori di EGFR. Le finalità palliative di un trattamento sistemico dell’aCSCC, in epoca pre-immunoterapia, erano da intendere nel senso classico del termine, cioè come miglior gestione possibile dei sintomi correlati alla malattia e della qualità di vita del paziente. Ci si chiede allora se, con l’avvento di cemiplimab nell’aCSCC, in considerazione delle brillanti risposte ottenute, si possa ancora parlare di palliazione o se ci si debba riferire ad un più ampio concetto di cronicizzazione e di potenziale guarigione di questa malattia.
Nel 2018 sono stati pubblicati i risultati di EMPOWERCSCC-1 (trial 1540), studio multicentrico non randomizzato in aperto di fase II che ha arruolato 193 pazienti con SCC metastatico o localmente avanzato, non candidabili a chirurgia o radioterapia con intento potenzialmente curativo.11 I pazienti erano suddivisi in tre coorti: A (SCC localmente avanzati, n=78) e B (metastatici, n=59) ricevevano cemiplimab a dose 3 mg/kg di peso corporeo per via endovenosa ogni 2 settimane per un massimo di 96 settimane; la coorte C (n=56) riceveva invece cemiplimab a dose fissa, 350 mg per via endovenosa ogni 3 settimane per un massimo di un anno. L’approvazione della FDA e l’attivazione di un programma di uso compassionevole nominale in Italia sono stati ottenuti, nel 2019, dopo la presentazione dei dati aggregati relativi alle coorti A e B, avvenuta all’ASCO.12 I pazienti avevano in gran parte un SCC del distretto testa-collo ed erano quasi tutti pretrattati con chemio e/o radioterapia. Qualora i pazienti con malattia localmente avanzata avessero mostrato una risposta sufficiente a cemiplimab, era consentito l’intervento chirurgico con intento curativo. Obiettivo primario era il tasso di risposte obiettive (Overall Response Rate, ORR), confermato da revisione centralizzata indipendente (Independent Central Review, ICR) e valutato
Figura 1. Risposte obiettive da parte degli inibitori EGFR e della chemioterapia nei pazienti con aCSCC.

Erlotinib ORR: 10% (Gold et al., 2018) 4
Gefitinib ORR: 16% (William et al., 2017) 5
Cetuximab ORR: 21% (Dereure et al., 2016) 6
Dacomitinib ORR: 28% (Cavalieri et al., 2018) 7
Panitumumab ORR: 31% (Foote et al., 2014) 8

Platinum-based: 34% ORR (Fitzgerald e Tsai, 2019) 9
ogni 8 settimane. L’età mediana dei pazienti era 72 anni, il Performance Status ECOG era 0 (44,6%) o 1 (55,4%) ed il 40,4% dei pazienti aveva più di 75 anni. Il 33,7% dei pazienti aveva ricevuto almeno una precedente terapia sistemica, il 90,2% dei pazienti era stato precedentemente sottoposto ad intervento chirurgico correlato al tumore e il 67,9% dei pazienti aveva ricevuto una radioterapia. Tra i pazienti con mCSCC, il 76,5% aveva metastasi a distanza e il 22,6% solo metastasi linfonodali. Era richiesta, tra i criteri di inclusione, almeno una lesione misurabile e, ove necessario, veniva richiesto di documentare le lesioni cutanee tramite immagini fotografiche. Non era per-
messa l’inclusione in studio ai pazienti con malattie del sistema immunitario o trapiantati d’organo in terapia immunosoppressiva negli ultimi 5 anni. I risultati relativi all’obiettivo primario ed agli obiettivi secondari, relativamente a tutte e tre le coorti, sono stati presentati al Virtual ASCO 2020,13 aggiornati ad un follow-up mediano più lungo (15,7 mesi) (tabella 2).
Le risposte obiettive sono complessivamente (pazienti localmente avanzati e metastatici) del 46,2%, a cui si deve aggiungere un 23,8% di pazienti stabili. Ciò significa che, con cemiplimab, si ottiene un controllo di malattia nel 70% dei pazienti con
Tabella 2. Risultati di efficacia dello studio EMPOWER-CSCC-1 (coorti A, B e C) ad un follow-up mediano di 15,7 mesi - ASCO 2020, abstract 367.
SCC metastatici
Cemiplimab dose 3 mg/kg q2w (coorte B)(n=59)
SCC localmente avanzati Cemiplimab dose 3 mg/kg q2w (coorte A)(n=78)
SCC metastatici Cemiplimab dose fissa 350 mg q3w (coorte C)(n=56)
Totale coorti A + B + C (n=193) Durata media del
Controllo di malattia per almeno 6 mesi, % (95% CI)
Tempo medio alla risposta, mesi (range)
Durata media della risposta, mesi (range)
Stima dei pazienti in risposta dopo 12 mesi, % (range) Kaplan-Meier
Stima dei pazienti in risposta dopo 24 mesi, % (range) Kaplan-Meier
NR=non raggiunta; NE=non valutabile.
CSCC avanzato o metastatico. I pazienti che rispondono sembrano farlo rapidamente (tempo medio alla risposta di circa 2 mesi) e per un tempo lungo, visto che la durata mediana della risposta, in tutte e tre le coorti, non è stata ancora raggiunta. La percentuale di risposte complete è molto rilevante, sia nei pazienti localmente avanzati (12,8%) che in quelli metastatici (20,3%). Il tempo medio al raggiungimento della risposta completa è di 11,2 mesi, il che sottolinea l’importanza di proseguire il trattamento con cemiplimab fin quando sia evidente un beneficio clinico ed obiettivo o finché non insorga tossicità inaccettabi-
le, per non incorrere nel rischio di non individuare la risposta completa stessa. Decisamente interessante è anche la stima dei pazienti che ancora rispondono dopo 12 mesi (87,8%) e dopo 24 mesi (69,4%) di cemiplimab. La stima sembra essere indipendente dal fatto che i pazienti abbiano malattia localmente avanzata oppure metastatica. Altro aspetto interessante, peraltro tipico dell’immunoterapia, è il fatto che in circa il 20% dei casi localmente avanzati ed anche in alcuni casi metastatici vi sia un’iniziale stabilità alla prima rivalutazione che, successivamente, si tramuta in risposta parziale (figura 2).
Figura 2. Andamento delle risposte (swimmer plot) nei pazienti trattati con cemiplimab nello studio EMPOWER-CSCC-1; i pallini rossi indicano i pazienti stabili alla prima rivalutazione e che poi hanno raggiunto una risposta obiettiva nelle successive.
Probability of PFS
Number of patients at risk
Group 1 (n=59)
Group 2 (n=78)
Group 3 (n=56)
Total (n=193)
Probability of OS
Number of patients at risk
Group 1 (n=59)
Group 2 (n=78)
Group 3 (n=56)
Total (n=193)
Group 1 (mCSCC) 3 mg/kg Q2W (n=59)
Group 2 (laCSCC) 3 mg/kg Q2W (n=78)
Group 3 (mCSCC) 350 mg Q3W (n=56)
Total (n=193)
Tabella 3. Profilo di tollerabilità di cemiplimab nello studio EMPOWER-CSCC-1 (n=193).
La PFS mediana nei pazienti arruolati nello studio
EMPOWER-CSCC-1 non è stata ancora raggiunta e, all’analisi più recente (ottobre 2019), è stimata essere pari a 18,4 mesi. Anche la OS mediana non è stata raggiunta ed è stimata pari al 73,3% a 2 anni (figura 3).
Cemiplimab è un farmaco molto ben tollerato, come riportato nella tabella 3.
Da registrare, a fronte di un 48,7% di eventi avversi di grado severo, solo un 7,3% di casi che ha dovuto interrompere il trattamento per tossicità. Non è stato segnalato alcun evento avverso immunocorrelato diverso rispetto a quanto atteso, eccetto un possibile flare infiammatorio alle prime somministrazioni. Non ci sono state ulteriori morti tossiche legate al trattamento rispetto ai precedenti report (due pazienti deceduti per polmonite, di cui una possibilmente correlata al trattamento). Al Virtual ASCO 2020 è stata presentata un’analisi esplorativa (non pianificata) dell’impatto di cemiplimab
Reazioni correlate a infusione
Casi di reazioni correlate a infusione si sono verificati in 54 (9,1%) dei 591 pazienti reazione correlata a infusione di Grado 3. La reazione correlata a infusione ha portato pazienti. I sintomi più comuni della reazione correlata a infusione sono stati nausea, Tutti i pazienti si sono ripresi dalla reazione correlata a infusione.
Immunogenicità
sulla qualità di vita dei pazienti trattati nello studio EMPOWER-CSCC-1.14 Già a partire dal terzo ciclo si assiste ad un significativo miglioramento della qualità di vita globale dei pazienti trattati, nonché di alcuni parametri specifici quali il dolore (soprattutto), l’insonnia, l’appetito e la stipsi. Il dolore e la qualità della vita sembrano continuare a migliorare anche con il prosieguo del trattamento, in particolare dopo 6 e 12 cicli (figura 4). Il dolore, in alcuni casi, sembra addirittura anticipare la risposta obiettiva e viene riportato anche il dato relativo ad una netta riduzione del consumo di oppiacei nei pazienti trattati con cemiplimab. Sulla base di questi dati possiamo certamente affermare che con l’immunoterapia, anche nel CSCC localmente avanzato o metastatico, possiamo alzare l’asticella mirando non più solo alla semplice palliazione dei sintomi ma anche alla cronicizzazione ed eventualmente alla guarigione di una malattia che, fino a poco tem -
Come per tutte le proteine ad uso terapeutico, anche con cemiplimab esiste il rischio ricevuto cemiplimab hanno sviluppato anticorpi contro cemiplimab derivanti dal trattamento, persistenti. Non sono stati osservati anticorpi neutralizzanti. Non vi è evidenza di un’alterazione di anticorpi anti-cemiplimab.
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospette che si verificano dopo l’autorizzazione monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari sospetta tramite il sistema nazionale di segnalazione all’indirizzo https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
4.9 Sovradosaggio
In caso di sovradosaggio, i pazienti devono essere sottoposti ad un attento monitoraggio avverse e deve essere predisposto un trattamento sintomatico adeguato.
5. PROPRIETÀ FARMACOLOGICHE
5.1 Proprietà farmacodinamiche
Categoria farmacoterapeutica: agenti antineoplastici, anticorpi monoclonali. Codice ATC:
Meccanismo d’azione
Cemiplimab è un anticorpo monoclonale interamente umano appartenente alla classe PD-1 (Programmed Cell Death-1, PD-1) bloccandone l’interazione con i suoi ligandi PD-L1 e PD-L2, che sono espressi dalle cellule presentanti l’antigene e possono essere espressi tumorale, determina l’inibizione della funzione delle cellule T, come la proliferazione, la potenzia le risposte delle cellule T, comprese le risposte antitumorali, attraverso il blocco
Efficacia e sicurezza clinica
L’efficacia e la sicurezza di cemiplimab sono state studiate in una sperimentazione clinica, (nodale o distante) o con laCSCC che non erano candidati ad intervento chirurgico curativo multicentrico, in aperto, di fase 2 che ha arruolato 193 pazienti con mCSCC o laCSCC 9,4 mesi. La durata mediana del follow-up era di 16,5 mesi per il gruppo con mCSCC trattato il gruppo laCSCC trattato con 3 mg/kg Q2W e 8,1 mesi per il gruppo mCSCC trattato con
Dallo studio sono stati esclusi i pazienti che presentano una qualsiasi delle seguenti condizioni: sistemica con agenti immunosoppressori entro i 5 anni precedenti, anamnesi di trapianto anni, precedente trattamento con anticorpi anti-PD-1/PD-L1 o con altra terapia di inibizione una terapia, inclusa infezione nota da virus dell’immunodeficienza umana, oppure infezione linfocitica cronica (LLC), metastasi cerebrali o Performance Status secondo ECOG (Eastern
Nello Studio 1540, i pazienti hanno ricevuto cemiplimab fino a progressione della trattamento programmato (3 mg/kg Q2W per 96 settimane o 350 mg Q3W per 54 avanzata avessero mostrato una risposta sufficiente al trattamento, sarebbe stato Le valutazioni della risposta tumorale sono state eseguite ogni 8 o 9 settimane (rispettivamente 350 mg Q3W). L’endpoint primario dello Studio 1540 era il tasso di risposta obiettiva centralizzata indipendente (Independent Central Review, ICR). Per i pazienti con mCSCC stato determinato mediante i Criteri di valutazione della risposta nei tumori solidi (Response Per i pazienti con lesioni target visibili esternamente (laCSCC e mCSCC), l’ORR è stato determinato valutazioni dei dati radiologici da parte dell’ICR (RECIST 1.1) e le immagini digitali (criteri dell’Organizzazione secondario era rappresentato dalla durata della risposta (Duration Of Response, DOR) secondo secondo la valutazione dello sperimentatore (Investigator Assessment, IA), sopravvivenza secondo ICR e IA, sopravvivenza assoluta (Overall Survival, OS), tasso di risposta completa nei punteggi degli esiti riferiti dal paziente valutati mediante il Questionario sulla qualità e il trattamento dei tumori (European Organisation for Research and Treatment of Cancer
Sono riportati i risultati dei 193 pazienti dello Studio 1540. Di questi 193 pazienti, 115 mediana era di 72 anni (intervallo: 38–96). Settantotto (40,4%) pazienti avevano un’età tra 65 e <75 anni e 49 pazienti (25,4%) avevano meno di 65 anni. In totale, 161 (83,4%) razza bianca; il PS ECOG era 0 (44,6%) e 1 (55,4%). Il 33,7% dei pazienti aveva ricevuto 90,2% dei pazienti era stato precedentemente sottoposto a un intervento chirurgico correlato precedente radioterapia. Tra i pazienti con mCSCC, il 76,5% presentava metastasi a distanza
I risultati di efficacia per lo Studio 1540 sono presentati nella Tabella 3.
po fa, era da considerare priva di trattamenti sistemici efficaci.
Come detto, cemiplimab da giugno 2020 è rimborsato in Italia per il trattamento del CSCC avanzato o metastatico, ma già in precedenza è stato utilizzato in programmi di accesso allargato (EAP) in diversi Paesi. Si tratta di studi che ci fanno capire come il farmaco risulti attivo e ben tollerato in un ampio spettro di pazienti, più tipici della pratica quotidiana come ad esempio i grandi anziani (>75 anni) ed i pazienti con comorbilità o ECOG Performance Status 2. All’ESMO Virtual Meeting 2020 sono stati presentati due EAP, condotti in Francia15 e negli Stati Uniti (C.A.S.E.).16 Lo studio francese ha esaminato retrospettivamente i dati di 247 pazienti trattati con cemiplimab in 45 centri, con particolare focus sulle risposte e su una serie di parametri secondari quali la durata della risposta, la PFS, la OS ed il profilo di tollerabilità. L’età media dei pazienti era 77,1 anni, il 74% aveva malattia localizzata inoperabile o localmente avanzata mentre il 26% aveva metastasi
a distanza. La sede principale del CSCC era il distretto testa-collo nel 68% dei casi; il 73% aveva un PS ECOG 0-1 ed il 24% era immunodepresso, principalmente a causa di malattie ematologiche (15% dei casi). Cemiplimab è stato somministrato come primo trattamento nel 51% dei pazienti, con una media di 10 infusioni ciascuno (range 4-22). Tra i 188 pazienti che hanno ricevuto almeno un’infusione si è registrato un 50,4% di risposte obiettive (95% CI 43-57%) di cui il 21% complete, con un controllo di malattia (DCR) pari al 59,6% dei casi. Ad un follow-up mediano di 12,6 mesi si registra una PFS di 8,2 mesi (95% CI 6,7-11,7) (figura 5), mentre non sono state ancora raggiunte né la OS mediana né la durata mediana della risposta.
Ad un anno dall’inizio di cemiplimab risulta vivo il 65% dei pazienti (95% CI 57-73%), mentre il 41% è libero da progressione (95% CI 34,5-48,7). Eventi avversi di grado severo sono stati riportati nel 9% dei pazienti, con interruzione precoce nel 7% dei casi per tossicità correlata al farmaco (3 casi di colestasi
e/o citolisi, anoressia, fatigue, anemia, insufficienza renale, poliartrite, colite, DRESS syndrome).
C.A.S.E. è invece uno studio prospettico, multicentrico e longitudinale, condotto con l’obiettivo di valutare efficacia, tollerabilità, qualità della vita e, in aggiunta, i patterns di selezione del trattamento e di evoluzione della malattia in pazienti con aCSCC trattati con cemiplimab. Lo studio è in corso e non sono stati ancora presentati risultati. Ad oggi sono stati arruolati 61 pazienti con età media 78 anni, di cui il 20% immunocompromessi. Il 44% aveva metastasi a distanza mentre la regione testa-collo era la sede primaria di malattia nel 69% dei casi. Solo per il 54% dei pazienti la scelta del trattamento è stata fatta all’interno di un team multidisciplinare. Le principali motivazioni per cui è stato selezionato cemiplimab sono state: l’assenza di indicazione a chirurgia o a radioterapia con intento curativo, la presenza di malattia metastatica e, in un 15% dei casi, la preferenza del paziente, che non ha voluto sottoporsi ad un intervento demolitivo.
Tra le prospettive future legate all’uso di cemiplimab, la più interessante è sicuramente il trattamento neoadiuvante preoperatorio. L’utilizzo in stadi più precoci, infatti, potrebbe avere una serie di vantaggi legati alle risposte obiettive, tra cui la netta riduzione dei casi di chirurgia borderline o estrema e l’esecuzione di interventi chirurgici meno demolitivi e con minor probabilità di avere margini positivi all’esame istologico (a cui consegue una minore necessità di radioterapia postoperatoria). Inoltre, aspetto tipico della terapia neoadiuvante, si possono selezionare i pazienti sulla base della risposta ottenuta alla terapia sistemica.
Esistono, per contro, alcune zone grigie legate al trattamento con cemiplimab come la gestione della risposta completa (interruzione programmata del trattamento, previsione di periodi di pausa nei pazienti più anziani) e quella dei pazienti immunocompromessi, trapiantati e con patologie ematologiche concomitanti.
Roberta
Depenni
AOU Policlinico, Modena
Al di là di quanto stabilito dalle linee-guida, esistono dei fattori clinicamente oggettivi di maggior rischio di recidiva di un CSCC. Essi sono correlabili sia al tumore che al paziente e possono, perciò, essere applicabili nella pratica quotidiana:
diametro del tumore >20 mm;
sede del tumore in area labbro/orecchio/regione temporale;
spessore del tumore >6 mm o invasione profonda;
tumore scarsamente differenziato;
presenza di invasione perineurale microscopica, sintomatica (nervo facciale) o radiologica;
presenza di erosione ossea;
stato di immunosoppressione del paziente.
I pazienti a maggior rischio sono più spesso i grandi anziani (>75 anni) e quelli con comorbilità, che possono aver già ricevuto una chirurgia e/o una radioterapia, e per cui un ulteriore intervento significherebbe un’ampia mutilazione o demolizione d’organo. Sono pazienti che talvolta hanno lesioni multiple, profonde, in zone del volto non facilmente aggredibili chirurgicamente e corrispondenti, in pratica, alla stragrande maggioranza dei casi T3 (tumore superiore a 4 cm o presenza di: invasione ossea minore oppure invasione perineurale [PNI] oppure invasione profonda [grasso sottocutaneo o oltre 6 mm di profondità]) o T4 (tumore con invasione corticale ossea maggiore o midollare o dello scheletro assiale, compresi i forami) ma anche di parte dei T2 (tumore di dimensioni comprese tra 2 e 4 cm).
L’Italia ha partecipato all’esperienza real-world di cemiplimab con un ampio programma di accesso allargato, in cui sono stati trattati, ad oggi, oltre 300 casi di aCSCC, molti dei quali grandi anziani e con Performance Status scaduto (spesso criteri di esclusione dagli studi clinici). Il Centro Oncologico di Modena è stato uno dei più attivi nell’arruolamento, con 20 pazienti trattati tra luglio 2019 e luglio 2020.17 Tra questi, il 10% era immunocompromesso (2 casi di leucemia linfatica cronica) e l’85% aveva il distretto testa-collo come sede del tumore primitivo; le caratteristiche di questi pazienti sono elencate nella tabella 4.
La percentuale di risposte obiettive è stata del 70%, di cui il 25% complete. La mediana di PFS e di
Tabella 4. Cemiplimab nell’esperienza real-world di Modena: caratteristiche dei pazienti.
OS non è stata ancora raggiunta e 12 dei 20 pazienti (60%) sono ancora in trattamento. Soltanto 2 pazienti (10%) hanno manifestato un evento avverso di grado severo (1 febbre, 1 miastenia) che ha portato all’interruzione definitiva del trattamento (tabella 5).
Per meglio comprendere l’efficacia di cemiplimab nella pratica clinica quotidiana vengono qui riportati, in maniera sintetica, alcuni casi clinici reali gestiti nel centro modenese.
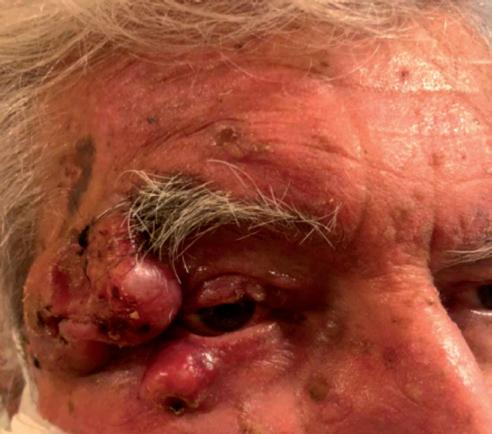
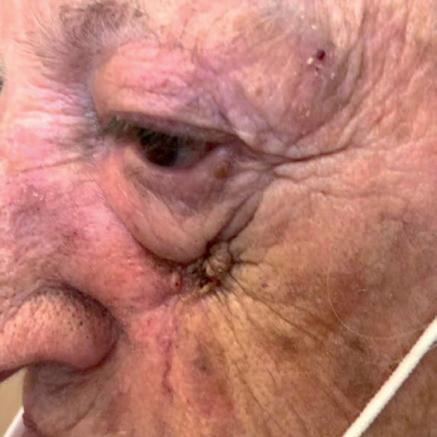
La prima paziente inserita in EAP era una donna di 87 anni, ECOG PS 2, portatrice di un voluminoso aCSCC della guancia sinistra con infiltrazione della palpebra inferiore, dell’ala nasale e dell’arco zigomatico ed esposizione del seno mascellare omolaterale (figura 6A). La paziente ha iniziato cemiplimab
Tabella 5. Cemiplimab nell’esperienza
real-world di Modena: profilo di tollerabilità.
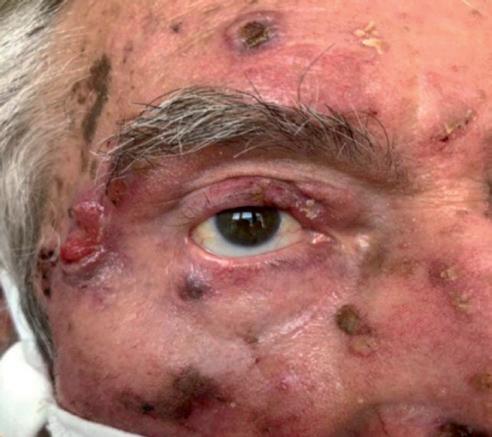
a giugno 2019, ottenendo subito un’ottima risposta ed arrivando a risposta completa clinica a febbraio 2020 (figura 6B). La risposta completa è tuttora persistente (figura 6C), nonostante una pausa di 3-4 mesi concessa alla paziente nel periodo di massima incidenza della covid-19. Il secondo caso riguarda una donna di 83 anni, ECOG PS 2, con un voluminoso aCSCC in regione pre-auricolare destra. La paziente era notevolmente sintomatica per dolore, per anemizzazione da sanguinamento (Hgb fino a 5 g/dl, con necessità di trasfusioni) e per difficoltà nell’alimentazione (figura 7A). Cemiplimab è stato iniziato ad agosto 2020 ottenendo, dopo due sole somministrazioni, un’iniziale risposta con netta riduzione dei sin-
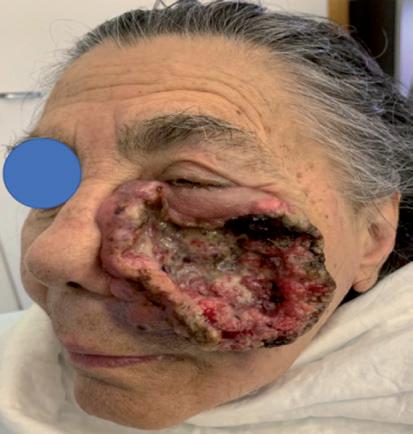
tomi Attualmente, la risposta parziale è di gran lunga superiore al 50% (figura 7B).
Il terzo caso riguarda un uomo di 75 anni, già sottoposto in passato a plurime asportazioni di tumori cutanei su tutta la superficie corporea (esposizione professionale ai raggi solari). Nel corso del 2020 gli è stato diagnosticato un aCSCC della regione temporale destra, infiltrante la palpebra superiore e la cavità orbitaria (figura 8A). In questo caso, la neoformazione non appariva particolarmente voluminosa, né ulcerata o sanguinante, ma la sua asportazione radicale avrebbe condotto ad un intervento potenzialmente demolitivo, con eviscerazione dell’occhio destro (intervento che, effettivamente, è stato proposto al paziente nel board multidisciplinare ma che è stato da

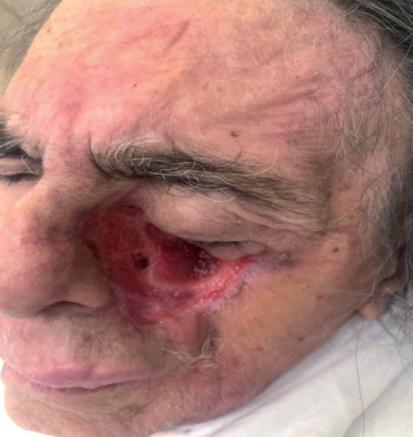
lui rifiutato). Contestualmente alla neoformazione principale, è stata effettuata una biopsia anche di una neoformazione sotto-oculare omolaterale, più piccola, che è risultata deponente per un carcinoma a cellule di Merkel. A luglio 2020 il paziente ha iniziato cemiplimab, ottenendo un’importante risposta sia sull’aCSCC che sul tumore di Merkel (settembre 2020) (figura 8B). Ad oggi, il trattamento è stato interrotto a causa dell’insorgenza di una febbre di grado severo (da possibile riattivazione di HBV), ma il paziente resta in risposta parziale. Il quarto caso si riferisce ad una donna di 94 anni, che a settembre 2019 aveva subito l’asportazione di un nodulo in regione zigomatica sinistra, senza che

venisse effettuato alcun esame istologico. Dopo circa 6 mesi (marzo 2020), è stata fatta una biopsia su una sospetta recidiva a placca, aderente l’osso zigomatico, risultata positiva per carcinoma squamoso. Alla TAC, la neoformazione risultava raggiungere il margine dell’orbita sinistra estendendosi al tessuto endo-orbitario, con infiltrazione del muscolo retto inferiore (figura 9A). Il sintomo d’esordio della paziente era stato, infatti, il dolore oculare. A marzo 2020 è stato iniziato cemiplimab, con una netta risposta clinica (figura 9B), sintomatica e radiologica. La paziente è poi deceduta, nei mesi successivi, per cause non correlabili al farmaco (polmonite da Legionella).
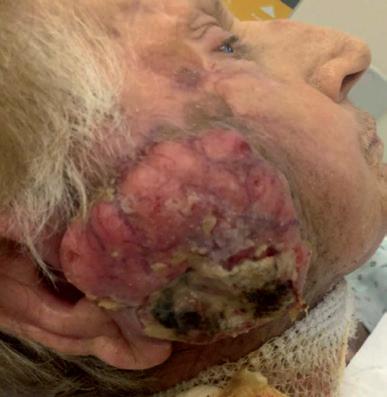
Il quinto caso è quello di una paziente di 94 anni, sottoposta nel tempo a plurime asportazioni di tumori cutanei. A settembre 2019 le è stato diagnosticato un aCSCC in regione retroauricolare destra (figura 10A), che alla TAC risultava infiltrare la parotide omolaterale con multipli linfonodi intraparotidei nei livelli II e V di destra, senza infiltrazione del nervo facciale. Cemiplimab è stato iniziato ad ottobre 2019, con un’importante risposta obiettiva (>50%) già dopo le prime tre somministrazioni (figura 10B) ed una risposta completa documentata clinicamente dopo 10 mesi di trattamento (giugno 2020), tuttora presente (figura 10C).
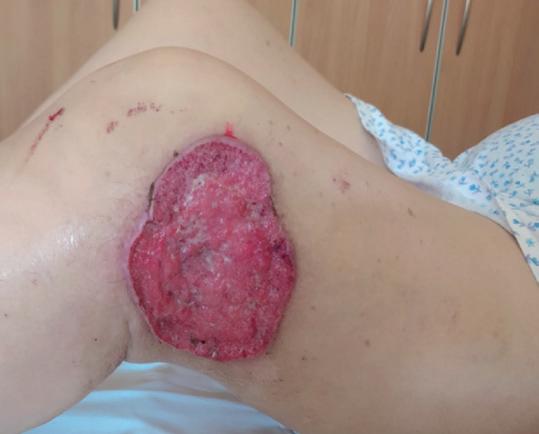
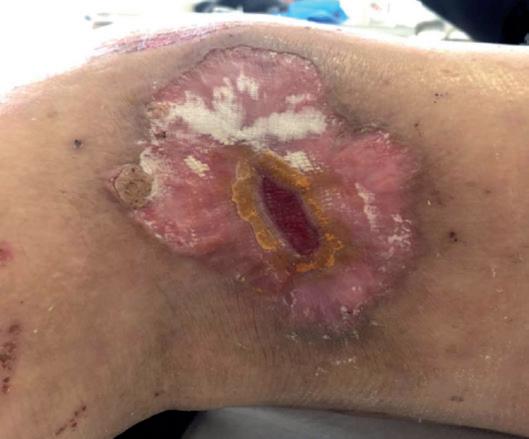
Il sesto caso si riferisce ad una paziente di 61 anni, che ha manifestato il progressivo aumento di una tumefazione cutanea lateralmente al ginocchio sinistro, con ulcerazione. La biopsia è risultata deponente per un aCSCC G3, infiltrante il derma (figura 11A).
Alla TAC il tessuto si estendeva nell’adipe sottocutaneo, con linfonodi necrotici e colliquati (diametro max 37 mm) in sede iliaca esterna sinistra ed inguinale omolaterale. La paziente ha, perciò, iniziato cemiplimab a luglio 2020, ottenendo una riduzione (>70%) della neoformazione ed una risposta completa radiologica sui linfonodi dopo le prime 6 somministrazioni (figura 11B).
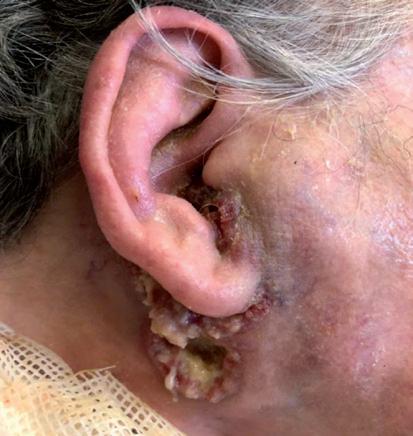
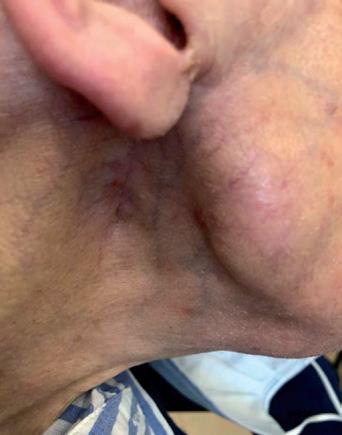
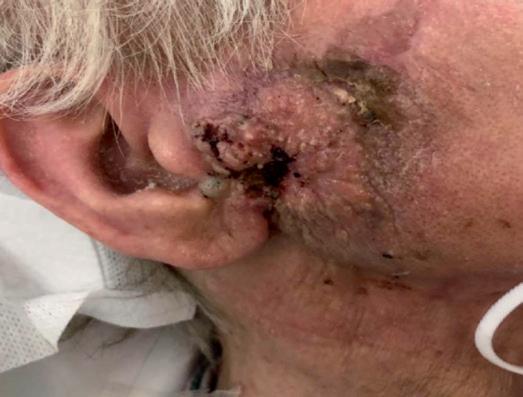
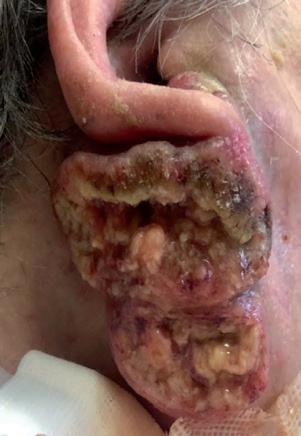
Il settimo caso è un uomo di 81 anni, con una recidiva di CSCC del padiglione auricolare destro, diagnosticata a settembre 2019 (figura 12A) dopo una prima asportazione radicale effettuata circa 6 mesi prima. La recidiva misurava circa 5 cm, con ampia ulcerazione estesa al condotto uditivo esterno e paralisi completa del nervo facciale. Alla TAC con mezzo di contrasto veniva evidenziato un interessamento della loggia parotidea e della corticale mastoidea omolaterale. A settembre 2019 il paziente ha iniziato cemiplimab, ottenendo rapidamente una risposta parziale (figura 12B). Attualmente (dopo circa 20 somministrazioni), è in risposta
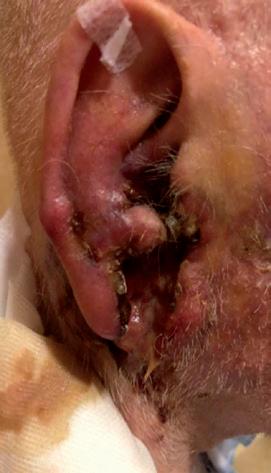
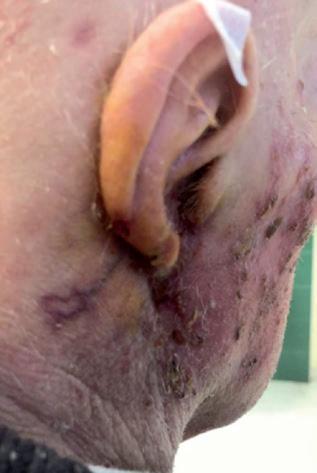
completa clinica e radiologica senza tossicità degne di nota (figura 12C).
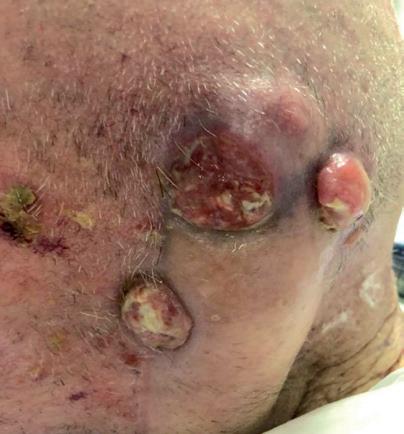
L’ultimo caso si riferisce ad un uomo di 88 anni, con multiple pregresse asportazioni di SCC al volto ed ai padiglioni auricolari. Ad aprile 2019 veniva diagnosticata una tumefazione in regione parotidea sinistra in progressivo incremento (probabile linfonodo), per cui il paziente veniva inviato a chirurgia con intento radicale dopo consultazione di un team multidisciplinare. A luglio 2019, poichè la neoformazione nel frattempo era notevolmente cresciuta, il paziente riceveva un intervento di resezione esteso fino all’orecchio medio, con rimozione del martello

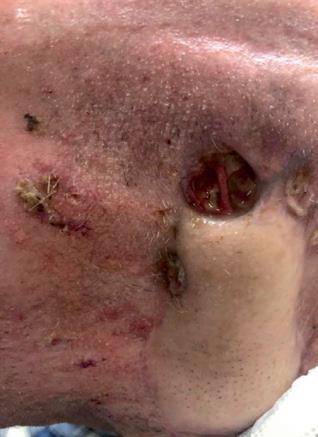
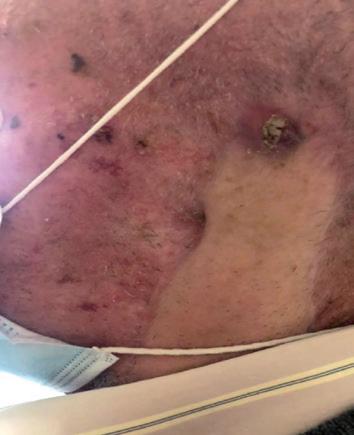
e dell’incudine, piombaggio della tuba uditiva, parotidectomia totale sinistra e ricostruzione con lembo di muscolo pettorale. Dopo 3 mesi, tuttavia, compariva una fistola nella sede del pregresso intervento, per cui veniva effettuato un esame citologico deponente per localizzazione di CSCC. A dicembre 2019 il paziente ha iniziato cemiplimab (figura 13A), ottenendo molto rapidamente una risposta parziale (figura 13B) e proseguendo tuttora il trattamento senza tossicità degne di nota (figura 13C).
Cemiplimab è un farmaco molto attivo e ben tollerato nel trattamento del CSCC avanzato/ metastatico e sta riscrivendo la storia di questa patologia. Esso, infatti, permette di gestire pazienti di ogni età, con comorbidità e con malattia molto avanzata attraverso risposte rapide e di lunga durata, spesso complete, favorendo altresì un miglioramento dei sintomi e della qualità della vita. Questi benefici sono stati evidenziati sia negli studi clinici che nella pratica quotidiana, attraverso i programmi di accesso allargato e le esperienze mono e pluricentriche. Come spesso accade con l’immunoterapia anche in questa patologia, finora orfana di trattamenti medici efficaci, possiamo alzare il livello di cura, mirando alla cronicizzazione e non più alla semplice palliazione, pur non avendo ancora fattori predittivi di efficacia. Per questo motivo, appare indispensabile che più figure professionali (oncologo, dermatologo, chirurgo, geriatra, reumatologo e tutti gli specialisti che si occupano del paziente anziano) lavorino in ambiente multidisciplinare affinché questi pazienti possano essere gestiti al meglio durante il loro percorso di cura. Restano da chiarire alcuni aspetti controversi, come la gestione della risposta
completa (si possono prendere in considerazione l’interruzione del trattamento oppure pause programmate?) e la possibilità di impiego di cemiplimab più precocemente oppure in combinazione con la radioterapia.
1. Linee Guida AIOM. Tumori cutanei non melanoma. Carcinoma squamocellulare cutaneo. 2019.
2. Cemiplimab. Riassunto delle caratteristiche di prodotto.
3. Peris K, Alaibac M, Argenziano G et al.; Italian Group of Dermato-Oncology (GIDO) of SIDeMaST. Cutaneous squamous cell carcinoma. Italian Guidelines by SIDeMaST adapted to and updating EADO/EDF/EORTC guidelines. G Ital Dermatol Venereol 2018; 153(6):747-62.
4. Gold KA, Kies MS, William WN Jr et al. Erlotinib in the treatment of recurrent or metastatic cutaneous squamous cell carcinoma: a single-arm phase 2 clinical trial. Cancer 2018; 124(10):2169-73.
5. William WN Jr, Feng L, Ferrarotto R et al. Gefitinib for patients with incurable cutaneous squamous cell carcinoma: a single-arm phase 2 clinical trial. J Am Acad Dermatol 2017; 77(6):1110-3.e2.
6. Dereure O, Missan H, Girard C et al. Efficacy and tolerance of cetuximab alone or combined with chemotherapy in locally advanced or metastatic cutaneous squamous cell carcinoma: an open study of 14 patients. Dermatology 2016; 232(6):721-30.
7. Cavalieri S, Perrone F, Miceli R et al. Efficacy and safety of single-agent pan-human epidermal growth factor receptor (HER) inhibitor dacomitinib in locally advanced unresectable or metastatic skin squamous cell cancer. Eur J Cancer 2018; 97:7-15.
8. Foote MC, McGrath M, Guminski A et al. Phase II study of single-agent panitumumab in patients with incurable cutaneous squamous cell carcinoma. Ann Oncol 2014; 25(10):2047-52.
9. Fitzgerald K, Tsai KK. Systemic therapy for advanced cutaneous squamous cell carcinoma. Semin Cutan Med Surg 2019; 38(1):E67-E74.
10. Pickering CR, Zhou JH, Lee JJ et al. Mutational landscape of aggressive cutaneous squamous cell carcinomas. Clin Cancer Res 2014; 20(24):6582-92.
11. Migden MR, Rischin D, Schmults CD et al. PD-1 blockade with cemiplimab in advanced cutaneous squamouscell carcinoma. N Engl J Med 2018; 379(4):341-51.
12. Migden MR, Khushalani NI, Chang A et al. Primary analysis of phase II results of cemiplimab, a human monoclonal anti-PD1, in patients with locally advanced cutaneous squamous cell carcinoma. Proc ASCO 2019. Abstract 6015.
13. Rischin D, Khushalani NI, Schmults CD et al. Phase II study of cemiplimab in patients with advanced cutaneous squamous cell carcinoma (CSCC): longer follow-up. Proc ASCO 2020; abstract 367.
14. Migden MR, Rischin D, Schmults CD et al. Healthrelated quality of life in patients with advanced cutaneous squamous cell carcinoma (CSCC) treated with cemiplimab: post-hoc exploratory analysis of a phase II clinical trial. Proc ASCO 2020; abstract 382.
15. Hober C, Fredeau L, Pham Ledard A et al. Cemiplimab for advanced cutaneous squamous cell carcinoma: real world experience. Ann Oncol 2020; Proc ESMO, abstract 1086P.
16. Rabinowits G, Homsi J, Nikamjan M et al. Demographics, prior therapies and reasons for cemiplimab treatment: prospective cemiplimab-rwlc survivorship and epidemiology (C.A.S.E.) study in patients with advanced cutaneous squamous cell carcinoma. Ann Oncol 2020; Proc ESMO, abstract 1094P.
17. Greco S, Rimini M, Riggi ML et al. Cemiplimab in advanced cutaneous squamous cell carcinoma: preliminary data from a single institution. Tumori Journal 2020; Proc AIOM, abstract M03.
Una pubblicazione de Il Pensiero Scientifico Editore e Think2it
Tutti i diritti riservati Oncoinfo – Anno XI, gennaio 2021
ISSN 2385-0108
