
21 minute read
Aplicación de alimentación continua y de pulso de bacterias probióticas multiespecies, en camarón blanco, Litopenaeus vannamei
Autores:
Jutta C. Kesselring Christina Gruber Benedict Standen Silvia Wein
jutta.kesselring@biomin.net
Los beneficios para la salud se han demostrado durante mucho tiempo para cepas probióticas específicas en humanos y otros mamíferos, como lo analizó Fuller (1989) y otros. La situación difiere en varios aspectos entre animales acuáticos cultivados y animales terrestres. Las principales diferencias comprenden entre otras, que los agentes patógenos son compatibles con el medio ambiente independientemente del huésped, los patógenos circundantes pueden alcanzar altas densidades y se ingieren continuamente con el agua (Verschuere, Rombaut, Sorgeloos y Verstraete, 2000), existe una dependencia total de la inmunidad innata en invertebrados (Vazquez et al., 2009), y una experiencia similar puede ser transferida a crustáceos. De acuerdo con van Hai y Fotedar (2010), los probióticos comprenden los siguientes principios en modo de acción en el camarón: (a) mejoran la calidad del agua, (b) producen compuestos inhibidores o antibióticos, (c) compiten por químicos o energía/nutrientes y por sitios de adhesión, (d) mejoran respuestas inmunes, (e) suministran macro y micronutrientes y enzimas digestivas, y (f) modulan las interacciones con el medio ambiente. Los probióticos han documentado efectos positivos sobre el sistema inmune innato (Bricknell & Dalmo, 2005), incluyendo mecanismos de defensa humoral y celular, y se ha demostrado que mejoran resistencia a enfermedades (Itami et al., 1998; Rengpipat, Rukpratanporn y Piyatiratitivorakul, 2000). Además, los probióticos pueden mejorar la resistencia al estrés y capacidad antioxidante, tasa de supervivencia y tasa de crecimiento.
A pesar de usar diferentes representantes de linajes bacterianos dispares para la aplicación de probióticos, los efectos positivos sobre la tasa de crecimiento se documentaron repetidamente en crustáceos (Duan, Zhang, Dong, Wang y Zhang, 2017; Franco et al., 2017; Shen, Fu, Li y Zhu, 2010; Zheng, Duan, Dong y Zhang, 2017; Zokaeifar et al., 2012). Este efecto en el peso corporal a menudo, pero no siempre, estuvo acompañado por una disminución del factor de conversión alimenticio (FCR) (Zokaeifar et al., 2012) o una tasa de supervivencia más alta (Shen et al., 2010), o los resultados fueron inconsistentes (Franco et al., 2017). Existen ejemplos en la literatura donde las aplicaciones de probióticos no afectaron los parámetros de crecimiento, pero los autores informaron efectos beneficiosos en la supervivencia de las larvas de Litopenaeus vannamei (Jamali et al., 2015).
Si bien los efectos generales de la mayoría de suplementos de probióticos parecen beneficiosos para el rendimiento de camarón blanco, sus efectos sobre otros parámetros (por ejemplo, capacidad antioxidante, inmunidad), son bastante heterogéneos
y, por lo tanto, requieren consideraciones distintas.
La efectividad de los probióticos depende del timing, la dosis, la administración, la especie y la cepa (Sakai, 1999). Las especies múltiples o las mezclas de múltiples generalmente se consideran superiores a las aplicaciones para una sola especie o de una sola cepa, y las rutas de ingesta son más productivas y prácticas que otras como la de inmersión (van Hai y Fotedar, 2010). Con respecto al timing, hay datos disponibles para diferentes peces (lubina: Bagni, Archetti, Amadori y Marino, 2000; dorada: Couso, Castro, Magarinos, Obach y Lamas, 2003; y salmón del Atlántico: Bridle, Carter, Morrison y Nowak, 2005), sugiriendo que la alimentación de probióticos de corta duración, seguida de un período de alimentación con una dieta control, da como resultado efectos óptimos sobre la respuesta inmune y la resistencia a enfermedades. Hasta donde sabemos, experimentos previos sobre la aplicación de probióticos en camarón blanco (L. vannamei) solo se utilizaron regímenes de aplicación continua. Para hacer declaraciones confiables sobre regímenes óptimos de aplicación para un probiótico de múltiples especies en camarón blanco, comparamos los efectos de un probiótico multiespecies (AquaStar® Growout) en camarón blanco (L. vannamei) en un protocolo de aplicación continua con diferentes protocolos de suplementación intermitente.
Material y métodos Animales y condiciones de alojamiento El ensayo se realizó en el Centro de Acuicultura para la Nutrición Aplicada Biomin (ACAN; Vietnam). Se compró y transportó juveniles de L. vannamei (resistente a patógenos específicos), de una granja local a las instalaciones de ACAN. Después de la transportación, el camarón se colocó en tanques de cuarentena de 2000 L con recirculación de agua (31.1 ± 0.8 ˚C, 20 ppt de salinidad, pH 8.12 ± 0.1, oxígeno disuelto 7.23 ± 0.9 ppm, nitrógeno amoniacal total 0 ppm, nitritos < 0.5 ppm, y alcalinidad > 150 ppm), donde se mantuvieron durante 7 días antes del inicio de los experimentos.
Durante este período de aclimatación, el camarón fue alimentado con una dieta comercial cuatro veces por día hasta aparente saciedad (Dieta control; Uni President V991, Tabla 2).
Diseño experimental y dietas Después del período de aclimatación, 525 camarones que mostraron un comportamiento normal de alimentación y ningún signo aparente de enfermedad, fueron seleccionados aleatoriamente y asignados a 35 tanques de 100 L dentro del mismo sistema de recirculación durante 87 días prueba de alimentación. Cada tanque fue abastecido con 15 individuos de género mixto que pesaban aproximadamente 1.1 g. Se asignaron al azar cinco grupos experimentales a los tanques (siete réplicas por tratamiento), cada uno alimentado con T1, la dieta comercial (Dieta control; Uni President V991), continuamente durante todo el ensayo o T2-T5, la dieta comercial suplementada con una preparación probiótica multiespecie (AquaStar® Growout, Biomin, Austria), en diferentes regímenes de aplicación, como se muestra en la Tabla 1.
AquaStar® Growout contenía Bacillus subtilis, Pediococcus acidilactici, Enterococcus faecium y Lactobacillus reuteri con un recuento celular total de 1 × 10 9
ufc/g. AquaStar® Growout recubrió el balanceado a 3 g/kg. Por cada kg alimentación, se mezclaron 3 g de probiótico con 10 mL de aceite de pescado y se aplicó cuidadosamente bajo agitación constante. En el grupo T1, el alimento se trató de manera similar sin agregar los probióticos (es decir, 10 mL de aceite de pescado como recubrimiento sin probióticos). Hasta la alimentación, los pellets secos se almacenaron en contenedores y dos capas de bolsas de plástico en un cuarto de almacenamiento con aire acondicionado. Se tomaron muestras de alimento (1 kg) para analizar la composición de nutrientes de la dieta comercial (Análisis Weende, cinco réplicas, tabla 2). Además, se evaluó en agar MRS el recuento de bacterias probióticas viables en el alimento (de Man, Rogosa y Sharpe, 1960) aproximadamente 2 semanas después de su preparación. También se realizó una prueba de lixiviación para la dieta comercial recubierta con AquaStar® Growout. Por lo tanto, 1 g de alimento se colocó en 9 mL de agua salada estéril (30 ppt NaCl, 20 ± 1 ˚C) y muestreada después de 10 y 30 min.
Durante la prueba de alimentación de 87 días, los camarones fueron alimentados casi hasta la saciedad seis veces al día. El comportamiento de alimentación, ingesta de alimento, y la mortalidad, fue registrado diariamente para cada tanque para estimar la cantidad de alimento proporcionado en las comidas posteriores. Este método minimizó la cantidad de alimento no consumido en los tanques, y redujo el deterioro de la calidad del agua.
Después de la prueba de alimentación de 87 días, se realizó un experimento posterior con Vibrio parahaemolyticus. Para el experimento, de cada tanque se seleccionaron al azar ocho camarones en etapa de muda, y se transfirieron a tanques de plástico de 40 L en una sala de pruebas experimentales. Cada tanque de plástico estaba equipado con un pequeño biofiltro. Los camarones se aclimataron a las nuevas condiciones durante 3 días. Después del período de aclimatación, no se alimentó a los camarones durante 24 horas y fueron infectados experimentalmente con V. parahaemolyticus (comprado en el Departamento de Patología de Peces, Facultad de Pesca, Universidad de
Tabla 1.- Vista general de los grupos experimentales
Grupo Código de Grupo Probiótico multiespecies Régimen de alimentación Réplicas Control T1 - Dieta control - alimento continuo 7 Continuo T2 3 g/kg de alimento Alimento suplementado: alimento continuo 7 Pulsado 1:1 T3 3 g/kg de alimento Pulsado: 1 semana suministrando alimento 7 suplementado, 1 semana con dieta control 7 Pulsado 2:2 T4 3 g/kg de alimento Pulsado: 2 semanas suministrando alimento 7 suplementado, 2 semanas con dieta control 7 Pulsado 2:1 T5 3 g/kg de alimento Pulsado: 2 semanas suministrando alimento 7 suplementado, 1 semana con dieta control 7
Nong Lam, Ciudad Ho Chi Minh, Vietnam), por inyección intramuscular (IM) de 50 μL de una suspensión de 9.6 × 10 5
ufc/mL. La inyección se administró entre el segundo y tercer segmento abdominal, usando una jeringa de tuberculina estéril de 1 mL. Los camarones inoculados fueron retenidos en cubos de plástico con agua de mar aireada (igual que los tanques experimentales), donde fueron monitoreados durante 30 minutos antes de ser colocados de vuelta en su respectivo tanque experimental.
Durante el período de prueba, se continuó alimentando con el tratamiento respectivo (Tabla 1). El camarón fue alimentado dos veces un día a una tasa del 2% de la biomasa total. La mortalidad se monitoreó durante 8 días. Se observó a los individuos al menos dos veces al día durante el período de experimentación (intervalos de 6 y 12 horas). Se retiraron los camarones moribundos o muertos, y se examinaron para ver signos clínicos externos e internos de enfermedades graves.
Procedimiento de muestreo El peso corporal inicial (Día 0), el peso corporal intermedio (Día 42) y el peso corporal final (Día 87), se calcularon a partir de mediciones basadas en tanques divididos por el número de camarón por tanque. Al final de la prueba de alimentación (Día 87), el peso corporal de todos los animales se registró individualmente y se seleccionó al azar un animal por tanque (7 por grupo), y se lo sacrificó para analizar parámetros de inmunidad. El factor de conversión alimenticio (FCR) se calculó como la proporción del consumo total de alimento para el aumento de peso por tanque. La tasa de supervivencia se calculó al final del ensayo de alimentación y de la experimentación. Veinticuatro horas después de administrar la dosis de prueba, un animal por tanque (es decir, siete por grupo), se seleccionó al azar y se sacrificó para analizar los parámetros de inmunidad después de la prueba.
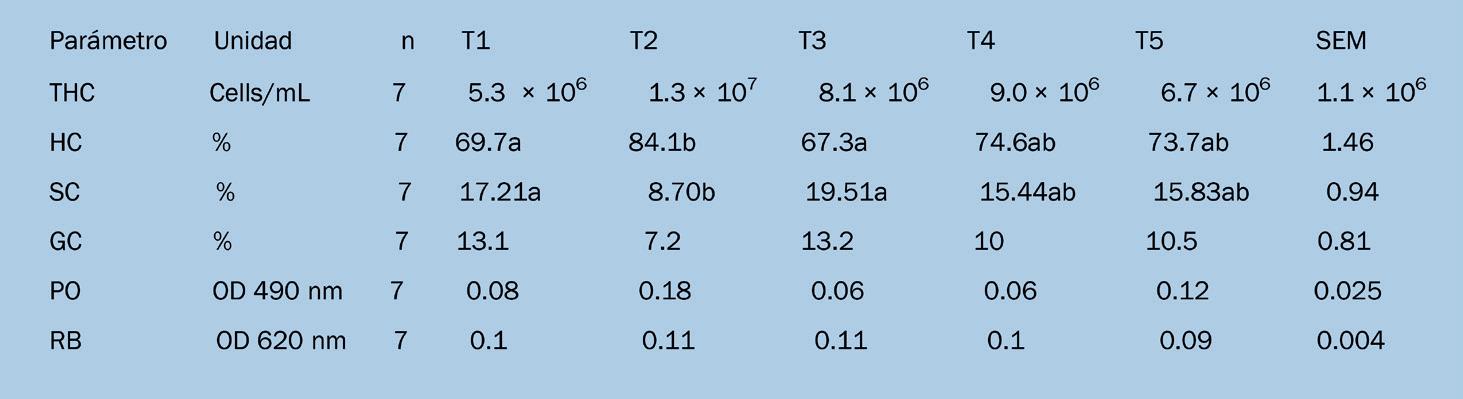
Parámetros de inmunidad Se recolectó hemolinfa de camarones seleccionados al azar en cada grupo para determinar: (a) hemocitos totales (THC), células hialinas (HCs), células semigranulares (SCs) y células granulares (GCs); (b) actividad de fenoloxidasa (PO); y Tabla 2.- Composición de nutrientes del alimento
Parámetro Subparámetro Método Unidad Alimento V991
Humedad EC 152/2009 g/100 g 7.1
Proteína AOAC 2001.11 g/100 g 40.9
Carbohidratos Cálculo g/100 g 34.5
Almidón g/100 g 15.8
Almidón EC 152/2009 %/ almidón total 39.7 gelatinizado GE047 (referencia Bipea 170/0011) Ceniza EC 152/2009 g/100 g 11.5
Lípidos Extracción por g/100 g 6.1 hidrólisis de grasa GE224
Energía bruta calorímetro de kcal/g 4.2 bomba
(c) estallido respiratorio (RB). La hemolinfa (200 μL) se retiró del seno ventral, entre el último segmento de cefalotórax y el primer segmento abdominal, con una jeringa de 1.0 mL (calibre 26) equipada con una aguja hipodérmica. La jeringa contenía 200 μL de una solución anticoagulante preenfriada (27 mM citrato trisódico, 336 mM NaCl, 115 mM glucosa, 9 mM Ácido etilendiaminotetraacético, pH 7).
De la solución anticoagulante-hemolinfa, se usaron 100 microlitros para cuantificar THC, HCs, SCs y GCs en un hemocitómetro de Neubauer y microscopio de contraste de fase invertido. La hemolinfa fue fijada con un volumen igual de 10% de formalina tamponada (proporción 1:3:5, hemolinfa: anticoagulante: formalina). Una alícuota de 20 μl se tiñó durante 20 minutos usando hematoxilina y eosina. Se contaron todos los hemocitos en los campos superior e inferior del hemocitómetro. Se contaron doscientas células para evaluar la diferenciación celular.
La actividad de PO se midió espectrofotométricamente a 490 nm registrando la formación de dopacromo producido a partir de L-3,4- dihidroxifenilalanina siguiendo un protocolo previamente publicado (Chang, Lee, Liu y Cheng, 2006). Una unidad de actividad enzimática representa la formación de dopacromo en 100 μL de hemolinfa.
El RB de los hemocitos se determinó mediante la reducción de nitroblue tetrazolium (NBT) a formazan como medida de la formación de aniones superóxido (Chang et al., 2006; Tan y Berridge, 2000). La densidad óptica se midió a 630 nm utilizando un lector de microplacas. El ensayo de anión superóxido (reducción de NBT) se realizó en una microplaca 96 well después del reemplazo de la solución anticoagulante por centrifugación, como se describió previamente (Chang et al., 2006).
La RB de los hemocitos se expresó como la reducción de NBT por 100 μL de hemolinfa. Todos los análisis se realizaron en el laboratorio del Departamento de Patología de Peces, de la Facultad de Pesca, Nong Lam University, Ciudad Ho Chi Minh, Vietnam.
Análisis estadístico Los diagramas de caja se usaron para inspeccionar visualmente la distribución de datos, la variabilidad y valores atípicos. Los supuestos del modelo (normalidad, homocedasticidad e independencia), se inspeccionaron a través de las parcelas residuales. El análisis de varianza (paramétrico), la prueba de Kruskal-Wallis (no paramétrica) y la regresión de Poisson (paramétrica) se usaron para probar las diferencias entre los tratamientos. El análisis de supervivencia de Kaplan-Meier se utilizó para investigar las diferencias en el tiempo de supervivencia después del ensayo entre tratamientos. Todas las estadísticas se realizaron en R-3.5. El nivel de significancia se definió como p < .05, y los valores de p ≥ .05 y < .10 se consideraron tendencias.
RESULTADOS En general, cualquier régimen de suplementación con probióticos aumentó significativamente el aumento de peso corporal (peso intermedio y final) en comparación con el control (Tabla 3). En los cuatro grupos de suplementos de probióticos, el peso corporal fue en promedio, 20% más alto, y la tasa de crecimiento específica 6.9% más alta que en el control. Las diferencias en los regímenes de aplicación de probióticos se hicieron evidentes para el FCR, que mejoró significativamente en un 24% cuando AquaStar® Growout se proporcionó de forma continua o en un protocolo 2:1, en el que se proporcionó un tratamiento alterno de 2 semanas de la dieta con recubrimiento de probiótico y 1 semana con la dieta control (Tabla 3). La tasa de supervivencia durante el ensayo de alimentación no difirió entre los tratamientos (Tabla 3).
El número total de camarones muertos después de la inyección IM con V. parahaemolyticus no difirió entre los cinco grupos (p > .05) después de 8 días de observación. En comparación al control, los camarones se alimentaron continuamente con AquaStar®- sin embargo, la alimentación suplementada mostró una tasa de supervivencia significativamente mayor (p = .04, Figura 1), mientras que en los otros grupos no fue diferente (p > .05). La suplementación continua con probióticos provocó un retraso significativo en el inicio de la mortalidad, y dio protección a los camarones hasta 72 horas después del ensayo. Las colonias de V. parahaemolyticus se volvieron a aislar con éxito de una muestra agrupada de camarones moribundos y muertos a 3 × 10 5
ufc / mL. Tabla 3.- Rendimiento del crecimiento y perfil hematológico de camarón alimentado de acuerdo a diferentes protocolos de aplicación de un probiótico multiespecies a 3 g/kg de alimento.

Nota: Las diferentes letras de la misma fila indican diferencias significativas (p < .05) en una fila utilizando análisis de varianza o prueba de Kruskal-Wallis con comparaciones ad hoc posteriores. Abreviaturas: BW D0, peso corporal inicial en el Día 0; BW D42, peso corporal intermedio en el Día 42; FBW, peso corporal final en el Día 87 basado en la medición en tanque; FBWi, basado en mediciones individuales; FCR, factor de conversión alimenticia; GC, células granulares; HC, células hialinas; PO, fenoloxidasa; RB, estallido respiratorio; SC, células semigranulares; SGR, tasa de crecimiento específica; T1, control; T2, suplementado continuamente; T3, pulsado 1:1; T4, pulsado 2:2; T5, pulsado 2:1; THC, recuento total de hemocitos.
80%
70%
60%
30% 40% 50% Mortalidad T1 T2 T3 T4 T5
El THC no se vio afectado por los tratamientos (Tabla 3, Tabla 4) o la prueba de Vibrio (p > .05). Sin embargo, la diferenciación de células hemocitarias se vio afectada, especialmente por la suplementación continua de probióticos. El tratamiento 2 tuvo la mayor abundancia de HCs antes de la prueba (p = .04, Tabla 3). Esta diferencia fue estadísticamente significativa en comparación con T3 y T5. Después de la prueba, T2 todavía tenía una abundancia de HC significativamente mayor que los camarones alimentados continuamente con el alimento control (T1) y los regímenes de
20%
10%
0%
02 04 06 08 01 00 1201 40 1601 80
Tiempo (h)
FIGURA 1 La mortalidad acumulada (%) del camarón blanco, Litopenaeus vannamei, se registró durante 8 días después del ensayo de inyección intramuscular (IM) con Vibrio parahaemolyticus. Los camarones alimentados continuamente con el probiótico multiespecies AquaStar® Growout tuvieron una tasa de supervivencia significativamente mayor (p = .04) que los del control. La alimentación se pulso intermitente del probiótico no tuvo ningún efecto protector después de la inyección IM con V. parahaemolyticus. T1, control; T2, suplementado continuamente; T3, pulsado 1:1; T4, pulsado 2:2; T5, pulsado 2:
alimentación pulsada 1:1 (T3) (Tabla 4). La abundancia de HC no se vio afectada por la prueba de Vibrio (p > .05). Tanto antes como después del ensayo, las abundancias SC (Tablas 3 y 4) tendieron a ser más bajas en el grupo alimentado continuamente con el probiótico (T2) que en los demás grupos, excepto el grupo con alimentación de régimen pulsado 2:2 (T4). La abundancia de SC no se vio afectada por la prueba de Vibrio (p > .05).
La abundancia de GC fue significativamente menor en el grupo alimentado continuamente con los probióticos que en todos los demás grupos, excepto el grupo alimentado continuamente con el alimento control (Tabla 3). Después de la prueba, no hubo diferencias estadísticamente significativas entre los tratamientos (Tabla 4). La abundancia de GC no se vio afectada por la prueba de Vibrio (p = .10).
La actividad de PO difirió significativamente entre los tratamientos inmediatamente después de la prueba de alimentación (p = .01) y 24h después del ensayo (p = .03). Antes del ensayo, la actividad de PO fue significativamente menor en el grupo alimentado continuamente con el alimento control y el régimen de alimentación pulsada 1:1 (T3), que en el grupo con la alimentación pulsada 2:2 (T4) y régimen de alimentación 2:1 (T5) (Tabla 3). Después del ensayo, la PO tendió a ser mayor en el grupo alimentado continuamente con los probióticos y el régimen de alimentación pulsada 2:1 (T5) (p < .10).
Al final de la prueba de alimentación, la actividad de RB difirió significativamente entre los tratamientos (Tabla 3). El RB tendía a ser mayor en el grupo alimentado consistentemente con el alimento control, que el grupo alimentado consistentemente con probióticos y el régimen de alimentación pulsada 2:2 (T4). Veinticuatro horas después del ensayo de Vibrio, el RB no difirió significativamente entre los grupos como se muestra en la Tabla 4. Al comienzo de la prueba, se confirmó que el alimento de camarón con recubrimiento probiótico tenía 3.6 × 10 6
ufc/g de bacterias probióticas (desviación estándar relativa [RSD] 1.4%) por cultivo en agar MRS. Dentro de 30 minutos, se encontró que la alimentación lixivió 1.4 × 10 6
Tabla 4.- Parámetros hematológicos en camarón 24 horas después del ensayo de inyección intramuscular con Vibrio parahaemolyticus
Nota: Las diferentes letras de la misma fila indican diferencias significativas (p < .05) en una fila usando análisis de varianza o Prueba de Kruskal-Wallis con comparaciones ad hoc posteriores. Abreviaturas: FCR, factor de conversión alimenticia; GC, células granulares; HC, células hialinas; PO, fenoloxidasa; RB, estallido respiratorio; SC, células semigranulares; T1, control; T2, suplementado continuamente; T3, pulsado 1: 1; T4, pulsado 2: 2; T5, pulsado 2: 1; THC, recuento total de hemocitos.
ufc (RSD 4.3%) en el agua salada, entonces 2 × 10 6
ufc/g del recubrimiento permaneció en los pellets después del tiempo de remojo. Cualquier efecto de la fuga de probióticos al agua ha sido aparente en todos los animales experimentales. de aplicación continua, T2, y la aplicación 2:1 (2 semanas de aplicación probiótica interrumpida por 1 semana de alimento control, T5), produjeron los mismos efectos beneficiosos sobre el crecimiento del camarón y el FCR.
Discusión Se ha demostrado repetidamente que los probióticos intestinales suministrados a través del alimento mejoran el rendimiento del crecimiento del camarón (Duan et al., 2017; Franco et al., 2017; Shen et al., 2010; Zheng et al., 2017; Toledo, Frizzo, Signorini, Bossier, & Arenal, A, 2019; Zokaeifar et al., 2012), a menudo acompañados por una disminución del FCR o una mayor tasa de supervivencia. Este estudio confirma esta suposición. Todos los camarones alimentados con una dieta comercial suplementada con una preparación de probióticos multiespecies mostraron un rendimiento de crecimiento mejorado en paralelo a una disminución del FCR, en comparación con los animales del alimento control.
Al final de nuestro estudio a largo plazo de más de 12 semanas (antes del inicio del ensayo), la tasa de supervivencia fue del 76% y no difirió entre los tratamientos. Tales largas duraciones de la prueba representan mayor riesgo de mortalidad, por ejemplo, debido a la muda. Las tasas de supervivencia en el presente estudio después de 42 días, son comparables con los datos de la literatura (Shen et al., 2010; Zokaeifar et al., 2012) y pueden considerarse altas (88-93%, Tabla 3).
Al comparar los diferentes protocolos de aplicación, encontramos que el tratamiento Para investigar los efectos de la preparación del probiótico multiespecies sobre la inmunidad innata en el camarón blanco, investigamos los hemocitos junto con la actividad de PO y RB. Se sabe que la disminución de los hemocitos circulantes, es parte de una respuesta inflamatoria (Van de Braak et al., 2002). La aplicación de probióticos no alteró el THC, lo que indica que el tratamiento con solo probióticos no indujo una respuesta inflamatoria.
La diferenciación de hemocitos, sin embargo, muestra una respuesta a los regímenes de aplicación de probióticos. La aplicación continua provocó una abundancia relativa significativamente mayor de HC y menor abundancia de SC y GC. Las variaciones en las poblaciones de HC se encuentran típicamente durante el ciclo de muda (Sequeira, Tavares y Arala-Chaves, 1996). En este estudio, solo se utilizaron camarones en la etapa de muda para el ensayo. Tras la activación por un antígeno, se sabe que los GC participan en el almacenamiento y la liberación del sistema de profenoloxidasa (Johansson y Soederhaell, 1985), y los SC son activos en la encapsulación y también en la fagocitosis (Johansson, Keyser, Sritanlucksana y Soederhaell, 2000; Persson, Vey y Soederhaell, 1987). Después de la desgranulación de los GC y SC y la liberación del sistema de activación de la profenoloxidasa (proPO), los HC se activan
para engullir a los organismos intrusos por fagocitosis (Smith y Soederhaell, 1983; Soederhaell y Smith, 1986; Thoernqvist, Johansson y Soederhaell, 1994). Por lo tanto, la diferenciación de hemocitos en este estudio indica que se reconocieron algunos componentes de la preparación probiótica, y se desencadenó una modificación inmune en el camarón, con la suplementación continua.
La actividad de PO fue significativamente elevada en los camarones que recibieron probióticos en los protocolos de aplicación 2:2 y 2:1 (T4 y T5), pero no después de una aplicación continua o 1:1 (T2 y T3). Trabajos anteriores demuestran una mayor actividad de PO después de la aplicación continua de probióticos (Franco et al., 2017; Shen et al., 2010). En nuestro estudio, no pudimos relacionar claramente la actividad de PO con ciertos protocolos de aplicación de probióticos. Además, la actividad de PO después del ensayo de alimentación no se correlacionó con la diferenciación de hemocitos o la tasa de supervivencia después del ensayo con Vibrio. Esto también fue cierto para la actividad de RB. Por lo tanto, los efectos probióticos pueden radicar en aumentar la preparación inmunológica del camarón, en lugar de en una estimulación inmunológica directa.
Zokaeifar et al. (2012) mostraron en su estudio, que la suplementación con probióticos conduce a una mayor expresión de los receptores de detección de lipopolisacáridos y una mayor expresión del sistema proPO. Tal aumento en el reconocimiento del antígeno, y un posterior reclutamiento de GC y SC a los tejidos intestinales, podría conducir a una mayor abundancia relativa de los HC restantes.
La ausencia de respuesta de PO y RB indica que la eliminación de GC y SC de la sangre circulante es más probable debido al reclutamiento de tejido que a la desgranulación. En ese caso, fue necesaria una tasa general de hematopoyesis más alta para mantener el mismo THC en este estudio. La tasa de mortalidad después del ensayo de Vibrio fue significativamente más lenta en el
grupo tratado continuamente con probióticos en comparación con el control, mientras que los protocolos de alimentación pulsada no fueron diferentes. Parece que la máxima protección requiere la aplicación continua del probiótico multiespecies AquaStar® Growout en las condiciones dadas.
El estudio presentado, demuestra que el producto probiótico multiespecies probado tiene efectos promotores del crecimiento en camarón, independientemente de los protocolos de aplicación probados. Sin embargo, los efectos beneficiosos fueron más notorios cuando el suplemento de alimentación probiótico multiespecies AquaStar® Growout se alimentó de forma continua o de acuerdo con T5, donde un período de aplicación de 2 semanas se interrumpió por 1 semana del tratamiento control. Los resultados zootécnicos están respaldados por parámetros inmunes medidos en este estudio, necesarios para explicar el efecto protector observado de AquaStar® Growout en el ensayo de V. parahaemolyticus•











