Učbenik za kemijo za srednje strokovno in poklicno tehniško izobraževanje

dr. Andrej Godec, Karin Mezgec, dr. Rok Rudež
POTOVANJE V SVET SNOVI
Učbenik za kemijo za srednje strokovno in poklicno tehniško izobraževanje
Soavtorji vsebin: dr. Saša A. Glažar, dr. Margareta Vrtačnik, dr. Katarina Wissiak Grm
Urednica: Karin Mezgec
Strokovni pregled: dr. Rok Rudež, dr. Marija Slavec, Tanja Jamnik, Katja Šinkovec
Ilustracije: Marina Gabor
Slikovno gradivo: Shutterstock et al. (natančen seznam je na zadnji strani)
Jezikovni pregled: Mateja Samastur
Direktor produkcije: Klemen Fedran
Izdala in založila: Modrijan izobraževanje, d. o. o.
Za založbo: Maruša Dejak
Oblikovanje: Jasna Karnar, Beti Jazbec
Grafični prelom: Anže Kotar
Tisk: Tiskara Zrinski, d. o. o.
1. izdaja
Naklada: 2500 izvodov
Ljubljana 2023
Vse knjige in dodatna gradiva Založbe Rokus Klett dobite tudi na naslovu www.knjigarna.com.
Učbenik Potovanje v svet snovi je Strokovni svet Republike Slovenije za splošno izobraževanje na svoji 228. seji dne 15. 6. 2023 s sklepom št. 013-10/2023/72 potrdil kot učbenik za kemijo za srednje strokovno in poklicno-tehniško izobraževanje.
© Modrijan izobraževanje, d. o. o. (2023). Vse pravice pridržane.
Brez pisnega dovoljenja založnika so prepovedani reproduciranje, distribuiranje, javna priobčitev, predelava ali druga uporaba avtorskega dela ali njegovih delov v kakršnem koli obsegu in postopku, kot tudi fotokopiranje, tiskanje ali shranitev v elektronski obliki. Tako ravnanje pomeni, razen v primerih od 46. do 57. člena Zakona o avtorski in sorodnih pravicah, kršitev avtorske pravice.
Založba se je trudila, da bi poiskala vse lastnike avtorskih pravic. Če v kakšnem primeru nismo navedli pravega lastnika, bomo to z veseljem uredili in popravili.
CIP - Kataložni zapis o publikaciji Narodna in univerzitetna knjižnica, Ljubljana 54(075.2)
Modrijan izobraževanje, d. o. o., Stegne 9 b, 1000 Ljubljana
Telefon: 01 513 44 00
Telefonska naročila: 01 513 44 04
E-pošta: narocila@modrijan-izobrazevanje.si www.modrijan-izobrazevanje.si, www.knjigarna.com
GODEC, Andrej, 1958 Potovanje v svet snovi. Učbenik za kemijo za srednje strokovno in poklicno tehniško izobraževanje / [Andrej Godec, Karin Mezgec, Rok Rudež ; soavtorji vsebin Saša
A. Glažar, Margareta Vrtačnik, Katarina Wissiak Grm ; ilustracije Marina Gabor ; slikovno gradivo Shutterstock ... et al.]. - 1. izd. - Ljubljana : Modrijan izobraževanje, 2023
ISBN 978-961-7181-11-1
COBISS.SI-ID 159666179
KAZALO Svet snovi ................................................................... 5 1.1 Kaj je snov 6 1.2 Metode ločevanja snovi 7 1.3 Agregatna stanja snovi ............................................... 8 1.4 Lastnosti materialov 8 1.5 Raztopine 9 1.5.1 Masni delež topljenca v raztopini ...................... 10 1.5.2 Masna koncentracija 11 1.5.3 Vpliv temperature na topnost snovi .................. 12 1.6 Nevarne snovi .......................................................... 12 1.6.1 Varno delo z nevarnimi snovmi 12 1.6.2 Označevanje nevarnih snovi .............................. 13 1.6.3 Vnos strupenih snovi v telo 14 Zgradba atoma ........................................................ 17 2.1 Zgradba atoma 18 2.2 Vrstno in masno število 19 2.2.1 Vrstno ali atomsko število ................................ 19 2.2.2 Masno število 19 2.3 Relativna atomska masa 19 2.3.1 Relativna molekulska masa .............................. 20 2.4 Izotopi 20 2.5 Elektronska ovojnica ................................................ 22 2.5.1 Razporeditev elektronov po orbitalah –elektronska konfiguracija 24 Elementi v periodnem sistemu 29 3.1 Elementi in njihove spojine v naravi 30 3.1.1 Voda .............................................................. 30 3.1.2 Kamnine 30 3.1.3 Zrak 31 3.2 Periodni sistem elementov ........................................ 32 3.2.1 Periode 33 3.2.2 Skupine .......................................................... 33 3.2.3 Reaktivnost elementov .................................... 33 3.3 Razvrstitev elementov v periodnem sistemu 34 3.4 Kovine .................................................................... 36 3.4.1 Lastnosti kovin 36 3.4.2 Oksidacija kovin 36 3.4.3 Alkalijske kovine ............................................. 37 3.4.4 Zemeljskoalkalijske kovine 38 3.4.5 Prehodni elementi 40 3.4.6 Zlitine ............................................................ 42 3.5 Polkovine 43 3.6 Nekovine 44 3.6.1 Halogeni elementi ........................................... 46 3.6.2 Žlahtni plini 47 Povezovanje delcev ............................................... 51 4.1 Kemijske vezi 52 4.2 Ionska vez 52 4.2.1 Ionski kristali .................................................. 54 4.3 Kovalentna vez 55 4.3.1 Nepolarna kovalentna vez 56 4.3.2 Polarna kovalentna vez .................................... 57 4.3.3 Kovalentni kristali 58 4.4 Kovinska vez ............................................................ 59 4.4.1 Kovinski kristali ............................................... 60 4.5 Medmolekulske sile 61 4.5.1 Disperzijska medmolekulska sila ....................... 61 4.5.2 Orientacijska medmolekulska sila 63 4.5.3 Indukcijska medmolekulska sila 64 4.5.4 Vodikova vez .................................................. 65 4.5.5 Molekulski kristali 67 Spremembe snovi ................................................... 69 5.1 Fizikalne in kemijske spremembe 70 5.1.1 Fizikalne spremembe ....................................... 70 5.1.2 Kemijske spremembe ...................................... 70 5.2 Kemijska enačba in zakon o ohranitvi mase 71 5.2.1 Enačba kemijske reakcije .................................. 71 5.2.2 Zakon o ohranitvi mase 72 5.3 Energijske spremembe pri kemijskih reakcijah 73 5.3.1 Eksotermna in endotermna reakcija .................. 73 5.3.2 Aktivacijska energija 74 5.4 Hitrost kemijskih reakcij 75 5.4.1 Merjenje in računanje hitrosti kemijske reakcije .. 75 5.4.2 Vplivi na hitrost reakcij 76 5.4.3 Aktivacijska energija 77 5.4.4 Katalizirana reakcija (kataliza) ........................... 78 5.5 Reakcije oksidacije in redukcije 82 5.5.1 Oksidacija, redukcija in redoks reakcije .............. 82 5.5.2 Urejanje enačb redoks reakcij ........................... 83 5.5.3 Galvanski členi 85 5.5.4 Elektrokemijska napetostna vrsta ...................... 88 5.5.5 Elektroliza 90 5.5.6 Galvanizacija 92 5.6 Kisline, baze in soli ................................................... 93 5.6.1 Brønsted-Lowryjeva teorija kislin in baz v vodnih raztopinah 93 5.6.2 Kisline, s katerimi se najpogosteje srečujemo ..... 95 5.6.3 Baze, s katerimi se najpogosteje srečujemo 96 5.6.4 Nevtralizacija 97 5.6.5 Indikatorji ....................................................... 98 5.6.6 Kisli dež 101 5.6.7 Reakcije med ioni ........................................... 102 1 2 3 4 5
Ogljikovodiki s polimeri .................................... 109 6.1 Nafta in predelava nafte 110 6.1.1 Ogljikovodiki 110 6.1.2 Predelava nafte .............................................. 111 6.1.3 Uporaba ogljikovodikov 112 6.2 Lastnosti ogljikovodikov 114 6.2.1 Učinki ogljikovodikov na okolje ....................... 114 6.3 Polimeri 117 6.3.1 Naravni polimeri 118 6.3.2 Sintetični polimeri .......................................... 119 6.3.3 Lastnosti polimerov 120 6.3.4 Skupine polimerov ......................................... 121 6.3.5 Polimeri in okolje ........................................... 123 Kemija v prehrani ................................................ 127 7.1 Hranilne snovi 128 7.1.1 Hranilne snovi v prehrani 128 7.1.2 Zdravo prehranjevanje ................................... 129 7.1.3 Energijska vrednost živila 130 7.2 Maščobe (lipidi) 130 7.2.1 Trigliceridi .................................................... 131 7.2.2 Masti 131 7.2.3 Olja .............................................................. 132 7.2.4 Maščobe in zdravje ........................................ 134 7.2.5 Kemijske reakcije maščob 135 7.2.6 Površinsko aktivna sredstva ............................ 135 7.3 Ogljikovi hidrati 137 7.3.1 Nastanek ogljikovih hidratov 137 7.3.2 Monosaharidi ............................................... 138 7.3.3 Disaharidi 140 7.3.4 Polisaharidi 142 7.3.5 Ogljikovi hidrati in zdravje .............................. 145 7.4 Beljakovine 146 7.4.1 Enostavne in sestavljene beljakovine 147 7.4.2 Globularne in fibrilarne beljakovine ................. 148 7.4.3 Aminokisline 148 7.4.4 Zgradba beljakovin ........................................ 151 7.4.5 Beljakovine in zdravje ...................................... 152 7.5 Dodatki v hrani 153 7.5.1 Aditivi za živila ............................................... 153 7.5.2 Vonji in dišave 154 Poimenovanje binarnih spojin 159 6 7 izbirne vsebine 4
1 Svet snovi
topnost snovi

letalna doza
Kemija je ena od temeljnih naravoslovnih ved, ki preučuje zgradbo snovi, njihove lastnosti in spremembe. Je eksperimentalna veda, ki razvija postopke za pripravo novih, za naše življenje pomembnih snovi. Pri tem se povezuje z biologijo, fiziko, matematiko, pa tudi z informatiko in drugimi vedami. Je interdisciplinarna veda.
Fritz Pregl (1869–1930) – Nobelova nagrada za kemijo 1923
Leta 1923 je na področju razvoja mikroanalize Nobelovo nagrado za kemijo dobil Fritz Pregl. Rodil se je v Ljubljani slovenskim staršem in ga zato upravičeno štejemo za prvega in zaenkrat edinega Slovenca, ki je dobil Nobelovo nagrado. V času, ko je razvijal svojo metodo analize, je bil zaposlen na Medicinsko-kemijskem inštitutu v avstrijskem Gradcu.

Po njem se imenuje Preglovo priznanje, ki ga vsako leto podeljujejo učencem osnovnih in srednjih šol na tekmovanju iz znanja kemije. nevarne snovi
elementi raztopine spojine materiali masni delež zmesi masna koncentracija
5
KAJ JE KEMIJA?
1.1 Kaj je snov?
Snov pogosto lažje zaznamo, kot pa ustrezno opredelimo; največkrat jo zaznavamo s čutili. Iz snovi so galaksije, Sonce in planeti, oceani, puščave in gozdovi, rastline in živali, človeško telo, celice in geni v našem telesu …
Ker so snovi tako raznolike, še ne poznamo enotne in popolne definicije snovi. Uporabna je definicija, da je snov vse, kar ima maso in prostornino. Snovi so zgrajene iz majhnih delcev, gradnikov snovi – to je atomov, molekul in ionov.
Snovi glede na izvor delimo na:
• naravne snovi (npr. voda, zrak, prst, kamnine …) ter


• umetne ali pridobljene snovi (npr. čistila, kozmetika, fitofarmacevtska sredstva, zdravila …).
Snovi glede na sestavo in lastnosti delimo na:
čiste snovi, med katere uvrščamo elemente in spojine
Imajo stalno kemijsko sestavo in kemijske lastnosti.
• Elementi so čiste snovi, zgrajene iz enakih gradnikov. Elementi so lahko zgrajeni iz atomov (npr. železo (Fe), natrij (Na), helij (He)) ali iz molekul (npr. jod (I2), kisik (O2), žveplo (S8)). Elementi so razvrščeni v periodni sistem.

• Spojina je čista snov, v kateri so atomi različnih elementov. Primeri spojin so voda (H2O), ogljikov dioksid (CO2), amonijak (NH3), glukoza (C6H12O6). Atomi različnih elementov v spojinah so med seboj povezani v točno določenem razmerju. Spojine so lahko zgrajene iz molekul ali iz ionov. V molekuli sta najmanj dva različna atoma, nekatere molekule pa imajo po več tisoč atomov (makromolekule). Med spojine uvrščamo tudi skupke ionov ali ionske kristale.


zmesi, ki so lahko homogene in heterogene
• Iz več čistih snovi, ki med seboj ne reagirajo, lahko pripravimo zmesi (mešanice). V zmesi ohrani vsaka čista snov svoje značilne lastnosti in zgradbo. V naravi prevladujejo zmesi.
• Homogena zmes vsebuje majhne in enakomerno porazdeljene delce, na videz zmes izgleda enotna (ne ločimo delcev zmesi).
• Pri heterogeni zmesi so vidne snovi, ki jo sestavljajo, na videz zmes izgleda raznolika.
Zdravila so primer umetnih snovi.
Voda je spojina, sestavljena iz dveh različnih elementov – vodika in kisika.
Zrak je homogena zmes, sestavljen iz 78,09 % dušika, 20,95 % kisika, 0,93 % žlahtnega plina argona in 0,03 % ogljikovega dioksida.
Zmes olja in vode je primer heterogene zmesi.
6
Baker je element.
homogena heterogena element spojina
Saharoza je spojina treh različnih elementov - ogljika, vodika in kisika.
1.2 Metode ločevanja zmesi
Bron je homogena zmes, zlitina bakra in kositra.
Žveplo je element. Heterogena zmes je zemlja (prst). V njej lahko vidimo kamenje, pesek in vrsto drugih snovi in organizmov.


Metodo ločevanja zmesi izberemo glede na lastnosti čistih snovi, ki so v njej. Če imamo na voljo več metod, s katerimi bi lahko ločili komponente zmesi, običajno izberemo cenejšo in hitrejšo metodo.
Metoda ločevanja Opis metode ločevanja Primeri zmesi
Sejanje
Dekantiranje (odlivanje)
Centrifugiranje
Ločevanje z magnetom
Sublimacija

Filtriranje
Izparevanje
Destilacija
Ločevanje z lijem ločnikom
Postopek ločevanja zmesi trdnih snovi na osnovi velikosti delcev.
Postopek ločevanja netopnih trdnih snovi v tekočini. Trdni delci se posedejo na dnu posode, tekočino pa lahko odlijemo.
Postopek ločevanja majhnih delcev snovi od tekočine. V centrifugi se pri hitrem vrtenju delci usedajo glede na njihovo gostoto.
Postopek ločevanja, ko je v zmesi snov, ki ima magnetne lastnosti (železo, nikelj, kobalt).
Postopek ločevanja zmesi trdnih snovi, ko le ena snov pri segrevanju sublimira.
Postopek ločevanja netopnih trdnih snovi od tekočine. Pri tem tekočina prehaja skozi filter, ki je nepropusten za trdno snov.

Postopek ločevanja v zmesi raztopljenih snovi, pri segrevanju ena izmed njiju izpari.
Postopek ločevanja snovi iz tekoče zmesi na podlagi njihovih različnih temperatur vrelišč.
Postopek ločevanja dveh tekočin, ki se med seboj ne mešata in imata različno gostoto.
Zmes svinčenih kroglic in mivke
Pesek v vodi
Kri (ločitev krvnih celic od krvne plazme)
Zmes železnih opilkov in lesne žagovine
Zmes joda in peska
Mivka v vodi
Pridobivanje soli iz morske vode
Žganjekuha (ločevanje etanola in vode)
Zmes olja in vode
SNOV
ČISTA
ZMES
SNOV
7
Jod pri nekoliko povišani temperaturi iz sivih kristalčkov sublimira v vijoličasto paro.
ALI VEŠ?
Suhi led (trdni ogljikov dioksid) sublimira že pri –78,5 °C v plinasti ogljikov dioksid.

OZNAKE OB SNOVEH
(s) – trdna snov
(l) – tekoča snov
(g) – plinasta snov
(aq) – vodna raztopina snovi

1.3 Agregatna stanja snovi
Delci snovi imajo v različnih stanjih – plinastem, tekočem in trdnem stanju –različno razporeditev delcev in hitrost gibanja. Ta stanja imenujemo agregatna stanja.
• V plinih so delci precej oddaljeni med seboj in se prosto gibljejo. Zaradi tega zavzemajo ves prostor, ki jim je na voljo. Delci se hitro gibljejo. Plini nimajo stalne oblike.
• V tekočinah so delci tesno skupaj in razporejeni brez reda. Gibljejo se drug mimo drugega. Zaradi tega tekočina nima stalne oblike in zavzame obliko posode.
• Delci v trdnem stanju so tesno skupaj in urejeno razporejeni. Gibljejo se lahko okoli svoje lege in je ne morejo zapustiti. Njihovo gibanje je omejeno na nihanje. Zaradi tega ima trdna snov določeno obliko.
Prehodu iz trdnega v plinasto agregatno stanje brez vmesnega tekočega stanja pravimo sublimacija. Sublimacija nastopi tudi, če se zrak, ki je nasičen z vodno paro, hitro ohladi pod temperaturo ledišča vode.
trdna snov (s) tekočina (l) plin (g)
izhlapevanje/ izparevanje
taljenje
strjevanje
utekočinjanje/ kondenzacija
sublimacija strjevanje
1.4 Lastnosti materialov
ALI VEŠ?
Materiali so npr. steklo, jeklo, les, plastika itd.
Materiali so snovi, iz katerih izdelujemo predmete. Vsak predmet ima svoj namen, kar moramo upoštevati pri izbiri materiala. Najpomembnejše lastnosti materialov lahko razdelimo v štiri skupine: fizikalne, kemijske, mehanske in tehnološke.

8
Fizikalna

Kemijska
Mehanska
Lastnost je merljiva in opisuje snov.
Lastnost podaja obnašanje snovi/materiala v prisotnosti drugih snovi.
Lastnost opiše obnašanje snovi/materiala pri mehanskih obremenitvah. Pri tem se spremeni zunanja oblika snovi, kemijska sestava pa se ohrani.
Tehnološka
ALI VEŠ?
Lastnost podaja primernost snovi/materiala za obdelavo z določenim tehnološkim postopkom.

Gostota, tališče in vrelišče, viskoznost, toplotna prevodnost, magnetne lastnosti, električna prevodnost
Odpornost proti koroziji, obstojnost pri povišani temperaturi, gorljivost
Trdota, elastičnost, plastičnost, krhkost, žilavost
Odrezovalnost, gnetljivost, toplotna obdelovalnost, livnost
1.5 Raztopine

Raztopina je homogena zmes topila in topljenca.
• Snov, ki jo raztapljamo, imenujemo topljenec.
• Snov, ki je v raztopini v večjem deležu in v njej raztapljamo topljenec, je topilo.
Topila in topljenci so lahko v trdnem, tekočem ali plinastem agregatnem stanju. Topilo je najpogosteje v tekočem agregatnem stanju (voda je polarno topilo, heksan, petroleter, bencin in cikloheksan so nepolarna topila).
Glede na to, koliko topljenca je raztopljenega v določeni količini topila, poznamo koncentrirane in razredčene raztopine.
• Če je topljenca v primerjavi s topilom malo, govorimo o razredčenih raztopinah
• Če je topljenca veliko, je raztopina koncentrirana
Poznavanje lastnosti materialov je pomembno v gradbeništvu. Obzidje starodavnega mesta Bam v Iranu je decembra 2003 porušil potres. Gradbeni material tega mesta je bila opeka iz gline in slame, sušena na zraku. Sodobne zgradbe so iz posebnih gradbenih materialov, na primer betona, ki je ojačan z jekleno konstrukcijo (temu pravimo armirani beton). Takšne zgradbe so potresno varnejše. Koncentrirana

Lastnost materialov Opis lastnosti Primeri lastnosti
V raztopini sladke vode je sladkor topljenec in voda topilo.
raztopina topilo topljenec
9
Razredčena raztopina
ALI VEŠ?
Raztopina se z dodajanjem topljenca ali odvzemanjem topila koncentrira, z dodajanjem topila ali z zmanjšanjem količine topljenca pa se razredčuje.
Zakaj je pomembno, da pravilno podamo sestavo raztopine? Poglejmo dva primera.
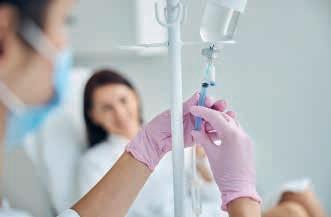
Če raztopina pri infuziji ne vsebuje takšne koncentracije soli, kot je v celicah, lahko pride do poškodbe celic.
1.5.1 Masni delež topljenca v raztopini
S pojmom masni delež topljenca povemo, kolikšen delež celotne mase raztopine predstavlja masa topljenca v raztopini.
• Masni delež označimo z w.
• Da bi lahko izračunali masni delež topljenca, moramo poznati tudi maso raztopine. Maso raztopine predstavljata masa topila in masa topljenca, ki je raztopljen v topilu.
• Če želimo masni delež podati v odstotkih, ga pomnožimo s 100 in dobimo odstotno koncentracijo raztopine.

w(topljenca) = m(topljenca)
m(raztopine)
masa(raztopine) = masa(topljenca) + masa(topila)
Primer: instant kava in voda


Instant kava je topljenec, voda pa topilo. Voda, v kateri je instant kava raztopljena, je raztopina.
Izračunajmo, kolikšen je masni delež instant kave, ki jo pripravimo tako, da v 100 g vode raztopimo 3 g instant kave.
masa topljenca = masa(instant kave) = 3 g
masa topila = masa(vode) = 100 g
w(topljenca) = m(topljenca)
m(raztopine)
masa(raztopine) = masa(topljenca) + masa(topila)
m(raztopine) = m(instant kave) + m(vode) = 3 g + 100 g = 103 g
w(topljenca) = m(topljenca)
m(raztopine) = 3 g 103 g = 0,029
w(instant kave) = 0,029
Če masni delež pomnožimo s 100, dobimo odstotek. Ta raztopina
vsebuje 2,9 % instant kave.
Kava z manjšim masnim deležem (w) – kava z manjšo odstotno koncentracijo
Kava z večjim masnim deležem (w) – kava z večjo odstotno koncentracijo
Če v antifrizu ni dovolj etilenglikola, lahko hladilna tekočina v hladilnem sistemu avtomobila zamrzne.
10























