9 minute read
Imunológia a alergológia
from inVitro 2/2022
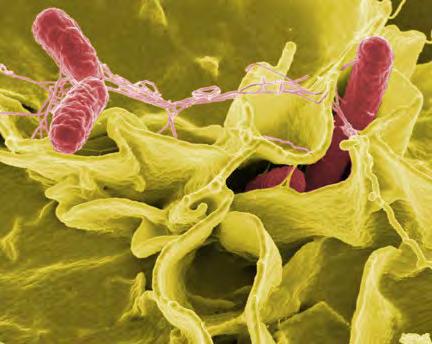
Baktéria Salmonella typhimurium, pôvodca úporných hnačkových ochorení. Snímka z elektrónového mikroskopu, umelo dofarbená. Zdroj: NAID, voľné dielo.
Pri cestách za hranice všedných dní majú mnohí účastníci zájazdu možnosť na vlastnej koži okúsiť faraónovu kliatbu, prípadne Montezumovu pomstu, ktorá sa pre nich stáva najintenzívnejším zážitkom z celej dovolenky. Najhoršie na takýchto skúsenostiach je zrejme to, že ani po vyliečení nemajú istotu, že sa závažný črevný zápal nerozvinie znova.
Advertisement
Rúško tajomstva, ktorým je mechanizmus recidívy zahalený, sa teraz podarilo poodkryť švajčiarskym expertom z Bazileja.
Existuje mnoho teórií, ktorými sa vedci usilujú vysvetliť, prečo je niekedy liečba antibiotikami neúčinná a prečo sa liečivá látka nedostáva ku všetkým bakteriálnym bunkám v dostatočnom množstve. Ako príčina sa spomína bariéra zníženej priepustnosti niektorých tkanív. Inokedy sa argumentuje schopnosťou baktérií utlmiť svoj metabolizmus do takej miery, že i keď sú obklopené jedovato pôsobiacimi látkami, cez membránu si do bunky pustia len také množstvo, s ktorým si dokážu poradiť. Ďalšia z teórií zas vidí dôvod v spomalení proliferácie v dôsledku stresu a nízkej hladiny adenozíntrifosfátu. Je opísaný aj ochranný vplyv asymetrického bunkového delenia, nerovnomerné rozdelenie efluxných púmp medzi dcérske bunky a množstvo ďalších mechanizmov umožňujúcich baktériám prežiť smrteľné koncentrácie antibiotík.
Švajčiarsky výskumný tím si na objasnenie záhady – prečo ani predĺžená liečba nedokáže patogén zlikvidovať – vzal na pomoc jeden z najnovších technologických vynálezov nazývaný STP (Serial Two-photon Tomography, teda dvojfotónovú tomografiu). Vytvára súbory údajov, z ktorých možno následne získať obrázky s vysokým rozlíšením a bez skreslenia. Skúmané tkanivo sa dá virtuálnymi rezmi krájať, čím vznikne trojrozmerná mapa. Dosiahnuté rozlíšenie postačuje dokonca aj na vizualizáciu jednotlivých buniek. Inak povedané, pred takým optickým rozčlenením tkaniva sa neschová žiadna baktéria.
Keďže vykonávanie pokusov na ľuďoch, zvlášť v prípade salmonely, sa nestretáva so záujmom pacientov, vedci si na spoluprácu vybrali hlodavce. Na obľúbenom myšom modeli potom testovali baktériu, ktorá patrí k najobávanejším ľudským patogénom: Salmonella enterica Typhimurium.

V roku 1884 objavil americký veterinár Daniel Elmer Salmon pôvodcu zhubného ochorenia prasiat. O päťdesiat rokov neskôr bol tento pôvodca podľa svojho objaviteľa pomenovaný „salmonela“. Dnes je opísaných viac ako 2 000 typov salmonel. Infekciu u ľudí vyvolávajú len štyri z nich. Zdroj: Wikipedia, voľné dielo.
Prečo sa salmonelám darí unikať aj razantnej antibiotickej liečbe? Je za tým slezina – jej časť nazývaná biela pulpa, kde je pre salmonely niečo ako imunitná tma.
Pomocou tejto novej techniky vedci získavali prehľad o prítomnosti salmonel v orgánoch, pričom išlo o veľmi nízke koncentrácie – jedna baktéria v 100 mm3 tkaniva. Umožňovalo im to pátrať po príčine, prečo sa salmonelám darí unikať aj razantnej antibiotickej liečbe. Vysvitlo, že je za tým slezina. Nie však celá, ale len jedna jej časť nazývaná biela pulpa. Tá je pretkaná veľkým množstvom lymfatických ciest a uzlíkmi plnými bielych krviniek. Prevažujú B-lymfocyty a ďalšie z hojne zastúpených buniek sú makrofágy a dendritové bunky. Všetky sú známe ako typickí účastníci zápalových reakcií.
Antibiotiká sú pri liečbe bakteriálnych ochorení neoceniteľnými pomocníkmi. V prípade sleziny však vyšlo najavo, že je tu háčik. Tamojší prirodzený imunitný systém sa pri ich použití doslova zrúti. Nie je to viditeľné na prvý pohľad, pretože počty salmonel v organizme pri liečbe antibiotikom začnú v okamihu klesať. Práve tak rýchlo sa začnú strácať aj zdravotné problémy. Problém je v tom, že salmonelám sa v bielej pulpe sleziny darí v zásade dobre aj pri tomto zlepšujúcom sa stave a po vysadení liečby im nerobí väčší problém znovu sa zapojiť do hry a prípadne svojmu dobrodincovi celú veselú záležitosť aj viackrát zopakovať.
Okrem objavu výskumníkov, že v bielej pulpe je pre salmonely niečo ako imunitná tma, sa im ďalšou metódou histochemických reakcií podarilo zistiť, kde presne sa tam salmonely schovávajú. A to je prekvapenie. V náročných antibiotických časoch si salmonely hovejú vnútri buniek nazývaných makrofágy. A pretože makrofágy sú jednou z opôr imunitného systému a slezina sa považuje za jedno z najdôležitejších sídel imunity, niet divu, že sami autori štúdie o salmonelách tvrdia, že sa dokážu schovávať priamo na „policajnom riaditeľstve“. V odbornom žargóne to spresňujú na „makrofágy s exprimovaným glykoproteínom CD68+“…
Výskumníci tomu spočiatku nechceli ani veriť, ale aj ďalšie pokusy im potvrdili, že ide naozaj len o makrofágy a nie iné typy bielych krviniek, napríklad B alebo T bunky (po starom B- a T-lymfocyty). A že útočisko salmonelám neposkytujú ani folikulárne dendritové bunky. Z pôvodne podozrivých museli vyškrtnúť aj monocyty a takisto lymfatické epiteliálne bunky a fibroblasty.
Jia-Gui Li, prvý autor štúdie. Center for Molecular Life Sciences. Zdroj: Biozentrum, University of Basel.
Dirk Bumann, profesor infekčnej biológie a biochemik, vedúci výskumného tímu na University of Basel. Zdroj: Biozentrum.
žila
tepna biela pulpa červená pulpa väzivové puzdro
slezina
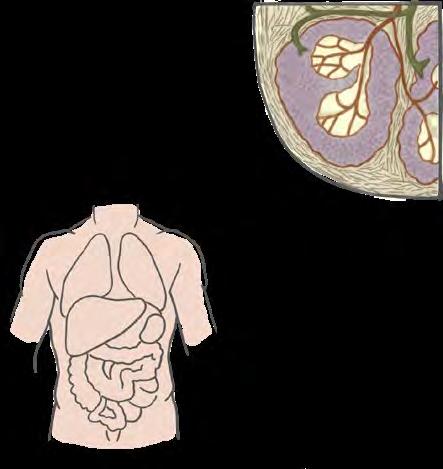
Slezina s vyznačením miesta „biela pulpa“. Zdroj: voľné dielo. Salmonely prežívajú liečbu antibiotikami v slezine na mieste nazývanom biela pulpa. V kultúre sa prezradia produkciou sírovodíka. Zdroj: Nathan Reading, Wikipedia, CCBY 2.0.
Poznatok, že sa patogénom darí útok antibiotík v slezine (konkrétne v lokalite biela pulpa) zvládnuť a že je to vďaka tamojším makrofágom, je zaujímavý. Z pohľadu praxe však bolo dôležitejšie zistiť, prečo tam antibiotiká na salmonely „nedosiahnu“, keď ich krv do sleziny prináša neúrekom. Nakoniec sa im podarilo vypátrať aj to. Antibiotiká síce do sleziny prúdia v hojnej miere, ale nie do všetkých miest. V prípade bielej pulpy sa to však nedeje prostredníctvom krvných vlásočníc, ale len difúziou. Vyšetrenie ultrazvukom odhalilo, že salmonely sa množením úspešne starajú o to, aby v cievach sleziny spôsobili rozsiahlu trombózu, čo tamojšiemu krvnému obehu práve neprospieva a znižuje to prísun antibiotík.
Na čo sú tieto nové poznatky dobré? Napríklad na to, že ukazujú cestu, ako vyberať chemoterapeutiká na liečbu salmonelových nákaz. Že voľba podľa ich účinnosti v kultúre na Petriho miske alebo podľa toho, ako rýchlo po ich podaní klesá počet salmonel v krvnom obehu, nie je tým pravým orechovým. A že lepším spôsobom bude difundovať ich schopnosť do trombózou zničených tkanív sleziny.
Ani to však nie je všetko. Aj pri antibiotiku a jeho dávkovaní bude treba zohľadniť, nakoľko razantne tlmí zápal. Pokusy na myšiach totiž ukázali, že zápal prebiehajúci pri salmonelóze v slezine je vec mimoriadne prospešná. Je to tak, nejde o nesprávny preklad pôvodného zdroja. Sprievodným znakom zápalu je totiž zvýšená koncentrácia neutrofilov a monocytov. Utlmením zápalu dochádza k výraznému poklesu týchto buniek a práve v tom sa skrýva čertovo kopyto. Bez ich spolupráce sa i antibiotická liečba salmonel míňa s účinkom.
To, že je zápal v prípade bakteriálnych infekcií pozitívom, preukázali už aj iní autori a objavila sa snaha využívať to aj pri liečbe salmonelózy. Nezáleží až tak na účinnosti medikamentu, ale ani na tom, či „chytíme“ salmonelu normálnu, alebo rezistentnú. Rozhodujúcim pre celkové vyliečenie sa ukazuje to, či sa podarí nevyradiť z hry náš imunitný systém.
Látka IL-15 stimuluje prirodzené zabíjačské schopnosti neutrofilov.
Napríklad pomocou injekcií usmrtenej salmonely alebo purifikovaného lipopolysacharidu (LPS). Ak by šlo len o to, k stimulácii imunitného systému po takých injekciách dochádza, ale veľmi to nepomáha. Vedci teraz odhalili, prečo je to tak. Tieto injekčne aplikované látky (lipopolysacharidy) sa zachytávajú na všetkých možných miestach, nedostávajú sa však práve tam, kde sú najviac potrebné, teda do sleziny. Inými slovami, aktivuje to imunitné bunky, len nie na tých miestach, kde je to žiaduce – v bielej pulpe, v ktorej sa salmonely v makrofágoch ukrývajú. Ak to všetko dosť zjednodušíme, tak nám nové poznatky hovoria, že nezáleží až tak na účinnosti medikamentu, ale ani na tom, či „chytíme“ salmonelu normálnu, alebo rezistentnú. Rozhodujúcim pre celkové vyliečenie sa ukazuje to, či sa podarí nevyradiť z hry (či už nevhodným načasovaním, alebo príliš razantným prístupom) náš imunitný systém. Zvládnuť salmonely samotnými antibiotikami nemožno. Spoluúčasť neutrofilov a monocytov pri likvidácii nepriateľa ukrývajúceho sa v samotnom riaditeľstve imunitného systému sa ukázala ako nevyhnutná.
V reči odborníkov to znamená sústreďovať sa napríklad na stimuláciu neutrofilov, čo je stratégia s nádejnými výsledkami – v poslednom čase sa zavádza ako doplnková liečba rakoviny. Pomôckou na postrčenie imunity k vyšším výkonom je v tomto prípade neutralizačná protilátka, ktorá potláča účinok cytokínov s neblaým vplyvom na funkciu neutrofilov (napríklad TGF-β).
Ďalšou sľubnou látkou je superantagonista interleukínu (konkrétne IL15). Jeho efekt spočíva v stimulácii prirodzených zabíjačských schopností neutrofilov. Pravdepodobne sa čoskoro nájdu aj ďalšie spôsoby, ako zachraňovať životy v prípade ťažkých sepsí a ako zbavovať recidív nešťastníkov, ktorí si z dovolenky okrem iného privezú aj nejakú tú bakteriálnu nepríjemnosť.
4
40 μm C2
C1 2
1
C2
C1 1 2 3
3
C
4
40 μm
C2
C1 1 2
3
Zobrazenie buniek pomocou 3D nanoendoskopie AFM. (A) Rôzne merané oblasti vykonané v bunkovej kultúre HeLa na test životaschopnosti buniek vrátane jadier a okrajových oblastí buniek: (1) 2 × 2 × 7 μm3, (2) 2 × 2 × 10 μm3, (3) 40 × 40 × 8 μm3 a (4) 2 × 2 × 7 μm3 , zvýraznené červenými štvorčekmi; dve bunky sa použili ako kontrola, C1 a C2. (C) Príklad fluorescenčnej snímky po 210 minútach. Na kontrolu platnosti testu sa po 260 minútach pridal do média peroxid, aby bunky zahubil. (D) Fluorescenčná snímka s už viditeľnými známkami poškodenia všetkých buniek, z ktorých väčšina už prekonala zmrštenie alebo apoptózu. Zdroj: Science Advances, 10.1126/sciadv.abj4990
Záver
Ukázalo sa, že STP tomografia by mohla byť metódou, ktorá posúva naše poznatky o veľký kus vpred a odpovedá na otázku, prečo je niekedy liečba bakteriálnych infekcií neúčinná. Hoci sa tento článok týka iba kritických miest recidivujúcej salmonelózy, podobná situácia by mohla byť aj pri stafylokokových, tuberkulóznych a iných ťažko liečiteľných infekciách. Už teraz je isté, že o STP tomografii budeme ešte počuť a čoskoro o nej opäť písať.
Len niekoľko dní po zverejnení švajčiarskej štúdie, v ktorej sa preukázala schopnosť STP tomografie, prekonali jej precíznosť japonskí vedci. V článku uverejnenom v časopise Science opísali metódu, ktorá umožňuje zobraziť v bunkách aj jednotlivé organely. Možno namietať, že to isté zvládali aj iné techniky skenovacej mikroskopie. To je síce pravda, ale tentokrát na to nebolo treba nechávať bunky zmraziť v tekutom dusíku alebo ich vysušovať, prípadne pokoviť, aby ich potom bolo možné (značne poškodené) pitvať. Takisto do nich nebolo treba vpravovať farby, ktoré sa viažu na štruktúry vnútri bunky, čím sa stáva pozorovateľnou vo fluorescenčnom mikroskope. Sledovať správanie organel „v priamom prenose“ sa zatiaľ veľmi nedarilo. Súčasná filigránska technika umožňujúca skúmať dynamiku organel v živých bunkách sa nazýva nanoendoskopia AFM. Jej princíp nie je nový. Vychádza z techniky nazývanej mikroskopia atomárnych síl, pri ktorej sa skenujúca sonda tesne približuje ku skúmanej vzorke. V Japonsku to však vylepšili do takej miery, že sondu vkladajú priamo do živých buniek.
Zatiaľ čo STP tomografia (o ktorej referoval text o salmonelách) umožňuje sledovať napríklad replikáciu jednotlivých buniek, pomocou nanoendoskopie možno pozorovať, čo sa pri tom deje vo vnútri bunky. Niet pochýb o tom, že sa obe metódy výrazne zapíšu do pokroku v biológii aj medicíne. Nezaškodí sledovať ďalšiu prácu oboch tímov a ich odporúčaniami sa aj riadiť.
Literatúra
1. Jia-Gui Li, Beatrice Claudi, Joseph
Fanous, Natalia Chicherova, Francesca
Romana Cianfanelli, Robert A. A.
Campbell, Dirk Bumann: Tissue compartmentalization enables
Salmonella persistence during chemotherapy. PNAS, publikované online 13. 12. 2021.
2. MARCOS PENEDO, et al.: Visualizing intracellular nanostructures of living cells by nanoendoscopy-AFM,
SCIENCE ADVANCES • 22 Dec 2021 •
Vol 7, Issue 52 • DOI: 10.1126/sciadv. abj4990
3. Niels de Jonge, Frances M. Ross.:
Electron microscopy of specimens in liquid, Nature Nanotechnology 6, 695–704 (2011)










