16 minute read
Bảng 1.1. Một số phương pháp phân tích AST từ dược liệu Thổ Phục Linh
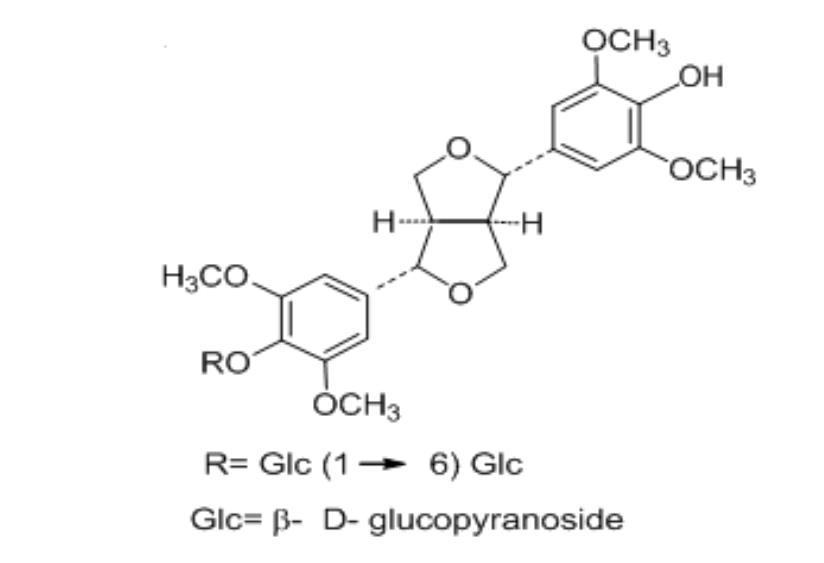
Lignan glycoside: lignan glycoside là chất mới (+) – syringaresinol 4-ODẠY KÈM QUY NHƠN OFFICIAL β-D-glucopyranosyl-(1-6)-β-D-glucopyranoside đã được tách ra với 12 cấu tử trên bởi Yuan(2003) [47]. Hình 1.6. Lignan glycoside được tách từ rễ TPL Các hợp chất phenylpropanoid glycoside [12] là lớp chất thứ hai có 7 cấu tử trong đó 5 cấu tử mới là smiglaside A-E. Các polyphenol, phenolic acid và các glycoside của nó [45]: lớp chất này bao gồm 9 cấu tử gồm các resveratrol. Các acid hữu cơ bao gồm các butan diacid, palmitic acid, và 2,2dimethylsuccinic acid. Các chất sterol gồm các β-sterol và stigmasterol. Cuối cùng là các hợp chất khác như các fructoside, các hợp chất dị tố, các acid amine, protein, … 1.1.3. Một số phương pháp phân tích AST từ dược liệu Thổ Phục Linh Bảng 1.1. Một số phương pháp phân tích AST từ dược liệu Thổ Phục Linh STT [TLTK]
Phương pháp chiết Điều kiện phân tích Kết quả phân tích
Advertisement
1 [2]
- Dung môi chiết: MeOH 60%. - Điều kiện chiết: đun hồi
HPLC
- Pha động: MeOH: CH3COOH 1% (39:61). - Pha tĩnh: Cột kích thước (25 cm x 4,6 mm; 5 µm) Dược liệu phải chứa không dưới 0,45% AST tính theo dược liệu khô kiệt.
lưu trong 1h. - Bước sóng phát hiện 291 DẠY KÈM QUY NHƠN OFFICIAL nm, tốc độ dòng 1 ml/phút, thể tích tiêm mẫu 10 µl. 2 [5]
- Dung môi Ethanol 50 %, - Nhiệt độ chiết 70ºC, chiết 2 lần - Tỷ lệ dung môi/ dược liệu 5/1,15/ lần, thời gian chiết 30 phút/lần.
HPLC
- Cột sắc ký SunFire C18 (25 cm x 4,6 mm; 5 µm); detector UV tại bước sóng 320 nm; tốc độ dòng 1,0 ml/phút; thể tích bơm mẫu 10µl. - Pha động: gradient ACN: HCOOH 0,2% thay đổi tỉ lệ từ 20: 80 đến 95:5. - Định lượng đồng thời AST và emodin trong bài thuốc GK1 (gồm nhiều loại dược liệu) với hàm lượng được xác định lần lượt là 3,30 ± 0,02 mg/g và 0,55 ± 0,02 mg/g tính theo khối lượng khô tuyệt đối. - Hiệu suất chiết AST là 94,86 ± 4,44 % và emodin là 62,61 ± 2,70 %. 3 [3]
- Dung môi chiết: Ethanol 85%. - Phương pháp chiết: ngâm trong thiết bị chiết thuỷ tinh ở nhiệt độ phòng trong 2 ngày.
HPLC
- Cột zobax eclipse XDB C18 (4,6 mm x 150 mm, 5 μm) và cột bảo vệ C18 của hãng Agilent. - Pha động Methanol : nước (0,3% acid acetic), chạy gradient. - Thời gian chạy 40 phút; Tốc độ dòng 0,5 ml/phút; Bước sóng lựa chọn phân tích 191 nm; - Lượng mẫu bơm 5 μl; Hàm lượng AST trong mẫu thổ phục linh Việt Nam tại các tỉnh là khá cao từ 0,8 - 1,1% so với trọng lượng mẫu củ khô (trừ vùng Sơn La 0,74%).
- Nhiệt độ cột 25ºC. DẠY KÈM QUY NHƠN OFFICIAL 4 [24]
- Dung môi chiết: MeOH. - Điều kiện chiết: chiết siêu âm 3 lần, mỗi lần 8ml dung môi.
HPLC
- Cột C18 (4,6 mm x 250 mm, 5 μm); tốc độ dòng 1,0 ml/phút; bước sóng phân tích 291 nm. - Pha động: acid acetic 0,1% - acetonitril (70:30, v/v). - LOD là 0,5 μg/ml, LOQ là 1,5 μg/ml. - Thời gian lưu của AST ở khoảng 19 phút. - Thẩm định phương pháp cho độ chính xác cao (98,3 ± 4,6% đến 102,5 ± 1,0%) và độ đúng có RSD 1,37%. 5 [39]
HPLC
- Pha động: acid Phosphoric 0,2%, acetonitril, chạy gradient. - Pha tĩnh: cột C18 (5 µm; 4,6 mm × 150 mm); bước sóng phát hiện 290 nm. - Định lượng được 10 mẫu dược liệu được thu nhặt ở những vùng khác nhau của tỉnh Guangxi. - Đường chuẩn có hệ số R2 = 0,9999. - RSD trung bình của độ thu hồi là 1,09%. 6 [25]
HPLC
- Cột ODS-A (5 μm, 4,6 mm x 250 mm); tốc độ dòng 0,8 ml/phút; bước sóng phát hiện 306 nm. - Pha động: acetonitril và acid phosphoric 0,05% chạy gradient. - Khoảng tuyến tính của AST là 0,018 –0,288 mg/ml. - Độ thu hồi trung bình từ 99,6%102,1% với RSD = 1,9%.
Nhận xét: DẠY KÈM QUY NHƠN OFFICIAL - Qua các nghiên cứu trong nước và trên thế giới, nhóm nghiên cứu nhận thấy AST được xác định hàm lượng trong dược liệu Thổ phục linh mà chưa có trong các chế phẩm. - Để chiết AST, dung môi được sử dụng chủ yếu là Methanol và Ethanol với các phương pháp chiết khác nhau như hồi lưu, siêu âm, chiết nóng, chiết ở nhiệt độ phòng, …Trong đó, chiết siêu âm với dung môi Methanol cho kết quả có độ chính xác khá cao, thao tác đơn giản và nhanh. - Phương pháp phân tích được sử dụng chủ yếu là HPLC với hệ pha động và bước sóng phát hiện khác nhau. Pha tĩnh được sử dụng chủ yếu là cột C18 của các hãng khác nhau. - Khoảng tuyến tính ở mỗi hệ dung môi trong các nghiên cứu khác nhau nhiều. Hệ pha động Acetonitril và acid phosphoric có khoảng tuyến tính dài từ 18 – 288 μg/ml [25]. 1.2. Sắc ký lỏng hiệu năng cao – HPLC 1.2.1. Khái niệm Sắc ký lỏng là một phương pháp tách sắc ký các chất dựa trên sự phân bố khác nhau của chúng giữa hai pha không trộn lẫn, trong đó pha động là chất lỏng chảy qua pha tĩnh chứa trong cột. Khi tiến hành chạy sắc ký, các chất phân tích được phân bố liên tục giữa pha động và pha tĩnh. Trong hỗn hợp các chất phân tích, do cấu trúc phân tử và tính chất lý hoá của các chất khác nhau nên khả năng tương tác của chúng với pha tĩnh và pha động khác nhau. Do vậy chúng di chuyển với tốc độ khác nhau và tách ra khỏi nhau. Trong HPLC, tùy thuộc vào kỹ thuật sắc ký người ta chia thành: - Sắc ký phân bố (Partition Chromatography: PC). - Sắc ký hấp phụ, có 2 loại: Pha thường (Normal phase: NP-HPLC), Pha ngược hay pha đảo (Reverse phase: RP- HPLC). - Sắc ký trao đổi ion (IE-HPLC) và cặp ion (IP-HPLC). - Sắc ký rây phân tử (FG-HPLC).
1.2.2. Cấu tạo hệ thống HPLC
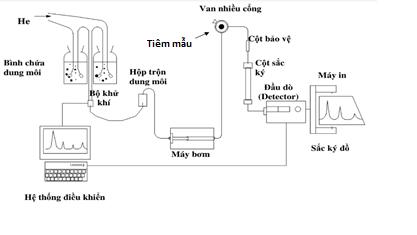
DẠY KÈM QUY NHƠN OFFICIAL Sơ đồ máy sắc ký lỏng hiệu năng cao HPLC (Hình 1.7) gồm các bộ phận sau: - Pha động: Dung môi đưa mẫu đi qua cột. - Pha tĩnh: Cột sắc ký đặt trong buồng cột. - Hệ thống tiêm mẫu: Đưa mẫu vào cột. - Detector (DAD): Phát hiện chất phân tích trong mẫu. - Hệ thống thu nhận và xử lý dữ liệu. Hình 1.7. Sơ đồ cấu trúc hệ thống HPLC 1.2.3. Một số thông số cơ bản của quá trình sắc ký - Thời gian lưu giữ - Hệ số phân bố và hệ số dung lượng - Độ chọn lọc - Số đĩa và chiều cao của đĩa trong cột sắc ký - Khả năng phân giải
DẠY KÈM QUY NHƠN OFFICIAL CHƯƠNG 2. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU 2.1. Đối tượng nghiên cứu 2.1.1. Mẫu thử Chế phẩm nghiên cứu là 6 mẫu thực phẩm bảo vệ sức khỏe (T1 đến T6) của Nanocare, Khương thảo đan, Goutcare, Viên gout Tâm Bình, Vương thảo kiện cốt với một số lô khác nhau. Các mẫu được mua ngẫu nhiên trên thị trường. Trong đó T1 được sử dụng để làm nền mẫu khảo sát xây dựng phương pháp định lượng. - Viên gout Nanocare: Sản xuất tại phân xưởng SX TPCN BKST2269 của Công ty CP Khoa học Kỹ thuật Bách Khoa; số lô sản xuất: 090419; hạn dùng: 080422 và số lô sản xuất: 201217; hạn dùng: 211220. - Khương thảo đan: Sản xuất tại Công ty Cổ phần Công nghệ cao Thái Minh; Số lô sản xuất: 150820; số đăng kí: 3131/2019/ĐKSP; hạn dùng: 090823. - Vương thảo kiên cốt: Sản xuất tại Xưởng sản xuất Công ty CP Y dược ELIPHA; Số lô sản xuất: 022021; Số đăng kí: 6668/2020/ĐKSP; Hạn dùng: 36 tháng từ ngày sản xuất. - Viên gout Tâm Bình: Sản xuất tại Công ty Dược phẩm Tâm Bình; số lô và ngày sản xuất: 06042020. - Gudcare: Sản xuất tại Công ty TNHH sản xuất DP công nghệ cao Nanofrance; Số lô sản xuất: 010120; số đăng kí: 66/2020/ĐKSP; hạn dùng: 18/01/2023. 2.1.2. Hoá chất - Chuẩn đối chiếu: AST mua từ Biopurify Phytochemicals ( Trung Quốc) (98,00%, Lot. No. PRF9022741). - Dược liệu chuẩn mua tại Viện kiểm nghiệm thuốc Trung Ương (SKS: CV 0116035.01), dược liệu mua ngẫu nhiên ở cửa hàng bán dược liệu. - Methanol (Merk) dùng cho HPLC. - Nước cất hai lần.
- Acid acetic, acid phosphoric đạt tiêu chuẩn hoá chất tinh khiết phân tích DẠY KÈM QUY NHƠN OFFICIAL dùng cho HPLC. 2.1.3. Thiết bị, dụng cụ - Hệ thống máy HPLC Agilent 1200 Series (Mỹ). - Cột sắc ký Sunfire C18 (250 mm x 4,6 mm; 5 μm), sử dụng phần mềm xử lý số liệu Agilent ChemStation. - Máy siêu âm Ultrasonic LC 60H (Đức). - Phễu lọc Buchner, màng lọc cellulose 0,45 µm. - Cân phân tích A&D, Model GR-200, Nhật Bản, d = 0,1 mg. - Tủ sấy, tủ hốt. - Máy ly tâm lạnh. - Micro pipet 10-100 µl ABMATE pro, 100-1000 µl Nichipet EX. - Pipet chính xác 5 ml, 10 ml. - Bộ chiết Soxhlet 100 ml. - Các dụng cụ khác: pipet Pasteur, cốc có mỏ, ống đong, vial, chày và cối. 2.2. Phương pháp nghiên cứu Phương pháp thực hiện được khảo sát và xây dựng phù hợp với từng nội dung và theo hướng dẫn của AOAC 2013. 2.2.1. Khảo sát qui trình xử lý mẫu Tiến hành khảo sát phương pháp chiết, thời gian chiết, số lần chiết. Dựa vào diện tích pic của chất phân tích trên thiết bị sắc ký HPLC để lựa chọn quy trình xử lý mẫu cho hoạt chất AST trong chế phẩm tối ưu sau khi chiết. 2.2.2. Khảo sát điều kiện sắc ký phân tích AST trong chế phẩm chứa thổ phục linh bằng sắc ký lỏng hiệu năng cao (HPLC) a) Lựa chọn pha tĩnh Pha tĩnh được sử dụng là cột Sunfire C18 (250 mm x 4,6 mm; 5µm). b) Khảo sát pha động Tiến hành khảo sát thành phần, tỷ lệ pha động. Dựa vào khả năng tách các chất, mức độ ổn định của đường nền, thời gian lưu và hình dáng pic của chất
phân tích để chọn pha động. Các pha động được khảo sát là hỗn hợp của MeOH DẠY KÈM QUY NHƠN OFFICIAL 60% và các dung dịch sau: - Acid acetic băng 1%. - Acid phosphoric 0,1%. - Nước cất 2 lần. Các dung dịch trên được chuẩn bị như sau: - Dung dịch acid acetic băng 1%: Hút chính xác 10,0 ml acid acetic 100% vào bình định mức 1000 ml. Thêm nước cất 2 lần từ từ, định mức cho vừa đủ thể tích. Lắc đều. - Dung dịch acid phosphoric 0,1%: Hút chính xác 600 µl acid phosphoric 85% vào bình định mức 100,0 ml. Thêm nước cất 2 lần từ từ, định mức vừa đủ thể tích. Lắc đều. - Methanol 60%: Lấy chính xác 600 ml dung dịch MeOH 100% cho HPLC vào bình định mức 1000,0 ml. Thêm nước cất 2 lần định mức vừa đủ thể tích. Lắc đều. - Nước cất 2 lần. Các dung dịch trên được lọc qua màng 0,45 µm và siêu âm trước khi sử dụng. 2.2.3.Thẩm định phương pháp Dựa trên các tiêu chí: độ phù hợp hệ thống, độ chọn lọc, đường chuẩn và khoảng tuyến tính, độ chính xác, độ đúng, giới hạn phát hiện (LOD) và giới hạn định lượng (LOQ) theo hướng dẫn của AOAC 2013. a) Độ phù hợp của hệ thống - Độ phù hợp hệ thống là phép thử nhằm đánh giá độ ổn định của toàn hệ thống phân tích bởi các yếu tố như máy móc, thiết bị. - Xác định tính thích hợp của hệ thống bằng cách tiêm lặp lại 6 lần liên tiếp mẫu chuẩn AST có nồng độ nằm trong khoảng tuyến tính. Ghi lại thời gian lưu và diện tích pic đáp ứng qua các lần sắc ký. - Yêu cầu: Chênh lệch diện tích pic và thời gian lưu giữa các lần tiêm của cùng một mẫu, biểu thị bằng độ lệch chuẩn tương đối RSD không lớn hơn 2%.
- Tiến hành: DẠY KÈM QUY NHƠN OFFICIAL + Mẫu chuẩn gốc: Cân chính xác 5 mg AST cho vào bình định mức 5,0 ml, hoà tan và định mức bằng dung dịch MeOH 60%, thu được dung dịch chuẩn gốc có nồng độ khoảng 1000 ppm (µg/ml). + Mẫu chuẩn làm việc: Hút chính xác 1 ml dung dịch chuẩn gốc cho vào bình định mức 100 ml, định mức vừa đủ bằng MeOH 60%. Mẫu có nồng độ 10 ppm. + Tiêm 6 lần mẫu chuẩn làm việc. - Yêu cầu: Độ lệch chuẩn tương đối RSD của 6 lần tiêm lặp lại dung dịch chuẩn 100% có thời gian lưu (≤ 2,0%) và diện tích pic (≤ 2,0 %) của AST đều nằm trong khoảng cho phép thì hệ thống sắc ký là ổn định để định lượng AST. b) Độ đặc hiệu - Độ đặc hiệu của phương pháp: là khả năng đánh giá một cách rõ ràng chất cần phân tích khi có mặt các thành phần khác như tạp chất và các chất cản trở khác. - Yêu cầu: Thời gian lưu AST của dung dịch chuẩn, dung dịch thử và dung dịch thử thêm chuẩn phải tương đương nhau. Pic trong mẫu thử và thử thêm chuẩn phải tách hoàn toàn với các pic khác trong nền mẫu. Dung môi pha mẫu không xuất hiện pic ở trong khoảng thời gian lưu tương ứng với thời gian lưu của AST trên sắc ký đồ của dung dịch chuẩn - Tiến hành: Tiến hành sắc ký các dung dịch mẫu trắng MeOH 60%, mẫu chuẩn, mẫu thử, mẫu thử thêm chuẩn, ghi lại sắc ký đồ và các thông số thời gian lưu, diện tích của các pic thu được. - Chuẩn bị các mẫu như sau: + Mẫu trắng: dung dịch pha mẫu MeOH 60%. + Mẫu chuẩn: mẫu chuẩn AST nồng độ 10 ppm. + Mẫu thử: cân chính xác khoảng 0,1250 g chế phẩm T1 vào bình định mức 10,0 ml, định mức vừa đủ bằng dung môi MeOH 60%. Xử lý mẫu như mục 3.1 thu được mẫu thử T1.
+ Mẫu thử thêm chuẩn: chuẩn bị thêm một mẫu thử T1 như trên, thêm 70 DẠY KÈM QUY NHƠN OFFICIAL µl chuẩn AST nồng độ 1000 ppm, trộn đều thu được mẫu thử thêm chuẩn. c) Đường chuẩn và khoảng tuyến tính - Đường chuẩn: là đường biểu diễn sự phụ thuộc tuyến tính giữa đại lượng đo được và nồng độ các chất phân tích. - Khoảng tuyến tính của một phương pháp phân tích: là khoảng nồng độ ở đó có sự phụ thuộc tuyến tính giữa tín hiệu đo được và nồng độ chất phân tích. - Thực hiện: + Mẫu chuẩn AST gốc: dung dịch chuẩn Astilbin trong MeOH 60% nồng độ 1000 ppm. + Mẫu chuẩn AST pha loãng: lấy chính xác 1 ml dung dịch chuẩn AST 1000 ppm pha vào bình định mức 10,0 ml. Thêm dung dịch MeOH 60% đến vạch để được dung dịch có nồng độ 100 ppm. + Từ dung dịch chuẩn gốc AST tiến hành pha loãng bằng MeOH 60% để được các dung dịch chuẩn có nồng độ lần lượt 1 ppm; 2 ppm; 5 ppm; 10 ppm; 15 ppm; 20 ppm. + Dùng micropipet hút chính xác lần lượt 10 µl; 20 µl; 50 µl; 100 µl; 150 µl; 200 µl dung dịch chuẩn AST 100 ppm rồi thêm chính xác lượng dung môi MeOH 60% cho đủ 1000 µl. + Viết phương trình thể hiện mối tương quan của diện tích pic theo nồng độ của mỗi chất và đánh giá đường chuẩn dựa vào hệ số tương quan r. d) Độ chính xác của phương pháp - Độ chính xác thể hiện mức độ phân tán kết quả giữa một loạt phép đo từ nhiều lần tiến hành phân tích trên cùng một mẫu thử đồng nhất dưới những điều kiện xác định. + Độ lặp lại của phương pháp: Độ lặp lại diễn tả độ chính xác của một quy trình phân tích trong cùng điều kiện thí nghiệm trong khoảng thời gian ngắn. Tiến hành thí nghiệm 6 lần với cùng một nồng độ mẫu thử, xác định độ lệch tương đối RSD (%) của hàm lượng.
+ Độ chính xác trung gian: Bố trí thí nghiệm tương tự phần độ lặp lại của DẠY KÈM QUY NHƠN OFFICIAL phương pháp nhưng tiến hành vào thời gian khác, đổi kiểm nghiệm viên và phân tích trên hệ sắc ký lỏng khác. + Thực hiện: Tiến hành định lượng 6 lần riêng biệt trên mẫu thử T1 và tính toán độ lệch chuẩn tương đối. ������(%)=
���� ×100
�� ⃐ ���� =√∑�� ��=1(���� −��)2 ��−1 Trong đó: xi: Nồng độ tính được của lần thử nghiệm thứ i. ��: Nồng độ trung bình tính được của N lần thử nghiệm. N: Số lần thử nghiệm. - Yêu cầu: + Độ lặp lại: Chênh lệch kết quả giữa 6 lần thử, biểu thị bằng độ lệch chuẩn tương đối RSD (%) của hàm lượng AST không quá 2%. + Độ chính xác trung gian: Chênh lệch kết quả giữa 6 lần thử trong cùng một ngày và 12 lần thử trong hai ngày khác nhau, biểu thị bằng độ lệch chuẩn tương đối RSD (%) của hàm lượng AST không quá 3%. e) Độ đúng - Độ đúng của phương pháp: là khái niệm chỉ mức độ gần nhau giữa các giá trị trung bình của kết quả thử nghiệm và giá trị thực hoặc giá trị được chấp nhận là đúng. - Độ thu hồi (đánh giá độ đúng): là tỷ lệ phần trăm giữa giá trị thu được so với giá trị lý thuyết. - Tiến hành: thêm vào mẫu thử đã được xác định hàm lượng hoạt chất một lượng chính xác chất chuẩn sao cho nồng độ AST trong mẫu thử ở các khoảng 5 ppm, 10 ppm và 15 ppm. Mỗi mức nồng độ làm 03 mẫu. Tiến hành sắc ký theo điều kiện đã chọn. Tính tỷ lệ lượng AST thu hồi lại được so với lượng thêm vào. - Độ thu hồi được tính theo công thức:






