AICCER
ASSOCIAZIONE ITALIANA DI CHIRURGIA DELLA CATARATTA E REFRATTIVA
RIVISTA SCIENTIFICA DI INFORMAZIONE

CHIRURGIA DELLA CATARATTA
Incrementato rischio di edema maculare dopo la chirurgia della cataratta in occhi precedentemente vitrectomizzati per memebrana epiretinica idiopatica
CHIRURGIA REFRATTIVA
Calcolo del potere della IOL dopo chirurgia rifrattiva: un approccio multi-formula per migliorare i risultati rifrattivi
CHIRURGIA REFRATTIVA
Autorefrattometria vs refrazione soggettiva con lenti intraoculari monofocali, multifocali e a profondità di fuoco estesa
CHIRURGIA REFRATTIVA
Sequential Custom Therapeutic Keratectomy (SCTK) per migliorare le caratteristiche della superficie corneale sottoposta a PRK prima della chirurgia della cataratta. Studio a lungo termine
CHIRURGIA DELLA CATARATTA
Benefici della terapia a base di acido ialuronico 0,15% e vitamina B12 nei pazienti sottoposti alla chirurgia della cataratta

Aderisci anche tu

In omaggio il kit essenziale per la gestione della presbiopia
Il kit contiene:
Manuale “La compensazione della presbiopia con lenti progressive: oftalmiche e a contatto”
Opuscolo “Le principali cause di perdita della vista”
Opuscolo “Lenti Progressive: vedere bene, a ogni distanza”
Ricettario
Modulo di accompagnamento al medico oculista
Scopri di più su
www.osservatoriopresbiopia.com info@fgeditore.it

Responsabile Editoriale
Scipione Rossi
Direttore Responsabile
Ferdinando Fabiano
Comitato Pubblicazioni AICCER
Giovanni Alessio, Roberto Bellucci, Vincenzo Orfeo, Riccardo Sciacca
Redazione
Segreteria AICCER
AIM Group International - Milan Office Viale Forlanini, 23 - 20134 Milano tel. 02 56601.1
e-mail: segreteriaaiccer@aimgroup.eu
Scipione Rossi
e-mail: scipione.rossi@gmail.com
Grafica e Stampa
FGE S.r.l.
Pubblicità
FGE S.r.l.
Reg. Rivelle 7/F - Moasca (AT) tel. 0141 1706694
e-mail: info@fgeditore.it

ISSN 1973-9419
Registrazione presso il Tribunale di Asti n° 5/98 del 15/12/1998
Il contenuto degli articoli pubblicati è di esclusiva responsabilità degli autori. La riproduzione di articoli o parte di essi deve essere autorizzata dall’Editore.
Redazione: Strada 4 Milano Fiori, Palazzo Q7 – 20089 Rozzano (MI)
Sede operativa: FGE srl − Regione Rivelle 7/F − 14050 Moasca (AT) – Tel. 0141 1706694 – Fax 0141 856013 e-mail: info@fgeditore.it − www.fgeditore.it
Garze sterili
Spray oculare
soluzione oculare










SICUREZZA IN OFTALMOLOGIA
Nella prevenzione delle infezioni dell’occhio e dei suoi annessi.

SOMMARIO
INTERAZIONI • NOTIZIE DAL CONSIGLIO DIRETTIVO di Paolo Vinciguerra ?
INTERAZIONI • NOTIZIE DAL CONSIGLIO DIRETTIVO di Daniele Tognetto ?
CHIRURGIA DELLA CATARATTA
Incrementato rischio di edema maculare dopo la chirurgia della cataratta in occhi precedentemente vitrectomizzati per memebrana epiretinica idiopatica
10 di Eleonora Corbelli, Lorenzo Iuliano, Francesco Fasce, Marco Codenotti, Francesco Bandello
CHIRURGIA REFRATTIVA
Calcolo del potere della IOL dopo chirurgia rifrattiva: un approccio multi-formula per migliorare i risultati rifrattivi
18 di Ferdinando Cione, Marco Gioia, Sergio Pagliarulo, Isabella Pellegrino, Margherita Di Stasi, Ilenia Di Paola, Maddalena De Bernardo, Nicola Rosa

CHIRURGIA REFRATTIVA
Autorefrattometria vs refrazione soggettiva con lenti intraoculari monofocali, multifocali e a profondità di fuoco estesa
32 di Carlo Bellucci, Paolo Mora, Salvatore Tedesco, Stefano Gandolfi, Roberto Bellucci
CHIRURGIA REFRATTIVA
Sequential Custom Therapeutic Keratectomy (SCTK) per migliorare le caratteristiche della superficie corneale sottoposta a PRK prima della chirurgia della cataratta. Studio a lungo termine
36 di Fabrizio I. Camesasca, Paolo Vinciguerra, Riccardo Vinciguerra
CHIRURGIA DELLA CATARATTA
Benefici della terapia a base di acido ialuronico 0,15% e vitamina B12 nei pazienti sottoposti alla chirurgia della cataratta
40 di Carlo Santucci




Gentili colleghi,
INTERAZIONI
NOTIZIE DAL CONSIGLIO DIRETTIVO
di Paolo Vinciguerra

scorrendo il programma del congresso nazionale AICCER venturo di Trieste ho fatto una considerazione: in pochi anni la tecnologia ha cambiato molto il nostro lavoro ed è ormai impensabile non rimanere aggiornati, fare da sé, considerando che ciascuno di noi eccelle in alcuni campi, ma non in tutti. È quindi necessario, attraverso questi incontri, vedere il futuro. Tale futuro lo vediamo a volte con ritardo sulle riviste che richiedono un percorso di review talvolta lungo. Stiamo osservando quante attività professionali personali vengano vendute a catene o società che si occupano di sanità. Nel futuro se questa tendenza, come probabile, continua sarà sempre più difficile una attività indipendente e libera per chi inizia, dovendosi confrontare con colossi finanziari. Sempre più spesso il chirurgo della cataratta oggi si trova ad affrontare casi che richiedano l’estrazione in pazienti precedentemente sottoposti a chirurgia refrattiva. Questa condizione pone molti limiti: condizione difficile poiché la valutazione della curvatura corneale in biometria con sim K misurati a 3 mm dal vertex presume la normale asfericità e prolatura. È vero che esistono formule dedicate ma anche queste talvolta falliscono in pazienti che hanno aspettative elevatissime abituati alla prevedibilità della chirurgia refrattiva e abituati all’emmetropia. Ma anche quando il target è raggiuntole aberrazioni indotte non consentono il perfetto funzionamento ottico di una lente multifocale o EDOF. Ci si trova limitati.
In Aiccer avremo simposi su questi aspetti ove un rimodellamento fotoablativo terapeutico, con la funzione esclusiva di rimodellare la cornea, eliminando ogni aberrazione e ripristinando la normale prolatura, consente biometrie più sicure, acutezza visiva più elevata (abbiamo rimosso tutte le aberrazioni) e maggiore libertà nella scelta della IOL poiché una cornea normalizzata diviene assimilabile a una cornea vergine.
È vero che questo trattamento preliminare di foto ablazione terapeutica induce un difetto refrattivo ma questo sarà facilmente sanabile con l’impianto di una IOL. Inoltre, il trattamento preliminare senza finalità emmetropiche, richiede una sottrazione di tessuto molto limitata poiché si abla in aree mai trattate in precedenza. Spesso un massimo di 60 micron sono sufficienti ma i risultati refrattivi e di qualità visiva non sono comparabili con la sola chirurgia della cataratta senza preliminare riduzione delle aberrazioni ottiche. Ricordo poi che, le nostre IOL hanno asfericità ottimizzata per cornee vergini, quindi se impiantate in pazienti con pregressa chirurgia refrattiva l’aberrazione sferica aumenterà con conseguente riduzione del contrasto (molto percepito nella visione notturna poiché l’aberrazione sferica cresce con la 4° potenza del raggio. Quindi da una pupilla da 3 mm a una di 6 l’aberrazione sferica aumenta non il doppio ma 9 volte).
Stiamo osservando, essendo partiti nel 2004 con lo studio del cross linking per la commissione europea con Theo Sailer, che in alcuni pazienti con follow up molto esteso> di 10 anni appiattimenti corneali massivi.
Lo stupore nasce dall’osservazione che questi pazienti avevano sviluppato la normale regolarizzazione morfologica nei primi due, tre anni per poi stabilizzarsi. Noi li seguiamo annualmente con tutti gli esami strumentali possibili e con nostra sorpresa dopo 10 oppure 12 anni dalla visita di un anno a quell’anno successivo sviluppano appiattimenti corneali massivi che in 2/3 anni inducono ipermetropie anche di 10D!
Tomograficamente spessore invariato per stroma ed epitelio, elevazione ant. e post molto ridotta in centro e incrementata in periferia, camera anteriore che si riduce lievemente a causa dell’appiattimento centrale.
Con l’università di Verona (Prof. Emilo Pedrotti) ne stiamo identificando cause. Presto ne daremo notizia.

Scopri le novità

Le lenti intraoculari Alcon sono state impiantate globalmente in più di 120 milioni di occhi1
1 Milione
Più di di Impianti.
Momenti straordinari resi possibili grazie alla IOL Vivity®, la EDOF #1 al mondo. 2-3

SCEGLI IL LEADER GLOBALE NELLE IOL TRIFOCALI 4-5 †
L'importanza di un'educazione incentrata sul paziente
I pazienti a etti da cataratta sono ben disposti a investire nella chirurgia, ma molti non conoscono che esistono diverse opzioni per le lenti intraoculari (IOL). Una chiara comunicazione durante il percorso del paziente è fondamentale per stabilire fiducia e massimizzare la soddisfazione post-operatoria.
Sono disposti a pagare per eliminare la necessità di occhiali7 38%
Sono al corrente delle diverse opzioni di lenti tra cui scegliere7

età. Diventa essenziale l'utilizzo di strumenti digitali per instaurare un legame col paziente, accompagnando lungo tutto il suo percorso, anche prima del suo arrivo in clinica.

Utilizzo di strumenti digitali nei pazienti over 606
Guarda video su dispositivi digitali 61%
Possiede uno smartphone 97%

Usa lo smartphone per visitare siti web 92%
Alcon mette a disposizione una serie di strumenti digitali e di risorse per aiutarvi a costruire il coinvolgimento dei pazienti.









INTERAZIONI
NOTIZIE DAL CONSIGLIO DIRETTIVO
di Daniele Tognetto

giungo alla conclusione del mio ultimo mandato come Presidente di AICCER con un sentimento di profonda gratitudine e soddisfazione. Guardando indietro al cammino percorso insieme, non posso che provare orgoglio per tutto ciò che abbiamo realizzato e per la crescita costante che la nostra Associazione ha vissuto negli ultimi anni. Questo incarico ha rappresentato per me non solo un’importante tappa professionale, ma anche un’esperienza umana straordinaria, fatta di incontri, confronti e momenti di grande valore condiviso.
Uno degli aspetti più significativi di questi anni è stata l’opportunità di accogliere nel Consiglio Direttivo nuovi membri, colleghi che si sono distinti per la loro competenza, la loro passione e il loro spirito di servizio. Il contributo di ciascuno di loro è stato essenziale per consolidare il ruolo di AICCER come punto di riferimento nella chirurgia della cataratta e della refrattiva, garantendo continuità ma anche innovazione nelle nostre attività scientifiche e formative.
Nel corso dei mandati, abbiamo lavorato con determinazione per ampliare le iniziative dell’Associazione, rendendo i nostri congressi e incontri sempre più dinamici e ricchi di contenuti. Abbiamo investito nella formazione delle nuove generazioni di chirurghi oftalmologi, favorendo il confronto tra esperti affermati e giovani professionisti desiderosi di crescere. Credo fermamente che il futuro della nostra disciplina passi proprio dalla capacità di trasmettere conoscenza ed esperienza, e AICCER ha sempre avuto questo obiettivo come guida.
Un altro importante traguardo è stato il potenziamento della formazione online attraverso i Webinar Focus online, che hanno permesso di approfondire temi di grande attualità con grandi esperti rendendo l’aggiornamento accessibile a tutti i nostri soci in modo diretto ed efficace. Questa modalità ha rafforzato ulteriormente il nostro impegno nella diffusione della conoscenza, creando nuove opportunità di confronto e crescita.
Parallelamente, abbiamo organizzato i nostri Congressi in alcune delle città più prestigiose d’Italia, portando la nostra attività scientifica in sedi di grande rilievo come Milano, Firenze e Roma, fino ad arrivare al 2025, quando avremo il piacere di ritrovarci a Trieste. Questi eventi sono stati momenti fondamentali per la nostra comunità, occasioni per condividere le più recenti innovazioni del settore in un contesto di altissimo livello scientifico e culturale.
Ma ciò che ha reso questo percorso ancora più speciale è stato il clima di collaborazione e amicizia che ha caratterizzato ogni attività dell’Associazione. Essere parte del Direttivo non è stato solo un impegno, ma un’esperienza di grande arricchimento personale. In questi anni, ho avuto il privilegio di lavorare con colleghi straordinari, persone di grande valore non solo dal punto di vista professionale, ma anche umano. È raro trovare un ambiente in cui il rispetto reciproco e la stima siano così profondi e sinceri, e posso dire con certezza che AICCER è stata ed è per me una seconda famiglia.
Ora, con la conclusione del mio mandato, guardo con fiducia al futuro dell’Associazione. Sono certo che chi prenderà il testimone saprà portare avanti con entusiasmo e determinazione il percorso di crescita che abbiamo costruito insieme. Mi auguro che AICCER continui a essere un punto di riferimento per tutti coloro che operano nel nostro campo, non solo per la qualità scientifica delle sue attività, ma anche per la capacità di creare connessioni autentiche tra i suoi membri.
Desidero ringraziare di cuore tutti coloro che hanno condiviso con me questo viaggio: i membri del Direttivo, i soci, i collaboratori e tutti coloro che hanno contribuito al successo della nostra Associazione. È stato un onore rappresentarvi e lavorare al vostro fianco. Con stima e riconoscenza.

CHIRURGIA DELLA CATARATTA
di Eleonora Corbelli, Lorenzo Iuliano, Francesco Fasce, Marco Codenotti, Francesco Bandello
Incrementato rischio di edema maculare dopo la chirurgia della cataratta in occhi precedentemente vitrectomizzati per memebrana epiretinica idiopatica
Introduzione
L’edema maculare cistoide pseudofachico (EMC), noto come sindrome di Irvine-Gass, è la causa più comune di deterioramento visivo dopo un intervento di cataratta non complicato, con tassi che variano dallo 0,1% al 3,8%.1–3
L’EMC può complicare anche altri interventi, in particolare la chirurgia per il glaucoma,4 la chirurgia corneale,5,6 e la chirurgia vitreoretinica, inclusi gli interventi di chirurgia maculare7-9 e per distacco di retina ab externo 10,11 o ab interno.12 L’edema maculare dopo chirurgia vitreoretinica si verifica con frequenze variabili dal 10% al 47%.8,9,13,14
Eseguire un intervento di cataratta in occhi precedentemente vitrectomizzati combina quindi due fattori di rischio: la chirurgia maculare e la facoemulsificazione, che potrebbero aumentare cumulativamente la probabilità di EMC post-operatorio. Gli studi hanno infatti dimostrato che eseguire un intervento di cataratta in occhi che hanno subito una pregressa chirurgia vitreoretinica per patologia maculare comporta un tasso più elevato di EMC (15-42%).7,15
Tuttavia, le evidenze riguardo i tassi di EMC postoperatorio negli occhi vitrectomizzati sono relativamente limitate in letteratura. Pertanto, lo scopo principale di questo studio è indagare la frequenza e la distribuzione di EMC dopo facoemulsificazione
in occhi precedentemente vitrectomizzati per varie patologie retiniche, con un focus sulle membrane epiretiniche idiopatiche (MER) e il distacco di retina regmatogeno primario non complicato (DRR).
Materiali e metodi
In questo studio retrospettivo longitudinale sono stati esaminati i dati di tutti i pazienti sottoposti a vitrectomia per MER o DRR dal gennaio 2016 al dicembre 2021 presso l’Unità di Chirurgia Vitreoretinica dell’IRCCS Ospedale San Raffaele di Milano. Sono stati esclusi:
• Occhi pseudofachici
• Equivalente sferico >-6,5 diottrie o lunghezza assiale >26 mm
• MER secondaria (es. retinopatia diabetica, uveite, occlusione venosa retinica, distrofie retiniche, trauma, ecc.)
• Glaucoma non compensato
• Casi complicati di DRR, inclusi: casi traumatici o recidivati, presenza di vitreoretinopatia proliferativa (PVR)>stadio A,16 rotture giganti, DRR associato a retinoschisi, distacco retinico associato a coloboma
• Complicazioni post-vitrectomia, come recidiva di DRR, occlusioni vascolari, neuropatie ottiche, ecc.
• Imaging compromesso dall’opacità dei mezzi ottici (cornea o cristallino)
• Pazienti con diabete senza retinopatia.
Abbiamo valutato longitudinalmente la frequenza di comparsa di EMC post-chirurgico dopo tali procedure vitreoretiniche non complicate, raggruppando gli occhi in base alla patologia retinica di partenza (MER o DRR).
In seguito, sono stati esaminati gli occhi che hanno sviluppato una cataratta visivamente invalidante e che sono stati sottoposti a facoemulsificazione (non complicata). È stato quindi di nuovo valutata la frequenza di comparsa di EMC entro i primi 6 mesi dopo l’intervento di cataratta.
Tutti i pazienti sono stati sottoposti a valutazione pre-operatoria, quindi a controlli standard dopo 1 settimana e a 1-3-6-12 mesi, poi come da prassi clinica. È stato eseguito ad ogni visita, tranne che alla visita a 1 settimana, l’esame OCT.
CHIRURGIA DELLA CATARATTA
La presenza di EMC è stata attribuita solo nei casi che hanno mostrato, entro i primi 6 mesi di follow-up: 1) l’insorgenza di nuovi spazi cistoidi iporeflettenti intraretinici maculari, visibili all’OCT, non presenti prima della vitrectomia (Figura 1); 2) un peggioramento evidente delle dimensioni e del numero degli spazi cistoidi preesistenti, con un aumento dello spessore maculare centrale (CFT) di più del 10% o più rispetto al valore di partenza.
Procedura chirurgica
Gli interventi sono stati eseguiti in anestesia retrobulbare da consulenti senior in chirurgia vitreoretinica (MC, LI) utilizzando il vitrectomo Constellation (Alcon Surgical, Fort Worth, TX, USA), con tecnica 23 o 25 gauge, a seconda della preferenza. Il PFCL (perfluorodecalina, Bausch+Lomb, New York, USA) è stato utilizzato a discrezione del chirurgo. Le membrane (MER e membrana limitante interna [MLI]) sono state seguito, sono stati esaminati gli occhi che hanno sviluppato una cataratta visivamente invalidante e che sono stati sottoposti a facoemulsificazione (non complicata). È stato quindi di nuovo valutata la frequenza di comparsa di EMC entro i primi 6 mesi dopo l'intervento di cataratta. Tutti i pazienti sono stati sottoposti a valutazione pre-operatoria, quindi a controlli standard dopo 1 settimana e a 1-3-6-12 mesi, poi come da prassi clinica. È stato eseguito ad ogni visita, tranne che visita a 1 settimana, l’esame OCT. presenza di EMC è stata attribuita solo nei casi che hanno mostrato, entro i primi 6 mesi di follow-up: 1) l'insorgenza di nuovi spazi cistoidi iporeflettenti intraretinici maculari, visibili all’OCT, presenti prima della vitrectomia (Figura 1); 2) un peggioramento evidente delle dimensioni e numero degli spazi cistoidi preesistenti, con un aumento dello spessore maculare centrale (CFT) di più del 10% o più rispetto al valore di partenza.

chirurgica
CHIRURGIA DELLA CATARATTA
rimosse quando necessario utilizzando il colorante coniugato TWIN (AL.CHI.MI.A., Italia). Al termine di tutte le chirurgie maculari è stato eseguito regolarmente uno scambio fluido-aria e, se necessario, anche un tamponamento con gas. Per il tamponamento con gas sono stati utilizzati C3F8 o SF6 (AL. CHI.MI.A. S.R.L., Italia), rispettivamente diluiti al 6% e al 10%. La facoemulsificazione è stata effettuata in anestesia topica utilizzando il faco Centurion (Alcon Surgical, Fort Worth, TX, USA), con la stessa procedura chirurgica standard.
Terapia dell’edema maculare
Interventi chirurgici: caratteristiche
Tutti i casi di MER inclusi nello studio erano idiopatici e fachici, come da protocollo. La distribuzione degli stadi di MER era la seguente: 12 (6,4%) stadio 1, 35 (18,7%) stadio 2, 125 (66,8%) stadio 3, 15 (8%) stadio 4. Al termine dell’intervento, 156 occhi (83,4%) sono stati tamponati in aria, 21 (11,2%) in BSS e i restanti 10 occhi (5,3%) in SF6, a causa del riscontro intra-operatorio di lesioni regmatogene. Tutti questi casi sono stati trattati con retinopessia laser. La durata media dell’intervento è stata di 23±4 minuti. Il numero di iniezioni di colorante richieste è stato di 1,13±0,41.
Tutti i casi di DRR inclusi nello studio sono risultati, come da protocollo, non complicati e con un tasso di successo del 100% dopo un singolo intervento. La maggior parte (n=256, 82,3%) aveva la macula non coinvolta. Il 92,6% (n=288) ha ricevuto C3F8, il 7,4% (n=23) SF6. Nessun occhio è stato trattato con olio di silicone nella nostra serie. Il PFCL è stato utilizzato in 280 interventi (90,0%). La tecnica di retinopessia più utilizzata è risultata essere la crio (n=187, 60,1%), seguita dalla combinazione laser+crio (n=85, 27,3%) e dal solo laser (n=39, 12,5%). Il peeling della MLI non è mai stato eseguito nella nostra serie di DRR. La durata media dell’intervento è stata di 41±13 minuti.
La terapia standard dopo le procedure vitreoretiniche è stata: associazione di netilmicina e desametasone 4 volte al dì per 3 settimane e tropicamide 2 volte al dì per 1 settimana; dopo l'estrazione della cataratta è stato utilizzato: fluorochinolone o cloramfenicolo associato a desametasone 4 volte al dì per 1 settimana, quindi FANS per 3 settimane. Il trattamento per la gestione dell’EMC nel nostro centro è: desametasone 0,2% topico 4 volte al dì più FANS topico (bromfenac 0,9 mg/ml) 2 volte al dì per 4 settimane. Secondo il giudizio del clinico, il trattamento poteva quindi essere sospeso, ridotto o modificato con farmaci di seconda linea, che comprendono steroidi intravitreali (triamcinolone acetonide 80 mg/ml o impianto di desametasone a lento rilascio 700 μg).
La terapia standard dopo le procedure vitreoretiniche è stata: associazione di netilmicina e desametasone 4 volte al dì per 3 settimane e tropicamide 2 volte al dì per 1 settimana; dopo l’estrazione della cataratta è stato utilizzato: fluorochinolone o cloramfenicolo associato a desametasone 4 volte al dì per 1 settimana, quindi FANS per 3 settimane. Il trattamento per la gestione dell’EMC nel nostro centro è: desametasone 0,2% topico 4 volte al dì più FANS topico (bromfenac 0,9 mg/ml) 2 volte al dì per 4 settimane. Secondo il giudizio del clinico, il trattamento poteva quindi essere sospeso, ridotto o modificato con farmaci di seconda linea, che comprendono steroidi intravitreali (triamcinolone acetonide 80 mg/ml o impianto di desametasone a lento rilascio 700 μg).
Risultati
Risultati
La figura 2 mostra la popolazione inclusa nello studio.
La figura 2 mostra la popolazione inclusa nello studio.
Abbiamo individuato 58 occhi, tra quelli vitrectomizzati per MER, e 99 occhi, tra quelli vitrectomizzati per DRR, che sono andati incontro ad intervento di cataratta non complicato. La facoemulsificazione è stata eseguita in media 485±425 giorni (~1,3 anni) dopo la vitrectomia (range 27-

Interventi chirurgici: caratteristiche
Tutti i casi di MER inclusi nello studio erano idiopatici e fachici, come da protocollo. La
CHIRURGIA DELLA CATARATTA
non è mai stato eseguito nella nostra serie di DRR. La durata media dell'intervento è stata di 41±13 minuti.
Baseline mese 1 mese 3 mese 6 Pre-faco p
Abbiamo individuato 58 occhi, tra quelli vitrectomizzati per MER, e 99 occhi, tra quelli vitrectomizzati per DRR, che sono andati incontro ad intervento di cataratta non complicato. La facoemulsificazione è stata eseguita in media 485±425 giorni (~1,3 anni) dopo la vitrectomia (range 27-1829; mediana 390), senza differenze di tempo tra i gruppi.
(393-524)
(354-599)
(318-499)
Spessore centrale foveale (micron)
Edema maculare cistoide post-operatorio
Dopo intervento vitreoretinico isolato
DRR259±12 (240-277)
1829; mediana 390), senza differenze di tempo tra i gruppi.
(240-376)
(242-280)
(241-275) 0.1863
Poiché solo pochi casi di DRR sono stati esaminati pre-operatoriamente con OCT, i dati basali di CFT di questi occhi non sono stati considerati. Il CFT dei casi con DRR è rimasto invariato dal primo mese fino al momento dell'estrazione della cataratta. Gli occhi con MER, invece, hanno mostrato una riduzione continua del CFT dopo vitrectomia fino al momento della facoemulsificazione Al momento dell'intervento di cataratta, gli occhi vitrectomizzati per MER hanno mostrato una macula più spessa rispetto a quelli per DRR (p<0,0001) (Tabella 1).
Edema maculare cistoide post-operatorio
Dopo intervento vitreoretinico isolato
Spessore centrale foveale (micron)
hanno mostrato una macula più spessa rispetto a quelli per DRR (p<0,0001) (Tabella 1).
Baseline mese 1 mese 3 mese 6 Pre-faco p
Poiché solo pochi casi di DRR sono stati esaminati pre-operatoriamente con OCT, i dati basali di CFT di questi occhi non sono stati considerati. Il CFT dei casi con DRR è rimasto invariato dal primo mese fino al momento dell’estrazione della cataratta. Gli occhi con MER, invece, hanno mostrato una riduzione continua del CFT dopo vitrectomia fino al momento della facoemulsificazione. Al momento dell’intervento di cataratta, gli occhi vitrectomizzati per MER
Il tasso di EMC post-vitrectomia è risultato essere più alto negli occhi con MER (12,8%, n=24) rispetto a quelli operati per DRR (1%, n=3; p<0,0001) (Figura 3A).
(270421) <0.0001
Dei 3 occhi che hanno mostrato EMC dopo il trattamento di DRR, tutti erano con macula non coinvolta e la retinopessia era stata eseguita con crio. L’edema maculare è stato riscontrato in tutti i casi al controllo a 1 mese.
(241-275) 0.1863
Tabella 1
Dei 24 occhi che hanno presentato EMC dopo il peeling di MER, 5 erano allo stadio 4 e 19 allo stadio 3. L’EMC è stato riscontrato in 17 casi (70,8%) al
Il tasso di EMC post-vitrectomia è risultato essere più alto negli occhi con MER (12,8%, n=24) rispetto a quelli operati per DRR (1%, n=3; p<0,0001) (Figura 3A).

Figura 3
CHIRURGIA DELLA CATARATTA
controllo a 1 mese e in 7 occhi (29,1%) al controllo a 3 mesi.
L’analisi di regressione logistica ha trovato che stadi più elevati di ERM sono associati a un aumento del tasso di EMC post-chirurgico (coefficiente 1,5476, OR 4,7 [95% CI: 1,9098-11,5671], p=0,0008). È stato anche riscontrato che l’uso intra-operatorio del laser era associato alla comparsa di EMC (p<0,0001).
Dopo intervento di cataratta (occhi vitrectomizzati)
Il tasso di EMC è risultato significativamente più alto negli occhi vitrectomizzati per MER (13,8%, n=8) rispetto a quelli vitrectomizzati per DRR primario non complicato (2%, n=2; p=0,0055) (Figura 3B). Il rapporto di probabilità (odds ratio) di sviluppare EMC è di 7,76 (95% CI: 1,588-37,93; p=0,0113) negli occhi vitrectomizzati per ERM.
L’edema maculare è stato riscontrato in tutti i casi al controllo a 1 mese. Degli 8 occhi precedentemente vitrectomizzati per MER che hanno presentato EMC post-cataratta, 7 (87,5%) erano quelli che avevano già mostrato l’edema dopo la procedura vitreoretinica. I 2 occhi precedentemente vitrectomizzati per DRR che hanno mostrato EMC post-cataratta hanno mostrato, al contrario, una nuova comparsa di edema maculare.
La media dello spessore maculare degli occhi precedentemente operati per MER ha mostrato un aumento significativo, ma moderato, e successivamente una riduzione, rimanendo complessivamente stabile tra il periodo pre-cataratta e l’ultimo followup (p=0,9999). Il CFT degli occhi precedentemente operati per DRR è rimasto complessivamente stabile dopo l’intervento di cataratta.
La comparsa di EMC post-vitrectomia è stata associata a un aumentato rischio di EMC post-facoemulsificazione (coefficiente 2,3507, OR 13,588 [95% CI: 1,543-119,7], p=0,0187).
Trattamento
Tutti gli occhi che hanno sviluppato EMC dopo chirurgia maculare hanno ricevuto una iniziale terapia topica, secondo il regime sopra riportato. La maggior parte (91,6%, n=22) ha risolto gradualmente e completamente l’edema con terapia topica entro 6 mesi dalla presentazione. Due occhi sono stati trattati con una singola iniezione di impianto di desametasone, somministrato dopo 2 mesi di terapia topica. Un occhio ha risolto l’edema, mentre il secondo ha mostrato un edema cronico e scarsamente responsivo, presente all’ultimo follow-up anche dopo facoemulsificazione. Gli occhi vitrectomizzati per MER che hanno sviluppato un EMC dopo l’intervento di

Discussione
Grazie alla sua praticità, la combinazione di facoemulsificazione e chirurgia vitreoretinica è diventata sempre più comune. Sebbene questo approccio combinato sia elegante ed efficace, può esporre i pazienti a un rischio maggiore di EMC, poiché entrambe le chirurgie presentano fattori predisponenti per questa condizione. In particolare, è stato dimostrato che l'esecuzione della sola
cataratta hanno risolto tutto il fluido con la sola terapia topica.
Tutti gli occhi che hanno sperimentato un EMC dopo la riparazione di DRR sono stati trattati secondo il protocollo con terapia topica e l’edema si è risolto completamente. Gli occhi che hanno presentato EMC dopo l’intervento di cataratta sono anch’essi guariti con sola terapia topica.
Acuità visiva
La figura mostra l’andamento dell’acuità visiva (BCVA) dei pazienti affetti da MER. Gli occhi che hanno presentato EMC post-vitrectomia hanno costantemente presentato una significativa peggiore acuità visiva durante il follow-up, specialmente dopo l’intervento di cataratta (Figura 4).
Discussione
Grazie alla sua praticità, la combinazione di facoemulsificazione e chirurgia vitreoretinica è diventata sempre più comune. Sebbene questo approccio combinato sia elegante ed efficace, può esporre i pazienti a un rischio maggiore di EMC, poiché entrambe le chirurgie presentano fattori predisponenti per questa condizione. In particolare, è stato dimostrato che l’esecuzione della sola chirurgia della cataratta in occhi affetti da MER idiopatica aumenta il rischio di edema maculare fino al 15,7%.15
Una strategia logica per ridurre questo rischio è eseguire prima la vitrectomia, seguita in un secondo tempo dalla chirurgia della cataratta. Sebbene questa opzione possa sembrare ragionevole, comporta un’alta probabilità di rapida formazione della cataratta, con un’incidenza che può arrivare fino al 50% dopo il primo anno e all’85% entro 5 anni.17 Inoltre, considerando quest’ultima opzione, va anche preso in considerazione che la facoemulsificazione eseguita in un occhio vitrectomizzato per MER aumenta di per sé il rischio di EMC.7
Essendo entrambe le strategie gravate dalla possibilità di EMC post-chirurgico, la gestione della facoemulsificazione associata alla chirurgia vitreoretinica rimane quindi controversa. Nel nostro studio, abbiamo osservato un tasso di EMC del 13,8% dopo facoemulsificazione non complicata in occhi vitrectomizzati per MER idiopatica, un dato comparabile al tasso del 12,8% osservato dopo procedure vitreoretiniche isolate. Queste frequenze sono in linea con quelle precedentemente pubblicate da Frisina8 e Iuliano.18 Inoltre, una recente meta-analisi supporta anche l’equivalenza, in termini di incidenza di EMC, tra chirurgia sequenziale e chirurgia combinata.19
CHIRURGIA DELLA CATARATTA
Pertanto, dati questi risultati, l’opzione delle chirurgie combinate (faco-vitrectomia) nelle MER idiopatiche sembra una scelta ragionevole, poiché espone i pazienti a un unico stress chirurgico e quindi a un’unica “dose” di infiammazione. Tuttavia, questa considerazione va presa con cautela, specialmente in relazione alle MER in stadio avanzato, dove il rischio di EMC post-chirurgico può arrivare fino al 57,1%.18 Al contrario, il rischio di EMC dopo chirurgia per DRR non è così semplice da interpretare. I tassi di EMC riportati in letteratura variano ampiamente, dal 9,6% al 31%.12,20-23 Tuttavia, nella nostra serie abbiamo osservato un tasso più basso (1%) di EMC dopo la riparazione di DRR primario non complicato. Questa discrepanza può essere spiegata dall’esclusione nel nostro studio di casi di DRR più complessi, come quelli con grave PVR o distacchi recidivi (con più interventi chirurgici), fattori noti per aumentare il rischio di EMC. Escludendo intenzionalmente questi casi complicati, abbiamo cercato di fornire una stima più accurata del tasso di EMC per DRR non complicato, giustificando così la differenza nei nostri risultati. Un recente studio di Souissi sembra infatti confermare i nostri risultati, riportando tassi di EMC comparabili (3,1%).24
Per quanto riguarda la facoemulsificazione in occhi vitrectomizzati per DRR, abbiamo trovato che il tasso di EMC post-chirurgico dopo cataratta rimane basso (2%), specialmente se confrontato con il tasso di EMC in occhi vitrectomizzati per MER. In letteratura, la probabilità di sviluppare EMC dopo cataratta in occhi già vitrectomizzati per DRR è riportata come lievemente raddoppiata (OR 1,96 da Merad e 2,76 da Starr 21,22). Come già osservato, i dati pubblicati sulla chirurgia della cataratta in occhi con precedente riparazione di DRR provengono da casi eterogenei di DRR, il che può spiegare la vasta gamma di tassi di EMC.
Si potrebbe quindi affermare che gli occhi vitrectomizzati per MER abbiano un rischio significativamente maggiore di sviluppare EMC post-cataratta rispetto agli occhi vitrectomizzati per DRR primario non complicato. Da ciò si possono creare alcuni spunti interessanti. Si può ipotizzare che l’EMC che si verifica dopo una chirurgia maculare possa essere attribuito ai cambiamenti strutturali patologici della macula, tra cui la disfunzione delle cellule di Müller e la fibrosi intraretinica.25 Inoltre, alcune MER sono descritte come responsabili di una rottura della barriera emato-retinica, che a sua volta può portare a un aumento della permeabilità vascolare, al rilascio di citochine pro-infiammatorie e, infine, a un aumento dell’infiammazione intraoculare.26,27
CHIRURGIA DELLA CATARATTA
Questi cambiamenti retinici, insieme alla manipolazione chirurgica del tessuto, potrebbero aumentare il rischio di sviluppare EMC, rendendo la macula più “vulnerabile” e suscettibile all’edema. Il nostro risultato, soprattutto riguardo all’aumento del rischio di EMC in relazione allo stadio della MER (più avanzato è lo stadio, maggiore è il rischio), supporta questa ipotesi: gli stadi avanzati possono infatti presentare una rottura significativa della barriera emato-retinica o un malfunzionamento della glia, che è coinvolta nel riassorbimento dei fluidi intraretinici.28
Il ruolo del peeling della MLI rimane comunque controverso: considerando che nella nostra serie, per protocollo, abbiamo sempre eseguito il peeling della MLI, va anche precisato che gli occhi sottoposti a rimozione della MER senza peeling della MLI potrebbero mostrare tassi di EMC post-chirurgico differenti da quelli riscontrati nel nostro studio.
La maggiore suscettibilità all’EMC della macula trattata è anche supportata dal fatto che quasi tutti (87,5%) gli occhi che hanno presentato EMC dopo chirurgia della cataratta avevano già mostrato EMC dopo vitrectomia e peeling della MER.
Il nostro studio presenta diverse limitazioni tra cui il disegno retrospettivo e il numero ridotto dei casi. Riconosciamo che, a causa della scarsità di procedure vitreoretiniche isolate, l’inclusione di tali casi è stata relativamente rara. Nonostante questi limiti, i punti di forza del nostro studio sono: una selezione accurata dei pazienti; l’esclusione di casi complicati di DRR (come quelli con PVR, miopia o rotture retiniche giganti), che avrebbero potuto compromettere i risultati; e la novità nell’offrire un’analisi comparata tra occhi vitrectomizzati per differenti patologie retiniche.
In conclusione, il rischio di EMC dopo chirurgia della cataratta in occhi vitrectomizzati differisce significativamente a seconda della patologia retinica sottostante. Gli occhi vitrectomizzati per MER idiopatica presentano un rischio significativamente maggiore di sviluppare EMC, specialmente in stadi avanzati, a causa dei cambiamenti strutturali della macula e delle risposte infiammatorie aumentate. Al contrario, gli occhi vitrectomizzati per DRR primario non complicato hanno un rischio molto più basso di EMC post-cataratta, suggerendo che la decisione di risparmiare il cristallino in tali casi non comporta preoccupazioni per un aumento del rischio di EMC dopo una successiva chirurgia della cataratta. Per i casi di MER, rimane il dubbio se eseguire chirurgie sequenziali (vitrectomia seguita da chirurgia della cataratta) o combinare la facoemulsificazione con la vitrectomia. Entrambe le strategie, secondo
i dati pubblicati,9 comportano un rischio simile di EMC, e la scelta dovrebbe essere personalizzata in base alla condizione individuale del paziente, considerando in particolare lo stadio della MER e la vulnerabilità potenziale della macula.
Ulteriori studi prospettici e randomizzati dovrebbero essere progettati per confermare i nostri risultati e, possibilmente, integrare alcune considerazioni terapeutiche.
Bibliografia
1. Zur D, Loewenstein A. Postsurgical Cystoid Macular Edema. In: Developments in Ophthalmology. Vol 58. ; 2017:178-190. doi:10.1159/000455280
2. Han J V, Patel D V, Squirrell D, McGhee CNJ. Cystoid macular oedema following cataract surgery: A review. Clin Exp Ophthalmol. 2019;47:346-356. doi:10.1111/ceo.13513
3. Iftikhar M, Dun C, Schein OD, et al. Cystoid Macular Edema after Cataract Surgery in the United States: IRIS® Registry (Intelligent Research in Sight) Analysis. Ophthalmology. 2023;130:1005-1014. doi:10.1016/j.ophtha.2023.06.001
4. Bhakta AS, Fortun J, Thomas J, et al. Visually Significant Cystoid Macula Edema after Glaucoma Drainage Implant Surgery. J Glaucoma. 2018;27:184-188. doi:10.1097/ IJG.0000000000000855
5. Inoda S, Hayashi T, Takahashi H, et al. Risk Factors for Cystoid Macular Edema after Descemet Membrane Endothelial Keratoplasty. Cornea. 2019;38:820-824. doi:10.1097/ ICO.0000000000001950
6. Gibbons A, Chang VS, Yannuzzi NA. Posterior Segment Complications of Endothelial Keratoplasty. Int Ophthalmol Clin. 2020;60:97-111. doi:10.1097/IIO.0000000000000331
7. Mylonas G, Sacu S, Deák G, et al. Macular edema following cataract surgery in eyes with previous 23-gauge vitrectomy and peeling of the internal limiting membrane. Am J Ophthalmol. 2013;155. doi:10.1016/j.ajo.2012.07.013
8. Frisina R, Pinackatt SJ, Sartore M, et al. Cystoid macular edema after pars plana vitrectomy for idiopathic epiretinal membrane. Graefes Arch Clin Exp Ophthalmol. 2015;253:47-56. doi:10.1007/s00417-014-2655-x
9. Iuliano L, Cisa di Gresy G, Fogliato G, et al. Increased risk of postsurgical macular edema in high stage idiopathic epiretinal membranes. Eye Vis (Lond). 2021;8. doi:10.1186/ S40662-021-00252-4
10. Lai TT, Huang JS, Yeh PT. Incidence and risk factors for cystoid macular edema following scleral buckling. Eye (Basingstoke). 2017;31:566-571. doi:10.1038/eye.2016.264
11. Lobes LA, Grand MG. Incidence of cystoid macular edema following scleral buckling procedure. Arch Ophthalmol. 1980;98:1230-1232. doi:10.1001/archopht.1980.01020040082010
12. Bernabei F, Marcireau I, Frongia F, et al. Risk Factors of Cystoid Macular Edema After Pars Plana Vitrectomy for Pseudophakic Retinal Detachment. Ophthalmol Ther. 2023;12:1737-1745. doi:10.1007/S40123-023-00705-0/ TABLES/3
13. Leisser C, Hirnschall N, Hackl C, et al. Risk factors for postoperative intraretinal cystoid changes after peeling of idiopathic epiretinal membranes among patients randomized for balanced salt solution and air-tamponade. Acta Ophthalmol.
2018;96:e439-e444. doi:10.1111/aos.13635
14. Kim SJ, Martin DF, Hubbard GB, et al. Incidence of Postvitrectomy Macular Edema Using Optical Coherence Tomography. Ophthalmology. 2009;116:1531-1537. doi:10.1016/j.ophtha.2009.02.008
15. Schaub F, Adler W, Enders P, et al. Preexisting epiretinal membrane is associated with pseudophakic cystoid macular edema. Graefes Arch Clin Exp Ophthalmol. 2018;256:909917. doi:10.1007/S00417-018-3954-4
16. Lean JS, Stern WH, Irvine AR, et al. Classification of proliferative vitreoretinopathy used in the silicone study. The Silicone Study Group. Ophthalmology. 1989;96:765-771. doi:10.1016/S0161-6420(89)32821-1
17. Jackson TL, Donachie PHJ, Sparrow JM, Johnston RL. United Kingdom National Ophthalmology Database study of vitreoretinal surgery: report 2, macular hole. Ophthalmology. 2013;120:629-634. doi:10.1016/J.OPHTHA.2012.09.003
18. Iuliano L, Cisa di Gresy G, Fogliato G, et al. Increased risk of postsurgical macular edema in high stage idiopathic epiretinal membranes. Eye Vis (Lond). 2021;8. doi:10.1186/ S40662-021-00252-4
19. Daud F, Daud K, Popovic MM, et al. Combined versus Sequential Pars Plana Vitrectomy and Phacoemulsification for Macular Hole and Epiretinal Membrane: A Systematic Review and Meta-Analysis. Ophthalmol Retina. 2023;7:721731. doi:10.1016/J.ORET.2023.03.017
20. Gebler M, Pfeiffer S, Callizo J, et al. Incidence and risk factors for macular oedema after primary rhegmatogenous retinal detachment surgery: a prospective single-centre study. Acta Ophthalmol. 2022;100:295-301. doi:10.1111/aos.14940
21. Merad M, Vérité F, Baudin F, et al. Cystoid Macular Edema
CHIRURGIA DELLA CATARATTA
after Rhegmatogenous Retinal Detachment Repair with Pars Plana Vitrectomy: Rate, Risk Factors, and Outcomes. J Clin Med. 2022;11. doi:10.3390/JCM11164914
22. Starr MR, Cai L, Obeid A, et al. Risk Factors for Presence of Cystoid Macular Edema following Rhegmatogenous Retinal Detachment Surgery. Curr Eye Res. 2021;46:1867-1875. do i:10.1080/02713683.2021.1929330
23. Motta L, Frisina R, Ripa M, et al. Postoperative complications after successful primary rhegmatogenous retinal detachment repair. BMC Ophthalmol. 2023;23. doi:10.1186/ S12886-023-02824-5
24. Souissi S, Allou V, Trucchi L, et al. Macular oedema secondary to rhegmatogenous retinal detachment repair: risk factors for resistance to first-line therapy and long-term response to dexamethasone intravitreal implant. Eye 2023. Published online December 1, 2023:1-7. doi:10.1038/s41433-02302852-x
25. Pierro L, Iuliano L, Gagliardi M, et al. Role of ganglion cell complex in visual recovery following surgical internal limiting membrane peeling. Graefe’s Archive for Clinical and Experimental Ophthalmology. 2015;253:37-45. doi:10.1007/ s00417-014-2665-8
26. Joshi M, Agrawal S, Christoforidis JB. Inflammatory mechanisms of idiopathic epiretinal membrane formation. Mediators Inflamm. 2013;2013. doi:10.1155/2013/192582
27. Bu SC, Kuijer R, Li XR, et al. Idiopathic epiretinal membrane. Retina. 2014;34:2317-2335. doi:10.1097/ IAE.0000000000000349
28. Govetto A, Sarraf D, Hubschman JP, et al. Distinctive mechanisms and patterns of exudative versus tractional intraretinal cystoid spaces as seen with multimodal imaging. Am J Ophthalmol. 2019;212:43-56. doi:10.1016/j. ajo.2019.12.010

0141 1706694 – Fax 0141 856013 – e-mail: info@fgeditore.it – www.fgeditore.it

CHIRURGIA REFRATTIVA
di Ferdinando Cione, Marco Gioia, Sergio Pagliarulo, Isabella Pellegrino, Margherita Di Stasi, Ilenia Di Paola, Maddalena De Bernardo, Nicola Rosa
Calcolo del potere della IOL dopo chirurgia rifrattiva: un approccio multi-formula per migliorare i risultati rifrattivi
Introduzione
Grazie agli eccellenti risultati ottenuti, la chirurgia refrattiva laser (LRS) per miopi, come la cheratectomia fotorefrattiva (PRK), la cheratomileusi laser in situ (LASIK) e la cheratectomia subepiteliale laser assistita (LASEK), è stata ampiamente utilizzata negli ultimi decenni [1,2]
È noto che la LRS può indurre cambiamenti che coinvolgono non solo la cornea, ma anche altre strutture oculari [3]. Questi cambiamenti possono rendere inaffidabili diverse misurazioni, come la pressione intraoculare e il potere corneale [4-9]
Per questi motivi, il calcolo del potere della lente intraoculare (IOL) sarà impegnativo in questi pazienti [10]. Dopo la LRS miopica, la maggior parte dei dispositivi misura una curvatura corneale anteriore più ripida, poiché estrapola la curvatura corneale centrale dalle misure paracentrali. Questo evento, oltre a una variazione dell’indice cheratometrico, causa una stima errata della posizione effettiva della lente (ELP), poiché tutti questi parametri sono obbligatori per un calcolo accurato [11,12]. Infatti, dopo l’intervento di cataratta in occhi post-LRS miopica che utilizzano la maggior parte delle formule abitualmente utilizzate, è comune la cosiddetta “sorpresa ipermetropica” [13]
La maggior parte dei metodi proposti per superare questo problema richiede la conoscenza dei dati relativi alla chirurgia pre-refrattiva come la quantità di trattamento, ma purtroppo queste informazioni non sono disponibili per la maggior parte dei pazienti [14] . Per questo motivo, sono stati proposti nuovi metodi che non richiedono la conoscenza dei dati della
chirurgia pre-refrattiva. Queste formule sono note anche come metodi “no-history” perché non richiedono dati anamnestici, come l’entità del trattamento refrattivo o l’errore refrattivo preoperatorio. Recentemente, vari studi hanno confrontato le diverse formule cercando di stabilire quale potesse essere la migliore in tutti i casi, anche se solo quattro di questi hanno analizzato le formule no-history in occhi con precedente LRS miopica in base alla loro lunghezza assiale (AL) e nessuno ha cercato di verificare se i diversi metodi potessero fornire risultati migliori se utilizzati in pazienti con diversa cheratometria media (K) o rapporto AL/K [15-19]
Lo scopo di questo studio è stato quello di calcolare e analizzare le differenze negli errori di predizione refrattiva (PE) tra diverse formule che considerano diversi intervalli di K e AL quando si utilizzano metodi senza storia in occhi post-LRS miopica.
Questo studio è stato eseguito secondo i protocolli pubblicati da Hoffer et al. [20], recentemente aggiornati [21], e da Holladay et al. [22] Un caposaldo di questi protocolli è rappresentato dalla necessità inderogabile di ottimizzare la costante della lente: questo si è ottenuto con l’azzeramento dell’errore medio (ME) dei PE per ciascuna formula al fine di eliminare qualsiasi errore sistematico [21]. Infatti, se il ME è diverso da zero, viene utilizzato un fattore di lente inappropriato per quel gruppo specifico [20]. Poiché alcuni lavori suggeriscono che l’azzeramento del ME non dovrebbe essere fatto per gli occhi atipici [23], questo studio, analogamente ad altri [16-24], è stato eseguito sia con che senza azzeramento del ME.
Materiali e metodi
In questo studio retrospettivo multicentrico sono stati valutati i pazienti sottoposti a estrazione della cataratta e all’impianto di IOL nel sacco capsulare dopo LASIK o PRK miopica.
Criteri di inclusione e di esclusione
La ricerca ha seguito i principi della Dichiarazione di Helsinki e il consenso informato preoperatorio dei pazienti è stato ottenuto prima dell’intervento di cataratta, compreso il consenso all’uso di informazioni mediche anonimizzate per scopi scientifici [25] . Data la natura multicentrica dello studio, i pazienti sono stati reclutati in diverse unità di oculistica di ospedali e cliniche in Italia, ma la valutazione finale dei dati post-operatori è stata effettuata presso l’Unità di Oculistica dell’Università di Salerno (centro di raccolta dati). Inoltre, i chirurghi dei centri satellite hanno fornito i dati preoperatori e postoperatori al centro di raccolta. È stata ottenuta l’approvazione dell’Institutional Review Board (IRB) per eseguire tali analisi. Inoltre, una parte del database dei pazienti è stata presa dalla letteratura internazionale: sono stati scelti solo gli occhi in cui erano disponibili dati biometrici e refrattivi, applicando gli stessi criteri di inclusione ed esclusione utilizzati per gli altri occhi [25,26]. I dati della letteratura provenivano dall’Associazione olandese per la chirurgia refrattiva [26] e dal Kangnam St. Mary’s Hospital di Seoul [25]
Sono risultati eleggibili per lo studio un totale di 446 occhi sottoposti a chirurgia della cataratta con precedente intervento LASIK o PRK per miopia da gennaio 2014 a dicembre 2021.
I pazienti senza precedenti interventi di chirurgia refrattiva o sottoposti a interventi di chirurgia refrattiva diversi dalla LASIK miopica o dalla PRK (ad esempio, LASIK ipermetropica) non sono stati considerati idonei per lo studio.
Dal totale degli occhi considerati idonei per lo studio, 314 occhi sono stati esclusi dopo l’applicazione dei criteri di esclusione:
– 24 occhi perché le letture cheratometriche non erano state ottenute con la cheratometria:
– 239 occhi perché non erano noti tutti i dati postoperatori (e.g. refrazione sconosciuta dopo l’estrazione della cataratta o potenza della IOL impiantata sconosciuta) secondariamente alla natura multicentrica dello studio;
– 34 occhi a causa di malattie retiniche o corneali confondenti (e.g. occhio secco grave, pterigio, malattie della superficie oculare);
– 17 occhi a causa di complicazioni associate alla
CHIRURGIA REFRATTIVA
chirurgia della cataratta o perché avevano un’acuità visiva a distanza corretta post-operatoria ≤20/40 [21]
Dopo aver applicato i criteri di inclusione ed esclusione, sono stati selezionati per l’analisi un totale di 132 occhi (Gruppo A). In tutti i soggetti, gli interventi di cataratta sono stati eseguiti da diversi chirurghi in diverse cliniche mediante facoemulsificazione standard con tutte le IOL posizionate nel sacco capsulare.
In tutti gli occhi erano disponibili i seguenti dati: K e AL prima della facoemulsificazione, costante A, potere della IOL impiantata e risultato refrattivo almeno un mese dopo l’intervento.
I dati selezionati non sono stati utilizzati in precedenza per sviluppare le formule in esame [21]
Le letture K e le misure AL sono state ottenute con l’interferometria a coerenza parziale (PCI) eseguita con uno IOLMaster 500 (versione software 5.4.4.0006; Carl Zeiss Meditec, Jena, Germania). Le rifrazioni sferiche equivalenti postoperatorie dei pazienti sono state ottenute con metodi soggettivi (eseguiti dal chirurgo) dopo una valutazione con autorefrattometro. Per i metodi di calcolo del potere delle IOL diversi dalle formule basate su SRK/T [27], le costanti A sono stati convertiti utilizzando relazioni standard.
Formule di potere delle IOL analizzate
Tra i metodi che non richiedono l’uso di parametri preoperatori o quantità di trattamento per calcolare il potere della IOL [11,24,26,28-41], è stato possibile valutare i metodi descritti da Rosa (ALMA) [24], Barrett (TrueK) [30], Ferrara [31], Jin [34], Kim [26], Latkany (flat-K) [35] e Shammas [39]
Non sono stati analizzati altri metodi di calcolo del potere delle IOL senza storia dopo LRS miopica perché alcuni di essi richiedono l’uso di dispositivi speciali non disponibili per i pazienti analizzati [11,28,29,40]; altri, come il metodo delle lenti a contatto [41] o la refrazione intraoperatoria [33,36] perché richiedono esami specifici che non sono stati eseguiti, e la formula Haigis-L senza storia [32] non è stata inclusa perché richiede la conoscenza della profondità della camera anteriore (ACD).
Questo parametro è stato raccomandato anche per la formula Barrett Universal II, la base della Barrett True-K (TK), insieme ad altri parametri opzionali, ma è stato dimostrato che il contributo dell’ACD non è clinicamente rilevante nel calcolo del potere delle IOL quando AL > 22,00 mm [42]. Infine, il metodo del fattore R [38] non è stato analizzato perché ALMA ne è l’evoluzione.
CHIRURGIA REFRATTIVA
Calcolo del potere della IOL e degli esiti rifrattivi
Per ottenere i risultati refrattivi, sono stati eseguiti i seguenti passaggi utilizzando il software Excel (Microsoft Corporation, Redmond, WA, USA):
(1) Inserimento dei dati dei pazienti in un foglio di calcolo Excel;
(2) Sulla base di questi dati, gli esiti refrattivi previsti sono stati calcolati retrospettivamente utilizzando sette diverse formule.
I metodi ALMA [24], Ferrara [31], Jin [34], Kim [26], Latkany [35] e Shammas [39] sono stati programmati nel nostro database.
– La correzione del valore K clinicamente derivato di Shammas (Shammas c.d.) è stata utilizzata con la formula Shammas-PL.
– Il metodo Kim è stato utilizzato con la formula SRK/T [27]
– Il metodo Jin è stato utilizzato con la formula Holladay I [43], puntando a -0,75 D.
– I metodi Ferrara, Latkany e ALMA sono stati utilizzati con la formula SRK/T.
– Poiché la formula di Barrett-TK non è ancora stata pubblicata e l’unico modo per calcolare il potere della IOL con questo metodo è il calcolatore online di IOL post-refrattivo dell’American Society of Cataract and Refractive Surgery (ASCRS) (disponibile all’indirizzo https://acrs. org/tools/iol-calculator, visitato il 24 febbraio 2023) o l’Asia Pacific Association of Cataract & Refractive Surgeon (APACRS) Online Post-Refractive IOL Calculator (disponibile all’indirizzo https://www.apacrs.org, visitato il 24 febbraio 2023), gli errori di rifrazione previsti per il metodo Barrett-TK sono stati calcolati attraverso il calcolatore IOL APACRS.
(3) La PE è stata calcolata per ogni paziente e per ogni formula. La differenza tra l’errore refrattivo postoperatorio e quello previsto ha dato il PE. L’errore refrattivo previsto è stato calcolato retrospettivamente come il risultato refrattivo previsto con la IOL impiantata con ciascun metodo.
Tra questi pazienti, l’azzeramento del ME è stato possibile in 90 occhi (Gruppo B), perché in alcuni di essi erano noti solo il potere e la costante della lente del produttore, ma non il modello di IOL impiantato (25 occhi), oppure i modelli di IOL erano stati impiantati in meno di tre pazienti (17 occhi), rendendo l’azzeramento inaffidabile [24]. Il gruppo B era quindi composto solo da occhi in cui era possibile un’ottimizzazione costante attraverso l’azzeramento del ME. In questo gruppo non sono stati inclusi dati provenienti dalla letteratura.
– Per azzerare il ME con i metodi ALMA, Ferrara,
Latkany, Kim, Jin e Shammas, i dati ottenuti sono stati suddivisi in gruppi in base ai modelli di IOL e alle formule applicate. Quindi, i PE sono stati mediati e azzerati applicando l’opzione “goal seek” della funzione “what f analysis” di Excel [20,21] .
– Per azzerare i ME con il metodo Barrett-TK, è stato utilizzato un linguaggio di programmazione informatico specifico (Python, versione 3.9.3, Python Software Foundation disponibile all’indirizzo https://www.python.org, consultato il 14 agosto 2022). Come riportato nel paragrafo precedente, è stata utilizzata la formula di Barrett-TK per calcolare la refrazione prevista per ciascun paziente, che è stata poi confrontata con la refrazione misurata dopo l’intervento e si è calcolato il ME per ciascun gruppo di pazienti. Questa procedura è stata ripetuta variando la costante A e cercando di minimizzare il ME. È stata annotata la costante A per la quale il ME era minore (più vicino a 0,000 D) per ciascun gruppo di pazienti.
Sono stati calcolati i seguenti valori, in valori assoluti:
– Errore assoluto mediano (MedAE);
– Errore assoluto medio (MAE);
– Numero e percentuale di occhi con PE entro ±0,50 e ±1,00 D;
– Errore minimo, massimo e standard, intervallo di confidenza al 95% intorno alla ME;
– Intervalli interquartili (IQR) [21]
In entrambi i gruppi, i PE sono stati messi in relazione con i corrispondenti valori di K e AL e sono stati suddivisi in quattro intervalli. I valori cut-off di AL e K sono stati stabiliti in questo modo:
– AL: quattro intervalli basati sul valore AL arrotondato a 0,50 mm più vicino a ciascun quartile del gruppo B.
– K: quattro intervalli basati sul valore K arrotondato a 1,00 D più vicino a ciascun valore del quartile del gruppo B.
Inoltre, è stato identificato il parametro AL/K. Ogni gruppo è stato quindi suddiviso in tre sottopopolazioni, in base al valore AL/K più vicino al valore della frazione di 2/3 (0,67) e ¾ (0,75).
Analisi statistica
Le statistiche descrittive e l’analisi statistica sono state eseguite con il software SPSS (versione 26.0 SPSS Inc., Chicago, IL, USA). La normalità dei dati è stata esaminata con il test esatto di KolmogorovSmirnov prima di azzerare il ME.
Per verificare se il ME fosse significativamente diverso da zero, è stato utilizzato il test t a un campione. Per il confronto a coppie degli errori assoluti, è stato utilizzato il test non parametrico di Friedman con
correzione di Bonferroni. Il test Q di Cochran è stato utilizzato per confrontare la percentuale di occhi entro ±0,50 D e ±1,00 D di PE. Un valore p < 0,050 è stato considerato statisticamente significativo. La dimensione del campione richiesta è stata calcolata con il software G*Power (versione 3.1.9.7, Faul, Erdfelder, Lang, & Buchner, 2020. Disponibile all’indirizzo https://www.gpower.hhu.de, consultato il 14 agosto 2022). Considerando un η2 parziale di 0,206, una correzione di non sfericità ε di 0,357 corretta con il metodo Greenhouse-Geisser, entrambi calcolati con il software SPSS, e una dimensione dell’effetto di 0,509. È stato stimato che, con un livello di significatività del 5% e una potenza del test dell’85% [21] , sarebbe stato necessario un campione di 27 occhi.
Risultati
Tutti i dati erano normalmente distribuiti (p > 0,050). Tutti i ME erano statisticamente diversi da zero (p < 0,050), tranne che per la formula di Shammas nel gruppo B (p = 0,127), il che significa che il fattore lente scelto per questa formula era più appropriato di altri per questo gruppo di occhi [18] Il gruppo A era composto da 132 occhi di 132 pa-
CHIRURGIA REFRATTIVA
zienti. Le misure di AL variavano da 23,72 a 34,20 mm, media = 27,65 ± 2,11 mm e mediana = 27,44 mm, le letture di K variavano da 31,56 a 43,81 D, media = 38,08 ± 2,69 D e mediana = 38,34 D.
Il gruppo B era composto da 90 occhi di 90 pazienti. In questo gruppo, le misure di AL variavano da 23,72 a 34,20 mm, media = 28,09 ± 2,13 mm e mediana = 27,97 mm, le letture di K variavano da 31,56 a 43,17 D, media = 37,64 ± 2,71 D e mediana = 37,71 D. Il confronto tra tutti i metodi di calcolo del potere delle IOL analizzati in entrambi i gruppi A e B, l’analisi post-hoc di Bonferroni e i confronti multipli secondo il test Q di Cochran sono riportati nella Tabella 1.
Gruppo A
In questo gruppo (132 occhi) il ME non è stato azzerato e per il calcolo del potere della IOL sono state utilizzate le costanti A suggerite dal produttore, come mostrato nella Tabella supplementare S1. Le figure 1-3 riportano la regressione LOESS (Locally Estimated Scatterplot Smoothing) che mostra la linea di tendenza dei PE in base ai valori di K, alle misure di AL e al rapporto AL/K. La relazione tra tutti i metodi di calcolo del potere delle IOL analizzati per
Parameter Gruppo B (90 occhi)
51 (56.7%) 23 (25.6%) 29 (32.3%) 45 (50.0%) 35 (37.8%) 46 (51.1%)
D (%) 68 (75.6%) 69 (76.7%) 43 (47.8%) 47 (52.2%) 62 (68.9%) 53 (58.9%) 66 (73.3%)
MedAE: errore assoluto mediano; MAE: errore assoluto medio; STD: errore standard; Min-Max: errori minimi e massimi; IQR: intervallo interquartile; CI 95%: 95%: intervallo di confidenza intorno alla media; <0,5 D (%)/<1,0 D (%): numeri e percentuali di occhi con un errore di predizione refrattiva (PE) entro 0,50 D ed entro 1,00 D.
Tabella 1. Confronto dei risultati refrattivi tra le formule esaminate (Gruppo A e Gruppo B).
CHIRURGIA REFRATTIVA

Figura 1. Curva di regressione LOESS tra gli errori di previsione refrattiva generati per ciascuna formula esaminata e il relativo valore cheratometrico medio K (Gruppo A).
Figura 1. Curva di regressione LOESS tra gli errori di previsione refrattiva generati per ciascuna formula esaminata e il relativo valore cheratometrico medio K (Gruppo A).
Figura 1 Curva di regressione LOESS tra gli errori di previsione refrattiva generati per ciascuna formula esaminata e il relativo valore cheratometrico medio K (Gruppo A).

Figur relativo valore di lunghezza assiale
Figura 2. Curva di regressione LOESS tra gli errori di previsione refrattiva generati per ciascuna formula esaminata e il relativo valore di lunghezza assiale AL (Gruppo A).
Figura 2. Curva di regressione LOESS tra gli errori di previsione refrattiva generati per ciascuna formula esaminata e il relativo valore di lunghezza assiale AL (Gruppo A).

Figura 3. Curva di regressione LOESS tra gli errori di previsione refrattiva generati per ciascuna formula esaminata e il relativo valore di lunghezza assiale (AL)/cheratometria media (K) (Gruppo A).
Figura 3. Curva di regressione LOESS tra gli errori di previsione refrattiva generati per ciascuna formula esaminata e il relativo valore di lunghezza assiale (AL)/cheratometria media (K) (Gruppo A).
Tabella 1. Confronto dei risultati refrattivi tra le formule esaminate (Gruppo A e Gruppo B).
tutti i pazienti del gruppo A e i valori di K, le misure di AL e il rapporto AL/K sono riportati nelle tabelle 2-4. I diagrammi boxplot e i grafici a barre che riportano i risultati refrattivi ottenuti in ogni singolo intervallo analizzato sono riportati nelle figure supplementari S1-S3.
ALMA Barrett Ferrara Jin Kim Latkany Shammas
Parameter Gruppo A (132 occhi) MedAE 0.81
Gruppo B
In questo gruppo (90 occhi) il ME è stato azzerato. Le costanti della lente modificate ottenute azzerando il ME sono riportate nella Tabella supplementare S1. Le figure 4-6 riportano la regressione LOESS che mostra la linea di tendenza dei PE in base ai valori di K, alle misure di AL e al rapporto AL/K. La relazione tra tutti i metodi di calcolo del potere delle IOL analizzati per tutti i pazienti del Gruppo B, in funzione dei valori K, delle misure di AL e del rapporto AL/K, è riportata nelle Tabelle 2-4. I diagrammi boxplot e i grafici a barre che riportano i risultati refrattivi ottenuti in ogni singolo intervallo analizzato sono riportati nelle figure supplementari S4-S6.
questo motivo, dal 2015 sono stati pubblicati diversi protocolli [20-22]. Hoffer et al. hanno inizialmente sottolineato la necessità di eliminare il bias sistemico dato dalla costante della lente con l’azzeramento del ME, regolando il PE per ogni metodo [20]. Hoffer et al. hanno riproposto l’ottimizzazione della costante attraverso l’azzeramento dell’errore medio nel 2020, per eliminare qualsiasi errore sistematico derivante dall’ambiente clinico, tra cui il biometro, la tecnica chirurgica e le proprietà fisiche della IOL [21]. Inoltre, Holladay et al. hanno fornito raccomandazioni simili [22]
Gruppo B (90 occhi)
MedAE: errore assoluto mediano; MAE: errore assoluto medio; STD: errore standard; Min-Max: errori minimi e massimi; IQR: intervallo interquartile; CI 95%: 95%: intervallo di confidenza intorno alla media; <0,5 D (%)/<1,0 D (%): numeri e percentuali di occhi con un errore di predizione refrattiva (PE) entro 0,50 D ed entro 1,00 D.
Discussione
Le comuni linee guida per valutare l’accuratezza del calcolo del potere delle IOL sono fondamentali: per
Alcuni autori hanno ritenuto inappropriato azzerare il ME per gli occhi atipici [23,44], ma Hoffer et al. hanno riferito che un’ottimizzazione costante sarebbe preferibile quando si analizzano gli occhi post-LRS [21] . Inoltre, sono stati pubblicati altri studi che eseguono l’azzeramento della ME in occhi atipici, ad esempio occhi vitrectomizzati [45] e occhi post-LRS [16,24] A causa di questi pareri discordanti e seguendo l’esempio di altri lavori [16,24], questo studio è stato eseguito sia con che senza azzeramento del ME, a rinforzo dei risultati ottenuti. Il gruppo A e il gruppo B sono parzialmente sovrapponibili, ma questo non è un limite perché l’obiettivo dello studio era l’analisi
Tabella 2. Confronto dei risultati refrattivi tra le formule esaminate in base ai diversi intervalli di cheratometria media (K). (Gruppo A e B).
G Formula ALMA Barrett Ferrara Jin Kim Latkany Shammas K ≤ 36.0 D (Gruppo A = 28 occhi/Gruppo B = 24 occhi)
CHIRURGIA REFRATTIVA
K ≤ 36.0 D (Gruppo A = 28 occhi/Gruppo B = 24 occhi)
36.0 D < K ≤ 38.0 D (Gruppo A = 32 occhi /Gruppo B =23 occhi)
<0.5 D (%) 12 (37.5%) 11 (34.4%) 2 (6.3%) 8 (25.0%)
K > 40.0 D (Gruppo A = 31 occhi / Gruppo
G: Gruppo; MedAE: errore assoluto mediano; <0,5 D (%)/<1,0 D (%): numeri e percentuali di occhi con un errore di previsione refrattiva (PE) entro 0,50 D ed entro 1,00 D.
Tabella 2. Confronto dei risultati refrattivi tra le formule esaminate in base ai diversi intervalli di cheratometria media (K). (Gruppo A e B).
G Formula
A
B
CHIRURGIA REFRATTIVA
AL ≤ 26.5 mm (Gruppo A = 47 occhi / Gruppo B = 24 occhi)
<0.5 D (%) 26 (55.3%) 23 (48.9%) 9 (19.1%) 16 (34.0%) 14 (29.8%) 11 (23.4%) 23 (48.9%)
<1.0 D (%) 33 (70.2%) 34 (72.3%) 27 (57.4%) 32 (68.1%) 28 (59.6%) 21 (44.7%) 32 (68.1%)
<0.5 D (%) 9 (37.5%) 15 (62.5%) 7 (29.2%) 2 (8.3%) 14 (58.3%) 5 (20.8%) 14 (58.3%)
<1.0 D (%) 16 (66.7%) 17 (70.8%) 8
26.50 < AL ≤ 28.00 mm (Gruppo A = 32 occhi / Gruppo B = 22 occhi)
16
<0.5 D (%) 11 (34.4%) 11 (34.4%) 1 (3.1%) 10 (31.1%) 8 (25.0%) 3 (9.4%) 10 (31.1%)
<1.0 D (%) 23 (71.9%) 20 (62.5%) 9 (28.1%) 18 (56.3%) 13 (40.6%) 6 (18.8%) 18 (56.3%)
D <0.5 D (%) 12 (54.5%) 11 (50.0%) 7 (31.8%) 11 (50.0%) 10(45.5%) 13 (59.1%) 10 (45.5%)
<1.0 D (%) 17 (77.3%) 18 (81.8%) 15 (68.2%) 15 (68.2%) 15 (68.2%) 17 (77.3%) 17 (77.3%) 28.00 < AL ≤ 29.50 mm (Gruppo A = 29 occhi / Gruppo B = 23 occhi) A MedAE 0.99 D 0.98 D 2.76 D 1.89 D 1.75 D 2.99 D 0.94 D
<0.5 D (%) 9 (31.0%) 9 (31.0%) 1 (3.4%) 3 (10.3%) 5 (17.2%) 0 (0.0%) 10 (34.5%) <1.0 D (%) 18 (62.1%) 17
B MedAE 0.57 D 0.53 D 0.99 D 0.82 D 0.68 D 0.69
AL > 29.50 mm (Gruppo A = 24 occhi / Gruppo B = 21
<1.0 D (%) 16 (76.2%) 17 (81.0%) 5 (23.8%) 8 (38.1%) 15 (71.4%) 10 (47.6%) 16 (76.2%)
G: gruppo; MedAE: errore assoluto mediano; <0,5 D (%)/<1,0 D (%): numero e percentuale di occhi con un errore di previsione refrattiva entro 0,50 D ed entro 1,00 D.
Tabella 3. Confronto dei risultati refrattivi tra le formule esaminate in base alle diverse lunghezze assiali (AL), intervalli. (Gruppi A e B).
CHIRURGIA REFRATTIVA
AL/K ≤ 0.67 (Gruppo A = 40 occhi / Gruppo B = 20 occhi)
0.67 < AL/K ≤ 0.75 (Gruppo A = 40 occhi / Gruppo B = 26 occhi)
<0.5 D (%) 17 (42.5%) 1 (2.5%) 2 (5.0%) 6 (15.0%) 11
G: gruppo; MedAE: errore assoluto mediano; <0,5 D (%)/<1,0 D (%): numeri e percentuali di occhi con un errore di previsione refrattiva entro 0,50 D ed entro 1,00 D.
Tabella 4. Confronto dei risultati refrattivi tra le formule esaminate in base a diversi intervalli di lunghezza assiale/rapporto cheratometrico medio (AL/K).
dell’accuratezza della formula dopo la LRS miopica con e senza ottimizzazione costante. Pertanto, i gruppi erano quasi uguali, ma sono stati analizzati in modi completamente diversi. A tal fine, sono necessari risultati di database simili e i risultati devono essere letti alla luce della discussione sopra citata [16,21,23,24,44,45] .
È noto che negli occhi non sottoposti a LRS è necessario utilizzare formule diverse in base ai diversi intervalli di AL per ottenere il risultato migliore [46]. Questa proposta non può essere utilizzata per gli occhi miopi sottoposti a LRS miopica perché richiedono formule specifiche per il calcolo del potere della IOL.
La novità del nostro studio è che non sono stati presi in considerazione i soli intervalli di AL, ma la combinazione di AL e K.
Partendo da questi concetti, il presente studio si
propone di verificare se i diversi metodi di calcolo del potere della IOL dopo la LRS miopica possano fornire risultati migliori in diversi intervalli dei seguenti parametri: – K, in quanto il K è il valore che viene modificato dalla chirurgia; – AL; – Rapporto AL/K.
I migliori risultati refrattivi ottenuti dal confronto tra i metodi di calcolo del potere delle IOL esaminati, tracciati con i corrispondenti valori di K e AL, sono stati riportati nella sezione dei risultati e nelle Figure 1, 2, 4 e 5, nella Tabella 2.
AL/K è stato studiato come parametro aggiuntivo per scegliere la migliore formula di calcolo del potere delle IOL, come mostrato nelle Figure 3 e 6, nella Tabella 3.
38.0 D < K < 40.0 D ALMA/Barrett ALMA ALMA ALMA/Barrett
K > 40.0 D Barrett Barrett ALMA/Barrett Barrett
Gruppo A
Gruppo B
AL/K < 0.67 ALMA Barrett
0.67 < AL/K < 0.75 ALMA -
CHIRURGIA REFRATTIVA
AL/K > 0.75 Barrett ALMA K: cheratometria media; AL: lunghezza assiale.

Figura 4. Curva di regressione LOESS tra gli errori di previsione refrattiva generati per ciascuna formula esaminata e il relativo valore cheratometrico medio K (Gruppo B).
Figura 4 Curva di regressione LOESS tra gli errori di previsione refraZiva generati per ciascuna formula esaminata e il relativo valore cheratometrico medio K (Gruppo B).
Gruppo A Parametri
K < 36.0 D Barrett Barrett Barrett Barrett
36.0 D < K < 38.0 D ALMA ALMA/Barrett ALMA/Barrett Barrett
38.0 D < K < 40.0 D ALMA ALMA ALMA ALMA/Barrett K > 40.0 D ALMA ALMA ALMA ALMA/Barrett
Gruppo B
K < 36.0 D Barrett ALMA/Barrett ALMA ALMA
36.0 D < K < 38.0 D Barrett ALMA/Barrett ALMA ALMA
38.0 D < K < 40.0 D ALMA/Barrett ALMA ALMA ALMA/Barrett
K > 40.0 D Barrett Barrett ALMA/Barrett Barrett
Gruppo A
Gruppo B
AL/K < 0.67 ALMA Barrett
0.67 < AL/K < 0.75 ALMAAL/K > 0.75
Barrett ALMA
Tabella 5. Formule suggerite in base a diversi intervalli di cheratometria media (K) e di lunghezza assiale (AL). Nel caso in cui siano state suggerite due formule, AL/K potrebbe chiarire quale dovrebbe essere preferita. Se l’analisi del parametro AL/K non è conclusiva, è possibile considerare un valore medio di potere della IOL tra i due metodi proposti.
CHIRURGIA REFRATTIVA
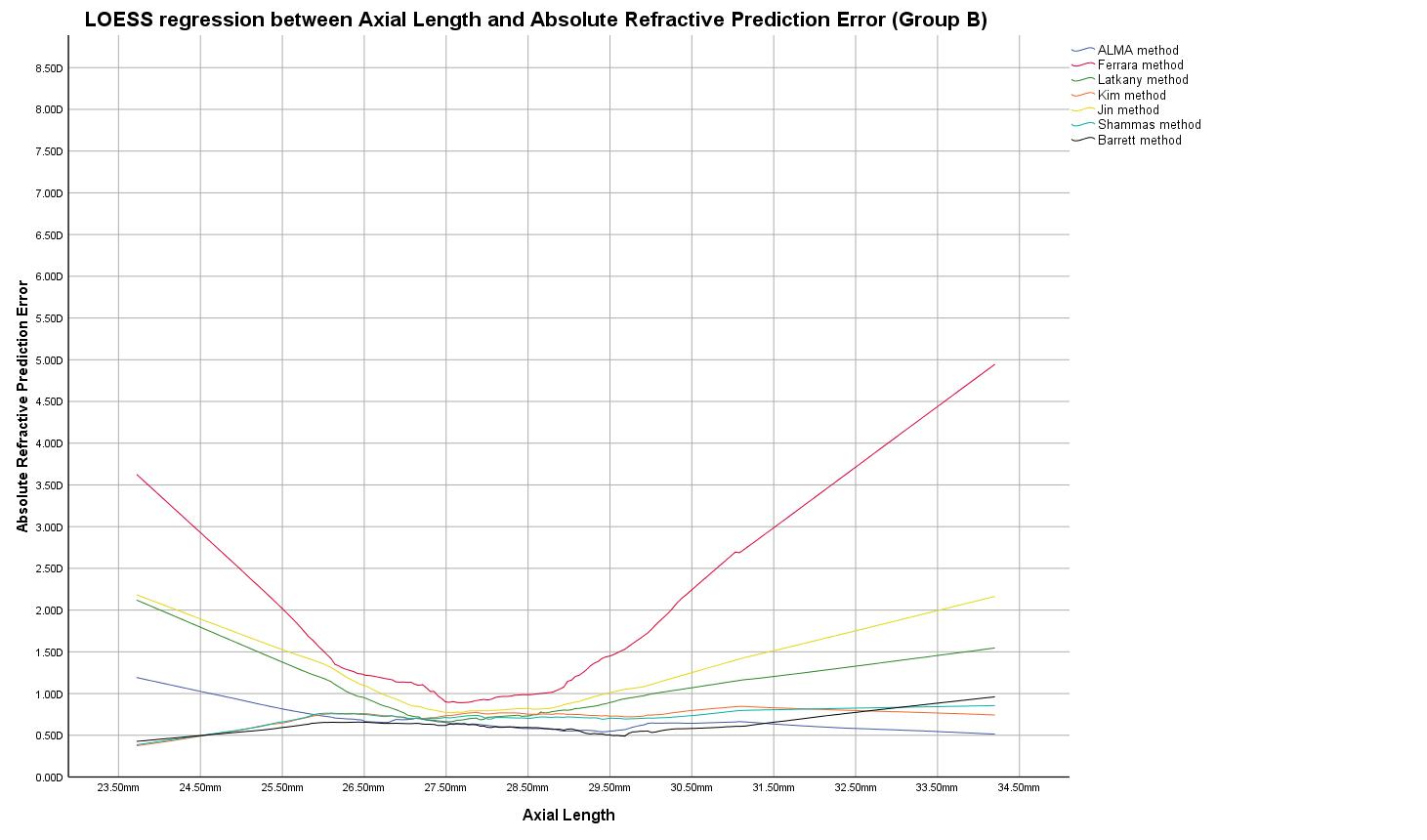
Figura 5. Curva di regressione LOESS tra gli errori di previsione rifrattiva generati per ciascuna formula esaminata e il relativo valore di lunghezza assiale AL (Gruppo B).
Figura 5. Curva di regressione LOESS tra gli errori di previsione rifraZiva generati per ciascuna formula esaminata e il relativo valore di lunghezza assiale AL (Gruppo B).
Figura 5. Curva di regressione LOESS tra gli errori di previsione rifraZiva generati per ciascuna formula esaminata e il relativo valore di lunghezza assiale AL (Gruppo B).

Figura 6 relativo valore di lunghezza assiale (AL)/cheratometria media (K) (Gruppo B).
Figura 6. Curva di regressione LOESS tra gli errori di previsione refrattiva generati per ciascuna formula esaminata e il relativo valore di lunghezza assiale (AL)/cheratometria media (K) (Gruppo B).
Figura 6 Curva di regressione LOESS tra gli errori di previsione refraZiva generati per ciascuna formula esaminata e il relativo valore di lunghezza assiale (AL)/cheratometria media (K) (Gruppo B).
L'adozione del PE come risultato primario anziché l'errore di previsione della IOL è un punto di forza di questo studio. Infatti, secondo Hoffer et al. convertire gli errori di previsione delle IOL in PE utilizzando un fattore costante per l'intero intervallo AL è un
L'adozione del PE come risultato primario anziché l'errore di previsione della IOL è un punto di forza di questo studio. Infatti, secondo Hoffer et al. convertire gli errori di previsione delle IOL in PE utilizzando un fattore costante per l'intero intervallo AL è un
Su questa base, è stato proposto un approccio multiformula, basato su diverse letture di K e misure di AL riassunto nella Tabella 5, sia utilizzando la costante A suggerita dai produttori (Gruppo A) che la costante A modificata attraverso l’azzeramento del ME (Gruppo B). Nel caso in cui venga proposta più di una formula, AL/K potrebbe chiarire quale dovrebbe essere preferita. Se anche l’AL/K non è convincente, si può utilizzare la media tra i due valori di potere della IOL. Nel Gruppo B, quando K ≤ 38,00 D e AL > 29,50 mm i metodi ALMA e Barrett-TK sono equivalenti ma, considerando che in questi intervalli il parametro AL/K è sempre maggiore di 0,75, si preferisce la formula ALMA.
L’adozione del PE come risultato primario anziché l’errore di previsione della IOL è un punto di forza di questo studio. Infatti, secondo Hoffer et al. convertire gli errori di previsione delle IOL in PE utilizzando un fattore costante per l’intero intervallo AL è un errore perché questo fattore cambia in funzione dei parametri oculari [21,47]. Mentre la maggior parte degli studi recenti sul calcolo del potere delle IOL dopo LRS si basa sul calcolatore di IOL ASCRS [18,19], dove è stato possibile calcolare solo le differenze tra i poteri delle IOL suggerite dall’ASCRS e i poteri delle IOL impiantate.
Un altro punto di forza di questo studio è l’analisi del Barrett-TK attraverso l’azzeramento del ME, ottenuto con uno specifico linguaggio di programmazione informatica, seguendo il suggerimento proposto da Hoffer et al. [21] .
Una limitazione di questo studio è che su 132 occhi, l’azzeramento della ME è stato possibile solo in 90 occhi a causa della presenza di un numero ridotto di pazienti per alcuni modelli di IOL o perché il modello di IOL era sconosciuto. Il basso numero di pazienti per alcuni modelli di IOL potrebbe causare un’alterazione della costante A, dovuta a un outlier (in statistica, valore anomalo e aberrante, n.d.c.). Di conseguenza, l’azzeramento del ME potrebbe attenuare questi outlier. Tuttavia, l’uso di MedAE invece del ME assoluto e la presenza di più modelli di IOL potrebbero limitare l’influenza di eventuali outlier. Altre limitazioni sono rappresentate dal disegno retrospettivo dello studio e dalla presenza di alcuni dati dei pazienti derivati dalla letteratura [26,26], ma queste informazioni non sono state incluse nel Gruppo B.
È difficile ottenere un’ampia base di dati negli studi sul calcolo del potere della IOL dopo la LRS miopica. Quando sono disponibili dati limitati, è opportuno analizzare più di un modello di IOL [21]. Inoltre, in altri studi recenti sull’accuratezza del calcolo del potere
della IOL dopo la LRS miopica sono stati analizzati più modelli di IOL [16-18,24,30]. In realtà, la natura multicentrica dello studio è stata giustificata dall’estrema difficoltà di ottenere un database ampio e affidabile di occhi sottoposti a chirurgia di cataratta dopo la chirurgia refrattiva.
Questo studio è stato eseguito con l’azzeramento del ME per ogni modello di IOL per minimizzare il bias dato dall’implementazione di più modelli di IOL, come da protocolli di Hoffer [20]. Inoltre, l’ottimizzazione delle costanti ottenuta con l’azzeramento dei ME elimina qualsiasi errore sistematico, rendendo tutte le formule comparabili.
Un approccio multiformula basato su diversi intervalli di AL e K potrebbe essere applicato anche a occhi “normali” o “speciali” (ad esempio, occhi con cheratocono), ma richiede formule di calcolo del potere della IOL diverse.
In conclusione, considerando i parametri K, AL e AL/K, è possibile utilizzare un approccio multiformula scegliendo un metodo specifico che potrebbe dare risultati migliori in alcune sottopopolazioni, come mostrato nella Tabella 5. Anche se sono necessari studi più ampi che utilizzino diversi modelli di IOL, l’approccio multiformula potrebbe rappresentare la risposta futura per migliorare i risultati refrattivi negli occhi post- LRS miopica.
NB: la formula ALMA, il cui algoritmo è pubblicato, da oggi è anche accessibile attraverso il sito www. almacataract.it. Sulla piattaforma” ALMA cataract” si avrà la possibilità di effettuare il calcolo attraverso il metodo ALMA: sarà necessario inserire i soli dati biometrici, il modello di IOL da impiantare e il target rifrattivo desiderato. Inoltre, sulla piattaforma è possibile accedere a tutta la bibliografia inerente il metodo in questione.
Bibliografia
1. Cennamo, G.; Menna, F.; Sinisi, F.; Cennamo, G.; Breve, M.A.; Napolitano, P.; De Bernardo, M.; Vitiello, L.; Rosa, N. Twenty-Year Follow-Up of Excimer Laser Photorefractive Keratectomy: A Retrospective Observational Study. Ophthalmol. Ther. 2020, 9, 917–927. https://doi.org/10.1007/ s40123-020-00281-7.
2. Montorio, D.; Cennamo, G.; Menna, F.; Donna, P.; Napolitano, P.; Breve, M.A.; Fiore, U.; Cennamo, G.; Rosa, N. Evaluation of corneal structures in myopic eyes more than twenty-two years after photorefractive keratectomy. J. Biophotonics 2020, 13, e202000138. https://doi.org/10.1002/ jbio.202000138.
3. De Bernardo, M.; Pagliarulo, S.; Rosa, N. Unexpected ocular morphological changes after corneal refractive surge-
CHIRURGIA REFRATTIVA
ry: A review. Front. Med. 2022, 9, 1014277. https://doi. org/10.3389/fmed.2022.
4. De Bernardo, M.; Borrelli, M.; Imparato, R.; Cione, F.; Rosa, N.; Anterior chamber depth measurement before and after photorefractive keratectomy. Comparison between IOLMaster and Pentacam. Photodiagnosis Photodyn. Ther. 2020, 32, 101976. https://doi.org/10.1016/j. pdpdt.2020.101976.
5. De Bernardo, M.; Cembalo, G.; Rosa, N. Reliability of Intraocular Pressure Measurement by Goldmann Applanation Tonometry After Refractive Surgery: A Review of Different Correction Formulas. Clin. Ophthalmol. 2020, 14, 2783–2788. https://doi.org/10.2147/OPTH.S263856.
6. De Bernardo, M.; Capasso, L.; Caliendo, L.; Vosa, Y.; Rosa, N. Intraocular Pressure Evaluation after Myopic Refractive Surgery: A Comparison of Methods in 121 Eyes. Semin. Ophthalmol. 2016, 31, 233–242. https://doi.org/10 .3109/08820538.2014.962156.
7. De Bernardo, M.; Cornetta, P.; Marotta, G.; Rosa, N. A Prospective Longitudinal Study to Investigate Corneal Hysteresis as a Risk Factor for Predicting Development of Glaucoma. Am. J. Ophthalmol. 2018, 195, 243. https:// doi.org/10.1016/j.ajo.2018.04.030.
8. Rosa, N.; De Bernardo, M.; Iaccarino, S.; Cennamo, M. Intraocular lens power calculation: A challenging case. Optom. Vis. Sci. 2014, 91, 29–31. https://doi.org/10.1097/ OPX.0000000000000127.
9. De Bernardo, M.; Casaburi, C.; De Pascale, I.; Capasso, L.; Cione, F.; Rosa, N. Comparison between dynamic contour tonometry and Goldmann applanation tonometry correcting equations. Sci. Rep. 2022, 12, 20190. https://doi. org/10.1038/s41598-022-24318-y.
10. De Bernardo, M.; Cione, F.; Capasso, L.; Coppola, A.; Rosa, N. A formula to improve the reliability of optical axial length measurement in IOL power calculation. Sci. Rep. 2022, 12, 18845. https://doi.org/10.1038/s41598-02223665-0.
11. Wang, L.; Booth, M.A.; Koch, D.D. Comparison of intraocular lens power calculation methods in eyes that have undergone LASIK. Ophthalmology 2004, 111, 1825–1831. https://doi.org/10.1016/j.ophtha.2004.04.022.
12. Savini, G.; Hoffer, K.J. Intraocular lens power calculation in eyes with previous corneal refractive surgery. Eye Vis. 2018, 5, 18. https://doi.org/10.1186/s40662-018-0110-5.
13. Siganos, D.S.; Pallikaris, I.G.; Lambropoulos, J.E.; Koufala, C.J. Keratometric readings after photorefractive keratectomy are unreliable for calculating IOL power. J. Refract. Surg. 1996, 12, 278–279. https://doi.org/10.3928/1081597X-19960201-17.
14. De Bernardo, M.; Capasso, L.; Caliendo, L.; Paolercio, F.; Rosa, N. IOL Power Calculation after Corneal Refractive Surgery. Biomed. Res. Int. 2014, 2014, 658350. https:// doi.org/10.1155/2014/658350.
15. Whang, W.J.; Hoffer, K.J.; Kim, S.J.; Chung, S.H.; Savini,
G. Comparison of intraocular lens power formulas according to axial length after myopic corneal laser refractive surgery. J. Cataract. Refract. Surg. 2021, 47, 297–303. https://doi.org/10.1097/j.jcrs.0000000000000445.
16. Ma, J.X.; Tang, M.; Wang, L.; Weikert, M.P.; Huang, D.; Koch, D.D. Comparison of Newer IOL Power Calculation Methods for Eyes With Previous Radial Keratotomy. Invest. Ophthalmol. Vis. Sci. 2016, 57, 162–168. https://doi. org/10.1167/iovs.15-18948.
17. Wang, L.; Spektor, T.; De Souza, R.G.; Koch, D.D. Evaluation of total keratometry and its accuracy for intraocular lens power calculation in eyes after corneal refractive surgery. J. Cataract. Refract. Surg. 2019, 45, 1416–1421. https://doi.org/10.1016/j.jcrs.2019.05.020.
18. Patel, P.; Ashena, Z.; Vasavada, V.; A Vasavada, S.; Vasavada, V.; Sudhalkar, A.; A Nanavaty, M. Comparison of intraocular lens calculation methods after myopic laser-assisted in situ keratomileusis and radial keratotomy without prior refractive data. Br. J. Ophthalmol. 2022, 106, 47–53. https://doi.org/10.1136/bjophthalmol-2020-317681.
19. Sandoval, H.P.; Serels, C.; Potvin, R.; Solomon, K.D. Cataract surgery after myopic laser in situ keratomileusis: Objective analysis to determine best formula and keratometry to use. J. Cataract. Refract. Surg. 2021, 47, 465–470. https://doi.org/10.1097/j.jcrs.0000000000000472.
20. Hoffer, K.J.; Aramberri, J.; Haigis, W.; Olsen, T.; Savini, G.; Shammas, H.J.; Bentow, S. Protocols for studies of intraocular lens formula accuracy. Am. J. Ophthalmol. 2015, 160, 403–405. https://doi.org/10.1016/j.ajo.2015.05.029.
21. Hoffer, K.J.; Savini, G. Update on Intraocular Lens Power Calculation Study Protocols: The Better Way to Design and Report Clinical Trials. Ophthalmology 2021, 128, e115–e120. https://doi.org/10.1016/j.ophtha.2020.07.005.
22. Holladay, J.T.; Wilcox, R.R.; Koch, D.D.; Wang, L. Review and recommendations for univariate statistical analysis of spherical equivalent prediction error for IOL power calculations. J. Cataract. Refract. Surg. 2021, 47, 65–77. https:// doi.org/10.1097/j.jcrs.0000000000000370.
23. Turnbull, A.M.J.; Crawford, G.J.; Barrett, G.D. Methods for Intraocular Lens Power Calculation in Cataract Surgery after Radial Keratotomy. Ophthalmology 2020, 127, 45–51. https://doi.org/10.1016/j.ophtha.2019.08.019.
24. Rosa, N.; Cione, F.; Pepe, A.; Musto, S.; De Bernardo, M. An Advanced Lens Measurement Approach (ALMA) in post refractive surgery IOL power calculation with unknown preoperative parameters. PLoS ONE 2020, 15, e0237990. https://doi.org/10.1371/journal.pone.0237990.
25. Odenthal, M.T.; Eggink, C.A.; Melles, G.; Pameyer, J.H.; Geerards, A.J.; Beekhuis, W.H. Clinical and theoretical results of intraocular lens power calculation for cataract surgery after photorefractive keratectomy for myopia. Arch. Ophthalmol. 2002, 120, 431–438. https://doi.org/10.1001/ archopht.120.4.431.
26. Kim, J.H.; Lee, D.H.; Joo, C.K. Measuring corneal power
for intraocular lens power calculation after refractive surgery. Comparison of methods. J. Cataract. Refract. Surg. 2002, 28, 1932–1938. https://doi.org/10.1016/s08863350(02)01438-4.
27. Retzlaff, J.A.; Sanders, D.R.; Kraff, M.C. Development of the SRK/T intraocular lens implant power calculation formula. J. Cataract. Refract. Surg. 1990, 16, 333–340. Erratum in: J. Cataract. Refract. Surg. 1990, 16, 528. https:// doi.org/10.1016/s0886-3350(13)80705-5.
28. Borasio, E.; Stevens, J.; Smith, G.T. Estimation of true corneal power after keratorefractive surgery in eyes requiring cataract surgery: BESSt formula. J. Cataract. Refract. Surg. 2006, 32, 2004–2014. https://doi.org/10.1016/j. jcrs.2006.08.037.
29. Cheng, A.C.; Lam, D.S. Keratometry for intraocular lens power calculation using Orbscan II in eyes with laser in situ keratomileusis. J. Refract. Surg. 2005, 21, 365–368. https://doi.org/10.3928/1081-597X-20050701-11.
30. Abulafia, A.; Hill, W.E.; Kock, D.D.; Wang, L.; Barrett, G.D. Accuracy of the Barrett True-K formula for intraocular lens power prediction after laser in situ keratomileusis or photorefractive keratectomy for myopia. J. Cataract. Refract. Surg. 2016, 42, 363–369. https://doi.org/10.1016/j. jcrs.2015.11.039.
31. Ferrara, G.; Cennamo, G.; Marotta, G.; Loffredo, E. New formula to calculate corneal power after refractive surgery. J. Refract. Surg. 2004, 20, 465–471. https://doi. org/10.3928/1081-597X-20040901-09.
32. Haigis, W. Intraocular lens calculation after refractive surgery for myopia: Haigis-L formula. J. Cataract. Refract. Surg. 2008, 34, 1658–1663. https://doi.org/10.1016/j. jcrs.2008.06.029.
33. Ianchulev, T.; Salz, J.; Hoffer, K.; Albini, T.; Hsu, H.; LaBree, L. Intraoperative optical refractive biometry for intraocular lens power estimation without axial length and keratometry measurements. J. Cataract. Refract. Surg. 2005, 31, 1530–1536. https://doi.org/10.1016/j.jcrs.2005.01.035.
34. Jin, G.J.; Crandall, A.S.; Jin, Y. Analysis of intraocular lens power calculation for eyes with previous myopic LASIK. J. Refract. Surg. 2006, 22, 387–395. https://doi. org/10.3928/1081-597X-20060401-16.
35. Latkany, R.A.; Chokshi, A.R.; Speaker, M.G.; Abramson, J.; Soloway, B.D.; Yu, G. Intraocular lens calculations after refractive surgery. J. Cataract. Refract. Surg. 2005, 31, 562–570. https://doi.org/10.1016/j.jcrs.2004.06.053.
36. Mackool, R.J.; Ko, W.; Mackool, R. Intraocular lens power calculation after laser in situ keratomileusis: Aphakic refraction technique. J. Cataract. Refract. Surg. 2006, 32, 435437. https://doi.org/10.1016/j.jcrs.2005.11.045.
37. Qazi, M.A.; Cua, I.Y.; Roberts, C.J.; Pepose, J.S. Deter-
CHIRURGIA REFRATTIVA
mining corneal power using Orbscan II videokeratography for intraocular lens calculation after excimer laser surgery for myopia. J. Cataract. Refract. Surg. 2007, 33, 21–30. https://doi.org/10.1016/j.jcrs.2006.08.026.
38. Rosa, N.; Capasso, L.; Romano, A. A new method of calculating intraocular lens power after photorefractive keratectomy. J. Refract. Surg. 2002, 18, 720–724. https://doi. org/10.3928/1081-597X-20021101-09.
39. Shammas, H.J.; Shammas, M.C. No-history method of intraocular lens power calculation for cataract surgery after myopic laser in situ keratomileusis. J. Cataract. Refract. Surg. 2007, 33, 31–36. https://doi.org/10.1016/j. jcrs.2006.08.045.
40. De Bernardo, M.; Iaccarino, S.; Cennamo, M.; Caliendo, L.; Rosa, N. Corneal Anterior Power Calculation for an IOL in Post-PRK Patients. Optom. Vis. Sci. 2015, 92, 190–195. https://doi.org/10.1097/OPX.0000000000000458.
41. Soper, J.W.; Goffman, J. Contact lens fitting by retinoscopy. In Contact Lenses: Advances in Design, Fitting Application; Soper, J.W., Ed.; Simposia Specialists: Miami, FL, USA, 1974; pp. 99–108.
42. Vega, Y.; Gershoni, A.; Achiron, A.; Tuuminen, R.; Weinberger, Y.; Livny, E.; Nahum, Y.; Bahar, I.; Elbaz, U. High Agreement between Barrett Universal II Calculations with and without Utilization of Optional Biometry Parameters. J. Clin. Med. 2021, 10, 542. https://doi.org/10.3390/ jcm10030542.
43. Holladay, J.T.; Prager, T.C.; Chandler, T.Y.; Musgrove, K.H.; Lewis, J.W.; Ruiz, R.S. A three-part system for refining intraocular lens power calculations. J. Cataract. Refract. Surg. 1988, 14, 17–24. https://doi.org/10.1016/s08863350(88)80059-2.
44. De Bernardo, M.; Cione, F.; Rosa, N. Re: Turnbull et al.: Methods for intraocular lens power calculation in cataract surgery after radial keratotomy. Ophthalmology 2020, 127, e87. https://doi.org/10.1016/j.ophtha.2020.05.017.
45. Tan, X.; Zhang, J.; Zhu, Y.; Xu, J.; Qiu, X.; Yang, G.; Liu, Z.; Luo, L.; Liu, Y. Accuracy of New Generation Intraocular Lens Calculation Formulas in Vitrectomized Eyes. Am. J. Ophthalmol. 2020, 217, 81–90. https://doi.org/10.1016/j. ajo.2020.04.035.
46. Aristodemou, P.; Knox Cartwright, N.E.; Sparrow, J.M.; Johnston, R.L. Formula choice: Hoffer Q, Holladay 1, or SRK/T and refractive outcomes in 8108 eyes after cataract surgery with biometry by partial coherence interferometry. J. Cataract. Refract. Surg. 2011, 37, 63–71. https://doi. org/10.1016/j.jcrs.2010.07.032.
47. Cione, F.; Gioia, M.; Pagliarulo, S.; Bias That Should Be Avoided to Obtain a Reliable Study of IOL Power Calculation After Myopic Refractive Surgery. J. Refract. Surg. 2023, 39, 68. https://doi.org/10.3928/1081597X-20221122-02.

CHIRURGIA REFRATTIVA
Autorefrattometria vs refrazione soggettiva con lenti intraoculari monofocali, multifocali e a profondità di fuoco estesa
L’autorefrattometria, al giorno d’oggi, risulta il punto di partenza fondamentale per la valutazione dello stato refrattivo del paziente(1-3) . Esistono tre principali tipologie di autorefrattometri, a seconda della tecnologia utilizzata:
1. Autorefrattometri basati sul principio di Scheiner: Il più diffuso tra gli autorefrattometri che utilizza un sistema di lenti di Badal per misurare la refrazione, dove la misurazione avviene lungo una circonferenza il cui diametro costituisce un parametro fondamentale dello strumento. Un diametro ampio (>3 mm) migliora la precisione, mentre un diametro ridotto (<2 mm) consente la misurazione attraverso pupille di dimensioni ridotte, sebbene a scapito della precisione(4)
2. Autorefrattometri basati sulla retinoscopia: misurano la direzione e la velocità del riflesso della luce infrarossa proiettata sulla retina tramite una fessura verticale e una obliqua(5)
3. Gli aberrometri ottici, basati sul principio di Hartmann-Shack, i quali misurano lo stato refrattivo del paziente a partire dalle aberrazioni ottiche dell’occhio. A differenza dei comuni autorefrattometri, gli aberrometri elaborano il risultato su un’area circolare piuttosto che su una circonferenza, motivo per cui spesso le due misurazioni presentano lievi differenze(6) Sebbene i risultati forniti dagli autorefrattometri risultino affidabili negli occhi impiantati con lenti intraoculari (IOL) monofocali, la precisione di questi utili strumenti può ridursi quando utilizzati in pazienti impiantati con IOL multifocali (mIOL) o a profondità
di fuoco estesa (Extended-Range Of Focus, EDOF), arrivando spesso a indicare un errore refrattivo non clinicamente presente(7-9)
In un paziente pseudofachico con impianto di lente premium è fondamentale, quindi, conoscere l’entità e il valore dell’errore che verrà rilevato dall’autorefrattometro, per evitare inutili e spiacevoli inconvenienti, come prescrizioni errate per difetti refrattivi soggettivamente inesistenti.
Abbiamo condotto quindi una ricerca bibliografica che mirava a includere studi in cui sia la refrazione automatizzata (AUTOref) che la refrazione soggettiva ottenuta clinicamente (SUBref) fossero state analizzate per individuare eventuali differenze(10). Al fine di rendere più omogenei i risultati, abbiamo riportato sia i valori di equivalente sferico che dell’astigmatismo, quest’ultimo scomposto nelle sue componenti vettoriali a 0° e a 45°. La formula adottata per riportare la differenza è stata:
DIFFref = AUTOref – SUBref dove DIFFref rappresenta la differenza ottenuta in diottrie, con segno positivo o negativo; AUTOref è l’equivalente sferico diottrico misurato con la refrazione automatizzata, mentre SUBref è l’equivalente sferico diottrico determinato con la refrazione soggettiva. Pertanto:
• Un valore negativo di DIFFref indicava che la refrazione automatizzata era più miopica rispetto alla refrazione soggettiva.
• Un valore positivo di DIFFref indicava che la refrazione automatizzata era più ipermetropica rispetto alla refrazione soggettiva.
CHIRURGIA REFRATTIVA
DIFFERENZA TRA LA REFRAZIONE OGGETTIVA E QUELLA SOGGETTIVA
mIOL refrattive
Author
IOL EDOF
Author
DIFFref: Equivalente sferico all’autorefrattometria – Equivalente sferico soggettivo
DIFFcyl 0°: Cilindro all’autorefrattometria 0° – Cilindro soggettivo 0°
DIFFcyl 45°: Cilindro all’autorefrattometria 45° – Cilindro soggettivo 0°
N: Numero di occhi studiati NR: Non riportato (V): Allineamento verticale della IOL (H): Allineamento orizzontale della IOL
CHIRURGIA REFRATTIVA
Per quanto riguarda il potere dell’astigmatismo invece:
• Un valore negativo di DIFFref indicava che la misurazione automatizzata era superiore a quella soggettiva.
• Un valore positivo di DIFFref indicava che la misurazione automatizzata era inferiore a quella soggettiva.
Conclusioni
Per la maggior parte delle IOL multifocali e delle IOL EDOF, esiste un errore refrattivo segnalato dall’autorefrattometro che però non risulta presente quando andiamo a provarlo soggettivamente sul paziente. Sebbene tale difetto segnalato vari a seconda della IOL, in media si tratta di una sovrastima miopica di circa 0,5 D.
Questo fenomeno potrebbe essere spiegato in parte dal fatto che la maggior parte degli autorefrattometri lavora basandosi sulla refrazione della luce infrarossa, mentre eseguendo una refrazione soggettiva si lavora ovviamente nello spettro di luce visibile; e in parte dalla possibile interferenza provocata dall’addizione diffrattiva durante la misurazione della macchina.
Le IOL diffrattive sono un caso particolare, la letteratura riporta che più è la luce mandata alla componente diffrattiva della IOL, maggior è l’errore refrattivo miopico (27). Ad esempio le lenti che inducono massimo errore miopico sono quelle con il fuoco per lontano diffrattivo, come le IOL Intensity® (Hanita lenses, Israele), le RayOne trifocal® (Rayner, UK) e le EDOF diffrattive Symfony® (Johnson & Johnson, USA),
Dal punto di vista pratico, sarebbe utile che le informazioni riguardanti l’errore refrattivo atteso all’autorefrattometro fossero essere incluse nel depliant informativo di qualsiasi IOL multifocale o EDOF, al fine di evitare potenziali situazioni spiacevoli. Ad esempio un paziente impiantato potrebbe essere esaminato da un medico o da un ortottista non consapevole della limitata precisione dell’autorefrattometro per queste IOL, con il rischio di prescrivere una correzione ottica non necessaria o, in casi estremi, di porre indicazione a un inappropriato trattamento di chirurgia corneale refrattiva.
Bibliografia
1. Guyton DL. Automated refractors-1983. Ophthalmology 1983;90:36–44
2. Carter J, Miller D. Automated objective refractometers. Ann Ophthalmol 1984;16:712–715
3. Bullimore MA, Fusaro RE, Adams CW. The repeatability of automated and clinician refraction. Optom Vis Sci 1998;75:617–622
4. Gurnani B, Kaur K. Autorefractors [2022 Jun 6]. In: StatPearls [Internet]. Treasure Island, FL: StatPearls Publishing; 2022
5. Yeung IYL, Mantry S, Cunliffe IA, Benson MT, Shah S. Correlation of Nidek OPD-Scan objective refraction with subjective refraction. J Refract Surg 2004;20:S734–S736
6. Marcos S. Aberrometry: basic science and clinical applications. Bull Soc Belge Ophtalmol 2006;302:197–213
7. Raj PS, Akingbehin T, Levy AM. Objective autorefraction in posterior chamber pseudophakia. Br J Ophthalmol 1990;74:731–733
8. Sunder Raj P, Villada JR, Myint k, Lewis AE, Akingbehin T. Clinical evaluation of automated refraction in anterior chamber pseudophakia. Br J Ophthalmol 1991;75:42–44
9. Kretz FTA, Linz K, Mueller M, Gerl M, Koss MJ, Gerl RH, Auffarth GU. Refraction after implantation of multifocal and presbyopia-correcting intraocular lenses [in German]. Klin Monbl Augenheilkd 2015;232:953–956
10. Bellucci C, Mora P, Tedesco SA, Gandolfi S, Bellucci R. Automated and subjective refraction with monofocal, multifocal, and EDOF intraocular lenses: review. J Cataract Refract Surg. 2023;49(6):642-648. doi:10.1097/j. jcrs.0000000000001186.
11. Fujimoto K, Honda K, Wada YR, Tanaka M, Irie T. Four-year experience with a silicone refractive multifocal intraocular lens. J Cataract Refract Surg 2010;36:1330–1335
12. Muñoz G, Albarran-Diego C, Sakla HF. Validity of autorefraction after cataract surgery with multifocal ReZoom intraocular lens implantation. J Cataract Refract Surg 2007;33:1573–1578
13. van der Linden JW, Vrijman V, Al-Saady R, van der Meulen IJ, Mourits MP, Lapid-Gortzak R. Autorefraction versus subjective refraction in a radially asymmetric multifocal intraocular lens. Acta Ophthalmol 2014;92:764–768. Erratum in: Acta Ophthalmol 2015;93:e82. El-Saady, Rana [corrected to AlSaady, Rana]
14. Ucar F, Cetinkaya S. The evaluation of postoperative objective and subjective refraction for premium intraocular lenses. Rev Bras Oftalmol 2020;79:386–390
15. Albarran-Diego C, Muñoz G, Rohrweck S, Garcıa-Lazaro S, Albero JR. Validity of automated refraction after segmented refractive multifocal intraocular lens implantation. Int J Ophthalmol 2017;10:1728–1733
16. Eom Y, Yang SK, Yoon EG, Choi JN, Ryu D, Kim DW, Kim JH, Song JS, Kim SW, Kim HM. Multizonal design multifocal intraocular lens-induced astigmatism according to orientation. J Refract Surg 2020;36:740–748
17. Bissen-Miyajima H, Minami K, Yoshino M, Nishimura M, Oki S. Autorefraction after implantation of diffractive multifocal intraocular lenses. J Cataract Refract Surg 2010;36:553–556
18. Vrijman V, van der Linden JW, Nieuwendaal CP, van der Meulen IJ, Mourits MP, Lapid-Gortzak R. Effect of Nd:YAG laser capsulotomy on refraction in multifocal apodized diffractive pseudophakia. J Refract Surg 2012;28:545–551
19. Garzón N, Garcıa-Montero M, López-Artero E, Poyales F, Albarran-Diego C. Influence of trifocal intraocular lenses on standard autorefraction and aberrometer-based autorefraction. J Cataract Refract Surg 2019;45:1265–1274
20. Garzón N, Poyales F, Garcıa-Montero M, Vega F, Millan MS, Albarran-Diego C. Impact of lens material on objective refraction in eyes with trifocal diffractive intraocular lenses. Curr Eye Res 2022;47:51–61
21. Rementerıa-Capelo LA, Garcıa-Perez JL, Contreras I, Blazquez V, Ruiz-Alcocer J. Automated refraction after trifocal and trifocal toric intraocular lens implantation. Eur J Ophthalmol 2021;31:1031–1038
22. Bellucci C, Mora P, Tedesco SA, Gandolfi S, Bellucci R. Comparison of Objective and Subjective Visual Outcomes Between Pentafocal and Trifocal Diffractive Intraocular Lenses. J Refract Surg. 2024;40(9):e604-e613. doi:10.3928/10 81597X-20240715-04
23. addad JS, Gouvea L, Ferreira JL, Ambrósio R Jr, Waring GO IV, Rocha KM. Impact of a chromatic aberration-correcting intraocular lens on automated refraction. J Refract Surg 2020;36:334–339
CHIRURGIA REFRATTIVA
24. Ota Y, Minami K, Oki S, Bissen-Miyajima H, Okamoto K, Nakashima M, Tsubota K. Subjective and objective refractions in eyes with extended depth-of-focus intraocular lenses using echelette optics: clinical and experimental study. Acta Ophthalmol 2021;99:e837–e843
25. Bellucci R, Cargnoni M, Bellucci C. Clinical and aberrometric evaluation of a new extended depth-of-focus intraocular lens based on spherical aberration. J Cataract Refract Surg 2019;45:919–926
26. Greve D, Bertelmann E, Pilger D, von Sonnleithner C. Visual outcome and optical quality of a wavefront-engineered extended depth-of-focus intraocular lens. J Cataract Refract Surg 2021;47:1139–1146
27. Nov E, Rubowitz A, Dar N, Sharon T, Assia EI. Visual Performance of a Novel Optical Design of a New Multifocal Intraocular Lens J Refract Surg. 2022;38(3):150-157. doi:10.3928 /1081597X-20220105-01
ORDINA LA TUA COPIA SU
Chirurgia della cataratta in casi difficili con la tecnica mini incisionale M-SICS
Alfonso Anania

FABIANO GRUPPO EDITORIALE
Redazione: Strada 4 Milano Fiori, Palazzo Q7 – 20089 Rozzano (MI)
Sede operativa: FGE srl – Regione Rivelle 7/F – 14050 Moasca (AT)
Tel. 0141 1706694 – Fax 0141 856013 – e-mail: info@fgeditore.it – www.fgeditore.it

CHIRURGIA REFRATTIVA
di Fabrizio Ivo Camesasca, Paolo Vinciguerra,
Sequential Custom Therapeutic Keratectomy (SCTK) per migliorare le caratteristiche della superficie corneale sottoposta a PRK prima della chirurgia della cataratta.
Studio a lungo termine
La prima chirurgia fotorefrattiva con laser ad eccimeri (PRK) venne eseguita da Marguerite McDonald il 25 marzo 1988. Da allora, decine di milioni di persone nel mondo si sono sottoposte alla correzione di miopia, astigmatismo e ipermetropia.
Sicuramente, i difetti più comunemente corretti sono stati la miopia e l’astigmatismo, ed è interessante notare come i cambiamenti di curvatura corneale indotti da queste correzioni possano indurre nuove aberrazioni corneali, quali l’aberrazione sferica, il coma ed il trifoglio. Ad inizio degli anni ’90, queste aberrazioni, oltre che poco o per nulla note, venivano indotte spesso in maniera assai marcata, sia causa delle zone ottiche ristrette disponibili con i primi laser ad eccimeri, che a causa di errori di tecnica, quali il decentramento dovuto alla mancanza di sistemi di inseguimento.
I pazienti che hanno effettuato chirurgia refrattiva negli anni ’90 si confrontano ora con il calo visivo legato alla cataratta. La chirurgia della cataratta, nel frattempo, grazie alle continue evoluzioni tecniche, come la microincisione e l’introduzione di IOL pieghevoli premium sempre più raffinate, è divenuta assimilabile alla chirurgia refrattiva. I
pazienti che per la loro età vanno incontro a intervento per cataratta infatti conducono oggi una vita molto attiva, guidano, usano incessantemente computer e Internet. Necessitano quindi di un alto livello di qualità di visione postoperatoria a diverse distanze, e gradiscono la maggior libertà possibile dagli occhiali.
La superficie corneale
anteriore
La superficie corneale anteriore è l’elemento refrattivo principale nel sistema ottico oculare, quindi la sua qualità è determinante per un buon visus e per ottenere i migliori risultati con IOL premium. Le più frequenti cause di un risultato post-cataratta inferiore alle previsioni sono legate ad un errore biometrico, o alla ridotta tolleranza di una IOL premium (torica, multifocale o EDOF). Il calcolo biometrico in occhi sottoposti in passato a chirurgia fotorefrattiva è complesso, in quanto la determinazione dei K realmente coinvolti nell’asse della visione può essere difficile. Una variazione della curvatura anteriore tramite sottrazione di tessuto induce un riassestamento anche della curvatura corneale posteriore. Tuttavia, a volte anche un calcolo biometrico ben fatto non risolve i problemi connessi alla presenza di aberrazioni di alto






ordine presenti in cornee altamente irregolari (Fig. 1). Il chirurgo quindi, qualora siano presenti troppe aberrazioni, come il trifoglio o il coma – tipicamente indotto da un decentramento – deve considerare la rinuncia all’utilizzo di una IOL premium passibile di scarsa tolleranza.
Le alternative comprendono la regolarizzazione pre-intervento per cataratta della superficie corneale mediante fotocheratectomia terapeutica (PTK) o Sequential Customized Therapeutic Keratectomy (SCTK).
La SCTK rappresenta una evoluzione della PTK, e non si accontenta di un singolo passaggio ablativo, anche se customizzato, ma applica una sequenza di verifiche della curvatura corneale mediante to-
pografie (o OCT del segmento anteriore) intraoperatorie post-ablativa, con analisi aberrometrica della superficie ottenuta e successiva eventuale nuova ablazione customizzata. Gli obiettivi della SCTK in questi casi sono il conseguimento di una superficie corneale regolare che consenta una biometria precisa, riducendo le aberrazioni di alto ordine indotte dalla irregolarità corneale post-chirurgia refrattiva. Una buona trasparenza corneale non è da trascurare e viene ridotta dalla SCTK, anche se influisce meno sul visus postoperatorio rispetto alla irregolarità di superficie.
Studio Clinico Abbiamo valutato retrospettivamente occhi con
CHIRURGIA REFRATTIVA





Pre-SCTK Pre-PFK 1.5 anni post-PFK post-PFK
cornee altamente aberrate e cataratta chirurgica. Le aberrazioni corneali di alto ordine erano conseguenti a chirurgia refrattiva di superficie (PRK) per miopia e astigmatismo. Abbiamo valutato preoperatoriamente i pazienti mediante topografia, aberrometria, tomografia Scheimpflug, OCT, ed endotelio corneale.
La SCTK consiste in una ablazione customizzata transepiteliale mediante laser ad eccimeri, seguita da una PTK con fluido maschera per aumentare la regolarità della superficie. Dopo queste due fasi, viene effettuata una topografia intraoperatoria con misurazione delle aberrazioni corneali residue, ed una misurazione del visus. Le fasi di ablazione e verifica topografica e pianificazione di nuova ablazione customizzata vengono ripetute sino ad ottenere una superficie corneale regolare con riduzione delle aberrazioni di alto ordine, o sino a quando lo scarso spessore corneale residuo sconsigli ulteriori
ablazioni. Nel postoperatorio, una volta ottenuta la stabilità della superficie corneale, si passava ad effettuare la chirurgia della cataratta. Il calcolo della IOL mirava ad ottenere emmetropia o miopia utile alla lettura.
Abbiamo trattato 56 occhi di 40 pazienti (età media 54.5 ± 10.7 anni), che avevano effettuato in precedenza PRK per un difetto miopico e/o astigmatico. La BSCVA media preoperatoria era di 0.37 ±0.18 con una correzione media di -2.38 D sfera e -1.26 D cilindro. Il K medio pupillare era di 40.72 ± 3.96 D, la pachimetria corneale minima media era di 437.37 ± 64.61 µm. Veniva effettuata SCTK con i criteri sopra esposti. Trattandosi di cornee oblate, l’aberrazione di alto ordine più frequentemente da eliminare era l’aberrazione sferica, e ciò veniva ottenuto con una ablazione customizzata di tipo ipermetropico, con consumo di cornea nella più spessa periferia corneale ed minima ablazione centrale. Infatti, lo spessore
CHIRURGIA REFRATTIVA




corneale minimo non mutava significativamente. Le altre aberrazioni presenti erano soprattutto il coma ed il trifoglio.
Dopo la SCTK non si osservava una variazione significativa nella curvature corneale media o uno shift ipermetropico, mentre diminuivano in maniera significativa sfera, astigmatismo, l’aberrazione sferica, il coma ed il trifoglio (Fig. 1, 2 e 3).
Dopo un periodo medio di 3.45 ± 5.12 anni dalla SCTK, la BSCVA media era di 0.48 ± 0.18 con una correzione media di -4.67 D sfera e -1.24 D cilindro. Il K medio pupillare era di 41.73± 3.96 D e la pachimetria minima media di 442.82±48.90 μm. I pazienti si sottoposero a quel punto a intervento di rimozione di cataratta e impianto di IOL. Dopo 5.54 ± 6.45 anni, la BSCVA finale media era di 0.84 ± 0.24 con una correzione media di -0.38 D sfera -0.74 D cilindro. Le differenze tra la BSCVA preoperatoria, post- SCTK e post-cataratta mostravano


tutte un significativo, progressive miglioramento (p< .001).
Conclusioni
Le aberrazioni ottiche e l’irregolarità corneale indotte nel passato dalla chirurgia refrattiva della miopia e dell’astigmatismo riducono la visione in una maniera non correggibile da occhiali o da protesi intraoculari, e certamente rendono implausibile o rischioso l’impianto di una IOL premium (es. trifocale o EDOF). La SCTK rappresenta uno strumento potente per ridurre aberrazzioni e irregolarità della superficie corneale, permettendo di ottenere un sistema ottico privo di aberrazioni significative e che consente di sfruttare appieno anche le possibilità offerte dale IOL premium. Si restituisce così una grande qualità visiva a pazienti che avevano intrapreso molti anni prima il cammino della chirurgia oculare per migliorare la propria visione.

CHIRURGIA DELLA CATARATTA
di Carlo Santucci
Benefici della terapia a base di acido ialuronico 0,15% e vitamina B12 nei pazienti sottoposti alla chirurgia della cataratta
Introduzione
La chirurgia della cataratta, in Italia, interessa ogni anno circa 650.000 pazienti, ed è una procedura sempre più diffusa a causa dell’invecchiamento della popolazione e sempre più sicura grazie alle moderne tecniche a nostra disposizione.
Sebbene, nella maggior parte dei casi, fornisca risultati soddisfacenti nel gradimento dei pazienti, una minoranza, ad oggi in ascesa, sviluppa disturbi postoperatori, come la sindrome dell’occhio secco (DED), con segni e sintomi caratteristici tra cui secchezza oculare, bruciore, prurito, sensazione di corpo estraneo e affaticamento della vista già dal primo controllo post-operatorio.
La patogenesi della sindrome dell’occhio secco dopo l’intervento chirurgico di cataratta rimane ancora poco chiara, la letteratura sembrerebbe, ad oggi, riconoscere come causa principale, la sofferenza delle fibre nervose del plesso corneale superficiale conseguente al traumatismo chirurgico, alla luce utilizzata dal microscopio e alla presenza di una componente cellulare infiammatoria sullo strato superficiale della cornea.
Il danno neurotrofico derivante dall’incisione chirurgica è quantificabile in 6 mm e presenta la tendenza a peggiorare nel tempo, se non trattato.
La secchezza post operatoria, infatti, può durare, spesso, fino a 6-8 mesi e risultare particolarmente invalidante per il paziente.
La sindrome dell’occhio secco è una complessa pa-
tologia della superficie oculare ad origine multifattoriale.
La perdita dell’omeostasi del film lacrimale si accompagna a caratteristici sintomi oculari in cui l’instabilità e l’iperosmolarità della lacrima, l’infiammazione, il danno della superficie oculare e le anomalie neurosensoriali svolgono un ruolo eziologico fondamentale.
La definizione che nel 2023 è stata scelta dalla “TEAR FILM AND OCULAR SURFACE SOCIETY” per inquadrare al meglio la sindrome dell’occhio secco dice che: “l’occhio secco è una malattia multifattoriale caratterizzata da una instabilità del film lacrimale in grado di causare una pletora di segni e /o sintomi visivi, potenzialmente accompagnati da danni alla superficie oculare”.
La DED è quindi un disturbo piuttosto comune, con una prevalenza che può arrivare fino al 75% in alcune sottocategorie della popolazione come, ad esempio, quella delle donne affette da patologie autoimmuni nel periodo post-menopausale.
L’eziologia multiforme della DED può renderla una condizione difficile da gestire in modo efficace e necessita di un intervento, quasi sempre, polispecialistico.
I fattori di rischio per la DED includono: l’età, il sesso femminile, le patologie autoimmuni (tra tutte la Sindrome di Sjögren), le terapie con farmaci specifici come i betabloccanti, gli antistaminici, gli ansiolitici, gli antidepressivi, la isotretinoina o i sostituti ormo-
nali, l’uso smodato e cronico di lenti a contatto, la disfunzione della ghiandola di Meibomio (MGD), l’etnia ed alcuni fattori genetici.
I principali meccanismi alla base della patogenesi della DED comprendono l’instabilità del film lacrimale e l’infiammazione della superficie oculare.
Al fine di inquadrare al meglio le due grandi categorie di disturbi legati all’occhio secco è necessario ricordare la composizione delle lacrime.
L’eterogena struttura del film lacrimale si compone di tre strati principali: - mucoso - acquoso - lipidico.
Lo strato mucoso è lo strato più profondo, ed è prodotto prevalentemente dalle cellule mucipare caliciformi della congiuntiva.
Il suo compito predominante è quello di mantenere l’idratazione della superficie oculare, proteggere le strutture epiteliali della superficie dell’occhio dallo sfregamento delle palpebre ed impedire l’adesione batterica.
Lo strato acquoso, quello intermedio, per la maggior parte proviene dalla secrezione delle ghiandole lacrimali principali ed accessorie.
L’acqua consente una continua idratazione delle cellule della cornea e della congiuntiva garantendo la loro sopravvivenza e la loro trasparenza.
Lo strato impermeabile lipidico, infine, è la porzione più esterna del film lacrimale, quella a diretto contatto con l’aria ed è costituita da una barriera che ricopre la porzione acquosa impedendone la sua evaporazione.
La sua maggiore funzione è quella di ridurre l’evaporazione del contenuto acquoso delle lacrime, contribuendo così alla lubrificazione delle palpebre e della congiuntiva.
Nel corso degli anni, grazie soprattutto alle evidenze della letteratura, siamo stati abituati a distinguere due sottocategorie principali di DED: quella da occhio secco evaporativo e quella da ipolacrimia, con un certo grado di sovrapposizione tra i due.
Nel deficit evaporativo si verifica un rapido tasso di evaporazione del film lacrimale dalla superficie oculare per la carenza dello strato lipidico prodotto dalle ghiandole di meibomio mentre nel deficit da ipolacrimia si riscontra una ridotta secrezione di lacrime dalla ghiandola principale lacrimale e da quelle accessorie.
In entrambe le situazioni si riscontra un netto aumento dell’iperosmolarità del film lacrimale, con una conseguente serie di processi di attivazione
CHIRURGIA DELLA CATARATTA
proinfiammatoria che contribuiscono al processo patologico.
Obiettivo
L’obiettivo del nostro studio è dimostrare come l’utilizzo di specifici sostituti lacrimali abbinati alla vitamina b12, già nel pre-operatorio, possano preparare al meglio l’occhio all’intervento di cataratta garantendo una superficie lacrimale compatta e ben levigata.
La terapia, continuata nel post-operatorio, aiuta a ridurre il danno neurotrofico derivante dal traumatismo chirurgico e a restituire alla superficie lacrimale l’omeostasi pre-esistente.
Materiali e metodi
Abbiamo condotto uno studio prospettico osservazionale selezionando 40 pazienti per i quali era in programma l’intervento di facoemulsificazione con impianto di IOL.
Ogni paziente è stato sottoposto ai seguenti esami:
- Schirmer test
- Blinking test
- Staining corneale
- Iperemia congiuntivale (red eye test)
- Flare e cellularità in camera anteriore
- Meibomiografia
- Test del menisco lacrimale
- Break up test
Gli esami sono stati ripetuti 30 giorni prima dell’intervento e nel post-operatorio a 7, 30 e 60 giorni dall’intervento di cataratta.
Sono stati esclusi dallo studio: pazienti affetti da patologie oculari diverse dalla cataratta o da patologie sistemiche con effetti sulla superficie oculare, pazienti in trattamento con farmaci aventi effetti collaterali a carico della superficie oculare, pazienti con intolleranza nota ad uno dei componenti o agli eccipienti dei colliri che abbiamo utilizzato.
È stato impiantato sempre lo stesso modello di lente intraoculare e in nessun intervento si sono verificate complicanze intraoperatorie.
Tutti i pazienti sono stati suddivisi in due gruppi di 20 unità ciascuno e solo ai pazienti del Gruppo 1 è stato richiesto di instillare un collirio con acido ialuronico 0,15% con vitamina b12 per 3 volte al giorno a partire da 30 giorni prima dell’intervento.
La terapia è stata poi mantenuta in questo gruppo di pazienti per i 60 giorni successivi all’intervento.
Tutti i pazienti sono stati valutati in modo da individuarne l’omogeneità al tempo 0, cioè al reclutamento e valutati successivamente a 7, 30 e 60 giorni.
CHIRURGIA DELLA CATARATTA
Gruppo 1 (20 pazienti): post-operatorio a 7 giorni
GRUPPO 1
Gruppo 1 (20 pazienti): post-operatorio a 30 giorni
PUNTEGGIO
Gruppo 1 (20 pazienti): post-operatorio a 60 giorni
Gruppo 2 (20 pazienti): post-operatorio a 7 giorni
CHIRURGIA DELLA CATARATTA
GRUPPO 2
PUNTEGGIO
Gruppo 2 (20 pazienti): post-operatorio a 30 giorni
PUNTEGGIO
Gruppo 2 (20 pazienti): post-operatorio a 60 giorni
PUNTEGGIO
CHIRURGIA DELLA CATARATTA
Ad ogni visita abbiamo eseguito i seguenti esami attribuendogli dei punteggi specifici:
- Test di Schirmer senza instillazione di anestetico topico: punteggio 0 tra 10 e 30 mm-; 1 sotto i 5 mm
- Blinking test (0: 100% completo, 1 parzialmente incompleto o abortivo in una percentuale tra il 10% e il 35%, 2: incompleto tra il 35% e il 50%, 3:abortivo tra il 50% e il 75%)
- Staining corneale in una scala di punteggio da 0 a 3 (0: assente, 1: positività di 1/3 della cornea, 2: positività di 2/3 della cornea, 3. positività di tutta la cornea); iperemia congiuntivale in una scala da 0 a 4 (0: assente, 1: lieve, 2: moderata, 3: moderatosevera, 4 grave con iniezione pericheratica);
- Presenza di flare e cellularità in camera anteriore: il punteggio è espressione della somma dei singoli punteggi relativi al flare (0: assente, 1: rare tracce, 2: lieve, 3: medio, 4: forte)
- Meibomiografia:0 preservata l’attività ghiandolare al 100%; 1 (preservata l’attività ghiandolare fino all’80%; 2:tra l’80% e il 60%,3: tra il 60 e il 40%,4: sotto il 40%)
- Menisco lacrimale: 0 :0,2 -0,5 mm, 1 < 0,2 mm
- BUT: 0, intorno ai 10 secondi; 1 tra 10 e 7; 2 tra 7 e 5; 3 sotto i 5).
Nell’ultima visita abbiamo valutato la presenza di sintomatologia soggettiva da occhio secco attraverso questionario OSDI.
Risultati
I risultati hanno dimostrato delle differenze sostanziali tra gruppo 1 e 2. A tutte le visite del post-operatorio, infatti, tutti i pazienti che avevano ricevuto un pre-trattamento (gruppo 1) presentavano valori migliori rispetto a quelli non trattati (gruppo 2).
Conclusioni
La sindrome dell’occhio secco è, mai come adesso, una delle patologie croniche multifattoriali più radicate nella nostra popolazione e la cui diagnosi, spesso complicata da diverse variabili, rappresenta una delle sfide principali per la clinica degli oculisti di oggi.
Intercettare, già dal pre-operatorio, gli occhi dei pazienti affetti da secchezza, ci permetterebbe di prepararli al meglio in vista di eventuali eventi traumatici, ma necessari per la salute dell’occhio, come proprio la chirurgia della cataratta.
Dai dati che abbiamo raccolto risulta evidente come, anche soggetti apparentemente sani e senza uno storico di sintomi legati alla secchezza oculare, ab-
bia manifestato, a seguito di un traumatismo chirurgico, un corteo di alterazioni ascrivibile a discomfort della superficie lacrimale.
L’utilizzo di un collirio con l’acido ialuronico 0,15 % con la vitamina b12, risulti efficace nel controllare il quadro di sintomi che può associarsi a questa chirurgia.
Tale beneficio è dimostrato dal netto vantaggio che la terapia dà nei soggetti trattati sia in termini di aumento quantitativo del film lacrimale (Schirmer), sia come miglioramento qualitativo (BUT). Inoltre, particolare interessante è che anche i segni di flogosi sono nettamente ridotti, verosimilmente per l’effetto lubrificante del sostituto lacrimale, ma anche per la riduzione dell’attrito meccanico che una superficie non perfettamente levigata può generare (staining corneo-congiuntivale). Anche la sintomatologia soggettiva quantificata con l’indice OSDI risulta beneficiare in maniera netta della terapia.
Viceversa il gruppo 2, quello dei pazienti che non ricevevano alcun trattamento prima dell’intervento chirurgico, slatentizzava già dal primo post-operatorio una serie di segni e sintomi ascrivibili al discomfort della superficie oculare che tendevano ad esacerbarsi a 1 e a 2 mesi.
La scelta di stabilizzare la lubrificazione della superficie lacrimale in vista dell’intervento di cataratta è risultata vincente e apre una strada che potrebbe essere percorsa per un numero via via sempre più numeroso di pazienti.
Bibliografia
1. Apple DJ, Ram J, Forster A et al. Cataract: Epidemiology and Service Delivery. Surv Ophthalmol 2000;45(suppl):32-44.
2. Porela-Tiihonen S, Roine RP, Sintonen H et al. Health related quality of life after cataract surgery with the phacoemulsification tecnique and intraocular lens implantation. Acta Ophthalmol 2015 May 14.doi: 10.1111/aos.12755.
3. Roach L. Special considerations in Cataract Surgery: Five cornea challengers. Eyenet Magazine 2015.
4. Rolando M, Calabria G. Superficie Oculare e Sostituti lacrimali. 1994 Sagep Editrice Genova.
5. The Ocular Surface 2007 Report of the International Dry Eye Workshop (DEWS) 2007, 5(2).
6. Hardten DR. Dry eye disease in patients after cataract surgery. Cornea 2008; 27(7): 855.
7. Li XM, Hu L, Hu J et al. Investigation of dry eye disease and analysis of the pathogenic factors in patients after cataract surgery. Cornea 2007;26(9suppl1):16-20.
8. Oh T, Jung Y, Chang D et al. Changes in the tear film and ocular surface after cataract surgery. Jpn J Ophthalmol 2012;56(2):113-8.



Scopri perche` e` importante controllare gli occhi sin dai primi anni di vita!

lui è Pigrocchio
ADERIS C I ANCH E
Puoi chiedere
50 copie gratuite da mettere a disposizione nella tua sala d'attesa

Richiedi gli opuscoli a info@fgeditore.it

Evoluzione e sviluppo nella chirurgia della cataratta: la piattaforma MS39-OSIRIS di CSO
La chirurgia della cataratta, tradizionalmente finalizzata a rimuovere il cristallino opaco, è un campo in rapida evoluzione in oftalmologia. Le richieste dei pazienti che ambiscono a una totale indipendenza dagli occhiali spingono i chirurghi a ottimizzare le loro tecniche e l’industria a migliorare i propri prodotti.
In questo contesto, CSO – Costruzione Strumenti Oftalmici, azienda leader nel settore della strumentazione oftalmica, propone la piattaforma compo-
sta da MS-39, OCT del segmento anteriore e Osiris, aberrometro oculare.
L’OCT del segmento anteriore MS-39 unisce la topografia a riflessione basata su disco di Placido alla tomografia ottenuta con tecnologia SD-OCT. Il dispositivo, oltre a fornire sezioni tomografiche del segmento anteriore ad altissima risoluzione (3.6 µm in tessuto), consente la rilevazione dei parametri necessari per la valutazione del paziente candidato a chirurgia premium.

Il modulo raytracing disponibile su MS-39 è in grado di calcolare il potere della IOL (la lunghezza assiale deve essere fornita da un dispositivo di terze parti), simulando il percorso della luce attraverso le strutture oculari. A differenza dei metodi tradizionali, il ray tracing, considera le proprietà anatomiche e ottiche di ciascun occhio, comprese possibili irregolarità o cambiamenti derivanti da precedenti interventi di chirurgia refrattiva.
L’aberrometro oculare Osiris consente la valutazione pre e post-operatoria del fronte d’onda oculare. Grazie all’analisi di 45.000 punti sul fronte d’onda, Osiris è in grado di rappresentare la curva di defocus oggettiva dell’occhio analizzato, informazione utile per valutare la performance visiva a varie distanze del paziente sottoposto a chirurgia premium.
La combinazione di MS-39 e Osiris offre la possibilità di studiare le aberrazioni oculari interne, di quantificare su base aberrometrica l’eventuale rotazione di IOL toriche e di stimare quale sarà la refrazione del paziente dopo il riposizionamento della IOL ruotata.
MS-39 OCT e Osiris sono esposti ad AICCER nello stand 9-10, dove il personale specializzato effettua dimostrazioni durante tutta la durata del Congresso.
CSO è presente nel settore oftalmologico dal 1967; negli anni l’azienda ha conquistato mercati sempre più vasti, affermandosi nei mercati europeo, asiatico e americano. La ricerca tecnologica, il design made in Italy, l’efficienza del processo produttivo, l’elevato livello dei prodotti sono alla base del successo dell’azienda.


Curva di defocus oggettiva in occhio sottoposto a chirurgia della cataratta con lente EDOF
Siamo presenti al XXVI Congresso Nazionale AICCER di Trieste – STAND 9-10
UN PASSO AVANTI NELL’USO DELLE TERAPIE ANTIBIOTICHE1





1 mg/ml desametasone + 5 mg/ml levofloxacina, collirio, soluzione
UNA STRATEGIA TERAPEUTICA
EFFICACE ED INNOVATIVA 1
DUCRESSA “1 mg/ml + 5 mg/ml, collirio,soluzione”
1 flacone in LDPE da 5 ml con contagocce (AIC n. 047874019)
Classe ai fini della rimborsabilità: Classe C
Prezzo al pubblico (IVA inclusa): €
Bibliografia: Classificazione ai fini della fornitura: RR - medicinale soggetto a prescrizione medica
1) Bandello F. et al. Eye (Lond). 2020 May 4. doi: 10.1038/s41433-020-0869-1. Online ahead of print.
2) RCP Ducressa. 20,90 in vigore dal 15/01/2025




La combinazione fissa Levofloxacina / Desametasone indicata per la prevenzione e il trattamento dell’infiammazione e per la prevenzione dell’infezione associata all’intervento chirurgico per la cataratta 2




Ducressa fornisce l’efficacia antibatterica con una sola settimana di trattamento dopo l’intervento di cataratta 1

RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
1. DENOMINAZIONE DEL MEDICINALE Ducressa 1 mg/ml + 5 mg/ml, collirio, soluzione
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml di collirio, soluzione contiene desametasone sodio fosfato, equivalente a 1 mg di desametasone e levofloxacina emiidrato, equivalente a 5 mg di levofloxacina. Una goccia (circa 30 microlitri) contiene circa 0,03 mg di desametasone e 0,150 mg di levofloxacina. Eccipienti con effetti noti: Un ml di collirio soluzione contiene 0,05 mg di benzalconio cloruro e una goccia contiene circa 0,0015 mg di benzalconio cloruro. Un ml di collirio soluzione contiene 4,01 mg di fosfati e una goccia contiene 0,12 mg di fosfati. Per l’elenco completo degli eccipienti, vedere paragrafo 6.1.
3. FORMA FARMACEUTICA Collirio, soluzione (collirio). Soluzione limpida, giallo-verdastra, praticamente priva di particelle con un pH di 7,0-7,4 e osmolalità di 270-330 mOsm/Kg. Le gocce erogate appaiono trasparenti ed incolore.
4. INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche Ducressa collirio, soluzione è indicato per la prevenzione e il trattamento dell’infiammazione e per la prevenzione dell’infezione associata all’intervento chirurgico per cataratta negli adulti. Tenere in considerazione le linee guida ufficiali sull’uso appropriato degli agenti antibatterici. 4.2 Posologia e modo di somministrazione Posologia Dopo l’intervento chirurgico, instillare una goccia nel sacco congiuntivale ogni 6 ore. La durata del trattamento è di 7 giorni. Fare attenzione a non interrompere anticipatamente la terapia. Se si dimentica una dose, il trattamento deve essere proseguito assumendo la dose successiva come pianificato. Dopo una settimana di trattamento con Ducressa collirio si raccomanda di rivalutare il paziente per stabilire se è necessario proseguire con la somministrazione di un collirio a base di corticosteroidi in monoterapia. La durata di questo trattamento può dipendere dai fattori di rischio del paziente e dall’esito dell’intervento chirurgico e deve essere stabilita dal medico dopo un esame con lampada a fessura e in base alla gravità del quadro clinico. Un trattamento di follow-up con collirio a base di steroidi non dovrebbe di norma superare le 2 settimane. Fare comunque attenzione a non interrompere anticipatamente la terapia. Popolazione pediatrica: La sicurezza e l’efficacia di Ducressa nei bambini e negli adolescenti di età inferiore a 18 anni non sono state stabilite. Non ci sono dati disponibili. L’uso di Ducressa non è raccomandato nei bambini e negli adolescenti di età inferiore a 18 anni. Pazienti anziani: Non c’è necessità di modificare la dose nei pazienti anziani. Uso nella compromissione renale/epatica: Ducressa non è stato studiato nei pazienti con compromissione renale/epatica e pertanto, Ducressa deve essere utilizzato con cautela in questi pazienti. Modo di somministrazione Uso oftalmico. Una goccia deve essere somministrata nel canto laterale applicando, nel contempo, una pressione a livello del canto mediale per evitare il drenaggio delle gocce. I pazienti devono essere istruiti a lavarsi le mani prima dell’uso e a evitare il contatto con la punta del contenitore e l’occhio o le aree circostanti, in quanto ciò potrebbe causare lesioni oculari. Inoltre, è necessario informare i pazienti che le soluzioni oftalmiche, se maneggiate in modo improprio, possono venire contaminate da batteri comuni in grado di causare infezioni oculari. L’uso di soluzioni contaminate può arrecare gravi danni all’occhio e successiva perdita della vista. L’occlusione nasolacrimale mediante compressione dei dotti lacrimali può ridurre l’assorbimento sistemico. In caso di trattamento concomitante con altri colliri, le instillazioni devono avvenire a distanza di 15 minuti. 4.3 Controindicazioni • Ipersensibilità al principio attivo levofloxacina o ad altri chinoloni, al desametasone o ad altri steroidi, o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1; • Cheratite da herpes simplex, varicella e altre malattie virali della cornea e della congiuntiva; • Infezioni oculari da micobatteri causate, ad esempio, da bacilli acido-resistenti quali Mycobacterium tuberculosis, Mycobacterium leprae o Mycobacterium avium; • Micosi delle strutture oculari; • Infezioni oculari purulente non trattate. 4.4 Avvertenze speciali e precauzioni di impiego Effetti oculari: Ducressa è esclusivamente per uso oftalmico. Ducressa non deve essere somministrato per iniezione sottocongiuntivale. La soluzione non deve essere introdotta direttamente nella camera anteriore dell’occhio. L’uso prolungato può indurre resistenza agli antibiotici con conseguente proliferazione di organismi non sensibili, inclusi i miceti. In presenza di infezioni è necessario interrompere il trattamento e adottare una terapia alternativa. Ogni qual volta richiesto dal giudizio clinico, il paziente deve essere esaminato mediante visualizzazione ingrandita, ad esempio tramite biomicroscopia con lampada a fessura ed eventualmente colorazione con fluoresceina. L’uso prolungato di corticosteroidi per uso topico oftalmico può causare ipertensione oculare/glaucoma, il verificarsi di tale evenienza è, tuttavia, improbabile se Ducressa viene utilizzato per il periodo di trattamento raccomandato (7 giorni). È in ogni caso consigliabile un controllo frequente della pressione intraoculare. Il rischio di innalzamento della pressione intraoculare indotto da corticosteroidi è maggiore nei pazienti predisposti (per es. i diabetici). Con l’uso di corticosteroidi sistemici e topici possono essere riferiti disturbi della vista. Se un paziente si presenta con sintomi quali visione offuscata o altri disturbi visivi, è necessario considerare la visita con un oftalmologo per la valutazione delle possibili cause che possono essere collegate a complicanze postoperatorie, allo sviluppo di glaucoma o a patologie rare, quali la corioretinopatia sierosa centrale (CSC), che sono state segnalate dopo l’uso di corticosteroidi sistemici e topici. I corticosteroidi per uso topico oftalmico possono rallentare la guarigione delle ferite corneali. È noto che anche i FANS per uso topico oftalmico possono rallentare o ritardare la guarigione. L’uso concomitante di FANS e steroidi per uso topico oftalmico può aumentare il rischio di problemi di guarigione. Nei pazienti con patologie che causano assottigliamento della cornea o della sclera, è stato riscontrato che si verificano perforazioni con l’uso di corticosteroidi topici. Effetti sistemici: I fluorochinoloni sono stati associati a reazioni di ipersensibilità anche dopo una singola dose. In presenza di una reazione allergica alla levofloxacina, interrompere il trattamento. Durante la terapia sistemica con fluorochinoloni, compresa la levofloxacina, possono verificarsi l’infiammazione e la rottura dei tendini, in particolare nei pazienti più anziani e in quelli trattati contemporaneamente con corticosteroidi. È, pertanto, necessario essere cauti e interrompere il trattamento con Ducressa ai primi segni di tendinite (vedere paragrafo 4.8). La Sindrome di Cushing e/o soppressione surrenalica associate con l’assorbimento sistemico di desametasone oculare possono verificarsi dopo terapia intensiva o continuata per lunghi periodi in pazienti predisposti, compresi bambini e pazienti trattati con inibitori del CYP3A4 (compresi ritonavir e cobicistat). In questi casi, il trattamento dovrebbe essere sospeso progressivamente. Effetti sul sistema immunitario: L’uso prolungato (in genere si osservano entro le 2 settimane di trattamento) può anche causare infezioni oculari secondarie (batteriche, virali o micotiche), dovute alla soppressione della risposta dell’ospite o a un ritardo nella guarigione. Inoltre, i corticosteroidi per uso topico oftalmico possono favorire, aggravare o mascherare i segni e i sintomi di infezioni oculari causate da microrganismi patogeni. Il verificarsi di tali patologie è limitato se il trattamento con corticosteroidi è di breve durata, come quello suggerito con Ducressa. Eccipienti Benzalconio cloruro: Sono stati riportati casi di irritazione agli occhi, occhio secco, alterazione del film e della superficie corneali a seguito di somministrazione oftalmica di benzalconio cloruro. Da usare con cautela nei pazienti con occhio secco e con compromissione della cornea. I pazienti devono essere monitorati in caso di uso prolungato. Dopo l’intervento di cataratta, i pazienti non devono portare lenti a contatto per tutta la durata del trattamento con Ducressa. 4.5 Interazioni con altri medicinali e altre forme di interazione Non sono stati effettuati studi di interazione. Dato che dopo somministrazione oculare le concentrazioni massime nel plasma di levofloxacina e desametasone sono almeno 1000 volte inferiori a quelle riferite dopo dosi orali standard, è improbabile che le interazioni con altri prodotti per uso sistemico siano clinicamente rilevanti. L’uso concomitante di probenecid, cimetidina o ciclosporina con levofloxacina ha alterato alcuni parametri farmacocinetici della levofloxacina, ma non in misura clinicamente significativa. L’uso concomitante di steroidi topici e FANS topici può aumentare il rischio di problemi di guarigione della cornea. Gli inibitori del CYP3A4 (inclusi ritonavir e cobicistat) possono ridurre la clearance del desametasone potenziandone gli effetti. La combinazione deve essere evitata, a meno che il beneficio non sia superiore al rischio aumentato di effetti collaterali sistemici causati dal corticosteroide, nel qual caso i pazienti devono essere monitorati per tali effetti sistemici. 4.6 Fertilità, gravidanza e allattamento Gravidanza I dati relativi all’uso di desametasone e levofloxacina in gravidanza non sono disponibili o sono in numero limitato. I corticosteroidi attraversano la placenta. L’uso prolungato o ripetuto di corticosteroidi durante la gravidanza è stato associato a un maggiore rischio di ritardo di crescita intrauterina, a un minor peso alla nascita e al rischio di ipertensione, disturbi vascolari e insulino-resistenza in età adulta. I lattanti nati da madri che hanno assunto dosi considerevoli di corticosteroidi durante la gravidanza devono essere sottoposti ad accurati controlli per rilevare eventuali segni di iposurrenalismo. Negli studi condotti sugli animali i corticosteroidi hanno mostrato tossicità riproduttiva ed effetti teratogeni (tra cui palatoschisi; vedere paragrafo 5.3). Dato che non può essere esclusa un’esposizione sistemica rilevante ai corticosteroidi conseguente alla somministrazione oculare, il trattamento con Ducressa non è raccomandato durante la gravidanza, in particolare durante i primi tre mesi, e dovrebbe essere impiegato solo dopo un’attenta valutazione dei rischi e dei benefici. Allattamento La levofloxacina e i corticosteroidi sistemici vengono escreti nel latte materno. Non vi sono dati disponibili per stabilire se nel latte materno possano passare quantità di desametasone tali da produrre effetti clinici nel lattante. Un rischio per il lattante non può essere escluso. È necessario decidere se interrompere l’allattamento con latte materno o interrompere/sospendere la terapia con Ducressa, valutando il beneficio per il bambino derivante dall’allattamento con latte materno e il beneficio per la donna derivante dal trattamento. Fertilità I corticosteroidi somministrati per via sistemica possono compromettere la fertilità maschile e femminile influenzando la secrezione ormonale dell’ipotalamo e dell’ipofisi, come pure la gametogenesi nei testicoli e nelle ovaie. Non è noto se il desametasone per uso oftalmico comprometta la fertilità umana. La levofloxacina non ha causato alcuna compromissione della fertilità nei ratti, a livelli di esposizione notevolmente più elevati rispetto all’esposizione massima nell’uomo dopo la somministrazione oculare. 4.7 Effetti sulla capacità di guidare veicoli e sull’uso di macchinari Come con qualsiasi altro collirio, un offuscamento transitorio della vista o altri disturbi visivi possono pregiudicare la capacità di guidare veicoli e di usare macchinari. In caso di offuscamento della vista, il paziente deve attendere che la vista ritorni nitida prima di mettersi alla guida o usare macchinari. 4.8 Effetti indesiderati Riassunto del profilo di sicurezza 438 pazienti sono stati trattati con Ducressa nell’ambito degli studi clinici. Non si sono verificate reazioni avverse gravi. Le reazioni avverse non gravi più comunemente riportate sono irritazione dell’occhio, ipertensione oculare e cefalea. Elenco tabulare delle reazioni avverse Le seguenti reazioni avverse correlate a Ducressa sono state riportate nel corso di studi clinici in cui sono stati arruolati pazienti sottoposti a intervento chirurgico di cataratta (all’interno di ciascuna categoria di frequenza, le reazioni avverse sono presentate in ordine di frequenza decrescente).
La frequenza delle possibili reazioni avverse di seguito elencate è stata definita sulla base della seguente convenzione:
molto comune
comune
non comune
rara
molto rara
non nota
≥1/10
≥1/100, <1/10
≥1/1.000, <1/100
≥1/10.000, <1/1.000
≤1/10.000
La frequenza non può essere definita sulla base dei dati disponibili
Ducressa (combinazione di levofloxacina/desametasone)
Classificazione per sistemi e organi Frequenza
Patologie del sistema nervoso Non comune
Patologie dell’occhio Non comune
Patologie della cute e del tessuto sottocutaneo Non comune
Esami diagnostici Non comune
Reazioni avverse
Cefalea, disgeusia.
Irritazione dell’occhio, sensazione anomala all’occhio, ipertensione oculare.
Prurito.
Pressione intraoculare aumentata (*). (*) > 6 mmHg che significa aumento significativo della pressione intraoculare
Le reazioni avverse osservate con i singoli principi attivi per uso oftalmico (levofloxacina o desametasone) e che possono potenzialmente manifestarsi anche con Ducressa sono riportate di seguito:
Levofloxacina
Classificazione per sistemi e organi Frequenza Reazioni avverse
Disturbi del sistema immunitario Rara
Reazioni allergiche extraoculari, incluso rash cutaneo. Molto rara Anafilassi.
Patologie del sistema nervoso Non comune
Cefalea.
Patologie dell’occhio Comune Bruciore agli occhi, diminuzione della vista e produzione di filamenti mucosi. Non comune
Formazione di croste sul margine palpebrale, chemosi, reazione papillare congiuntivale, edema palpebrale, fastidio oculare, prurito oculare, dolore oculare, iperemia congiuntivale, follicoli congiuntivali, secchezza oculare, eritema palpebrale e fotofobia.
Patologie respiratorie, toraciche e mediastiniche Non comune Rinite.
Molto rara Edema laringeo.
Desametasone
Patologie dell’occhio
Molto comune
Aumento della pressione intraoculare*.
Comune Fastidio*, irritazione*, bruciore*, dolore puntorio*, prurito* e visione offuscata*. Non comune
Molto rara
Patologie della cute e tessuto sottocutaneo Molto rara
Patologie endocrine
Reazioni allergiche e di ipersensibilità, ritardata guarigione delle ferite, cataratta capsulare posteriore*, infezioni opportunistiche, glaucoma*.
Congiuntivite, midriasi, ptosi, uveite indotta da corticosteroidi, calcificazioni corneali, cheratopatia cristallina, alterazioni dello spessore corneale*, edema corneale, ulcera corneale e perforazione corneale.
Edema facciale.
Frequenza non nota Sindrome di Cushing, soppressione surrenalica.
* vedere il paragrafo Descrizione di alcune reazioni avverse
Descrizione di selezionate reazioni avverse Aumento della pressione intraoculare Possono manifestarsi aumento della pressione intraoculare (PIO) e glaucoma. L’uso prolungato di corticosteroidi può comportare ipertensione oculare/glaucoma (in particolare nei pazienti con precedente PIO elevata indotta da steroidi o con PIO elevata o glaucoma preesistenti). Bambini e anziani possono essere particolarmente suscettibili all’insorgere di PIO indotta da steroidi (vedere paragrafo 4.4). Anche i diabetici sono più soggetti a sviluppare cataratte sottocapsulari dopo somministrazione prolungata di steroidi topici. Reazioni avverse post-procedurali Nel corso degli studi clinici sono stati segnalati disturbi oculari (per es. edema corneale, irritazione dell’occhio, sensazione anomala all’occhio, aumento della lacrimazione, astenopia, disturbi della cornea, secchezza oculare, dolore oculare, fastidio oculare, uveite, visione offuscata, luminosità visiva, congiuntivite) e nausea. Queste reazioni sono generalmente lievi e transitorie e si reputa siano connesse all’intervento stesso di cataratta. Possibili reazioni avverse connesse alla cornea Nelle patologie che causano assottigliamento della cornea, l’uso topico di steroidi può talora comportare perforazione corneale (vedere paragrafo 4.4). Molto raramente sono stati riportati casi di calcificazione della cornea associati all’uso di colliri contenenti fosfati in pazienti con cornea significativamente danneggiata. Ulteriori reazioni avverse osservate con l’uso prolungato del principio attivo levofloxacina che possono potenzialmente verificarsi anche con Ducressa Rotture dei tendini della spalla, della mano, del tendine di Achille e di altri tendini, che hanno richiesto una riparazione chirurgica, o hanno comportato un’invalidità prolungata, sono state riferite in pazienti trattati con fluorochinoloni per via sistemica. Studi ed esperienze post-marketing con i chinoloni per via sistemica indicano che il rischio di tali rotture può essere aumentato nei pazienti trattati con corticosteroidi, in particolare nei pazienti geriatrici e nei tendini sottoposti a sollecitazioni elevate, incluso il tendine di Achille (vedere paragrafo 4.4). Segnalazione delle reazioni avverse sospette La segnalazione delle reazioni avverse sospette che si verificano dopo l’autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione all’indirizzo www.aifa.gov.it/content/segnalazioni-reazioni-avverse 4.9 Sovradosaggio La quantità totale di le -
vofloxacina e desametasone 21-Fosfato contenuta nel flaconcino di Ducressa è troppo esigua per indurre effetti tossici dopo un’assunzione accidentale. In caso di sovradosaggio topico il trattamento deve essere interrotto. In caso di irritazione prolungata, sciacquare l’occhio/gli occhi con acqua sterile. La sintomatologia dovuta a ingestione accidentale non è nota. Il medico può considerare la lavanda gastrica o l’emesi.
5. PROPRIETÀ FARMACOLOGICHE 5.1 Proprietà farmacodinamiche Categoria farmacoterapeutica: agenti antinfiammatori e antinfettivi in combinazione, corticosteroidi e antinfettivi in combinazione. Codice ATC: S01C A01. Ducressa è una combinazione fissa di due principi attivi: levofloxacina e desametasone.Levofloxacina: Meccanismo d’azione: La levofloxacina, L-isomero attivo dell’ofloxacina, è un agente antibatterico della classe dei fluorochinoloni che inibisce le topoisomerasi batteriche di tipo II: DNA girasi e topoisomerasi IV. I target della levofloxacina sono principalmente la DNA girasi nei batteri Gram-negativi e la topoisomerasi IV nei batteri Gram-positivi. Lo spettro di attività contro i patogeni oculari include microrganismi aerobi Gram-positivi (per es. S. aureus MSSA, S. pyogenes, S. pneumoniae e gli streptococchi del gruppo viridans), batteri aerobi Gram-negativi (per es. E. coli, H. influenzae, M. catarrhalis, isolati ambientali di P. aeruginosa) e altri organismi (per es. Chlamydia trachomatis). Meccanismo di resistenza La resistenza batterica alla levofloxacina può svilupparsi principalmente attraverso due meccanismi principali: una riduzione della concentrazione intrabatterica del farmaco o alterazioni dei suoi enzimi target. L’alterazione del sito target deriva da mutazioni dei geni cromosomici che codificano la DNA girasi (gyrA e gyrB) e la topoisomerasi IV (parC e parE; grlA e grlB nello Staphylococcus aureus). La resistenza dovuta a una bassa concentrazione intrabatterica del farmaco può essere legata a un’alterazione delle porine della membrana esterna (OmpF), con conseguente riduzione del passaggio dei fluorochinoloni all’interno dei batteri Gram-negativi, oppure alle pompe di efflusso. La resistenza mediata dalle pompe di efflusso è stata descritta in pneumococchi (PmrA), stafilococchi (NorA), anaerobi e batteri Gram-negativi. Infine, una resistenza ai chinoloni mediata dai plasmidi (determinata dal gene qnr) è stata descritta nella Klebsiella pneumoniae e nell’E. coli Resistenza crociata Può verificarsi una resistenza crociata tra i fluorochinoloni. Le singole mutazioni possono non comportare resistenza clinica, tuttavia le mutazioni multiple generalmente comportano resistenza clinica a tutti i farmaci appartenenti alla classe dei fluorochinoloni. Le porine alterate della membrana esterna e i sistemi di efflusso possono avere un’ampia specificità di substrato, individuando diverse classi di agenti antibatterici, con conseguente resistenza multipla.Criteri interpretativi dei saggi di sensibilità Non ci sono criteri interpretativi. Desametasone: Meccanismo d’azione: I corticosteroidi come il desametasone sopprimono l’espressione delle molecole di adesione delle cellule endoteliali vascolari, delle ciclossigenasi I o II e delle citochine. Tale azione culmina in un’espressione ridotta dei mediatori proinfiammatori e nella soppressione dell’adesione dei leucociti circolanti all’endotelio vascolare, impedendo pertanto la loro migrazione nel tessuto oculare infiammato. Il desametasone esercita una spiccata attività antinfiammatoria con un’attività mineralcorticoide limitata rispetto ad alcuni altri steroidi, ed è uno dei più importanti agenti antinfiammatori. Efficacia clinica: L’efficacia di Ducressa è stata indagata in uno studio controllato per valutare la non inferiorità di Ducressa rispetto al trattamento standard con una formulazione commerciale di tobramicina (0,3%) e desametasone (0,1%) in gocce oculari, per la prevenzione e il trattamento dell’infiammazione e per la prevenzione delle infezioni associate all’intervento chirurgico per cataratta negli adulti. Allo Sperimentatore addetto alla valutazione dei parametri dello studio non è stata resa nota l’assegnazione del trattamento. I pazienti che dopo l’intervento di cataratta non presentavano complicanze sono stati assegnati a Ducressa collirio, 1 goccia 4 volte al giorno per 7 giorni, seguito da desametasone 0,1% collirio, 1 goccia 4 volte al giorno, per altri 7 giorni, o al trattamento di riferimento con tobramicina + desametasone collirio, 1 goccia 4 volte al giorno per 14 giorni. I dati di efficacia sono disponibili in 395 pazienti trattati con Ducressa e in 393 pazienti trattati con il prodotto di riferimento dopo l’intervento di cataratta. Dopo 14 giorni di trattamento, la percentuale di pazienti che non presenta segni di infiammazione (endpoint primario dello studio) nel gruppo Ducressa seguito da desametasone è del 95,19%, rispetto al 94,91% del gruppo tobramicina + desametasone. La differenza tra le due percentuali è di 0,0028 (IC al 95%: [-0,0275; 0,0331]), dimostrano pertanto la non inferiorità del regime di trattamento sperimentale rispetto a quello di riferimento. Nel corso dello studio l’endoftalmite non è stata riscontrata in nessuno dei due gruppi. Nel braccio Ducressa, i segni di infiammazione della camera anteriore sono risultati assenti nel 73,16% dei pazienti al giorno 4 e nell’85,57% dei pazienti al giorno 8 successivi all’intervento chirurgico. Nel braccio tobramicina + desametasone, i segni di infiammazione della camera anteriore sono risultati assenti nel 76,84% dei pazienti al giorno 4 e nell’86,77% dei pazienti al giorno 8. L’iperemia congiuntivale è già assente al giorno 4 nell’85,75% dei pazienti del braccio Ducressa rispetto all’82,19% del braccio tobramicina + desametasone. Il profilo di sicurezza è risultato simile in entrambi i gruppi. Popolazione pediatrica L’Agenzia europea per i medicinali ha previsto l’esonero dall’obbligo di presentare i risultati degli studi con Ducressa in tutti i sottogruppi della popolazione pediatrica per la prevenzione e il trattamento dell’infiammazione e per la prevenzione delle infezioni associate all’intervento chirurgico per cataratta (vedere paragrafo 4.2 per informazioni sull’uso pediatrico). 5.2 Proprietà farmacocinetiche L’instillazione oculare di Ducressa comporta l’assorbimento di entrambi i principi attivi nei tessuti oculari e, in misura molto minore, nella circolazione sistemica. Nei conigli, dopo instillazione oculare, le concentrazioni plasmatiche di levofloxacina aumentano con la dose, sia dopo somministrazione singola, sia dopo somministrazione ripetuta. I livelli di desametasone sodio fosfato misurati nel plasma sono bassi. Infatti, il desametasone sodio fosfato viene rapidamente metabolizzato in vivo in desametasone, che è il metabolita attivo. L’esposizione al desametasone aumenta con la dose e dopo dosi ripetute è evidente un lieve accumulo sia di levofloxacina sia di desametasone. Nei tessuti oculari (umore acqueo, cornea e congiuntiva) i livelli di levofloxacina e di desametasone risultano superiori ai livelli massimi plasmatici dopo dosi singole e ripetute. In particolare, dopo 28 giorni di trattamento i livelli di levofloxacina e desametasone nei tessuti oculari sono superiori alla Cmax plasmatica da 50 a 100 volte e da 3 a 4 volte, rispettivamente. Centoventicinque pazienti sottoposti a intervento chirurgico di cataratta sono stati assegnati in modo casuale a 3 gruppi: levofloxacina, desametasone e Ducressa. Una goccia di ciascun farmaco è stata somministrata 90 e 60 minuti prima della paracentesi limbare. La media dei valori osservati per la concentrazione di levofloxacina era di 711,899 ng/ml (IC al 95%: 595,538; 828,260) nel gruppo Ducressa, e di 777,307 ng/ml (IC al 95%: 617,220; 937,394) con somministrazione della sola levofloxacina. Le concentrazioni di levofloxacina nell’umore acqueo sono ben al di sopra delle concentrazioni minime inibitorie per i patogeni oculari nello spettro di attività della levofloxacina. Quando Ducressa è stato somministrato con desametasone si è raggiunta una concentrazione nell’umore acqueo di 11,774 ng/ml (IC al 95%: 9,812; 13,736) rispetto ai 16,483 ng/ml (IC al 95%: 13,736; 18,838) con somministrazione del solo desametasone. Sia la levofloxacina sia il desametasone vengono eliminati con le urine. 5.3 Dati preclinici di sicurezza Gli studi sulla tossicità oculare per dosi ripetute condotti nei conigli con la combinazione fissa di levofloxacina/desametasone per un periodo di 28 giorni hanno evidenziato tossicità sistemiche attribuibili a effetti farmacologici esagerati del desametasone (necrosi focale delle cellule tubulari e glomerulopatia con necrosi e/o depositi ialini nei reni, ipertrofia epatica con inclusioni ialine intracellulari e necrosi di singole cellule, atrofia della corteccia surrenale e diminuzione dei linfociti dovuta ad atrofia della milza, del timo e dei linfonodi). Tali effetti sono stati osservati solo a esposizioni circa 3 volte superiori rispetto a quelle raggiunte alla massima dose oftalmica raccomandata per l’uomo, a indicare la scarsa rilevanza nell’uso clinico. Gli studi condotti sugli animali hanno dimostrato che gli inibitori della girasi causano disturbi nella crescita delle articolazioni portanti. Nel ratto e nel cane la levofloxacina, come altri fluorochinoloni, ha mostrato effetti sulla cartilagine (formazione di vesciche e cavità) dopo dosi elevate per via orale. Genotossicità e cancerogenicità Il desametasone e la levofloxacina non rivelano alcun potenziale genotossico o cancerogeno clinicamente rilevante. Tossicità riproduttiva: La levofloxacina non ha influenzato la fertilità e ha compromesso lo sviluppo embrio-fetale negli animali solo a esposizioni notevolmente più elevate di quelle raggiungibili con la dose terapeutica per via oftalmica raccomandata per l’uomo. La somministrazione topica e sistemica di desametasone ha compromesso la fertilità maschile e femminile e indotto effetti teratogeni che comprendono formazione di palatoschisi, ritardo di crescita intrauterina e mortalità fetale. È stata osservata anche una tossicità peri- e postnatale del desametasone. Potenziale fototossico: Gli studi nel topo, dopo dosaggio sia orale sia endovenoso, hanno mostrato che la levofloxacina svolge un’attività fototossica solo a dosi molto elevate.
6. INFORMAZIONI FARMACEUTICHE 6.1 Elenco degli eccipienti Sodio diidrogeno fosfato monoidrato, Disodio fosfato dodecaidrato, Sodio citrato, Benzalconio cloruro, Sodio idrossido/acido cloridrico (per la correzione del pH), Acqua per preparazioni iniettabili 6.2 Incompatibilità Non pertinente. 6.3 Periodo di validità 3 anni. Eliminare entro 28 giorni dopo la prima apertura. 6.4 Precauzioni particolari per la conservazione Questo medicinale non richiede alcuna precauzione particolare per la conservazione. 6.5 Natura e contenuto del contenitore Flacone da 5 ml in polietilene a bassa densità (LDPE), con un contagocce in LDPE e un tappo a vite in polietilene ad alta densità (HDPE). Confezione da: 1 flacone x 5 ml 6.6 Precauzioni particolari per lo smaltimento L’antibiotico non utilizzato o la soluzione antibiotica residua e i materiali utilizzati per la somministrazione devono essere smaltiti in conformità alla normativa locale vigente.
7. TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO SANTEN OY Niittyhaankatu 20 33720 Tampere Finlandia
8. NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO AIC n. 047874019 - “1 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE” 1 FLACONE IN LDPE DA 5 ML CON CONTAGOCCE
9. DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL’AUTORIZZAZIONE Data della prima autorizzazione: 15 ottobre 2020. Data del rinnovo più recente:
10. DATA DI REVISIONE DEL TESTO 07/2022
DUCRESSA “1 mg/ml + 5 mg/ml, collirio, soluzione” 1 flacone in LDPE da 5 ml con contagocce (AIC n. 047874019). Classificazione ai fini della fornitura: RR - medicinale soggetto a prescrizione medica. Classe ai fini della rimborsabilità: classe C. Prezzo al pubblico (IVA inclusa): € 20,90 in vigore dal 15/01/2025
Depositato in AIFA in data 07/02/2024 - Codice AIFA: DUC-IT-230005




