






Massimo Camellin, Umberto Camellin
venerdì 19 aprile ore 18.30
Hotel Ergife Roma
Zona Atrium
Area Interviste
Eyesee - Giornale Italiano di Oftalmologia
Segue aperitivo



Quando la lacrima non basta
Carlo Orione
ReLex SMILE: la chirurgia refrattiva All-Femto
Massimo Mammone, Marco Fantozzi
Nuove frontiere nella terapia conservativa del cheratocono: rimodellamento corneale con laser ad eccimeri transepiteliale guidato dal Ray-Tracing combinato con crosslinking accelerato pulsato a guida pachimetrica 18
Cosimo Mazzotta
Le congiuntiviti allergiche in età pediatrica
Luca Buzzonetti, Sergio Petroni
Medicina di precisione nella pratica clinica ambulatoriale mediante citologia congiuntivale 32
Arianna De Rossi, Anna Miglietta, Matteo Gelardi
Colliri contenenti olio ozonizzato in liposomi riducono la formazione di biofilm, la selezione di batteri resistenti agli antibiotici e l’adesione batterica alle cellule corneali umane 38
Valentina Gentili
A tu per tu 46
Vittorio Picardo intervista Grazia Pertile
La miopia in età pediatrica 50
Roberto Caputo, Massimiliano Serafino, Paolo Nucci
La chirurgia del glaucoma negli ultimi 50 anni: perché la trabeculectomia è ancora il gold standard 54
Emilio Balestrazzi, Luigi Mosca, Maria Ilaria Giannico, Alessandra Mastrocola, Patrizio Bernardinelli, Angelo Balestrazzi
Modello organizzativo dei trattamenti intravitreali
Carlo Cagini, Giuseppe De Filippis
Efficacia di un integratore orale multicomponente nella terapia delle degenerazioni vitreali dopo capsulotomia yag laser
Alex Malandrini, Davide Marini, Dario Zappalà, Christian Crudale, Giulia Spadavecchia, Gian Marco Tosi
Web identity dei medici millennials
Giordano Fanton
Giustizia è fatta
Vincenzo De Vitto
Splash
Approfondimenti in collaborazione con le aziende del settore
Board
M. Borgioli
L. Menabuoni
S. Zuccarini
G. Alessio
D. Bacherini
A. Balestrazzi
A. Malandrini
G. Marchini
A. Galan
L. Mosca
R. Mastropasqua
V. Picardo
R. Protti
M.C. Savastano
Editore
FGE S.r.l
Fabiano Gruppo Editoriale
Redazione: Strada 4 Milano Fiori, Palazzo Q7 20089 Rozzano (MI)
Sede legale: Regione Rivelle, 7 14050 Moasca (AT) Tel. 0141 1706694 - Fax 0141 856013
Pubblicità info@fgeditore.it tel. 0141 1706694
Direttore responsabile
Ferdinando Fabiano f.fabiano@fgeditore.it
68
76
78
53
Registrazione presso il Tribunale di Asti N. 02/2024 in data 14 marzo 2024
© Copyright FGE srl È vietata ogni riproduzione totale o parziale di testi e immagini

Copia omaggio
nelle alterazioni del corpo vitreo associate a miodesopsie, fosfeni e DPV di natura fisiologica o iatrogena.
FASE 1
VITREOLISINAforte
1 cpr al dì per due mesi
Per favorire il ripristino strutturale del vitreo

FASE 2
VITREOLISINAidro
1 cpr al dì per due mesi
Per il mantenimento delle condizioni siologiche del vitreo



Carissimi colleghi e amici, abbiamo felicemente superato il battesimo, la nostra rivista è stata molto apprezzata e richiesta da molti di voi. Grazie, questo ripaga l’impegno e la dedizione che ci abbiamo messo e così continueremo.
Di questo secondo numero, ne abbiamo ritardato l’uscita per farlo corrispondere al congresso SISO a cui teniamo molto, numerosi saranno gli argomenti che spazieranno tra le varie patologie oculari; particolare rilievo è stato dato alla vincitrice della migliore relazione allo scorso congresso AIMO: “Medicina di precisione nella pratica clinica ambulatoriale mediante citologia congiuntivale” di Arianna De Rossi e coll.
L’intervista, il nostro a tu per tu, l'abbiamo fatta alla bravissima Pertile, leggetela è davvero interessante.
Nel prossimo numero, per seguire il criterio che ci siamo prefissi, cioè di intervistare a rotazione un maestro (uomo e donna) e poi un giovane emergente, toccherà ad un oculista che ha già girato in largo il mondo per farsi esperienza, sentiremo cosa avrà da raccontarci.
Vi auguriamo buona lettura confidando di trovare ancora il vostro positivo riscontro.
Luca e Silvio

Come dice il mio amico Rolando Toyos “L'occhio secco è una malattia cronica infiammatoria della pelle e delle ghiandole che è anche influenzata da problemi sistemici che portano ad una scarsa produzione lacrimale.
Un film lacrimale anormale può devastare la superficie oculare, portando ad una diminuzione della visione, al dolore ed alla difficoltà a svolgere le attività quotidiane.
Il miglior trattamento è un approccio plurifattoriale unico e a lungo termine che è adattato alle specifiche esigenze di ciascun paziente”.
Per questo motivo il sostituto lacrimale, anche se importante, non è quasi mai sufficiente da solo a risolvere il problema.
Un’anamnesi accurata ed appositi test sono basilari per cercare di capire le cause ed il tipo di Dry Eye: se il paziente ha più fastidio al mattino probabilmente

sarà evaporativo, se la sera sarà, probabilmente, da ipoproduzione, anche se la maggior parte di pazienti con occhio secco sono di tipo misto.
Tra i vari test ritengo importanti la misurazione del NIBUT (BUT non invasivo) per valutare in ogni punto della superficie oculare il tempo di evaporazione della lacrima, la MEIBOMIOGRAFIA per testare il numero e la funzionalità delle Ghiandole del Meibomio presenti nelle palpebre, il Test di SHIRMER per misurare la produzione lacrimale in 5 minuti, il questionario OSDI per valutare la gravità dei sintomi, la misurazione del MENISCO LACRIMALE per misurare quanta lacrima rimane nell’occhio, la SENSIBILITÀ CORNEALE misurata toccandone la superficie con un filo, l’INTERFEROMETRIA, per valutare la composizione e la qualità della lacrima, l’OSMOLARITÀ che misura la concentrazione dei soluti nelle lacrime sempre elevati nel Dry Eye, la BIOMICROSCOPIA DIGITALIZZATA per fotografare e studiare la superficie oculare tramite test di colorazione del film lacrimale, delle cellule corneali e congiuntivali, il DENSITY MEIBUM GRADE (DMG), che ho classificato con mio figlio Matteo per valutare il grado di salute delle Ghiandole del Meibomio (GHM) controllando la densità del meibum. Con un’apposita pinza eseguo uno squeezing (spremitura) sulle GHM e ne valuto, in una scala da zero a 5, la densità dove 0 è un Meibum normale, oleoso, 1 più denso, 2 molto denso con una consistenza tipo dentifricio giallastro, 3 denso biancastro, 4 a filamenti con ghiandole che si stanno chiudendo e 5 nessun meibum fuoriesce in quanto le ghiandole sono chiuse.
Una delle cause più frequenti di Dry EYE è la rosacea del bordo palpebrale e, a volte, di tutto il viso. In questo caso il trattamento di prima scelta è la Luce

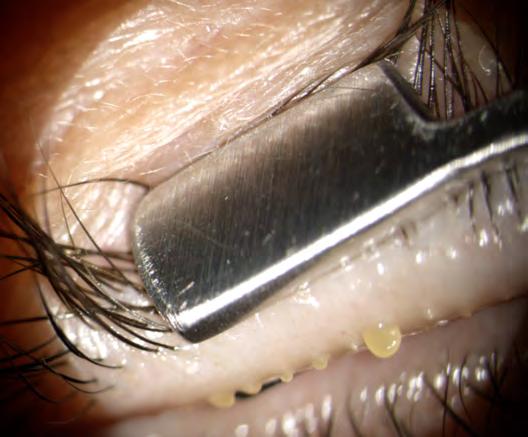

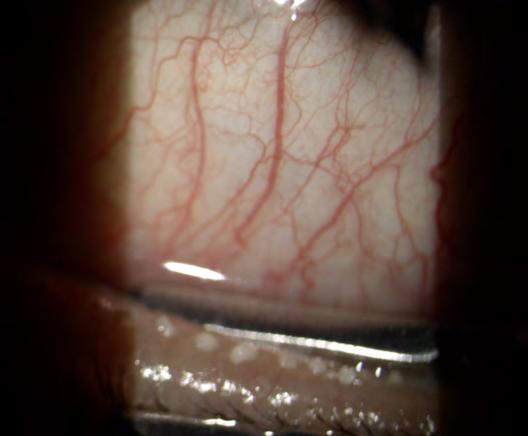


Pulsata (IPL) in quanto la sola lacrima artificiale non risolve la patologia.
La Luce Pulsata regolarizza la secrezione delle ghiandole del Meibomio, agendo sull'ATP cellulare, inoltre le scalda favorendone la disostruzione tramite lo squeezing successivo, stimola il sistema parasimpatico a produrre più lacrime e, soprattutto, elimina le teleangectasie del bordo palpebrale, principale causa della Disfunzione delle Ghiandole del Meibomio (MGD), anche quando non sono visibili ad occhio nudo.
Questi vasellini anomali producono citochine e chemochine che richiamano cellule infiammatorie alimentando il circolo vizioso infiammatorio che porta alla cheratinizzazione delle ghiandole del Meibomio rendendole più aggredibili dai batteri e favorendo l'insorgenza della Blefarite o della Meibomite.
Questa condizione patologica riduce la parte oleosa della lacrima esitando in una precoce evaporazione della stessa con conseguente occhio secco.
Questi vasi anomali, inoltre, si trovano molto spesso anche nel derma del terzo medio del volto ed è per questo motivo che si consiglia di effettuare molti spots (in media 30 per ogni trattamento, da trago a trago per 2 volte) in modo da chiudere anche quelli non visibili.
Rolando Toyos, dal 2001 al 2007, ha sperimentato diversi protocolli e parametri di utilizzo della IPL per il Dry Eye dovuto a MGD ed ha ottenuto il più elevato tasso di successo eseguendo, per ogni paziente, 4 trattamenti da trago a trago per 2 volte consecutive (25 spot compreso il naso) seguiti dallo squeezing delle ghiandole con filtro a 590nm. (per raggiungere la zona vascolare), con potenze variabili da 8 a 25 J/


cm2 a seconda della gravità della MGD, con lunghezza dell'impulso pari a 5ms., a distanza di un mese uno dall'altro per evitare di irritare la cute con sedute troppo ravvicinate.
In caso di Rosacea viene migliorata anche questa patologia effettuando gli circa 40 spots sull’intero volto. La Luce Pulsata ha dato guarigione completa nel 60% dei pazienti trattati, notevole miglioramento nel 25% e non ha avuto effetto solo nel 15% dei pazienti trattati. Dopo le 4 sedute è possibile, se occorre, ripetere una o più sedute a distanza di mesi, ma la maggior parte dei pazienti non ne hanno più avuto bisogno.
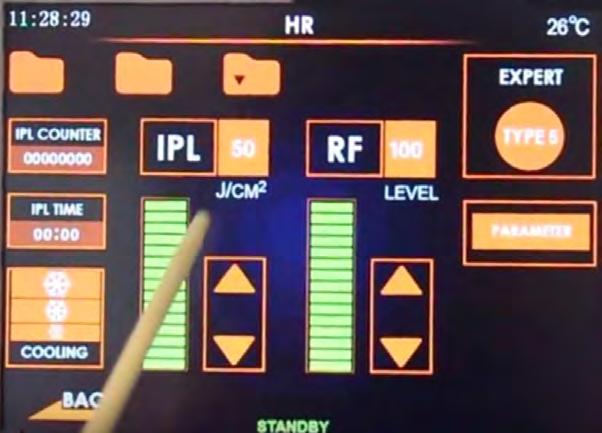
Nel 2017 ho personalmente collaborato allo sviluppo di una nuova macchina a luce pulsata per la cura dell’occhio secco che è stata presentata nel mese maggio 2018, la IPLRF DRY EYE DUAL SYSTEM, distribuita da EB Medical, che presenta caratteristiche del tutto innovative.
Questa IPL ha la possibilità di erogare sino a 50 joule/cm2 potendo incrementare la velocità dell'impulso da 1 a 15 ms. Questo è possibile grazie ai ben tre diversi sistemi di raffreddamento – ad aria, ad acqua e cooling gel – regolabile a 5 intensità, che permettono di lavorare a potenze molto più elevate con il vantaggio di poter personalizzare il trattamento in base alla gravità della patologia.
Altra caratteristica importantissima di questo strumento è la possibilità di lavorare con diversi filtri (6 filtri: 430, 480, 530, 590, 640, 750 nm), per decidere a che profondità agire nel tessuto. La IPL, infatti, agisce dall'esterno verso l'interno ed il filtro esercita la funzione detta di “CUT OFF” che impedisce alla luce di penetrare nei tessuti oltre la zona che si vuole trattare. La tecnologia che però la rende unica è quella di poterla utilizzare in doppia modalità: solo IPL o IPLRF, vale a dire in combinazione con la Radiofrequenza che agisce in maniera opposta alla IPL, dall'interno verso l'esterno.
Questa sua singolare e innovativa versatilità ci permette di ottenere un doppio effetto di riscaldamento sulle ghiandole del Meibomio agendo in maniera molto più efficace.
Recenti studi, inoltre, hanno dimostrato come la Radiofrequenza agisca sui nervi della Ghiandola Lacrimale principale stimolando una maggior secrezione, e rendendo utile questa macchina anche per chi ha un occhio secco da ridotta produzione lacrimale. Per questo motivo ho redatto un protocollo che prevede, in ogni trattamento, una combinazione della IPL con la Radiofrequenza (IPLRF Dual Mode) con una potenza da 10 a 100 watt tenendo conto del fototipo del paziente (la macchina permette la scelta tra 5 fenotipi differenti) e della profondità che vogliamo raggiungere (6 possibilità di scelta cambiando i filtri).
Un’altra funzione della IPL si è dimostrato essere la capacità di agire sul DEMODEX, un parassita presente nei follicoli delle ciglia e nelle GHM, che causa blefarite e perdita delle ciglia.
Quando la sola luce pulsata non é sufficiente si puó associare la Tecnica di Maskin, il Probing 1 delle Ghiandole del Meibomio, per ripulirle dai sedimenti che possono averle occluse oppure il Probing 2 dove, oltre ad aprire le ghiandole viene iniettato in ognuna

di esse un collirio antibiotico cortisonico o PRP. L’ultima novità tecnologica disponibile dal 2023 in Italia si chiama JETT-PLASMA.
Questa nuovissima tecnologia permette una decheratinizzazione del bordo palpebrale che apre le GHM tramite gas ionizzato senza contatto e scioglie il Meibum denso presente nelle ghiandole stesse.
Il plasma è il quarto stato della materia dove gli elettroni si separano dagli atomi per formare un gas ionizzato.
Il flusso del Plasma stimola la formazione di nuovo collagene e di fibre di elastina riducendo così l’infiammazione dei tessuti e procurando molti altri benefici. Vi sono 2 tipi di trattamento molto differenti a seconda se si è a contatto o meno del tessuto.
Tra 1 e 4 mm. dai tessuti cutanei o mucosi viene generato un raggio plasma molto concentrato che sublima il tessuto permettendo di eliminare la metaplasia squamosa e o il tessuto cicatriziale che bloccano gli orifizi delle GHM.
Quando, invece, utilizziamo gli elettrodi a contatto otteniamo un effetto triplo: riscaldamento, elettroporazione reversibile e depolarizzazione delle membrane cellulari.
La corrente continua produce una vibrazione cellulare liberando energia e aumentando la temperatura interna fino a 45 gradi.
Lo scambio di polarità di membrana permette la penetrazione di sostanze all’interno della cellula.
Le cellule a riposo hanno un potenziale di membrana negativo.
Quando invecchiano perdono il loro potenziale di membrana alterando i canali del sodio e del potassio e la loro capacità di introdurre sostanze nutrienti al loro interno.
Aprendo i canali elettricamente, il potenziale di membrana cellulare viene ripristinato.

Questa tripla azione è molto utile per il trattamento della MGD perché svuota le ghiandole dal Meibum denso e le ringiovanisce in modo che possano produrre un Meibum chiaro e oleoso.
Il miglior risultato si ottiene effettuando 3 trattamenti a distanza di 1 mese uno dall’altro. Anche gli integratori possono aiutare i pazienti con Dry Eye.
Thomas Edison diceva: "Il medico del futuro non si limiterà a prescrivere farmaci, ma indurrà ad interessarsi maggiormente alla causa ed alla prevenzione delle malattie attraverso l'alimentazione."
In USA prescrivono la Nicotinamide (NAD) in compresse una volta al giorno per migliorare la sintomatologia del Dry Eye.
Il NAD è un regolatore centrale del metabolismo energetico che si è dimostrato essere coinvolto nella riparazione del DNA aumentando la durata di vita dei topi, diventando così un integratore anti-invecchiamento. Alcuni studi dimostrano che il NAD diminuisce fino al 50% tra i 40 e i 60 anni. Uno studio pubblicato su Nature Cell Biology dimostra che il NAD può aiutare le cellule che invecchiano a ripararsi.
Il CoQ10 è un coenzima necessario per alimentare i mitocondri. È anche un antiossidante che rigenera la vitamina C ed E. Il nostro corpo utilizza la HMGCoA reduttasi per produrre il CoQ10. Si ritiene che i pazienti affetti da DED possano trarre beneficio dall'integrazione perché stiamo cercando di far ripartire le cellule responsabili della produzione delle nostre lacrime naturali.
L’utilizzo degli OMEGA3 nella DED è invece controverso. Gli ultimi studi affermano che agisca solo come antinfiammatorio e non migliorando la parte oleosa della lacrima.
Per concludere, ritengo che l’obiettivo primario della terapia del Dry Eye sia di capirne le cause e di intervenire su quelle per fare in modo che la quantità e la qualità della nostra lacrima migliori, ricordandoci che le lacrime naturali sono nettamente migliori rispetto a qualsiasi lacrima artificiale che contiene solo alcune delle 2000 molecole presenti nella nostra, per questo motivo le lacrime artificiali devono essere utilizzate come rimedio temporaneo, ma la terapia deve mirare a fare in modo che si ristabilizzi una produzione di un film lacrimale normale.
Bibliografia
- Intense Pulsed Light Treatment for Dry Eye Disease Due to Meibomian Gland Dysfunction; A 3-Year Retrospective Study; Photomedicine and Laser Surgery, January 2015 Rolando Toyos, MD, William McGill, PhD and Dustin Briscoe, OD
- Intense pulsed light therapy for the treatment of evaporative dry eye disease. Curr Opin Ophthalmol. 2015 Jul Vora GK, Gupta PK.
- Prospective trial of intense pulsed light for the treatment of meibomian gland dysfunction. Invest Ophthalmol Vis Sci. 2015 Feb. Craig JP, Chen YH, Turnbull PR.
- Outcomes of intense pulsed light therapy for treatment of evaporative dry eye disease. Canadian Journal of Ophthalmology, Gennaio 2016. Preeya K. Gupta, MD, Gargi K. Vora, MD, Cynthia Matossian, MD, Michelle Kim, MD, Sandra Stinnett, DrPH
- Combination Therapy of Intense Pulsed Light Therapy and Meibomian Gland Expression (IPL/MGX) Can Improve Dry Eye Symptoms and Meibomian Gland Function in Patients With Refractory Dry Eye: A Retrospective Analysis. Cornea, Marzo 2016. Vegunta S, Patel D, Shen JF.
- Evaluation of the Safety and Effectiveness of Intense Pulsed Light in the Treatment of Meibomian Gland Dysfunction. Journal of Ophthalmology, Giugno 2016. Xiaodan Jiang, Huibin Lv, Hang Song, Mingzhou Zhang, Yan Liu, Xiaodan Hu, Xuemin Li and Wei Wang
- Studio presentato SOPANOP Cancun Aprile 2017. IPL e IPLRF: risultati a confronto. C. Orione, M. Orione - Nizza M.to, Genova
- Investire Ophthalmol Vis Sci. 2015 12 Feb; 56 (3): 1965-1970. doi: 10,1167 / iovs.14-15764. Studio prospettico di luce pulsata per il trattamento della disfunzione della ghiandola di Meibomio. Craig JP, Chen YH, Turnbull PR
- Schaumberg DA, Nichols JJ, Papas EB, Tong L, M Uchino, Nichols KK. Il workshop internazionale sulla ghiandola di Meibomio disfunzione:. Relazione della sottocommissione sull'epidemiologia, e fattori di rischio associati per, MGD Invest Ophthalmol Vis Sci. 2011; 52: 1994-2005.
- Shimazaki J, M Sakala, cambiamenti della superficie Tsubota K. oculari e il disagio nei pazienti con disfunzione delle ghiandole di Meibomio. Arch Ophthalmol. 1995; 113: 1266-1270.
- Geerling G, J Tauber, Baudouin C, et al.Il workshop internazionale sulla ghiandola di Meibomio disfunzione:. Relazione della sottocommissione per la gestione e il trattamento della disfunzione della ghiandola di Meibomio Investire Ophthalmol Vis Sci. 2011; 52: 2050-2064.
- Gipson IK, Argüeso P, Beuerman R, et al. La ricerca in secchezza oculare: rapporto della sottocommissione di ricerca del Workshop Internazionale Dry Eye (2007) Ocul Surf.. 2007; 5: 179-193.
- Obata H. Anatomia e istopatologia della ghiandola di Meibomio umana. Cornea. 2002; 21: S70-S74.
- Borchman D, Foulks GN, Yappert MC, Milliner SE. Le differenze nella composizione umana meibum lipidica con disfunzione delle ghiandole di Meibomio con NMR e analisi delle componenti principali. Investire Ophthalmol Vis Sci. 2012; 53: 337-347.
- Graham JE, Moore JE, Jiru X, et al. Patogeno oculare o commensale:. Uno studio basato-PCR di superficie flora batterica occhi normali e secche Invest Ophthalmol Vis Sci. 2007; 48: 5.616-5.623.
- Mathers WD, Shields WJ, Sachdev MS, Petroll WM, Jester JV. Disfunzione della ghiandola di Meibomio in blefarite cronica. Cornea. 1991; 10: 277-285.
- Blackie CA, Korb DR, Knop E, Bedi R, N Knop, Olanda EJ. Non ovvia ostruttiva disfunzione delle ghiandole di Meibomio. Cornea. 2010; 29: 1333-1345.
- Knop E, Knop N, Millar T, H Obata, Sullivan DA. Il workshop internazionale sulla ghiandola di Meibomio disfunzione:. Relazione della sottocommissione di anatomia, fisiologia e fisiopatologia della ghiandola di Meibomio Invest Ophthalmol Vis Sci. 2011; 52: 1938-1978.
- Smith RE, fiori CWJr. Blefarite cronica: una recensione CLAO J 1995;.. 21: 200-207.
- Arciniega JC, Wojtowicz JC, Mohamed EM, McCulley JP. Le variazioni del tasso di evaporazione del film lacrimale dopo espressione delle ghiandole di Meibomio digitale in pazienti con e senza occhio secco. Cornea. 2011; 30: 843-847.
- Bilkhu PS, Naroo SA, Wolffsohn JS. Effetto di un impacco caldo disponibile in commercio dalla temperatura palpebra e film lacrimale in occhi sani. Optom Vis Sci. 2014; 91: 163-170.
- Romero JM, Biser SA, Perry HD, et al. Il trattamento conservativo di disfunzione della ghiandola di Meibomio. Contatto con gli occhi della lente. 2004; 30: 14-19.
- Olenik A, Mahillo-Fernández I, Alejandre-Alba N, et al. Benefici di acidi grassi omega-3 supplementazione dietetica di salute connessi qualità della vita nei pazienti con disfunzione della ghiandola di Meibomio. Clin Ophthalmol. 2014; 8: 831-836.
- Sobolewska B, Doycheva D, Deuter C, Pfeffer io, Schaller M, Zierhut M. trattamento della rosacea oculare con una volta al giorno doxiciclina a basso dosaggio. Cornea. 2014; 33: 257-260.
- Raulin C, Greve B, Grema tecnologia H. IPL:. Una recensione Laser Surg Med. 2003; 32: 78-87.
- Wat H, Wu DC, Rao J, Goldman MP. Applicazione della luce pulsata per il trattamento della malattia dermatologica:. Una revisione sistematica Dermatol Surg. 2014; 40: 359-377.
- Schroeter CA. Haaf-von Below S, Neumann HAM. Efficace trattamento della rosacea con intensi sistemi a luce pulsata. Dermatol Surg. 2005; 31: 1285-1289.
- Tomlinson A, AJ Bron, Korb DR, et al. Il workshop internazionale sulla ghiandola di Meibomio disfunzione:. Relazione della sottocommissione diagnosi Invest Ophthalmol Vis Sci. 2011; 52: 2006-2049.
- Roberts WE. Sistemi di classificazione tipo di pelle vecchia e nuova. Dermatol Clin. 2009; 27: 529-533.
- Ngo W, P Situ, Keir N, D Korb, Blackie C, proprietà Simpson T. psicometriche e la validazione della valutazione standard di paziente di secchezza oculare questionario. Cornea. 2013; 32: 1204-1210.
- Gupta PK, Vora GK, Stinnett SS. I risultati di intensa terapia luce pulsata per il trattamento della malattia di evaporazione dell'occhio secco. In: ASCRS-ASOA Symposium & Congress. Boston, MA: American Society of Cataract e Chirurgia Refrattiva; 2014. astratta 6388.
- Toyos R. Intenso, luce pulsata per la sindrome dell'occhio secco. Cataract & Chirurgia refrattiva oggi. Http://crstoday.com/2009/04/ CRST0409_14.php. Pubblicato aprile 2009. Accessed 31 LUGLIO 2013.
- Toyos R, Buffa CM, Youngerman SM. Case report: sintomi secco occhio migliorano con il trattamento a luce pulsata intensa EyeWorld.. Http://www.eyeworld.org/article.php?sid=2698. Pubblicato settembre 2005. Accessed 31 luglio 2013.
- Craig JP, Tomlinson A. Importanza dello strato lipidico della stabilità del film lacrimale umano e l'evaporazione. Optom Vis Sci. 1997; 74: 8-13.
- Pflugfelder SC, Tseng SCG, Sanabria O, et al. Valutazione delle valutazioni soggettive e test diagnostici oggettivi per la diagnosi di disturbi allo strappo di film noti per causare irritazione oculare. Cornea. 1998; 17: 38-56.
- Pepose JS, Sullivan BD, Foulks GN, Lemp MA. Il valore di osmolarità lacrimale come metrica per valutare la risposta alla terapia con occhio asciutto nella clinica e negli studi clinici. Am J Ophthalmol. 2014; 157: 4-6.e1.
- Farrell HP, Garvey M, Cormican M, Laffey JG, Rowan NJ. Indagine su fattori critici interconnessi che influenzano l'efficacia della luce pulsata per inattivare batteri patogeni clinicamente rilevanti. J Appl Microbiol. 2010; 108: 1494-1508.
- Chung H, Dai T, S Sharma, Huang YY, Carroll J, Hamblin M. I dadi e bulloni di basso livello del laser (luce) Terapia. Ann Biomed Eng. 2012; 40: 516-533.
- Wakamatsu TH, Dogru M, Matsumoto Y, et al. La valutazione di lipidi ossidativo stato di stress nei pazienti con sindrome di Sjogren. Investire Ophthalmol Vis Sci. 2013; 54: 201-210.
- Hamblin MR, Huang YY, Sharma SK, Carroll J. bifasico dosare risposta a basso livello di luce terapia a un aggiornamento. Dose Response. 2011; 9: 602-618.
- Hamblin MR, Demidova TN. Meccanismi di terapia della luce a basso livello. Scienze foto biologia online. Pubblicato il 14 agosto 2008. Disponibile all'indirizzo: http://www.photobiology.info/Hamblin.html. Accessed 21 lug 2014.
- Prospective evaluation of intense pulsed light and meibomian gland expression efficacy on relieving signs and symptoms of dry eye disease due to meibomian gland dysfunction. Clin Ophthalmol., Maggio 2017. Dell SJ, Gaster RN, Barbarino SC, Cunningham DN.
- Toyos Dry Eye Diet: What to Eat to Heal your Dry Eyes (Dry Eye Disease Treatment in the Year 2020 Book 1)
La storia della chirurgia refrattiva ha attraversato diverse fasi di sviluppo, ciascuna caratterizzata da miglioramenti tecnologici e metodologici.
Il passaggio dalla poco prevedibile chirurgia manuale incisionale ad una metodica completamente laser assistita e con risultati ripetibili ed efficaci, ha consentito il notevole diffondersi di questa branca dell’oftalmologia in maniera esponenziale a livello mondiale. Una delle più moderne ed innovative tecniche chirurgiche refrattive è rappresentata appunto dalla ReLEx SMILE ovvero una procedura All-Femto che consente l’estrazione di un lenticolo corneale a scopo refrattivo (REfractive Lenticule EXtraction) attraverso una piccola incisione (Small Incision Lenticule Extraction).
La SMILE è stata introdotta per la prima volta da un gruppo di ricercatori guidati dal professor W. Sekundo nel 2011 e ad oggi risultano ormai eseguite con pieno successo oltre 8 milioni di procedure in tutto il mondo.1 (fig. 1).
Oltre ad una serie di vantaggi, che proveremo a sottolineare in questo articolo, questa metodica ha acquisito sempre più interesse in campo chirurgico

Figura 1

poiché in grado di porsi perfettamente tra la PRK e la Lasik (Femtolasik) non dovendo gestire il prolungato discomfort post-operatorio da un lato né le, seppur molto rare, complicanze legate al flap dall’altro, essendo difatti questa una tecnica completamente “flapless”.
La SMILE è difatti una tecnica minimamente invasiva e come sottolineato da Rupal Shah (MD): “SMILE is a LASIK without a flap and a PRK without pain”.2 Ridotto discomfort e rapido recupero visivo della Lasik da un lato e sicurezza biomeccanica della PRK dall’altra.
Stiamo assistendo negli ultimi anni alla messa in commercio di diversi laser a femtosecondi in grado di offrire una procedura intrastromale ALL-Femto e sembra giusto e doveroso sottolineare a questo punto come il termine SMILE, sia legato esclusivamente alla ReLex eseguita con piattaforme laser ZEISS (Visumax 500 - Visumax 800) e che tale acronimo non valga per tutte le altre ReLex eseguite con altre piattaforme laser presenti oggi sul mercato (Schwind, Ziemer, Johnson & Johnson); ovvero la tecnica chirurgica intrastromale di per sé non è tanto la SMILE ma appunto la ReLex che, se eseguita con laser Schwind avrà il nome di SmartSight, se eseguita con laser Ziemer avrà il nome di CLEAR (Corneal Lenticule Extraction for Advanced Refractive Correction) e se eseguita infine con laser a femtosecondi di Johnson & Johnson avrà il nome di SILK (Smooth Incision Lenticule Keratomileusis).
Procedura chirurgica
Come precedentemente sottolineato, la SMILE rappresenta una procedura minimamente invasiva, in quanto è necessaria solo un'incisione molto piccola (2 mm) attraverso la quale rimuovere il tessuto precedentemente scolpito dal laser, senza la necessità di creare un flap corneale come nella LASIK. I range di correzione dipendono dalle caratteristiche

individuali degli occhi dei pazienti e dalle specifiche capacità del laser femtosecondi utilizzato. La procedura può correggere miopie di vario grado, fino a 10 diottrie per la miopia e fino a 5 diottrie per l’astigmatismo miopico con equivalente sferico finale al massimo di 12,5 D.3 È importante notare che la scelta della correzione dipenderà dalla valutazione del chirurgo e dalle caratteristiche specifiche di ciascun paziente. La pianificazione accurata del trattamento in base ai range di correzione consentiti è parte integrante della fase di preparazione del paziente. Ad oggi non esiste ancora la possibilità di correggere comunque difetti ipermetropici anche se in letteratura sono pubblicati dati incoraggianti in tal senso.4

La procedura si sviluppa in tre momenti fondamentali: fase del docking, fase di erogazione laser, fase di slamellamento ed estrazione del lenticolo.
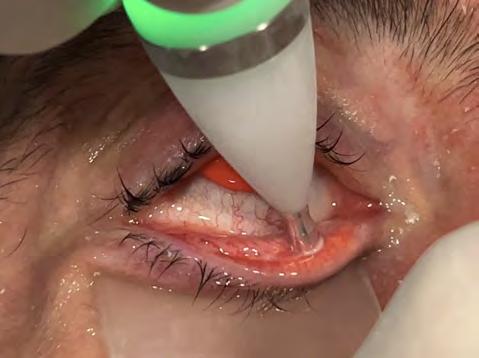
Dopo adeguata anestesia topica il paziente viene posizionato sul lettino operatorio con la richiesta di fissare in direzione di una luce verde lampeggiante in modo tale da centrare il trattamento sul riflesso di Purkinje (Coassialy Sighted Corneal Light Reflex) ovvero il vertice corneale (Fig. 2). Non appena il cono del docking, mediante lente curva, tocca la cornea inizia ad apparire il menisco lacrimale. Tale menisco aiuta molto sia nella centratura del trattamento (menisco sempre concentrico al led verde) sia per capire quando attivare la funzione Suction-on (momento in cui il cono viene saldamente agganciato al bulbo oculare).
La pressione di aspirazione generata dal sistema laser VisuMax è di circa 35 mmHg. È in questa fase che, dopo attivazione del sistema Suction-On, può essere eseguita la compensazione manuale per il controllo della ciclotorsione statica in caso di astigmatismo significativo.
In prima battuta viene delineata la faccia posteriore del lenticolo (quella più profonda) con impulsi laser che procedono in maniera centripeta. Il passaggio successivo prevede la scolpitura delle spalle del lenticolo e del cap (tetto del lenticolo - parte più superficiale) con impulsi che stavolta decorrono in maniera centrifuga.
Infine, viene delineata proprio la Small Incision. Questa incisione serve da punto di ingresso per il chirurgo che provvederà a slamellare e rimuovere il lenticolo (Fig. 3 a-b-c).


Slamellamento ed estrazione del lenticolo
Alla fine del trattamento laser, che in genere dura circa 28-29 secondi (VisuMax 500 kHz), il chirurgo procederà con lo slamellamento e quindi la rimozione del lenticolo attraverso l'incisione di accesso. Questo processo richiede abilità e precisione, motivo per cui la learning curve di questa metodica appare essere piuttosto alta rispetto alle precedenti tecniche descritte. I passaggi corretti prevedono lo scollamento prima della faccia anteriore del lenticolo (quella più superficiale) e successivamente di quella posteriore (più profonda) su tutti i 360° al fine di non lasciare ponti residui o eventuali frammenti del lenticolo nella tasca.
Quali i possibili vantaggi della SMILE?
La tecnica SMILE ha guadagnato notorietà e popolarità tra i medici oculisti grazie ad alcuni vantaggi in grado di offrire rispetto ad altre procedure chirurgiche refrattive come la LASIK e la PRK.
Minore Impatto sulla Biomeccanica Corneale
Pur essendoci ancora alcune riserve in ambito scientifico, concettualmente la tecnica SMILE avrebbe come principale vantaggio il minore impatto sulla struttura biomeccanica della cornea rispetto ad altre tecniche intrastromali. A differenza della LASIK, infatti, che richiede la creazione di un flap negli strati più superficiali della cornea (già di per sé penalizzante in tal senso), nella SMILE si crea solo una piccola incisione (2 mm) per la rimozione del lenticolo in tale sede. Inoltre, in questa tecnica, la creazione
del lenticolo rifrattivo avviene nello stroma corneale più profondo, in genere dopo i 130-140 micron anteriori, lasciando preservate le lamelle stromali più superficiali (strong cornea).5
Proprio per tale motivo, alcuni autori, suggeriscono questa tecnica particolarmente in miopie medio-elevate rispetto alla Lasik (fig. 4).6
Numerosi lavori scientifici evidenziano senza dubbio un minor rischio di Dry Eye post-operatorio della SMILE rispetto ad altri interventi laser (specie flap-related). La rigenerazione delle fibre nervose sub-basali è più rapida e i sintomi dell'occhio secco, se presenti, sono più lievi e meno duraturi nel tempo.
Il flap infatti prevede, di per sé, la resezione di tessuto corneale e quindi di terminazioni nervose dello strato basale e sub-basale per circa 310°. La SMILE comporta una minore interruzione dei nervi corneali grazie alla sola presenza di un’incisione di piccole dimensioni (circa 20-30°) e questo si traduce inevitabilmente in un minore rischio di secchezza oculare a lungo termine e più rapido ripristino della sensibilità corneale. Di riferimento in tal senso lo studio condotto, con microscopia confocale, dal gruppo del professor L. Mastropasqua che evidenzia la netta differenza di velocità di reinnervazione tra la SMILE e la LASIK (Fig. 5).7
Il minore impatto sulla superficie oculare rende la SMILE un'opzione più indicata per i casi con lieve secchezza oculare preesistente.8-9


Aberrazioni sferiche contenute
Le aberrazioni corneali possono influenzare negativamente la qualità visiva post-operatoria e molti studi hanno dimostrato come la SMILE possa comportare una minore induzione di aberrazioni corneali di alto ordine, con particolare riferimento alla aberrazione sferica, rispetto alla LASIK. Ciò si traduce inevitabilmente in una migliore qualità visiva dei pazienti specie in condizioni scotopiche e una migliore sensibilità al contrasto.10-11
I pazienti con pupille medio-grandi sono inclini a sperimentare riflessi e aloni dopo LASIK a causa dell'aumento delle aberrazioni sferiche e, particolarmente in questi casi, la SMILE può essere preferita. In uno studio condotto dal professor D. Reinstein a

parità di zona ottica e di difetto miopico trattato la SMILE sembrerebbe indurre circa il 64% in meno di aberrazioni sferiche rispetto alla tecnica LASIK.12
La tecnica IELM
Uno dei talloni di Achille per la tecnica SMILE, eseguita con Laser a Femtosecondi VisuMax (Zeiss), è sempre stato il controllo della ciclotorsione statica per il corretto allineamento dell’asse dell’astigmatismo da correggere. Non avendo difatti al momento questa piattaforma, un sistema di Eye Tracker integrato bisogna inevitabilmente premarcare la cornea con pennino dermografico in fase perioperatoria. Troviamo molto comodo e affidabile a tal proposito marcare la cornea con una metodica pensata dal nostro team mediante tecnica da noi definita: IELM (Intra Epithelial Laser Marking).
Utilizzando il laser ad eccimeri Amaris (Schwind Eye Tech-Solutions) disponibile nella stessa sala operatoria e il suo potente e preciso Eye tracker, eseguiamo una procedura che descriviamo come PTK focale intraepiteliale (40 micron) sul meridiano 0-180° (Fig. 6). Le due piccole aree ablate (solo a livello epiteliale e senza intaccare la Bowman) risultano essere equidistanti circa 4 mm dal vertice corneale per poter cadere all’interno della superficie visualizzata attraverso la lente del cono del docking (Fig. 7). Tali aree saranno quindi facilmente identificate e marcate con inchiostro per essere più visibili durante il trattamento laser (Fig. 8).
In tal modo risulta semplice, immediato e soprattutto preciso l’allineamento del laser sull’asse del cilindro da correggere.


Una volta infatti attivata la fase Suction-on basterà ruotare manualmente il Joystick della guida laser per far combaciare l’asse 0-180° del laser stesso con l’omonimo asse corneale premarcato.
Conclusioni
La ReLex SMILE è sicuramente entrata ormai a pieno titolo nell’armamentario della moderna chirurgia corneale laser assistita. Da quando nel 2006 sono partiti i primi studi di ricerca su questa metodica sono stati pubblicati, ad oggi, numerosi lavori scientifici
validati per quanto concerne la stabilità refrattiva, la sicurezza, la ripetibilità e l’efficacia a lungo termine della capacità visiva non corretta.
Il vero ostacolo di questa chirurgia sembra essere in parte legato ancora oggi, alla lunga curva di apprendimento che, in alcuni passaggi, può diventare una piccola sfida anche in mani più esperte.
Valida nel correggere difetti miopici e astigmatismi miopici, sembra ormai non lontana, come dimostrato da alcuni lavori, la correzione anche dei difetti ipermetropici.

Bibliografia
1. Sekundo, W., Kunert, K. S., Blum, M., & Bischoff, M. Small incision corneal refractive surgery using the small incision lenticule extraction (SMILE) procedure for the correction of myopia and myopic astigmatism: results of a 6 month prospective study. British Journal of Ophthalmology 2011; 95(3), 335-339.
2. Nicolae Miruna, Filip Andrei et al. Smile-the next generation of laser vision correction. Rom J Ophthalmol. 2016 Jan-Mar;60(1):6-8.
3. Reinstein, D. Z., Archer, T. J., and Gobbe, M. Small Incision Lenticule Extraction (Smile) History, Fundamentals of A New Refractive Surgery Technique and Clinical Outcomes. Eye Vis 2014;1, 3.
4. Dan Z Reinstein, Walter Sekundo, Timothy J Archer et al. SMILE for Hyperopia With and Without Astigmatism: Results of a Prospective Multicenter 12-Month Study. J Refract Surg. 2022 Dec;38(12):760-769.
5. Shetty R, Francis M, Strofe R, et al. Corneal Biomechanical Changes and Tissue Remodeling After SMILE and LASIK. Invest Ophthalmol Vis Sci. 2017; 58(13): 5703–5712.
6. Chen M, Yu M, Dai J. Comparison of biomechanical effects of small incision lenticule extraction and laser-assisted subepithelial keratomileusis. Acta Ophthalmol. 2016;94(7):e586–e591.
7. Leonardo Mastropasqua; Mario Nubile; Niccoló Salgari; and Roberta Calienno. Preserving Corneal Neural Architecture With a Flapless Technique. CATARACT & REFRACTIVE SURGERY TODAY EUROPE JUNE 2015
8. Kobashi H, Kamiya K, Shimizu K. Dry Eye After Small Incision Lenticule Extraction and Femtosecond Laser-Assisted LASIK: Meta-Analysis. Cornea. 2017;36(1):85–91.
9. Cai WT, Liu QY, Ren CD, et al. Dry eye and corneal sensitivity after small incision lenticule extraction and femtosecond laser-assisted in situ keratomileusis: a Meta-analysis. Int J Ophthalmol. 2017;10(4): 632–638.
10. Gyldenkerne A, Ivarsen A, Hjortdal JØ. Comparison of corneal shape changes and aberrations induced By FS-LASIK and SMILE for myopia. J Refract Surg. 2015;31(4):223–229.
11. Ye MJ, Liu CY, Liao RF, et al. SMILE and Wavefront-Guided LASIK Out-Compete Other Refractive Surgeries in Ameliorating the Induction of High-Order Aberrations in Anterior Corneal Surface. J Ophthalmol. 2016;2016:8702162.
12. Dan Reinstein; Timothy Archer; Marine Gobbe. To analyze spherical aberration induction in matched myopic small incision lenticule extraction (SMILE) and sub-bowman’s femtosecond flap LASIK and correlate this to comparative relative postoperative corneal tensile strength. Volume 55, Issue 13. ARVO Annual Meeting Abstract. April 2014




Cosimo Mazzotta

– Professore associato in Oftalmologia, Professore a contratto in servizio presso la Scuola di Specializzazione in Oftalmologia dell’Università degli Studi di Siena
– Specialista Ambulatoriale per Chirurgia del Segmento Anteriore della USL Toscana Sud Est presso l’Unità Dipartimentale di Oculistica dell’Ospedale Alta Val D’Elsa, Poggibonsi (Siena)
– Fondatore, Direttore e Responsabile Scientifico del Centro di terapia Conservativa del Cheratocono e delle Ectasie Secondarie, Siena Crosslinking Center.
– Fellow del World Council of Refractive Surgeons and Visual Sciences
Introduzione
La cheratectomia fotorefrattiva e fototerapeuitica transepiteliale (t-PRK/t-PTK) combinata con il crosslinking corneale accelerato individualizzato guidato dalla pachimetria (ACXL) rappresenta un'opportunità terapeutica nuova ed in evidente espansione nei pazienti con cheratocono (KC) con scarsa o insufficiente acuità visiva corretta con gli occhiali (BSCVA) che sono intolleranti alle lenti a contatto rigide gas permeabili (RGP CL). Lo scopo di questo trattamento è migliorare l'acuità visiva non corretta (UCVA) e la acuità visiva corretta con lenti a tempiale (BSCVA) possibilmente evitando o posticipando la necessità di una cheratoplastica.1-4
La combinazione fra Ray Tracing (RT)t-PRK ed ACXL consiste in un rimodellamento corneale centrale (CCR) per via transepiteliale mediante laser ad eccimeri con approccio personalizzato e mirato, minimamente invasivo e modernamente basato sul calcolo del Ray-Tracing (tracciamento del raggio luminoso a sua volta basato sulla Legge di Snell) al fine di migliorare l'intera qualità della visione naturale e corretta con occhiali (QoV), riducendo le aberrazioni di
alto ordine (HOA), consumando la minima quantità di stroma corneale possibile che generalmente non supera i 55-60 µm. 5-7
L'uso combinato della t-PRK e t-PTK guidata dalla topografia (Topography-Guided) più crosslinking (CXL) rappresenta una realtà terapeutica eseguita in casi selezionati in molti Paesi già negli ultimi due decenni.8
Gli studi di follow-up a lungo termine hanno dimostrato l'efficacia e la sicurezza di queste due procedure nel migliorare l'UCVA e la BSCVA dei pazienti con KC, sia eseguite simultaneamente (nello stesso giorno) o in sequenza (Laser dopo almeno 6 mesi dal CXL).9-18
Il CXL, che ho avuto l’onore di introdurre in Italia nel 2004 dopo la mia fellowship all’Università Tecnica Carl Gustav Carus di Dresda, ha aperto fortunatamente la strada a questi trattamenti combinati oltre alla terapia stabilizzante del cheratocono, rafforzando lo stroma corneale e stabilizzando contestualmente la progressione della ectasia.19-21
L'ablazione laser di superficie nei pazienti con KC aggiunge una risorsa fondamentale laddove la visione
con occhiali è insufficiente donando al paziente ed al chirurgo Oftalmico una preziosissima arma terapeutica in più nella gestione di questi casi complessi. Questo trattamento combinato viene pianificato utilizzando classicamente algoritmi guidati dalla topografia corneale (topography-Guided) o dalla aberrometria (ocular wavefront), ottimizzando le zone ottiche, riducendo le aberrazioni di ordine superiore (Coma) minimizzando il consumo di tessuto stromale, oltre a migliorare l'UDVA e la BSCVA del paziente. Un altro scopo di questa opzione terapeutica consiste nel fornire al paziente e al contattologo un'altra possibilità di applicazione delle lenti a contatto su una superficie corneale rimodellata e più regolare.22
L’introduzione odierna della tecnologia Ray-Tracing nella pianificazione del trattamento rappresenta una svolta reale e tangibile, consentendo il calcolo del contributo refrattivo della superficie corneale posteriore e dell’epitelio, evitando così ipercorrezioni indesiderate, spesso riportate in letteratura con le tecniche Topography-Guided e consente la riduzione dell’ablazione del tessuto stromale con notevole risparmio tissutale, fondamentale in questi approcci terapeutici selezionati.23
L'impostazione del trattamento mira quindi alla correzione delle aberrazioni di ordine elevato (coma, trifoglio) e l'ablazione laser ad eccimeri si basa sul ray-tracing totale della cornea (wavefront corneale) o dell’occhio (wavefront biometrico) tenendo conto sia della superficie corneale anteriore che di quella posteriore, che della lunghezza assiale del bulbo, della camera anteriore e dello spessore della lente, possibilità del tutto nuove rispetto al trattamento guidato dalla topografia che utilizza solo la superficie corneale anteriore. Quest'ultimo può infatti potenzialmente indurre una correzione eccessiva per una regolarizzazione anteriore totale (full anterior regularization) delle aberrazioni corneali anteriori perché i dati della cornea anteriore non comprendono nel calcolo l'effetto compensativo della superficie corneale posteriore, basato principio dell’ottica inversa. Utilizzando il calcolo di ray-tracing del potere corneale totale in zona ottica questo non succede e si riesce a calcolare precisamente il contributo refrattivo (comatico) della cornea posteriore, migliorando il risultato refrattivo e risparmiando ulteriormente tessuto. Presento in questo lavoro i primi risultati internazionali a lungo termine recentemente pubblicati su Cornea35 sul rimodellamento corneale centrale (CCR) con laser ad eccimeri transepiteliale guidato da ray-tracing combinato con il trattamento di cros-
slinking accelerato da me sviluppato guidato dalla pachimetria (nomogramma M)24 in una serie di pazienti con KC che erano intolleranti a lenti RGP CL e avevano scadente o insufficiente acuità visiva a distanza (BSCVA) con occhiali nell’occhio peggiore4. La procedura è eseguita al fine del miglioramento della funzione visiva mediante lenti a tempiale nei pazienti con KC ed è combinata simultaneamente al CXL accelerato a guida pachimetrica e luce pulsata per indurre la stabilità dell’ectasia corneale.
Materiali e Metodi
Progettazione dello studio
Lo studio interventistico prospettico RT t-PRK più ACXL è stato approvato dall'Institutional Review Board del Siena Crosslinking Center, Siena, Italia ed ha incluso 40 occhi di 40 pazienti giovani adulti con KC in stadio II secondo la stadiazione Krumeich-Amsler,25 con un età media di 33 anni (intervallo 21-46 anni) sottoposti a t-PRK6 guidato da Ray-Tracing simultaneo più ACXL personalizzato basato sulla pachimetria (nomogramma M).24 Tutti i trattamenti riguardavano l'occhio peggiore e sono stati eseguiti presso il Siena Crosslinking Center utilizzando il laser ad eccimeri iVis Suite iRES (iVis Technologies s.r.l., Taranto, Italia). I dati diagnostici sono stati valutati utilizzando il Tomografo Precisio 2 (iVis Technologies S.r.l., Taranto, Italia) ed il Tomografo Sirius (C.S.O., Scandicci, Firenze, Italia).
Criteri di inclusione
Stadio II KC, età ≥ 21 anni, BSCVA insufficiente ≤ 0,5, linee di Snellen (SL), intolleranza alle lenti a contatto rigide gas permeabili (RGP CL), anamnesi negativa per cheratite infettiva da HSV, secchezza oculare grave, distrofie corneali associate, opacità corneali e gravidanza. Nessun precedente trattamento di CXL. Lo spessore corneale minimo (MCT) richiesto per l'arruolamento nel protocollo di trattamento è stato ≥420 µm (epitelio incluso); pertanto lo spessore residuo post-trattamento non è mai stato inferiore a 350 µm (epitelio compreso). I pazienti hanno fornito un doppio consenso informato, uno per la procedura laser t-PRK/PTK ed uno per il crosslinking accelerato pulsato (ACXL) basato sulla pachimetria.
Le principali misurazioni pre e postoperatorie includevano l'acuità visiva a distanza non corretta (UCVA), la migliore acuità visiva corretta con gli occhiali (BSCVA), la curvatura corneale simulata (sim K max), il potere pupillare medio (MPP), il cilindro topografico (T-Cyl), le aberrazioni oltre il secondo
ordine (Coma e vertical trefoil), l’elevazione posteriore (PE) misurate utilizzando il Tomografo Precisio 2 ed il tomografo Sirius. È stato inoltre eseguito l'OCT corneale del segmento anteriore (OptoVue, Freemont, Irvine, CA, USA) per valutare la linea di demarcazione (DL) e lo spessore minimo corneale (MCT). Tutti i pazienti inclusi nello studio avevano completato il follow-up di 48 mesi.
Pianificazione chirurgica
Tutti i trattamenti sono stati pianificati utilizzando l'applicazione CIPTA 2 Web (iVis Technologies s.r.l., Taranto, Italia). Per generare un piano di ablazione personalizzato, sono stati importati nel software i dati di elevazione anteriore e posteriore (i dati di spessore dell'epitelio e dello stroma). Le ablazioni sono state programmate per trattare le aberrazioni di ordine elevato HOA, che sono le componenti maggiormente interessate dal rimodellamento laser transepiteliale. Per migliorare la qualità della visione e la stabilità del trattamento, il software supera la classica separazione tra la “zona ottica” e la “zona di transizione”, definendo una superficie ideale continua “unica” a pendenza costante, riducendo la percentuale di ablazione di tessuto. Il rimodellamento corneale centrale (CCR) guidato dal ray-tracing mira a rimodellare la cornea anteriore, prendendosi cura del contributo rifrattivo dell’aberrazione della superficie corneale posteriore al fine di ottimizzare la BSCVA finale e ridurre il più possibile il consumo di tessuto stromale. Si tratta quindi di una procedura “terapeutica”, a scopo refrattivo, cioè che mira a migliorare la performance visiva mediante l’uso degli occhiali e non di una procedura refrattiva che mira ad eliminare l’uso degli occhiali. La forma corneale posteriore introduce irregolarità morfologiche (aberrazioni posteriori di alto ordine), che compensano parzialmente le irregolarità morfologiche corneali anteriori che sono di segno opposto. Questo è particolarmente rilevante nella gestione di casi complessi, come le cornee irregolari di cui il KC è una delle massime espressioni e dove la superficie corneale posteriore può raggiungere un potere divergente comatico anche molto consistente. In altre parole, la superficie ideale generata dal software ray-tracing rimodella la cornea anteriore, lasciando sulla superficie anteriore l'esatta quantità di aberrazione necessaria per compensare quella posteriore (di segno opposto), per annullare l'irregolarità morfologica corneale totale (tCMI) creando un “equilibrio refrattivo” tra le superfici, evitando
shift ipermetropici indesiderati, altamente probabili se non si calcola con precisione il coma posteriore. Oltre a migliorare il risultato funzionale, il ray-tracing riduce notevolmente la quantità di ablazione tissutale rispetto ad un normale rimodellamento corneale anteriore completo guidato dalla topografia. L'algoritmo di ray-tracing del CIPTA Web traccia (Ray-Trace vuol dire tracciamento del raggio) i fasci di luce rifratti attraverso le superfici corneali anteriori e posteriori su una griglia di 50 µm all'interno della zona rifrattiva per determinare il miglior punto di messa a fuoco. I dati di input per la pianificazione del profilo di ablazione personalizzato sono i seguenti: forma corneale anteriore, stromale e posteriore ad alta definizione, pachimetria epiteliale, stromale e totale; mappe refrattive anteriori, stromali e posteriori mediante ray-tracing tutte acquisite dal Precisio 2.5-7 La pianificazione del trattamento con ray-tracing considera anche i dati biometrici oculari: lunghezza assiale (ALX), profondità della camera anteriore (ACD) e spessore della lente (LT). Sono state incluse anche la rifrazione manifesta e quella cicloplegica e sono stati confrontati sempre i dati relativi alla biometria e alla rifrazione dell'occhio adelfo. Il Chirurgo può scegliere comparando i dati se optare per un trattamento basato sul ray-tracing corneale oppure se dirigersi verso un trattamento full ray-racing biometrico. La scelta del piano sarà guidata dal minor consumo di tessuto possibile a parità del miglior risultato refrattivo ottenibile nella simulazione preoperatoria. La pupillometria dinamica è stata acquisita utilizzando un pupillometro binoculare P-Metrics (iVis Technologies S.r.l., Taranto, Italia), che fornisce un calcolo del diametro pupillare ideale basato su diverse impostazioni di illuminazione, tenendo conto dello stile di vita e delle attività lavorative dei pazienti (ad es. o lavoratori giornalieri). Secondo l’effetto Stiles-Crawford26, essendo l’area centrale di 1.00 mm la porzione della cornea più rilevante per la visione distinta, è possibile selezionare una piccola zona rifrattiva compresa tra 1.0 e 4.0 mm per ridurre ulteriormente l’ablazione del tessuto stromale, lavorando su un approccio personalizzato per la zona di connessione mediante un gradiente di curvatura costante entro un'ablazione totale fino a 10,0 mm di diametro, con l'obiettivo di ridurre al minimo il rischio di abbagliamento e aloni nonché il rischio di regressione. In tutti i casi di questo protocollo si raccomanda uno spessore stromale residuo postoperatorio minimo di 300 µm (350 µm misurati con l'epitelio).
Tecnica chirurgica
I trattamenti sono stati eseguiti in anestesia topica con gocce di ossibuprocaina cloridrato al 4%, 1,6 mg/0,4 ml. Dopo aver applicato uno speculum palpebrale a valve chiuse e aver asciugato la superficie corneale con una spugna in Merocel, è stato ottenuto un rimodellamento centrale corneale (CCR) personalizzato utilizzando una RT t-PRK no-touch in un unico passaggio con il laser ad eccimeri iRES (iVis Technologies S.r.l., Taranto, Italia), che ha uno spot di piccole dimensioni (0,65 mm) ed una frequenza fino a 1000 Hz. Il laser utilizza un algoritmo brevettato che fornisce una fluenza costante per unità di tempo per prevenire il surriscaldamento e massimizzare la levigatezza del profilo di ablazione. Immediatamente dopo l'ablazione laser, è stata eseguito un Crosslinking Accelerato Pulsato Guidato dalla Pachimetria residua stromale (PA-RSB) per rafforzare lo stroma corneale post-ablazione. Dopo 10 minuti di imbibizione stromale con la soluzione isotonica di Riboflavina 0.1% senza destrano e con HPMC all’1% (Vibex Rapid™ Glaukos-Avedro, Waltam, MA, USA), i trattamenti di ACXL sono stati personalizzati utilizzando le linee guida del nomogramma M 24 mantenendo cioè una fluenza costante di 5,4 J/cm2 (come raccomandata e standardizzata dal protocollo di Dresda per il blocco della progressione del KC), una potenza UV-A compresa nell’intervallo tra i 15 ed i 30 mW/ cm2 e un tempo di esposizione tra 6 e 12 minuti con luce pulsata. Una goccia di soluzione di riboflavina è stata somministrata ogni 3 minuti durante l'irradiazione UV-A. Al termine dell'irradiazione, la superficie corneale è stata lavata con soluzione salina bilanciata (BSS) fredda, medicata con netilmicina + desametasone e ciclopentolato e applicate lenti a contatto morbide per bendaggio terapeutico per 5 giorni. Dopo la rimozione delle lenti a contatto terapeutiche, il trattamento postoperatorio è continuato con la riduzione scalare di gocce oculari di fluorometolone al 2% per 12 settimane e lacrime artificiali q.i.d.
Risultati
Al follow-up di 4 anni, l'aumento medio di UDVA e BSCVA è stato rispettivamente + 3,5 ±1,28 linee di Snellen (SL) e + 4,3 ±1,3 SL, come mostrato nella Figura 1. Le differenze sono state considerate statisticamente significative con valori di P ≤ 0,05. Il guadagno percentuale in UDVA è stato ≥ 4 ±1,34 SL nel 38% degli occhi; ≥ 3 SL ±1,21 nel 35% degli occhi; ≥ 2 ±1,12 SL nel 22% degli occhi; ≥ 1 ±0,75 SL nel restante 5%. Il guadagno della BSCVA è stato ≥ 4
±0,88 SL nel 68% degli occhi; ≥ 3 ±0,78 SL nel 30%; ≥ 2 ± ≥ 0,33 nel 10% degli occhi; ≥ 1 ±0,24 SL nel 2% degli occhi. Nessuna linea di visus è stata persa nel follow-up di lungo termine, Figura 2.
Le mappe differenziali refrattive (Figura 3) e tangenziali (Figura 4) mostrano il pattern di l'ablazione guidata con ray-tracing, e la relativa riduzione postoperatoria della point spread function (PSF) con il relativo miglioramento della qualità visiva (QoV) simulata, Figure 3 e 4.
Il valore medio di K max preoperatorio era 49,07 ± 0,9 D mentre il valore medio di K max era ridotto a 46,43 ± 0,7 D. Le differenze sono state considerate statisticamente significative con P ≤ 0,05. Il valore medio del COMA preoperatorio era 0,67 ± 0,09 µm; il valore COMA medio era dimezzato a 0,35 ± 0,02 µm. Le differenze sono state considerate statisticamente significative con P ≤ 0,05 sia per il K max che per la COMA, Figura 5.
Il valore medio del cilindro tomografico preoperatorio era -3,27±1,55 diottrie (D) ed è stato ridotto a -2,14±1,30 D. Le differenze non sono state statisticamente significative, tuttavia la riduzione della COMA comporta una riduzione del cilindro in quanto si elimina parte dello pseudo-cilindro di origine aberrometrica. Lo spessore corneale medio minimo (MCT) medio preoperatorio era 467,60 (intervallo 421–509 µm) e l'MCT medio postoperatorio era 401 µm (intervallo 351–440 µm). L'elevazione posteriore preoperatoria media è stata di 56,80 ±1,3 µm. L'elevazione posteriore postoperatoria è stata di 58,80 ±1,2 µm. La differenza non è risultata statisticamente significativa
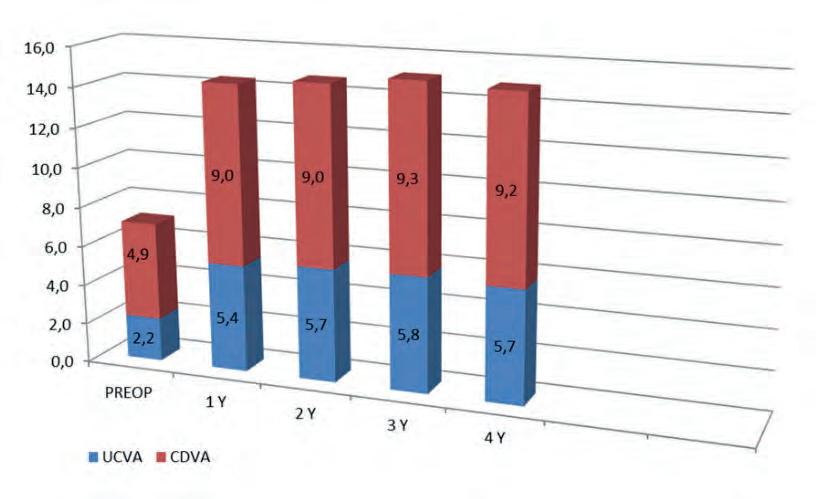
Figura 1. UCVA, CDVA. Il Grafico a barre mostra l'andamento dell'acuità visiva a distanza non corretta (UDVA: barre blu) e della migliore acuità visiva a distanza corretta con occhiali (CDVA: barre rosse) dopo il rimodellamento corneale centrale con laser transepiteliale ad eccimeri mediante ray-tracing combinato con ACXL accelerato guidata pachimetrica (M nomogram). Il Guadagno medio è rispettivamente di + 3,5 ±1,28 linee di Snellen (SL) naturali e + 4,3 ±1,3 SL con correzione a tempiale

Figura 2. Guadagno visivo postoperatorio percentuale in UDVA (barre blu) ≥ 4 ±1,34 SL nel 38% degli occhi; ≥ 3 SL ±1,21 nel 35% degli occhi; ≥ 2 ±1,12 SL nel 22% degli occhi; ≥ 1 ±0,75 SL nel restante 5%. Il guadagno percentuale in linee di Snellen della BSCVA (barre rosse): ≥ 4 ±0,88 SL nel 68% degli occhi; ≥ 3 ±0,78 SL nel 30%; ≥ 2 ± ≥ 0,33 nel 10% degli occhi; ≥ 1 ±0,24 SL nel 2% degli occhi. Nessuna linea di visus è stata persa nel follow-up a 4 anni
Figura 3. La mappa differenziale refrattiva mostra l'ablazione guidata con ray-tracing con il miglioramento relativo della point spread function (PSF) e della qualità visiva
(P > 0,05), mostrando stabilità durante l'intero periodo di follow-up. Il potere pupillare medio (MPP) preoperatorio era 47,27 ± 0,5 D; l'MPP postoperatorio è stato ridotto a 44,20 ± 0,6 D. Le differenze sono state considerate statisticamente significative con P ≤ 0,05. La densità delle cellule endoteliali non ha mostrato alcuna riduzione statisticamente significativa rispetto alla conta media delle cellule al basale da 2622±31 cellule/mm2 a 2597±39 cellule/mm2 Le mappe di follow-up dell'elevazione posteriore
4. La mappa differenziale con algoritmo tangenziale true curvature mostra l'ablazione guidata con ray-tracing con il miglioramento relativo della point spread function (PSF) e della qualità visiva simulata. Oltre la stabilità della elevazione posteriore durante il follow-up
mostrano la stabilità postoperatoria dell'ectasia nel tempo nonostante l'ablazione come dimostrato dalla Figura 6.
La mappa di ray-tracing del potere corneale totale dimostra una chiara regolarizzazione della cornea nel postoperatorio valutata con Precisio 2, Figura 7.
Una linea di demarcazione è stata documentata durante il primo mese di valutazione postoperatoria utilizzando l'OCT del segmento anteriore in tutti i casi osservati. La linea di demarcazione media era ad una profondità media di 238,2 ± 33 µm.
Durante il follow-up non sono stati registrati eventi avversi intraoperatori e postoperatori.
I dati demografici e i risultati complessivi dello studio sono riepilogati rispettivamente nelle Tabelle 1 e 2.
Discussione
L'uso combinato della t-PRK guidata dalla topografia più crosslinking (CXL) rappresenta una realtà terapeutica eseguita in casi selezionati in molti Paesi quasi da oltre due decenni.1,3,8 Kanellopoulos et al e Kymionis et al sono stati i pionieri di questi trattamenti pubblicando le prime esperienze internazionali1,2 sfociate poi nei rispettivi protocolli a guida topografica: il “Protocollo di Atene”10 e il “Protocollo di Creta”4. Studi di follow-up a lungo termine8,9,12 hanno dimostrato l'efficacia e la sicurezza delle procedure
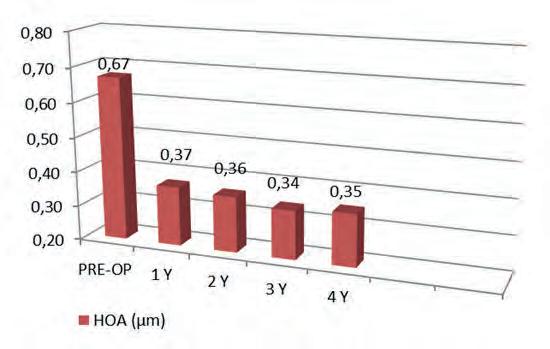
Figura 5. Il valore medio della COMA preoperatorio di 0,67 ± 0,09 µm mostra una riduzione statisticamente significativa (P ≤ 0,05) a 0,35 ± 0,02 µm
t-PRK e t-PTK guidate dalla topografia nel migliorare l'UCVA e la BSCVA nei pazienti con KC, riducendo le HOA, senza eventi avversi e senza casi di instabilità dell'ectasia nonostante l'ablazione di una piccola parte di tessuto stromale. Una certa percentuale di ipercorrezioni indesiderate è stata riportata in letteratura con i trattamenti a guida topografica.8,14 Il ray-tracing oggi segna la svolta e questo primo lavoro internazionale a lungo-termine su ampia casistica lo dimostra nei risultati, ovvero la possibilità

6. Le mappe di follow-up dell'elevazione posteriore mostrano la stabilità postoperatoria dell'ectasia nel tempo nonostante l'ablazione stromale selettiva
di calcolare finemente e con precisione il contributo refrattivo della superficie corneale posteriore e dell'epitelio corneale. Le ablazioni personalizzate guidate da ray-tracing fanno realmente ed efficacemente la differenza prevenendo le ipercorrezioni, migliorando i risultati funzionali e risparmiando ulteriormente il tessuto, come dimostrato dagli studi pilota5,6,23 e confermato in questa casistica, prima a livello internazionale con ray-tracing e follow-up di oltre 4 anni. In effetti, gli aumenti medi di UDVA e CDVA degli occhiali sono stati rispettivamente + 3,5 e + 4,3 linee di Snellen, quindi superiori ai risultati medi riportati negli studi a lungo termine senza l'utilizzo di un software di ray-tracing per t-PRK. I risultati a lungo
termine dei trattamenti di rifrazione parziale guidati dalla topografia riportati da Kanellopoulos,8 hanno mostrato un guadagno in UDVA di oltre 2 linee nel 45% e CDVA nel 37,5% mentre utilizzando l'algoritmo di ray-tracing nella nostra tecnica, il guadagno in UDVA è stato ≥ 4 linee nel 40% circa e in BSCVA ≥ 4 linee Snellen nel 70% circa dei pazienti trattati. Percentuali quindi molto superiori. L'impostazione del trattamento mira alla esclusiva correzione delle aberrazioni di ordine elevato (HOA), in particolare coma e il trifoglio verticale, e l'ablazione con il laser ad eccimeri si basa sul ray-tracing totale della cornea tenendo conto sia della superficie corneale anteriore che posteriore, che è in contrasto con il trattamento

a guida topografica che normalmente utilizza solo la superficie corneale anteriore. Quest'ultimo può potenzialmente indurre infatti una correzione eccessiva delle HOA corneali perché i dati della cornea anteriore non comprendono l'effetto compensativo attenuante della superficie corneale posteriore che, al contrario, viene impedito utilizzando il ray-tracing corneale totale. La stabilità dell'ectasia è stata confermata utilizzando mappe differenziali di elevazione posteriore e pachimetriche durante tutto il follow-up. Rari i casi di haze transitorio sono stati osservati (inferiori al 5%) risolti con cortisonici topici a scalare per 3 mesi e qualche caso di incremento della aberrazione sferica negativa (inferiore al 2%) postoperatoria ben tollerato dal paziente mediante occhiale in un caso, lente a contatto morbida giornaliera in un secondo
caso (inapplicabile nel preoperatorio per visus ottenibile molto basso). Solo un paziente ha necessitato di impianto di IOL fachica da camera posteriore per una anisometropia miopica postoperatoria non correggibile con lente a tempiale ed intollerante a lente a contatto morbida. In questi casi la regolarizzazione corneale è propedeutica alla correzione della miopia elevata e della anisometropia miopica mediante IOL fachica da camera posteriore in collamero con risultati eccellenti, avendo eliminato le aberrazioni corneali di alto ordine le quali ci consentono un preciso calcolo biometrico e la ottimizzazione del risultato refrattivo finale, impossibile senza aver regolarizzato prima la cornea.
La progettazione del software CIPTA Web differisce in modo significativo dalle progettazioni laser
standard, soprattutto rispetto alle "zone ottiche" estremamente piccole e alle transizioni molto grandi, pertanto il ragionamento comune sulla formula di Munnerlyn non può essere applicato se trattiamo solo le HOA. Il ray tracing si basa sulla legge di rifrazione di Snell e permette di valutare il percorso dei raggi luminosi dopo il loro passaggio attraverso l’occhio, dalla superficie corneale anteriore alla retina. In questo modo è possibile conoscere l'esatto contributo rifrattivo di ciascuna superficie e personalizzare l'ablazione laser ad eccimeri al fine di ridurre o normalizzare la distorsione dell’immagine dovuta all'ectasia. Ciò si ottiene non effettuando una completa regolarizzazione della cornea anteriore, che indurrebbe una ipercorrezione facendo prevalere la componente comatica della superficie corneale posteriore e aumenterebbe il consumo di tessuto; viene invece lasciata una piccola quantità di aberrazione pianificata sulla superficie corneale anteriore per compensare le aberrazioni della superficie posteriore. Per quanto riguarda la CXL,19 non è stato utilizzato lo stesso protocollo per tutti i pazienti. Il protocollo guidato dalla pachimetria che ho sviluppato e pubblicato nel 201824 recentemente35 ci consente di personalizzare la strategia di ACXL in molti modi impostando la profondità della linea di demarcazione in base alla pachimetria stromale residua post-ablazione (PA RSB), risparmiando tempo, prevenendo danni all'endotelio, riducendo la possibilità di haze e di appiattimenti secondari, mantenendo il risultato refrattivo programmato. Pertanto, è possibile ridurre il rischio di haze che era maggiore con il protocollo convenzionale Dresda19-21 di 1 ora in luce continua e soluzioni di riboflavina con destrano. Questo studio manda definitivamente in pensione il protocollo originale di Dresda da 3mW/cm2 che in questi trattamenti combinati non è quindi raccomandato a causa della maggiore possibilità di sviluppo di opacità corneali ed iperappiattimenti nel medio-lungo termine.22 Un'altra raccomandazione importante è che l'uso di mitomicina C (MMC) dopo CXL, in particolare nella t-PRK combinata con ACXL deve essere assolutamente evitato, perché aumenta il rischio di sviluppo di haze.27
Il “Nomogramma M” di crosslinking a guida pachimetrica da me sviluppato e premiato alla ESCRS di Parigi nel 2019 con il premio Joseph Colin, consente di mantenere una fluenza costante di 5,4J/cm2, stabilita come standard di riferimento nel Protocollo di Dresda nelle cornee affette da KC, a partire da uno
spessore stromale minimo di 200 µm, conferendo sempre la stessa dose e resistenza biomeccanica allo stroma, senza diminuire mai la fluenza.24 In questo modo l'ACXL può essere personalizzato in un range compreso tra 200 e 400 µm, particolarmente utile nei trattamenti combinati così come nel trattamento standardizzato delle cornee sottili. Specificamente in questa serie di casi, il nomogramma M individualizzato ACXL35 è stato utilizzato in base al letto stromale residuo minimo post-ablazione (PA RSB): 15mW/ cm2 per 12 minuti di irradiazione con luce pulsata
UV-A (1on, 1 off ) per RSB ≥400μm; 18mW/cm2 per 10 minuti di luce pulsata UV-A (1 sec on, 1 sec off) per un m RSB compreso tra 400 e 350 µm; 30mW/ cm2 per 6 minuti di irraggiamento in luce pulsata
UV-A (1 sec on, 1 sec off) per un PA RSB compreso tra 300 e 350 µm, mantenendo sempre una Fluenza (Energia) costante di 5,4 J/cm2.
Questo studio dimostra che il rimodellamento corneale centrale (CCR) con laser ad eccimeri per via transepiteliale guidato dal ray-tracing combinato al trattamento di ACXL personalizzato guidato dalla pachimetria migliora l'UCVA e la BSCVA nei pazienti con KC in stadio I e II intolleranti alle RGP CL, particolarmente nelle forme di KC fortemente asimmetrico riguardanti un solo occhio (indicazione principale), è sicuro ed efficace, senza sacrificare la stabilità biomeccanica della cornea nel follow-up di oltre 4 anni. Rispettando le indicazioni ed i criteri di inclusione, questo protocollo rappresenta una “terapia premium” che offre un trattamento preciso, più prevedibile e standardizzato, unico nel calcolo del contributo refrattivo della superficie corneale posteriore, unico nel calcolo del contributo refrattivo della superficie corneale epiteliale (grazie alle mappe epiteliali di ray-tracing), un calcolo biometrico integrato per risultati refrattivi ottimali e massimo risparmio di tessuto con stabilità comprovata a lungo termine. Si tratta di risultati refrattivi concreti che cambiano la qualità della vita di questi pazienti prevenendo in molti casi la necessità di cheratoplastica o posticipandola. Nel panorama delle terapie conservative per il cheratocono, il rimodellamento selettivo con laser ad eccimeri per via trasepiteliale mediante ray-tracing delle cornee irregolari, combinato con crosslinking personalizzato a guida pachimetrica secondo il nomogramma M, è quanto di meglio si possa offrire oggi al paziente con Cheratocono intollerante all’utilizzo di lenti a contatto RGP con scarsa od insufficiente acuità visiva con lenti a tempiale e che rispetti i criteri di inclusione riportati.
Bibliografia
1. Kanellopoulos AJ, Binder PS. Collagen cross-linking (CCL) with sequential topography-guided PRK: a temporizing alternative for keratoconus to penetrating keratoplasty. Cornea. 2007 Aug;26(7):891-
2. Kymionis GD, Kontadakis GA, Kounis GA, Portaliou DM, Karavitaki AE, Magarakis M, Yoo S, Pallikaris IG. Simultaneous topography-guided PRK followed by corneal collagen cross-linking for keratoconus. J Refract Surg. 2009 Sep;25(9): S807-11.
3. Kymionis GD, Grentzelos MA, Kounis GA, Diakonis VF, Limnopoulou AN, Panagopoulou SI. Combined transepithelial phototherapeutic keratectomy and corneal collagen cross-linking for progressive keratoconus. Ophthalmology. 2012 Sep;119(9):1777-84.
4. Kymionis GD, Grentzelos MA, Kankariya VP, Pallikaris IG. Combined transepithelial phototherapeutic keratectomy and corneal collagen crosslinking for ectatic disorders: Cretan protocol. J Cataract Refract Surg. 2013 Dec;39(12):1939.
5. Stojanovic A, Zhang J, Chen X, Nitter TA, Chen S, Wang Q. Topography-guided transepithelial surface ablation followed by corneal collagen cross-linking performed in a single combined procedure for the treatment of keratoconus and pellucid marginal degeneration. J Refract Surg. 2010 Feb;26(2):145-52.
6. Mulè G, Chen S, Zhang J, Zhou W, Selimis V, Stojanovic A, Aslanides IM. Central corneal regularization (CCR): an alternative approach in keratoconus treatment. Eye Vis (Lond). 2019 Dec 16;6: 40
7. Zhou W, Reinstein DZ, Archer TJ, Nitter T, Feng Y, Mule G, Stojanovic A. The Impact of Epithelial Remodeling on Surgical Techniques Used in Topography-guided Surface Ablation in Irregular Corneas. J Refract Surg. 2022 Aug;38(8):529-537.
8. Kanellopoulos AJ. Ten-Year Outcomes of Progressive Keratoconus Management With the Athens Protocol (Topography-Guided Partial-Refraction PRK Combined With CXL). J Refract Surg. 2019 Aug 1;35(8):478-483.
9. Grentzelos MA, Liakopoulos DA, Siganos CS, Tsilimbaris MK, Pallikaris IG, Kymionis GD. Long-term Comparison of Combined t-PTK and CXL (Cretan Protocol) Versus CXL With Mechanical Epithelial Debridement for Keratoconus. J Refract Surg. 2019 Oct 1;35(10):650-655.
10. Kanellopoulos AJ, Asimellis G. Keratoconus management: long-term stability of topography-guided normalization combined with high-fluence CXL stabilization (the Athens Protocol). J Refract Surg. 2014 Feb;30(2):88-93.
11. Kanellopoulos AJ. Comparison of sequential vs same-day simultaneous collagen cross-linking and topography-guided PRK for treatment of keratoconus. J Refract Surg. 2009 Sep;25(9): S812-8.
12. Kymionis GD, Grentzelos MA, Kankariya VP, Liakopoulos DA, Karavitaki AE, Portaliou DM, Tsoulnaras KI, Pallikaris IG. Long-term results of combined transepithelial phototherapeutic keratectomy and corneal collagen crosslinking for keratoconus: Cretan protocol. J Cataract Refract Surg. 2014 Sep;40(9):1439-45.
13. Sakla H, Altroudi W, Muñoz G, Albarrán-Diego C. Simultaneous topography- guided partial photorefractive keratectomy and corneal collagen crosslinking for keratoconus. J Cataract Refract Surg 2014; 40(9): 1430-1438.
14. Kontadakis GA, Kankariya VP, Tsoulnaras K, Pallikaris AI, Plaka A, Kymionis GD. Long-Term Comparison of Simultaneous Topography-Guided Photorefractive Keratectomy Followed by Corneal Cross-linking versus Corneal Cross-linking Alone. Ophthalmology. 2016 May;123(5):974-83.
15. Camellin M, Guidotti JM, Arba Mosquera S. Corneal-Wavefront guided transepithelial photorefractive keratectomy after corneal collagen cross linking in keratoconus. J Optom. 2017 Jan-Mar;10(1):52-62.
16. Shaheen MS, Shalaby Bardan A, Piñero DP, Ezzeldin H, El-Kateb M, Helaly H, Khalifa MA. Wave Front-Guided Photorefractive Keratectomy Using a High-Resolution Aberrometer After Corneal Collagen Cross-Linking in Keratoconus. Cornea. 2016 Jul;35(7):946-53.
17. Gore DM, Leucci MT, Anand V, Fernandez-Vega Cueto L, Arba Mosquera S, Allan BD. Combined wavefront-guided transepithelial photorefractive keratectomy and corneal crosslinking for visual rehabilitation in moderate keratoconus. J Cataract Refract Surg. 2018 May;44(5):571-580.
18. Shetty R, Nuijts RM, Nicholson M, Sargod K, Jayadev C, Veluri H, Sinha Roy A. Cone location-dependent outcomes after combined topography-guided photorefractive keratectomy and collagen cross-linking. Am J Ophthalmol. 2015 Mar;159(3):419-25.
19. Wollensak G, Spoerl E, Seiler T. Riboflavin/ultraviolet-a-induced collagen crosslinking for the treatment of keratoconus. Am J Ophthalmol. 2003;135(5):620-7.
20. Caporossi A, Mazzotta C, Baiocchi S, Caporossi T. Long-term results of riboflavin ultraviolet a corneal collagen cross-linking for keratoconus in Italy: The Siena Eye Cross Study. Am J Ophthalmol. 2010;149(4):585-93.
21. Raiskup F, Spoerl E. Corneal crosslinking with riboflavin and ultraviolet A. I. Principles. Ocul Surf. 2013;11(2):65-74.
22. Rechichi M, Mazzotta C, Oliverio GW, Romano V, Borroni D, Ferrise M, Bagaglia S, Jacob S, Meduri A. Selective transepithelial ablation with simultaneous accelerated corneal crosslinking for corneal regularization of keratoconus: STARE-X protocol. J Cataract Refract Surg. 2021 Nov 1;47(11):1403-1410.
23. Kanellopoulos AJ. Keratoconus Management With Customized Photorefractive Keratectomy by Artificial Intelligence Ray-Tracing Optimization Combined With Higher Fluence Corneal Crosslinking: The Ray-Tracing Athens Protocol. Cornea. 2021 Sep 1;40(9):1181-1187.
24. Mazzotta C, Romani A, Burroni A. Pachymetry-based accelerated cross-linking: the “M Nomogram” for standardized treatment of all-thickness progressive ectatic corneas. Int J Keratoconus Ectatic Corneal Dis. 2019;7(2):137-44.
25. Krumeich JH, Daniel J, Knülle A. Live-epikeratophakia for keratoconus. J Cataract Refract Surg. 1998 Apr;24(4):456-63.
26. Olsen T. On the Stiles-Crawford effect and ocular imagery. Acta Ophthalmol (Copenh). 1993 Feb;71(1):85-8.
27. Awwad ST, Chacra LM, Helwe C, Dhaini AR, Telvizian T, Torbey J, Abdul Fattah M, Torres-Netto EA, Hafezi F, Shetty R. Mitomycin C Application After Corneal Cross-linking for Keratoconus Increases Stromal Haze. J Refract Surg. 2021 Feb 1;37(2):83-90.
28. Mazzotta C, Raiskup F, Hafezi F, Torres-Netto EA, Armia Balamoun A, Giannaccare G, Bagaglia SA. Long term results of accelerated 9 mW corneal crosslinking for early progressive keratoconus: the Siena Eye-Cross Study 2. Eye Vis (Lond). 2021 May 1;8(1):16.
29. Tomita M, Mita M, Huseynova T. Accelerated versus conventional corneal collagen crosslinking. J Cataract Refract Surg. 2014;40(6):1013-20.
30. Hashemi H, Miraftab M, Seyedian MA, Hafezi F, Bahrmandy H, Heidarian S, et al. Long-term results of an accelerated corneal cross-linking protocol (18mW/cm2) for the treatment of progressive keratoconus. Am J Ophthalmol. 2015;160(6):1164-70.
31. Mazzotta C, Traversi C, Caragiuli S, Rechichi M. Pulsed vs continuous light accelerated corneal collagen crosslinking: in vivo qualitative investigation by confocal microscopy and corneal OCT. Eye (Lond). 2014;28(10):1179-83.
32. Mazzotta C, Traversi C, Paradiso AL, et al. Pulsed light accelerated crosslinking versus continuous light accelerated crosslinking one-year results. J Ophthalmol. 2014;2014: 1–6.
33. Mazzotta, C., Baiocchi, S., Bagaglia, S.A., Fruschelli, M., Meduri, A., Rechichi, M. Accelerated 15mW pulsed-light crosslinking to treat progressive keratoconus: Two-year clinical results (2017) Journal of Cataract and Refractive Surgery, 43 (8), pp. 1081-1088.
34. Mazzotta C, Hafezi F, Kymionis G, Caragiuli S, Jacob S, Traversi C, Barabino S, Randleman JB. In Vivo Confocal Microscopy after Corneal Collagen Crosslinking. Ocul Surf. 2015 Oct;13(4):298-314.
35. Mazzotta C, Stojanovic A, Romano V, Addabbo G, Borroni D, Balamoun AA, Ferrise M. Ray-Tracing Transepithelial Excimer Laser Central Corneal Remodeling Plus Pachymetry-Guided Accelerated Corneal Crosslinking for Keratoconus. Cornea. 2023 Sep 8. doi: 10.1097/ ICO.0000000000003380. Epub ahead of print. PMID: 37699556.
U.O.C.
di OculisticaLa congiuntivite allergica è una patologia molto frequente che interessa fino al 20% della popolazione mondiale1. I quadri clinici con cui si presenta possono essere ampiamente variabili, spaziando dalle comuni e lievi forme stagionali (la congiuntivite allergica stagionale - SAC), a quadri più rari ma decisamente più gravi, come la congiuntivite allergica perenne (PAC), la cheratocongiuntivite Vernal (VKC), la cheratocongiuntivite atopica (AKC) o la congiuntivite gigantopapillare (GPC). Occupandoci di congiuntiviti allergiche pediatriche, dobbiamo prima di tutto considerare l’età d’esordio dei singoli quadri. Infatti, nei primi 10 anni di vita l’interessamento oculare è tipico della VKC (dai 3 anni in poi), mentre il picco all’esordio per SAC, PAC, AKC e GPC è la fine della seconda decade di vita. Va comunque considerata la frequenza di queste affezioni rispetto alla rarità della VKC. Uchio et al2 hanno evidenziato che, in pazienti con allergie oculari includendo SAC (81,2%), PAC (10,6%), AKC (4,4%), e VKC (3.8 %), è stata osservata un'età media in ciascuna malattia rispettivamente di 52,9, 56,1, 25,7 e 16,6 anni.
La congiuntivite allergica stagionale (SAC)
La SAC può interessare l’età pediatrica anche se il picco di incidenza si colloca negli ultimi anni della seconda decade.
La SAC è la forma più diffusa di congiuntivite allergica, rappresentando più del 50% dei casi. La SAC è una congiuntivite stagionale, spesso associata a rinite, e la sua comparsa è legata alla presenza di allergeni come pollini delle graminacee, parietaria e di piante arboree3,4 I sintomi più importanti sono prurito e bruciore oculare, lacrimazione, talvolta fotofobia e annebbiamento visivo. I segni clinici sono rappresentati da iperemia congiuntivale, ipertrofia papillare della congiuntiva tarsale ed essudato (sieroso in fase acuta, più denso in fase cronica), e sono riscontrabili annualmente durante la stessa stagione.
La SAC è una classica reazione di ipersensibilita IgE

mediata dove gli allergeni, legandosi con IgE specifiche presenti sui mastociti congiuntivali, determinano degranulazione mastocitaria con rilascio di mediatori vasoattivi, scatenando la reazione allergica.4,5
La congiuntivite allergica perenne (PAC)
La PAC è considerata una variante della SAC presente tutto l’anno ed associata a rinite persistente. Gli allergeni coinvolti sono gli acari della polvere, gli epiteli di animali e le spore fungine. Nelle forme perenni la sintomatologia, meno pronunciata, è caratterizzata da prurito, bruciore oculare e sensazione di corpo estraneo. La SAC e la PAC hanno un esordio simile e possono associarsi entrambe a sintomi quali asma o eczema6.
La diagnosi si basa sulla presenza di segni clinici (iperemia congiuntivale, ipertrofia papillare, edema palpebrale) e sintomi soggettivi (prurito e bruciore oculare), confermati da esami di laboratorio (ipereosinofilia ed iperneutrofilia, aumento IgE sieriche e cutanee).
Terapia di SAC e PAC
La terapia delle congiuntiviti allergiche stagionali e perenni ha due cardini: la prevenzione ambientale e la terapia farmacologica.
La prevenzione ambientale è fondamentale, soprattutto nelle PAC. Si deve tenere il paziente lontano quanto più possibile dal contatto con i pollini, utilizzare occhiali da sole in ambienti esterni, bonificare l’abitazione per ridurre i livelli di acari della polvere, rimuovere la polvere da tappeti e tende e lavare spesso i pupazzi dei bambini.
La terapia prevede l’uso di colliri antistaminici, stabilizzanti di membrana e steroidi.
L’obiettivo primario della terapia farmacologica antiallergica è inibire la degranulazione dei mastociti e delle cellule infiammatorie coinvolte nella flogosi allergica. L’impiego degli stabilizzanti di membrana dovrebbe quindi essere costante e prolungato al fine di mantenere un’azione preventiva, efficace nei confronti degli stimoli ambientali.
L’uso degli antistaminici resta però uno dei cardini della terapia antiallergica in quanto riduce drasticamente e rapidamente la sintomatologia accusata dal paziente una volta che il processo patologico è iniziato. Tra i colliri usati nella SAC, gli antistaminici (azelastina, levocabastina e emedastina) sono più efficaci dei farmaci stabilizzatori mastocitari (sodio cromoglicato, nedocromile, lodoxamide) per il controllo della sintomatologia soggettiva6. Gli antistaminici topici, come azelastina ed emedastina sono farmaci di prima scelta, ma le molecole a doppia azione (inibizione del rilascio di mediatori mastocitari e inibizione competitiva per il recettore H1), come olopatadina , epinastina cloridrato e chetotifene fumarato, sono da preferire7-9. Il chetotifene fumarato, inoltre, modula l’azione degli eosinofili inibendo la sintesi e l’espressione a livello endoteliale delle molecole di adesione cellulare che giocano un ruolo chiave nel loro reclutamento. Il chetotifene può inibire la chemiotassi e l’attivazione degli eosinofili indotta da IL-5. Gli steroidi sono i farmaci antinfiammatori più potenti ed efficaci; la loro azione antinfiammatoria e immunosoppressiva si esplica localmente per assorbimento attraverso la congiuntiva e la cornea. La capacità di penetrazione in camera anteriore, essendo responsabile di effetti collaterali gravi come la cataratta e il glaucoma, deve essere sempre considerata.
Gli steroidi in collirio con maggiore efficacia antinfiammatoria sono il betametasone, il desametasone alcol o fosfato e il prednisolone acetato e sodio fosfato all’1%; queste molecole hanno anche maggiore penetrabilità intraoculare e quindi maggiori rischi di causare effetti collaterali. Il fluorometolone, il clobetasone e l’idrocortisone sodio fosfato hanno una valida attività antiinfiammatoria ed una scarsa penetrabilità in camera anteriore con minimi effetti collaterali.
Tutti questi farmaci sono preferenzialmente impiegati a livello topico (colliri), ma non dobbiamo dimenticare che, nelle forme particolarmente severe, può essere utile impiegare farmaci antistaminici (come Terfenadina, astemizolo, axatomide, loratadina o cetirizina) o steroidei anche per via sistemica.
La cheratocongiuntivite Vernal (VKC)
La cheratocongiuntivite Vernal (VKC) è una patologia oculare considerata rara (1 caso su 10.000 in Europa), classificata come allergica, anche se ad eziologia sconosciuta. È stata identificata una familiarità per VKC in circa il 5-8% dei soggetti. Nei soggetti con VKC familiare è stato riscontrato l'aplotipo HLA A-19 nel 75% dei casi. Anche l'aplotipo HLA A-32 è risulta-
to presente nel 30% delle forme familiari e nel 5% di quelle sporadiche10. La VKC è una malattia principalmente dell'infanzia e delle successive età pediatriche fino all'adolescenza. Tuttavia, la maggior parte dei pazienti interessati ha tra i 5 ei 25 anni di età.2,11. L'età media di esordio è tra i 6 e i 7 anni, con una comparsa un po' più precoce nei ragazzi che nelle ragazze3,12. La VKC inizia a manifestarsi nella prima decade di vita, solitamente non prima dei 3 anni e tende a risolversi spontaneamente (anche se non sempre) dopo la pubertà, alla fine della seconda decade.
La VKC è una patologia cronica bilaterale, spesso severa, a rischio di esiti permanenti se non adeguatamente trattata13. Il termine cheratocongiuntivite implica un possibile coinvolgimento della cornea (cheratite puntata superficiale, ulcera a scudo, placca corneale) con conseguente compromissione del visus. Il cheratocono viene diagnosticato in una percentuale che va dal 8.8% al 36%. Segni oculari patognomonici sono rappresentati dalle papille giganti tarsali superiori, e/o da papille limbari associate e depositi biancastri (Horner-Trantas dots).
La difficile gestione di questa patologia dipende soprattutto dalla inefficacia dei farmaci tradizionali impiegati per il trattamento delle congiuntiviti allergiche (antistaminici e cromoni) e dalla necessità di utilizzo per lungo tempo di colliri a base di cortisonici, farmaci efficaci ma con effetti collaterali oculari come l’aumento del tono e la cataratta. Attualmente esistono due immunosoppressori che possono essere utilizzati localmente nei casi più gravi di VKC: la ciclosporina ed il tacrolimus.13,14 La ciclosporina agisce sulla componente cellulo-mediata riducendo la produzione di IL-2 e del suo recettore da parte del linfocita Th, oltre ad avere un effetto stabilizzante sui mastociti e sugli eosinofili.
La cheratocongiuntivite atopica (AKC)
L’AKC è un’infiammazione cronica che può coinvolge la congiuntiva tarsale inferiore e la cornea. E molto frequente una storia familiare per atopia, in particolare eczema (95% pazienti) o asma (87%)2,12. L’esordio di questa patologia e tra i 16-19 anni e può persistere fino alla quarta-quinta decade di vita. La sintomatologia è caratterizzata da prurito, bruciore, fotofobia e sensazione di corpo estraneo; tali sintomi sono più severi rispetto alla SAC e PAC e sono presenti per tutto l’anno.
Sono state descritte esacerbazioni stagionali in molti pazienti soprattutto in inverno e in estate, e spesso dopo esposizione ad animali, acari della polvere ed alcuni alimenti. I segni oculari sono rappresentati dalle
pieghe di Dennie Morgan (pieghe della cute palpebrale inferiore), blefatite, madarosi, ipertrofia papillare tarsale (inizialmente inferiore), cheratite puntata, infiltrati limbari; nei casi più gravi si può presentare congiuntivite cicatriziale con fibrosi subepiteliale e simblefaron. La terapia si avvale dell’impiego di corticosteroidi topici e di ciclosporina per via oculare. In un recente studio l’impiego di tacrolimus unguento nella terapia dell’eczema palpebrale in questi pazienti ha prodotto un significativo miglioramento nel quadro oculare in pazienti con AKC15
La congiuntivite gigantopapillare (GPC)
La congiuntivite giganto papillare e una patologia caratterizzata da un’infiammazione della congiuntiva tarsale. Le cause e la patogenesi della congiuntivite gigantopapillare non sono ancora del tutto conosciute. Anche se la congiuntivite giganto-papillare si manifesta principalmente in portatori di lenti a contatto morbide, rigide, o semi-rigide, non può essere attribuita semplicemente ad una reazione verso il materiale di composizione della lente.
La sintomatologia comprende prurito oculare, offuscamento del visus, intolleranza alle lenti, secchezza oculare; obiettivamente si possono rilevare papille tarsali superiori e sul bordo palpebrale, secrezione mucosa, cheratopatia puntata. La terapia si basa essenzialmente sulla sospensione dell’utilizzo della lente o dell’eventuale causa meccanica, e sull’impiego di farmaci antinfiammatori locali; la prognosi è buona16.
Bibliografia
In conclusione
Per porre una corretta diagnosi di congiuntivite allergica in età pediatrica, bisogna innanzitutto considerare l’età all’esordio. Nei primi 10 anni di vita l’interessamento oculare è tipico della VKC (dai 3 anni in poi). L’esordio delle altre forme di congiuntivite allergiche (SAC, PAC, AKC e GPC) avviene verso la fine della seconda decade.
L’andamento stagionale può, spesso da solo, far porre più che un sospetto diagnostico: la primavera esclusiva per la SAC, il peggioramento in estate per la VKC. Il riscontro di segni/sintomi associati (come la dermatite atopica per la AKC) può facilitare la diagnosi. Il sospetto diagnostico deriva anche dalla valutazione della risposta alla terapia con colliri “tradizionali”, come antistaminici e stabilizzatori di membrana. Le forme più gravi, infatti, non rispondono a tali trattamenti. Anche se la diagnosi viene posta dall’oftalmologo, il pediatra e l’allergologo svolgono un ruolo fondamentale. Per quanto riguarda la terapia, i farmaci più sicuri ed efficaci con effetti positivi su segni e sintomi dell’allergia sono i colliri con azione multipla che intervengono sia sulla flogosi allergica in atto, essendo antagonisti competitivi dei recettori dell’istamina, che sul rilascio d’istamina agendo da stabilizzanti di membrana. Tra i colliri cortisonici andrebbero preferiti quelli a scarsa penetrazione in camera anteriore, per ridurre nei trattamenti a lungo termine i rischi degli effetti collaterali. L’uso degli immunosoppressori topici deve essere circoscritto a casi selezionati.
1. Takamura E, Uchio E, Ebihara N, Ohno S, Ohashi Y, Okamoto S, Kumagai N, Satake Y, Shoji J, Nakagawa Y, Namba K, Fukagawa K, Fukushima A, Fujishima H; Japanese Society of Allergology Japanese guidelines for allergic conjunctival diseases 2017.Allergol Int. 2017 Feb 10. pii: S1323-8930(16)30173-3.
2. Bielory L. Allergic and immunologic disorders of the eye. Part II: Ocular allergy. J Allergy Clin Immunol 2000;106:1019-32.
3. Bielory L, Friedlaender MH. Allergic conjunctivitis. Immunol Allergy Clin North Am 2008;28:43-48.
4. Bourcier T, Moldovan M, Goldschild M, et al. Value of lacrimal IgE determinationand conjunctival cytology in the diagnosis of chronic conjunctivitis. J Fr Ophthalmol 1998;21:209-13.
5. Tabbara KF. Ocular complications of vernal keratoconjunctivitis. Can J Ophthalm 1999;34:88-92.
6. Leonardi A. Expert opinion. Emerging drugs for ocular allergy. Exp Opin Emerg Drugs 2005;10:505-20.
7. Schultz BL. Pharmacology of ocular allergy. Curr Opin All Clin Immunol 2006;6:383-9.
8. Bielory L, Kenneth W, Bigelsen LS. Effi cacy and tolerability of newer antihistamines in the treatment of allergic conjunctivitis. Drugs 2005;65:215-28.
9. Pucci N, Novembre E, Cianferoni A, et al. Efficacy and safety of cyclosporine eyedrops in vernal keratoconjunctivitis. Ann Allergy Asthma Immunol 2002;89:298-303.
10. Tufts SJ, Kemeny EM, Dart JKG, et al. Clinical features of atopic keratoconjunctivitis. Ophthalmology 1991;98:150-8.
11. Calonge M, Herreras JM. Clinical grading of atopic keratoconjunctivitis. Curr Opin Allergy Clin Immunol 2007;7:442-5.
12. Pucci N, Novembre E, Lombardi E, et al. Atopy and serum eosinophil cationic protein in 110 white children with vernal keratoconjunctivitis: differences between tarsal and limbal forms. Clin Exp Allergy 2003;33:325-30.
13. Ebihara N, Ohashi Y, Uchio E, et al. A large prospective observational study of novel cyclosporine 0.1% aqueous ophthalmic solution in the treatment of severe allergic conjunctivitis. J Ocul Pharmacol Ther 2009;25:365-72.
14. Ohashi Y, Ebihara N, Fujishima H, Fukushima A, Kumagai N, Nakagawa Y, et al. A randomized, placebo-controlled clinical trial of tacrolimus ophthalmic suspension 0.1% in severe allergic conjunctivitis. J Ocul Pharmacol Ther 2010;26: 165e74
15. Zribi H, Descamps V, Hoang-Xuan T, et al. Dramatic improvement of atopic keratoconjunctivitis after topical treatment with tacrolimus ointment restricted to the eyelids. J Eur Acad Dermatol Venereol 2009;23:489-90.
16. Allansmith MR, Ross RN. Giant papillary conjunctivitis. Int Ophthalmol Clin 1988;28.309-16.



Arianna De Rossi1, Anna Miglietta1, Matteo Gelardi2
1. Centro oculistico e Otorinolaringoiatrico Studi Santa Chiara - Verona
2. Professore ordinario di Otorinolaringoiatria - Università di Foggia

Le patologie della superficie oculare (OSD) costituiscono un gruppo eterogeneo di malattie acute e croniche epidemiologicamente molto frequenti e accomunate dal comportare una riduzione significativa della qualità della vita di molti pazienti. La diagnosi clinica di queste patologie non è semplice, in quanto patologie diverse si possono presentare con sintomi simili (come prurito, bruciore, sensazione di corpo estraneo..); e i segni di infiammazione obiettivabili all’esame clinico della congiuntiva con lampada a fessura (follicoli, papille, iperemia, secrezioni.. ) sono spesso non specifici per patologia. Eppure, l’esecuzione della diagnosi corretta e l’impostazione della terapia adeguata possono fare la differenza per i pazienti. In questo scenario, la citologia congiuntivale (CC) mediante scraping si presenta come una tecnica semplice, economica e non invasiva che può essere di grande aiuto per l’oculista nella diagnosi differenziale di precisione delle OSD. La CC prevede il prelievo delle cellule della congiuntiva tarsale, la deposizione su vetrino, la colorazione con May-Grünwald Giemsa, e l’osservazione al microscopio ottico a immersione in olio con ingrandimento 1000x. La visualizzazione diretta del tipo di cellule infiammatorie eventualmente presenti (neutrofili, linfociti, eosinofili, mastociti) e del loro stato funzionale (degranulazione, attivazione..), in correlazione diretta col dato clinico, indirizza con precisione verso la causa dell’infiammazione e la scelta della terapia adeguata. La CC può essere fondamentale sia per la diagnosi che per il follow-up, in quanto consente di raccogliere dati non solo qualitativi, ma anche quantitativi in merito alle cellule presenti, quindi l’esame può essere ripetuto dopo la terapia per valutare con dati oggettivamente misurabili e documentabili l’andamento clinico della patologia.
La tecnica citologica
La più grande forza di questa tecnica diagnostica, che la rende adatta ad essere eseguita a livello ambulatoriale, è la semplicità: può infatti essere eseguita in autonomia dall’oculista in tutti i suoi passaggi. Occorre solo un laboratorio di livello base per la processazione e colorazione del campione, e un microscopio ottico per l’osservazione delle cellule.
Prelievo
Lo scraping congiuntivale viene eseguito mediante una spatola sterile a livello della congiuntiva tarsale superiore e inferiore del paziente, previa instillazione di anestetico topico.
Processazione
Il campione prelevato viene strisciato delicatamente sulla superficie di un vetrino portaoggetto. Sulla banda smerigliata del vetrino vengono riportati a matita i dati anagrafici del paziente, la lateralità (occhio destro, occhio sinistro) e la data del prelievo.
Fissazione
Lo striscio citologico viene lasciato asciugare all’aria e riposto in un portavetrini. La seccatura all’aria è necessaria per evitare la lisi cellulare.
Colorazione
La colorazione dello scraping citologico viene eseguita con la colorazione May-Grunwald-Giemsa. Il vetrino portaoggetto viene immerso nel colorante per tutta la superficie. Il colorante viene lasciato agire per 3 minuti. Successivamente si aggiunge un volume di acqua demineralizzata uguale a quello di colorante (rapporto 1 a 1). Si lascia agire per 6 minuti. Si ri-
muove il vetrino dalla vaschetta e si rimuove il colorante in eccesso mediante lavaggio in acqua demineralizzata. Il preparato viene poi posto nella soluzione di Giemsa diluita con acqua tamponata in rapporto 1 a 10. Il vetrino viene lasciato in soluzione per almeno 30 minuti, viene poi lavato sotto acqua corrente e fatto asciugare.
Montaggio del vetrino
Questa procedura prevede l’applicazione di una resina sintetica che salda il vetrino portaoggetto al vetrino coprioggetto.
Osservazione microscopica
La lettura del vetrino avviene per campi microscopici. Una prima osservazione viene eseguita con piccolo ingrandimento, si individua la sede di maggiore concentrazione cellulare e si procede all’osservazione a un ingrandimento 1000x in olio per immersione. Per 50 campi microscopici si riporta la media del numero di cellule identificate per ogni tipo e il loro stato morfo-funzionale.
Citotipi riconoscibili tramite citologia
Di seguito, da Fig. 1 a Fig. 3 si mostrano i principali citotipi osservabili alla citologia congiuntivale; in figura 4 si noti che è possibile anche evidenziare la presenza di batteri.
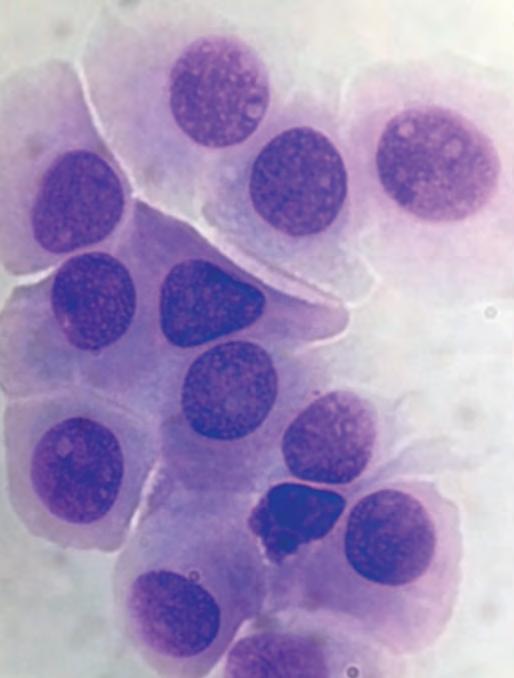
Quadri clinici di comune interesse nella pratica clinica ambulatoriale
Si presentano tre casi esemplari che si manifestano clinicamente in modo simile con “occhio rosso”, ma dal punto di vista citologico si presentano in modo completamente diverso, portando a diagnosi e quindi implicazioni terapeutiche molto diverse. Con la descrizione di questi tre casi non si pretende certo di riassumere tutti i possibili quadri citologici identificabili o tutte le possibili patologie diagnosticabili tramite citologia, ma di offrire un’indicazione pratica delle potenzialità diagnostiche di questa tecnica.
Bambino di 8 anni: i genitori riferiscono che tende spesso a strofinarsi gli occhi e ammicca frequentemente. La citologia congiuntivale mostra eosinofili e mastociti in degranulazione (vedi Fig. 5). Nel sospetto di una congiuntivite allergica, vengono eseguite prove allergologiche che risultano positive per graminacee, composite, cupressacee, nocciolo, betullacee, parietaria. Il sospetto diagnostico di congiuntivite allergica poteva nascere dall’anamnesi, ma tramite la citologia è stato possibile documentare con immagini il grado di infiammazione della congiuntiva. In questo caso la diagnosi di allergia è nata dall’oculista, e trattandosi di una patologia sistemica è stato possibile indirizzare il paziente ad approfondimento dia-
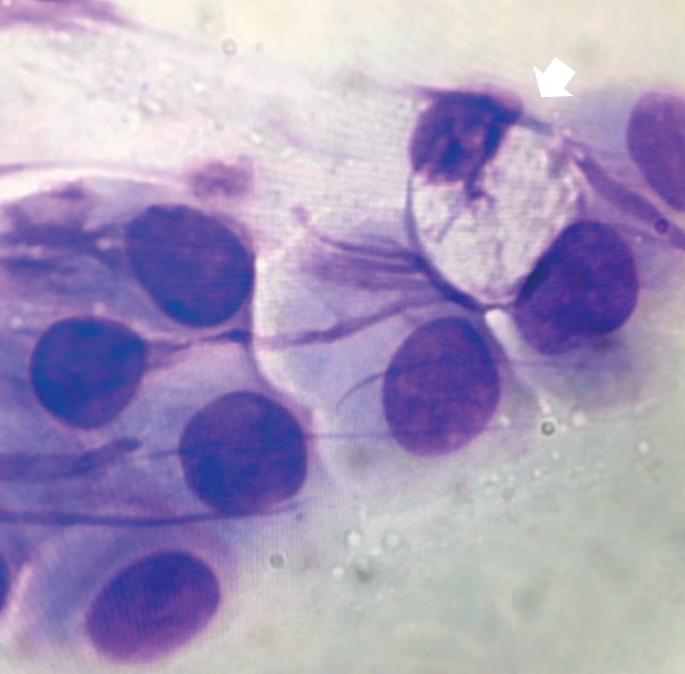


gnostico presso otorinolaringoiatra, pneumologo e allergologo, al fine di prevenire l’insorgere di poliposi nasale e asma allergica.
Caso 2
Donna di 70 anni che lamenta bruciore e prurito oculare da molto tempo, senza beneficio da alcuna terapia. Circa 1 anno prima, presso un altro centro, le è stata diagnosticata la malattia dell’occhio secco, è stata trattata con lacrime artificiali e impacchi caldo umidi e 3 sedute di luce pulsata, l’ultima solo due mesi prima di giungere alla nostra attenzione. La citologia congiuntivale mostra mastociti degranulati e alcuni eosinofili (Fig. 6). Sebbene i citotipi osservati siano simili a quelli del paziente del caso 1, non è possibile giungere alla diagnosi di congiuntivite allergica senza conferma con prove allergologiche. Le prove allergologiche nel caso di questa paziente risultano infatti negative, e congiuntamente con la valutazione dell’otorinolaringoiatra con endoscopia e citolo-

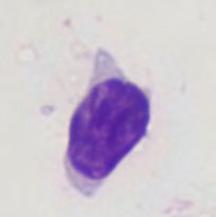
gia nasale è possibile fare diagnosi di congiuntivite non allergica associata a rinite non allergica mastocitaria (NARMA). Anche in questo caso il sospetto diagnostico per una condizione non oculare è nato dalla citologia congiuntivale. Le riniti non allergiche (NAR) sono gravi patologie nasali con tendenza alla cronicizzazione e progressione a rinosinusite cronica con poliposi nasale. I pazienti affetti da questa patologia conducono un’esistenza di qualità molto scarsa, se non trattati. Queste patologie possono essere identificate solo tramite citologia. La collaborazione interdisciplinare si è rivelata anche in questo caso importante.
Uomo di 50 anni che si presenta in ambulatorio lamentando arrossamento oculare associato a sensazione di corpo estraneo con alcune secrezioni in occhio destro da circa 3 giorni. In questo caso la CC consente di eseguire una diagnosi differenziale tra



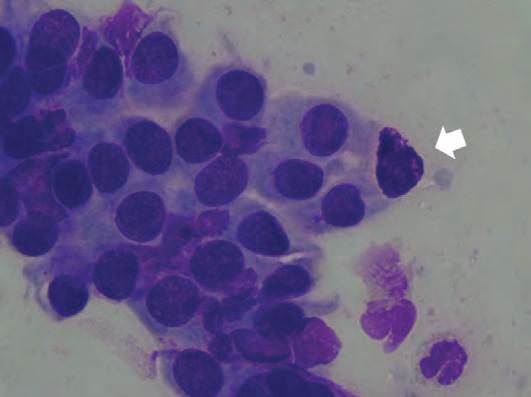

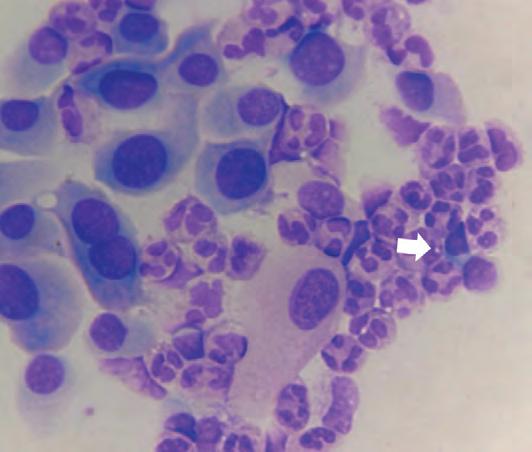
congiuntivite batterica e congiuntivite virale, documentata con immagini. Infatti, in caso di eziologia infettiva, batteri eventualmente presenti possono essere visualizzati direttamente, se invece si tratta di virus, possono essere evidenziati indirettamente i segni del loro effetto citopatico (le dimensioni dei virus sono al di sotto del limite di risoluzione del microscopio ottico).
In questo caso la citologia congiuntivale mostra una massima neutrofilia con alcuni linfociti attivati, in assenza di batteri (Fig. 7). La diagnosi è dunque di congiuntivite acuta virale, perciò la terapia può essere impostata di conseguenza.
Conclusioni
La citologia congiuntivale è una tecnica semplice, economica e non invasiva che può essere eseguita in
autonomia dall’oculista nel proprio ambulatorio. La CC si distingue dalla citologia ad impressione, tecnica estremamente informativa, ma costosa ed eseguibile solo presso centri selezionati e dotati di laboratori di
livello sofisticato. Per questi suoi importanti vantaggi la CC potrebbe diventare una tecnica irrinunciabile nella diagnosi differenziale delle OSD, nella pratica clinica ambulatoriale di tutti i giorni.
1. Stapleton F, Alves M, Bunya VY, Jalbert I, Lekhanont K, Malet F, Na KS, Schaumberg D, Uchino M, Vehof J, Viso E, Vitale S, Jones L. TFOS DEWS II Epidemiology Report. Ocul Surf. 2017 Jul;15(3):334-365. doi: 10.1016/j.jtos.2017.05.003. Epub 2017 Jul 20. PMID: 28736337
2. Leonardi A, Modugno RL, Salami E. Allergy and Dry Eye Disease. Ocul Immunol Inflamm. 2021 Aug 18;29(6):1168-1176. doi: 10.1080/09273948.2020.1841804. Epub 2021 Feb 5. PMID: 33544639.
3. Kari O, Saari KM. Clinical measurement of eosinophil numbers in eosinophilic conjunctivitis. Methods Mol Biol. 2014;1178:197-202. doi: 10.1007/978-1-4939-1016-8_17. PMID: 24986618.
4. L’esame citologico nelle flogosi della superficie oculare. 2007. Salvatore Troisi, Antonio del Prete.
5. Gelardi M, Iannuzzi L, Quaranta N, Landi M, Passalacqua G. NASAL cytology: practical aspects and clinical relevance. Clin Exp Allergy. 2016 Jun;46(6):785-92. doi: 10.1111/cea.12730. PMID: 27009397.
6. Kari O, Haahtela T, Laine P, Turunen JP, Kari M, Sarna S, Laitinen T, Kovanen PT. Cellular characteristics of non-allergic eosinophilic conjunctivitis. Acta Ophthalmol. 2010 Mar;88(2):245-50. doi: 10.1111/j.1755-3768.2009.01599.x. Epub 2009 Nov 23. PMID: 19930216.
7. Gelardi M, Maselli del Giudice A, Fiorella ML, Fiorella R, Russo C, Soleti P, Di Gioacchino M, Ciprandi G. Non-allergic rhinitis with eosinophils and mast cells constitutes a new severe nasal disorder. Int J Immunopathol Pharmacol. 2008 Apr-Jun;21(2):325-31. doi: 10.1177/039463200802100209. PMID: 18547476.
8. Stone KD, Prussin C, Metcalfe DD. IgE, mast cells, basophils, and eosinophils. J Allergy Clin Immunol. 2010 Feb;125(2 Suppl 2):S73-80. doi: 10.1016/j.jaci.2009.11.017. PMID: 20176269; PMCID: PMC2847274.
9. Cvenkel B, Globocnik M. Conjunctival scrapings and impression cytology in chronic conjunctivitis. Correlation with microbiology. Eur J Ophthalmol. 1997 Jan-Mar;7(1):19-23. doi: 10.1177/112067219700700104. PMID: 9101190.
10. Singh R, Joseph A, Umapathy T, Tint NL, Dua HS. Impression cytology of the ocular surface. Br J Ophthalmol. 2005 Dec;89(12):1655-9. doi: 10.1136/bjo.2005.073916. PMID: 16299150; PMCID: PMC1772976

Con il patrocinio di

Fondazione Villa Bertelli Via Giuseppe Mazzini, 200
Organizzatori: Andrea Bedei
Giovanni Cardini
Acquisibili tramite corso FAD ECM
Segreteria organizzativa:
FGE - Fabiano Gruppo Editoriale Reg. Rivelle 7/F - 14050 Moasca (AT) Tel. 0141 1706694 - info@fgeditore.it
Segreteria on-site: Devon Group srl Viareggio


Le lenti Essilor®
Stellest® rallentano

Le Lenti Stellest® sono la soluzione visiva di Essilor® progettata per contrastare la miopia dei tuoi bambini. Rallentano in media del 67%(1) la progressione della miopia rispetto alle lenti monofocali, se indossate 12 ore al giorno
Dipartimento
 di Scienze Chimiche, Farmaceutiche ed Agrarie, Università di Ferrara
di Scienze Chimiche, Farmaceutiche ed Agrarie, Università di Ferrara
Abstract
L'attenzione recente sui potenziali danni permanenti causati da infezioni oculari ha spinto a un'approfondita esplorazione degli attuali agenti antimicrobici. Gli agenti antimicrobici utilizzati in oftalmologia dovrebbero possedere le seguenti caratteristiche: un ampio spettro antimicrobico, un'azione rapida anche in presenza di materiale organico e devono essere privi di tossicità. Lo scopo di questo studio è confrontare l'efficacia antimicrobica di antisettici oftalmici ampiamente utilizzati contenenti iodopovidone, clorexidina e liposomi con olio di girasole ozonizzato. Sono state valutate le concentrazioni minime inibenti (MIC) su diverse specie batteriche e sono state esaminate anche le capacità di controllare la resistenza agli antibiotici, la formazione di biofilm e l'adesione batterica. Tutti e tre i preparati antisettici oftalmici hanno dimostrato una significativa attività antimicrobica e anti-biofilm, ma i liposomi contenenti olio di girasole ozonizzato hanno mostrato la maggiore capacità nel contrastare la resistenza agli antibiotici e nell'evitare l'adesione batterica alle cellule corneali umane.
La chirurgia intraoculare può comportare il rischio di gravi complicazioni oculari, tra cui l'endoftalmite infettiva, principalmente di origine batterica, che può avere conseguenze devastanti. Tuttavia, ad oggi sono disponibili pochi studi riguardo all'epidemiologia e al pattern di suscettibilità agli antibiotici dei patogeni oculari, anche se la resistenza antimicrobica (AMR) è riconosciuta come una significativa minaccia per
la salute a livello mondiale [1]. Gli organismi multidrug-resistenti (MDRO) sono in continuo aumento e nel campo dell'oftalmologia destano particolare preoccupazione batteri come Staphylococcus aureus e Pseudomonas aeruginosa. Inoltre, le infezioni oculari da Staphylococcus aureus meticillino-resistenti (MRSA) stanno aumentando, secondo diversi studi di sorveglianza. Per fornire una copertura ad ampio spettro per le specie più diffuse, gli antibiotici empirici sono spesso raccomandati per queste condizioni senza ricorrere alla caratterizzazione preventiva dell’infezione [2]. Vengono perciò prescritti frequentemente antibiotici ad ampio spettro come fluorochinoloni, gentamicina, tobramicina, polimixina B e trimetoprim. È allarmante vedere che questi antibiotici stanno diventando meno efficaci contro S. aureus e P. aeruginosa, suggerendo l’utilizzo di strategie alternative. Per queste ragioni, è diventato sempre più cruciale l'uso di antisettici nelle fasi perioperatorie. Grazie alla loro efficacia comprovata, iodo-povidone (PVP-I) e la clorexidina sono agenti antisettici ampiamente utilizzati in chirurgia oftalmica [3, 4]. In particolare, PVP-I, un complesso polimerico solubile di iodio, penetra rapidamente nei microorganismi e ossida le macromolecole essenziali (proteine, nucleotidi e acidi grassi), causando la morte microbica. Inoltre, PVP-I mostra un'ampia gamma di azione anche contro virus, funghi, protozoi e alcuni ceppi batterici resistenti agli antibiotici e agli antisettici, nonché biofilm batterici e fungini maturi in vitro ed ex vivo [5]. D'altra parte, la clorexidina, un biguanide sintetico con proprietà surfattanti, mostra un ampio effetto
antibatterico e parziali proprietà antifungine. Agisce interferendo e scomponendo le membrane cellulari microbiche [6]. Anche se vi sono prove solide della loro efficacia e tollerabilità, accettabile nella pratica clinica, sono stati segnalati alcuni effetti avversi associati al loro uso anche a basse concentrazioni, come tossicità dell'epitelio corneale, dolore oculare postoperatorio, difetti epiteliali corneali persistenti e un aumento del rischio di cheratite [7]. Dato il crescente numero di iniezioni intravitreali eseguite ogni anno e l'importanza dell'antisepsi oculare nelle procedure intraoculari, sono necessari approcci alternativi e lo sviluppo di nuove formulazioni. Un disinfettante ideale dovrebbe avere un ampio spettro antimicrobico, azione rapida anche in presenza di materia organica e non essere tossico [8]. In questo contesto, l'olio ozonizzato liposomiale rappresenta una possibile nuova formulazione oculare per la prevenzione e il trattamento delle infezioni oculari. Gli oli ozonizzati sono ottenuti mediante un processo chimico di ozonizzazione di acidi grassi insaturi in oli vegetali, producendo derivati ozonizzati, gli ozonidi, che sono più stabili con acidi grassi rispetto all'ozono stesso, con un tempo di vita relativamente lungo. Questi derivati sono prodotti altamente reattivi con attività battericida, antivirale e antifungina documentata, insieme a proprietà anti-infiammatorie e riparative dei tessuti, che possono essere applicate a diverse patologie come malattie della pelle, patologie della mucosa vaginale, ulcere orali, parodontiti e infezioni oculari [9]. Meccanicamente, i liposomi aderiscono alla superficie del patogeno, inducendo la sua rottura attraverso l'ozonolisi e rilasciando ozonidi. Questi ozonidi infiltrano il patogeno e subiscono idrolisi, generando composti ossigenati come e specie reattive dell'ossigeno (ROS), che contribuiscono ulteriormente all’alterazione delle macromolecole del patogeno e distruggendolo. Di conseguenza, l'olio ozonizzato liposomiale mostra una duplice azione antibatterica: ossidazione diretta della superficie e alterazione delle macromolecole del patogeno [10]. Per preservare ulteriormente le proprietà degli ozonidi e migliorare la loro tollerabilità sulla superficie oculare, è stata recentemente progettata una formulazione basata sull'olio di girasole ozonizzato liposomiale e altri ingredienti per applicazioni oftalmiche. Infatti, l'olio di girasole incorporato nei liposomi può favorire la stabilizzazione della fase lipidica del film lacrimale riducendo l'evaporazione della fase acquosa e garantendo un immediato sollievo. Inoltre, i liposomi contenenti olio ozonizzato
sono spesso inclusi in una soluzione di metilcellulosa di ipromellosa (HPMC), estremamente biocompatibile con il delicato tessuto della superficie oculare [11]. A questo scopo, questo studio ha valutato l'attività antimicrobica e la capacità di ridurre la selezione di batteri resistenti agli antibiotici e la formazione di biofilm di una preparazione di olio ozonizzato liposomiale (Ozodrop, FB Vision, San Benedetto del Tronto, Italia) confrontandola con preparati antiossidanti oftalmici ampiamente utilizzati contenenti PVP-I (Iodim, Medivis, Tremestieri Etneo, Italia) e clorexidina (Dropsept, Sooft, Montegiorgio, Italia) come principi attivi.
Risultati
Azione antimicrobica
Ozodrop contiene oltre all’olio ozonizzato anche: HPMC, acido borico, tetraborato di sodio (che ha caratteristiche antisettiche e astringenti lievi), disodio edetato sodico (usato per rimuovere depositi di calcio dagli occhi), poliexanide (PHMB) e acqua deionizzata. L'efficacia di questa preparazione è stata confrontata con due attivi standard: PVP-I con acido ialuronico e clorexidina con tocoferolo polietilene glicole 1000 succinato, entrambi in preparazioni di colliri.
La concentrazione minima inibente (MIC) è stata determinata utilizzando il metodo di microdiluizione EUCAST, con diluizioni da 50 a 0,3%. Dopo 24 ore di trattamento, è stata misurata la MIC e confrontata con batteri non trattati. La Tabella 1 mostra i valori MIC ottenuti per ciascuna preparazione oftalmica su ceppi batterici corrispondenti. Le tre preparazioni sono state efficaci contro i batteri Gram-positivi, a concentrazioni dal 12,5% al 50%. Solo Ozodrop ha mostrato una MIC quantificabile contro i batteri Gram-negativi, mentre gli altri sono efficaci solo a concentrazione piena del 100%. (Tabella 1)
Azione antibiofilm
Poiché sia P. aeruginosa che S. aureus possono produrre biofilm, è stata valutata la capacità delle tre preparazioni oftalmiche di prevenire la formazione o disgregare il biofilm preesistente. La produzione di biofilm è un processo complesso e multistadio spesso associato a varie specie batteriche. L'adesione alle superfici è un passaggio critico nello sviluppo del biofilm, che porta a diversi cambiamenti metabolici nelle cellule come l'espressione di sostanze polimeriche extracellulari (EPS). Una volta formati, i biofilm diventano resistenti alle risposte del sistema immunitario e al trattamento antibiotico, rendendoli quasi impossibili da rimuovere [12] . Questo studio ha esaminato l'impatto delle tre diverse soluzioni oftalmiche sull'eradicazione del biofilm preformato e sull'inibizione della formazione del biofilm. La percentuale di rimozione della biomassa è stata valutata utilizzando le soluzioni oftalmiche
ai loro valori di MIC. I risultati hanno mostrato che le soluzioni oftalmiche variavano nella loro efficacia nell'eradicare il biofilm, spaziando da accettabile a eccellente. In particolare, la soluzione oftalmica contenente olio di girasole ozonizzato ha dimostrato un'eradicazione superiore del biofilm rispetto alle altre due soluzioni oftalmiche in tutti e tre i batteri testati. Inoltre, tutte e tre le soluzioni oftalmiche hanno dimostrato di essere efficaci nel ridurre la formazione del biofilm, con la soluzione di olio di girasole ozonizzato che ha mostrato la più alta percentuale di riduzione (Figura 1).
Resistenza agli antibiotici
P. aeruginosa, S. aureus e MRSA sono stati anche testati per la resistenza agli antibiotici. Abbiamo selezionato antibiotici approvati dalla FDA utilizzati per curare malattie infettive oftalmiche, tra cui aminoglicosidi (gentamicina, tobramicina e neomicina),
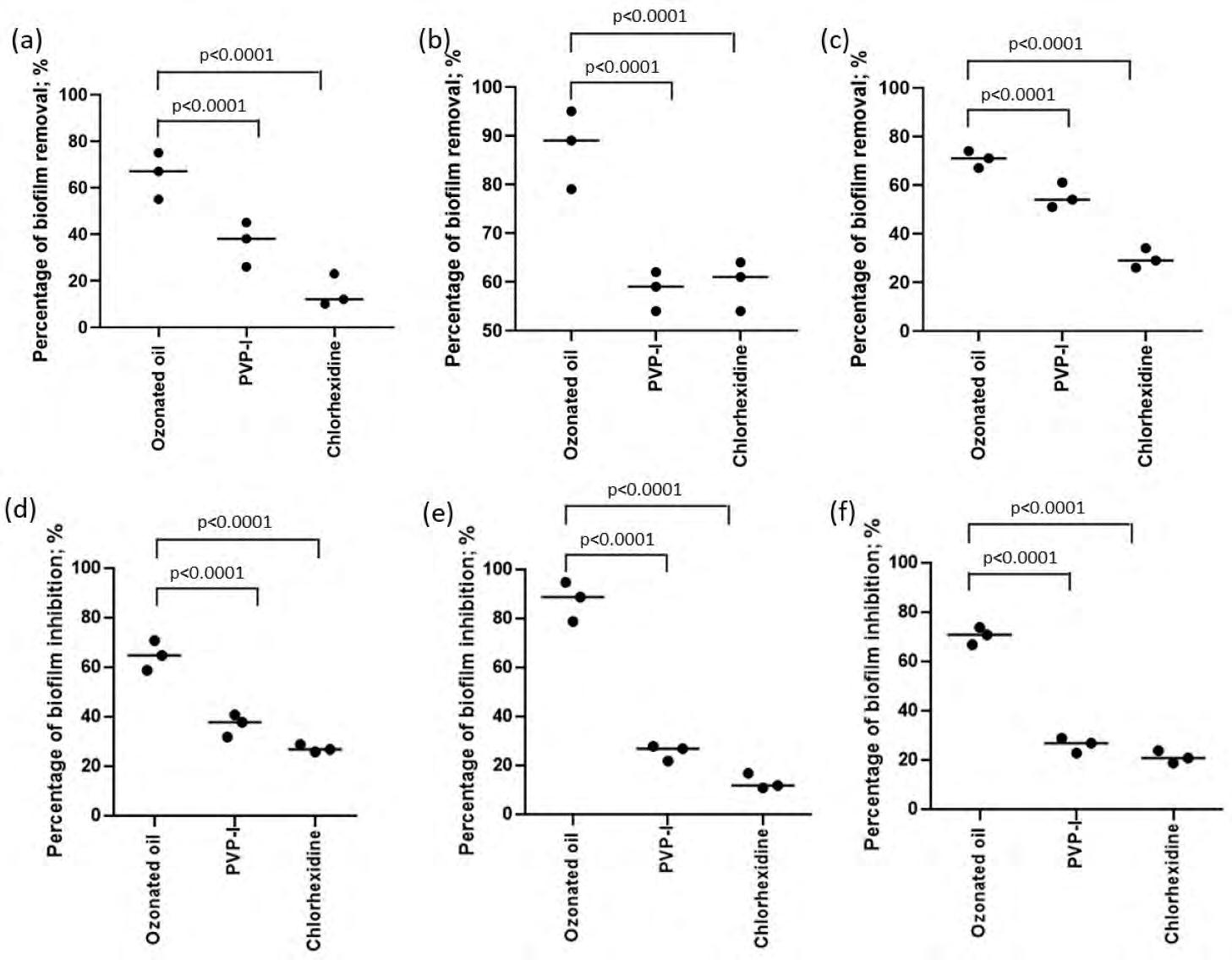

cloramfenicolo, macrolidi (azitromicina e eritromicina), chinoloni (ciprofloxacina, moxifloxacina, besifloxacina, gatifloxacina, levofloxacina e ofloxacina) e tetracicline.
La percentuale dii resistenza è stata determinata seguendo i valori di breakpoint EUCAST per il diametro della zona di inibizione. P. aeruginosa ha mostrato una elevata resistenza al cloramfenicolo, macrolidi e chinoloni mentre S. aureus ha mostrato una elevata resistenza ai macrolidi. Tuttavia, il MRSA ha mostrato una elevata percentuale di resistenza a tutti i trattamenti. Successivamente, abbiamo pretrattato i batteri con le soluzioni oftalmiche per 24 ore prima dell'aggiunta degli antibiotici (Figura 2). Ozodrop ha aumentato la suscettibilità di P. aeruginosa al cloramfenicolo, ai macrolidi e alle tetracicline. Ha anche aumentato la suscettibilità di S. aureus ai macrolidi e del MRSA a tutte le classi antibiotiche testate. PVP-I ha aumentato la suscettibilità di alcune classi seppur non in modo significativo. La clorexidina ha aumentato la suscettibilità di P. aeruginosa al cloramfenicolo ma ne ha aumentato la resistenza ai chinoloni. Ha anche aumentato la resistenza del MRSA alle tetracicline.
Resistenza agli antisettici
P. aeruginosa, S. aureus e MRSA sono stati testati anche per la resistenza agli antisettici stessi. Questi tre ceppi batterici sono stati esposti alla MIC delle tre soluzioni oftalmiche per 7 giorni, sufficienti per far sviluppare eventualmente delle resistenze. Successivamente sono stati registrati i valori di MIC, che sono risultati uguali a quelli ottenuti con sole 24 ore di trattamento, indice che non di sono sviluppati ceppi resistenti nei 7 giorni di trattamento.
Test di adesione batterica
I batteri hanno bisogno di colonizzare il loro ospite per poter infettare. Abbiamo valutato l'effetto dei batteri con o senza pretrattamento con le tre soluzioni oftalmiche sull'adesione cellulare in vitro. In primo luogo, abbiamo valutato la citotossicità delle tre soluzioni oftalmiche alle concentrazioni MIC. La vitalità delle cellule epiteliali corneali HCE-2 è stata valutata dopo 4 ore di esposizione a diluizioni seriali delle soluzioni oftalmiche.
Il test di vitalità ha rivelato che la soluzione oftalmica contenente olio di girasole ozonizzato altera la vitalità cellulare a concentrazioni molto più elevate rispetto a PVP-I e Clorexidina, quindi è meglio tollerato dalle cellule corneali. Abbiamo utilizzato le concentrazioni non tossiche per valutare la capacità di interferire con l'adesione. Il trattamento con tutte le soluzioni oftalmiche ha ridotto l'adesione dei batteri. Entrambe le preparazioni di PVP-I e clorexidina hanno ridotto le UFC dei batteri aderenti del 90%. Tuttavia, la soluzione oftalmica contenente olio di girasole ozonizzato è stata in grado di ridurre l'adesione fino al 99%.
Discussione
In questo studio, abbiamo valutato per la prima volta l'efficacia dell'olio ozonizzato liposomiale nella prevenzione della formazione del biofilm, nell'eliminazione del biofilm preesistente e nel mantenimento della suscettibilità agli antibiotici di diversi ceppi batterici, in confronto con agenti antisettici ampiamente utilizzati come il PVP-I e la clorexidina.
I nostri esperimenti hanno dimostrato e confermato che tutte le tre preparazioni antisettiche hanno mostrato attività microbicida a diverse concentrazioni. Sono state variabilmente efficaci contro i batteri
Gram-positivi, con valori MIC compresi tra 12,5 e 50%. Solo la preparazione di olio di girasole ozonizzato liposomiale ha mostrato una MIC anche contro i batteri Gram-negativi. La novità di questa ricerca risiede nella valutazione dell'effetto delle tre soluzioni oftalmiche sulla formazione del biofilm, sulla suscettibilità agli antibiotici dei batteri e sull'adesione cellulare. La capacità di rimuovere il biofilm preformato è risultata essere da discreta a eccellente, con la soluzione oftalmica contenente olio di girasole ozonizzato che ha mostrato il maggiore effetto rispetto alle altre due soluzioni oftalmiche. Ciò potrebbe essere attribuito al componente liposomiale, che può invadere il biofilm grazie alle sue proprietà fusogene [13] . Per quanto riguarda le antibiotico-resistenze, il trattamento con le soluzioni oftalmiche ha aumentato la suscettibilità agli antibiotici valutati, con la soluzione oftalmica contenente olio di girasole ozonizzato che ha mostrato un'azione più ampia, in particolare contro i macrolidi e il cloramfenicolo, per i tre batteri testati. L'efficacia della soluzione oftalmica contenente olio di girasole ozonizzato potrebbe essere attribuita alla presenza di liposomi, che possono facilitare il trasporto non solo dell'ozono all'interno dei batteri, ma anche degli antibiotici, creando uno spazio nella membrana dove interagiscono. È interessante osservare che un trattamento di 7 giorni con le tre soluzioni antisettiche non ha portato allo sviluppo di resistenze contro gli stessi per tutti i batteri testati, suggerendo la loro efficacia stabile dopo un uso prolungato anche nella pratica clinica.
Infine, i liposomi possono interferire con l'adesione dei batteri alle cellule corneali, come dimostrato dalla riduzione del 99% dei batteri aderenti, quando l'infezione è trattata con la soluzione oftalmica contenente olio di girasole ozonizzato. È importante notare che questo studio ha limitazioni, tra cui l'assenza di isolati clinici e modelli in vivo, ma rappresenta un punto di partenza importante per approfondire il potenziale degli oli ozonizzati liposomiali nelle applicazioni oftalmiche.
Nel complesso, questi risultati suggeriscono che le tre soluzioni oftalmiche antisettiche possono controllare la replicazione batterica, l’adesione e la formazione del biofilm. La soluzione oftalmica contenente olio di girasole ozonizzato ha mostrato una maggiore capacità di controllo della resistenza agli antibiotici, dell'adesione batterica e della formazione del biofilm, supportando la validità del suo utilizzo come antisettico. Inoltre, quando applicata sulla superficie ocu-
lare, questa soluzione non è citotossica, ma al contrario ha proprietà rigenerative e anti-infiammatorie documentate, implicando un possibile utilizzo come coadiuvante in varie patologie oftalmiche caratterizzate da infiammazione, infezione e danni tissutali [14] .
Materiali e metodi
Attività antimicrobica
L'attività antimicrobica è stata valutata contro S. aureus (ATCC 6538), MRSA (ATCC 33591), S. epidermidis (ATCC 12228), P. aeruginosa (ATCC 9027) ed E. coli (ATCC 8739). I ceppi batterici sono stati coltivati a 37 °C in brodo Mueller-Hinton. Per ciascun ceppo, sono stati utilizzati i seguenti antisettici oftalmici: Ozodrop (olio di girasole ozonizzato autoconservante, idrossipropilmetilcellulosa, liposomi, acido borico, tetraborato di sodio, sodio edetato disodico, PHMB, acqua deionizzata - concentrazione non specificata; FB Vision, San Benedetto del Tronto, Italia), Iodim (PVP-I 0,6%, veicolo di acido ialuronico; Medivis, Tremestieri Etneo, Italia), Dropsept (clorossidina 0,02%, 0,5% succinato di tocoferolo polietilenglicole 1000 (TPGS1000); Sooft, Montegiorgio, Italia). L'olio di girasole ozonizzato è stato prodotto in conformità al brevetto IT201600078872A1, garantendo stabilità che soddisfa i requisiti di registrazione descritti nel dossier tecnico presentato all'organismo notificato. Il prodotto è stato valutato e trovato conforme a tutti i requisiti necessari per la commercializzazione. La MIC è stata determinata eseguendo il metodo di microdiluizione in brodo EUCAST definendola come la concentrazione più bassa di farmaco che inibisce la crescita visibile dell'organismo dopo incubazione overnight. Tutti i preparati antisettici oftalmici sono stati diluiti seriamente in PBS 1× utilizzando una diluizione seriale 1:2 volte dallo 0,3 al 100% e incubati con 5 × 10^6 UFC/mL di ciascun microrganismo.
Azione antibiofilm
La quantità di biofilm (preformato o in formazione) viene quantificata facendo formare il biofilm ai batteri in coltura in multiwell da 96 pozzetti. Al termine dei trattamenti e delle incubazioni, il biofilm viene fissato con 200 µL di etanolo al 96% (v/v) per 15 minuti. Successivamente, sono stati aggiunti 200 µL di cristalvioletto allo 0,1% a ciascun pozzetto della piastra per 10 minuti a temperatura ambiente. Le piastre sono state quindi lasciate asciugare all'aria, il cristalvioletto in eccesso è stato sciacquato via e de-
licatamente lavato in soluzione salina. Il colorante è stato quindi disciolto in 200 µL di acido acetico glaciale al 33% (v/v), e la biomassa è stata determinata misurando la densità ottica (OD) a 570 nm utilizzando un lettore di micropiastre (BioTek, Winooski, VT, USA).
Test di suscettibilità agli antibiotici
Utilizzando il tradizionale metodo di diffusione da dischetto (Kirby-Bauer), e dischi antibatterici disponibili commercialmente, i ceppi selezionati sono stati valutati per la loro suscettibilità o resistenza a vari antibiotici. I batteri sono stati coltivati su agar soia triptica (Liofilchem, Roseto degli Abruzzi, Italia) per 24 ore a 37 °C. Le colonie raccolte sono state sospese in acqua sterile fino a una torbidità di 0,5 McFarland, equivalente a 1,5 × 10^8 CFU/mL e successivamente seminate su piastre di agar Mueller-Hinton con i dischetti antibiotici. Dopo 24 ore a 37 °C, il diametro delle zone di inibizione è stato determinato utilizzando un calibro di precisione. La percentuale di resistenza è stata calcolata come 100 − [(Diametro di controllo della zona di inibizione − (Diametro della zona di inibizione del campione / Diametro di controllo della zona di inibizione))] × 100.
Test di citotossicità
La linea cellulare epiteliale corneale umana (HCE2) (ATCC, CRL-11135) è stata coltivata in terreno di coltura senza siero keratinocyte medium (Gibco, Waltham, MA, USA) integrato con 0,05 mg/mL di estratto di ghiandola pituitaria bovina (Gibco, USA), 5 ng/mL di fattore di crescita epidermica, 500 ng/mL di idrocortisone e 0,005 mg/mL di insulina (Gibco, USA) a 37 °C e 5% di CO2. La vitalità cellulare di HCE-2 è stata valutata eseguendo il test colorimetrico MTT (bromuro di 3-[4,5-dimetiltiazol-2-il]-2,5-difeniltetrazolio, Roche, Basilea, Svizzera) secondo il protocollo del produttore. In breve, le cellule HCE-2 sono state seminate in piastre da 96 pozzetti ad una densità di 5 × 10^3 cellule per pozzetto e coltivate durante la notte. Il giorno successivo, le cellule HCE2 sono state trattate con le soluzioni oftalmiche a diverse diluizioni seriali 1:2 (da 50 a 1,5625% v/v) per 4 ore. Dopo il tempo di incubazione, è stato eseguito il test MTT e l'assorbanza è stata misurata a 450 nm utilizzando un lettore di micropiastre (Multiskan FC, Thermo Fisher, Waltham, MA, USA). La citotossicità è stata calcolata come IC50, la concentrazione di un dato agente che risulta letale per il 50% delle cellule.
Test di adesione batterica
Le cellule HCE-2 sono state risospese in terreno di coltura fresco integrato con il 10% di siero senza antibiotici alla concentrazione di 2 × 10^5 cellule/ mL. Un millilitro di sospensione cellulare è stato seminato in tre serie di pozzetti duplicati (uno per ogni ceppo) al centro di una piastra da 24 pozzetti e incubato overnight in un incubatore per colture cellulari. Un singolo isolato di ciascun ceppo batterico è stato inoculato in 5 mL di terreno LB (1% triptone, 0,5% cloruro di sodio, 0,5% estratto di lievito) e cresciuto per 18 ore a 37 °C con agitazione vigorosa (180 rpm).
Le cellule HCE-2 sono state lavate con 1× DPBS caldo e sostituito con 1 mL di terreno fresco integrato con il 10% di siero senza antibiotici. Un'aliquota (10^6 CFU) di ciascuna coltura batterica è stata aggiunta a una serie di pozzetti duplicati contenenti cellule HCE-2 (molteplicità di infezione di 5:1 batteri: cellule) e a un pozzetto senza cellule. Le cellule sono state incubate con i batteri per 3 ore a 37 °C con il 5% di CO2. Al termine, il terreno è stato rimosso dalle cellule infettate, che sono state lavate 3 volte con 1× DPBS caldo. I batteri rimasti in adesione vengono con 100 μL di Triton X-100 al 1% per 10 minuti a temperatura ambiente e quindi aggiunti con 900 μL di terreno LB. Dopo omogeneizzazione delicata, sono state eseguite diluizioni seriali di 10 volte delle sospensioni di batteri aderenti in terreno LB e sono stati seminati 100 μL da 3 diluizioni su terreno LB agar e incubati per 18 ore a 37 °C. Le colonie sono state contate come CFU di batteri aderenti. Per garantire che il trattamento con Triton X-100 al 1% non influenzasse la vitalità dei batteri, è stato eseguito un esperimento di controllo, mantenendo i batteri con e senza Triton X-100 al 1% per 10 minuti e valutando le CFU, come precedentemente riportato [15]. Non abbiamo trovato prove di alcuna differenza nel conteggio delle CFU.
Analisi statistica
Le analisi statistiche sono state eseguite utilizzando il software GraphPad Prism (v.8, San Diego, CA, USA). I dati sono stati confrontati statisticamente utilizzando il test U di Mann-Whitney, poiché tutti i dati non mostravano una distribuzione normale basata sui test di normalità di Kolmogorov-Smirnov e D'Agostino-Pearson. Le percentuali sono state confrontate mediante il test esatto di Fisher. I valori di p < 0,05 sono stati considerati significativi.
1. Lee AE, Niruttan K, Rawson TM, Moore LSP. Antibacterial resistance in ophthalmic infections: a multi-centre analysis across UK care settings. BMC Infect Dis. 2019 Sep 3;19(1):768. doi: 10.1186/s12879-019-4418-0. PMID: 31481023; PMCID: PMC6724305.
2. Asbell PA, Sanfilippo CM, Pillar CM, DeCory HH, Sahm DF, Morris TW. Antibiotic Resistance Among Ocular Pathogens in the United States: Five-Year Results From the Antibiotic Resistance Monitoring in Ocular Microorganisms (ARMOR) Surveillance Study. JAMA Ophthalmol. 2015 Dec;133(12):1445-54. doi: 10.1001/jamaophthalmol.2015.3888. PMID: 26502312.
3. Grzybowski A, Kanclerz P, Myers WG. The use of povidone-iodine in ophthalmology. Curr Opin Ophthalmol. 2018 Jan;29(1):19-32. doi: 10.1097/ICU.0000000000000437. PMID: 28984794.
4. Merani R, McPherson ZE, Luckie AP, Gilhotra JS, Runciman J, Durkin S, Muecke J, Donaldson M, Aralar A, Rao A, Davies PE. Aqueous Chlorhexidine for Intravitreal Injection Antisepsis: A Case Series and Review of the Literature. Ophthalmology. 2016 Dec;123(12):2588-2594. doi: 10.1016/j.ophtha.2016.08.022. Epub 2016 Oct 6. PMID: 27720552.
5. Hoekstra MJ, Westgate SJ, Mueller S. Povidone-iodine ointment demonstrates in vitro efficacy against biofilm formation. Int Wound J. 2017 Feb;14(1):172-179. doi: 10.1111/iwj.12578. Epub 2016 Mar 10. PMID: 26968574; PMCID: PMC7949843. oekstra, M.J.; Westgate, S.J.; Mueller, S. Povidone-iodine Ointment Demonstrates In Vitro Efficacy Against Biofilm Formation. Int. Wound J. 2017
6. Lim KS, Kam PC. Chlorhexidine--pharmacology and clinical applications. Anaesth Intensive Care. 2008 Jul;36(4):502-12. doi: 10.1177/0310057X0803600404. PMID: 18714617.
7. Oakley C, Allen P, Hooshmand J, Vote BJT. PAIN AND ANTISEPSIS AFTER OCULAR ADMINISTRATION OF POVIDONE-IODINE VERSUS CHLORHEXIDINE. Retina. 2018 Oct;38(10):2064-2066. doi: 10.1097/IAE.0000000000001800. PMID: 28796148.
8. Artasensi A, Mazzotta S, Fumagalli L. Back to Basics: Choosing the Appropriate Surface Disinfectant. Antibiotics (Basel). 2021 May 21;10(6):613. doi: 10.3390/antibiotics10060613. PMID: 34063833; PMCID: PMC8224088.
9. Ugazio E, Tullio V, Binello A, Tagliapietra S, Dosio F. Ozonated Oils as Antimicrobial Systems in Topical Applications. Their Characterization, Current Applications, and Advances in Improved Delivery Techniques. Molecules. 2020 Jan 14;25(2):334. doi: 10.3390/molecules25020334. PMID: 31947580; PMCID: PMC7024311.
10. Zeng J, Lu J. Mechanisms of action involved in ozone-therapy in skin diseases. Int Immunopharmacol. 2018 Mar;56:235-241. doi: 10.1016/j. intimp.2018.01.040. Epub 2018 Feb 3. PMID: 29414657.
11. Pérez-Santonja JJ, Güell JL, Gris O, Vázquez Dorrego XM, Pellicer E, Benítez-Del-Castillo JM. Liposomal Ozonated Oil in Ocular Infections: A Review of Preclinical and Clinical Studies, Focusing on Its Antiseptic and Regenerative Properties. Clin Ophthalmol. 2022 Jun 14;16:19531962. doi: 10.2147/OPTH.S360929. PMID: 35726319; PMCID: PMC9206455.
12. Perez AP, Perez N, Lozano CMS, Altube MJ, de Farias MA, Portugal RV, Buzzola F, Morilla MJ, Romero EL. The anti MRSA biofilm activity of Thymus vulgaris essential oil in nanovesicles. Phytomedicine. 2019 Apr;57:339-351. doi: 10.1016/j.phymed.2018.12.025. Epub 2019 Jan 3. PMID: 30826631.
13. Wang Y. Liposome as a delivery system for the treatment of biofilm-mediated infections. J Appl Microbiol. 2021 Dec;131(6):2626-2639. doi: 10.1111/jam.15053. Epub 2021 Mar 12. PMID: 33650748.
14. Cutarelli, A. , Carlini, G. , Sarno, F. , Nebbioso, A. , Garofalo, F. , Altucci, L. and Corrado, F. (2019) The Role of Ozone Carried by Liposomes in the Therapy of Infectious and Skin-Regenerating Ocular Surface. Journal of Biomedical Science and Engineering, 12, 347-353. doi: 10.4236/ jbise.2019.127026.
15. Letourneau J, Levesque C, Berthiaume F, Jacques M, Mourez M. In vitro assay of bacterial adhesion onto mammalian epithelial cells. J Vis Exp. 2011 May 16;(51):2783. doi: 10.3791/2783. PMID: 21633326; PMCID: PMC3197129.
Atlante di diagnostica oculare
Guida alla interpretazione delle immagini: Ecografia, OCT, OCTA, Fluorangiografia
Luisa Pierro





Le lenti da vista MiYOSMART correggono la miopia e ne rallentano la progressione. La loro efficacia è provata a livello globale da solide evidenze scientifiche. Nel mondo, oltre 2,5 milioni di giovani miopi, di cui circa 70.000 in Italia, ne beneficiano, perché semplici da usare ed efficaci.
Per informazioni, è possibile contattare la propria Medical Relations Specialist di riferimento o scrivere a oculisti@hoya.it
Hoya Italia


La Sua esperienza nel mondo della chirurgia vitreoretinica nasce più di 20 anni fa, con una formazione maturata all’estero, in Olanda, per poi trasferirsi a Negrar. Molte saranno le differenze e i miglioramenti nel corso di questi anni che Lei ha vissuto.
Sì, certamente la chirurgia vitreoretinica ha avuto degli enormi sviluppi, sia nelle tecniche chirurgiche che ancor più nell’evoluzione tecnica e tecnologica di cui hanno logicamente beneficiato i pazienti.
Ricordo, per esempio, che all’inizio il calibro degli strumenti adoperati era apparentemente piccolo, 20G, ma in effetti sufficientemente grande per la nostra microchirurgia da richiedere punti di sutura sulla incisione sclerale.
 Vittorio Picardo intervista Grazia Pertile
Vittorio Picardo intervista Grazia Pertile
Quali le più importanti novità nelle unità per vitrectomia?
La prima novità è la diminuzione del calibro della strumentazione endoculare, delle sorgenti luminose e l’importante innovazione dei trocar valvolati. Tutto questo ha consentito una gestione ancor più mininvasiva nella chirurgia vitreoretinica che, per la maggior parte degli interventi di routine, permette la dimissione del paziente poche ore dopo la fine della chirurgia. Altro elemento importante è stato il miglioramento delle sorgenti luminose con l’utilizzo di luci fredde che hanno ridotto i pericoli legati alla foto tossicità da utilizzo prolungato o molto vicino alla superficie retinica. A queste sorgenti di illuminazioni vanno aggiunti anche i sistemi a candeliere che, da soli o in associazione alla sorgente luminosa tradizionale, in alcune fasi della chirurgia consentono al chirurgo delle manovre bimanuali con aumento della sicurezza e dell’efficacia della manovra chirurgica.
Da qualche tempo esistono anche i coloranti specifici per la chirurgia vitreo retinica Sì certamente. L’uso di questi devices ha ulteriormente agevolato la sicurezza e la precisione di questa chirurgia. Il triamcinolone viene adoperato da tempo sia come sistema per evidenziare la trama vitreale che per le proprietà antiinfiammatorie. Da alcuni anni sono presenti nel mercato dei coloranti elettivi, alcuni addirittura medicati con luteina che permettono di identificare con precisione alcune strutture come la corticale vitreale, le membrane epiretiniche o la membrana limitante interna.

Dottoressa Pertile, possiamo allora dire che la chirurgica maculare può essere una chirurgia riabilitativa della visione?
Direi di sì, perché dopo aver diagnosticato la patologia vitreo maculare che produce metamorfopsie e perdita di qualità e di quantità del visus del nostro paziente, l’intervento permette spesso di ottenere un’ottima ripresa funzionale, se l’intervento viene condotto nei tempi e nei modi corretti. Purtroppo però, la struttura maculare è simile ad un reticolo molto fitto e regolare che, una volta deformato, non può recuperare completamente la configurazione originale.
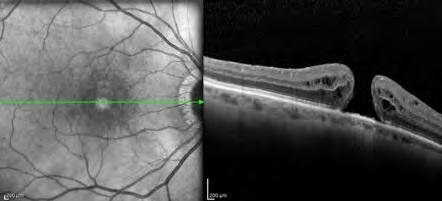

E per le patologie più gravi, come il foro maculare di grandi dimensioni?
Anche in questi casi, si riescono ad ottenere risultati molto validi sia dal punto di vista anatomico che funzionale con le tecniche di riempimento di ricoprimento del foro maculare, effettuando il cosiddetto inverted flap nella quale il chirurgo non libera completamente la superficie retinica dalla limitante interna, ma addirittura la adopera per posizionarla nel foro per facilitare il meccanismo di auto riparazione. In alternativa, viene utilizzata lo stesso scopo anche con la membrana amniotica o con un frammento di retina autologa prelevata dalla periferia. In fori di dimensioni relativamente piccole o fori non a tutto spessore viene anche utilizzato un concentrato di piastrine ottenuto facendo centrifugare il sangue ottenuto dal paziente stesso.
I sistemi panoramici per la chirurgia vitreoretinica e l’apparecchiatura per la visualizzazione in 3D sono oggi fattori determinanti nello svolgimento della chirurgia vitreoretinica?
Indubbiamente sì, perché quanto migliore è la visualizzazione, tanto più precisa può essere la chirurgia. I cosiddetti sistemi di visualizzazione panoramica, ossia sistemi ottici che permettono di avere una buona immagine anche della parte più periferica della retina, e hanno permesso di migliorare significativamente i risultati degli interventi più complessi. Negli ultimi anni si stanno perfezionando i sistemi di

visualizzazione in 3D ancora oggi prevalentemente analogici, ma è stata recentemente introdotta la prima apparecchiatura digitale che, tra l’altro, sto provando in questi giorni.
Ma i microscopi sono oggi anche …pluri accessoriati Sì è vero, la maggior parte dei microscopi operatori, in fondo anche per il segmento anteriore, hanno dei sistemi OCT integrati che aiutano molto spesso il chirurgo nelle sue manovre intraoculari. In alcuni sistemi 3D il chirurgo riesce a visualizzare sullo schermo una serie di dati clinici provenienti da differenti apparecchiature, come topografo, OCT, e alcune informazioni provenienti dalla cartella clinica digitalizzata. Tutto questo è possibile con maggiore facilità quando si lavori con piattaforme integrate che possono mettere in rete tutto il materiale acquisito in fase pre-operatoria direttamente sullo schermo in sala operatoria, a cominciare dal diametro della capsuloressi e gli assi per impiantare le lenti toriche Insomma, il futuro è già nelle nostre sale operatorie e tutto questo obbliga noi chirurghi vitreoretinici, ma in fondo anche i chirurghi di altre specialità, a doversi interfacciare rapidamente con queste evoluzioni tecniche e tecnologiche che, apparentemente sembrerebbero sminuire il ruolo del chirurgo, ma che a mio avviso, invece, sono uno stimolo a fare meglio e con più sicurezza. Un capitolo a parte potrà essere un domani la chirurgia robotica e la partecipazione dell’intelligenza artificiale nelle nostre attività professionali.












Caputo1,
Massimiliano Serafino2, Paolo Nucci31. Direttore S.O.C. Oftalmologia Pediatrica A.O.U. A. Meyer I.R.C.C.S. Firenze
2. Direttore S.O.C. Oftalmologia Pediatrica I.R.C.C.S. Istituto G. Gaslini Genova
3. Professore Ordinario di Oftalmologia Facoltà di Medicina Dipartimento di Scienze Biomediche, Chirurgiche e Odontoiatriche - Università di Milano

Roberto Caputo
Epidemiologia ed importanza socioeconomica
Negli ultimi anni si è assistito ad un aumento progressivo della prevalenza della miopia nella popolazione giovanile. Questo fenomeno ha raggiunto picchi veramente elevati nelle popolazioni asiatiche (anche il 70%)1 ma con incrementi consistenti anche nei paesi occidentali2,3 fino ad ipotizzare la presenza di circa 5 miliardi di miopi nel 2050 con oltre 800 milioni di miopi elevati4. Questo dato è talmente evidente e di importanza socioeconomica, da aver indotto l’American Academy of Ophthalmology’s Board of Trustees a creare una Task Force sulla miopia4.
Pur conoscendo l’importanza dell’ereditarietà nella miopia, questo fattore non può essere stato chiamato in causa per giustificare l’aumento di questi ultimi decenni.
Sono quindi stati studiati vari fattori ambientali come cofattori causali nell’aumento della prevalenza miopica e della progressione della stessa.
Pur non essendoci una totale convergenza di tutti gli studi, da un punto di vista epidemiologico e statistico, l’attività da vicino5-7, soprattutto come alto livello educazionale8 e la riduzione dell’attività all’aria aperta9,10 sembrano essere tra i fattori principali che possano giustificare questo cambiamento, soprattutto come fattori aggravanti in soggetti geneticamente predisposti.
È ben noto tra gli oftalmologi, quanto la miopia possa essere associata ad una maggiore incidenza di complicanze come la cataratta11, glaucoma12,13, distacco di retina14, e maculopatia15 e che queste complicanze aumentano con la progressione del difetto refrattivo.
Strategie
Alla luce di questi dati epidemiologici, negli ultimi decenni sono state studiate numerose strategie vol-
te a rallentare la progressione miopica. Nel 2016 su Ophthalmology è stata pubblicata una metanalisi che ha valutato l’efficacia di 16 tipi di trattamento nel controllo della progressione miopica16. Da questa review è emerso che i colliri a base di Atropina sono il trattamento con la maggior efficacia, mentre la pirenzepina, l’ortocheratologia e le lenti a contatto a defocus avevano un effetto moderato. Risultavano invece scarsamente efficaci gli occhiali con lenti a defocus e le lenti a contatto morbide e gas permeabili monofocali.
Negli ultimi anni però sono aumentati gli studi soprattutto sull’atropina e su nuove tecnologie di lenti a defocus di cui andrò a parlare un po’ più approfonditamente.
Sono centinaia gli studi ad oggi pubblicati che hanno dimostrato l’efficacia dell’atropina nel contenimento della progressione miopica. Il primo di una grandissima importanza è stato lo studio ATOM 1 (Atropine for the Treatment Of Myopia)17 pubblicato nel 2006 che ha valutato l’efficacia dell’atropina in collirio alla concentrazione del 1% rispetto al placebo. Ciononostante, l’atropina a quella concentrazione provoca una midriasi ed un blocco dell’accomodazione incompatibili con un uso clinico e presenta un marcato effetto rebound alla sospensione. Il cambio di paradigma è avvenuto nel 2012 con la pubblicazione dello studio ATOM 2 che valutava l’efficacia e la sicurezza di varie concentrazioni di atropina, 0.5%, 0.1% e 0.01%18 e le confrontava con i risultati dell’ATOM 1 dimostrando che l’efficacia era proporzionale alla concentrazione del farmaco ma lo era anche l’effetto rebound alla sospensione. Finalmente nel 2016 gli stessi autori hanno pubblicato il follow up a 5 anni dello studio
ATOM 2 sottolineando che l’atropina 0.01% nel lungo tempo aveva un buon effetto sul contenimento della progressione miopica, scarsi effetti collaterali e pochissimo rebound alla sospensione19. Numerosi altri studi hanno poi cercato di dimostrare l’efficacia di questa concentrazione anche in popolazioni non asiatiche con buoni risultati20-22 anche se recenti lavori hanno posto il dubbio che lo 0.01% potesse non essere così efficace23. Proprio alla ricerca del miglior rapporto tra efficacia ed effetti collaterali, i ricercatori dello studio LAMP Low-Concentration Atropine for Myopia Progression) hanno confrontato i risultati di 3 tipi di concentrazione di atropina: 0.05%, 0.025%, 0.01% confermando che maggiore e la concentrazione e maggiore è l’efficacia, con lo 0.05% che dimostrava avere un ottimo rapporto efficacia/sicurezza24-26. Da un punto di vista del meccanismo patogenetico, ancora non è ben chiaro quale sia il percorso biochimico che porta il collirio a base di atropina, a ridurre la progressione miopica. Si tratta sicuramente di un meccanismo muscarinico che agisce probabilmente a livello di recettori sclerali, coroideali e forse retinici. Sicuramente sappiamo che non agisce tramite una riduzione dell’accomodazione in quanto efficace anche
nei polli, dove l’accomodazione non è muscarinica, e in soggetti deprivati del nucleo di Edinger Westphal. Possiamo quindi concludere che l’atropina è efficace ma che ancora non è perfettamente chiaro quale sia la concentrazione migliore e quali siano le variabili per cui alcuni soggetti rispondono meglio di altri al trattamento, cosa per altro presente per qualsiasi farmaco o trattamento anche di altre malattie.
Come avevo precedentemente accennato, fino al 2016 gli studi sul defocus non avevano dimostrato una grande efficacia nel controllo della progressione miopica nei giovani16. Negli ultimi anni però, alcune aziende produttrici di lenti, hanno fatto studiare l’efficacia di due nuove tecnologie di defocus per il controllo della progressione miopica. Queste tecnologie, nello specifico la DIMS (Defocus Incorporated Multiple Segments) e HALT (Highly Aspherical Lenslets Target) hanno la parte centrale della lente con la refrazione scelta dall’oftalmologo, mentre la periferia è formata da micro lenti defocalizzate al davanti del piano retinico, alternate a zone di focalizzazione normale) I lavori pubblicati
 Roberto Caputo, Massimiliano Serafino, Paolo Nucci
Foto di Andriyko Podilnyk su Unsplash
Roberto Caputo, Massimiliano Serafino, Paolo Nucci
Foto di Andriyko Podilnyk su Unsplash

hanno evidenziato un’efficacia di circa il 50-60% nel controllo della progressione miopica per entrambi i tipi di tecnologia27-32. Il razionale che sta alla base del defocus è che la lente monofocale e la forma non perfettamente sferica del bulbo, provocano uno spostamento del fuoco posteriormente alla retina nella parte periferica dell’occhio, comportano uno stimolo all’allungamento del bulbo e conseguente progressione della miopia. Una defocalizzazione al davanti del piano retinico sarebbe quindi un freno a questo stimolo.
Viene quindi spontaneo chiedersi se l’associazione di entrambe le tecnologie potesse aumentare l’efficacia rispetto alle stesse utilizzate singolarmente. Un recente studio fatto da un’equipe internazionale coordinata da Nucci, ha in effetti dimostrato come, l’utilizzo contemporaneo di lenti a defocus con tecnologia DIMS associate all’uso di atropina 0.01%, fosse maggiormente efficace se confrontato con i singoli trattamenti33
Take home messages
• La prevalenza della miopia è in forte aumento sia nelle popolazioni asiatiche che nei paesi occidentali
• A questo ne può conseguire un aumento delle complicanze legate alla miopia e i costi sociali conseguenti
• L’atropina a bassa concentrazione è efficacie nel trattamento della progressione miopica, anche se non è ancora chiara la miglior concentrazione. Proprio per questo penso possano esistere due tipi di approccio:
– Nei bambini più piccoli, in cui la progressione è più rapida iniziare con 0.05% ed eventualmente ridurre allo 0.01% con il crescere dell’età
– Oppure iniziare con lo 0.01% e passare allo 0.05% in quelli che rispondono poco al trattamento.
• Le lenti a defocus con tecnologia DIMS o HALT hanno ad oggi dimostrato una buona efficacia e possono essere usate in associazione con l’atropina avendo con essa un effetto addizionale.
Bibliografia
1. Guo, K., et al., Prevalence of myopia in schoolchildren in Ejina: the Gobi Desert Children Eye Study. Invest Ophthalmol Vis Sci, 2015. 56(3): p. 1769-74.
2. Susan Vitale, P., MHS; Robert D. Sperduto, MD; Frederick L. Ferris III, MD, Increased Prevalence of Myopia in the United States Between 1971-1972 and 1999-2004. Arch Ophthalmol, 2009. 127(12): p. 1632.
3. Williams, K.M., et al., Increasing Prevalence of Myopia in Europe and the Impact of Education. Ophthalmology, 2015. 122(7): p. 1489-97.
4. Modjtahedi, B.S., et al., Reducing the Global Burden of Myopia by Delaying the Onset of Myopia and Reducing Myopic Progression in Children: The Academy's Task Force on Myopia. Ophthalmology, 2021. 128(6): p. 816-826.
5. Ip, J., Role of Near Work in Myopia: Findings in a Sample of Australian School Children. IOVS, 2008.
6. Huang, H.M., D.S. Chang, and P.C. Wu, The Association between Near Work Activities and Myopia in Children-A Systematic Review and Meta-Analysis. PLoS One, 2015. 10(10): p. e0140419.
7. Guo, Y., et al., Outdoor activity and myopia among primary students in rural and urban regions of Beijing. Ophthalmology, 2013. 120(2): p. 277-83.
8. Verhoeven, V.J., et al., Education influences the role of genetics in myopia. Eur J Epidemiol, 2013. 28(12): p. 973-80.
9. Ningli Wang; for the Anyang Childhood Eye Study Group, S.-M.L.H.L.S.-Y.L.L.-R.L.M.-T.K.Y.-P.W.F.Z.S.-Y.Z.B.G.P.M., Time Outdoors and Myopia Progression Over 2 Years in Chinese Children: The Anyang Childhood Eye Study. IOVS, 2015. 56(8): p. 4734-40.
10. He, M., et al., Effect of Time Spent Outdoors at School on the Development of Myopia Among Children in China: A Randomized Clinical Trial. JAMA, 2015. 314(11): p. 1142-8.
11. Kanthan, G.L., et al., Myopia and the long-term incidence of cataract and cataract surgery: the Blue Mountains Eye Study. Clin Exp Ophthalmol, 2014. 42(4): p. 347-53.
12. Qiu, M., et al., Association between myopia and glaucoma in the United States population. Invest Ophthalmol Vis Sci, 2013. 54(1): p. 830-5.
13. Mitchell, P., et al., The relationship between glaucoma and myopia. Ophthalmology, 1999. 106(10): p. 2010-2015.
14. Ludwig, C.A., et al., Epidemiology of rhegmatogenous retinal detachment in commercially insured myopes in the United States. Sci Rep, 2023. 13(1): p. 9430.
15. Wong, T.Y., et al., Epidemiology and disease burden of pathologic myopia and myopic choroidal neovascularization: an evidence-based systematic review. Am J Ophthalmol, 2014. 157(1): p. 9-25 e12.
16. Huang, J., et al., Efficacy Comparison of 16 Interventions for Myopia Control in Children: A Network Meta-analysis. Ophthalmology, 2016. 123(4): p. 697-708.
17. Chua, W.H., et al., Atropine for the treatment of childhood myopia. Ophthalmology, 2006. 113(12): p. 2285-91.
18. Chia, A., et al., Atropine for the treatment of childhood myopia: safety and efficacy of 0.5%, 0.1%, and 0.01% doses (Atropine for the Treatment of Myopia 2). Ophthalmology, 2012. 119(2): p. 347-54.
19. Chia, A., Q.S. Lu, and D. Tan, Five-Year Clinical Trial on Atropine for the Treatment of Myopia 2: Myopia Control with Atropine 0.01% Eyedrops. Ophthalmology, 2016. 123(2): p. 391-9.
20. Sacchi, M., et al., Efficacy of atropine 0.01% for the treatment of childhood myopia in European patients. Acta Ophthalmol, 2019. 97(8): p. e1136-e1140.
21. Moriche-Carretero, M., et al., Five-year results of atropine 0.01% efficacy in the myopia control in a European population. Br J Ophthalmol, 2023.
22. Zadnik, K., et al., Efficacy and Safety of 0.01% and 0.02% Atropine for the Treatment of Pediatric Myopia Progression Over 3 Years: A Randomized Clinical Trial. JAMA Ophthalmol, 2023.
23. Repka, M.X., et al., Low-Dose 0.01% Atropine Eye Drops vs Placebo for Myopia Control: A Randomized Clinical Trial. JAMA Ophthalmol, 2023.
24. Yam, J.C., et al., Low-Concentration Atropine for Myopia Progression (LAMP) Study: A Randomized, Double-Blinded, Placebo-Controlled Trial of 0.05%, 0.025%, and 0.01% Atropine Eye Drops in Myopia Control. Ophthalmology, 2019. 126(1): p. 113-124.
25. Yam, J.C., et al., Two-Year Clinical Trial of the Low-Concentration Atropine for Myopia Progression (LAMP) Study: Phase 2 Report. Ophthalmology, 2020. 127(7): p. 910-919.
26. Yam, J.C., et al., Three-Year Clinical Trial of Low-Concentration Atropine for Myopia Progression (LAMP) Study: Continued Versus Washout: Phase 3 Report. Ophthalmology, 2022. 129(3): p. 308-321.
27. Sankaridurg, P., et al., Spectacle Lenses With Highly Aspherical Lenslets for Slowing Myopia: A Randomized, Double-Blind, Cross-Over Clinical Trial: Parts of these data were presented as a poster at the Annual Research in Vision and Ophthalmology meeting, 2022. Am J Ophthalmol, 2023. 247: p. 18-24.
28. Li, X., et al., Myopia Control Efficacy of Spectacle Lenses With Aspherical Lenslets: Results of a 3-Year Follow-Up Study. Am J Ophthalmol, 2023. 253: p. 160-168.
29. Bao J, P.Y.H., MD; Xue Li, PhD; Adeline Yang, MSc; Fengchao Zhou, BSc; Junqian Wu, BSc; Chu Wang, BSc; Yuhao Li, BSc; Ee Woon Lim, BSc; Daniel P. Spiegel, PhD; Björn Drobe, PhD; Hao Chen, MD, OD, Spectacle Lenses With Aspherical Lenslets for Myopia Control vs Single-Vision Spectacle Lenses A Randomized Clinical Trial. JAMA Ophthalmology, 2022. 140(5): p. 472-478.
30. Lam, C.S.Y., et al., Defocus Incorporated Multiple Segments (DIMS) spectacle lenses slow myopia progression: a 2-year randomised clinical trial. Br J Ophthalmol, 2020. 104(3): p. 363-368.
31. Lam, C.S., et al., Myopia control effect of defocus incorporated multiple segments (DIMS) spectacle lens in Chinese children: results of a 3-year follow-up study. Br J Ophthalmol, 2021.
32. Lam, C.S.Y., et al., Long-term myopia control effect and safety in children wearing DIMS spectacle lenses for 6 years. Sci Rep, 2023. 13(1): p. 5475.
33. Nucci, P., et al., A comparison of myopia control in European children and adolescents with defocus incorporated multiple segments (DIMS) spectacles, atropine, and combined DIMS/atropine. Plos One, 2023. 18(2).
Emilio Balestrazzi1, Luigi Mosca2, Maria Ilaria Giannico3, Alessandra Mastrocola4, Patrizio Bernardinelli2, Angelo Balestrazzi5
1. Studio Oculistico Associato Balestrazzi, Roma
2. Istituto di Oftalmologia, Università Cattolica del S. Cuore, Roma
3. U.O.C. Oculistica, Ospedale S. Eugenio, Roma
4. Clinica Pierangeli gruppo Synergo SRL, Pescara
5. U.O.C. Oculistica, Ospedale Misericordia, Grosseto
Esattamente 51 anni fa, nel 1972, nella Clinica Oculistica dell’Università di Bari, iniziavo ad eseguire i miei primi interventi di chirurgia del glaucoma. A quell’epoca erano ancora in auge vecchi interventi che risalivano addirittura al secolo precedente quando Albrecht von Graefe, nel 1857, propose di eseguire un’iridectomia per curare un attacco acuto di glaucoma e realizzò un’osservazione molto importante secondo cui la presenza di una cystic wound risultava in una riduzione del tono oculare.
Nel 1867 De Wecker, ideatore delle microforbici iridee che portano il suo nome, propose una tecnica di sclerectomia anteriore, eseguita 1 mm posteriormente al limbus, così da permettere un drenaggio dell’umore acqueo dall’interno dell’occhio allo spazio sottocongiuntivale.
Fin da allora si realizzò però che il maggior problema di questi interventi era legato ai processi di guarigione e di cicatrizzazione conseguenti che potevano finire con il vanificare la filtrazione ottenuta, bloccandola per mezzo di fenomeni di fibrosi cicatriziale. Vari materiali allogenici furono impiegati allo scopo di mantenere pervia la via di fistolizzazione ottenuta, ma con scarsi successi, tanto che tali metodiche vennero abbandonate a favore dell’iridencleisis, proposta nel 1906 da Holt e poi praticamente abbandonata a causa delle sue complicanze (Harris, 1961).
Quest’ultima tecnica, che prevedeva l’inserimento nella ferita chirurgica, provocata dalla sclerectomia, di un lembetto di iride, ottenuto da un’incisione ra-

Emilio Balestrazzi
diale a tutto spessore dall’orletto fino alla radice, ad ore 12 ed in continuità con l’iride rimasta in camera anteriore, mirava ad impedire la chiusura della filtrazione per mezzo di un tessuto autologo che mantenesse in qualche modo beante la fistola creata. Tale tecnica aveva percentuali di successo discrete, così come le tecniche di filtrazione non protette che descriveremo in seguito e fu abbandonata del tutto, almeno per la nostra esperienza, solo dopo l’avvento della trabeculectomia, prima tecnica di filtrazione protetta, all’inizio degli anni 70.
Nel 1909 Elliot aveva proposto una tecnica filtrante non protetta che consisteva in una trapanazione corneo-sclerale, con un trapano calibrato, ricoperta dalla sola congiuntiva.
Anche Lagrange (1906) e Scheie (1958) descrissero tecniche di sclerectomia limbare rispettivamente senza e con cauterizzazione dei bordi della ferita chirurgica.
Tali tecniche vennero largamente ed a lungo impiegate pur con le complicanze legate alla mancata, adeguata protezione della fistola ricoperta e protetta dalla sola congiuntiva, finché nel 1968 Cairns introdusse la trabeculectomia.
In realtà una tecnica simile era stata descritta da Sugar nel 1961 e soprattutto dall’italiano Castelli nel 1965, ma furono i lavori in lingua inglese di Cairns a renderla popolare ed a farla adottare quasi universalmente, come, per quanto riguarda l’Italia e noi stessi, solo dal 1975, parallelamente alla diffusione del mi-
croscopio operatorio nella chirurgia oculare. (Balestrazzi ed al., 1987).
La tecnica prevedeva l’asportazione di un tassello sclerale comprendente il trabecolato corneosclerale, ma questa volta la ferita chirurgica era ricoperta e protetta da uno sportello sclerale base limbus, a sua volta ricoperto dalla capsula di Tenone e dalla congiuntiva.
Cairns aveva ipotizzato che, con tale tecnica, il deflusso dell’umore acqueo, proveniente dalla camera anteriore, si realizzasse, attraverso l’apertura provocata dalla trabeculectomia, per la via degli osti dei monconi beanti del canale di Schlemm e quindi delle vene acquose.
Si è compreso poi che il principale meccanismo di deflusso avvenisse in realtà per la via intrasclerale e sottocongiuntivale, come per tutti gli interventi fistolizzanti precedenti.
La principale differenza consisteva nella maggior protezione della filtrazione, garantita dallo sportello sclerale e dalla maggiore precisione delle manovre chirurgiche eseguite al microscopio ciò che garantiva un miglior rispetto dell’anatomia chirurgica. Numerose varianti alla tecnica originale sono state proposte nel tempo, allo scopo di ridurre le complicazioni ed aumentare le percentuali di successo ed hanno contribuito, assieme all’introduzione dell’utilizzo degli antifibrotici, a far sì che questa rimanga l’unica tecnica chirurgica antiglaucoma in grado di portare la pressione intraoculare (IOP) a valori tra i 10 ed i 15 mmHg (Khaw et al. 2017).
Per questo motivo, fin dalla sua descrizione, la trabeculectomia è stata la chirurgia incisionale più largamente utilizzata, da sola o in combinazione con la chirurgia della cataratta, per il trattamento chirurgico di vari tipi di glaucoma (Koike and Chang 2018).
Questa longevità della procedura, davvero unica, più di 50 anni, potrebbe sorprendere, se si considerano le numerose segnalazioni di complicanze anche gravi per la funzione visiva e per la qualità di vita (Megevand et al. 2021)
Il fatto è che altre tecniche proposte nel tempo ed abbandonate, spesso dopo un breve periodo, non hanno mai raggiunto la popolarità e l’universalità di impiego della trabeculectomia (Rodriguez-Una et al. 2017) a causa di un insufficiente controllo della IOP, della difficoltà di tecnica e di esecuzione, di una lunga curva di apprendimento o per costi elevati. Per questi motivi la trabeculectomia, con l’uso aggiuntivo di Mitomicina C, è ancora considerata il gold standard della chirurgia del glau-
coma, a cui si fa riferimento per comparazione dei risultati di tutte le altre procedure chirurgiche antiglaucoma (Megevand et al. 2020).
Considerazioni
Molti fattori di rischio sono stati nel tempo considerati ed acclarati per quanto riguarda il fallimento della procedura ed i fenomeni di guarigione della ferita chirurgica, strettamente connessi tra di loro.
Ma non è su questi che desideriamo focalizzare la nostra attenzione quanto piuttosto su altri aspetti della tecnica chirurgica e sulle numerose variazioni alla tecnica originale, ciò che ha reso difficile eseguire studi comparativi tra procedure, definite con la stessa denominazione, ma spesso in realtà ben diverse tra loro.
Non è quindi nostra intenzione procedere ad alcun tipo di raffronto tra la trabeculectomia ed altre tecniche chirurgiche antiglaucoma, comprese quelle più recenti che più o meno impropriamente vanno sotto il nome di MIGS.
Scopo di questa trattazione è invece quello di dimostrare che le singole varianti di tecnica non sono assolutamente ininfluenti, come si è spesso affermato, nel determinare o meno alcune complicazioni, come nel consentire una maggiore o minore percentuale di successi chirurgici.
Tutto ciò potrebbe a nostro avviso configurare la individuazione, tra le varianti di tecnica, di veri e propri fattori di rischio ai fini sia delle complicanze che dei successi operatori.
Procederemo quindi alla disamina dei singoli tempi chirurgici della procedura, partendo dal presupposto che la trabeculectomia andrebbe secondo noi sempre associata, tranne nel glaucoma giovanile, alla facoemulsificazione del cristallino, la cui presenza costituisce spesso una delle principali cause di alcune tra le più temibili complicazioni.
La chirurgia in Oftalmologia ha compiuto enormi passi in avanti negli ultimi decenni grazie all’introduzione di moderne tecniche chirurgiche mininvasive ed all’ausilio di laser di ultima generazione (basti pensare alla moderna facoemulsificazione, alla femtocataract, alle innovazioni nell’ambito della correzione dei difetti rifrattivi con laser ad eccimeri ed a femtosecondi, alla moderna chirurgia vitreoretinica in 3D, ecc..).
Tuttavia, nonostante ripetuti tentativi, la chirurgia del glaucoma rimane, ad oggi, quella che ha registrato i minori progressi negli ultimi 40-50 anni. Perché? Si tratta di una chirurgia meno predittibile e meno
dosabile, poiché legata a diverse variabili di esecuzione tecnica, spesso eseguita in tempi troppo tardivi, con compromissione talora irreversibile della funzionalità del nervo ottico ed in presenza di tessuto congiuntivale frequentemente compromesso da terapie topiche ipotonizzanti topiche prolungate; agisce, inoltre, solo su uno dei fattori di rischio del glaucoma, anche se quasi sempre il più importante, l’ipertono oculare.
Al contrario delle altre chirurgie, ha tratto pochi o nulli benefici dal progresso tecnologico. Per tutte queste ragioni, la trabeculectomia resta attualmente la tecnica chirurgica statisticamente e significativamente più efficace da oltre 50 anni.
Cos’è che fa discutere molto di questa tecnica?
Le percentuali non altissime di successo, non paragonabili alle altre chirurgie che hanno tratto maggior vantaggio dal progresso tecnologico, le innumerevoli varianti alla tecnica originale di Cairns, ed in particolare il timore delle complicanze.
L’esperienza maturata in questi decenni ci ha portato a selezionare degli accorgimenti mirati alla tecnica chirurgica standard e finalizzati proprio a ridurre tali complicanze. Facciamo una premessa.
Quando dobbiamo ricorrere alla facotrabeculectomia?
In presenza di qualunque forma di glaucoma ad eccezione del glaucoma neovascolare, del glaucoma maligno e rare altre forme di glaucoma; in pazienti di età superiore a 40 anni, con o senza cataratta, con insufficiente compenso tonometrico, in massima terapia medica tollerata e conseguente incremento del deficit perimetrico, ma anche in presenza di ipertensione oculare ad alto rischio, nonostante la terapia o il laser, anche in assenza di danni perimetrici, pazienti inaffidabili per compliance, o intolleranti alla terapia medica, ed in caso di inefficacia della trabeculoplastica laser.
Controindicazioni sono rappresentate dalla neovascolarizzazione del segmento anteriore, dalla presenza di assottigliamento sclerale e congiuntiva compromessa da pregressa chirurgia o eventi traumatici. Le variabili in gioco che potrebbero influire sul buon esito di questa chirurgia sono diverse: la terapia topica cronica, ed in particolare i conservanti dei colliri antiglaucoma, le flogosi bulbari, l’etnia afro-americana, l’età giovanile, precedenti interventi chirurgici coinvolgenti la congiuntiva nella stessa sede, il glaucoma pseudoesfoliativo,il glaucoma pigmentario. In
particolare nel glaucoma pseudoesfoliativo ed in pazienti in terapia con anti aggreganti o anticoagulanti (in particolare in terapia con clopidogrel) preferiamo l’impianto di dispositivo Express alla trabeculectomia.
In questi casi infatti la Facoexpress o l’impianto di un dispositivo Express in un occhio già pseudofachico generano un minore stimolo infiammatorio rispetto alla Trabeculectomia ed un minore rischio di complicanze emorragiche, dal momento che vengono risparmiati i tempi della apertura della camera anteriore e della iridectomia periferica.
Un’altra questione fondamentale è rappresentata dalla scelta di abbinare alla trabeculectomia la facoemulsificazione del cristallino, a prescindere dalla presenza o meno di una cataratta più o meno avanzata.
Perché preferire l’intervento combinato?
Sicuramente per l’elevata efficacia ipotensiva dell’intervento filtrante associato alla facoemulsificazione del cristallino. La chirurgia filtrante, infatti, eseguita separatamente e per prima, accelera l’insorgenza o l’evoluzione della cataratta ed il conseguente intervento di cataratta finisce con il provocare inevitabili fenomeni flogistici in grado di aumentare il rischio di chiusura della bozza.
La facoemulsificazione contemporanea del cristallino riduce in maggior misura la IOP oltre a ridurre il rischio di ipo-atalamia da decompressione, poiché la lente intraoculare (IOL) con il suo minore ingombro e la sua “inerzia fisiologica” non produce le stesse possibili conseguenze dello spostamento in avanti del cristallino naturale e quindi un minore rischio di sinechie anteriori e posteriori, di disversione dell’acqueo, fino al glaucoma maligno.
L’intervento combinato ha naturalmente un minore costo e costituisce un vantaggio per il paziente che talora, per problemi logistici e/o geografici, è impossibilitato a ritornare per una seconda chirurgia. Infine la cataratta impedisce una corretta valutazione della progressione del danno campimetrico ed ovviamente la sua risoluzione fornisce maggiore affidabilità all’esame campimetrico.
La gestione preparatoria preoperatoria riveste un ruolo fondamentale per il buon esito dell’intervento chirurgico. Alcuni accorgimenti sono raccomandabili : cercare di migliorare la condizione della mucosa congiuntivale, alterata dai colliri ipotonizzanti, impiegando blandi colliri cortisonici, sospendere o modulare eventuali farmaci antiaggreganti o anticoagulanti, cercare di ridurre la IOP a livelli normali,
anche con agenti osmotici, per minimizzare il rischio di emorragia espulsiva, cercare un perfetto controllo della pressione arteriosa sistemica ed informare il paziente sulla possibile necessità di terapia ipotonizzante nel post-operatorio, di controlli post-operatori ravvicinati e di una eventuale revisione chirurgica. Per ciò che riguarda l’ANESTESIA, attualmente la PERIBULBARE rappresenta la tecnica prescelta nella maggior parte dei casi.
Riportiamo di seguito le fasi salienti della nostra TECNICA CHIRURGICA DI FACOTRABECULECTOMIA.
L’intervento coinvolge in genere il SETTORE SUPERIORE del bulbo oculare così che la palpebra superiore protegga la bozza congiuntivale e ricopra l’iridectomia evitando il rischio di disfotopsie e di diplopia monoculare; minori risultano inoltre la componente infiammatoria ed il pericolo di infezioni; buona è quasi sempre l’esposizione del bulbo anche in assenza di suture di trazione. Occorre limitare il settore interessato dall’intervento chirurgico ad un quadrante, in previsione di un possibile secondo intervento ed utilizzare un blefarostato leggero che non eserciti eccessiva pressione sul bulbo.
Si procede successivamente alla creazione del LEMBO CONGIUNTIVALE (Fig. 1). Preferiamo preparare il LEMBO BASE LIMBUS: la congiuntiva supero-temporale dell’OD o supero-nasale dell’OS viene esposta in prossimità del fornice superiore. Con forbice tipo Vannas si crea una piccola apertura circolare della congiuntiva e della capsula di Tenone sino a raggiungere la sclera; si induce quindi una idroemostasi, passando un agocannula al di sotto della Tenone, iniettando BSS o anestetico scollando così congiuntiva e Tenone (la compressione esercitata dal liquido iniettato provoca ischemia dei vasi sanguigni tenoniani e congiuntivali favorendo così un minore sanguinamento ed una minore necessità di
cauterizzazione con bipolare);si allarga quindi l’incisione congiuntivale e della Tenone fino ad ottenere un’apertura di circa 8mm e ribaltando quindi il lembo,così ottenuto, sulla superficie corneale.
Quali sono i vantaggi del lembo base limbus rispetto alla variante base fornice?
Consente una filtrazione non affidata al solo strato congiuntivale, spesso alterato dalla terapia antiglaucoma topica, ma protetta anche dalla Tenone, che,nella variante base fornice finisce col retrarsi posteriormente; consente un’ottima tenuta stagna, in assenza totale di Seidel positivo, ipotalamia, atalamia; consente una buona visualizzazione del campo chirurgico favorendo l’uso più sicuro degli antimetaboliti; minore è il rischio di deiscenza e maggiore è la protezione della palpebra superiore. Questo approccio chirurgico è più impegnativo e di maggiore durata, la superficie bulbare coinvolta è più estesa ed è di più predifficile esecuzione in caso di rima palpebrale piccola, per cui spesso gli viene preferito l’approccio base fornice. La DIATERMIA del letto sclerale, quando necessaria, va eseguita in modo parsimonioso ed in superficie, per non alterare il tessuto sclerale; l’eccessivo rilascio di calore può stimolare infatti una maggiore reazione fibroblastica cicatriziale nel post-operatorio, con rischio aumentato di chiusura della bozza. Si procede quindi con la creazione dello SPORTELLO SCLERALE (Fig. 2) che noi preferiamo di forma trapezoidale (alle varianti triangolare e rettangolare), esteso fino al tendine del muscolo retto superiore, per favorire una filtrazione quanto più possibile posteriore, di dimensioni 3 x 4 x 7 mm.circa, profondo circa metà - 1/3 dello spessore sclerale. Lo sportello deve esercitare una resistenza alla fuoruscita dell’acqueo attraverso la sclerotrabeculectomia, deve essere sufficientemente grande per coprirla e di spessore tale da non favorire deiscenze.



Dopo aver disegnato lo sportello, incidendo la sclera con tagliente 15°, prima di eseguire lo slamellamento della faccia profonda, applichiamo sulla faccia anteriore dello sportello sclerale e sulla Tenone contigua un asciughino triangolare imbevuto di Mitomicina C (0.2mg/ml) per 2 minuti, eseguiamo quindi un generoso lavaggio con BSS; lo slamellamento sclerale deve essere delicato, in modo da creare una superficie liscia, evitando lacerazioni dello sportello; la sclera va incisa sempre alla stessa profondità, fino ad arrivare oltre il limbus, 1-2mm in cornea chiara.
A questo punto si interrompe la procedura antiglaucoma e si procede con la FACOEMULSIFICAZIONE della cataratta. La sostituzione del cristallino con una lente intraoculare contribuice a prevenire il glaucoma maligno ampliando la profondità della camera posteriore e favorendo il normale deflusso dell’acqueo per la via desiderata.
Dopo aver impiantato la IOL, suturiamo il tunnel corneale con punto in Nylon 10.0 ed induciamo la miosi con acetilcolina iniettata in camera anteriore,così da facilitare un’iridectomia la più basale possibile. Procediamo quindi con la SCLEROTRABECULECTOMIA (Fig. 3).
Eseguiamo un’incisione al di sotto del margine ante-
riore dello sportello sclerale, parallela al limbus, con tagliente 15°, il più anteriormente possibile, fino alla fuoriuscita dell’umore acqueo. Con il punch, inserito nell’incisione, viene asportato un tassello semicircolare di tessuto limbare di 1 mm. posteriore rispetto all’incisione stessa.
Ciò consente di avere margini regolari e nessun ri-


schio di iperfiltrazione o di impegno irideo. Il passo successivo è rappresentato dall’IRIDECTOMIA PERIFERICA (Fig. 4). L’iridectomia deve essere sufficientemente grande in modo che i margini non occludano la breccia sclero-trabecolare , non troppo da causare diplopia o glare (ampia alla base e corta in lunghezza). Con pinza da iride si esercita una delicata trazione sulla porzione iridea centrale attraverso l’incisione sclerocorneale, asportandone un frammento con forbice rivolta parallelamente al limbus. L’iridectomia ha la funzione di evitare il rischio di impegno irideo nell’ostio ottenuto con il punch e previene il blocco pupillare.
Appena eseguita l’iridectomia, instilliamo ATROPINA collirio 1% allo scopo di ottenere una midriasi ed una cicloplegia che rimuovano la congestione dell’uvea e quindi il rischio di ipoema. Il trattamento
dovrebbe essere continuato per 4-5 giorni nel post-operatorio.
PER SUTURARE LO SPORTELLO SCLERALE utilizziamo 3 punti staccati in Vicryl 8.0 lungo i lati dello sportello (Fig. 5). In circa 7 giorni i punti tendono ad autolisarsi ed in caso di necessità è possibile accelerare la lisi con lente di Hoskins e laser Argon o diodo.
PER SUTURARE LA TENONE E LA CONGIUNTIVA utilizziamo una sutura continua in Vicryl 8.0 su due piani, poiché rispettare i piani anatomici fisiologici previene il rischio di bozze cistiche, di Seidel positivo e di atalamia nel post-operatorio (Fig. 6). Concludiamo la procedura chirurgica con l’aspirazione del viscoelastico dalla camera anteriore, l’idrosutura delle vie di servizio ed una iniezione, sottotenoniana di corticosteroide.
Materiali e metodi
Abbiamo eseguito, nel corso della stesura di una Tesi di Specializzazione in Oftalmologia, uno studio retrospettivo, non comparativo su 46 pazienti (età media 66 anni ± 13, 13 donne e 30 uomini) per un totale di 69 occhi sottoposti a trabeculectomia + FACO + IOL, follow-up non inferiore a 24 mesi. Sono stati inclusi nello studio occhi affetti da glaucoma moderato (MD -6/-12 dB) o avanzato (MD >-12 dB) ad angolo aperto, cin terapia topica massimale, neurootticopatia glaucomatosa e peggioramento documentato del campo visivo preoperatorio e pazienti con cataratta e glaucoma ad angolo aperto con scarsa compliance o non responsivi alla terapia medica topica. Sono stati reclutati nello studio pazienti con caratteristiche cliniche omogenee, trattati in tempi consecutivi e con un follow up di almeno due anni dall’intervento.

SUCCESSO COMPLETO
SUCCESSO PARZIALE
INSUCCESSO
CONDIZIONI
Senza medicazioni
- IOP<21mmHg
- 10<IOP>15mmHg
- Riduzione IOP del 20%
- Miglioramento AV
Con medicazioni
- IOP<21mmHg
- 10<IOP>15mmHg
- Riduzione IOP del 20%
- Stabilizzazione AV
Con o senza medicazioni
- IOP<21mmHg
- Riduzione IOP <20%
- Riduzione AV
Scopo dello studio è stato valutare le percentuali di successo e le complicanze della nostra tecnica di facotrabeculectomia attraverso i seguenti parametri: IOP, acuità visiva, complicanze, morfologia della bozza e numero di medicazioni pre/postoperatorie.
Lo studio ha evidenziato una riduzione della IOP da
medicazioni
con o senza medicazioni
23 (± 4.9) mmHg del pre-op a 15.5 (± 3.8) mmHg ad almeno 2 anni. Il 73% degli occhi presentava una IOP <21mmHg in assenza di terapia topica (30% IOP 15-21 mmHg; 43% IOP 10-15mmHg); il 16% degli occhi registrava una IOP <21mmHg con terapia topica aggiuntiva (in media 2.2 medicazioni); l’11% degli occhi era affetto da IOP >21mmHg (range 21-22) con

Emilio Balestrazzi, Luigi Mosca, Maria Ilaria Giannico, Alessandra Mastrocola, Patrizio Bernardinelli, Angelo Balestrazzi
terapia topica aggiuntiva (in media 2.6 medicazioni).
L’acuità visiva media pre-op era pari a 40.8 lettere ETDRS e risultava migliorata di 6.81, 7.76 e 8.3 lettere ad 1, 3 e 6 mesi. Il 51.5% degli occhi presentava una stabilizzazione e il 48.5% un miglioramento significativo del visus ad almeno 2 anni.
Le complicanze registrate sono state le seguenti:
- Precoci: ipoema (massimo circa 2 mm. ed a rapida risoluzione) (5%), ipotono (IOP <4mmHg per più di 2 settimane) (3%), ipertono (>30mmHg) (0%), atalamia (0%), distacco di coroide (3%), edema maculare cistoide (0%), emorragie della bozza (0%); - Tardive: disestesia della bozza (2%), YAG laser per opacità della capsula posteriore (53%), nessuna complicanza (27%).
Il sistema di classificazione a cui abbiamo fatto riferimento per la valutazione della bozza è quello di Wüerzburg (WBCS) che attribuisce un punteggio alla morfologia della bozza da 0 a 3 in funzione del grado di vascolarizzazione, della presenza di vasi a cavaturacciolo, di microcisti ed incapsulamento. In tutti i pazienti il punteggio totale è aumentato da 7.6 ± 1.3 a 9.6 ± 1.3 al termine del follow-up. Il numero medio di medicazioni nel pre-op era 4.2 ± 1.2, ad 1 anno si è ridotto a 0.60 ed a 2 anni a 0.67. In tabella 1 sono riportati i dati riassuntivi dello studio.
In figura 7 sono evidenziati i passaggi salienti della nostra tecnica chirurgica raccolti nell’acronimo “THE SAFE TRAB”.
Conclusioni
In conclusione, la facotrabeculectomia rappresenta attualmente l’intervento d’elezione per il trattamento del glaucoma associato o meno ad una cataratta più o meno evoluta. In casi selezionati la facoemulsificazione del cristallino può essere preferibilmente associata all’impianto di dispositivo Express 200 piuttosto che alla trabeculectomia.
La nostra tecnica chirurgica si è dimostrata efficace nel mantenimento del target IOP senza terapia e comunque con una riduzione del numero di medicazioni preoperatorie.
Il tasso di complicanze intra e post-operatorie ad almeno 2 anni dall’intervento è risultato inferiore ai dati riportati in Letteratura.
Nuove procedure chirurgiche sono in corso di studio per ripristinare il deflusso dell’umore acqueo senza la creazione della bozza filtrante, nell’intento di ridurre le complicanze ad essa associate, ma devono ancora dimostrare di dare a lungo termine risultati statisticamente e significativamente superiori alla facotrabeculectomia. (Rao e Cruz 2022)
Bibliografia
– Balestrazzi E. et al. 1975.La sclerectomia con iridectomia periferica nella terapia chirurgica del glaucoma da cortisone.Min Oftal 17A 216225.
– Balestrazzi E. et al.,1977.La cataratta come complicanza degli interventi antiglaucomatosi.Scritti in onore del Prof.G.B.Bietti.Supplemento del Boll d’Oc,57,387-402.
– Balestrazzi E. et al.,1979.Modifiche tecniche originali all’intervento di trabeculectomia.La loro validità in base ai risultati ottenuti su 106 occhi in 3 anni.Min Oftal,2,21,65-70.
– Balestrazzi E. et al.,1980.Gli interventi combinati di cataratta e glaucoma.Clin Oc e Pat Ocul,1,5-16.
– Balestrazzi E. et al.,1980,Modifications of trabeculectomy.III International Glaucoma Congress.Las Vegas.Glaucoma,2,5,500-506.
– Balestrazzi E. et al.,1993.Pathology of ocular disease associated with pseudoexfoliative syndrome.New Trends in Ophthalmology VIII,3,151155.
– Balestrazzi E.,et al.,1987.Preliminary results of original modifications to Cairns trabeculectomy technique.Glaucoma 9,3,81-83and 98.
– Balestrazzi E. et al.,1994,Combined surgery of cataract and glaucoma with Mitomycin C..Proceedings of 27th International Congress of Ophthalmology,Toronto.
– Balestrazzi E. et al.,2000.Combined phacoemulsification and deep sclerectomy vs phacoemulsification and trabeculectomy.Acta Ophthalmol Scand Suppl,(232):59-60.
– Bowman RJC, Hay A, Wood ML, Murdoch IE 2010. Combined cataract and trabeculectomy surgery for advanced glaucoma in East Africa; visual and intra-ocular pressure outcomes. Eye;24,573-577.
– Cairns,J.E.,1968.Trabeculectomia.Preliminary report of a new method.Am J Ophthalmology 66,673-679.
– Castelli,A. 1965.Tecnica di fistolizzazione profonda antiglaucomatosa.Atti Soc Oftalmol Lombarda 20/1:21-28.
– Clement CY, Yolanda YY Kwong, Dexter YL Leung, SW Lam, Felix CH Li, Thomas YH Chiu, Jonathan CH Chan, Catherine Chan, Agnes SYPoon, Doris WF Yick, CC Chi, Dennis SC Lam, Jimmy SM Lai 2008. Phacoemulsification versus combined phacotrabeculectomy in medically controlled chronic angle closure glaucoma with cataract. Ophthalmology;115:2167-2173.
– Cotran PR, Shiyoung R , Gerald MG, 2008. Randomized comparison of 1-site and 2-site phacotrabeculectomy with 3-year follow-up. Ophthalmology;115:447-454.
– Elliot,R.H.,1909.A preliminary note on a new operative procedure for the establishment of a filtering cicatrix in the menagement of glaucoma. Ophthalmoscope 7,804-807.
Harris,D.,1961.Sympathetic ophthalmia following iridencleisis.Case report and incidence.Am J Ophthalmology 51,829-831.
He-Nan Liu, Xun Li, Qing-Zhu Nie, Xiao-Long Chen 2010. Efficacy and tolerability of one-site versus two-site phacotrabeculectomy: a me ta-analysis. Int J Ophthalmol;3(3):264-268.
– Jonathan H Tzu, Christopher T Shah, Anat Galor, Anna K Junk, Ananth Sastry, Sarah R Wellik 2015. Refractive outcomes of combined cata ract and glaucoma surgery. J Glaucoma;24:161-164.00
– RR Khandelwa, D Raje, A Rathi, A Agashe, M Majumdar, R Khandelwal. 2015; Surgical outcome of safe surgery system trabeculectomy com bined with cataract extraction. Eye 29, 363-370.
Khaw,P.T.,Khiang,M.,Shah,P.,Sii,F.,Lockwood,A.,Khalili,A., 2017 Enhanced Trabeculectomy: The Moorfields Safer Surgery System. Dev Ophthalmol 59,15-35.
– Koike,K.J.,Chang,P.T.,2018.Trabeculectomy:A Brief Hystory and Review of Current Trends.Int Ophthalmol Clin 58,117-133.
– Megevand,G.S.,Bron,A.M.,2020.Personalising surgical treatments for glaucoma patients.Progress in Retinal and Eye Research,doi:https://doi. org/10.1016/j.preteyeres.100879.
Rao A.,Cruz R.D.,2022.Trabeculectomy: Does It Have a Future?Cureus 14(8):e27834.
Rodriguez-Una,I.,Azuara-Blanco,A.,King,A.J.2017.Survey of glaucoma surgical preferences and post-operative care in the United Kingdom. Clin Exp Ophthalmol 45,232-240.
– Sanjay K Murthy, Karim F Damji, Yi Pan, William G Hodge. Can J Ophthalmol 2006;41:51-Trabeculectomy and phacotrabeculectomy, with mitomycin-C, show similar two-year target IOP outcomes.
Scheie,H.G.,1958.Retraction of scleral wound edges as a fistulizing procedure for glaucoma.Am J Ophthalmol 45,220-229.

Scuderi G.,Balacco Gabrieli C.,Balestrazzi E.,Bucci M.G.,Cardia L.,Cerulli L.,Reibaldi A. 1991.Trattamento del glaucoma primario.Ghedini Ed.
– Sugar,S.1961.Experimental trabeculectomy in glaucoma.Am J Ophthalmolo 51,623-627.
– Xu Hou, Dan Hu, Zhili Cui, Jian Zhou, Li Cai, Yusheng Wang 2015. Small-incision phacotrabeculectomy versus phacoemulsification in re fractory acute primary angle closure with cataract. BMC Ophthalmology;15:88.





FABIANO GRUPPO EDITORIALE
Redazione: Strada 4 Milano Fiori, Palazzo Q7 – 20089 Rozzano














Carlo Cagini1, Giuseppe De Filippis2
1. Direttore Clinica Oculistica – Dipartimento di Medicina e Chirurgia
Università degli Studi di Perugia – Azienda Ospedaliera di Perugia
2. Direttore Generale Azienda Ospedaliera di Perugia

Abstract
Con l’aumento dell’età media della popolazione mondiale l’incidenza di patologie retiniche e della coroide che necessitano di IVT è incrementata ed è destinata ad incrementare ulteriormente nel prossimo futuro. Tra i vari paesi del mondo le normative che regolano la somministrazione di IVT differiscono e con esse i setting di somministrazione possibili. In Italia il limite alla somministrazione era rappresentato dalla scarsa disponibilità di sale operatorie, unico setting precedentemente autorizzato. La pandemia di Covid-19 ha determinato un'ulteriore riduzione della disponibilità di somministrazione in sala operatoria evidenziando ulteriormente il problema. Per far fronte a tale richiesta terapeutica abbiamo quindi allestito presso la clinica Oculistica dell’azienda Ospedaliera di Perugia uno dei primi ambulatori chirurgici in Italia per la somministrazione di terapie IVT con la capacità di somministrare oltre 5000 trattamenti all’anno. Questo ci consente di garantire dei livelli di sicurezza non inferiori a quelli della sala operatori grazie all’ausilio di un generatore a flusso laminare, aumenta la possibilità di accesso alle cure e riduce l’attesa lungo tutto il percorso terapeutico.
Text
Le iniezioni intravitreali rappresentano il gold standard terapeutico di numerose patologie fra cui le più frequenti sono la degenerazione maculare senile essudativa e l’edema maculare secondario a retinopatia diabetica ed a trombosi venosa: esse hanno rappresentato una vera e propria rivoluzione in oftalmologia perché hanno permesso di trattare malattie che in passato non potevano essere gestite in modo efficace. La somministrazione intravitreale di farmaco si caratterizza per un ottimo profilo di sicurezza e di efficacia essendo in grado di garantire elevate concentrazioni
intraoculari e di minimizzare gli effetti sistemici. Per questi motivi il numero di trattamenti intravitreali è costantemente aumentato negli ultimi anni ed oggi rappresentano la procedura chirurgica in assoluto più eseguita in oculistica; si prevede inoltre che il loro numero sia destinato a crescere nel prossimo futuro per la introduzione di nuove indicazioni terapeutiche e di nuovi farmaci che permetteranno di trattare patologie che attualmente sono orfane di trattamento o vengono trattate con differenti modalità.
L’aumento del numero di iniezioni ha rappresentato una sfida per le nostre strutture perché ha costretto ad attuare una profonda riorganizzazione con la istituzione di specifici servizi dedicati alla diagnosi ed al trattamento di queste patologie; questo ha creato numerose difficoltà per il gran numero di pazienti da trattare, per la necessità di eseguire un corretto follow-up a tutti i pazienti e per la scarsa disponibilità delle sale operatorie dove eseguire il trattamento iniettivo.
Queste problematiche presso la Clinica Oculistica dell’Azienda Ospedaliera di Perugia sono state affrontate cercando di ottimizzare il percorso dei pazienti che può essere suddiviso in due fasi: la loro presa in carico – arruolamento, diagnosi e programmazione delle iniezioni intravitreali – ed il trattamento intravitreale che viene effettuato in una saletta chirurgica dedicata. Questo risultato è stato possibile grazie ad un lavoro di sinergia tra la Clinica Oculistica, la Direzione Aziendale diretta dal dott. Giuseppe De Filippis, la Direzione Medica diretta dal dott. Arturo Pasqualucci, e la Direzione delle Professioni Sanitarie. La presa in carico dei pazienti si realizza al primo contatto quando il paziente viene valutato presso il servizio di Retina Medica e viene definita la patologia in atto ed il corretto regime terapeutico che viene scelto in base alle linee guida redatte dalla Regione
Umbria. Il paziente viene informato delle possibilità terapeutiche, viene redatta la cartella ambulatoriale e rilasciato il consenso informato; il personale provvede quindi a segnalare il nominativo al Centro Unificato di Prenotazione (CUP) che si fa carico di contattare il paziente organizzando il percorso comunicando le date dei trattamenti e le successive visite di follow-up agli opportuni intervalli di tempo. Per l’elevata incidenza di recidive che si osservano in questo tipo di patologie, i pazienti sono monitorati per almeno due anni dalla prima diagnosi, e tutti i controlli ed eventuali successivi trattamenti sono gestiti dal CUP su indicazione dei sanitari curanti. Questa organizzazione ha portato ad una elevatissima efficienza del servizio e marcata riduzione delle problematiche legate a difficoltà di comunicazione fra i pazienti ed i sanitari della struttura, non presentazione dei pazienti alle visite di follow-up o al trattamento, errori nella compilazione delle liste operatorie, mancato utilizzo dei farmaci preparati per il trattamento.
Il secondo punto di forza di questo percorso terapeutico è costituito dall’ambulatorio chirurgico apposi-

tamente predisposto per i trattamenti intravitreali. Questa soluzione è nata nella primavera del 2023 dalla necessità di garantire il trattamento in tempi adeguati: presso la Clinica Oculistica di Perugia abbiamo assistito ad un costante aumento del numero di pazienti seguiti ed attualmente vengono effettuate oltre 5.000 trattamenti intravitreali ogni anno che, quando effettuati nelle normali sale operatorie costituiscono un importante problema perché tolgono importanti spazi e risorse che potrebbero essere dedicati ad attività chirurgiche più complesse. La possibilità di poter eseguire questi trattamenti al di fuori dei blocchi operatori in ambulatori dedicati ed appositamente attrezzati costituisce quindi una importante opportunità.
In Italia nell’ambito del Sistema Nazionale delle Linee Guida (SNLG) ex DM 30 giugno 2004 e DM 27 febbraio 2017 non esistono indicazioni sul setting chirurgico delle iniezioni intravitreali, ovvero sui requisiti di ventilazione specifici per l'iniezione intravitreale, né alcuna evidenza di un aumentato tasso di infezione correlato ad un ridotto ricambio d'aria. La iniezione intravitreale è considerata una procedura minore e le complicanze maggiori come l'endoftalmite sono un evento molto raro. Le linee guida della Società Oftalmologica Italiana (SOI) raccomandavano fin dal 2007 di eseguire le IVT in una sala operatoria per ridurre al minimo la possibilità di endoftalmite, ma aggiungono che la introduzione di tecnologie idonee per la riduzione del numero di particelle sul campo operatorio (ricambi d’aria superiori a 12) rende idonee le sale operatorie oculistiche di 1° livello all’esecuzione delle iniezioni intravitreali. Inoltre, viene specificato che la struttura deve essere dotata di un generatore di un flusso laminare orizzontale dotato di filtro HEPA14 con numero massimo di particelle per l’area critica non superiore a 3520/m3 del diametro 0,5 micron che corrisponde alla classe ISO 5 (ISO 14644-1), e che è opportuno attenersi ad un definito numero di pazienti da trattare con adeguato distanziamento. Le linee guida dell’Associazione Italiana Medici Oculisti (AIMO) (ottobre 2023) riportano che il trattamento può essere eseguito in un ambulatorio chirurgico dedicato alle terapie intravitreali che deve rispettare alcune caratteristiche nelle dimensioni, illuminazione, pulizia e presenza di tutta la strumentazione per la rianimazione cardiopolmonare con un defibrillatore automatico nelle vicinanze. Inoltre, per migliorare le condizioni di asepsi del campo chirurgico, nell’ambulatorio può essere posizionata una macchina generante un flusso laminare focalizzato posta nelle vici-
nanze della testa del paziente. Il flusso laminare deve garantire un livello di asetticità pari alla norma ISO5 e deve essere dotato di sistemi di tracciabilità. Infine, il paziente deve entrare nell’ambulatorio chirurgico indossando calzari e cappellino, il medico deve per ogni procedura deve lavarsi e disinfettarsi le mani per almeno 3 minuti e indossare guanti sterili per microchirurgia oculare che andranno cambiati dopo ogni intervento, il medico deve indossare idoneo camice chirurgico e mascherina che copra naso e bocca, il farmaco deve essere in siringhe pre-riempite sterili o in packaging adeguato e sterile preparato e fornito dalla farmacia ospedaliera. Il nostro ambulatorio chirurgico è stato istituito con delibera aziendale (N. 87168 del 23/12/2021 l’"Ambulatorio Chirurgico Oculistico") e rispetta tutte queste caratteristiche ed è dotato di un generatore a flusso laminare focalizzato (TOUL) con un filtro HEPA14 in grado di eliminare il 99,9% dei batteri e microrganismi aerodispersi e produce un flusso di aria laminare orizzontale ultrapulito diretto sul tavolo e sul campo operatorio. Il generatore a flusso laminare ha una portata di 400 m3/h riducendo quindi sensibilmente i microrganismi di tutto l’ambiente in cui è posizionato: con il passare del tempo quindi, tutta l’aria dell’ambiente in cui lo strumento lavora viene più volte depurata. Questo significa che l’aria di un ambiente di 60 m3 verrà completamente filtrata ogni 10 minuti. La peculiarità di questi moderni generatori a flusso laminare è quella di creare un flusso d’aria orizzontale agendo senza interposizione di ostacoli sulle aree critiche, ovvero sul campo operatorio e sugli strumenti chirurgici. Al contrario, l’aria filtrata attraverso i tradizionali sistemi di aereazione che si trovano nelle sale operatorie viene immessa all’interno della sala operatoria attraverso bocchette di aereazione collocate al soffitto, e nel suo percorso verticale l’aria incontra degli ostacoli come le lampade scialitiche, la testa dei chirurghi ed il microscopio, che vanno a deviare e potenzialmente a contaminare il flusso d’aria stesso.
Il dispositivo Toul flusso laminare ha ricevuto delle convalide dalla società Veram in riferimento alla normativa UNI EN ISO 14644 - “Camere bianche ed ambienti associati controllati”. Considerando che il particolato aerodisperso è in grado di veicolare i microrganismi eventualmente presenti, è stato dimostrato il mantenimento di valori particellari al di sotto di valori necessari per ottenere i valori di classe ISO 5 in porzioni di ambienti con classi particellari superiori.
Per dimostrare l’efficacia del Toul abbiamo utilizzato un contatore di particelle la cui sonda è stata rivolta verso il flusso d’aria e la valutazione della concentrazione di particelle in aria è stata effettuata in condizioni di sala operatoria allestita e in assenza di personale eseguendo vari campionamenti sia con dispositivo spento sia con dispositivo acceso ad intervalli di 30 secondi. Nel nostro ambulatorio chirurgico il Toul a flusso laminare si è dimostrato in grado di rientrare nella normativa ISO5 e quindi di abbattere la concentrazione di particelle portando tale valore a 0 particelle/m3 dopo un minuto dalla accensione. Inoltre, il profilo di sicurezza è stato testato con la collaborazione della sezione Controlli Ambientali della struttura complessa di Microbiologia della nostra azienda Ospedaliera verificando tramite coltura su piastra la crescita di microorganismi aerodispersi. Il controllo microbiologico dell’aria è stato eseguito in due momenti: il primo giorno è stata valutata l’aria al centro stanza e di fronte al flusso laminare in presenza di 4 operatori, il secondo giorno è stata esaminata l’aria di lato al flusso e sulla testa della poltrona operatoria in presenza di 2-3 operatori. Il campionamento è stato effettuato prima dell’accensione del flusso laminare mobile e dopo 10 e 25 minuti dall’inizio del flusso. Il flusso laminare del carrello mobile ha ridotto significativamente il numero dei microrganismi nell’aria rispettando i valori delle sale operatorie a flusso turbolento. I risultati ottenuti per le superfici esaminate prima dell’accensione del flusso hanno rispettato i valori attesi.
L’allestimento della sala operatoria con un TOUL a flusso laminare ci allinea a quanto è già diffuso in molti paesi europei dove il modello dell’ambulatorio chirurgico è già utilizzato da tempo (Germania, Francia) mentre in Canada, negli Stati Uniti e in Giappone, le IVT vengono eseguite principalmente nello studio medico dell’oculista. Nel Regno Unito e nei Paesi Bassi esse vengono prevalentemente eseguite in un ambulatorio dedicato con elevati standard igienici ma senza sistemi di filtraggio dell'aria.
Uno studio multicentrico eseguito nel 2019 in 12 paesi ha preso in considerazione 96.624 trattamenti intravitreali di anti-VEGF analizzando l’incidenza di endoftalmite postoperatoria e di eventi avversi gravi collegati al trattamento. Le IVT sono state eseguite nel 35% dei casi in sala operatoria, nel 40% dei casi in ambulatori dedicati senza sistema di filtrazione dell’aria, nel 15% dei casi in ambulatori chirurgici e nel 10% dei casi in studi medici. L’analisi dei risultati ha messo in evidenza che è stata riscontrata complessivamen-
te una percentuale di endoftalmiti pari allo 0.02% di cui 0.017% in pazienti trattati in sala operatoria, lo 0.019% in pazienti trattati in ambulatori dedicati e in ambulatori chirurgici e lo 0.06% in pazienti trattati in uno studio medico. Lo studio ha quindi mostrato che il rischio di endoftalmite ed eventi avversi sistemici sia estremamente basso e come non ci sia differenza significata tra i vari setting di assistenziali. Il nuovo percorso ambulatoriale ha migliorato la nostra organizzazione, ha aumentato il comfort dei pazienti ma soprattutto ci ha permesso di trattare un elevato numero di pazienti ottimizzando il percorso assistenziale mantenendo elevati standard di qualità
e sicurezza. La esecuzione delle procedure iniettive intravitreali al di fuori delle sale operatorie è stata sentita come una necessità da parte di molti colleghi durante la recente pandemia COVID 19 al fine di poter garantire la esecuzione dei trattamenti in un periodo nel quale erano presenti importanti difficoltà logistiche. Oggi una buona organizzazione e una adeguata strumentazione ci permettono di eseguire i trattamenti intravitreali in ambulatori chirurgici dedicati con le stesse garanzie delle sale operatorie: questo non può che essere visto come un importante miglioramento organizzativo che ci aiuta ad assicurare i migliori standard di trattamento ai nostri pazienti.
Bibliografia
1. Grzybowski A, Told R, Sacu S, Bandello F, Moisseiev E, Loewenstein A, Schmidt-Erfurth U; Euretina Board. 2018 Update on Intravitreal Injections: Euretina Expert Consensus Recommendations. Ophthalmologica. 2018;239(4):181-193.
2. Veritti D, Sarao V, Gorni G, Lanzetta P. Anti-VEGF Drugs Dynamics: Relevance for Clinical Practice. Pharmaceutics. 2022 Jan 23;14(2):265
3. Lanzetta P. Anti-VEGF therapies for age-related macular degeneration: a powerful tactical gear or a blunt weapon? The choice is ours. Graefes Arch Clin Exp Ophthalmol. 2021 Dec;259(12):3561-3567.
4. Petri AS, Boysen K, Cehofski LJ, van Dijk EHC, Dysli C, Fuchs J, Mastropasqua R, Subhi Y. Intravitreal Injections with Vascular Endothelial Growth Factor Inhibitors: A Practical Approach. Ophthalmol Ther. 2020 Mar;9(1):191-203.
5. Linee Di Indirizzo Iniezione Di Farmaci Per Via Intravitreale (IV). https://www.sedesoi.com/linee-guida-soi/1/
6. Linee guida AIMO. Iniezioni Intravitreali. https://www.oculistiaimo.it/consensi-informati-e-linee-guida/linee-guida.html
7. Sedeh FB, Scott DAR, Subhi Y, Sørensen TL. Prevalence of neovascular age-related macular degeneration and geographic atrophy in Denmark. Dan Med J. 2017 Nov;64(11):A5422.
8. Scarpa G, Urban F, Scarpa M, Formentini S, Beccastrini A. Intravitreal Injections during the COVID-19 Outbreak in Northern Italy: An Innovative Approach for a High Quality and Safe Treatment. Eur J Ophthalmol. 2022 Nov;32(6):3667-3673.
9. Xing L, Dorrepaal SJ, Gale J. Survey of intravitreal injection techniques and treatment protocols among retina specialists in Canada. Can J Ophthalmol. 2014 Jun;49(3):261-6.
10. Samia-Aly E, Cassels-Brown A, Morris DS, Stancliffe R, Somner JE. A survey of UK practice patterns in the delivery of intravitreal injections. Ophthalmic Physiol Opt. 2015 Jul;35(4):450-4.
11. Veritti D, Sarao V, Chhablani J, Loewenstein A, Lanzetta P; Società Italiana della Retina (SIR) Study Group; Intravitreal Injection Setting Study Group (I2SG). The ideal intravitreal injection setting: office, ambulatory surgery room or operating theatre? A narrative review and international survey. Graefes Arch Clin Exp Ophthalmol. 2023 Nov;261(11):3299-3306.
Trocar Surgery per i chirurghi della cataratta
12. Moreto R, Cyrino FV, Jorge R. Use of an ultra-clean air flow for surgical field asepsis when performing intravitreous injections in an ambulatory surgical environment. Int J Retina Vitreous. 2020 Nov 19;6(1):57.
Ulrich Spandau - Edizione italiana a cura di Alfonso Anania
Trocar Surgery per i chirurghi della cataratta
Ulrich Spandau
Edizione italiana a cura di Alfonso Anania
Presentazione del Prof. Stanislao Rizzo

GRUPPO EDITORIALE
Strada 4 Milano Fiori, Palazzo Q7 – 20089 Rozzano (MI) Sede operativa: FGE srl – Regione Rivelle 7/F – 14050 Moasca (AT) Tel. 0141 1706694 – Fax 0141 856013 – e-mail: info@fgeditore.it – www.fgeditore.it

Alex Malandrini1, Davide Marini2, Dario Zappalà2, Christian Crudale2, Giulia Spadavecchia2, Gian Marco Tosi1,2
1. U.O.C. Oculistica, Azienda Ospedaliero-Universitaria Senese, Siena

2. Dipartimento di Scienze Mediche, Chirurgiche e Neuroscienze – Oftalmologia, Università degli Studi di Siena
Introduzione
L’opacità capsulare posteriore (OCP) è una comune complicanza postoperatoria dell’intervento di cataratta che riduce l’acuità visiva e la sensibilità al contrasto1 e la cui incidenza nella chirurgia moderna è fino al 34% dopo 5 anni dall’intervento2
La capsulotomia con laser Nd:YAG rappresenta il trattamento standard. I corpi mobili vitreali (floaters) sono un possibile effetto collaterale della capsulotomia YAG con incidenza dal 20 al 50% dopo 1 mese dal trattamento laser in base alla tecnica impiegata3,4. Attualmente il trattamento dei corpi mobili sintomatici è piuttosto carente e prevede nella maggior parte dei casi una gestione conservativa basata sull’osservazione del paziente5. Le altre tecniche più o meno invasive comprendono la vitrectomia chirurgica, la vitreolisi YAG laser e la vitreolisi farmacologica5. L’obiettivo di questo studio pilota è stato valutare l’efficacia dell’integratore orale multicomponente Vitreolisina forte (OFFHEALTH Spa) a base di Curcumina, Bromelina e Costituenti della matrice fibrillare del vitreo come primo approccio terapeutico non invasivo nella riduzione dei corpi mobili sintomatici secondari a capsulotomia YAG laser.
La curcumina è una molecola antinfiammatoria e antiossidante già studiata su diverse patologie sistemiche e oculari6,7 ed è coformulata con la Piperina per aumentarne la biodisponibilità sistemica dato lo scarso assorbimento intestinale8. La bromelina ha dimostrate proprietà antinfiammatorie e antiedemigene9,10 mentre il Collagene di tipo 2, i mucopolisaccaridi Glucosamina, Condroitin solfato ed il Sodio ialuronato sono molecole che partecipano alla strut-
tura fibrillare del vitreo e sono associate alla Vitamina C, cofattore della sintesi del collagene.
Pazienti e metodi I pazienti eleggibili sono stati inseriti in uno studio prospettico interventistico randomizzato controllato dopo informazione dettagliata ed aver fornito il consenso e sono stati selezionati tra quelli inviati presso l’ambulatorio YAG laser della Clinica Oculistica dell’Azienda Ospedaliero-Universitaria Senese. I criteri di inclusione erano (1) OCP successiva a facoemulsificazione e impianto di IOL nel sacco, (2) riduzione clinicamente significativa dell’acuità visiva a distanza (BCVA ≤6.3/10, ≥0.2 logMAR), (3) pazienti sintomatici per corpi mobili vitreali dopo capsulotomia YAG. Sono stati esclusi i pazienti con patologie oculari significative, precedenti chirurgie complicate, BCVA <3/10 (>0.5 logMAR), corpi mobili molto sintomatici già al baseline o assenza di sintomi riferibili a corpi mobili dopo capsulotomia Nd:YAG.
Le valutazioni sono state eseguite prima della capsulotomia laser (Pre-trattamento/Baseline), il giorno successivo al trattamento (Giorno 1) e alla visita finale (Mese 2) e prevedevano BCVA e sensibilità al contrasto (CS), pressione intraoculare, biomicroscopia del segmento anteriore con quantificazione dell’OCP score4, esame del fondo oculare. È stato auto-somministrato un questionario con tre domande, ciascuna con punteggio da 0 a 4, circa la percezione dei corpi mobili (QS1), l’interferenza di questi con la vita quotidiana (QS2) ed il discomfort oculare ovvero sensazione di corpo estraneo (QS3).
I pazienti sintomatici per corpi mobili il giorno suc-
Tabella 1. Caratteristiche Baseline
* Significatività statistica. Confronto fra i due gruppi con Test t di Student per variabili continue o ordinali, Test del Chi-quadrato per variabili categoriali
cessivo al trattamento (aumento QS1 ≥2) sono stati divisi in maniera casuale 1:1 fra i due gruppi di studio sovrapponibili al baseline fino ad arrivare a 40 occhi totali (Tabella 1). Il gruppo di controllo ha seguito la terapia standard dopo capsulotomia con Bromfenac 0.09% collirio (Yellox, Bausch & Lomb) 2 volte al giorno per 15 giorni e Acido ialuronico cross-linkato 0.2% con aloe collirio non-conservato (Alocross, OFFHEALTH Spa) 4 volte al giorno per 2 mesi. Il gruppo di trattamento ha assunto in aggiunta alla terapia standard l’integratore Vitreolisina forte 1 compressa al giorno per 2 mesi (Tabella 2).
I corpi mobili sono stati quantificati con l’ecografia oculare (AVISO, Quantel Medical). In A-SCAN è stata calcolata la media del numero di picchi vitreali significativi (mean vitreal peaks, MVP) con altezza
CURCUMINA
190 mg (Curcuma longa L. rizoma e.s. tit. 95% curcumina)
Piperina 2 mg
BROMELINA
COSTITUENTI MATRICE VITREALE
Glucosamina
100 mg (Ananas comosus L. Merr. gambo e.s. 2,500 GDU/g)
Tabella 2 - Composizione (1 compressa) Vitreolisina forte
superiore al 50%, su quattro scansioni longitudinali cardinali. Con la metodica B-SCAN è stata invece misurata la media dell’intensità dei grigi (mean grey intensity, MGI) su scala 8 bit 0-255 all’interno di una finestra ellissoidale nella cavità vitreale posteriore (200x280 pixels) attraverso un software di processamento delle immagini (ImageJ Software z project tool, National Institute of Health) su una scansione sagittale antero-posteriore e su quattro scansioni trasversali cardinali B-scan con Gain massimale a 105 dB (Figura 1).
L’effetto dell’integratore su ciascuna variabile è stato valutato con un modello misto di analisi della varianza (ANOVA) per misure ripetute, confrontando il Mese 2 con il Giorno 1 dopo capsulotomia laser, e assumendo il gruppo come fattore-tra-soggetti.
Risultati
Ottantacinque pazienti eleggibili per lo studio sono stati sottoposti a capsulotomia e successivamente 40 pazienti (47%), sintomatici per corpi mobili il giorno dopo la capsulotomia, sono stati inclusi nello studio e divisi in 2 gruppi. Tutte le variabili (BCVA, CS, QS1-3, MVP e MGI) erano comparabili fra i due gruppi al Baseline e il Giorno 1 dopo la capsulotomia (Figure 2-8).
La BCVA media ha mostrato un peggioramento significativo immediatamente dopo la capsulotomia, ma con un recupero quasi totale alla visita finale del secondo mese senza differenze statisticamente significative fra i due gruppi (Figura 2). La CS media ha mostrato un miglioramento marginale dopo la capsulotomia divenuto però più significativo alla visita finale nel gruppo che ha assunto Vitreolisina forte riportando valori comparabili a soggetti nor-

1. A) Metodo di analisi A-SCAN: numero di picchi vitreali sopra la linea del 50% dopo aver posto l’AVG Height al 72%. (B) Metodo di analisi B-SCAN: media dell’intensità dei grigi dentro una finestra standard posta nella cavità vitreale posteriore attraverso il software ImageJ dopo aver posto il Gain massimale a 105 dB

Figura 2. Andamento Acuità Visiva (LogMAR). Significatività statistica (P) e dimensione d’effetto (h2) dell’interazione fra assunzione di Vitreolisina forte e andamento temporale della BCVA
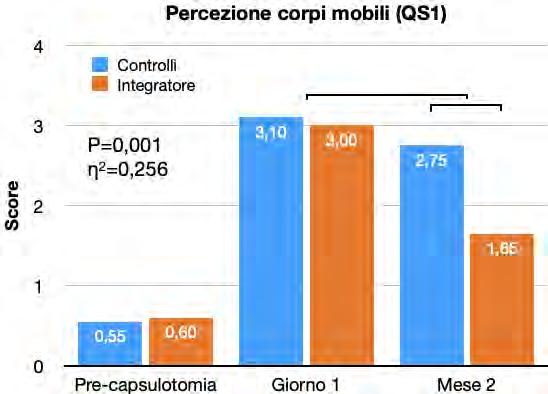
Figura 4. Andamento Percezione corpi mobili-QS1 (score). Significatività statistica (P) e dimensione d’effetto (h2) dell’interazione fra assunzione di Vitreolisina forte e andamento temporale dello score
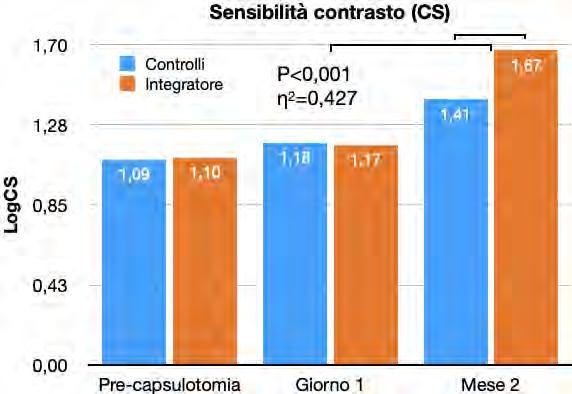
Figura 3. Andamento Sensibilità al contrasto (LogCS). Significatività statistica (P) e dimensione d’effetto (h2) dell’interazione fra assunzione di Vitreolisina forte e andamento temporale della CS

Figura 5. Andamento Interferenza vita quotidiana-QS2 (score). Significatività statistica (P) e dimensione d’effetto (h2) dell’interazione fra assunzione di Vitreolisina forte e andamento temporale dello score
mali della stessa età, mentre il gruppo di controllo è rimasto inferiore la norma (Figura 3).
Tutti i punteggi del questionario (QS1-3) hanno mostrato in media un peggioramento dopo la capsulotomia (Giorno 1) e un miglioramento al termine del follow-up in maniera più significativa nel gruppo che ha assunto Vitreolisina forte (Figure 4-6).
Il numero di picchi vitreali significativi (MVP) medio nelle scansioni A-SCAN è aumentato nel giorno successivo al laser registrando alla fine una riduzione molto più marcata nel gruppo che ha assunto Vitreolisina forte (Figura 7). L’intensità media dei grigi (MGI) nelle scansioni B-SCAN ha mostrato un aumento dopo la capsulotomia (Giorno 1), e alla visita finale (Mese 2) il gruppo che ha assunto Vitreolisina forte è rimasto stabile a dispetto di un au-

Figura 6. Andamento Sensazione corpo estraneo-QS3 (score). Significatività statistica (P) e dimensione d’effetto (h2) dell’interazione fra assunzione di Vitreolisina forte e andamento temporale dello score
mento dell’intensità nel gruppo di controllo (Figura 8). Le Figure 9 e 10 riportano un esempio di A-scan e B-scan, confrontando l’andamento temporale di un soggetto che ha assunto Vitreolisina forte e un soggetto di controllo.
Il modello misto di ANOVA per misure ripetute ha dimostrato un’interazione statisticamente significativa fra assunzione dell’integratore Vitreolisina forte e andamento temporale di CS (P<0.001), QS1 (P=0.001), QS2 (P<0.001), QS3 (P=0.008), MVP (P<0.001) e MGI (P<0.001), l’effetto di interazione era assente soltanto per la BCVA (P=0.610). La dimensione d’effetto dell’interazione è risultata molto grande per le variabili CS (η2p=0.43), QS1 (η2p=0.26), QS2 (η2p=0.30), QS3 (η2p=0.17), MVP (η2p=0.39) e MGI (η2p=0.39), ad eccezione della BCVA (η2p<0.01).
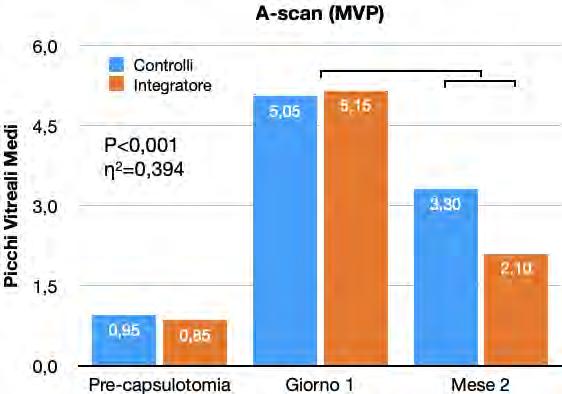
Figura 7. Andamento A-scan (Picchi Vitreali Medi). Significatività statistica (P) e dimensione d’effetto (h2) dell’interazione fra assunzione di Vitreolisina forte e andamento temporale dello score

Figura 8. Andamento B-scan (Intensità Grigi Media). Significatività statistica (P) e dimensione d’effetto (h2) dell’interazione fra assunzione di Vitreolisina forte e andamento temporale dello score


Discussione
L’integratore orale a base di curcumina, bromelina e costituenti della matrice vitreale si è rivelato efficace nel ridurre in maniera statisticamente significativa e con una grande dimensione d’effetto sia i corpi mobili sintomatici secondari a capsulotomia YAG che il discomfort oculare associato alla procedura. Il grup-
po che ha assunto Vitreolisina forte ha riportato un miglioramento più significativo rispetto al gruppo di controllo della sensibilità al contrasto, dei parametri soggettivi del questionario e dei parametri oggettivi ecografici. Inoltre non sono stati riferiti eventi avversi correlati alle procedure di studio.
La curcumina (diferuloilmetano) è il principale po-
lifenolo giallo nella radice della pianta indiana Curcuma longa6, ed è una molecola antinfiammatoria e antiossidante attraverso l’inibizione del NF-κB e di altri fattori intracellulari e citochine pro-infiammatorie7. A causa dello scarso assorbimento intestinale, non essendo idrosolubile, può essere coformulata insieme alla Piperina (alcaloide estratto dal Pepe nero) per aumentarne la biodisponibilità sistemica fino a 2000%8
Sono stati dimostrati numerosi effetti biologici in vitro, in modelli animali e in studi clinici su diverse patologie oculari del segmento anteriore, come per esempio neovascolarizzazione corneale (antiangiogenico)11,12; guarigione delle ferite corneali, protezione della barriera epiteliale, occhio secco, congiuntivite e uveite anteriore (antinfiammatorio e antiallergico)11,12; pterigio (antiproliferativo e propapoptico)11,12, cataratta (antiossidante, antiosmotico, antiperossidante e proapoptotico)11,12, glaucoma (neuroprotettivo)11,12, degenerazione maculare legata all’età (antiapoptotico)11 e retinopatia diabetica (antiossidante e antiangiogenico)
In vivo finora sono stati condotti studi clinici sulla retinopatia diabetica proliferativa (PDR)13 e sulla vitreoretinopatia proliferativa (PVR)14,15 mentre gli effetti sui corpi mobili non erano stati ancora valutati: riguardo allo studio in oggetto è ipotizzabile un effetto antinfiammatorio sul corpo vitreo con riduzione della flogosi intraoculare YAG-indotta.
La bromelina è un enzima fibrinolitico, estratto dal gambo di ananas (Ananas comosus L. Merr.), con proprietà antinfiammatorie e antiedemigene e di cui è noto il ruolo proteolitico sui corpi mobili primari ed ematici9,10.
Il collagene di tipo 2 e i mucopolisaccaridi glucosamina, condroitin solfato e acido ialuronico sono molecole che partecipano alla struttura fibrillare del vitreo e sono associate alla vitamina C, cofattore della sintesi del collagene: giocherebbero un ruolo ristrutturante e ricostituente sulla matrice fibrillare del vitreo alterata dai processi di naturale invecchiamento (sinchisi e sineresi) e dalla flogosi intraoculare YAG-indotta5. Finora solo due studi clinici hanno dimostrato l’efficacia dell’integrazione orale con micronutrienti (L-lisina, vitamina C, zinco, estratti di Vitis vinifera e Citrus aurantium) sulla riduzione a 6 mesi dei disturbi visivi associati ai corpi mobili vitreali16. A differenza dell’acuità visiva che non è ritenuta una misura efficace21 in quanto misura un contrasto fisso e alto (100%), la sensibilità al contrasto è il parametro
funzionale più sensibile alla presenza di corpi mobili vitreali17 e all’occhio secco18, così come lo straylight intraoculare è una misura psicofisica dell’abbagliamento o glare molto sensibile alle miodesopsie5. Nel nostro studio la CS al baseline era ridotta rispetto a soggetti normali della stessa età19, coerentemente con i dati già pubblicati sull’argomento20, ed è migliorata marginalmente il giorno dopo la capsulotomia. Due mesi dopo però il gruppo che ha assunto Vitreolisina forte ha mostrato un recupero quasi totale del contrasto rispetto a soggetti normali della stessa età, mentre il gruppo di controllo ha mostrato un recupero parziale.
Attualmente non esistono metodi consolidati di quantificazione dei corpi mobili vitreali; in questo studio ne proponiamo due: un conteggio semplice dei picchi significativi con tecnica A-SCAN (MVP) ed il calcolo della media dei grigi (MGI) tramite un software di processamento delle immagini B-SCAN anch’esso abbastanza immediato come procedura. Serviranno ulteriori ricerche per valutarne l’accuratezza e la riproducibilità.
È ormai acclarato che i corpi mobili sintomatici sono causa di riduzione della qualità di vita correlata alla visione23. Il vantaggio dei questionari è proprio il tentativo di sottolineare l’importanza dei sintomi per i pazienti. Il punto debole è invece la soggettività di tale misura, infatti la sintomaticità dei corpi mobili vitreali è molto legata ad aspetti psicologici. Non è ancora ben definito se i corpi mobili accentuino tratti psicologici preesistenti o se chi soffre di alcuni disturbi psicologici (come depressione, ansia, stress) sopravvaluti le miodesopsie concentrandosi su tale sintomo24.
Attualmente il trattamento dei corpi mobili sintomatici è piuttosto carente. La gestione principale è conservativa con l’osservazione clinica, rassicurando il paziente che si adatterà al sintomo5. Gli interventi più o meno invasivi sono la vitrectomia chirurgica, la vitreolisi YAG, e la vitreolisi farmacologica5
La vitrectomia limitata small gauge (floaterectomia) rappresenta il trattamento che rimuove definitivamente le opacità, ed è associata ad un miglioramento significativo della sensibilità al contrasto, dell’abbagliamento e dei punteggi dei questionari con un aumento invece marginale dell’acuità visiva. I possibili eventi avversi sono rotture e distacco della retina, emorragia coroideale, vitreoretinopatia proliferativa, ipertono o raramente ipotono, cataratta, endoftalmite, ricorso all’anestesia5
La vitreolisi YAG (floateressi) riduce i grandi corpi mobili in frammenti più piccoli, finora è stata valutata l’efficacia solo da pochi piccoli studi con questionari non-standardizzati e senza misure oggettive. Richiede sedute multiple e sono stati segnalati casi sporadici di uveite e ipertono5; cataratta, distacco di retina, emorragia retinica, scotomi, peggioramento delle miodesopsie25.
La vitreolisi farmacologica dissolverebbe enzimaticamente i corpi mobili, tuttavia non ci sono molecole enzimatiche approvate, né sono stati condotti studi clinici5 Lo studio ha evidenziato tuttavia anche un miglioramento soggettivo del discomfort oculare più significativo nel gruppo che ha ricevuto l’integrazione orale. La procedura laser prevedendo l’utilizzo di una lente a contatto e l’anestesia topica potrebbe alterare la superficie oculare e danneggiare l’epitelio corneale: verosimilmente una sinergia dell’effetto antinfiammatorio della curcumina con quello protettivo della lacrima artificiale migliora lo stato della superficie oculare e conseguentemente riduce la percezione dei corpi mobili vitreali26
Non esistono evidenze scientifiche che valutino diret-
Bibliografia
tamente l’effetto delle alterazioni della superficie oculare sulla percezione dei corpi mobili. È noto come l’abbagliamento/glare sia maggiore nei pazienti con corpi mobili e sia una misura oggettiva e indipendente di percezione visiva molto ben correlata al fastidio lamentato dai pazienti con miodesopsie21, così come l’occhio secco è associato ad un aumento dello straylight27 oltreché a una riduzione della sensibilità al contrasto18, le quali migliorano dopo trattamento topico con lacrima artificiale29. Pertanto il miglioramento dello stato di salute della superficie oculare contribuisce probabilmente ad un’ulteriore riduzione della percezione dei corpi mobili.
Conclusioni
L’integratore orale Vitreolisina forte a base di curcumina, bromelina e costituenti della matrice vitreale è efficace nel ridurre i corpi mobili sintomatici secondari a capsulotomia Nd:YAG e quindi dovrebbe essere considerato come primo approccio terapeutico non invasivo. Serviranno ulteriori ricerche per confermarne il ruolo sui corpi mobili primari o secondari ad altre condizioni.
1. Joshi RS, Rasal AV. Posterior capsular opacification and Nd:YAG capsulotomy rates in patients implanted with square-edged and non-square-edged intraocular lenses in manual small-incision cataract surgery: A randomized controlled study. Indian J Ophthalmol. 2023 Sep;71(9):32193223. doi: 10.4103/IJO.IJO_359_23. PMID: 37602611; PMCID: PMC10565942.
2. Donachie PHJ, Barnes BL, Olaitan M, Sparrow JM, Buchan JC. The Royal College of Ophthalmologists' National Ophthalmology Database study of cataract surgery: Report 9, Risk factors for posterior capsule opacification. Eye (Lond). 2023 Jun;37(8):1633-1639. doi: 10.1038/ s41433-022-02204-1. Epub 2022 Aug 24. PMID: 36002508; PMCID: PMC10219961.
3. Alipour F, Jabbarvand M, Hashemian H, Hosseini S, Khodaparast M. Hinged Capsulotomy--Does it Decrease Floaters After Yttrium Aluminum Garnet Laser Capsulotomy? Middle East Afr J Ophthalmol. 2015 Jul-Sep;22(3):352-5. doi: 10.4103/0974-9233.159761. PMID: 26180476; PMCID: PMC4502181.
4. Kara N, Evcimen Y, Kirik F, Agachan A, Yigit FU. Comparison of two laser capsulotomy techniques: cruciate versus circular. Semin Ophthalmol. 2014 May;29(3):151-5. doi: 10.3109/08820538.2013.874467. Epub 2014 Jan 29. PMID: 24475914.
5. Milston R, Madigan MC, Sebag J. Vitreous floaters: Etiology, diagnostics, and management. Surv Ophthalmol. 2016 Mar-Apr;61(2):211-27. doi: 10.1016/j.survophthal.2015.11.008. Epub 2015 Dec 8. PMID: 26679984.
6. Hewlings SJ, Kalman DS. Curcumin: A Review of Its Effects on Human Health. Foods. 2017 Oct 22;6(10):92. doi: 10.3390/foods6100092. PMID: 29065496; PMCID: PMC5664031.
7. Platania CBM, Fidilio A, Lazzara F, Piazza C, Geraci F, Giurdanella G, Leggio GM, Salomone S, Drago F, Bucolo C. Retinal Protection and Distribution of Curcumin in Vitro and in Vivo. Front Pharmacol. 2018 Jun 22;9:670. doi: 10.3389/fphar.2018.00670. PMID: 30013474; PMCID: PMC6036289.
8. Shoba G, Joy D, Joseph T, Majeed M, Rajendran R, Srinivas PS. Influence of piperine on the pharmacokinetics of curcumin in animals and human volunteers. Planta Med. 1998 May;64(4):353-6. doi: 10.1055/s-2006-957450. PMID: 9619120.
9. Ma JW, Hung JL, Takeuchi M, Shieh PC, Horng CT. A New Pharmacological Vitreolysis through the Supplement of Mixed Fruit Enzymes for Patients with Ocular Floaters or Vitreous Hemorrhage-Induced Floaters. J Clin Med. 2022 Nov 13;11(22):6710. doi: 10.3390/jcm11226710. PMID: 36431188; PMCID: PMC9695351.
10. Takeuichi, M.; Shieh, P.C.; Horng, C.T. Treatment of symptomatic vitreous opacities with pharmacologic vitrelysis using a mixture of bromelain, papain and ficin supplement. Appl. Sci. 2020, 10, 5901.
11. Radomska-Leśniewska DM, Osiecka-Iwan A, Hyc A, Góźdź A, Dąbrowska AM, Skopiński P. Therapeutic potential of curcumin in eye diseases. Cent Eur J Immunol. 2019;44(2):181-189. doi: 10.5114/ceji.2019.87070. Epub 2019 Jul 30. PMID: 31530988; PMCID: PMC6745545.
12. Liu XF, Hao JL, Xie T, Mukhtar NJ, Zhang W, Malik TH, Lu CW, Zhou DD. Curcumin, A Potential Therapeutic Candidate for Anterior Segment Eye Diseases: A Review. Front Pharmacol. 2017 Feb 14;8:66. doi: 10.3389/fphar.2017.00066. PMID: 28261099; PMCID: PMC5306202.
13. Filippelli M, Campagna G, Vito P, Zotti T, Ventre L, Rinaldi M, Bartollino S, dell'Omo R, Costagliola C. Anti-inflammatory Effect of Curcumin, Homotaurine, and Vitamin D3 on Human Vitreous in Patients With Diabetic Retinopathy. Front Neurol. 2021 Feb 5;11:592274. doi: 10.3389/fneur.2020.592274. PMID: 33633656; PMCID: PMC7901953.
14. Ren YX, Ma JX, Zhao F, An JB, Geng YX, Liu LY. Effects of Curcumin on Epidermal Growth Factor in Proliferative Vitreoretinopathy. Cell Physiol Biochem. 2018;47(5):2136-2146. doi: 10.1159/000491525. Epub 2018 Jul 5. PMID: 29975931.
15. Mendes TS, Novais EA, Badaró E, de Oliveira Dias JR, Kniggendorf V, Lima-Filho AAS, Watanabe S, Farah ME, Rodrigues EB. Antiangiogenic effect of intravitreal curcumin in experimental model of proliferative retinopathy. Acta Ophthalmol. 2020 Feb;98(1):e132-e133. doi: 10.1111/aos.14179. Epub 2019 Jul 5. PMID: 31273914.
16. Ankamah E, Green-Gomez M, Roche W, Ng E, Welge-Lüßen U, Kaercher T, Nolan JM. Dietary Intervention With a Targeted Micronutrient Formulation Reduces the Visual Discomfort Associated With Vitreous Degeneration. Transl Vis Sci Technol. 2021 Oct 4;10(12):19. doi: 10.1167/tvst.10.12.19. PMID: 34647961; PMCID: PMC8525826.
17. Mamou J, Wa CA, Yee KM, Silverman RH, Ketterling JA, Sadun AA, Sebag J. Ultrasound-based quantification of vitreous floaters correlates with contrast sensitivity and quality of life. Invest Ophthalmol Vis Sci. 2015 Jan 22;56(3):1611-7. doi: 10.1167/iovs.14-15414. PMID: 25613948; PMCID: PMC4554261.
18. Puell MC, Benítez-del-Castillo JM, Martínez-de-la-Casa J, Sánchez-Ramos C, Vico E, Pérez-Carrasco MJ, Pedraza C, del-Hierro A. Contrast sensitivity and disability glare in patients with dry eye. Acta Ophthalmol Scand. 2006 Aug;84(4):527-31. doi: 10.1111/j.1600-0420.2006.00671.x. PMID: 16879576.
19. Mäntyjärvi M, Laitinen T. Normal values for the Pelli-Robson contrast sensitivity test. J Cataract Refract Surg. 2001 Feb;27(2):261-6. doi: 10.1016/s0886-3350(00)00562-9. PMID: 11226793.
20. Elgohary MA, Beckingsale AB. Effect of posterior capsular opacification on visual function in patients with monofocal and multifocal intraocular lenses. Eye (Lond). 2008 May;22(5):613-9. doi: 10.1038/sj.eye.6702661. Epub 2006 Dec 22. PMID: 17187030.
21. Castilla-Marti M, van den Berg TJ, de Smet MD. Effect of vitreous opacities on straylight measurements. Retina. 2015 Jun;35(6):1240-6. doi: 10.1097/IAE.0000000000000456. PMID: 25650709.
22. Salcedo-Villanueva G, Trujillo-Alvarez M, Becerra-Revollo C, Ibarra-Elizalde E, Mayorquín-Ruiz M, Velez-Montoya R, García-Aguirre G, Gonzalez-Salinas R, Morales-Cantón V, Quiroz-Mercado H, Moragrega-Adame E. A Proposed Method to Quantify Vitreous Hemorrhage by Ultrasound. Clin Ophthalmol. 2019 Dec 2;13:2377-2384. doi: 10.2147/OPTH.S229857. PMID: 31819363; PMCID: PMC6896922.
23. Zou H, Liu H, Xu X, Zhang X. The impact of persistent visually disabling vitreous floaters on health status utility values. Qual Life Res. 2013 Aug;22(6):1507-14. doi: 10.1007/s11136-012-0256-x. Epub 2012 Oct 11. PMID: 23054488.
24. Kim YK, Moon SY, Yim KM, Seong SJ, Hwang JY, Park SP. Psychological Distress in Patients with Symptomatic Vitreous Floaters. J Ophthalmol. 2017;2017:3191576. doi: 10.1155/2017/3191576. Epub 2017 Dec 10. PMID: 29375909; PMCID: PMC5742468.
25. Liu X, Wang Q, Zhao J. Acute retinal detachment after Nd:YAG treatment for vitreous floaters and postertior capsule opacification: a case report. BMC Ophthalmol. 2020 Apr 19;20(1):157. doi: 10.1186/s12886-020-01428-7. PMID: 32306922; PMCID: PMC7168856.
26. Muz OE, Orhan C, Erten F, Tuzcu M, Ozercan IH, Singh P, Morde A, Padigaru M, Rai D, Sahin K. A Novel Integrated Active Herbal Formulation Ameliorates Dry Eye Syndrome by Inhibiting Inflammation and Oxidative Stress and Enhancing Glycosylated Phosphoproteins in Rats. Pharmaceuticals (Basel). 2020 Oct 7;13(10):295. doi: 10.3390/ph13100295. PMID: 33036453; PMCID: PMC7599565.
27. van de Wouw DS, van der Meulen IJ, van Vliet JM, Lapid-Gortzak R, Nieuwendaal CP, van den Berg TJ. Increased Straylight in Patients With Keratoconjunctivitis Sicca. Cornea. 2016 Jun;35(6):749-53. doi: 10.1097/ICO.0000000000000828. PMID: 27032024.
28. Huang FC, Tseng SH, Shih MH, Chen FK. Effect of artificial tears on corneal surface regularity, contrast sensitivity, and glare disability in dry eyes. Ophthalmology. 2002 Oct;109(10):1934-40. doi: 10.1016/s0161-6420(02)01136-3. PMID: 12359618.
Volume 1
Redazione: Strada 4 Milano Fiori, Palazzo Q7 – 20089 Rozzano (MI) Sede operativa: FGE srl – Regione Rivelle 7/F – 14050 Moasca (AT) Tel. 0141 1706694 – Fax 0141 856013 – e-mail: info@fgeditore.it – www.fgeditore.it Ophthalmology up-to-date

FABIANO GRUPPO EDITORIALE

1. Fondatore di “Oftalmologia Clinica: Oculisti 2.0 Network”

Sono meno stanziali dei loro Maestri e più avvezzi a vivere in rete, non soltanto in corsia. Anche i medici si adeguano ai tempi che corrono. Le abitudini dei camici bianchi più giovani denotano una maggiore presenza sui social network, utilizzati per condividere informazioni utili alla popolazione e per rispondere ai dubbi dei pazienti. Sia chiaro: nulla sostituisce il contatto diretto, ancora imprescindibile. Ma l'evoluzione in atto è comunque un segno tangibile dei tempi che corrono e delle professioni che mutano.
Lo studio di Havas Life

«Il medico trentenne è un professionista in grado di combinare la pratica medica con lo sviluppo tecnologico e l'attività imprenditoriale», afferma Carola Salvato, a capo di Havas Life, tra le principali multinazionali che si occupano di comunicazione in ambito medico e sanitario. L'agenzia, in collaborazione con Ipsos, ha realizzato un'indagine tra i giovani specialisti per andare al cuore delle trasformazioni che stanno attraversando il mondo dei medici: specialisti e

non. La ricerca ha coinvolto 152 camici bianchi con un'età media di 31 anni, con lo scopo di identificare attitudini e comportamenti che possano avere un impatto sullo sviluppo della medicina del futuro. Quella dei professionisti nati negli anni Ottanta e diventati maggiorenni nel nuovo millennio è una generazione che comprende il digitale e reagisce alle sue molteplici evoluzioni. L'84 per cento degli interpellati ha dichiarato di trascorrere più di un'ora al giorno su internet per motivi personali. I medici più giovani navigano prevalentemente attraverso device mobili: smartphone, computer portatili, tablet e soltanto in una parte residuale col computer fisso. Quasi inevitabile ormai la presenza sui social network: appena il sette per cento degli intervistati ha dichiarato di non avere alcun profilo social. Facebook, tra i camici bianchi, è ancora il più utilizzato (82 per cento). Più bassi i tassi di adesione a Instagram (41 per cento) e LinkedIn (37 per cento), segno in quest'ultimo caso di una consapevolezza non ancora piena delle dinamiche del mondo del lavoro.
I Millennials non hanno dubbi: la tecnologia giocherà un ruolo chiave nell'influenzare la relazione tra medico e paziente. Soltanto un professionista su quattro pensa infatti che il più facile accesso alle informazioni non avrà conseguenze su questa relazione. Ma i cambiamenti tecnologici non estingueranno il tempo dedicato al dialogo. Per la maggior parte dei medici, soprattutto tra chi non è ancora specializzato, prevale la convinzione che la tecnologia avrà un effetto migliorativo sul rapporto con i propri pazienti. Dare a loro la possibilità di avere accesso con continuità e ovunque si trovino a contenuti e servizi dedicati porterà a renderli anche degli interlocutori più consapevoli, rendendo il rapporto all'insegna di
una migliore interazione. Per la quasi totalità degli intervistati sarà molto importante tenersi aggiornati sugli sviluppi tecnologici e le decisioni di trattamento saranno guidate in maniera sempre crescente dai dati scientifici. La tecnologia è considerata come un semplificatore nella pratica clinica, a vantaggio della presa in carico multidisciplinare del paziente: con un potenziale miglioramento delle possibilità di monitoraggio dei dati clinici e l'agevolazione dell'aderenza del paziente alle terapie.
L’Oftalmologia si conferma pioniera del cambiamento
Essere precursori dei tempi è storicamente sempre stato il beauceant della nostra Specialità. Già nel Codice di Hammurabi più di 3600 anni fa furono promulgate leggi che, per prime, regolavano le operazioni agli occhi: il medico doveva ottenere una retribuzione di dieci scicli per un'operazione con esito positivo, mentre in caso di esito negativo gli sarebbero state tagliate le mani. L'oculistica, che faceva parte inizialmente della Chirurgia, nel XIX secolo si emancipò, per prima, come materia autonoma. Anche oggi nella cosiddetta digital transformation, l’Oftalmologia è riuscita ad essere pioniera rispetto ad altre Specialità. Non solo tutte le principali Società Scientifiche si sono dotate di un proprio sito web e di un profilo social, cosi come la maggior parte dei Colleghi Oculisti, ma i professionisti si sono liberamente organizzati in

un Network autonomo ed indipendente in cui potersi confrontare e sostenere reciprocamente. Nata nel novembre 2017, Oftalmologica Clinica: Oculisti 2.0 Network, oggi è diventata la prima aula congressuale permanente, ove quasi tremila Colleghi si confrontano ogni giorno, crescendo professionalmente insieme. Un gruppo Facebook, riservato ai soli Oculisti (che vengono singolarmente censiti sul portale di FNOMCeO prima di essere ammessi) dove tutti trovano pari attenzione e soprattutto rispetto: Universitari e Ospedalieri, Territoriali e Liberi Professionisti, Specializzandi e Direttori di Struttura Complessa possono confrontarsi con rispetto e simpatia, crescendo umanamente e professionalmente all’interno di una community attenta ai bisogni della quotidianità professionale. Sermo, una delle web community scientifiche più importanti a livello internazionale, nata negli Stati Uniti ma oggi presente in oltre 150 Stati, ha definito “il progetto Oftalmologia Clinica uno delle Social Community mono-specialistiche più sviluppate” nel nostro Paese.
Con uno share di oltre l’87% e una frequenza di rimbalzo elevatissima, abbiamo creato Oftaclinic Channel, ovvero il canale Telegram dal quale è possibile accedere a tante web utility e piattaforme social distinte (Facebook, Instagram, LinkedIn, Youtube) e a numerosi servizi di Instant Messaging (fra i quali una menzione particolare va certamente ad #OftaHelp, il gruppo di mutuo soccorso tra Colleghi pensato per riferire pazienti critici o, più semplicemente, per ottenere un rapido consiglio su casi clinici e chirurgici complessi). Da qualche mese è stato lanciato il nuovo sito web (www.oftalmologiaclinica.it) dove ogni Oculista può gratuitamente geolocalizzarsi e gestire le prenotazioni dei propri pazienti. Grandioso il lavoro svolto dagli otto membri dell’#OftaTeam, Amministratori e Moderatori del gruppo Facebook, e dagli oltre quaranta #OftaCoRe, i Coordinatori Regionali su suolo nazionale, culminato nella realizzazione dell’attesissima III Edizione degli #OftaForce, il modulo congressuale interattivo inserito nel programma del XIV Congresso Nazionale AIMO. Tante le attività in programma per il 2024, che verranno affrontate con lo stesso entusiasmo ed una rinnovata volontà di cercare di essere il cambiamento digitale che tutti vorremmo vedere. Come recita il nostro claim - #WEr1 - l’Oculista 2.0 crede nel Network di Colleghi come unica strategia vincente nell’affrontare le sfide che la rivoluzione digitale impone alla nostra professione ed al mondo dell’Health caring del terzo millennio.
Che l'oftalmologia legale sia una specializzazione nella specializzazione è oramai da tempo un dato di fatto e chi la esercita, tra quelli che hanno maturato una certa esperienza nella loro più che trentennale attività e quelli che più di recente l'hanno scoperta, sa bene che la esperienza clinica costituisce il fattore primario imprescindibile, inderogabile prima che si arrivi a quella che è la proiezione medico legale propriamente detta.
In tutto questo quale che sia il ruolo dell'Oculista, d’Ufficio, quindi vincolato da un giuramento che è quello di far conoscere la verità o anche di parte, fondamentale è l'onestà intellettuale perché sia riaffermata e preservata la Nostra dignità di Professionisti nei confronti, prima di tutto del malato-periziando e poi di quelli che sono i colleghi coinvolti. E perché tutto questo possa avvenire è fondamentale il rispetto della verità che è sì scientifica, dettata dalla comune esperienza, ma anche basata sulla misura, sull'equilibrio, sul buon senso evitando difese a prescindere o dell'operato del collega o per converso per non aver sufficientemente valutato casi in cui l'unico dato certo è la insoddisfazione per il risultato ottenuto o il dubbio insinuato da altro specialista sulla correttezza dell'operato altrui. Quello che segue quindi è un esempio emblematico che dimostra quanto valida possa essere la macchina della Giustizia e come non si debba per forza perseguire la novità o farsi conquistare dall'alta tecnologia nel proporre una certa soluzione.
Il fatto
Il Sig. XY affetto da cheratocono in OO veniva sottoposto ad intervento di KPP all’OD all’età di 35 anni e all’OS a 44 anni.
Periodicamente si sottoponeva a dei controlli dallo specialista di fiducia che gli diagnosticava in OS, l’occhio con cui peraltro ha sempre visto meglio, la cataratta.

Essendogli stato consigliato il ricorso all’intervento di estrazione della cataratta, consultava il Dott. XY che gli prospettava la possibilità di correggere l’astigmatismo di cui era portatore (>7D), oltre ovviamente alla rimozione del cristallino opacato, con una lente intraoculare (IOL) ad alta tecnologia. Anche un altro oculista, il Prof. XY, confermava la necessità di intervenire in OS e di impiantare una IOL torica.
All’età di 73 anni si rivolgeva poi al Prof. XY che decideva di intervenire sull’OS in data ... presso la Clinica Oculistica dell’Azienda Ospedaliera-Universitaria di ...
Successivamente a Lione, nel ..., veniva rioperato, secondo quanto racconta, per ridurre l’astigmatismo dell’OS; dopo un anno è stato eseguito un nuovo trapianto di cornea nell’altro occhio, in OD, ed estrazione di cataratta con impianto di IOL monofocale.
La consulenza tecnica d’ufficio
...
– che l’astigmatismo secondario ad un trapianto corneale subisce delle modificazioni nel corso del tempo dato questo di facile comprensione dal momento che quella cicatrice che si viene a formare tra cornea innestata e cornea del ricevente non è stabile;
– che è impossibile prevedere di quanto e quale sarà l’orientamento dell’asse dell’astigmatismo che si verrà a determinare dopo un intervento di cataratta.
– che la sutura a punti staccati nel settore infero temporale, che va in pratica da ore 4 ad ore 6, è stata posta in un settore lontano rispetto a quelle che sono le normali sedi di accesso chirurgico per un intervento di cataratta tra tunnel corneale e paracentesi (ore 12 , ore 10, ore 2 o piuttosto ore 3).
che si renderà necessario a distanza di tempo (dopo 15 anni secondo alcune casistiche) di dover ripetere la cheratoplastica (“un trapianto non è per sempre” riprendendo la pubblicità di un famoso prezioso), il che darà luogo ad un astigmatismo secondario alla sutura diverso per entità ed asse rispetto a quello che si intendeva correggere anni addietro con una IOL torica.
Il che sta a significare che il presunto aumento dell’astigmatismo dopo l’intervento di cataratta sia del tutto disgiunto da questo atto chirurgico.
A questo punto vien da sé a fronte: – di un valore dell’astigmatismo pre-operatorio elevato e compensabile solo parzialmente con una IOL torica che non va oltre le tre diottrie, – di una variabilità certa nell’asse che avrebbe potuto assumere quella curvatura della cornea e nell’entità, nella previsione tutt’altro che peregrina, vaga o piuttosto astratta di un reintervento per eccessivo depauperamento del patrimonio di cellule endoteliali, la decisione di impiantare una IOL torica sarebbe stata a dir poco devastante, sconsiderata, improvvida.
Allora sì, questione di tempo, ma anche da subito chi avesse eseguito quell’intervento si sarebbe fatto carico di una colpa certa.
Eppure, in questa vicenda ove non sussistono quelle responsabilità prefigurate dalla Parte Attrice per non aver impiantato una IOL Torica a fronte delle indicazioni che da più di un oculista erano state date, una mancanza c’è stata alla luce delle considerazioni di cui sopra e sta nel difetto di informativa sulla bontà delle informazioni di cui era in possesso il Signor XY al di là dell’autorevolezza della fonte si chiamasse Tizio o Caio o chissà chi altro, accreditato quanto si voglia, professionista.
L’aver prospettato la possibilità di impiantare una IOL torica in un caso simile ha tutto il sapore di quelle che vengono etichettate, per essere attuali, come “fake-news”.
Al Signor XY nel momento in cui si è proposto per l’intervento di cataratta agli Specialisti della Clinica Oculistica di ….., e in particolare al Prof. …., gli andava detto senza mezzi termini, per la elevata riconosciuta competenza e prestigio di cui gode, che quanto in precedenza prefigurato non era adeguato, corretto, anzi sarebbe stato deleterio, dannoso, peggiorativo per il suo caso.
A tutto questo va poi aggiunto che una volta impiantata una IOL Torica non è che sia semplice ri-
muoverla e sostituirla specie se a distanza di tempo. Insomma l’occhio, e più in particolare un occhio operato di cheratoplastica, non è assimilabile ad un cassetto di un mobile che si apre e si chiude quando si vuole.
La prova provata di tutto questo sta nel fatto che l’innesto in OS si era per così dire slivellato, ectasizzato, e hanno ricruentato la cicatrice nel settore infero nasale e apposto dei punti per ridurre l’astigmatismo venutosi a creare (ciò ricavato dall’obbiettività dell’OS e dalle notizie apprese sull’impianto di IOL monofocale in OD - in Francia - difatti piuttosto che IOL torica, hanno impiantato una IOL monolocale.
Alla base della correttezza dell’impianto nel sacco capsulare di una IOL monofocale e non, come si contesta di una IOL torica, è dunque la incontrovertibile verità della variabilità dell’astigmatismo presente in un occhio sottoposto a KP ciò per tre motivi:
1. La instabilità nel tempo dell’anello cicatriziale che si viene a formare tra cornea innestata(del donatore) e cornea del ricevente.
2. La impossibilità di prevedere eventuali modificazioni della convessità corneale a seguito degli accessi che vengono praticati nel corso di un intervento di cataratta.
3. La possibilità di dover reintervenire, come talvolta accade in occhi non sottoposti ad intervento di cheratoplastica come nel caso del Sig. XY, per un mal posizionamento della IOL torica; il che avrebbe cagionato un ulteriore depauperamento del già insufficiente patrimonio di cellule endoteliali.
Le conclusioni della CTU
Non si ravvisano responsabilità da parte del Prof. XY nell’aver impiantato una lente monofocale in OS, invece che torica (come contestato da Parte Attice), nel corso dell’intervento di cataratta effettuato in data XXX presso la Clinica Oculistica dell’Azienda Ospedaliera-Universitaria, quanto piuttosto nel non aver informato e/o dimostrato di aver informato sul perché non poteva e non doveva essere utilizzato questo tipo di IOL contrariamente a quanto era stato prospettato da altri Specialisti.
La sentenza
Nelle pagine seguenti un estratto della sentenza.
(ii) venga ritenuta operante la polizza: -escludere, determinare, limitare e/o contenere il
previsto dalla Polizza, nonché di ogni altro limite ivi previsto, ed, infine, subordinando altresì il
pagamento da parte del Prof. Motolese in favore degli aventi diritto; in ogni caso: con vittoria di spese e compensi di causa oltre IVA e CPA .
Con atto di citazione ritualmente notificato Enea Loreti ha evocato in giudizio
oculistica, chiedendone la condanna al risarcimento dei danni non patrimoniali subiti a causa rata diagnosi/attività medica.
A fondamento della domanda ha dedotto: di essersi recato da un medico specialista di Cesena dopo aver riscontrato una diminuzione della vista; che detto medico suggeriva un intervento di rimozione della cataratta con inserimento di un cristallino artificiale
adeguatamente specializzata; di essere stato sottoposto a visita medica dal Prof. Motolese che, confermato il quadro clinico, consigliava un intervento chirurgico di rimozione della cataratta; di aver eseguito in data 19.2.2013 ma di non aver riportato un di essersi sottoposto a visita in data
25.3.2013 dal Prof. Motolese che prospettava alcune soluzioni migliorative, assicurando che avrebbe eseguito successivi accertamenti; che, non contattato ulteriormente, si rivolgeva ad un centro oftalmico ove apprendeva che gli era stata impiantata e non una lente torica che avrebbe invec un pari a 1/20 mentre era di 1/10; di essersi sottoposto a visita medico-legale la quale aveva accertato la responsabi lità del chirurgo per negligenza ed imperizia con conseguente danno consistente nella perdita pressochè integrale profilo corneale dovuto a manipolazione chirurgica.
a struttura e dello specialista.

medico. In questi casi, è dunque onere del medico dimostrare che il danno non sussiste, ovvero non è dipeso da propria colpa (ex multis Cass., sez. III, 23-05-2001, n. 7027, Cass. sez. III, 06-10-1997, n. 9705).
Né rileva che il medico sia intervenuto non già in forza di un contratto di prestazione venzionata.
conseguenza che non è onere del paziente provare la colpa del medico, ma è onere di -legale le cui conclusioni vengono fatte proprie da questo giudice essendo frutto di rigorosi accertamenti tecnici ed esente da vizi logico-giuridici.
Il CTU ha accertato: na lente monofocale in OS, invece che torica (come
Universitaria Senese, quanto piuttosto nel non aver informato e/o dimostrato di aver informato sul perché non poteva e non doveva essere utilizzato questo tipo di IOL contrariamente a quanto era stato prospettato da altri Specialisti.
2. Non vi sono lesioni causalmente collegate ai fatti oggetto del presente
3. Per quanto risposto al Punto 2 non sono stati accertati esiti permanenti menomativi, tanto precisato però si ritiene che la mancata informativa resa al Sig. EL, con relativa condivisio tipo di IOL che sarebbe stata impiantata), non solo con la estrazione della cataratta, ma ro, comporti artificiale (IOL) di un tipo piuttosto che di un altro, comporti una valutazione forfettaria di un 2-3% (due-tre per cento). Premesso che detto orientamento è stato verbalmente prospettato ai diversi CCTTPP e accolto, se pur con riserva del Collega che U. Senese, nella consapevolezza della evidente contraddittorietà di dare un valore numerico ad un difetto di consenso a fronte di un danno biologico sensu Giudice, quale peritus peritorum. a del Sig.

a del Sig.
ENEA LORETI risulta ridotta a causa della presenza di una cataratta secondaria, che è possibile rimuovere ricorrendo ad intervento parachirurgico di capsulotomia mediante yang laser.
6. Riguardo la congruità delle spese sostenute, per quanto non essendosi in atti la Parte Attrice riservata di documentarle, a seguito di quanto fin qui argomentato è
stata chiara, completa e del tutto esaustiva il Sig. Enea Loreti si sarebbe evitato tutto quel viatico di visite ed indagini strumentali, non avrebbe dovuto, in buona sostanza, interpellare
i responsabilità ha, addirittura, precisato che la decisione di impiantare una IOL torica sarebbe stata a dir poco devastante, sconsiderata, improvvida. Allora si, questione di tempo, ma anche da subito chi avesse eseguito o carico di una colpa certa. Eppure, in questa vicenda ove non sussistono quelle responsabilità prefigurate dalla parte attrice per non aver impiantato una IOL torica a fronte delle indicazioni che da più di un oculista erano state date, una mancanza c'è stata alla luce delle considerazioni di cui sopra e sta nel difetto di informativa sulla bontà delle informazioni di cui era in possesso il Sig. Enea Loreti al di là
termini, per la elevata riconosciuta competenza prestigio di cui gode, che quanto in precedenza prefigurato non era adeguato, corretto, anzi deleterio, dannoso, peggiorativo per il suo caso. A tutto questo va poi aggiunto una volta impiantata una IOL torica non è (pagg. 12, 13 CTU).
Nel caso di specie, tuttavia, la carenza di consenso informato non può dar luogo ad alcun risarcimento, non avendo parte attrice svolto alcuna specifica domanda sul punto e non potendo la stessa essere ricompresa in quella di diagnosi/attività medica di cui in narrativa
In tema di consenso informato giova preliminarmente riportare parte della motivazione
secondo la definizione datane dal giudice delle leggi (Corte Cost. 23 dicembre 2008, n.438),
4.2.5. Al rilievo che il danno-conseguenza rappresentato dalla sofferenza e dalla contrazione della libertà di disporre di se stesso corrisponde allo sviluppo di circostanze connotate da normalità e all'id quod plerumque accidit in seguito alla violazione dell'obbligo informativo, consegue che la risarcibilità di tali perdite non esige una specifica prova. Questa Corte ha infatti statuito che è da ritenersi immediata, siccome riferita al foro interno della coscienza dell'individuo, la compromissione della genuinità dei processi decisionali fondati su dati alterati o incompleti per incompletezza delle informazioni (Cass.

4.2.5. Al rilievo che il danno-conseguenza rappresentato dalla sofferenza e dalla contrazione della libertà di disporre di se stesso corrisponde allo sviluppo di circostanze connotate da normalità e all'id quod plerumque accidit in seguito alla violazione dell'obbligo informativo, consegue che la risarcibilità di tali perdite non esige una specifica prova. Questa Corte ha infatti statuito che è da ritenersi immediata, siccome riferita al foro interno della coscienza dell'individuo, la compromissione della genuinità dei processi decisionali fondati su dati alterati o incompleti per incompletezza delle informazioni (Cass. 05/07/2017, n. 16503). Pertanto, mentre in relazione alle ulteriori conseguenze dannose che non rientrano nella sequenza causale normale resta necessaria una specifica dimostrazione, in relazione al danno-conseguenza costituito dalla sofferenza e dalla contrazione della libertà di disporre di se stesso non occorre fornire alcuna prova specifica, ferme restando la possibilità di contestazione della controparte e quella del paziente di a llegare e provare fatti a sé ancor più favorevoli di cui intenda giovarsi a fini risarcitori (Cass. 05/07/2017, n.professionale del medico, l'inadempimento dell'obbligo di informazione sussistente nei confronti del paziente può assumere rilievo a fini risarcitori - anche in assenza di un danno alla salute o in presenza di un danno alla salute non ricollegabile alla lesione del diritto all'informazione - a condizione che sia allegata e provata, da parte dell'attore, l'esistenza di pregiudizi non patrimoniali derivanti dalla violazione del diritto fondamentale all'autodeterminazione in sè considerato, sempre che essi superino la soglia minima di tollerabilità imposta dai doveri di solidarietà sociale e non siano futili, ovvero consistenti in
non ha lamentato acquisizione del consenso informato e non ha avanzato alcuna domanda di risarcimento del danno per
fatto che, se fosse stato correttamente informato dei rischi e delle complicanze rvisi, né tale prova è emersa a livello presuntivo.
parte del medico e/o della struttura sanitaria in ordine alle modalità concrete di acquisizione di valido consenso informato stante, lo si ribadisce, la mancata proposizione di specifica
informato d sottoporvisi.
terzo sollevata da Amtrust Europe Limited.
tazione o della chiamata in causa per petitum omesso o assolutamente incerto, ex art. 164, comma 4 c.p.c. richiede una valutazione caso per caso in
relazione allo scopo del requisito di consentire alla controparte di apprestare adeguate e controparte (Cass. 1681/15).

tazione o della chiamata in causa per petitum omesso o assolutamente incerto, ex art. 164, comma 4 c.p.c. richiede una valutazione caso per caso in relazione allo scopo del requisito di consentire alla controparte di apprestare adeguate e controparte (Cass. 1681/15).
Analoghe considerazioni valgono per la causa petendi che, ai fini della declaratoria di nullità, deve risultare del tutto omessa o risultare assolutamente incerta. Segnatamente, ratio della norma che sua domanda; detta ratio nelle condizioni di apprestare adeguate e puntuali difese, onde non potrà prescindersi, nel valutare il grado di incertezza della domanda, dalla relazione con cui, con esso, si trovi eventualmente la controparte (Cass. 29241/08, Cass. 11571/13).
Nella presente fattispec compagnia ha comunque individuato il rapporto evocato, svolgendo compiute difese anche contrattuali, onde non vi è stata alcuna lesione o compromissione del contraddittorio e del diritto di difesa.
Assorbite le ulteriori questioni.
Le spese di lite, liquidate in dispositivo secondo i parametri medi di cui al DM 55/14 per lo scaglione di riferimento (controversia di valore indeterminabile), seguono la soccombenza e sono pertanto poste a carico di parte attrice nei confronti delle parti convenute, analogamente alle spese di lite.
P.Q.M.
il Tribunale, definitivamente pronunziando nella causa in epigrafe, ogni altra domanda ed eccezione disattesa, cosi provvede: rigetta le domande avanzate da Loreti Enea;
condanna Loreti Enea alla rifusione in favore di Azienda Ospedaliera Universitaria
Senese delle spese di lite che liquida in 7.254,00 per compensi, oltre rimborso spese forfettarie, IVA e CPA se per legge;
condanna Loreti Enea alla rifusione in favore di Motolese Eduardo delle spese di lite 7.254,00 15,48 per spese, oltre rimborso spese forfettarie, IVA e CPA se per legge.
Così deciso in Siena, il 13/07/2019
Il Giudice (Dott.ssa Giulia Capannoli)

approfondimenti in collaborazione con le Aziende del settore
Lenti oftalmiche ZEISS
dedicate a bambini e adolescenti
MyoCare® si distingue per la tecnologia brevettata
C.A.R.E.® (Cylindrical Annular Refractive Elements), che utilizza microstrutture cilindriche alternate ad aree di correzione regolare per creare il defocus simultaneo competitivo, che ad oggi risulta essere una delle soluzioni più efficaci per il contenimento della progressione miopica.
In seguito ai risultati dello studio condotto presso l’Ospedale oftalmico dell’Università di Medicina di Wenzhou (WMU)1, ZEISS propone due innovativi design della lente MyoCare® specifici in base all’età del bambino (fino a 10 anni oppure oltre i 10 anni).
Inoltre, il design ZEISS ClearFocus della lente consente una correzione ottimale dell’errore refrattivo del singo-


lo paziente, riducendo al minimo le distorsioni periferiche, sempre mantenendo il defocus miopico desiderato in tutti gli angoli di visione. Per tutte le altre ametropie, in cui non si verifica una progressione miopica importante, le lenti monofocali ZEISS SmartLife Young considerano i parametri personali variabili in base alla crescita ed età del giovane paziente: i movimenti degli occhi nello spazio, le variazioni del diametro pupillare durante la
crescita e i cambiamenti anatomici del viso grazie alla tecnologia Dynamic AgeFIT, per ottenere fino al 60% di campi di visione più ampi2.
Inoltre, le lenti oftalmiche ZEISS specifiche per i bambini sono protettive dai raggi UV fino a 400nm e usufruiscono del programma 4 Kids per il rinnovo successivo delle lenti a condizioni agevolate.
Per maggiori informazioni sulle lenti MyoCare® o ZEISS SmartLife Young, scrivere a: oculisti.vision@zeiss.com

1.
2.
lo stesso fattore di riempimento (fill factor) 50:50, bilanciando le aree funzionali e di correzione refrattiva per garantire comfort e portabilità.
Lieti di condividere i dati retrospettivi ad interim a 1 anno dello studio randomizzato controllato (RCT) PROTECT condotto da Visioneering Technologies, Inc. produttore della lente a contatto Menicon Bloom DayTM, la soluzione morbida giornaliera inclusa nel Menicon BloomTM Myopia Control Management System, un approccio olistico per la gestione del controllo della miopia.
MODALITÀ
Per lo studio PROTECT, sono stati presi in esame bambini di età compresa tra 7 e i 13 anni con autorefrazione cicloplegica compresa tra -0,75D e -5D in otto strutture cliniche. I soggetti sono stati casualmente assegnati ai due gruppi di trattamento: lenti a contatto monofocali e lenti a contatto multifocali, con valutazioni primarie che includevano l'autorefrazione cicloplegica (CSER) e la lunghezza assiale (AXL). Sono state identificate le pubblicazioni di tre studi retrospettivi su bambini che indossavano queste lenti e analizzate per un totale di due anni. Infine, è stata analizzata la tendenza dei valori CSER e AXL osservati in questi studi.
Una lente a contatto morbida monouso giornaliera disponibile in commercio, che fornisce da 6 a 8D di potere positivo relativo in un’area dal diametro della dimensione media della pupilla dei bambini, ha dimostrato in
precedenza l'efficacia per il controllo della progressione della miopia in diversi real-world studies. PROTECT è uno studio randomizzato controllato (RCT) multinazionale, in doppio cieco, che valuta l'efficacia e la sicurezza di queste lenti per il controllo della progressione della miopia nei bambini. Viene presentato un confronto delle caratteristiche dei pazienti e dell'andamento dei risultati di efficacia tra i dati dei real-world studies e quelli del primo anno di ricerca dello studio RCT. L'analisi dei risultati del follow-up a 1 anno mostra che l'effetto del trattamento è stato di 0,41D, pari al 71% dell'errore refrattivo, rispetto al gruppo di controllo. In termini di lunghezza assiale, l'effetto del trattamento è stato di 0,17 mm, o del 61%, rispetto al gruppo di controllo. La variazione media della lunghezza assiale risulta essere di 0,11 mm nei bambini che indossavano la lente Menicon Bloom DayTM. Il 64% dei soggetti non ha mostrato una progressione significativa (0,25D o meno). In relazione ai dati precedenti di sei anni1 di ricerca, l'analisi dei risultati del follow-up a 1 anno mostra che l'effetto del trattamento è stato di 0,45D per l'errore refrattivo e di 0,17 mm per la lunghezza assiale rispetto al gruppo di controllo. Un altro studio indipendente2 ha mostrato risultati simili: 0,23 D per l'errore refrattivo e 0,17 mm per la lunghezza assiale rispetto al gruppo di controllo. Questi risultati supportano ulteriormente l’efficacia di Menicon Bloom DayTM come trattamento per rallentare la progressione della miopia nei bambini.

un’esperienza d’uso unica e sicura
le applicazioni Menicon Bloom Night per i bambini miopi.
Nel PROTECT abbiamo 145 soggetti provenienti da Canada, Stati Uniti, Hong Kong e Singapore assegnati casualmente ai gruppi in esame per il trattamento. L'età media±DS era di 9,9±1,5 e il CSER di -2,4±1,3, senza differenze statistiche tra i due gruppi per età, sesso o razza. Le tre analisi retrospettive includono i dati di 106 soggetti statunitensi di età compresa tra 8 e 16 anni. L'età media e l'errore di refrazione (occhi destri) nelle analisi retrospettive pubblicate variavano da 10,3 a 12,0 anni e da -3,14 a -3,95 D. Le variazioni analizzate erano in media comprese tra 0,01 e 0,10D per CSER al primo anno e tra 0,08 e 0,28 D al secondo anno (cumulativo). Due analisi hanno riportato AXL, con un allungamento medio di 0,03 e 0,08 mm al primo anno e di 0,06 e 0,15 mm al secondo (cumulativo). In tutti e quattro gli studi, la maggior parte dei bambini che indossano lenti a contatto con profilo di potere cate -
nario ha registrato una variazione del CSER ≤0,25D all'anno. La variazione di CSER e AXL è stata ridotta di almeno il 50% all'anno rispetto ai gruppi di controllo. Sebbene vi siano differenze tra gli studi retrospettivi e gli studi controllati randomizzati, l'analisi e la correlazione dei loro trend fornisce una preziosa visione della coerenza delle prestazioni di questa lente a contatto in contesti pratici diversi.
«Siamo entusiasti di constatare che i dati a un anno confermano la nostra fiducia nell'efficacia di Menicon Bloom DayTM nel rallentare la progressione della miopia nei giovani pazienti miopi.
Noi di Menicon vogliamo supportare i professionisti della vista nel fornire i migliori strumenti per la gestione della miopia e questi risultati confermano il nostro impegno nei loro confronti e nei confronti dei loro pazienti.» Peter Nijhuis, direttore della divisione Myopia Management e Menicon Holdings B.V.

1. Cooper J, O'Connor B, Aller T, Dillehay SM, Weibel K, Benoit D. Reduction of Myopic Progression Using a Multifocal Soft Contact Lens: A Retrospective Cohort Study. Clin Ophthalmol. 2022 Jul 4;16:2145-2155.
2. Cooper J, Aller T, Smith EL 3rd, Chan K, Dillehay SM, O'Connor B. Retrospective Analysis of a Clinical Algorithm for Managing Childhood Myopia Progression. Optom Vis Sci. 2023 Jan 1;100(1):117-124.
Il diabete mellito è caratterizzato da un’iperglicemia che determina uno stato infiammatorio cronico conseguente alla alterata omeostasi cellulare. Tutto ciò si riflette in un danno vascolare e disfunzionale multiorgano, che a livello della retina si può presentare con complicanze microvascolari e danno alla neuroretina. L’eccesso dei prodotti di glicazione avanzata (AGE), innesacata da specie reattive dell’ossigeno (ROS), è uno dei meccanismi più importanti coinvolti nella fisiopatologia delle complicanze croniche del diabete, come le microemorragie retiniche.
ERREDI e la protezione dei capillari nella retinopatia diabetica non proliferante Esistono alcuni particolari micronutrienti vegetali che presentano capacità protettive nei confronti dei capillari retinici, ma affiché essi possano contribuire al
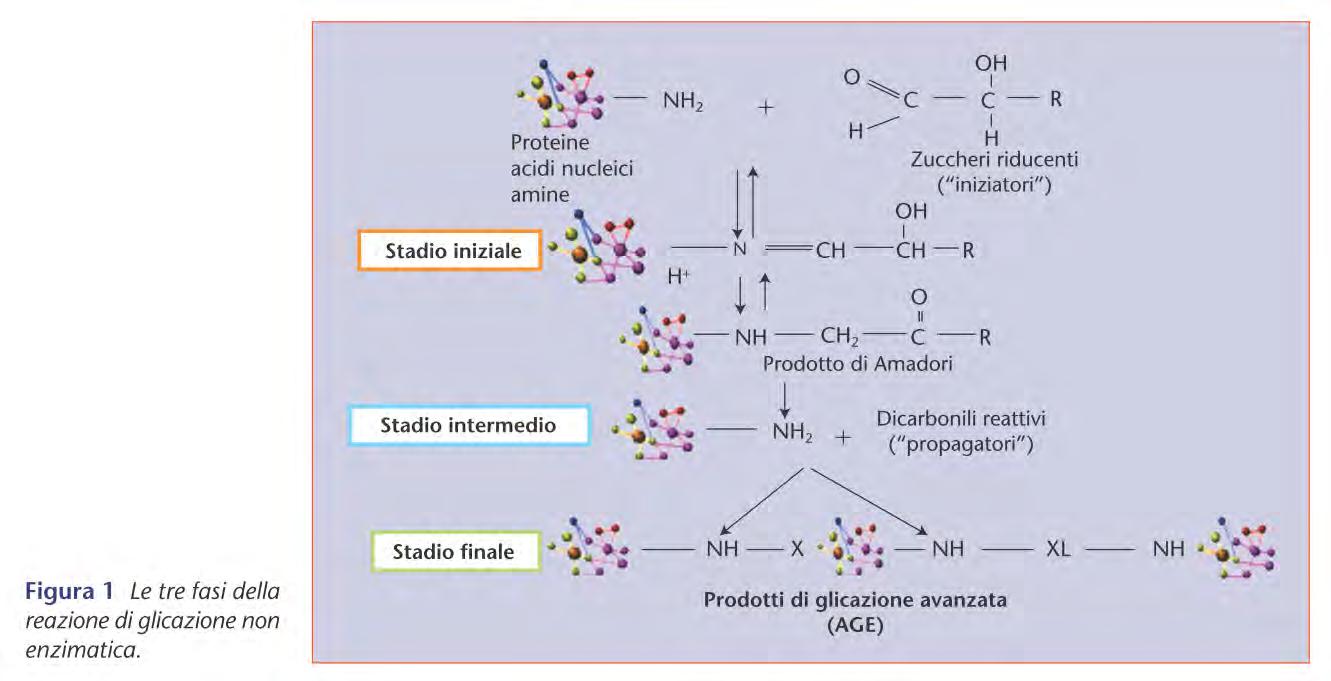
mantenimento dell’integrità capillare, è necessario che possano garantire una serie di proprietà quali.
1. Contrastare la formazione degli AGE
2. Migliorare le tolleranza al glucosio
3. Neutralizzare lo stress ossidativo tramite inibizione dei radicali liberi dell’ossigeno (ROS)
4. Inter venire riducendo i fenomeni infiammatori.
L’Acido Oleanolico (OA), agisce inibendo le tre fasi della glicazione avanzata, che portano alla formazione dei prodotti finali, gli AGE.
La Quercetina (Quercefit®), riduce l’assorbimento intestinale del glucosio ed incrementa l’assorbimento del glucosio nei muscoli scheletrici, contribuendo in tal modo al controllo della glicemia.
I beta-glucani contenuti in Betavia™ Complete, polisaccaridi derivati da una particolare microalga, l’Euglena gracilis, presentano proprietà antiossidanti, immunomodulanti ed antitumorali.
Una caratteristica dei beta-glucani è quella di stimolare i meccanismi di difesa, principalmente l'attivazione dei granulociti, monociti, macrofagi e cellule killer naturali.
Al tempo stesso, come catene polimeriche di glucosio, i beta-glucani alimentano e supportano la crescita di Lactobacillus e Bifidobacteria nell'intestino, i batteri probiotici che costituiscono la flora intestinale dell’organismo, agendo sull’asse intestino-retina: una nuova prospettiva nella prevenzione e nel trattamento della retinopatia diabetica.
Gli estratti della Boswellia serrata contengono gli Acidi Boswellici, che posseggono significative proprietà antinfiammatorie.
ERREDI costituisce un valido contributo nel prevenire i fenomeni microemorragici della retina nella retinopatia diabetica non proliferante.
1. Huafang Ding et al; The inhibition of oleanolic acid on protein non-enzymatic glycation. LWT - Food Science and Technology 125 (2020) 109253
2. Priya Mijgar and Uday Deokate. Antidiabetic Potential of Quercetin. DOI: http://dx.doi. org/10.5772/intechopen.1003171.
3. Anna Ciecierska et al; NUTRACEUTICAL FUNCTIONS OF BETA-GLUCANS Rocz Panstw Zakl Hig 2019;70(4):315-324. https://doi.org/10.32394/rpzh.2019.0082
4. M.Z. Siddiqui. Boswellia Serrata, A Potential Antiinflammatory Agent: An Overview. Indian Journal of Pharmaceutical Sciences May-June 2011


Figura 1. Proiezioni del numero di persone con lieve, moderata e grave riduzione della capacità visiva dal 1990 al 2050
Da: R. Bourne et al., «Trends in prevalence of blindness and distance and near vision impairment over 30 years: an analysis for the Global Burden of Disease Study», The Lancet Global Health, vol. 9, fasc. 2, pp. e130–e143, feb. 2021, doi: 10.1016/ S2214-109X(20)30425-3
Controintuitivamente, il miglioramento dell'assistenza sanitaria avvenuto negli ultimi decenni e il conseguente miglioramento dell'aspettativa di vita hanno portato ad un aumento del numero di persone ipovedenti. Questo accade poiché la maggior parte delle malattie oculari che causano una riduzione elevata della funzione visiva sono correlate all’età, dunque la loro prevalenza aumenta con l'ingresso di più persone nella fascia più anziana della popolazione. Si stima, infatti, che tra il 2020 e il 2050 la popolazione mondiale con più di 65 anni raddoppierà, passando da circa 1 miliardo a 2 miliardi. Questa tendenza avrà profonde implicazioni per le patologie oculari legate all'età, come si può osservare nelle proiezioni in Figura 1. Se si considera l'intera popolazione mondiale, le cause più frequenti di Ipovisione lieve e moderata sono gli errori di rifrazione non corretti (soprattutto la presbiopia), la cataratta, la degenerazione maculare legata all'età, la retinopatia diabetica e il glaucoma. Gli errori di rifrazione sono facilmente risolvibili con le moderne lenti oftalmiche e le tecniche chirurgiche per la cataratta sono sempre più efficaci nel ripristinare una buona qualità della visione. Tuttavia, sarebbe auspicabile che queste tecnologie si diffondessero in tutti i Paesi. Al contrario, altre malattie oculari come il glaucoma, la degenerazione maculare legata all'età (AMD) e la retinopatia diabetica possono facilmente causare la perdita permanente della funzione visiva.

DAI Optical mette al servizio degli oculisti e degli ottici la sua esperienza trentennale nella produzione e progettazione di lenti oftalmiche, anche nell’ambito dell’ipovisione. La divisione aziendale SOFT CARE, ricca di ausili ottici dedicati agli ipovedenti, si aggiorna ogni anno grazie al dipartimento Ricerca e Sviluppo interno, dove informatici e ingegneri quotidianamente lavorano per migliorare la resa estetica e ottica degli ausili. Vediamone alcuni.
Molte patologie possono causare una riduzione più o meno marcata dell’acuità visiva da lontano, creando disagi nella vita quotidiana della persona. Per gestire meglio il residuo visivo si potrebbe optare per una lente ingrandente per fattore forma IPERVIEW di DAI Optical, ina lente capace di ingran -
dire l’immagine retinica fino al 9% e incorporando anche la prescrizione sferocilindrica per lontano. In casi più gravi, in cui è presente uno scotoma assoluto centrale binoculare e la persona è costretta ad utilizzare la fissazione eccentrica, è possibile compensare la deviazione con una lente prismatica IPER-X, progettata per alleviare lo sforzo dei muscoli extra-oculari e ingrandire l’immagine retinica del 6%.
Tra gli ausili ottici più utilizzati per vicino spiccano gli iper-correttivi prismatici IPER-BINO, capaci di ingrandire l’immagine fino a 4X offrendo una lettura confortevole grazie al campo visivo esteso e al prisma base interna. Per ingrandimenti superiori, fino ad 8X, l’innovativo sistema aplanatico monoculare IPER-APLANAT si rivela la lente per occhiale più performante.

Figura 2
Comparazione di spessori tra le lenti classicamente utilizzate e le lenti innovative ottimizzate dagli ingegneri di DAI Optical, nel caso di occhiali aplanatici o iper-correttivi prismatici
Le lenti MiYOSMART con tecnologia D.I.M.S., prima soluzione oftalmica per la gestione della miopia, vengono riconosciute dalla comunità scientifica come soluzione valida sia in termini di efficacia che di adattamento e tollerabilità per i giovani miopi.

In Italia, secondo dati Istat, circa 2 milioni di bambini sono miopi e si stima che circa l’80% di loro sia in progressione.
In una recente intervista organizzata da Hoya in occasione del Congresso AICCER, il professor Paolo Nucci, medico-oculista e divulgatore scientifico ordinario all'Università degli Studi di Milano ha discusso della crescente epidemia di miopia, soprattutto tra i bambini, e delle strategie necessarie per affrontarla. "È urgente prendere provvedimenti per contrastare questa epidemia di miopia, che sta colpendo sempre più le giovani generazioni," ha affermato il professor Nucci. "È fondamentale promuovere attività all'aria aperta e sensibilizzare i genitori sull'importanza di limitare il tempo trascorso sui dispositivi digitali." Nucci ha inoltre enfatizzato il ruolo fondamentale dei pediatri di famiglia nel riconoscimento precoce della miopia e nell'educazione sanitaria a scopo preventivo. Ha parlato quindi dell'importanza della ricerca scientifica nel campo della miopia pediatrica, evidenziando l’aumento significativo delle pubblicazioni negli ultimi anni e la crescente collaborazione tra industria ottica e oftalmologia. "Possiamo parlare quasi di un patto etico tra industria ottica e ricerca scientifica," ha dichiarato
il professor Nucci. "L'obiettivo è quello di combinare il progresso tecnologico delle lenti da vista con il benessere sociale. Questa collaborazione è fondamentale, specialmente quando si tratta della salute dei bambini".
Le lenti MiYOSMART con tecnologia D.I.M.S. di Hoya, progettate per rallentare la progressione della miopia nei bambini, hanno dimostrato risultati promettenti. Lo studio clinico di 2 anni arrivato al sesto anno di follow-up, il più lungo per una lente da vista per la gestione della miopia, e oltre 25 pubblicazioni in tutto il mondo confermano l’efficacia e sicurezza delle lenti nel tempo, in diverse etnie e fasce d’età: grazie alle lenti MiYOSMART, la progressione della miopia viene rallentata in media del 60% e si arresta nel 21,5% dei casi.
"Le lenti D.I.M.S. costituiscono una soluzione non invasiva che i genitori accettano più facilmente rispetto alle gocce di atropina. I bambini dopo il primo giorno si adattano molto bene, personalmente ho buoni risultati."
L’esperto invita infine a una maggiore consapevolezza sull'importanza della prevenzione e della comunicazione alle famiglie dell’esistenza e dell’efficacia di soluzioni innovative per la gestione della progressione miopica, sostenute e avvalorate da studi e pubblicazioni scientifiche, come le lenti D.I.M.S.



2 BORSE DI STUDIO NICOLA PESCOSOLIDO ALLE MIGLIORI TESI DI SPECIALIZZAZIONE O DOTTORATO IN OFTALMOLOGIA AA 2022/23 PROGRAMMA PRELIMINARE
Presidente
Marcella Nebbioso (Roma)
Vice presidente
Emilia Gallo (Catania)
Segretario scientifico
Maria Rosaria Franco (Lecce)
Consiglieri
Federico Bartolomei (Bologna)
Rocco Di Lorenzo (Palermo)
Luigi Donato (Messina)
Federica Franzone (Torino)
Paolo Giuseppe Limoli (Milano)
Marco Ulisse Morales (Padova)
Erika Rigoni (Latina)
Sergio Zaccaria Scalinci (Bologna)
Lucia Scorolli (Bologna)
Gianfrancesco Villani (Verona)
Enzo Maria Vingolo (Roma)
Segreteria Organizzativa
Reg. Rivelle 7/F - Moasca (AT) Tel. 0141 1706694 - Fax 0141 856013 info@fgeditore.it
Consulta il









Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta. Vedere paragrafo 4.8 per informazioni sulle modalità di segnalazione delle reazioni avverse.
1. DENOMINAZIONE DEL MEDICINALE Roclanda 50 microgrammi/mL + 200 microgrammi/mL collirio, soluzione
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni mL di soluzione contiene 50 microgrammi di latanoprost e 200 microgrammi di netarsudil (come mesilato). Eccipiente(i) con effetti noti Ogni mL di soluzione contiene 200 microgrammi di benzalconio cloruro. Per l’elenco completo degli eccipienti, vedere paragrafo 6.1.
3. FORMA FARMACEUTICA Collirio, soluzione. Soluzione limpida, incolore, pH 5 (indicativamente). Osmolalità: 280 mOsm/kg.
4. INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche Roclanda è indicato per la riduzione della pressione intraoculare (PIO) elevata in pazienti adulti con glaucoma primario ad angolo aperto o ipertensione dell’occhio nei quali la monoterapia con una prostaglandina o netarsudil determini una riduzione della PIO insufficiente. 4.2 Posologia e modo di somministrazione Il trattamento con Roclanda deve essere iniziato esclusivamente da un oculista o da un operatore sanitario qualificato in oftalmologia. Posologia Uso negli adulti, compresi gli anziani Il dosaggio raccomandato è di una goccia nello(negli) occhio(i) affetto(i) una volta al giorno alla sera. I pazienti non devono instillare più di una goccia nello(negli) occhio(i) affetto(i) ogni giorno. Se si dimentica una dose, il trattamento deve continuare con la dose successiva alla sera. Popolazione pediatrica La sicurezza e l’efficacia di Roclanda nei bambini di età inferiore a 18 anni non sono state stabilite. Non ci sono dati disponibili. Modo di somministrazione Per uso oftalmico. I dati sulle potenziali interazioni specifiche per latanoprost + netarsudil sono riportati nel paragrafo 4.5. Se l’associazione latanoprost + netarsudil deve essere usata in concomitanza con altri medicinali oftalmici per uso topico, ogni medicinale deve essere somministrato a distanza di almeno cinque minuti dall’altro. A causa delle proprietà vasodilatatorie di netarsudil, gli altri colliri devono essere somministrati prima di latanoprost + netarsudil. Gli unguenti oftalmici devono essere somministrati per ultimi. Le lenti a contatto devono essere rimosse prima dell’instillazione di latanoprost + netarsudil e possono essere riposizionate 15 minuti dopo la sua somministrazione (vedere paragrafo 4.4). Come per ogni collirio, per ridurre il possibile assorbimento sistemico si raccomanda di comprimere il sacco lacrimale a livello del canto mediale (occlusione puntale) per un minuto. Questa operazione deve essere effettuata immediatamente dopo aver instillato ogni goccia. Al fine di evitare la contaminazione della soluzione, la punta del contagocce non deve entrare in contatto con l’occhio, le strutture circostanti, le dita o qualsiasi altra superficie. Dall’uso di soluzioni contaminate possono derivare gravi danni agli occhi e conseguente perdita della vista. 4.3 Controindicazioni Ipersensibilità al(ai) principio(i) attivo(i) o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1. 4.4 Avvertenze speciali e precauzioni d’impiego Pigmentazione dell’iride Latanoprost può causare una graduale alterazione del colore dell’occhio poiché aumenta la quantità di pigmento marrone presente nell’iride. Prima di istituire la terapia, i pazienti devono essere informati della possibilità di una variazione permanente del colore degli occhi. Il trattamento unilaterale può causare eterocromia permanente. L’aumento della pigmentazione dell’iride non ha mostrato di determinare conseguenze cliniche negative ed è possibile proseguire il trattamento con medicinali contenenti latanoprost anche dopo aver riscontrato la pigmentazione dell’iride. I pazienti devono comunque essere monitorati regolarmente e, nel caso in cui il quadro clinico lo richieda, il trattamento con medicinali contenenti latanoprost può essere sospeso. Cheratite erpetica I medicinali contenenti latanoprost devono essere usati con cautela in pazienti con anamnesi di cheratite erpetica e devono essere evitati nei casi di cheratite da herpes simplex in fase attiva e nei pazienti con anamnesi di cheratite erpetica ricorrente specificamente associata agli analoghi delle prostaglandine. Rischio di edema maculare Le segnalazioni di edema maculare con medicinali contenenti latanoprost hanno riguardato principalmente pazienti afachici, pseudofachici con rottura della capsula posteriore del cristallino o con lenti in camera anteriore o in pazienti con fattori di rischio noti per l’edema maculare cistoide (come la retinopatia diabetica e l’occlusione venosa retinica). I medicinali contenenti latanoprost devono essere usati con cautela nei pazienti afachici, pseudofachici con rottura della capsula posteriore del cristallino o con lenti in camera anteriore o nei pazienti con fattori di rischio noti per l’edema maculare cistoide. Rischio di irite/uveite Nei pazienti con noti fattori di rischio predisponenti allo sviluppo di irite/uveite, i medicinali contenenti latanoprost possono essere usati con cautela. Esacerbazione dell’asma Vi è un’esperienza limitata sull’uso di latanoprost in pazienti asmatici, ma dopo la commercializzazione del medicinale sono stati segnalati alcuni casi di esacerbazione dell’asma e/o della dispnea. I pazienti asmatici devono quindi essere trattati con cautela in attesa di acquisire un’esperienza sufficiente con l’associazione. Alterazione del colore della pelle periorbitale Nel corso del trattamento con medicinali contenenti latanoprost è stata osservata un’alterazione del colore della pelle periorbitale; la maggior parte delle segnalazioni ha riguardato pazienti giapponesi. L’esperienza acquisita finora dimostra che l’alterazione del colore della pelle periorbitale non è permanente e in alcuni casi risulta reversibile mentre si prosegue il trattamento con latanoprost. Cambiamenti nelle ciglia Il trattamento con medicinali contenenti latanoprost può gradualmente modificare le ciglia e la peluria dell’occhio trattato e delle aree circostanti; questi cambiamenti includono l’allungamento, l’ispessimento, la pigmentazione e l’infoltimento delle ciglia o della peluria e la crescita di ciglia con orientamento anomalo. I cambiamenti nelle ciglia sono reversibili con la sospensione del trattamento. Contenuto di benzalconio cloruro Questo medicinale contiene benzalconio cloruro. È stato segnalato che benzalconio cloruro provoca irritazione oculare, sintomi di secchezza oculare e può influire sul film lacrimale e sulla superficie corneale ed è noto per causare cambiamento di colore delle lenti a contatto morbide. Deve essere usato con cautela nei pazienti con occhi secchi e nei pazienti in cui la cornea può essere compromessa. I pazienti devono essere monitorati in caso di uso prolungato. L’efficacia di Roclanda non è stata studiata oltre i 12 mesi. 4.5 Interazioni con altri medicinali ed altre forme d’interazione Studi di interazione in vitro hanno mostrato che mischiando colliri contenenti timerosal a latanoprost + netarsudil si può formare del precipitato. Eventuali altri colliri devono essere applicati a distanza di almeno cinque minuti (vedere paragrafo 4.2). Studi in vitro hanno indicato che netarsudil è un potenziale inibitore degli isoenzimi del CYP450 nella cornea; tuttavia, finora non sono state osservate evidenze cliniche di interazioni farmacocinetiche locali. Sono stati riferiti casi di aumenti paradossi della PIO dopo la somministrazione oftalmica concomitante di due analoghi delle prostaglandine. L’uso di due o più prostaglandine, analoghi delle prostaglandine o derivati delle prostaglandine non è pertanto raccomandato. 4.6 Fertilità, gravidanza e allattamento Gravidanza I dati relativi all’uso di latanoprost + netarsudil in donne in gravidanza non esistono o sono in numero limitato. Non si ritiene che netarsudil possa causare effetti durante la gravidanza, dal momento che l’esposizione sistemica a netarsudil è trascurabile (vedere paragrafo 5.2). Gli studi sugli animali con somministrazione endovenosa di netarsudil non indicano effetti dannosi diretti o indiretti di tossicità riproduttiva a esposizioni clinicamente rilevanti (vedere paragrafo 5.3). Latanoprost potrebbe causare effetti farmacologici dannosi durante la gravidanza e/o sul feto/neonato (vedere paragrafo 5.3). L’associazione latanoprost + netarsudil non deve pertanto essere usata durante la gravidanza. Allattamento Non è noto se netarsudil/metaboliti siano escreti nel latte materno. Tuttavia, sebbene non si ritenga che netarsudil possa causare effetti su neonati/lattanti, dal momento che l’esposizione sistemica a netarsudil di donne che allattano è prevedibilmente trascurabile, non sono disponibili dati clinici rilevanti (vedere paragrafo 5.2). Latanoprost e i suoi metaboliti potrebbero essere escreti nel latte materno. Si deve decidere se interrompere l’allattamento o interrompere la terapia/astenersi dalla terapia con Roclanda tenendo in considerazione il beneficio dell’allattamento per il bambino e il beneficio della terapia per la donna. Fertilità Non sono disponibili dati relativi agli effetti di netarsudil sulla fertilità maschile o femminile. Tuttavia, non sono previsti effetti, poiché l’esposizione sistemica a netarsudil è trascurabile (vedere paragrafo 5.2). Gli studi sugli animali hanno dimostrato che latanoprost non ha effetto sulla fertilità maschile o femminile (vedere paragrafo 5.3). 4.7 Effetti
sulla capacità di guidare veicoli e sull’uso di macchinari Roclanda altera in modo trascurabile la capacità di guidare veicoli e di usare macchinari. In caso di visione annebbiata transitoria durante l’instillazione, prima di guidare veicoli o usare macchinari il paziente deve attendere che la visione torni nitida. 4.8 Effetti indesiderati Riassunto del profilo di sicurezza La reazione avversa oculare più comunemente osservata è l’iperemia congiuntivale, segnalata nel 46% dei pazienti. Altre reazioni avverse oculari riferite sono dolore in sede di instillazione (14%), cornea verticillata (12%) e prurito oculare (7%). La maggior parte delle reazioni avverse segnalate negli studi clinici con Roclanda erano oculari, di entità da lieve a moderata. Sulla base degli studi clinici, l’iperemia congiuntivale, segnalata in circa il 46% dei pazienti, ha portato alla sospensione nel 4,9% dei pazienti. Tabella delle reazioni avverse Le seguenti reazioni avverse sono state segnalate con l’associazione latanoprost + netarsudil, somministrata una volta al giorno e durante gli studi clinici e la sorveglianza post-commercializzazione con i singoli componenti latanoprost e netarsudil. Le reazioni avverse sono presentate in base alla classificazione per sistemi e organi secondo MedDRA. All’interno di ciascuna classe sistemicoorganica, le reazioni avverse sono classificate in base alla frequenza e alla seguente convenzione: molto comune (≥1/10), comune (≥1/100, <1/10), non comune (≥1/1.000, <1/100), raro (≥1/10.000, <1/1.000), molto raro (<1/10.000). Descrizione di reazioni avverse selezionate Iperemia della congiuntiva L’iperemia della congiuntiva è stata la reazione avversa più frequentemente segnalata associata al trattamento con latanoprost + netarsudil nelle sperimentazioni cliniche ed è attribuita all’effetto di vasodilatazione della classe di medicinali inibitori della Rho-chinasi. L’iperemia della congiuntiva era tipicamente di severità lieve e sporadica. Tuttavia, una percentuale relativamente ridotta di soggetti con iperemia moderata o severa ha sospeso il trattamento a causa di questa reazione avversa (5,0% negli studi clinici di fase 3). Cornea verticillata La cornea verticillata si è verificata in circa il 13% dei pazienti in studi clinici controllati di fase 3. La cornea verticillata osservata nei pazienti trattati con latanoprost + netarsudil è stata riscontrata per la prima volta dopo 4 settimane di somministrazione giornaliera. Questa reazione non ha comportato alcuna apparente alterazione funzionale visiva nei pazienti. La maggior parte dei casi di cornea verticillata si è risolta con la sospensione del trattamento. L’incidenza della cornea verticillata è stata più elevata in alcune sottopopolazioni: anziani (≥ 65 anni) rispetto a non anziani (18,8 contro 11,5%); maschi rispetto a femmine (18,8 contro 13,0%) e nei bianchi rispetto ad altre razze (21,7 contro 2,5%). Pigmentazione dell’iride Roclanda contiene latanoprost, che è un analogo della prostaglandina F2a. La maggior parte delle reazioni avverse associate a latanoprost è di natura oculare. In uno studio della durata di 5 anni sulla sicurezza di latanoprost, la pigmentazione dell’iride è stata riscontrata nel 33% dei pazienti (vedere paragrafo 4.4). Questa alterazione del colore dell’occhio è stata osservata in prevalenza in pazienti con iridi di colore misto, ossia blu-marrone, grigio-marrone, giallo-marrone e verde-marrone. Negli studi su latanoprost, l’insorgenza dell’alterazione è stata generalmente osservata nei primi 8 mesi di trattamento, raramente durante il secondo o terzo anno e mai dopo il quarto anno di trattamento. La frequenza di progressione della pigmentazione dell’iride si riduce nel tempo ed è stabile per cinque anni. L’effetto dell’aumentata pigmentazione dell’iride oltre i cinque anni non è stato valutato. Nella maggior parte dei casi l’alterazione del colore dell’iride è lieve e spesso non osservabile clinicamente. L’incidenza in pazienti con iridi di colore misto oscilla tra il 7 e l’85% e l’incidenza maggiore si osserva nelle iridi di colore giallo-marrone. L’alterazione non è stata osservata in pazienti con occhi di colore blu omogeneo ed è stata riscontrata solo raramente in pazienti con occhi di colore grigio, verde o marrone omogeneo. L’alterazione del colore è dovuta a un aumento del contenuto di melanina nei melanociti dello stroma dell’iride e non a un aumento del numero di melanociti. Di solito la pigmentazione marrone attorno alla pupilla si diffonde concentricamente verso la zona periferica dell’occhio interessato, ma può imbrunire anche tutta l’iride o settori dell’iride. Dopo la sospensione del trattamento non è stata osservata un’ulteriore pigmentazione marrone dell’iride. Negli studi clinici condotti finora, questo effetto non si è associato ad alcun sintomo o alterazione patologica. Nevi ed efelidi dell’iride non sono stati influenzati dal trattamento. Gli studi clinici non hanno evidenziato un accumulo di pigmento nella rete trabecolare o in altre zone della camera anteriore. Altre popolazioni speciali Anziani Ad eccezione della cornea verticillata (vedere sopra), non è stata osservata alcuna differenza nel profilo di sicurezza di latanoprost + netarsudil tra soggetti di età < 65 o ≥ 65 anni. Segnalazione delle reazioni avverse sospette La segnalazione delle reazioni avverse sospette che si verificano dopo l’autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione all´indirizzo: Agenzia Italiana del Farmaco. Sito web: https://www.aifa.gov.it/ content/segnalazioni-reazioni-avverse. 4.9 Sovradosaggio L’esposizione sistemica al componente netarsudil dell’associazione latanoprost + netarsudil in seguito a somministrazione oftalmica topica si è dimostrata trascurabile. Eccetto irritazione oculare e iperemia della congiuntiva, non sono noti altri effetti indesiderati oculari correlati al sovradosaggio di latanoprost. In caso di ingestione accidentale di latanoprost, possono essere utili le seguenti informazioni: un flacone contiene 125 microgrammi di latanoprost. Più del 90% è metabolizzato durante il primo passaggio nel fegato. L’infusione endovenosa di 3 microgrammi/kg in volontari sani non ha indotto sintomi, ma una dose di 5,5-10 microgrammi/kg ha causato nausea, dolore addominale, capogiro, stanchezza, vampate di calore e sudorazione. Latanoprost è stato somministrato per infusione endovenosa nella scimmia a dosi fino a 500 microgrammi/kg senza causare effetti importanti sul sistema cardiovascolare. Somministrazioni endovenose di latanoprost nella scimmia sono state correlate a broncocostrizione transitoria. Tuttavia, se applicato per via topica nell’occhio ad una dose sette volte superiore a quella usata in clinica, latanoprost non ha indotto broncocostrizione in pazienti affetti da asma bronchiale moderata. In caso di sovradosaggio topico di latanoprost + netarsudil, lo(gli) occhio(i) può(possono) essere lavato(i) con acqua corrente. Il trattamento del sovradosaggio include una terapia di supporto e sintomatica. 5. PROPRIETÀ FARMACOLOGICHE 5.1 Proprietà farmacodinamiche Categoria farmacoterapeutica: oftalmologici, preparati antiglaucoma e miotici, codice ATC: S01EE51 Meccanismo d’azione Roclanda contiene due principi attivi: latanoprost e netarsudil. Questi due componenti abbassano la PIO aumentando il deflusso dell’umore acqueo. Sebbene sia latanoprost sia netarsudil riducano la PIO aumentando il deflusso dell’umore acqueo, i rispettivi meccanismi d’azione sono diversi. Gli studi sugli animali e sull’uomo suggeriscono che il principale meccanismo d’azione di netarsudil, un inibitore della Rho-chinasi, è l’aumento del deflusso trabecolare. Questi studi indicano inoltre che netarsudil riduce la PIO abbassando la pressione venosa episclerale. Gli studi sugli animali e sull’uomo indicano che il principale meccanismo d’azione di latanoprost, un analogo della prostaglandina F2a, è l’aumento del deflusso uveosclerale, sebbene nell’uomo sia stato riferito un certo aumento della facilità di deflusso (riduzione della resistenza al deflusso). Efficacia e sicurezza clinica Roclanda è stato valutato in 3 studi clinici di fase 3 randomizzati, in doppio cieco, multicentrici, condotti su 1686 pazienti con glaucoma ad angolo aperto e ipertensione oculare. Gli studi 301 e 302 hanno arruolato soggetti con PIO < 36 mmHg e confrontato l’effetto di riduzione della PIO dell’associazione latanoprost + netarsudil somministrata una volta al giorno con la somministrazione dei singoli componenti, netarsudil 0,02% una volta al giorno e latanoprost 0,005% una volta al giorno. Il trattamento è durato 12 mesi nello studio 301 e 3 mesi nello studio 302. L’età mediana dei partecipanti agli studi era di 66 anni (intervallo compreso tra 18 e 99 anni). Lo Studio 303 ha valutato l’efficacia ipotensiva sull’occhio di latanoprost + netarsudil rispetto a Ganfort® (bimatoprost 0,03%/timololo 0,5%). La durata del trattamento era di 6 mesi. Gli studi 301 e 302 erano progettati per dimostrare la superiorità dell’associazione latanoprost + netarsudil somministrata una volta al giorno la sera rispetto ai singoli componenti netarsudil 0,02% una volta al giorno e latanoprost 0,005% una volta al giorno. L’indicatore primario dell’esito di efficacia era la PIO media (minimi quadrati, LS) in ciascuno dei 9 punti temporali misurati alle ore 08:00, 10:00 e 16:00 al giorno 15, al giorno 43 e al giorno 90. L’effetto di riduzione della media della PIO dell’associazione latanoprost + netarsudil è stato di 1-3 mmHg superiore rispetto alla monoterapia sia con netarsudil 0,02% sia con latanoprost 0,005% nel corso di 3 mesi (figure 1 e 2). Nello studio 301 le riduzioni della PIO si sono mantenute, dimostrando la superiorità statistica di latanoprost + netarsudil nei 12 mesi del periodo di trattamento. In tutti i casi, le differenze nella PIO media (LS) sono risultate clinicamente rilevanti e statisticamente significative (p < 0,0001) fino al mese 3. Circa il 30% dei soggetti inclusi negli studi di fase 3 aveva una PIO al basale ≥ 27 mmHg (132, 136 e 143 nei gruppi trattati rispettivamente con latanoprost + netarsudil, latanoprost e netarsudil). In tali soggetti, l’associazione latanoprost + netarsudil ha evidenziato, in tutti i punti temporali, un’efficacia di diminuzione della PIO superiore in misura statisticamente
Classificazione per sistemi e organi Frequenza
Infezioni ed infestazioni Raro
Disturbi del sistema immunitarioNon comune
Patologie del sistema nervosoNon comune
Patologie dell’occhio Molto comune
Comune
Non comune
Reazioni avverse
cheratite erpetica2
ipersensibilità vomito
cefalea, contrazioni muscolari involontarie, capogiro, difetto del campo visivo3
iperemia congiuntivale1, cornea verticillata1, dolore in sede di instillazione, iperpigmentazione dell’iride2, cambiamenti delle ciglia o della peluria delle palpebre (allungamento, ispessimento, pigmentazione e aumento del numero delle ciglia)2
emorragia della congiuntiva, visione offuscata, lacrimazione aumentata, eritema della palpebra, prurito oculare, irritazione oculare, acuità visiva ridotta, edema delle palpebre, cheratite puntata, disturbo corneale, edema congiuntivale, congiuntivite allergica, dolore oculare, occhio secco, sensazione di corpo estraneo negli occhi, croste del margine palpebrale, blefarite, eritema in sede di instillazione, fastidio in sede di instillazione, colorazione vitale della cornea presente
prurito della palpebra, disturbo della congiuntiva, opacità corneale, secrezione oculare, depositi corneali, congiuntivite, dacriostenosi acquisita, infiammazione oculare, parestesia dell’occhio, follicoli della congiuntiva, tumefazione degli occhi, disfunzione delle ghiandole di Meibomio, pigmentazione corneale, diplopia, congiuntivite non infettiva, sensibilità oculare anormale, cheratite, disturbo della rifrazione, flare della camera anteriore, irritazione della congiuntiva, pressione intraoculare aumentata, eruzione cutanea della palpebra, secchezza cutanea della palpebra, crescita delle ciglia, affezione lacrimale, irite, compromissione della visione, distrofia della cornea, secchezza in sede di instillazione, prurito in sede di instillazione, reazione in sede di instillazione, complicazione oculare associata a dispositivo, stanchezza, parestesia in sede di instillazione, edema maculare, incluso edema maculare cistoide2, uveite2, iperemia oculare, retinopatia diabetica3, allergia oculare3, fastidio oculare, disturbo palpebrale3, ectropion3, opacità lenticolari3, astenopia3, iperemia episclerale3, visione con alone3, infiammazione della camera anteriore3, cecità3, congiuntivocalasia, eczema delle palpebre3, glaucoma3, aderenze dell’iride3, iride bombé3, ipertensione dell’occhio3, irritazione in sede di instillazione3, occhi vitrei3, edema in sede di instillazione3, colorazione della congiuntiva3, rapporto fovea/disco del nervo ottico aumentato3, madarosi3 pigmentazione delle palpebre, disturbi dell’occhio, emorragia retinica, fotofobia
Classificazione per sistemi e organi
Frequenza
Raro
Patologie cardiache
Patologie respiratorie, toraciche e mediastiniche
Patologie della cute e del tessuto sottocutaneo
Patologie del sistema muscoloscheletrico e del tessuto connettivo
Patologie generali e condizioni relative alla sede di somministrazione
Traumatismi, intossicazioni e complicazioni da procedura
Reazioni avverse
edema corneale2, erosione della cornea2, edema periorbitale2, trichiasi2, distichiasi2, cisti dell’iride2, reazione cutanea localizzata sulle palpebre2, scurimento della pelle delle palpebre2, pseudopemfigoide della congiuntiva oculare2
Molto raro alterazioni periorbitali e palpebrali che provocano un approfondimento del solco palpebrale2
Non comune
angina2, palpitazioni2
Molto raro angina instabile2
Non comune epistassi, congestione nasale, fastidio nasale3, rinalgia3 asma2, dispnea2
Raro esacerbazione di asma2
Comune
Non comune
dermatite da contatto
lichenificazione, cute secca, eritema, malattia della pelle, dermatite allergica3 petecchie, eczema
Raro prurito2
Non comune
Non comune
Non comune
1 Per ulteriori informazioni, vedere Descrizione di reazioni avverse selezionate
2 Ulteriore reazione avversa osservata con latanoprost in monoterapia
3 Ulteriore reazione avversa osservata con netarsudil in monoterapia
dolore alla mandibola/mascella, mialgia2, artralgia2, policondrite3, debolezza muscolare, sindrome di Sjögren
dolore toracico2
escoriazione3
significativa rispetto a ciascuno dei suoi componenti. In entrambi gli studi, il medicinale in associazione ha ridotto la PIO di ulteriori 1,7 mmHg, a un valore di 3,7 mmHg, rispetto a latanoprost da solo, e di ulteriori 3,4 mmHg, a un valore di 5,9 mmHg, rispetto a netarsudil da solo. Circa il 67% dei soggetti inclusi nei gruppi di trattamento con latanoprost + netarsudil degli studi di fase 3 era caucasico e il 30% nero o afroamericano. Oltre la metà aveva un’età ≥ 65 anni. Ad eccezione dell’incidenza della cornea verticillata (paragrafo 4.8), non sono state osservate altre differenze nel profilo di sicurezza tra razze o fasce di età. I tassi di completamento negli studi 301 e 302 erano inferiori nei gruppi trattati con latanoprost + netarsudil e con netarsudil rispetto al gruppo trattato con latanoprost. I tassi di sospensione dovuti a eventi avversi al mese 3 sono stati dell’8,7% per il gruppo trattato con latanoprost + netarsudil aggregato rispetto al 7,6% per il gruppo trattato con netarsudil aggregato e all’1,0% per il gruppo trattato con latanoprost aggregato. I tassi di sospensione dovuti a eventi avversi al mese 12 nello studio 301 sono stati del 19,7% per il gruppo trattato con latanoprost + netarsudil rispetto al 21,7% per il gruppo trattato con netarsudil e all’1,7% per il gruppo trattato con latanoprost. La maggior parte delle sospensioni era associata a eventi di natura oculare. L’evento avverso più frequentemente segnalato, associato alla sospensione nel gruppo trattato con latanoprost + netarsudil è stata l’iperemia della congiuntiva (7,6% al mese 12). Nella maggior parte dei casi gli eventi avversi riferiti con latanoprost + netarsudil erano di intensità lieve. Lo Studio 303 era uno studio prospettico in doppio cieco, randomizzato, multicentrico, con controllo attivo, a gruppi paralleli, della durata di 6 mesi, volto a valutare la sicurezza e l’efficacia ipotensiva sull’occhio di latanoprost + netarsudil rispetto a bimatoprost + timololo in 430 soggetti con pressione intraoculare elevata. I soggetti sono stati randomizzati a un regime di trattamento programmato a dose fissa con latanoprost + netarsudil (218 soggetti), una goccia una volta al giorno (QD) ogni sera in entrambi gli occhi (OU) o al trattamento di confronto bimatoprost + timololo (212 soggetti) una goccia QD ogni sera OU per circa 180 giorni dopo un periodo di washout. L’esito primario di efficacia era il confronto di latanoprost + netarsudil rispetto a bimatoprost + timololo per la IOP media in punti temporali specifici alla Settimana 2, Settimana 6 e al Mese 3. L’analisi primaria è stata eseguita sulla popolazione ITT con imputazione tramite metodo Monte Carlo basato su Catena di Markov (Markov Chain Monte Carlo, MCMC). Questa analisi ha dimostrato la non inferiorità clinica della soluzione oftalmica latanoprost + netarsudil rispetto a bimatoprost + timololo con dosaggio QD nella popolazione ITT entro il limite superiore dell’IC al 95% con una differenza (latanoprost + netarsudil - bimatoprost + timololo) ≤ 1,5 mmHg in tutti e 9 i punti temporali e ≤ 1,0 mmHg nella maggior parte (6 su 9) dei punti temporali dalla Settimana 2 fino al Mese 3, in conformità ai criteri di successo. La soglia per la non inferiorità clinica di latanoprost + netarsudil QD rispetto a bimatoprost + timololo QD (la differenza tra gruppi ≤ 1,5 mmHg) è stata dimostrata nella popolazione PP in 8 punti temporali su 9 (08:00, 10.00 e 16:00) alla Settimana 2, fino al Mese 3 utilizzando il metodo MCMC. Tuttavia, la non inferiorità clinica non è stata rispettata complessivamente, dal momento che al punto temporale 08:00 della Settimana 6, il limite superiore dell’IC al 95% era di 1,55. Complessivamente, c’è stata una riduzione media della IOP nel corso della giornata di circa 9,5 mmHg sia tra il gruppo latanoprost + netarsudil che tra il gruppo bimatoprost + timololo. Il tasso di sospensione complessivo dal trattamento dello studio dovuto a TEAE è stato dell’11,2%. Un numero superiore di soggetti nel gruppo di trattamento latanoprost + netarsudil QD ha sospeso il trattamento dello studio a causa di TEAE (20,2%) rispetto al gruppo bimatoprost + timololo QD (1,9%), e la maggior parte dei TEAE che hanno causato la sospensione erano TEAE oculari. In nessun gruppo di trattamento sono stati segnalati eventi avversi gravi associati al trattamento, e il profilo di sicurezza rimane coerente con il profilo noto per latanoprost + netarsudil e/o latanoprost o netarsudil come monoterapia. L’efficacia e la
Figura 1. PIO media (mmHg) per gruppo di trattamento e di erenza della PIO media tra i trattamenti dello studio 301
Roclanda Netarsudil LatanoprostGiorno 15 (08:00)
latanoprost + netarsudil vs netarsudil, IC 95%
latanoprost + netarsudil vs latanoprost, IC 95%
Giorno 15 (10:00)
(2,5-3,6)
(1,7-2,8)
Giorno 15 (16:00)
(2,4-3,6)
(2,0-3,2)
Giorno 43 (08:00)
Giorno 43 (10:00)
Giorno 43 (16:00)
(1,3-2,5)
Giorno 90 (08:00)
(1,7-2,8)
Giorno 90 (10:00)
(2,5-3,8)
(0,9-2,1)
Giorno 90 (16:00)
(0,7-1,9)
La PIO media (LS) in ciascuno dei punti temporali post-basali è stata calcolata utilizzando un’analisi della covarianza aggiustata per la PIO basale e basata sui dati osservati in tutti i soggetti randomizzati (238 nel gruppo latanoprost + netarsudil, 244 nel gruppo netarsudil, 236 nel gruppo latanoprost).
2. PIO media (mmHg) per gruppo di trattamento e di erenza della PIO media tra i trattamenti dello studio 302
Roclanda Netarsudil Latanoprost
Basale
15 (08:00)
latanoprost + netarsudil vs netarsudil, IC 95%
latanoprost + netarsudil vs latanoprost, IC 95%
15 (10:00)
15 (16:00)
43 (08:00)
43 (10:00)
43 (16:00)
90 (08:00)
90 (10:00)
90 (16:00)
La PIO media (LS) in ciascuno dei punti temporali
è
calcolata utilizzando un’analisi della covarianza aggiustata per la PIO basale e basata sui dati osservati in tutti i soggetti randomizzati (245 nel gruppo latanoprost + netarsudil, 255 nel gruppo netarsudil, 250 nel gruppo latanoprost).
sicurezza di latanoprost + netarsudil in soggetti con epitelio corneale compromesso o patologie oculari coesistenti, ad es. la sindrome pseudoesfoliativa e quella da dispersione del pigmento, non sono state stabilite. Popolazione pediatrica L’Agenzia europea dei medicinali ha previsto l’esonero dall’obbligo di presentare i risultati degli studi con Roclanda in tutti i sottogruppi della popolazione pediatrica per la riduzione della pressione intraoculare elevata in pazienti con glaucoma ad angolo aperto o ipertensione oculare (vedere paragrafo 4.2 per informazioni sull’uso pediatrico). 5.2 Proprietà farmacocinetiche Assorbimento Le esposizioni sistemiche a netarsudil e al suo metabolita attivo, AR-13503, sono state valutate in 18 soggetti sani dopo somministrazione oftalmica topica di netarsudil 200 microgrammi/mL una volta al giorno (una goccia bilateralmente al mattino) per 8 giorni. Non erano riscontrabili concentrazioni plasmatiche quantificabili di netarsudil [limite inferiore di quantificazione (LLOQ) 0,100 ng/mL] dopo la somministrazione della dose al giorno 1 e al giorno 8. È stata osservata soltanto una concentrazione plasmatica di 0,11 ng/mL del metabolita attivo per un soggetto al giorno 8, 8 ore dopo la somministrazione della dose. Latanoprost (peso molecolare 432,58) è un profarmaco esterificato con un gruppo isopropile, di per sé inattivo, che diventa biologicamente attivo dopo reazione di idrolisi nella forma acida. Il profarmaco è ben assorbito attraverso la cornea e tutto il principio attivo che entra nell’umore acqueo viene idrolizzato durante il passaggio attraverso la cornea. Gli studi sull’uomo indicano che il picco di concentrazione nell’umore acqueo viene raggiunto circa due ore dopo la somministrazione per via topica. Dopo instillazione locale nella scimmia, latanoprost si distribuisce soprattutto nel segmento anteriore, nella congiuntiva e nelle palpebre. Solo piccole quantità di latanoprost raggiungono il segmento posteriore. Biotrasformazione Dopo somministrazione oftalmica topica, netarsudil viene metabolizzato dalle esterasi nell’occhio in un metabolita attivo, AR-13503. La forma acida di latanoprost non viene praticamente metabolizzata nell’occhio. Il metabolismo principale avviene nel fegato. Nell’uomo l’emivita plasmatica è di 17 minuti. Gli studi sugli animali hanno dimostrato che i metaboliti principali (1,2-dinor e 1,2,3,4-tetranor) non esercitano alcuna o solo una debole attività biologica e sono escreti soprattutto nell’urina. 5.3 Dati preclinici di sicurezza Netarsudil I dati preclinici relativi a netarsudil non rivelano rischi particolari per l’uomo sulla base di studi convenzionali di sicurezza farmacologica, tossicità a dosi ripetute, genotossicità e tossicità dello sviluppo. Negli studi preclinici sono stati osservati effetti soltanto a esposizioni considerate sufficientemente superiori alla massima esposizione nell’uomo, il che indica una scarsa rilevanza clinica. La somministrazione endovenosa di netarsudil a ratti e conigli in gravidanza durante l’organogenesi non ha prodotto effetti embriofetali avversi a esposizioni sistemiche clinicamente rilevanti. Nei ratti in gravidanza, la dose di 0,1 mg/ kg/die non ha mostrato effetti avversi materni o embriofetali, mentre un dosaggio pari o superiore a 0,3 mg/kg/die ha mostrato un aumento della perdita post-impianto e una riduzione della vitalità fetale. Nei conigli in gravidanza, la dose di 3 mg/kg/die non ha mostrato effetti materni o embriofetali, mentre la dose di 5 mg/kg/die ha mostrato un aumento della perdita post-impianto e una riduzione ponderale del feto. Non sono stati condotti studi a lungo termine su animali per valutare il potenziale cancerogeno di netarsudil. Netarsudil non è risultato mutageno in un saggio di mutazione batterica, in un saggio sul linfoma murino o in un test del micronucleo nel ratto. È stato scoperto che netarsudil e il suo metabolita attivo AR-13503 possiedono un potenziale fototossico in un saggio in vitro 3T3 NRU-PT modificato, in cui la lunghezza d’onda è stata estesa per includere la luce UVB. Latanoprost La tossicità oculare di latanoprost, al pari di quella sistemica, è stata valutata in diverse specie animali. In genere latanoprost è ben tollerato, con un margine di sicurezza tra dose clinica oculare e tossicità sistemica di almeno 1000 volte. Dosi elevate di latanoprost, pari a circa 100 volte la dose clinica/kg di peso corporeo, somministrate a scimmie non anestetizzate per via endovenosa hanno dimostrato un aumento della frequenza respiratoria probabilmente indotta da broncocostrizione di breve durata. Negli studi sugli animali latanoprost non ha evidenziato proprietà sensibilizzanti. Non sono stati osservati effetti tossici nell’occhio con dosi fino a 100 microgrammi/occhio/die nel coniglio o nella scimmia (la dose clinica è di circa 1,5 microgrammi/occhio/die). Nella scimmia, comunque, latanoprost ha dimostrato di indurre un aumento della pigmentazione dell’iride. La pigmentazione sembra essere determinata da una stimolazione della produzione di melanina nei melanociti dell’iride; non sono state osservate alterazioni di tipo proliferativo. L’alterazione del colore dell’iride può essere permanente. Studi di tossicità oculare cronica hanno inoltre dimostrato che la somministrazione di 6 microgrammi/occhio/die di latanoprost può indurre un allargamento della rima palpebrale. Questo effetto è reversibile e si verifica in seguito alla somministrazione di dosi superiori alla dose clinica. Tale effetto non è stato riscontrato nell’uomo. Latanoprost è risultato negativo nei test di mutazione inversa nei batteri, di mutazione genica nel linfoma murino e nel test del micronucleo nel topo. Aberrazioni cromosomiche sono state osservate in vitro su linfociti umani. Effetti simili sono stati osservati con la prostaglandina F2a, una prostaglandina di origine naturale; ciò sta ad indicare che si tratta di un effetto di classe. Ulteriori studi di mutagenesi in vitro/in vivo nel ratto, su sintesi di DNA non programmata, hanno dato risultati negativi e indicano che latanoprost non ha proprietà mutagene. Studi di carcinogenesi sul topo e sul ratto sono risultati negativi. Gli studi sugli animali hanno dimostrato che latanoprost non ha effetto sulla fertilità maschile o femminile. Negli studi di tossicità embrionale sul ratto non è stata riscontrata tossicità embrionale con dosi di latanoprost (5, 50 e 250 microgrammi/kg/die) per via endovenosa. Comunque latanoprost induce effetti letali per l’embrione nel coniglio alla dose di 5 microgrammi/kg/die e a dosi superiori. La dose di 5 microgrammi/kg/die (circa 100 volte la dose clinica) ha causato tossicità embrionale e fetale significativa, caratterizzata da aumentata incidenza di riassorbimento ritardato e aborto e da peso fetale ridotto. Non è stato rilevato alcun potenziale teratogeno.
6. INFORMAZIONI FARMACEUTICHE 6.1 Elenco degli eccipienti Benzalconio cloruro Mannitolo Acido borico Sodio idrossido (per la regolazione del pH) Acqua per preparazioni iniettabili 6.2 Incompatibilità Non pertinente. 6.3 Periodo di validità 3 anni. Flacone aperto: 4 settimane dopo la prima apertura del flacone. Non conservare a temperatura superiore a 25°C. 6.4 Precauzioni particolari per la conservazione Conservare in frigorifero (2°C – 8°C). Conservare nella confezione originale per proteggere il medicinale dalla luce. Per le condizioni di conservazione dopo la prima apertura vedere paragrafo 6.3. 6.5 Natura e contenuto del contenitore Roclanda viene fornito in flaconi di polietilene trasparente a bassa densità (2,5 mL di contenuto in un contenitore da 4 mL) e punte in polipropilene bianco opaco a bassa densità con tappi a vite in polipropilene bianco opaco e sigilli anti-manomissione. Scatola contenente 1 o 3 flaconi. È possibile che non tutte le confezioni siano commercializzate. 6.6 Precauzioni particolari per lo smaltimento Il medicinale non utilizzato e i rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla normativa locale vigente.
7. TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO Santen Oy Niittyhaankatu 20 33720 Tampere Finlandia
8. NUMERO(I) DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO EU/1/20/1502/001 EU/1/20/1502/002
9. DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL’AUTORIZZAZIONE Data della prima autorizzazione: 7 gennaio 2021
10. DATA DI REVISIONE DEL TESTO 06/2022
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea dei medicinali, http://www. ema.europa.eu.
CLASSIFICAZIONE AI FINI DELLA FORNITURA, REGIME DI RIMBORSABILITÀ E PREZZO Roclanda “50 mcg/ml/200 mcg/ml - collirio, soluzione - uso oftalmico - flacone (HDPE)” 2,5 ml - 1 flacone (AIC n. 049317011/E) Classificazione ai fini della fornitura: Medicinale soggetto a ricetta medica ripetibile (RR) Regime di rimborsabilità: classe A Prezzo al pubblico (IVA inclusa): € 14,00
Depositato in AIFA in data 08/04/2024 - Codice AIFA: ROC-IT-240013
MEDICINALE NON IN COMMERCIO. MEDICINALE IN COMMERCIO DAL 12/04/2024

Roclanda®, la nuova 1 associazione fissa che agisce anche sul trabecolato: l’evoluzione nel trattamento del glaucoma* 1-3

riduce efficacemente la IOP agendo sul tessuto trabecolare disfunzionale 3-7
é una combinazione fissa contenente un inibitore del fattore ROCK 3 , un’innovazione nella gestione terapeutica del glaucoma 2
i meccanismi d’azione complementari di latanoprost e netarsudil sono in grado di aumentare il deflusso sia trabecolare che uveosclerale 3
è stato considerato ben tollerato 8 , senza eventi avversi seri correlati al trattamento 3,5
Roclanda®, una valida opzione di prima scelta 2 nel passaggio dalla monoterapia 3
Roclanda® è indicato per la riduzione della pressione intraoculare (IOP) elevata in pazienti adulti con glaucoma primario ad angolo aperto o ipertensione dell’occhio nei quali la monoterapia con una prostaglandina o netarsudil determini una riduzione della IOP insufficiente. 3
*Glaucoma primario ad angolo aperto
CLASSIFICAZIONE AI FINI DELLA FORNITURA, REGIME DI RIMBORSABILITÀ E PREZZO
Roclanda® “50 mcg/ml/200 mcg/ml - collirio, soluzione - uso oftalmicoflacone (HDPE)” 2,5 ml - 1 flacone (AIC n. 049317011/E)
Classificazione ai fini della fornitura: Medicinale soggetto a ricetta medica ripetibile (RR)
Regime di rimborsabilità: classe A
Prezzo al pubblico (IVA inclusa): € 14,00 medicinale sottoposto a monitoraggio addizionale
Bibliografia: 1. Gazzetta Ufficiale della Repubblica Italiana; Serie generale n.43 del 21/02/2024.Art.1. 2. Schehlein EM et al. Drugs 2019; 79:1031-1036. 3. Roclanda®. Riassunto delle Caratteristiche del Prodotto
4. Buffault J.J Clian Med 2022; 11:1001. 5. Stalmans l et al. Graefe’s Arch Clin Exp Ophthalmol 2023. https://doi.org/10.1007/s00417-023-06192-0. 6. Al-Humimat G et al. J Experiment Pharmacol 2021; 13:197-212. 7. Moshirfar M et al. Med Hypothesis Discov Innov Ophthalmol 2018; 7(3): 101-111. 8. Roclanda.European Public Assessment Report (EPAR). EMA/ CHMP/637805/November 2020
Codice AIFA: ROC-IT-240013
Pubblicità rivolta ai medici - Vietata l’esposizione al pubblico. Depositato presso AIFA in data 08/04/2024
MEDICINALE NON IN COMMERCIO. MEDICINALE IN COMMERCIO DAL 12/04/2024
