Hepatitis Viral: unidos en la lucha global para la erradicación de las infecciones por Hepatitis B y C
Resistencia antimicrobial alarmante amenaza a la salud pública y un llamado a la reflexión para un futuro saludable
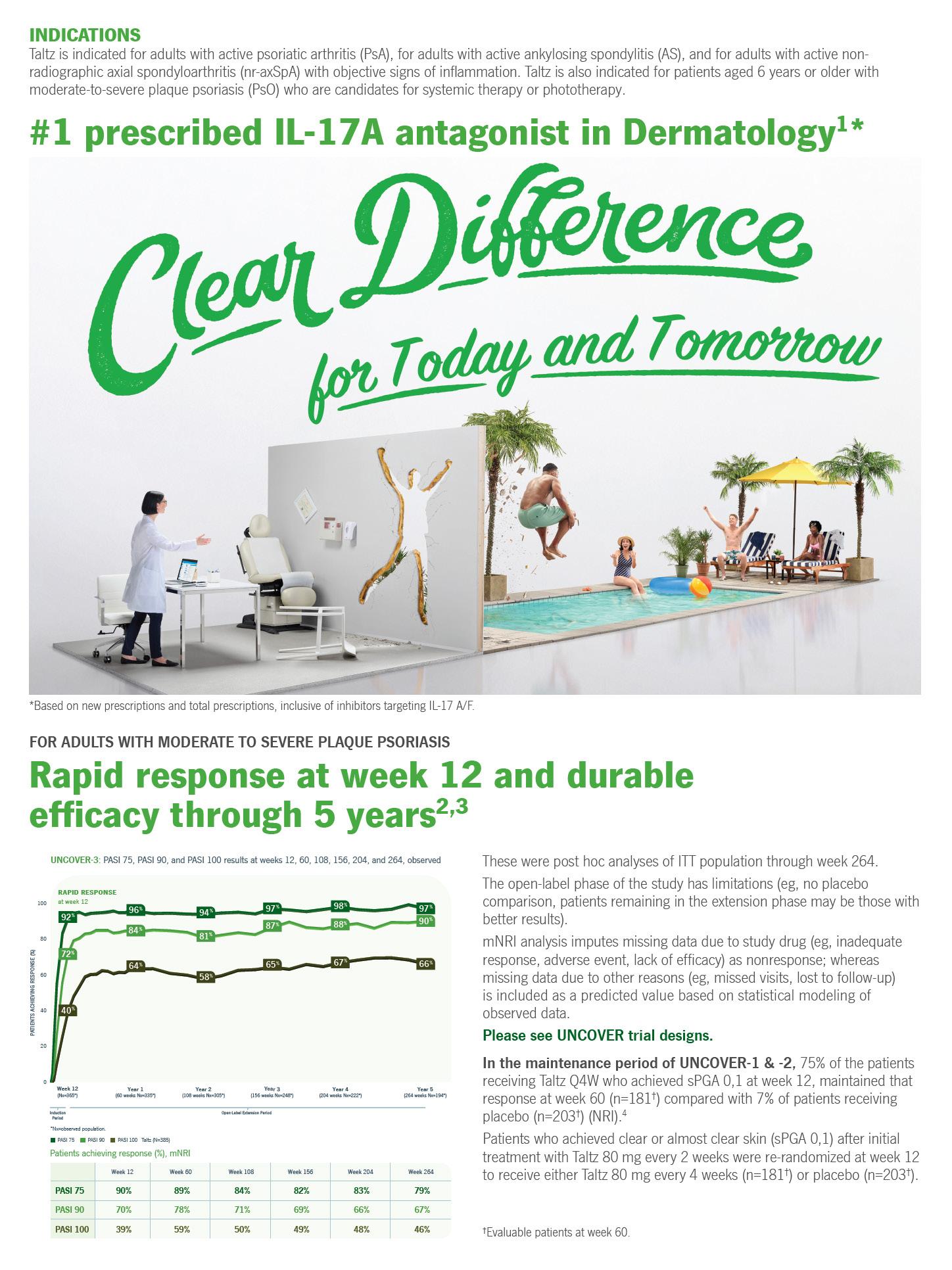
El rol del médico primario en la promoción y manejo de la salud de la piel
Manifestaciones neuropsiquiátricas del paciente con enfermedad tiroidea
La prueba de vih: Puerta de entrada hacia el tratamiento o la prevención
Cuidado preventivo para pacientes con enfermedad inflamatoria de intestino
Notas sobre el inicio y desarrollo de la medicina de familia como especialidad
NIVEL DE CONOCIMIENTO EN MUJERES EMBARAZADAS ANTE LA DIABETES GESTACIONAL EN SU PRIMER Y SEGUNDO TRIMESTRE
Dra. Katherine Soto-Moreno, MD

Especialista en Cardiología y Medicina Interna
ABIM Board Certified en Medicina Interna y Enfermedades Cardiovasculares
C.E.O. Cardiowest Clínica Cardiovascular en Mayagüez
@RevistaMSP
12 20 24 34 34 44 56

2 Revista Puertorriqueña de Medicina y Salud Pública



Revista Puertorriqueña de Medicina y Salud Pública 3


4 Revista Puertorriqueña de Medicina y Salud Pública


Revista Puertorriqueña de Medicina y Salud Pública 5
CONTENIDO
HEPATITIS VIRAL:

UNIDOS EN LA LUCHA GLOBAL PARA LA ERRADICACIÓN DE LAS INFECCIONES POR HEPATITIS B Y C
NIVEL DE CONOCIMIENTO EN MUJERES EMBARAZADAS ANTE LA DIABETES GESTACIONAL EN SU PRIMER Y SEGUNDO TRIMESTRE
RESISTENCIA ANTIMICROBIAL ALARMANTE AMENAZA A LA SALUD PÚBLICA Y UN LLAMADO A LA REFLEXIÓN PARA UN FUTURO SALUDABLE
EL ROL DEL MÉDICO PRIMARIO EN LA PROMOCIÓN Y MANEJO DE LA SALUD DE LA PIEL
MANIFESTACIONES NEUROPSIQUIÁTRICAS DEL PACIENTE CON ENFERMEDAD TIROIDEA
LA PRUEBA DE VIH: PUERTA DE ENTRADA HACIA EL TRATAMIENTO O LA PREVENCIÓN
CUIDADO PREVENTIVO PARA PACIENTES CON ENFERMEDAD INFLAMATORIA DE INTESTINO
NOTAS SOBRE EL INICIO Y DESARROLLO DE LA MEDICINA DE FAMILIA COMO ESPECIALIDAD
EDITOR FUNDADOR Juan Carlos Orengo Valverde, MD, MPH, PhD EDITOR Alberto Santiago Cornier, MD, PhD CONSEJO ASESOR Oscar Soto Raíces, MD, Ahmed Morales, MD, FACP, FACG, FASGE, AGAF, Lcda. Wanda González fisióloga del ejercicio PRINCIPAL OFICIAL EJECUTIVO Pedro Carlos Lugo Hernández III, P.A.C. PRESIDENTA Y FUNDADORA Glorybelle Hernández Figueroa, MBA
VICEPRESIDENTA Y FUNDADORA Laila Paloma Lugo, MBA CONTABILIDAD Julio Soto ADMINISTRACIÓN Marta Ivelisse Vélez Ramos, MBA, MARKETING Y SERVICIOS 360 Darlene Rodríguez, Yasmin Morell, Belinda Burgos PERIODISTAS Mayra Acevedo, Luis Penchi, Limarys Suárez DIRECCIÓN GRÁFICA Natalia Zoé Rivera Torres ARTISTA GRÁFICO Jhorman González
DIRECTOR AUDIOVISUAL Christopher Soto REALIZADORA AUDIOVISIAL Salomé Mateus, Duban Valencia FOTOS Revista Medicina y Salud Pública DIRECCIÓN GENERAL / FUNDADOR Carlos Alexis Lugo Marrero DISTRIBUCIÓN OFICINAS Y TORRES MÉDICAS Editorial Mundo
ENVÍO DE REVISTAS Y DISTRIBUCIÓN A GRUPOS MÉDICOS Servicio de correo postal/Comunicación Inteligente Para ventas y otros servicios pueden comunicarse al 787.848.3333, msp@editorialmundo.com o www.medicinaysaludpublica.com
Revista Puertorriqueña de Medicina y Salud Pública ISSN 1937-8521
COMITÉ EDITORIAL CIENTÍFICO

COMITÉ EDITORIAL Olga Rodríguez, MD - Decana Escuela de Medicina de Ponce (Puerto Rico), Vivian Green, LND, MS, PhD, Sub editora y fundadora (Puerto Rico), José Cordero, MD, MPH - Exdecano Escuela Graduada Salud Pública Recinto de Ciencias Médicas UPR (Puerto Rico), Ángeles Rodríguez, MD, MPH (Puerto Rico), Simón Carlo, MD (Puerto Rico), Bárbara Rosado, MD (Puerto Rico), Idhaliz Flores PhD (Puerto Rico), Jesús Cruz-Correa, MD, FACOG (Puerto Rico), Rafael Bredy, MD, LicMTo, MBE, MS (Puerto Rico), David Caseida, MD, FACOG, (Puerto Rico), José Capriles, MD, MHSA (Puerto Rico) Joaquín Laboy, MD, FACOG (Puerto Rico), Luis Adrian Rivera Pomales, MD, PEMBA, MPH, CMQ (Puerto Rico), Juan Fernández, MS, PhD (Puerto Rico), Nuria Sebate, MD (Puerto Rico), Pedro Amador, MD, MPH (Puerto Rico), Nydia Cappas, PsyD (Puerto Rico), Luis Franco, MD (Puerto Rico), Federico Montealegre, DVM, PhD, Msc (Puerto Rico), Nydia Ortiz, PsyD (Puerto Rico), José Pons, PhD, FPPR (Puerto Rico), Esdrás Vélez, JD, MPH (Puerto Rico), Diego Zavala, MSc, PhD, (Puerto Rico), Ana Torres-Martín, MD (Puerto Rico), Julio Cádiz, MD, MPH (Puerto Rico), Rafael Gómez-Cuevas (Colombia), José Javier Orengo, PhD(c) (España), Cesar A. Del Rey, MD (Panamá), Pedro Serrano, MD, PhD (España), Luis Serra-Majem, MD, PhD (España), José Ramón Calvo, MD, PhD (España).
Síguenos en www.medicinaysaludpublica.com, www.facebook.com/revistamsp, en Twitter @revistamsp, en LinkedIn como Revista Puertorriqueña de Medicina y Salud Pública. Las normas editoriales de la Revista Puertorriqueña de Medicina y Salud Pública para la publicación de artículos originales y cartas al editor pueden ser accesadas en la página web: www.medicinaysaludpublica.com, y solicitadas a través de msp@editorialmundo.com.
6 Revista Puertorriqueña de Medicina y Salud Pública
8 34 24 44 38 12 56
20
EDITORIAL
Directamente desde mi escritorio.
Avances en la erradicación de la hepatitis C desde la perspectiva de un profesional de enfermedades infecciosas.
La hepatitis C es un virus transmitido por sangre que afecta principalmente al hígado, lo que provoca inflamación y puede progresar a causar cirrosis, insuficiencia hepática y cáncer de hígado. Se estima que alrededor de 71 millones de personas en todo el mundo viven con hepatitis C crónica, y cerca de 2,2 millones en los EE. UU., de los cuales solo el 40 % conoce su diagnóstico, y alrededor de 400, 000 personas mueren cada año por enfermedades hepáticas relacionadas con la hepatitis C. Si no se trata, la condición representa una carga significativa a largo plazo en los gastos de atención médica con todas las comorbilidades asociadas. Todavía sigue siendo la causa número uno de trasplantes de hígado en todo el mundo.
El desarrollo de fármacos antivirales orales de acción directa (AAD/DAA) ha transformado el panorama para el tratamiento y posible erradicación de la Hepatitis C. Estos fármacos con actividad pan-genotípica son altamente efectivos para curar la infección, con tasas de curación cercanas al 95 % libres de inyectables y en la mayoría de los casos en sólo 8-12 semanas de terapia. Esta es una ventaja significativa en comparación con los tratamientos anteriores los cuales solían ser más prolongados, más costosos, menos efectivos y más difíciles de tolerar.
La Organización Mundial de la Salud (OMS) se ha fijado el objetivo de eliminar la Hepatitis C como una amenaza para la salud pública para el año 2030. Este objetivo es alcanzable gracias a la disponibilidad de estos nuevos fármacos AAD, que han hecho que el tratamiento sea más eficaz y accesible.
Para lograr este objetivo, será necesario emplear varias estrategias, incluyendo pero no limitado a esfuerzos concertados para aumentar la conciencia tanto en la comunidad médica como en la social, lo que incluye aumentar el acceso a las pruebas y el tratamiento de la hepatitis C en el punto de atención (POC), reducir el costo de los medicamentos y mejorar los esfuerzos de prevención para evitar o minimizar nuevas infecciones a través de medidas como prácticas seguras de inyección, educación y estrategias de reducción de daños para las personas que se inyectan drogas. Muchos países ya han avanzado hacia este objetivo, pero aún queda mucho trabajo por hacer.
En Puerto Rico nos encontramos en una encrucijada histórica para lograr esta meta. La isla es un escenario perfecto para controlar y erradicar la epidemia. En la actualidad, el acceso al tratamiento está ampliamente disponible, la población es en su mayoría cautiva y fácilmente identificable, incluidas las áreas rurales en comparación con muchos estados de la nación o partes del mundo. Los esfuerzos del Departamento de Salud para desarrollar una base de datos sólida de vigilancia en la incidencia y prevalencia finalmente están en marcha, lo que permitirá determinar e identificará las áreas de necesidad específicas para implementar programas sostenibles para realizar pruebas, tratar y vincular la atención de la población en riesgo.
En general, la perspectiva sobre la erradicación de la hepatitis C con nuevos fármacos (AAD/DAA) es positiva. La disponibilidad de estos medicamentos ha hecho posible curar la infección en casi todos los casos, y con las estrategias científicas específicas y la voluntad sociopolítica adecuada, es posible eliminar la hepatitis C como una amenaza para la salud pública durante generaciones por venir.
Dr. Jorge L. Santana; FIDSA

Profesor Medicina y Enfermedades Infecciosas
Departamento de Medicina de la Universidad de Puerto Rico
Director médico de la Unidad de Investigaciones Clínicas para el SIDA

Revista Puertorriqueña de Medicina y Salud Pública 7
NIVEL DE CONOCIMIENTO EN MUJERES EMBARAZADAS
ANTE LA DIABETES GESTACIONAL EN

SU PRIMER Y SEGUNDO TRIMESTRE
Nola Pender es una enfermera estadounidense que desarrolló un modelo de promoción de salud. La característica principal de este modelo de prevención es que enfatiza aquellas medidas preventivas que las personas deben tomar para evitar las enfermedades en general.


8 Revista Puertorriqueña de Medicina y Salud Pública
RN, BSN, MSN’s Universidad de Puerto Rico
Recinto de Ciencias Médicas
RN, BSN, MSN’s Universidad de Puerto Rico
Recinto de Ciencias Médicas
Ariam Ortiz Torres


RN, BSN, MSN’s Universidad de Puerto Rico

Recinto de Ciencias Médicas
Universidad de Puerto Rico


Recinto de Ciencias Médicas
Escuela de Enfermería
Departamento Graduado
RESUMEN

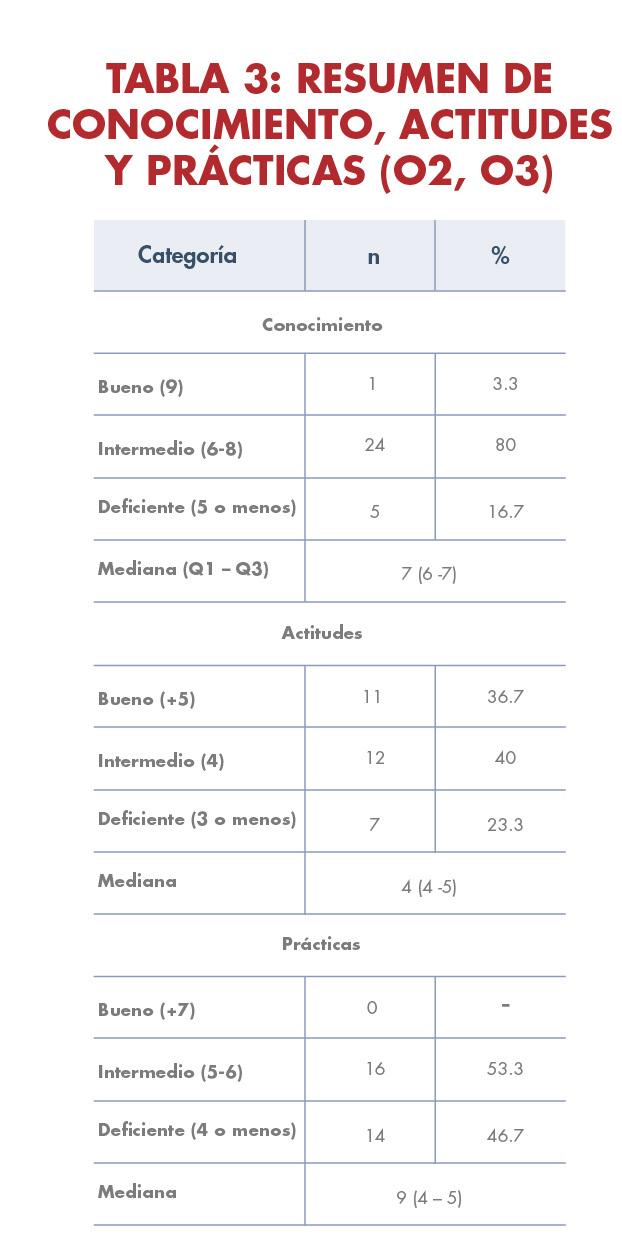
El propósito de este proyecto basado en evidencia es principalmente medir el conocimiento general, actitudes y prácticas de salud relacionadas con la diabetes gestacional en una muestra de 30 mujeres embarazadas. Para eso, se utilizó un enfoque cuantitativo descriptivo basado en el Modelo de Promoción de la Salud de Nola Pender para su análisis. La mayoría de las participantes tenían un nivel de conocimiento intermedio y se encontró una correlación positiva entre la edad y el conocimiento sobre la diabetes gestacional. Las actitudes de afrontamiento fueron favorables, sin embargo todas las gestantes presentaron prácticas de salud intermedias o deficientes. En conclusión, las participantes tienen un conocimiento general sobre la condición, pero no están plenamente conscientes de la importancia de cambiar su estilo de vida para prevenirla. Por lo que, es crucial abordar la atención de las mujeres embarazadas con diabetes gestacional a través de un equipo interdisciplinario en lugar de depender únicamente del obstetra-ginecólogo.
La colaboración de diferentes profesionales es fundamental para prevenir la enfermedad.

Revista Puertorriqueña de Medicina y Salud Pública 9
Lylibeth Cotto Perez
Valeria Colón López
Este estudio de investigación de tipo cuantitativo descriptivo se realizó en el Centro de Salud Integral de la Montaña en Naranjito, Puerto Rico, con la participación de 30 mujeres embarazadas en su primer o segundo trimestre. Se utilizó un cuestionario titulado “Conocimiento, Actitudes y Prácticas de Embarazadas sobre Diabetes Gestacional”, encontrado en la revisión de literatura. Los datos se recolectaron en la clínica prenatal, presentando el cuestionario de forma impresa o digital a través de dispositivos electrónicos. Los resultados destacan datos relevantes para futuros proyectos y actividades educativas dirigidas a poblaciones similares. Quedó evidenciado que las prácticas de salud están influenciadas por el conocimiento y las características biopsicosociales, se destaca la importancia de proporcionar información práctica y adaptada a la población para fomentar cambios positivos en actitudes y prácticas de salud.
INTRODUCCIÓN
De acuerdo con el Centro para el Control y la Prevención de Enfermedades (CDC) la diabetes gestacional (DG) es un tipo de diabetes que se diagnostica por primera vez durante el estado de embarazo de una mujer, que nunca había presentado esta patología. La DG se ha convertido en una de las complicaciones más comunes entre las mujeres embarazadas. Esto sucede ya que, las hormonas del embarazo inhiben la efectividad de la insulina, que es la hormona responsable de procesar los niveles de azúcar en sangre, y en efecto desarrolla resistencia a la insulina aumentando los niveles en sangre y afectando a la madre gestante con hiperglucemia. Los efectos que puede enfrentar la madre y su bebé en caso de no controlar los niveles de azúcar en sangre son macrosomía del bebé, cesárea al momento del parto, preeclampsia, hipoglucemia y mayor riesgo de desarrollar diabetes mellitus tipo II. (CDC, 2020) Por lo que, es necesario un manejo antenatal de la condición, de tal manera que se puedan prevenir diagnósticos relacionados a complicaciones materno fetales y en esto los profesionales de la salud tienen el rol principal en promover la educación de tal manera que se asegure un auto manejo efectivo de la condición (Aypar & Alus, 2021).
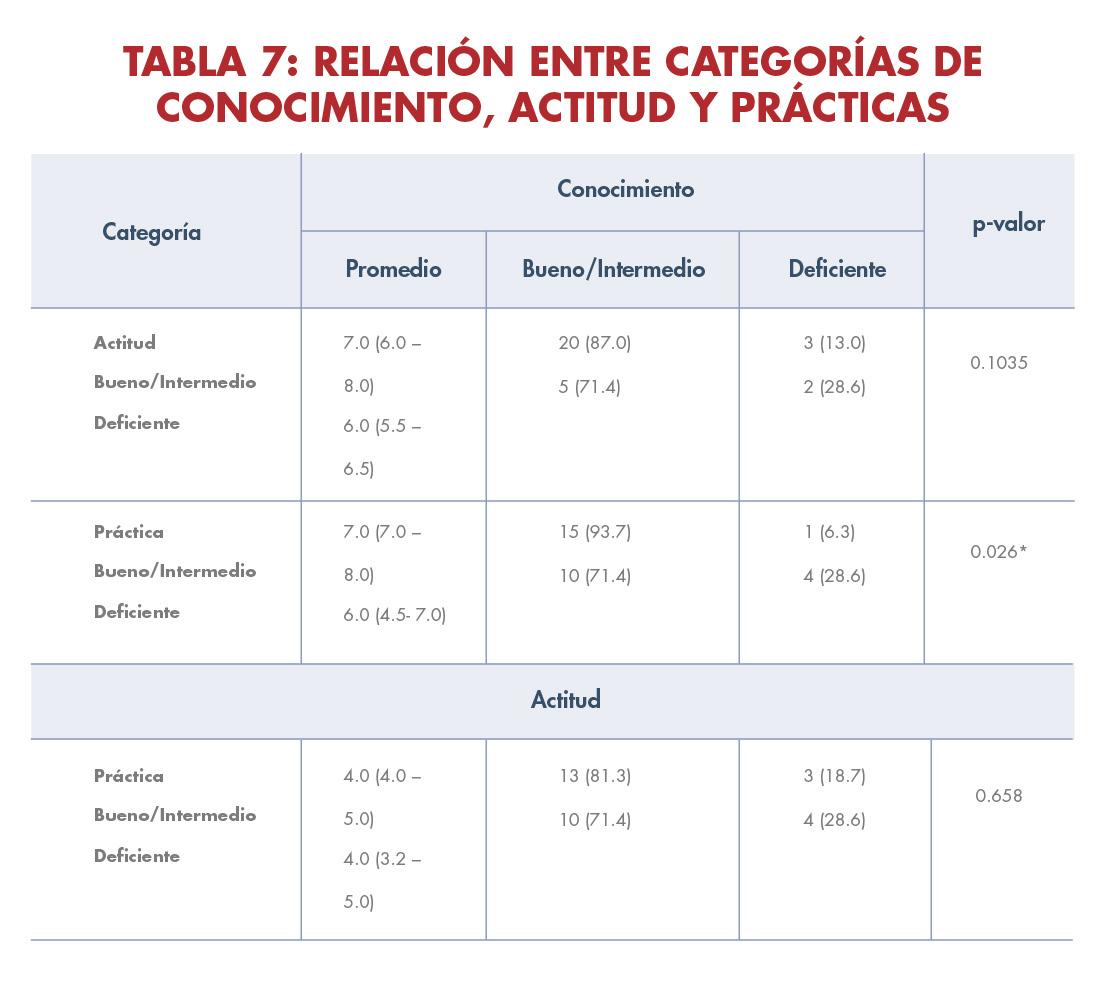
• Conocimiento y Actitudes: coeficiente Kendall tau = 0.341, p-valor = 0.0305

• Conocimiento y Prácticas: coeficiente Kendall tau = 0.446, p-valor = 0.0035
CORRELACIÓN ENTRE CONOCIMIENTO, ACTITUD Y PRÁCTICAS: Resaltado con los datos estadísticamente significativos antes mencionados, las prácticas de salud son definidas por el conocimiento. Ambos resultados para prácticas y actitudes se relacionan con el conocimiento en los niveles intermedio y deficiente.
CONCLUSIÓN:
Este estudio logró medir el nivel de conocimiento sobre la diabetes gestacional y establecer una relación entre el conocimiento, las prácticas y las actitudes de las participantes. Se encontró que la mayoría tenía un nivel de conocimiento intermedio y que el conocimiento aumentaba con la edad y las semanas de gestación. Sin embargo, las prácticas de salud fueron en su mayoría intermedias o deficientes. Se destaca la importancia de la educación y la promoción de un estilo de vida saludable durante el embarazo para prevenir la diabetes gestacional. El Modelo de Promoción de la Salud de Nola Pender utilizado en este estudio proporciona una base teórica para abordar el cambio de comportamiento y promover un embarazo saludable. Se sugiere continuar investigando y desarrollando políticas públicas que brinden educación y promoción de salud a mujeres embarazadas en relación a la diabetes gestacional. Además es importante que se aborde la enfermedad desde la literacia en salud en mujeres embarazadas con diabetes gestacional. Se
recomienda además, ampliar el estudio a diferentes centros de atención prenatal y entidades gubernamentales para obtener una perspectiva más completa y menos sesgada, y así contextualizar la importancia del diagnóstico de la diabetes gestacional en la vida de las mujeres embarazadas.
Es importante recalcar que el bienestar y el cuidado que una madre gestante recibe durante esta etapa deben ser holísticos, integrales y basados en información precisa para que puedan tomar decisiones informadas sobre sus prácticas de salud y, por lo tanto, adoptar actitudes más favorables. Y a su vez, exigir y recibir un cuidado centrado en sus propias necesidades y particularidades. De acuerdo a los resultados obtenidos en este proyecto de investigación estos se les presentarán al centro pero debido a que no existe un programa de educación regulado sobre la diabetes gestacional no se garantiza que a las pacientes se les continúe brindando un seguimiento luego de haber culminado el proyecto de investigación.
10 Revista Puertorriqueña de Medicina y Salud Pública
METODOLOGÍA/DISCUSIÓN:
REFERENCIAS
Aristizábal Hoyos, G. P., Blanco Borjas, D. M., Sánchez Ramos, A., & Ostiguín Meléndez, R. M. (2011). El modelo de promoción de la salud de Nola Pender: Una reflexión en torno a su comprensión. Enfermería universitaria, 8(4), 16-23.
Aypar Akbag, N. N., & Alus Tokat, M. (2021). Gestational diabetes mellitus knowledge of pregnant women and the factors affecting knowledge: A Cross Sectional Study.
Dokuz Eylül Üniversitesi Hemsirelik Fakültesi Elektronik Dergisi, 395–403.
https://doi.org/10.46483/ deuhfed.822421
Centers for Disease Control and Prevention. (20 de febrero de 2020). Diabetes
Gestacional y Embarazo. Centers for Disease Control and Prevention.https://www.cdc.gov/ pregnancy/ spanish/diabetes- gestational. html#print
Centro para el Control y la Prevención de Enfermedades. (2020). Diabetes gestacional y embarazo.https://www.cdc.gov/pregnancy/ spanish/diabetes-gestational.htm
Reyes Burgos, C., & Guillén Matos, M. (2015). Conocimiento, Actitudes y Prácticas de Embarazadas sobre Diabetes Gestacional, Hospital Maternidad Nuestra Señora de Altagracia, Universidad Nacional Pedro Henríquez Ureña, República Dominicana. Repositorio Institucional RI-UNPHU
https://repositorio.unphu.edu.do/
handle/123456789/666
Valle Lopez, M.I., Cusacani Calisaya, D. C. (2021). Conocimiento y Prácticas sobre Autocuidado en pacientes con Diabetes Gestacional Atendidas en un Hospital Estatal de Lima. Universidad Interamericana. (70).
https://alicia.concytec.gob.pe/vufind/ Record/UNID_
463afb0233079afca7010042e4f46da9

Revista Puertorriqueña de Medicina y Salud Pública 11
Palabras Clave: Hepatitis viral, Hepatitis B, Hepatitis C, Transmisión, Antivirales, Vacuna, Cura.

La belleza se compone de muchos factores, entre ellos la forma, la forma, el color y el contraste, que trabajan juntos para traer el deleite a los ojos y el refresco al alma. Obra maestra del arte de diseño

RESUMEN
Las hepatitis virales son un grupo de enfermedades infecciosas que afectan principalmente al hígado y representan un importante desafío para la salud pública a nivel mundial. Actualmente, la Hepatitis, es la causa principal de cáncer de hígado y una de las principales causas de trasplante de hígado. Tanto el virus de Hepatitis B (VHB) como C (VHC) se transmiten por
contacto con sangre, fluidos corporales infectados y relaciones sexuales sin protección; siendo la transmisión sexual la forma más común de contagio en los Estados Unidos. La transmisión puede ser perinatal u horizontal, cuando una persona no infectada entra en contacto con los fluidos de una persona infectada. La gran mayoría de las personas con Hepatitis B o C aguda no
suelen presentar síntomas. El manejo del VHB es complejo y depende de múltiples factores incluyendo la presencia o ausencia de inflamación del hígado, y/o cirrosis. Actualmente, contamos con varias alternativas de tratamiento para la Hepatitis B como lo son los antivirales y el Interferón. En el caso de la hepatitis C, gracias a tratamientos efectivos como lo son los antivirales de acción directa,
12 Revista Puertorriqueña de Medicina y Salud Pública
Dra. Heydee Fournier Especialista en Medicina Interna Infectóloga Universidad de Puerto Rico Recinto de Ciencias Médica
Dra. Ethyann Garcia Especialista en Medicina Interna Infectóloga Universidad de Puerto Rico Recinto de Ciencias Médica


HEPATITIS VIRAL: Unidos en la lucha global para la erradicación de las infecciones por Hepatitis B
y C

hoy día se puede hablar de cura en tan solo 8 a 16 semanas. Sin embargo, más del 80% de las personas con hepatitis carecen de servicios de prevención, detección y tratamiento afectando a 325 millones de personas en todo el mundo y siendo causante de 1.4 millones de muertes al año según datos provistos por la Organización Mundial de la Salud (OMS). En Puerto Rico no
estamos exentos de esta preocupante situación pues entre los años 2010 a 2015 se identificaron 11,334 personas con casos confirmados y sospechosos de diagnóstico de Hepatitis C, mientras que en el año 2022 se identificaron 3758 casos confirmados y sospechosos, lo que representa un 33% de lo identificado entre los años 2010 a 2015 de los cuales su mayoría, está las edades de
35 a 54 años. Con este artículo buscamos informar sobre la transmisión, prevención y el tratamiento para las hepatitis B y C, aclarar la realidad de la condición en nuestra isla e invitar al lector a ser parte de la historia.

Revista Puertorriqueña de Medicina y Salud Pública 13
INTRODUCCIÓN
Las hepatitis virales son un grupo de enfermedades infecciosas que afectan principalmente al hígado y representan un importante desafío para la salud pública a nivel mundial. Estas enfermedades son causadas por diferentes virus de la hepatitis, incluyendo los virus A, B, C, D y E. Actualmente, la Hepatitis es la causa principal de cáncer de hígado y una de las principales de trasplante de hígado. Los tipos A, B y C son los tipos más comunes en Estados Unidos, incluyendo Puerto Rico. Tanto el virus de Hepatitis B como C (VHB, VHC) se transmiten por contacto con sangre, fluidos corporales infectados y relaciones sexuales sin protección; siendo la transmisión sexual la forma más común de contagio en los Estados Unidos. La transmisión puede ser perinatal u horizontal, cuando una persona no infectada entra en contacto con los fluidos de una persona infectada. Por lo que también puede transmitirse a través de pinchazos, tatuajes, y perforaciones. Otros factores de riesgo incluyen compartir agujas, jeringuillas u objetos cortantes contaminados en establecimientos de salud, en el entorno comunitario o al consumir drogas inyectables. Es importante destacar que en el caso del VHB, es 50 a 100
veces más contagioso que el virus de inmunodeficiencia humana (VIH). Una vez el virus está en la sangre de la persona infectada, se replica en el hígado causando enfermedad aguda o crónica. La gran mayoría de las personas con Hepatitis B o C aguda no suelen presentar síntomas, pero cuando lo hacen, los síntomas más comunes son fiebre, dolor de cabeza, malestar general, anorexia, náusea, vómitos, mialgias, artralgias, diarreas, orina oscura, dolor abdominal e ictericia, que aparece pocos días después del comienzo de síntomas y/o un aumento en los niveles de enzimas hepáticas. El manejo de VHB es complejo y depende de múltiples factores incluyendo la presencia o ausencia de inflamación del hígado, y o cirrosis; la respuesta inmunológica a la infección, factores virológicos y factores de riesgo para progresión de la enfermedad. Actualmente contamos con varias alternativas de tratamiento, como lo son los antivirales y el Interferón. Los antivirales se utilizan para reducir la replicación del virus en el hígado, disminuir la inflamación y prevenir daño adicional al hígado. En el caso de la Hepatitis C, existen tratamientos efectivos como antivirales de acción directa que
hacen posible su cura en tan solo 8 a 16 semanas. Sin embargo, más del 80% de las personas con hepatitis carecen de servicios de prevención, detección y tratamiento. Por lo que el cernimiento de ambas condiciones es sumamente importante, y se hace a través de muestras de sangre y se recomienda a mayores de 18 años al menos una vez en la vida. En el caso de personas con conductas de alto riesgo, un cernimiento más seguido es recomendado. En cuanto a la prevención, la vacuna contra el VHB es una herramienta importante para prevenir la infección. Esta contiene partículas virales inactivadas o fragmentos del virus que estimulan la respuesta inmunológica del cuerpo sin causar la enfermedad. Se recomienda para todas las personas y especialmente a los grupos de alto riesgo, como trabajadores de la salud, personas con múltiples parejas sexuales, usuarios de drogas inyectables, personas con enfermedad hepática crónica, parejas sexuales de personas con hepatitis B y viajeros a áreas de alta prevalencia. También se recomienda vacunar a los contactos cercanos y familiares de las personas con hepatitis B crónica.
DISCUSIÓN:
HEPATITIS B Y C

A 325 MILLONES DE PERSONAS EN TODO
AFECTAN
EL
MUNDO Y CAUSAN 1.4
DE MUERTES AL AÑO SEGÚN LA ORGANIZACIÓN MUNDIAL DE LA SALUD (OMS).
MILLONES
También, representan la segunda enfermedad infecciosa más mortífera después de la tuberculosis. De hecho, se estima que hay 9 veces más personas infectadas por los VHB y VHC que por el VIH. En el caso del VHB solamente, se estima que aproximadamente 257 millones de personas están crónicamente infectadas en todo el mundo, y alrededor de 887,000 personas mueren cada año debido a sus complicaciones. En Puerto Rico, según los datos presentados por la Oficina de Epidemiología e Investigación del Departamento de Salud, los casos de Hepatitis B reportados para el periodo de 2019-2022 presentaron un pico a partir del 2021 con una tasa de 2.2 X 100,000 habitantes, lo cual demuestra un aumento de casos sostenido durante el 2022, con una tasa de 1.8 X 100,000 habitantes. La tasa de mayor incidencia de casos reportados por región de salud para el mismo periodo, se vieron en las regiones de Arecibo y Fajardo, durante el 2022. En el caso de la Hepatitis C, fue causante de alrededor de 290,000 muertes mayormente de
cirrosis o cáncer hepático primario en el 2019 basado en datos publicados por la OMS, mientras que en Puerto Rico, según datos del estudio “HIV and Viral Hepatitis Local Situation in Puerto Rico Epidemiology and Treatment” realizado por el Dr. Jorge L. Santana de la Escuela de Medicina del Recinto de Ciencias Médicas de la Universidad de Puerto Rico, entre los años 2010 a 2015 se identificaron 11,334 personas con casos confirmados y sospechosos de diagnóstico de Hepatitis C lo cual se traduce a una prevalencia de 0.31. Según datos más recientes provistos por la Oficina de Epidemiología e Investigación del Departamento de Salud de Puerto Rico, en el año 2022 se identificaron 3758 casos confirmados y sospechosos, lo cual representa un 33% de lo identificado entre los años 2010 a 2015. No sólo la cifra es alarmante, sino que se encontró que la hepatitis C es más común en las personas de entre 35-54 años, dato que denota el cambio histórico de esta población.
14 Revista Puertorriqueña de Medicina y Salud Pública
LAS
CONCLUSIÓN:
Estas infecciones en especial la Hepatitis C es considerada una epidemia silente, pues conservadoramente alrededor de tres millones de personas están infectadas solo en Estados Unidos, y globalmente se estima que, alrededor de 58 millones de personas tienen enfermedad crónica. Estas cifras destacan la importancia de abordar esta enfermedad de manera efectiva. Sin embargo, nuevos datos del Centro De Control de infecciones (CDC) revelan que menos de un tercio de las personas con diagnóstico de Hepatitis C reciben tratamiento oportuno para la mortal, aunque curable infección. La OMS y el Gobierno de Puerto Rico están haciendo esfuerzos para
hacer consciencia, aumentar recursos, prevenir transmisión y aumentar los servicios de cernimiento, cuidado y tratamiento de la hepatitis C, con la meta de erradicar la enfermedad para el año 2030. Como individuo, es importante mantenerse informado, realizarse las pruebas de cernimiento, evitar compartir agujas, protegerse al tener relaciones sexuales y vacunarse. Como sociedad, debemos hacernos conscientes de que este problema tiene solución, hacer un esfuerzo por ser partícipes de la misma, y de esta manera ser parte de la historia que se contará a nuestras futuras generaciones cuando se hable de la erradicación de los virus de la hepatitis B y C.
REFERENCIAS
1. World Health Organization. (n.d.). Hepatitis B. World Health Organization. https://www.who.int/ es/news-room/fact-sheets/detail/ hepatitis-b

2. World Health Organization. (n.d.-b). Hepatitis C. World Health Organization. https://www.who. int/news-room/fact-sheets/detail/ hepatitis-c#:~:text=Globally%2C%20 an%20estimated%2058%20 million,with%20chronic%20 hepatitis%20C%20infection.
3. Eliminación de las hepatitis virales. Portal del Departamento de Salud. (n.d.). https://www.salud.pr.gov/
CMS/45
4. Prevención de Hepatitis Virales. Portal del Departamento de Salud. (n.d.). https://www.salud.pr.gov/CMS/327
5. Puerto Rico meeting on Hepatitis & HIV 2019. Puerto Rico Meeting on Hepatitis & HIV 2019 | AME. (n.d.). https://academicmedicaleducation. com/meeting/puerto-rico-meetinghepatitis-hiv-2019
6. ESTADO LIBRE ASOCIADO DE PUERTO RICO 19na Asamblea 2da Sesión Legislativa Ordinaria. SENADO DE PUERTO RICO P. del S. 515 13 de agosto de 2021.
7. Departamento de Salud de Puerto Rico. Plan para la eliminación de las hepatitis virales en Puerto Rico. https://www.salud.pr.gov/CMS/ DOWNLOAD/7595
8. U.S. Department of Health and Human Services. (2020). Viral Hepatitis National Strategic Plan for the United States: A Roadmap to Elimination (2021–2025). Washington, DC.
9. Viral Hepatitis: Hepatitis B. https:// www.cdc.gov/hepatitis/hbv/index. htm
10. Viral Hepatitis: Hepatitis C. https:// www.cdc.gov/hepatitis/hcv/index. htm
Revista Puertorriqueña de Medicina y Salud Pública 15
INDICATIONS1
Hypothyroidism
INDICATIONS1
Hypothyroidism
SYNTHROID® (levothyroxine sodium) tablets for oral use is an L-thyroxine (T4) indicated in adult and pediatric patients, including neonates, as a replacement therapy in primary (thyroidal), secondary (pituitary), and tertiary (hypothalamic) congenital or acquired hypothyroidism.
• Patients with coronary artery disease who are receiving SYNTHROID should be monitored closely during surgical procedures for cardiac arrhythmias. Monitor patients during concomitant administration of SYNTHROID and sympathomimetic agents for signs and symptoms of coronary insu ciency.
Pituitary Thyrotropin (Thyroid Stimulating Hormone, TSH)

Suppression
SYNTHROID® (levothyroxine sodium) tablets for oral use is an L-thyroxine (T4) indicated in adult and pediatric patients, including neonates, as a replacement therapy in primary (thyroidal), secondary (pituitary), and tertiary (hypothalamic) congenital or acquired hypothyroidism.
Pituitary Thyrotropin (Thyroid Stimulating Hormone, TSH) Suppression
SYNTHROID is indicated in adult and pediatric patients, including neonates, as an adjunct to surgery and radioiodine therapy in the management of thyrotropin-dependent well-di erentiated thyroid cancer.
SYNTHROID is indicated in adult and pediatric patients, including neonates, as an adjunct to surgery and radioiodine therapy in the management of thyrotropin-dependent well-di erentiated thyroid cancer.
Limitation of Use
SYNTHROID is not indicated for suppression of benign thyroid nodules and nontoxic di use goiter in iodine-su cient patients, as there are no clinical benefits and overtreatment with SYNTHROID may induce hyperthyroidism.
Limitation of Use
SYNTHROID is not indicated for treatment of hypothyroidism during the recovery phase of subacute thyroiditis.
IMPORTANT SAFETY INFORMATION1
SYNTHROID is not indicated for suppression of benign thyroid nodules and nontoxic di use goiter in iodine-su cient patients, as there are no clinical benefits and overtreatment with SYNTHROID may induce hyperthyroidism.
SYNTHROID is not indicated for treatment of hypothyroidism during the recovery phase of subacute thyroiditis.
WARNING:
IMPORTANT SAFETY INFORMATION1
WARNING:
Thyroid hormones, including SYNTHROID, either alone or with other therapeutic agents, should not be used for the treatment of obesity or for weight loss. In euthyroid patients, doses within the range of daily hormonal requirements are ine ective for weight reduction. Larger doses may produce serious or even life-threatening manifestations of toxicity, particularly when given in association with sympathomimetic amines such as those used for their anorectic e ects.
CONTRAINDICATIONS
Thyroid hormones, including SYNTHROID, either alone or with other therapeutic agents, should not be used for the treatment of obesity or for weight loss. In euthyroid patients, doses within the range of daily hormonal requirements are ine ective for weight reduction. Larger doses may produce serious or even life-threatening manifestations of toxicity, particularly when given in association with sympathomimetic amines such as those used for their anorectic e ects.
• SYNTHROID is contraindicated in patients with uncorrected adrenal insu ciency.
CONTRAINDICATIONS
WARNINGS AND PRECAUTIONS
• SYNTHROID is contraindicated in patients with uncorrected adrenal insu ciency.
WARNINGS AND PRECAUTIONS
• SYNTHROID has a narrow therapeutic index. Overtreatment or undertreatment with SYNTHROID may have negative e ects on growth and development, cardiovascular function, bone metabolism, reproductive function, cognitive function, gastrointestinal function, and glucose and lipid metabolism in adult or pediatric patients. In pediatric patients with congenital and acquired hypothyroidism, undertreatment may adversely a ect cognitive development and linear growth, and overtreatment is associated with craniosynostosis and acceleration of bone age. Titrate the dose of SYNTHROID carefully and monitor response to titration to avoid these e ects.
• SYNTHROID has a narrow therapeutic index. Overtreatment or undertreatment with SYNTHROID may have negative e ects on growth and development, cardiovascular function, bone metabolism, reproductive function, cognitive function, gastrointestinal function, and glucose and lipid metabolism in adult or pediatric patients. In pediatric patients with congenital and acquired hypothyroidism, undertreatment may adversely a ect cognitive development and linear growth, and overtreatment is associated with craniosynostosis and acceleration of bone age. Titrate the dose of SYNTHROID carefully and monitor response to titration to avoid these e ects.
• In the elderly and in patients with cardiovascular disease, SYNTHROID should be initiated at lower doses than those recommended in younger individuals or in patients without cardiac disease. If cardiac symptoms develop or worsen, the SYNTHROID dose should be reduced or withheld for one week and restarted at a lower dose.
• In the elderly and in patients with cardiovascular disease, SYNTHROID should be initiated at lower doses than those recommended in younger individuals or in patients without cardiac disease. If cardiac symptoms develop or worsen, the SYNTHROID dose should be reduced or withheld for one week and restarted at a lower dose.
• Patients with coronary artery disease who are receiving SYNTHROID should be monitored closely during surgical procedures for cardiac arrhythmias. Monitor patients during concomitant administration of SYNTHROID and sympathomimetic agents for signs and symptoms of coronary insu ciency.
• Use of oral thyroid hormone is not recommended in myxedema coma. Products formulated for IV administration should be used to treat myxedema coma.
• Patients with adrenal insu ciency should be treated with replacement glucocorticoids prior to initiating treatment with SYNTHROID. Failure to do so may precipitate an acute adrenal crisis when thyroid hormone therapy is initiated.
• Use of oral thyroid hormone is not recommended in myxedema coma. Products formulated for IV administration should be used to treat myxedema coma.
• Addition of levothyroxine therapy in patients with diabetes mellitus may worsen glycemic control and result in increased antidiabetic agent or insulin requirements. Carefully monitor glycemic control after starting, changing, or discontinuing SYNTHROID.
• Patients with adrenal insu ciency should be treated with replacement glucocorticoids prior to initiating treatment with SYNTHROID. Failure to do so may precipitate an acute adrenal crisis when thyroid hormone therapy is initiated.
• Addition of levothyroxine therapy in patients with diabetes mellitus may worsen glycemic control and result in increased antidiabetic agent or insulin requirements. Carefully monitor glycemic control after starting, changing, or discontinuing SYNTHROID.
• Increased bone resorption and decreased bone mineral density may occur as a result of levothyroxine over-replacement, particularly in postmenopausal women. To mitigate this risk, patients receiving SYNTHROID should be given the minimum dose necessary that achieves the desired response.
ADVERSE REACTIONS
• Increased bone resorption and decreased bone mineral density may occur as a result of levothyroxine over-replacement, particularly in postmenopausal women. To mitigate this risk, patients receiving SYNTHROID should be given the minimum dose necessary that achieves the desired response.


• Adverse reactions associated with SYNTHROID therapy are primarily those of hyperthyroidism due to therapeutic overdosage.
ADVERSE REACTIONS
• Adverse reactions associated with SYNTHROID therapy are primarily those of hyperthyroidism due to therapeutic overdosage.
• In pediatric patients receiving levothyroxine therapy, pseudotumor cerebri and slipped capital femoral epiphysis have been reported. Overtreatment may result in craniosynostosis in infants who have not undergone complete closure of the fontanelles, and in premature closure of the epiphyses in pediatric patients still experiencing growth with resultant compromised adult height.
DRUG INTERACTIONS
• In pediatric patients receiving levothyroxine therapy, pseudotumor cerebri and slipped capital femoral epiphysis have been reported. Overtreatment may result in craniosynostosis in infants who have not undergone complete closure of the fontanelles, and in premature closure of the epiphyses in pediatric patients still experiencing growth with resultant compromised adult height.
DRUG INTERACTIONS
• Many drugs and some foods a ect thyroid hormone pharmacokinetics and metabolism and may alter the therapeutic response to SYNTHROID. In addition, thyroid hormones and thyroid status have varied e ects on the pharmacokinetics and actions of other drugs. Administer at least 4 hours before or after drugs that are known to interfere with absorption. Evaluate the need for dose adjustments when regularly administering within one hour of certain foods that may a ect absorption. Prescribers should consult appropriate reference sources for additional information on drug or food interactions with SYNTHROID.
USE IN SPECIFIC POPULATIONS
• Many drugs and some foods a ect thyroid hormone pharmacokinetics and metabolism and may alter the therapeutic response to SYNTHROID. In addition, thyroid hormones and thyroid status have varied e ects on the pharmacokinetics and actions of other drugs. Administer at least 4 hours before or after drugs that are known to interfere with absorption. Evaluate the need for dose adjustments when regularly administering within one hour of certain foods that may a ect absorption. Prescribers should consult appropriate reference sources for additional information on drug or food interactions with SYNTHROID.
USE IN SPECIFIC POPULATIONS
• SYNTHROID should not be discontinued during pregnancy, and hypothyroidism diagnosed during pregnancy should be promptly treated. TSH levels may increase during pregnancy, so TSH should be monitored and SYNTHROID dose adjusted as needed.
Please see accompanying full prescribing information or visit https://www.rxabbvie.com/pdf/synthroid.pdf
Reference:
• SYNTHROID should not be discontinued during pregnancy, and hypothyroidism diagnosed during pregnancy should be promptly treated. TSH levels may increase during pregnancy, so TSH should be monitored and SYNTHROID dose adjusted as needed.
Please see accompanying full prescribing information or visit https://www.rxabbvie.com/pdf/synthroid.pdf Reference:
16 Revista Puertorriqueña de Medicina y Salud Pública
1. SYNTHROID [package insert]. North Chicago, IL: AbbVie Inc. © 2022 AbbVie. All rights reserved. US-SYNT-220312 November 2022 A-F 16_9558 US-SYNT-220312.indd 1
2022 AbbVie. All rights reserved. US-SYNT-220312 November 2022 A-F 16_9558 US-SYNT-220312.indd 1
1. SYNTHROID [package insert]. North Chicago, IL: AbbVie Inc. ©
FOR PUERTO RICO HEALTHCARE PROFESSIONALS
A new site with resources and support to help you manage your hypothyroidism patients and where you can request to contact an AbbVie Representative.
INDICATIONS1
Hypothyroidism
SynthroidHCPpr.com HCP WEBSITE
A new site with resources and support to help you manage your hypothyroidism patients and where you can request to contact an AbbVie Representative.


Limitation of Use
INDICATIONS1
Hypothyroidism
SYNTHROID® (levothyroxine sodium) tablets for oral use is an L-thyroxine (T4) indicated in adult and pediatric patients, including neonates, as a replacement therapy in primary (thyroidal), secondary (pituitary), and tertiary (hypothalamic) congenital or acquired hypothyroidism.
Pituitary Thyrotropin (Thyroid Stimulating Hormone, TSH) Suppression

SYNTHROID® (levothyroxine sodium) tablets for oral use is an L-thyroxine (T4) indicated in adult and pediatric patients, including neonates, as a replacement therapy in primary (thyroidal), secondary (pituitary), and tertiary (hypothalamic) congenital or acquired hypothyroidism.
SYNTHROID is indicated in adult and pediatric patients, including neonates, as an adjunct to surgery and radioiodine therapy in the management of thyrotropin-dependent well-di erentiated thyroid cancer.
Pituitary Thyrotropin (Thyroid Stimulating Hormone, TSH) Suppression SYNTHROID is indicated in adult and pediatric patients, including neonates, as an adjunct to surgery and radioiodine therapy in the management of thyrotropin-dependent well-di erentiated thyroid cancer.
SYNTHROID is not indicated for suppression of benign thyroid nodules and nontoxic di use goiter in iodine-su cient patients, as there are no clinical benefits and overtreatment with SYNTHROID may induce hyperthyroidism.
Limitation of Use
SYNTHROID is not indicated for treatment of hypothyroidism during the recovery phase of subacute thyroiditis.
SAFETY CONSIDERATIONS1
SYNTHROID is not indicated for suppression of benign thyroid nodules and nontoxic di use goiter in iodine-su cient patients, as there are no clinical benefits and overtreatment with SYNTHROID may induce hyperthyroidism.
SYNTHROID is not indicated for treatment of hypothyroidism during the recovery phase of subacute thyroiditis.
• SYNTHROID should not be used for the treatment of obesity or for weight loss.
SAFETY CONSIDERATIONS1
• SYNTHROID should not be used for the treatment of obesity or for weight loss.
Please see Important Safety Information, including BOXED Warning regarding inappropriate treatment for obesity or for weight loss, on the adjacent page.
Please see the following pages for a brief summary of the prescribing information.
Please see Important Safety Information, including BOXED Warning regarding inappropriate treatment for obesity or for weight loss, on the adjacent page. Please see the following pages for a brief summary of the prescribing information.
Revista Puertorriqueña de Medicina y Salud Pública 17
1/23/23 5:50 PM
HCP WEBSITE
SynthroidHCPpr.com
1/23/23 5:50 PM
SYNTHROID® (sin-throyd) (levothyroxine sodium) tablets, USP
WARNING: NOT FOR TREATMENT OF OBESITY OR FOR WEIGHT LOSS
Thyroid hormones, including SYNTHROID, either alone or with other therapeutic agents, should not be used for the treatment of obesity or for weight loss.
In euthyroid patients, doses within the range of daily hormonal requirements are ineffective for weight reduction.
Larger doses may produce serious or even life-threatening manifestations of toxicity, particularly when given in association with sympathomimetic amines such as those used for their anorectic effects [see Adverse Reactions, Drug Interactions, and Overdosage]
INDICATIONS AND USAGE
Hypothyroidism
SYNTHROID is indicated in adult and pediatric patients, including neonates, as a replacement therapy in primary (thyroidal), secondary (pituitary), and tertiary (hypothalamic) congenital or acquired hypothyroidism.
Pituitary Thyrotropin (Thyroid-Stimulating Hormone, TSH) Suppression
SYNTHROID is indicated in adult and pediatric patients, including neonates, as an adjunct to surgery and radioiodine therapy in the management of thyrotropin-dependent well-differentiated thyroid cancer.
Limitations of Use
• SYNTHROID is not indicated for suppression of benign thyroid nodules
hyperthyroidism [see Warnings and Precautions]
• SYNTHROID is not indicated for treatment of hypothyroidism during the recovery phase of subacute thyroiditis.
CONTRAINDICATIONS
SYNTHROID is contraindicated in patients with uncorrected adrenal [see Warnings and Precautions]
WARNINGS AND PRECAUTIONS
Serious Risks Related to Overtreatment or Undertreatment with SYNTHROID
SYNTHROID has a narrow therapeutic index. Overtreatment or undertreatment with SYNTHROID may have negative effects on growth and development, cardiovascular function, bone metabolism, reproductive function, cognitive function, gastrointestinal function, and glucose and lipid metabolism in adult or pediatric patients.
In pediatric patients with congenital and acquired hypothyroidism, undertreatment may adversely affect cognitive development and linear growth, and overtreatment is associated with craniosynostosis and acceleration of bone age
Titrate the dose of SYNTHROID carefully and monitor response to titration to avoid these effects. Consider the potential for food or drug interactions and adjust the administration or dosage of SYNTHROID as needed
[see Drug Interactions]

Cardiac Adverse Reactions in the Elderly and in Patients with Underlying Cardiovascular Disease
Over-treatment with levothyroxine may cause an increase in heart rate, cardiac wall thickness, and cardiac contractility and may precipitate angina or arrhythmias, particularly in patients with cardiovascular disease and in elderly patients. Initiate SYNTHROID therapy in this population at lower doses than those recommended in younger individuals or in patients without cardiac disease
Monitor for cardiac arrhythmias during surgical procedures in patients with coronary artery disease receiving suppressive SYNTHROID therapy. Monitor patients receiving concomitant SYNTHROID and sympathomimetic agents for If cardiac symptoms develop or worsen, reduce the SYNTHROID dose or withhold for one week and restart at a lower dose.
Myxedema Coma
Myxedema coma is a life-threatening emergency characterized by poor circulation and hypometabolism and may result in unpredictable absorption of levothyroxine sodium from the gastrointestinal tract. Use of oral thyroid hormone drug products is not recommended to treat myxedema coma. Administer thyroid hormone products formulated for intravenous administration to treat myxedema coma.
Acute Adrenal Crisis in Patients with Concomitant Adrenal Insufficiency Thyroid hormone increases metabolic clearance of glucocorticoids. Initiation of thyroid hormone therapy prior to initiating glucocorticoid therapy may
prior to initiating treatment with SYNTHROID [see Contraindications]
Worsening of Diabetic Control
Addition of levothyroxine therapy in patients with diabetes mellitus may worsen glycemic control and result in increased antidiabetic agent or insulin requirements. Carefully monitor glycemic control after starting, changing, or discontinuing SYNTHROID [see Drug Interactions]
Decreased Bone Mineral Density Associated with Thyroid Hormone
Over-Replacement
Increased bone resorption and decreased bone mineral density may occur as a result of levothyroxine over-replacement, particularly in postmenopausal women. The increased bone resorption may be associated with increased serum levels and urinary excretion of calcium and phosphorous, elevations in bone alkaline phosphatase, and suppressed serum parathyroid hormone levels. Administer the minimum dose of SYNTHROID that achieves the desired clinical and biochemical response to mitigate this risk.
ADVERSE REACTIONS
Adverse reactions associated with SYNTHROID therapy are primarily those of hyperthyroidism due to therapeutic overdosage [see Warnings and Precautions, Overdosage]. They include the following:
• General: fatigue, increased appetite, weight loss, heat intolerance, fever, excessive sweating
• Central nervous system: headache, hyperactivity, nervousness, anxiety, irritability, emotional lability, insomnia
• Musculoskeletal: tremors, muscle weakness, muscle spasm
• Cardiovascular: palpitations, tachycardia, arrhythmias, increased pulse and blood pressure, heart failure, angina, myocardial infarction, cardiac arrest
• Respiratory: dyspnea
PROFESSIONAL BRIEF SUMMARY CONSULT PACKAGE INSERT FOR FULL PRESCRIBING INFORMATION
• Gastrointestinal: diarrhea, vomiting, abdominal cramps, elevations in liver function tests
• Dermatologic:
• Endocrine: decreased bone mineral density
• Reproductive: menstrual irregularities, impaired fertility
Seizures have been reported rarely with the institution of levothyroxine therapy.
Adverse Reactions in Pediatric Patients
Pseudotumor cerebri and slipped capital femoral epiphysis have been reported in pediatric patients receiving levothyroxine therapy. Overtreatment may result in craniosynostosis in infants who have not undergone complete closure of the fontanelles, and in premature closure of the epiphyses in pediatric patients still experiencing growth with resultant compromised adult height.
Hypersensitivity Reactions
Hypersensitivity reactions to inactive ingredients have occurred in patients treated with thyroid hormone products. These include urticaria, pruritus, (abdominal pain, nausea, vomiting and diarrhea), fever, arthralgia, serum sickness, and wheezing. Hypersensitivity to levothyroxine itself is not known to occur.
DRUG INTERACTIONS
Drugs Known to Affect Thyroid Hormone Pharmacokinetics
Many drugs can exert effects on thyroid hormone pharmacokinetics and metabolism (e.g., absorption, synthesis, secretion, catabolism, protein binding, and target tissue response) and may alter the therapeutic response to SYNTHROID (Tables 1 to 4).
Table 1. Drugs That May Decrease T4 Absorption (Hypothyroidism) by binding and delaying or preventing absorption, potentially resulting in hypothyroidism.
Drug or Drug Class Effect
Phosphate Binders (e.g., calcium carbonate, ferrous sulfate, sevelamer, lanthanum)
Table 3. Drugs That May Alter Hepatic Metabolism of T4 (Hypothyroidism)
Potential impact: Stimulation of hepatic microsomal drug-metabolizing enzyme activity may cause increased hepatic degradation of levothyroxine, resulting in increased SYNTHROID requirements.
Drug or Drug Class Effect
Phenobarbital Rifampin
Phenobarbital has been shown to reduce the response to thyroxine. Phenobarbital increases L-thyroxine metabolism by inducing uridine 5’-diphospho-glucuronosyltransferase (UGT) and leads to lower T4 serum levels. Changes in thyroid status may occur if barbiturates are added or withdrawn from patients being treated for hypothyroidism. Rifampin has been shown to accelerate the metabolism of levothyroxine.
Table 4.
Drugs That May Decrease Conversion of T4 to T3
Potential impact: Administration of these enzyme inhibitors decreases the peripheral conversion of T4 to T3, leading to decreased T3 levels. However, serum T4 levels are usually normal but may occasionally be slightly increased.
Drug or Drug Class Effect
Beta-adrenergic antagonists (e.g., Propranolol > 160 mg/day)
Glucocorticoids (e.g., Dexamethasone ≥ 4 mg/day)
Phosphate binders may bind to levothyroxine. Administer SYNTHROID at least 4 hours apart from these agents.
Orlistat Monitor patients treated concomitantly with orlistat and SYNTHROID for changes in thyroid function.
Bile Acid Sequestrants (e.g., colesevelam, cholestyramine, colestipol)
Ion Exchange Resins (e.g., Kayexalate)
Proton Pump Inhibitors
Sucralfate
Antacids (e.g., aluminum & magnesium hydroxides, simethicone)
Bile acid sequestrants and ion exchange resins are known to decrease levothyroxine absorption. Administer SYNTHROID at least 4 hours prior to these drugs or monitor TSH levels.
Gastric acidity is an essential requirement for adequate absorption of levothyroxine. Sucralfate, antacids and proton pump inhibitors may cause hypochlorhydria, affect intragastric pH, and reduce levothyroxine absorption. Monitor patients appropriately.
Table 2. Drugs That May Alter T4 and Triiodothyronine (T3)
Serum Transport Without Affecting Free Thyroxine (FT4) Concentration (Euthyroidism)
Drug or Drug Class Effect
Estrogen-containing oral contraceptives
Estrogens (oral)
Heroin / Methadone
5-Fluorouracil
Mitotane Tamoxifen
Androgens / Anabolic Steroids
Asparaginase
Glucocorticoids
Slow-Release Nicotinic Acid
These drugs may increase serum thyroxine-binding globulin (TBG) concentration.
These drugs may decrease serum TBG concentration.
Potential impact (below): Administration of these agents with SYNTHROID results in an initial transient increase in FT4. Continued administration results in a decrease in serum T4 and normal FT4 and TSH concentrations.
Salicylates (> 2 g/day) Salicylates inhibit binding of T4 and T3 to TBG and transthyretin. An initial increase in serum FT4 is followed by return of FT4 to normal levels with sustained therapeutic serum salicylate concentrations, although total T4 levels may decrease by as much as 30%.
Other drugs:
Carbamazepine
Furosemide (> 80 mg IV)
Heparin
Hydantoins
Drugs - Fenamates
These drugs may cause protein-binding site displacement. Furosemide has been shown to inhibit the protein binding of T4 to TBG and albumin, causing an increase free T4 fraction in serum. Furosemide competes for T4-binding sites on TBG, prealbumin, and albumin, so that a single high dose can acutely lower the total T4 level. Phenytoin and carbamazepine reduce serum protein binding of levothyroxine, and total and free T4 may be reduced by 20% to 40%, but most patients have normal serum TSH levels and are clinically euthyroid. Closely monitor thyroid hormone parameters.
In patients treated with large doses of propranolol (> 160 mg/day), T3 and T4 levels change, TSH levels remain normal, and patients are clinically euthyroid. Actions of particular beta-adrenergic antagonists may be impaired when a hypothyroid patient is converted to the euthyroid state.
Short-term administration of large doses of glucocorticoids may decrease serum T3 concentrations by 30% with minimal change in serum T4 levels. However, long-term glucocorticoid therapy may result in slightly decreased T3 and T4 levels due to decreased TBG production (See above).
Other drugs: Amiodarone Amiodarone inhibits peripheral conversion of levothyroxine (T4) to triiodothyronine (T3) and may cause isolated biochemical changes (increase in serum free-T4, and decreased or normal free-T3) in clinically euthyroid patients.
Antidiabetic Therapy
Addition of SYNTHROID therapy in patients with diabetes mellitus may worsen glycemic control and result in increased antidiabetic agent or insulin requirements. Carefully monitor glycemic control, especially when thyroid therapy is started, changed, or discontinued [see Warnings and Precautions]
Oral Anticoagulants
SYNTHROID increases the response to oral anticoagulant therapy. Therefore, a decrease in the dose of anticoagulant may be warranted with correction of the hypothyroid state or when the SYNTHROID dose is increased. Closely monitor coagulation tests to permit appropriate and timely dosage adjustments.
Digitalis Glycosides
SYNTHROID may reduce the therapeutic effects of digitalis glycosides. Serum digitalis glycoside levels may decrease when a hypothyroid patient becomes euthyroid, necessitating an increase in the dose of digitalis glycosides.
Antidepressant Therapy
Concurrent use of tricyclic (e.g., amitriptyline) or tetracyclic (e.g., maprotiline) antidepressants and SYNTHROID may increase the therapeutic and toxic effects of both drugs, possibly due to increased receptor sensitivity to catecholamines. Toxic effects may include increased risk of cardiac arrhythmias and central nervous system stimulation.
SYNTHROID may accelerate the onset of action of tricyclics. Administration of sertraline in patients stabilized on SYNTHROID may result in increased SYNTHROID requirements.
Ketamine
Concurrent use of ketamine and SYNTHROID may produce marked hypertension and tachycardia. Closely monitor blood pressure and heart rate in these patients.
Sympathomimetics
Concurrent use of sympathomimetics and SYNTHROID may increase the effects of sympathomimetics or thyroid hormone. Thyroid hormones may are administered to patients with coronary artery disease.
Tyrosine-Kinase Inhibitors
Concurrent use of tyrosine-kinase inhibitors such as imatinib may cause hypothyroidism. Closely monitor TSH levels in such patients.
Drug-Food Interactions
Consumption of certain foods may affect SYNTHROID absorption thereby SYNTHROID from the gastrointestinal tract. Grapefruit juice may delay the absorption of levothyroxine and reduce its bioavailability.
Drug-Laboratory Test Interactions
Consider changes in TBG concentration when interpreting T4 and T3 values. Measure and evaluate unbound (free) hormone and/or determine the free-T4 index (FT4I) in this circumstance. Pregnancy, infectious hepatitis, estrogens, estrogen-containing oral contraceptives, and acute intermittent porphyria increase TBG concentration. Nephrosis, severe hypoproteinemia, severe liver disease, acromegaly, androgens, and corticosteroids decrease TBG concentration. Familial hyper- or hypo-thyroxine binding globulinemias have
USE IN SPECIFIC POPULATIONS
Pregnancy
Risk Summary
The clinical experience, including data from postmarketing studies, in pregnant women treated with oral levothyroxine to maintain euthyroid state have not reported increased rates of major birth defects, miscarriages, or
18 Revista Puertorriqueña de Medicina y Salud Pública
other adverse maternal or fetal outcomes There are risks to the mother and fetus associated with untreated hypothyroidism in pregnancy. Since TSH levels may increase during pregnancy, TSH should be monitored and
SYNTHROID dosage adjusted during pregnancy (see Clinical Considerations)
Animal reproductive studies have not been conducted with levothyroxine sodium. SYNTHROID should not be discontinued during pregnancy and hypothyroidism diagnosed during pregnancy should be promptly treated. The estimated background risk of major birth defects and miscarriage for the indicated population is unknown. All pregnancies have a background risk of birth defect, loss, or other adverse outcomes. In the U.S. general population, the estimated background risk of major birth defects and miscarriage in clinically recognized pregnancies is 2% to 4% and 15% to 20%, respectively.
Clinical Considerations
Disease-Associated Maternal and/or Embryo/Fetal Risk
Maternal hypothyroidism during pregnancy is associated with a higher rate of complications, including spontaneous abortion, gestational hypertension, pre-eclampsia, stillbirth, and premature delivery.
Untreated maternal hypothyroidism may have an adverse effect on fetal neurocognitive development.
Dose Adjustments During Pregnancy and the Postpartum Period
Pregnancy may increase SYNTHROID requirements. Serum TSH levels should be monitored and the SYNTHROID dosage adjusted during pregnancy. Since postpartum TSH levels are similar to preconception values, the SYNTHROID dosage should return to the pre-pregnancy dose immediately after delivery
Lactation
Risk Summary
Published studies report that levothyroxine is present in human milk following the administration of oral levothyroxine. No adverse effects on the breastfed infant have been reported and there is no information on the effects of levothyroxine on milk production. Adequate levothyroxine treatment during lactation may normalize milk production in hypothyroid lactating mothers with low milk supply. The developmental and health clinical need for SYNTHROID and any potential adverse effects on the breastfed infant from SYNTHROID or from the underlying maternal condition.
Pediatric Use
SYNTHROID is indicated in patients from birth to less than 17 years of age:
• As a replacement therapy in primary (thyroidal), secondary (pituitary), and tertiary (hypothalamic) congenital or acquired hypothyroidism.
• As an adjunct to surgery and radioiodine therapy in the management of thyrotropin-dependent well-differentiated thyroid cancer. Rapid restoration of normal serum T4 concentrations is essential for preventing the adverse effects of congenital hypothyroidism on cognitive
development as well as on overall physical growth and maturation. Therefore, initiate SYNTHROID therapy immediately upon diagnosis. Levothyroxine is generally continued for life in these patients [see Warnings and Precautions]
cardiac overload and arrhythmias.
Geriatric Use
Because of the increased prevalence of cardiovascular disease among the elderly, initiate SYNTHROID at less than the full replacement dose [see Warnings and Precautions]. Atrial arrhythmias can occur in elderly with levothyroxine overtreatment in the elderly.
OVERDOSAGE
The signs and symptoms of overdosage are those of hyperthyroidism [see Warnings and Precautions and Adverse Reactions]. In addition, confusion and disorientation may occur. Cerebral embolism, shock, coma, and death have been reported. Seizures occurred in a 3-year-old child ingesting not appear until several days after ingestion of levothyroxine sodium. Reduce the SYNTHROID dosage or discontinue temporarily if signs or symptoms of overdosage occur. Initiate appropriate supportive treatment as dictated by the patient’s medical status.

For current information on the management of poisoning or overdosage, contact the National Poison Control Center at 1-800-222-1222 or www.poison.org.
PATIENT COUNSELING INFORMATION
Inform the patient of the following information to aid in the safe and effective use of SYNTHROID:
Dosing and Administration
• Instruct patients to take SYNTHROID only as directed by their healthcare provider.
• Instruct patients to take SYNTHROID as a single dose, preferably on an empty stomach, one-half to one hour before breakfast.
• Inform patients that agents such as iron and calcium supplements and antacids can decrease the absorption of levothyroxine. Instruct patients not to take SYNTHROID tablets within 4 hours of these agents.
• Instruct patients to notify their healthcare provider if they are pregnant or breastfeeding or are thinking of becoming pregnant while taking SYNTHROID.
Important Information
• Inform patients that it may take several weeks before they notice an improvement in symptoms.
• Inform patients that the levothyroxine in SYNTHROID is intended to replace a hormone that is normally produced by the thyroid gland. Generally, replacement therapy is to be taken for life.
• Inform patients that SYNTHROID should not be used as a primary or adjunctive therapy in a weight control program.
• Instruct patients to notify their healthcare provider if they are taking any other medications, including prescription and over-the-counter preparations.
• Instruct patients to notify their physician of any other medical conditions they may have, particularly heart disease, diabetes, clotting disorders, and adrenal or pituitary gland problems, as the dose of medications used to control these other conditions may need to be adjusted while they are taking SYNTHROID. If they have diabetes, instruct patients to monitor their blood and/or urinary glucose levels as directed by their physician and immediately report any changes to their physician. If patients are taking anticoagulants, their clotting status should be checked frequently.
• Instruct patients to notify their physician or dentist that they are taking SYNTHROID prior to any surgery.
Adverse Reactions
• Instruct patients to notify their healthcare provider if they experience any of the following symptoms: rapid or irregular heartbeat, chest pain, shortness of breath, leg cramps, headache, nervousness, irritability, sleeplessness, tremors, change in appetite, weight gain or loss, vomiting, diarrhea, excessive sweating, heat intolerance, fever, changes in menstrual periods, hives or skin rash, or any other unusual medical event.
• months of SYNTHROID therapy, but this is usually temporary. AbbVie Inc. North Chicago, IL 60064, U.S.A.
© 2022 AbbVie Inc.
Ref: 20075189 Revised: October 2022 LAB-8351 MASTER
Revista Puertorriqueña de Medicina y Salud Pública 19
US-SYNT-220312
RESISTENCIA ANTIMICROBIAL Alarmante amenaza a la salud pública y un llamado a la reflexión para un futuro saludable


20 Revista Puertorriqueña de Medicina y Salud Pública
1 Ref: National Foundation for Infectious Disease/ CDC adapted
Figura
Dra. Heydee Fournier

Especialista en Medicina Interna
Infectóloga
Universidad de Puerto Rico
Recinto de Ciencias Médica
Dr. Jorge L Santana
Profesor Medicina y Enfermedades

Infecciosas
Departamento de Medicina de la Universidad de Puerto Rico
Director médico de la Unidad de Investigaciones Clínicas para el SIDA

RESUMEN
La resistencia antimicrobiana representa uno de los retos mayores en la medicina moderna. El uso inapropiado e injustificado de antibióticos recetados contribuye marcadamente a ese fenómeno de resistencia adquirida por mutaciones emergentes en la sobrevida y perpetuidad de las bacterias. Ente un 2530% de los antibióticos recetados en la mayoría de los países son inapropiados y no justificados y/o completado su curso apropiadamente. Esto resulta en un exceso de 3 millones de infecciones resistentes documentadas muy en especial en personas vulnerables con sistemas inmunológicos comprometidos, pacientes de cáncer, trasplante y quimioterapia conllevando consigo una mortalidad entre 35,000 a 48,000 personas/ ano. Educación colectiva medico/paciente es imperativo para mitigar la progresión de este fenómeno.
INTRODUCCIÓN
El descubrimiento accidental de la penicilina por el científico escoces Alexander Fleming en 1928, sin lugar a duda revolucionó la medicina, salvando innumerables vidas y permitiendo el tratamiento exitoso de infecciones que antes eran mortales. Sin embargo, la emergente resistencia a los antibióticos trae a la luz, la necesidad del uso responsable de estos, y el desarrollo de nuevos antibióticos para enfrentar los presentes y futuros desafíos de la medicina moderna.
¿Cuántos de ustedes han utilizado un antibiótico no prescrito cuando se sienten mal, asumiendo que acortará el periodo de enfermedad? ¿O han ido al doctor pidiendo un antibiótico para sentirse mejor?, ¿o peor aún, han compartido o recibido antibióticos del vecino? Es de pleno conocimiento y común creencia que los antibióticos
Revista Puertorriqueña de Medicina y Salud Pública 21
Palabras Clave: resistencia antimicrobial, antibióticos, Salud publica.
pueden tratar cualquier tipo de infección o enfermedad. O que incluso, pueden aliviar o tratar los síntomas. Es importante tener presente que son medicamentos dirigidos a enfermedades infecciosas causadas solamente por bacterias. No tienen actividad alguna para mejorar los síntomas, bajar la inflamación o acortar el curso de cualquier enfermedad que no sea de origen bacteriano, o viral. Tampoco son efectivos en contra de infecciones virales tales como la gripe y los resfriados comunes. Sin embargo, su uso desmedido e inapropiado es cada vez más frecuente, aumentando la exposición y variabilidad genética de las bacterias y con ello, su resistencia.
¿Pero porque ocurre esto? Existen razones multifactoriales a considerar. Una de ellas y no es el motivo de este ensayo, recae en el uso excesivo de antibióticos en las sociedades agrarias
DISCUSIÓN

No hay duda de que los antibióticos salvan vidas, pero cada vez que los utilizamos, nos exponemos a sus efectos secundarios, y a alterar la flora natural de bacterias en nuestro cuerpo y contribuir al desarrollo de bacterias resistentes. Como hemos señalado. este uso desmedido de antibióticos ha causado una proliferación emergente de resistencia, lo que representa una amenaza urgente a la salud pública a nivel global, causando al menos 1.27 millones de muertes en personas.
Según las más recientes estadísticas del Centro de control y prevención (CDC por sus siglas en inglés) de los Estados Unidos (EU), en las oficinas médicas y unidades de sala de emergencias del país, al menos el 28% de los antibióticos recetados cada año, son innecesarios. Mientras, se reportaron más de 2.8 millones de infecciones resistentes a antibióticos en el año, y 35,000 muertes a consecuencia de ello. Cuando a esa cifra se le añaden infecciones por Clostridiodes difficile, una bacteria que típicamente es parte de nuestra flora intestinal y no es resistente, pero puede mediante sobrecrecimiento selectivo causar una diarrea en ocasiones mortal que está directamente asociada al uso de antibióticos, esa cifra en los EU excede los 3 millones de infecciones y 48,000 muertes. Lo que nos lleva a hacer de ello una prioridad nacional, para mejorar su prescripción y uso.
Tanto el CDC, como la Organización
para proliferar la cantidad, maduración y desarrollo de pollos, cerdos y ganado vacuno alterando la genética intestinal de los mismos. En relaciona este renglón ya muchos países en especial en Europa han abandonado esta práctica y se está contribuyendo a aminorar los efectos y la posible transmisión de bacterias resistentes en la alimentación derivada de los mismos. (Ver Fig. 1)
Hay que recordar entonces, que los microorganismos tienen la capacidad de adaptarse y desarrollar resistencia cada vez que se exponen al medicamento, haciendo que sean menos efectivos o inefectivos a través del tiempo. Es un proceso natural de evolución para la supervivencia que ocurre cuando la bacteria se adapta y desarrolla mecanismos para soportar los efectos del antibiótico, los cuales son diseñados para matar o inhibir el
crecimiento de estas. Cuando no son utilizados adecuadamente, las bacterias tienden a mutar, pueden sobrevivir y multiplicarse, conllevando al desarrollo de cepas resistentes. Este fenómeno de forma repetitiva y sostenida amenaza nuestra habilidad de tratar infecciones efectivamente y puede aumentar el riesgo de complicaciones e incluso la muerte.
Y es que, los antibióticos no solo juegan un papel crucial en las prácticas de la medicina moderna para tratar infecciones bacterianas, sino que también se utilizan para evitar complicaciones infecciosas en cirugías, durante tratamientos de quimioterapia, y trasplantes de órganos; y ayudan a prevenir y tratar infecciones durante procesos que comprometen el sistema inmunológico.
Mundial de la Salud (OMS), han unido esfuerzos en el desarrollo de programas para movilizar la cooperación internacional, combatir la resistencia de antibióticos y preservar su efectividad para las presentes y futuras generaciones. Esto a través del uso correcto de antibióticos, en la dosis y duración correcta, y en el momento indicado. Mejorar la manera en que prescribimos el uso de antibióticos, es crítico para efectivamente tratar las infecciones, proteger a los pacientes del daño causado por antibióticos innecesarios, y por consiguiente minimizar esa resistencia.
El significado de la resistencia a los antibióticos recae en su impacto en la salud pública, en mayor riesgo se encuentran las poblaciones más vulnerables como los pacientes geriátricos, infantes, e individuos con el sistema inmunológico comprometido, como lo son pacientes de cáncer, enfermedades autoinmunes, trasplantados, entre otros. Además, no solo afectan al paciente expuesto al antibiótico, pues las bacterias resistentes pueden transmitir la resistencia a otras a través de su material genético. De esa manera, se pueden diseminar dentro y fuera del hospital, afectando también la comunidad. Estas infecciones a menudo son un desafío para tratar, requieren de un mayor cuidado, y contribuyen a la carga fiscal del sistema de salud. Esa carga tiene un significativo impacto económico, con aumento de los gastos de cuidado de salud por estadías
extensas, alternativas de tratamiento costosas, y perdidas de productividad, por enfermedades más prolongadas. El desarrollo de bacterias resistentes no solo afecta al individuo enfermo, también impacta el sistema de salud y las consecuencias de la resistencia a antibióticos son de amplio alcance y hay que tener en cuenta que son infecciones más desafiantes para tratar, resultan en prolongada enfermedad, aumentan los costos de salud, y tienen una tasa más alta de mortalidad.
PREVENIR LA RESISTENCIA A LOS ANTIBIÓTICOS, REQUIERE DE UN ESFUERZO COLECTIVO DE LOS PROFESIONALES DE SALUD, DE LOS QUE HACEN LAS POLÍTICAS PÚBLICAS, Y DE LA POBLACIÓN EN GENERAL. CADA INDIVIDUO PUEDE CONTRIBUIR AL ESFUERZO COLECTIVO DE COMBATIR ESTA AMENAZA A LA SALUD PÚBLICA.
22 Revista Puertorriqueña de Medicina y Salud Pública
¿Qué podemos hacer, como podemos ayudar? Como señalado anteriormente, el hacer un uso apropiado de ellos, educar a la población, creando el desarrollo de consciencia y promoviendo el uso responsable de antibióticos. Hable con su médico sobre el mejor tratamiento para su enfermedad y no lo presione a recetar antibióticos de no ser indicados. Tome antibióticos solamente cuando sean recetados por un médico, en la dosis y duración precisa. No comparta medicamentos ni use sobrantes. El curso debe ser completado según sea indicado, incluso cuando empiece a sentirse mejor. Parar el tratamiento de manera prematura puede permitir que algunas bacterias sobrevivan y desarrollen resistencia. Siempre consulte a un profesional de la salud para un diagnóstico y tratamiento adecuado.
¿Como podemos contribuir y proteger los nuestros? Practique buena higiene, tal y como lavarse las manos con agua y jabón regularmente. Recuerde que el uso de agentes con alcohol no debe remplazar el lavado de manos. Siga las prácticas de seguridad para la preparación y almacenamiento de los alimentos. Asegúrese de tener su récord de vacunación al día para prevenir infecciones y reducir la necesidad de antibióticos. Diseminar la información y voz de alerta sobre la resistencia a los antibióticos en su comunidad. Eduque a su familia, amigos y colegas sobre la importancia del uso responsable de antibióticos y las consecuencias de su mal uso.
Como hemos visto, el “issue” de resistencia antimicrobiana es una amenaza de salud global que no conoce límites y precisamente por esa globalización puede diseminarse fácilmente a través de viajes e intercambio internacional. Es imperativo la intervención y desarrollo de una política de cooperación internacional, vigilancia, y esfuerzos coordinados. Dado la gravedad del asunto, es crucial promover su uso responsable, desarrollar nuevos antibióticos, invertir en investigación, e implementar estrategias que prevengan o mitiguen esa diseminación. Queda en nuestras manos adoptar comportamientos responsables para ayudar a preservar la efectividad de los antibióticos y por esta acción colectiva, podemos mitigar las consecuencias nefastas de la resistencia a los antibióticos y salvaguardar su efectividad para las actuales y futuras generaciones.
REFERENCIAS
• About Antimicrobial Resistance
• https://www.cdc.gov/ drugresistance/about.html
• Last Reviewed: October 5, 2022

• 4Source: Centers for Disease Control and Prevention, National Center for Emerging and Zoonotic Infectious Diseases (NCEZID), Division of Healthcare Quality Promotion (DHQP)
• New Guidance for Treating Antimicrobial-Resistant Infections Released
• https://www.idsociety.org/news-publications-new/articles/2021/ new-guidance-for-treatingantimicrobial-resistant-infectionsreleased/
• https://www.cdc.gov/ drugresistance/pdf/CDC-FightsAR-Healthcare-508.pdf
Revista Puertorriqueña de Medicina y Salud Pública 23
CONCLUSION
EL ROL DEL MÉDICO PRIMARIO EN LA PROMOCIÓN Y MANEJO DE LA SALUD DE LA PIEL
La piel es el órgano más grande del cuerpo humano, y su cuidado es fundamental para una vida saludable. La piel puede verse afectada por numerosos factores, como la exposición a los rayos ultravioleta, la edad, la genética y el estilo de vida. Por ello, el papel del médico primario en la promoción de la salud de la piel es de suma importancia.
El médico primario, incluyendo al médico generalista y especialistas en pediatría, ginecología, medicina de familia y medicina interna tiene un rol clave en la prevención, diagnóstico y tratamiento de las afecciones de la piel porque suele ser el primer contacto de
los pacientes en el sistema de salud. Además, coordina la atención médica especializada cuando es necesario.
El médico primario ayuda a evitar afecciones de la piel mediante la educación al paciente sobre los efectos del sol y las medidas preventivas para proteger su piel, como por ejemplo el uso de protector solar, ropa protectora, sombreros, así como los efectos de la nutrición y estilos de vida en la salud de la piel.
Cuando los pacientes presentan problemas en la piel, el médico primario tiene la misión de ayudar a identificar el problema y proporcionar
tratamiento adecuado. Estos problemas pueden incluir infecciones cutáneas, como hongos o bacterias, y condiciones inflamatorias, como eczema, psoriasis, caída de pelo, condiciones en las uñas y mucosas orales y genitales. También pueden diagnosticar lesiones de piel sospechosas como lunares o manchas anormales que pueden ser signo de cáncer de piel.
Para ser más efectivo en el diagnóstico de condiciones dermatológicas, es importante que el médico tenga conocimiento de las lesiones en la piel y su relación con distintas enfermedades cutáneas o incluso poder llevar a cabo cultivos o


24 Revista Puertorriqueña de Medicina y Salud Pública
biopsias en la piel.
El médico puede proporcionar alternativas para el manejo inicial o a largo plazo de múltiples condiciones en la piel, pelo y uñas cuando un paciente acude a ellos en búsqueda de ayuda antes de poder llegar al dermatólogo. El tratamiento puede incluir el uso de cremas, ungüentos y lociones tópicas para tratar infecciones, inflamación y resequedad de la piel. También puede recetar medicamentos orales para afecciones como el acné, la rosácea, alergias e infecciones virales, bacterianas o por hongos. En muchos casos, puede ser necesario un referido al dermatólogo para un diagnóstico preciso y un tratamiento especializado. A continuación algunos criterios que el médico primario debe considerar al referir un paciente al dermatólogo:
• Lesiones cutáneas sospechosas o cambiantes: Estas son una indicación clara para referir al paciente a un dermatólogo. Incluyen lunares nuevos o cambiantes, bultos o nódulos en la piel, y manchas rojas, blancas u oscuras. El dermatólogo puede evaluar estas lesiones y determinar si son benignas o malignas o realizar biopsias y pruebas adicionales si se sospecha que es cancerosa para tener un diagnóstico preciso y un tratamiento temprano.
• Afecciones de la piel que no responden al tratamiento: Una condición de la piel que no
Luis J. Ortiz-Espinosa, MD, FAAD


Dermatólogo de la red de proveedores de MCS y presidente de la Fundación Piel Puerto Rico
responde al tratamiento inicial necesitará una evaluación adicional de un dermatólogo. Los problemas de la piel que requieren consulta a un dermatólogo incluyen: acné severo, rosácea, eczema, psoriasis, enfermedades endocrinas o inmunológicas con manifestación en la piel, pérdida de cabello y alergias severas crónicas. Los dermatólogos pueden evaluar la condición y prescribir tratamientos más avanzados, ya sean medicamentos orales, sistémicos (ej. biológicos), terapia de luz, láser u otras tecnologías.
• Enfermedades infecciosas de la piel: Algunas infecciones cutáneas, como las causadas por hongos, bacterias o virus, pueden requerir tratamiento especializado. Una infección cutánea que no responde al tratamiento o se vuelve recurrente necesita una evaluación de un dermatólogo para hacerle biopsia o cultivo. El dermatólogo puede prescribir tratamientos específicos como antimicóticos, antibióticos o antivirales, y monitorear la afección hasta que se resuelva.
• Lesiones en la piel que pueden ser cancerosas: Si un médico primario sospecha que una afección de la piel puede ser cancerosa primaria o metastásica, debe consultar al dermatólogo de inmediato. Los cánceres de piel como el melanoma pueden propagarse rápidamente si no se detectan y tratan a tiempo. Los
dermatólogos pueden realizar una biopsia de la lesión y determinar si es maligna o benigna. En algunos casos, también se requerirá consultar al cirujano u oncólogo o radioterapeuta para el manejo de éstos.
Los pacientes con enfermedades crónicas como la diabetes o la enfermedad renal pueden ser más susceptibles a afecciones de la piel. Estas pueden incluir úlceras cutáneas, infecciones y trastornos inflamatorios. Además, muchas condiciones internas tienen manifestaciones en la piel que suelen ser difíciles de diagnosticar, por lo que una consulta al dermatólogo puede hacer la diferencia.
En fin, son múltiples las maneras en que el médico primario puede ayudar al paciente con afecciones dermatológicas. Además de atender su necesidad inmediata para evitar que espere un tiempo prolongado en lo que puede visitar un especialista, el personal de la oficina del médico primario puede asistir en la coordinación de la cita con el dermatólogo cuando se identifique la necesidad de una consulta urgente como, por ejemplo, cuando una lesión le parezca sospechosa de cáncer. El diagnóstico temprano e intervención rápida confirma la importancia del trabajo en equipo entre el médico primarios y el dermatólogo, y puede proteger al paciente de complicaciones o efectos adversos prevenibles.
Revista Puertorriqueña de Medicina y Salud Pública 25



26 Revista Puertorriqueña de Medicina y Salud Pública
787.758.2500 | www.mcsclassicare.com ¡Con MCS estás EXTRA querido!
@MCSPuertoRico
Dr. Eric Adler Cirujano Plástico Facial
te brinda beneficios EXTRA para que tengas salud completa. Con más de 13,000 proveedores de salud
de toda la isla y varios programas de bienestar,
tú mereces estar
querido.
Dr. Álvarez Romagosa Ginecólogo/Obstetra
MCS
alrededor
porque
extra

For moderate to severe rheumatoid arthritis (RA) in adult TNFi-IR patients1

EXPECTATIONS
EXPECTATIONS
CHALLENGE TREATMENT GOALS IN RA WITH A ONCE-DAILY ORAL JAK INHIBITOR
CHALLENGE TREATMENT GOALS IN RA WITH A ONCE-DAILY ORAL JAK INHIBITOR
RINVOQ met primary (ACR20 or ACR50 at Week 12 or 14) and ranked secondary endpoints in clinical trials, with some patients achieving ACR20 as early as Week 1 in SELECT-BEYOND1-3,a,b
RINVOQ met primary (ACR20 or ACR50 at Week 12 or 14) and ranked secondary endpoints in clinical trials, with some patients achieving ACR20 as early as Week 1 in SELECT-BEYOND1-3,a,b
LONG-TERM REMISSION AND LOW DISEASE ACTIVITY DATA observed up to 84 weeks with or without MTX1,3-6
LONG-TERM REMISSION AND LOW DISEASE ACTIVITY DATA observed up to 84 weeks with or without MTX1,3-6
• DAS28-CRP<2.6* and DAS28-CRP≤3.2 evaluated at Week 12 or 14, with response rates from 60 to 84 weeks (in SELECT-BEYOND and SELECT-MONOTHERAPY, respectively)
Discover
• DAS28-CRP<2.6* and DAS28-CRP≤3.2 evaluated at Week 12 or 14, with response rates from 60 to 84 weeks (in SELECT-BEYOND and SELECT-MONOTHERAPY, respectively)
*Clinical remission does not mean drug-free remission or complete absence of disease activity.
Clinical remission does not mean drug-free remission or complete absence of disease activity.
LONG-TERM SAFETY DATA
AEs observed in long-term analysis with ~4.5 years maximum and ~2.6 years median exposure to RINVOQ 15 mg as of 6/30/207,a,b
LONG-TERM SAFETY DATA
AEs observed in long-term analysis with ~4.5 years maximum and ~2.6 years median exposure to RINVOQ 15 mg as of 6/30/207,a,b
• >4400 patients evaluated on upadacitinib,c with >7000 patientyears of long-term exposure to RINVOQ 15 mg as of 6/30/207,a,b
• >4400 patients evaluated on upadacitinib,c with >7000 patientyears of long-term exposure to RINVOQ 15 mg as of 6/30/207,a,b
our commitment to exceptional access and patient support at RinvoqHCPPR.com
Discover our commitment to






exceptional access and patient support at RinvoqHCPPR.com
a SELECT-EARLY (RA-I; MTX-naïve) [primary endpoint at Week 12: ACR50 response vs MTX, select ranked secondary endpoint at Week 24: Δ mTSS vs MTX]; SELECT-MONOTHERAPY (RA-II; MTX-IR) [primary endpoint at Week 14: ACR20 response vs MTX, select ranked secondary endpoints at Week 14: DAS28-CRP<2.6 vs MTX, DAS28-CRP≤3.2 vs MTX]; SELECT-NEXT (RA-III; csDMARD-IR) [RINVOQ + csDMARD; primary endpoint at Week 12: ACR20 response vs placebo + csDMARD]; SELECT-COMPARE (RA-IV; MTX-IR) [RINVOQ + MTX; primary endpoint at Week 12: ACR20 response vs placebo + MTX, select ranked secondary endpoints at Week 26: Δ mTSS vs placebo + MTX]; SELECT-BEYOND (RA-V; bDMARD-IR) [RINVOQ + csDMARD; primary endpoint at Week 12: ACR20 response vs placebo + csDMARD, select ranked secondary endpoints at Week 12: DAS28-CRP≤3.2 vs placebo + csDMARD.] 1,2 bSELECT-CHOICE (bDMARD-IR) [RINVOQ + csDMARDs; primary endpoint at Week 12: Δ DAS28-CRP (noninferiority) vs active comparator + csDMARDs]. 8
c RINVOQ 15 mg; upadacitinib 30 mg; RINVOQ 15 mg is the approved dose.1,7
INDICATION1
a SELECT-EARLY (RA-I; MTX-naïve) [primary endpoint at Week 12: ACR50 response vs MTX, select ranked secondary endpoint at Week 24: Δ mTSS vs MTX]; SELECT-MONOTHERAPY (RA-II; MTX-IR) [primary endpoint at Week 14: ACR20 response vs MTX, select ranked secondary endpoints at Week 14: DAS28-CRP<2.6 vs MTX, DAS28-CRP≤3.2 vs MTX]; SELECT-NEXT (RA-III; csDMARD-IR) [RINVOQ + csDMARD; primary endpoint at Week 12: ACR20 response vs placebo + csDMARD]; SELECT-COMPARE (RA-IV; MTX-IR) [RINVOQ + MTX; primary endpoint at Week 12: ACR20 response vs placebo + MTX, select ranked secondary endpoints at Week 26: Δ mTSS vs placebo + MTX]; SELECT-BEYOND (RA-V; bDMARD-IR) [RINVOQ + csDMARD; primary endpoint at Week 12: ACR20 response vs placebo + csDMARD, select ranked secondary endpoints at Week 12: DAS28-CRP≤3.2 vs placebo + csDMARD.] 1,2 bSELECT-CHOICE (bDMARD-IR) [RINVOQ + csDMARDs; primary endpoint at Week 12: Δ DAS28-CRP (noninferiority) vs active comparator + csDMARDs]. 8 c RINVOQ 15 mg; upadacitinib 30 mg; RINVOQ 15 mg is the approved dose.1,7
RINVOQ is indicated for the treatment of adults with moderately to severely active rheumatoid arthritis who have had an inadequate response or intolerance to one or more TNF blockers.
INDICATION1



RINVOQ is indicated for the treatment of adults with moderately to severely active rheumatoid arthritis who have had an inadequate response or intolerance to one or more TNF blockers.
Limitation of Use: Use of RINVOQ in combination with other JAK inhibitors, biologic DMARDs, or with potent immunosuppressants, such as azathioprine and cyclosporine, is not recommended.
Malignancies: Lymphoma and other malignancies have been observed in RINVOQ-treated patients. A higher rate of malignancies (excluding non-melanoma skin cancer [NMSC]), lymphomas, and lung cancer (in current or past smokers) was observed with another JAK inhibitor when compared with TNF blockers in RA patients. Patients who are current or past smokers are at additional increased risk.
Malignancies: Lymphoma and other malignancies have been observed in RINVOQ-treated patients. A higher rate of malignancies (excluding non-melanoma skin cancer [NMSC]), lymphomas, and lung cancer (in current or past smokers) was observed with another JAK inhibitor when compared with TNF blockers in RA patients. Patients who are current or past smokers are at additional increased risk.
SAFETY CONSIDERATIONS1
Limitation of Use: Use of RINVOQ in combination with other JAK inhibitors, biologic DMARDs, or with potent immunosuppressants, such as azathioprine and cyclosporine, is not recommended.
Major Adverse Cardiovascular Events: A higher rate of CV death, myocardial infarction, and stroke was observed with a JAK inhibitor in a study comparing another JAK inhibitor with TNF blockers in RA patients ≥50 years of age with at least one CV risk factor. Current or past smokers are at additional increased risk.
SAFETY CONSIDERATIONS1
Serious Infections: Patients treated with RINVOQ are at increased risk for developing serious infections that may lead to hospitalization or death. These infections include tuberculosis (TB), invasive fungal, bacterial, viral, and other infections due to opportunistic pathogens. Most patients who developed these infections were taking concomitant immunosuppressants, such as methotrexate or corticosteroids.
Serious Infections: Patients treated with RINVOQ are at increased risk for developing serious infections that may lead to hospitalization or death. These infections include tuberculosis (TB), invasive fungal, bacterial, viral, and other infections due to opportunistic pathogens. Most patients who developed these infections were taking concomitant immunosuppressants, such as methotrexate or corticosteroids.
Mortality: A higher rate of all-cause mortality, including sudden cardiovascular (CV) death, was observed with a Janus kinase (JAK) inhibitor in a study comparing another JAK inhibitor with tumor necrosis factor (TNF) blockers in rheumatoid arthritis (RA) patients ≥50 years of age with at least one CV risk factor.
Mortality: A higher rate of all-cause mortality, including sudden cardiovascular (CV) death, was observed with a Janus kinase (JAK) inhibitor in a study comparing another JAK inhibitor with tumor necrosis factor (TNF) blockers in rheumatoid arthritis (RA) patients ≥50 years of age with at least one CV risk factor.
Major Adverse Cardiovascular Events: A higher rate of CV death, myocardial infarction, and stroke was observed with a JAK inhibitor in a study comparing another JAK inhibitor with TNF blockers in RA patients ≥50 years of age with at least one CV risk factor. Current or past smokers are at additional increased risk.
Thrombosis: Thrombosis, including deep venous thrombosis, pulmonary embolism, and arterial thrombosis have occurred in patients treated with JAK inhibitors used to treat inflammatory conditions. A higher rate of thrombosis was observed with another JAK inhibitor when compared with TNF blockers in RA patients.
Hypersensitivity: RINVOQ is contraindicated in patients with known hypersensitivity to upadacitinib or any of its excipients.
Thrombosis: Thrombosis, including deep venous thrombosis, pulmonary embolism, and arterial thrombosis have occurred in patients treated with JAK inhibitors used to treat inflammatory conditions. A higher rate of thrombosis was observed with another JAK inhibitor when compared with TNF blockers in RA patients.
Hypersensitivity: RINVOQ is contraindicated in patients with known hypersensitivity to upadacitinib or any of its excipients.
Other Serious Adverse Reactions: Hypersensitivity Reactions (anaphylaxis and angioedema), Gastrointestinal Perforations, Laboratory Abnormalities (neutropenia, lymphopenia, anemia, lipid elevations, liver enzyme elevations), and Embryo-Fetal Toxicity.
Please see additional Important Safety Information, including BOXED WARNING on Serious Infections, Mortality, Malignancies, Major Adverse Cardiovascular Events, and Thrombosis, on the previous page of this advertisement.
Other Serious Adverse Reactions: Hypersensitivity Reactions (anaphylaxis and angioedema), Gastrointestinal Perforations, Laboratory Abnormalities (neutropenia, lymphopenia, anemia, lipid elevations, liver enzyme elevations), and Embryo-Fetal Toxicity.
Please see Brief Summary of full Prescribing Information on previous pages of this advertisement.
ACR=American College of Rheumatology; AEs=adverse events; bDMARD=biologic DMARD; csDMARD=conventional synthetic DMARD; DAS28-CRP=Disease Activity Score 28 joints, C-reactive protein; DMARD=disease-modifying antirheumatic drug; HAQ-DI=Health Assessment
Please see additional Important Safety Information, including BOXED WARNING on Serious Infections, Mortality, Malignancies, Major Adverse Cardiovascular Events, and Thrombosis, on the previous page of this advertisement. Please see Brief Summary of full Prescribing Information on previous pages of this advertisement.
Questionnaire Disability Index; IR=intolerance or inadequate response; JAK=Janus kinase; mTSS=modified total Sharp score; MTX=methotrexate; TNFi=tumor necrosis factor inhibitor.
ACR=American College of Rheumatology; AEs=adverse events; bDMARD=biologic DMARD; csDMARD=conventional synthetic DMARD; DAS28-CRP=Disease Activity Score 28 joints, C-reactive protein; DMARD=disease-modifying antirheumatic drug; HAQ-DI=Health Assessment Questionnaire Disability Index; IR=intolerance or inadequate response; JAK=Janus kinase; mTSS=modified total Sharp score; MTX=methotrexate; TNFi=tumor necrosis factor inhibitor.
28 Revista Puertorriqueña de Medicina y Salud Pública
RINVOQ® (RIN-VOKE) (upadacitinib) extended-release tablets, for oral use
WARNING: SERIOUS INFECTIONS, MORTALITY, MALIGNANCY, MAJOR ADVERSE CARDIOVASCULAR EVENTS, and THROMBOSIS SERIOUS INFECTIONS
Patients treated with RINVOQ are at increased risk for developing serious infections that may lead to hospitalization or death [see Warnings and Precautions, Adverse Reactions]. Most patients who developed these infections were taking concomitant immunosuppressants such as methotrexate or corticosteroids. If a serious infection develops, interrupt RINVOQ until the infection is controlled.
Reported infections include:
• Active tuberculosis, which may present with pulmonary or extrapulmonary disease. Patients should be tested for latent tuberculosis before RINVOQ use and during therapy. Treatment for latent infection should be considered prior to RINVOQ use.
• Invasive fungal infections, including cryptococcosis and pneumocystosis.
• Bacterial, viral, including herpes zoster, and other infections due to opportunistic pathogens.
The risks and benefits of treatment with RINVOQ should be carefully considered prior to initiating therapy in patients with chronic or recurrent infection.
Patients should be closely monitored for the development of signs and symptoms of infection during and after treatment with RINVOQ, including the possible development of tuberculosis in patients who tested negative for latent tuberculosis infection prior to initiating therapy [see Warnings and Precautions]
MORTALITY
In a large, randomized, postmarketing safety study in rheumatoid arthritis (RA) patients 50 years of age and older with at least one cardiovascular risk factor comparing another Janus kinase (JAK) inhibitor to tumor necrosis factor (TNF) blockers, a higher rate of all-cause mortality, including sudden cardiovascular death, was observed with the JAK inhibitor [see Warnings and Precautions]
MALIGNANCIES
Lymphoma and other malignancies have been observed in patients treated with RINVOQ. In RA patients treated with another JAK inhibitor, a higher rate of malignancies (excluding non-melanoma skin cancer (NMSC)) was observed when compared with TNF blockers. Patients who are current or past smokers are at additional increased risk [see Warnings and Precautions].
MAJOR ADVERSE CARDIOVASCULAR EVENTS
In RA patients 50 years of age and older with at least one cardiovascular risk factor treated with another JAK inhibitor, a higher rate of major adverse cardiovascular events (MACE) (defined as cardiovascular death, myocardial infarction, and stroke), was observed when compared with TNF blockers. Patients who are current or past smokers are at additional increased risk. Discontinue RINVOQ in patients that have experienced a myocardial infarction or stroke [see Warnings and Precautions].
THROMBOSIS
Thrombosis, including deep venous thrombosis, pulmonary embolism, and arterial thrombosis have occurred in patients treated with JAK inhibitors used to treat inflammatory conditions. Many of these adverse events were serious and some resulted in death. In RA patients 50 years of age and older with at least one cardiovascular risk factor treated with another JAK inhibitor, a higher rate of thrombosis was observed when compared with TNF blockers. Avoid RINVOQ in patients at risk. Patients with symptoms of thrombosis should discontinue RINVOQ and be promptly evaluated [see Warnings and Precautions]
INDICATIONS AND USAGE
Rheumatoid Arthritis
RINVOQ® is indicated for the treatment of adults with moderately to severely active rheumatoid arthritis who have had an inadequate response or intolerance to one or more TNF blockers.
• Limitations of Use: Use of RINVOQ in combination with other JAK inhibitors, biologic disease-modifying antirheumatic drugs (DMARDs), or with potent immunosuppressants such as azathioprine and cyclosporine, is not recommended.
Psoriatic Arthritis
RINVOQ is indicated for the treatment of adults with active psoriatic arthritis who have had an inadequate response or intolerance to one or more TNF blockers.
• Limitations of Use: Use of RINVOQ in combination with other JAK inhibitors, biologic DMARDs, or with potent immunosuppressants such as azathioprine and cyclosporine, is not recommended.
Atopic Dermatitis
RINVOQ is indicated for the treatment of adults and pediatric patients
12 years of age and older with refractory, moderate to severe atopic dermatitis whose disease is not adequately controlled with other systemic drug products, including biologics, or when use of those therapies are inadvisable.
• Limitations of Use: RINVOQ is not recommended for use in combination with other JAK inhibitors, biologic immunomodulators, or with other immunosuppressants.
Ulcerative Colitis
RINVOQ is indicated for the treatment of adult patients with moderately to severely active ulcerative colitis who have had an inadequate response or intolerance to one or more TNF blockers.
• Limitations of Use: RINVOQ is not recommended for use in combination with other JAK inhibitors, biological therapies for ulcerative colitis, or with potent immunosuppressants such as azathioprine and cyclosporine.
Ankylosing Spondylitis
RINVOQ is indicated for the treatment of adults with active ankylosing spondylitis who have had an inadequate response or intolerance to one or more TNF blockers.
• Limitations of Use: Use of RINVOQ in combination with other JAK inhibitors, biologic DMARDs, or with potent immunosuppressants such as azathioprine and cyclosporine, is not recommended.
CONTRAINDICATIONS
PROFESSIONAL BRIEF SUMMARY
CONSULT PACKAGE INSERT FOR FULL PRESCRIBING INFORMATION
RINVOQ is contraindicated in patients with known hypersensitivity to upadacitinib or any of its excipients [see Warnings and Precautions].
WARNINGS AND PRECAUTIONS
Serious Infections
Serious and sometimes fatal infections have been reported in patients receiving RINVOQ. The most frequent serious infections reported with RINVOQ included pneumonia and cellulitis [see Adverse Reactions]. Among opportunistic infections, tuberculosis, multidermatomal herpes zoster, oral/esophageal candidiasis, and cryptococcosis, were reported with RINVOQ.
Avoid use of RINVOQ in patients with an active, serious infection, including localized infections. Consider the risks and benefits of treatment prior to initiating RINVOQ in patients:
• with chronic or recurrent infection
• who have been exposed to tuberculosis
• with a history of a serious or an opportunistic infection
• who have resided or traveled in areas of endemic tuberculosis or endemic mycoses; or
• with underlying conditions that may predispose them to infection. Closely monitor patients for the development of signs and symptoms of infection during and after treatment with RINVOQ. Interrupt RINVOQ if a patient develops a serious or opportunistic infection.
A patient who develops a new infection during treatment with RINVOQ should undergo prompt and complete diagnostic testing appropriate for an immunocompromised patient; appropriate antimicrobial therapy should be initiated, the patient should be closely monitored, and RINVOQ should be interrupted if the patient is not responding to antimicrobial therapy. RINVOQ may be resumed once the infection is controlled.
Tuberculosis
Evaluate and test patients for latent and active tuberculosis (TB) infection prior to administration of RINVOQ. Patients with latent TB should be treated with standard antimycobacterial therapy before initiating RINVOQ. RINVOQ should not be given to patients with active TB. Consider anti-TB therapy prior to initiation of RINVOQ in patients with previously untreated latent TB or active TB in whom an adequate course of treatment cannot be confirmed, and for patients with a negative test for latent TB but who have risk factors for TB infection.
Consultation with a physician with expertise in the treatment of TB is recommended to aid in the decision about whether initiating anti-TB therapy is appropriate for an individual patient.
During RINVOQ use, monitor patients for the development of signs and symptoms of TB, including patients who tested negative for latent TB infection prior to initiating therapy.
Viral Reactivation

Viral reactivation, including cases of herpes virus reactivation (e.g., herpes zoster) and hepatitis B virus reactivation, were reported in clinical trials with RINVOQ [see Adverse Reactions]. The risk of herpes zoster appears to be higher in patients treated with RINVOQ in Japan. If a patient develops herpes zoster, consider temporarily interrupting RINVOQ until the episode resolves. Screening for viral hepatitis and monitoring for reactivation should be performed in accordance with clinical guidelines before starting and during therapy with RINVOQ. Patients who were positive for hepatitis C antibody and hepatitis C virus RNA, were excluded from clinical trials. Patients who were positive for hepatitis B surface antigen or hepatitis B virus DNA were excluded from clinical trials. However, cases of hepatitis B reactivation were still reported in patients enrolled in the Phase 3 trials of RINVOQ. If hepatitis B virus DNA is detected while receiving RINVOQ, a liver specialist should be consulted.
Mortality
In a large, randomized, postmarketing safety study of another JAK inhibitor in RA patients 50 years of age and older with at least one cardiovascular risk factor, a higher rate of all-cause mortality, including sudden cardiovascular death, was observed in patients treated with the JAK inhibitor compared with TNF blockers.
Consider the benefits and risks for the individual patient prior to initiating or continuing therapy with RINVOQ.
Malignancy and Lymphoproliferative Disorders
Malignancies, including lymphomas, were observed in clinical trials of RINVOQ [see Adverse Reactions]
In a large, randomized, postmarketing safety study of another JAK inhibitor in RA patients, a higher rate of malignancies (excluding non-melanoma skin cancer (NMSC)) was observed in patients treated with the JAK inhibitor compared to those treated with TNF blockers. A higher rate of lymphomas was observed in patients treated with the JAK inhibitor compared to those treated with TNF blockers. A higher rate of lung cancers was observed in current or past smokers treated with the JAK inhibitor compared to those treated with TNF blockers. In this study, current or past smokers had an additional increased risk of overall malignancies.
Consider the benefits and risks for the individual patient prior to initiating or continuing therapy with RINVOQ, particularly in patients with a known malignancy (other than a successfully treated NMSC), patients who develop a malignancy when on treatment, and patients who are current or past smokers.
Non-Melanoma Skin Cancer
NMSCs have been reported in patients treated with RINVOQ. Periodic skin examination is recommended for patients who are at increased risk for skin cancer.
Exposure to sunlight and UV light should be limited by wearing protective clothing and using a broad-spectrum sunscreen.
Major Adverse Cardiovascular Events
In a large, randomized, postmarketing safety study of another JAK inhibitor in RA patients 50 years of age and older with at least one cardiovascular risk factor, a higher rate of major adverse cardiovascular events (MACE) defined as cardiovascular death, non-fatal myocardial infarction (MI), and non-fatal stroke was observed with the JAK inhibitor compared to those treated with TNF blockers. Patients who are current or past smokers are at additional increased risk.
Consider the benefits and risks for the individual patient prior to initiating or continuing therapy with RINVOQ, particularly in patients who are current or past smokers and patients with other cardiovascular risk factors. Patients
should be informed about the symptoms of serious cardiovascular events and the steps to take if they occur. Discontinue RINVOQ in patients that have experienced a myocardial infarction or stroke.
Thrombosis
Thrombosis, including deep venous thrombosis (DVT), pulmonary embolism (PE), and arterial thrombosis, have occurred in patients treated for inflammatory conditions with JAK inhibitors, including RINVOQ. Many of these adverse events were serious and some resulted in death.
In a large, randomized, postmarketing safety study of another JAK inhibitor in RA patients 50 years of age and older with at least one cardiovascular risk factor, higher rates of overall thrombosis, DVT, and PE were observed compared to those treated with TNF blockers.
If symptoms of thrombosis occur, patients should discontinue RINVOQ and be evaluated promptly and treated appropriately. Avoid RINVOQ in patients that may be at increased risk of thrombosis.
Hypersensitivity Reactions
Serious hypersensitivity reactions such as anaphylaxis and angioedema were reported in patients receiving RINVOQ in clinical trials. If a clinically significant hypersensitivity reaction occurs, discontinue RINVOQ and institute appropriate therapy [see Adverse Reactions].
Gastrointestinal Perforations
Gastrointestinal perforations have been reported in clinical trials with RINVOQ.
Monitor RINVOQ-treated patients who may be at risk for gastrointestinal perforation (e.g., patients with a history of diverticulitis or taking NSAIDs).
Evaluate promptly patients presenting with new onset abdominal pain for early identification of gastrointestinal perforation.
Laboratory Abnormalities
Neutropenia
Treatment with RINVOQ was associated with an increased incidence of neutropenia (ANC less than 1000 cells/mm3).
Evaluate neutrophil counts at baseline and thereafter according to routine patient management. Avoid RINVOQ initiation and interrupt RINVOQ treatment in patients with a low neutrophil count (i.e., ANC less than 1000 cells/mm3).
Lymphopenia
ALC less than 500 cells/mm3 were reported in RINVOQ-treated patients in clinical trials.
Evaluate lymphocyte counts at baseline and thereafter according to routine patient management. Avoid RINVOQ initiation or interrupt RINVOQ treatment in patients with a low lymphocyte count (i.e., less than 500 cells/mm3).
Anemia
Decreases in hemoglobin levels to less than 8 g/dL were reported in RINVOQ-treated patients in clinical trials.
Evaluate hemoglobin at baseline and thereafter according to routine patient management. Avoid RINVOQ initiation or interrupt RINVOQ treatment in patients with a low hemoglobin level (i.e., less than 8 g/dL).
Lipids
Treatment with RINVOQ was associated with increases in lipid parameters, including total cholesterol, low-density lipoprotein (LDL) cholesterol, and high-density lipoprotein (HDL) cholesterol [see Adverse Reactions]
Elevations in LDL cholesterol decreased to pre-treatment levels in response to statin therapy. The effect of these lipid parameter elevations on cardiovascular morbidity and mortality has not been determined.
Assess lipid parameters approximately 12 weeks after initiation of treatment, and thereafter according to the clinical guidelines for hyperlipidemia. Manage patients according to clinical guidelines for the management of hyperlipidemia.
Liver Enzyme Elevations
Treatment with RINVOQ was associated with increased incidence of liver enzyme elevations compared to treatment with placebo.
Evaluate liver enzymes at baseline and thereafter according to routine patient management. Prompt investigation of the cause of liver enzyme elevation is recommended to identify potential cases of drug-induced liver injury.
If increases in ALT or AST are observed during routine patient management and drug-induced liver injury is suspected, RINVOQ should be interrupted until this diagnosis is excluded.
Embryo-Fetal Toxicity
Based on findings in animal studies, RINVOQ may cause fetal harm when administered to a pregnant woman. Administration of upadacitinib to rats and rabbits during organogenesis caused increases in fetal malformations. Verify the pregnancy status of patients of reproductive potential prior to starting treatment. Advise females of reproductive potential of the potential risk to the fetus and to use effective contraception during treatment with RINVOQ and for 4 weeks following completion of therapy [see Use in
Specific Populations]
Vaccinations
Avoid use of live vaccines during, or immediately prior to, RINVOQ therapy. Prior to initiating RINVOQ, it is recommended that patients be brought up to date with all immunizations, including varicella zoster or prophylactic herpes zoster vaccinations, in agreement with current immunization guidelines.
ADVERSE REACTIONS
The following clinically significant adverse reactions are described elsewhere in the labeling:
• Serious Infections [see Warnings and Precautions]
• Mortality [see Warnings and Precautions]
• Malignancy and Lymphoproliferative Disorders [see Warnings and Precautions]
• Major Adverse Cardiovascular Events [see Warnings and Precautions]
• Thrombosis [see Warnings and Precautions]
• Hypersensitivity Reactions [see Warnings and Precautions]
• Gastrointestinal Perforations [see Warnings and Precautions]
• Laboratory Abnormalities [see Warnings and Precautions]
Clinical Trials Experience
Because clinical trials are conducted under widely varying conditions, adverse reaction rates observed in the clinical trials of a drug cannot be directly compared to rates in the clinical trials of another drug and may not reflect the rates observed in practice.
30 Revista Puertorriqueña de Medicina y Salud Pública
20071734 Rinvoq PB-7.625 x 10.5(3.5).indd 1 04 May 2022 9:00 AM US-RNQR-220149
Adverse Reactions in Patients with Rheumatoid Arthritis
A total of 3833 patients with rheumatoid arthritis were treated with upadacitinib in the Phase 3 clinical trials of whom 2806 were exposed for at least one year.
Patients could advance or switch to RINVOQ 15 mg from placebo, or be rescued to RINVOQ from active comparator or placebo from as early as Week 12 depending on the trial design.
A total of 2630 patients received at least 1 dose of RINVOQ 15 mg, of whom 1860 were exposed for at least one year. In trials RA-I, RA-II, RA-III and RA-V, 1213 patients received at least 1 dose of RINVOQ 15 mg, of which 986 patients were exposed for at least one year, and 1203 patients received at least 1 dose of upadacitinib 30 mg, of which 946 were exposed for at least one year.
Table 1: Adverse Reactions Reported in ≥ 1% of Rheumatoid Arthritis
Patients Treated with RINVOQ 15 mg in Placebo-controlled Trials
treated with RINVOQ 15 mg monotherapy, and 4 patients (3.2 per 100 patient-years) treated with upadacitinib 30 mg monotherapy.
12-Month Exposure Dataset: Opportunistic infections were reported in 7 patients (0.6 per 100 patient-years) treated with RINVOQ 15 mg and 15 patients (1.4 per 100 patient-years) treated with upadacitinib 30 mg.
Malignancies
Placebo-controlled Trials: In RA-III, RA-IV, and RA-V, malignancies excluding NMSC were reported in 1 patient (0.4 per 100 patient-years) treated with placebo, and 1 patient (0.4 per 100 patient-years) treated with RINVOQ 15 mg. In RA-III and RA-V, malignancies excluding NMSC were reported in 0 patients treated with placebo, 1 patient (1.1 per 100 patient-years) treated with RINVOQ 15 mg, and 3 patients (3.5 per 100 patient-years) treated with upadacitinib 30 mg.
MTX-controlled Trials: Malignancies excluding NMSC were reported in 1 patient (0.8 per 100 patient-years) treated with MTX monotherapy, 3 patients (2.4 per 100 patient-years) treated with RINVOQ 15 mg monotherapy, and 0 patients treated with upadacitinib 30 mg monotherapy.
12-Month Exposure Dataset: Malignancies excluding NMSC were reported in 13 patients (1.2 per 100 patient-years) treated with RINVOQ 15 mg and 14 patients (1.3 per 100 patient-years) treated with upadacitinib 30 mg.
Gastrointestinal Perforations
Placebo-controlled Trials: There were no gastrointestinal perforations (based on medical review) reported in patients treated with placebo, RINVOQ 15 mg, and upadacitinib 30 mg.
and 0.7% of patients in the RINVOQ 15 mg and placebo groups, respectively. In RA-III and RA-V, decreases in lymphocyte counts below 500 cells/mm3 in at least one measurement occurred in 0.5% of patients treated with placebo, 0.5% of patients treated with RINVOQ 15 mg, and 2.4% of patients treated with upadacitinib 30 mg.
Anemia
In placebo-controlled trials (RA-III, RA-IV, and RA-V) with background DMARDs, for up to 12/14 weeks, hemoglobin decreases below 8 g/dL in at least one measurement occurred in <0.1% of patients in both the RINVOQ 15 mg and placebo groups. In RA-III and RA-V, hemoglobin decreases below 8 g/dL in at least one measurement were observed in 0.3% of patients treated with placebo, and none in patients treated with RINVOQ 15 mg and upadacitinib 30 mg.
Adverse Reactions in Patients with Psoriatic Arthritis
A total of 1827 patients with psoriatic arthritis were treated with upadacitinib in clinical trials representing 1639.2 patient-years of exposure, of whom 722 were exposed to upadacitinib for at least one year. In the two Phase 3 trials, 907 patients received at least 1 dose of RINVOQ 15 mg, of whom 359 were exposed for at least one year.
Two placebo-controlled trials were integrated (640 patients on RINVOQ 15 mg once daily and 635 patients on placebo) to evaluate the safety of RINVOQ 15 mg in comparison to placebo for up to 24 weeks after treatment initiation.
*URTI includes: acute sinusitis, laryngitis, nasopharyngitis, oropharyngeal pain, pharyngitis, pharyngotonsillitis, rhinitis, sinusitis, tonsillitis, viral upper respiratory tract infection
Other adverse reactions reported in less than 1% of patients in the RINVOQ 15 mg group and at a higher rate than in the placebo group through Week 12 included pneumonia, herpes zoster, herpes simplex (includes oral herpes), and oral candidiasis.
Four integrated datasets are presented in the Specific Adverse Reaction section:
Placebo-controlled Trials: Trials RA-III, RA-IV, and RA-V were integrated to represent safety through 12/14 weeks for placebo (n=1042) and RINVOQ 15 mg (n=1035). Trials RA-III and RA-V were integrated to represent safety through 12 weeks for placebo (n=390), RINVOQ 15 mg (n=385), and upadacitinib 30 mg (n=384). Trial RA-IV did not include the 30 mg dose and, therefore, safety data for upadacitinib 30 mg can only be compared with placebo and RINVOQ 15 mg rates from pooling trials RA-III and RA-V.
MTX-controlled Trials: Trials RA-I and RA-II were integrated to represent safety through 12/14 weeks for MTX (n=530), RINVOQ 15 mg (n=534), and upadacitinib 30 mg (n=529).
12-Month Exposure Dataset: Trials RA-I, II, III, and V were integrated to represent the long-term safety of RINVOQ 15 mg (n=1213) and upadacitinib 30 mg (n=1203).
Exposure adjusted incidence rates were adjusted by trial for all the adverse events reported in this section.
Specific Adverse Reactions
Infections
Placebo-controlled Trials: In RA-III, RA-IV, and RA-V, infections were reported in 218 patients (95.7 per 100 patient-years) treated with placebo and 284 patients (127.8 per 100 patient-years) treated with RINVOQ 15 mg. In RA-III and RA-V, infections were reported in 99 patients (136.5 per 100 patient-years) treated with placebo, 118 patients (164.5 per 100 patient-years) treated with RINVOQ 15 mg, and 126 patients (180.3 per 100 patient-years) treated with upadacitinib 30 mg.
MTX-controlled Trials: Infections were reported in 127 patients (119.5 per 100 patient-years) treated with MTX monotherapy, 104 patients (91.8 per 100 patient-years) treated with RINVOQ 15 mg monotherapy, and 128 patients (115.1 per 100 patient-years) treated with upadacitinib 30 mg monotherapy.
12-Month Exposure Dataset: Infections were reported in 615 patients (83.8 per 100 patient-years) treated with RINVOQ 15 mg and 674 patients (99.7 per 100 patient-years) treated with upadacitinib 30 mg.
Serious Infections
Placebo-controlled Trials: In RA-III, RA-IV, and RA-V, serious infections were reported in 6 patients (2.3 per 100 patient-years) treated with placebo, and 12 patients (4.6 per 100 patient-years) treated with RINVOQ 15 mg. In RA-III and RA-V, serious infections were reported in 1 patient (1.2 per 100 patientyears) treated with placebo, 2 patients (2.3 per 100 patient-years) treated with RINVOQ 15 mg, and 7 patients (8.2 per 100 patient-years) treated with upadacitinib 30 mg.
MTX-controlled Trials: Serious infections were reported in 2 patients (1.6 per 100 patient-years) treated with MTX monotherapy, 3 patients (2.4 per 100 patient-years) treated with RINVOQ 15 mg monotherapy, and 8 patients (6.4 per 100 patient-years) treated with upadacitinib 30 mg monotherapy.
12-Month Exposure Dataset: Serious infections were reported in 38 patients (3.5 per 100 patient-years) treated with RINVOQ 15 mg and 59 patients (5.6 per 100 patient-years) treated with upadacitinib 30 mg.
The most frequently reported serious infections were pneumonia and cellulitis.
Tuberculosis
Placebo-controlled Trials and MTX-controlled Trials: In the placebo-controlled period, there were no active cases of tuberculosis reported in the placebo, RINVOQ 15 mg, and upadacitinib 30 mg groups. In the MTX-controlled period, there were no active cases of tuberculosis reported in the MTX monotherapy, RINVOQ 15 mg monotherapy, and upadacitinib 30 mg monotherapy groups.

12-Month Exposure Dataset: Active tuberculosis was reported for 2 patients treated with RINVOQ 15 mg and 1 patient treated with upadacitinib 30 mg.
Cases of extra-pulmonary tuberculosis were reported.
Opportunistic Infections (excluding tuberculosis)
Placebo-controlled Trials: In RA-III, RA-IV, and RA-V, opportunistic infections were reported in 3 patients (1.2 per 100 patient-years) treated with placebo, and 5 patients (1.9 per 100 patient-years) treated with RINVOQ 15 mg. In RA-III and RA-V, opportunistic infections were reported in 1 patient (1.2 per 100 patient-years) treated with placebo, 2 patients (2.3 per 100 patient-years) treated with RINVOQ 15 mg, and 6 patients (7.1 per 100 patient-years) treated with upadacitinib 30 mg.
MTX-controlled Trials: Opportunistic infections were reported in 1 patient (0.8 per 100 patient-years) treated with MTX monotherapy, 0 patients
MTX-controlled Trials: There were no cases of gastrointestinal perforations reported in the MTX and RINVOQ 15 mg group through 12/14 weeks. Two cases of gastrointestinal perforations were observed in the upadacitinib 30 mg group.
12-Month Exposure Dataset: Gastrointestinal perforations were reported in 1 patient treated with RINVOQ 15 mg and 4 patients treated with upadacitinib 30 mg.
Thrombosis
Placebo-controlled Trials: In RA-IV, venous thrombosis (pulmonary embolism or deep vein thrombosis) was observed in 1 patient treated with placebo and 1 patient treated with RINVOQ 15 mg. In RA-V, venous thrombosis was observed in 1 patient treated with RINVOQ 15 mg. There were no observed cases of venous thrombosis reported in RA-III. No cases of arterial thrombosis were observed through 12/14 weeks.
MTX-controlled Trials: In RA-II, venous thrombosis was observed in 0 patients treated with MTX monotherapy, 1 patient treated with RINVOQ 15 mg monotherapy and 0 patients treated with upadacitinib 30 mg monotherapy through Week 14. In RA-II, no cases of arterial thrombosis were observed through 12/14 weeks. In RA-I, venous thrombosis was observed in 1 patient treated with MTX, 0 patients treated with RINVOQ 15 mg and 1 patient treated with upadacitinib 30 mg through Week 24. In RA-I, arterial thrombosis was observed in 1 patient treated with upadacitinib 30 mg through Week 24.
12-Month Exposure Dataset: Venous thrombosis events were reported in 5 patients (0.5 per 100 patient-years) treated with RINVOQ 15 mg and 4 patients (0.4 per 100 patient-years) treated with upadacitinib 30 mg.
Arterial thrombosis events were reported in 0 patients treated with RINVOQ 15 mg and 2 patients (0.2 per 100 patient-years) treated with upadacitinib 30 mg.
Laboratory Abnormalities
Hepatic Transaminase Elevations
In placebo-controlled trials (RA-III, RA-IV, and RA-V) with background DMARDs, for up to 12/14 weeks, alanine transaminase (ALT) and aspartate transaminase (AST) elevations ≥ 3 x upper limit of normal (ULN) in at least one measurement were observed in 2.1% and 1.5% of patients treated with RINVOQ 15 mg, and in 1.5% and 0.7% of patients treated with placebo, respectively. In RA-III and RA-V, ALT and AST elevations ≥ 3 x ULN in at least one measurement were observed in 0.8% and 1.0% of patients treated with RINVOQ 15 mg, 1.0% and 0% of patients treated with upadacitinib 30 mg and in 1.3% and 1.0% of patients treated with placebo, respectively.
In MTX-controlled trials, for up to 12/14 weeks, ALT and AST elevations ≥ 3 x ULN in at least one measurement were observed in 0.8% and 0.4% of patients treated with RINVOQ 15 mg, 1.7% and 1.3% of patients treated with upadacitinib 30 mg and in 1.9% and 0.9% of patients treated with MTX, respectively.
Lipid Elevations
Upadacitinib treatment was associated with dose-related increases in total cholesterol, triglycerides and LDL cholesterol. Upadacitinib was also associated with increases in HDL cholesterol. Elevations in LDL and HDL cholesterol peaked by Week 8 and remained stable thereafter. In controlled trials, for up to 12/14 weeks, changes from baseline in lipid parameters in patients treated with RINVOQ 15 mg and upadacitinib 30 mg, respectively, are summarized below:
• Mean LDL cholesterol increased by 14.81 mg/dL and 17.17 mg/dL.
• Mean HDL cholesterol increased by 8.16 mg/dL and 9.01 mg/dL.
• The mean LDL/HDL ratio remained stable.
• Mean triglycerides increased by 13.55 mg/dL and 14.44 mg/dL.
Creatine Phosphokinase Elevations
In placebo-controlled trials (RA-III, RA-IV, and RA-V) with background DMARDs, for up to 12/14 weeks, dose-related increases in creatine phosphokinase (CPK) values were observed. CPK elevations > 5 x ULN were reported in 1.0%, and 0.3% of patients over 12/14 weeks in the RINVOQ 15 mg and placebo groups, respectively. Most elevations >5 x ULN were transient and did not require treatment discontinuation. In RA-III and RA-V, CPK elevations > 5 x ULN were observed in 0.3% of patients treated with placebo, 1.6% of patients treated with RINVOQ 15 mg, and none in patients treated with upadacitinib 30 mg.
Neutropenia
In placebo-controlled trials (RA-III, RA-IV, and RA-V) with background DMARDs, for up to 12/14 weeks, dose-related decreases in neutrophil counts, below 1000 cells/mm3 in at least one measurement occurred in 1.1% and <0.1% of patients in the RINVOQ 15 mg and placebo groups, respectively. In RA-III and RA-V, decreases in neutrophil counts below 1000 cells/mm3 in at least one measurement occurred in 0.3% of patients treated with placebo, 1.3% of patients treated with RINVOQ 15 mg, and 2.4% of patients treated with upadacitinib 30 mg. In clinical trials, treatment was interrupted in response to ANC less than 1000 cells/mm3
Lymphopenia
In placebo-controlled trials (RA-III, RA-IV, and RA-V) with background DMARDs, for up to 12/14 weeks, dose-related decreases in lymphocyte counts below 500 cells/mm3 in at least one measurement occurred in 0.9%
Overall, the safety profile observed in patients with active psoriatic arthritis treated with RINVOQ 15 mg was consistent with the safety profile observed in patients with rheumatoid arthritis. During the 24-week placebo-controlled period, the frequencies of herpes zoster and herpes simplex were ≥1% (1.1% and 1.4%, respectively) with RINVOQ 15 mg and 0.8% and 1.3%, respectively with placebo. A higher incidence of acne and bronchitis was also observed in patients treated with RINVOQ 15 mg (1.3% and 3.9%, respectively) compared to placebo (0.3% and 2.7%, respectively).
Adverse Reactions in Patients with Atopic Dermatitis
Three Phase 3 (AD-1, AD-2, and AD-3) and one Phase 2b (AD-4) randomized, double-blind, placebo-controlled, multicenter trials evaluated the safety of RINVOQ in patients with moderate-to-severe atopic dermatitis. The majority of patients were White (68%) and male (57%). The mean age was 34 years (ranged from 12 to 75 years) and 13% of the patients were 12 to less than 18 years. In these 4 trials, 2612 patients were treated with RINVOQ 15 mg or 30 mg orally once daily, with or without concomitant topical corticosteroids (TCS).
In the Phase 3 clinical trials (AD-1, AD-2, and AD-3), a total of 1239 patients received RINVOQ 15 mg, of whom 791 were exposed for at least one year and 1246 patients received RINVOQ 30 mg, of whom 826 were exposed for at least one year.
Trials AD-1, AD-2, and AD-4 compared the safety of RINVOQ monotherapy to placebo through Week 16. Trial AD-3 compared the safety of RINVOQ + TCS to placebo + TCS through Week 16.
Weeks 0 to 16 (Trials AD-1 to AD-4)
In RINVOQ trials with and without TCS (Trials AD-1, 2, 3 and 4) through Week 16, the proportion of patients who discontinued treatment because of adverse reactions in the RINVOQ 15 mg, 30 mg and placebo groups were 2.3%, 2.9% and 3.8%, respectively. Table 2 summarizes the adverse reactions that occurred at a rate of at least 1% in the RINVOQ 15 mg or 30 mg groups during the first 16 weeks of treatment.
Table 2: Adverse Reactions Reported in ≥ 1% of Patients with Atopic Dermatitis Treated with RINVOQ 15 mg or 30 mg
* Includes: laryngitis, laryngitis viral, nasopharyngitis, oropharyngeal pain, pharyngeal abscess, pharyngitis, pharyngitis streptococcal, pharyngotonsillitis, respiratory tract infection, respiratory tract infection viral, rhinitis, rhinolaryngitis, sinusitis, tonsillitis, tonsillitis bacterial, upper respiratory tract infection, viral pharyngitis, viral upper respiratory tract infection
** Includes: acne and dermatitis acneiform
*** Includes: genital herpes, genital herpes simplex, herpes dermatitis, herpes ophthalmic, herpes simplex, nasal herpes, ophthalmic herpes simplex, herpes virus infection, oral herpes
**** Includes anaphylactic reaction, anaphylactic shock, angioedema, dermatitis exfoliative generalized, drug hypersensitivity, eyelid oedema, face oedema, hypersensitivity, periorbital swelling, pharyngeal swelling, swelling face, toxic skin eruption, type I hypersensitivity, urticaria
***** Includes abdominal pain and abdominal pain upper
****** Includes herpes zoster and varicella
Revista Puertorriqueña de Medicina y Salud Pública 31
Adverse Reaction Placebo RINVOQ 15 mg n=1042 (%) n=1035 (%) Upper respiratory tract infection (URTI)* 9.5 13.5 Nausea 2.2 3.5 Cough 1.0 2.2 Pyrexia 0 1.2
Adverse Reaction Placebo RINVOQ 15 mg RINVOQ 30 mg n=902 (%) n=899 (%) n=906 (%) Upper respiratory tract infection (URTI)* 17 23 25 Acne** 2 10 16 Herpes simplex*** 2 4 8 Headache 4 6 6 Increased blood creatine phosphokinase 2 5 6 Cough 1 3 3 Hypersensitivity**** 2 2 3 Folliculitis 1 2 3 Nausea 1 3 3 Abdominal pain***** 1 3 2 Pyrexia 1 2 2 Increased Weight 1 2 2 Herpes zoster****** 1 2 2 Influenza <1 2 2 Fatigue 1 1 2 Neutropenia <1 1 2 Myalgia 1 1 2 Influenza like illness 1 1 2
20071734 Rinvoq PB-7.625 x 10.5(3.5).indd 2 04 May 2022 9:00 AM US-RNQR-220149
Other adverse reactions reported in less than 1% of patients in the RINVOQ 15 mg and/or 30 mg group and at a higher rate than in the placebo group through Week 16 included anemia, oral candidiasis, pneumonia, and the adverse event of retinal detachment.
The safety profile of RINVOQ through Week 52 was generally consistent with the safety profile observed at Week 16.
Overall, the safety profile observed in patients with AD treated with RINVOQ was similar to the safety profile in patients with RA. Other specific adverse reactions that were reported in patients with AD included eczema herpeticum/Kaposi’s varicelliform eruption.
Eczema Herpeticum/Kaposi’s Varicelliform Eruption
Placebo-controlled Period (16 weeks): Eczema herpeticum was reported in 4 patients (1.6 per 100 patient-years) treated with placebo, 6 patients (2.2 per 100 patient-years) treated with RINVOQ 15 mg and 7 patients (2.6 per 100 patient-years) treated with RINVOQ 30 mg.
12-Month Exposure (Weeks 0 to 52): Eczema herpeticum was reported in 18 patients (1.6 per 100 patient-years) treated with RINVOQ 15 mg and 17 patients (1.5 per 100 patient-years) treated with RINVOQ 30 mg.
Adverse Reactions in Patients with Ulcerative Colitis
RINVOQ was studied up to 8 weeks in patients with moderately to severely active ulcerative colitis in two randomized, double-blind, placebo-controlled induction studies (UC-1, UC-2) and a randomized, double-blind, placebo controlled, dose-finding study (UC-4; NCT02819635). Long term safety up to 52-weeks was evaluated in patients who responded to induction therapy in a randomized, double-blind, placebo-controlled maintenance study (UC-3) and a long-term extension study.
In the two induction studies (UC-1, UC-2) and a dose finding study (UC-4), 1097 patients were enrolled of whom 719 patients received RINVOQ 45 mg once daily.
In the maintenance study (UC-3), 746 patients were enrolled of whom 250 patients received RINVOQ 15 mg once daily and 251 patients received RINVOQ 30 mg once daily.
Adverse reactions reported in ≥2% of patients in any treatment arm in the induction and maintenance studies are shown in Tables 3 and 4, respectively.
Table 3. Adverse Reactions Reported in ≥2% of Patients with Ulcerative Colitis Treated with RINVOQ 45 mg in Placebo-Controlled Induction Studies (UC-1, UC-2 and UC-4)
Specific Adverse Reactions
Serious Infections
Induction Studies: In UC-1, UC-2, and UC-4, serious infections were reported in 5 patients (8.4 per 100 patient-years) treated with placebo and 9 patients (8.4 per 100 patient-years) treated with RINVOQ 45 mg through 8 weeks. Placebo-controlled Maintenance Study: In UC-3, serious infections were reported in 8 patients (6.3 per 100 patient-years) treated with placebo, 8 patients (4.5 per 100 patient-years) treated with RINVOQ 15 mg, and 6 patients (3.1 per 100 patient-years) treated with RINVOQ 30 mg through 52 weeks.
Laboratory Abnormalities
Hepatic Transaminase Elevations
In studies UC-1, UC-2, and UC-4, elevations of ALT to ≥ 3 x ULN in at least one measurement were observed in 1.5% of patients treated with RINVOQ 45 mg, and 0% of patients treated with placebo for 8 weeks. AST elevations to ≥ 3 x ULN occurred in 1.5% of patients treated with RINVOQ 45 mg, and 0.3% of patients treated with placebo. Elevations of ALT to ≥ 5 x ULN occurred in 0.4% of patients treated with RINVOQ 45 mg and 0% of patients treated with placebo.
In UC-3, elevations of ALT to ≥ 3 x ULN in at least one measurement were observed in 4% of patients treated with RINVOQ 30 mg, 2% of patients treated with RINVOQ 15 mg, and 0.8% of patients treated with placebo for 52 weeks. Elevations of AST to ≥ 3 x ULN in at least one measurement were observed in 2% of patients treated with RINVOQ 30 mg, 1.6% of patients treated with RINVOQ 15 mg and 0.4% of patients treated with placebo. Elevations of ALT to ≥ 5 x ULN were observed in 0.8% of patients treated with 30 mg, 0.4% of patients treated with 15 mg, and 0.4% of patients treated with placebo.
Overall, laboratory abnormalities observed in patients with ulcerative colitis treated with RINVOQ were similar to those described in patients with RA.
Adverse Reactions in Patients with Ankylosing Spondylitis
A total of 596 patients with ankylosing spondylitis were treated with RINVOQ 15 mg in the two clinical trials representing 577.3 patient-years of exposure, of whom 228 were exposed to RINVOQ 15 mg for at least one year.
Overall, the safety profile observed in patients with active ankylosing spondylitis treated with RINVOQ 15 mg was consistent with the safety profile observed in patients with rheumatoid arthritis and psoriatic arthritis.
During the 14-week placebo-controlled period in Trial AS-I, the frequency of headache was 5.4% with RINVOQ 15 mg and 2.1% with placebo. During the 14-week placebo-controlled period in Trial AS-II, the frequency of headache was 3.3% with RINVOQ 15 mg and 1.4% with placebo.
DRUG INTERACTIONS
Strong CYP3A4 Inhibitors
Upadacitinib exposure is increased when RINVOQ is co-administered with a strong CYP3A4 inhibitor (such as ketoconazole and clarithromycin), which may increase the risk of RINVOQ adverse reactions. Monitor patients closely for adverse reactions when co-administering RINVOQ 15 mg once daily with strong CYP3A4 inhibitors.
For patients with atopic dermatitis, coadministration of RINVOQ 30 mg once daily with strong CYP3A4 inhibitors is not recommended. For patients with ulcerative colitis taking strong CYP3A4 inhibitors, reduce the RINVOQ induction dosage to 30 mg once daily. The recommended maintenance dosage is 15 mg once daily.
Strong CYP3A4 Inducers
15 mg dose, 0.9 times the 30 mg dose, and 0.6 times the MRHD (on an AUC basis at maternal oral doses of 5 mg/kg/day and higher). Additional skeletal malformations (bent forelimbs/hindlimbs and rib/vertebral defects) and decreased fetal body weights were observed in the absence of maternal toxicity at an exposure approximately 84 times the 15 mg dose, 43 times the 30 mg dose, and 31 times the MRHD (on an AUC basis at a maternal oral dose of 75 mg/kg/day).
In a second oral embryo-fetal development study, pregnant rats received upadacitinib at doses of 1.5 and 4 mg/kg/day during the period of organogenesis from gestation day 6 to 17. Upadacitinib was teratogenic (skeletal malformations that included bent humerus and scapula) at exposures approximately 1.6 times the 15 mg dose, 0.8 times the 30 mg dose, and 0.6 times the MRHD (on an AUC basis at maternal oral doses of 4 mg/kg/day). No developmental toxicity was observed in rats at an exposure approximately 0.29 times the 15 mg dose, 0.15 times the 30 mg dose, and 0.11 times the MRHD (on an AUC basis at a maternal oral dose of 1.5 mg/kg/day).
In an oral embryo-fetal developmental study, pregnant rabbits received upadacitinib at doses of 2.5, 10, and 25 mg/kg/day during the period of organogenesis from gestation day 7 to 19. Embryolethality, decreased fetal body weights, and cardiovascular malformations were observed in the presence of maternal toxicity at an exposure approximately 15 times the 15 mg dose, 7.6 times the 30 mg dose, and 5.6 times the MRHD (on an AUC basis at a maternal oral dose of 25 mg/kg/day). Embryolethality consisted of increased post-implantation loss that was due to elevated incidences of both total and early resorptions. No developmental toxicity was observed in rabbits at an exposure approximately 2.2 times the 15 mg dose, 1.1 times the 30 mg dose, and 0.82 times the MRHD (on an AUC basis at a maternal oral dose of 10 mg/kg/day).
In an oral pre- and post-natal development study, pregnant female rats received upadacitinib at doses of 2.5, 5, and 10 mg/kg/day from gestation day 6 through lactation day 20. No maternal or developmental toxicity was observed in either mothers or offspring, respectively, at an exposure approximately 3 times the 15 mg dose, 1.4 times the 30 mg dose, and at approximately the same exposure as the MRHD (on an AUC basis at a maternal oral dose of 10 mg/kg/day).
Lactation
Risk Summary
There are no data on the presence of upadacitinib in human milk, the effects on the breastfed infant, or the effects on milk production. Available pharmacodynamic/toxicological data in animals have shown excretion of upadacitinib in milk (see Data). When a drug is present in animal milk, it is likely that the drug will be present in human milk. Because of the potential for serious adverse reactions in the breastfed infant, advise patients that breastfeeding is not recommended during treatment with RINVOQ, and for 6 days (approximately 10 half-lives) after the last dose.
Data
A single oral dose of 10 mg/kg radiolabeled upadacitinib was administered to lactating female Sprague-Dawley rats on post-partum days 7-8. Drug exposure was approximately 30-fold greater in milk than in maternal plasma based on AUC0-t values. Approximately 97% of drug-related material in milk was parent drug.
Females and Males of Reproductive Potential
Pregnancy Testing
Verify the pregnancy status of females of reproductive potential prior to starting treatment with RINVOQ [see Use in Specific Populations]
* Composed of several similar terms
** Elevated liver enzymes composed of elevated ALT, AST, GGT, ALP, liver transaminases, hepatic enzymes, bilirubin, drug-induced liver injury and cholestasis.
Other adverse reactions reported in less than 2% of patients in the RINVOQ 45 mg group and at a higher rate than in the placebo group through Week 8 included herpes zoster and pneumonia.
Table 4. Adverse Reactions Reported in ≥2% of Patients with Ulcerative Colitis Treated with RINVOQ 15 mg or 30 mg in the Placebo-Controlled Maintenance Study (UC-3)1
Upadacitinib exposure is decreased when RINVOQ is co-administered with strong CYP3A4 inducers (such as rifampin), which may lead to reduced therapeutic effect of RINVOQ. Coadministration of RINVOQ with strong CYP3A4 inducers is not recommended.
USE IN SPECIFIC POPULATIONS
Pregnancy
Risk Summary
Available data from the pharmacovigilance safety database and postmarketing case reports on use of RINVOQ in pregnant women are not sufficient to evaluate a drug-associated risk for major birth defects or miscarriage. Based on animal studies, RINVOQ has the potential to adversely affect a developing fetus. Advise patients of reproductive potential and pregnant patients of the potential risk to the fetus.
In animal embryo-fetal development studies, oral upadacitinib administration to pregnant rats and rabbits at exposures equal to or greater than approximately 1.6 and 15 times the 15 mg dose, 0.8 and 7.6 times the 30 mg dose, and 0.6 and 5.6 times the maximum recommended human dose (MRHD) of 45 mg (on an AUC basis) resulted in dose-related increases in skeletal malformations (rats only), an increased incidence of cardiovascular malformations (rabbits only), increased post-implantation loss (rabbits only), and decreased fetal body weights in both rats and rabbits. No developmental toxicity was observed in pregnant rats and rabbits treated with oral upadacitinib during organogenesis at exposures approximately 0.29 and 2.2 times the 15 mg dose, 0.15 times and 1.1 times the 30 mg dose, and at 0.11 and 0.82 times the MHRD (on an AUC basis).
In a pre- and post-natal development study in pregnant female rats, oral upadacitinib administration at exposures approximately 3 times the 15 mg dose, 1.4 times the 30 mg dose, and the same as the MRHD (on an AUC basis) resulted in no maternal or developmental toxicity (see Data)
The background risks of major birth defects and miscarriage for the indicated populations are unknown. All pregnancies have a background risk of birth defect, loss, or other adverse outcomes. In the U.S. general population, the estimated background risk of major birth defects and miscarriages are 2-4% and 15-20%, respectively.
Report pregnancies to the AbbVie Inc.’s Adverse Event reporting line at 1-888-633-9110, or FDA at 1-800-FDA-1088 or www.fda.gov/medwatch.
Clinical Considerations
Disease-Associated Maternal and/or Embryo/Fetal Risk
1 Patients who were responders to 8 weeks induction therapy with RINVOQ 45 mg once daily
* Composed of several similar terms
** Elevated liver enzymes composed of elevated ALT, AST, GGT, ALP, liver transaminases, hepatic enzymes, bilirubin, drug-induced liver injury, and cholestasis.
The safety profile of RINVOQ in the long-term extension study was similar to the safety profile observed in the placebo-controlled induction and maintenance periods.
Overall, the safety profile observed in patients with ulcerative colitis treated with RINVOQ was generally similar to the safety profile in patients with RA and AD.
Published data suggest that increased disease activity is associated with the risk of developing adverse pregnancy outcomes in women with rheumatoid arthritis or ulcerative colitis. Adverse pregnancy outcomes include preterm delivery (before 37 weeks of gestation), low birth weight (less than 2500 g) infants, and small for gestational age at birth.
Data
Animal Data
In an oral embryo-fetal development study, pregnant rats received upadacitinib at doses of 5, 25, and 75 mg/kg/day during the period of organogenesis from gestation day 6 to 17. Upadacitinib was teratogenic (skeletal malformations that consisted of misshapen humerus and bent scapula) at exposures equal to or greater than approximately 1.7 times the
Contraception
Females
Based on animal studies, upadacitinib may cause embryo-fetal harm when administered to pregnant women [see Use in Specific Populations]. Advise female patients of reproductive potential to use effective contraception during treatment with RINVOQ and for 4 weeks after the final dose.
Pediatric Use
Juvenile Idiopathic Arthritis, Psoriatic Arthritis, and Ankylosing Spondylitis

The safety and effectiveness of RINVOQ in pediatric patients with juvenile idiopathic arthritis, psoriatic arthritis, and ankylosing spondylitis have not been established.
Atopic Dermatitis
The safety and effectiveness of RINVOQ in pediatric patients 12 years of age and older weighing at least 40 kg with atopic dermatitis have been established. A total of 344 pediatric patients aged 12 to 17 years with moderate to severe atopic dermatitis were randomized across three trials (AD-1, AD-2 and AD-3) to receive either RINVOQ 15 mg (N=114) or 30 mg (N=114) or matching placebo (N=116) in monotherapy or combination with topical corticosteroids. Efficacy was consistent between the pediatric patients and adults. The adverse reaction profile in the pediatric patients was similar to the adults [see Adverse Reactions].
The safety and effectiveness of RINVOQ in pediatric patients less than 12 years of age with atopic dermatitis have not been established.
Ulcerative Colitis
The safety and effectiveness of RINVOQ in pediatric patients with ulcerative colitis have not been established.
Geriatric Use
Rheumatoid Arthritis and Psoriatic Arthritis
Of the 4381 patients treated in the five clinical trials, a total of 906 rheumatoid arthritis patients were 65 years of age or older, including 146 patients 75 years and older. Of the 1827 patients treated in the two psoriatic arthritis Phase 3 clinical trials, a total of 274 patients were 65 years of age or older, including 34 patients 75 years and older. No differences in effectiveness were observed between these patients and younger patients; however, there was a higher rate of overall adverse events, including serious infections, in patients 65 years of age and older.
Atopic Dermatitis
Of the 2583 patients treated in the three Phase 3 clinical trials, a total of 120 patients with atopic dermatitis were 65 years of age or older, including 6 patients 75 years of age. No differences in effectiveness were observed between these patients and younger patients; however, there was a higher rate of serious infections and malignancies in those patients 65 years of age or older in the 30 mg dosing group in the long-term trials.
Ulcerative Colitis
Of the 1097 patients treated in the controlled clinical trials, a total of 95 patients with ulcerative colitis were 65 years and older. Clinical studies of RINVOQ did not include sufficient numbers of patients 65 years of age and older with ulcerative colitis to determine whether they respond differently from younger adult patients.
32 Revista Puertorriqueña de Medicina y Salud Pública
Adverse Reaction Placebo RINVOQ 45 mg Once Daily N= 378 (%) N = 719 (%) Upper respiratory tract infection* 7 9 Acne* 1 6 Increased blood creatine phosphokinase 1 5 Neutropenia* <1 5 Rash* 1 4 Elevated liver enzymes** 2 3 Lymphopenia* 1 3 Folliculitis 1 2 Herpes simplex* <1 2
Adverse Reaction Placebo RINVOQ 15 mg Once Daily RINVOQ 30 mg Once Daily n = 245 (%) n = 250 (%) n = 251 (%) Upper respiratory tract infection* 18 16 20 Increased blood creatine phosphokinase 2 6 8 Neutropenia* 2 3 6 Elevated liver enzymes** 1 6 4 Rash* 4 5 5 Herpes zoster 0 4 4 Folliculitis 2 2 4 Hypercholesterolemia* 1 2 4 Influenza 1 3 3 Herpes simplex* 1 2 3 Lymphopenia* 2 3 2 Hyperlipidemia* 0 2
2
20071734 Rinvoq PB-7.625 x 10.5(3.5).indd 3 04 May 2022 9:00 AM US-RNQR-220149
Renal Impairment
For patients with rheumatoid arthritis, psoriatic arthritis, and ankylosing spondylitis, no dosage adjustment is needed in patients with mild (eGFR 60 to < 90 mL/min/1.73 m2), moderate (eGFR 30 to < 60 mL/min/1.73 m2), or severe renal impairment (eGFR 15 to < 30 mL/min/1.73 m2).
For patients with atopic dermatitis, the maximum recommended dosage is 15 mg once daily for patients with severe renal impairment. No dosage adjustment is needed in patients with mild or moderate renal impairment. For patients with ulcerative colitis, the recommended dosage for severe renal impairment is 30 mg once daily for induction and 15 mg once daily for maintenance. No dosage adjustment is needed in patients with mild or moderate renal impairment.
RINVOQ has not been studied in patients with end stage renal disease (eGFR <15 mL/min/1.73m2). Use in patients with atopic dermatitis or ulcerative colitis with end stage renal disease is not recommended. Hepatic Impairment
The use of RINVOQ has not been studied in patients with severe hepatic impairment (Child Pugh C), and therefore not recommended for use in patients with rheumatoid arthritis, psoriatic arthritis, atopic dermatitis, ulcerative colitis, or ankylosing spondylitis.
For patients with rheumatoid arthritis, psoriatic arthritis, atopic dermatitis, and ankylosing spondylitis, no dosage adjustment is needed in patients with mild (Child Pugh A) or moderate (Child Pugh B) hepatic impairment. For patients with ulcerative colitis, the recommended dosage for mild to moderate hepatic impairment is 30 mg once daily for induction and 15 mg once daily for maintenance
PATIENT COUNSELING INFORMATION
Advise the patient to read the FDA-approved patient labeling (Medication Guide).
Serious Infections
Inform patients that they may be more likely to develop infections when taking RINVOQ. Instruct patients to contact their healthcare provider immediately during treatment if they develop any signs or symptoms of an infection [see Warnings and Precautions]
Advise patients that the risk of herpes zoster is increased in patients taking RINVOQ and in some cases can be serious [see Warnings and Precautions]
Malignancies
Inform patients that RINVOQ may increase their risk of certain cancers and that periodic skin examinations should be performed while using RINVOQ. Advise patients that exposure to sunlight and UV light should be limited by wearing protective clothing and using a broad-spectrum sunscreen [see Warnings and Precautions]
Major Adverse Cardiovascular Events
Inform patients that RINVOQ may increase their risk of major adverse cardiovascular events (MACE) including myocardial infarction, stroke,
and cardiovascular death. Instruct all patients, especially current or past smokers or patients with other cardiovascular risk factors, to be alert for the development of signs and symptoms of cardiovascular events [see Warnings and Precautions]
Thrombosis
Inform patients that events of deep venous thrombosis and pulmonary embolism have been reported in clinical trials with RINVOQ. Instruct patients to seek immediate medical attention if they develop any signs or symptoms of a DVT or PE [see Warnings and Precautions]
Hypersensitivity Reactions
Advise patients to discontinue RINVOQ and seek immediate medical attention if they develop any signs and symptoms of allergic reactions [see Warnings and Precautions].
Gastrointestinal Perforations
Inform patients that gastrointestinal perforations have been reported in clinical trials with RINVOQ and that risk factors include the use of NSAIDS or history of diverticulitis. Instruct patients to seek medical care immediately if they experience new onset of abdominal pain, fever, chills, nausea, or vomiting [see Warnings and Precautions].
Retinal Detachment

Inform patients that retinal detachment has been reported in clinical trials with RINVOQ. Advise patients to immediately inform their healthcare provider if they develop any sudden changes in vision while receiving RINVOQ [see Adverse Reactions]
Laboratory Abnormalities
Inform patients that RINVOQ may affect certain lab tests, and that blood tests are required before and during RINVOQ treatment [see Warnings and Precautions]
Vaccinations
Advise patients to avoid use of live vaccines with RINVOQ. Instruct patients to inform their healthcare practitioner that they are taking RINVOQ prior to a potential vaccination [see Warnings and Precautions] Embryo-Fetal Toxicity
Advise pregnant women and females of reproductive potential that exposure to RINVOQ during pregnancy may result in fetal harm. Advise females to inform their healthcare provider of a known or suspected pregnancy [see Warnings and Precautions and Use in Specific Populations]
Advise females of reproductive potential that effective contraception should be used during treatment and for 4 weeks following the final dose of upadacitinib [see Use in Specific Populations]
Advise females patients who are exposed to RINVOQ during pregnancy to contact AbbVie Inc. at 1-800-633-9110 or FDA at 1-800-FDA-1088 or www.fda.gov/medwatch.
Lactation
Advise women not to breastfeed during treatment with RINVOQ and for 6 days after the last dose [see Use in Specific Populations]
Administration Advise patients not to chew, crush, or split RINVOQ tablets. Manufactured by: AbbVie Inc., North Chicago, IL 60064, USA
RINVOQ® is a registered trademark of AbbVie Biotechnology Ltd.
©2019-2022 AbbVie Inc.
Ref: 20071734 Revised: April 2022
LAB-7082 MASTER
US-RNQR-220149
Revista Puertorriqueña de Medicina y Salud Pública 33
20071734 Rinvoq PB-7.625 x 10.5(3.5).indd 4 04 May 2022 9:00 AM US-RNQR-220149
MANIFESTACIONES NEUROPSIQUIÁTRICAS DEL PACIENTE CON ENFERMEDAD TIROIDEA
RESUMEN DEFINICIONES
La disfunción tiroidea es frecuentemente asociada con problemas cognitivos y condiciones psiquiátricos.
En hipotiroidismo nos encontramos comúnmente con disfunción cognitiva; disforia; y depresión. Con hipertiroidismo es común ver agitación; psicosis aguda y apatía.
En este artículo se resumen los hallazgos patofisiológicos que hasta el presente se han podido estudiar en las manifestaciones neuropsiquiátricas del paciente con desorden en función tiroidea.
• Deiodinasa: DIO1, DIO2, DIO3
• MCT8: transportador de hormona tiroidea al interior de la célula
• TR receptor : receptores de hormona tiroidea ( TRa1 TR b y otros subtipos)

• T4: tiroxina
• T3: triiodotironina
INTRODUCCIÓN
Los principales desordenes neuropsiquiátricos en condiciones tiroideas se pueden resumir en :(1)
Palabras
Hormona tiroidea, triiodotironina, tetraiodotiroxina, TSH (hormona estimuladora del tiroides), deiodinasa, demencia, depresión, depresión mayor severa, declive cognitivo, disforia, delirio.
HIPOTIROIDISMO
• Disminución en la capacidad cognitiva
• Pérdida de memoria
• Demencia
• Disforia
• Depresión
HIPERTIROIDISMO
• Agitación
• Apatía (principalmente en envejecientes)
• Manía
• Delirio
• Alucinaciones
• Psicosis
34 Revista Puertorriqueña de Medicina y Salud Pública
Clave:
La glándula tiroidea es uno de los órganos endocrinos primeros en formarse durante el desarrollo del embrión (2). En la circulación humana se detecta presencia de hormona tiroidea entre las 11-13 semanas de gestación (3). La glándula tiroidea es el único órgano que produce y almacena la hormona tiroidea. La glándula produce tiroxina (T4) en una cuantía mayor que triiodotironina (T3) que tiene la mayor actividad biológica.

El rol principal de la hormona tiroidea es regular el metabolismo; crecimiento celular; y su desarrollo.
En el sistema nervioso la actividad de la hormona tiroidea regula la diferenciación neuronal ya que tiene efectos en la neurogénesis, migración neuronal; diferenciación de la célula glial; mielinización y sinaptogénesis.
Jorge De Jesús Miranda MD FACE Endocrinólogo


Ex-Presidente Sociedad Puertorriqueña de Endocrinología y Diabetología
La insuficiencia de hormona tiroidea puede causar problemas cognitivos; de atención visual; procesamiento visual; habilidades motoras; problemas del lenguaje y la memoria.
Las alteraciones en la producción de hormona tiroidea también han sido relacionadas con desórdenes psiquiátricos tales como: esquizofrenia; el espectro del desorden bipolar; ansiedad y depresión. El mecanismo molecular detrás de estos efectos todavía se desconoce en su totalidad.
Algunas enfermedades neurológicas incluyendo la enfermedad de Alzhéimer; enfermedad de Parkinson; y la depresión tienen una clara relación con enfermedades del tiroides.
La producción de hormona tiroidea está bajo el control del ejehipotalámico-pituitario-tiroideo (HPT). Su
efecto (hormona tiroidea) a nivel celular depende de deiodinasas que convierten la tiroxina (T4) en triiodotironina (T3), (que es biológicamente mucho más activa que T4). Las acciones de las deiodinasas están en balance de acuerdo con la necesidad metabólica requerida por el individuo.
En adición, para que la hormona tiroidea pueda entrar a la célula requiere de un trasportador que pueda facilitar su paso a través de la membrana celular y lograr que la hormona active los receptores específicos para la hormona tiroidea (TRa1 y TRb1 y sus variantes) y así pueda lograr el efecto genómico propio de la hormona.
Existen efectos no genómicos de la hormona tiroidea en el sistema nervioso que todavía faltan por esclarecer, pero que pudieran tener mucha importancia clínica.
Revista Puertorriqueña de Medicina y Salud Pública 35
1
Figura
Como vemos este complejo grupo de señales puede alterarse en cualquier punto y así tener consecuencias en la producción o en la acción de las hormonas tiroideas (T4 y T3).
En la siguiente figura se resumen de forma esquemática los múltiples efectos de la hormona tiroidea en el tejido cerebral.
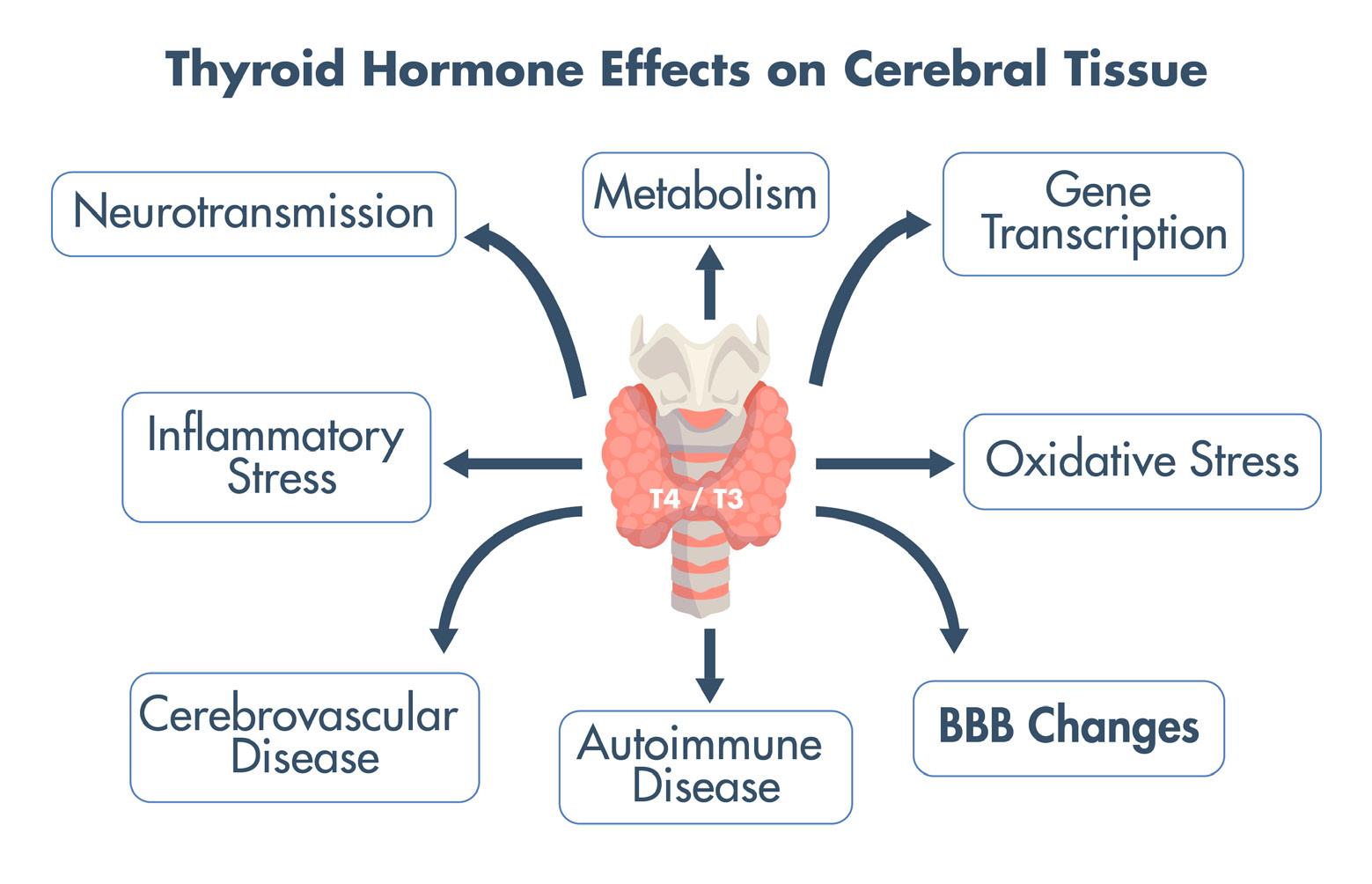
Por tomar un ejemplo, la mutación en el transportador de T3 a las células (MCT8) causa un defecto neurológico severo (síndrome de AllanHerdon-Dudley) ya que la triiodotironina no puede ser transportada a la neurona.
Hay variaciones genéticas en la deiodinasa-1 (DIO1) que producen alteraciones en los niveles de T4 en algunos adultos con depresión mayor severa. Estas variaciones afectan principalmente a mujeres.
En un estudio reciente llevado a cabo en Taiwán se encontró que en individuos mayores a 65 años, un historial de hipotiroidismo, estaba asociado a un 81 % de riesgo de ser diagnosticado con demencia (4). Esta relación fue más significativa entre aquellos individuos con hipotiroidismo tratados con levotiroxina.
Muchos pacientes con hipotiroidismo, tratados con levotiroxina y que tienen “niveles de hormonas normales en plasma” no se sienten óptimos: tienen síntomas de pobre memoria , concentración, y dificultad en mantener y peso deseado.
¿Será, que, por alguna razón, el sistema nervioso central no obtiene los niveles de T3 necesarios para funcionamiento óptimo?
La gran mayoría de los pacientes hipotiroideos utilizan levotiroxina T4. Un número significativo de pacientes prefieren utilizar extractos de hormona disecada que contiene T4 y T3 en una relación aproximada de 4:1. En condiciones normales la síntesis de
hormona tiroidea por nuestra glándula tiene una proporción de 14:1 (T4/T3).
(4)

En estas preparaciones de tiroides disecada es muy difícil titular la dosis exacta de T3 que se administra, lo cual puede tener consecuencias clínicas asociadas. Puede haber elevaciones en pico de concentración de T3, luego de la administración, y todavía no se sabe las implicaciones de seguridad que esto pueda tener.
Lo ideal es que podamos utilizar dosis sintéticas de T4 y T3 de acuerdo a las necesidades del paciente. Al presente al hacer esto el paciente paga un deducible por cada preparación y resulta oneroso.
En todo caso lo importante cuando fuese necesario utilizar combinaciones de T4/T3, es dar seguimiento los niveles del TSH.
LA INDUSTRIA FARMACÉUTICA ESTÁ ESTUDIANDO LA POSIBILIDAD DE MANUFACTURAR COMBINACIONES DE T4/T3 SINTÉTICAS, QUE SEAN SEGURAS, EFECTIVAS Y PREDECIBLES.
Las guías actuales recomiendan usar preferiblemente levotiroxina en el tratamiento de hipotiroidismo (5).
En aquel caso en que el paciente este tratado con levotiroxina, y las determinaciones de hormonas de tiroides por el laboratorio están normales,
y el paciente continua con síntomas residuales cognitivos, metabólicos y/o pobre calidad de vida;
Se pudiera considerar terapia combinada con la cautela de no sobremedicar al paciente con T3.
Un dilema clínico que enfrentamos comúnmente con otras condiciones clínicas que pueden confundir el cuadro clínico. La mayoría de los pacientes con hipotiroidismo son mujeres y cuando llegan a la menopausia los síntomas confunden, y aquí sería buena oportunidad de consultar a un colega ginecólogo que ayude en el manejo.
Otras condiciones clínicas como anemia; deficiencia de hierro; condiciones autoinmunes, pueden también confundir la sintomatología.
Si usted como clínico evalúa las variables que la sintomatología que paciente exhibe, entonces pudiera considerar terapia de combinación.
Se estima que como un 50-60% de los pacientes (que tuvieron síntomas residuales con levotiroxina) respondieron favorablemente a extractos de tiroides disecada.
En mi opinión, utilizar combinaciones sintéticas y predecibles seria mi preferencia. Pero… la mayoría de estos pacientes “prefieren las preparaciones de tiroides disecada” .
Si se va a utilizar una combinación de tiroxina con triiodotironina hay que reducir la dosis de tiroxina. Existen fórmulas que nos ayudan a determinar
36 Revista Puertorriqueña de Medicina y Salud Pública
las distintas modificaciones que debemos hacer en dosificación.
Lo más importante es que el paciente entienda las expectativas del este cambio, y que no todos van a responder de forma similar.
Nuestro sistema nervioso central funciona en base a niveles de triiodotironina. Se va a buscar el balance que mejor provea la T3 óptimo para el funcionamiento del sistema nervioso. El hipotálamo dirige los cambios para tener los niveles de T3 normales en todo momento.
DISCUSIÓN
Los datos que se resumen tienen una importancia clínica de gran relevancia en una población como la nuestra, envejeciente y en donde los problemas del tiroides predominan en la mujer.
En el estudio LAVOS(Latin America Vertebral Osteoporosis Study) (6) se encontró que en la muestra de mujeres entre las edades de 50 a 90 años el 24.2 % eran hipotiroideas. (Lavos)
Esto nos da una idea del riesgo aumentado de demencia en nuestra población de mujeres envejecientes.
Como clínicos debemos hacer la diferencia y preguntar aquello que preocupa pero que el paciente no verbaliza.
De particular interés en la mujer postmenopáusica en donde el rigor del control hormonal es esencial para evitar problemas cardiovasculares, osteoporosis y comorbilidades asociadas.

En ese mismo estudio “LAVOS” muchas de las mujeres estudiadas con hipotiroidismo no estaban en control.
Nuestra población envejeciente es frágil. La mayoría viven solos y si añadimos la demencia están a la deriva.
CONCLUSIÓN
En todo paciente con síntomas de depresión, o trastornos neuropsiquiátricos debeos hacer una evaluación de la función tiroidea del mismo.
El hipotiroidismo es mas común en la mujer al igual que la enfermedad de
Alzheimer. Debemos pues estar atentos a la posibilidad de trastornos cognitivos en esta población.
Un particular interés a la mujer postmenopáusica en donde podemos tener un riesgo aumentado de hipotiroidismo y a la vez desordenes cognitivos.
REFERENCIAS
- Pathopysiologial and Clinical Features of Neuropsychiatric Manifestations of Thyroid Disease Marilu Jurado- Flores ;Firas Warda; Arshag Mooradian J Endo Soc. 2022;(6)
- Davis CL. Description of a human embryo having twenty paired somites; - 1923
- Thyroid Hormone : Sex dependent role in nervous system regulation Baksi and Pradman (2021) 12:25
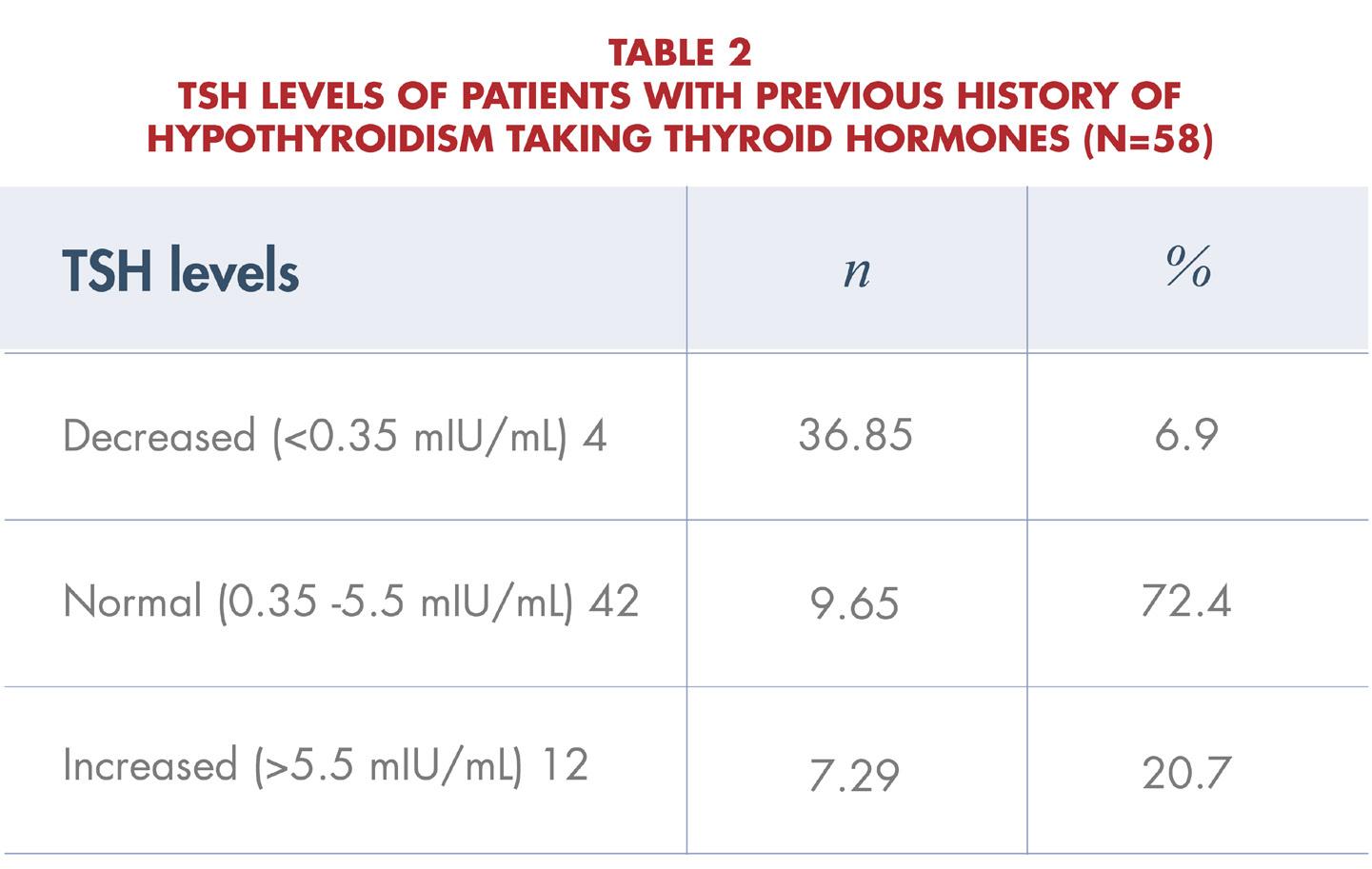
- Hypothyroidism Tied to Increased Risk of Dementia Weng; Lin Neurology published online July 6, 2022
- Why Hesitancy in Recommending Combination T3/T4 Therapy? Medscape May 25, 2023 Kanisha Dosai, MD Antonio Bianco, MD PhD

Revista Puertorriqueña de Medicina y Salud Pública 37
LA PRUEBA DE VIH: PUERTA DE ENTRADA HACIA EL TRATAMIENTO O LA PREVENCIÓN
Palabras Clave: Prueba de VIH, Virus de Inmunodeficiencia Humana, Ending the HIV Epidemic, Antirretrovirales, Indetectable = Intransmisible.
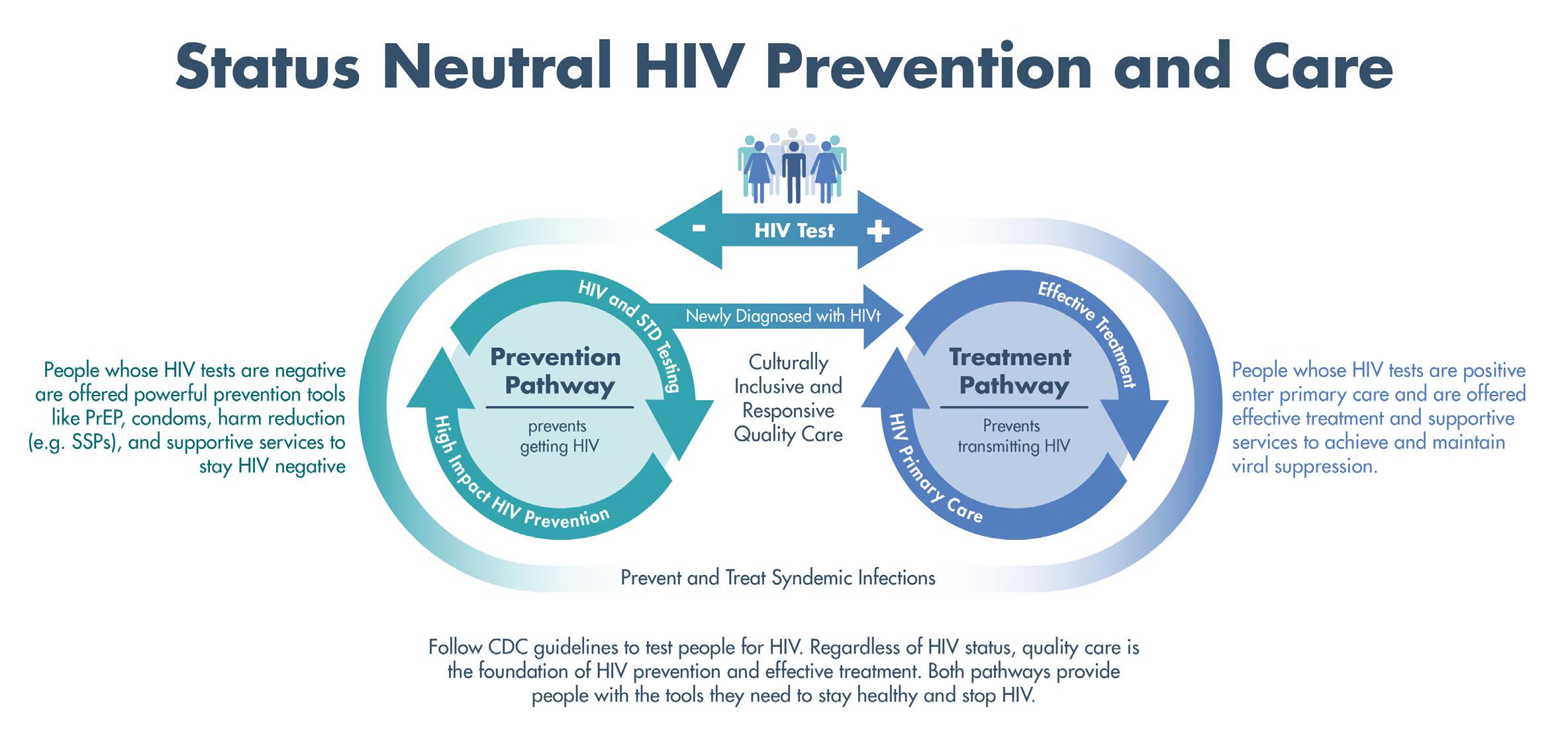

RESUMEN
Los proveedores de salud primaria están en primera fila para mejorar las tasas de detección del VIH. La detección y enlace a tratamiento temprano se asocia con una reducción de morbilidad, mortalidad y transmisión del VIH. Por otro lado, se les puede ofrecer herramientas efectivas de prevención a las personas con resultados negativos.
ARTÍCULO
Las estadísticas de vigilancia de VIH/ SIDA del Departamento de Salud de Puerto Rico reportan los diagnósticos acumulados desde el comienzo de la epidemia. Hasta el 31 de mayo de
2023, se había alcanzado 51,610 casos en personas puertorriqueñas, incluyendo menores de 13 años. El 66% de los diagnósticos ocurrieron en personas entre las edades de 25 y 44 años. Dado el estado actual del VIH/ SIDA en Puerto Rico, es importante mirar hacia el futuro y lo que se puede hacer para abordar la epidemia en la isla. Desde que se reconocieron los primeros casos de SIDA en Estados Unidos en 1981, han ocurrido muchos avances en la lucha contra el VIH/ SIDA. Estos avances han provocado una conversación distinta entre los proveedores de salud. Ahora podemos dialogar sobre el comienzo del final de la epidemia de VIH/SIDA.
La Estrategia Nacional contra el VIH/ SIDA (2022-2025) proporciona el método para acelerar los esfuerzos para poner fin a la epidemia del VIH en los Estados Unidos para 2030. Como parte de esta estrategia, en el 2019 se anunció Ending the HIV Epidemic, un plan con varias metas ambiciosas incluyendo la reducción del 75% en las nuevas infecciones por el VIH para 2025 y una reducción del 90% para 2030. Ending the HIV Epidemic identificó 57 jurisdicciones de Estados Unidos altamente afectadas por el VIH y San Juan, Puerto Rico es una de ellas. El plan aspira hacer seguimiento de todos los casos de VIH, intervenir para detener la transmisión y vincular a las personas
38 Revista Puertorriqueña de Medicina y Salud Pública
de la comunidad con los recursos adecuados de tratamiento, atención y prevención. Hay mucho trabajo por hacer, pero también tenemos varias herramientas que permiten que las metas propuestas sean alcanzables.
En años recientes se ha adquirido mejor entendimiento del uso de los antirretrovirales. Las terapias se han expandido e incluyen fármacos dentro de 6 clases principales. Gracias a estos medicamentos y a su gran efectividad, existen reducciones dramáticas en morbilidad y mortalidad. La infección por VIH ya no es una sentencia de muerte; es una enfermedad crónica manejable.

Para muchos individuos las terapias consisten en 3 ingredientes. Sin embargo, está ocurriendo un cambio de paradigma muy notable al obtener
¿Pero cómo se logra el vínculo al tratamiento o a la prevención de VIH y se asegura un cuidado de salud de alta calidad para los pacientes? Haciendo la prueba de VIH. Estudios han demostrado que cuando un proveedor de salud recomienda la prueba del VIH, ocurre un impacto significativo sobre la decisión de un paciente de hacerse la prueba. Teniendo esto en cuenta, los proveedores de salud desempeñan un papel crucial para que las personas se hagan la prueba de VIH de manera rutinaria. Los Centros para el Control y Prevención de Enfermedades (CDC, por sus en inglés) recomiendan que todas las personas entre los 13 y 64 años se hagan la prueba del VIH al menos una vez, como parte de su cuidado primario. Otras situaciones clave para ofrecer esta prueba son:
Marisel Bosques Rosado, MD, AAHIVS Infectóloga
Presidenta de HIV Treaters Medical Association of Puerto Rico
eficacia extraordinaria al utilizar regímenes con solo dos ingredientes. En adición, se están utilizando medicamentos inyectables de larga duración con excelentes resultados. El tratamiento no solo produce los beneficios de salud que ya conocemos en la persona que vive con el virus, sino que también se ha convertido en un arma poderosa para reducir la transmisión de la infección. Esto garantiza una reducción de riesgo de infección en las parejas de aquellos que viven con VIH y, por ende, a la comunidad. Precisamente de esto se trata la campaña “indetectable es igual a intransmisible” (I = I). Significa que una persona que vive con VIH que está bajo tratamiento y tiene carga viral indetectable no puede transmitir el VIH por medio de relaciones sexuales. Esta campaña se lanzó después
• Al iniciar tratamiento de tuberculosis.
• Al buscar tratamiento para una infección de transmisión sexual (ITS)

• Al iniciar una nueva relación sexual.
• Como parte del panel de rutina de pruebas de detección prenatal.
La detección rutinaria del VIH reduce el estigma en torno a las pruebas del VIH. Aunque la identificación de comportamientos que aumentan el riesgo de contraer el VIH es importante, a veces esta búsqueda provoca que las personas se sientan señaladas o juzgadas. Es más probable que los pacientes acepten la prueba de VIH recomendada cuando se ofrece de forma rutinaria a todos y no se basa en una evaluación de riesgo. El proceso debe ser tan usual como las muestras de
de que se realizaran tres grandes estudios – PARNTER, Opposites Attract y PARTNER2 - sobre la transmisión sexual del VIH en miles de parejas serodiscordantes (una pareja viviendo con el VIH y la otra no). No hubo transmisión de VIH a la pareja negativa de una persona bajo tratamiento y con supresión virológica en ninguno de los estudios. La supresión viral se definió como menos de 200 copias de VIH por mililitro de sangre.
Mas allá, ahora podemos utilizar los medicamentos antirretrovirales como herramientas efectivas para la prevención del VIH en personas que no han adquirido el virus. Existen 3 medicamentos aprobados por la Administración de Drogas y Alimentos (FDA, por sus siglas en ingles) y están descritos en la tabla 2.
colesterol, glucosa en sangre, antígeno prostático u otras pruebas que se ofrecerían de manera habitual según la edad y el sexo al nacer del paciente. La adopción de este enfoque normaliza el proceso de evaluación y análisis del riesgo del VIH a medida que los pacientes esperan estos servicios dentro de su atención primaria.
En adición, las pruebas de detección rutinarias favorecen a que se pierdan menos diagnósticos. El proceso recomendado por los CDC consta de dos pasos: detección inicial con una prueba de antígeno-anticuerpo, seguida por una prueba de diferenciación de VIH-1/2 y/o prueba de ácido nucleico (carga viral) a las muestras reactivas para confirmar el diagnóstico.
Revista Puertorriqueña de Medicina y Salud Pública 39
Finalmente, según los resultados, se puede dirigir a los pacientes hacia la prevención o el tratamiento contra el VIH. En algunos casos, también es importante tener un proceso de referencia establecido para vincular rápidamente a los pacientes al cuidado de salud que se merecen.



40 Revista Puertorriqueña de Medicina y Salud Pública
Tabla 2


Revista Puertorriqueña de Medicina y Salud Pública 41
ATENCIÓN: ORGANIZACIONES SIN FINES DE LUCRO
ATENCIÓN:
ATENCIÓN:
ORGANIZACIONES
ATENCIÓN: ORGANIZACIONES SIN FINES DE LUCRO
ORGANIZACIONES
SIN FINES DE LUCRO
ATENCIÓN:
ORGANIZACIONES
SIN FINES DE LUCRO
ATENCIÓN:
Nos enorgullece anunciar el inicio de los Programas de Ayuda: Ciclo 2024, a través de los cuales financiamos proyectos relacionados a la salud de los senos y el cáncer de seno.
SIN FINES DE LUCRO
ORGANIZACIONES
Nos enorgullece anunciar el inicio de los Programas de Ayuda: Ciclo 2024, a través de los cuales financiamos proyectos relacionados a la salud de los senos y el cáncer de seno.
SIN FINES DE LUCRO

ATENCIÓN: ORGANIZACIONES SIN FINES DE LUCRO
Nos enorgullece anunciar el inicio de los Programas de Ayuda: Ciclo 2024, a través de los cuales financiamos proyectos relacionados a la salud de los senos y el cáncer de seno.
Nos enorgullece anunciar el inicio de los Programas de Ayuda: Ciclo 2024, a través de los cuales financiamos proyectos relacionados a la salud de los senos y el cáncer de seno.
ATENCIÓN: ORGANIZACIONES SIN FINES DE LUCRO
Son elegibles para solicitar fondos: organizaciones sin fines de lucro registradas en el Departamento de Estado, con fuertes lazos en la comunidad, que provean servicios en Puerto Rico, incluyendo Vieques y Culebra.
Nos enorgullece anunciar el inicio de los Programas de Ayuda: Ciclo 2024, a través de los cuales financiamos proyectos relacionados a la salud de los senos y el cáncer de seno.
Son elegibles para solicitar fondos: organizaciones sin fines de lucro registradas en el Departamento de Estado, con fuertes lazos en la comunidad, que provean servicios en Puerto Rico, incluyendo Vieques y Culebra.
Nos enorgullece anunciar el inicio de los Programas de Ayuda: Ciclo 2024, a través de los cuales financiamos proyectos relacionados a la salud de los senos y el cáncer de seno.
Son elegibles para solicitar fondos: organizaciones sin fines de lucro registradas en el Departamento de Estado, con fuertes lazos en la comunidad, que provean servicios en Puerto Rico, incluyendo Vieques y Culebra.
Nos enorgullece anunciar el inicio de los Programas de Ayuda: Ciclo 2024, a través de los cuales financiamos proyectos relacionados a la salud de los senos y el cáncer de seno.
REGÍSTRATE AQUÍ EN NUESTRO TALLER DE CUMPLIMIENTO (ES REQUERIDO ASISTIR PARA SOMETER PROPUESTAS)
Son elegibles para solicitar fondos: organizaciones sin fines de lucro registradas en el Departamento de Estado, con fuertes lazos en la comunidad, que provean servicios en Puerto Rico, incluyendo Vieques y Culebra.
Nos enorgullece anunciar el inicio de los Programas de Ayuda: Ciclo 2024, a través de los cuales financiamos proyectos relacionados a la salud de los senos y el cáncer de seno.
DE CUMPLIMIENTO (ES REQUERIDO ASISTIR PARA SOMETER PROPUESTAS)
Son elegibles para solicitar fondos: organizaciones sin fines de lucro registradas en el Departamento de Estado, con fuertes lazos en la comunidad, que provean servicios en Puerto Rico, incluyendo Vieques y Culebra.
REGÍSTRATE AQUÍ EN NUESTRO TALLER DE CUMPLIMIENTO (ES REQUERIDO ASISTIR PARA SOMETER PROPUESTAS)
Son elegibles para solicitar fondos: organizaciones sin fines de lucro registradas en el Departamento de Estado, con fuertes lazos en la comunidad, que provean servicios en Puerto Rico, incluyendo Vieques y Culebra.
1 DE AGOSTO SAN JUAN
Son elegibles para solicitar fondos: organizaciones sin fines de lucro registradas en el Departamento de Estado, con fuertes lazos en la comunidad, que provean servicios en Puerto Rico, incluyendo Vieques y Culebra.
2 DE AGOSTO FAJARDO
ASISTIR PARA SOMETER PROPUESTAS)
REGÍSTRATE AQUÍ EN NUESTRO TALLER DE CUMPLIMIENTO (ES REQUERIDO ASISTIR PARA SOMETER PROPUESTAS)
3 DE AGOSTO CABO ROJO
Son elegibles para solicitar fondos: organizaciones sin fines de lucro registradas en el Departamento de Estado, con fuertes lazos en la comunidad, que provean servicios en Puerto Rico, incluyendo Vieques y Culebra.
4 DE AGOSTO PONCE
REGÍSTRATE AQUÍ EN NUESTRO TALLER DE CUMPLIMIENTO (ES REQUERIDO ASISTIR PARA SOMETER PROPUESTAS)
1 DE AGOSTO SAN JUAN
MÁS INFORMACIÓN: 787-751-9096 |
2 DE AGOSTO FAJARDO
REGÍSTRATE AQUÍ EN NUESTRO TALLER DE CUMPLIMIENTO (ES REQUERIDO ASISTIR PARA SOMETER PROPUESTAS)
3 DE AGOSTO CABO ROJO
1 DE AGOSTO SAN JUAN
MÁS INFORMACIÓN: 787-751-9096 |
1 DE AGOSTO SAN JUAN
MÁS INFORMACIÓN: 787-751-9096 |
1 DE AGOSTO SAN JUAN
INFO@KOMENPR.ORG | WWW.KOMENPR.ORG
4 DE AGOSTO PONCE
2 DE AGOSTO FAJARDO
INFO@KOMENPR.ORG | WWW.KOMENPR.ORG
3 DE AGOSTO CABO ROJO
2 DE AGOSTO FAJARDO
4 DE AGOSTO PONCE
| WWW.KOMENPR.ORG
2 DE AGOSTO FAJARDO
MÁS INFORMACIÓN: 787-751-9096 | INFO@KOMENPR.ORG | WWW.KOMENPR.ORG
3 DE AGOSTO CABO ROJO 4 DE AGOSTO PONCE
MÁS INFORMACIÓN: 787-751-9096 |
3 DE AGOSTO CABO ROJO
4 DE AGOSTO PONCE
|
MÁS INFORMACIÓN: 787-751-9096 | INFO@KOMENPR.ORG | WWW.KOMENPR.ORG

42 Revista Puertorriqueña de Medicina y Salud Pública MÁS INFORMACIÓN:
| INFO@KOMENPR.ORG | WWW.KOMENPR.ORG
787-751-9096
1 DE AGOSTO SAN JUAN 2
FAJARDO 3 DE AGOSTO CABO ROJO 4 DE AGOSTO PONCE
AQUÍ EN NUESTRO TALLER
(ES
| INFO@KOMENPR.ORG | WWW.KOMENPR.ORG
DE AGOSTO
REGÍSTRATE
DE CUMPLIMIENTO
REQUERIDO ASISTIR PARA SOMETER PROPUESTAS) MÁS INFORMACIÓN: 787-751-9096
INFO@KOMENPR.ORG
WWW.KOMENPR.ORG
INFO@KOMENPR.ORG
1 DE AGOSTO SAN JUAN 2 DE AGOSTO FAJARDO 3 DE AGOSTO CABO ROJO 4 DE AGOSTO PONCE
REGÍSTRATE AQUÍ EN NUESTRO TALLER DE CUMPLIMIENTO (ES REQUERIDO
AGOSTO
4
REGÍSTRATE AQUÍ EN NUESTRO TALLER
1 DE AGOSTO SAN JUAN 2 DE AGOSTO FAJARDO 3 DE
CABO ROJO
DE AGOSTO PONCE
ATENCIÓN ORGANIZACIONES SIN FINES DE LUCRO:

Abren convocatoria para prestar servicios de salud
• El Programa de Ayudas de Susan G. Komen inicia nuevo ciclo para financiar propuestas de organizaciones sin fines de lucro para brindar cuidado de la salud y de cáncer de seno.
• Celebrarán Talleres de Cumplimiento los días 1,2,3 y 4 de agosto en San Juan, Fajardo, Cabo Rojo y Ponce, respetivamente.
SAN JUAN, PUERTO RICO – Susan G. Komen Puerto Rico® (SGK) presenta la oportunidad de ser parte del Programa de Ayudas Ciclo 2024 a toda organización sin fines de lucro con fuertes lazos en la comunidad, que tenga el propósito de mejorar las condiciones sociales, culturales y financieras que impiden a la población en Puerto Rico recibir atención médica y tratamientos de calidad. La iniciativa otorga fondos a entidades que sometan propuestas enfocadas en la salud y cáncer de seno bajo cuatro categorías: cernimiento (mamografías), pruebas de diagnóstico (sonomamografía, biopsia, MRI y bone scan), asistencia económica en tratamiento activo de cáncer de seno (quimioterapia, radioterapia, medicamentos recetados, entre otros) y programas de apoyo para pacientes en tratamiento y post tratamiento.
“Se enfatiza en la detección temprana que salva vidas, y nuestros programas proveen ayuda al paciente desde su diagnóstico hasta el manejo de los efectos secundarios. Lo principal es que se les provean ayudas económicas para que la paciente se adhiera a su tratamiento y pueda salir victoriosa de esta enfermedad. Estos programas atienden el componente físico con
los tratamiento y manejo de efectos secundarios, con la ayuda de nuestro programa de apoyo. Hasta el momento, se han otorgado más de $3 millones en ayudas, del cual se han beneficiado hasta 264 organizaciones a través de toda la Isla, incluyendo las islas municipios de Vieques y Culebra. Estos programas incluyen no tan solo detección temprana si no también se proveen servicios como asistencia entre otras ayudas de transportación para la adherencia de su tratamiento, al igual que el pago de agua y luz a pacientes en tratamiento activo de quimioterapia y radioterapias”, dijo Lynnette Rodríguez, Directora Ejecutiva.
Las organizaciones sin fines de lucro interesadas en recibir fondos del Programa de Ayudas deben estar registradas en el Departamento de Estado y tienen que participar en uno (1) de los Talleres de Cumplimiento que se ofrecerán en la isla. El primer Taller se llevará a cabo en San Juan el próximo martes, 1 de agosto a las 10:00 a.m. en las facilidades del Colegio de CPA de P.R. El segundo Taller tendrá lugar el miércoles, 2 de agosto a las 10:00 a.m. en las facilidades del Municipio de Fajardo. El tercer taller se ofrecerá el jueves, 3 de agosto a las 10:00 a.m.
Acerca de Susan G. Komen Puerto Rico.
en Caribbean Cancer Care Services de Cabo Rojo y el último de los talleres será el viernes 4 de agosto, desde las 10:00 a.m. en Ponce, en las facilidades de la Fundación Rafael Hernández Colón. En los talleres se proveerá la información del programa, categorías a financiar y cómo someter propuesta y solicitud. Para poder someter la solicitud de fondos y formar parte del Programa, la asistencia a este taller es un requisito ineludible.
El Programa de Ayudas va dirigido a proyectos comunitarios innovadores que busquen reducir la mortalidad del cáncer de seno y provean herramientas enfocadas en mejorar las condiciones sociales, culturales y financieras de las mujeres y hombres en Puerto Rico. Con la labor de estas organizaciones Susan G. Komen ®Puerto Rico llega a cada rincón de esta Isla para salvar vidas, proveer herramientas de apoderamiento a la comunidad, y garantizar los cuidados de calidad.
Para más información acerca de los Talleres de Cumplimiento y reservar su espacio, puede comunicarse a info@ komenpr.org o llamar al (787) 7519096.
Susan G. Komen Puerto Rico – Es la organización líder en la concienciación de cáncer de seno en la Isla. El 100% de los fondos recaudados por Susan G. Komen se quedan en Puerto Rico para mejorar las condiciones sociales, culturales y financieras que impiden que las mujeres puertorriqueñas reciban educación sobre el cáncer de seno, cuidados de la salud de los senos, atención médica y tratamientos de calidad. Establecida en el 2003, Komen Puerto Rico ha trabajado arduamente promoviendo la concienciación de cáncer de seno en nuestra Isla con la visión de que la detección temprana es parte de la cura para combatir esta enfermedad.
Revista Puertorriqueña de Medicina y Salud Pública 43
CUIDADO PREVENTIVO PARA PACIENTES CON ENFERMEDAD INFLAMATORIA DE INTESTINO

Palabras Clave: Enfermedad inflamatoria de intestino, cuidado preventivo, enfermedad de Crohn, colitis ulcerosa, vacunas, cernimiento de cáncer, osteoporosis, cáncer colorrectal, COVID-19

RESUMEN
El Colegio Americano de Gastroenterología (ACG por sus siglas en inglés) publicó unas guías para el cuidado preventivo requerido en pacientes con enfermedad inflamatoria de intestino (EII), que incluyen vacunas y cernimientos de cáncer, osteoporosis, e infecciones como tuberculosis latente. Debido al impacto que tiene esta condición crónica en la salud emocional de los pacientes con EII, las guías también
hacen un enfoque en el cernimiento para condiciones psiquiátricas como depresión mayor y ansiedad generalizada. Fumar activamente es un factor de riesgo para complicaciones y pobre respuesta a terapia, por lo cual también se recomienda un cernimiento cercano sobre el uso del cigarrillo. Ante la llegada de la pandemia y la severidad del coronavirus, el ACG también recomienda la vacuna contra
el COVID-19 de acuerdo con las recomendaciones del Centro para el Control y la Prevención de Enfermedades (CDC por sus siglas en inglés). Estas guías son una fuente de educación no solo para los gastroenterólogos sino para los médicos primarios con el fin de mejorar el cuidado preventivo y la calidad de vida de estos pacientes.
44 Revista Puertorriqueña de Medicina y Salud Pública
Karelys Burgos Irizarry
 Yue Sai Jao
Yue Sai Jao
La enfermedad inflamatoria de intestino (EII) es un término amplio que se usa para describir desórdenes que causan inflamación crónica del tracto digestivo, como colitis ulcerosa (CU) y enfermedad de Crohn (EC). EII es una de las 5 condiciones crónicas gastrointestinales más prevalentes en los Estados Unidos, con un costo total anual en servicios de salud que sobrepasa los $1.5 billones. Por la severidad de esta condición y la continuidad de cuidado que requiere, estos pacientes tienden a considerar su gastroenterólogo como su médico primario, lo cual lleva a una disminución de visitas al médico primario.
Hay una alta prevalencia de pacientes con EII moderada a severa que requiere tratamiento con terapia inmunosupresora, lo que conlleva un cuidado preventivo específico por las complicaciones asociadas a la inmunosupresión. Sin embargo, los estudios demuestran que estos pacientes no reciben cuidado preventivo con la
INTRODUCCIÓN DISCUSIÓN
Vacunas
Todo paciente con Enfermedad Inflamatoria del Intestino (EII) debe recibir las vacunas inactivadas sin importar su estado de inmunosupresión; estas vacunas incluyen, pero no se limitan a Influenza, Neumococo, Hepatitis A y B, Haemophilus influenza B, Virus del Papilloma Humano, tétano y pertussis. No obstante, la mayoría de las vacunas atenuadas también son parte del mantenimiento de salud y son recomendadas a aquellos pacientes
misma frecuencia que el resto de la población. Una de las razones para esta disparidad es que hay un enfoque primordial en control de síntomas por encima de medidas preventivas. La ausencia de cuidado preventivo en estos pacientes afecta tanto la calidad de cuidado como los resultados de los pacientes. Por lo tanto, no solo los gastroenterólogos, sino los médicos primarios deben crear un enfoque multidisciplinario y tomar un rol proactivo con la meta de empoderar al paciente a responsabilizarse y crear conciencia sobre su enfermedad y el cuidado preventivo que compele.
De acuerdo con las guías del Colegio Americano de Gastroenterología (ACG por sus siglas en inglés) para el cuidado preventivo de pacientes con EII, los asuntos de mantenimiento de salud incluyen: vacunas indicadas para pacientes con EII, cernimiento de tuberculosis latente, osteoporosis, cáncer cervical, melanoma y cáncer de piel no melanoma, cáncer de colon y una
evaluación para depresión, ansiedad y el hábito de fumar. Todos deben ser repasados en cada visita para asegurar la adherencia y el cumplimiento por parte de los pacientes.
Para el año 2013, la prevalencia de EII en Puerto Rico mostró un alza de hasta 4 veces el número de pacientes en comparación con la prevalencia del 2005. Desafortunadamente hay datos limitados sobre el conocimiento y percepción del cuidado preventivo de pacientes con EII en Puerto Rico. Actualmente se está conduciendo un estudio con el fin de evaluar el conocimiento y percepción tanto en los pacientes como en los gastroenterólogos acerca de las guías de cuidado preventivo con el fin de crear conciencia, aumentar el conocimiento y de esa manera mejorar el cuidado multidisciplinario de los pacientes con EII. Mediante este artículo les proveemos un resumen sobre los aspectos más importantes del cuidado preventivo de pacientes con EII.


con EII que no estén inmunosuprimidos (sea por medicamentos, cáncer o malnutrición severa) o que estén a un nivel mínimo de inmunosupresión. Sin embargo, existen excepciones. Hasta el momento, no tenemos evidencia de que las vacunas desencadenen una exacerbación de EII según varios estudios publicados.
La vacuna inactivada contra la influenza se recomienda anualmente.
Las vacunas contra el neumococo PCV13 y PPSV23 se deben administrar en pacientes inmunosuprimidos, pero no simultáneamente. Actualmente, existen dos formulaciones nuevas de la vacuna conjugada contra el neumococo (PCV15 o PCV20). El Centro para Control y Prevención de Enfermedades (CDC) recomienda que se les ofrezca estas alternativas a los adultos de 65 años o más que nunca han recibido la versión de PCV13 o
Revista Puertorriqueña de Medicina y Salud Pública 45
Programa de Adiestramiento en Gastroenterología, Escuela de Medicina, Recinto de Ciencias Médicas UPR
Fellow de Gastroenterología UPR Recinto de Ciencias Médicas
MD, fellow de Gastroenterología, Escuela de Medicina, Recinto de Ciencias Médicas
que su historial de vacunación sea desconocido. A adultos mayores de 50 años, que incluyen los pacientes con EII sin discriminación alguna por su estado de inmunosupresión, se les recomienda que se vacunen contra el Herpes Zoster. El estudio de VERVE, mejor conocido por sus siglas en ingles de “VaricElla ZosteR VaccinE”, demostró seguridad y eficacia de la vacuna en pacientes que fueron administrados la vacuna atenuada de Herpes Zoster mientras estaban recibiendo su tratamiento con biológicos (anti-TNF).
Se recomienda que se administre la vacuna de varicela antes de empezar terapia de inmunosupresión, verificando que el paciente no haya tenido exposición previa al virus o la vacuna. No existe contraindicación para que miembros del hogar que conviven con personas inmunosuprimidas reciban vacunas atenuadas como las vacunas contra paperas, Sarampión o Rubeola, Rotavirus, Varicela y Herpes Zoster, tomando las debidas precauciones para proteger a los pacientes vulnerables. En caso de que una persona saludable se vacune contra la varicela y luego presente una lesión sospechosa en piel, esta persona debe ser aislada para proteger al individuo inmunocomprometido. A los pacientes con EII se les recomienda ser evaluados por un infectólogo por
Prevención de cáncer
El mantenimiento de salud en los pacientes con EII no solo incluye la vacunación sino también los cernimientos adecuados para la detección temprana y correcta de distintos tipos de cáncer. De acuerdo con el Colegio Americano de Obstetricia y Ginecología (ACOG en inglés) y el CDC, se recomienda que se haga un cernimiento anual para la prevención de cáncer cervical con el uso de la prueba de Papanicolaou, ya que los pacientes con EII están predispuestos a tener mayor incidencia de displasia y cáncer cervical en comparación con la población general. A los pacientes con EII se les recomienda que rutinariamente usen bloqueador solar y se hagan cernimientos dermatológicos rutinarios para evaluación de cáncer de la piel incluyendo el melanoma. Se debe enfocar aún más la atención en los pacientes que estén usando medicamentos de inmunosupresión. Se ha identificado una relación entre
lo menos tres meses antes de que se vayan a viajar a países en donde haya diversidad de enfermedades infecciosas para poder administrar las vacunas correspondientes, de ser candidatos. La vacuna contra la fiebre amarilla es atenuada. A aquellos pacientes que por su inmunosupresión no puedan recibir la vacuna contra la fiebre amarilla, se les recomienda que eviten viajar a países endémicos donde puedan contraer esta condición y de ser inevitable el viaje tomar las precauciones necesarias para evitar la infección.
A los pacientes con EII se les recomienda la vacuna contra el meningococo sin importar su estado de inmunosupresión; la vacuna está específicamente destinada para las adolescentes y los adultos jóvenes entre 16 a 23 años que tienen mayor riesgo de infección. A todo paciente de EII se le recomienda recibir las vacunas que le correspondan de acuerdo con su edad, específicamente las vacunas atenuadas e inactivadas al menos 4 y 2 semanas antes de comenzar una terapia de inmunosupresión, respectivamente. Una vez que se le ofrezcan las vacunas inactivadas se recomienda verificar inmunidad en el tiempo de post vacunación para corroborar la necesidad de un refuerzo. La respuesta inmune a la vacuna disminuye a medida que aumente
el estado de inmunosupresión, pero se ha visto que, a pesar de lo antes mencionado, las vacunas siguen siendo beneficiosas y seguras en esta población, según lo descrito en literatura científica. Es importante resaltar que la responsabilidad de las recomendaciones de vacunas descritas en esta publicación debe ser compartida entre el gastroenterólogo y el médico primario para poder fomentar el cuidado preventivo necesario para los pacientes de Crohn y colitis ulcerosa. Por último, la Fundación de Crohn y Colitis, la cual aboga por prácticas seguras en pacientes con EII, apoya la vacunación contra el virus de COVID 19 en pacientes con EII. Ellos entienden que los pacientes con EII no tienen riesgo aumentado de enfermedad severa por coronavirus y no consideran que los pacientes con EII necesiten una dosis adicional de la vacuna de mRNA, ya que muchos no son considerados inmunosuprimidos. Deben seguir las recomendaciones de la población general. Las recomendaciones en cuanto a la vacuna de COVID por parte del ACG se basan en las guías del CDC, por lo cual hay que mantenerse al tanto a los cambios y las actualizaciones más recientes para poder proveerle al paciente la información adecuada.
los biológicos contra factor de necrosis tumoral y el riesgo de melanoma y el uso de tiopurina con el cáncer escamoso de la piel, el último mencionado en adultos mayores de 50 años según el estudio de CESAME.15 A los pacientes con EII se les recomienda cernimiento de cáncer colorrectal después de 8 años de enfermedad mediante evaluación por colonoscopia, dependiendo de la extensión de la enfermedad.
está en remisión.18,19 Hay un estudio en donde se observó una correlación inversa entre la presencia de depresión y la adherencia de medicamentos.20 Lo antes descrito resalta la importancia de identificar las condiciones sicológicas en los pacientes con EII para proveer un manejo completo de la enfermedad y sus complejidades.
Estrés, Depresión y Ansiedad Osteoporosis

Las enfermedades sicológicas son factores que añaden complejidad a los pacientes con Crohn y colitis ulcerosa, ya que afectan como el paciente percibe su condición y el manejo que está recibiendo. Hay diversas publicaciones que han determinado que hay mayor nivel de estrés, depresión y ansiedad en pacientes que tienen la enfermedad activa en comparación con aquellos en quienes su enfermedad
Los pacientes con EII están a mayor riesgo de tener osteoporosis.21 Los factores de riesgo para pérdida de densidad de masa ósea incluyen a mujeres deficientes de estrógeno/ postmenopausia, mujeres de bajo índice de masa corporal, hiperparatiroidismo primario e individuos que estén usando terapia prolongada de corticoesteroides definida como mayor o igual a 5 mg por día de prednisona o una dosis
46 Revista Puertorriqueña de Medicina y Salud Pública
equivalente por al menos 3 meses. A los pacientes que tengan los factores de riesgo antes mencionados se les recomienda el estudio para evaluar la densitometría ósea (DXA), el cual también es útil para mujeres de 65 años o más y hombres de 70 años o más según la Fundación Nacional de Osteoporosis.
Osteoporosis
Se ha identificado una asociación significativa entre el fumador activo y el desarrollo y progresión de la enfermedad de Crohn. Según diversos estudios publicados, los pacientes con
EII que se denominaban fumadores activos estaban relacionados con una alta frecuencia de uso de terapia de mantenimiento específicamente el uso de biológicos, pobre respuesta a terapia y alta frecuencia de intervenciones quirúrgicas en comparación con los no fumadores.
CONCLUSIONES
• Existen guías para el cuidado preventivo requerido para pacientes con EII que incluyen vacunas y cernimientos de cáncer, osteoporosis y tuberculosis latente, indicados para estos pacientes.
• Las guías también hacen enfoque en la evaluación de condiciones psiquiátricas como depresión mayor, ansiedad generalizada y abuso de sustancias, como el cigarrillo, que afectan la percepción y el manejo de la enfermedad.
• No solo los gastroenterólogos deben ser los responsables de inculcar el cuidado preventivo en pacientes con EII y el enfoque debe dirigirse al empoderamiento del paciente con respecto a su cuidado.
• Se debe recomendar a todos los pacientes la vacunación contra el virus de COVID 19 de acuerdo con las recomendaciones del CDC.
CUIDADO DE SALUD PREVENTIVO PARA PACIENTES CON EII: VACUNAS
* Frecuencias y dosis indicadas están disponibles en las recomendaciones del Comité Asesor sobre Prácticas de Inmunización (ACIP).
• Contraindicada en pacientes recibiendo tratamiento inmunosupresor.
† Depende del tipo de medicamento inmunosupresor.
Δ Las recomendaciones resumidas en esta tabla se basan en las guías de cuidado preventivo de EII del ACG y la lista de cotejo de mantenimiento de salud de la Fundación de Crohn y Colitis.

REFERENCIAS
Abegunde AT, Muhammad BH, Ali T. Preventive health measures in inflammatory bowel disease. World J Gastroenterol. 2016 Sep 14;22(34):7625-44. Doi: 10.3748/ wjg.v22.i34.7625.

Farraye F A, Melmed GY, Lichtenstein GR, Kane,SV. ACG Clinical Guideline: Preventive Care in Inflammatory Bowel Disease. Amer J Gastroenterol: February 2017 – Volume 112 – Issue 2 – p 241258 doi: 10.1038/ajg.2016.537.
Cosman F, de Beur SJ, LeBoff MS, Lewiecki EM, Tanner B, Randall S, Lindsay R; National Osteoporosis Foundation. Clinician’s Guide to Prevention and Treatment of Osteoporosis. Osteoporos Int. 2014 Oct;25(10):2359-81. Doi: 10.1007/s00198-014-2794-2. Epub 2014 Aug 15. Erratum in: Osteoporos Int. 2015 Jul;26(7):2045-7.
Kroger A, Bahta L, Hunter P. General Best Practice Guidelines for Immunization. Best Practices Guidance of the Advisory
Committee on Immunization Practices (ACIP). https://www.cdc.gov/vaccines/hcp/aciprecs/general-recs/index.html
Pillai N, Dusheiko M, Burnand B, Pittet V. A systematic review of cost-effectiveness studies comparing conventional, biological and surgical interventions for inflammatory bowel disease. PloS One. 2017 Oct 3;12(10):e0185500. Doi: 10.1371/ journal.pone.0185500.
Revista Puertorriqueña de Medicina y Salud Pública 47
Practice Bulletin No. 157: Cervical Cancer Screening and Prevention. Obstet Gynecol. 2016 Jan;127(1):e1-e20. Doi: 10.1097/ AOG.0000000000001263.
Torres EA, Torres-Cintron M, Velazquez S, Vendrell R, Del Valle A, Pérez CM. Prevalence of Inflammatory Bowel Diseases in Puerto Rico: A Health Care Claims Analysis of an Insured Population. P R Health Sci J. 2021 Sep;40(3):103-109.

Rahier JF, Papay P, Salleron J et al. H1N1 vaccines in a large observational cohort of patients with inflammatory bowel disease treated with immu- nomodulators and biological therapy. Gut 2011;60:456–62.
Dotan I, Werner L, Vigodman S et al. Normal response to vaccines in inflammatory bowel disease patients treated with thiopurines. Inflamm Bowel Dis 2012;18:261–8.
Agarwal N, Ollington K, Kaneshiro M et al. Are immunosuppressive medications associated with decreased responses to routine immuniza- tions? A systematic review. Vaccine 2012;30:1413–24.
Curtis JR, Cofield SS, Bridges SL, et al; The Safety and Immunologic Effectiveness of the Live Varicella-Zoster Vaccine in Patients Receiving Tumor Necrosis Factor Inhibitor Therapy: A Randomized Controlled Trial. Ann Intern Med.2021;174:1510-1518. [Epub 28 September 2021]. doi:10.7326/
M20-6928
Andrisani G, Frasca D, Romero M et al. Immune response to influenza A/ H1N1 vaccine in inflammatory bowel disease patients treated with anti TNFalpha agents: effects of combined therapy with immunosuppressants. J Crohn’s Colitis 2013;7:301–7.
Hagihara Y, Ohfuji S, Watanabe K et al. Infliximab and/or immunomodu- lators inhibit immune responses to trivalent influenza vaccination in adults with inflammatory bowel disease. J Crohn’s Colitis 2014;8:223–33.
Nguyen DL, Nguyen ET, Bechtold ML. Effect of immunosuppressive therapies for the treatment of inflammatory bowel disease on response to routine vaccinations: a metaanalysis. Dig Dis Sci 2015;60:2446–53.
Beaugerie L, Brousse N, Bouvier AM, Colombel JF, Lémann M, Cosnes J, Hébuterne X, Cortot A, Bouhnik Y, Gendre JP, Simon T, Maynadié M, Hermine O, Faivre J, Carrat F; CESAME Study Group. Lymphoproliferative disorders in patients receiving thiopurines for inflammatory bowel disease: a prospective observational cohort study. Lancet. 2009 Nov 7;374(9701):1617-25. doi:
10.1016/S0140-6736(09)61302-7. PMID: 19837455.
Farraye FA, Odze RD, Eaden J, Itzkowitz SH. AGA technical review on the diagnosis and management of colorectal neoplasia in inflammatory bowel disease. Gastroenterology. 2010;138:746–774, 774.e1-4; quiz e12-13.
Clarke WT, Feuerstein JD. Colorectal cancer surveillance in inflammatory bowel disease: Practice guidelines and recent developments. World J Gastroenterol. 2019 Aug 14;25(30):4148-4157. doi: 10.3748/ wjg.v25.i30.4148. PMID: 31435169; PMCID: PMC6700690.
Persoons P, Vermeire S, Demyttenaere K et al. The impact of major depressive disorder on the short- and long-term outcome of Crohn’s disease treatment with infliximab. Aliment Pharmacol Ther 2005;22: 101–10.
Calvet X, Gallardo O, Coronas R et al. Remission on thiopurinic immunomodulators normalizes quality of life and psychological status in patients with Crohn’s disease. Inflamm Bowel Dis 2006;12:692–6.
Nigro G, Angelini G, Grosso SB et al. Psychiatric predictors of noncompli- ance in inflammatory bowel disease: psychiatry and compliance. J Clin Gastroenterol 2001;32:66–8.
Pollak RD, Karmeli F, Eliakim R et al. Femoral neck osteopenia in patients with inflammatory bowel disease. Am J Gastroenterol 1998;93:1483–90.
Nunes T, Etchevers MJ, Merino O et al. Does smoking influence Crohn’s disease in the biologic era? The TABACROHN study. Inflamm Bowel Dis 2013;19:23–9.
To N, Gracie DJ, Ford AC. Systematic review with meta-analysis: the ad- verse effects of tobacco smoking on the natural history of Crohn’s disease. Aliment Pharmacol Ther 2016;43:549–61.
Parsi MA, Achkar JP, Richardson S et al. Predictors of response to infliximab in patients with Crohn’s disease. Gastroenterology 2002;123:707–13.
Moss A, Farraye F, Gordon G, Vrabie R. Health Maintenance Checklist for Adult IBD Patients. Crohn’s & Colitis Foundation’s Professional Education Committee Sub-Group. https://www. crohnscolitisfoundation.org/sites/default/
files/legacy/science-and-professionals/ programs-materials/health-maintenancechecklist.pdf
48 Revista Puertorriqueña de Medicina y Salud Pública

Results were measured at Weeks 12 and 52
RAPID SYMPTOM RELIEF
Clinical response* achieved at Week 21
DURABLE CLINICAL REMISSION
Clinical remission† achieved at Weeks 12 and 521
SIGNIFICANT ENDOSCOPIC CONTROL
Visible mucosal improvement with endoscopic response§ achieved at Weeks 12 and 521

U-EXCEL Induction & U-EXCEED Induction Study Design Intro: 12-week, double-blind, placebo-controlled Phase 3 induction studies that evaluated the efficacy and safety of RINVOQ in 857 patients (419 patients for U-EXCEED and 438 patients for U-EXCEL) with moderately to severely active Crohn’s disease who demonstrated prior failure to biologic treatment (U-EXCEED) or prior failure to conventional and/or biologic treatment (U-EXCEL). Patients were randomized to receive RINVOQ 45 mg or placebo once daily for 12 weeks. The co-primary endpoints were the proportion of patients who achieved clinical remission (by CDAI) and endoscopic response (by SES-CD) at Week 12.1
U-ENDURE Maintenance Study Design Intro: 52-week, double-blind, placebo-controlled Phase 3 maintenance study of 343 adult patients with moderately to severely active Crohn’s disease who achieved clinical response (decrease in CDAI ≥100 points from baseline from RINVOQ induction) in the U-EXCEL and U-EXCEED studies. Patients were re-randomized to receive a maintenance regimen of either RINVOQ 15 mg, RINVOQ 30 mg, or placebo once daily for 52 weeks. The co-primary endpoints were the proportion of patients who achieved clinical remission (by CDAI) and endoscopic response (by SES-CD) at Week 52.1
I NDICATION1
RINVOQ is indicated for the treatment of adults with moderately to severely active Crohn’s disease who have had an inadequate response or intolerance to one or more tumor necrosis factor (TNF) blockers.













Limitations of Use: RINVOQ is not recommended for use in combination with other Janus kinase (JAK) inhibitors, biological therapies for Crohn’s disease, or with potent immunosuppressants such as azathioprine and cyclosporine.



SAFETY CONSIDERATIONS1


Serious Infections: RINVOQ-treated patients are at increased risk of serious bacterial (including tuberculosis [TB]), fungal, viral, and opportunistic infections leading to hospitalization or death. Most patients who developed these infections were taking concomitant immunosuppressants, such as methotrexate or corticosteroids.
Mortality: A higher rate of all-cause mortality, including sudden cardiovascular (CV) death, was observed with a Janus kinase inhibitor (JAKi) in a study comparing another JAKi with tumor necrosis factor (TNF) blockers in rheumatoid arthritis (RA) patients ≥50 years with ≥1 CV risk factor.
50 Revista Puertorriqueña de Medicina y Salud Pública
For adults with moderately to severely active Crohn’s disease (CD) who have had an inadequate response or intolerance to one or more TNF blockers.1
17-2694 US-RNQG-230245 AD.indd 1 6/22/23 7:57 AM
In both induction trials, ~1/3 of patients achieved rapid symptom relief (CDAI CR-100) at Week 2 (ranked secondary endpoint).3
U-EXCEED 37% (n=273) RINVOQ 45 mg; 14% (n=146) placebo (P<0.001). 3





















U-EXCEL 37% (n=295) RINVOQ 45 mg; 24% (n=143) placebo (P<0.01). 3





RESULTS YOUR PATIENTS CAN FEEL AND YOU CAN SEE
RECOMMENDED MAINTENANCE
DOSING
RINVOQ is indicated for TNFi-IR patients.
A maintenance dose of refractory, severe, or extensive disease. Discontinue RINVOQ if an adequate therapeutic response is not achieved with the 30 mg dose.
CDAI=Crohn’s disease activity index; SES-CD=simple endoscopic score for Crohn’s disease; TNFi-IR=tumor necrosis factor inhibitor-intolerance or inadequate response.
*Clinical response was defined as a reduction of CDAI score ≥100 points from baseline.
†Clinical remission was defined as CDAI <150 points.
§ Endoscopic response was defined as a decrease in SES-CD >50% from baseline, or a decrease of at least 2 points for subjects with a baseline score of 4 and isolated ileal disease, based on central reading. The sections evaluated on endoscopy are the: rectum, sigmoid and left colon, transverse colon, right colon and ileum (per SES-CD assessment).
|| Prior biologic failure includes inadequate response, loss of response, or intolerance to one or more biologics.









¶ The mixed population included patients who had inadequate response, loss of response, or intolerance to one or more biologics (biologic failure), as well as some patients who were not bio-exposed and some patients who were bio-exposed but did not have an inadequate response, loss of response, or intolerance to biologics (bio-naive).
SAFETY CONSIDERATIONS

CONSIDERATIONS1 (continued) patients.
Malignancies: Malignancies have occurred in RINVOQ-treated patients. A higher rate of lymphomas and lung cancer (in current or past smokers) was observed with another JAKi when compared with TNF blockers in RA patients.
Major Adverse Cardiovascular Events: A higher rate of CV death, myocardial infarction, and stroke was observed with a JAKi in a study comparing another JAKi with TNF blockers in RA patients ≥50 years with ≥1 CV risk factor. History of smoking increases risk.
Thrombosis: Deep venous thrombosis, pulmonary embolism, and arterial thrombosis have occurred in patients treated with JAK inhibitors used to treat inflammatory conditions. A higher rate of thrombosis was observed with another JAKi when compared with TNF blockers in RA patients.
Hypersensitivity: RINVOQ is contraindicated in patients with hypersensitivity to RINVOQ or its excipients.





























Other Serious Adverse Reactions: Hypersensitivity Reactions, Gastrointestinal Perforations, Laboratory Abnormalities, and Embryo-Fetal Toxicity. Please see additional Important Safety Information for RINVOQ, including BOXED WARNING on Serious Infections, Mortality, Malignancies, Major Adverse Cardiovascular Events, and Thrombosis, on the following page of this advertisement.
Please see Brief Summary of full Prescribing Information on adjacent pages of this advertisement.
Revista Puertorriqueña de Medicina y Salud Pública 51
Durable clinical remission
1§
baseline.1 points.1 2 4 The colon, ileum assessment).1 biologics.1 not (bio-naive).1 30 mg may
for
with † and significant endoscopic control RINVOQ 45 mg RINVOQ 15 mg RINVOQ 30 mg Placebo All P-values are RINVOQ treatment arms vs placebo 41% 7 % 28 % N=111 N=113 N=119 U-ENDU R E WEE K 5 2 MIXED POPULATIO N || 14% 55% 42% N=111 N=113 N=119 % P<0.001 P<0.001 % 3% N=146 N=273 34% U-E XCEED WEE K 1 2 BIOLOGIC FAILURE POPULATION || 36% 18% N=146 N=273 % P<0.001 % 4% P<0.001 P<0.001 P<0.001 % of Patients ENDOSCOPIC RESPONSE§ (SES-CD) (Co-primary endpoint) CLINICAL REMISSION† (CDAI) (Co-primary endpoint) 13% 46% N=143 N=295 % U - E XC E L WEE K 1 2 MIXED POPULATION ¶ 23% N=143 N=295 46% 3% P<0.001 P<0.001 20 40 60 0 20 40 60 0
including steroid-free clinical remission at RINVOQHCP.COM/CD
be considered
patients
SEE MORE DATA
of TNF blockers venous JAK hypersensitivity 17-2694 US-RNQG-230245 AD.indd 2 6/22/23 7:57 AM
Creatine Phosphokinase Elevations
In placebo-controlled trials (RA-III, RA-IV, and RA-V) with background DMARDs, for up to 12/14 weeks, dose-related increases in creatine phosphokinase (CPK) values were observed. CPK elevations > 5 x ULN were reported in 1.0%, and 0.3% of patients over 12/14 weeks in the RINVOQ 15 mg and placebo groups, respectively. Most elevations >5 x ULN were transient and did not require treatment discontinuation. In RA-III and RA-V, CPK elevations > 5 x ULN were observed in 0.3% of patients treated with placebo, 1.6% of patients treated with RINVOQ 15 mg, and none in patients treated with upadacitinib 30 mg.
Neutropenia
In placebo-controlled trials (RA-III, RA-IV, and RA-V) with background DMARDs, for up to 12/14 weeks, doserelated decreases in neutrophil counts, below 1000 cells/mm3 in at least one measurement occurred in 1.1% and <0.1% of patients in the RINVOQ 15 mg and placebo groups, respectively. In RA-III and RA-V, decreases in neutrophil counts below 1000 cells/mm3 in at least one measurement occurred in 0.3% of patients treated with placebo, 1.3% of patients treated with RINVOQ 15 mg, and 2.4% of patients treated with upadacitinib 30 mg. In clinical trials, treatment was interrupted in response to ANC less than 1000 cells/mm3
Lymphopenia
In placebo-controlled trials (RA-III, RA-IV, and RA-V) with background DMARDs, for up to 12/14 weeks, doserelated decreases in lymphocyte counts below 500 cells/mm3 in at least one measurement occurred in 0.9% and 0.7% of patients in the RINVOQ 15 mg and placebo groups, respectively. In RA-III and RA-V, decreases in lymphocyte counts below 500 cells/mm3 in at least one measurement occurred in 0.5% of patients treated with placebo, 0.5% of patients treated with RINVOQ 15 mg, and 2.4% of patients treated with upadacitinib 30 mg.
Anemia
In placebo-controlled trials (RA-III, RA-IV, and RA-V) with background DMARDs, for up to 12/14 weeks, hemoglobin decreases below 8 g/dL in at least one measurement occurred in <0.1% of patients in both the RINVOQ 15 mg and placebo groups. In RA-III and RA-V, hemoglobin decreases below 8 g/dL in at least one measurement were observed in 0.3% of patients treated with placebo, and none in patients treated with RINVOQ 15 mg and upadacitinib 30 mg.
Adverse Reactions in Patients with Psoriatic Arthritis
A total of 1827 patients with psoriatic arthritis were treated with upadacitinib in clinical trials representing 1639.2 patient-years of exposure, of whom 722 were exposed to upadacitinib for at least one year. In the two Phase 3 trials, 907 patients received at least 1 dose of RINVOQ 15 mg, of whom 359 were exposed for at least one year.
Two placebo-controlled trials were integrated (640 patients on RINVOQ 15 mg once daily and 635 patients on placebo) to evaluate the safety of RINVOQ 15 mg in comparison to placebo for up to 24 weeks after treatment initiation.
Overall, the safety profile observed in patients with active psoriatic arthritis treated with RINVOQ 15 mg was consistent with the safety profile observed in patients with rheumatoid arthritis. During the 24-week placebo-controlled period, the frequencies of herpes zoster and herpes simplex were ≥1% (1.1% and 1.4%, respectively) with RINVOQ 15 mg and 0.8% and 1.3%, respectively with placebo. A higher incidence of acne and bronchitis was also observed in patients treated with RINVOQ 15 mg (1.3% and 3.9%, respectively) compared to placebo (0.3% and 2.7%, respectively).
Adverse Reactions in Patients with Atopic Dermatitis
Three Phase 3 (AD-1, AD-2, and AD-3) and one Phase 2b (AD-4) randomized, double-blind, placebo-controlled, multicenter trials evaluated the safety of RINVOQ in patients with moderate-to-severe atopic dermatitis. The majority of patients were White (68%) and male (57%). The mean age was 34 years (ranged from 12 to 75 years) and 13% of the patients were 12 to less than 18 years. In these 4 trials, 2612 patients were treated with RINVOQ 15 mg or 30 mg orally once daily, with or without concomitant topical corticosteroids (TCS).
In the Phase 3 clinical trials (AD-1, AD-2, and AD-3), a total of 1239 patients received RINVOQ 15 mg, of whom 791 were exposed for at least one year and 1246 patients received RINVOQ 30 mg, of whom 826 were exposed for at least one year.
Trials AD-1, AD-2, and AD-4 compared the safety of RINVOQ monotherapy to placebo through Week 16. Trial AD-3 compared the safety of RINVOQ + TCS to placebo + TCS through Week 16.
Weeks 0 to 16 (Trials AD-1 to AD-4)
In RINVOQ trials with and without TCS (Trials AD-1, 2, 3 and 4) through Week 16, the proportion of patients who discontinued treatment because of adverse reactions in the RINVOQ 15 mg, 30 mg and placebo groups were 2.3%, 2.9% and 3.8%, respectively. Table 2 summarizes the adverse reactions that occurred at a rate of at least 1% in the RINVOQ 15 mg or 30 mg groups during the first 16 weeks of treatment.
or 30 mg
* Includes: laryngitis, laryngitis viral, nasopharyngitis, oropharyngeal pain, pharyngeal abscess, pharyngitis, pharyngitis streptococcal, pharyngotonsillitis, respiratory tract infection, respiratory tract infection viral, rhinitis, rhinolaryngitis, sinusitis, tonsillitis, tonsillitis bacterial, upper respiratory tract infection, viral pharyngitis, viral upper respiratory tract infection
** Includes: acne and dermatitis acneiform
*** Includes: genital herpes, genital herpes simplex, herpes dermatitis, herpes ophthalmic, herpes simplex, nasal herpes, ophthalmic herpes simplex, herpes virus infection, oral herpes

**** Includes anaphylactic reaction, anaphylactic shock, angioedema, dermatitis exfoliative generalized, drug hypersensitivity, eyelid oedema, face oedema, hypersensitivity, periorbital swelling, pharyngeal swelling, swelling face, toxic skin eruption, type hypersensitivity, urticaria
***** Includes abdominal pain and abdominal pain upper
****** Includes herpes zoster and varicella
Other adverse reactions reported in less than 1% of patients in the RINVOQ 15 mg and/or 30 mg group and at a higher rate than in the placebo group through Week 16 included anemia, oral candidiasis, pneumonia, non-melanoma skin cancer, and the adverse event of retinal detachment.
The safety profile of RINVOQ through Week 52 was generally consistent with the safety profile observed at Week 16.
Overall, the safety profile observed in patients with AD treated with RINVOQ was similar to the safety profile in patients with RA. Other specific adverse reactions that were reported in patients with AD included eczema herpeticum/Kaposi’s varicelliform eruption.
Eczema Herpeticum/Kaposi’s Varicelliform Eruption
Placebo-controlled Period (16 weeks): Eczema herpeticum was reported in 4 patients (1.6 per 100 patientyears) treated with placebo, 6 patients (2.2 per 100 patient-years) treated with RINVOQ 15 mg and 7 patients (2.6 per 100 patient-years) treated with RINVOQ 30 mg.
12-Month Exposure (Weeks 0 to 52): Eczema herpeticum was reported in 18 patients (1.6 per 100 patientyears) treated with RINVOQ 15 mg and 17 patients (1.5 per 100 patient-years) treated with RINVOQ 30 mg.
Adverse Reactions in Patients with Ulcerative Colitis
RINVOQ was studied up to 8 weeks in patients with moderately to severely active ulcerative colitis in two randomized, double-blind, placebo-controlled induction studies (UC-1, UC-2) and a randomized, double-blind, placebo controlled, dose-finding study (UC-4; NCT02819635). Long term safety up to 52-weeks was evaluated in patients who responded to induction therapy in a randomized, double-blind, placebo-controlled maintenance study (UC-3) and a long-term extension study.
In the two induction studies (UC-1, UC-2) and a dose finding study (UC-4), 1097 patients were enrolled of whom 719 patients received RINVOQ 45 mg once daily.
In the maintenance study (UC-3), 746 patients were enrolled of whom 250 patients received RINVOQ 15 mg once daily and 251 patients received RINVOQ 30 mg once daily.
Adverse reactions reported in ≥2% of patients in any treatment arm in the induction and maintenance studies are shown in Tables 3 and 4, respectively.
Table 3: Adverse Reactions Reported in ≥2% of Patients with Ulcerative Colitis Treated with RINVOQ 45 mg in Placebo-Controlled Induction Studies (UC-1, UC-2 and UC-4)
Table 6: Adverse Reactions Reported in ≥2% of Patients with Crohn’s Disease Treated with RINVOQ 15 mg or 30 mg in the Placebo-Controlled Maintenance Study (CD-3)1
* Composed of several similar terms
** Elevated liver enzymes composed of elevated ALT, AST, GGT, ALP, liver transaminases, hepatic enzymes, bilirubin, drug-induced liver injury and cholestasis.
Other adverse reactions reported in less than 2% of patients in the RINVOQ 45 mg group and at a higher rate than in the placebo group through Week 8 included herpes zoster and pneumonia.
Table 4: Adverse Reactions Reported in ≥2% of Patients with Ulcerative Colitis Treated with RINVOQ 15 mg or 30 mg in the Placebo-Controlled Maintenance Study (UC-3)1
Patients who were responders to 12 weeks induction therapy with RINVOQ 45 mg once daily. 2 Elevated liver enzymes includes alanine aminotransferase increased, aspartate aminotransferase increased, blood alkaline phosphatase increased, transaminases increased, blood bilirubin increased. * Composed of several similar terms Adverse reactions reported in less than 2% of patients in the RINVOQ 15 mg or 30 mg group and at a higher rate than in the placebo group through Week 52 included hyperlipidemia, oral candidiasis, and hypercholesterolemia.
The safety profile of RINVOQ in the long-term extension study was similar to the safety profile observed in the placebo-controlled induction and maintenance periods.
Adverse Reactions
Infections Induction Studies: In CD-1 and CD-2, serious infections were reported in 6 patients (8 per 100 patient-years) treated with placebo and 13 patients (9 per 100 patient-years) treated with RINVOQ 45 mg through 12 weeks of the placebo-controlled period.
Maintenance Study/LTE: In the long-term placebo-controlled period, serious infections were reported in 10 patients (7 per 100 patient-years) treated with placebo, 7 patients (4 per 100 patient-years) treated with RINVOQ 15 mg, and 13 patients (6 per 100 patient-years) treated with RINVOQ 30 mg.
Gastrointestinal Perforations
Induction Studies: During the induction studies in all patients treated with RINVOQ 45 mg (N=938), gastrointestinal perforation was reported in 4 patients (2 per 100 patient-years). In the placebo-controlled induction period, in CD-1 and CD-2, gastrointestinal perforation was reported in no patients treated with placebo (N=347) and 1 patient (1 per 100 patient-years) treated with RINVOQ 45 mg (N=674) through 12 weeks.
1 Patients who were responders to 8 weeks induction therapy with RINVOQ 45 mg once daily
* Composed of several similar terms
** Elevated liver enzymes composed of elevated ALT, AST, GGT, ALP, liver transaminases, hepatic enzymes, bilirubin, drug-induced liver injury, and cholestasis.
The adverse reaction of non-melanoma skin cancer was reported in 1% of patients in the RINVOQ 30 mg group and none of the patients in the RINVOQ 15 mg or placebo group through Week 52.
The safety profile of RINVOQ in the long-term extension study was similar to the safety profile observed in the placebo-controlled induction and maintenance periods.
Overall, the safety profile observed in patients with ulcerative colitis treated with RINVOQ was generally similar to the safety profile in patients with RA and AD.
Specific Adverse Reactions
Serious Infections
Induction Studies: In UC-1, UC-2, and UC-4, serious infections were reported in 5 patients (8.4 per 100 patient-years) treated with placebo and 9 patients (8.4 per 100 patient-years) treated with RINVOQ 45 mg through 8 weeks.
Placebo-controlled Maintenance Study: In UC-3, serious infections were reported in 8 patients (6.3 per 100 patient-years) treated with placebo, 8 patients (4.5 per 100 patient-years) treated with RINVOQ 15 mg, and 6 patients (3.1 per 100 patient-years) treated with RINVOQ 30 mg through 52 weeks.
Laboratory Abnormalities
Hepatic Transaminase Elevations
In studies UC-1, UC-2, and UC-4, elevations of ALT to ≥ 3 x ULN in at least one measurement were observed in 1.5% of patients treated with RINVOQ 45 mg, and 0% of patients treated with placebo for 8 weeks. AST elevations to ≥ 3 x ULN occurred in 1.5% of patients treated with RINVOQ 45 mg, and 0.3% of patients treated with placebo. Elevations of ALT to ≥ 5 x ULN occurred in 0.4% of patients treated with RINVOQ 45 mg and 0% of patients treated with placebo.
In UC-3, elevations of ALT to ≥ 3 x ULN in at least one measurement were observed in 4% of patients treated with RINVOQ 30 mg, 2% of patients treated with RINVOQ 15 mg, and 0.8% of patients treated with placebo for 52 weeks. Elevations of AST to ≥ 3 x ULN in at least one measurement were observed in 2% of patients treated with RINVOQ 30 mg, 1.6% of patients treated with RINVOQ 15 mg and 0.4% of patients treated with placebo. Elevations of ALT to ≥ 5 x ULN were observed in 0.8% of patients treated with 30 mg, 0.4% of patients treated with 15 mg, and 0.4% of patients treated with placebo.
Overall, laboratory abnormalities observed in patients with ulcerative colitis treated with RINVOQ were similar to those described in patients with RA.
Adverse Reactions in Patients with Crohn’s Disease RINVOQ was studied up to 12 weeks in patients with moderately to severely active CD in two randomized, double-blind, placebo-controlled induction studies (CD-1, CD-2). Long term safety up to 52 weeks was evaluated in patients who responded to induction therapy in a randomized, double-blind, placebo-controlled maintenance study (CD-3), with additional data provided from a long-term extension (LTE) period.
In the two induction studies (CD-1, CD-2), 1021 patients were enrolled, of whom 674 patients received RINVOQ 45 mg once daily during the placebo-controlled period.
In the maintenance study (CD-3), 673 patients were enrolled, of whom 221 patients received RINVOQ 15 mg once daily and 229 patients received RINVOQ 30 mg once daily during the randomized, placebo-controlled period.
Overall, the safety profile observed in patients with Crohn’s disease treated with RINVOQ was consistent with the known safety profile for RINVOQ in other indications.
Adverse reactions reported in ≥2% of patients treated with RINVOQ and at a higher rate than placebo in the induction and maintenance studies are shown in Tables 5 and 6, respectively.
Table 5: Adverse Reactions Reported in ≥2% of Patients with Crohn’s Disease Treated with RINVOQ 45 mg in Placebo-Controlled Induction Studies (CD-1 and CD-2)
Maintenance Study/LTE: In the long-term placebo-controlled period, gastrointestinal perforation was reported in 1 patient (1 per 100 patient-years) treated with placebo, 1 patient (<1 per 100 patient-years) treated with RINVOQ 15 mg, and 1 patient (<1 per 100 patient-years) treated with RINVOQ 30 mg.
Patients who received placebo or RINVOQ 15 mg for maintenance therapy and lost response were treated with rescue RINVOQ 30 mg (N=336). Among these patients, gastrointestinal perforation was reported in 3 patients (1 per 100 patient-years) through long-term treatment.
Adverse Reactions in Patients with Ankylosing Spondylitis
A total of 596 patients with ankylosing spondylitis were treated with RINVOQ 15 mg in the two clinical trials representing 577.3 patient-years of exposure, of whom 220 were exposed to RINVOQ 15 mg for at least one year.
Overall, the safety profile observed in patients with active ankylosing spondylitis treated with RINVOQ 15 mg was consistent with the safety profile observed in patients with rheumatoid arthritis and psoriatic arthritis. During the 14-week placebo-controlled period in Trial AS-I, the frequency of headache was 5.4% with RINVOQ 15 mg and 2.1% with placebo. During the 14-week placebo-controlled period in Trial AS-II, the frequency of headache was 3.3% with RINVOQ 15 mg and 1.4% with placebo.
Adverse Reactions in Patients with Non-radiographic Axial Spondyloarthritis
A total of 187 patients with non-radiographic axial spondyloarthritis were treated with RINVOQ 15 mg in the clinical trial representing 116.6 patient-years of exposure, of whom 31 were exposed to RINVOQ 15 mg for at least one year.
Overall, the safety profile observed in patients with active non-radiographic axial spondyloarthritis treated with RINVOQ 15 mg was consistent with the safety profile observed in patients with rheumatoid arthritis, psoriatic arthritis, and ankylosing spondylitis.
DRUG INTERACTIONS
Strong CYP3A4 Inhibitors
Upadacitinib exposure is increased when RINVOQ is co-administered with a strong CYP3A4 inhibitor (such as ketoconazole, clarithromycin, and grapefruit), which may increase the risk of RINVOQ adverse reactions. Monitor patients with rheumatoid arthritis, psoriatic arthritis, ankylosing spondylitis and non-radiographic axial spondylarthritis closely for adverse reactions when co-administering RINVOQ 15 mg once daily with strong CYP3A4 inhibitors. Food or drink containing grapefruit should be avoided during treatment with RINVOQ. For patients with atopic dermatitis, coadministration of RINVOQ 30 mg once daily with strong CYP3A4 inhibitors is not recommended.
For patients with ulcerative colitis or Crohn’s disease taking strong CYP3A4 inhibitors, reduce the RINVOQ induction dosage to 30 mg once daily. The recommended maintenance dosage is 15 mg once daily.
Strong CYP3A4 Inducers
Upadacitinib exposure is decreased when RINVOQ is co-administered with strong CYP3A4 inducers (such as rifampin), which may lead to reduced therapeutic effect of RINVOQ. Coadministration of RINVOQ with strong CYP3A4 inducers is not recommended.
USE IN SPECIFIC POPULATIONS
Pregnancy
Risk Summary
Available data from the pharmacovigilance safety database and postmarketing case reports on use of RINVOQ in pregnant women are not sufficient to evaluate a drug-associated risk for major birth defects or miscarriage. Based on animal studies, RINVOQ has the potential to adversely affect a developing fetus. Advise patients of reproductive potential and pregnant patients of the potential risk to the fetus.
In animal embryo-fetal development studies, oral upadacitinib administration to pregnant rats and rabbits at exposures equal to or greater than approximately 1.6 and 15 times the 15 mg dose, 0.8 and 7.6 times the 30 mg dose, and 0.6 and 5.6 times the maximum recommended human dose (MRHD) of 45 mg (on an AUC basis) resulted in dose-related increases in skeletal malformations (rats only), an increased incidence of cardiovascular malformations (rabbits only), increased post-implantation loss (rabbits only), and decreased fetal body weights in both rats and rabbits. No developmental toxicity was observed in pregnant rats and rabbits treated with oral upadacitinib during organogenesis at exposures approximately 0.29 and 2.2 times the 15 mg dose, 0.15 times and 1.1 times the 30 mg dose, and at 0.11 and 0.82 times the MRHD (on an AUC basis). In a pre- and post-natal development study in pregnant female rats, oral upadacitinib administration at exposures approximately 3 times the 15 mg dose, 1.4 times the 30 mg dose, and the same as the MRHD (on an AUC basis) resulted in no maternal or developmental toxicity see Data)
The background risks of major birth defects and miscarriage for the indicated populations are unknown. All pregnancies have a background risk of birth defect, loss, or other adverse outcomes. In the U.S. general population, the estimated background risk of major birth defects and miscarriages are 2-4% and 15-20%, respectively.
Report pregnancies to the AbbVie Inc.’s Adverse Event reporting line at 1-800-633-9110, or FDA at 1-800-FDA-1088 or www.fda.gov/medwatch.
Clinical Considerations
Disease-Associated Maternal and/or Embryo/Fetal Risk
Published data suggest that increased disease activity is associated with the risk of developing adverse pregnancy outcomes in women with rheumatoid arthritis or inflammatory bowel disease. Adverse pregnancy outcomes include preterm delivery (before 37 weeks of gestation), low birth weight (less than 2500 g) infants, and small for gestational age at birth.
Data
Composed of several similar terms
reactions reported in less than 2% of patients in the RINVOQ 45 mg group and at a higher rate than in the placebo group through Week 12 included folliculitis, hypercholesterolemia, bronchitis, pneumonia, oral candidiasis, and
Animal Data
In an oral embryo-fetal development study, pregnant rats received upadacitinib at doses of 5, 25, and 75 mg/kg/day during the period of organogenesis from gestation day 6 to 17. Upadacitinib was teratogenic (skeletal malformations that consisted of misshapen humerus and bent scapula) at exposures equal to or greater than approximately 1.7 times the 15 mg dose, 0.9 times the 30 mg dose, and 0.6 times the MRHD (on an AUC basis at maternal oral doses of 5 mg/kg/day and higher). Additional skeletal malformations (bent forelimbs/hindlimbs and rib/vertebral defects) and decreased fetal body weights were observed in the absence of maternal toxicity at an exposure approximately 84 times the 15 mg dose, 43 times the 30 mg dose, and 31 times the MRHD (on an AUC basis at a maternal oral dose of 75 mg/kg/day).
In a second oral embryo-fetal development study, pregnant rats received upadacitinib at doses of 1.5 and 4 mg/kg/day during the period of organogenesis from gestation day 6 to 17. Upadacitinib was teratogenic (skeletal malformations that included bent humerus and scapula) at exposures approximately 1.6 times the 15 mg dose, 0.8 times the 30 mg dose, and 0.6 times the MRHD (on an AUC basis at maternal oral doses of 4 mg/kg/day). No developmental toxicity was observed in rats at an exposure approximately 0.29 times the 15 mg dose, 0.15 times the 30 mg dose, and 0.11 times the MRHD (on an AUC basis at a maternal oral dose of 1.5 mg/kg/day).
54 Revista Puertorriqueña de Medicina y Salud Pública DO NOT RE-SIZE
Adverse Reaction Placebo RINVOQ 45 mg Once Daily N = 378 (%) N = 719 (%) Upper respiratory tract infection* 7 9 Acne* 1 6 Increased blood creatine phosphokinase 1 5 Neutropenia* <1 5 Rash* 1 4 Elevated liver enzymes** 2 3 Lymphopenia* 1 3 Folliculitis 1 2 Herpes simplex* <1 2
Adverse Reaction Placebo RINVOQ 15 mg Once Daily RINVOQ 30 mg Once Daily N = 245 (%) N = 250 (%) N = 251 (%) Upper respiratory tract infection* 18 16 20 Increased blood creatine phosphokinase 2 6 8 Neutropenia* 2 3 6 Elevated liver enzymes** 1 6 4 Rash* 4 5 5 Herpes zoster 0 4 4 Folliculitis 2 2 4 Hypercholesterolemia* 1 2 4 Influenza 1 3 3 Herpes simplex* 1 2 3 Lymphopenia* 2 3 2 Hyperlipidemia* 0 2 2
Adverse Reaction Placebo RINVOQ 45 mg Once Daily N = 347 (%) N = 674 (%) Upper respiratory tract infection* 8 13 Anemia* 6 7 Acne* 2 6 Pyrexia 3 4 Increased blood creatine phosphokinase 1 3 Influenza 1 3 Herpes simplex* 1 3 Leukopenia* 1 2 Neutropenia* <1 2 Herpes zoster 0 2 *
Adverse
hyperlipidemia.
Adverse Reaction Placebo RINVOQ 15 mg Once Daily RINVOQ 30 mg Once Daily N = 223 (%) N = 221 (%) N = 229 (%) Upper respiratory tract infection* 11 14 12 Pyrexia 2 3 7 Herpes zoster* 2 3 5 Headache* 1 3 5 Acne* 3 2 5 Gastroenteritis* 2 3 3 Fatigue 2 3 3 Increased blood creatine phosphokinase 1 2 3 Elevated liver enzymes2 <1 2 3 Leukopenia* <1 1 2 Neutropenia* <1 1 2 Bronchitis* 0 1 2 Pneumonia* 1 4 1 Cough 2 3 1 1
Specific
Serious
2: Adverse Reactions Reported in ≥ 1% of Patients with Atopic Dermatitis Treated with RINVOQ 15 mg
Adverse Reaction Placebo RINVOQ 15 mg RINVOQ 30 mg N = 902 (%) N = 899 (%) N = 906 (%) Upper respiratory tract infection (URTI)* 17 23 25 Acne** 2 10 16 Herpes simplex*** 2 4 8 Headache 4 6 6 Increased blood creatine phosphokinase 2 5 6 Cough 1 3 3 Hypersensitivity**** 2 2 3 Folliculitis 1 2 3 Nausea 1 3 3 Abdominal pain***** 1 3 2 Pyrexia 1 2 2 Increased Weight 1 2 2 Herpes zoster****** 1 2 2 Influenza <1 2 2 Fatigue 1 1 2 Neutropenia <1 1 2 Myalgia 1 1 2 Influenza like illness 1 1 2
Table
20078707 R1 Rinvoq PB-10.5x13 (3).indd 2 08 Jun 2023 11:40 AM US-RNQG-230245
In an oral embryo-fetal developmental study, pregnant rabbits received upadacitinib at doses of 2.5, 10, and 25 mg/kg/day during the period of organogenesis from gestation day 7 to 19. Embryolethality, decreased fetal body weights, and cardiovascular malformations were observed in the presence of maternal toxicity at an exposure approximately 15 times the 15 mg dose, 7.6 times the 30 mg dose, and 5.6 times the MRHD (on an AUC basis at a maternal oral dose of 25 mg/kg/day). Embryolethality consisted of increased post-implantation loss that was due to elevated incidences of both total and early resorptions. No developmental toxicity was observed in rabbits at an exposure approximately 2.2 times the 15 mg dose, 1.1 times the 30 mg dose, and 0.82 times the MRHD (on an AUC basis at a maternal oral dose of 10 mg/kg/day).
In an oral pre- and post-natal development study, pregnant female rats received upadacitinib at doses of 2.5, 5, and 10 mg/kg/day from gestation day 6 through lactation day 20. No maternal or developmental toxicity was observed in either mothers or offspring, respectively, at an exposure approximately 3 times the 15 mg dose, 1.4 times the 30 mg dose, and at approximately the same exposure as the MRHD (on an AUC basis at a maternal oral dose of 10 mg/kg/day).
Lactation
Risk Summary
There are no data on the presence of upadacitinib in human milk, the effects on the breastfed infant, or the effects on milk production. Available pharmacodynamic/toxicological data in animals have shown excretion of upadacitinib in milk (see Data). When a drug is present in animal milk, it is likely that the drug will be present in human milk. Because of the potential for serious adverse reactions in the breastfed infant, advise patients that breastfeeding is not recommended during treatment with RINVOQ, and for 6 days (approximately 10 half-lives) after the last dose.
Data A single oral dose of 10 mg/kg radiolabeled upadacitinib was administered to lactating female Sprague-Dawley rats on post-partum days 7-8. Drug exposure was approximately 30-fold greater in milk than in maternal plasma based on AUC0-t values. Approximately 97% of drug-related material in milk was parent drug.
Females and Males of Reproductive Potential
Pregnancy Testing
Verify the pregnancy status of females of reproductive potential prior to starting treatment with RINVOQ
[see Use in Specific Populations]
Contraception
Females
Based on animal studies, upadacitinib may cause embryo-fetal harm when administered to pregnant women [see Use in Specific Populations]. Advise female patients of reproductive potential to use effective contraception during treatment with RINVOQ and for 4 weeks after the final dose.
Pediatric Use
Juvenile Idiopathic Arthritis, Psoriatic Arthritis, Ankylosing Spondylitis, and Non-radiographic Axial

Spondyloarthritis
The safety and effectiveness of RINVOQ in pediatric patients with juvenile idiopathic arthritis, psoriatic arthritis, ankylosing spondylitis, or non-radiographic axial spondyloarthritis have not been established.
Atopic Dermatitis
The safety and effectiveness of RINVOQ in pediatric patients 12 years of age and older weighing at least 40 kg with atopic dermatitis have been established. A total of 344 pediatric patients aged 12 to 17 years with moderate to severe atopic dermatitis were randomized across three trials (AD-1, AD-2 and AD-3) to receive either RINVOQ 15 mg (N=114) or 30 mg (N=114) or matching placebo (N=116) in monotherapy or combination with topical corticosteroids. Efficacy was consistent between the pediatric patients and adults. The adverse reaction profile in the pediatric patients was similar to the adults [see Adverse Reactions].
The safety and effectiveness of RINVOQ in pediatric patients less than 12 years of age with atopic dermatitis have not been established.
Ulcerative Colitis and Crohn’s Disease
The safety and effectiveness of RINVOQ in pediatric patients with ulcerative colitis and Crohn’s disease have not been established.
Geriatric Use
Rheumatoid Arthritis and Psoriatic Arthritis
Of the 4381 patients treated in the five clinical trials, a total of 906 rheumatoid arthritis patients were 65 years of age or older, including 146 patients 75 years and older. Of the 1827 patients treated in the two psoriatic arthritis Phase 3 clinical trials, a total of 274 patients were 65 years of age or older, including 34 patients 75 years and older. No differences in effectiveness were observed between these patients and younger patients; however, there was a higher rate of overall adverse events, including serious infections, in patients 65 years of age and older.
Atopic Dermatitis
Of the 2583 patients treated in the three Phase 3 clinical trials, a total of 120 patients with atopic dermatitis were 65 years of age or older, including 6 patients 75 years of age. No differences in effectiveness were observed between these patients and younger patients; however, there was a higher rate of serious infections and malignancies in those patients 65 years of age or older in the 30 mg dosing group in the long-term trials.
Ulcerative Colitis
Of the 1097 patients treated in the controlled clinical trials, a total of 95 patients with ulcerative colitis were 65 years and older. Clinical studies of RINVOQ did not include sufficient numbers of patients 65 years of age and older with ulcerative colitis to determine whether they respond differently from younger adult patients.
Crohn’s Disease
Of the 1021 patients who were treated in the controlled induction clinical trials, a total of 39 patients with Crohn’s disease were 65 years of age or older, and no patients were 75 years of age or older. Clinical studies of RINVOQ did not include sufficient numbers of patients 65 years of age and older with Crohn’s disease to determine whether they respond differently from younger adult patients.
Ankylosing Spondylitis
Of the 607 patients treated in the controlled clinical trials, a total of 32 patients with ankylosing spondylitis were 65 years and older. Clinical studies of RINVOQ did not include sufficient numbers of patients 65 years of age and older with ankylosing spondylitis to determine whether they respond differently from younger adult patients.
Non-radiographic Axial Spondyloarthritis
Of the 313 patients treated in a phase 3 clinical trial, a total of 9 patients with non-radiographic axial spondyloarthritis were 65 years and older. Clinical studies of RINVOQ did not include sufficient numbers of patients 65 years of age and older with non-radiographic axial spondyloarthritis to determine whether they respond differently from younger adult patients.
Renal Impairment
For patients with rheumatoid arthritis, psoriatic arthritis, ankylosing spondylitis, or non-radiographic axial spondyloarthritis, no dosage adjustment is needed in patients with mild (eGFR 60 to < 90 mL/min/1.73 m2), moderate (eGFR 30 to < 60 mL/min/1.73 m2), or severe renal impairment (eGFR 15 to < 30 mL/min/1.73 m2).
For patients with atopic dermatitis, the maximum recommended dosage is 15 mg once daily for patients with severe renal impairment. No dosage adjustment is needed in patients with mild or moderate renal impairment.
For patients with ulcerative colitis or Crohn’s disease, the recommended dosage for severe renal impairment is 30 mg once daily for induction and 15 mg once daily for maintenance. No dosage adjustment is needed in patients with mild or moderate renal impairment.
RINVOQ has not been studied in patients with end stage renal disease (eGFR <15 mL/min/1.73m2).
Use in patients with atopic dermatitis, ulcerative colitis, or Crohn’s disease with end stage renal disease is not recommended.
Hepatic Impairment
The use of RINVOQ has not been studied in patients with severe hepatic impairment (Child Pugh C), and therefore not recommended for use in patients with rheumatoid arthritis, psoriatic arthritis, atopic dermatitis, ulcerative colitis, Crohn’s disease, ankylosing spondylitis, and non-radiographic axial spondyloarthritis.
For patients with rheumatoid arthritis, psoriatic arthritis, atopic dermatitis, ankylosing spondylitis, and non-radiographic axial spondyloarthritis no dosage adjustment is needed in patients with mild (Child Pugh A) or moderate (Child Pugh B) hepatic impairment.
For patients with ulcerative colitis or Crohn’s disease, the recommended dosage for mild to moderate hepatic impairment is 30 mg once daily for induction and 15 mg once daily for maintenance
PATIENT COUNSELING INFORMATION
Advise the patient to read the FDA-approved patient labeling (Medication Guide).
Serious Infections
Inform patients that they may be more likely to develop infections when taking RINVOQ. Instruct patients to contact their healthcare provider immediately during treatment if they develop any signs or symptoms of an infection [see Warnings and Precautions]
Advise patients that the risk of herpes zoster is increased in patients taking RINVOQ and in some cases can be serious [see Warnings and Precautions]
Malignancies
Inform patients that RINVOQ may increase their risk of certain cancers and that periodic skin examinations should be performed while using RINVOQ.
Advise patients that exposure to sunlight and UV light should be limited by wearing protective clothing and using a broad-spectrum sunscreen [see Warnings and Precautions]
Major Adverse Cardiovascular Events
Inform patients that RINVOQ may increase their risk of major adverse cardiovascular events (MACE) including myocardial infarction, stroke, and cardiovascular death. Instruct all patients, especially current or past smokers or patients with other cardiovascular risk factors, to be alert for the development of signs and symptoms of cardiovascular events [see Warnings and Precautions]
Thrombosis
Inform patients that events of deep venous thrombosis and pulmonary embolism have been reported in clinical trials with RINVOQ. Instruct patients to seek immediate medical attention if they develop any signs or symptoms of a DVT or PE [see Warnings and Precautions]
Hypersensitivity Reactions
Advise patients to discontinue RINVOQ and seek immediate medical attention if they develop any signs and symptoms of allergic reactions [see Warnings and Precautions].
Gastrointestinal Perforations
Inform patients that gastrointestinal perforations have been reported in clinical trials with RINVOQ and that risk factors include the use of NSAIDs, corticosteroids, or history of diverticulitis. Instruct patients to seek medical care immediately if they experience new onset of abdominal pain, fever, chills, nausea, or vomiting [see Warnings and Precautions].
Retinal Detachment
Inform patients that retinal detachment has been reported in clinical trials with RINVOQ. Advise patients to immediately inform their healthcare provider if they develop any sudden changes in vision while receiving RINVOQ [see Adverse Reactions]
Laboratory Abnormalities
Inform patients that RINVOQ may affect certain lab tests, and that blood tests are required before and during RINVOQ treatment [see Warnings and Precautions]
Vaccinations
Advise patients to avoid use of live vaccines with RINVOQ. Instruct patients to inform their healthcare practitioner that they are taking RINVOQ prior to a potential vaccination [see Warnings and Precautions]
Embryo-Fetal Toxicity
Advise pregnant women and females of reproductive potential that exposure to RINVOQ during pregnancy may result in fetal harm. Advise females to inform their healthcare provider of a known or suspected pregnancy [see Warnings and Precautions and Use in Specific Populations]
Advise females of reproductive potential that effective contraception should be used during treatment and for 4 weeks following the final dose of upadacitinib [see Use in Specific Populations]
Advise females patients who are exposed to RINVOQ during pregnancy to contact AbbVie Inc. at 1-800-633-9110 or FDA at 1-800-FDA-1088 or www.fda.gov/medwatch.
Lactation
Advise women not to breastfeed during treatment with RINVOQ and for 6 days after the last dose [see Use in
Specific Populations]
Administration
Advise patients not to chew, crush, or split RINVOQ tablets.
Advise patients to avoid food or drink containing grapefruit during treatment with RINVOQ [see Drug Interactions]
Medication Residue in Stool
Instruct patients to notify their healthcare provider if they repeatedly notice medication residue (e.g., intact RINVOQ tablet or fragments) in stool or ostomy output [see Warnings and Precautions].
Manufactured by: AbbVie Inc., North Chicago, IL 60064, USA
RINVOQ® is a registered trademark of AbbVie Biotechnology Ltd.
©2019-2023 AbbVie Inc.
Ref: 20078707 R1
LAB-9408 MASTER
Revised: May 2023
Revista Puertorriqueña de Medicina y Salud Pública 55 DO NOT RE-SIZE
20078707 R1 Rinvoq PB-10.5x13 (3).indd 3 08 Jun 2023 11:40 AM US-RNQG-230245 US-RNQG-230245
NOTAS SOBRE EL INICIO Y DESARROLLO DE LA MEDICINA DE FAMILIA COMO ESPECIALIDAD


56 Revista Puertorriqueña de Medicina y Salud Pública
Félix Betancourt Bojos, MD, DABFM


La Medicina de Familia como especialidad tiene su origen en los Estados Unidos de Norteamérica (EEUU) por una serie de circunstancias médico-sociales que impactaron los servicios médicos en esa nación.
Para 1931 el 80% de los médicos en EEUU eran generalistas (GP). Sin embargo, este tipo de practica comenzaba gradualmente a desaparecer por una serie de circunstancias históricas que se mencionan a continuación.
1. Con los avances acelerados en la medicina que ocurrían en la primera mitad del Siglo XX, la comunidad médica académica consideraba imposible que alguien pudiera dominar todos los avances científicos, clínicos y tecnológicos de la medicina. Esta actitud y falta de modelos (“role models”), entiéndase médicos generalistas, dentro de las facultades médicas en las escuelas de medicina, desilusionaba a los egresados para seguir una carrera como generalista y los persuadía a adiestrarse en especialidades donde pudiesen adquirir un dominio mucho mayor sobre su campo de conocimiento.

2. Dentro de la medicina organizada,
los especialistas se fueron posesionando de los roles de liderato y los generalistas se percibían como una cepa en extinción y, aunque eran tolerados, no tenían ni poder ni portavoces efectivos.
3. Muchos generalistas que sirvieron en las fuerzas armadas durante la Segunda Guerra Mundial, al licenciarse, aprovechaban el “G.I. Bill” 3 que les permitía especializarse y tener carreras más lucrativas.
4. Después de la guerra, aquellos generalistas que regresaban a sus pueblos esperando continuar su práctica médica como antes, se encontraban con que se les limitaba sus privilegios para hacer cirugía en los hospitales, incluyendo procedimientos que antes hacían. En ese entonces el “American College of Surgeons” (“Colegio Americano de Cirujanos”) era la agencia acreditadora de los hospitales.
5. Los generalistas que permanecieron trabajando en sus pueblos durante la guerra se encontraron con una carga de trabajo excesivo que les daba poco tiempo para el enriquecimiento educativo o personal y renovarse profesionalmente.
Revista Puertorriqueña de Medicina y Salud Pública 57
Médico de familia y coordinador de Educación Médica en Manatí Medical Center.
Ante este panorama, el 3 de junio de 1946, un grupo de médicos generalistas que formaron la sección de medicina general de la “American Medical Association” (Asociación Médica Americana” o “AMA por sus siglas en inglés) tuvieron su primera reunión en la ciudad de San Francisco. Allí decidieron formar su propia sociedad médica el año siguiente. El 10 de junio de 1947 alrededor de 200 generalistas se reunieron en Atlantic City, aprobaron una constitución y unos “by-laws”, eligieron sus oficiales y dieron origen al “American Academy of General Practice” (“Academia Americana de Practica General” o “AAGP” por sus siglas en inglés). Esta organización se convierte en la portavoz unificada y fuerte de los generalistas y su representación en el ámbito privado y profesional. Fue la primera organización médica en requerir un mínimo de 150 horas de educación médica continua (CME) cada 3 años como condición para mantener la membrecía activa.
Su crecimiento fue rápido y pronto se convierte en la segunda organización médica más numerosa después de la AMA. Para 1949 ya la AAGP contaba
con alrededor de 10,000 miembros. En ese mismo año, en Cincinnati, Ohio se celebró la primera Asamblea Científica Anual, una tradición educativa que ha perdurado hasta el presente.
En la década de 1950 se ve claramente que la supervivencia de Medicina General va a depender de captar y mantener el interés de los estudiantes de medicina, la mayoría de los cuales indicaban su intención en convertirse en GP’s al entrar, pero al final de sus estudios pocos proseguían esa línea.
Esta situación se debía a que:
1. Había una falta de “role models” en las escuelas de medicina.
2. El adiestramiento se llevaba a cabo mayormente con pacientes encamados y enfermedades poco usuales y
3. Los problemas médicos comunes, la continuidad de cuidado, la medicina ambulatoria, el mantenimiento de salud y la prevención, el cuidado longitudinal de las condiciones crónicas y la consejería casi se olvidaba dentro de la preocupación con enfermedades inusuales en una población de pacientes casi totalmente intrahospitalaria.

Para ese año (1965), la importancia y la necesidad de certificación (“board”) se hacía aparente y habiéndose logrado un consenso en el Congreso de Delegados de la AAGP, se ordena a los oficiales de esta organización que procedieran a solicitar la formación de una Junta Acreditadora. Ese año se le pidió a la AAGP que retirara su solicitud momentáneamente hasta esperar el reporte de 2 grupos designados por la AMA para estudiar el problema: el “Citizens Commission on Graduate Medical Education” (“Comisión Ciudadana Para Educación Médica Graduada”) dirigido por John S. Millis, PhD, presidente de Western Reserve University y el “Ad Hoc Committee on Education for Family Practice” (“Comité Ad Hoc Para Educación en Practica de Medicina Familiar”), dirigido por el Dr. William R. Willard, Decano de Medicina de la Universidad de Kentucky. Además, un tercer grupo, el “National Commission on Community Health Services” (“Comisión Nacional en Servicios de Salud Comunitarios”) dirigido por
Los 3 grupos rindieron sus informes en 1966 y coincidieron grandemente en sus conclusiones. El Reporte Millis indicaba que la creciente especialización había llevado a la fragmentación de la educación y a un desbalance en la prestación del cuidado médico. Muy pocos médicos se estaban adiestrando para aceptar responsabilidad primaria por el cuidado abarcador y continuo del paciente y un nuevo tipo de proveedor, el “medico primario” era necesitado. En sus conclusiones decía este informe: “There should be a specialty board certification examination and diplomate status for physicians highly qualified in comprehensive care” (“Debe haber un examen de certificación de una junta de especialidad y status de diplomado para médicos altamente cualificados en cuidado abarcador”). El reporte Willard abogaba por “un por nuevo tipo de especialista en medicina de familia, educado para proveer

58 Revista Puertorriqueña de Medicina y Salud Pública
YA PARA 1965, SOLO EL 37% DE LOS MÉDICOS EN LOS EEUU ERAN GENERALISTAS Y SOLO EL 15% DE LOS GRADUADOS ESCOGÍAN ESA PRACTICA.
Marion B. Folsom, Ex - Secretario de Salud, Educación y Bienestar, también investigaba estos problemas.
un cuidado de salud abarcador y personal.” En sus conclusiones decía este informe:” … Recognition and status equivalent to other medical specialties should be given to Family practice.” (“… Reconocimiento y status equivalente al de otras especialidades médicas debe ser otorgada a la práctica familiar”) El reporte Folsom concluye: “Every individual should have a personal physician who is the central point for integration and continuity of all medical and medically related services to his patients” 6 (“Cada individuo debe tener un médico personal que sea el punto central de integración y continuidad de todos los servicios médicos o medicamente relacionados de sus pacientes).
Finalmente, luego de una serie de inconvenientes y exigencias repetitivas para lograr una definición más clara de la especialidad, el 8 de febrero de 1969 el “Liason Committee for Specialty Boards” (“Comité de Enlace para Juntas de Especialidades”) aprobó el establecimiento del “American Board of
Através de los esfuerzos de la AAGP, las gestiones hechas por los exalumnos GP’s y legisladores estatales, algunas escuelas de medicina iniciaron preceptorías para exponer a sus estudiantes al “mundo real” de la practica general. Se pretendía persuadir a los estudiantes a que siguieran la práctica de medicina general en áreas de escasez de servicios médicos ya que la mayoría de las preceptorías se llevaban a cabo en comunidades pequeñas y áreas rurales. Aunque estas acciones marcaron el inicio de un esfuerzo, la necesidad absoluta de un adiestramiento en medicina general más allá del internado se iba reconociendo, al igual que la necesidad de un espacio significativo en el ámbito académico.
En 1958, un comité de la AAGP le reportó al Congreso de Delegados (la “legislatura” de la organización) que la falta de una Junta Certificadora (“Board”) entorpecía seriamente el desarrollo de programas de adiestramiento y desanimaba a los jóvenes graduados de escoger Medicina General como su área de práctica. El comité propuso reemplazar el internado de un año por un adiestramiento intrahospitalario de dos años. Aunque la Junta de Directores
de la AAGP aprobó el reporte, este fue rechazado por el Congreso de Delegados. Muchos GP’s se sentían amenazados de perder los privilegios hospitalarios que tenían, especialmente en cirugía, al tener que competir con los egresados de estos nuevos programas.
A pesar de esto, 2 meses más tarde, la Sección de Medicina General de la AMA adoptó una resolución pidiendo a sus oficiales “que se procediera con deliberada premura hacia la creación de un “Board” de Medicina General para los médicos de familia”.
Las residencias de 2 años en Medicina General que surgieron en esta época eran variables en sus ofrecimientos: algunas requerían adiestramiento en gineco-obstetricia o cirugía y otras no. Se podía decir que, colectivamente, estaban pobremente organizadas, pobremente financiadas, orientadas hacia el servicio y con muchas posiciones vacantes.
Family Practice” (“Junta Americana de Practica Familiar” o ABFP por sus siglas en inglés) como la vigésima especialidad en la medicina estadounidense. Reconociendo la nueva especialidad, la AAGP cambio su nombre a “American Academy of Family Physicians” (“Academia Americana de Medicos de Familia” o AAFP por sus siglas en ingles) en 1971. Entre 1968 y 1970, varias de las antiguas residencias de 2 años en medicina general adoptaron el nuevo currículo de 3 años e hicieron la transición a la nueva especialidad.

En 1970 se ofrece por primera vez el examen de certificación a aquellos médicos generalistas que llenaban los requisitos de experiencias y educación médica continúa exigidos por el ABFP. Este “board” fue el primero que caducaba a los 7 años y requería del médico que lo tomara luego de estos intervalos y que tuviera una cantidad mínima de CME requerida para poder hacerlo.
En 1976 se ofreció el primer examen
de re-certificación y el 1978 fue el último año en que se pudo tomar el examen sin haber completado una residencia.
No entraremos aquí en los detalles de las dificultades organizacionales, administrativas, curriculares y del reclutamiento inicial de facultativos por las cuales ha pasado la especialidad. Basta decir que para mediados de la década de 1980 se habían acreditado alrededor de 380 programas de residencia y había unos 7,400 residentes.
LA
Revista Puertorriqueña de Medicina y Salud Pública 59
HAN
ESPECIALIDAD HA CONTINUADO SU EVOLUCIÓN RESPONDIENDO A LOS CAMBIOS CIENTÍFICOS, TECNOLÓGICOS, SOCIALES, ECONÓMICOS Y GUBERNAMENTALES
QUE
IMPACTADO NUESTRO ENTORNO.
LA EXPERIENCIA EN PUERTO RICO

mitad de la década de 1960 se crea también una Residencia en Medicina General en el Hospital Universitario (taller clínico de la EM-UPR) y esta logra graduar a solamente un residente: el Dr. Aníbal Marín10. El interés casi nulo de los graduandos de la EM-UPR por seguir esta trayectoria, sin duda por falta de modelos a emular dentro de la facultad, hace que esta residencia no prospere. Es importante señalar también que, para esta época, la EM-UPR era la única escuela de medicina existente en PR.
espacio y tiempo, igual que a los detractores en contra del proyecto de ley…”
En 1957, diez años después de haberse fundado en EEUU la AAGP, varios médicos generalistas en Puerto Rico (PR) se reunieron en el restaurant Swiss Chalet en Santurce y decidieron fundar un capítulo de PR de la AAGP7,8. Los miembros fundadores fueron los doctores Fernando Vallecillo, primer presidente, Ralph Lum, secretario y delegado a la AAGP, Pedro Molano, Luis Torres Aguiar, Héctor Sampayo, Rafael Cuevas Zamora, Henry Soto, Manuel Rodríguez Emma, Eladio Montalvo Duran, Rafael Guerrero, Anthony Lombardi, Ángel Mattos y Héctor Feliciano.
El grupo original y los numerosos médicos que se unieron posteriormente, bajo el liderato del Dr. Ralph Lum, comienzan a celebrar anualmente, a partir de 1963, una actividad científica anual de educación médica continua la cual se denominó “Caribbean Conference on Diagnostic Medicine” (Conferencia Caribeña en Medicina Diagnostica”). En años subsiguientes se logra que los capítulos de Connecticut, Georgia, Ohio y Pennsylvania celebren sus convenciones en PR7. Esta actividad anual ayudaba a los médicos locales a obtener los créditos de CME necesarios para actualizar sus conocimientos y cumplir con este requisito de membresía de la AAGP.
Entre los años 1966 y 1969 se inician conversaciones entre el liderato del capítulo local (Asociación de Médicos de Familia de Puerto Rico o AMFPR) con la Escuela de Medicina de la Universidad de Puerto Rico (EM-UPR) para gestionar la formación de una sección de Medicina General dentro del Departamento de Medicina Interna. En esta gestión tuvieron participación prominente los doctores Héctor y Lino Feliciano, Ángel Mattos, Eladio Montalvo Duran, Eliseo Boneta y Rafael Guerrero. Esta meta se logra para finales de la década. En la segunda

Subsiguientemente, también a instancia del liderato de la Academia local, se desarrolla un curso electivo dentro del currículo de la EM-UPR consistente en una preceptoría que permitía a los estudiantes de tercero y cuarto año rotar durante el verano por la oficina privada de médicos de la Academia.
Esta actividad comienza en 1971 con el Dr. Héctor Feliciano como el primer preceptor9 y luego con los doctores Lino Feliciano, Ángel Mattos, Pedro Ortiz Santiago, Eliseo Boneta, Roberto Correa Ayala, Antonio Carro y José Abreu Elías entre otros.
En 1970 el primer año en que el ABFP ofrece el “Board”, el Dr. Héctor Feliciano lo aprueba, siendo el primer médico en PR en lograrlo.
A principios de la década de 1970, la AMFPR inicia gestiones para planificar y desarrollar un programa de Residencia en Medicina de Familia adscrito a la EM-UPR. Para tales propósitos, se le delega dicha encomienda al Dr. Merlín Lugo Faria, quien era miembro del capítulo local y egresado de la EM-UPR.
El Dr. Lugo formo un equipo de trabajo y en corto tiempo completó un proyecto para el cual hacía falta financiamiento. Afortunadamente, para ese entonces, el Dr. Luis Izquierdo Mora, quien había sido Presidente de la AMFPR para 1966-67, era Senador y Presidente de la Comisión de Hacienda y Secretario de la Comisión de Salud del Senado de PR. Este recibe la encomienda de parte del Presidente del capítulo local, Dr. Pedro Ortiz Santiago y de un numeroso grupo de miembros y “… Después de múltiples gestiones, debates, desvelos, controversias y de oposición inclusive de algunos médicos de la Legislatura… logra que se apruebe el proyecto derrotando las objeciones legendarias y tradicionales… de falta de dinero,
El proyecto aprobado fue la Resolución Conjunta del Senado Numero 228 que asignaba $250,000 anuales a la EM-UPR para el establecimiento de un Programa de Residencia en la recién creada especialidad. Se designó como primer Director al Dr. Aníbal Marín, que como se apuntó anteriormente, fue el único egresado de la Residencia en Medicina General del Hospital Universitario.
Se escoge para la sede del Programa al Hospital Regional de Caguas, Dr. Eduardo Garrido Morales (hoy Hospital Menonita de Caguas) y el primer grupo de 2 residentes comienza el 1ro de julio de 1973. Ellos fueron el Dr. Félix Betancourt Bojos y el Dr. Néstor Rivera Pérez. Ambos completan su adiestramiento en 1976 y el Dr. Betancourt Bojos aprueba el “Board” ese mismo año, siendo el primer egresado de la especialidad en PR en hacerlo.
Resulta curioso e interesante señalar que el Dr. Rivera Pérez había ejercido como Ingeniero Civil y había trabajado con la Autoridad de Carreteras antes de estudiar medicina y posteriormente, luego de establecer su oficina médica privada, estudio leyes, aprobando la reválida y convirtiéndose en poseedor de 3 profesiones: ingeniería civil, médico y abogado.
Luego de su retiro de la política en 1976, el Dr. Izquierdo Mora retornó a su práctica médica, aprobó el “Board” (ya que hasta el 1978 se podía tomar sin haber cursado una residencia) y de ahí en adelante dedicó todos sus esfuerzos a promover la especialidad en las nuevas escuelas de medicina (San Juan Bautista; Escuela de Medicina de Cayey – luego renombrada Universidad Central del Caribe o U.C.C y la Escuela de Medicina de Ponce) y en los diversos hospitales de la isla, estimulando la creación de nuevas residencias y departamentos de la especialidad en dichas instituciones.
En enero de 1985 el gobernador Rafael Hernández Colón nombra al Dr. Luis Izquierdo Mora Secretario de Salud. Este evento da un poderoso impulso al rol de la especialidad en la prestación de servicios de salud por el gobierno de PR a nivel primario, incluyendo la conversión de Centros de Diagnóstico y
60 Revista Puertorriqueña de Medicina y Salud Pública
Tratamiento en los pueblos a Centros de Salud Familiar.
En estos menesteres estuvieron envueltos Médicos de Familia tales como el Dr. Ramon Suarez, el Dr. Jaime Diaz Hernández y el Dr. Víctor Mercado, todos egresados de la residencia de la EM-UPR, además del Dr. Raúl Castellanos Bran y muchos otros colegas cuyos nombres aparecen en la referencia citada. Nunca se podrá sobreestimar el rol del Dr. Luis Izquierdo Mora en el inicio y desarrollo de la especialidad en PR, ni su incansable actividad como servidor público. En los últimos años una de sus nietas la Dra. Carmen Izquierdo Henn, también escogió Medicina de Familia como su área de especialidad.

Retornando al desarrollo histórico, mencionamos a continuación las residencias que surgen posteriormente y sus fundadores:
Año de inicio: 1985
Fundadores: Dr. Edgardo Laguillo, Dr. Gerard Ramos y colaboradores.
El Dr. Luis F. Sala, Presidente de la Junta de Directores de la EMP y el Dr. Enrique Méndez, Jr. su Decano al igual que el Dr. Miro, de la Junta de Directores del hospital, dieron su respaldo a la residencia.
3. Hospital de Área Dr. Alejandro Otero López, Manatí (hoy “Manatí Medical Center”).
Anteriormente había sido un taller clínico de la residencia del Hospital San Pablo y consigue acreditación como residencia independiente.
Año de inicio: 1991
Fundadores: Dr. Víctor Mercado, Dra. Enid Mateo y colaboradores.
4. Hospital Regional Ramon Ruiz Arnau, Bayamón adscrito a la Escuela de Medicina de la UCC.
Fundador: Dr. Eliasin Muñoz y Dra. Laura Mata
El Dr. Muñoz fue egresado de la residencia del Hospital Dr. Pila.
6. Mayagüez Medical Center, Mayagüez

Año de inicio: 2012
Fundadores: Dr. Eliasin Muñoz y Dra. Laura Mata incluyendo al Dr. Norman Ramírez Lluch, Ortopeda Pediátrico.
En la década de 1990 comienza la reforma del sistema de salud pública de la isla. Este cambio afecta a algunas de las residencias, mayormente por la disminución o perdida de pacientes, factor que es monitorizado y regulado por la agencia acreditadora. Desafortunadamente, este y otros cambios provocan el que 3 programas cierren sus puertas:
Año de inicio: 1981
Fundadores: Dr. Ramón Suarez, Dr. Víctor Mercado, Dra. Julia Bonilla y colaboradores.
El Dr. Arturo Cadilla, hijo, principal accionista del hospital, y el Dr. Pedro Mayol, su Director Médico, al igual que la Junta de Directores, dieron su apoyo a este proyecto.
Año de inicio: 1991
Fundadores: Dr. Ramón Suarez, Dra. Julia Bonilla, Dr. Harry Mercado y colaboradores.
Es importante señalar que todas las residencias que se establecen hasta 1991 son fundadas por, o sus primeros directores son, egresados del primer programa de residencia que comenzó en 1973.
5. Hospital Bella Vista, Mayagüez
Año de inicio: 1997
• Hospital San Pablo en 2005 por perdida de acreditación
• Hospital Ramón Ruiz Arnau en 2006, también por perdida de acreditación y
• Hospital Dr. Pila en 2008 quien se retira voluntariamente del proceso de acreditación por no poder cumplir con los requisitos.
A pesar de estas pérdidas, los 4 programas que aún existen han logrado solidificar su status económico y académico y continúan egresando médicos en la especialidad.
Revista Puertorriqueña de Medicina y Salud Pública 61
1. Hospital San Pablo, Bayamón
2. Hospital Manuel de la Pila Iglesias (Dr. Pila), Ponce adscrito a la escuela de Medicina de Ponce (EMP)
ALGUNOS LOGROS IMPORTANTES DE LOS MEDICOS DE FAMILIA EN PUERTO RICO
Dos médicos de Familia logran alcanzar sucesivamente la posición de Decano de Medicina de la Universidad Central del Caribe: las doctoras Julia Bonilla y Helen Rosa.
El Dr. Ángel Mattos, quien cumplió recientemente sus 100 años, enseñó a toda una generación de residentes de la EM-UPR las destrezas de cirugía menor. Por muchos años fue delegado del Capítulo de PR al Congreso de la AAFP y fue electo por 3 años como miembro de su Junta de Directores. Además, fue el fundador y Director del Coro de Bayamón por más de 25 años.
Los doctores Aníbal Marín y Richard Martínez de Andino tuvieron un rol prominente como catedráticos a nivel pre y postgrado e investigación en la EMUPR. Ambos sirvieron como Presidentes de la AMFPR: el Dr. Marín en 1975-76 y el Dr. Martínez de Andino en 1984-85. La esposa del Dr. De Andino, Marian de Jesús, también Médico de Familia ha estado envuelta en la residencia de la EM-UPR y prominentemente a nivel nacional en la AAFP.
El Dr. José Ramon Medina, además de servir como Secretario y Tesorero de la AMFPR por varios años en la década del 70, fue el moderador del programa televisivo “EL BUZON DE LA MEDICINA”, que se transmitía semanalmente por la WIPR, canal 6, desde 1968 hasta 1988.
El Dr. Jaime Claudio Villamil también ha tenido un rol prominente en los medios de comunicación masiva. Desde 1983 hasta 1996 ofreció un segmento de periodismo medico a través de WAPA, canal 4 y luego por el canal 11 entre 1999 y 2002. Desde 2008 tiene un programa por Radio-Isla. El Dr. Claudio Villamil es Catedrático Ad-Honorem de la EM-UPR y ha sido investigador
afiliado al “National Institutes of Health” (NIH). Ha participado activamente en círculos de arte, filosofía e historia en PR.
El Dr. Ismael Toro Grajales además de haber sido Presidente de la AMFPR (1997-98) ha formado parte de la oficialidad del Colegio de Médicos de PR. Junto a su esposa, la Dra. Ilia Zayas, ha demostrado lo exitoso que se puede ser como empresario en la práctica privada de la especialidad, habiendo creado un excelente centro geriátrico en Bayamón.
El Dr. Héctor Feliciano enseño por 15 años un curso de EKG para los internos del Hospital Auxilio Mutuo. Además, ha tenido nombramientos como Catedrático (“Full Professor”) de la EM-UPR y recientemente (2017) fue honrado con la distinción de PROFESOR EMERITO de la UCC.
El Dr. Rafael Iriarte ha sido por muchos años un pilar de la educación médica en el área suroeste de Puerto Rico: actualmente labora como Decano Auxiliar para Desarrollo Profesional en el “Ponce Health Sciences University School of Medicine” y es Profesor de Salud Pública, Medicina de Familia y Pediatría en dicha institución. Autor y co-autor de numerosos estudios, sus intereses y actividades incluyen la práctica de la acupuntura y un profundo y variado interés en la música, incluyendo la ejecución en el saxofón.
El Dr. Carlos Garcia Goyco fue socio y colaborador del Dr. Luis Izquierdo Mora por muchos años. Aprobó los exámenes de certificación en Geriatría y Medicina Deportiva y se adiestró para realizar colonoscopias, procedimiento que también enseñaba a residentes de Medicina de Familia.
Los doctores Raúl Castellanos y Marina Almenas, además de haber sido presidentes del capítulo local y haber estado activos por décadas en su directiva, también se han envuelto a nivel internacional en la Organización Mundial de Médicos de Familia (WONCA), representado a Puerto Rico en dicha organización.
Una parte fundamental de la especialidad es el manejo de conocimientos y destrezas en las ciencias de la conducta. El Dr. Rafael Rodriguez Santiago fue el primer psiquiatra en la EM-UPR adiestrado en Terapia de Familia y fue el primer instructor de esa disciplina en la Residencia de Medicina de Familia de dicha institución. Luego le siguió la psicóloga Dra. Maria Batlle quien diseño un currículo para los residentes de dicho programa y años más tarde formó parte de la facultad del Programa de Residencia del Hospital San Pablo en Bayamón. Otra pionera en este campo ha sido la psicóloga Dra. Maria de los Angeles De Jesús quien comenzó esta actividad en la Residencia del Hospital de Área de Manatí (hoy “Manatí Medical Center”) desde sus inicios en 1991 y ha continuado su labor hasta el presente.
En la Residencia del Hospital Dr. Pila en Ponce, las psicólogas doctoras Milde Cordoliani y Catalina Quesada iniciaron un currículo en esa disciplina, seguidas por la Dra. Marta Febo, Médico de Familia.
Muchos otros colegas de la especialidad se han distinguido a nivel insular, nacional e internacional pero no podemos mencionarlos a todos. Reciban nuestras excusas por la omisión, pero sabrán que siempre permanecen en el recuerdo de sus pacientes y comunidades.
ROL DEL ESPECIALISTA EN MEDICINA DE FAMILIA
La AAFP define el rol del Médico de Familia de la siguiente forma: “Family physicians, through education and residency training, possess distinct attitudes, skills, and knowledge which qualify them to provide continuing and comprehensive medical care, health maintenance and preventive services to each member of the family regardless of gender, age, or type of problem, be it biological, behavioral, or social.

These specialists, because of their backgrounds and interactions with the family, are best qualified to serve as each patient’s advocate in all health-related matters, including the appropriate use of consultants, health services, and community resources” 12. (“Los médicos de familia, a través de su educación y adiestramiento en la residencia, poseen actitudes particulares, destrezas y conocimiento que los cualifica para
proveer cuidado medico continuo y abarcador, mantenimiento de salud y servicios preventivos a cada miembro de la familia, sin importar su género, edad o tipo de problema, ya sea biológico, conductual o social. Estos especialistas, debido a su trasfondo e interacciones con la familia, son los mejores cualificados para servir como partidarios de cada paciente en toda materia relacionada con la
62 Revista Puertorriqueña de Medicina y Salud Pública
salud, incluyendo el uso apropiado de consultores, servicios de salud y recursos comunitarios.”
Es de notar que la especialidad se crea, no para incorporar un cumulo de información cada vez mas abundante y de mayor profundidad en un área limitada, sino que surge como un reclamo de una profesión y una sociedad que entendía que las necesidades biosico-sociales de una población no se estaban atendiendo adecuadamente y que se necesitaba un médico con una amplitud de conocimientos que lo capacitaran para ser el eje central en la coordinación del cuidado de salud de los pacientes y sus comunidades. Es una especialidad en AMPLITUD, más
que en PROFUNDIDAD. Sin embargo, el Médico de Familia tiene la flexibilidad de concentrar su actividad en áreas de la medicina mas especializadas, si así lo desea, adquiriendo conocimientos y destrezas adicionales a través de diversos “fellowships”. El ABFM ofrece diversos “Certificate of Added Qualifications” (CAQ) en colaboración con otras juntas de especialidad que incluyen: Medicina de Adolescentes, Medicina Geriátrica, Medicina de Hospicio y Paliativa, Medicina de Control del Dolor, Medicina Deportiva y otros 13.
Un hecho que es importante mencionar es que, en la experiencia del autor, la obtención de algunos
privilegios en algunos hospitales por parte de los Médicos de Familia ha sido negados u obstaculizados por los comités de credenciales dirigidos por otros especialistas. Estos han excluido privilegios tales como: admisión de pacientes pediátricos, lectura de EKG’S, manejo de pacientes en unidades de intensivo/coronarias y evaluaciones pre-operatorias. Ese hecho subraya la importancia para los residentes y “fellows” de documentar exhaustivamente las experiencias clínicas y los procedimientos realizados durante su adiestramiento para luego poder presentar dicha evidencia cuando se solicitan privilegios en hospitales.
NOTA FINAL REFERENCIAS
En 1973 se publica el primer libro de texto de la recién creada especialidad: “FAMILY PRACTICE”, editado por los doctores Conn, Rakel y Johnson. En las primeras paginas del libro aparece una frase lapidaria atribuida al celebre escritor y novelista francés Victor Hugo. La frase dice: “Ningún ejercito puede soportar la fuerza de una idea cuyo momento ha llegado”. La historia de la especialidad en Medicina de Familia ha probado una vez mas la veracidad de esa afirmación.
El autor fue Director de la Residencia en Medicina de Familia de la EM-UPR (1976-78) y del Hospital San Pablo (1990-2005). Fue Presidente del Capitulo de PR de la AAFP (1979-80). Ha recibido nombramientos como Catedrático Asociado de la U.C.C y Catedrático Auxiliar de la EM-UPR, la Escuela de Medicina de Ponce y la Escuela de Medicina San Juan Bautista. Actualmente se desempeña como Coordinador de Educación Médica en Manatí Medical Center.
E-mail:
dr_f_betancourt@hotmail.com
P.O. Box 195134
San Juan, PR 00919-5134
1. “The Role of the Family Physician in America’s Developing Medical Care Program” (1968)

2. “Family Practice 1947-1987 A PGM Retrospective” Postgraduate Medicine (Journal) Vol. 81, No 2 February 1, 1987. La mayor parte de la información sobre el inicio y el desarrollo de la Medicina de Familia en los EEUU ha sido tomada verbatim o resumida y traducida de este excelente artículo. Su autor, el Dr. Jack Stelmach (ya fallecido) fue Presidente de la AAFP de 1978-79, Director del “Baptist Medical Center Family Practice Residency Program” en Kansas City, MO y un prominente líder de la especialidad a nivel nacional.
3. “Serviceman’s Readjustment Act” o “GI Bill of Rights” Ley aprobada en 1944 para ayudar a los veteranos que retornaban de la guerra. Este proveía ciertos beneficios, incluyendo prestamos o pagos de matrícula para estudiar profesiones.
4. Tomado del informe del “Citizen’s Commission on Graduate Medical Education”
5. Tomado del informe del “Ad Hoc Committee on Education for Family Practice”
6. Tomado del informe del “National Commission on Community Health Services”
7. “El Médico de Familia” libro del Dr. Luis Izquierdo Mora Págs. 29-41
8. Las paginas citadas de este libro son fundamentales para el entendimiento
de la dinámica en que se desarrolla la especialidad en PR.
9. Revista de la “Academia de Médicos de Familia de Puerto Rico” (AMFPR), edición especial de 2017 celebrando el 60 aniversario de la fundación del capitulo local. Esta edición es una excelente fuente de información sobre la historia de la AMFPR, sobre los logros de sus pasados presidentes y sobre las múltiples actividades a nivel nacional e internacional en que se han envuelto los oficiales y los miembros de dicha organización. También posee importantes fotos históricas de todo lo anterior.
10. Dr. Héctor Feliciano, comunicación personal
11. “Propuesta para la creación de un Departamento de Medicina de Familia” (1977). Documento interno de la EMUPR. Este documento fue el reporte final de un comité nombrado por el Decano de Medicina de dicha escuela con el propósito de crear un departamento en la especialidad a nivel pre-grado y reconocerle un status independiente del Departamento de Medicina Interna, del cual había sido una “sección” hasta entonces.
12. “El Médico de Familia” Págs. 58-70
13. Internet: “AAFP Family Physician, Definition”
14. Internet: “American Board of Family Medicine – Home Added Qualifications”
Revista Puertorriqueña de Medicina y Salud Pública 63
AGENDA MÉDICA 2023
EVENTOS Y CONVENCIONES
www.medicinaysaludpublica.com
Puerto Rico
Fecha Actividad Lugar Contacto TIPO DE EVENTO
15 al 18 de marzo de 2023
19 de marzo de 2023
30 de marzo de 2023
1 al 2 de abril de 2023
21 al 22 de abril de 2023
21 al 22 de abril de 2023
28 al 29 de abril de 2023
28 al 30 de abril de 2023
20 de mayo de 2023
26 al 29 de mayo de 2023
26 al 29 de mayo de 202
Julio 2023
11 al 13 de agosto de 2023
11 al 13 de agosto de 2023
12 al 13 de agosto de 2023
Convención anual #49 de la Academia Médica del Sur & Casa del Médico
Nephrology Symposium for Primary Physicians 2023
Convención anual de PIA
Academia de Patología y Medicina de Laboratorio de Puerto Rico
Convención de Médicos de Familia
Convención anual American College of Cardiology- PR Chapter
Convención anual Sociedad Radiológica de PR
Sociedad de Enfermedades Infecciosas de PR (SEINPR)
Caribbean Breast SymposiumSociedad Puertorriqueña de Senología
Ponce Hilton Hotel & Casino Ponce, PR
Antonio’s Restaurant, Condado, PR
Academia Médica del Sur 787-987-8301 / 787-843-0610 academiamedicadelsur@gmail.com
Business Planners - Merna Morales 787-645-9914 bplanner21@gmail.com
Convención
Simposio
Sheraton Puerto Rico Hotel & Casino, San Juan Virginia de los Reyes Convención
Caribe Hilton Hotel San Juan, PR
Serra & Serra 787 406-4571 / 787 640-5776 patologospr@serrayserra.com
Marriot Resort, San Juan, Stelaris Casino, Condado, Puerto Rico Nelly Feliciano
Royal Sonesta San Juan Carolina, PR Aixa Vélez 787-649-7681 / genteinc@gmail.com
Sheraton Convention Center Hotel San Juan, PR
Embassy Isla Verde
Embassy Suites, Isla Verde, Puerto Rico
Convención Sociedad Puertorriqueña de Oftalmología El Conquistador Resort, Fajardo, Puerto Rico
Convención Semi anual Sociedad Puertorriqueña de Endocrinología y Diabetología (SPED)
Convención anual Sociedad Puertorriqueña de Cardiología
Convención Colegio de Optómetras de Puerto Rico
13ma Convención Anual de la Academia de Médicos Generalistas y Primarios de PR
Convención anual Sociedad de Cirujanos Vasculares y Endovasculares de PR
17 al 19 de agosto de 2023 Convención Sociedad de Médicos Podiatras

19 de agosto de 2023
Convención anual de la Asociación de Gastroenterología y Hepatología Pediátrica de PR
19 de agosto de 2023 2023 Excellence in GI Nursing - Sociedad Puertorriqueña de Asistentes de Gastroenterología
23 al 24 de agosto de 2023
Convención Sociedad Puertorriqueña de Nefrología
Ponce Hilton Hotel & Casino Ponce, PR
Hyatt Regency Grand Reserve PR Río Grande, PR
Serra & Serra 787 406-4571 / 787 640-5776 info@socrad.com / info@serrayserra.com
Enid Rivera (804) 774-6326 / enidrm27@gmail.com
Priscilla González 787-615-6796 sociedadsenologapr@gmail.com
Rivs Marketing 787-294-9185 , 787-409-6497 rinavega@rivsmarketing.com
Educational Partners & Coaching 787-646-0780 perez.vilma@gmail.com
Sociedad Puertorriqueña de Cardiología 787-620-2228 socprcardio@gmail.com
Ponce Hilton Hotel & Casino Ponce, PR info@colegiooptometraspr.com
Hotel Sheraton Convention Center, San Juan, PR
La Concha Hotel, San Juan, P.R.
El Convento Hotel, San Juan, PR
Royal Sonesta SJ Hotel, Carolina, PR
Hotel La Concha, San Juan, PR
Royal Sonesta SJ Hotel, Carolina, PR
SR Consultants & Events 939-292-4115 / 787-649-2367 srconsultants&events@gmail.com
AMEC amec@amec-pr.com 787-289-8989

Aixa Vélez genteinc@gmail.com 787-649-7681
IC Planners ivettecolon@icplannerspr.com 787-504-3655
Rivs Marketing 787-548-0047 / info@rivsmarketing.com
Business Planners- Merna Morales 787-645-9914 bplanner21@gmail.com
Convención
Convención
Convención
Convención
Convención
Simposio
Convención
Convención
Convención
Convención
Convención
Convención
Convención
Convención
Convención
64 Revista Puertorriqueña de Medicina y Salud Pública
ACTIVIDADES ESTÁN SUJETAS A CAMBIO
AGENDA MÉDICA 2023
EVENTOS Y CONVENCIONES
www.medicinaysaludpublica.com
24 al 27 de agosto de 2023
25 al 27 de agosto de 2023
26 de agosto de 2023
26 de agosto de 2023
2 al 4 de septiembre de 2023
8 al 9 de septiembre de 2023
Convención anual del Colegio de Farmacéuticos de PR
Convención Sociedad Puertorriqueña de Neurología
Simposio de Alergistas e Immunólogos del Oeste - Asociación Puertorriqueña Médicos Alergistas
Educación Continua - Congreso de Psiquiatras de PR“Mental Health: New Frontiers of Hope”
Convención Anual de la Asociación de Médicos Pediatras de la Región Oeste (AMPRO)
2023 Caribbean Congress on Emergency Medicine - Colegio de Emergenciólogos de Puerto Rico
Sheraton Convention Center, San Juan, PR
Fairmont El San Juan Hotel, San Juan, PR
Rincón beach resort, PR
Royal Sonesta SJ Hotel, Carolina, PR
Mayagüez Resort & Casino, Mayagüez, PR
Royal Sonesta Hotel, Isla Verde, PR
Colegio de Farmacéuticos de PR 787-753-7157
AMEC 787-289-8989 - amec@amec-pr.com
IC Planners ivettecolon@icplannerspr.com 787-504-3655
Japri Planners - 787-612-6775 cmejapri@hotmail.com/japriplanners@hotmail.com
AMPRO ampropediatras@gmail.com
Rivs Marketing 787-548-0047 / info@rivsmarketing.com
Puerto Rico
Convención
Convención
Simposio
Convención
Congreso
22 al 24 de septiembre de 2023
Septiembre 2023
6 al 9 de octubre 2023
Congreso Coalición de Asma y otras Condiciones Respiraciones Crónicas de PR
Clinical Gastroenterology and Hepatology Update
Convención Sociedad Puertorriqueña de Cardiología Intervencional
Convención anual de la Asociación de Hematología y Oncología Médica de PR (AHOMPR)
Sheraton, San Juan, PR
Sheraton Convention Center, San Juan, PR
Fairmont El San Juan Hotel, 6063 Av. Isla Verde
Ponce Hilton
IC Planners ivettecolon@icplannerspr.com / 787-504-3655
Congreso 23 de septiembre de 2023
Rivs Marketing 787-548-0047 / info@rivsmarketing.com
Enid Rivera (804) 774-6326 enidrm27@gmail.com
Germaine Quiñones ahomprgq@gmail.com
787-608-1477
Convención
Convención
18 al 20 de octubre de 2023
26 al 29 de octubre de 2023
Dr. Susoni & Pavia Arecibo Medical Faculty Convention
14 de octubre de 2023 Hot Topics in Internal Medicine - Hospital Metropolitano
Convención annual de la Asociación de Hospitales de PR
Embassy Dorado del Mar, Dorado, PR
Sheraton Convention Center Hotel San Juan, PR
Caribe Gyn Ponce Hilton
26 al 28 de octubre de 2023 Convención anual Puerto Rico Urological Association (PRUA)
28 de octubre de 2023
Congreso anual Asociación Puertorriqueña de Médicos Alergistas
Sheraton Convention Center HotelSan Juan, PR
Sheraton Convention Center Hotel San Juan, PR
3 al 5 de noviembre de 2023 Puerto Rico HIV Treaters Medical Association Annual Convention Embassy Suites, Dorado, PR
3 al 5 de noviembre de 2023
10 al 12 noviembre de 2023
15 al 18 de noviembre de 2023
17 al 19 de noviembre de 2023
18 de noviembre de 2023
Convención Sociedad de Cirugía Plástica de PR Hyatt Regency Grand Reserve PR Río Grande, PR
Convención annual de la Asociación de Médicos Pediatras de la Región Este (AMPRE)
XIII Congreso Asoc Latinoamericana de Nefrología Pediátrica (ALANEPE)
Convención Anual Sociedad Puertorriqueña de Neumología
Improving Elderly Patient Care & 2023 Clinical Vignettes & Research Competition - American College of Physicians

Hotel Marriott Condado
Centro de Convenciones
Gobernador Pedro Roselló González, San Juan, PR
Royal Sonesta SJ Hotel, Carolina, PR
Sheraton Convention Center, San Juan, PR
Diciembre 2023 Convención Anual SPED Por confirmar
Diciembre 2023
Convención anual Colegio de Médicos Cirujanos de PR Por confirmar
Rivs Marketing - 787-548-0047 info@rivsmarketing.com Convención
Business Planners- Merna Morales 787-645-9914 bplanner21@gmail.com Convención
Germaine Quiñones ahomprgq@gmail.com 787-608-1477 Convención
Aixa Vélez genteinc@gmail.com 787-649-7681 Convención
IC Planners ivettecolon@icplannerspr.com 787-504-3655 Congreso
HIV Treaters Medical Association 787-646-0780 Educational Partners/Vilma Pérez

Aixa Vélez genteinc@gmail.com787-649-7681
Business Planners- Merna Morales 787-645-9914 bplanner21@gmail.com
www.alanepe.org + 56 2 3251 4970 info@alanepe.org
Business Planners- Merna Morales 787-645-9914 bplanner21@gmail.com
Rivs Marketing - 787-548-0047 info@rivsmarketing.com
Educational Partners & Coaching 787-646-0780 perez.vilma@gmail.com
Colegio de Médicos Cirujanos de PR 787-751-5979 info@colegiomedicopr.org
Convención
Convención
Congreso
Convención
Convención
Convención
ACTIVIDADES ESTÁN SUJETAS A CAMBIO
Revista Puertorriqueña de Medicina y Salud Pública 65
Fecha Actividad Lugar Contacto TIPO DE EVENTO
Tuve suerte.
“Estaba ocupada – trabajando y disfrutando de la vida. Ya me tocaba hacerme la prueba de Papanicolaou para verificar si tenía cáncer de cuello uterino. Cuando me hicieron la prueba, creímos que podría tener cáncer de cuello uterino. Finalmente, me llegaron resultados buenos – ¡no tuve cáncer! Mujeres, por favor háganse la prueba para detectar el cáncer de cuello uterino. Infórmense sobre el cáncer ginecológico.”



Los cánceres ginecológicos incluyen: cáncer de cuello uterino, de ovario, de útero, de vagina y de vulva. Solo el cáncer de cuello uterino se puede detectar a través de una prueba.
Aprenda cuáles son los síntomas y qué puede hacer para prevenir los cánceres ginecológicos.
http://www.cdc.gov/spanish/ cancer/knowledge
1-800-CDC-INFO
Cote De Pablo, Actriz
Visita Nuestro Mundo Digital
Web - Podcast - Video

Visita nuestra plataforma web, redes sociales y podcast ahora también disponibles en iTunes y Spotify, Suscríbete y no te pierdas el mejor contenido de Medicina y Salud Pública
PROTEGE TU PIEL PR: EVENTO MULTIDISCIPLINARIO SOBRE CONDICIONES DE LA PIEL
SÁBADO, 10 DE JUNIO DE 2023 EN SAN JUAN, PUERTO RICO
El encuentro entre pacientes y expertos logró fortalecer la educación sobre el diagnóstico y tratamiento de una gran variedad de enfermedades dermatológicas, al igual que concientizar y orientar sobre el manejo adecuado de las mismas.


Graduación Programas de Residencia Grupo Hospitalario (Bayamón,
Manatí y Mayagüez Medical Center)
Back to SchoolSecretaria de Educación Exitoso simposio sobre los últimos avances en la condición de cáncer de seno
Martes, 1 de agosto de 2023 en Corozal, Puerto Rico
Entrevista con la Dra. Yanira Raíces, secretaria del Departamento de Educación, durante la entrega de unas tarjetas de débito con fondos para cubrir la compra de materiales en las escuelas públicas para el regreso a clases.

Sociedad Puertorriqueña de Senología Sábado, 20 de mayo de 2023 en San Juan, PR

Durante el Caribbean Breast Symposium se discutieron las últimas vertientes referentes al cáncer de seno, además sobre otras condiciones que pueden afectar la salud de las mujeres.

Durante la tarde del sábado 20 de mayo se llevó a cabo la graduación de los programas de residencias del Grupo Hospitalario, que integra al Mayagüez Medical Center, Manatí Medical Center, Bayamón Medical Center y al Puerto Rico Women and Children’s Hospital. Del Programa de Residencia de Medicina Interna en Mayagüez Medical Center, se graduaron siete residentes, de los cuales cinco se quedarán practicando en Puerto Rico.

Revista Puertorriqueña de Medicina y Salud Pública 67
www.medicinaysaludpublica.com
@revistaMSP @revistaMSP @revistaMSP
Sábado, 20 de mayo de 2023 en San Juan, Puerto Rico
Entre los invitados al evento estuvieron presentes: Dr. José González y Dra. Alma Cruz, ambos dermatólogos, y varias asociaciones de pacientes. Fotomontaje de la Revista MSP.
Cinco de los siete residentes graduados se quedaron en Puerto Rico. Fotomontaje: Revista MSP.
Dra. Yanira Raíces, secretaria designada del Departamento de Educación. Foto: Revista MSP.
Dr. Bolivar Arboleda Osorio, cirujano especializado en Seno y director médico del Hospital Hima San Pablo de Caguas y Dr. Luis Báez Vallecillo, hematólogo oncólogo, ambos conferenciantes durante el Caribbean Breast Symposium 2023.
Abundan sobre numerosos temas relacionados a últimas innovaciones en el manejo adecuado de condiciones endocrinas
Sociedad Puertorriqueña de Endocrinología y Diabetología

Viernes, 26 de mayo al 28 de mayo de 2023 en Ponce, Puerto Rico
Durante la convención anual de SPED se discutieron temas como diabetes, hipertrigliceridemia y osteoporosis.
Viernes,
Más de 750 estudiantes del Recinto de Ciencias Médicas se graduaron en la Quincuagésima Séptima Colación de Grados de la Universidad de Puerto Rico, celebrada en el Coliseo Rubén Rodríguez en Bayamón. En la ceremonia de graduación se reconocieron a los estudiantes destacados de los diversos programas de la Escuela de Medicina, de Farmacia y de Salud Pública.


Caminata Da Vida
Miércoles, 31 de mayo de 2023 en Ponce, Puerto Rico
Bristol Myers Squibb reiteró su solidaridad con los pacientes de cáncer, a través de su participación en el evento “Da Vida Caminando con Raymond” y su colaboración con la Liga Puertorriqueña Contra el Cáncer y el Hospital Oncológico.


Empleados de la manufacturera en Manatí, Humacao y de la oficina comercial de Bristol Myers Squibb (BMS) caminaron junto con Raymond, pacientes, familiares, sobrevivientes y el público general desde Ponce hasta Juana Díaz, completando una ruta de siete (7) millas.
Miércoles, 7 de junio de 2023 en Ponce, Puerto Rico
En la mañana del miércoles 7 de junio de 2023, se realizó la ceremonia de grado número 43 de Ponce Health Sciences University. Desfilaron los candidatos a graduación de grado doctor en salud pública con especialidad en epidemiología, maestría en salud pública general, maestría en salud pública con especialidad en epidemiología y maestría en salud pública con especialidad en salud ambiental.

Miércoles, 7 de junio de 2023 en San Juan, Puerto Rico
La Escuela de Medicina San Juan Bautista celebró la ceremonia de graduación de los médicos y profesionales del área de la salud, quienes no solo terminaron una importante etapa educativa, sino que se convirtieron en el futuro inmediato de la salud en Puerto Rico.

68 Revista Puertorriqueña de Medicina y Salud Pública MSP / MUNDO DIGITAL
Graduación Recinto de Ciencias Médicas
Graduación Ponce Health Sciences University
Graduación Escuela de Medicina San Juan Bautista
2 de junio de 2023 en Bayamón, Puerto Rico
Dr. José García Mateo, pasado presidente de la SPED y Dra. Leticia Hernández, presidenta de la misma asociación médica. Fotomontaje: Revista MSP.
Unos 750 profesionales de la salud se graduaron este año 2023 del Recinto de Ciencias Médicas. Foto Suministrada.
En la ceremonia de grado se realizó el desfile de la facultad de la Escuela de Medicina de la Universidad. Foto: Revista Medicina y Salud Pública.
Ceremonia de graduación de la Escuela de Medicina San Juan Bautista. Foto: cobertura de la Revista Medicina y Salud Pública.
La caminata recorrió unas siete millas entre Ponce y Juana Díaz. Foto Suministrada.
Graduación Universidad Central del Caribe
Viernes, 9 de junio de 2023 en San Juan, Puerto Rico
Un total de 150 profesionales de la salud se graduaron en la Quincuagésima Segunda Colación de Grados de la Universidad Central del Caribe. En detalle fueron 67 nuevos médicos y otros 83 nuevos profesionales de la salud, en disciplinas como quiropráctica, ciencias biomédicas, tecnología de imágenes médicas y consejería en abuso de sustancias.


Sociedad Puertorriqueña de Neumología


Viernes, 9 de junio al Sábado, 10 de junio de 2023 en San Juan, Puerto Rico
La Dra. Daphne Delgado, presidenta de la Sociedad Puertorriqueña de Neumología, destacó durante la convención anual de la Sociedad Puertorriqueña de Neumología la importancia de reconocer los síntomas asociados al asma, como enfermedad respiratoria más prevalente y persistente en Puerto Rico, de una forma más severa y crónica.



Convención Anual Asociación de Reumatólogos de Puerto Rico

Viernes, 9 de junio de al Domingo, 11 de junio de 2023 en Río Grande, Puerto Rico
Durante el mismo se reunieron especialistas de condiciones reumáticas para abordar sobre los últimos avances en el diagnóstico y tratamiento en la disciplina. Al igual, se discutieron estrategias para mejorar la accesibilidad del paciente a los servicios de salud necesarios.
Revista Puertorriqueña de Medicina y Salud Pública 69 MSP / REVISTAMSP.COM
Expertos en Neumología se reúnen para conocer sobre los últimos avances en la disciplina
Especialistas en reumatología se reúnen para conocer sobre los últimos avances en la disciplina
Ceremonia de graduación de la Escuela de Medicina San Juan Bautista. Foto: cobertura de la Revista Medicina y Salud Pública.
Dra. Daphne Delgado, presidenta de la Sociedad Puertorriqueña de Neumología. Fotomontaje: Revista Medicina y Salud Pública.
Durante nuestra cobertura se abordaron temas relacionados a tratamientos, diagnóstico y toda la mejor información sobre la práctica de la Reumatología en Puerto Rico, de la mano del Dr. Oscar Soto, reumatólogo y asesor editorial de la Revista MSP.
Medicina de rehabilitación: Enfoque multidisciplinario para el cuidado del paciente con cáncer
Dr. Gerardo Miranda, presidente de la Asociación Puertorriqueña de Medicina Física y Rehabilitación. Fotomontaje: Revista Medicina y Salud Pública.
Asociación de Medicina Física y Rehabilitación de Puerto Rico

Jueves, 22 de junio al Sábado, 24 de junio de 2023 en Río Grande, Puerto Rico
Durante la convención anual se discutió el rol del fisiatra para el manejo óptimo del paciente de cáncer y mejorar su calidad de vida.
Se celebró la convención anual de la Sociedad Dermatológica de Puerto Rico
Dr. Samuel Sánchez, presidente de la Sociedad Dermatológica de Puerto Rico. Foto: Revista Medicina y Salud Pública.
Sociedad Dermatológica de Puerto Rico
Jueves, 22 de junio al Sábado, 24 de junio de 2023 en Río Grande, Puerto Rico
El Presidente de la Sociedad Dermatológica de Puerto Rico puso en conocimiento un hecho que, según afirma, se ha venido presentando y afecta la práctica médica de los dermatólogos de la Isla, durante su convención anual este año. Se trata de que varios médicos no especializados en dermatología están llevando a cabo procedimientos dermatológicos sin tener la formación adecuada para realizarlos, lo que puede poner en riesgo la vida de los pacientes e impactar en la práctica que realizan los especialistas.

Expo Diabetes 2023 en Plaza del Caribe en Ponce. Foto: Facebook / Asociación Puertorriqueña de Diabetes.

Expo Diabetes: Iniciativa Educativa de la Asociación Puertorriqueña de Diabetes
Asociación Puertorriqueña de Diabetes
Jueves, 29 de junio al Domingo, 2 de julio de 2023 en Ponce, Puerto Rico
Más de 20 exhibidores, clínicas de salud, talleres gratuitos, charlas, tarimas de entretenimiento, cooking labs, pruebas de cernimiento y estación de masajes, fueron parte de toda la agenda educativa que presentó esta edición de Expo Diabetes desde el 29 de junio.
Conferencia de Prensa Colegio de Médicos Cirujanos de PR: Crisis de los pediatras pone en riesgo la salud de nuestros niños

Colegio de Médicos Cirujanos de Puerto Rico
Martes, 11 de julio de 2023 en San Juan, Puerto Rico
Durante la conferencia de prensa se trajeron múltiples puntos a coalición referente a la situación de los pediatras en PR y las barreras en el acceso a los servicios de salud que se ofrecen a niños y adolescentes.
Dr. Luis Renta, cardiólogo y presidente electo de la Sociedad Puertorriqueña de Cardiología.


Foto: Revista Medina y Salud Pública.
Se celebró el XXX Congreso Anual de la Sociedad Puertorriqueña de Cardiología
Conferencia de Prensa desde el Colegio de Médicos de Puerto Rico. Foto: Revista Medicina y Salud Pública.
Conferencia de Prensa Colegio de Médicos Cirujanos de PR: Sin control, en estado crítico la salud de Puerto Rico

Colegio de Médicos Cirujanos de Puerto Rico
Jueves, 6 de julio de 2023 en San Juan, Puerto Rico
El Colegio de Médicos Cirujanos de Puerto Rico junto a otras organizaciones como el Colegio de Médicos y Cirujanos Dentistas, los dueños de laboratorios clínicos y radiológicos se reunieron para discutir la crisis de salud en Puerto Rico.
Sociedad Puertorriqueña de Cardiología
Viernes, 14 de julio de 2023 al Domingo, 16 de julio de 2023 en Río Grande, Puerto Rico
La enfermedad arterial periférica es una condición que obstruye progresivamente las arterias de las extremidades y puede manifestarse de manera silenciosa. Además, factores de riesgo como fumar pueden contribuir a su desarrollo, por lo que es crucial crear conciencia y tomar medidas preventivas, resaltó el Dr. Luis Renta, cardiólogo y presidente electo de la Sociedad Puertorriqueña de Cardiología, durante su convención anual. Destacó la relevancia de ofrecer orientación a los pacientes acerca de los factores de riesgo.
70 Revista Puertorriqueña de Medicina y Salud Pública MSP / MUNDO DIGITAL


MEDICINA DE CORAZÓN: LA PRÁCTICA DEL DR. EDMUNDO JORDAN
Fue mientras veía a sus tíos Oscar y Tomás ejercer como médicos y a su abuelo realizar servicios misioneros y pastorales, cuando el Dr. Edmundo Jordán supo que su futuro iría rodeado de la medicina y salud.
La clave de un buen servicio es que su profesión debe ir más allá de recetar medicamentos y ordenar estudios. Comprende, sin embargo, un tratamiento integral que abarque ámbitos del alma, espíritu, cuerpo y mente.
“Siempre es importante ese trato integral, porque el paciente tiene emociones y unas creencias”, resalta el especialista en cardiología y pasado presidente de la Sociedad Puertorriqueña de Cardiología.
Su medicina de corazón va más allá, siendo uno de los pocos cardiólogos que se han hecho vocal de la educación a la ciudadanía sobre condiciones como miocardiopatía hipertrófica y su impacto en deportistas, hipertensión arterial, infarto, fibrilación atrial, entre otras condiciones cardiovasculares que más afectan a los puertorriqueños.
“No existe mayor satisfacción cuando un paciente te dice que lo que uno hizo le ayudó a vivir mejor, que los consejos que les di fueron fundamentales para cambiar su estado de salud. No tiene precio”, ha expresado el Dr. Jordán en múltiples entrevistas con la Revista Medicina y Salud Pública.
Por tal razón, en esta edición impresa, su A Ciencia Cierta es dedicado a este destacado especialista de la cardiología puertorriqueña.
DR. EDMUNDO JORDAN


72 Revista Puertorriqueña de Medicina y Salud Pública MSP / A CIENCIA CIERTA
Expresidente de la Sociedad Puertorriqueña de Cardiología.



















































 Yue Sai Jao
Yue Sai Jao




















































































