MARAVILLOSO MAVACAMTEN: Explorando la mejora farmacológica de la Miocardiopatía Hipertrófica
La salud cardiovascular en el paciente que vive con diabetes
Prevalencia de hipoglicemia y calidad de vida en pacientes hispanos con diabetes mellitus tipo 2
36 Perfil de salud de una muestra de mujeres diagnosticadas con el virus del papiloma humano en Puerto Rico: un estudio exploratorio
Estudio sobre la efectividad de terapias en pacientes con psoriasis
Esquizofrenia: la enfermedad que todos conocen, pero no todos entienden
Janssen presenta Abrazo Floral en Puerto Rico para educar y crear conciencia sobre la psoriasis a través del arte
GUÍAS SOBRE EL DIAGNÓSTICO Y TRATAMIENTO DE LA FIBRILACIÓN AURICULAR


Dra. Katherine Soto-Moreno, MD
Especialista en Cardiología y Medicina Interna
ABIM Board Certified en Medicina Interna y Enfermedades Cardiovasculares
C.E.O. Cardiowest Clínica Cardiovascular en Mayagüez
@RevistaMSP
8 18 20
47 60 76
FOR ADULTS WITH MODERATE TO SEVERE PLAQUE PSORIASIS
Data on long-term complete clearance in challenging body areas
1-7
Scalp, nail, genital, and palmoplantar psoriasis
AVAILABLE
Taltz is indicated for patients aged 6 years or older with moderate-to-severe plaque psoriasis (PsO) who are candidates for systemic therapy or phototherapy. Taltz is also indicated for adult patients with active psoriatic arthritis (PsA), adult patients with active ankylosing spondylitis (AS), and adult patients with active non-radiographic axial spondyloarthritis (nr-axSpA) with objective signs of inflammation.
COMPLETE CLEARANCE IN SCALP PSORIASIS
87%
PSSI=0 by year 5, observed Nx=173
Mean baseline PSSI=20 mNRI analysis=69% (n=349)
COMPLETE CLEARANCE IN NAIL PSORIASIS
77%
NAPSI=0 by year 5, observed Nx=127

Mean baseline NAPSI=27 mNRI analysis=64% (n=229)
Scalp and nail psoriasis often are predictors of a patient developing PsA18
COMPLETE CLEARANCE IN GENITAL PSORIASIS
60%
sPGA-G 0 by year 1, NRI* n=75
Mean baseline sPGA-G=3.4
COMPLETE CLEARANCE IN PALMOPLANTAR PSORIASIS
90%
PPASI 100 by year 5, observed Nx=41
Mean baseline PPASI=10 mNRI analysis=75% (n=96)
Nail, scalp, and palmoplantar data are from an open-label extension of UNCOVER-3 and are post hoc, subgroup analyses of patients who had nail, scalp, and palmoplantar psoriasis at baseline. sPGA-G 0 was a prespecified, exploratory endpoint from an open-label extension of IXORA-Q. The open-label phase of the studies has limitations (eg, no placebo comparison, patients remaining in the extension phase may be those with better results).
*At week 12, 73% of patients taking Taltz vs 8% of patients taking placebo achieved the primary endpoint in IXORA-Q of sPGA-G 0,1.7
#1 prescribed IL-17A antagonist in Dermatology*
*Based on new prescriptions and total prescriptions, inclusive of inhibitors targeting IL-17 A/F.
Co-primary endpoint results (NRI) in UNCOVER-1 (Taltz n=433; placebo n=431), UNCOVER-2 (Taltz n=351; placebo n=168), and UNCOVER-3 (Taltz n=385; placebo n=193): 89%, 90%, and 87% of Taltz patients, respectively, achieved PASI 75 at week 12 vs 4%, 2%, and 7% for placebo. Also, 82%, 83%, and 81% of Taltz patients, respectively, achieved sPGA 0,1 at week 12 vs 3%, 2%, and 7% for placebo.8
Additional week 12 results NRI: In UNCOVER-1, UNCOVER-2, and UNCOVER-3: 35%, 40%, and 38% of Taltz patients achieved PASI 100 vs 0%, 1%, and 0% for placebo, respectively.
In the maintenance period of UNCOVER-1 and -2, among patients who achieved sPGA 0,1 at week 12 with Taltz 80 mg every 2 weeks (NRI), 75% of patients who were re-randomized to Taltz 80 mg every 4 weeks (n=181† ) and 7% of patients who were rerandomized to placebo (n=203† ) achieved sPGA 0,1 at week 60.8,9
†Evaluable patients at week 60
PSSI=Psoriasis Scalp Severity Index; mNRI=modified nonresponder imputation; NAPSI=Nail Psoriasis Severity Index; sPGA-G=static Physician’s Global Assessment of Genitalia; NRI=nonresponder imputation; PPASI=Palmoplantar Psoriasis Area Severity Index.
2 Revista Puertorriqueña de Medicina y Salud Pública
See more Taltz efficacy Taltz.com/CBA
Important Safety Information
CONTRAINDICATIONS
Taltz is contraindicated in patients with a previous serious hypersensitivity reaction, such as anaphylaxis, to ixekizumab or to any of the excipients.
WARNINGS AND PRECAUTIONS
Infections
Taltz may increase the risk of infection. In clinical trials of adult patients with plaque psoriasis, the Taltz group had a higher rate of infections than the placebo group (27% vs 23%). A similar increase in risk of infection was seen in placebo-controlled trials of adult patients with psoriatic arthritis, ankylosing spondylitis, non-radiographic axial spondyloarthritis, and pediatric patients with plaque psoriasis. Serious infections have occurred. Instruct patients to seek medical advice if signs or symptoms of clinically important chronic or acute infection occur. If a serious infection develops, discontinue Taltz until the infection resolves.
Pre-Treatment Evaluation for Tuberculosis
Evaluate patients for tuberculosis (TB) infection prior to initiating treatment with Taltz. Do not administer to patients with active TB infection. Initiate treatment of latent TB prior to administering Taltz. Closely monitor patients receiving Taltz for signs and symptoms of active TB during and after treatment
Hypersensitivity

Serious hypersensitivity reactions, including angioedema and urticaria (each ≤0.1%), occurred in the Taltz group in clinical trials. Anaphylaxis, including cases leading to hospitalization, has been reported in post-marketing use with Taltz. If a serious
Trial Designs
UNCOVER-1, -2, and -38,11: The Taltz plaque psoriasis clinical trial program included 3 randomized, double-blind, placebo-controlled trials to evaluate the efficacy and safety of Taltz. All patients were ≥18 years of age and had plaque psoriasis with a body surface area involvement of ≥10%, a static Physician’s Global Assessment (sPGA) score ≥3, and a Psoriasis Area and Severity Index (PASI) score ≥12, and were candidates for phototherapy or systemic therapy. Participants were randomized to receive placebo or Taltz 80 mg every 2 weeks following a 160 mg starting dose. In UNCOVER-2 and -3, an additional arm of US-approved Enbrel® (etanercept) (50 mg twice weekly) was included. Co-primary efficacy endpoints were proportion of patients with an sPGA 0,1 and at least a 2-point improvement from baseline and proportion of patients achieving PASI 75 (at least a 75% reduction in the PASI composite score) at week 12. Nonresponder imputation (NRI) methods were used for categorical efficacy analyses.
Patients originally randomized to Taltz who were responders at week 12 (ie, sPGA 0,1) in UNCOVER-1 and -2 were rerandomized to either Taltz 80 mg every 4 weeks or placebo. In UNCOVER-3, after week 12 all patients received open label Taltz 80 mg every 4 weeks. In all UNCOVER trials, any patients who relapsed (sPGA ≥3) at any time during the maintenance period were classified as nonresponders.
hypersensitivity reaction occurs, discontinue Taltz immediately and initiate appropriate therapy.
Inflammatory Bowel Disease
Patients treated with Taltz may be at an increased risk of inflammatory bowel disease. In clinical trials, Crohn’s disease and ulcerative colitis, including exacerbations, occurred at a greater frequency in the Taltz group than the placebo group. During Taltz treatment, monitor patients for onset or exacerbations of inflammatory bowel disease and if IBD occurs, discontinue Taltz and initiate appropriate medical management.
Immunizations
Prior to initiating therapy with Taltz, consider completion of all age-appropriate immunizations according to current immunization guidelines. Avoid use of live vaccines in patients treated with Taltz.
ADVERSE REACTIONS
Most common adverse reactions (≥1%) associated with Taltz treatment are injection site reactions, upper respiratory tract infections, nausea, and tinea infections. Overall, the safety profiles observed in adult patients with psoriatic arthritis, ankylosing spondylitis, non-radiographic axial spondyloarthritis, and pediatric patients with plaque psoriasis were consistent with the safety profile in adult patients with plaque psoriasis, with the exception of influenza and conjunctivitis in psoriatic arthritis and conjunctivitis, influenza, and urticaria in pediatric psoriasis. Please see Brief Summary of full Prescribing Information on the following pages. See Instructions for Use included with the device.
IX HCP ISI 07MAY2020
IXORA-Q8,10: IXORA-Q is a placebo-controlled, randomized, double-blind study comparing the efficacy and safety of Taltz vs placebo in patients with moderate to severe genital psoriasis, as measured by the proportion of patients achieving sPGA-G 0,1 at week 12 (primary endpoint).
The study enrolled 149 adult patients with plaque psoriasis who had minimum BSA of ≥1%, sPGA ≥3 (moderate psoriasis) and sPGA-G score of ≥3 (moderate genital psoriasis), who failed to respond to or were intolerant of at least one topical therapy used for treatment of psoriasis affecting the genital area (corticosteroids, calcineurin inhibitors, and/or vitamin D analogues), and who were candidates for phototherapy and/or systemic therapy. Patients were randomized to receive placebo or Taltz 80 mg every 2 weeks after a 160 mg starting dose. Nonresponder imputation (NRI) methods were used for categorical efficacy analyses.
References: 1. Data on file. Lilly USA, LLC. DOF-IX-US-0264. 2. Blauvelt A, Lebwohl MG, Mabuchi T, et al. Long-term efficacy and safety of ixekizumab: 5-year analysis of the UNCOVER-3 randomized controlled trial [published online ahead of print November 27, 2020]. J Am Acad Dermatol. doi:10.1016/j.aad.2020.11.022. 3. Data on file. Lilly USA, LLC. DOF-IX-US-0271. 4. Data on file. Lilly USA, LLC. DOF-IX-US-0259. 5. Data on file. Lilly USA, LLC. DOF-IX-US-0258. 6. Data on file. Lilly USA, LLC. DOFIX-US-0263. 7. Ryan C, Menter A, Guenther L, et al; on behalf of IXORA-Q Study Group. Efficacy and safety of ixekizumab in a randomized, double-blinded, placebo-controlled phase IIIb study of patients with moderate-to-severe genital psoriasis. Br J Dermatol. 2018;179:844-852. 8. Taltz [package insert]. Indianapolis, IN: Eli Lilly and Company; 2022. 9. Data on file. Lilly USA, LLC. DOF-IX-US-0274. 10. Data on file. Lilly USA, LLC. DOF-IX-US-0273. 11. Data on file. Lilly USA, LLC. DOF-IX-US-0183.
Taltz® is a registered trademark owned or licensed by Eli Lilly and Company, its subsidiaries or affiliates. PP-IX-US-5432 06/2022 ©Lilly USA, LLC 2022. All rights reserved.
Revista Puertorriqueña de Medicina y Salud Pública 3
Taltz® (ixekizumab) injection
Brief Summary: Consult the package insert for complete prescribing information.
INDICATIONS AND USAGE
Plaque Psoriasis—Taltz is indicated for the treatment of patients aged 6 years and older with moderate-to-severe plaque psoriasis who are candidates for systemic therapy or phototherapy. Psoriatic Arthritis—Taltz is indicated for the treatment of adult patients with active psoriatic arthritis.
Ankylosing Spondylitis—Taltz is indicated for the treatment of adult patients with active ankylosing spondylitis.
Non-radiographic Axial Spondyloarthritis—Taltz is indicated for the treatment of adult patients with active non-radiographic axial spondyloarthritis (nr-axSpA) with objective signs of inflammation.
CONTRAINDICATIONS
Taltz is contraindicated in patients with a previous serious hypersensitivity reaction, such as anaphylaxis, to ixekizumab or to any of the excipients (Warnings and Precautions)
WARNINGS AND PRECAUTIONS
Infections—Taltz may increase the risk of infection. In clinical trials in adult patients with plaque psoriasis, the Taltz group had a higher rate of infections than the placebo group (27% vs 23%). Upper respiratory tract infections, oral candidiasis, conjunctivitis and tinea infections occurred more frequently in the Taltz group than in the placebo group. A similar increase in risk of infection was seen in placebo-controlled trials in patients with pediatric psoriasis, psoriatic arthritis, ankylosing spondylitis, and non-radiographic axial spondyloarthritis (Adverse Reactions). Instruct patients treated with Taltz to seek medical advice if signs or symptoms of clinically important chronic or acute infection occur. If a patient develops a serious infection or is not responding to standard therapy, monitor the patient closely and discontinue Taltz until the infection resolves.
Pre-treatment Evaluation for Tuberculosis—Evaluate patients for tuberculosis (TB) infection prior to initiating treatment with Taltz. Do not administer to patients with active TB infection. Initiate treatment of latent TB prior to administering Taltz. Consider anti-TB therapy prior to initiating Taltz in patients with a past history of latent or active TB in whom an adequate course of treatment cannot be confirmed. Patients receiving Taltz should be monitored closely for signs and symptoms of active TB during and after treatment.
Hypersensitivity—Serious hypersensitivity reactions, including angioedema and urticaria (each ≤0.1%), occurred in the Taltz group in clinical trials. Anaphylaxis, including cases leading to hospitalization, has been reported in post-marketing use with Taltz (Adverse Reactions). If a serious hypersensitivity reaction occurs, discontinue Taltz immediately and initiate appropriate therapy.
Inflammatory Bowel Disease—Patients treated with Taltz may be at an increased risk of inflammatory bowel disease. In clinical trials, Crohn’s disease and ulcerative colitis, including exacerbations, occurred at a greater frequency in the Taltz group than in the control group (Adverse Reactions). During Taltz treatment, monitor for onset or exacerbation of inflammatory bowel disease and if IBD occurs, discontinue Taltz and initiate appropriate medical management. Immunizations—Prior to initiating therapy with Taltz, consider completion of all age-appropriate immunizations according to current immunization guidelines. Avoid use of live vaccines in patients treated with Taltz. No data are available on the response to live vaccines.
ADVERSE REACTIONS
The following adverse drug reactions are discussed in greater detail in other sections of the label:
• Infections (Warnings and Precautions)
• Hypersensitivity Reactions (Contraindications and Warnings and Precautions)
• Inflammatory Bowel Disease (Warnings and Precautions)
Clinical Trials Experience—Because clinical trials are conducted under widely varying and controlled conditions, adverse reaction rates observed in the clinical trials of a drug cannot be directly compared to rates in the clinical trials of another drug and may not reflect the rates observed in practice.
Adult Plaque Psoriasis
Weeks 0 to 12: Three placebo-controlled trials in subjects with plaque psoriasis were integrated to evaluate the safety of Taltz compared to placebo for up to 12 weeks. A total of 1167 subjects (mean age 45 years; 66% men; 94% White) with plaque psoriasis received Taltz (160 mg at Week 0, 80 mg every 2 weeks [Q2W] for 12 weeks) subcutaneously. In two of the trials, the safety of Taltz (use up to 12 weeks) was also compared with an active comparator, U.S. approved etanercept.
In the 12-week, placebo-controlled period, adverse events occurred in 58% of the Taltz Q2W group (2.5 per subject-year of follow-up) compared with 47% of the placebo group (2.1 per subject-year of follow-up). Serious adverse events occurred in 2% of the Taltz group (0.07 per subject-year of follow-up), and in 2% of the placebo group (0.07 per subject-year of follow-up).
Table 1 summarizes the adverse reactions that occurred at a rate of at least 1% and at a higher rate in the Taltz group than the placebo group during the 12-week placebo-controlled period of the pooled clinical trials.
Table 1: Adverse Reactions Occurring in ≥1% of the Taltz Group and More Frequently than in the Placebo Group in the Plaque Psoriasis Clinical Trials through Week 12
Adverse reactions that occurred at rates less than 1% in the Taltz group and more frequently than in the placebo group during the 12-week induction period included rhinitis, oral candidiasis, urticaria, influenza, conjunctivitis, inflammatory bowel disease, and angioedema.
Weeks 13 to 60: A total of 332 subjects received the recommended maintenance regimen of Taltz 80 mg dosed every 4 weeks. During the maintenance period (Weeks 13 to 60), adverse events occurred in 80% of subjects treated with Taltz (1.0 per subject-year of follow-up) compared to 58% of subjects treated with placebo (1.1 per subject-year of follow-up). Serious adverse events were reported in 4% of subjects treated with Taltz (0.05 per subject-year of follow-up) and none in the subjects treated with placebo.
Weeks 0 to 60: Over the entire treatment period (Weeks 0 to 60), adverse events were reported in 67% of subjects treated with Taltz (1.4 per subject-year of follow-up) compared to 48% of subjects treated with placebo (2.0 per subject-year of follow-up). Serious adverse events were reported in 3% of subjects treated with Taltz (0.06 per subject-year of follow-up), and in 2% of subjects treated with placebo (0.06 per subject-year of follow-up).
Specific Adverse Drug Reactions: Injection Site Reactions: The most frequent injection site reactions were erythema and pain. Most injection site reactions were mild-to-moderate in severity and did not lead to discontinuation of Taltz.

Infections: In the 12-week, placebo-controlled period of the clinical trials in plaque psoriasis, infections occurred in 27% of subjects treated with Taltz (1.2 per subject-year of follow-up) compared to 23% of subjects treated with placebo (1.0 per subject-year of follow-up). Serious infections occurred in 0.4% of subjects treated with Taltz (0.02 per subject-year of follow-up) and in 0.4% of subjects treated with placebo (0.02 per subject-year of follow-up) (Warnings and Precautions)
During the maintenance treatment period (Weeks 13 to 60), infections occurred in 57% of subjects treated with Taltz (0.70 per subject-year of follow-up) compared to 32% of subjects treated with placebo (0.61 per subject-year of follow-up). Serious infections occurred in 0.9% of subjects treated with Taltz (0.01 per subject-year of follow-up) and none in the subjects treated with placebo.
Over the entire treatment period (Weeks 0 to 60), infections were reported in 38% of subjects treated with Taltz (0.83 per subject-year of follow-up) compared to 23% of subjects treated with placebo (1.0 per subject-year of follow-up). Serious infections occurred in 0.7% of subjects treated with Taltz (0.02 per subject-year of follow-up), and in 0.4% of subject treated with placebo (0.02 per subject-year of follow-up).
Inflammatory Bowel Disease: In adult subjects with plaque psoriasis, Crohn’s disease and ulcerative colitis, including exacerbations, occurred at a greater frequency in the TALTZ 80 mg Q2W group (Crohn’s disease 0.1%, ulcerative colitis 0.2%) than the placebo group (0%) during the 12-week, placebo-controlled period in clinical trials (Warnings and Precautions).
Laboratory Assessment of Cytopenia:
Neutropenia—Over the entire treatment period (Weeks 0 to 60), neutropenia occurred in 11% of subjects treated with Taltz (0.24 per subject-year of follow-up) compared to 3% of subjects treated with placebo (0.14 per subject-year of follow-up). In subjects treated with Taltz, the incidence rate of neutropenia during Weeks 13 to 60 was lower than the incidence rate during Weeks 0 to 12.
In the 12-week, placebo-controlled period, neutropenia ≥ Grade 3 (<1,000 cells/mm3) occurred in 0.2% of the Taltz group (0.007 per subject-year of follow-up) compared to 0.1% of the placebo group (0.006 per subject-year of follow-up). The majority of cases of neutropenia were either Grade 2 (2% for Taltz 80 mg Q2W versus 0.3% for placebo; ≥1,000 to <1,500 cells/mm3) or Grade 1 (7% for Taltz 80 mg Q2W versus 3% for placebo; ≥1,500 cells/mm3 to <2,000 cells/mm3). Neutropenia in the Taltz group was not associated with an increased rate of infection compared to the placebo group.
Thrombocytopenia—Ninety eight percent of cases of thrombocytopenia were Grade 1 (3% for Taltz 80 mg Q2W versus 1% for placebo; ≥75,000 cells/mm3 to <150,000 cells/mm3). Thrombocytopenia in subjects treated with Taltz was not associated with an increased rate of bleeding compared to subjects treated with placebo.
Active Comparator Trials: In the two clinical trials that included an active comparator, the rate of serious adverse events during weeks zero to twelve was 0.7% for U.S.-approved etanercept and 2% for Taltz 80 mg Q2W, and the rate of discontinuation from adverse events was 0.7% for U.S. approved etanercept and 2% for Taltz 80 mg Q2W. The incidence of infections was 18% for U.S. approved etanercept and 26% for Taltz 80 mg Q2W. The rate of serious infections was 0.3% for both Taltz 80 mg Q2W and U.S. approved etanercept.
Pediatric Plaque Psoriasis
Taltz was evaluated in a placebo-controlled trial in pediatric subjects with moderate-to-severe psoriasis 6 to less than 18 years of age. A total of 171 subjects were studied (115 subjects on Taltz and 56 subjects on placebo). Overall, the safety profile observed in pediatric subjects with plaque psoriasis treated with Taltz every 4 weeks is consistent with the safety profile in adult subjects with plaque psoriasis with the exception of the frequencies of conjunctivitis (2.6%), influenza (1.7%), and urticaria (1.7%).
In this clinical trial, Crohn’s disease occurred at a greater frequency in the Taltz group (0.9%) than the placebo group (0%) during the 12-week, placebo-controlled period. Crohn’s disease occurred in a total of 4 Taltz treated subjects (2.0%) in the clinical trial (Warnings and Precautions).
Psoriatic Arthritis
Taltz was studied in two placebo-controlled trials in patients with psoriatic arthritis. A total of 678 patients were studied (454 patients on Taltz and 224 on placebo). A total of 229 patients in these trials received Taltz 160 mg at Week 0, followed by 80 mg every 4 weeks (Q4W). Overall, the safety profile observed in patients with psoriatic arthritis treated with Taltz Q4W is consistent with the safety profile in adult patients with plaque psoriasis with the exception of the frequencies of influenza (1.3%) and conjunctivitis (1.3%).
Ankylosing Spondylitis
a Upper respiratory tract infections cluster includes nasopharyngitis and rhinovirus infection. b U.S. approved etanercept.
Taltz was studied in two placebo-controlled trials in patients with ankylosing spondylitis. A total of 566 patients were studied (376 patients on Taltz and 190 on placebo). A total of 195 patients in these trials received Taltz 80 or 160 mg at Week 0, followed by 80 mg every 4 weeks (Q4W). Overall, the safety profile observed in patients with ankylosing spondylitis treated with Taltz Q4W is consistent with the safety profile in adult patients with plaque psoriasis.
4 Revista Puertorriqueña de Medicina y Salud Pública
Adverse Reactions Taltz 80 mg Q2W (N=1167) (n%) Etanerceptb (N=287) (n%) Placebo (N=791) (n%) Injection site reactions 196 (17) 32 (11) 26 (3) Upper respiratory tract infectionsa 163 (14) 23 (8) 101 (13) Nausea 23 (2) 1 (<1) 5 (1) Tinea infections 17 (2) 0 1 (<1) IX HCP BS 27SEP2022 Taltz® (ixekizumab) injection PP-IX-US-6026 Taltz Derm PPG and Upcoming Journal Ad Placement-PR.indd 3-4
In adult patients with ankylosing spondylitis, Crohn’s disease and ulcerative colitis, including exacerbations, occurred in 2 patients (1.0%) and 1 patient (0.5%), respectively, in the Taltz 80 mg Q4W group and 1 patient (0.5%) and 0%, respectively, in the placebo group during the 16-week, placebo-controlled period in clinical trials. Of these patients, serious events occurred in 1 patient in the Taltz 80 mg Q4W group and 1 patient in the placebo group (Warnings and Precautions).
Non-radiographic Axial Spondyloarthritis
Taltz was studied in a placebo-controlled trial in patients with non-radiographic axial spondyloarthritis. A total of 303 patients were studied (198 patients on Taltz and 105 on placebo).
A total of 96 patients in this trial received Taltz 80 or 160 mg at Week 0, followed by 80 mg every 4 weeks (Q4W). Overall, the safety profile observed in patients with non-radiographic axial spondyloarthritis treated with Taltz 80 mg Q4W up to Week 16 is consistent with the previous experience of Taltz in other indications.
Immunogenicity—As with all therapeutic proteins, there is the potential for immunogenicity with Taltz. The assay to test for neutralizing antibodies has limitations detecting neutralizing antibodies in the presence of ixekizumab; therefore, the incidence of neutralizing antibodies development could be underestimated.
Plaque Psoriasis Population
By Week 12, approximately 9% of adult subjects treated with Taltz every 2 weeks developed antibodies to ixekizumab. Approximately 22% of subjects treated with Taltz at the recommended dosing regimen developed antibodies to ixekizumab during the 60-week treatment period. The clinical effects of antibodies to ixekizumab are dependent on the antibody titer; higher antibody titers were associated with decreasing drug concentration and clinical response.
Of the adult subjects who developed antibodies to ixekizumab during the 60-week treatment period, approximately 10%, which equates to 2% of subjects treated with Taltz at the recommended dosing regimen, had antibodies that were classified as neutralizing. Neutralizing antibodies were associated with reduced drug concentrations and loss of efficacy.
In pediatric psoriasis subjects treated with ixekizumab at the recommended dosing regimen up to 12 weeks, 21 subjects (18%) developed anti-drug antibodies, 5 subjects (4%) had confirmed neutralizing antibodies associated with low drug concentrations. No conclusive evidence could be obtained on the potential association of neutralizing antibodies and clinical response and/or adverse events due to small number of pediatric subjects in the study.
Psoriatic Arthritis Population
For subjects treated with Taltz 80 mg every 4 weeks for up to 52 weeks (PsA1), 11% developed anti-drug antibodies, and 8% had confirmed neutralizing antibodies.
Ankylosing Spondylitis Population
For patients treated with Taltz 80 mg every 4 weeks for up to 16 weeks (AS1, AS2), 5.2% developed anti-drug antibodies, and 1.5% had neutralizing antibodies.
Non-radiographic Axial Spondyloarthritis Population
Of patients treated with Taltz 80 mg every 4 weeks for up to 52 weeks (nr-axSpA1), 8.9% developed anti-drug antibodies, all of which were low titer. No patient had neutralizing antibodies. The detection of antibody formation is highly dependent on the sensitivity and specificity of the assay. Additionally, the observed incidence of antibody (including neutralizing antibody) positivity in an assay may be influenced by several factors including assay methodology, sample handling, timing of sample collection, concomitant medications, and underlying disease. For these reasons, comparison of incidence of antibodies to Taltz across indications or with the incidences of antibodies to other products may be misleading.
Postmarketing Experience—The following adverse reactions have been identified during post-approval use of Taltz. Because the reactions are reported voluntarily from a population of uncertain size, it is not always possible to reliably estimate their frequency or establish a causal relationship to Taltz exposure.
Immune system disorders: anaphylaxis (Contraindications and Warnings and Precautions) Infections: esophageal candidiasis.
USE IN SPECIFIC POPULATIONS
Pregnancy
Pregnancy Exposure Registry—There is a pregnancy exposure registry that monitors pregnancy outcomes in women exposed to Taltz during pregnancy. Pregnant women exposed to Taltz are encouraged to enroll in the Taltz Pregnancy Registry by calling 1-800-284-1695. Contact information for the registry is also available on https://www.taltz.com.
Risk Summary—Available data from the published literature and the pharmacovigilance database with Taltz use in pregnant women are insufficient to evaluate for a drug-associated risk of major birth defects, miscarriage or other adverse maternal or fetal outcomes.
Human IgG is known to cross the placental barrier; therefore, Taltz may be transmitted from the mother to the developing fetus. An embryofetal development study conducted in pregnant monkeys during organogenesis at doses up to 19 times the maximum recommended human dose (MRHD) revealed no evidence of harm to the developing fetus. When dosing was continued until parturition, neonatal deaths were observed at 1.9 times the MRHD [see Data]. The clinical significance of these nonclinical findings is unknown.
The background risk of major birth defects and miscarriage for the indicated population is unknown. All pregnancies have a background risk of birth defect, loss, or other adverse outcomes. In the U.S. general population, the estimated background risk of major birth defects and miscarriage in clinically recognized pregnancies is 2 to 4% and 15 to 20%, respectively.
Data
Animal Data—An embryofetal development study was conducted in cynomolgus monkeys administered ixekizumab. No malformations or embryofetal toxicity were observed in fetuses from pregnant monkeys administered ixekizumab weekly by subcutaneous injection during organogenesis to near parturition at doses up to 19 times the MRHD (on a mg/kg basis of 50 mg/kg/week). Ixekizumab crossed the placenta in monkeys.

In a pre- and post-natal development toxicity study, pregnant cynomolgus monkeys
were administered weekly subcutaneous doses of ixekizumab up to 19 times the MRHD from the beginning of organogenesis to parturition. Neonatal deaths occurred in the offspring of two monkeys administered ixekizumab at 1.9 times the MRHD (on a mg/kg basis of 5 mg/kg/week) and two monkeys administered ixekizumab at 19 times the MRHD (on a mg/kg basis of 50 mg/kg/week). These neonatal deaths were attributed to early delivery, trauma, or congenital defect. The clinical significance of these findings is unknown. No ixekizumab-related effects on functional or immunological development were observed in the surviving infants from birth through 6 months of age.
Lactation
Risk Summary—There are no available data on the presence of ixekizumab in human milk, the effects on the breastfed infant, or the effects on milk production. Ixekizumab was detected in the milk of lactating cynomolgus monkeys. When a drug is present in animal milk, it is likely that the drug will be present in human milk. The developmental and health benefits of breastfeeding should be considered along with the mother’s clinical need for Taltz and any potential adverse effects on the breastfed infant from Taltz or from the underlying maternal condition.
Pediatric Use—The safety and effectiveness of Taltz have been established in pediatric subjects aged 6 years to less than 18 years with moderate-to-severe plaque psoriasis. The safety and effectiveness of Taltz in other pediatric indications and for pediatric subjects less than 6 years of age have not been established.
Geriatric Use—Of the 4204 psoriasis subjects exposed to Taltz, a total of 301 were 65 years or older, and 36 subjects were 75 years or older. Although no differences in safety or efficacy were observed between older and younger subjects, the number of subjects aged 65 and over is not sufficient to determine whether they respond differently from younger subjects.
PATIENT COUNSELING INFORMATION—Advise the patient and/or caregiver to read the FDAapproved patient labeling (Medication Guide and Instructions for Use) before the patient starts using Taltz and each time the prescription is renewed, as there may be new information they need to know.
Instructions on Self-Administration: Provide guidance to patients and caregivers on proper subcutaneous injection technique, including aseptic technique, and how to use the autoinjector or prefilled syringe correctly (Instructions for Use)
Infection: Inform patients that Taltz may lower the ability of their immune system to fight infections. Instruct patients of the importance of communicating any history of infections to the healthcare provider, and contacting their healthcare provider if they develop any symptoms of infection (Warnings and Precautions).
Allergic Reactions: Advise patients to seek immediate medical attention if they experience any symptoms of serious hypersensitivity reactions (Warnings and Precautions).
Pregnancy: Advise patients that there is a pregnancy exposure registry that monitors pregnancy outcomes in women exposed to Taltz during pregnancy. Advise patients to contact the registry at 1-800-284-1695 to enroll (Use in Specific Populations) Additional
See Instructions for Use accompanying the product device.
IX HCP BS 27SEP2022
Marketed by: Lilly USA, LLC, Indianapolis, IN 46285, USA
Copyright © 2016, 2017, 2019, 2020, 2021, 2022, 2023 Eli Lilly and Company. All rights reserved. PP-IX-US-6026
Revista Puertorriqueña de Medicina y Salud Pública 5
information can be found at www.Taltz.com
IX HCP BS 27SEP2022
Taltz® (ixekizumab) injection
1/27/23 12:10
CONTENIDO
JANSSEN PRESENTA ABRAZO FLORAL EN PUERTO RICO PARA

EDUCAR Y CREAR CONCIENCIA SOBRE LA PSORIASIS A TRAVÉS DEL ARTE 14
GUÍAS SOBRE EL DIAGNÓSTICO Y TRATAMIENTO DE LA FIBRILACIÓN AURICULAR
MARAVILLOSO MAVACAMTEN: EXPLORANDO LA MEJORA FARMACOLÓGICA DE LA MIOCARDIOPATÍA HIPERTRÓFICA
LA SALUD CARDIOVASCULAR EN EL PACIENTE QUE VIVE CON DIABETES
PREVALENCIA DE HIPOGLICEMIA Y CALIDAD DE VIDA EN PACIENTES HISPANOS CON DIABETES MELLITUS TIPO 2: EL PUERTO RICO REAL-LIFE EFFECTIVENESS AND CARE PATTERNS OF DIABETES MANAGEMENT (RECAP-MD)
PERFIL DE SALUD DE UNA MUESTRA DE MUJERES DIAGNOSTICADAS CON EL VIRUS DEL PAPILOMA HUMANO EN PUERTO RICO: UN ESTUDIO EXPLORATORIO
ESTUDIO SOBRE LA EFECTIVIDAD DE TERAPIAS EN PACIENTES CON PSORIASIS
ESQUIZOFRENIA: LA ENFERMEDAD QUE TODOS CONOCEN, PERO NO TODOS ENTIENDEN
CONDICIONES ASOCIADAS A LA GLÁNDULA DE TIROIDES
EDITOR FUNDADOR Juan Carlos Orengo Valverde, MD, MPH, PhD EDITOR Alberto Santiago Cornier, MD, PhD CONSEJO ASESOR Oscar Soto Raíces, MD, Ahmed Morales, MD, FACP, FACG, FASGE, AGAF, Lcda. Wanda González fisióloga del ejercicio PRINCIPAL OFICIAL EJECUTIVO Pedro Carlos Lugo Hernández III, P.A.C. PRESIDENTA Y FUNDADORA Glorybelle Hernández Figueroa, MBA
VICEPRESIDENTA Y FUNDADORA Laila Paloma Lugo, MBA CONTABILIDAD Julio Soto ADMINISTRACIÓN Marta Ivelisse Vélez Ramos, MBA, MARKETING Y SERVICIOS 360 Darlene Rodríguez, Yasmin Morell, Belinda Burgos PERIODISTAS Mayra Acevedo, Luis Penchi, Limarys Suárez DIRECCIÓN GRÁFICA Natalia Zoé Rivera Torres ARTISTA GRÁFICO Jhorman González
DIRECTOR AUDIOVISUAL Christopher Soto REALIZADORA AUDIOVISIAL Salomé Mateus, Duban Valencia FOTOS Revista Medicina y Salud Pública
DIRECCIÓN GENERAL / FUNDADOR Carlos Alexis Lugo Marrero DISTRIBUCIÓN OFICINAS Y TORRES MÉDICAS Editorial Mundo ENVÍO DE REVISTAS Y DISTRIBUCIÓN A GRUPOS MÉDICOS Servicio de correo postal/Comunicación Inteligente Para ventas y otros servicios pueden comunicarse al 787.848.3333, msp@editorialmundo.com o www.medicinaysaludpublica.com
Revista Puertorriqueña de Medicina y Salud Pública ISSN 1937-8521
COMITÉ EDITORIAL CIENTÍFICO

COMITÉ EDITORIAL Olga Rodríguez, MD - Decana Escuela de Medicina de Ponce (Puerto Rico), Vivian Green, LND, MS, PhD, Sub editora y fundadora (Puerto Rico), José Cordero, MD, MPH - Exdecano Escuela Graduada Salud Pública Recinto de Ciencias Médicas UPR (Puerto Rico), Ángeles Rodríguez, MD, MPH (Puerto Rico), Simón Carlo, MD (Puerto Rico), Bárbara Rosado, MD (Puerto Rico), Idhaliz Flores PhD (Puerto Rico), Jesús Cruz-Correa, MD, FACOG (Puerto Rico), Rafael Bredy, MD, LicMTo, MBE, MS (Puerto Rico), David Caseida, MD, FACOG, (Puerto Rico), José Capriles, MD, MHSA (Puerto Rico) Joaquín Laboy, MD, FACOG (Puerto Rico), Luis Adrian Rivera Pomales, MD, PEMBA, MPH, CMQ (Puerto Rico), Juan Fernández, MS, PhD (Puerto Rico), Nuria Sebate, MD (Puerto Rico), Pedro Amador, MD, MPH (Puerto Rico), Nydia Cappas, PsyD (Puerto Rico), Luis Franco, MD (Puerto Rico), Federico Montealegre, DVM, PhD, Msc (Puerto Rico), Nydia Ortiz, PsyD (Puerto Rico), José Pons, PhD, FPPR (Puerto Rico), Esdrás Vélez, JD, MPH (Puerto Rico), Diego Zavala, MSc, PhD, (Puerto Rico), Ana Torres-Martín, MD (Puerto Rico), Julio Cádiz, MD, MPH (Puerto Rico), Rafael Gómez-Cuevas (Colombia), José Javier Orengo, PhD(c) (España), Cesar A. Del Rey, MD (Panamá), Pedro Serrano, MD, PhD (España), Luis Serra-Majem, MD, PhD (España), José Ramón Calvo, MD, PhD (España).
Síguenos en www.medicinaysaludpublica.com, www.facebook.com/revistamsp, en Twitter @revistamsp, en LinkedIn como Revista Puertorriqueña de Medicina y Salud Pública. Las normas editoriales de la Revista Puertorriqueña de Medicina y Salud Pública para la publicación de artículos originales y cartas al editor pueden ser accesadas en la página web: www.medicinaysaludpublica.com, y solicitadas a través de msp@editorialmundo.com.
6 Revista Puertorriqueña de Medicina y Salud Pública
8 36
76
18 60 20 47
63
EDITORIAL
Oportunidades
Recientemente, el 20 de mayo se celebró el día mundial de la investigación clínica. Es importante aprovechar el contexto para destacar algunos fundamentos que nos permitan fortalecer y avanzar en una de las actividades mas importantes y de mayor crecimiento a nivel mundial.

Ante la trascendental importancia de frenar el avance de la pandemia que ocasionó el SARS-CoV-2 y los descubrimientos para ganarle la batalla a enfermedades como la hepatitis, VIH y los cánceres de mayor incidencia y mortalidad, la investigación clínica despierta un mayor interés en nuestra sociedad.
No estamos hablando de cualquier tema. Se trata de preservar la existencia a través de la salud del género humano.
Tampoco podemos ignorar qué hay un antes y un después en la investigación producto de las actividades científicas relacionadas con el COVID-19. El número de investigaciones se disparó pero también el número de de protocolos ante el crecimiento de estudios y ensayos clínicos.
Puerto Rico no está al margen de esta tendencia mundial. Nuestro principal reto es garantizar la estabilidad y sostenibilidad de las iniciativas nacionales apoyadas por distintos sectores en la academia y en el sector privado.
Reconociendo que aún tenemos limitaciones relacionadas principalmente con la parte financiera, todos los actores de la investigación están comprometidos con el desarrollo de los protocolos, más cuando conocemos que redundará en una mejoría económica para el país y en un mayor conocimiento, que hará que Puerto Rico pueda tener una mejor cualificación a nivel mundial y de esta forma, convertirnos en una alternativa real para los principales laboratorios de investigación clínica mundial.
Faltan muchas cosas para lograr ese posicionamiento, sin embargo hemos demostrado ser relevantes y eficientes en trámites regulatorios y en el cumplimiento de los protocolos, con el objetivo de ser más competitivos a nivel global.
La experiencia ya acumulada, la seriedad de profesionales como Carmen Zorrilla, Javier Morales, Jorge Santana Bagur y tantos otros, los entes de control, la credibilidad y la participación en investigaciones que han sido trascendentales para la especie humana se tiene que armonizar con el entusiasmo, la inteligencia, la ética y la voluntad para continuar participando del mundo del conocimiento y de la investigación clínica. Esto es lo que nos llevará a posicionarnos en el lugar que Puerto Rico merece estar.
Principal Oficial Médico
Soto-Raíces Mindful Rehumatix & Medical Research Group.

Revista Puertorriqueña de Medicina y Salud Pública 7
Dr. Oscar Soto Raíces Presidente Asociación Enfermedades Reumáticas de Puerto Rico (FER).
y desafíos en la investigación clínica puertorriqueña
GUÍAS SOBRE EL DIAGNÓSTICO Y TRATAMIENTO DE LA FIBRILACIÓN AURICULAR
Palabras Clave: ablación, antiarrítmicos, anticoagulantes, apéndice atrial, arritmia cardíaca, cardioversión, fibrilación auricular.

8 Revista Puertorriqueña de Medicina y Salud Pública
Dra. Katherine Soto-Moreno, MD


Especialista en Cardiología y Medicina Interna
ABIM Board Certified en Medicina Interna y Enfermedades Cardiovasculares
C.E.O. Cardiowest Clínica Cardiovascular en Mayagüez
RESUMEN INTRODUCCIÓN
La fibrilación auricular es la arritmia más común y se caracteriza por un ritmo cardíaco irregular y en ocasiones acelerado, que aumenta el riesgo de formación de coágulos de sangre dentro del corazón. La fibrilación auricular puede aumentar el riesgo de sufrir un accidente cerebrovascular isquémico, insuficiencia cardíaca y otras complicaciones relacionadas con el corazón. Los episodios de fibrilación auricular pueden ser transitorios e intermitentes, pero también pueden ser persistentes. Aunque la fibrilación auricular en sí misma no suele poner en riesgo la vida, es una afección médica grave que requiere un diagnóstico temprano y tratamiento adecuado, principalmente para prevenir las complicaciones tromboembólicas que conlleva. El tratamiento de la fibrilación auricular puede incluir medicamentos para controlar la frecuencia cardíaca, terapia para restablecer el ritmo cardíaco y/o procedimientos invasivos para bloquear la conducción eléctrica defectuosa que provoca la arritmia.
Una arritmia es un problema con la velocidad o el ritmo de los latidos del corazón. La fibrilación auricular es el tipo más común de arritmia cardíaca, que aumenta en frecuencia con la edad y es causada por un problema en el sistema eléctrico del corazón. Durante la fibrilación auricular, las cavidades superiores (aurículas) del corazón laten de forma caótica e irregular, de forma no sincronizada con las cavidades inferiores (ventrículos) del corazón. Los problemas estructurales del corazón son la causa más frecuente de la fibrilación auricular, ya que cuando hay alteraciones en el tejido atrial por inflamación, fibrosis, hipertrofia, u otros factores, se promueve la formación y propagación de impulsos eléctricos anormales. Sin embargo, aún se desconoce el mecanismo exacto por el cual se inicia y sostiene esta arritmia. En muchas personas, la fibrilación auricular puede ser asintomática. En los casos en que sí provoca síntomas, las personas pueden experimentar palpitaciones, latidos cardíacos rápidos y fuertes,
Revista Puertorriqueña de Medicina y Salud Pública 9
falta de aire, cansancio, mareos, desmayos o dolor de pecho. El mayor riesgo de padecer fibrilación auricular es que la contracción irregular de las aurículas puede conducir a un riesgo mayor de ataque isquémico cerebral, por coágulos de sangre que se forman principalmente en el apéndice auricular izquierdo. La presencia prolongada de fibrilación auricular también aumenta el riesgo de complicaciones cardíacas incluyendo infartos del miocardio y fallo cardíaco.
DISCUSIÓN
El diagnóstico de la fibrilación auricular se realiza estudiando el historial médico y examen físico del paciente y se confirma con un electrocardiograma de 12 derivaciones que analiza las ondas eléctricas del corazón. Los síntomas de la fibrilación auricular son variados y no específicos, incluyendo un tercio de pacientes que no presentan ningún síntoma relacionado a la condición. Las evaluaciones cardiovasculares rutinarias en los pacientes de alto riesgo, que incluyen pacientes con: edad avanzada, hipertensión, diabetes mellitus, enfermedad coronaria, fallo cardíaco congestivo, valvulopatías y eventos cerebrovasculares previos, es la mejor forma de diagnosticar de forma temprana a las personas que padecen de esta arritmia. Las características principales de la fibrilación auricular en electrocardiograma incluyen: intervalos R-R irregulares (cuando hay conducción atrioventricular), ausencia de ondas P distintivas y presencia de ondulaciones basales que representan la actividad atrial irregular. En los pacientes que presentan síntomas sugestivos de fibrilación auricular intermitente (paroxística) se puede realizar una evaluación con monitores cardíacos ambulatorios de diferente duración tales como: monitores Holter de 24 a 48 horas, telemetría, monitores de eventos (usualmente hasta 30 días), o monitores cardíacos implantables o loop recorders de larga duración (hasta 3 años). Para corroborar el diagnóstico e identificar posibles problemas estructurales del corazón, también se recomienda realizar una ecocardiografía cardíaca como parte de la evaluación de la fibrilación auricular, en donde se pueden identificar hipertrofia auricular izquierda, alteraciones del movimiento
El diagnóstico temprano y tratamiento de la fibrilación auricular es de suma importancia, ya que los pacientes que la padecen tienen el doble de riesgo de hospitalizaciones y el doble de riesgo de mortalidad que los pacientes sin arritmia, adicional a que aumenta el costo de salud anual en más de 20 billones de dólares (USD) en Estados Unidos solamente.
de la pared del ventrículo izquierdo que sugieren una isquemia pasada o actual, valvulopatías, miocardiopatía y detectar otros factores de riesgo para el desarrollo de accidente cerebrovascular (estasis de la sangre o trombo en la aurícula izquierda). En pacientes en los que se sospecha trombos auriculares o en los cuales se busca reestablecer el ritmo sinusal, se recomienda realizar una ecocardiografía transesofágica, la cual permite evaluar de forma óptima el apéndice auricular izquierdo.
LA EVALUACIÓN INICIAL DE LOS PACIENTES CON SOSPECHA O DIAGNÓSTICO DE FIBRILACIÓN AURICULAR DEBE INCLUIR UNA CARACTERIZACIÓN DEL PATRÓN DE LA ARRITMIA
(paroxístico, persistente, persistente de larga duración, o permanente). La fibrilación auricular paroxística es la que dura menos de 1 semana antes de haberse convertido a ritmo sinusal (normal), ya sea espontáneamente o con intervención médica. La fibrilación auricular persistente es la que dura un periodo mayor a 1 semana. La fibrilación persistente de larga duración es la que prevalece por más de 1 año, pero todavía existe la posibilidad de restaurar el ritmo sinusal. La fibrilación auricular permanente es la que ya no se puede convertir al ritmo sinusal, incluyendo a aquellos pacientes que deciden junto a su médico no intentar la conversión a ritmo sinusal. La importancia de identificar el tipo de fibrilación auricular se debe a que cuanto más prolongada es
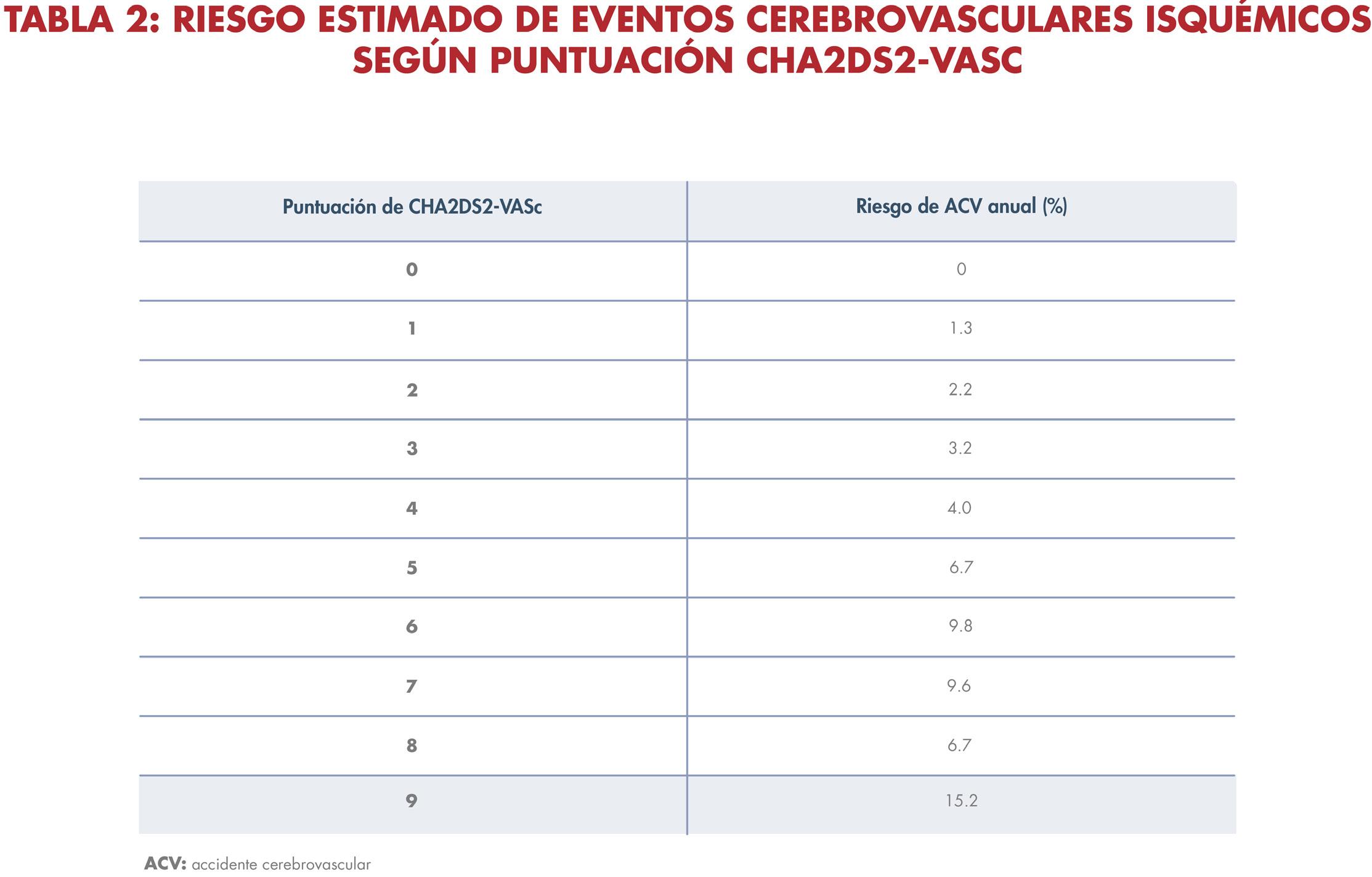
la fibrilación auricular, menos probable es su conversión espontánea a ritmo sinusal y más difícil la cardioversión debido a la dilatación y remodelado de las aurículas. Adicional a caracterizar la duración de la arritmia, en la evaluación inicial se debe realizar una estratificación de riesgos para identificar las personas que tienen mayor riesgo de coágulos mediante el puntaje CHA2DS2-VASc (ver tabla 1). Diversos estudios han demostrado un aumento en el riesgo de eventos cerebrovasculares isquémicos de aproximadamente 2% por cada 1 punto de aumento en la escala CHA2DS2-VASc (ver tabla 2).
El tratamiento para la fibrilación auricular depende de la duración de la arritmia, los síntomas asociados y la causa subyacente del problema cardíaco. Los tratamientos para la fibrilación auricular incluyen medicamentos y procedimientos para restablecer o controlar el ritmo cardíaco y disminuir los síntomas asociados a la arritmia. Sin embargo, la piedra angular del tratamiento es la prevención de eventos tromboembólicos. La contracción auricular rápida en los pacientes con fibrilación auricular disminuye el gasto cardíaco, especialmente en personas con disfunción ventricular diastólica previa, por lo cual disminuir el pulso ayuda a disminuir los síntomas de la arritmia y el riesgo de desarrollar miocardiopatía inducida por arritmia. Los medicamentos más utilizados para disminuir la frecuencia cardiaca en pacientes con fibrilación auricular son los que bloquean el nodo atrioventricular, incluyendo betabloqueadores y antagonistas de los canales de calcio no dihidropiridina. Los pacientes que tienen un primer episodio de fibrilación atrial paroxística o persistente, que

10 Revista Puertorriqueña de Medicina y Salud Pública
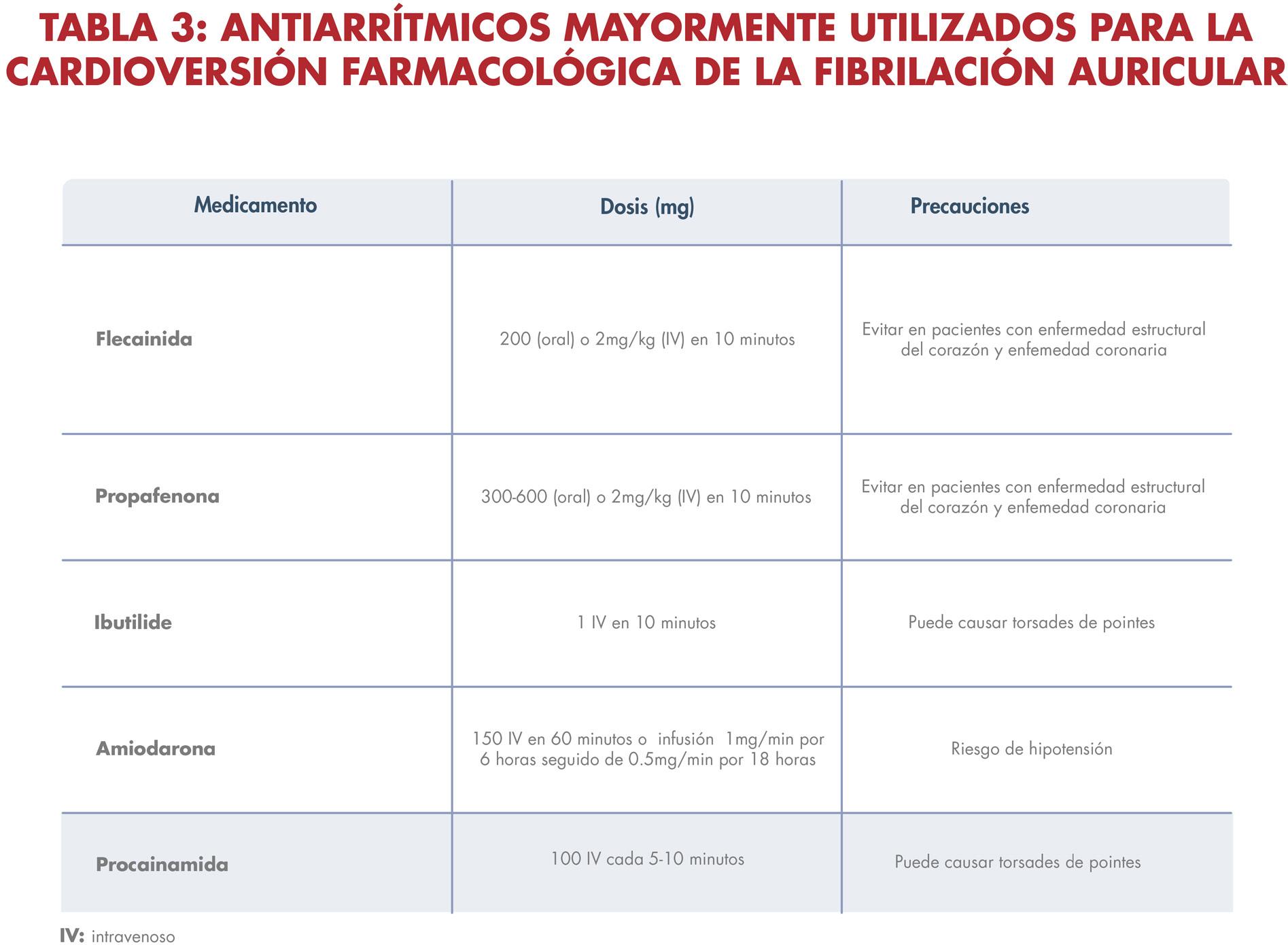
tienen síntomas marcados relacionados a la arritmia, también se benefician de restaurar el ritmo sinusal en adición al control de la frecuencia cardíaca. Existen diversas estrategias para restaurar el ritmo sinusal, incluyendo medicamentos antiarrítmicos, cardioversión eléctrica y la ablación mediante catéter. Los antiarrítmicos capaces de convertir la fibrilación a ritmo sinusal son los de clase Ia (procainamida, quinidina), Ic (flecainida, propafenona), y III (amiodarona, dronedarona, ibutilida, sotalol) (ver tabla 3), pero tienen un riesgo elevado en producir efectos adversos, funcionan en aproximadamente 50 al 60% de los pacientes y podrían aumentar la tasa de mortalidad en pacientes con enfermedad estructural del corazón. La cardioversión sincronizada convierte la fibrilación auricular en ritmo sinusal normal en 75 al 90% de los pacientes, aunque la tasa de recurrencia es elevada. La eficacia y el mantenimiento del ritmo sinusal después de la cardioversión aumentan cuando se utilizan antiarrítmicos previo al procedimiento. La cardioversión eléctrica es más eficaz en pacientes con fibrilación auricular breve, aislada o fibrilación auricular
producida por una causa reversible como lo son desbalances en la tiroides y es menos eficaz en presencia de hipertrofia de la aurícula izquierda o cardiopatía estructural subyacente. Antes de realizar una cardioversión eléctrica o farmacológica es importante anticoagular los pacientes según su riesgo para evitar la embolización de posibles coágulos pre-existentes en la aurícula izquierda. En términos generales, si la fibrilación auricular ha estado presente por un periodo mayor a 48 horas o se desconoce su duración, se debe indicar un anticoagulante por vía oral y mantenerse durante más de 3 semanas antes de la conversión o puede administrarse por un tiempo más corto antes si se utiliza una ecocardiografía transesofágica para descartar la presencia de trombo auricular izquierdo. La anticoagulación debe continuarse por al menos 4 semanas después de la cardioversión y muchos pacientes necesitan anticoagulación crónica dependiendo de su riesgo. Otra alternativa para el restablecimiento del ritmo cardíaco normal en pacientes resistentes a los medicamentos es la ablación mediante catéter. La ablación

para el aislamiento eléctrico de las venas pulmonares respecto de la aurícula izquierda puede prevenir la fibrilación auricular en 60 al 80% de los pacientes, en consecuencia, a menudo se reserva para los mejores candidatos (pacientes más jóvenes, que no tienen enfermedad cardíaca estructural significativa, o pacientes con disfunción sistólica del ventrículo izquierdo e insuficiencia cardíaca). Otra alternativa para pacientes en los cuales no es posible controlar la frecuencia cardiaca con medicamentos, o no han respondido a otros procedimientos para convertir la fibrilación a ritmo sinusal, es la ablación del nodo atrioventricular, que busca causar un bloqueo atrioventricular completo para disminuir el número de impulsos auriculares que llegan a los ventrículos. En estos casos, el paciente necesitará la implantación de un marcapasos permanente durante el procedimiento para mantener la frecuencia ventricular cardíaca. En pacientes que tienen fibrilación auricular y otra cardiopatía que requiera intervención quirúrgica, tales como valvulopatías o enfermedad coronaria severa, se puede también

Revista Puertorriqueña de Medicina y Salud Pública 11
realizar la cirugía de Maze, que se basa en la creación de cicatrices de aislamiento en la aurícula con el propósito de evitar los fenómenos de reentrada que inician y perpetúan la arritmia, permitiendo la conducción del estímulo normal desde el nodo sinusal hasta el nodo atrioventricular.
En las personas con fibrilación auricular, el control de la frecuencia cardíaca y la restauración del ritmo sinusal no disminuyen el riesgo de formación de coágulos y accidente cerebrovascular. Es necesario el uso crónico de anticoagulantes para disminuir el riesgo de tromboembolia en los pacientes de riesgo intermedio y alto, según la escala CHA2DS2-VASc. Los pacientes de fibrilación atrial con estenosis mitral reumática moderada
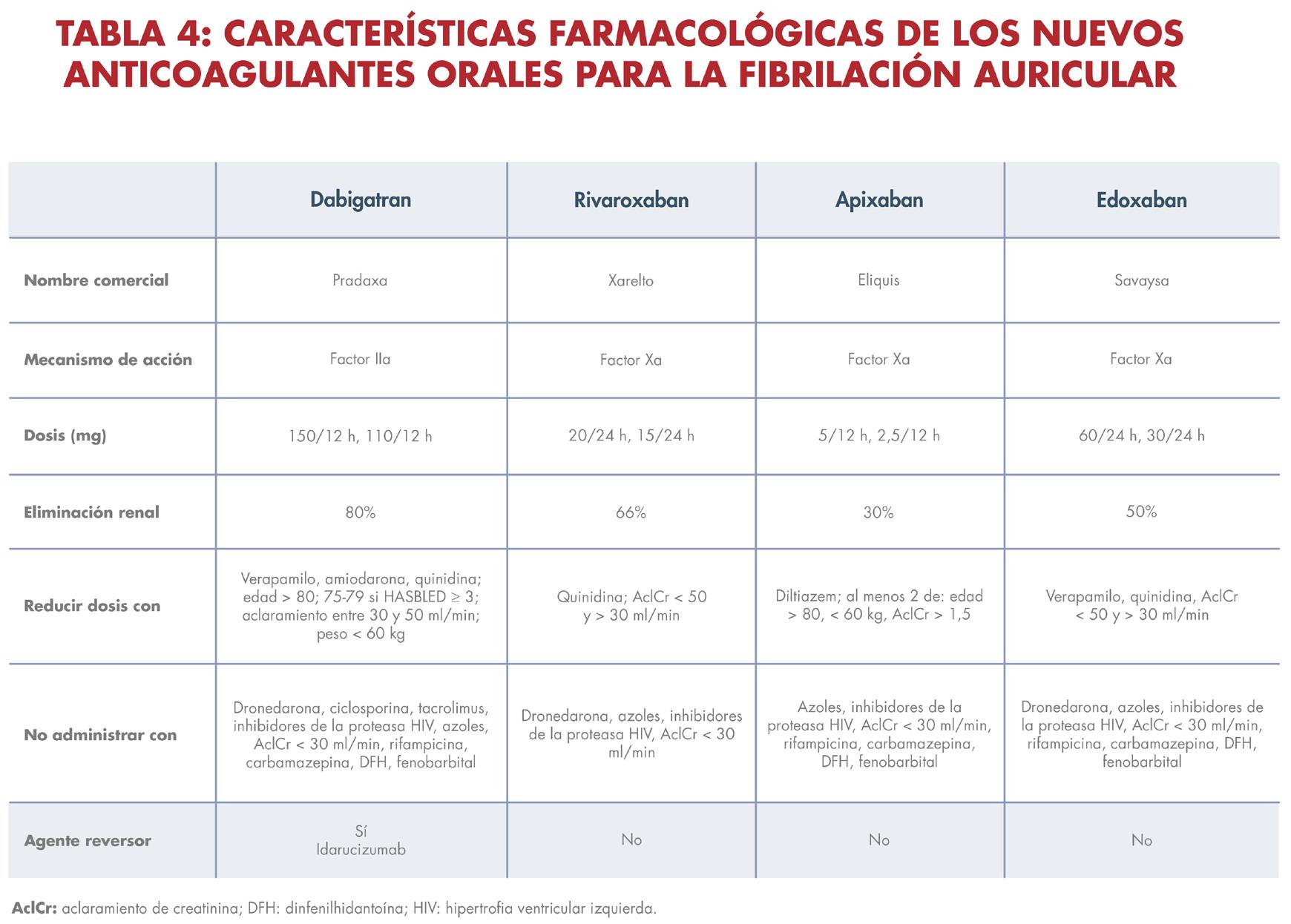
a severa y los pacientes con válvulas cardíacas mecánicas son considerados como de alto riesgo para desarrollar un evento tromboembólico. Estos pacientes con fibrilación auricular valvular se deben anticoagular con warfarina oral hasta obtener un nivel de INR terapéutico, si no tienen un riesgo elevado de sangrado. A los pacientes con fibrilación auricular no valvular se les debe estratificar mediante la puntuación CHA2DS2-VASc. Según las guías más recientes de la ACC/AHA se deben comenzar anticoagulantes orales directos (DOAC por sus siglas en inglés) (ver tabla 4) preferible a warfarina en pacientes que tengan una puntuación CHA2DS2-VASc ≥ 2 en hombres y ≥ 3 en mujeres (recomendación de clase I) y puede considerarse después de una discusión de riesgos y beneficios para
pacientes con puntuaciones CHA2DS2VASc ≥ 1 en hombres y ≥ 2 en mujeres (recomendación de clase IIb). No se recomienda ningún tratamiento antitrombótico en los pacientes con fibrilación auricular no valvular y puntuaciones CHA2DS2-VASc de 0 en hombres y 1 en mujeres. En pacientes que no son candidatos a recibir anticoagulación por tener un alto riesgo de sangrado o una contraindicación absoluta para el uso de anticoagulantes; y que tienen un riesgo elevado de eventos cerebrales embólicos, existe la alternativa de implantar mediante catéter un dispositivo para cerrar la orejuela auricular izquierda, que es donde ocurre la formación mayor de coágulos en los pacientes con fibrilación atrial.

CONCLUSIÓN
a fibrilación auricular es la arritmia sostenida más frecuente en todo el mundo. Se asocia clínicamente a la insuficiencia cardíaca, eventos cerebrovasculares isquémicos y deteriora la calidad de vida de los pacientes. El diagnóstico temprano y eficaz de la fibrilación auricular es de vital importancia para prevenir sus complicaciones y disminuir los costos que conlleva las hospitalizaciones frecuentes de las mismas. Se pueden disminuir los síntomas y la progresión de la enfermedad controlando la frecuencia cardíaca o restableciendo el ritmo normal sinusal del corazón.
Es fundamental evaluar el riesgo individual de cada paciente para prevenir eventos embólicos, principalmente mediante el uso de anticoagulantes orales.
12 Revista Puertorriqueña de Medicina y Salud Pública
L
REFERENCIAS
2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society
2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation

Revista Puertorriqueña de Medicina y Salud Pública 13
MARAVILLOSO MAVACAMTEN: Explorando la mejora farmacológica de la Miocardiopatía Hipertrófica
MAVACAMTEN, EL INHIBIDOR ALOSTÉRICO DE MIOSINA CARDÍACA
PRIMERO EN SU CLASE, HA SIDO APROBADO RECIENTEMENTE POR
LA FDA PARA ADULTOS CON MCH CLASE SINTOMÁTICA II-III NYHA.

14 Revista Puertorriqueña de Medicina y Salud Pública
MSP CASO / CLÍNICO
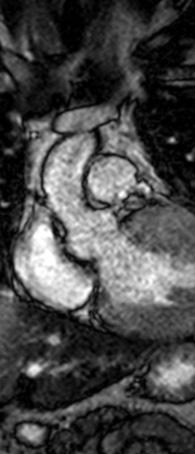
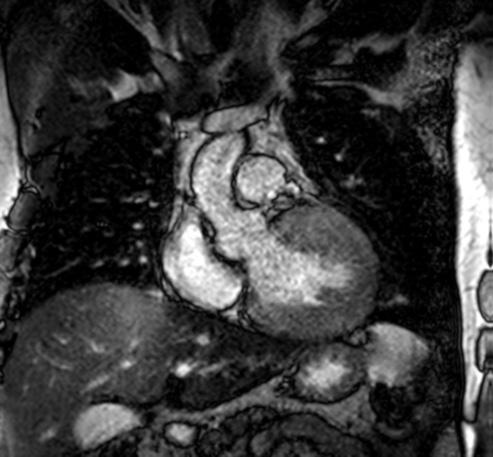
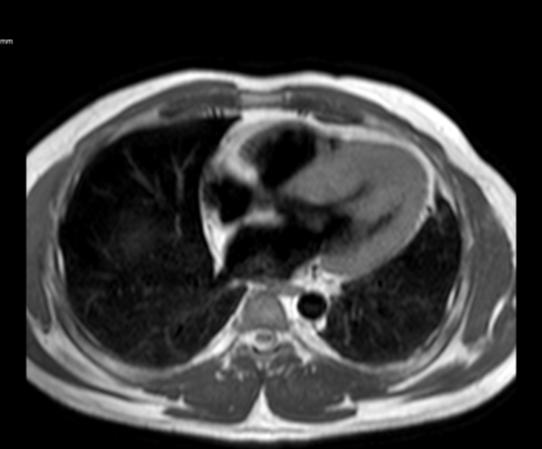
Figure 1: Vista coronal de resonancia magnética cardíaca IVS engrosamiento 3,0cm e infiltración fibrosa septal.
INTRODUCCIÓN
• La miocardiopatía hipertrófica (MCH) es una enfermedad cardíaca genética autosómica dominante, caracterizada predominantemente por hipertrofia ventricular izquierda (HVI) secundaria a mutaciones genéticas que codifican proteínas del sarcómero cardíaco.
• Esta mutación puede conducir a un gradiente del tracto de salida del ventrículo izquierdo (TSVI) de más de 30 mmHg causando obstrucción del TSVI en hasta el 75% de los pacientes con MCH.
• La terapia de reducción septal se ha reservado para pacientes sintomáticos con gradiente de más de 50 mmHg refractario a la terapia médica. Sin embargo, el tratamiento farmacológico con Mavacamten, el inhibidor alostérico de miosina cardíaca primero en su clase, obtuvo recientemente la aprobación de la FDA debido a una mejora significativa del gradiente TSVI y mejoría de los síntomas.
BACKGROUND

• Hypertrophic cardiomyopathy (HCM) is an autosomal dominant genetic heart disease, characterized predominantly by left ventricular hypertrophy (LVH) secondary to gene mutations encoding cardiac sarcomere proteins.
• This mutation may lead to left ventricular outflow tract (LVOT) gradient of more than 30mmHg causing LVOT obstruction in up to 75% of patients with HCM.
 Francisco Tirado-Polo, MD
Isabel Rodríguez- Candelario, MD
José Román-Ramos, MD
Luke’s
Francisco Tirado-Polo, MD
Isabel Rodríguez- Candelario, MD
José Román-Ramos, MD
Luke’s
Episcopal Medical Center, Ponce, PR, USA
• Septal reduction therapy has been reserved for symptomatic patients with gradient of more than 50mmHg refractory to medical therapy, however pharmacological therapy with Mavacamten, the first-in-class allosteric inhibitor of cardiac myosin, has gained recent FDA approval due to significant improvement of LVOT gradient and improved symptoms.
CASO
• Hombre hispano (puertorriqueño) de 39 años con antecedentes de dislipidemia e hipertensión arterial que
desarrolló disnea al realizar actividad física.
• Estaba hemodinámicamente estable y el examen físico fue notable para un II/VI soplo sistólico que se escucha mejor a través del RUSB y LLSB.
• El ecocardiograma realizado para evaluar la función y las estructuras cardíacas, reveló fracción de eyección conservada, engrosamiento del tabique interventricular de 2,9 cm y gradiente del TSVI de 48 mmHg.
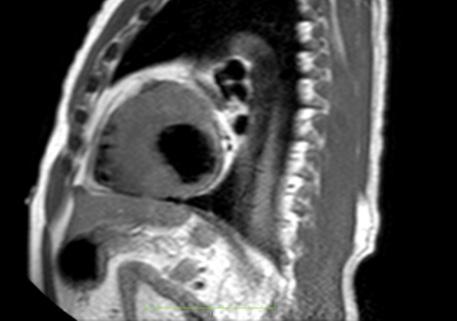
• La resonancia magnética cardíaca

Revista Puertorriqueña de Medicina y Salud Pública 15
Cardiovascular Disease Fellowship Program, St.
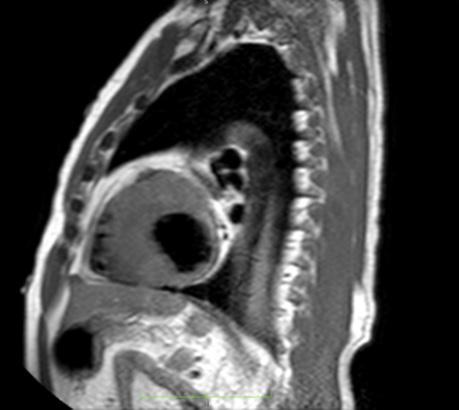
Figure 2: Vista sagital de la resonancia magnética cardíaca IVS engrosamiento de 3,0 cm e infiltración fibrosa septal.
MSP CASO / CLÍNICO
posterior mostró un engrosamiento del tabique interventricular de 3,0 cm, así como una infiltración fibrosa del tabique confirmando el diagnóstico de MCH.
TOMA DE DECISIONES
• Se inició la terapia establecida por guías médicas y se colocó desfibrilador cardioversor implantable como prevención primaria de muerte súbita cardiaca.
• En vista de síntomas persistentes congruentes con la New York Heart

Association (NYHA) clase II, a pesar de terapia óptima establecida por guías médicas, el paciente se inició en Mavacamten.
• La visita de seguimiento a las 8 semanas de su inicio demostró síntomas mejorados consistentes con la clase I de la NYHA, ausencia de soplos audibles y evidencia de reducción del gradiente del TSVI a 7 mmHg.
CONCLUSIÓN
•La terapia de reducción septal se
ha considerado la terapia principal para reducir el gradiente y los síntomas de TSVI, sin embargo, los resultados dependen del operador y están limitados por el acceso a centros de atención terciaria capaces de realizar estos procedimientos invasivos.
• El auge de Mavacamten puede proporcionar un cambio a una alternativa no invasiva, mejorando la accesibilidad y reduciendo las complicaciones quirúrgicas en el manejo de la MCH avanzada.
16 Revista Puertorriqueña de Medicina y Salud Pública MSP CASO / CLÍNICO
Figure 3: Vista axial de resonancia magnética cardíaca IVS engrosamiento 3.0cm e infiltración fibrosa septal.
EL AUGE DE MAVACAMTEN PUEDE PROPORCIONAR UN CAMBIO A UNA ALTERNATIVA NO INVASIVA, MEJORAR LA ACCESIBILIDAD Y REDUCIR COMPLICACIONES QUIRÚRGICAS EN EL MANEJO DE MCH AVANZADA.
DIVULGACIÓN DE INFORMACIÓN
Los autores declaran que no tienen intereses materiales o económicos relevantes que se relacionan con el caso descrito en este póster.

Revista Puertorriqueña de Medicina y Salud Pública 17 MSP CASO / CLÍNICO
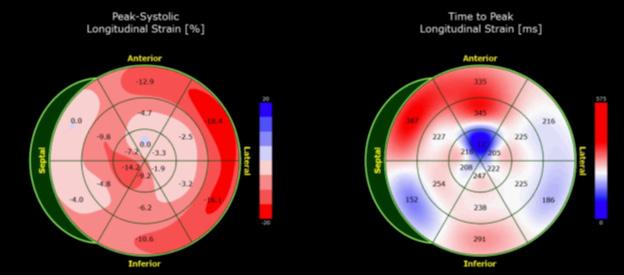
Figure 4: Deformación miocárdica longitudinal del ecocardiograma basal.
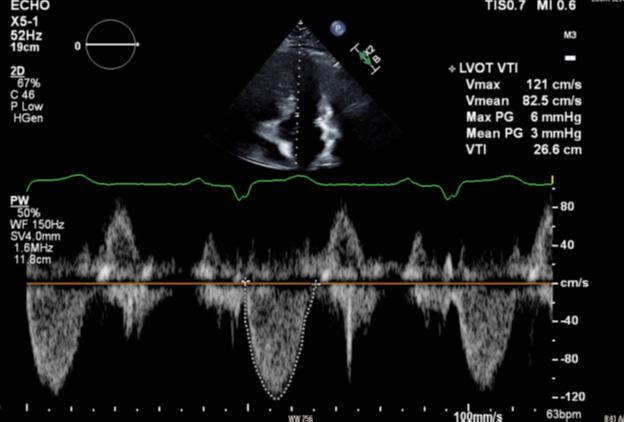
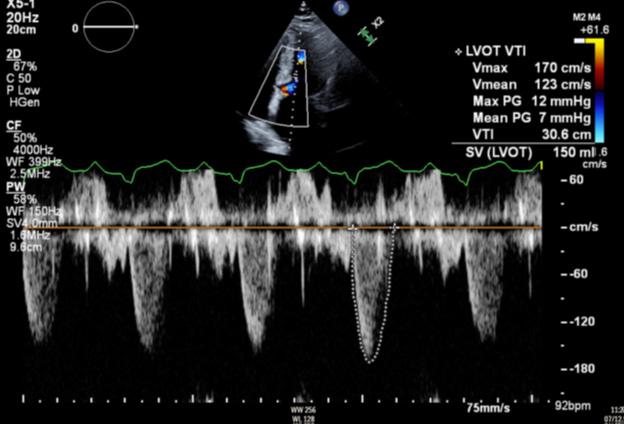
Figure 5: Ecocardiograma 8 semanas después del uso de Mavacamten que muestra un gradiente en el TSVI reducción de 48 mmHg a 7 mmHg.
Figure 6:Ecocardiograma 12 semanas después del uso de Mavacamten que muestra una continua reducción del gradiente del TSVI a 3 mmHg.
LA SALUD CARDIOVASCULAR EN EL PACIENTE QUE VIVE CON DIABETES
La diabetes es un grupo de enfermedades caracterizadas por un alto nivel de glucosa en sangre, que ocurre como resultado de defectos en la capacidad del cuerpo para producir o utilizar insulina.
La prevalencia de diabetes es alta en la población hispana.
El Centro para el Control de Enfermedades de los Estados Unidos (CDC, por sus siglas en inglés) estima que el 9.3% de la población en los 50 estados tiene diabetes, pero en Puerto Rico esa prevalencia al momento es de alrededor de un 20%.
La enfermedad cardiovascular es

más común en los pacientes que viven con diabetes. Estadísticas de Estados Unidos estiman que la enfermedad cardiovascular y cerebrovascular es de 2 a 4 veces más común en adultos que viven con diabetes. Todas las entidades profesionales para el manejo de pacientes que viven con diabetes (Asociación Americana de

18 Revista Puertorriqueña de Medicina y Salud Pública
José M García Mateo, MD, FACE

 Endocrinólogo y Lipidólogo Clínico Certificado
Endocrinólogo y Lipidólogo Clínico Certificado
Diabetes, Asociación Americana del Corazón, entre otras), consideran que la diabetes es parte de un síndrome cardiometabólico-renal. Esto es debido a que una gran cantidad de estos pacientes también sufren de hipertensión arterial, niveles altos de colesterol y otras grasas, obesidad y enfermedad crónica renal.
Varios medicamentos están disponibles para el manejo de la diabetes mellitus y las complicaciones asociadas a ella, incluyendo complicaciones cardiovasculares. Aunque esto es un hecho, no debemos olvidar que la prevención de la diabetes mellitus tipo 2 es la clave. Los métodos preventivos no cuestan nada, estos son:
• Dieta (reducir azúcares simples y grasas)
• Ejercicio (mayormente aeróbico)
• Reducción de peso (al menos un 7 a 10%)
• Educación sobre la condición
Manejar la hipertensión arterial, alcanzando un nivel debajo de 130/80 mmHg; reducir el colesterol malo (LDL) menor de 70 mg/dL y mantener un colesterol no HDL (non-HDL), menos de 100 mg/dL son recomendaciones para disminuir el riesgo de desarrollar eventos cardiovasculares y cerebrovasculares. En las recomendaciones más recientes para el manejo de colesterol alto, si el paciente además de vivir con diabetes también tiene diagnóstico documentado de enfermedad cardiovascular (infarto al miocardio, infarto cerebral o enfermedad vascular periferal), su nivel de colesterol malo LDL y no HDL deben
mantenerse más bajos aún, con un valor menor de 55 mg/dL y 85 mg/ dL respectivamente. Esto se puede lograr con modificaciones en el estilo de vida y terapia farmacológica. Entre estas terapias están las estatinas como primera línea, inhibidores de la absorción intestinal como ezetimibe, los inhibidores de PCSK9 y ácido bempedoico (preferido en pacientes intolerantes a estatinas). Todos estos fármacos han demostrado beneficio en prevención de eventos cardiovasculares y se pueden utilizar en combinación cuando sea necesario. Para el manejo de la hipertensión, además de modificaciones en estilos de vida, se prefiere el uso de medicamentos inhibidores o bloqueadores de angiotensina, mayormente en aquellos que además tienen enfermedad renal crónica o múltiples factores de riesgo para enfermedad cardiovascular. Usualmente en la población con diabetes se necesitan 2 a 3 medicamentos para controlar la hipertensión arterial.
El uso de aspirina se ha mantenido firme en el manejo de aquellos pacientes que viven con diabetes y tienen enfermedad cardiovascular documentada. Aquellos que no tienen enfermedad cardiovascular, se individualiza dependiendo de los factores de riesgo cardiovasculares y el riesgo de experimentar algún sangrado. Extender el tiempo de terapia dual de aspirina con otro agente antiplaquetario por más de 1 año, se está recomendando luego de un evento cardiovascular mayormente si el paciente ha sido intervenido y si el paciente no tiene mayor riesgo de sangrado.
Finalmente, en los últimos años se
han agregado a nuestro armamento para manejar a los pacientes que viven con diabetes, dos clases de fármacos que han demostrado reducción de eventos cardiovasculares, mortalidad y hospitalización por fallo cardiaco, irrespectivamente del control glucémico. Los agonistas de GLP1 han demostrado disminución de eventos, en especial derrames cerebrales y mortalidad cardiovascular. Los inhibidores de SGLT2 por su parte han demostrado beneficio cardiovascular, especialmente en el tratamiento y prevención de fallo cardiaco. El beneficio de este último se extiende a la población con fallo cardiaco que no vive con diabetes. Estos fármacos pueden añadirse a la terapia, aunque el paciente este en control de su glucosa por estos beneficios adicionales.
EN CONCLUSIÓN:
• Si vives con diabetes, mejora tu estilo de vida, lleva tu presión arterial y niveles de colesterol a lo recomendado por las entidades que rigen el manejo de la diabetes y sus complicaciones cardiovasculares.
• Si vives con diabetes y ya tienes enfermedad aterosclerótica cardiovascular o estas a riesgo a esta, tu tratamiento debe ser más agresivo y requerir varios medicamentos con diferentes indicaciones para prevenir un evento que podría ser mortal.
• Edúcate, la información está cerca de tus manos. Hablar con tu médico y aclarar tus dudas es la mejor manera de tratar tu diabetes y sus complicaciones. Siempre estarás a tiempo.
Revista Puertorriqueña de Medicina y Salud Pública 19
PREVALENCIA DE HIPOGLICEMIA Y CALIDAD DE VIDA EN PACIENTES HISPANOS CON DIABETES MELLITUS TIPO 2: EL PUERTO RICO REAL-LIFE EFFECTIVENESS AND CARE PATTERNS
OF DIABETES MANAGEMENT (RECAP-DM)

AUTORES:
Vivian S. Green, PhD, MS, LND Public Health Program, Ponce Health Sciences University vgreen@psm.edu (Vivian S. Green es el autor para correspondencia)
Soreli Santana Public Health Program, Ponce Health Sciences University Ssantana13@stu.psm.edu
Mayra Roubert Public Health Program, Ponce Health Sciences University mroubert@psm.edu
Yemile Ron-Suarez, MD Merck & Co., Inc., Carolina, PR, USA yemile_ron@merck.com

Luis Carlos Mejia-Rivera, PhD, MD Merck & Co., Inc., Carolina, PR, USA luis.mejia-rivera@merck.com
Felipe Arbelaez, MD, MBA Merck & Co., Inc., Kenilworth, NJ, USA felipe_arbelaez@merck.com
Homero Monsanto, PhD Merck & Co., Inc., Carolina, PR, USA homero_monsanto@merck.com
Edgar I. Miranda, PhD Merck & Co., Inc., Carolina, PR, USA edgar.i.miranda.avalo@merck.com
Cecile Marqués-Goyco, MD Merck & Co., Inc., Carolina, PR, USA cecile_marques-goyco@merck.com
Juan C. Orengo, MD, MPH, PhD Public Health Program, Ponce Health Sciences University jorengo@psm.edu
CONFLICTO DE INTERÉS: YR, HM, LCM-R, EIM y CM-G son empleados de Merck & Co., Inc., Carolina, PR, EEUU.; FA es Merck & Co., Inc., Kenilworth, NJ, Estados Unidos; JCO era un empleado de Merck & Co., Inc., Carolina, PR, EEUU cuando se diseñó el estudio.
FINANCIACIÓN: MSD (IA) LLC, Carolina, Puerto Rico
CONTRIBUCIONES DE LOS AUTORES: VSG, SS, MR y JCO trabajaron en la implementación del estudio, análisis de datos, interpretación de resultados y redacción del manuscrito; YR, HM, FA, LCM-R, EIM, CM-G y JCO colaboraron en el diseño de la investigación. El manuscrito fue revisado y aprobado por todos los autores.
AGRADECIMIENTOS: Queremos agradecer a los pacientes que participaron voluntariamente en el estudio y a los médicos que colaboraron en la implementación del proyecto.
PALABRAS CLAVE: Hipoglucemia, diabetes, hispano, Puerto Rico, calidad de vida
KEYWORDS: hypoglycemic, diabetes, Hispanic, Puerto Rico, quality of life
20 Revista Puertorriqueña de Medicina y Salud Pública Revista Puertorriqueña de Medicina y Salud Pública 16
MSP ARTÍCULO / ORIGINAL
RESUMEN
En Puerto Rico la prevalencia de la diabetes mellitus tipo 2 (DMT2) es del 15,5% (2016). Los objetivos de nuestro estudio fueron: 1) evaluar la prevalencia de hipoglucemia en pacientes con DMT2 que toman sulfonilureas; 2) evaluar la prevalencia de pacientes con DMT2 que no están en la meta de HbA1c de <7%; 3) evaluar la evaluación del autocuidado, la calidad de vida y la adherencia general al tratamiento. Se realizó un estudio exploratorio transversal en consultorios médicos privados en todo Puerto Rico (2016-2017). Los pacientes con diagnóstico de DMT2 tratados con sulfonilureas fueron invitados a participar en el estudio. Los datos sobre el cumplimiento, la calidad de vida, el estilo de vida y los factores conductuales fueron informados por el participante y se recopilaron los datos clínicos de la historia clínica. Se utilizaron estadísticas descriptivas e inferenciales para resumir los datos generales de los pacientes. (260 participantes fueron inscritos en el estudio). Durante los últimos seis meses la hipoglucemia autoinformada fue del 41,2%, siendo el 58,9% la prevalencia de pacientes con la última HbA1c <7%. El 85,3% de los participantes siempre utilizaron sus medicamentos según lo prescrito por su médico. El 60,3% de los participantes no sigue una dieta especial para diabéticos y el 67,2% no sigue un programa de ejercicios de rutina. La puntuación del Índice EQ-5D para los pacientes hipoglucémicos fue de 0,77 (DE=0,21) y para los pacientes no hipoglucémicos fue de 0,85 (DE=0,14) (p <0,05). La prevalencia de hipoglucemia autoinformada se encuentra en el rango de otros estudios realizados en Asia y Europa; el objetivo de HbA1c<7 no se alcanzó en el 41,1% de la muestra. Estos hallazgos resaltan la necesidad médica insatisfecha de tratamiento que puede ayudar a los pacientes a alcanzar los objetivos del tratamiento con DMT2.
INTRODUCCIÓN
La prevalencia de diabetes mellitus (DM) en Puerto Rico se encuentra entre las más altas de América Latina y el Caribe 1 . Se estima que casi 400 000 personas entre 20 a 79 años tienen diabetes en Puerto Rico. Según el Sistema de Vigilancia de los Factores de Riesgo del Comportamiento (BRFSS, por sus siglas en inglés) de los Centros para el Control y la Prevención de Enfermedades (CDC) en 2010, al 8,7% de la población de los Estados Unidos se le había informado que tenía DM y en 2018 la prevalencia era del 11%, siendo para Puerto Rico de un 15,5% 2
La DM fue la tercera causa de muerte en Puerto Rico en el 2016 y así desde el 2004 3,4 . La tasa de mortalidad por DM más alta en Puerto Rico fue durante el 2011 (75,5 por cada 100 000 habitantes), pero datos de 2016 mostraron que la tasa de mortalidad fue de 66,3 por cada 100 000 habitantes 3,4 . En Puerto Rico, en el 2013, el presupuesto invertido a DM ascendió a $138 416 722 y el grupo de edad entre 65 a 69 años invirtió aun más con aproximadamente $25,4 millones.
ABSTRACT
In Puerto Rico the prevalence of Type 2 Diabetes Mellitus (T2DM) is 15,5% (2016). The objectives of our study were: 1) to assess the prevalence of hypoglycemia in T2DM patients taking sulfonylureas; 2) to assess the prevalence of T2DM patients who are not at the HbA1c goal of <7%; 3) to assess self-care evaluation, quality of life and the general adherence to treatment. An exploratory cross-sectional study was conducted in private medical offices across Puerto Rico (2016-2017). Patients with a diagnosis of T2DM treated with sulfonylureas were invited to participate in the study. Data on adherence, quality of life, lifestyle/behavioral factors were reported by the participant and clinical data from the medical record were collected. Descriptive and inferential statistics were used to summarize general data of the patients. (260 participants were enrolled in the study).

During the last six months the self-reported hypoglycemia was 41,2%, being 58,9% the prevalence of patients with the last HbA1c <7%. 85,3% of the participants always used their medicines as prescribed by their doctor. The 60,3% of the participants do not follow a special diabetic diet and 67,2% do not follow a routine exercise program. The EQ-5D Index score for hypoglycemic patients was 0.77 (SD=0.21) and for non-hypoglycemic patients was 0.85 (SD=0.14) (p <0.05). The prevalence of self-reported hypoglycemia is in the range of other studies conducted in Asia and Europa; the target of HbA1c < 7 was not achieved by the 41,1% of the sample. These findings highlight the unmet medical need for treatment that can help patients achieve T2DM treatment goals.
La diabetes mellitus tipo 2 es la forma más común de diabetes mellitus (DM2) y representa el 90% de todos los casos diagnosticados en todo el mundo
A su vez es la causa principal de morbilidad y mortalidad5 , particularmente con enfermedad cardiovascular, neuropatía y enfermedad renal crónica6,7. Además, dado que las enfermedades cardiovasculares y la DM son la primera y la tercera causa de muerte en Puerto Rico (2016) respectivamente, la prevención y el tratamiento de la diabetes mellitus son de máxima prioridad4 . Se estima que el 80-90% de los pacientes con DM2 requieren tratamientos farmacológicos de un tipo u otro. El objetivo del tratamiento es controlar los parámetros glucémicos (HbA1c Objetivo <7%,
American Diabetes Association, 2014) para minimizar el riesgo de complicaciones a largo plazo y aliviar cualquier síntoma8 Sin embargo, se ha documentado que el control glucémico intensivo puede conducir a eventos hipoglucémicos en pacientes diabéticos, por lo que actúa como un obstáculo significativo en los esfuerzos de control glucémico en el tratamiento del paciente9 . La hipoglucemia ocurre cuando los niveles de glucosa en sangre se encuentran por debajo de la línea de base, generalmente a 70 mg /dL8 o menos. En algunos pacientes diabéticos la respuesta al glucagón se ve afectada y su respuesta a otras hormonas (epinefrina y adrenalina) puede elevar los niveles de glucosa en sangre. El problema de estos pacientes surge debido a su tratamiento: la insulina y los agentes hipoglucemiantes orales (OHA), como las sulfonilureas (SU), aumentan la producción de insulina, por lo que los niveles de glucosa no pueden volver a su rango normal 10 . Según los hallazgos de tres grandes ensayos aleatorios controlados (ACCORD, ADVANCE, VADT) 11,13 , la
Revista Puertorriqueña de Medicina y Salud Pública 21 Revista Puertorriqueña de Medicina y Salud Pública 17
CARACTERÍSTICAS SOCIODEMOGRÁFICAS DE LA MUESTRA
relevancia clínica de los eventos hipoglucémicos se ha vuelto cada vez más importante en las guías internacionales para el tratamiento de DM2. La Declaración de Consenso 2013 del Algoritmo de Manejo Integral de la Diabetes de AACE destacó que “minimizar el riesgo de hipoglucemia es una prioridad. Es una cuestión de seguridad, adherencia y costo”.14 En los estudios de Real-Life Effectiveness and Care Patterns of Diabetes Management (RECAP-DM) Asia Pacífico y RECAP DM de la Unión Europea, el 36% de los pacientes tratados en la región de Asia Pacífico y el 38% de los pacientes tratados en la región de la Unión Europea informaron síntomas de hipoglucemia.15,16
En Puerto Rico, donde la diabetes es altamente predominante, la prevalencia de hipoglucemia en pacientes tratados con SU en un entorno real aún no se ha evaluado. Por lo tanto, los objetivos generales de este estudio fueron: 1) evaluar la prevalencia de hipoglucemia (autoinformada o documentada en la historia clínica del participante) en pacientes diabéticos tipo 2 tratados con SU (como monoterapia o en combinación con metformina) en Puerto Rico y 2) estimar la prevalencia de pacientes que alcanzan la meta de HbA1c de <7%.
MATERIAL Y MÉTODOS
Se realizó un estudio exploratorio de corte transversal en consultorios médicos privados en las regiones norte y sur de Puerto Rico durante los años 2016-2017. Los pacientes con un diagnóstico de diabetes mellitus tipo 2 tratados con sulfonilureas como monoterapia o en combinación con metformina y otros criterios de inclusión fueron invitados a participar en el estudio. Los objetivos del estudio fueron, primero, evaluar la prevalencia de hipoglucemia en pacientes con diabetes mellitus tipo 2 que toman sulfonilureas en Puerto Rico; segundo, evaluar la prevalencia de pacientes con diabetes mellitus tipo 2 en Puerto Rico que no están en el objetivo de HbA1c de <7 %; y tercero, evaluar el autocuidado, la calidad de vida y la adherencia general al tratamiento. La población de estudio eran pacientes adultos diagnosticados con diabetes mellitus tipo 2 de acuerdo con los criterios de la ADA a) Síntomas de DM más concentración de glucosa en plasma casual ≥200 mg/dl (11.1 mmol/l); b) FPG ≥ 126 mg/ dl (7,0 mmol/l); y c) PG≥200 mg /dl de 2 h (11.1 mmol/l) durante un OGTT) de 30 años de edad o más que han estado tomando SU (terapia mono o en combinación con metformina) durante al menos 6 meses.
Durante la visita de rutina al consultorio, el participante completó una serie de cuestionarios de pacientes para recopilar datos notificados por el paciente sobre la experiencia de haber padecido hipoglucemia (incluida la frecuencia/gravedad), la adherencia al tratamiento, la calidad de vida (QoL) y los factores de estilo de vida/comportamiento. Además, se recopilaron datos médicos prespecificados de los expedientes médicos para el período de 6 meses anterior a la fecha de inscripción del paciente al estudio, los cuales incluyeron datos demográficos del paciente, factores de riesgo, historial de enfermedad/medicación, uso de recursos y HbA1c, entre otros valores de laboratorio. Se utilizaron estadísticas descriptivas para resumir los datos generales de los pacientes y las pruebas de Chi cuadrado, OR y T para comparar grupos. El muestreo no fue probabilístico. Se usó una fórmula de muestra aleatoria simple para calcular el tamaño de la muestra, siendo esta de 260 pacientes. Todos los participantes dieron su consentimiento informado para la inclusión en el estudio antes de participar en el mismo. El estudio se realizó de conformidad con la Declaración de Helsinki y el protocolo fue aprobado por la Junta de Revisión Institucional de la Ponce Health Sciences University.

22 Revista Puertorriqueña de Medicina y Salud Pública Revista Puertorriqueña de Medicina y Salud Pública 18 MSP ARTÍCULO / ORIGINAL
*
No Hipoglucémico media (SD) 95% IC de la diferencia Todos Hipoglucémico media (SD) Edad Edad del diagnóstico Duración de la DM 65.8 (13.2) SOLTERO/A CASADO/A DIVORSIADO/A VIUDO/A 56.7 (13.3) 48.3 (14.6) 9.7 (8.7) 11.5 (11.4) 2.6 , 9.6* Trabajando tiempo completo Escuela primaria Escuela secundaria Universitario postgrado Medio tiempo Desempleado (Buscando trabajo) Retirado Ama de casa Discapacitado 38 64 22 27 27 45 14 31 65 109 36 48 25.2% 21 13.7% 25% 19.6% 22.8% 52% 43.9% 48.6% 21.7% 1.3% 0.8% 36.4% 27.8% 17.8% 9.2% 14% 11.2% 34.6% 19.6% 28.5% 31.4% 2% 3.7% 2.7% 31.5% 31.8% 15.4% 40 38 33 2 2 0 39 72 79 47 126 59 21 19 53 48 3 4 7 34 82 21 74 14 15 29 42.4% 14.6% 17.9% 25.2% 42.1% 13.1% 19.6% 25.2% 42.2% 14% 18.6% 4.8 , 12.0* -4.3 , 0.7 59.7(14.6)
Diferencia estadísticamente significativa (p<0.05)
RESULTADOS
El 36,7% de la muestra eran hombres y el 63,3% mujeres. La edad media fue de 63,4 años (DE=14) y la mediana fue de 65 años. La edad promedio de las mujeres fue de 63,7 años (DE=14) y la de los hombres de 63,1 años (DE=14); las diferencias no fueron estadísticamente significativas.
La edad media al diagnóstico de diabetes mellitus (DM) fue de 53,2 años (DE=14) y la mediana de 55 años; en las mujeres, la edad promedio al diagnóstico fue de 53,7 años (DE=14) y en los hombres fue de 52,5 años (DE=15); la duración promedio de la enfermedad desde el diagnóstico fue de 10,4 años (DE=10) y la mediana de 8 años, en mujeres fue de 10,1 (DE=9,7) y en hombres de 10,9 (DE=10,4) la mediana fue de 8,5 años y 7 años para mujeres y hombres respectivamente, sin diferencias estadísticamente significativas.

En los últimos seis meses, el 41,2% de los participantes en el estudio informaron un episodio de hipoglucemia como se define en el estudio. En cuanto a la relación entre hombres y mujeres, 40% (38) y 43,1% (69) respectivamente informaron algún episodio de hipoglucemia.
En la tabla 1 podemos ver la edad media en el momento del diagnóstico y la duración promedio de la DM según el paciente que informó haber sufrido un episodio de hipoglucemia o no. Encontramos diferencias estadísticamente significativas en la edad del paciente y en la edad de diagnóstico. Los pacientes con hipoglucemia tenían una edad menor y eran más jóvenes cuando fueron diagnosticados. También podemos observar los resultados relacionados con las características sociodemográficas de la muestra, tanto para los pacientes que notificaron hipoglucemia como los que no la notificaron.
El 66,4% (168) de la muestra informó que sus padres también habían sido diagnosticados con DM, para los participantes no hipoglucémicos fue del 58,5% (89) y para los hipoglucémicos del 75,2% (79), por lo que se encontro una diferencia estadísticamente significativa (p <0.05) para estos dos grupos, lo que representa para los pacientes con hipoglucemia 2,01 veces más posibilidades (OR) de tener padres diabéticos (IC 95%: 1,16; 3,49).
El 65% (169) de la muestra nunca había fumado; aquellos que habían dejado de fumar o fumaban actualmente representaban el 25,8% (67) y 8,8% (23) respectivamente. En relación con los participantes no hipoglucémicos, el 63,4% (97) nunca había fumado, el 28,1% (43) había dejado de fumar y el 8,5% (13) continuó fumando; para los pacientes con hipoglucemia, el 67% (72) nunca había fumado, el 22,4% (24) había dejado de fumar y el 9,3% (10) fumaba actualmente.
El 49,8% (129) de los participantes informaron que realizaban algún tipo de actividad física, siendo el 53,9% (82) de los no hipoglucémicos y el 43,9% (47) de los hipoglucémicos. El 69,8% (180) de la muestra notificó que ingiere una dieta baja en azúcar, lo que corresponde al 73,5% (111) de los pacientes no hipoglucémicos y al 64,5% (69) de los hipoglucémicos. Una dieta baja en calorías es seguida por el 46,5% (111) de los participantes, esta misma dieta es seguida por el 48,7% (73) de los no hipoglucémicos y el 43,4% (46) de los hipoglucémicos.
El índice de masa corporal (IMC) medio de la muestra fue de 30 (DE=6,8) y la mediana de 28,6 en hipoglucémicos; el promedio fue de 31,3 (DE=6,7) y la mediana fue de 30,2, en no hipoglucémicos, la media fue de 29 (DE=6,8) y la mediana de 27,3; al comparar las medias encontramos una diferencia estadísticamente significativa (p <0.05) con una diferencia entre
las medias de -2,3 (95% Ci -4,0, -0,6). Los pacientes no hipoglucémicos tienen 1,9 (IC 95% 1.1.3.2) más posibilidades de tener un peso saludable que los pacientes que presentaron hipoglucemia en los últimos seis meses.
En la tabla 2 podemos observar la clasificación de los participantes según el índice de masa corporal.
En el 67,5% (172) de la muestra no se informaron cambios en el peso en los últimos seis meses ni en el 62,6% (67) de los pacientes con hipoglucemia y el 70,9% (105) de los participantes no hipoglucémicos. Por otro lado, el 9,4% (24) de los participantes informaron pérdida de peso, así como el 13,1% (14) de los pacientes con hipoglucemia y el 6,8% (10) de los pacientes sin hipoglucemia (Figura 1). No encontramos diferencias estadísticamente significativas en la ganancia o pérdida de peso entre pacientes con hipoglucemia y pacientes no hipoglucémicos. Sin embargo, se observa una mayor pérdida de peso en pacientes con hipoglucemia.
Los pacientes que informaron haber tenido un episodio de hipoglucemia en los últimos seis meses informaron haber sufrido “leve” (síntomas de bajo nivel de azúcar en la sangre definidos como poca o ninguna interrupción de las actividades, y no sienten la ayuda necesaria para controlar los síntomas), “moderado” (síntomas de bajo nivel de azúcar en la sangre definidos como cierta interrupción de actividades, pero no siente la asistencia necesaria para controlar los síntomas), “grave” (síntomas de bajo nivel de azúcar en la sangre definidos como que sentían que necesitaba la ayuda de otros para controlar los síntomas (por ejemplo, para llevar comida o bebida) o “muy grave”
Revista Puertorriqueña de Medicina y Salud Pública 23 Revista Puertorriqueña de Medicina y Salud Pública 19
IMC C lasificación No hipoglucémico Hipog lucémico T odos Bajo peso 3(2.1%) 0 3(1.2%) Peso saludable 33(23.4%) 17(16.2%) 50(20.3%) Sobrepeso 55(39.0%) 34(32.4%) 89(36.2%) Obeso 50(35 5%) 54(51 4%)* 104(42 3%)
* Diferencia estadísticamente significativa (p<0.05)
Tabla 2. Clasificación del índice de masa corporal (IMC)
MSP ARTÍCULO / ORIGINAL

(síntomas de bajo nivel de azúcar en la sangre definidos como atención médica necesaria (por ejemplo, llamar a una ambulancia, visitar una sala de emergencias u hospital, o ser visto por un médico o enfermera) síntomas en el 68,9% (73) , 29,9% (32), 6,5% (7) y 2,8% (3) respectivamente. 16,9% (25) informaron que no sentían “ninguna preocupación” por sus síntomas, 18,7% (20) “sin molestias”, 34,6 % (37) una “pequeña molestia”, 15% (16) “algo de incomodidad” y 8,4% (9) “mucha incomodidad “.
En relación con la información que el médico discutió en el momento del diagnóstico de DM encontramos que la dieta, los niveles de glucosa en la sangre, el control de la presión arterial, la salud emocional, el manejo del nivel alto de azúcar en la sangre y la cobertura del
seguro de salud se discutieron menos con los hipoglucémicos, siendo esta diferencia estadísticamente significativo (p <0.05). En la información discutida por el médico con el paciente en una revisión de seguimiento de la patología encontramos que a los pacientes hipoglucémicos se les habla menos sobre la dieta, la salud emocional y el manejo del nivel
alto de azúcar en la sangre, siendo para estas características la diferencia estadísticamente significativa (p <0.05).
Las tablas 3 y tabla 4 presentan la información que fue discutida por el médico con el paciente en el momento del diagnóstico de DM y se dialoga en una revisión de la enfermedad, respectivamente.
24 Revista Puertorriqueña de Medicina y Salud Pública Revista Puertorriqueña de Medicina y Salud Pública 20 Infor mación No h ipoglucémico Hipog lucémico T odos Dieta 139(90.8%) 81(76.4%)* 220(84.9%) Factores culturales 42(27.5%) 24(22.6%) 66(25.5%) Actividad f ísica 132(86.3%) 88(83.0%) 220(84.9%) Monitoreo de la glucosa 124(81 0%) 82(77 4%) 206(79 5%) Opciones de tratamiento 89(58.2%) 58(54.7%) 147(56.8%) Niveles de glucosa en sangre 113(73.9%) 61(57.5%)* 174(67.2%) Presión sanguínea 133(86 9%) 82(77 4%)* 215(83 0%) Colesterol 124(81 0%) 78(73 6%) 202(78 0%) Empleo 44(28 9%) 26(24 5%) 70(27 1%) Hábito tabáquico 51(33.6%) 37(34.9%) 88(34.1%) Ingesta de alcohol 50(32 7%) 32(30 2%) 82(31 7%) Salud emocional 94(61 4%) 41(38 7%)* 135(52 1%) Manejo de niveles altos de glucosa en sangre 107(69.9%) 57(53.8%)* 164(63.3%) Cobertura de seguro médico 51(33.3%) 22(20.8%)* 73(28.2%) No discutió nada 2(5.6%) 2(5.9%) 4(5.7%) No recuerda 7(19 4%) 7(20 6%) 14(20 0%)
Figura 1. Prevalencia de pérdida de peso notificada por el participante
No hypoglycemic patients 0.00% 6.80% 13.10% Prevalence 2.00% 4.00% 6.00% 8.00% 10.00% 12.00% 14.00% Hypoglycemic patients
Tabla 3. Información discutida por el médico con el paciente al momento del diagnóstico
* Diferencia estadísticamente significativa (p<0.05)
El 26,3% (40) de los no hipoglucémicos y el 21% (22) de los hipoglucémicos notificaron que nunca omiten alimentos cuando trabajan, mientras que el 0,7% (1) de los no hipoglucémicos y el 3,8% (4) de ellos lo hacen. El 46,7% (121) de los participantes han sido referidos a un educador en diabetes o a un dietista o nutricionista, el 43% (46) de los pacientes con hipoglucemia informaron que fueron referidos a uno de los especialistas anteriores mientras que los no hipoglucémicos el 49,3% (75) informó haber recibido referidos. De los que recibieron un referido, el 50% (60) fue en los primeros meses, el 5% (6) en los primeros tres meses, el 10% (12) en los primeros seis meses, el 11,7% (14) en el primer año, el 12,5 % (15) después del primer año y 10,8% (13) nunca asistieron a la cita. En relación con los pacientes con hipoglucemia, el 32,6% (15) fue en los primeros meses, el 6,5% (3) en los primeros tres meses, el 4,3%
visita de seguimiento
(2) en los primeros seis meses, el 21,7% (10) en el primer año, el 17,4% (8) después del primer año y el 17,4% (4) nunca asistieron a la cita en comparación con el 61.6% (45), 2,7% (2), 13,7% (10), 5,5% (4), 9,6% (7) y 6,8% (5) de pacientes no hipoglucémicos. Los pacientes que presentaron hipoglucemia visitaron al educador o al dietista en menor frecuencia durante los primeros tres meses y lo visitaron más en el primer año, siendo estas diferencias estadísticamente significativas (p <0.05).

El 58,6% (150) de la muestra informó que no desembolsó dinero para pagar los medicamentos recetados para la diabetes, el 28,5% (73) pagó un copago, el 3,9% (10) pagó por algunos de ellos y el 9% (23) pagó por todos. Para el 59,8% (153) es muy importante en el diálogo con el médico, el costo de los medicamentos en la elección de su tratamiento médico, para el 8,2% (21) no es importante.
La tabla 5 presenta los valores clínicos de la
muestra total para pacientes con episodios de hipoglucemia en los últimos seis meses y, para aquellos participantes que no los notificaron, encontramos diferencias estadísticamente significativas (p <0.05) en los valores de HDL, triglicéridos y cintura. La prevalencia de participantes con el último valor de HbA1c <7% fue del 58,9%. En relación con la calidad de vida, se modificaron las respuestas al cuestionario EQ-5D-3L. Las tres posibles respuestas a cada dimensión se redujeron a dos, si el participante no presentaba ningún problema se consideraba “sin problemas” y si el participante respondía “algún problema” (el paciente presenta limitaciones para realizar alguna actividad) o se sentía incapacitado en la dimensión estudiada se consideró “con problemas”. En la tabla 6 podemos ver los resultados para cada
Revista Puertorriqueña de Medicina y Salud Pública 25 Revista Puertorriqueña de Medicina y Salud Pública 21
* Diferencia estadísticamente significativa (p<0.05)
Infor mación No Hipoglucémico Hipog lucémico T odos Dieta 139(90 8%) 79(74 5%)* 41(15 8%) Factores culturales 39(25 5%) 20(18 9%) 59(22 8%) Actividad f ísica 124(81 0%) 77(72 6%) 201(77 6%) Monitoreo de la glucosa 121(79.1%) 77(72.6%) 198(76.4%) Opciones de tratamiento 80(52 3%) 58(54 7%) 138(53 3%) Niveles de glucosa en sangre 116(75.8%) 74(69.8%) 190(73.4%) Presión sanguínea 129(84 3%) 80(83 4%) 2010(81 1%) Colesterol 113(73 9%) 78(73 6%) 191(73 7%) Empleo 35(23 0%) 31(29 2%) 66(25 6%) Hábito tabáquico 45(29 6%) 24(22 6%) 69(26 7%) Ingesta de alcohol 52(34 4%) 30(28 3%) 82(31 9%) Salud emocional 78(51.3%) 37(34.9%)* 115(44.6%) Manejo de niveles bajos de glucosa en sangre 97(63.4%) 58(54.7%) 155(59.8%) Manejo de niveles altos de glucosa en sangre 105(68.6%) 55(51.9%)* 160(61.8%) Cobertura de seguro médico 53(34.9%) 28(26.4%) 81(31.4%) No discutió nada 1(3 1%) 3(7 5%) 4(5 6%) No recuerda 6(18.8%) 7(17.5%) 13(18.1%)
Tabla 4. Información discutida por el médico con el paciente en una
MSP ARTÍCULO / ORIGINAL

dimensión en el caso de que el participante respondió “sin problemas”, según el participante informó si había sufrido hipoglucemia o no. Para la dimensión de movilidad, dolor y ansiedad/depresión encontramos una diferencia estadísticamente significativa (p<0.05), presentando los pacientes con hipoglucemia 1.8 (IC 95%: 1.1, 3.0) más posibilidad de presentar problemas de movilidad, 1.9 (IC 95%): 1.2.3.2) más posibilidades de presentar problemas de dolor y 2,3 (IC 95%: 1.4.3.9) más posibilidades de presentar ansiedad/ depresión.
El puntaje del índice EQ-5D (las cinco preguntas del EQ-5D-3L se usaron para calcular este puntaje, el 0 se refiere al peor estado de salud (muerte) y el 1 al mejor estado de salud) fue de 0.82 (DE=0.17) para toda la muestra del estudio, siendo para los pacientes hipoglucémicos de 0,77 (DE=0,21) y para los pacientes no hipoglucémicos de 0,85 (DE=0.14), encontrando esta diferencia estadísticamente significativa (p <0.05), para una diferencia de las medias de 0,08 (IC del 95% de diferencia: - 1,26; - 0,35 )
DISCUSIÓN
En nuestro estudio la prevalencia de hipoglucemia informada por los pacientes con diabetes tipo 2 tratados con sulfonilureas fue del 41,2%, lo que corresponde a la prevalencia encontrada en otros estudios. En el estudio RECAP-DM de Asia-Pacífico realizado por Chan et al (2010) en una muestra de 2257 pacientes con diabetes tipo 2, la prevalencia de hipoglucemia fue del 35,8%, siendo el 41,7% la prevalencia en China (muestra de 484 pacientes), similar a la encontrada en Puerto Rico. Por otro lado, la prevalencia en Taiwán fue del 29,4% en una muestra de 609 pacientes. En general, en el estudio de Chan et al., el 11,6% informó síntomas “graves” de hipoglucemia y el 8,2% síntomas “muy graves”. En nuestro estudio encontramos 6,1% y 2,6% respectivamente, que es similar al encontrado en China que fue de 6,9% y 4,0% respectivamente16. En el estudio realizado por Alvarez-Guisasola et al (2008) en varios países europeos (España, Francia, Alemania, Reino Unido, Polonia, Noruega y Finlandia), en una muestra de 1709 pacientes
diagnosticados con diabetes tipo 2 con una edad promedio de 62.9 ± 10,6 años, la prevalencia general de hipoglucemia encontrada fue de un 38,4%, la prevalencia más baja se encontró en Alemania con un 24,2% y la más alta en el Reino Unido con un 53,8%, mientras que la más similar a Puerto Rico se encontró en Francia, que fue de un 38,7 %. Como en nuestro estudio no se encontraron diferencias estadísticamente significativas relacionadas con el valor objetivo de una HbA1c en los límites recomendados entre los pacientes
que informaron hipoglucemia y los que no15. Majanovic et al (2017) en el estudio RECAP-DM en la región de los Balcanes con una muestra de 573 pacientes con diabetes tipo 2 y una edad media de 67,2 años encontraron una prevalencia de hipoglucemia del 36,6%; de estos, 62,8% tenían síntomas leves, 31,2% moderados, 4% severos y 2 % muy severos, resultados similares a los nuestros 17 González y Cols. en el estudio RECAP-DM realizado en Argentina en el 2015 con una muestra de 397 participantes y una edad
26 Revista Puertorriqueña de Medicina y Salud Pública Revista Puertorriqueña de Medicina y Salud Pública 22
Valor clínico No hipoglucémico Hipoglucémico Todos HbA1c Media DE Mediana 7 1 1 4 6 8 7 7 7 3 6 7 7 3 4 7 6 8 Glucosa en ayunas Media DE Mediana 130 6 45 3 123 0 132 3 50 4 127 5 131 1 47 4 124 0 Colesterol Media DE Mediana 167 7 44 7 166 0 172 1 39 1 171 0 169 6 42 6 167 0 HDL * Media DE Mediana 52 0 25 5 48 1 46 4 13 6 44 0 49 8 21 9 46 7 LDL Media DE Mediana 90 0 34 9 87 8 95 1 34 5 93 0 92 2 34 7 89 0 Triglicéridos * Media DE Mediana 133 9 63 9 119 0 171 6 109 9 145 147 6 84 9 128 0 Presión sistólica Media DE Mediana 125 6 17 5 125 0 128 3 14 5 129 0 126 5 16 4 128 0 Presión diastólica Media DE Mediana 74 1 13 3 78 0 77 1 9 6 80 0 75 4 12 0 80 0 Creatinina Media DE Mediana 2 3 11 5 0 8 2 6 10 7 0 8 2 4 11 1 0 8 Cintura * Media DE Mediana 88 7 13 2 86 4 93 1 14 3 91 4 90 4 13 8 87 0
Tabla 5. Valores clínicos
* Diferencia estadísticamente significativa (p<0.05)
promedio de 62,5 años encontraron una prevalencia de hipoglucemia autoinformada de 45,5% y diabetes controlada del 36,4%; para Puerto Rico la prevalencia fue de 41,2% y 58,9% respectivamente. Similar a nuestro estudio, el tiempo promedio con el diagnóstico de diabetes en Argentina fue de 10 años con una edad promedio de 52,7 años al tiempo del diagnóstico, siendo Puerto Rico de 10,4 años y 53,2 años 18
En el estudio Exhype realizado en Suecia en 2010 por Petterson et al. con una muestra de 430 pacientes, la prevalencia informada de hipoglucemia fue del 34%19 . También en Suecia, Lundkvist et al (2005) encontraron una prevalencia de hipoglucemia del 37% en una muestra de 399 pacientes diabéticos tipo 2 con una edad media de 65 ± 11 años20 . Rombopoulos et al. (2013) en el estudio HYPO implementado en Grecia, en una muestra de 6631 pacientes con diabetes tipo 2, evidenciaron que la prevalencia estimada de hipoglucemia informada por los pacientes fue del 41,9%, presentando el 41% del total de la muestra los valores de la HbA1c en los límites recomendados21 . En España en 2013, Orozco-Beltrán et al. encontraron una prevalencia de hipoglucemia (eventos de salud no graves) informada por pacientes con diabetes tipo 2 del 39% 22 . Edidge et al. (2015) en un metanálisis encontraron una prevalencia del 33% (IC 95% 24% - 42%) de hipoglucemia en los paciente tratados con terapia con sulfonilureas23
En relación con el IMC, en nuestro estudio encontramos una mayor prevalencia de obesidad (51,4%) en los pacientes que informaron al menos un episodio de hipoglucemia frente a los que no notificaron hipoglucemia. Sin embargo, no encontramos diferencias estadísticamente significativas al agrupar las categorías en “sobrepeso + obesidad” y “peso saludable”. En el estudio de Álvarez-Guisasola (2008) no encontraron diferencias en el peso entre los pacientes que informaron un episodio de hipoglucemia y los que no lo informaron15 . Petterson et al. (2011) encontraron que los pacientes que no presentaban hipoglucemia o hipoglucemia leve tenían un IMC de 28.8 ± 4.4 frente a 28.5 ± 4.1 en pacientes con hipoglucemia moderada o peor 19 . Nunes et al. (2017) en un estudio realizado en 143 635 pacientes con diabetes tipo 2 que usaron sulfonilureas, el IMC promedio de la muestra total fue de 32.3 kg/m2. En pacientes con algún evento de
LOS OBJETIVOS DEL ESTUDIO FUERON, PRIMERO, EVALUAR LA PREVALENCIA DE HIPOGLUCEMIA EN PACIENTES CON DIABETES MELLITUS TIPO 2 QUE TOMAN SULFONILUREAS EN PUERTO RICO; SEGUNDO, EVALUAR LA PREVALENCIA DE PACIENTES CON DIABETES MELLITUS TIPO 2 EN PUERTO RICO QUE NO ESTÁN EN EL OBJETIVO DE HBA1C DE <7 %; Y TERCERO, EVALUAR EL AUTOCUIDADO, LA CALIDAD DE VIDA Y LA ADHERENCIA GENERAL AL TRATAMIENTO.
hipoglucemia, el IMC fue de 31,7 kg/m2 y en aquellos que no presentaron hipoglucemia, de 32,4 kg/m2. En nuestra muestra fue de 30kg/m2, 31.3 kg/m2 y 29 kg/m2 para el total de participantes, pacientes que informaron hipoglucemia y los que no respectivamente24 . Majanovic et al. (2017) encontraron que un 28,2% informó un aumento de peso en el último año, en nuestro estudio el 23,1% notificó lo mismo 17
Petterson et al. (2011) encontraron una puntuación del índice EQ-5D no ponderada para toda la muestra de 0.81 ± 0.22 similar a la encontrada por nosotros que fue de 0.82 ± 0.17. En ese estudio agruparon a los pacientes que no habían notificado hipoglucemia con los que informaron hipoglucemia leve. Ambos grupos de pacientes fueron comparados con aquellos que habían notificado una hipoglucemia moderada o peor. La puntuación del índice EQ-5D fue de 0.83 ± 0.21 y 0.75 ± 0.26 respectivamente 19 . Rombopoulos et al. encontraron que los pacientes que informaron un episodio de hipoglucemia tenían una peor calidad de vida que aquellos que no presentaron ningún evento de hipoglucemia21 . Zhang et al. (2010) en su revisión sistemática de la carga de hipoglucemia en pacientes con diabetes tipo 2 encontraron que los pacientes que presentaron algún evento de hipoglu-
cemia tenían valores de calidad de vida (EQ-5D) más bajos que aquellos que no presentaron ningún evento. También encontraron valores más bajos al evaluar el puntaje de la Escala Visual Analógica25 . Marrett et al. (2009) en un estudio basado en Internet y con una muestra de 1984 pacientes con DM2 en tratamiento con agentes antihiperglucemiantes orales encontraron que los pacientes con hipoglucemia informaron una peor puntuación del índice EQ-5D que aquellos que no la presentaron (0,78 frente a 0,86) 26 . En nuestro estudio, los valores del índice EQ-5D fueron de 0.85 ± 0.14 y 0.77 ± 0.21 para los pacientes que no informaron hipoglucemia y para aquellos que la notificaron. Respectivamente, otros autores encontraron valores similares a estos; a su vez, las puntuaciones de la Escala Visual Analógica fueron más bajas para los pacientes con hipoglucemia que para los que no la informaron20

Aproximadamente el 25% de las hospitalizaciones en pacientes de edad avanzada se deben a hipoglucemia 27. Zhang et al. (2010) encontraron un mayor costo médico y una mayor pérdida de días de trabajo. López et al. (2015) encontraron que en 367 602 pacientes con diabetes tipo 2, beneficiarios de Medicare, el 2,9% de los blancos solicitaron servicios de salud relacionados con eventos de hipoglucemia en comparación con el 3,6% de los hispanos y el 4,7% de los negros, lo que podría generar inequidad en la salud 25,28 . Estos datos refuerzan la importancia de realizar estudios como el que hemos presentado.
Las generalizaciones del presente estudio pueden estar limitadas por las características del tipo de diseño, incluso cuando se trata de un estudio del mundo real. El estudio fue exploratorio con un diseño transversal. La falta de información en Puerto Rico relacionada con los eventos de hipoglucemia en pacientes con diabetes tipo 2 justifica este tipo de estudio con el fin de encontrar respuestas y desarrollar nuevas preguntas que puedan guiar nuevos estudios. Al ser un estudio transversal, no nos permite temporalizar la información obtenida. No podemos establecer la relación causa-efecto, por ejemplo, en nuestro
Revista Puertorriqueña de Medicina y Salud Pública 27 Revista Puertorriqueña de Medicina y Salud Pública 23
estudio, los pacientes que presentaron hipoglucemia tenían un IMC más alto que aquellos que no, mientras que en la literatura encontramos resultados opuestos. Por otro lado, una mayor proporción de pacientes con hipoglucemia informaron haber perdido peso, podríamos plantearnos la siguiente pregunta: ¿los pacientes con hipoglucemia tienen un IMC similar a los que no tienen hipoglucemia y antes de un episodio de hipoglucemia presentan una disminución de peso? Otro tipo de sesgo que podemos encontrar es el de recuerdo. Incluso teniendo en cuenta estas limitaciones, el estudio es de gran importancia porque es el primero de este tipo que se lleva a cabo en Puerto Rico en un entorno del mundo real y proporciona información muy útil para pacientes y médicos. Por ejemplo, encontramos valores altos de triglicéridos y niveles bajos de HDL en pacientes con hipoglucemia que fueron estadísticamente significativos y valores más altos en colesterol, LDL, presión sistólica y diastólica, creatinina y HbA1c también en estos pacientes, con diferencias no estadísticamente significativas.
REFERENCIAS
1. IDF Diabetes Atlas 6th Edition. (n.d.). Country Estimates Table 2013. Retrieved from htpp://www. idf.org/atlasmap/atlasmap
2. Centers for Disease Control and Prevention, CDC. (2019). BRFSS Prevalence & Trends Data [online]. Retrieved Sept. 23, 2019, from https://www.cdc.gov/ brfss/brfssprevalence/
3. Sánchez-Hernández, E., Morales-González, J. J., Machín-Rivera, S., & Torres-Concepción, K. (2015, Septiembre). Informe de Salud de Puerto Rico 2015. Resumen General de la Salud en Puerto Rico. San Juan, Puerto Rico: Departamento de Salud de Puerto Rico
4. Departamento de Salud (2019). Informe Annual de Estadísticas Vitales: Defunciones, años 2015 y 2016.
5. Groenveld, Y., Petri, H., & Hermans, J. (1999). Relationship between blood glucose level and mortality in type 2 diabetes mellitus: a systematic review. Diabetes Med, 16, 2-13.
6. Gilet, H., Gruenberg, J., Bader, G., & Viala-Danten, M. (2012). Demonstrating the burden of hypoglycemia on Patients’ Quality of life in Diabetes Clinical Trials: Measurement Considerations for Hypoglycemia. Value in Health , 15, 1036-1041. doi:http:// dx.doi.org/10.1016/j.jval.2012.06.002
7. Real, J., & Carmena, R. (2004). La diabetes tipo 2 o la enfermedad incomprendida. Revista Clínica Española(1), 1-2.
8. American Diabetes Association. (2015). Hypoglycemia (Low Blood Sugar). Retrieved from http://www.diabetes.org/living-with-diabetes/ treatment-and-care/blood-glucose-control/ hypoglycemia-low-blood.html
9. Morales, J., & Schneider, D. (2014). Hypoglycemia. The American Journal of Medicine, 127(S17-S24). doi:http://dx.doi.org/10.1016/j.amjmed.2014.07.004
CONCLUSIONES
Como resumen final, podemos decir que la prevalencia de hipoglucemia en pacientes con diabetes mellitus tipo 2 tratados con sulfonilureas en Puerto Rico es similar a la encontrada en la literatura. Los pacientes que informaron un episodio de hipoglucemia tuvieron más limitaciones en la movilidad, más dolor y ansiedad/depresión, lo que evidencia una puntuación más baja de índice calidad de vida. Por último, un gran número de pacientes no tenía la HbA1c controlada.
10. US Department of Health and Human Services, N. N. (2008, October). Hypoglycemia. Retrieved from www.diabetes.niddk.nih.gov

11. The Action to Control Cardiovascular Risk in Diabetes Study Group. Effects of Intensive Glucose Lowering in Type 2 Diabetes. Vol 358; 2008:2545-2559.
12. Duckworth W, Abraira C, Moritz T, et al. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med. Jan 8 2009;360(2):129-139.
13. Patel A, MacMahon S, Chalmers J, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med. Jun 12 2008;358(24):2560-2572.
1 4. Garber AJ, Abrahamson MJ, Barzilay JI, et al. AACE Comprehensive Diabetes Management, Endocr Pract. 2013;19(Suppl 2):1-38
15. Alvarez Guisasola F, Tofe Povedano S, Krishnarajah G, Lyu R, Mavros P, Yin D. Hypoglycaemic symptoms, treatment satisfaction, adherence and their associations with glycaemic goal in patients with type 2 diabetes mellitus: findings from the
Real-Life Effectiveness and Care Patterns of Diabetes Management (RECAP-DM) Study. Diabetes Obes Metab. Jun 2008;10 Suppl 1:25-32.
16.Chan, S. P., Ji, L. N., Nitiyanant, W., Baik, S. H., & Sheu, W. H. H. (2010). Hypoglycemic symptoms in patients with type 2 diabetes in Asia-Pacific-Real-life effectiveness and care patterns of diabetes management: The RECAP-DM study. Diabetes Research and Clinical Practice,89(2). DOI:10.1016/j.diabres.2010.05.008
17.Majanovic SK . Janez A . Lefterov I . Tasic S . Cikac T. The Real-Life Effectiveness and Care Patterns of Diabetes Management Study for Balkan Region (Slovenia, Croatia, Serbia, Bulgaria): A Multicenter, Observational, Cross-Sectional Study. Diabetes Ther (2017) 8:929–940. DOI 10.1007/s13300-017-0288-x
18.Gonzalez C, et al. Prevalence of hypoglycemia among a sample of sulfonylurea-treated patients with Type 2 diabetes mellitus in Argentina: The real-life effectiveness and care patterns of diabetes management (RECAP-DM) study. Endocrinol Diabetes Nutr. 2018. https:// doi.org/10.1016/j.endinu.2018.05.014
19.Pettersson B, Rosenqvist U, Deleskog A, Journath G, Wändell P.Self-reported experience of hypoglycemia among adults with type 2 diabetes mellitus (Exhype). Diabetes research and clinical practice, 92 (2011): 19-25.
20.Lundkvist J, Berne C, ·Bolinder B, ·Jönsson L. The economic and quality of life impact of hypoglycemia. Eur J Health Econom 2005 · 50:197–202 DOI 10.1007/s10198-005-0276-3
21.Rombopoulos G, Hatzikou M, Latsou D, Yfantopoulos J.The prevalence of hypoglycemia and its impact on the quality of life (QoL) of type 2 diabetes mellitus patients (The HYPO Study). HORMONES 2013, 12(4):550-558
22.Orozco-Beltrán D,Mezquita-Raya P, Ramírez de Arellano A, Galán M. Self-Reported Frequency and Impact of Hypoglycemic Events in Spain. Diabetes Ther (2014) 5:155–168. DOI 10.1007/ s13300-014-0057-z
23.Edridge CL, Dunkley AJ, Bodicoat DH, Rose TC, Gray LJ, Davies MJ, et al. (2015) Prevalence and Incidence of Hypoglycaemia in 532,542 People with Type 2 Diabetes on Oral Therapies and Insulin: A Systematic Review and Meta-Analysis of Population Based Studies. PLoS ONE 10(6): e0126427. doi:10.1371/journal. pone.0126427
24.Nunes AP, Iglay K, Radican L, Engel SS, Yang J, Doherty MC, Dore DD. Hypoglycaemia seriousness and weight gain as determinants of cardiovascular disease outcomes among sulfonylurea users. Diabetes Obes Metab. 2017;1–11
25.Zhang Y, Wieffer H, Modha R, Balar B, Pollack M, Krishnarajah G.The Burden of Hypoglycemia in Type 2 Diabetes: A Systematic Review of Patient and Economic Perspectives. JCOM (2010); 17 (12):547-557
26.Marrett E1, Stargardt T, Mavros P, Alexander CM. Patient-reported outcomes in a survey of patients treated with oral antihyperglycaemic medications: associations with hypoglycaemia and weight gain. Diabetes Obes Metab. 2009 Dec;11(12):1138-44. doi: 10.1111/j.14631326.2009.01123.x. Epub 2009 Sep 16.
27. Ahrén B. Avoiding hypoglycemia: a key to success for glucose-lowering therapy in type 2 diabetes. Vascular Health and Risk Management 2013:9 155–163
* Diferencia estadísticamente significativa (p<0.05)
28.Lopez JM1, Bailey RA1, Rupnow MF. Demographic Disparities Among Medicare Beneficiaries with Type 2 Diabetes Mellitus in 2011: Diabetes Prevalence, Comorbidities, and Hypoglycemia Events. Popul Health Manag. 2015 Aug;18(4):283-9. doi: 10.1089/pop.2014.0115. Epub 2015 Feb 3.
28 Revista Puertorriqueña de Medicina y Salud Pública Revista Puertorriqueña de Medicina y Salud Pública 24
Dimensiones EQ Todos No hipoglucémico Hipoglucémico Valor P OR (95% IC) Movilidad limitada 83 (49 4%) 41 (26 8%) 42 (50 6%) < 0 05 1 793 (1 057, 3 042) Autocuidado limitado 25 (9 7%) 14 (9 3%) 11 (10 3%) 0 787 ns Actividades habituales limitadas 66 (25 0%) 33 (21 7%) 33 (30 8%) 0 097 1 608 (0 916,2 824) Más dolor/incomodidad 145 (56 0%) 75 (49 3%) 70 (65 4%) < 0 05 1 942 (1 167,3 234) Más ansiedad/depresión 88 (34%) 40 (26 1%) 48 (45 3%) <0 01 2 338 (1 382,3 995)
Tabla 6. Dimensiones EQ
C M Y CM MY CY CMY K








574BMC-030 Revista Medicina y Salud.ai 1 10/15/19 5:34 PM
Información importante de seguridad de SOLIQUA® 100/33 (insulina glargina y lixisenatida) inyección de 100 Unidades/mL y 33 mcg/mL
¿Cuál es la información más importante que debo conocer acerca de SOLIQUA 100/33?
No comparta su pluma de SOLIQUA 100/33 con otras personas, aunque se haya cambiado la aguja. Puede contagiar a otras personas con una infección grave o adquirir una infección grave de estas.
SOLIQUA 100/33 puede causar efectos secundarios graves, incluida inflamación del páncreas, que puede ser severa y causar la muerte.
Antes de usar SOLIQUA 100/33, déjele saber a su médico si ha tenido pancreatitis, piedras en la vesícula biliar (colelitiasis) o antecedentes de alcoholismo. Estos problemas médicos pueden hacerlo más propenso a tener pancreatitis.
Deje de usar SOLIQUA 100/33 y llame a su profesional del cuidado de la salud de inmediato si tiene dolor en el área del estómago (abdomen) que es severo y no desaparece. El dolor puede sentirse en el área de la espalda. El dolor puede ocurrir con o sin vómitos.
¿Quién no debe usar SOLIQUA 100/33? No use SOLIQUA 100/33 si:
• está teniendo un episodio de azúcar bajo en la sangre (hipoglucemia).
• es alérgico a la insulina glargina, lixisenatida o a alguno de los ingredientes en SOLIQUA 100/33. Los síntomas de una reacción alérgica severa con SOLIQUA 100/33 pueden incluir hinchazón de la cara, los labios, la lengua o la garganta, desmayo o sentirse mareado, problemas para respirar o tragar, latidos del corazón muy rápidos, erupción o picor severos o presión arterial baja.
Antes de usar SOLIQUA 100/33, déjele saber a su profesional del cuidado de la salud acerca de todas sus condiciones médicas, incluido si usted:
• tiene o ha tenido problemas del páncreas, riñones o hígado, piedras en la vesícula biliar o antecedentes de alcoholismo.
• tiene insuficiencia cardiaca u otros problemas cardiacos. Si tiene insuficiencia cardiaca, esta puede empeorar cuando usa tiazolidinedionas (TZD).
• tiene problemas severos del estómago, como vaciado lento del estómago o problemas para digerir la comida.
• usa ciertos medicamentos conocidos como agonistas del receptor del péptido 1 similar al glucagón (agonistas del receptor GLP-1).
• ha tenido una reacción alérgica a un agonista del receptor GLP-1.
• está embarazada o lactando o tiene planes de quedar embarazada o lactar. No se conoce si SOLIQUA 100/33 puede causarle daño al feto o pasa a la leche materna.
Déjele saber a su profesional del cuidado de la salud acerca de todos los medicamentos que usa, incluidos los recetados y los que no requieren receta, vitaminas y suplementos herbarios. SOLIQUA 100/33 puede afectar la manera en que algunos medicamentos funcionan. Antes de usar SOLIQUA 100/33, hable con su profesional del cuidado de la salud acerca del azúcar bajo en la sangre y cómo manejarlo.
¿Cómo debo usar SOLIQUA 100/33?
• No haga cambios en la dosis sin primero hablar con su profesional del cuidado de la salud.
• Verifique la etiqueta de la pluma cada vez que se inyecte para asegurarse que está usando el medicamento correcto.
• No use más de 60 unidades de SOLIQUA 100/33 al día. No use SOLIQUA 100/33 junto con otros agonistas del receptor GLP-1.
• Solo use SOLIQUA 100/33 si se ve transparente e incoloro a casi incoloro. Si ve partículas pequeñas, devuélvalo a la farmacia para un reemplazo.
• Cambie (rote) el lugar de la inyección dentro del área que escoja con cada dosis para reducir el riesgo de tener hoyuelos o engrosamiento de la piel (lipodistrofia) o bultos en la piel (amiloidosis cutánea localizada) en los lugares de inyección. No use el mismo lugar para cada inyección ni inyecte en la piel donde haya hoyuelos, engrosamiento, bultos, dolor, hematomas, escamas, endurecimiento, cicatrices o lesión.
• No saque SOLIQUA 100/33 de la pluma con una jeringuilla.
• No reuse ni comparta las agujas con otras personas. Puede contagiar a otras personas con una infección grave o adquirir una infección grave de estas.
• Verifique sus niveles de azúcar en la sangre. Pregúntele a su profesional del cuidado de la salud cuál debe ser su nivel de azúcar en la sangre y cuándo lo debe verificar.
¿Cuáles son los posibles efectos secundarios de SOLIQUA 100/33?
SOLIQUA 100/33 puede causar efectos secundarios graves, incluido:
• Vea “¿Cuál es la información más importante que debo conocer acerca de SOLIQUA 100/33?”
• Reacciones alérgicas graves. Pueden ocurrir reacciones alérgicas graves con SOLIQUA 100/33. Deje de usar SOLIQUA 100/33 y busque ayuda médica de inmediato si tiene algún síntoma de una reacción alérgica grave. Vea “¿Quién no debe usar SOLIQUA 100/33?”
• Azúcar bajo en la sangre (hipoglucemia). El riesgo de tener azúcar bajo en la sangre es más alto si usa otro medicamento que puede causar azúcar bajo en la sangre. Los signos y síntomas de azúcar bajo en la sangre pueden incluir:
º dolor de cabeza
º somnolencia
º debilidad
º hambre
º latidos del corazón rápidos
º confusión
º mareo
º sudoración
º irritabilidad
º visión borrosa
º sensación de intranquilidad
º ansiedad
• Problemas renales (insuficiencia renal). En personas que padecen de problemas renales, el surgimiento de diarreas, náuseas y vómitos puede causar pérdida de líquidos (deshidratación), lo que puede provocar el empeoramiento de los problemas renales.
• Potasio bajo en la sangre (hipopotasemia).
• Insuficiencia cardiaca. Tomar píldoras específicas para la diabetes, conocidas como tiazolidinedionas (TZD), junto con SOLIQUA 100/33 puede causar insuficiencia cardiaca en algunas personas. Esto puede ocurrir aun cuando nunca haya padecido de insuficiencia cardiaca o problemas cardiacos. Si actualmente padece de insuficiencia cardiaca, esta puede empeorarse mientras toma TZD con SOLIQUA 100/33. Su profesional de la salud debe brindarle seguimiento minucioso mientras toma TZD con SOLIQUA 100/33. Déjele saber a su profesional de la salud si presenta síntomas nuevos o empeoramiento de los síntomas de insuficiencia cardiaca, entre ellos, falta de aliento, hinchazón de los tobillos o los pies o aumento de peso repentino. Puede ser necesario que su profesional de la salud tenga que ajustar o suspender el tratamiento con TZD y SOLIQUA 100/33 si presenta insuficiencia cardiaca de nuevo inicio o empeoramiento de esta.
• Problemas de la vesícula biliar. Han ocurrido problemas de la vesícula biliar en algunas personas que usan SOLIQUA 100/33. Infórmele a su profesional del cuidado de la salud de inmediato si presenta síntomas de problemas de la vesícula biliar, que pueden incluir:
º dolor en la parte superior del estómago (abdomen)
º fiebre
º color amarillento de la piel o los ojos (ictericia)
º heces color arcilla
Los efectos secundarios más comunes de SOLIQUA 100/33 incluyen:
• azúcar bajo en la sangre (hipoglucemia)
• náuseas
• congestión o gotereo nasal y dolor de garganta
• diarrea
• infección del tracto respiratorio superior
• dolor de cabeza
Las náuseas y las diarreas, por lo regular, ocurren más a menudo cuando comienza a usar SOLIQUA 100/33.
Estos no son todos los efectos secundarios posibles de SOLIQUA 100/33. Llame a su médico para recibir consejo médico acerca de los efectos secundarios. Puede notificar los efectos secundarios a la FDA al 1-800-FDA-1088.
sanofi-aventis U.S. LLC | Bridgewater, NJ 08807 UNA COMPAÑÍA SANOFI
© 2022 sanofi-aventis U.S. LLC. Derechos reservados. MAT-US-2204111-v1.0-08/2022

32 Revista Puertorriqueña de Medicina y Salud Pública


Revista Puertorriqueña de Medicina y Salud Pública 33
LA DIABETES MELLITUS TIPO 2 EN PUERTO RICO: ¿PODREMOS CAMBIAR EL PANORAMA?
La diabetes mellitus es una condición crónica en la cual nuestro cuerpo no puede manejar adecuadamente la glucosa (azúcar) de nuestros alimentos. Los dos principales tipos de diabetes mellitus son la diabetes mellitus tipo 1 y la diabetes mellitus tipo 2. La diabetes mellitus tipo 1 es una condición no prevenible donde por un ataque autoinmune al páncreas, este órgano deja de producir insulina. La diabetes mellitus tipo 2 es una condición que se puede prevenir y que ocurre por una serie de defectos en el manejo de glucosa del cuerpo, pero se caracteriza principalmente por la resistencia a la insulina. La insulina es la hormona o
mensajero que permite que la glucosa pueda entrar a nuestras células para ser utilizada como fuente de energía.
La diabetes mellitus es una condición común en la población puertorriqueña. Un estudio reciente estimó que un 20% de la población puertorriqueña vive con diabetes mellitus. De esta cantidad aproximadamente el 90% vive con diabetes mellitus tipo 2. Sin embargo, hemos visto que la prevalencia de esta condición no se ha reducido en los pasados años a pesar de que modificaciones en el estilo de vida pueden ayudar a prevenir o retrasar la aparición de esta condición.

Hay dos aspectos fundamentales que hacen de vital importancia la prevención de la diabetes mellitus tipo 2: el costo humano y el costo a nivel económico.
Para hablar del costo humano tenemos que hablar de las complicaciones relacionadas a la diabetes mellitus a corto y largo plazo.
Los niveles elevados de glucosa a corto plazo pueden producir síntomas

34 Revista Puertorriqueña de Medicina y Salud Pública
¿Y POR QUÉ ES TAN IMPORTANTE LA PREVENCIÓN DE LA DIABETES MELLITUS TIPO 2?
sumamente molestos como visión borrosa, mareos, cansancio, frecuencia urinaria, dificulta la sanación de heridas y aumenta el riesgo de ciertas infecciones. En casos extremos la diabetes tipo 2 puede producir una condición seria llamada coma hiperosmolar que ocurre por niveles muy altos de glucosa y que puede poner en peligro nuestra vida: esta produce alteración del estado de consciencia y deshidratación severa.
Las complicaciones a largo plazo se dividen en las complicaciones microvasculares (de vasos pequeños) y las complicaciones macrovasculares (de vasos grandes):
Las complicaciones de vasos pequeños incluyen:
• Neuropatía diabética: Ocurre por daño a los nervios y suele producir dolor y sensación de alfilerazos en las extremidades, particularmente las inferiores. Eventualmente puede causar que perdamos capacidades sensoriales como la capacidad de sentir calor o dolor aumentando así el riesgo de sufrir lesiones que no se detectan a tiempo y que pueden convertirse en un foco de infección.
• Retinopatía diabética: Es el daño que ocurre en los vasos sanguíneos de la retina que es la parte del ojo que recibe las imágenes y las envía hacia el cerebro.
• Nefropatía diabética: Esta se refiere los cambios que ocurren en nuestros riñones como resultado de la diabetes.
Leticia Hernández Dávila, MD FACE

Endocrinology, Diabetes and Metabolism

Presidenta Sociedad Puertorriqueña de Endocrinología y Diabetología
Se ha comprobado que mantener un buen control de la diabetes mellitus desde sus etapas tempranas reduce la probabilidad de tener complicaciones microvasculares.
Las complicaciones macrovasculares incluyen:
• Los infartos al corazón.
• Las apoplejías (derrames cerebrales)
• Enfermedad periferovascular (complicaciones de la circulación)
Tanto las complicaciones microvasculares como macrovasculares de la diabetes mellitus tienen un alto costo a nivel humano al afectar negativamente la calidad de vida y la productividad de quienes viven con esta condición. A esto se une el costo económico personal que tiene el manejo de la diabetes mellitus y sus complicaciones.
Sin embargo, a nivel de sociedad la diabetes mellitus también tiene un impacto enorme:
La diabetes mellitus y sus complicaciones son la tercera causa de muerte en nuestra Isla.
La diabetes mellitus contribuye al desarrollo de las enfermedades del corazón que son la segunda causa de muerte en la Isla.
La diabetes mellitus es una de las primeras causas de hospitalización y re-hospitalización a nivel de Estados Unidos.
En los Estados Unidos $1 de cada $4 dirigidos al cuidado de la salud se utiliza para el manejo de la diabetes mellitus.
Siendo la diabetes mellitus tipo 2 la causa de aproximadamente el 90% de los casos de diabetes mellitus deberíamos realizar más esfuerzos nivel de país dirigidos a la prevención. Entre los factores de riesgo modificables asociados a esta condición se encuentran los estilos de alimentación, sedentarismo, y el sobrepeso. Sin embargo, al momento no tenemos estrategias sólidas a nivel educativo dirigidas fomentar la sana alimentación desde las etapas tempranas de la vida. Necesitamos más espacios seguros que nos permitan mejorar nuestro nivel de actividad física. La mayoría de las aseguradoras no cubren servicios de nutricionista con propósitos de prevención de condiciones como la diabetes mellitus tipo 2, prediabetes u obesidad. Estos servicios son cubiertos por los seguros médicos cuando ya se ha desarrollado diabetes mellitus. Tampoco existe acceso a los medicamentos aprobados por la administración de drogas y alimentos para el tratamiento de la obesidad a largo plazo.
Si deseamos crear un verdadero impacto en la prevalencia de la diabetes mellitus tipo 2 y sus complicaciones, necesitamos replantearnos nuestras estrategias a nivel gubernamental, aseguradoras, entidades sin fines de lucro, e individuos de manera que podamos reducir el costo humano y el impacto económico individual y a nivel de país que esta condición acarrea.
Revista Puertorriqueña de Medicina y Salud Pública 35
PERFIL DE SALUD DE UNA MUESTRA DE
MUJERES DIAGNOSTICADAS CON EL VIRUS DEL PAPILOMA HUMANO EN PUERTO RICO: UN ESTUDIO EXPLORATORIO
RESUMEN
Objetivo: El propósito de este estudio fue estudiar el perfil de salud de mujeres diagnosticadas con el Virus del Papiloma Humano (VPH), explorar el acceso a los servicios de psicología de la salud, y describir el rol del psicólogo de la salud en mujeres con VPH.
Método: Se utilizó un diseño no experimental transversal exploratoriodescriptivo. La muestra fue de 165 mujeres con una edad media de 34 años. Se recopiló información sobre autoestima, sintomatología depresiva, sintomatología de ansiedad, calidad
de vida, conocimiento sobre el VPH, y estigma relacionado al VPH. Los datos fueron recopilados en línea. Resultados: Se encontró que un 76% de las participantes presentaron síntomas de ansiedad y un 62.3 % síntomas de depresión. Las personas que indicaron que no recibieron una explicación adecuada su diagnóstico reportaron más sintomatología de ansiedad y estigma, y una menor autoestima y calidad de vida psicológica que las sí recibieron una explicación adecuada.
Conclusiones: A través de este

Palabras Clave: Virus del Papiloma Humano, ansiedad, depresión, salud mental, cuidado colaborativo, psicología de la salud.
estudio se pudo concluir que el diagnóstico de VPH tuvo un impacto emocional en las participantes. Se observó que el tener un espacio en donde se les pueda explicar el diagnóstico de VPH y aclarar inquietudes y dudas ayuda a disminuir el malestar emocional. Además, se pudo evidenciar que existe una necesidad de incorporar un cuidado colaborativo entre la salud mental y los centros ginecológicos, hospitales, clínicas, y centros de salud para atender a la población con este diagnóstico y evitar que lleguen a tener un impacto emocional severo.

36 Revista Puertorriqueña de Medicina y Salud Pública
Anivel mundial y en Puerto Rico la infección de transmisión sexual más común es el Virus del Papiloma Humano (VPH). Esta infección tiene más de 100 cepas, las cuales se dividen entre bajo y alto riesgo. Las cepas de bajo riesgo usualmente se presentan en verrugas genitales. Las de alto riesgo, por lo general, no presenta sintomatología y son las de mayor riesgo de convertirse en cáncer. Las personas al ser diagnosticas con VPH experimentan diversas emociones, entre ellas angustia, tristeza, y culpabilidad lo que puede generar un estigma
B. Rodríguez Rivera1, Marcos Reyes1, Karen Malaret1 1Universidad Albizu
Notas de Autor

Cristina B. Rodríguez Rivera https://orcid.org/0000-0002-2841-8164
Marcos Reyes https://orcird.org/0000-0002-1401-4708
Karen Malaret https://orcird.org/0000-0003-0092-3174
No hay conflictos de interés en el desarrollo de esta investigación. Los autores no tienen ningún conflicto de interés que revelar. Toda correspondencia relacionada a esta investigación debe ir dirigida a cristinabrr20@gmail.com
internalizado. De igual manera, experimentan otros tipos de desafíos como pensar que su pareja le fue infiel, tener miedo de comunicárselo a su pareja, lucha interna con su aspecto religioso y espiritual entre otras.
La mayoría de estas mujeres no aparentan tener servicios de salud dirigidos a atender la sintomatología que presentan una vez son diagnosticadas con este virus. En Latinoamérica y Estados Unidos hay bastante evidencia de esta sintomatología presente en mujeres diagnosticadas con VPH.
No obstante, no se ha encontrado literatura en Puerto Rico que estudie los síntomas emocionales que presentan las mujeres al ser diagnosticas con este virus. Por tal razón, esta investigación estudió el perfil de salud de mujeres diagnosticadas con VPH, al igual que se exploró el acceso a servicios de psicología de la salud desde que fueron diagnosticadas con el virus. De igual forma, esta investigación tuvo como propósito describir el rol del psicólogo de la salud en mujeres con VPH.
Virus del Papiloma Humano
El VPH es una infección de transmisión sexual de la cual existen más de 100 tipos, de los que aproximadamente 13 son oncogénicos o también llamados de alto riesgo. Esta infección es la causa principal de cáncer de cuello uterino en las mujeres. Se ha encontrado que los tipos 16 y 18 son los causantes de la mayoría de este tipo de cánceres. No obstante, el VPH se ha asociado también a cánceres de ano, vulva, vagina, pene y orofaríngeos.
Se estima que aproximadamente el 80% de las personas están en riego de desarrollar este virus alguna vez en su vida, sin embargo, en la mayoría de los casos el cuerpo lo combatirá. Entre el 2010-2014, el cáncer de cuello uterino fue el cuarto cáncer más diagnosticado entre las mujeres en Puerto Rico. Al igual, representó el 7.9% de todos los casos de cáncer en mujeres puertorriqueñas y 4.4% de todas las muertes por cáncer. En promedio, 577
mujeres son diagnosticadas anualmente y 103 mujeres mueren cada año por este cáncer en Puerto Rico.
En la mayoría de los casos el VPH desaparece por sí solo del sistema y no causa ningún problema de salud. Sin embargo, cuando el VPH no desaparece puede causar problemas de salud como lo son verrugas genitales o cáncer. Por lo general, las verrugas aparecen como pequeños bultos o grupos de bultos en la zona genital.
Esta patología, como muchas no solo afecta el componente biológico del paciente sino también el componente psicológico y social. Se ha encontrado que el VPH tiene implicaciones en la vida cotidiana de las mujeres infectadas con sentimientos de decepción, preocupación por su salud, miedo a tener relaciones sexuales y percepción de que la infección sea el punto de inicio de un cáncer. El impacto emocional
causado por el diagnóstico puede ser más dañino que los problemas físicos por reacciones emocionales como enojo, depresión, aislamiento, miedo, rechazo, vergüenza y culpa.
En un estudio cualitativo realizado en México encontró que las mujeres viven la experiencia del diagnóstico como un estigma, por lo que toman estrategias protectoras para evitar ser estigmatizadas por la sociedad. El sentir vergüenza y culpa por tener un diagnóstico de VPH tiene repercusiones en poder crear redes de apoyo o compartir la información con los demás. En el área médica el estigma es un elemento invisibilizado el cual muchas veces el personal de salud no atiende todas las preocupaciones que la paciente puede experimentar al ser diagnosticada con VPH. La falta de información y de educación influye para que las pacientes refuercen sus temores frente a este diagnóstico.
Revista Puertorriqueña de Medicina y Salud Pública 37
Cristina
Trasfondo Teórico
El modelo biopsicosocial es un modelo que parte de la integración de los factores biológicos, psicológicos, socioculturales y espirituales. En la integración de estos se pueden mejorar los resultados clínicos, ya que se tiene en cuenta todas las dimensiones y también facilita la relación entre el proveedor de salud y el paciente11. Uno de los factores que se beneficia con este modelo es la “multimorbilidad”, lo cual se refiere a la presencia conjunta de múltiples condiciones de salud física y mental. Este es un problema de salud pública cada vez mayor ya que una gran parte de la población vive con múltiples condiciones de salud concurrentes. El psicólogo de la salud puede insertarse y trabajar en el impacto de las condiciones físicas en la salud mental y viceversa, al igual que trabajarlas de manera integrada. Las tres principales áreas en las que los
Preguntas de Investigación
En esta investigación nos formulamos las siguientes tres preguntas: ¿Cuál es el perfil de salud mental de una muestra de personas diagnosticadas con el VPH en Puerto Rico?, ¿La muestra de mujeres puertorriqueñas diagnosticadas con el VPH tuvo acceso a servicios de psicología de la salud al ser diagnosticadas o durante el proceso?, y ¿Qué rol tiene el psicólogo de la salud cuando una mujer es diagnosticada con el VPH?
Justificación

Se ha enfatizado mucho en las repercusiones en el área de salud física, en múltiples estrategias y campañas de prevención en relación de este virus a nivel mundial y en Puerto Rico. Sin embargo, un área que permanece invisibilizada en este diagnóstico es el área de salud mental y las experiencias que viven las mujeres puertorriqueñas que son diagnosticadas con VPH. Es importante que se puedan examinar las experiencias que vive una paciente cuando se diagnostica con VPH ya que es una de las enfermedades de transmisión sexual más común. En Puerto Rico la tasa de diagnóstico de cáncer cervical, enfermedad asociada a este virus es más alta que en los Estados Unidos16. Por lo que es un diagnóstico común y muchas veces permanece en silencio e invisibilizado,
psicólogos de la salud pueden contribuir a la comprensión y el tratamiento de la multimorbilidad son la etiología, la prevención y autogestión, y la atención clínica. Al igual se enfatiza en que se puede beneficiar la salud individual y de la población, desarrollando e implementando intervenciones efectivas para prevenir y manejar la multimorbilidad.
Hasta el momento no se ha encontrado evidencia en Puerto Rico que sustente que en las clínicas de ginecología se ofrezcan servicios de psicología de la salud, o que sean referidas a un psicólogo de la salud externo una vez son diagnosticadas con VPH. Por lo que al momento no se ha evidenciado que las mujeres puertorriqueñas tengan acceso a recibir servicios psicológicos una vez reciben un diagnóstico de VPH y en el proceso de la condición. Al igual
para ofrecerles herramientas en áreas como: comunicación del diagnóstico a su pareja, trabajar el estigma entre otros como se mencionan en diversos estudios.
El propósito principal de esta investigación es describir el perfil de salud de mujeres diagnosticadas con VPH en Puerto Rico. Al igual que explorar si estas mujeres tienen acceso a servicios psicológicos al ser diagnosticadas con VPH, esto debido a que la literatura latinoamericana resalta que la persona diagnosticada con VPH puede sufrir síntomas de ansiedad y depresión, estigma internalizado entre otros. Al presente no se ha encontrado investigaciones en Puerto Rico que estudien el perfil de salud de las mujeres puertorriqueñas diagnosticadas con VPH y si actualmente reciben servicios psicológicos.
en ocasiones por el aspecto sexual que involucra. Además, en culturas religiosas y donde el sexo permanece como un taboo, puede llevar a la paciente a callar su diagnóstico y no tener recursos de apoyo para evitar ser juzgada.
Método Muestra
Los criterios de inclusión para este estudio fueron los siguientes: ser una mujer puertorriqueña entre 21 a 65 años, y haber sido diagnosticada con el VPH en algún momento de su vida. Por otro lado, los criterios de exclusión fueron: presentar algún tipo de impedimento que le imposibilitara contestar los instrumentos de investigación, y que la participante no supiera leer o escribir.
Se reclutaron a 165 mujeres de las cuales 133 que completaron los cuestionarios en su totalidad. La edad de las participantes fluctuó entre 21 a 65 años (M = 34 años). La mayoría de las participantes reportaron estar casadas (36.4%) de religión católica (44.2%), con una preparación académica de maestría (37.0%). Además, la mayoría reportó haber sido diagnosticada con VPH hace más de dos años (66.1%). En cuanto a la salud física,
la condición principalmente reportada fue la hipertensión (15.2%). Respecto a la salud mental, la condición mayor reportada fue la ansiedad (19.4%), sin embargo, el 73.3% de la muestra indicó no tener ninguna condición de salud mental diagnosticada.
En relación con la forma en que se le comunicó el diagnóstico de VPH, la mayoría de las participantes indicaron que fue de forma adecuada (55.2%). De igual forma, la mayoría indicó que entiende que el profesional de la salud le aclaró sus dudas cuando le ofrecieron el diagnóstico (52.7%). Asimismo, gran parte de las participantes indicaron no haberse sentido juzgadas por el profesional de la salud cuando le comunicaron sobre su diagnóstico (82.9%). Por otro lado, la mayoría mencionó haber sentido miedo a ser juzgada por su pareja si le contaba sobre su diagnóstico de VPH (62.4%). De forma similar, las participantes indicaron que sintieron miedo a ser juzgadas al contarle a algún familiar o amigo sobre su diagnóstico de VPH (83.5%). Además, se observó que poco más de la mitad de las participantes indicaron que culparon a su pareja o expareja por su diagnóstico de VPH (67.9%). En la Tabla 1 se muestran los datos sociodemográficos de las participantes.
38 Revista Puertorriqueña de Medicina y Salud Pública

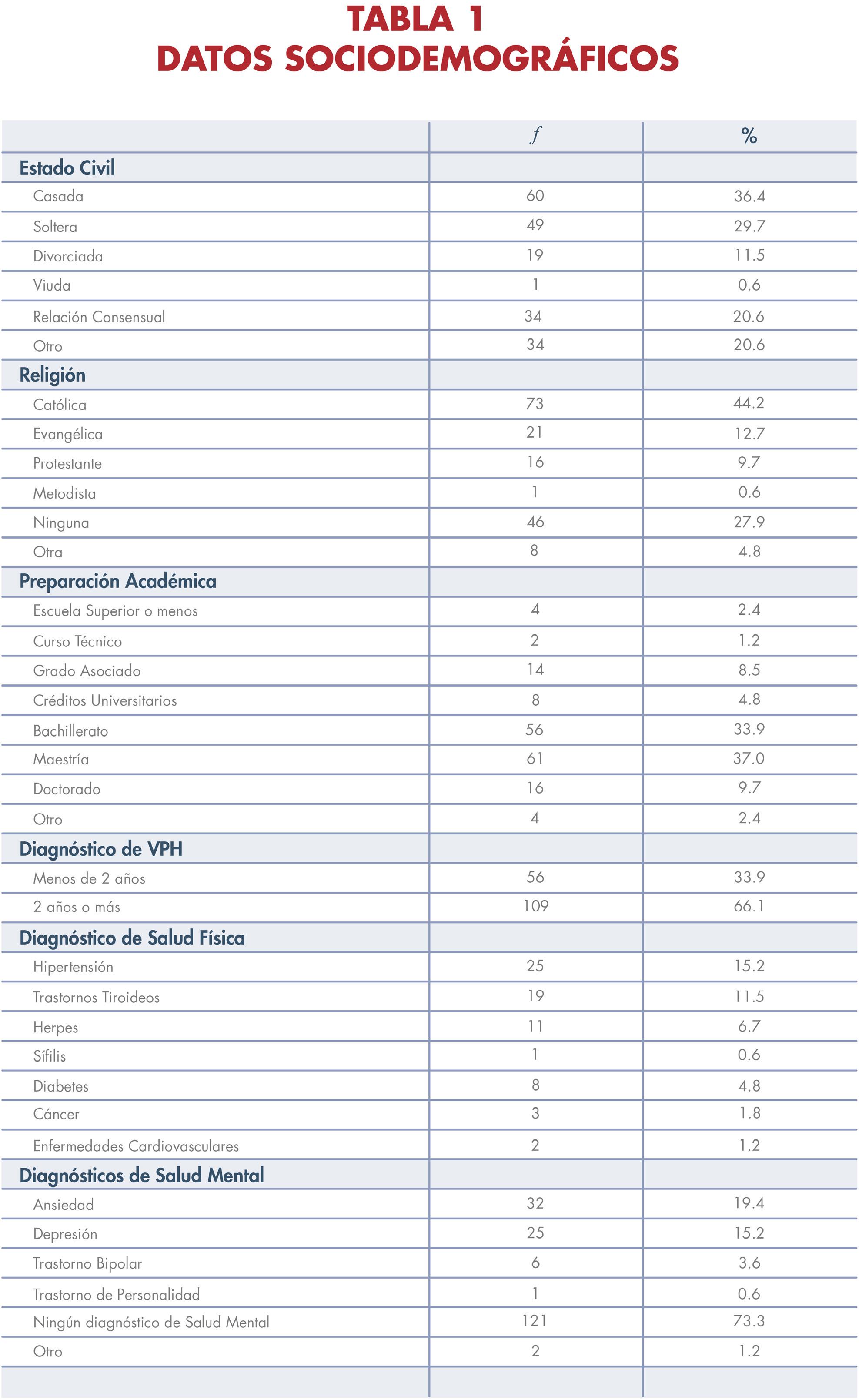
Revista Puertorriqueña de Medicina y Salud Pública 39
Instrumentos
En esta investigación se utilizaron ocho instrumentos: (1) consentimiento informado, (2) hoja de datos sociodemograficos, (3) escala de autoestima de Rosenberg, (4) patient health questionnarie - PHQ-819, (5) escala para el trastorno de ansiedad generalizada - GAD-720-21, (6) escala de calidad de vida - WHOQOL-BREF, (7) escala de conocimiento del VPH, y (8) escala de estigma VPH. Todos los instrumentos han sido utilizados anteriormente en investigaciones en Puerto Rico y han obtenido buenas propiedades psicométricas.
Diseño

Este estudio tuvo un diseño no experimental transversal exploratoriodescriptivo. Este diseño se utiliza para describir, analizar y observar las relaciones de variables en un momento dado.
Procedimientos
Este estudio fue aprobado por un Comité de Ética Institucional (IRB por sus siglas en inglés) de una universidad en Puerto Rico. Luego de la aprobación se procedió a subir los instrumentos en la plataforma de recopilación de datos SurveyMonkey. Se colocó un anuncio sobre el estudio en redes sociales (e.g. Facebook, Instagram). El anuncio tenía un enlace que dirigía al participante a la plataforma de SurveyMonkey. Lo primero que veían las participantes al entrar al enlace era el consentimiento informado en donde se le explicaban todos los detalles del estudio, así como sus derechos como participante. Una vez la participante aceptaba ser parte del estudio tenía acceso a los demás instrumentos de investigación, en caso contrario era redirigida a la sección de agradecimientos.
Los datos recopilados fueron analizados utilizando el programa estadístico IBM SPSS Statistics versión. Una vez se corroboraron los datos, se realizaron los análisis estadísticos. Se realizaron estadísticas descriptivas e inferenciales para explorar el perfil de salud de la muestra de mujeres diagnosticadas con VPH. Además, se analizó la consistencia interna de los instrumentos mediante el coeficiente alfa de Cronbach.
Resultados Acceso a Servicios Psicológicos
En relación con los servicios psicológicos, un 87.3% de la muestra mencionó no haber recibido ayuda de algún profesional de la conducta humana luego de su diagnóstico, un 3.0% indicó que sí y un 9.7% indicó que recibía ayuda desde antes. Sin embargo, un 74.5% mencionó que se hubiese beneficiado de poder trabajar el tema del VPH con un psicólogo especializado en el área de la salud. Un 35.2% informó que no recibió la ayuda psicológica, ya que no sabía que un psicólogo podía ayudarle en esto. Un 15.8% no recibió la ayuda psicológica, ya que tenía miedo de contarlo y ser juzgada. Un 26.7% mencionó que no la recibió, ya que entendía no le afectaba emocionalmente y un 6.7 % no la recibió por asuntos económicos. Además, en 60.0% de la muestra indicó que su salud emocional se vio afectada al recibir el diagnóstico de VPH o cambios asociados a este.
Recomendaciones Médicas y Adherencia al Tratamiento
En relación con las recomendaciones médicas y procedimientos un 90.9 % indicó que ha seguido fielmente las recomendaciones de su médico. Un 36.4% mencionó que no a encontrado tiempo o momento para realizarse la prueba, un 13.9% mencionó que en algún momento ha dejado de hacerse la prueba por asuntos económicos, y un 9.1% por miedo a salir positiva nuevamente.
VPH y Efectos Psicológicos
El 13.9% de la muestra mencionó que luego de ser diagnosticada sintió miedo a ser juzgada por su congregación religiosa, un 43.6 %
mencionó que no sintió miedo y un 42.4% indicó “no aplica”. Al presente, un 52.1 % de la población consideró el VPH o los cambios asociados a este, como por ejemplo la displasia cervical, como un estresor en su vida actual. En relación con los síntomas de ansiedad al momento de ser diagnosticadas un 36.4% reportó síntomas leves de ansiedad, un 39.6 % reportó tener síntomas entre moderados y severos de ansiedad y un 23.8% no reportaron síntomas de ansiedad. En este estudio el GAD-7 obtuvo una consistencia interna alta (a = 0.91).
Al evaluarse los resultados de la sintomatología de depresión un 37.9% no reportó síntomas de depresión al momento de ser diagnosticadas, un 32.7% reportó síntomas leves y un 29.6% reportó síntomas entre moderados y severos. El PHQ-8 obtuvo una consistencia interna alta en este estudio (a = 0.92).
Al evaluar la autoestima de las participantes se encontró que un 71.3% de la muestra tuvo una autoestima normal, un 14.7% una autoestima media, y un 14.0% una autoestima baja. Al evaluar la consistencia interna se observó una puntuación alta adecuada (a = 0.89).
En relación con el conocimiento del VPH, contestando incorrectamente, el 50.0% piensa que las verrugas genitales son causadas por el virus del herpes, el 45.0% considera que tener sexo antes de los 16 años no aumenta el riesgo de contraer el VPH y un 26.0% considera que los cambios en una prueba de Papanicolau no pueden ser un indicador de VPH. En la Tabla 2 se muestra la distribución de frecuencias y porcentajes correspondiente a cada uno de los reactivos. En relación con la confiabilidad, la prueba obtuvo una consistencia interna baja (a = 0.55).
Por otro lado, el estigma que perciben las mujeres diagnosticadas con VPH, se observaron medias que fluctuaron entre 1.69 (DE = 0.94) a 4.48 (DE = 0.91) con una media general de 2.59 (DE = 0.80) lo que indica que las mujeres de esta muestra tienden a estar en desacuerdo a una percepción de estigma. Sin embargo, se destacan los siguientes reactivos en los cuales se observaron niveles mayores de estigma: “En muchas áreas de mi vida, nadie sabe que tengo VPH” (M = 4.48, DE = 0.91); “Yo soy muy cuidadosa a quien le digo que tengo el VPH” (M = 4.23, DE = 1.22), y “Nunca siento que tengo que ocultar que tengo VPH” (M = 3.54, DE = 1.28). En la Tabla 3, se muestran las medias, medianas y desviaciones estándar para cada uno de los reactivos. Al evaluar la confiabilidad de esta escala se obtuvo una consistencia interna alta (a = 0.96).
40 Revista Puertorriqueña de Medicina y Salud Pública
Las puntuaciones obtenidas para la exploración de calidad de vida fueron distribuidas entre 4 a 20. Al evaluar los cuatro factores de la escala de forma individual se encontró que la muestra ubicó su calidad de vida entre “normal” y “bastante satisfecha” (calidad física: M = 14.31, DE = 3.27; calidad psicológica: M = 14.02, DE = 3.09; calidad social: M = 13.13, DE = 4.15; y calidad ambiental: M = 14.40, DE = 2.77). En relación con la interpretación de los resultados, es importante considerar la ausencia de puntos de corte para el instrumento y se realizan los análisis basados en que, a mayor puntación, mayor el nivel de calidad de vida. Al evaluar la confiabilidad de esta escala (WHQOLBREF) se observó una consistencia interna alta (a = 0.94).
Correlaciones
Se calcularon las correlaciones Producto-Momento de Pearson entre las variables de edad, depresión, ansiedad, conocimiento, autoestima, estigma
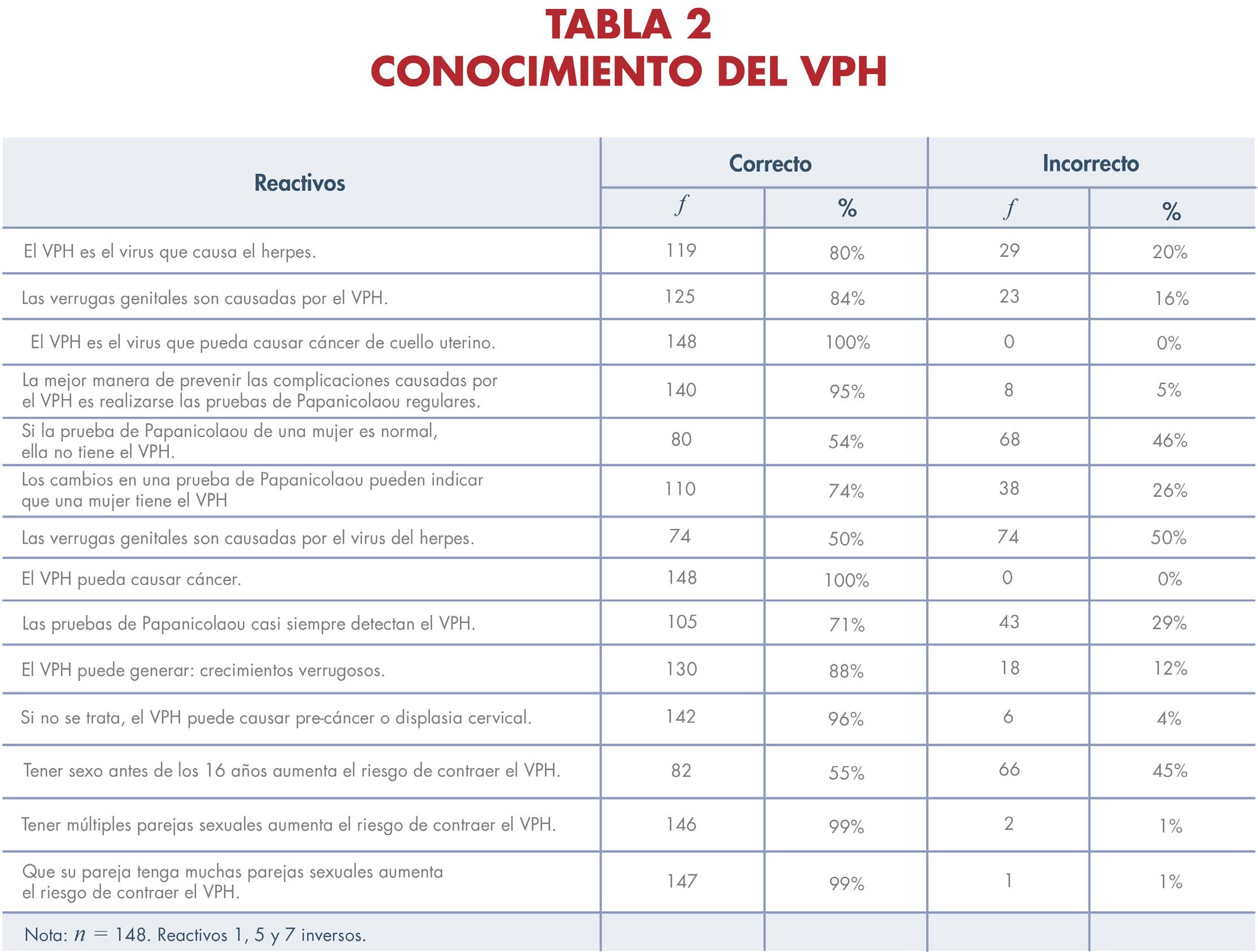
y calidad de vida. Se utilizó la r de Pearson ya que Neudecker y Satorra27 concluyeron que los coeficientes de correlación cuando los datos no siguen una distribución normal, no presentan diferencias significativas, usando Pearson u otros coeficientes como Spearman. Los resultados obtenidos muestran relaciones significativas entre algunas variables (ver Tabla 4).

De estas relaciones significativas se destacan las correlaciones del estigma con depresión y ansiedad, donde a mayor estigma mayores niveles de síntomas de depresión (r = .41, p < .01) y ansiedad (r = .35, p < .01). De igual manera se observaron relaciones significativas entre el estigma con la ansiedad (r = -.28, p < .01) y la depresión (r = -.44, p < .01). Se observó que a mayores niveles de autoestima, mayor calidad física (r = .42, p < .01), psicológica (r = .66, p < .01), social (r = .57, p < .01) y ambiental (r = .45, p < .01). Por otro lado, se observaron relaciones negativas entre depresión y ansiedad con calidad de vida en sus
cuatro factores (p < .01). Esto podría sugerir que, a mayor sintomatología de depresión y ansiedad, la calidad de vida en sus cuatro factores disminuiría o viceversa.
Atención de Salud y Factores Psicológicos
Se realizó un análisis para evaluar la normalidad de los datos y se observó que estos no se distribuyeron normalmente, por lo que se procedió a usar pruebas no-paramétricas. Se realizó una comparación de grupos utilizando la prueba U de MannWhitney y se encontraron diferencias significativas entre el nivel de ansiedad de las personas que entienden que el profesional les explicó de manera adecuada sobre su diagnóstico y los que no (U = 3,741.5, z = 2.11, p < .05 ). Se encontró que las personas que entienden que no le explicaron de manera adecuada (Mrango = 88.47) están significativamente más ansiosas que las que sí entienden que le explicaron de manera
Revista Puertorriqueña de Medicina y Salud Pública 41


42 Revista Puertorriqueña de Medicina y Salud Pública
adecuada (Mrango = 72.99). Al igual, se encontraron diferencias estadísticamente significativas entre el nivel de ansiedad de las personas que entienden que se les aclararon sus dudas y los que no (U = 3,933, z = 2.68, p < .01). Se observaron mayores niveles de ansiedad en las personas que entendían que el profesional no le había aclarado sus dudas (Mrango = 90.08) que los que entendían que sí les habían aclarado (Mrango = 70.54). De igual forma se encontraron diferencias significativas entre el nivel de ansiedad de las personas que entendían que sus inquietudes fueron atendidas que las que no (U = 4,205, z = 3.67, p < .001). Las personas que entendieron que sus inquietudes fueron atendidas reportaron mayor sintomatología de ansiedad (Mrango = 94.32) que las que entendían que sus inquietudes no fueron atendidas (Mrango = 67.53).
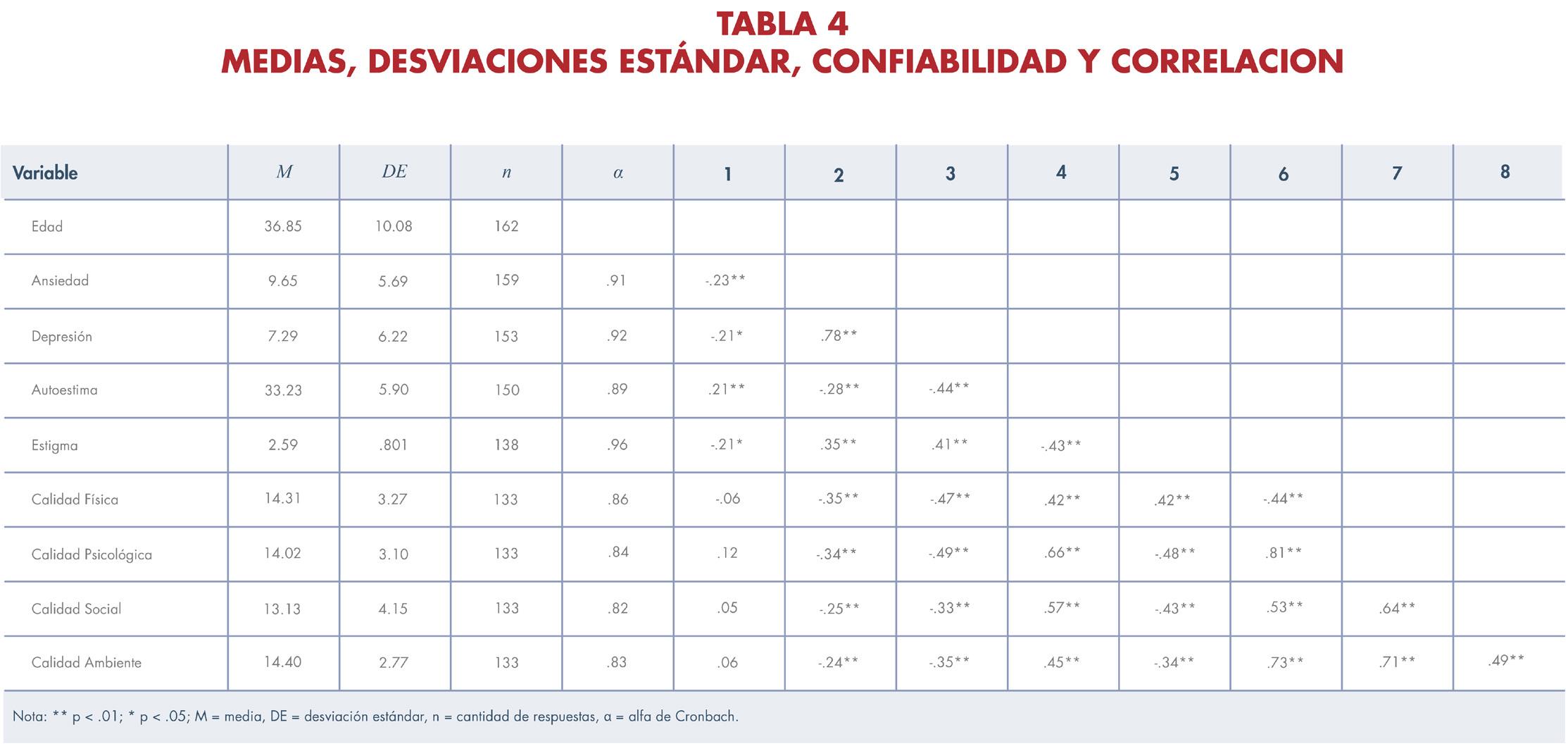

De igual forma, se encontraron diferencias significativas entre el nivel de depresión de las personas que entienden que el profesional les aclaró las dudas sobre su diagnóstico y las que no (U = 3,610, z = 2.51, p < .05). Las personas que entienden que sus dudas fueron aclaradas (Mrango = 70.54) tuvieron diferencias estadísticamente significativas en sus puntuaciones de nivel de depresión en comparación con las que no (Mrango = 90.08). Por otro lado, también se observaron diferencias estadísticamente significativas entre el nivel de sintomatología de depresión entre los que entendía que el profesional de la salud atendió sus inquietudes y las
que no (U = 3,578, z = 2.45, p < .05). Las que entendían que sus inquietudes no fueron aclaradas (Mrango = 86.40) reportaron mayor sintomatología de depresión que las que entendieron que sus dudas sí fueron aclaradas (Mrango = 68.88).
Al igual se encontraron diferencias estadísticamente significativas entre el nivel de estigma de las mujeres que entendieron que el profesional les explicó de manera adecuada sobre su diagnóstico y las que no (U = 2,923, z = 2.35, p < .05). Las que entendían que sus dudas no fueron explicadas de manera adecuada presentaron mayor estigma (Mrango = 77.96) que las que entendían que sí le habían explicado de manera adecuada (Mrango = 61.97). De igual manera, se encontraron diferencias significativas entre el nivel de estigma y si entendían que el profesional le había aclarado sus dudas (U = 2,895, z = 2.20, p < .05). Cuando entendían que el profesional sí le aclaró sus dudas reportaban menor estigma (Mrango = 77.22) que cuando entendían que no habían sido aclaradas (Mrango = 62.22). Asimismo, se encontraron diferencias estadísticamente significativas entre el nivel de estigma y si entendían que sus inquietudes habían sido atendidas (U = 2,852, z = 2.05, p < .05). Las personas que entendían que sus inquietudes no habían sido atendidas (Mrango = 76.88) reportaron mayor estigma que las que entendían que sus inquietudes fueron atendidas (Mrango = 62.93).
En relación con la autoestima se encontraron diferencias estadísticamente significativas en el nivel de autoestima de las personas que entienden que el profesional de la salud sí les explicó de manera adecuada sobre su diagnóstico en comparación con las que entienden que el profesional no les explicó de manera adecuada (U = 2,250, z = -2.08, p < .05). Las mujeres que entendieron que le explicaron de manera adecuada tuvieron una autoestima significativamente mayor (Mrango = 82.37) que las que entendieron que no le explicaron de manera adecuada (Mrango = 67.65).
Al evaluar el nivel de calidad de vida en sus cuatro factores se observaron diferencias estadísticamente significativas entre las personas que le aclararon sus dudas y las que no. Las personas que sí le aclararon sus dudas mostraron significativamente mayor calidad de vida en sus cuatro factores (ver Tabla 5). Al igual, las personas que entendieron que el profesional de la salud les explicó de manera adecuada sobre su diagnóstico mostraron mayor calidad de vida psicológica que las que entendieron que no les explicaron (U = 1,676, z = -2.37, p < 0.05). De forma similar se encontraron diferencias estadísticamente significativas entre si entendían que atendieron sus inquietudes y el nivel de calidad de vida física (U = 1,592, z = -2.77, p < .01), al igual con el nivel de calidad de vida psicológica (U = 1,721, z = -2.19, p < .05) y la calidad de vida ambiental (U = 1,730, z = -2.15, p < .05). Al
Revista Puertorriqueña de Medicina y Salud Pública 43
entender que sus inquietudes fueron atendidas reportaron mayor calidad de vida física (Mrango = 75.76) que las que entendían que no (Mrango = 57.27). Asimismo, ocurrió con la calidad de vida psicológica donde
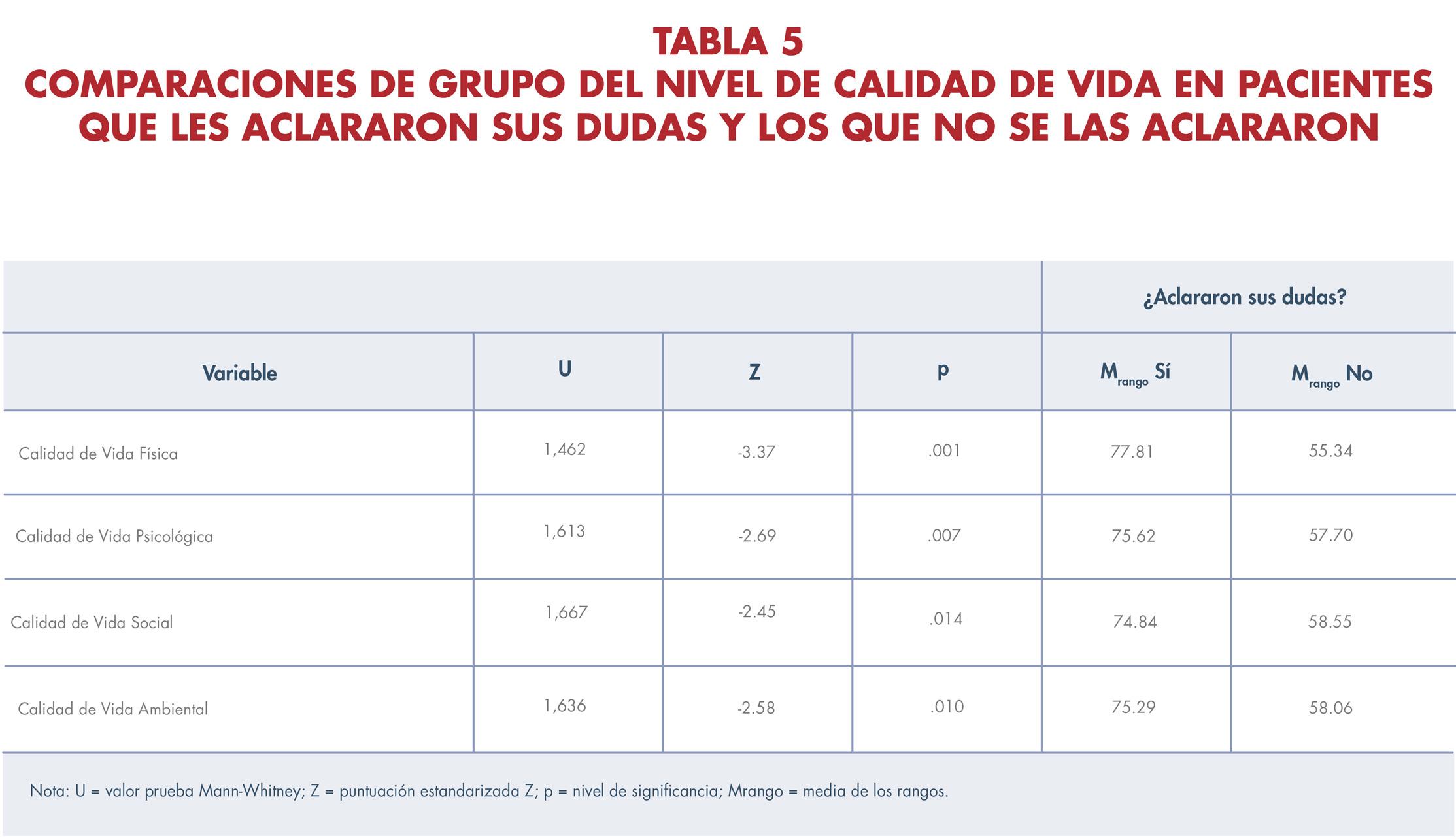
las que entendían que sus inquietudes habían sido atendidas (Mrango = 73.91) reportaron mayor calidad de vida psicológica que las que no (Mrango = 59.32). Así se observó con la calidad de vida ambiental en donde
las que entendían que sus inquietudes habían sido atendidas reportaron mejor calidad de vida ambiental (Mrango = 73.79) que las que no (Mrango = 59.46).
Discusión

La presente investigación tuvo como objetivo principal explorar y describir el perfil de salud de una muestra de mujeres puertorriqueñas diagnosticadas con VPH en Puerto Rico. En países de Latinoamérica se ha encontrado que las mujeres al ser diagnosticadas con este virus experimentan diversas emociones, entre estas angustia, tristeza, y culpabilidad a lo que muchas llegan a experimentar estigma internalizado.
Al evaluar el perfil de esta muestra de mujeres puertorriqueñas con VPH se observó que un 76.0% reportó síntomas de ansiedad y un 62.3 % reportó tener síntomas de depresión. Estos resultados son consistentes con un estudio realizado en México donde las mujeres que presentaban malestar psicológico, un 84.6% presentó cierto nivel de ansiedad y un 80.8% síntomas de depresión4. Estos resultados demuestran la necesidad que existe de atender esta área incluso de trabajar estrategias dirigidas al manejo de la ansiedad para disminuir las probabilidades de tener trastornos de depresión. La literatura destaca que
en la mayoría de los casos, la ansiedad precede a la depresión.
Al estudiar el área de estigma, autoestima y calidad de vida, se pudo observar que estas mantenían unos niveles adecuados, lo cual no es consistente con alguna literatura Latinoamericana. Sin embargo, se pudo ver como el nivel de autoestima, estigma y calidad de vida era impactado si entendían que se les había explicado de manera adecuada sobre su diagnóstico, lo cual es consistente con la literatura.
Las personas que entienden que no le explicaron de manera adecuada sobre su diagnóstico de VPH reportaron significativamente mayor sintomatología de ansiedad, mayor estigma, una menor autoestima y calidad de vida psicológica que las mujeres participantes que entendieron que sí le explicaron de manera adecuada. Esto es consistente con la literatura. Por tanto, se recomienda realizar un protocolo para las mujeres positivos en VPH y se pueda insertar
la psicología de la salud en esta área y para trabajar el proceso e impacto emocional que pudiera presentar, que como vemos con los resultados al trabajarlo va a tener un efecto a largo plazo en su calidad de vida y demás aspectos emocionales.
Al igual se encontró que las mujeres que entienden que sus dudas no fueron aclaradas, reportaron un nivel significativamente mayor de síntomas de depresión, ansiedad, mayor estigma y menor calidad de vida en sus cuatro factores en comparación con las mujeres que entendieron que sus dudas habían sido aclaradas. Otro aspecto importante fue que las mujeres que sintieron que no tuvieron un espacio para aclarar sus inquietudes también reportaron mayor sintomatología de depresión, ansiedad, menor estigma y menor calidad de vida en los factores psicológico, físico y ambiental. Estos resultados son consistentes con el aspecto que se refleja en la literatura donde explica que la falta de información y de educación influye para que las pacientes refuercen sus
44 Revista Puertorriqueña de Medicina y Salud Pública
temores frente a este diagnóstico3,10. Se ha evidenciado que las mujeres requieren información, oportunidad de aclarar dudas y apoyo emocional durante el proceso de cernimiento.
Castro-Vázquez y Arellano-Gálvez6 explican que hay una necesidad constante de las mujeres pacientes de acceder, recibir y entender la información sobre el VPH y los cambios asociados a este, como las displasias cervicales, ya que esto les permite disminuir la angustia y percepción de fatalidad que pudiera tener la paciente respecto a que fuera a desarrollar cáncer. Estos autores explican que el recibir la información permitirá a las mujeres apropiarse de sus procesos de atención. Cuando esta información no se ofrece, se genera mayor incertidumbre y efectos emocionales en la paciente lo cual es completamente consistente con lo observado en nuestra investigación. Muchas veces las mujeres tienen una visión del VPH como un diagnóstico futuro de cáncer y no reciben información donde se les pueda educar y aclarar esta percepción.
Una explicación a la poca información que en muchas ocasiones la paciente siente que se le dio sobre el diagnóstico, al igual con el proceso de aclarar inquietudes y dudas, pudiera ser un elemento que permanece invisibilizado como lo es el estigma en el profesional de la salud respecto a este diagnóstico3,6.
Entre las limitaciones que se tuvo en este estudio destacan los pocos estudios para referenciar en la investigación ya que la mayoría de la literatura existente es referente al proceso biológico, la vacunación y actitudes hacia esta y no hacia el aspecto emocional. Otra de las limitaciones fue el reclutamiento en línea que excluye a las personas que no tienen acceso al internet y a las redes sociales utilizadas. Esto influye en tener una muestra heterogénea en sus características y hace que no sea una muestra representativa de la población.
Se recomienda realizar más estudios inferenciales para profundizar más sobre el tema. Además, se pueden desarrollar protocolos para centros ginecológicos y hospitales para que se asegure que se puedan cubrir las necesidades psicológicas de estas pacientes. De igual forma que se incorpore en futuros estudios aspectos de diversidad con poblaciones que han
tenido cirugía de afirmación de género e integrar cernimiento psicológico cuando una paciente es diagnosticada con VPH. Asimismo, se recomienda integrar estrategias en el área de cuidado primario11.
En conclusión, se pudo validar que las mujeres al ser diagnosticadas con el VPH reportan síntomas de ansiedad y muchas llegan a reportar sintomatología de depresión. Las explicaciones y aclaración de dudas e inquietudes sobre el diagnóstico contribuyen a disminuir significativamente el malestar emocional3,10,42. Además, se pudo observar la necesidad de incorporar el cuidado multidisciplinario entre la salud mental y física para atender a la población con este diagnóstico y evitar que lleguen a tener un impacto emocional severo.
REFERENCIAS
Instituto Nacional del Cáncer. VPH y el cáncer [Internet]. National Institute of Health; 2019 [updated 2022 June 2; cited 2022 October]. Available from: https:// www.cancer.gov/espanol/cancer/causasprevencion/riesgo/germenes-infecciosos/vphy-cancer.
Sociedad Americana del Cáncer. El VPH y las pruebas del VPH [Internet]. 2017, October 9 [updated 2020 July 30; cited 2022 October]. Available from: https://www. cancer.org/es/cancer/causas-del-cancer/ agentes-infecciosos/vph/vph-y-pruebas-paravph.html.
Gálvez A, Vásquez C. El estigma en mujeres diagnosticadas con VPH, displasia y cáncer cervicouterino en Hermosillo, Sonora. Estudios Sociales. 2013 [cited 2022 October];21(42):259-78.
Rodríguez M, Mancilla R, Morales F, Sánchez C, Pimentel D, Carreño M. Adaptación psicológica en mujeres con infección con el Virus del Papiloma Humano. Perinatología y Reproducción Humana. 2011 [cited 2022 October];25(1):17-22.
Brown L, Ritvo P, Howlett R, Cotterchio M, Matthew A, Rosen B. Attitudes toward HPV testing: Interview findings from a random sample of women in Ontario, Canada. Health Care Women Int. 2007 [cited 2022 October];28(9):782-98.
Castro-Vásquez M, Arellano-Gálvez M. Acceso a la información de mujeres con VPH, displasia y cáncer cervical in situ. Salud Pública de México. 2010 [cited 2022 October];52(3):207-212.
Waller J, McCaffery K, Kitchener H, Nazroo J, Wardle J. Women’s experiences of repeated HPV testing in the context of cervical cancer screening: a qualitative study. Psychooncology. 2007 [cited 2022 October];16(3):196-204.
Organización Mundial de la Salud. Virus
del Papiloma Humano (VPH) [Internet]. 2017 [cited 2022 October]. Available from: https:// www.who.int/immunization/diseases/hpv/ es/.
Voces Panel Asesor. Radiografía sobre el VPH en Puerto Rico y recomendaciones de un Panel Asesor: La vacuna que previene el cáncer asociado al Virus del Papiloma Humano (VPH) [Internet]. VOCES; 2015 [cited 2022 October]. Available from: http:// revistareportemedico.com/home/wp-content/ uploads/2016/01/Informe-PANEL-VPHVoces-Aug-2015.pdf
Malaret K. A treatment program design for women diagnosed with Human Papilomavirus (HPV) [tesis de maestría]. [Puerto Rico]: Universidad Albizu; 2012 [cited 2022 October].
Kusnanto H, Agustian D, Hilmanto D. Biopsychosocial model of illnesses in primary care: a hermeneutic literature review. Journal of Family Medicine & Primary Care [Internet]. 2018 May-June [cited 2022 October];7(3):497-500. Available from: https://doi.org/10.4103/jfmpc. jfmpc_145_17.
Suls J, Green PA, Boyd CM. Multimorbidity: implications and directions for health psychology and behavioral medicine. Health Psychology [Internet]. 2019 [cited 2022 October];38(9):772-82. Available from: https://doi.org/10.1037/hea0000762.
Bierman AS. Preventing and managing multimorbidity by integrating behavioral health and primary care. Health Psychology [Internet]. 2019 [cited 2022 October];38(9):851-54. Available from: https://doi.org/10.1037/ hea0000787.
León-Maldonado L, Allen-Leigh B, LazcanoPonce E. Consejería en la detección de VPH como prueba de tamizaje de cáncer cervical: un estudio cualitativo sobre necesidades de mujeres de Michoacean, México. Salud Pública Mex. 2014 [cited 2022 October];56(5): 51927.
Newton DC, McCabe MP. A theoretical discussion of the impact of stigma on psychological adjustment to having a sexually transmissible infection. Sexual Health [Internet]. 2005 [cited 2022 October];2(2):63-69. Available from: https://doi.org/10.1071/ sh04015

Asencio A, Torres-Cintrón CR, AlvaradoOrtiz M, Tortolero-Luna G, Zavala D, Ortiz AP. Cáncer cervical: Puerto Rico: 2009-2013 [Internet]. Puerto Rico Central Cáncer Registry; 2016 [cited 2022 October]. Available from: http://www.cccupr.org/wp-content/ uploads/2017/01/fs.cervical.pdf.
Rosenberg M. Society and the adolescent self-image. Princeton University Press; 1965 [cited 2022 October]. 338 p.
González-Rivera JA, Pagán-Torres OM. Validación y análisis de la dimensionalidad de la escala de autoestima de Rosenberg en mujeres puertorriqueñas: unifactorial o bifactorial. Apuntes de Psicología. 2017 [cited 2022 October];35(3):169-77.
Revista Puertorriqueña de Medicina y Salud Pública 45


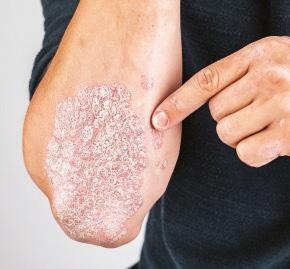

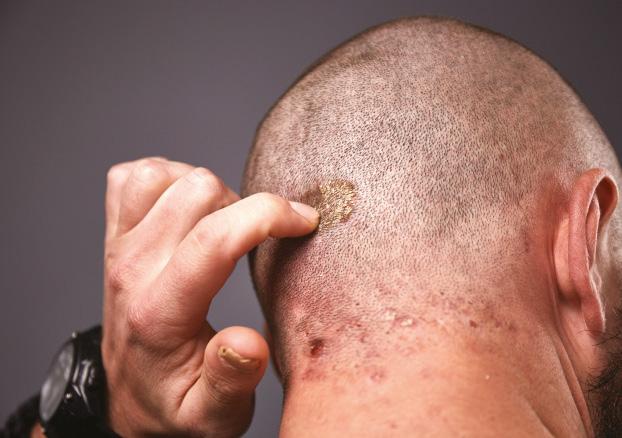
46 Revista Puertorriqueña de Medicina y Salud Pública
24
Revista Puertorriqueña de Medicina y Salud Pública
ESTUDIO SOBRE LA EFECTIVIDAD DE TERAPIAS EN PACIENTES CON PSORIASIS
ABSTRACT
Objective: This study aims to describe the frequency of biologic therapy failure in psoriasis patients along with associated patient demographics and characteristics.
Methods: This was a retrospective medical-record review of psoriasis patients evaluated from January 1st, 2013, through May 1st, 2018, and who failed at least once to adhere to their biologic therapy.
Results: Seventy-seven patients with psoriasis who had discontinued biologic therapy at least once were included in this study. Hypertension (58.4%), diabetes (37.7%), dyslipidemia (27.3%), and psoriatic arthritis (23.4%) were the main comorbidities observed. Adalimumab (ADA, 80.5%), ustekinumab (UST, 70.1%), and etanercept (ETA, 14.2%) were the most frequently used biologics in our cohort. The biologic with the longest mean duration of use prior to its discontinuation was UST (17.0 months), followed by ADA (15.9 months) and ETA (13.6 months).
Conclusion: The most common reason for discontinuing biologic therapy was that said therapy was not effective, though for ETA and UST, the fact that biologic therapies are not universally covered by insurance
companies was found to be associated with their discontinuation, as well. There were no statistically significant associations found between biologic therapy discontinuation and age, gender, or comorbidities, which last included obesity, class I. Larger studies are warranted to identify risk factors associated with biologic therapy failure to help guide drug selection, decrease morbidity associated with such nonadherence and improve patient outcomes. [P R Health Sci J 2021;40:63-67]
RESUMEN
Objetivo: Este estudio tiene como objetivo describir la frecuencia del fracaso de la terapia biológica en pacientes con psoriasis junto con la demografía y las características asociadas de los pacientes.
Métodos: Esta fue una revisión retrospectiva de historias clínicas de pacientes con psoriasis evaluados desde el 1 de enero de 2013 hasta el 1 de mayo de 2018, y que no cumplieron al menos una vez con su terapia biológica.

Resultados: Se incluyeron en este estudio 77 pacientes con psoriasis que habían discontinuado la terapia biológica al menos una vez. La hipertensión arterial (58.4%), la diabetes (37.7%), la dislipidemia (27.3%)
y la artritis psoriásica (23.4%) fueron las principales comorbilidades observadas. Adalimumab (ADA, 80.5%), ustekinumab (UST, 70.1%) y etanercept (ETA, 14.2%) fueron los biológicos más utilizados en nuestra cohorte. El biológico con mayor duración media de uso antes de su suspensión fue UST (17.0 meses), seguido de ADA (15.9 meses) y ETA (13.6 meses). Conclusión: La razón más común para descontinuar la terapia biológica fue que dicha terapia no fue efectiva, aunque para ETA y UST, el hecho de que las terapias biológicas no estén universalmente cubiertas por las compañías de seguros, también se asoció con su descontinuación. No se encontraron asociaciones estadísticamente significativas entre la interrupción de la terapia biológica y la edad, el sexo o las comorbilidades, que por último incluyeron la obesidad, clase I. Se justifican estudios más amplios para identificar los factores de riesgo asociados con la falla de la terapia biológica para ayudar a guiar la selección de medicamentos, disminuir la morbilidad asociada con dicha falta de adherencia y mejorar los resultados de los pacientes. [PR Health Sci J 2021;40:63-67]
Palabras clave Psoriasis, Terapia biológica, Cambio biológico, Fracaso de la terapia biológica, Interrupción de la terapia biológica
Keywords
Psoriasis, Biologic therapy, Biologic switching, Biologic therapy failure, Biologic therapy discontinuation


Revista Puertorriqueña de Medicina y Salud Pública 47 Revista Puertorriqueña de Medicina y Salud Pública 25
Rocío Cardona, MD; Natalia M. Pelet del Toro, BS; Eduardo Michelen-Gómez, BS; Gabriel E. Arias Berríos, MD; Rafael F. Martín-García, MD Escuela de Medicina, Recinto de Ciencias Médicas de la Universidad de Puerto Rico, San Juan, Puerto Rico. Los autores no tienen conflictos de intereses a revelar.
Se han hecho muchos avances con respecto a los medicamentos biológicos para el tratamiento de la psoriasis, aunque la interrupción de estos agentes (debido a la ineficacia, los efectos secundarios, el hecho de que las terapias biológicas no están universalmente cubiertas por las compañías de seguros y/o la preferencia de los pacientes) sigue siendo un problema. reportado (1, 2, 3, 4). Se ha informado que el cambio biológico, la interrupción de un biológico para la transición a otro, llega al 44.1 % (2).
La principal razón que dan los pacientes con psoriasis para sus-
PACIENTES Y MÉTODOS
Extracción de datos
Luego de su aprobación por la junta de revisión institucional de la Facultad de Medicina de la Universidad de Puerto Rico (protocolo n.º B1340218), se realizó una revisión retrospectiva del expediente médico electrónico (EMR) en las Clínicas de Dermatología de la Facultad de Medicina de la Universidad de Puerto Rico. Este estudio incluyó pacientes de 18 años o más con diagnóstico de psoriasis que habían fallado la terapia biológica al menos una vez y que habían sido evaluados desde el 1 de enero de 2013 hasta el 1 de mayo de 2018. Los datos recopilados incluyeron edad, sexo, IMC, comorbilidades, antecedentes sociales (incluyendo si el paciente consumió activamente alcohol o tabaco durante su tratamiento con un agente biológico), duración del tratamiento y los motivos de la interrupción de la terapia biológica (ineficacia, efectos secundarios, problemas de seguro u otros). Ciertas frases en los registros médicos indicaron una falta de eficacia correspondiente. Los médicos evaluadores generaron comentarios sobre las evaluaciones de EMR como “falta de mejoría” y “lesiones refractarias”, cuyos comentarios se consideraron relacionados con la terminación final de la terapia.


pender su terapia biológica es la ineficacia de dicho tratamiento (3, 5). En consecuencia, Gniadecki et confirmaron que la eficacia de un biológico disminuye con el tiempo (6). La supervivencia del fármaco, o el tiempo hasta la interrupción de un fármaco, está determinada por el perfil de eficacia y seguridad de un medicamento determinado, así como por otros factores (7). Se estima que la supervivencia promedio de un medicamento biológico es de 5 años (5, 8). El índice de masa corporal (IMC) (4), la inmunogenicidad biológica (9,10) y el consumo de alcohol y tabaco (11) se han asociado con la inefi-

cacia del tratamiento y la interrupción posterior de la terapia biológica. Así mismo, algunos estudios han encontrado que el ser mujer predispone a dichas pacientes a desarrollar efectos secundarios que comprometen la supervivencia del fármaco (4). El objetivo de este estudio fue el identificar las características de los pacientes que podrían servir como predictores para la interrupción de la terapia biológica. Para mejorar los resultados del tratamiento y disminuir la morbilidad en pacientes con psoriasis, es importante detectar a aquellos que están en riesgo de fracaso de la terapia biológica.
La duración de la terapia se informa en meses consecutivos de uso; por lo tanto, la duración de la terapia antes de una interrupción de más de 3 meses en esa terapia no se incluyó en la duración del tratamiento, lo cual es similar a lo que se ha hecho en otros ensayos (3,4). Se excluyeron los pacientes que no estaban en terapia biológica para su psoriasis o que no habían suspendido la terapia biológica. Como resultado de la revisión retrospectiva de historias clínicas, se identificaron un total de 537 pacientes con diagnóstico de
psoriasis.
Después de aplicar los criterios de exclusión e inclusión (Figura 1) a los registros, el personal del estudio analizó los datos de los que quedaron, todos los cuales eran de personas que habían discontinuado la terapia (n = 77).
Se realizó un análisis descriptivo, y los datos categóricos se resumieron como frecuencias con porcentajes, mientras que los datos continuos se resumieron con medidas de tendencia central y dispersión (frecuencia, media ± DE, mediana, valores mínimo y máximo). Se realizó
48 Revista Puertorriqueña de Medicina y Salud Pública Revista Puertorriqueña de Medicina y Salud Pública 26
Figura 1. Criterios de inclusión y exclusión de análisis estadístico
una comparación de proporciones entre grupos (prueba exacta de Fisher); se realizó una comparación de medias mediante una prueba t. Todos los análisis estadísticos se evaluaron con un nivel de significación de dos colas de 0.05. El análisis estadístico se realizó utilizando el software STATA, v. 14.0.


Resultados
SSe observó una edad media de 49.7 años, habiéndo identificado una mayoría femenina del 63.6% (n = 49). Un análisis de cuartil de edad reveló que la mayoría de los pacientes tenían entre 36 y 50 años (n = 25; 32.5 %) o entre 51 y 65 años (n = 26; 33.8 %), y el resto de los pacientes se distribuyeron uniformemente entre los grupos de edad de 18 a 35 años y mayores de 65 años (n = 13 [16.9%] para ambos grupos de edad). La hipertensión arterial (58.4%), la diabetes (37.7%), la dislipidemia (27.3%) y la artritis psoriásica (PsoA, 23.4%) fueron las principales comorbilidades observadas (tabla I). Las historias sociales y las puntuaciones del IMC estaban disponibles para 45 de los 77 pacientes incluidos. El consumo activo de alcohol o tabaco durante la terapia biológica se observó en el 6.7% y el 4.4% de los participantes, respectivamente. El IMC medio fue de 32.6 kg/m2, y la mayoría de los pacientes presentaban obesidad, clase I (42.2%) o sobrepeso (22.2%), como se muestra en la Tabla 1.
La Tabla 2 muestra la frecuencia del uso y la interrupción de la terapia biológica, así como la duración media de la terapia. Adalimumab (ADA), ustekinumab (UST) y etanercept (ETA) fueron los biológicos más utilizados (80.5%, 70.1% y 14.2%, respectivamente). El biológico con la duración media más larga antes de la suspensión fue UST (17,0 meses), seguido de ADA (15,9 meses) y ETA (13.6 meses). Los biológicos más discontinuados fueron ADA (77.4%), ETA (72.7%) y UST (59.3%). En la tabla IV se detallan los motivos de discontinuación, siendo la ineficacia la más común para todos los grupos biológicos, seguida por el hecho de que un determinado biológico no estaba cubierto por la compañía aseguradora de un determinado paciente. Los efectos secundarios que conducen a la interrupción de la terapia biológica se muestran en la Tabla 3, junto con otras razones para suspender la terapia biológica. Durante la revisión retrospectiva de EMR, las razones clasificadas bajo el término general “efectos secundarios” pudieron asociarse directamente con el uso biológico, mientras que las clasificadas bajo el término general “otros” no lo fueron. No se identificó un patrón significativo con los efectos secundarios informados asociados con la interrupción del tratamiento biológico.
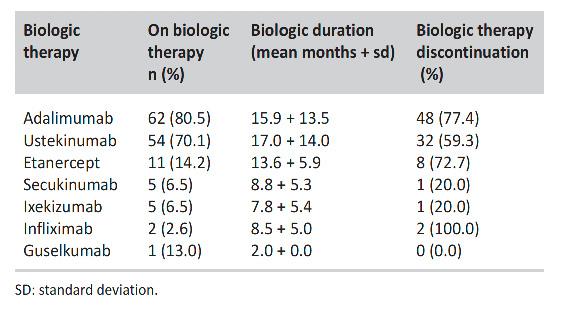
La edad, el sexo, el IMC y las comorbilidades no se asociaron con la suspensión de ADA, ETA o UST (p > 0.05). De manera similar, la Tabla 4 demuestra la asociación estadísticamente significativa entre la ineficacia y la interrupción de ADA, UST y ETA (P < 0.001), mientras que la falta de cobertura de seguro para las 2 terapias biológicas relevantes se asoció significativamente con la interrupción de UST (P < .001) y ETA (p = .001).
Discusión
Nuestros datos describen la demografía y las comorbilidades de los pacientes con psoriasis que interrumpieron la terapia biológica al menos una vez. Este grupo tenía una edad media de 49.7 años, con predominio del sexo femenino (63.6%) y un IMC medio de 32.6 kg/m2, encontrándose la mayoría de los participantes con obesidad clase I (42.2%) o sobrepeso (22.2%), muy similar a lo encontrado por Kimball et al en su registro prospectivo multicéntrico de pacientes con psoriasis que estaban en tratamiento sistémico o biológico o eran candidatos a recibirlo (12). Nuestra población tuvo mayores frecuencias de hipertensión, diabetes tipo II, dislipidemia y PsoA en comparación con la cohorte de Kimball et a La CAD, que puede haber estado infra notificada en nuestra cohorte, fue la excepción a esta tendencia al aumento de las frecuencias (12). Heiss et al también notaron una mayor frecuencia de comorbilidades asociadas con la enfermedad cardíaca en hispanos en comparación con los caucásicos, lo que destaca la importancia de reforzar las opciones de estilo de vida saludable (p. ej., dieta y ejercicio, consultar a un nutricionista), así como de realizar un seguimiento adecuado y manejo de comorbilidades en hispanos con psoriasis (13).

Revista Puertorriqueña de Medicina y Salud Pública 49 Revista Puertorriqueña de Medicina y Salud Pública 27
En nuestra cohorte no se encontró una asociación significativa entre la interrupción de la terapia biológica y la edad, el género, las comorbilidades o el IMC. Reddy et al observaron una mayor supervivencia del fármaco (tiempo hasta la interrupción) en pacientes con PsoA, mientras que Warren et al no encontraron ninguna asociación entre la PsoA y la supervivencia del fármaco (3, 14). Tener un IMC superior a 35, ser fumador activo y usar ETA se han asociado con ineficacia, mientras que ser mujer y usar infliximab se ha aso -
ciado con eventos adversos (3). El aumento de la edad y un IMC alto se han asociado con la ineficacia de los inhibidores del TNF-alfa (TNFI) (15,16,17). Con respecto a los predictores de interrupción de la terapia biológica, Zweegers et al observaron que las mujeres que usaban ADA y ETA tendían a sufrir más efectos secundarios que los pacientes masculinos y que las terapias de individuos con IMC alto que usaban ETA y UST tendían a ser ineficaces en comparación con las terapias de aquellos con BMIS más bajo (4). Honda et al encontra-
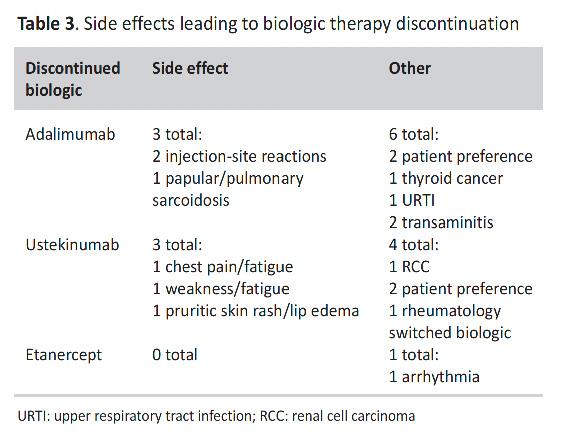


ron puntajes más altos en el Índice de Severidad y Área de Psoriasis (PASI) al aumentar la edad y una asociación entre un PASI inicial alto y la interrupción general de la terapia biológica, aunque no encontraron ninguna asociación significativa entre la suspensión de UST o infliximab con la edad, el género , PASI basal o tabaquismo (2). El tabaquismo activo y/o el consumo de alcohol durante la terapia biológica pueden potencialmente disminuir la eficacia del tratamiento en la psoriasis al exacerbar la enfermedad subyacente (11).
En nuestra cohorte, ADA es el biológico más prescrito (80,5%), seguido de UST (70.1%) y ETA (14.2%), mientras que el más discontinuado es ADA (77.4%), seguido de ETA (72,7%) y UST (59.3%). Warren et al también observaron que había una mayoría de pacientes con ADA (53 %), con más casos de PsoA con TNFI que con UST (3). La interrupción de la terapia biológica se observó en el 42% de nuestros pacientes con psoriasis, y la ineficacia del tratamiento fue la razón más común que fue estadísticamente significativa para ADA, UST y ETA. De igual manera, la ineficacia (74,5%), seguida de los eventos adversos (21.6%), fue la principal razón para el cambio biológico en un estudio realizado por Honda et al (2). Otros autores han observado que ADA y UST se asocian con falla primaria (ineficacia observada desde el inicio de la terapia), mientras que infliximab se asocia con falla secundaria (mejoría inicial seguida de ineficacia) y reacciones en el lugar de la infusión (3, 19). En nuestra cohorte no se encontró una tendencia en términos de efectos secundarios que condujeran a la interrupción de la terapia biológica, aunque Zweegers et al encontraron una mayor frecuencia de efectos secundarios con el uso de ETA (51%), seguido de ADA (38%) y luego UST (11%) con infecciones
(en su mayoría de origen en las vías respiratorias superiores) que conducen principalmente a la interrupción de ADA y ETA, pero no de UST (4). En nuestro estudio, el hecho de que las terapias biológicas no estén universalmente cubiertas por las compañías de seguros también se asoció significativamente con la suspensión de ETA y UST. Algunos autores han opinado que los costes asociados a la terapia biológica pueden ser una de las razones por las que los pacientes abandonan el tratamiento biológico (1). En nuestra cohorte, UST tuvo la duración
media más larga de la terapia (17 meses) antes de su interrupción; le siguieron ADA (15.9 meses) y ETA (13.6 meses). En otros estudios (3, 4) se informó una supervivencia superior del fármaco con UST (en comparación con otros agentes biológicos). Con respecto a la eficacia y los efectos secundarios, estudios previos informaron una mayor supervivencia del fármaco en el grupo UST en comparación con los grupos ADA y ETA después de corregir los factores de confusión, mientras que no se encontraron diferencias significativas entre los grupos ADA y ETA
50 Revista Puertorriqueña de Medicina y Salud Pública Revista Puertorriqueña de Medicina y Salud Pública 28
(4). Sin embargo, ADA ha demostrado la mayor supervivencia del fármaco dentro del grupo TNFI (3).
La tasa superior de supervivencia del fármaco de UST en comparación con las tasas de TNFI puede explicarse por su mayor eficacia (20), menor inmunogenicidad (21) y perfil adecuado de efectos secundarios, así como el hecho de que tiende a ser preferido por los pacientes. debido a la disminución del régimen de dosificación y su forma de administración (3). Las diferencias en la presentación clínica, el pronóstico, la comunicación de los síntomas y los resultados del tratamiento se han propuesto como posibles explicaciones de que las mujeres se asocian con efectos secundarios que conducen a la finalización prematura del tratamiento (22). La inmunogenicidad puede conducir a una disminución de la eficacia de la terapia biológica con el tiempo y se ha informado que es tan alta como 19.5 a 51.5 % para infliximab, 4 a 46 % para ADA, 1.1 a 18.3 % para ETA y 3.8 a 5.1 % para UST ( 21). Las moléculas quiméricas como el infliximab contienen porciones murinas y son más inmunogénicas que otros anticuerpos humanizados (ADA, UST y ETA, por ejemplo) (23, 24,25).
Este estudio está limitado por su naturaleza retrospectiva; por lo tanto, está sujeto al sesgo de recuerdo, así como al sesgo de informe. En general, las evaluaciones de EMR no hicieron un uso consistente de objetivos medidas, como el cambio desde el valor inicial en el porcentaje de área de superficie corporal involucrada o las puntuaciones PASI, para determinar la eficacia del tratamiento. Este estudio está limitado por la naturaleza subjetiva de determinar el fracaso de la terapia biológica en función de las evaluaciones de la respuesta al tratamiento por parte del médico y del paciente. Además, se trata de un tamaño de muestra pequeño, sujeto a sesgos de selección y de derivación, ya que la población de estudio procedía de un único centro de tercer nivel. Los estudios adicionales deben comparar a los pacientes con psoriasis que requirieron un cambio en la terapia biológica versus aquellos que no lo requirieron y comparar, también, las tasas de supervivencia de los medicamentos de las terapias biológicas disponibles y enfocarse en estudios prospectivos más amplios para determinar el impacto de las características de un paciente dado en su decisión de suspender la terapia biológica. Por último, los pacientes pueden ser menos comunicativos sobre el consumo de tabaco (18) y/o alcohol durante los encuentros clínicos, lo
que podría explicar las bajas frecuencias de consumo de alcohol y tabaco notificadas en nuestra cohorte.
Conclusión
La ineficacia biológica se identificó como la razón más común para suspender la terapia biológica en todos los grupos de fármacos y fue estadísticamente significativa para ADA, UST y ETA. Sin embargo, no se encontraron asociaciones estadísticamente significativas entre la suspensión de la terapia biológica y la edad, el IMC, el sexo o las comorbilidades, mientras que la falta de cobertura por parte de algunas compañías de seguros se asoció significativamente con la suspensión de ETA y UST. La identificación de las características de los pacientes como posibles factores de riesgo para la interrupción prematura de la terapia biológica puede disminuir la morbilidad asociada con el fracaso de la terapia biológica en pacientes con psoriasis y mejorar los resultados clínicos.
RESUMEN
Objetivo: El objetivo es describir la frecuencia de la interrupción de la terapia biológica en pacientes con psoriasis y las características asociadas al fallo del tratamiento. Métodos: Una revisión retrospectiva de los registros médicos de pacientes con psoriasis evaluados entre el 1 de enero del 2013 y el 1 de mayo del 2018 que fallaron con tratamientos biológicos al menos una vez. Resultados: Setenta y siete pacientes con psoriasis que descontinuaron las terapias biológicas fueron incluidos. Se describió la prevalencia de hipertensión (58.4%), diabetes (37.7%), dislipidemia (27.3%) y artritis psoriásica (23.4%). Adalimumab (ADA, 80.5%), Ustekinumab (UST, 70.1%) y Etanercept (ETA, 14.2%) fueron los biológicos más utilizados. El con mayor tiempo biológico de uso fue UST (17 meses), seguido por ADA (15.9 meses) y ETA
(13.6 meses). Conclusión: Factores como la ineficacia del tratamiento biológico y la falta de cubierta de plan médico se asociaron al fallo terapéutico con biológicos en la cohorte. No hubo asociación entre la edad, el género o las comorbilidades del paciente y la interrupción de la terapia biológica. Se necesitan estudios de poblaciones más grandes para identificar factores de riesgo asociados a la interrupción de la terapia biológica en pacientes con psoriasis. Esta información podrá guiar la selección de terapia biológica, disminuir la morbilidad asociada a la falla terapéutica y mejorar el pronóstico clínico de pacientes con psoriasis.
REFERENCIAS
1. Foster SA, Zhu B, Guo J, et al. Patient Characteristics, Health Care Re-source Utilization, and Costs Associated with Treatment-Regimen Failure with Biologics in the Treatment of Psoriasis. J Manag Care Spec Pharm. 2016;22(4):396-405. doi:10.18553/ jmcp.2016.22.4.396

2. Honda H, Umezawa Y, Kikuchi S, et al. Switching of biologics in psoriasis: Reasons and results. J Dermatol. 2017;44(9):10151019. doi:10.1111/1346-8138.13860


3. Warren RB, Smith CH, Yiu ZZN, et al. Differential Drug Survival of Biologic Therapies for the Treatment of Psoriasis: A Prospective Ob-servational Cohort Study from the British Association of Dermatolo-gists Biologic Interventions Register (BADBIR). J Invest Dermatol. 2015;135(11):2632-2640. doi:10.1038/ jid.2015.208
4. Zweegers J, van den Reek JM, van de Kerkhof PC, et al. Body mass index predicts discontinuation due to ineffectiveness and female sex predicts discontinuation due to side-effects in patients with psoriasis treated with adalimumab, etanercept or ustekinumab in daily practice: a prospective, comparative, long-term drug-survival study from the BioCAPTURE reg-istry. Br J Dermatol.
Revista Puertorriqueña de Medicina y Salud Pública 51 Revista Puertorriqueña de Medicina y Salud Pública 29
2016;175(2):340-347. doi:10.1111/bjd.14552
5. Gniadecki R, Bang B, Bryld LE, Iversen L, Lasthein S, Skov L. Comparison of long-term drug survival and safety of biologic agents in patients with psoriasis vulgaris. Br J Dermatol. 2015;172(1):244252. doi:10.1111/bjd.13343
6. Gniadecki R, Kragballe K, Dam TN, Skov L. Comparison of drug survival rates for adalimumab, etanercept and infliximab in patients with psoriasis vulgaris. Br J Dermatol. 2011;164(5):1091-1096. doi:10.1111/j.1365-2133.2011.10213.x
7. van den Reek JMPA, Kievit W, Gniadecki R, et al. Drug Survival Stud-ies in Dermatology: Principles, Purposes, and Pitfalls. J Invest Dermatol. 2015;135(7):1-5. doi:10.1038/jid.2015.171
8. Menter A, Papp KA, Gooderham M, et al. Drug survival of biologic therapy in a large, disease-based registry of patients with psoriasis: results from the Psoriasis Longitudinal Assessment and Registry (PSOLAR). J Eur Acad Dermatol Venereol. 2016;30(7):1148-1158. doi:10.1111/jdv.13611
9. Vincent FB, Morand EF, Murphy K, Mackay F, Mariette X, Marcelli C. Antidrug antibodies (ADAb) to tumour necrosis factor (TNF)-specific neutralising agents in chronic inflammatory diseases: a real issue, a clini-cal perspective. Ann Rheum Dis. 2013;72(2):165-178. doi:10.1136/an-nrheumdis-2012-202545
10. Chaparro M, Guerra I, Muñoz-Linares P, Gisbert JP. Systematic re-view: antibodies and anti-TNF-α levels in inflammatory bowel disease. Aliment Pharmacol Ther. 2012;35(9):971-986. doi:10.1111/j.1365-2036.2012.05057.x
11. Hayes J, Koo J. Psoriasis: depression, anxiety, smoking, and drinking habits. Dermatol Ther. 2010;23(2):174-180. doi:10.1111/j.15298019.2010.01312.x


12. Kimball AB, Leonardi C, Stahle M, et al. Demography, baseline disease characteristics and treatment history of patients with psoriasis enrolled in a multicenter, prospective, disease-based registry (PSOLAR). Br J Der-matol. 2014;171(1):137-147. doi:10.1111/bjd.13013
13. Heiss G, Snyder ML, Teng Y, et al. Prevalence of metabolic syndrome among Hispanics/Latinos of diverse background: the Hispanic Commu-nity Health Study/Study of Latinos. Diabetes Care. 2014;37(8):2391-2399. doi:10.2337/dc13-2505
14. Reddy SP, Lin EJ, Shah VV, Wu JJ. Persistence and failure rates of adalim-umab monotherapy in biologic-naïve patients with psoriasis: A retrospec-tive study. J Am Acad Dermatol. 2016;74(3):575577. doi:10.1016/j. jaad.2015.11.005
15. Menter A, Gordon KB, Leonardi CL, Gu Y, Goldblum OM. Efficacy and safety of adalimumab across subgroups of patients with moderate to se-vere psoriasis. J Am Acad Dermatol. 2010;63(3):448456. doi:10.1016/j. jaad.2009.09.040
16. Di Lernia V, Tasin L, Pellicano R, Zumiani G, Albertini G. Impact of body mass index on retention rates of anti-TNF-alfa drugs in daily practice for psoriasis. J Dermatolog Treat. 2012;23(6):404-409. doi:10.3109/09546 634.2011.593489
17. Di Lernia V, Ricci C, Lallas A, Ficarelli E. Clinical predictors of non-response to any tumor necrosis factor (TNF) blockers: a retrospective study. J Dermatolog Treat. 2014;25(1):73-74. doi:10.3109/09546634.2 013.800184
18. Burris JL, Studts JL, DeRosa AP, Ostroff JS. Systematic Review of To-bacco Use after Lung or Head/Neck Cancer Diagnosis: Results and Rec-ommendations for Future Research. Cancer Epidemiol Biomarkers Prev. 2015;24(10):1450-1461. doi:10.1158/1055-9965.EPI-15-0257
19. Umezawa Y, Nobeyama Y, Hayashi M, et al. Drug survival rates in patients with psoriasis after treatment with biologics. J Dermatol. 2013;40(12):1008-1013. doi:10.1111/13468138.12353
20. Griffiths CE, Strober BE, van de Kerkhof P, et al. Comparison of ustekinumab and etanercept for moderate-to-severe psoriasis. N Engl J Med. 2010;362(2):118-128. doi:10.1056/NEJMoa0810652
21. Carrascosa JM, van Doorn MB, Lahfa M, Nestle FO, Jullien D, Prinz JC. Clinical relevance of immunogenicity of biologics in psoriasis: implications for treatment strategies. J Eur Acad Dermatol Venereol. 2014;28(11):1424-1430. doi:10.1111/ jdv.12549
22. Teunissen TAM, Rotink ME, Lagro-Janssen ALM. Gender differences in quality of care experiences during hospital stay: A contribution to pa-tient-centered healthcare for both men and women. Patient Educ Couns. 2016;99(4):631-637. doi:10.1016/j.pec.2015.10.033
23. De Groot AS, Terry F, Cousens L, Martin W. Beyond humanization and de-immunization: tolerization as a method for reducing the immunoge-nicity of biologics. Expert Rev Clin Pharmacol. 2013;6(6):651-662. doi: 10.1586/17512433.2013.835698
24. Emi Aikawa N, de Carvalho JF, Artur Almeida Silva C, Bonfá E. Im-munogenicity of Anti-TNF-alpha agents in autoimmune diseases. Clin Rev Allergy Immunol. 2010;38(2-3):82-89. doi:10.1007/ s12016-009-8140-3
25. Lombardi G, Perego S, Sansoni V, Diani M, Banfi G, Altomare G. Anti-adalimumab antibodies in psoriasis: lack of clinical utility and labora-tory evidence. BMJ Open. 2016;6(12):e011941. Published 2016 Dec 9. doi:10.1136/bmjopen-2016-011941
52 Revista Puertorriqueña de Medicina y Salud Pública Revista Puertorriqueña de Medicina y Salud Pública 30

For moderate to severe rheumatoid arthritis (RA) in adult TNFi-IR patients1
For moderate to severe rheumatoid arthritis (RA) in adult TNFi-IR patients1

EXPECTATIONS
EXPECTATIONS
CHALLENGE TREATMENT GOALS IN RA WITH A ONCE-DAILY ORAL JAK INHIBITOR
CHALLENGE TREATMENT GOALS IN RA WITH A ONCE-DAILY ORAL JAK INHIBITOR
RINVOQ met primary (ACR20 or ACR50 at Week 12 or 14) and ranked secondary endpoints in clinical trials, with some patients achieving ACR20 as early as Week 1 in SELECT-BEYOND1-3,a,b
RINVOQ met primary (ACR20 or ACR50 at Week 12 or 14) and ranked secondary endpoints in clinical trials, with some patients achieving ACR20 as early as Week 1 in SELECT-BEYOND1-3,a,b
LONG-TERM REMISSION AND LOW DISEASE ACTIVITY DATA observed up to 84 weeks with or without MTX1,3-6
LONG-TERM REMISSION AND LOW DISEASE ACTIVITY DATA observed up to 84 weeks with or without MTX1,3-6
• DAS28-CRP<2.6* and DAS28-CRP≤3.2 evaluated at Week 12 or 14, with response rates from 60 to 84 weeks (in SELECT-BEYOND and SELECT-MONOTHERAPY, respectively)
• DAS28-CRP<2.6* and DAS28-CRP≤3.2 evaluated at Week 12 or 14, with response rates from 60 to 84 weeks (in SELECT-BEYOND and SELECT-MONOTHERAPY, respectively)
*Clinical remission does not mean drug-free remission or complete absence of disease activity.
Clinical remission does not mean drug-free remission or complete absence of disease activity.


LONG-TERM SAFETY DATA
AEs observed in long-term analysis with ~4.5 years maximum and ~2.6 years median exposure to RINVOQ 15 mg as of 6/30/207,a,b
LONG-TERM SAFETY DATA
AEs observed in long-term analysis with ~4.5 years maximum and ~2.6 years median exposure to RINVOQ 15 mg as of 6/30/207,a,b
• >4400 patients evaluated on upadacitinib,c with >7000 patientyears of long-term exposure to RINVOQ 15 mg as of 6/30/207,a,b
• >4400 patients evaluated on upadacitinib,c with >7000 patientyears of long-term exposure to RINVOQ 15 mg as of 6/30/207,a,b
Discover our commitment to exceptional access and patient support at RinvoqHCPPR.com
Discover our commitment to exceptional access and patient support at RinvoqHCPPR.com

a SELECT-EARLY (RA-I; MTX-naïve) [primary endpoint at Week 12: ACR50 response vs MTX, select ranked secondary endpoint at Week 24: Δ mTSS vs MTX]; SELECT-MONOTHERAPY (RA-II; MTX-IR) [primary endpoint at Week 14: ACR20 response vs MTX, select ranked secondary endpoints at Week 14: DAS28-CRP<2.6 vs MTX, DAS28-CRP≤3.2 vs MTX]; SELECT-NEXT (RA-III; csDMARD-IR) [RINVOQ + csDMARD; primary endpoint at Week 12: ACR20 response vs placebo + csDMARD]; SELECT-COMPARE (RA-IV; MTX-IR) [RINVOQ + MTX; primary endpoint at Week 12: ACR20 response vs placebo
+ MTX, select ranked secondary endpoints at Week 26: Δ mTSS vs placebo + MTX]; SELECT-BEYOND (RA-V; bDMARD-IR) [RINVOQ + csDMARD; primary endpoint at Week 12: ACR20 response vs placebo + csDMARD, select ranked secondary endpoints at Week 12: DAS28-CRP≤3.2 vs placebo + csDMARD.] 1,2 bSELECT-CHOICE (bDMARD-IR) [RINVOQ + csDMARDs; primary endpoint at Week 12: Δ DAS28-CRP (noninferiority) vs active comparator + csDMARDs]. 8 c RINVOQ 15 mg; upadacitinib 30 mg; RINVOQ 15 mg is the approved dose.1,7
INDICATION1
a SELECT-EARLY (RA-I; MTX-naïve) [primary endpoint at Week 12: ACR50 response vs MTX, select ranked secondary endpoint at Week 24: Δ mTSS vs MTX]; SELECT-MONOTHERAPY (RA-II; MTX-IR) [primary endpoint at Week 14: ACR20 response vs MTX, select ranked secondary endpoints at Week 14: DAS28-CRP<2.6 vs MTX, DAS28-CRP≤3.2 vs MTX]; SELECT-NEXT (RA-III; csDMARD-IR) [RINVOQ + csDMARD; primary endpoint at Week 12: ACR20 response vs placebo + csDMARD]; SELECT-COMPARE (RA-IV; MTX-IR) [RINVOQ + MTX; primary endpoint at Week 12: ACR20 response vs placebo + MTX, select ranked secondary endpoints at Week 26: Δ mTSS vs placebo + MTX]; SELECT-BEYOND (RA-V; bDMARD-IR) [RINVOQ + csDMARD; primary endpoint at Week 12: ACR20 response vs placebo + csDMARD, select ranked secondary endpoints at Week 12: DAS28-CRP≤3.2 vs placebo + csDMARD.] 1,2 bSELECT-CHOICE (bDMARD-IR) [RINVOQ + csDMARDs; primary endpoint at Week 12: Δ DAS28-CRP (noninferiority) vs active comparator + csDMARDs]. 8 c RINVOQ 15 mg; upadacitinib 30 mg; RINVOQ 15 mg is the approved dose.1,7
RINVOQ is indicated for the treatment of adults with moderately to severely active rheumatoid arthritis who have had an inadequate response or intolerance to one or more TNF blockers.
INDICATION1



RINVOQ is indicated for the treatment of adults with moderately to severely active rheumatoid arthritis who have had an inadequate response or intolerance to one or more TNF blockers.
Limitation of Use: Use of RINVOQ in combination with other JAK inhibitors, biologic DMARDs, or with potent immunosuppressants, such as azathioprine and cyclosporine, is not recommended.
Limitation of Use: Use of RINVOQ in combination with other JAK inhibitors, biologic DMARDs, or with potent immunosuppressants, such as azathioprine and cyclosporine, is not recommended.
SAFETY CONSIDERATIONS1
Malignancies: Lymphoma and other malignancies have been observed in RINVOQ-treated patients. A higher rate of malignancies (excluding non-melanoma skin cancer [NMSC]), lymphomas, and lung cancer (in current or past smokers) was observed with another JAK inhibitor when compared with TNF blockers in RA patients. Patients who are current or past smokers are at additional increased risk.
Malignancies: Lymphoma and other malignancies have been observed in RINVOQ-treated patients. A higher rate of malignancies (excluding non-melanoma skin cancer [NMSC]), lymphomas, and lung cancer (in current or past smokers) was observed with another JAK inhibitor when compared with TNF blockers in RA patients. Patients who are current or past smokers are at additional increased risk.
Major Adverse Cardiovascular Events: A higher rate of CV death, myocardial infarction, and stroke was observed with a JAK inhibitor in a study comparing another JAK inhibitor with TNF blockers in RA patients ≥50 years of age with at least one CV risk factor. Current or past smokers are at additional increased risk.
SAFETY CONSIDERATIONS1
Serious Infections: Patients treated with RINVOQ are at increased risk for developing serious infections that may lead to hospitalization or death. These infections include tuberculosis (TB), invasive fungal, bacterial, viral, and other infections due to opportunistic pathogens. Most patients who developed these infections were taking concomitant immunosuppressants, such as methotrexate or corticosteroids.
Serious Infections: Patients treated with RINVOQ are at increased risk for developing serious infections that may lead to hospitalization or death. These infections include tuberculosis (TB), invasive fungal, bacterial, viral, and other infections due to opportunistic pathogens. Most patients who developed these infections were taking concomitant immunosuppressants, such as methotrexate or corticosteroids.
Mortality: A higher rate of all-cause mortality, including sudden cardiovascular (CV) death, was observed with a Janus kinase (JAK) inhibitor in a study comparing another JAK inhibitor with tumor necrosis factor (TNF) blockers in rheumatoid arthritis (RA) patients ≥50 years of age with at least one CV risk factor.
Mortality: A higher rate of all-cause mortality, including sudden cardiovascular (CV) death, was observed with a Janus kinase (JAK) inhibitor in a study comparing another JAK inhibitor with tumor necrosis factor (TNF) blockers in rheumatoid arthritis (RA) patients ≥50 years of age with at least one CV risk factor.
Major Adverse Cardiovascular Events: A higher rate of CV death, myocardial infarction, and stroke was observed with a JAK inhibitor in a study comparing another JAK inhibitor with TNF blockers in RA patients ≥50 years of age with at least one CV risk factor. Current or past smokers are at additional increased risk.
Thrombosis: Thrombosis, including deep venous thrombosis, pulmonary embolism, and arterial thrombosis have occurred in patients treated with JAK inhibitors used to treat inflammatory conditions. A higher rate of thrombosis was observed with another JAK inhibitor when compared with TNF blockers in RA patients.
Thrombosis: Thrombosis, including deep venous thrombosis, pulmonary embolism, and arterial thrombosis have occurred in patients treated with JAK inhibitors used to treat inflammatory conditions. A higher rate of thrombosis was observed with another JAK inhibitor when compared with TNF blockers in RA patients.
Hypersensitivity: RINVOQ is contraindicated in patients with known hypersensitivity to upadacitinib or any of its excipients.
Hypersensitivity: RINVOQ is contraindicated in patients with known hypersensitivity to upadacitinib or any of its excipients.
Other Serious Adverse Reactions: Hypersensitivity Reactions (anaphylaxis and angioedema), Gastrointestinal Perforations, Laboratory Abnormalities (neutropenia, lymphopenia, anemia, lipid elevations, liver enzyme elevations), and Embryo-Fetal Toxicity.
Other Serious Adverse Reactions: Hypersensitivity Reactions (anaphylaxis and angioedema), Gastrointestinal Perforations, Laboratory Abnormalities (neutropenia, lymphopenia, anemia, lipid elevations, liver enzyme elevations), and Embryo-Fetal Toxicity.
Please see additional Important Safety Information, including BOXED WARNING on Serious Infections, Mortality, Malignancies, Major Adverse Cardiovascular Events, and Thrombosis, on the previous page of this advertisement.
Please see Brief Summary of full Prescribing Information on previous pages of this advertisement.
ACR=American College of Rheumatology; AEs=adverse events; bDMARD=biologic DMARD; csDMARD=conventional synthetic DMARD; DAS28-CRP=Disease Activity Score 28 joints, C-reactive protein; DMARD=disease-modifying antirheumatic drug; HAQ-DI=Health Assessment
Please see additional Important Safety Information, including BOXED WARNING on Serious Infections, Mortality, Malignancies, Major Adverse Cardiovascular Events, and Thrombosis, on the previous page of this advertisement. Please see Brief Summary of full Prescribing Information on previous pages of this advertisement.
Questionnaire Disability Index; IR=intolerance or inadequate response; JAK=Janus kinase; mTSS=modified total Sharp score; MTX=methotrexate; TNFi=tumor necrosis factor inhibitor.
ACR=American College of Rheumatology; AEs=adverse events; bDMARD=biologic DMARD; csDMARD=conventional synthetic DMARD; DAS28-CRP=Disease Activity Score 28 joints, C-reactive protein; DMARD=disease-modifying antirheumatic drug; HAQ-DI=Health Assessment Questionnaire
Index;
or inadequate response; JAK=Janus kinase; mTSS=modified total Sharp score; MTX=methotrexate;
54 Revista Puertorriqueña de Medicina y Salud Pública
TNFi=tumor necrosis factor inhibitor.
Disability
IR=intolerance
RINVOQ® (RIN-VOKE) (upadacitinib) extended-release tablets, for oral use
WARNING: SERIOUS INFECTIONS, MORTALITY, MALIGNANCY, MAJOR ADVERSE CARDIOVASCULAR EVENTS, and THROMBOSIS SERIOUS INFECTIONS
Patients treated with RINVOQ are at increased risk for developing serious infections that may lead to hospitalization or death [see Warnings and Precautions, Adverse Reactions]. Most patients who developed these infections were taking concomitant immunosuppressants such as methotrexate or corticosteroids. If a serious infection develops, interrupt RINVOQ until the infection is controlled.
Reported infections include:
• Active tuberculosis, which may present with pulmonary or extrapulmonary disease. Patients should be tested for latent tuberculosis before RINVOQ use and during therapy. Treatment for latent infection should be considered prior to RINVOQ use.
• Invasive fungal infections, including cryptococcosis and pneumocystosis.
• Bacterial, viral, including herpes zoster, and other infections due to opportunistic pathogens.
The risks and benefits of treatment with RINVOQ should be carefully considered prior to initiating therapy in patients with chronic or recurrent infection.
Patients should be closely monitored for the development of signs and symptoms of infection during and after treatment with RINVOQ, including the possible development of tuberculosis in patients who tested negative for latent tuberculosis infection prior to initiating therapy [see Warnings and Precautions]
MORTALITY
In a large, randomized, postmarketing safety study in rheumatoid arthritis (RA) patients 50 years of age and older with at least one cardiovascular risk factor comparing another Janus kinase (JAK) inhibitor to tumor necrosis factor (TNF) blockers, a higher rate of all-cause mortality, including sudden cardiovascular death, was observed with the JAK inhibitor [see Warnings and Precautions].
MALIGNANCIES
Lymphoma and other malignancies have been observed in patients treated with RINVOQ. In RA patients treated with another JAK inhibitor, a higher rate of malignancies (excluding non-melanoma skin cancer (NMSC)) was observed when compared with TNF blockers. Patients who are current or past smokers are at additional increased risk [see Warnings and Precautions]
MAJOR ADVERSE CARDIOVASCULAR EVENTS
In RA patients 50 years of age and older with at least one cardiovascular risk factor treated with another JAK inhibitor, a higher rate of major adverse cardiovascular events (MACE) (defined as cardiovascular death, myocardial infarction, and stroke), was observed when compared with TNF blockers. Patients who are current or past smokers are at additional increased risk. Discontinue RINVOQ in patients that have experienced a myocardial infarction or stroke [see Warnings and Precautions].
THROMBOSIS
Thrombosis, including deep venous thrombosis, pulmonary embolism, and arterial thrombosis have occurred in patients treated with JAK inhibitors used to treat inflammatory conditions. Many of these adverse events were serious and some resulted in death. In RA patients 50 years of age and older with at least one cardiovascular risk factor treated with another JAK inhibitor, a higher rate of thrombosis was observed when compared with TNF blockers. Avoid RINVOQ in patients at risk. Patients with symptoms of thrombosis should discontinue RINVOQ and be promptly evaluated [see Warnings and Precautions]
INDICATIONS AND USAGE
Rheumatoid Arthritis
RINVOQ® is indicated for the treatment of adults with moderately to severely active rheumatoid arthritis who have had an inadequate response or intolerance to one or more TNF blockers.
• Limitations of Use: Use of RINVOQ in combination with other JAK inhibitors, biologic disease-modifying antirheumatic drugs (DMARDs), or with potent immunosuppressants such as azathioprine and cyclosporine, is not recommended.
Psoriatic Arthritis
RINVOQ is indicated for the treatment of adults with active psoriatic arthritis who have had an inadequate response or intolerance to one or more TNF blockers.
• Limitations of Use: Use of RINVOQ in combination with other JAK inhibitors, biologic DMARDs, or with potent immunosuppressants such as azathioprine and cyclosporine, is not recommended.
Atopic Dermatitis
RINVOQ is indicated for the treatment of adults and pediatric patients 12 years of age and older with refractory, moderate to severe atopic dermatitis whose disease is not adequately controlled with other systemic drug products, including biologics, or when use of those therapies are inadvisable.
• Limitations of Use: RINVOQ is not recommended for use in combination with other JAK inhibitors, biologic immunomodulators, or with other immunosuppressants.
Ulcerative Colitis
RINVOQ is indicated for the treatment of adult patients with moderately to severely active ulcerative colitis who have had an inadequate response or intolerance to one or more TNF blockers.
• Limitations of Use: RINVOQ is not recommended for use in combination with other JAK inhibitors, biological therapies for ulcerative colitis, or with potent immunosuppressants such as azathioprine and cyclosporine.
Ankylosing Spondylitis
RINVOQ is indicated for the treatment of adults with active ankylosing spondylitis who have had an inadequate response or intolerance to one or more TNF blockers.
• Limitations of Use: Use of RINVOQ in combination with other JAK inhibitors, biologic DMARDs, or with potent immunosuppressants such as azathioprine and cyclosporine, is not recommended.
CONTRAINDICATIONS
PROFESSIONAL BRIEF SUMMARY
CONSULT PACKAGE INSERT FOR FULL PRESCRIBING INFORMATION
RINVOQ is contraindicated in patients with known hypersensitivity to upadacitinib or any of its excipients [see Warnings and Precautions].
WARNINGS AND PRECAUTIONS
Serious Infections
Serious and sometimes fatal infections have been reported in patients receiving RINVOQ. The most frequent serious infections reported with RINVOQ included pneumonia and cellulitis [see Adverse Reactions]. Among opportunistic infections, tuberculosis, multidermatomal herpes zoster, oral/esophageal candidiasis, and cryptococcosis, were reported with RINVOQ.
Avoid use of RINVOQ in patients with an active, serious infection, including localized infections. Consider the risks and benefits of treatment prior to initiating RINVOQ in patients:
• with chronic or recurrent infection
• who have been exposed to tuberculosis
• with a history of a serious or an opportunistic infection
• who have resided or traveled in areas of endemic tuberculosis or endemic mycoses; or
• with underlying conditions that may predispose them to infection. Closely monitor patients for the development of signs and symptoms of infection during and after treatment with RINVOQ. Interrupt RINVOQ if a patient develops a serious or opportunistic infection.
A patient who develops a new infection during treatment with RINVOQ should undergo prompt and complete diagnostic testing appropriate for an immunocompromised patient; appropriate antimicrobial therapy should be initiated, the patient should be closely monitored, and RINVOQ should be interrupted if the patient is not responding to antimicrobial therapy. RINVOQ may be resumed once the infection is controlled.
Tuberculosis
Evaluate and test patients for latent and active tuberculosis (TB) infection prior to administration of RINVOQ. Patients with latent TB should be treated with standard antimycobacterial therapy before initiating RINVOQ. RINVOQ should not be given to patients with active TB. Consider anti-TB therapy prior to initiation of RINVOQ in patients with previously untreated latent TB or active TB in whom an adequate course of treatment cannot be confirmed, and for patients with a negative test for latent TB but who have risk factors for TB infection.
Consultation with a physician with expertise in the treatment of TB is recommended to aid in the decision about whether initiating anti-TB therapy is appropriate for an individual patient.
During RINVOQ use, monitor patients for the development of signs and symptoms of TB, including patients who tested negative for latent TB infection prior to initiating therapy.
Viral Reactivation

Viral reactivation, including cases of herpes virus reactivation (e.g., herpes zoster) and hepatitis B virus reactivation, were reported in clinical trials with RINVOQ [see Adverse Reactions]. The risk of herpes zoster appears to be higher in patients treated with RINVOQ in Japan. If a patient develops herpes zoster, consider temporarily interrupting RINVOQ until the episode resolves. Screening for viral hepatitis and monitoring for reactivation should be performed in accordance with clinical guidelines before starting and during therapy with RINVOQ. Patients who were positive for hepatitis C antibody and hepatitis C virus RNA, were excluded from clinical trials. Patients who were positive for hepatitis B surface antigen or hepatitis B virus DNA were excluded from clinical trials. However, cases of hepatitis B reactivation were still reported in patients enrolled in the Phase 3 trials of RINVOQ. If hepatitis B virus DNA is detected while receiving RINVOQ, a liver specialist should be consulted.
Mortality
In a large, randomized, postmarketing safety study of another JAK inhibitor in RA patients 50 years of age and older with at least one cardiovascular risk factor, a higher rate of all-cause mortality, including sudden cardiovascular death, was observed in patients treated with the JAK inhibitor compared with TNF blockers.
Consider the benefits and risks for the individual patient prior to initiating or continuing therapy with RINVOQ. Malignancy and Lymphoproliferative Disorders
Malignancies, including lymphomas, were observed in clinical trials of RINVOQ [see Adverse Reactions]
In a large, randomized, postmarketing safety study of another JAK inhibitor in RA patients, a higher rate of malignancies (excluding non-melanoma skin cancer (NMSC)) was observed in patients treated with the JAK inhibitor compared to those treated with TNF blockers. A higher rate of lymphomas was observed in patients treated with the JAK inhibitor compared to those treated with TNF blockers. A higher rate of lung cancers was observed in current or past smokers treated with the JAK inhibitor compared to those treated with TNF blockers. In this study, current or past smokers had an additional increased risk of overall malignancies.
Consider the benefits and risks for the individual patient prior to initiating or continuing therapy with RINVOQ, particularly in patients with a known malignancy (other than a successfully treated NMSC), patients who develop a malignancy when on treatment, and patients who are current or past smokers.
Non-Melanoma Skin Cancer
NMSCs have been reported in patients treated with RINVOQ. Periodic skin examination is recommended for patients who are at increased risk for skin cancer.
Exposure to sunlight and UV light should be limited by wearing protective clothing and using a broad-spectrum sunscreen.
Major Adverse Cardiovascular Events
In a large, randomized, postmarketing safety study of another JAK inhibitor in RA patients 50 years of age and older with at least one cardiovascular risk factor, a higher rate of major adverse cardiovascular events (MACE) defined as cardiovascular death, non-fatal myocardial infarction (MI), and non-fatal stroke was observed with the JAK inhibitor compared to those treated with TNF blockers. Patients who are current or past smokers are at additional increased risk.
Consider the benefits and risks for the individual patient prior to initiating or continuing therapy with RINVOQ, particularly in patients who are current or past smokers and patients with other cardiovascular risk factors. Patients
should be informed about the symptoms of serious cardiovascular events and the steps to take if they occur. Discontinue RINVOQ in patients that have experienced a myocardial infarction or stroke.
Thrombosis
Thrombosis, including deep venous thrombosis (DVT), pulmonary embolism (PE), and arterial thrombosis, have occurred in patients treated for inflammatory conditions with JAK inhibitors, including RINVOQ. Many of these adverse events were serious and some resulted in death.
In a large, randomized, postmarketing safety study of another JAK inhibitor in RA patients 50 years of age and older with at least one cardiovascular risk factor, higher rates of overall thrombosis, DVT, and PE were observed compared to those treated with TNF blockers. If symptoms of thrombosis occur, patients should discontinue RINVOQ and be evaluated promptly and treated appropriately. Avoid RINVOQ in patients that may be at increased risk of thrombosis.
Hypersensitivity Reactions
Serious hypersensitivity reactions such as anaphylaxis and angioedema were reported in patients receiving RINVOQ in clinical trials. If a clinically significant hypersensitivity reaction occurs, discontinue RINVOQ and institute appropriate therapy [see Adverse Reactions].
Gastrointestinal Perforations
Gastrointestinal perforations have been reported in clinical trials with RINVOQ.
Monitor RINVOQ-treated patients who may be at risk for gastrointestinal perforation (e.g., patients with a history of diverticulitis or taking NSAIDs). Evaluate promptly patients presenting with new onset abdominal pain for early identification of gastrointestinal perforation.
Laboratory Abnormalities
Neutropenia
Treatment with RINVOQ was associated with an increased incidence of neutropenia (ANC less than 1000 cells/mm3).
Evaluate neutrophil counts at baseline and thereafter according to routine patient management. Avoid RINVOQ initiation and interrupt RINVOQ treatment in patients with a low neutrophil count (i.e., ANC less than 1000 cells/mm3).
Lymphopenia
ALC less than 500 cells/mm3 were reported in RINVOQ-treated patients in clinical trials.
Evaluate lymphocyte counts at baseline and thereafter according to routine patient management. Avoid RINVOQ initiation or interrupt RINVOQ treatment in patients with a low lymphocyte count (i.e., less than 500 cells/mm3).
Anemia
Decreases in hemoglobin levels to less than 8 g/dL were reported in RINVOQ-treated patients in clinical trials.
Evaluate hemoglobin at baseline and thereafter according to routine patient management. Avoid RINVOQ initiation or interrupt RINVOQ treatment in patients with a low hemoglobin level (i.e., less than 8 g/dL).
Lipids
Treatment with RINVOQ was associated with increases in lipid parameters, including total cholesterol, low-density lipoprotein (LDL) cholesterol, and high-density lipoprotein (HDL) cholesterol [see Adverse Reactions]
Elevations in LDL cholesterol decreased to pre-treatment levels in response to statin therapy. The effect of these lipid parameter elevations on cardiovascular morbidity and mortality has not been determined.
Assess lipid parameters approximately 12 weeks after initiation of treatment, and thereafter according to the clinical guidelines for hyperlipidemia. Manage patients according to clinical guidelines for the management of hyperlipidemia.
Liver Enzyme Elevations
Treatment with RINVOQ was associated with increased incidence of liver enzyme elevations compared to treatment with placebo.
Evaluate liver enzymes at baseline and thereafter according to routine patient management. Prompt investigation of the cause of liver enzyme elevation is recommended to identify potential cases of drug-induced liver injury.
If increases in ALT or AST are observed during routine patient management and drug-induced liver injury is suspected, RINVOQ should be interrupted until this diagnosis is excluded.
Embryo-Fetal Toxicity
Based on findings in animal studies, RINVOQ may cause fetal harm when administered to a pregnant woman. Administration of upadacitinib to rats and rabbits during organogenesis caused increases in fetal malformations. Verify the pregnancy status of patients of reproductive potential prior to starting treatment. Advise females of reproductive potential of the potential risk to the fetus and to use effective contraception during treatment with RINVOQ and for 4 weeks following completion of therapy [see Use in
Specific Populations]
Vaccinations
Avoid use of live vaccines during, or immediately prior to, RINVOQ therapy. Prior to initiating RINVOQ, it is recommended that patients be brought up to date with all immunizations, including varicella zoster or prophylactic herpes zoster vaccinations, in agreement with current immunization guidelines.
ADVERSE REACTIONS
The following clinically significant adverse reactions are described elsewhere in the labeling:
• Serious Infections [see Warnings and Precautions]
• Mortality [see Warnings and Precautions]
• Malignancy and Lymphoproliferative Disorders [see Warnings and Precautions]
• Major Adverse Cardiovascular Events [see Warnings and Precautions]
• Thrombosis [see Warnings and Precautions]
• Hypersensitivity Reactions [see Warnings and Precautions]
• Gastrointestinal Perforations [see Warnings and Precautions]
• Laboratory Abnormalities [see Warnings and Precautions]
Clinical Trials Experience
Because clinical trials are conducted under widely varying conditions, adverse reaction rates observed in the clinical trials of a drug cannot be directly compared to rates in the clinical trials of another drug and may not reflect the rates observed in practice.
56 Revista Puertorriqueña de Medicina y Salud Pública DO NOT RE-SIZE
20071734 Rinvoq PB-7.625 x 10.5(3.5).indd 1 04 May 2022 9:00 AM US-RNQR-220149
Adverse Reactions in Patients with Rheumatoid Arthritis
A total of 3833 patients with rheumatoid arthritis were treated with upadacitinib in the Phase 3 clinical trials of whom 2806 were exposed for at least one year. Patients could advance or switch to RINVOQ 15 mg from placebo, or be rescued to RINVOQ from active comparator or placebo from as early as Week 12 depending on the trial design.
A total of 2630 patients received at least 1 dose of RINVOQ 15 mg, of whom 1860 were exposed for at least one year. In trials RA-I, RA-II, RA-III and RA-V, 1213 patients received at least 1 dose of RINVOQ 15 mg, of which 986 patients were exposed for at least one year, and 1203 patients received at least 1 dose of upadacitinib 30 mg, of which 946 were exposed for at least one year.
Table 1: Adverse Reactions Reported in ≥ 1% of Rheumatoid Arthritis Patients Treated with RINVOQ 15 mg in Placebo-controlled Trials
treated with RINVOQ 15 mg monotherapy, and 4 patients (3.2 per 100 patient-years) treated with upadacitinib 30 mg monotherapy.
12-Month Exposure Dataset: Opportunistic infections were reported in 7 patients (0.6 per 100 patient-years) treated with RINVOQ 15 mg and 15 patients (1.4 per 100 patient-years) treated with upadacitinib 30 mg.
Malignancies
Placebo-controlled Trials: In RA-III, RA-IV, and RA-V, malignancies excluding NMSC were reported in 1 patient (0.4 per 100 patient-years) treated with placebo, and 1 patient (0.4 per 100 patient-years) treated with RINVOQ 15 mg. In RA-III and RA-V, malignancies excluding NMSC were reported in 0 patients treated with placebo, 1 patient (1.1 per 100 patient-years) treated with RINVOQ 15 mg, and 3 patients (3.5 per 100 patient-years) treated with upadacitinib 30 mg.
MTX-controlled Trials: Malignancies excluding NMSC were reported in 1 patient (0.8 per 100 patient-years) treated with MTX monotherapy, 3 patients (2.4 per 100 patient-years) treated with RINVOQ 15 mg monotherapy, and 0 patients treated with upadacitinib 30 mg monotherapy.
12-Month Exposure Dataset: Malignancies excluding NMSC were reported in 13 patients (1.2 per 100 patient-years) treated with RINVOQ 15 mg and 14 patients (1.3 per 100 patient-years) treated with upadacitinib 30 mg.
Gastrointestinal Perforations
Placebo-controlled Trials: There were no gastrointestinal perforations (based on medical review) reported in patients treated with placebo, RINVOQ 15 mg, and upadacitinib 30 mg.
and 0.7% of patients in the RINVOQ 15 mg and placebo groups, respectively. In RA-III and RA-V, decreases in lymphocyte counts below 500 cells/mm3 in at least one measurement occurred in 0.5% of patients treated with placebo, 0.5% of patients treated with RINVOQ 15 mg, and 2.4% of patients treated with upadacitinib 30 mg.
Anemia
In placebo-controlled trials (RA-III, RA-IV, and RA-V) with background DMARDs, for up to 12/14 weeks, hemoglobin decreases below 8 g/dL in at least one measurement occurred in <0.1% of patients in both the RINVOQ 15 mg and placebo groups. In RA-III and RA-V, hemoglobin decreases below 8 g/dL in at least one measurement were observed in 0.3% of patients treated with placebo, and none in patients treated with RINVOQ 15 mg and upadacitinib 30 mg.
Adverse Reactions in Patients with Psoriatic Arthritis
A total of 1827 patients with psoriatic arthritis were treated with upadacitinib in clinical trials representing 1639.2 patient-years of exposure, of whom 722 were exposed to upadacitinib for at least one year. In the two Phase 3 trials, 907 patients received at least 1 dose of RINVOQ 15 mg, of whom 359 were exposed for at least one year.
Two placebo-controlled trials were integrated (640 patients on RINVOQ 15 mg once daily and 635 patients on placebo) to evaluate the safety of RINVOQ 15 mg in comparison to placebo for up to 24 weeks after treatment initiation.
*URTI includes: acute sinusitis, laryngitis, nasopharyngitis, oropharyngeal pain, pharyngitis, pharyngotonsillitis, rhinitis, sinusitis, tonsillitis, viral upper respiratory tract infection
Other adverse reactions reported in less than 1% of patients in the RINVOQ 15 mg group and at a higher rate than in the placebo group through Week 12 included pneumonia, herpes zoster, herpes simplex (includes oral herpes), and oral candidiasis.
Four integrated datasets are presented in the Specific Adverse Reaction
section:
Placebo-controlled Trials: Trials RA-III, RA-IV, and RA-V were integrated to represent safety through 12/14 weeks for placebo (n=1042) and RINVOQ 15 mg (n=1035). Trials RA-III and RA-V were integrated to represent safety through 12 weeks for placebo (n=390), RINVOQ 15 mg (n=385), and upadacitinib 30 mg (n=384). Trial RA-IV did not include the 30 mg dose and, therefore, safety data for upadacitinib 30 mg can only be compared with placebo and RINVOQ 15 mg rates from pooling trials RA-III and RA-V.
MTX-controlled Trials: Trials RA-I and RA-II were integrated to represent safety through 12/14 weeks for MTX (n=530), RINVOQ 15 mg (n=534), and upadacitinib 30 mg (n=529).
12-Month Exposure Dataset: Trials RA-I, II, III, and V were integrated to represent the long-term safety of RINVOQ 15 mg (n=1213) and upadacitinib 30 mg (n=1203).
Exposure adjusted incidence rates were adjusted by trial for all the adverse events reported in this section.
Specific Adverse Reactions
Infections
Placebo-controlled Trials: In RA-III, RA-IV, and RA-V, infections were reported in 218 patients (95.7 per 100 patient-years) treated with placebo and 284 patients (127.8 per 100 patient-years) treated with RINVOQ 15 mg. In RA-III and RA-V, infections were reported in 99 patients (136.5 per 100 patient-years) treated with placebo, 118 patients (164.5 per 100 patient-years) treated with RINVOQ 15 mg, and 126 patients (180.3 per 100 patient-years) treated with upadacitinib 30 mg.
MTX-controlled Trials: Infections were reported in 127 patients (119.5 per 100 patient-years) treated with MTX monotherapy, 104 patients (91.8 per 100 patient-years) treated with RINVOQ 15 mg monotherapy, and 128 patients (115.1 per 100 patient-years) treated with upadacitinib 30 mg monotherapy.
12-Month Exposure Dataset: Infections were reported in 615 patients (83.8 per 100 patient-years) treated with RINVOQ 15 mg and 674 patients (99.7 per 100 patient-years) treated with upadacitinib 30 mg.
Serious Infections
Placebo-controlled Trials: In RA-III, RA-IV, and RA-V, serious infections were reported in 6 patients (2.3 per 100 patient-years) treated with placebo, and 12 patients (4.6 per 100 patient-years) treated with RINVOQ 15 mg. In RA-III and RA-V, serious infections were reported in 1 patient (1.2 per 100 patientyears) treated with placebo, 2 patients (2.3 per 100 patient-years) treated with RINVOQ 15 mg, and 7 patients (8.2 per 100 patient-years) treated with upadacitinib 30 mg.
MTX-controlled Trials: Serious infections were reported in 2 patients (1.6 per 100 patient-years) treated with MTX monotherapy, 3 patients (2.4 per 100 patient-years) treated with RINVOQ 15 mg monotherapy, and 8 patients (6.4 per 100 patient-years) treated with upadacitinib 30 mg monotherapy. 12-Month Exposure Dataset: Serious infections were reported in 38 patients (3.5 per 100 patient-years) treated with RINVOQ 15 mg and 59 patients (5.6 per 100 patient-years) treated with upadacitinib 30 mg.
The most frequently reported serious infections were pneumonia and cellulitis.
Tuberculosis
Placebo-controlled Trials and MTX-controlled Trials: In the placebo-controlled period, there were no active cases of tuberculosis reported in the placebo, RINVOQ 15 mg, and upadacitinib 30 mg groups. In the MTX-controlled period, there were no active cases of tuberculosis reported in the MTX monotherapy, RINVOQ 15 mg monotherapy, and upadacitinib 30 mg monotherapy groups.

12-Month Exposure Dataset: Active tuberculosis was reported for 2 patients treated with RINVOQ 15 mg and 1 patient treated with upadacitinib 30 mg.
Cases of extra-pulmonary tuberculosis were reported.
Opportunistic Infections (excluding tuberculosis)
Placebo-controlled Trials: In RA-III, RA-IV, and RA-V, opportunistic infections were reported in 3 patients (1.2 per 100 patient-years) treated with placebo, and 5 patients (1.9 per 100 patient-years) treated with RINVOQ 15 mg. In RA-III and RA-V, opportunistic infections were reported in 1 patient (1.2 per 100 patient-years) treated with placebo, 2 patients (2.3 per 100 patient-years) treated with RINVOQ 15 mg, and 6 patients (7.1 per 100 patient-years) treated with upadacitinib 30 mg.
MTX-controlled Trials: Opportunistic infections were reported in 1 patient (0.8 per 100 patient-years) treated with MTX monotherapy, 0 patients
MTX-controlled Trials: There were no cases of gastrointestinal perforations reported in the MTX and RINVOQ 15 mg group through 12/14 weeks. Two cases of gastrointestinal perforations were observed in the upadacitinib 30 mg group.
12-Month Exposure Dataset: Gastrointestinal perforations were reported in 1 patient treated with RINVOQ 15 mg and 4 patients treated with upadacitinib 30 mg.
Thrombosis
Placebo-controlled Trials: In RA-IV, venous thrombosis (pulmonary embolism or deep vein thrombosis) was observed in 1 patient treated with placebo and 1 patient treated with RINVOQ 15 mg. In RA-V, venous thrombosis was observed in 1 patient treated with RINVOQ 15 mg. There were no observed cases of venous thrombosis reported in RA-III. No cases of arterial thrombosis were observed through 12/14 weeks.
MTX-controlled Trials: In RA-II, venous thrombosis was observed in 0 patients treated with MTX monotherapy, 1 patient treated with RINVOQ 15 mg monotherapy and 0 patients treated with upadacitinib 30 mg monotherapy through Week 14. In RA-II, no cases of arterial thrombosis were observed through 12/14 weeks. In RA-I, venous thrombosis was observed in 1 patient treated with MTX, 0 patients treated with RINVOQ 15 mg and 1 patient treated with upadacitinib 30 mg through Week 24. In RA-I, arterial thrombosis was observed in 1 patient treated with upadacitinib 30 mg through Week 24.
12-Month Exposure Dataset: Venous thrombosis events were reported in 5 patients (0.5 per 100 patient-years) treated with RINVOQ 15 mg and 4 patients (0.4 per 100 patient-years) treated with upadacitinib 30 mg. Arterial thrombosis events were reported in 0 patients treated with RINVOQ 15 mg and 2 patients (0.2 per 100 patient-years) treated with upadacitinib 30 mg.
Laboratory Abnormalities
Hepatic Transaminase Elevations
In placebo-controlled trials (RA-III, RA-IV, and RA-V) with background DMARDs, for up to 12/14 weeks, alanine transaminase (ALT) and aspartate transaminase (AST) elevations ≥ 3 x upper limit of normal (ULN) in at least one measurement were observed in 2.1% and 1.5% of patients treated with RINVOQ 15 mg, and in 1.5% and 0.7% of patients treated with placebo, respectively. In RA-III and RA-V, ALT and AST elevations ≥ 3 x ULN in at least one measurement were observed in 0.8% and 1.0% of patients treated with RINVOQ 15 mg, 1.0% and 0% of patients treated with upadacitinib 30 mg and in 1.3% and 1.0% of patients treated with placebo, respectively.
In MTX-controlled trials, for up to 12/14 weeks, ALT and AST elevations ≥ 3 x ULN in at least one measurement were observed in 0.8% and 0.4% of patients treated with RINVOQ 15 mg, 1.7% and 1.3% of patients treated with upadacitinib 30 mg and in 1.9% and 0.9% of patients treated with MTX, respectively.
Lipid Elevations
Upadacitinib treatment was associated with dose-related increases in total cholesterol, triglycerides and LDL cholesterol. Upadacitinib was also associated with increases in HDL cholesterol. Elevations in LDL and HDL cholesterol peaked by Week 8 and remained stable thereafter. In controlled trials, for up to 12/14 weeks, changes from baseline in lipid parameters in patients treated with RINVOQ 15 mg and upadacitinib 30 mg, respectively, are summarized below:
• Mean LDL cholesterol increased by 14.81 mg/dL and 17.17 mg/dL.
• Mean HDL cholesterol increased by 8.16 mg/dL and 9.01 mg/dL.
• The mean LDL/HDL ratio remained stable.
• Mean triglycerides increased by 13.55 mg/dL and 14.44 mg/dL.
Creatine Phosphokinase Elevations
In placebo-controlled trials (RA-III, RA-IV, and RA-V) with background DMARDs, for up to 12/14 weeks, dose-related increases in creatine phosphokinase (CPK) values were observed. CPK elevations > 5 x ULN were reported in 1.0%, and 0.3% of patients over 12/14 weeks in the RINVOQ 15 mg and placebo groups, respectively. Most elevations >5 x ULN were transient and did not require treatment discontinuation. In RA-III and RA-V, CPK elevations > 5 x ULN were observed in 0.3% of patients treated with placebo, 1.6% of patients treated with RINVOQ 15 mg, and none in patients treated with upadacitinib 30 mg.
Neutropenia
In placebo-controlled trials (RA-III, RA-IV, and RA-V) with background DMARDs, for up to 12/14 weeks, dose-related decreases in neutrophil counts, below 1000 cells/mm3 in at least one measurement occurred in 1.1% and <0.1% of patients in the RINVOQ 15 mg and placebo groups, respectively. In RA-III and RA-V, decreases in neutrophil counts below 1000 cells/mm3 in at least one measurement occurred in 0.3% of patients treated with placebo, 1.3% of patients treated with RINVOQ 15 mg, and 2.4% of patients treated with upadacitinib 30 mg. In clinical trials, treatment was interrupted in response to ANC less than 1000 cells/mm3
Lymphopenia
In placebo-controlled trials (RA-III, RA-IV, and RA-V) with background DMARDs, for up to 12/14 weeks, dose-related decreases in lymphocyte counts below 500 cells/mm3 in at least one measurement occurred in 0.9%
Overall, the safety profile observed in patients with active psoriatic arthritis treated with RINVOQ 15 mg was consistent with the safety profile observed in patients with rheumatoid arthritis. During the 24-week placebo-controlled period, the frequencies of herpes zoster and herpes simplex were ≥1% (1.1% and 1.4%, respectively) with RINVOQ 15 mg and 0.8% and 1.3%, respectively with placebo. A higher incidence of acne and bronchitis was also observed in patients treated with RINVOQ 15 mg (1.3% and 3.9%, respectively) compared to placebo (0.3% and 2.7%, respectively).
Adverse Reactions in Patients with Atopic Dermatitis
Three Phase 3 (AD-1, AD-2, and AD-3) and one Phase 2b (AD-4) randomized, double-blind, placebo-controlled, multicenter trials evaluated the safety of RINVOQ in patients with moderate-to-severe atopic dermatitis. The majority of patients were White (68%) and male (57%). The mean age was 34 years (ranged from 12 to 75 years) and 13% of the patients were 12 to less than 18 years. In these 4 trials, 2612 patients were treated with RINVOQ 15 mg or 30 mg orally once daily, with or without concomitant topical corticosteroids (TCS).
In the Phase 3 clinical trials (AD-1, AD-2, and AD-3), a total of 1239 patients received RINVOQ 15 mg, of whom 791 were exposed for at least one year and 1246 patients received RINVOQ 30 mg, of whom 826 were exposed for at least one year.
Trials AD-1, AD-2, and AD-4 compared the safety of RINVOQ monotherapy to placebo through Week 16. Trial AD-3 compared the safety of RINVOQ + TCS to placebo + TCS through Week 16.
Weeks 0 to 16 (Trials AD-1 to AD-4)
In RINVOQ trials with and without TCS (Trials AD-1, 2, 3 and 4) through Week 16, the proportion of patients who discontinued treatment because of adverse reactions in the RINVOQ 15 mg, 30 mg and placebo groups were 2.3%, 2.9% and 3.8%, respectively. Table 2 summarizes the adverse reactions that occurred at a rate of at least 1% in the RINVOQ 15 mg or 30 mg groups during the first 16 weeks of treatment.
Table 2: Adverse Reactions Reported in ≥ 1% of Patients with Atopic Dermatitis Treated with RINVOQ 15 mg or 30 mg
* Includes: laryngitis, laryngitis viral, nasopharyngitis, oropharyngeal pain, pharyngeal abscess, pharyngitis, pharyngitis streptococcal, pharyngotonsillitis, respiratory tract infection, respiratory tract infection viral, rhinitis, rhinolaryngitis, sinusitis, tonsillitis, tonsillitis bacterial, upper respiratory tract infection, viral pharyngitis, viral upper respiratory tract infection
** Includes: acne and dermatitis acneiform
*** Includes: genital herpes, genital herpes simplex, herpes dermatitis, herpes ophthalmic, herpes simplex, nasal herpes, ophthalmic herpes simplex, herpes virus infection, oral herpes
**** Includes anaphylactic reaction, anaphylactic shock, angioedema, dermatitis exfoliative generalized, drug hypersensitivity, eyelid oedema, face oedema, hypersensitivity, periorbital swelling, pharyngeal swelling, swelling face, toxic skin eruption, type hypersensitivity, urticaria
***** Includes abdominal pain and abdominal pain upper
****** Includes herpes zoster and varicella
Revista Puertorriqueña de Medicina y Salud Pública 57 DO NOT RE-SIZE
Adverse Reaction Placebo RINVOQ 15 mg n=1042 (%) n=1035 (%) Upper respiratory tract infection (URTI)* 9.5 13.5 Nausea 2.2 3.5 Cough 1.0 2.2 Pyrexia 0 1.2
Adverse Reaction Placebo RINVOQ 15 mg RINVOQ 30 mg n=902 (%) n=899 (%) n=906 (%) Upper respiratory tract infection (URTI)* 17 23 25 Acne** 2 10 16 Herpes simplex*** 2 4 8 Headache 4 6 6 Increased blood creatine phosphokinase 2 5 6 Cough 1 3 3 Hypersensitivity**** 2 2 3 Folliculitis 1 2 3 Nausea 1 3 3 Abdominal pain***** 1 3 2 Pyrexia 1 2 2 Increased Weight 1 2 2 Herpes zoster****** 1 2 2 Influenza <1 2 2 Fatigue 1 1 2 Neutropenia <1 1 2 Myalgia 1 1 2 Influenza like illness 1 1 2
20071734 Rinvoq PB-7.625 x 10.5(3.5).indd 2 04 May 2022 9:00 AM US-RNQR-220149
Other adverse reactions reported in less than 1% of patients in the RINVOQ 15 mg and/or 30 mg group and at a higher rate than in the placebo group through Week 16 included anemia, oral candidiasis, pneumonia, and the adverse event of retinal detachment.
The safety profile of RINVOQ through Week 52 was generally consistent with the safety profile observed at Week 16.
Overall, the safety profile observed in patients with AD treated with RINVOQ was similar to the safety profile in patients with RA. Other specific adverse reactions that were reported in patients with AD included eczema herpeticum/Kaposi’s varicelliform eruption.
Eczema Herpeticum/Kaposi’s Varicelliform Eruption
Placebo-controlled Period (16 weeks): Eczema herpeticum was reported in
4 patients (1.6 per 100 patient-years) treated with placebo, 6 patients (2.2 per 100 patient-years) treated with RINVOQ 15 mg and 7 patients (2.6 per 100 patient-years) treated with RINVOQ 30 mg.
12-Month Exposure (Weeks 0 to 52): Eczema herpeticum was reported in

18 patients (1.6 per 100 patient-years) treated with RINVOQ 15 mg and
17 patients (1.5 per 100 patient-years) treated with RINVOQ 30 mg.
Adverse Reactions in Patients with Ulcerative Colitis
RINVOQ was studied up to 8 weeks in patients with moderately to severely active ulcerative colitis in two randomized, double-blind, placebo-controlled induction studies (UC-1, UC-2) and a randomized, double-blind, placebo controlled, dose-finding study (UC-4; NCT02819635). Long term safety up to 52-weeks was evaluated in patients who responded to induction therapy in a randomized, double-blind, placebo-controlled maintenance study (UC-3) and a long-term extension study.
In the two induction studies (UC-1, UC-2) and a dose finding study (UC-4), 1097 patients were enrolled of whom 719 patients received RINVOQ 45 mg once daily.
In the maintenance study (UC-3), 746 patients were enrolled of whom 250 patients received RINVOQ 15 mg once daily and 251 patients received RINVOQ 30 mg once daily.
Adverse reactions reported in ≥2% of patients in any treatment arm in the induction and maintenance studies are shown in Tables 3 and 4, respectively.
Table 3. Adverse Reactions Reported in ≥2% of Patients with Ulcerative Colitis Treated with RINVOQ 45 mg in Placebo-Controlled Induction Studies (UC-1, UC-2 and UC-4)
Specific Adverse Reactions
Serious Infections
Induction Studies: In UC-1, UC-2, and UC-4, serious infections were reported in 5 patients (8.4 per 100 patient-years) treated with placebo and 9 patients (8.4 per 100 patient-years) treated with RINVOQ 45 mg through 8 weeks. Placebo-controlled Maintenance Study: In UC-3, serious infections were reported in 8 patients (6.3 per 100 patient-years) treated with placebo, 8 patients (4.5 per 100 patient-years) treated with RINVOQ 15 mg, and 6 patients (3.1 per 100 patient-years) treated with RINVOQ 30 mg through 52 weeks.
Laboratory Abnormalities
Hepatic Transaminase Elevations
In studies UC-1, UC-2, and UC-4, elevations of ALT to ≥ 3 x ULN in at least one measurement were observed in 1.5% of patients treated with RINVOQ 45 mg, and 0% of patients treated with placebo for 8 weeks. AST elevations to ≥ 3 x ULN occurred in 1.5% of patients treated with RINVOQ 45 mg, and 0.3% of patients treated with placebo. Elevations of ALT to ≥ 5 x ULN occurred in 0.4% of patients treated with RINVOQ 45 mg and 0% of patients treated with placebo.
In UC-3, elevations of ALT to ≥ 3 x ULN in at least one measurement were observed in 4% of patients treated with RINVOQ 30 mg, 2% of patients treated with RINVOQ 15 mg, and 0.8% of patients treated with placebo for 52 weeks. Elevations of AST to ≥ 3 x ULN in at least one measurement were observed in 2% of patients treated with RINVOQ 30 mg, 1.6% of patients treated with RINVOQ 15 mg and 0.4% of patients treated with placebo. Elevations of ALT to ≥ 5 x ULN were observed in 0.8% of patients treated with 30 mg, 0.4% of patients treated with 15 mg, and 0.4% of patients treated with placebo.
Overall, laboratory abnormalities observed in patients with ulcerative colitis treated with RINVOQ were similar to those described in patients with RA. Adverse Reactions in Patients with Ankylosing Spondylitis
A total of 596 patients with ankylosing spondylitis were treated with RINVOQ 15 mg in the two clinical trials representing 577.3 patient-years of exposure, of whom 228 were exposed to RINVOQ 15 mg for at least one year.
Overall, the safety profile observed in patients with active ankylosing spondylitis treated with RINVOQ 15 mg was consistent with the safety profile observed in patients with rheumatoid arthritis and psoriatic arthritis.
During the 14-week placebo-controlled period in Trial AS-I, the frequency of headache was 5.4% with RINVOQ 15 mg and 2.1% with placebo. During the 14-week placebo-controlled period in Trial AS-II, the frequency of headache was 3.3% with RINVOQ 15 mg and 1.4% with placebo.
DRUG INTERACTIONS
Strong CYP3A4 Inhibitors
Upadacitinib exposure is increased when RINVOQ is co-administered with a strong CYP3A4 inhibitor (such as ketoconazole and clarithromycin), which may increase the risk of RINVOQ adverse reactions. Monitor patients closely for adverse reactions when co-administering RINVOQ 15 mg once daily with strong CYP3A4 inhibitors.
For patients with atopic dermatitis, coadministration of RINVOQ 30 mg once daily with strong CYP3A4 inhibitors is not recommended.
For patients with ulcerative colitis taking strong CYP3A4 inhibitors, reduce the RINVOQ induction dosage to 30 mg once daily. The recommended maintenance dosage is 15 mg once daily.
Strong CYP3A4 Inducers
15 mg dose, 0.9 times the 30 mg dose, and 0.6 times the MRHD (on an AUC basis at maternal oral doses of 5 mg/kg/day and higher). Additional skeletal malformations (bent forelimbs/hindlimbs and rib/vertebral defects) and decreased fetal body weights were observed in the absence of maternal toxicity at an exposure approximately 84 times the 15 mg dose, 43 times the 30 mg dose, and 31 times the MRHD (on an AUC basis at a maternal oral dose of 75 mg/kg/day).
In a second oral embryo-fetal development study, pregnant rats received upadacitinib at doses of 1.5 and 4 mg/kg/day during the period of organogenesis from gestation day 6 to 17. Upadacitinib was teratogenic (skeletal malformations that included bent humerus and scapula) at exposures approximately 1.6 times the 15 mg dose, 0.8 times the 30 mg dose, and 0.6 times the MRHD (on an AUC basis at maternal oral doses of 4 mg/kg/day). No developmental toxicity was observed in rats at an exposure approximately 0.29 times the 15 mg dose, 0.15 times the 30 mg dose, and 0.11 times the MRHD (on an AUC basis at a maternal oral dose of 1.5 mg/kg/day).
In an oral embryo-fetal developmental study, pregnant rabbits received upadacitinib at doses of 2.5, 10, and 25 mg/kg/day during the period of organogenesis from gestation day 7 to 19. Embryolethality, decreased fetal body weights, and cardiovascular malformations were observed in the presence of maternal toxicity at an exposure approximately 15 times the 15 mg dose, 7.6 times the 30 mg dose, and 5.6 times the MRHD (on an AUC basis at a maternal oral dose of 25 mg/kg/day). Embryolethality consisted of increased post-implantation loss that was due to elevated incidences of both total and early resorptions. No developmental toxicity was observed in rabbits at an exposure approximately 2.2 times the 15 mg dose, 1.1 times the 30 mg dose, and 0.82 times the MRHD (on an AUC basis at a maternal oral dose of 10 mg/kg/day).
In an oral pre- and post-natal development study, pregnant female rats received upadacitinib at doses of 2.5, 5, and 10 mg/kg/day from gestation day 6 through lactation day 20. No maternal or developmental toxicity was observed in either mothers or offspring, respectively, at an exposure approximately 3 times the 15 mg dose, 1.4 times the 30 mg dose, and at approximately the same exposure as the MRHD (on an AUC basis at a maternal oral dose of 10 mg/kg/day).
Lactation
Risk Summary
There are no data on the presence of upadacitinib in human milk, the effects on the breastfed infant, or the effects on milk production. Available pharmacodynamic/toxicological data in animals have shown excretion of upadacitinib in milk (see Data). When a drug is present in animal milk, it is likely that the drug will be present in human milk. Because of the potential for serious adverse reactions in the breastfed infant, advise patients that breastfeeding is not recommended during treatment with RINVOQ, and for 6 days (approximately 10 half-lives) after the last dose.
Data
A single oral dose of 10 mg/kg radiolabeled upadacitinib was administered to lactating female Sprague-Dawley rats on post-partum days 7-8. Drug exposure was approximately 30-fold greater in milk than in maternal plasma based on AUC0-t values. Approximately 97% of drug-related material in milk was parent drug.
Females and Males of Reproductive Potential
Pregnancy Testing
Verify the pregnancy status of females of reproductive potential prior to starting treatment with RINVOQ [see Use in Specific Populations]
* Composed of several similar terms
** Elevated liver enzymes composed of elevated ALT, AST, GGT, ALP, liver transaminases, hepatic enzymes, bilirubin, drug-induced liver injury and cholestasis.
Other adverse reactions reported in less than 2% of patients in the RINVOQ 45 mg group and at a higher rate than in the placebo group through Week 8 included herpes zoster and pneumonia.
Table 4. Adverse Reactions Reported in ≥2% of Patients with Ulcerative Colitis Treated with RINVOQ 15 mg or 30 mg in the Placebo-Controlled Maintenance Study (UC-3)1
Upadacitinib exposure is decreased when RINVOQ is co-administered with strong CYP3A4 inducers (such as rifampin), which may lead to reduced therapeutic effect of RINVOQ. Coadministration of RINVOQ with strong CYP3A4 inducers is not recommended.
USE IN SPECIFIC POPULATIONS
Pregnancy
Risk Summary
Available data from the pharmacovigilance safety database and postmarketing case reports on use of RINVOQ in pregnant women are not sufficient to evaluate a drug-associated risk for major birth defects or miscarriage. Based on animal studies, RINVOQ has the potential to adversely affect a developing fetus. Advise patients of reproductive potential and pregnant patients of the potential risk to the fetus.
In animal embryo-fetal development studies, oral upadacitinib administration to pregnant rats and rabbits at exposures equal to or greater than approximately 1.6 and 15 times the 15 mg dose, 0.8 and 7.6 times the 30 mg dose, and 0.6 and 5.6 times the maximum recommended human dose (MRHD) of 45 mg (on an AUC basis) resulted in dose-related increases in skeletal malformations (rats only), an increased incidence of cardiovascular malformations (rabbits only), increased post-implantation loss (rabbits only), and decreased fetal body weights in both rats and rabbits. No developmental toxicity was observed in pregnant rats and rabbits treated with oral upadacitinib during organogenesis at exposures approximately 0.29 and 2.2 times the 15 mg dose, 0.15 times and 1.1 times the 30 mg dose, and at 0.11 and 0.82 times the MHRD (on an AUC basis).
In a pre- and post-natal development study in pregnant female rats, oral upadacitinib administration at exposures approximately 3 times the 15 mg dose, 1.4 times the 30 mg dose, and the same as the MRHD (on an AUC basis) resulted in no maternal or developmental toxicity (see Data)
The background risks of major birth defects and miscarriage for the indicated populations are unknown. All pregnancies have a background risk of birth defect, loss, or other adverse outcomes. In the U.S. general population, the estimated background risk of major birth defects and miscarriages are 2-4% and 15-20%, respectively. Report pregnancies to the AbbVie Inc.’s Adverse Event reporting line at 1-888-633-9110, or FDA at 1-800-FDA-1088 or www.fda.gov/medwatch.
Clinical Considerations
Disease-Associated Maternal and/or Embryo/Fetal Risk
1 Patients who were responders to 8 weeks induction therapy with RINVOQ 45 mg once daily
* Composed of several similar terms
** Elevated liver enzymes composed of elevated ALT, AST, GGT, ALP, liver transaminases, hepatic enzymes, bilirubin, drug-induced liver injury, and cholestasis.
The safety profile of RINVOQ in the long-term extension study was similar to the safety profile observed in the placebo-controlled induction and maintenance periods.
Overall, the safety profile observed in patients with ulcerative colitis treated with RINVOQ was generally similar to the safety profile in patients with RA and AD.
Published data suggest that increased disease activity is associated with the risk of developing adverse pregnancy outcomes in women with rheumatoid arthritis or ulcerative colitis. Adverse pregnancy outcomes include preterm delivery (before 37 weeks of gestation), low birth weight (less than 2500 g) infants, and small for gestational age at birth.
Data
Animal Data
In an oral embryo-fetal development study, pregnant rats received upadacitinib at doses of 5, 25, and 75 mg/kg/day during the period of organogenesis from gestation day 6 to 17. Upadacitinib was teratogenic (skeletal malformations that consisted of misshapen humerus and bent scapula) at exposures equal to or greater than approximately 1.7 times the
Contraception
Females
Based on animal studies, upadacitinib may cause embryo-fetal harm when administered to pregnant women [see Use in Specific Populations]. Advise female patients of reproductive potential to use effective contraception during treatment with RINVOQ and for 4 weeks after the final dose.
Pediatric Use
Juvenile Idiopathic Arthritis, Psoriatic Arthritis, and Ankylosing Spondylitis
The safety and effectiveness of RINVOQ in pediatric patients with juvenile idiopathic arthritis, psoriatic arthritis, and ankylosing spondylitis have not been established.
Atopic Dermatitis
The safety and effectiveness of RINVOQ in pediatric patients 12 years of age and older weighing at least 40 kg with atopic dermatitis have been established. A total of 344 pediatric patients aged 12 to 17 years with moderate to severe atopic dermatitis were randomized across three trials (AD-1, AD-2 and AD-3) to receive either RINVOQ 15 mg (N=114) or 30 mg (N=114) or matching placebo (N=116) in monotherapy or combination with topical corticosteroids. Efficacy was consistent between the pediatric patients and adults. The adverse reaction profile in the pediatric patients was similar to the adults [see Adverse Reactions].
The safety and effectiveness of RINVOQ in pediatric patients less than 12 years of age with atopic dermatitis have not been established.
Ulcerative Colitis
The safety and effectiveness of RINVOQ in pediatric patients with ulcerative colitis have not been established.
Geriatric Use
Rheumatoid Arthritis and Psoriatic Arthritis
Of the 4381 patients treated in the five clinical trials, a total of 906 rheumatoid arthritis patients were 65 years of age or older, including 146 patients 75 years and older. Of the 1827 patients treated in the two psoriatic arthritis Phase 3 clinical trials, a total of 274 patients were 65 years of age or older, including 34 patients 75 years and older. No differences in effectiveness were observed between these patients and younger patients; however, there was a higher rate of overall adverse events, including serious infections, in patients 65 years of age and older.
Atopic Dermatitis
Of the 2583 patients treated in the three Phase 3 clinical trials, a total of 120 patients with atopic dermatitis were 65 years of age or older, including 6 patients 75 years of age. No differences in effectiveness were observed between these patients and younger patients; however, there was a higher rate of serious infections and malignancies in those patients 65 years of age or older in the 30 mg dosing group in the long-term trials.
Ulcerative Colitis
Of the 1097 patients treated in the controlled clinical trials, a total of 95 patients with ulcerative colitis were 65 years and older. Clinical studies of RINVOQ did not include sufficient numbers of patients 65 years of age and older with ulcerative colitis to determine whether they respond differently from younger adult patients.
58 Revista Puertorriqueña de Medicina y Salud Pública DO NOT RE-SIZE
Adverse Reaction Placebo RINVOQ 45 mg Once Daily N= 378 (%) N = 719 (%) Upper respiratory tract infection* 7 9 Acne* 1 6 Increased blood creatine phosphokinase 1 5 Neutropenia* <1 5 Rash* 1 4 Elevated liver enzymes** 2 3 Lymphopenia* 1 3 Folliculitis 1 2 Herpes simplex* <1 2
Adverse Reaction Placebo RINVOQ 15 mg Once Daily RINVOQ 30 mg Once Daily n = 245 (%) n = 250 (%) n = 251 (%) Upper respiratory tract infection* 18 16 20 Increased blood creatine phosphokinase 2 6 8 Neutropenia* 2 3 6 Elevated liver enzymes** 1 6 4 Rash* 4 5 5 Herpes zoster 0 4 4 Folliculitis 2 2 4 Hypercholesterolemia* 1 2 4 Influenza 1 3 3 Herpes simplex* 1 2 3 Lymphopenia* 2 3 2 Hyperlipidemia* 0 2 2
20071734 Rinvoq PB-7.625 x 10.5(3.5).indd 3 04 May 2022 9:00 AM US-RNQR-220149
Renal Impairment
For patients with rheumatoid arthritis, psoriatic arthritis, and ankylosing spondylitis, no dosage adjustment is needed in patients with mild (eGFR 60 to < 90 mL/min/1.73 m2), moderate (eGFR 30 to < 60 mL/min/1.73 m2), or severe renal impairment (eGFR 15 to < 30 mL/min/1.73 m2). For patients with atopic dermatitis, the maximum recommended dosage is 15 mg once daily for patients with severe renal impairment. No dosage adjustment is needed in patients with mild or moderate renal impairment. For patients with ulcerative colitis, the recommended dosage for severe renal impairment is 30 mg once daily for induction and 15 mg once daily for maintenance. No dosage adjustment is needed in patients with mild or moderate renal impairment.
RINVOQ has not been studied in patients with end stage renal disease (eGFR <15 mL/min/1.73m2). Use in patients with atopic dermatitis or ulcerative colitis with end stage renal disease is not recommended.
Hepatic Impairment
The use of RINVOQ has not been studied in patients with severe hepatic impairment (Child Pugh C), and therefore not recommended for use in patients with rheumatoid arthritis, psoriatic arthritis, atopic dermatitis, ulcerative colitis, or ankylosing spondylitis.
For patients with rheumatoid arthritis, psoriatic arthritis, atopic dermatitis, and ankylosing spondylitis, no dosage adjustment is needed in patients with mild (Child Pugh A) or moderate (Child Pugh B) hepatic impairment. For patients with ulcerative colitis, the recommended dosage for mild to moderate hepatic impairment is 30 mg once daily for induction and 15 mg once daily for maintenance
PATIENT COUNSELING INFORMATION
Advise the patient to read the FDA-approved patient labeling (Medication Guide).
Serious Infections
Inform patients that they may be more likely to develop infections when taking RINVOQ. Instruct patients to contact their healthcare provider immediately during treatment if they develop any signs or symptoms of an infection [see Warnings and Precautions]
Advise patients that the risk of herpes zoster is increased in patients taking RINVOQ and in some cases can be serious [see Warnings and Precautions]
Malignancies
Inform patients that RINVOQ may increase their risk of certain cancers and that periodic skin examinations should be performed while using RINVOQ. Advise patients that exposure to sunlight and UV light should be limited by wearing protective clothing and using a broad-spectrum sunscreen [see Warnings and Precautions]
Major Adverse Cardiovascular Events
Inform patients that RINVOQ may increase their risk of major adverse cardiovascular events (MACE) including myocardial infarction, stroke,
and cardiovascular death. Instruct all patients, especially current or past smokers or patients with other cardiovascular risk factors, to be alert for the development of signs and symptoms of cardiovascular events [see Warnings and Precautions]
Thrombosis
Inform patients that events of deep venous thrombosis and pulmonary embolism have been reported in clinical trials with RINVOQ. Instruct patients to seek immediate medical attention if they develop any signs or symptoms of a DVT or PE [see Warnings and Precautions]
Hypersensitivity Reactions
Advise patients to discontinue RINVOQ and seek immediate medical attention if they develop any signs and symptoms of allergic reactions [see Warnings and Precautions].
Gastrointestinal Perforations
Inform patients that gastrointestinal perforations have been reported in clinical trials with RINVOQ and that risk factors include the use of NSAIDS or history of diverticulitis. Instruct patients to seek medical care immediately if they experience new onset of abdominal pain, fever, chills, nausea, or vomiting [see Warnings and Precautions].
Retinal Detachment

Inform patients that retinal detachment has been reported in clinical trials with RINVOQ. Advise patients to immediately inform their healthcare provider if they develop any sudden changes in vision while receiving RINVOQ [see Adverse Reactions]
Laboratory Abnormalities
Inform patients that RINVOQ may affect certain lab tests, and that blood tests are required before and during RINVOQ treatment [see Warnings and Precautions]
Vaccinations
Advise patients to avoid use of live vaccines with RINVOQ. Instruct patients to inform their healthcare practitioner that they are taking RINVOQ prior to a potential vaccination [see Warnings and Precautions]
Embryo-Fetal Toxicity
Advise pregnant women and females of reproductive potential that exposure to RINVOQ during pregnancy may result in fetal harm. Advise females to inform their healthcare provider of a known or suspected pregnancy [see Warnings and Precautions and Use in Specific Populations]
Advise females of reproductive potential that effective contraception should be used during treatment and for 4 weeks following the final dose of upadacitinib [see Use in Specific Populations]
Advise females patients who are exposed to RINVOQ during pregnancy to contact AbbVie Inc. at 1-800-633-9110 or FDA at 1-800-FDA-1088 or www.fda.gov/medwatch.
Lactation
Advise women not to breastfeed during treatment with RINVOQ and for 6 days after the last dose [see Use in Specific Populations]
Administration
Advise patients not to chew, crush, or split RINVOQ tablets. Manufactured by: AbbVie Inc., North Chicago, IL 60064, USA
RINVOQ® is a registered trademark of AbbVie Biotechnology Ltd.
©2019-2022 AbbVie Inc.
Ref: 20071734 Revised: April 2022
LAB-7082 MASTER
US-RNQR-220149
Revista Puertorriqueña de Medicina y Salud Pública 59 DO NOT RE-SIZE
20071734 Rinvoq PB-7.625 x 10.5(3.5).indd 4 04 May 2022 9:00 AM US-RNQR-220149
ESQUIZOFRENIA: LA ENFERMEDAD QUE TODOS CONOCEN, PERO NO TODOS ENTIENDEN
Palabras claves: Esquizofrenia, Salud Mental, Psicosis

La Esquizofrenia es una de las condiciones que mayor atención necesita, ya que presenta múltiples comorbilidades y una necesidad de tratamiento de por vida. Intervenciones tempranas pudieran ayudar a mejorar la calidad de vida de nuestros pacientes. Existen diversos tratamientos que pudieran ayudar a disminuir las exacerbaciones. Con estos tratamientos, podemos minimizar el estigma que rodea a nuestros pacientes. Es responsabilidad de todos nosotros educarnos y trabajar en equipo en beneficio de los pacientes diagnosticados con Esquizofrenia.
INTRODUCCIÓN
Con una simple búsqueda en el internet podemos encontrar abundante información sobre este diagnóstico. No obstante, nuestros pacientes con Esquizofrenia son de los que mayor discrimen sufren en nuestra sociedad. Desde cobertura en los medios noticiosos, hasta la dificultad que experimentan para obtener igualdad de servicios, los retos a los que se enfrentan son muchos. Aun presentando menos de un 1% de nuestra sociedad, es uno de los diagnósticos que las personas más conocen.
Con esto en mente, nos toca a nosotros poder compartir y educar a la sociedad sobre lo que verdaderamente representa. No todas las personas que son agresivas ni que odian padecen de este diagnóstico. En cambio, la mayoría de estos pacientes no tienden a ser agresivos. Hablemos un poco sobre como poder diagnosticar y manejar a nuestros pacientes con Esquizofrenia.
DIAGNÓSTICO
La Esquizofrenia es una enfermedad psiquiátrica crónica y debilitante que puede incluir un sentido

60 Revista Puertorriqueña de Medicina y Salud Pública
alterado de la realidad, ideas delirantes, alucinaciones, conducta y pensamientos desorganizados, un patrón de aislamiento, y disminución en expresiones de emoción. Esta percepción alterada de la realidad es definida como un proceso psicótico, pero hay otros diagnósticos que pudieran presentar con psicosis, como lo son el Trastorno Bipolar y la Depresión Mayor Severa. Es importante reconocer los síntomas afectivos que predominan en estas dos condiciones para poder diferenciarlas de Esquizofrenia. Este patrón conductual se puede comenzar a percibir mayormente desde los 15
 Joalex Antongiorgi Torres, MD Psiquiatra General, Board Certified Psiquiatra Niños y Adolescentes, Board Certified Profesor Asociado Departamento de Psiquiatría Escuela de Medicina, UPR
Joalex Antongiorgi Torres, MD Psiquiatra General, Board Certified Psiquiatra Niños y Adolescentes, Board Certified Profesor Asociado Departamento de Psiquiatría Escuela de Medicina, UPR


a 25 años en los varones y entre los 25 a 35 años en las féminas, con una distribución bastante similar en ambos sexos. Esto no excluye que se pueda diagnosticar de manera temprana o de manera tardía en algunos pacientes, aunque no es muy común.
Con respecto a los síntomas, debemos recordar que los mismos merecen una evaluación psiquiátrica enfocada para poder diferenciar de otros diagnósticos relacionados, utilizando las guías establecidas por el DSM (Manual Diagnóstico y Estadístico de Trastornos Mentales). El uso de algunas sustancias, como lo son la cocaína o los estimulantes, pueden provocar síntomas muy relacionados. Estos pacientes en la fase de intoxicación aguda pueden presentar paranoia severa que causa una disfunción social y personal marcada. Debido a esto, al menos
dos o más de estos síntomas se deben presentar por al menos un mes en la ausencia de otras condiciones médicas o uso de sustancias que pudieran presentar síntomas relacionados. Adicional, uno de estos síntomas debe ser las ideas delirantes, alucinaciones o el hablar desorganizado. En nuestra cultura, muchos pacientes refieren que escuchan que los llaman o que ven un celaje por momentos. Parte de nuestra evaluación debe ser reconocer que las alucinaciones de la Esquizofrenia tienden a ser derogatorias y continuas, provocando un sentido de ansiedad y tristeza en el paciente. Esto pudiera incluso llevar a la persona a considerar el suicidio como alternativa ante la frustración y la desesperanza.
FACTORES DE RIESGO
Hasta este momento, no tenemos
Revista Puertorriqueña de Medicina y Salud Pública 61
una causa directa de establecer la razón por la cual un paciente pudiera desarrollar Esquizofrenia. Podemos reconocer algunos factores de riesgo, pero esta enfermedad es multifactorial. Hay una correlación con los meses de nacimiento, ya que un parto en el invierno o primavera se ha visto relacionado con un aumento en este diagnóstico, debido a que son meses en los que la influenza prevalece. Algunos estudios han hecho la relación con influenza maternal como un factor relacionado, pero no es una relación exclusiva y directa. También encontramos edad avanzada de padre, el “stress”, infecciones, malnutrición, uso de sustancias y factores genéticos. Ninguno de estos factores por su cuenta se ha encontrado que pueda predisponer a la enfermedad, pero es importante reconocerlos para tratar de minimizarlos en personas que tienen riesgo. Por ejemplo, un paciente que presenta con historial familiar de Esquizofrenia en su familia se beneficiaría grandemente de orientación para la prevención del uso de sustancias y manejo de ansiedad.
de manera intramuscular para poder considerar formulaciones de liberación prolongada, para fomentar un mejor cumplimiento con el régimen establecido. No obstante, puede ser que el presentar una situación de alta tensión sea suficiente para que el paciente tenga una exacerbación de síntomas y requiera hospitalización para manejo agudo. En casos de pacientes que no respondan a tratamiento, se pudiera considerar la Terapia Electroconvulsiva como una alternativa. Estos pacientes requieren que se administre anestesia para poder aplicar una corriente eléctrica que estimule ciertas partes del cerebro, lo cual provoca una breve convulsión. Es de suma importancia que una persona adiestrada en Terapia Electroconvulsiva provea la orientación y sea quien administre este procedimiento.
PROGNOSIS
utilizar sustancias (como el alcohol, cannabis y cigarrillos) para manejar sus síntomas, y puede incurrir en acciones peligrosas que afecten su bienestar. Adicional, los propios medicamentos antipsicóticos pudieran causar síndrome metabólico. Por estas razones y por su funcionamiento afectado, cerca de un 10% de los pacientes con Esquizofrenia pueden completar un suicidio, por lo que es importante que se brinde seguimiento y tratamiento individualizado para evitar que nuestros pacientes experimenten frustración marcada y pierdan la esperanza en la vida.
REFERIDOS
TRATAMIENTO
Una vez se realiza el diagnóstico, se debe establecer de por vida un tratamiento individualizado. Es una de las condiciones más incapacitantes del mundo y amerita poder establecer un grupo de apoyo que respalde al paciente. Esto incluye el poder ayudar a la familia, ya que pueden sentir la quemazón del cuidador ante las situaciones que tuvieran que manejar. Por lo tanto, intervenciones que incluyan a toda la familia deben ser consideradas. Algunas terapias que se consideran son la de Destrezas Sociales, Terapia de Familia, Terapia Individual y Rehabilitación Vocacional. Estas deben ir de la mano con el uso de antipsicóticos, muchas veces considerando administrarlos
REFERENCIAS
American Psychiatric Association. (2022). Diagnostic and Statistical Manual of Mental Disorders. (5th Edition). Washington, DC.
Brown, A.S., Patterson, P.H. (2011).
Los pacientes con Esquizofrenia sin tratamiento no tendrán calidad de vida. El cumplimiento con el tratamiento y el apoyo familiar son dos factores vitales para poder establecer un pronóstico. Algunos tendrán episodios de exacerbación de síntomas, mientras que otros tendrán un deterioro progresivo y constante. Con el tratamiento adecuado, el impacto en el funcionamiento se puede minimizar y los pacientes pueden llegar a mantener vidas funcionales. Intervenciones a tiempo pueden llegar a ser la diferencia en nuestros pacientes para lograr una mejor calidad de vida.
El estado físico de estos pacientes se puede ver afectado por dos maneras: el uso de medicamentos de manera crónica y el descuido personal que ocurre con las exacerbaciones agudas. El riesgo mayor presentado es de enfermedades vasculares. Una persona con psicosis aguda no se alimenta bien, no se da seguimiento de sus condiciones primarias, puede
Puerto Rico cuenta con dos programas que apoyan a pacientes que experimentan su primer episodio psicótico. El Programa PORTI en el Recinto de Ciencias Médicas y el Programa PROCCER en Mayagüez. Estos programas atienden pacientes de 16 a 35 años y trabajan para lograr su integración a la comunidad de manera funcional. El contacto para San Juan es 787-600-3115 o por su correo electrónico porti.rcm@ upr.edu y en Mayagüez es 787-8330663 en las extensiones 297 y 238. Adicional, si el paciente así lo desea o no cualifica para estos programas, se recomienda que tenga evaluación por un psiquiatra que pueda liderar el equipo de especialistas que nuestros pacientes necesitarán. La comunicación entre psicólogos, trabajadores sociales, profesores, terapistas, y los especialistas médicos pudiera ser un factor determinante en la recuperación de nuestros pacientes. Por último, a cada paciente siempre se le debe orientar de la Línea PAS (1-800-981-0023) y la línea de emergencia 9-8-8, las cuales funcionan las 24 horas del día y los 7 días de la semana.
Maternal Infection and Schizophrenia. Implications for Prevention. Schizophrenia Bulletin .37(2):284-290.

National Institute of Mental Health (NIH).
Schizophrenia Reviewed 2022.
Oficina de Calidad de la Administración de Servicios de Salud y Contra la Adicción (ASSMCA): Primer Episodio Psicótico.
62 Revista Puertorriqueña de Medicina y Salud Pública
CONDICIONES ASOCIADAS A LA GLÁNDULA DE TIROIDES
La tiroides es una glándula que descansa en la parte baja del cuello. Su función es producir la hormona tiroidea, la cual regula todos los mecanismos del cuerpo, como la presión arterial, la digestión, el ritmo cardiaco, las funciones del sistema nervioso central, el ánimo, el sueño, entre otros.
Las enfermedades tiroideas son muchas, pero se pueden clasificar en 5 categorías de manera general:
• Hipotiroidismo: Condición en la cual la glándula tiroides no produce suficiente hormona tiroidea.
• Hipertiroidismo: Condición en la cual hay exceso de hormona tiroidea en la sangre.
• Bocio: Agrandamiento de la glándula tiroides.
• Nódulos tiroideos: Crecimientos anormales en la glándula tiroides que pueden ser benignos o malignos.
• Cáncer de tiroides
El primer paso para determinar el tipo de diagnóstico de una enfermedad tiroidea es realizar una evaluación clínica completa, que debe incluir una historia clínica y un examen físico detallado.También, se pueden solicitar pruebas de laboratorio en sangre para medir los niveles de hormonas tiroideas. Una vez se han recopilado todos los datos, el médico podrá determinar la necesidad de realizar pruebas adicionales.
El hipertiroidismo y el hipotiroidismo se pueden diagnosticar a través de pruebas de función tiroidea. Las pruebas más comunes son la medición de la hormona estimulante de la tiroides (TSH) y los niveles de hormonas tiroideas libres (T4 y T3). En el hipertiroidismo primario, los niveles de T4 y T3 en sangre suelen estar altos y el nivel de TSH bajo, mientras que en el hipotiroidismo, los niveles de T4 en sangre suelen estar bajos y el nivel de TSH alto.
Para determinar si un paciente tiene bocio, se pueden realizar varias pruebas y exámenes, que pueden incluir:
Dra. Nicolle Canales Ramos, MD

Endocrinóloga

• Examen físico: El médico puede examinar el cuello del paciente para detectar si hay un agrandamiento de la tiroides o un bulto en la zona.
• Ecografía tiroidea: Una ecografía puede evaluar el tamaño de la glándula tiroides, así como su estructura y la presencia de nódulos o masas.
Algunos consejos generales que pueden ayudar a los pacientes con condiciones tiroideas a mantener una buena calidad de vida, incluyen:
Tomar medicamentos según lo prescrito
• Seguir una dieta saludable
• Hacer ejercicio regularmente
• Asegurar sus horas de sueño
• Evitar el estrés excesivo
Es importante recordar que cada persona es única y que la mejor manera de mantener una buena calidad de vida con una condición de tiroides es trabajar con su médico para desarrollar un plan de tratamiento personalizado que se adapte a sus necesidades individuales.
Revista Puertorriqueña de Medicina y Salud Pública 63

64 Revista Puertorriqueña de Medicina y Salud Pública


Revista Puertorriqueña de Medicina y Salud Pública 65

66 Revista Puertorriqueña de Medicina y Salud Pública

Revista Puertorriqueña de Medicina y Salud Pública 67
LA CARDIOLOGÍA EN PUERTO RICO, UN SIGLO DE HISTORIA

Podriamos decir que la cardiología en Puerto Rico comienza en Ponce cuando el Dr. Manuel de la Pila Iglesias trae a la isla el primer electrocardiógrafo en 1922. Médicos puertorriqueños comienzan a practicar cardiología con el uso de éste primer equipo. Sin embargo, no es hasta una década después cuando el Dr. Antonio Fernós Isern , primer cardiólogo puertorrriqueño, entrenado en el Medical Center de la Universidad de Columbia en Nueva York, regresa a la isla en 1933. El Dr. Fernós fué además Secretario del Departamento de Salud, Comisionado Residente y Senador.

La década de 1940 marca un significativo desarrollo de la cardiología

PRIMEROS CINCUENTA ANOS
puertorriqueña con la llegada de los primeros cardiológos puertorriqueños entrenados en Estados Unidos: Dr. Carlos Timothee, Dr. Dwight Santiago Stevenson, Dr. Roberto Francisco, Dr. José N. Gándara, Dr. Rurico Díaz Rivera, Dr. Ramón M. Suárez Calderón. Es en 1948 cuando el Dr. Díaz Rivera se convierte en el primer cardiólogo puertorriqueño en aprobar los exámenes de la American Board of Cardiovascular Diseases, un logro histórico.


En 1949 se crea la Sección de Cardiología de la Asociación Médica de Puerto Rico y es el Dr. Ramón M. Suárez Calderón su primer presidente. El Dr. Suárez fue el primer fellow del American College of Cardiology en



Puerto Rico en 1951. Además el Dr. Suárez es el segundo puertorriqueño en aprobar los examénes del American Board of Cardiovascular Disease en 1949.
La década de 1950 tiene un significativo suceso para la medicina en P.R. con la creación de la Escuela de Medicina de la Universidad de Puerto Rico. Además marca un significativo crecimiento para la cardiología puertorriqueña con la llegada de cardiólogos formalmente entrenados en Estados Unidos que se integran a la facultad de la nueva escuela: Dr. Ernesto J. Marchand, Dr. Eli A. Ramírez, Rodriguez. La Asociación Puetorriqueña del Corazón, organizada en el 1950

68 Revista Puertorriqueña de Medicina y Salud Pública
Las fotos que acompañan el siguiente reportaje fueron enviadas a la Revista Puertorriqueña de Medicina y Salud Pública por el Dr. Mario García Palmieri(QDP) en ocasión de publicarse su artículo en torno a los 20 años de fundación del Centro Cardiovascular de Puerto Rico y el Caribe.
por el Dr. Roberto Francisco, jugó un crucial papel protagónico en el establecimiento del primer laboratorio cardiopulmonar en 1955 ubicado en el Viejo Hospital Municipal de San Juan. El Dr. Mario Rubén García Palmieri, graduado de la Escuela de Medicina de Maryland regresa en 1951. Es el primer fellow de cardiología entrenado en P.R. financiado por un grant del National Institute of Health. Con el financiamiento del U.S. National Institute of Cardiology, en 1965 desarrolló el Puerto Rico Heart Program para estudiar la epidemiologia de la enfermedad arteriosclerótica


En la década de los 80, al igual que hoy, son las enfermedades del corazón, la primera causa de muerte en Puerto Rico. Aunque los servicios médicos



se planificó un centro cardiovascular, las facilidades estaban dispersas en diferentes edificios del Centro Médico de P.R. que obligaba a trasladar pacientes muy enfermos o recién operados por largos pasillos para recibir los servicios
El 1984 marca un encuentro fortuito entre dos viejos amigos . El Dr. Efrain Defendini se encontraba en el Hospital Pavia y una enfermera le pidió ayuda al no poder canular la vena de un paciente en necesidad de recibir medicamentos intravenosos. El paciente fue canalizado exitosamente por el Dr. Defendini. La paciente era la madre del gobernadora electo, Lcdo. Rafael Hernández Colón, que agradeció a su amigo y propició un diálogo que resultó de beneficio para el futuro de la cardiología en P.R. El Dr.
Arturo Medina Ruiz, MD, FACC

Catedrático de Medicina (Cardiología) Escuela de Medicina Universidad de Puerto Rico.
del corazón. Este programa de fama mundial es solo comparable al famoso Framingham Heart Study. La contribución del Dr. García Palmieri a la cardiología puertorriqueña es abundante y valiosa. Sin embargo, la contribución más importante, a mi juicio, es sin duda, la creación de un exitoso programa de fellowship en cardiología en la Sección de Cardiología del Recinto de Ciencias Médicas de la Universidad de Puerto Rico.
A finales de los años 60 y a principios de los 70 llegan graduados de nuestra
SEGUNDOS CINCUENTA ANOS
Defendini le habló al Gobernador de la necesidad de un centro cardiovascular para P.R., que contara con todos las facilidades físicas y todos los recursos diagnósticos y terapeúticos en gran demanda por los pacientes cardiacos.
En un encuentro casual en el Recinto de Ciencias Médicas el Dr. Defendini le contó al Dr. García Palmieri de la conversación que tuvo con el gobernador Hernández Colón. Una vez terminada la conversación, el Dr. García se dirigió a mi oficina, entonces Decano de Asuntos Clínicos de la Escuela de
Escuela de Medicina de la UPR y otros entrenados en Estados Unidos: Dr. José Eugenio López, Dr. José Fernandez Martínez, Dr. Francisco Olazabal Feliú, Dr. Luis A. Román Irizarry, Dr. José A. Perelló. Para esa época surge la necesidad de facilidades médicas, laboratorios cardiovasculares y equipos con el cual nuestros nuevos cardiólogos pudieran practicar sus destrezas aprendidas durante su entrenamiento.



Medicina y me habló de la importancia de aprovechar ese momento histórico para desarrollar nuestro sueño de un centro cardiovascular para P.R. Siendo el Secretario de Salud nuestro mutuo amigo, el Dr. Luis Izquierdo Mora, decidimos ir a visitarlo y venderle la idea del Centro Cardiovascular para Puerto Rico.
En su mensaje a la Asamblea Legislativa en febrero de 1985, el Gobernador Hernández Colón dijo: “En el Centro Médico ampliaremos los servicios médicos cardiovasculares para
69
ofrecerlos a los puertorriqueños más necesitados. De ahí nos encaminamos hacia la creación de un centro de medicina cardiovascular para el Caribe que nos permitirá mejorar la variedad de servicios que aquí se ofrecen y compartir los mismos con nuestros vecinos caribeños.”
Con el endoso del Gobernador , el Dr. Luis Izquierdo Mora nombró un comité para que estudie y evalue los servicios disponibles para la prevención, diagnóstico, tratamiento y rehabilitación de la enfermedades cardiovasculares y que desarrollara un plan para el establecimiento de un Centro Cardiovascular de Puerto Rico y el Caribe. El comité fue presidido por el Dr. Rubén García Palmieri y quedó constituido por los doctores Nydia De Jesús, Migdalia González, Efrain Defendini, Angel F. Espinosa, José Eugenio López y Arturo Medina Ruiz. Además incluyó a la Sra. Laura Torres, Directora Ejecutiva de la Administración de Servicios Médicos y más tarde el Dr. William Torruella, administrador de hospitales.
Comenzando en julio de 1985 el Comité se reunió todos los lunes por largas horas de intenso trabajo. El 17 de enero de 1986 el Dr. García Palmieri entregó al Dr. Izquierdo Mora una propuesta detallada para la creación del

Centro Cardiovascular de Puerto Rico y el Caribe junto a un borrador de la legislación que lo crearía. El 30 de mayo de 1986 se radicó ante la legislatura del país el Proyecto de Ley que propone la creación del Centro Cardiovascular y del Caribe y un mes después el Proyecto se conviertió en la Ley número 51 de 1986, para crear la Corporación del Centro Cardiovascular de Puerto Rico y el Caribe, una corporación pública para operar el Centro. La Junta de Directores la componen el Secretario de Salud que la preside, el Rector del Recinto de Ciencias Médicas de la Universidad de Puertto Rico, el Director Ejecutivo de la Administración de Servicios Médicos de Puerto Rico, un representante de la Sociedad Puertorriqueña de Cardiología y un representante de una Fundación de Cardiólogos sin fines de lucro. La Junta de Directores nombró al Lcdo. Aurelio Lladó como el primer Director Ejecutivo del Centro, con la encomienda de activar el plan de desarrollo.


A finales del año 1986 un grupo de médicos, el arquitecto Simón Fracinetti y el Lcdo. Aurelio Lladó visitaron varios centros cardiovasculares en Estados Unidos. El arquitecto Fracinetti diseñó y redactó los planos de construcción. El jueves 23 de abril de 1987, se realizó la ceremonia de colocación de la primera piedra. Desde ese momento histórico
hasta agosto de 1992 se construye la planta física, se compran materiales, equipos, se recluta el personal y se escriben las normas y reglamentos para su operación. Y listo!
Se inaugura el Centro Cardiovascular de Puerto Rico y del Caribe el 18 de agosto de 1992 y con su apertura se resuelve el acinamiento de pacientes pendientes de servicios cardiovascualres y rapidamente se convierte en el único centro en Puerto Rico con servicios para neonates, infantes, niños, adolescentes y adultos con condiciones cardiacas tanto congénitas como adquiridas.
entrenamiento para los programas de la Escuela de Medicina de la Universidad de Puerto Rico. El Centro tambien ha servido como taller de enseñanza para los programas de enfermería de la Universidad de Puerto Rico y de varias escuelas privadas “.

70
EL PROGRAMA DE FELLOWSHIP EN CARDIOLOGÍA DE ADULTOS DE LA UNIVERSIDAD DE PUERTO RICO ESTÁ ACREDITADO POR EL ACREDITATION COUNCIL OF GRADUATE MEDICAL EDUCATION (ACGME).
Este programa comenzó en 1954 en el Hospital Municipal de Santurce donde estuvo hasta el 1960, cuando se mudó al Hospital Universitario en el Centro Médico de Puerto Rico y luego en el Centro Cardiovascular de Puerto Rico y el Caribe desde 1992.



En los 30 años del Centro, la facultad de la Escuela de Medicina de la Universidad de Puerto Rico ha entrenado más de 100 cardiólogso de adultos, con la ayuda de otros facultativos del Centro. Aunque algunos egresados practican en ciudades de Estados Unidos, la gran mayoría de nuestros egresados practican en la isla.
No puedo dejar de mencionar el Programa de Trasplante de Corazón, único en Puerto Rico y motivo de orgullo para nuestra institución, En noviembre de 1998 se recibe notificación del United Network for Organ Sharing (UNOS) la acreditación para establecer un Programa de Trasplante de Corazón. Se establece el programa bajo la dirección conjunta del Dr. Iván González Cancel y el Dr. Héctor Banchs Pieretti. El 27 de junio de 1999 se realizó el primer trasplante de corazón por el Dr. González Cancel y la colaboración de los cirujanos Dr. Cid Quintana y el Dr. Rolando Colón.
El servicio que le ha dado el Centro Cardiovascular de Puerto Rico y el Caribe a Puerto Rico y sus ciudadanos puede clasificarse de colossal. También ha servido bien a ciudadanos / pacientes de otras latitudes. El programa de trasplante de corazón ha realizado 175 desde junio de 1999, un número impresioante cuando sabemos que el principal problema del programa , igual que en Estados Unidos , es la escasez de órganos. Los resultados comparan favorablemente con los mejores centros en Estados Unidos.
En el Programa de Reemplazo de la Válvula Aórtica por Catéter (TAVR) que comenzó en 2017 se han realizado 86
reemplazos a enero 2022. El Programa de Reparación de Válvula Mitral por Catéter comenzó en el 2019 y se han
25 pruebas de Head Up Tilt Test y 55 cardioversiones eléctricas al mes. La cantidad de electrocardiogramas por

catéter, reemplazo y reparación de válvulas cardiacas) para un total de sobre 300,000 procedimientos. Se han realizado 74,000 cirugías de adultos y niños. El Centro cuenta con una facultad de activa de 161 facultativos y 16 facultativos con privilegios temporeros. Cuenta además con 509 empleados a tiempo completo.
El laboratorio no-invasivo es un área de mucha actividad diaria. Allí se realizan electrocardiogramas, ecocardiogramas (transtorácicos, transesofágicos , y estres ecocardiogramas) ,defribilación eléctrica de arritmias, pruebas de esfuerzo, Holters y head up tilt tests.
En un mes promedio el laboratorio noinvasivo realiza 350 ecocardiogramas transtorácicos, 14 ecocardiogramas con dobutamina, 7 ecocardiogramas con esfuerzo (stress echocardiograms).
Se hacen unas 110 pruebas de Holter por mes, 45 pruebas de ejercicio (TMT). Tambien se realizan 200 ecocardiogramas transesofágicos,
,con un plan estratégico abarcador con mejoras de infraestructura y servicios, El Centro tiene en sus planes la adquisición de un equipo de resonancia magnética, salas angiográficas y salas híbridas quirurgícas, una unidad de medicina nuclear nueva, adquisición de materiales y equipos de avanzada, todo dirigido a brindar el servicio más completo y moderno, todo enmarcado en nuestra institución medico-académica v de excelencia”, añadió el Lcdo. Marrero.
El Centro Cardiovascular de Puerto Rico y el Caribe, Dr. Ramón Suárez Calderón es una institución médicoacadémica que ofrece servicios cardiovasculares de alta demanda para nuestra población y ha sido además el taller para el desarrollo de médicos cardiólogos que le han servido bien al país. Es su norte el brindar servicios cardiovasculares de calidad mundial y servir de taller clínico al exitoso programa de fellowship de cardiología de la Universidad de Puerto Rico.
Revista Puertorriqueña de Medicina y Salud Pública 71
USO CONCURRENTE DE OPIOIDES Y BENZODIACEPINAS: RIESGOS Y MEDICACIÓN APROPIADA
El uso concurrente de opioides y benzodiacepinas puede provocar serias complicaciones de salud como deterioro cognitivo, somnolencia extrema, depresión respiratoria, caídas, sobredosis y estado de coma e incluso la muerte. Las complicaciones son más comunes en pacientes de 65 años o más. Dicha población, comúnmente, utiliza múltiples medicamentos recetados por varios proveedores, lo que dificulta la identificación de sobreutilización y efectos adversos.
Según los Centros para el Control y la Prevención de Enfermedades (CDC, por sus siglas en inglés), en Estados Unidos más de 40 personas mueren cada día por sobredosis de opioides recetados. De acuerdo con estadísticas en Puerto Rico de la Administración de Servicios de Salud Mental y Contra la Adicción (ASSMCA), en la isla se registraron
739 casos de sobredosis por opioides entre junio de 2019 y agosto de 2021, una media de 28 mensuales en ese periodo. Sin embargo, en Puerto Rico se procesan mayores cantidades de benzodiacepinas que opioides. En el 2021, se dispensaron en el país un total de 2,962,807 recetas de benzodiacepinas, las cuales representan el 67.2% del total de prescripciones de medicamentos controlados reportados al Prescription Drug Monitoring Program.
El CDC recomienda evitar prescribir benzodiacepinas en forma concurrente con opioides por el riesgo de depresión respiratoria, sobredosis, caídas y posible trastorno de dependencia al igual que aumentos significativos en costos médicos. Pacientes que usan ambos medicamentos, se debe considerar comenzar un proceso planificado para reducir o detener de manera segura el
Dra. Carolyn Rodríguez Rivera Vicepresidente Ejecutiva de Farmacia de MCS

uso del medicamento. Se recomienda disminuir paulatinamente los opioides antes que las benzodiacepinas para reducir la ansiedad asociada al proceso de descontinuación de la terapia.
La reducción de dosis de opioides debe ser individualizada para evitar o minimizar síntomas de retirada mientras se modifican otras terapias no farmacológicas y medicamentos no opioides.
• Pacientes con uso de opioides durante más de un (1) año: se recomienda reducir un 10% de la dosis diaria de opioide cada mes.
• Pacientes con uso de opioides durante menos de (1) año: recomienda reducir un 10% de la dosis diaria de opioide cada semana.
Alternativas durante y luego del proceso deretirada de opioides son:
ALTERNATIVAS NO FARMACOLÓGICAS
• Acupuntura
• Masajes terapéuticos


• Yoga
ALTERNATIVAS FARMACOLÓGICAS
• Antiinflamatorios (Naproxeno, meloxicam)

• Antidepresivos (Duloxetina, venlafaxina)
• Anticonvulsivos (gabapentina)
72 Revista Puertorriqueña de Medicina y Salud Pública



Revista Puertorriqueña de Medicina y Salud Pública 73 @MCSPuertoRico 787.758.2500 | www.mcsclassicare.com ¡Con MCS estás EXTRA querido!
Dr. Eric Adler Cirujano Plástico Facial
te brinda beneficios EXTRA para que tengas salud completa. Con más de 13,000 proveedores de salud alrededor de toda la isla y varios programas de bienestar, porque tú mereces estar extra querido.
Dr. Álvarez Romagosa Ginecólogo/Obstetra
MCS
AGENDA MÉDICA 2023

EVENTOS Y CONVENCIONES
www.medicinaysaludpublica.com
17 y 18 de febrero de 2023
24 al 25 de febrero de 2023
23 al 25 de febrero de 2023
Puerto Rico Alzheimer’s Disease Research Symposium
Asociación Puertorriqueña de Gastroenterología Digestive Diseases of the Caribbean

Convención annual American College of Surgeons- PR Chapter
2 al 4 de marzo de 2023 American College of Physicians PR Chapter
15 al 18 de marzo de 2023
19 de marzo de 2023
30 de marzo de 2023
1 al 2 de abril de 2023
21 al 22 de abril de 2023
21 al 22 de abril de 2023
28 al 29 de abril de 2023
28 al 30 de abril de 2023
20 de mayo de 2023
26 al 29 de mayo de 2023
26 al 29 de mayo de 202
1 al 4 de junio de 2023
9 al 10 de junio de 2023
Convención anual #49 de la Academia Médica del Sur & Casa del Médico
Nephrology Symposium for Primary Physicians 2023
Convención anual de PIA
Academia de Patología y Medicina de Laboratorio de Puerto Rico
Convención de Médicos de Familia
Convención anual American College of Cardiology- PR Chapter
Convención anual Sociedad Radiológica de PR
Sociedad de Enfermedades Infecciosas de PR (SEINPR)
Caribbean Breast SymposiumSociedad Puertorriqueña de Senología
Convención Sociedad Puertorriqueña de Oftalmología
Convención Semi anual Sociedad Puertorriqueña de Endocrinología y Diabetología (SPED)
Convención Sociedad de Otorrinolaringólogos de Puerto Rico
Convención Semi anual de la Sociedad Puertorriqueña de Neumología
Ponce Hilton Hotel & Casino Ponce, PR
Sheraton Convention Center Hotel San Juan, PR
23-RCM // 24-25
Embassy Suites Hotel, Carolina, PR
Hotel La Concha San Juan, PR
Ponce Hilton Hotel & Casino Ponce, PR
Antonio’s Restaurant, Condado, PR
Puerto Rico
Lourdes Burgos 787-562-2932
Rivs Marketing 787-294-9185 / 787-409-6497 rinavega@rivsmarketing.com
Aixa Vélez 787-649-7681 / genteinc@gmail.com
Rivs Marketing 787-294-9185 / 787-409-6497 rinavega@rivsmarketing.com
Academia Médica del Sur 787-987-8301 / 787-843-0610 academiamedicadelsur@gmail.com
Business Planners - Merna Morales 787-645-9914 bplanner21@gmail.com
Simposio
Convención
Convención
Convención
Convención
Simposio
Sheraton Puerto Rico Hotel & Casino, San Juan Virginia de los Reyes Convención
Caribe Hilton Hotel San Juan, PR
Serra & Serra 787 406-4571 / 787 640-5776 patologospr@serrayserra.com
Marriot Resort, San Juan, Stelaris Casino, Condado, Puerto Rico Nelly Feliciano
Royal Sonesta San Juan Carolina, PR Aixa Vélez 787-649-7681 / genteinc@gmail.com
Sheraton Convention Center Hotel San Juan, PR
Serra & Serra 787 406-4571 / 787 640-5776 info@socrad.com / info@serrayserra.com
Embassy Isla Verde Enid Rivera (804) 774-6326 / enidrm27@gmail.com
Embassy Suites, Isla Verde, Puerto Rico
El Conquistador Resort, Fajardo, Puerto Rico
Priscilla González 787-615-6796 sociedadsenologapr@gmail.com
Rivs Marketing 787-294-9185 , 787-409-6497 rinavega@rivsmarketing.com
Ponce Hilton Hotel & Casino Ponce, PR Educational Partners & Coaching 787-646-0780 perez.vilma@gmail.com
Hyatt Regency Grand Reserve PR Río Grande, PR
Sheraton
Aixa Vélez genteinc@gmail.com 787-649-7681
Convención
Convención
Convención
Convención
Convención
Simposio
Convención
Convención
Convención
74 Revista Puertorriqueña de Medicina y Salud Pública
Fecha Actividad Lugar Contacto TIPO DE EVENTO
Convention
Center Hotel, Miramar
Convención 9 al 11 de junio de 2023 Convención Anual Asociación de Reumatólogos de Puerto Rico The St. Regis Bahia Beach Resort, Río Grande PR
reumatologospr@serrayserra.com 787 406-4571 &
Convención 22 al 24 de junio de 2023 Asociación Puertorriqueña de Medicina Física y Rehabilitación The St. Regis Bahia Beach Resort, Río Grande PR Serra & Serra asocfisiatraspr@serrayserra.com 787 406-4571 & 787 640-5776 Por confirmar ACTIVIDADES ESTÁN SUJETAS A CAMBIO
Business Planners- Merna Morales 787-645-9914 bplanner21@gmail.com
Serra & Serra
787 640-5776
AGENDA MÉDICA 2023

EVENTOS Y CONVENCIONES
www.medicinaysaludpublica.com
22 al 24 de junio de 2023
Julio 2023
Convención Anual Sociedad Dermatológica de PR
Convención anual Sociedad Puertorriqueña de Cardiología
Wyndham Grand Rio Mar Río Grande, PR
Hyatt Regency Grand Reserve PR Río Grande, PR
Agosto 2023 Convención Sociedad de Médicos Podiatras Por confirmar
11 al 13 de agosto de 2023 Congreso Coalición de Asma y otras condiciones Respiraciones Crónicas de PR
11 al 13 de agosto de 2023
19 de agosto de 2023
23 al 24 de agosto de 2023
24 al 27 de agosto de 2023
26 de agosto de 2023
Septiembre 2023
Septiembre 2023
6 al 8 de octubre 2023
18 al 20 de octubre de 2023
27 al 29 de octubre de 2023
26 al 28 de octubre de 2023
28 de octubre de 2023
3 al 5 de noviembre de 2023
17 al 19 de noviembre de 2023
10 al 12 noviembre de 2023
15 al 18 de noviembre de 2023
Diciembre 2023
Diciembre 2023
13ma Convención Anual de la Academia de Médicos Generalistas y Primarios de PR
Convención anual de la Asociación de Gastroenterología y Hepatología Pediátrica de PR
Convención Sociedad Puertorriqueña de Nefrología
Convención anual del Colegio de Farmacéuticos de PR
Hotel Sheraton Convention Center, San Juan, PR
Hotel Sheraton Convention Center, San Juan, PR
Por confirmar
Royal Sonesta SJ Hotel, Carolina, PR
Sheraton Convention Center, San Juan, PR
Simposio de Alergistas e Immunólogos del Oeste - Asociación Puertorriqueña Médicos Alergistas Rincón beach resort, PR
Convención Anual de la Asociación de Médicos Pediatras de la Región Oeste (AMPRO) Por confirmar
Convención Sociedad Puertorriqueña de Cardiología Intervencional
Fairmont El San Juan Hotel, 6063 Av. Isla Verde
Convención anual de la Asociación de Hematología y Oncología Médica de PR (AHOMPR) Ponce Hilton
Convención annual de la Asociación de Hospitales de PR
Sheraton Convention Center Hotel San Juan, PR
Caribe Gyn Ponce Hilton
Convención anual Puerto Rico Urological Association (PRUA)
Congreso Anual Coalición de Asma y otras condiciones Respiraciones Crónicas de PR
Convención Sociedad de Cirugía Plástica de PR
Sheraton Convention Center HotelSan Juan, PR
Sheraton Convention Center Hotel San Juan, PR
Hyatt Regency Grand Reserve PR Río Grande, PR
Convención Anual Sociedad Puertorriqueña de Neumología Por confirmar
Convención annual de la Asociación de Médicos Pediatras de la Región Este (AMPRE) Hotel Marriott Condado
XIII Congreso Asociación Latinoamericana de Nefrología Pediátrica (ALANEPE)
Centro de Convenciones Gobernador Pedro Roselló González, San Juan, PR
Convención Anual SPED Por confirmar
Convención anual Colegio de Médicos Cirujanos de PR Por confirmar
RN Pro Events- Rafy Nieto (787) 368-7939 (866) 232-2068 rafinieto@rnproevents.com
Sociedad Puertorriqueña de Cardiología 787-620-2228 socprcardio@gmail.com
Aixa Vélez genteinc@gmail.com
Puerto Rico
787-649-7681
IC Planners ivettecolon@icplannerspr.com
787-504-3655
SR Consultants & Events 939-292-4115 / 787-649-2367 srconsultants&events@gmail.com

IC Planners ivettecolon@icplannerspr.com
787-504-3655
Business Planners- Merna Morales 787-645-9914 bplanner21@gmail.com
Colegio de Farmacéuticos de PR 787-753-7157
IC Planners ivettecolon@icplannerspr.com
787-504-3655
AMPRO ampropediatras@gmail.com
Enid Rivera (804) 774-6326 enidrm27@gmail.com
Germaine Quiñones ahomprgq@gmail.com
787-608-1477
Business Planners- Merna Morales 787-645-9914 bplanner21@gmail.com
Germaine Quiñones ahomprgq@gmail.com
787-608-1477
Aixa Vélez genteinc@gmail.com 787-649-7681
IC Planners ivettecolon@icplannerspr.com 787-504-3655
Aixa Vélez genteinc@gmail.com787-649-7681
Business Planners- Merna Morales 787-645-9914 bplanner21@gmail.com
Business Planners- Merna Morales 787-645-9914 bplanner21@gmail.com
Convención
Convención
Convención
Congreso
Convención
Convención
Convención
Convención
Simposio
Convención
Convención
Convención
Convención
Convención
Convención
Congreso
Convención
Convención
Convención
Dr. Melvin Bonilla, Presidente ALANEPE Dra. Nilka de Jesús, Presidenta Congreso XIII ALANEPE Congreso
Educational Partners & Coaching 787-646-0780 perez.vilma@gmail.com
Colegio de Médicos Cirujanos de PR 787-751-5979 info@colegiomedicopr.org
Convención
Convención
Revista Puertorriqueña de Medicina y Salud Pública 75
Fecha Actividad Lugar Contacto
DE EVENTO
TIPO
ACTIVIDADES ESTÁN SUJETAS A CAMBIO
Janssen presenta Abrazo Floral en Puerto Rico para educar y crear conciencia sobre la psoriasis a través del arte

El mural creado por Rafael Enrique Vega (Rafique) interpreta los retos y dificultades que deben superar las personas que viven con psoriasis debido a los mitos y el estigma social. Se estima que hasta 100,000 personas viven con psoriasis en Puerto Rico.
SAN JUAN, PUERTO RICO, 17 de mayo de 2023 – Janssen, el grupo de compañías farmacéuticas de Johnson & Johnson, en colaboración con la Asociación Puertorriqueña de Ayuda al Paciente de Psoriasis (APAPP), dieron a conocer hoy el mural Abrazo Floral del artista puertorriqueño Rafael Enrique “Rafique “Vega.

Abrazo Floral fue creado para educar al público sobre la psoriasis y ayudar a derrotar los mitos y el estigma social que conlleva esta enfermedad. Abrazo Floral estará en exhibición en el segundo piso de Plaza Las Américas hasta el 15 de julio.

Abrazo Floral se centra en el acto de un abrazo entre flores de sábila para demostrar que las personas con psoriasis pueden tocarse y tener contacto físico, ya que la enfermedad no es contagiosa. Los patrones florecientes, circulares y de medialuna se utilizan como metáfora de las marcas que esta condición deja en la piel. Fue inspirado por testimonios de puertorriqueños que viven con psoriasis quienes compartieron sus experiencias personales con Rafael sobre cómo es vivir con esta condición. Estudios
muestran que entre 35,000 y 100,000 personas en Puerto Rico viven con psoriasis, principalmente entre los 50 y 69 años de edad.
“Hay muchos mitos sobre la psoriasis, y los pacientes que la padecen suelen ser rechazados o discriminados por la falta de información sobre esta enfermedad crónica”, dijo la Dra. Alma Cruz*, MD, FAAD. “Si bien es cierto que los pacientes deben educarse sobre las opciones de tratamiento, existe la necesidad de educar al público y romper con los estigmas sociales, para
que las personas sepan que pueden estrechar la mano o abrazar a una persona con psoriasis. La psoriasis no es una enfermedad contagiosa”.
La psoriasis es una enfermedad mediada por el sistema inmunitario que produce una sobreproducción de células de la piel, lo que provoca placas rojas, escamosas y elevadas que pueden producir picazón o dolor. Vivir con psoriasis puede ser desafiante e impactar la vida más allá de la salud física de una persona, incluida la salud emocional, las relaciones y el manejo
76 Revista Puertorriqueña de Medicina y Salud Pública MSP / MUNDO DIGITAL
Equipo de ejecutivos de Janssen Puerto Rico.
Abrazo Floral, creado por Rafael Enrique “Rafique” Vega
de los factores estresantes de la vida.
La psoriasis no es contagiosa, sin embargo, no tiene cura. Hay opciones de tratamiento que ayudan a los pacientes a controlar los síntomas, como el dolor, la picazón y el ardor.
“ Es de suma importancia que la población en general comprenda las dificultades y desafíos que experimentan a diario las personas que viven con psoriasis, para que puedan ser sensibles a la lucha de quienes vivimos con esta enfermedad”, dijo Leticia López, directora de APAPP. “Las escamas, las lesiones y el dolor que padecen los pacientes con psoriasis son grandes desafíos. Además, hay un impacto emocional y psicológico que provoca que las personas no se atrevan a tocarnos o abrazarnos por miedo al


contagio. Esos mitos son los que hay que combatir”.
“Crear Abrazo Floral fue un proceso difícil, pero también inspirador. Mientras escuchaba los testimonios de los pacientes, entendí mejor todo lo que los pacientes con psoriasis tienen que atravesar debido a la falta de educación”, dijo Rafique. “Pude simbólicamente estar en su piel a través de las experiencias que estos pacientes compartieron conmigo, y puedo decir que son personas decididas y valientes. Lo que deben soportar no es fácil. Tienen mi mayor admiración”.



Acerca de Janssen, el grupo de compañías farmacéuticas de Johnson & Johnson
En Janssen, estamos creando un
futuro en el que las enfermedades sean cosa del pasado. Somos las compañías farmacéuticas de Johnson & Johnson, y trabajamos incansablemente para llevar ese futuro a los pacientes de todo el mundo, combatiendo las enfermedades con ciencia, mejorando el acceso con ingenio y curando la desesperanza con el corazón. Nos enfocamos en las áreas de la medicina donde podemos hacer la mayor diferencia: Cardiovascular y Metabolismo, Inmunología, Enfermedades Infecciosas y Vacunas, Neurociencia, Oncología e Hipertensión Pulmonar.
Conozca más en www.janssen.com. Síganos en www.twitter.com/JanssenUS y www.twitter.com/JanssenGlobal. Janssen Research & Development, LLC, es parte de las Compañías Farmacéuticas Janssen de Johnson & Johnson.

Revista Puertorriqueña de Medicina y Salud Pública 77 MSP / REVISTAMSP.COM
Leticia López, directora ejecutiva de la Asociación puertorriqueña de ayuda al paciente de psoriasis (APAPP)
Sheila Irizarry, Director of Patient Experiences and Customer Solutions Janssen Puerto Rico
Rafael Enrique “Rafique” Vega, muralista.
Equipo de Janssen Puerto Rico junto a pacientes de APAPP
Rafael Enrique “Rafique” Vega, muralista; Carlos Santos, Senior Manager Janssen Puerto RicoCommunications and Public Affairs y Leticia López, directora ejecutiva de APAPP.

www.medicinaysaludpublica.com
@revistaMSP @revistaMSP @revistaMSP
Visita Nuestro Mundo Digital
Web - Podcast - Video
Visita nuestra plataforma web, redes sociales y podcast ahora también disponibles en iTunes y Spotify, Suscríbete y no te pierdas el mejor contenido de Medicina y Salud
Pública
SIMPOSIO DEL INSTITUTO DE NEUROCIENCIAS DE PR REÚNE
A

MÉDICOS DEL GRUPO HOSPITALARIO
PARA EDUCAR ACERCA DE LAS ENFERMEDADES NEUROLÓGICAS EN PUERTO RICO
San Juan, Puerto Rico - El pasado 29 de abril de 2023, el Instituto de Neurociencias de PR llevó a cabo un exitoso simposio dirigido por médicos del Grupo Hospitalario, que incluye a Manati, Mayagüez, Bayamón Medical
y Puerto Rico Woman and Children’s Hospital (PRWCH).
Este evento marcó el regreso de actividades académicas tras una pausa debido a la pandemia y reunió a profesionales de la salud de los cuatro hospitales del grupo, sino también a médicos en general de diversos municipios de Puerto Rico.
Durante el simposio, se abordaron temas clave relacionados con los servicios del Instituto, destacando especial énfasis en las condiciones y enfermedades neurológicas que más afectan a la comunidad puertorriqueña. El objetivo principal del encuentro fue compartir y actualizar conocimientos para mejorar el diagnóstico y tratamiento de estos trastornos, en
beneficio de la salud de la población.
El Dr. Marcos Mercado de Górgolas, neurocirujano y director de la Sección de Neurocirugía y Columna Vertebral, expresó su entusiasmo por la oportunidad de retomar las actividades académicas y reunir a la Facultad Médica de los cuatro hospitales. “El propósito es hacer lo que nos apasiona: compartir conocimiento y educación

actualizada en torno al diagnóstico y tratamiento de diferentes condiciones neurológicas. Sin duda alguna, ha sido una gran oportunidad para complementarnos en nuestra diversidad y enriquecer nuestras capacidades como profesionales en el campo de la Neurociencia, garantizando así el bienestar de Puerto Rico”, comentó el Dr. Mercado de Górgolas.
El Instituto de Neurociencias de PR, ubicado dentro del Manatí Medical Center y dirigido por el Dr. Jorge Lastra Power, es una institución líder en la investigación y tratamiento de condiciones neurológicas en Puerto Rico. Con profesionales altamente capacitados y una infraestructura de vanguardia, el Instituto busca mejorar continuamente la calidad de vida de los pacientes y sus familias, mediante el diagnóstico, tratamiento y prevención de enfermedades neurológicas.

Contacto: Lourdes Morales De Jesús | 787-621-3700 x. 2123 lmmorales@manatimedical.com
Instituto de Neurociencias de PR Urb. Atenas, calle a Hernández Carrión #668 Piso 2, Manatí Medical Center
Revista Puertorriqueña de Medicina y Salud Pública 79
Dr. Jorge Lastra Power – Director Instituto de Neurociencias de PR en el manatí medical center
Dr. Giancarlo Gierbolini González – Director Sección Neurología de Adultos y Dr. Carlos Weber, neuroradiólogo.
Center
VOCES inaugura exposición “Las vacunas: una historia de éxito en la salud pública” en Plaza Las Américas

La sala de exposición estará abierta al público general durante varios meses.
Tras 10 años de la fundación de la Coalición de Inmunización y Promoción de la Salud, VOCES, recientemente se realizó la inauguración de la sala de exposición “Las vacunas: una historia de éxito en la salud pública”, ubicada en Plaza las Américas.
La exposición tiene como misión explicar la historia de éxito en Puerto Rico erradicando enfermedades a través de la vacunación, mostrando cómo las vacunas han salvado millones de vidas y cómo protegen a la comunidad puertorriqueña.
“En la Semana Nacional de la Inmunización Infantil y la Semana de la Vacunación a nivel mundial, queremos celebrar como se han salvado miles y millones de vidas en el mundo, a través de la vacunación” dijo Lilliam Rodríguez Capo, CEO y fundadora de Voces. Esta exposición cuenta con una recopilación
de datos y fotografías que evidencian la trayectoria de las enfermedades prevenibles gracias a la inmunización, “mitigando la desinformación que encontramos hoy en día”, explicó Rodríguez.
Dentro de los datos que trae esta exposición se podrán encontrar: ¿Cómo se hace una vacuna?, cantidad de personas que han fallecido, cuando se logra inmunidad de rebaño, entre otros.

“Puerto Rico se ha distinguido por tener altos niveles de vacunación en nuestra población por décadas” dio a conocer Rodríguez.
Según explica Rodríguez, esto ha permitido que en la Isla no se reporten casos de sarampión hace más de 20 años, ni casos de paperas, polio, ni pertussis, enfermedades que cobraron
millones de vidas en el mundo.
La Dra. Iris Cardona, principal oficial médico del Departamento de Salud de Puerto Rico, manifiesta que “las vacunas son efectivas en prevenir enfermedades e interrumpir la transmisión de estos agentes infecciosos. Son seguras, salvan vidas y han sido reconocidas como el avance más ventajoso de la salud pública”.

80 Revista Puertorriqueña de Medicina y Salud Pública MSP / MUNDO
DIGITAL
Un nutrido grupo de profesionales de la salud se dio cita a la apertura de la exposición “Las vacunas: una historia de éxito en la salud pública”, ubicada en Plaza las Américas.
Lilliam Rodríguez explicó que la exposición tiene como misión explicar la historia de éxito en Puerto Rico erradicando enfermedades a través de la vacunación.
Los visitantes a la exposición pueden hacer un recorrido por una línea de tiempo donde pueden corroborar fechas en torno a las pandemias mas dramáticas que impactaron a la humanidad.

En la actividad participó el Dr. José Rigau Pérez quien es miembro de la Academia Puertorriqueña de la Historia y Catedrático Auxiliar Ad Honorem de los Departamentos de Pediatría y Epidemiología de las Escuelas de Medicina y Salud Pública de la Universidad de Puerto Rico.


El corte de cinta sirvió como antesala a la exposición que muestra cómo las vacunas han salvado millones de vidas y cómo protegen a la comunidad puertorriqueña y a nivel mundial.





El local ubicado en Plaza las Américas recrea un cinema donde se presentan documentales sobre la historia de las enfermedades.

Revista Puertorriqueña de Medicina y Salud Pública 81
MSP / REVISTAMSP.COM
SOCIEDAD RADIOLÓGICA DE PUERTO RICO CELEBRARÁ SU CONVENCIÓN ANUAL NÚMERO 26

La temática principal de este año está orientada hacia el abordaje de las nuevas tendencias de radiología diagnóstica para la atención de los pacientes, y en conocer todas las alternativas modernas que permitan mejorar la práctica de los especialistas en radiología.
Cabe mencionar que este congreso está dirigido a radiólogos, tecnólogos radiológicos y médicos que deseen orientarse en los temas relacionados con la radiología diagnóstica en Puerto Rico.

De otra parte, este año la convención estará dedicada al reconocido Dr. Efrén Flores, quien se desempeña en la actualidad como Presidente Asociado de Equidad, Inclusión y Salud Comunitaria de Radiología del Mass General Brigham en los Estados Unidos y se ha destacado por impulsar la investigación para el desarrollo de programas sanitarios.
El doctor es radiólogo certificado en Radiología Torácica en el Massachusetts General Hospital (MGH) y también es profesor asociado de radiología en la Facultad de Medicina de Harvard.
“AUNQUE SOMOS POCOS INFECTÓLOGOS, PROCURAMOS QUE LOS SERVICIOS EN PUERTO RICO NO SE VEAN DESATENDIDOS”
Por primera vez después de la pandemia, la Sociedad de Enfermedades Infecciosas de Puerto Rico celebró su convención anual de forma presencial donde fueron convocados todos los infectólogos y profesionales de la salud relacionados con esta especialidad médica.

De acuerdo con la Dra. Marielys Otero Maldonado, infectóloga y vicepresidenta de la Sociedad de Enfermedades Infecciosas de Puerto Rico, en la Isla existen alrededor de 80 a 85 infectólogos, un número significativamente pequeño comparado con la población
que necesita sus servicios de salud.
“En Puerto Rico puede haber entre 80 a 85 infectólogos y en la Sociedad de Enfermedades Infecciosas de Puerto Rico puede haber como 60. Aunque somos pocos, procuramos que los servicios en Puerto Rico no se vean desatendidos”, afirmó.
El rol de los infectólogos es determinante para la salud pública del país y en medio de la pandemia por COVID-19 los especialistas estuvieron atendiendo y orientando a los pacientes y liderando investigaciones para mitigar los efectos del virus.
“La mayoría de los casos de VIH en Puerto Rico son no detectables y esa es la meta de los CDC y la OMS; por eso ofrecemos tratamiento a todos para que el virus sea indetectable o tengan una carga viral bajita”.
82 Revista Puertorriqueña de Medicina y Salud Pública MSP / MUNDO DIGITAL
Dra. Marielys Otero Maldonado, infectóloga y vicepresidenta de la Sociedad de Enfermedades Infecciosas de Puerto Rico.
AAPDA REALIZA CON ROTUNDO ÉXITO SIMPOSIO CUIDADOS PRÁCTICOS PARA EL CONTRO DE LA DERMATITIS ATÓPICA



El encuentro entre expertos y pacientes con dermatitis atópica permitió poner sobre la mesa el cuidado de las enfermedades de la piel.

“No hay razón para que un paciente con dermatitis atópica esté sufriendo”
Allí los especialistas tuvieron la oportunidad de resaltar la efectividad de los nuevos tratamientos que están saliendo en el mercado y que permiten tener calidad de vida aun con la condición.



“Una pregunta que tengo frecuentemente de los papás cuando llevan sus nenes pequeños, es que si los pacientes con dermatitis atópica pueden vivir una vida normal, y yo les pongo
mi ejemplo, yo padezco la condición desde pequeño y la he mantenido en control toda la vida”, reconoció el Dr. Rogelio Mercado, dermatólogo.
“Ahora hay muchas alternativas de tratamiento, no hay razón para que un paciente con dermatitis atópica esté sufriendo”, añadió.
Por su parte, varios profesionales resaltaron en las medidas de higiene y cuidado de la piel, para evitar llegar a un grado de dermatitis atópica severa.
Revista Puertorriqueña de Medicina y Salud Pública 83 MSP / REVISTAMSP.COM
Dr. Wilfredo Cosme, Alergista e Inmunólogo, Yasmin Morell Casellas, Ejecutiva de la Revista Medicina y Salud Pública, Brenda Gerena, portavoz de la Alianza de Apoyo al Paciente con Dermatitis Atópica y el Dr. Rogelio Mercado, Dermatólogo y Ex Presidente de la Sociedad Dermatológica de Puerto Rico.
Dr. Rogelio Mercado, Dermatólogo y Ex Presidente de la Sociedad Dermatológica de Puerto Rico y el Dr. Wilfredo Cosme, Alergista e Inmunólogo.
Desde el centro comercial Mayagüez Mall se realizó el evento de la Alianza de Apoyo al Paciente con Dermatitis Atópica.
DR. HUMBERTO GUIOT, UNA CELEBRACIÓN DE LA COMUNIDAD INVESTIGADORA PUERTORRIQUEÑA
La Revista Puertorriqueña de Medicina y Salud Pública distingue a investigadores y organizaciones investigadoras cuyos logros destacados tienen una importante contribución al avance de la ciencia, influyendo así de manera positiva en nuestra sociedad.
La aportación del distinguido galeno en el área de la investigación sobre el cáncer de ano, VIH y VPH son del mayor valor para cientos de pacientes y una innovadora colaboración al progreso del conocimiento a través de su dedicación a la ciencia. La trayectoria del doctor Humberto Guiot, sirve como fuente de inspiración, ayudan a mejorar la visibilidad de individuos con talento para la ciencia y de las organizaciones especializadas, así como de la profesión médica en su conjunto.
A Ciencia Cierta podemos decir, que Puerto Rico y la ilustre Escuela de Medicina del Recinto de Ciencias Médicas de la Universidad de Puerto Rico de donde es cofundador de la Clínica de Neoplasia Anal,cuenta con un profesional humanista, innovador y un académico de excelencia en el rendimiento de la investigación y las contribuciones hechas al desarrollo científico de su país. Igual de orgullo debe sentir la academia al ver a uno de los suyos siendo inspiración y un modelo de vida para las nuevas generaciones, que completan su formación en el primer centro docente del país. Lo hizo en medicina interna y su especialización en enfermedades infecciosas en la Escuela de Medicina de la Universidad de Puerto Rico.
DR. HUMBERTO GUIOT


Decano
Escuela de Medicina Recinto de Ciencias Médicas UPR
84 Revista Puertorriqueña de Medicina y Salud Pública MSP / A CIENCIA CIERTA
Reconocemos al Dr. Humberto Guiot por sus considerables aportaciones y contribución a la investigación científica, a la educación médica y a la infectología.





































 Francisco Tirado-Polo, MD
Isabel Rodríguez- Candelario, MD
José Román-Ramos, MD
Luke’s
Francisco Tirado-Polo, MD
Isabel Rodríguez- Candelario, MD
José Román-Ramos, MD
Luke’s
































 Joalex Antongiorgi Torres, MD Psiquiatra General, Board Certified Psiquiatra Niños y Adolescentes, Board Certified Profesor Asociado Departamento de Psiquiatría Escuela de Medicina, UPR
Joalex Antongiorgi Torres, MD Psiquiatra General, Board Certified Psiquiatra Niños y Adolescentes, Board Certified Profesor Asociado Departamento de Psiquiatría Escuela de Medicina, UPR








































































