




A cura di Davide Fattore e Maria Carmela Annunziata
Introduzione di Carmine Pinto
A cura di Davide Fattore
e Maria Carmela Annunziata
introduzione di Carmine Pinto
Davide Fattore
Medico-Chirurgo, Specialista in Dermatologia e Venereologia
Sezione di Dermatologia, Dipartimento di Medicina Clinica e Chirurgia Università degli Studi di Napoli Federico II
Maria Carmela Annunziata
Medico-Chirurgo, Specialista in Dermatologia e Venereologia
Sezione di Dermatologia, Dipartimento di Medicina Clinica e Chirurgia Università degli Studi di Napoli Federico II
Prima edizione Dicembre 2023 © 2023 Il Pensiero Scientifico Editore Via San Giovanni Valdarno 8, 00138 Roma Tel. (+39) 06 862821 - Fax (+39) 06 86282250 pensiero@pensiero.it www.pensiero.it - www.vapensiero.info www.facebook.com/PensieroScientifico twitter.com/ilpensiero www.pinterest.com/ilpensiero
Tutti i diritti sono riservati per tutti i Paesi
Stampato in Italia da Ti printing S.r.l. Via delle Case Rosse 23, 00131 Roma
Impaginazione e copertina Doppiosegno S.n.c.
Immagine in copertina © iStock by Getty Images Coordinamento editoriale Martina Teodoli
ISBN 978-88-490-0768-8
Parte prima. Effetti collaterali dermatologici in corso di terapia con anticorpi monoclonali anti-EGFR
Davide Fattore
1.
Parte seconda. Approccio multidisciplinare al malato oncologico
Maria Carmela Annunziata
4. Impatto degli effetti collaterali in corso di terapia antitumorale sulla qualità di vita 35
5. Approccio multidisciplinare e figure professionali coinvolte 39
6. Gestione proattiva, cosmesi e camouflage 43
Bibliografia 47
L’impiego, ormai da oltre 15 anni, nella terapia oncologica di rilevanti patologie come i tumori del polmone, del colonretto e del testa-collo, di farmaci anti-EGFR come piccole molecole orali o come anticorpi monoclonali somministrati per via parenterale, ha dimostrato l’efficacia di questi farmaci con importanti e consolidati vantaggi clinici sia in termini di controllo di malattia che di miglioramento della sopravvivenza.
L’introduzione di nuove classi di farmaci, come vediamo sempre più frequentemente in oncologia, si accompagna spesso all’insorgenza di “nuove” tossicità che possono impattare in maniera anche significativa sulla compliance terapeutica e quindi sull’efficacia del trattamento, con rilevanti effetti anche sulla qualità di vita dei pazienti. Per i farmaci anti-EGFR la specifica e più rilevante tossicità correlata è rappresentata dalla tossicità cutanea, una “nuova” tossicità da gestire per gli oncologi, che non molto frequentemente nel passato avevano affrontato questa problematica sia dal punto di vista biologico che clinico.
La tossicità cutanea diventa quindi un ambito di ricerca e di interesse clinico per professionisti di diverse discipline, quali gli oncologi, i radioterapisti, i dermatologi, gli anatomo-patologi e i biologi molecolari, per individuarne i meccanismi patogenetici, i fattori predisponenti e quindi le possibilità di intervento sia come profilassi che come strategia di trattamento.
Questa “nuova” tossicità emergente ha richiesto dapprima una definizione e un inquadramento nosologico del “rash cutaneo” da anti-EGFR e delle altre tossicità, sia della cute
che degli annessi cutanei, come il follicolo pilifero e le unghie. Tutto questo ha portato nel tempo a nuove definizioni e all’individuazioni di grading della tossicità cutanea nelle classificazioni internazionali, che sono stati correlati anche all’impatto sulla vita relazionale del paziente e alle modificazioni di dose fino alle sospensioni previste per i farmaci anti-EGFR.
La tossicità cutanea, inoltre, può presentarsi con manifestazioni ed entità differenti a seconda delle modalità terapeutiche con cui vengono somministrati i farmaci anti-EGFR. Diversa è infatti la prevalenza e l’intensità della tossicità cutanea da anticorpi monoclonali anti-EGFR nel carcinoma del colon-retto quando questi farmaci sono utilizzati in monoterapia o in combinazione con regimi di chemioterapia, o nei tumori del testa-collo se i farmaci sono utilizzati come trattamento integrato con la radioterapia nei tumori localizzati o in combinazione con la chemioterapia nella malattia avanzata.
Nel presente volume sono affrontate tutte queste tematiche partendo dalla più moderna letteratura scientifica e dalle evidenze disponibili. Vengono così riportate tutte le alterazioni cutanee descritte per intensità nei diversi gradi, le misure preventive e le strategie terapeutiche più appropriate che possono oggi essere adottate per i diversi gradi di tossicità. Per i diversi farmaci anti-EGFR verranno inoltre discussi i possibili interventi anche in termini di modifica e sospensione del trattamento. Elementi centrali in questo approccio multidimensionale sono la valutazione e la misurazione dell’impatto della tossicità cutanea sulla qualità di vita del paziente con gli strumenti validati che sono oggi riconosciuti, in una visione globale nel processo assistenziale che mette insieme e non contrappone gli obiettivi di “quantità” e di “qualità” di vita.
Tutti questi aspetti correlati alla gestione della tossicità cutanea da farmaci anti-EGFR sono posizionati nella multidisciplinarietà professionale e nella strutturazione di percorsi assistenziali, che vedono la partecipazione di tutte le figure coinvolte nella “cura” del paziente, quali l’oncologo, il radioterapista, il dermatologo, e lo psico-oncologo. In quest’ambito il ruolo e l’attività dell’infermiere, che rappresenta la figura professionale che spesso, e talora per primo, informa il paziente su misure preventive e che ne raccoglie le
problematiche cliniche, sono determinanti e richiedono una specifica formazione.
Questo volume, proprio come un gruppo multidisciplinare che raccoglie tutte le competenze, ha come ambizione l’obiettivo di un rapido e completo aggiornamento per i professionisti, e quindi di favorire un continuo miglioramento della pratica clinica per i nostri pazienti.
Carmine Pinto Oncologia Medica
Comprehensive Cancer Centre
AUSL-IRCCS di Reggio Emilia
Gli inibitori dell’EGFR sono utilizzati di routine per trattare tumori maligni avanzati di origine epiteliale come il cancro del colon-retto, il cancro del polmone e i tumori del distretto testa-collo.1 2 Questi ultimi infatti possono essere caratterizzati da mutazioni nei fattori di crescita e nei recettori dei fattori di crescita, che conferiscono loro un potenziale di proliferazione cellulare non ostacolata, migrazione e promozione dell’angiogenesi.1 Gli inibitori del recettore del fattore di crescita epidermico (EGFRI) agiscono inibendo questa via di segnalazione.
A causa del loro meccanismo d’azione e dei bersagli che riconoscono, il loro uso è spesso associato allo sviluppo di eventi avversi dermatologici che devono essere compresi e gestiti sia dall’oncologo che da tutte le figure professionali coinvolte nel trattamento dei pazienti. I segni, i sintomi e i problemi estetici correlati a tali terapie hanno un forte impatto sulla qualità di vita dei malati, sulle relazioni personali, sociali e lavorative. Inoltre, come nel caso delle tossicità da chemioterapia, gli effetti collaterali dermatologici possono causare riduzioni della dose e ritardi di somministrazione della terapia salvavita per il paziente, o addirittura l’interruzione del trattamento.3 4 Per questo motivo è necessaria una diagnosi precoce e accurata e vanno introdotte quanto prima terapie per ridurne la gravità e la durata. Date le premesse, si comprende come la valutazione multidisciplinare di dermatologi e oncologi sia fondamentale per la cura ottimale di questi pazienti. In condizioni normali, l’EGFR è espresso e attivato in un’ampia varietà di tessuti come ad esempio nei cheratinociti basali, nella guaina esterna dei follicoli piliferi e in cellule del tessuto connettivo dermico.5 L’EGFR partecipa alla crescita epidermica, alla differenziazione e migrazione dei cheratinociti e alla guarigione delle ferite. Approssimativamente da 40.000 a 100.000 recettori sono espressi sulla superficie cellulare nei tessuti normali, mentre il numero può raggiungere circa 2 milioni per cellula maligna. L’arresto della crescita e della differenziazione del follicolo pilifero in seguito alla terapia con farmaci inibitori dell’EGFR può causare la rottura meccanica del follicolo stesso, generando ipercheratosi e tamponamento follicolare. I farmaci anti-EGFR
possono anche influenzare la produzione di citochine, con conseguente chemiotassi dei leucociti e infiltrazione nella pelle, nonché cambiamenti nella microflora cutanea, dando origine a una reazione infiammatoria.6 7
Sebbene queste terapie siano meglio tollerate rispetto alla chemioterapia convenzionale, presentano profili di effetti collaterali unici, legati al loro meccanismo d’azione. Data la presenza ubiquitaria degli EGFR nelle cellule basali dell’epidermide, del fusto del pelo, delle ghiandole sebacee e della guaina radicolare esterna, i profili di effetti collaterali includono alterazioni dermatologiche con danni alla pelle, alle mucose, ai capelli e alle unghie. La normale architettura cutanea è perturbata dall’inibizione dell’EGFR, causando la perdita del potenziale proliferativo delle cellule basali e un’alterazione della differenziazione dei cheratinociti. Anche gli strati superiori dell’epidermide sono compromessi, a causa della riduzione delle proteine della giunzione stretta (tight junction). In aggiunta, la formazione e la funzione dello strato corneo vengono meno, con un aumento della desquamazione e della perdita di liquidi corporei, facilitando l’accesso di microrganismi, particelle e sostanze chimiche ambientali. Questi difetti nei meccanismi di difesa dell’ospite possono portare all’invasione microbica e a frequenti infezioni cutanee.8
L’epidermide, privata della segnalazione dell’EGFR, può incorrere in un’alterazione dell’espressione e del rilascio di chemochine e citochine cruciali, con conseguente reclutamento e attivazione massiccia di popolazioni di cellule immunitarie e manifestazione finale di danni cutanei. Esiste un’interazione sinergica tra l’attivazione dell’EGFR e il meccanismo dell’immunità innata nella cute al fine di potenziare al massimo l’espressione delle AMP: l’inibizione dell’EGFR blocca sia l’attività chemiotattica dei neutrofili sia l’espressione della maggior parte delle AMP. Questo difetto porta a una pelle secca, squamosa e fortemente pruriginosa, con conseguente disidratazione.8
È stato suggerito che diverse molecole di segnalazione svolgono un ruolo nella patogenesi delle azioni anti-EGFR cutanee, tra cui l’interleuchina-1 (IL-1), il fattore di necrosi tumorale alfa (TNF-a) e l’interleuchina-8 (IL-8).9 L’inibizione dell’EGFR interrompe la crescita cellulare, portando all’apoptosi, alla segnalazione di chemochine e all’infiammazione.6 7
In definitiva, l’inibizione degli EGFR provoca un aumento dell’infiammazione nella pelle e nei tessuti annessi e quindi i vari effetti collaterali infiammatori che si osservano con l’uso degli inibitori dell’EGFR, tra cui le eruzioni papulo-pustolose, la xerosi cutanea, la paronichia con i granulomi periungueali, le alterazioni dei capelli e delle unghie, la fotosensibilità, le mucositi.
Le eruzioni papulo-pustolose o rash, definite anche (erroneamente) eruzioni acneiformi, sono gli effetti collaterali più precoci e comuni. Si associano comunemente alle target therapies che inibiscono vie di segnalazione specifiche quali EGFR, MEK,
Principali tossicità cutanee in corso di terapia con farmaci anti-EGFR 5
mTOR (ad esempio cetuximab, panitumumab, pertuzumab, gefitinib, erlotinib, afatinib, everolimus, trametinib, binimetinib). Una minore incidenza è riportata con agenti chemioterapici come i taxani e farmaci di supporto (ad esempio prednisone).
Interessano il 20-80% dei pazienti trattati con terapia anti-EGFR.11 I tassi di eventi avversi cutanei e di eruzioni papulo-pustolose dovuti alla terapia anti-EGRF tendono a essere più elevati con i mAb (Anticorpi Monoclonali) rispetto ai TKI (Inibitori Tirosin Kinasi), verificandosi in genere nel 70% dei soggetti trattati. Inoltre, i mAb tendono a causare eruzioni più severe (9-10%) rispetto ai TKI (2-4%).10
Queste eruzioni si caratterizzano per lo sviluppo di macule, papule e pustole eritematose di consistenza morbida, pruriginose, tipicamente distribuite in aree seborroiche come il cuoio capelluto, il viso, le regioni retro-auricolari, la regione centrale del torace, le spalle e il terzo superiore della schiena (figura 1.1).11 Sebbene il rash sia stato

Figura 1.1
Eruzione papulo-pustolosa causata da terapia con EGFRI, con papule, pustole, placche eritematose e lesioni crostose nella regione centro-toracica.
spesso descritto come acneiforme, si differenzia dall’acne per l’assenza di comedoni e cisti e per la presenza di sintomi funzionali associati, come sensazione di bruciore, prurito o dolore (figura 1.2). Inoltre, migliora con gli steroidi topici e non migliora con i retinoidi.12 È una reazione cutanea dose-dipendente, che di solito si sviluppa nelle prime 1-2 settimane e raggiunge il picco a 3-4 settimane di terapia, sebbene siano possibili casi ad esordio tardivo. L’eruzione tende a risolversi in circa 8-12 settimane, lasciando eritema e pigmentazioni post-infiammatorie.
Lo sviluppo di questa tossicità in corso di terapia con inibitori dell’EGFR è stato suggerito come fattore prognostico indicativo di una buona risposta al trattamento13 e si correla a una migliore sopravvivenza globale e libera da progressione di malattia nei soggetti trattati con mAb e TKI anti-EGFR. Tuttavia, questa condizione può influire

Figura 1.2
Eruzione papulo-pustolosa causata da terapia con EGFRI. Nonostante fosse definita come eruzione acneiforme un esame più ravvicinato consente di rilevare l’assenza delle lesioni tipiche dell’acne come i comedoni e le pseudo-cisti.
Principali tossicità cutanee in corso di terapia con farmaci anti-EGFR 7
sulla qualità di vita dei pazienti e può talvolta portare all’interruzione della terapia antineoplastica. La sua localizzazione in un’area visibile come il viso ha un forte impatto sulla vita emotiva e sociale del malato, in aggiunta ai segni e sintomi che tale reazione determina.
Tra le complicanze dell’eruzione papulo-pustolosa è frequente l’impetiginizzazione a causa dell’alterazione della barriera cutanea.14 Va sottolineato che le infezioni non sembrano essere la causa scatenante della manifestazione; infatti, all’esordio del rash le lesioni pustolose sono sterili. Studi condotti su erlotinib hanno dimostrato un’alterazione nelle vie di segnalazione coinvolte nell’attivazione del sistema immunitario innato.7 In particolare, in uno studio retrospettivo il 38% dei soggetti con queste eruzioni indotte da EGFRI ha sviluppato infezioni batteriche o virali, più frequentemente da Staphylococcus aureus e fino al 22,6% dei casi.15 I pazienti che ricevono EGFRI hanno anche dimostrato una maggiore densità di Demodex nella pelle colpita da reazioni papulo-pustolose,16 il che è probabilmente dovuto a un’alterazione dei meccanismi di difesa dell’ospite e può contribuire al pattern rosaceiforme della tipica eruzione papulo-pustolosa. Si deve sospettare un’impetiginizzazione batterica quando si verifica un improvviso peggioramento dell’eruzione cutanea e sono osservate lesioni più polimorfe sormontate dalla caratteristica crosta color dorata mielicerica. Il principale patogeno responsabile delle sovrainfezioni batteriche è lo Staphylococcus aureus, soprattutto nei pazienti che ne sono portatori nasali (figura 1.3).
Istologicamente, il rash si caratterizza per uno strato corneo più sottile e compatto, con occasionale paracheratosi focale e perdita della normale configurazione a trama di canestro, insieme a una leggera ipogranulosi, tappi di cheratina prominenti e infundiboli follicolari dilatati.17
Data la prevalente localizzazione delle eruzioni papulo-pustolose al volto e alle aree foto esposte del torace, si è ipotizzato che le radiazioni ultraviolette (UV) giochino un ruolo nella predisposizione agli effetti collaterali degli inibitori dell’EGFR. È stato riscontrato che l’EGFR è up-regolato nei cheratinociti esposti ai raggi UV6 e che gli inibitori dell’EGFR aumentano il rischio e la gravità della dermatite indotta da radiazioni.18 19 Tuttavia, non è stato dimostrato alcun beneficio della protezione solare per prevenire l’eruzione cutanea indotta da EGFRI.20 Sono ovviamente necessari ulteriori studi per chiarire meglio i meccanismi alla base degli effetti collaterali degli inibitori dell’EGFR.

Figura 1.3
Eruzione papulo-pustolosa del tronco in paziente in terapia con EGFRI. Si rilevano lesioni sormontate da croste mieliceriche indice di sovrinfezione da Staphilococcus aureus.
I pazienti oncologici possono presentare prurito a causa del tumore in sé, della cute secca o per l’assunzione dei farmaci. Fino al 50% dei soggetti in terapia antitumorale può manifestare prurito con un meccanismo di insorgenza che dipende dalla tipologia di farmaco assunto (chemioterapia, terapia target, terapia endocrina o immunoterapia).
La xerosi e il prurito sono effetti collaterali comuni nei pazienti in terapia con antiEGFR, spesso significativamente impattanti. Sia il prurito acuto che quello cronico possono ostacolare il sonno e ridurre la qualità di vita di chi ne è affetto. In particolare, la xerosi cutanea si verifica fino al 35% dei pazienti trattati con EGFRI.21 Quando il prurito è causato da farmaci antitumorali può presentarsi senza altre manifestazioni evidenti sulla cute. Tuttavia, il grattamento ripetuto causa escoriazioni, sanguinamenti,
Principali tossicità cutanee in corso di terapia con farmaci anti-EGFR 9
aree eritematose e lichenificate, croste e sovrainfezioni.22 In alcuni casi, il prurito può essere associato ad altre reazioni cutanee quali eczema, psoriasi, orticaria o xerosi. In questo caso si possono osservare sulla cute chiazze squamose, eritema, pomfi, vescicole o bolle.
L’alterata differenziazione epidermica indotta dalla terapia dà luogo ad anomalie nello strato corneo e ad una scarsa funzionalità delle ghiandole sebacee, che si traduce in secchezza cutanea.23
I pazienti anziani con una storia di eczema atopico e i soggetti precedentemente trattati con agenti citotossici hanno maggiori probabilità di sviluppare la xerosi. La tossicità si presenta come pelle secca e desquamata, spesso sede di lesioni da grattamento essendo intensamente pruriginosa. Può localizzarsi in maniera elettiva nelle aree contemporaneamente o precedentemente interessate da eruzione papulo-pustolosa e può evolvere in eczema asteatosico cronico (figura 1.4), con placche eritematose e desquamative sul tronco e sulle estremità. In altri casi la secchezza e il prurito possono essere generalizzati e di intensità anche severa. Va ricordato il rischio di sovrinfezioni da S. aureus nelle aree di cute lesa e, più raramente, da Herpes Simplex

Figura 1.4
Intensa xerosi e lesioni da grattamento in paziente in terapia con gefitinib per carcinoma polmonare.
Virus 1. La xerosi può anche portare alla formazione di spacchi ragadiformi sulla pelle, con un significativo dolore associato. Le sedi elettive sono i polpastrelli sia delle mani che dei piedi e, quando presenti, causano una marcata riduzione della qualità di vita con forte impedimento alle attività quotidiane (figura 1.5).
In un recente studio che ha valutato l’impatto degli eventi dermatologici correlati a EGFRI sulla qualità della vita, la xerosi e il prurito sono risultati gli eventi avversi più significativi riportati. Il prurito di tutti i gradi si presentava nel 17-58% dei pazienti trattati con EGFRI, con una frequenza più elevata in quelli trattati con panitumumab.24
Il prurito si localizza più frequentemente al cuoio capelluto, al viso e al tronco in oltre il 50% dei casi, soprattutto durante la terapia con cetuximab e panitumumab (si manifesta fino al 100% dei casi).25
Questa tossicità è di solito più grave con la somministrazione di anticorpi monoclonali che con i TKI, e si sviluppa una settimana dopo l’inizio del trattamento. Sebbene la maggior parte delle manifestazioni sia di grado lieve, una maggiore gravità tende a essere associata a una migliore risposta del tumore alla terapia come accade per il rash papulo-pustoloso. 25-27 Non va dimenticato che la secchezza cutanea e il prurito possono diventare severi se il paziente ha già una condizione personale di cute xerotica, evento comune nella popolazione geriatrica.

Principali tossicità cutanee in corso di terapia con farmaci anti-EGFR 11
Le mucositi rappresentano effetti collaterali comuni e fastidiosi di molte terapie antitumorali. La mucosite del cavo orale può colpire fino al 90% dei pazienti che si sottopone a terapie oncologiche e la sua frequenza dipende dal tipo di trattamento. La mucosite indotta dal blocco dell’EGFR si può manifestare in tutto il tratto gastrointestinale, dalla bocca all’ano, nella mucosa genitale e oculare. 9 I fattori di rischio per questa tossicità includono il fumo di sigaretta, la scarsa igiene orale, la giovane età, lo stato nutrizionale, il basso numero di globuli bianchi. Possono provocare disagio al paziente e comprometterne la qualità di vita, poiché si associano a dolore e difficoltà nel mangiare e deglutire quando interessano il cavo orale, difficoltà respiratorie quando interessanti la mucosa nasale, bruciore intimo nelle mucositi genitali e difficoltà visive nella mucosite oculare. Solitamente sono reversibili e migliorano gradualmente quando il farmaco responsabile viene sospeso. La mucosite indotta da target therapy si presenta con ulcerazioni ben limitate, simili alle afte, che si manifestano entro i primi cicli di trattamento.28 Nella prima fase si presentano con eritema, infiammazione e bruciore (figura 1.6). Successivamente possono evolvere in erosioni dolorose e ulcerazioni.29 I pazienti possono manifestare ulcere orali multiple o atipiche come conseguenza della terapia con EGFRI. Per la diagnosi differenziale è sempre importante fare una coltura di queste ulcere per il virus dell’Herpes Simplex e della Varicella-Zoster per escludere un’eziologia virale o un tampone per esame micologico per escludere sovrapposizioni di Candida albicans. Possono comparire anche secchezza della bocca e lingua a carta geografica.28 Può verificarsi un coinvolgimento degli occhi con cheratite e congiuntivite, e può essere coinvolta la mucosa genitale, con conseguente vulvovaginite e balaniti.9 Gli EGFRI (erlotinib, gefitinib) sviluppano in prevalenza stomatite. Tuttavia, l’incidenza di tutti i gradi sembra essere significativamente più elevata con i nuovi inibitori pan-HER (dacomitinib, afatinib).
Possono anche verificarsi ulcerazioni simili e ben delimitate su mucosa non cheratinizzata, che sono approssimativamente simili alle afte.29 Tuttavia, il più delle volte sono limitate e di basso grado e i pazienti riferiscono generalmente stomatiti non specifiche con ipersensibilità, disestesia diffusa della mucosa e disgeusia, talvolta associate a eritema o bruciore doloroso della bocca. Si nota un’evoluzione rapida dopo l’inizio del trattamento e una scomparsa graduale. Questo le differenzia dalle mucositi indotte da radioterapia che generalmente si verificano intorno alla terza settimana di trattamento, mentre quella da chemioterapia appare più precocemente (durante la prima settimana di trattamento). Quest’ultima può gradualmente regredire in pochi giorni, ma esistono rischi di recidiva durante i successivi cicli di chemioterapia.

Figura 1.6
Paziente affetta da mucosite alle fosse nasali e alla mucosa labiale in corso di terapia con EGFRI.
La paronichia e le lesioni periungueali simili a granulomi piogeni, i cosiddetti granulomi periungueali, si verificano nel 10-30% dei pazienti che ricevono EGFRI.12
Queste tossicità sono effetti collaterali anche di altri farmaci inclusi il metotrexato, gli inibitori di MEK (Mitogen-Activated Protein Kinase), tra cui selumetinib, trametinib, cobimetinib e gli inibitori di BRAF.28 30 31
Tipicamente si manifestano entro 1-3 mesi dall’inizio dell’assunzione della molecola scatenante, a causa di cambiamenti nella crescita e nella differenziazione dell’unghia.32 La paronichia si presenta come un’infiammazione con intenso eritema e dolore delle pieghe ungueali prossimali o laterali. Le lesioni tipiche, che colpiscono soprattutto le unghie dei piedi, si sviluppano lentamente dopo diverse settimane o mesi di trattamento. Il danno inizia tipicamente con lo sviluppo di una paronichia infiammatoria periungueale e può evolvere in una crescita eccessiva di tessuto di granulazione sulle
Principali tossicità cutanee in corso di terapia con farmaci anti-EGFR 13
pieghe laterali e/o prossimali dell’unghia, imitando le unghie incarnite (figura 1.7). I granulomi piogenici, caratterizzati dalla crescita di tessuto vascolare friabile e facilmente sanguinante a livello del solco ungueale, si presentano come noduli eritematosi ricoperti da croste, sono estremamente dolenti e possono impattare significativamente la qualità di vita, il riposo notturno e le attività quotidiane (figura 1.8).33
Sebbene la patogenesi sia poco chiara, si ritiene correlata alla penetrazione e alla ritenzione di frammenti e detriti di unghia nel solco periungueale a causa del conflitto traumatico tra il tessuto che circonda l’unghia che risulta assottigliato e l’unghia stessa. In particolare, l’inibizione degli EGFR provoca un aumento dell’infiammazione nella pelle e nei tessuti annessi aumentando la produzione di diverse citochine infiammatorie, tra cui l’interleuchina-1 (IL-1), il fattore di necrosi tumorale alfa (TNF-a) e l’interleuchina-8 (IL-8) che favoriscono l’infiammazione a livello periungueale (la paronichia) e l’associata vasodilatazione.
Anche se di solito non sono gravi, queste lesioni possono comunque essere molto debilitanti per il paziente, soprattutto quando persistono per lungo tempo. Pertanto, è necessario attuare strategie aggressive per aiutare i pazienti a gestire questi effetti negativi.

Granulomi periungueali multipli diffusi alle dita dei piedi in paziente in terapia con EGFRI.
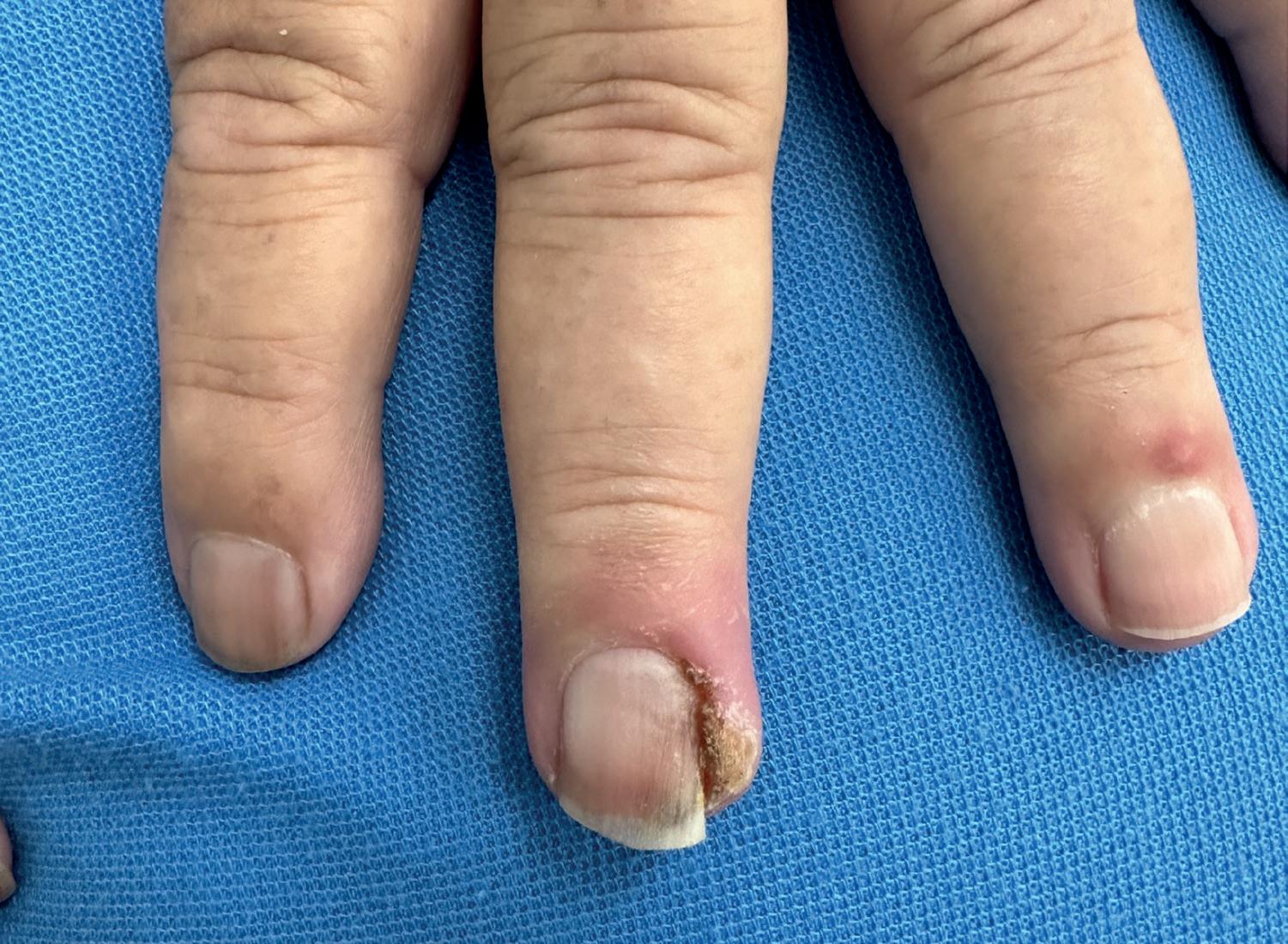
Figura 1.8 Granuloma periungueale: nodulo eritematoso ricoperto da formazioni crostose dolente.
Gli inibitori del EGFR possono indurre anomalie dei peli, dei capelli e del cuoio capelluto: sensibilità cutanea, alterazioni di crescita, colore e consistenza, raramente alopecia. Le alterazioni dei capelli sono frequenti in caso di terapia prolungata con EGFRI.
I pazienti possono sviluppare una lieve alopecia e cambiamenti nella struttura dei capelli, così come una perdita di capelli a chiazze sia con pattern cicatriziali che non cicatriziali.34-36 In genere, la perdita di capelli non cicatriziale migliora dopo la sospensione della terapia (figura 1.9).37 In letteratura è stato riportato che i TKI causano un’alopecia frontale di tipo androgenetico con crescita progressiva dei peli del viso e delle ciglia, più evidente nei pazienti di sesso femminile.11 È stata segnalata anche la possibile insorgenza di poliosi sopraccigliare, con perdita del pigmento delle ciglia e conseguente sviluppo di peli bianchi. Si osserva spesso irsutismo con localizzazione a viso e tronco (figura 1.10).38-40
La tricomegalia consiste in una crescita paradossale, in spessore e lunghezza, delle ciglia. È un raro evento avverso agli EGFRI che di solito si verifica 2-5 mesi dopo l’ini-
Principali tossicità cutanee in corso di terapia con farmaci anti-EGFR 15

Figura 1.9
Paziente affetta da alopecia cicatriziale e croste tenacemente adese al cuoio capelluto insorte dopo terapia con farmaci anti-EGFR.

Figura 1.10
Ipertricosi e rash papulo pustoloso in paziente in terapia con inibitore EGFR.
zio del trattamento e può risolversi in alcune settimane o mesi dopo la sospensione del farmaco.41
La patogenesi non è del tutto chiarita. L’EGFR è espresso nei cheratinociti dello strato più esterno del follicolo pilifero. La sua inibizione blocca la progressione dall’anagen al telogen, portando a una fase anagen aberrante e di conseguenza a una crescita anormale dei capelli e alla formazione di un follicolo pilifero disorganizzato. Tuttavia, questo effetto collaterale tende a persistere per tutta la durata del trattamento e può protrarsi a lungo anche dopo la fine della terapia.
Sono segnalati in letteratura casi di dermatosi pustolosa erosiva dello scalpo in corso di terapia con gefitinib. Si tratta di una rara tossicità dalla patogenesi sconosciuta con esordio variabile da due settimane fino a 3 anni dopo l’inizio della terapia. Si caratterizza per la formazione sul cuoio capelluto di eritema intenso accompagnato da formazione di erosioni e crostosità ed evoluzione verso forme di alopecia cicatriziale. La dermatosi è intensamente dolente e pruriginosa. Sono rilevabili in fase iniziale lesioni pustolose, dal contenuto sterile, ma con tendenza alla sovrainfezione batterica. La tossicità è fortemente invalidante sulla qualità di vita e può essere progressiva nonostante la sospensione del farmaco scatenante (figura 1.11).
Principali tossicità cutanee in corso di terapia con farmaci anti-EGFR 17

L’insorgenza di eventi avversi dermatologici durante la terapia antitumorale è spesso causa di riduzioni della dose e/o ritardi nella somministrazione della terapia prescritta, che possono influire sulla sopravvivenza e sulla qualità di vita dei pazienti. È importante prevenire la comparsa delle tossicità dermatologiche e diagnosticare e trattare quelli inevitabili il prima possibile. Ciò richiede la collaborazione tra oncologi e dermatologi.
Le raccomandazioni generali per tutti i soggetti in trattamento con EGFRI dovrebbero includere le comuni raccomandazioni per la cura della pelle delicata e secca, nonché un’adeguata protezione solare. Un interessante studio trasversale ha determinato che i soggetti sottoposti a terapia oncologica possono beneficiare di minori complicanze evitando docce calde prolungate, il che dovrebbe rientrare nelle raccomandazioni generali di prevenzione della pelle secca.42 Ai pazienti dovrebbe essere consigliato l’uso di una crema idratante giornaliera, preferendo le creme alle lozioni, e una crema solare con un fattore di protezione solare (SPF) 50+. Tutti i prodotti per la cura della pelle non devono essere profumati e i detergenti utilizzati per lavare i vestiti vanno preferiti privi di additivi potenzialmente irritanti.43 9
La terapia profilattica è essenziale nei pazienti trattati con EGFRI per prevenire e ridurre la gravità delle reazioni cutanee. Prendersi cura dei pazienti all’inizio dell’oncoterapia, prima che si manifestino gli effetti collaterali, è la scelta giusta per evitare le tossicità o comunque per ridurne la gravità.
I pazienti devono essere ben informati su quali sono gli eventi comuni, prima di iniziare la terapia, e devono essere avvisati di ridurre al minimo l’esposizione alla luce solare, poiché l’eruzione cutanea può essere più grave nelle aree della pelle esposte al sole. Inoltre, devono essere evitati i saponi a pH basico, le fragranze e le lozioni a base di alcol.
È stato dimostrato che le tossicità dermatologiche predicono la risposta del tumore alla terapia.44 Informare il paziente che le dermatosi rappresentano un indice di una buona risposta alla cura in alcuni casi può alleviare, almeno psicologicamente,
il peso di una nuova malattia che grava su di una persona la cui qualità di vita è già compromessa dal tumore. Gli EGFRI sono idealmente continuati nonostante certe manifestazioni dermatologiche, poiché gli effetti collaterali cutanei possono essere un’indicazione di una risposta efficace.
La prima mossa nella gestione del rash è rappresentata da generali misure preventive che devono essere messe in atto prima ancora di iniziare il percorso antitumorale. Va informato il paziente sulle corrette abitudini da mantenere, su come applicare le creme e su quali procedure evitare o ridurre al minimo per prevenire o attenuare la manifestazione. Ad esempio, va raccomandato di fare il bagno in acqua fredda o tiepida e di applicare una crema emolliente subito dopo il bagno. Si sconsigliano i prodotti da banco senza prescrizione, così come i farmaci topici per l’acne (perossido di benzoile, tretinoina, adapalene, tazarotene) che possono essere erroneamente applicati sulle pustole del viso e indurre secchezza e irritazione.
In generale, si raccomanda di preferire detergenti delicati senza alcool, preferibilmente oleosi o prodotti a basso o nullo contenuto di tensioattivi. Per il cuoio capelluto si consiglia l’utilizzo di shampoo delicati per uso frequente. È consigliabile preferire prodotti ricchi di grassi vegetali per l’idratazione (karité, argan, oliva) ed evitare quelli derivati da minerali (paraffina, petrolio, PEG).
Nel caso in cui la tossicità si sviluppasse nonostante le misure preventive si raccomanda di rivolgersi al dermatologo per una valutazione, prima dell’automedicazione che deve essere sistematicamente scoraggiata. Nella nostra esperienza la terapia preventiva può ridurre l’incidenza e il grado dell’eruzione papulo-pustolosa, consentendo di evitare l’uso di antibiotici sistemici, che dovrebbero essere necessari solo in caso di resistenza alla terapia topica o in caso di superinfezione.
In letteratura è descritto il trattamento farmacologico profilattico, soprattutto con l’uso degli EGFRI mAb (cetuximab e panitumumab), che hanno un’alta incidenza riportata di tossicità dermatologica. La profilassi viene effettuata con doxiciclina 100200 mg al giorno o minociclina 100 mg al giorno per 8 settimane e può essere presa in considerazione se non ci sono controindicazioni significative.45 Il trattamento profilattico con tetraciclina, minociclina o doxiciclina ha dimostrato di ridurre la frequenza delle eruzioni papulo-pustolose di grado 2-3 e di migliorare i punteggi relativi alla qualità della vita in diversi studi di controllo randomizzati.46 Questa classe di antibiotici, infatti, ha un effetto antinfiammatorio e protettivo dei tessuti. La doxiciclina è un’opzione sicura nei pazienti con disfunzione renale, mentre la minociclina è appropriata durante l’estate o nelle regioni con un alto indice di raggi UV, perché è meno fotosensibilizzante.
Misure preventive e gestione terapeutica 21
La somministrazione di antibiotici dovrebbe iniziare il primo giorno del trattamento con inibitori dell’EGFR, perché la tossicità può insorgere già dopo pochi giorni dopo la prima dose.
Sebbene la terapia profilattica con antibiotici della classe delle tetracicline abbia generalmente dimostrato di ridurre la gravità delle reazioni cutanee papulo-pustolose, non riduce necessariamente il numero di pazienti complessivamente colpiti e non è associata a un miglioramento della sopravvivenza.47 48 È importante notare che la terapia con tetracicline non sembra influenzare negativamente la risposta del tumore alla terapia con EGFR, e anzi può avere effetti antitumorali benefici.49-51 Emergono studi riguardo lo sviluppo di antibiotico-resistenza degli Stafilococchi e degli Streptococchi alla clindamicina e alla doxiciclina nei pazienti trattati con antibiotici per la profilassi o per la terapia reattiva del rash per periodi superiori alle quattro settimane. Per questo motivo la terapia profilattica con antibiotici deve essere valutata con attenzione dall’oncologo e dal dermatologo e utilizzata solo nei casi in cui sia strettamente necessaria.52
Il trattamento delle eruzioni papulo-pustolose sintomatiche dipende dalla presentazione e dalla sintomatologia del paziente. Il rash papulo-pustoloso nelle forme lievi è trattato con l’applicazione di una crema idratante non grassa e di una protezione solare con un alto SPF, per proteggere la cute dai danni UV. Il trattamento locale può includere corticosteroidi topici come idrocortisone o metilprednisolone e antibiotici (clindamicina, metronidazolo, eritromicina).11 53 54
Se l’EGFRI deve essere continuato, si raccomanda un algoritmo di trattamento basato sul grado dell’eruzione papulo-pustolosa. Per le eruzioni di grado 1-2, il trattamento dovrebbe includere un antibiotico topico (ad esempio clindamicina 1% gel) e uno steroide topico (ad esempio desonide 0,05% crema, idrocortisone 2,5% crema; per il cuoio capelluto sono utili le formule in soluzione o in lozione). Il prurito associato a queste eruzioni può essere gestito con gli emollienti, gli steroidi topici e gli antistaminici (ad esempio cetirizina, fexofenadina, idrossizina).54 55
Per un’eruzione di grado 2 o un’eruzione di grado 1 che non è migliorata con la sola terapia topica, si consiglia di iniziare uno steroide potente o molto potente (ad esempio mometasone o clobetasolo crema) insieme a una tetraciclina orale (ad esempio doxiciclina 100 mg una o due volte al giorno o minociclina 100 mg due volte al giorno).
Se l’eruzione è caratterizzata da numerose pustole, oppure l’eruzione non è responsiva alle cure o si sospetta una sovrainfezione, si consiglia vivamente di prelevare un tampone da una o più pustole e di inviarlo per una coltura batterica. Occasionalmente, è possibile una crescita batterica che mostra resistenza alla classe delle tetracicline.
In questi casi, per trattare l’eruzione papulo-pustolosa la terapia deve essere guidata dall’antibiogramma e può basarsi sull’utilizzo orale di cefalosporine di prima generazione (ad esempio cefalessina) o trimetoprim/sulfametossazolo, se la crescita batterica mostra sensibilità a queste classi di antibiotici.
Va inoltre sottolineata l’importanza di escludere infezioni virali concomitanti, come l’Herpes Simplex Virus, se clinicamente indicato.56 Il trattamento con tetraci-
cline migliora le eruzioni papulo-pustolose di solito dopo 1-4 settimane di terapia. In generale, si consiglia un trattamento per 4 settimane fino alla valutazione della risposta alla terapia. Se l’eruzione cutanea non dovesse migliorare sarebbe indicato ridurre la dose di farmaco anti-EGFR o di sospenderne l’utilizzo.
Per le eruzioni di grado 3, gli steroidi topici di alta potenza (ad esempio clobetasolo 0,05% crema, fluocinonide 0,05% crema) possono essere utilizzati per brevi periodi di tempo, in combinazione con antibiotici orali e corticosteroidi orali (ad esempio prednisone 50 mg /die), con buona efficacia.
La xerosi e il prurito sono effetti collaterali comuni, spesso associati fra loro, causati dalla terapia con EGFRI e possono verificarsi fino al 35% dei pazienti in trattamento. La prevenzione, la diagnosi precoce e la terapia tempestiva sono importanti per evitare questi effetti collaterali. La cute secca è una causa comune di prurito durante il trattamento con farmaci antitumorali e può essere trattata con creme idratanti ed emollienti. Può essere utile lavare la pelle con un detergente oleoso. Altre misure preventive includono evitare i bagni lunghi, utilizzare detergenti delicati, applicare una crema idratante dopo la doccia, preferire abiti di cotone anziché vestiti sintetici o di lana. Le fissurazioni cutanee indotte dal grattamento possono essere dolorose e sede di superinfezione batterica o raramente da Herpes Simplex Virus. In caso di desquamazione significativa o presenza di lesioni crostose, si possono usare creme con basse concentrazioni di urea.
Il medico può prescrivere prodotti antinfiammatori (steroidi, inibitori della calcineurina) e antibiotici (in caso di sovrinfezioni). Se i sintomi non si risolvono con una terapia locale, può essere utile la terapia orale oppure la fototerapia con luce ultravioletta B a banda stretta (NBUVB).
Le terapie orali per il prurito includono gli antistaminici, gabapentinoidi, antagonisti del recettore della neurochinina-1, agenti immunomodulanti, steroidi, antidepressivi.55 61 62
Per il prurito di grado 1, è indicato l’uso di steroidi topici in creme o unguenti due volte al giorno (ad esempio triamcinolone, mometasone, clobetasolo) o un antipruriginoso topico (pramoxina 1%, mentolo 0,5%).59
Per il prurito di grado 2, si consiglia di aggiungere antistaminici orali (cetirizina, idrossizina).
Per il prurito di grado 3, considerare l’aggiunta di steroidi orali (0,5 mg/kg al giorno) o gabapentin/pregabalin; infine, solo se questi trattamenti non funzionano dopo almeno 4 settimane, può essere considerata la riduzione della dose o l’interruzione della terapia. Inoltre, l’aprepitant si dimostra promettente per il trattamento del prurito da EGFRI attraverso l’inibizione del recettore della neurochinina-1.55 61 62
La gestione della mucosite orale si concentra su misure preventive fra cui la cura del cavo orale, il risciacquo della bocca con bicarbonato, la modifica della dieta. Prima di iniziare il trattamento è fortemente raccomandato sottoporsi ad una visita odontostomatologica per trattare qualsiasi anomalia dentale, parodontale o protesica eventualmente presente. L’igiene orale di base e alcune modifiche della dieta sono fondamentali in quanto possono alleviare il dolore. A seconda del trattamento, possono essere raccomandate dall’oncologo alcune misure preventive o speciali collutori.60 61 Consigli pratici per la cura della mucosite da dare ai pazienti includono: mantenere una buona igiene orale (lavare i denti dopo ogni pasto usando il filo interdentale, sciacquare la bocca con collutori, pulire le protesi rimovibili); evitare cibi piccanti, acidi, duri, croccanti e/o cibi e liquidi molto caldi; evitare collutori contenenti alcool e dentifricio con laurilsolfato di sodio, prodotti antimicotici o antimicrobici senza indicazioni specifiche, bevande alcoliche, fumo. Per la prevenzione delle mucositi nasali è utile il lavaggio frequente con soluzione fisiologica o soluzioni ipertoniche.
Per i casi di mucosite orale sviluppatesi nonostante le misure preventive, le terapie tipiche includono gel o paste steroidee antinfiammatorie topiche, lavaggi antisettici o analgesici.11 In caso di irritazione oculare persistente, è necessario consultare l’oftalmologo per evitare effetti collaterali oculari significativi.62 In caso di mucosite nasale un approccio terapeutico consiste nell’utilizzo di steroidi per via locale (fluticasone furoato) o via orale.
In alcuni casi può essere necessario modificare la dose o interrompere il trattamento e aggiungere steroidi orali (ad esempio prednisone 25-50 mg /die) per mitigare i fenomeni infiammatori e alleviare la sintomatologia.
Il trattamento delle alterazioni ungueali associate agli EGFRI deve iniziare dalle misure preventive. Per prevenire gli effetti avversi sulle unghie e sui tessuti periungueali, si deve consigliare ai pazienti di evitare traumi ripetuti e pressioni sulle unghie e sui letti ungueali, utilizzare guanti protettivi, evitare il contatto prolungato con l’acqua, non utilizzare prodotti per la rimozione e l’indurimento dello smalto, tagliare regolarmente le unghie, applicare quotidianamente emollienti topici e lacche per unghie, indossare calzature comode e larghe e calze di cotone all’inizio del trattamento.63
È importante incoraggiare una cura delicata della pelle delle mani e dei piedi evitando traumi e manipolazioni delle unghie e delle aree periungueali. Questo include l’evitare di mordere, fare la manicure, tagliare le cuticole o traumatizzare in altro modo l’area. Per le unghie fragili, l’uso di lacche per unghie può prevenire la disidratazione e dare maggiore resistenza; sia l’idrossipropilchitosano che il poliuretano 16%
sono lacche non farmacologiche approvate per questo uso. Inoltre, gli integratori di biotina e i multivitaminici possono essere utili per rafforzare le unghie.
La paronichia inizialmente non ha una genesi infettiva, ma l’infiammazione persistente può essere un segno di sovrainfezione da parte di organismi come Staphylococcus aureus e Candida albicans 64 Pertanto, è sempre importante eseguire una coltura dell’area interessata se si sospetta un’infezione, in particolare in presenza di essudato purulento.
Il trattamento iniziale della paronichia dovrebbe includere bagni antisettici (con detergenti alla clorexidina) e soluzioni antibatteriche, nonché una crema o un unguento steroideo topico potente ogni giorno se la zona interessata non è infetta.64 Per l’eccesso di tessuto di granulazione e per i granulomi piogeni, si possono utilizzare varie modalità di trattamento topico, tra cui le creme steroidee, la cauterizzazione del granuloma con una soluzione di fenolo all’8%, la crioterapia con azoto liquido, il nitrato d’argento acquoso al 10% settimanale o la laserterapia con laser CO2. Si raccomanda l’uso di antibiotici per via orale per le lesioni più gravi (ad esempio doxiciclina 100-200 mg die per 4 settimane).63 64
Lo standard di cura per il granuloma piogenico è la chirurgia con la rimozione parziale della lamina ungueale e della matrice, la distruzione fisica del tessuto di granulazione e la fenolizzazione, ma le lesioni raramente possono recidivare.65 In aggiunta e come terapia sperimentale, la terapia fotodinamica può essere un trattamento utile.66
Nei pazienti con lesioni multiple concomitanti, si dovrebbe privilegiare un trattamento conservativo, con un’oncodermatologia di supporto, pur mantenendo una terapia mirata. Se necessario, in stretta collaborazione con un podologo, è possibile correggere la curvatura dell’unghia. Si possono utilizzare anche nastro adesivo estensibile, una combinazione di corticosteroidi topici e/o la pomata alla mupirocina che possono contribuire a migliorare i sintomi e a prevenire le infezioni, bagni antisettici e nitrato d’argento. Anche il timololo topico si è rivelato utile per il granuloma piogenico periungueale.67
La terapia antitumorale nei casi severi può essere ridotta nel dosaggio o temporaneamente interrotta per favorire la cicatrizzazione dei tessuti periungueali e la risoluzione dell’infiammazione.
Cambiamenti dei capelli e dei peli
In caso di tricomegalia delle ciglia con l’uso di EGFRI, può essere necessario tagliare le ciglia per prevenire cheratiti e blefariti. È inoltre utile spazzolare frequentemente i capelli se sono appena crespi o ricci.9 68 Per l’ipertricosi facciale o i peli indesiderati, si può usare l’eflornitina per via topica quotidiana. I pazienti possono anche prendere in considerazione l’epilazione con laser Alessandrite per la rimozione permanente dei peli. Per l’alopecia non cicatriziale, si può utilizzare il minoxidil orale oppure per uso topico al 5% due volte al giorno per gli uomini o al 2% nelle donne.11 69 I pazienti spesso
Misure preventive e gestione terapeutica 25
preferiscono la formulazione in schiuma rispetto alla soluzione per la facilità d’uso, ed è necessario attendere almeno 6 mesi per vedere i risultati dell’uso.
Per l’alopecia cicatriziale, si consiglia di rivolgersi tempestivamente a un dermatologo, poiché si può prendere in considerazione l’inizio di una soluzione, una schiuma o una lozione di steroidi topici da applicare quotidianamente sul cuoio capelluto.11
I farmaci anti-EGFR, da soli o in associazione alla chemioterapia, prolungano la sopravvivenza dei malati oncologici. Tuttavia, il loro utilizzo si associa comunemente a tossicità dermatologiche. Ciò si verifica in circa l’80% dei casi trattati, influenzando negativamente la qualità di vita e la quotidianità.70 Le tossicità cutanee, infatti, spesso deturpano il volto e l’aspetto fisico, con un grave impatto psicologico che porta il paziente a ritirarsi dalle relazioni sociali, con ripercussioni simili a quelle date dall’alopecia o dalle mutilazioni per procedure chirurgiche come la mastectomia o la colectomia. Questo, associato a manifestazioni cliniche come prurito, dolore, limitazione funzionale, può portare l’oncologo a rivalutare la validità della cura, il dosaggio o lo schema terapeutico. Il malato oncologico è già fragilizzato fisicamente ed emotivamente dalla patologia tumorale di per sé, e la presenza di un’ulteriore malattia che si aggiunge a quelle già presenti può avere effetti devastanti. Se non vengono affrontate correttamente, infatti, le tossicità cutanee possono essere causa di riduzione della dose dei farmaci antitumorali salvavita o, nei casi più gravi, di interruzione temporanea o sospensione della terapia.71
Le modifiche nello schema antitumorale devono essere guidate da scelte ponderate e basate su una valutazione multidisciplinare. I punti chiave da analizzare sono numerosi e fra questi sicuramente vanno menzionati lo stato generale del malato, il tipo e la gravità degli eventi avversi dermatologici riscontrati, lo stadio della patologia tumorale, la possibilità del paziente di gestire gli eventi avversi, l’impatto sulla qualità di vita, la disponibilità di cure alternative contro il cancro.
Non di rado ci si trova a dover gestire casi complessi con tossicità pericolose per la salute generale del paziente in cui l’unica soluzione è l’interruzione definita del trattamento anti-EGFR. Tuttavia, grandi difficoltà possono derivare anche dai pazienti che sviluppano tossicità complessivamente non gravi, ma con un significativo impatto sulla qualità di vita. Si pensi ad esempio a un prurito intenso che impedisce al malato il riposo notturno, oppure allo sviluppo di granulomi periungueali delle mani in un paziente lavoratore con attività manuale, oppure a un rash del viso non
responsivo alle misure preventive e alle terapie reattive oppure alle alopecie cicatriziali.
La presenza di effetti collaterali dermatologici è spesso espressione di una buona efficacia della cura antitumorale e le valutazioni sulla diminuzione, interruzione o sospensione di un trattamento valido nel ridurre la progressione tumorale non devono essere mai scontate. Le misure preventive, qualora esistenti, dovrebbero essere applicate ogni volta sin dall’inizio della cura consentendo una riduzione del numero complessivo di dermatosi riscontrate e della loro severità. Qualora dovessero fallire, l’algoritmo per guidare le scelte cliniche deve iniziare con la valutazione multidisciplinare del paziente, che va correttamente informato sulla lunga durata delle tossicità, parallelamente alla terapia. Viene spesso dimenticato che la presenza di un effetto collaterale sulla pelle è strettamente correlata all’assunzione del farmaco che, qualora non sospeso, può essere causa di persistenza di tossicità oppure scarsa risposta clinica alla terapia dermatologica. Va ricordato inoltre che alcune manifestazioni possono essere tardive o recidivare anche molti mesi dopo il primo episodio.
Molte delle malattie cutanee esaminate nei capitoli precedenti possono essere infatti mitigate o trattate tramite le terapie dermatologiche, consentendo al paziente di proseguire la propria cura. Per questo motivo, salvo casi di tossicità severe, il principio generale è quello di evitare sospensioni o riduzioni nel dosaggio se prima non si è certi che la tossicità in questione non possa essere in qualche modo trattata.
1. Ciardiello F, Tortora G. EGFR antagonists in cancer treatment. N Engl J Med 2008; 358(11): 1160-74.
2. Nolting M, Schneider-Merck T, Trepel M. Lapatinib. Recent Results Cancer Res 2014; 201: 125-43.
3. Rosen AC, Case EC, Dusza SW, et al. Impact of dermatologic adverse events on quality of life in 283 cancer patients: a questionnaire study in a dermatology referral clinic. Am J Clin Dermatol 2013; 14(4): 327-33.
4. Osio A, Mateus C, Soria J-C, et al. Cutaneous side-effects in patients on long-term treatment with epidermal growth factor receptor inhibitors. Br J Dermatol 2009; 161(3): 515-21.
5. Green MR, Couchman JR. Differences in human skin between the epidermal growth factor receptor distribution detected by EGF binding and mono- clonal antibody recognition. J Invest Dermatol 1985; 85(3): 239-45.
6. Lacouture ME. Mechanisms of cutaneous toxicities to EGFR inhibitors. Nat Rev Cancer 2006; 6(10): 803-12.
7. Lichtenberger BM, Gerber PA, Holcmann M, et al. Epidermal EGFR controls cutaneous host defense and prevents inflammation. Sci Transl Med 2013; 5(199): 199ra111.
8. Pastore S, Lulli D, Girolomoni G. Epidermal growth factor receptor signaling in keratinocyte biology: implications for skin toxicity of tyrosine kinase inhibitors. Arch Toxicol 2014; 88(6): 1189203.
9. Macdonald JB, Macdonald B, Golitz LE, LoRusso P, Sekulic A. Cutaneous adverse effects of targeted therapies: Part I: inhibitors of the cellular membrane. J Am Acad Dermatol 2015; 72(2): 203-18 (quiz 219-20).
10. Bachet JB, Peuvrel Lucie, Bachmeyer Claude, et al. Folliculitis induced by EGFR inhibitors, preventive and curative efficacy of tetracyclines in the management and incidence rates according to the type of EGFR inhibitor administered: a systematic literature review. Oncologist 2012; 17(4): 555-68.
11. Lacouture ME, Anadkat Milan J, Bensadoun
René-Jean, et al. Clinical practice guidelines for the prevention and treatment of EGFR inhibitorassociated dermatologic toxicities. Support Care Cancer 2011; 19(8): 107995.
12. Scope A, Agero ALC, Dusza SW et al. Randomized double-blind trial of prophylactic oral minocycline and topical tazarotene for cetuximabassociated acne-like eruption. J Clin Oncol 2007; 25(34): 5390-6.
13. Journagan S, Obadiah J. An acneiform eruption due to erlotinib: prognostic implications and management. J Am Acad Dermatol 2006; 54: 358-60.
14. Peuvrel L, Bachmeyer C, Reguiai Z, et al. Semiology of skin toxicity associated with epidermal growth factor receptor (EGFR) inhibitors. Support Care Cancer 2012; 20(5): 909-21.
15. Eilers RE Jr, Gandhi M, Patel JD, et al. Dermatologic infections in cancer patients treated with epidermal growth factor receptor inhibitor therapy. J Natl Cancer Inst 2010; 102(1): 47-53.
16. Gerber PA, Kukova G, Buhren BA, Homey B. Density of Demodex folliculorum in patients receiving epidermal growth factor receptor inhibitors. Dermatology 2011; 222(2): 144-7.
17. Vanhoefer U, Tewes M, Rojo F, et al. Phase I study of the humanized antiepidermal growth factor receptor monoclonal antibody EMD72000 in patients with advanced solid tumors that express the epidermal growth factor receptor. J Clin Oncol 2004; 22: 175-84.
18. Koutcher LD, Wolden S, Lee N. Severe radiation dermatitis in patients with locally advanced head and neck cancer treated with concurrent radiation and cetuximab. Am J Clin Oncol 2009; 32(5): 472-6.
19. Tejwani A, Wu S, Jia Y, Agulnik M, Millender L, Lacouture ME. Increased risk of high-grade dermatologic toxicities with radiation plus epidermal growth factor receptor inhibitor therapy. Cancer 2009; 115(6): 1286-99.
20. Jatoi A, Thrower A, Sloan JA, et al. Does sunscreen prevent epidermal growth factor receptor (EGFR) inhibitor-induced rash? Results of a placebocontrolled trial from the North Central Cancer Treatment Group (N05C4). Oncologist 2010; 15(9): 1016-22.
21. Lynch TJ Jr, Kim ES, Eaby B, Garey J, West DP, Lacouture ME. Epidermal growth factor receptor inhibitorassociated cutaneous toxicities: an evolving paradigm in clinical management. Oncologist 2007; 12(5): 610-21.
22. Hu JC, Sadeghi P, PinterBrown LC, Yashar S, Chiu MW. Cutaneous side effects
of epidermal growth factor receptor inhibitors: clinical presentation, pathogenesis, and management. J Am Acad Dermatol 2007; 56: 317-26.
23. Valentine J, Belum VR, Duran J, et al. Incidence and risk of xerosis with targeted anticancer therapies. J Am Acad Dermatol 2015; 72: 656-67.
24. Ensslin CJ, Rosen AC, Wu S, Lacouture ME. Pruritus in patients treated with targeted cancer therapies: systematic review and meta-analysis. J Am Acad Dermatol 2013; 69: 708-20.
25. Hu JC, Sadeghi P, PinterBrown LC, Yashar S, Chiu MW. Cutaneous side effects of epidermal growth factor receptor inhibitors: clinical presentation, pathogenesis, and management. J Am Acad Dermatol 2007; 56: 317-26.
26. Agero AL, Dusza SW, Benvenuto-Andrade C, Busam KJ, Myskowski P, Halpern AC. Dermatologic side effects associated with the epidermal growth factor receptor inhibitors. J Am Acad Dermatol 2006; 55: 657-70.
27. Nanney LB, Magid M, Stoscheck CM, King LE Jr. Comparison of epidermal growth factor binding and receptor distribution in normal human epidermis and epidermal appendages. J Invest Dermatol 1984; 83: 385-93.
28. Busam KJ, Capodieci P, Motzer R, Kiehn T, Phelan D, Halpern AC. Cutaneous side-effects in cancer patients treated with the antiepidermal growth factor receptor antibody C225. Br J Dermatol 2001; 144(6): 1169-76.
29. Vigarios E, Epstein JB, Sibaud V. Oral mucosal changes induced by
anticancer targeted therapies and immune checkpoint inhibitors. Support Care Cancer 2017; 25(5): 1713-39.
30. Chang GC, Yang TY, Chen KC, et al. Paronychia and skin hyperpigmentation induced by gefitinib in advanced non-small cell lung cancer. J Clin Oncol 2004; 22(22): 4646-8.
31. Balagula Y, Barth Huston K, Busam KJ, et al. Dermatologic side effects associated in the MEK 1/2 inhibitor, selumetinib. Invest New Drugs 2011; 29(5): 1114-12.
32. Deslandres M, Sibaud V, Chevreau C, et al. Cutaneous side effects associated with epidermal growth factor receptor and tyrosine kinase inhibitors. Ann Dermatol Venereol 2008; 1: 16-24.
33. Garden BC, Wu S, Lacouture ME. The risk of nail changes with epidermal growth factor receptor inhibitors: a systematic review of the literature and metaanalysis. J Am Acad Dermatol 2012; 67(3): 400-8.
34. Aw DC, Tan EH, Chin TM, Lim HL, Lee HY, Soo RA. Management of epidermal growth factor receptor tyrosine kinase inhibitorrelated cutaneous and gastrointestinal toxicities. Asia Pac J Clin Oncol 2018; 14(1): 23-31.
35. Pongpudpunth M, Demierre MF, Goldberg LJ. A case report of inflammatory nonscarring alopecia associated with the epidermal growth factor receptor inhibitor erlotinib. J Cutan Pathol 2009; 36(12): 1303-7.
36. Yang BH, Bang CYL, Byun JW, et al. A case of cicatricial alopecia
associated with erlotinib. Ann Dermatol 2011; 23(Suppl 3): S350-3.
37. Hueso L, Sanmartín O, Nagore E, et al. Chemotherapy-induced acral erythema: a clinical and histopathologic study of 44 cases. Actas Dermosifiliogr 2008; 99: 281-90.
38. Dueland S, Sauer T, LundJohansen F, Ostenstad B, Tveit KM. Epidermal growth factor receptor inhibition induces trichomegaly. Acta Oncol 2003; 42(4): 345-6.
39. Fabbrocini G, Panariello L, Cacciapuoti S, Bianca D, Ayala F. Trichomegaly of the eyelashes during therapy with epidermal growth factor receptor inhibitors: report of 3 cases. Dermatitis 2012; 23(5): 237-8.
40. Rodriguez NA, Ascaso FJ. Trichomegaly and poliosis of the eyelashes during cetuximab treatment of metastatic colorectal cancer. J Clin Oncol 2011; 29(18): e532-3.
41. Vergou T, Stratigos AJ, Karapanagiotou EM, et al. Facial hypertrichosis and trichomegaly developing in patients treated with the epidermal growth factor receptor inhibitor erlotinib. J Am Acad Dermatol 2010: 63(2): e56-8.
42. Byun HJ, Lee H J, Yang JI, et al. Daily skin care habits and the risk of skin eruptions and symptoms in cancer patients. Ann Oncol 2012; 23(8): 1992-8.
43. Hofheinz RD, Deplanque G, Komatsu Y, et al. Recommendations for the prophylactic management of skin reactions induced by epidermal growth factor receptor inhibitors in patients with solid tumors.
Oncologist 2016; 21(12): 1483-91.
44. Liu HB, Wu Y, Lv T-F, et al. Skin rash could predict the response to EGFR tyrosine kinase inhibitor and the prognosis for patients with non-small cell lung cancer: a systematic review and meta-analysis. PLoS One 2013; 8(1): e55128.
45. Lacouture ME, Anadkat M, Jatoi A, Garawin T, Bohac C, Mitchell E. Dermatologic toxicity occurring during anti-EGFR monoclonal inhibitor therapy in patients with metastatic colorectal cancer: a systematic review. Clin Colorectal Cancer 2018; 17(2): 85-96.
46. Bachet JB, Peuvrel L, Bachmeyer C, et al. Folliculitis induced by EGFR inhibitors, preventive and curative efficacy of tetracyclines in the management and incidence rates according to the type of EGFR inhibitor administered: a systematic literature review. Oncologist 2012; 17: 555-68.
47. Jatoi A, Rowland K, Sloan Jeff A, et al. Tetracycline to prevent epidermal growth factor receptor inhibitorinduced skin rashes: results of a placebo-controlled trial from the North Central Cancer Treatment Group (N03CB). Cancer 2008; 113(4): 847-53.
48. Jatoi A, Dakhil SR, Sloan JA, et al. Prophylactic tetracycline does not diminish the severity of epidermal growth factor receptor (EGFR) inhibitorinduced rash: results from the North Central Cancer Treatment Group (Supplementary N03CB). Support Care Cancer 2011; 19(10): 1601-7.
49. Melosky B, Anderson H, Burkes RL, et al. Pan
Canadian Rash Trial: a randomized phase III trial evaluating the impact of a prophylactic skin treatment regimen on epidermal growth factor receptortyrosine kinase inhibitorinduced skin toxicities in patients with metastatic lung cancer. J Clin Oncol 2016; 34(8): 810-5.
50. Yamada M, Iihara H, Fujii H, et al. Prophylactic effect of oral minocycline in combination with topical steroid and skin care against panitumumabinduced acneiform rash in metastatic colorectal cancer patients. Anticancer Res 2015; 35(11): 6175-81.
51. Dascalu B, Kennecke HF, Lim HJ, et al. Prophylactic versus reactive treatment of acneiform skin rashes from epidermal growth factor receptor inhibitors in metastatic colorectal cancer. Support Care Cancer 2016; 24(2): 799-805.
52. Hirotsu K, Dang TM, Li S, et al. Association of antibiotic resistance with antibiotic use for epidermal growth factor receptor inhibitorrelated papulopustular eruption. JAMA Dermatol 2019; 155(7): 848-50.
53. Jacot W, Bessis D, Jorda E, et al. Acneiform eruption induced by epidermal growth factor receptor inhibitors in patients with solid tumours. Br J Dermatol 2004; 151(1): 238-41.
54. Brown J, Su Y, Nelleson D, Shankar P, Mayo C. Management of epidermal growth factor receptor inhibitor-associated rash: a systematic review. J Community Support Oncol 2016; 14(1): 21-8.
55. Fischer A, Rosen AC, Ensslin CJ, Wu S, Lacouture ME. Pruritus to anticancer agents targeting the EGFR, BRAF, and CTLA-4.
Dermatol Ther 2013; 26(2): 135-48.
56. Eilers RE Jr, Gandhi M, Patel JD, et al. Dermatologic infections in cancer patients treated with epidermal growth factor receptor inhibitor therapy. J Natl Cancer Inst 2010; 102: 47-53.
57. Gerber PA, Buhren BA, Homey B. More on aprepitant for erlotinibinduced pruritus. N Engl J Med 2011; 364(5): 486-7.
58. Vincenzi B, Tonini G, Santini D. Aprepitant for erlotinib-induced pruritus. N Engl J Med 2010; 363(4): 397-8.
59. Roe E, Muret MPG, Marcuello E, Capdevila J, Pallarés C, Alomar A. Description and management of cutaneous side effects during cetuximab or erlotinib treatments: a prospective study of 30 patients. J Am Acad Dermatol 2006; 55(3): 429-37.
60. Vigarios E, Epstein JB, Sibaud V. Oral mucosal changes induced by anticancer targeted therapies and immune checkpoint inhibitors. Support Care Cancer 2017; 25(5): 1713-39.
61. Peterson DE, BoersDoets CB, Bensadoun RJ, Herrstedt J. Management of oral and gastrointestinal mucosal injury: ESMO
clinical practice guidelines for diagnosis, treatment, and follow-up. Ann Oncol 2015; 26(Suppl 5): v139-51.
62. Melichar B, Nemcova I. Eye complications of cetuximab therapy. Eur J Cancer Care (Engl) 2007; 16(5): 439-43.
63. Robert C, Sibaud V, Mateus C, et al. Nail toxicities induced by systemic anticancer treatments. Lancet Oncol 2015; 16(4): e181-9.
64. Eames T, Grabein B, Kroth J, Wollenberg A. Microbiological analysis of epidermal growth factor receptor inhibitor therapyassociated paronychia. J Eur Acad Dermatol Venereol 2010; 24(8): 958-60.
65. Dreno B, Bensadoun RJ, Humbert P, et al. Algorithm for dermocosmetic use in the management of cutaneous side-effects associated with targeted therapy in oncology. J Eur Acad Dermatol Venereol 2013; 27(9): 1071-80.
66. Fabbrocini G, Annunziata MC, Donnarumma M, Cacciapuoti S, Marasca C, Tosti A. Photodynamic therapy for periungual pyogenic granuloma-like during chemotherapy: our preliminary results. Support Care Cancer 2018; 26(5): 1353-5.
67. Sollena P, Mannino M, Tassone F, Calegari MA, D’Argento E, Peris
K. Efficacy of topical beta-blockers in the management of EGFRinhibitor induced paronychia and pyogenic granuloma-like lesions: case series and review of the literature. Drugs Context 2019 6; 8: 212613.
68. Cohen PR, Escudier SM, Kurzrock R. Cetuximabassociated elongation of the eyelashes: case report and review of eyelash trichomegaly secondary to epidermal growth factor receptor inhibitors. Am J Clin Dermatol 2011; 12(1): 63-7.
69. Martora F, Vastarella M, Fattore D, Patri A, Fabbrocini G, Cantelli M. Oral Minoxidil for chemotherapy-induced alopecia. Skin Appendage Disord 2022; 8(6): 508-10.
70. De Luca R, Lo Coco G, Addeo R, et al. Quality of life in patients with severe skin reactions in course of first-generation epidermal growth factor receptor inhibitors monoclonal antibodies (our experience with cetuximab). World J Oncol 2021; 12(4): 104-10.
71. Fattore D, Fabbrocini G, Sibaud V, Sollena P. The urgent need of dermatologists for cancer patients in Italy. Ital J Dermatol Venerol 2023; 158(3): 274-5.
4. Impatto degli effetti collaterali in corso di terapia antitumorale sulla qualità di vita
Come ampiamente discusso nei capitoli precedenti, i nuovi farmaci utilizzati in oncologia garantiscono un importante effetto terapeutico sulla malattia metastatica e migliorano senza dubbio le curve di sopravvivenza e il tasso di risposta globale. Tuttavia in una percentuale che varia, in base ai farmaci, dal 50 all’80% dei pazienti, essi provocano una tossicità cutanea fortemente impattante sulla quotidianità del paziente, soprattutto quando la tossicità riguarda volto e collo.
Le lesioni cutanee iniziano con un eritema facciale spesso diffuso anche al collo, pelle xerotica e desquamata con eruzione papulosa diffusa e pruriginosa, che evolve in pustole con formazione di croste giallastre fortemente aderenti.1-3
La tossicità dermatologica più comunemente riportata è infatti il rash o eruzione papulo-pustolosa, più spesso di grado lieve-moderato o grave in circa il 18% dei pazienti.4 Le lesioni cutanee spesso deturpano il volto e l’aspetto fisico dei pazienti, con un grave impatto psicologico che porta talvolta il paziente a ritirarsi dalle relazioni sociali, un impatto che potremmo assimilare a quello dell’alopecia o delle mutilazioni derivanti da procedure chirurgiche come la mastectomia o la colectomia.5 6 Un approccio multidisciplinare, con uno psico-oncologo in équipe, è senza dubbio il modo migliore per gestire adeguatamente il paziente.7 Almeno due terzi dei pazienti soffrono di effetti collaterali associati alla chemioterapia con conseguenti sensazioni di angoscia, ansia e depressione. Questi effetti collaterali rappresentano una componente determinante nell’esperienza della malattia e nel percorso di guarigione e compromettono in modo significativo la qualità di vita (QoL).
In effetti, la maggior parte dei pazienti teme, non tanto la malattia, ma le conseguenze fisiche e psicologiche del trattamento.8 I pazienti sperimentano modifica negativa dell’immagine e del concetto di sé, un abbassamento dell’autostima, modifiche dello stile di vita e nelle relazioni affettive e coniugali. Le emozioni che accompagnano questo processo di “perdita” vanno dallo shock alla negazione, dalla rabbia alla paura, dall’amarezza al dolore, fino alla depressione e alla disperazione.9 L’imbarazzo
e la vergogna possono trasformarsi in esperienze persecutorie, come ad esempio il sentirsi stigmatizzati ed evitati.
I progressi nella ricerca oncologica e le nuove strategie terapeutiche volte a gestire la cronicizzazione della malattia oncologica, hanno reso la QoL di importanza cruciale per la sopravvivenza del paziente. Questo aspetto può influenzare il benessere psicologico del paziente e l’aderenza alle cure.10Sempre più studi stanno valutando l’impatto psicologico delle tossicità cutanee nei pazienti oncologici e la misura in cui l’eruzione cutanea può influire sul benessere psicologico dei pazienti.11
Il termine QoL è viene utilizzato per valutare il benessere generale degli individui e delle società. Secondo l’Organizzazione Mondiale della Sanità (OMS), la QoL è definita come la percezione individuale della vita, dei valori, degli obiettivi, degli standard e degli interessi nel quadro della cultura. Esistono numerosi fattori correlati alle patologie che possono influenzare la QoL. La quantità di sintomi sperimentati da un individuo affetto da una o più patologie è stata correlata alla QoL.12 La QoL viene, inoltre, sempre più utilizzata come misura primaria di esito negli studi per valutare l’efficacia del trattamento.13
La riduzione della mortalità e la garanzia, al contempo, di una qualità della vita ottimale correlata alla salute sono forse gli obiettivi principali dell’assistenza medica; in effetti, il miglioramento della QoL è importante quanto il beneficio di sopravvivenza che può fornire un trattamento farmacologico.12
Questo perché le patologie acute e croniche, così come le tossicità che si possono sviluppare in seguito alla somministrazione di un farmaco, possono trasformare notevolmente la quotidianità di un individuo, impedendogli di svolgere le attività più disparate e limitando la completa espressione della persona. Infatti, le reazioni dermatologiche da oncoterapia possono influenzare ampiamente le ADL (Activities of Daily Living), ovvero tutte quelle attività che vengono eseguite normalmente nella quotidianità di un individuo.
Ad esempio, i pazienti che sviluppano rash, disordini bollosi autoimmuni, alterazioni delle mucose e degli annessi cutanei possono presentare delle difficoltà a compiere normali attività come fare la spesa, occuparsi della casa/del giardino, praticare sport, lavorare; potrebbero dover modificare la scelta del proprio abbigliamento per trovare un maggiore sollievo (ad esempio indossare tessuti che procurino minor prurito, prediligere tessuti maggiormente traspiranti, evitare indumenti troppo aderenti che vadano a comprimere le lesioni), o semplicemente potrebbero scegliere di modificare la scelta dei propri vestiti per nascondere lesioni che gli procurano disagio e imbarazzo.
È altresì doveroso considerare che le tossicità cutanee potrebbero influire sui rapporti sociali più disparati del paziente in ambito sia familiare sia lavorativo. Le dinamiche per cui questo può accadere sono perlopiù associate a imbarazzo, disagio, alla volontà di non procurare preoccupazione e suscitare domande: è infatti molto frequente che il paziente limiti la propria partecipazione a uscite o eventi di qualun-
Impatto degli effetti collaterali in corso di terapia antitumorale sulla qualità di vita 37
que genere per non diventare oggetto di curiosità altrui. Altre volte, invece, sono le sensazioni di prurito, fastidio, bruciore, ecc., oltre che i fattori di natura psicologica, a limitare il paziente e la sua vita sociale.
Risulta evidente, dunque, che le modifiche nell’aspetto fisico hanno un impatto negativo sulla percezione del body image (immagine corporea) del/della paziente. Con il termine body image ci si riferisce a un costrutto multidimensionale che comprende aspetti cognitivi, comportamentali e affettivi legati al proprio aspetto fisico. Nel caso delle donne con diagnosi oncologica, l’alterazione del body image dovuta a un trattamento antitumorale può essere accompagnata da sentimenti di vergogna, bassa autostima o evitamento sociale.14 15 Per alcune pazienti, la percezione negativa legata alla propria immagine corporea persiste anche una volta terminato il trattamento antitumorale16 17 e può, a sua volta, avere un impatto avverso sulla qualità della vita. Il body image, infatti, è considerato un fattore essenziale per la qualità della vita connessa alla salute (Health Related Quality Of Life, HRQoL) nelle pazienti oncologiche,18 tanto che la lenta risoluzione della tossicità dermatologica rallenta, anche a trattamenti conclusi, la percezione di guarigione e di benessere.
Esistono dei metodi di valutazione che, attraverso la somministrazione di questionari, consentono di valutare l’impatto di patologie, trattamenti ecc. sulla qualità di vita e sull’immagine corporea.
Alcune scale sono applicabili trasversalmente a tutte le patologie dermatologiche (DLQI), ma esistono anche dei grading più specifici come ad esempio il questionario EORTC-C30 (Organizzazione Europea per la Ricerca e il Trattamento del Cancro). Il questionario EORTC QLQ-C30 19-21 è un questionario validato dal gruppo EORTC. Il questionario è composto da 30 item su una scala a quattro punti (1 = “no”; 4 = “molto”) che valutano la QoL dei pazienti oncologici negli ultimi 7 giorni. Cinque item valutano la scala di funzionalità generale (fisica, emotiva, cognitiva e sociale), tre item valutano la scala dei sintomi (fatica, nausea/vomito e dolore), un item valuta la scala della salute globale/qualità della vita, e sei item valutano lo stato fisico (respirazione, insonnia, anoressia, costipazione, diarrea e impatto economico della malattia). Un ulteriore questionario è denominato BUT (Test del disagio corporeo). Il BUT 22 è un questionario di autovalutazione psicometrico per la valutazione clinica del disagio legato all’immagine corporea. Il test è composto da 71 item con risposte a scelta multipla ed è diviso in due parti. La prima parte (BUT a) è composta da 34 item il cui punteggio medio complessivo identifica il grado di severità della percezione dell’immagine corporea di un individuo (Global Severity Index, GSI). Si compone di cinque aree: fobia del peso (WP), preoccupazioni per l’immagine corporea (BIC), prevenzione (A), automonitoraggio compulsivo (CSM) e depersonalizzazione (D). La seconda parte (BUT b) è composta da 37 item che elencano parti e funzioni del corpo. La gravità è espressa in una scala da 0 a 5, dove 0 corrisponde all’assenza di problemi in quel settore e 5 alla massima gravità.
QoL e percezione dell’immagine corporea influenzano l’accettazione della diagnosi, una migliore compliance terapeutica, l’adattamento alla malattia e, di conseguenza, una maggiore accettazione degli effetti collaterali. Nell’era della “medicina di precisione”, la considerazione della QoL consente di concentrarsi in modo specifico su una nuova dimensione, sui problemi e sui bisogni specifici e personali di un paziente.23
I numerosi studi analizzati all’interno del capitolo hanno dimostrato come lo stato d’animo del paziente oncologico, già messo a dura prova dalla malattia, risenta fortemente dello stress e degli effetti del trattamento cui va incontro. Un’esigenza pressante che impone una presa in carico del paziente non solo dal punto di vista oncologico, ma anche dermatologico e multidisciplinare. Riconsegnare alla vita un organismo profondamente minato è un’esigenza imprescindibile per il paziente oncologico, che affianco alla terapia tradizionale necessita di un controllo mirato a contrastare e/o, dove possibile, risolvere, ridurre i danni che, altrimenti e inesorabilmente, subirebbe sulla propria pelle e sul proprio aspetto estetico dalla terapia che gli salva la vita. Risulta sempre più evidente, pertanto, la necessità di offrire al paziente oncologico un servizio di supporto preventivo e correttivo, ma anche la valutazione e la standardizzazione di nuovi protocolli diagnostico-terapeutici al fine di poter ottenere ulteriori progressi anche dal punto di vista della prevenzione nell’ambito di un rapporto collaborativo tra i diversi specialisti.
L’interesse verso il paziente e verso tutte le problematiche relative al percorso oncologico che egli intraprende rientra nel processo di umanizzazione delle cure e dell’assistenza clinica. È fondamentale curare e prendersi cura del paziente in maniera multidisciplinare attraverso la creazione di una rete assistenziale che garantisca il raggiungimento di uno stato di benessere sia fisico che psichico.
Da queste consapevolezze nasce l’esigenza di un team multidisciplinare che possa gestire a 360° il paziente, offrendo un servizio di accudimento dermatologico, psicologico, metabolico ed endocrinologico, nonché di prevenzione e terapia delle tossicità cutanee per pazienti in oncoterapia. Tra le preoccupazioni che più destabilizzano il paziente vi sono le tossicità delle terapie, tra cui spiccano sicuramente l’alopecia e i rash papulo-pustolosi, tossicità che minano maggiormente la qualità di vita e la socialità soprattutto delle pazienti di sesso femminile, come è stato dimostrato nella letteratura scientifica: esiste una quota di pazienti che meditano di non intraprendere le terapie oncologiche salvavita per non incorrere nella perdita dei capelli. Tali effetti
sulla propria pelle sono visibili quotidianamente e ricordano al paziente ininterrottamente la propria malattia con compromissione della QoL, che spesso costringe anche a interrompere le cure. La dermocosmesi permette di prevenire e trattare gli effetti sia della malattia sia della terapia, mostrando a sé stessi e agli altri un aspetto sano e piacevole, dando nuova vita e speranza al paziente che si sentirà in grado di vincere la battaglia col cancro.
La rete di professionisti che ruota intorno al paziente oncologico affetto da tossicità cutanea è ampia e il network che si instaura tra le varie figure è fondamentale perché si possano ottenere i migliori risultati per il paziente. Comunicazione costante, trasparenza e collaborazione sono imprescindibili.
Le figure che irrinunciabilmente dovrebbero essere coinvolte sono le seguenti:
• Dermatologo. Il dermatologo ha il compito di prevenire, quando possibile, porre correttamente diagnosi e trattare efficacemente le tossicità indotte dall’oncoterapia attraverso terapie mediche e/o dermochirurgiche domiciliari e ambulatoriali, indirizzando inoltre il paziente ad effettuare le consulenze specialistiche più appropriate in base al singolo caso e al singolo paziente.
• Infermiere specializzato. L’infermiere rappresenta una figura imprescindibile per l’ambulatorio multidisciplinare dedicato al paziente oncologico con tossicità cutanea e spesso costituisce un punto di riferimento nell’accoglienza e nell’accompagnamento del paziente stesso durante il percorso diagnostico-terapeutico. Si tratta di una figura professionale molto delicata che deve riuscire, più che in ogni altro ambito, a integrare le competenze scientifiche e assistenziali con quelle umane ed empatiche; risulta indispensabile nella pratica clinica (durante visite, interventi dermato-chirurgici, biopsie cutanee, medicazioni di ferite e ulcere ecc.), nella corretta gestione dell’ambulatorio e, non in ultimo, nel supporto morale ed emotivo per i pazienti oncologici attraverso l’ascolto, il dialogo e la disponibilità all’aiuto.
• Oncologo. L’oncologo, in aggiunta al complesso compito di inquadramento diagnostico terapeutico, può accompagnare il paziente affetto da tossicità dermatologica indirizzandolo fin da subito al centro specialistico più vicino.
• Radioterapista. Le radiodermiti sono sicuramente da annoverare tra le prime tossicità collegate all’oncoterapia. I radioterapisti spesso riescono a gestire queste dermatosi ma, fortunatamente, la collaborazione con i dermatologi sta diventando nel corso degli anni sempre più costante e spesso i pazienti vengono valutati prima dell’inizio delle sedute di radioterapia per poter avere le prescrizioni più appropriate e i consigli più adatti alla prevenzione e alla gestione della dermatosi.
• Endocrinologo. L’inquadramento metabolico e ormonale è fondamentale nei pazienti oncologici, in particolar modo per quei pazienti affetti da carcinoma della mammella, carcinomi tiroidei, carcinomi ovarici.
• Nutrizionista. Sempre più frequentemente la richiesta di poter consultare un nutrizionista arriva direttamente dai pazienti: è ormai noto e dimostrato che un corretto regime alimentare influisca positivamente sulla gestione della patologia e delle tossicità ad essa correlate.
41
• Ginecologo. La consulenza con i colleghi ginecologi risulta spesso necessaria per gestire e trattare importanti situazioni di xerosi vaginale derivanti dalle terapie oncologiche nonché per pazienti in procinto di intraprendere il percorso oncologico e che sono interessate alla crioconservazione degli ovociti.
• Psicologo. La malattia neoplastica si caratterizza come una patologia complessa che richiede un approccio multidisciplinare e integrato al paziente che coinvolge anche lo psico-oncologo, in grado di valutarne i diversi aspetti e le diverse implicazioni, non solo dal punto di vista fisico ma anche psicologico.24 25 Lo psico-oncologo è di fondamentale importanza proprio nella percezione soggettiva del paziente delle strategie di coping per affrontare la malattia. L’intervento psicologico prevede la presa in carico del paziente attraverso colloqui settimanali e la somministrazione di strumenti psicometrici, promuovendo strategie di coping adattive che permettano al paziente di non abbattersi e di non arrendersi ai primi sintomi della tossicità cutanea. Il lavoro psico-oncologico dovrebbe concentrarsi sulla minimizzazione del disagio e sviluppare strategie di coping attive, motivando il paziente a non interrompere il trattamento. L’approccio psicoeducativo, con una corretta informazione sugli effetti collaterali e sul loro possibile trattamento, potrebbe giocare un ruolo decisivo nella compliance terapeutica e nel benessere psicologico del paziente.26
Come già sottolineato, il trattamento più comune per le reazioni cutanee correlate all’oncoterapia e in particolare agli inibitori dell’EGFR, è rappresentato dall’applicazione orale o topica di antibiotici della famiglia delle tetracicline e/o di corticosteroidi, da soli o in combinazione con creme idratanti e protezione solare.27-35
Questi farmaci, che includono doxiciclina e minociclina, sono comunemente utilizzati per trattare l’eruzione papulo-pustolosa e contribuire a ridurne i sintomi. La prescrizione di queste cure è stata storicamente solo reattiva (cioè successiva allo sviluppo della reazione cutanea); tuttavia, molti autori sostengono che la gestione profilattica delle reazioni cutanee dovrebbe essere raccomandata per tutti i pazienti trattati con EGFR-inibitori. Infatti, un’adeguata gestione profilattica potrebbe ridurre efficacemente la gravità (anche se forse non l’incidenza) delle reazioni cutanee nei pazienti trattati con inibitori dell’EGFR, e quindi avrebbe il potenziale di apportare benefici diretti ai pazienti e di migliorare l’aderenza al farmaco.
Sono stati condotti numerosi studi per valutare la gestione profilattica delle reazioni cutanee correlate agli inibitori dell’EGFR utilizzando antibiotici della famiglia delle tetracicline, spesso in combinazione con approcci topici.27-35 In una varietà di indicazioni, tra cui mCRC e NSCLC, il trattamento profilattico con farmaci della classe delle tetracicline (doxiciclina, minociclina, ecc.) ha ridotto significativamente la gravità delle reazioni cutanee, ecc. Tuttavia, nonostante la riduzione della loro gravità, va sottolineato che non è stata sempre osservata una riduzione dell’incidenza dei vari gradi di reazione cutanea.
Vi sono, nondimeno, alcuni studi che invece riportano dati contrastanti rispetto a quanto esposto. Jatoi et al.27 28 nel loro studio originale hanno osservato che la tetraciclina potrebbe ridurre la gravità delle reazioni cutanee quando viene somministrata proattivamente; in uno studio di follow-up che includeva nuovi dati e una revisione dei dati prospettici raccolti in precedenza, gli autori hanno stabilito che il trattamento con tetraciclina non ha ridotto significativamente l’incidenza o la gravità delle reazioni cutanee.27 28 Questa incongruenza può essere attribuita allo sbilanciamento deri-
vante dai molteplici tipi di tumore esaminati simultaneamente (polmone, gastrointestinale e altre sedi) rispetto alle singole indicazioni valutate dagli altri studi. Infine, i dati di questi studi potrebbero essere stati influenzati dall’utilizzo di una dose non sufficiente di tetraciclina.
In conclusione, la preponderanza delle prove disponibili stabilisce che il trattamento con tetracicline riduce la gravità delle reazioni cutanee quando viene somministrato in modo profilattico.
Alla luce dei dati sopra citati, che suggeriscono che la profilassi può potenzialmente ridurre la gravità delle reazioni cutanee di due o più volte, è però fondamentale sottolineare e ricordare in primo luogo gli effetti avversi più comuni delle tetracicline (fotosensibilità, disturbi gastrici, diarrea, vertigini) e in secondo luogo l’aumentata probabilità di sviluppare antibiotico-resistenza per i pazienti che assumono tetraciclina sistemica per un periodo superiore alle 4 settimane;36 è, dunque, sempre opportuno valutare il singolo paziente e decidere, considerando il rapporto costo-beneficio, la terapia più adatta.
Al di là dell’utilizzo preventivo dell’antibioticoterapia, vi sono alcune raccomandazioni, basate sull’evidenza scientifica, per la gestione profilattica delle reazioni cutanee. Le raccomandazioni generali quotidiane dovrebbero essere applicate sin dalla prima dose di farmaco chemioterapico e prevedono una detersione delicata, l’idratazione della cute e la protezione dalla luce solare con appositi filtri in crema. I detergenti dovrebbero essere oleosi e poco schiumogeni mentre l’idratazione dovrebbe essere ottenuta quotidianamente utilizzando creme prive di profumi e/o conservanti.
In aggiunta alle prescrizioni dermocosmetiche, per un efficace approccio proattivo, i pazienti oncologici con tossicità cutanea possono beneficiare, in alcuni casi, del camouflage. Per camouflage si intende una tecnica di trucco volta a nascondere inestetismi cutanei di vario genere (angiomi, vitiligine, cicatrici ecc.) e tale tecnica può altresì aiutare a mimetizzare o rendere meno visibili, ad esempio, le papulo-pustole tipiche dei rash o può aiutare i pazienti ad accettare in maniera più graduale e dolce gli esiti di interventi chirurgici più o meno deturpanti. Si tratta senza dubbio di uno strumento utile a migliorare la qualità di vita dei pazienti e l’autostima dei pazienti e rappresenta un valido aiuto nelle relazioni sociali. Gli obiettivi principali di una o più sedute di camouflage per i pazienti oncologici sono: correggere le alterazioni di colore e struttura della cute; creare un effetto naturale; assicurare un risultato duraturo. Le prime sessioni sono praticate da personale formato e specializzato e sono volte a istruire i pazienti per far sì che possano praticare le stesse tecniche in autonomia; poche sessioni sono solitamente sufficienti a formare i pazienti (figure 6.1, 6.2, per gentile concessione della dott.ssa Gabriella Calabrò).
In conclusione, attuando una gestione delle reazioni cutanee completa e olistica, è possibile migliorare la qualità della vita dei pazienti ed evitare le interruzioni della somministrazione dei farmaci oncologici (che potrebbero, a loro volta, portare a una riduzione dell’efficacia).
Gestione proattiva, cosmesi e camouflage 45
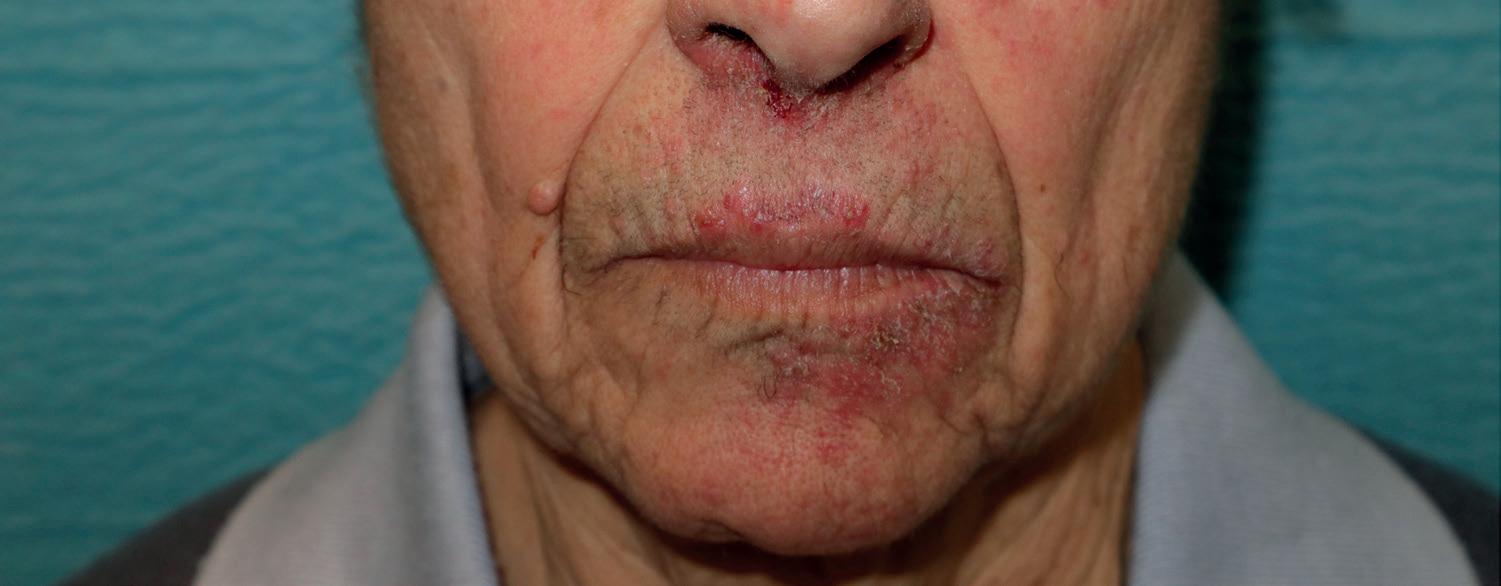

Prima/dopo seduta di camouflage per un’eruzione papulo-pustolosa.


1. Labianca R, La Verde N, Garassino MC. Development and clinical indications of cetuximab. Int J Biol Markers 2007; 22(1 Suppl 4): S40-46.
2. Marventano S, Forjaz M, Grosso G, et al. Health related quality of life in colorectal cancer patients: state of the art. BMC Surg 2013; 13(Suppl 2): S15.
3. Sultan S, Fisher DA, Voils CI, Kinney AY, Sandler RS, Provenzale D. Impact of functional support on health-related quality of life in patients with colorectal cancer. Cancer 2004; 101(12): 2737-43.
4. Au HJ, Karapetis CS, O’Callaghan CJ, et al. Health-related quality of life in patients with advanced colorectal cancer treated with cetuximab: overall and KRAS-specific results of the NCIC CTG and AGITG CO.17 Trial. J Clin Oncol 2009; 27(11): 1822-8.
5. LoRusso P. Toward evidence-based management of the dermatologic effects of EGFR inhibitors. Oncology (Williston Park) 2009; 23(2): 186-94.
6. De Luca R, Lo Coco G, Ardizzone A, et al.
Psychological distress and quality of life in ostomy patients with colorectal cancer: a systematic review of the literature. Acta Medica Mediterranea 2018; 34: 1357.
7. Lemieux J, Maunsell E, Provencher L. Chemotherapy induced alopecia and effects on quality of life among women with breast cancer: a literature review. Psychooncology 2008; 17(4): 317-3.
8. Dunn J, Lynch B, Aitken J, Leggett B, Pakenham K, Newman B. Quality of life and colorectal cancer: a review. Aust N Z J Public Health 2003; 27(1): 41-53.
9. Lacouture ME, Mitchell EP, Piperdi B, et al. Skin toxicity evaluation protocol with panitumumab (STEPP), a phase II, open-label, randomized trial evaluating the impact of a pre-emptive skin treatment regimen on skin toxicities and quality of life in patients with metastatic colorectal cancer. J Clin Oncol 2010; 28(8): 1351-7.
10. Schover LR. The impact of breast cancer on sexuality, body image, and intimate
relationships. CA Cancer J Clin 1991; 41(2): 112-20.
11. Heydarnejad MS, Hassanpour DA, Solati DK. Factors affecting quality of life in cancer patients undergoing chemotherapy. Afr Health Sci 2011; 11(2): 266-70.
12. Guyatt G, Feeny DH, Patrick DL. Measuring health-related quality of life. Ann Inter Med 1993; 118: 622-9.
13. Casso D, Buist DS, Taplin S. Quality of life of 5-10 year breast cancer survivors diagnosed between age 40 and 49. Health Qual Life Outcomes 2004; 2: 25.
14. Lehmann V, Hagedoorn M, Tuinman MA. Body image in cancer survivors: a systematic review of casecontrol studies. J Cancer Surviv 2015; 9(2): 339-48.
15. Rumsey N, Harcourt D. Body image and disfigurement: issues and interventions. Body Image 2004; 1(1): 83-97.
16. Falk Dahl CA, Reinertsen KV, Nesvold IL, Fosså SD, Dahl AA. A study of body image in long-term breast cancer survivors. Cancer 2010; 116(15): 3549-57.
17. Rhoten BA, Murphy B, Ridner SH. Body image in patients with head and neck cancer: a review of the literature. Oral Oncol 2013; 49(8): 753-60.
18. Taylor-Ford M, Meyerowitz BE, D’Orazio LM, Christie KM, Gross ME, Agus DB. Body image predicts quality of life in men with prostate cancer. Psychooncology 2013; 22(4): 756-61.
19. Trotti A, Colevas AD, Setser A, et al. CTCAE v3.0: development of a comprehensive grading system for the adverse effects of cancer treatment. Semin Radiat Oncol 2003; 13(3).
20. Snyder CF, Blackford AL, Okuyama T, et al. Using the EORTC-QLQ-C30 in clinical practice for patient management: identifying scores requiring a clinician’s attention. Qual Life Res 2013; 22(10): 2685-91.
21. Sprangers MA, Cull A, Bjordal K, Groenvold M, Aaronson NK. The European Organization for research and treatment of cancer. Approach to quality of life assessment: guidelines for developing questionnaire modules. EORTC Study Group on Quality of Life. Qual Life Res 1993; 2(4): 287-95.
22. Cuzzolaro M, Vetrone G, Marano G, et al. Body uneasiness test BUT. In: Conti L, ed. Repertorio delle scale di valutazione in psichiatria. SEE 2000; 3(1): 759-61.
23. Chernyshov PV. The evolution of quality of life assessment and use in dermatology. Dermatology 2019; 235: 167-74.
24. Wagner LI, Lacouture ME. Dermatologic toxicities associated with EGFR inhibitors: the
clinical psychologist’s perspective. Impact on health-related quality of life and implications for clinical management of psychological sequelae. Oncology (Williston Park) 2007; 21(11 Suppl 5): 34-6.
25. Cicero G, De Luca R, Dieli F. Progression-free survival as a surrogate endpoint of overall survival in patients with metastatic colorectal cancer. Onco Targets Ther 2018; 11: 3059-63.
26. Teker F, Demirag G, Erdem D, et al. Quality of life in colorectal cancer patients during chemotherapy in the era of monoclonal antibody therapies. J Buon 2015; 20(2): 43- 51.
27. Jatoi A, Rowland K, Sloan JA, et al. Tetracycline to prevent epidermal growth factor receptor inhibitorinduced skin rashes: results of a placebo controlled trial from the North Central Cancer Treatment Group (N03CB). Cancer 2008; 113: 847-53.
28. Jatoi A, Dakhil SR, Sloan JA, et al. Prophylactic tetracycline does not diminish the severity of epidermal growth factor receptor (EGFR) inhibitor induced rash: results from the North Central Cancer Treatment Group (Supplementary N03CB). Support Care Cancer 2011; 19: 1601-7.
29. Scope A, Agero AL, Dusza SW et al. Randomized double-blind trial of prophylactic oral minocycline and topical tazarotene for cetuximabassociated acne-like eruption. J Clin Oncol 2007; 25: 5390-6.
30. Deplanque G, Radj G, Vergnenegre A, et al. Doxycycline for prevention of erlotinib-induced rash in non-small-cell lung cancer patients after failure of
first-line chemotherapy: a randomized, open-label trial. J Am Acad Dermatol 2016; 74: 1077-85.
31. Lacouture ME, Mitchell EP, Piperdi B, et al. Skin toxicity evaluation protocol with panitumumab (STEPP), a phase II, openlabel, randomized trial evaluating the impact of a pre-emptive skin treatment regimen on skin toxicities and quality of life in patients with metastatic colorectal cancer. J Clin Oncol 2010; 28: 1351-7.
32. Melosky B, Anderson H, Burkes RL, et al. Pan Canadian rash trial: a randomized phase III trial evaluating the impact of a prophylactic skin treatment regimen on epidermal growth factor receptor tyrosine kinase inhibitorinduced skin toxicities in patients with metastatic lung cancer. J Clin Oncol 2016; 34: 810-5.
33. Arrieta O, Vega-Gonzalez MT, Lopez-Macias D, et al. Randomized, openlabel trial evaluating the preventive effect of tetracycline on afatinib induced skin toxicities in non-small cell lung cancer patients. Lung Cancer 2015; 88: 282-8.
34. Kobayashi Y, Komatsu Y, Yuki S, et al. Randomized controlled trial on the skin toxicity of panitumumab in Japanese patients with metastatic colorectal cancer: HGCSG1001 study; J-STEPP. Future Oncol 2015; 11: 617-27.
35. Yamada M, Iihara H, Fujii H, et al. Prophylactic effect of oral minocycline in combination with topical steroid and skin care against panitumumab induced acneiform rash in metastatic colorectal cancer patients. Anticancer Res 2015; 35: 6175-81.
36. Hirotsu K, Dang TM, Li S, Neal JW, Pugliese S, Subramanian A, Kwong BY. Association of antibiotic resistance with antibiotic
use for epidermal growth factor receptor inhibitorrelated papulopustular eruption. JAMA Dermatol 2019; 155(7): 848-50.
Segnalazione delle reazioni avverse sospette La segnalazione delle reazioni avverse sospette che si verificano dopo l’autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite l’Agenzia Italiana del Farmaco, sito web: https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse. 4.9 Sovradosaggio Ad oggi esiste un’esperienza limitata con dosi singole superiori a 400 mg/m² di superficie corporea o somministrazioni settimanali di dosi superiori a 250 mg/m² di superficie corporea. In studi clinici condotti con dosi fino a 700 mg/m² somministrate ogni 2 settimane, il profilo di sicurezza è stato conforme al profilo descritto nel paragrafo 4.8. 5. PROPRIETÀ FARMACOLOGICHE 5.1 Proprietà farmacodinamiche Categoria farmacoterapeutica: agenti antineoplastici, anticorpi monoclonali, codice ATC: L01FE01 Meccanismo d’azione Cetuximab è un anticorpo monoclonale chimerico IgG1 specificamente diretto contro il recettore per il fattore di crescita epidermico (EGFR). Le vie di trasduzione del segnale dipendenti dall’EGFR sono coinvolte nel controllo della sopravvivenza cellulare, della progressione del ciclo cellulare, dell’angiogenesi, della migrazione cellulare e dell’invasione/ metastasi cellulare. Cetuximab si lega all’EGFR con un’affinità che è circa 5-10 volte più alta di quella dei ligandi endogeni. Cetuximab blocca il legame con i ligandi endogeni dell’EGFR, inibendo così la funzione del recettore. Esso inoltre induce l’internalizzazione dell’EGFR, il che può provocare la down-regulation dell’EGFR stesso. Cetuximab inoltre indirizza le cellule immunitarie effettrici citotossiche verso le cellule tumorali che esprimono l’EGFR (citotossicità cellulo-mediata anticorpodipendente, ADCC). Cetuximab non si lega ad altri recettori facenti parte della famiglia HER. Il prodotto proteico del protooncogene RAS (sarcoma del ratto) è un trasduttore centrale del segnale a valle per l’EGFR. Nei tumori, l’attivazione di RAS tramite l’EGFR contribuisce ad un aumento della proliferazione, della sopravvivenza e della produzione di fattori proangiogenici mediati da EGFR. RAS è una delle famiglie di oncogeni attivate più di frequente nei tumori umani. Le mutazioni dei geni RAS in determinati ‘punti caldi’ sugli esoni 2, 3 e 4 comportano l’attivazione costitutiva delle proteine RAS indipendentemente dai segnali dell’EGFR. Effetti farmacodinamici In esperimenti sia in vitro che in vivo, cetuximab inibisce la proliferazione e induce l’apoptosi di cellule tumorali umane che esprimono l’EGFR. In vitro cetuximab inibisce la produzione di fattori angiogenici da parte delle cellule tumorali, e blocca la migrazione delle cellule endoteliali. In vivo cetuximab inibisce l’espressione di fattori angiogenici da parte delle cellule tumorali e causa una riduzione della neo-vascolarizzazione tumorale e delle metastasi. Immunogenicità Lo sviluppo di anticorpi umani anti-chimerici (HACA) è un effetto di classe degli anticorpi monoclonali chimerici. I dati attuali sullo sviluppo degli anticorpi HACA sono limitati. Nel complesso, titoli misurabili di HACA sono stati osservati nel 3,4% dei pazienti studiati, con incidenza compresa tra 0% e 9,6% negli studi condotti nelle indicazioni in oggetto. Ad oggi non sono disponibili dati conclusivi circa l’effetto neutralizzante di HACA su cetuximab. La comparsa di HACA non è stata correlata al verificarsi di reazioni di ipersensibilità o di qualsiasi altro effetto indesiderato di cetuximab. Carcinoma del colon-retto Per determinare l’espressione dell’EGFR nel materiale tumorale è stato utilizzato un test diagnostico immunoistochimico (EGFR pharmDx). Il tumore veniva considerato esprimente l’EGFR se poteva essere identificata almeno una cellula colorata. Circa il 75% dei pazienti con carcinoma metastatico del colon-retto selezionati per gli studi clinici presentavano un tumore esprimente l’EGFR ed erano quindi considerati idonei ad essere trattati con cetuximab. L’efficacia e la sicurezza di cetuximab non sono state documentate in pazienti con tumori in cui l’EGFR non è stato determinato. Dati ottenuti in studi clinici dimostrano che i pazienti affetti da mCRC con mutazioni di RAS hanno una probabilità molto bassa di trarre beneficio dal trattamento con cetuximab o da una associazione di cetuximab e chemioterapia; e inoltre è stato osservato un significativo effetto negativo sul tempo di PFS in associazione con FOLFOX4. Cetuximab in monoterapia o in associazione con chemioterapia è stato valutato in 5 studi clinici controllati randomizzati e in diversi studi di supporto. I 5 studi randomizzati sono stati condotti con un totale di 3.734 pazienti con mCRC, con espressione rilevabile di EGFR e performance status ECOG ≤ 2. La maggior parte dei pazienti inclusi nello studio aveva un performance status ECOG ≤ 1. In tutti gli studi, cetuximab è stato somministrato come descritto nel paragrafo 4.2. Lo stato dell’esone 2 di KRAS è stato riconosciuto come fattore predittivo per il trattamento con cetuximab in 4 degli studi controllati randomizzati (EMR 62 202 013, EMR 62 202 047, CA225006 e CA225025). Lo stato mutazionale del KRAS era disponibile per 2.072 pazienti. Negli studi EMR 62 202 013 ed EMR 62 202 047 sono state effettuate analisi supplementari a posteriori che hanno permesso di determinare anche mutazioni dei geni RAS (NRAS e KRAS) in aggiunta a quelle dell’esone 2 di KRAS. Solo nello studio EMR 62 202-007 non è stato possibile eseguire un’analisi a posteriori. In uno studio di fase III, randomizzato e controllato, condotto da un gruppo di ricercatori indipendenti (investigator-initiated) (COIN, COntinuous chemotherapy plus cetuximab or INtermittent chemotherapy – Chemioterapia cOntinua più cetuximab o chemioterapia INtermittente) è stato inoltre indagato l’uso di cetuximab in associazione con chemioterapia. In questo studio, l’espressione di EGFR non rappresentava un criterio di inclusione. I campioni di tumore dell’81% circa dei pazienti sono stati analizzati retrospettivamente per identificare l’espressione di KRAS. Nello studio FIRE-3, studio clinico di fase III di tipo non commerciale (investigator-sponsored), è stato confrontato il trattamento con FOLFIRI in associazione con cetuximab o con bevacizumab nel trattamento di prima linea di pazienti affetti da mCRC con esone 2 di KRAS non mutato. Sono state valutate ulteriori analisi a posteriori delle mutazioni dei geni RAS diversi dall’esone 2 di KRAS. Cetuximab in associazione con chemioterapia • EMR 62 202-013: questo studio randomizzato, condotto con pazienti con mCRC che non avevano ricevuto trattamenti precedenti per la patologia metastatica, ha confrontato la associazione di cetuximab e irinotecan più 5-fluorouracile infusionale/acido folinico (FOLFIRI) (599 pazienti) rispetto alla sola chemioterapia (599 pazienti). La proporzione di pazienti affetti da tumore KRAS non mutato rispetto alla popolazione di pazienti valutabile per lo stato di KRAS è risultata essere del 63%. Per la valutazione dello stato di RAS sono state prese in considerazione mutazioni diverse da quelle dell’esone 2 del gene KRAS a partire da tutti i campioni di tumore valutabili nella popolazione con esone 2 del gene KRAS non mutato (65%). La popolazione con mutazioni di RAS è costituita da pazienti con mutazioni dell’esone 2 di KRAS note e con altre mutazioni di RAS identificate.
I dati di efficacia ottenuti da questo studio sono riassunti nella tabella sottostante:
Variabile / statistica
Popolazione con RAS non mutato
Cetuximab più FOLFIRI (N=178) FOLFIRI (N=189)
Popolazione con RAS mutato
Cetuximab più FOLFIRI (N=246) FOLFIRI (N=214)
OS mesi, mediana (95% CI) 28,4 (24,7; 31,6) 20,2 (17,0; 24,5) 16,4 (14,9; 18,4) 17,7 (15,4; 19,6)
Rapporto di rischio (95% CI) 0,69 (0,54; 0,88) 1,05 (0,86; 1,28)
valore p 0,0024 0,6355
PFS mesi, mediana (95% CI) 11,4 (10,00; 14,6) 8,4 (7,4; 9,4) 7,4 (6,4; 8,0) 7,5 (7,2; 8,5)
Rapporto di rischio (95% CI) 0,56 (0,41; 0,76) 1,10 (0,85; 1,42)
valore p 0,0002 0,4696
ORR % (95% CI) 66,3 (58,8; 73,2) 38,6 (31,7; 46,0) 31,7 (25,9; 37,9) 36,0 (29,6; 42,8)
Odds ratio (95% CI) 3,1145 (2,0279; 4,7835) 0,8478 (0,5767; 1,2462)
valore p <0,0001 0,3970
CI = confidence interval, intervallo di confidenza, FOLFIRI = irinotecan più 5-FU/AF infusionale, ORR = objective response rate, tasso di risposta obiettiva (pazienti con risposta completa o risposta parziale), OS = overall survival time, tempo di sopravvivenza globale, PFS = progression-free survival time, tempo di sopravvivenza libera da progressione • EMR 62 202-047: questo studio randomizzato, condotto con pazienti con mCRC che non avevano ricevuto trattamenti precedenti per la patologia metastatica, ha confrontato la associazione di cetuximab e oxaliplatino più 5-fluorouracile infusionale/acido folinico (FOLFOX4) ad infusione continua (169 pazienti) rispetto alla sola chemioterapia (168 pazienti). La proporzione di pazienti affetti da tumore senza mutazioni di KRAS rispetto alla popolazione di pazienti valutabile per lo stato di KRAS è risultata essere del 57%. Per la valutazione dello stato di RAS sono state prese in considerazione mutazioni diverse da quelle dell’esone 2 del gene KRAS a partire da tutti i campioni di tumore valutabili nella popolazione con esone 2 di KRAS non mutato. La popolazione con mutazioni di RAS è costituita da pazienti con mutazioni dell’esone 2 di KRAS note e con altre mutazioni di RAS identificate.
I dati di efficacia ottenuti da questo studio sono riassunti nella tabella sottostante:
Variabile / statistica
Popolazione con RAS non mutato Popolazione con RAS mutato
Cetuximab più FOLFOX4 (N=38) FOLFOX4 (N=49)
Cetuximab più FOLFOX4 (N=92) FOLFOX4 (N=75)
OS mesi, mediana (95% CI) 19,8 (16,6; 25,4) 17,8 (13,8; 23,9) 13,5 (12,1; 17,7) 17,8 (15,9; 23,6)
Rapporto di rischio (95% CI) 0,94 (0,56; 1,56) 1,29 (0,91; 1,84) valore p 0,8002 0,1573
PFS
mesi, mediana (95% CI) 12,0 (5,8; NV) 5,8 (4,7; 7,9) 5,6 (4,4; 7,5) 7,8 (6,7; 9,3) Rapporto di rischio (95% CI) 0,53 (0,27; 1,04) 1,54 (1,04; 2,29)
valore p 0,0615 0,0309
ORR
% (95% CI) 57,9 (40,8; 73,7) 28,6 (16,6; 43,3) 37,0 (27,1; 47,7)
(38,9; 62,4)
Odds ratio (95% CI) 3,3302 (1,375; 8,172) 0,580 (0,311; 1,080)
valore p 0,0084 0,0865
CI = confidence interval, intervallo di confidenza, FOLFOX4 = oxaliplatino più 5-FU/AF ad infusione continua, ORR = objective response rate, tasso di risposta obiettiva (pazienti con risposta completa o risposta parziale), OS = overall survival time, tempo di sopravvivenza globale, PFS = progression-free survival time tempo di sopravvivenza libera da progressione, NV = non valutabile In particolare, è stato osservato un effetto negativo dell’aggiunta di cetuximab nella popolazione con mutazioni di RAS. • COIN: questo studio randomizzato in aperto, a 3 bracci, condotto su 2.445 pazienti con carcinoma metastatico o locoregionale non operabile del colon-retto che non avevano ricevuto trattamenti precedenti per la patologia metastatica, ha confrontato oxaliplatino più fluoropirimidine (5-fluorouracile/acido folinico ad infusione continua [OxMdG] o capecitabina [XELOX)] in associazione con cetuximab rispetto allo stesso regime chemioterapico da solo. Nel terzo braccio sperimentale è stato usato un trattamento intermittente con OxMdG o XELOX senza cetuximab. I dati relativi al trattamento con XELOX e al terzo braccio sperimentale non sono presentati. I campioni di tumore dell’81% circa dei pazienti sono stati analizzati retrospettivamente per identificare l’espressione di KRAS; il 55% dei campioni era senza mutazioni di KRAS. Di questi, 362 pazienti hanno ricevuto cetuximab e oxaliplatino più fluoropirimidine (117 pazienti OxMdG e 245 pazienti XELOX) e 367 pazienti hanno ricevuto solo oxaliplatino più fluoropirimidine (127 pazienti OxMdG e 240 pazienti XELOX). Nella popolazione con KRAS mutato, 297 pazienti hanno ricevuto cetuximab e oxaliplatino più fluoropirimidine (101 pazienti OxMdG e 196 pazienti XELOX) e 268 pazienti hanno ricevuto solo oxaliplatino più fluoropirimidine (78 pazienti OxMdG e 190 pazienti XELOX).
I dati di efficacia sul trattamento con OxMdG ottenuti da questo studio sono riassunti nella tabella sottostante:
Variabile / statistica
Popolazione con KRAS non mutato Popolazione con KRAS mutato Cetuximab più OxMdG (N=117) OxMdG (N=127) Cetuximab più OxMdG (N=101) OxMdG (N=78)
OS mesi, mediana (95% CI) 16,3 (10,3; 32,2) 18,2 (9,8; 27,5) 13,1 (8,0; 23,9) 14,6 (9,5; 22,0)
Rapporto di rischio (95% CI) 0,93 (0,72; 1,19) 0,99 (0,75; 1,30) valore p 0,617 0,931
PFS
mesi, mediana (95% CI) 9,0 (5,8; 15,5) 9,2 (5,8; 12,7) 6,8 (5,0; 10,7) 8,5 (3,4; 10,8) Rapporto di rischio (95% CI) 0,77 (0,59; 1,01) 1,05 (0,77; 1,41) valore p 0,056 0,78
Tasso della migliore risposta globale
% (95% CI) 68 (58; 76) 59 (50; 68) 47 (37; 57) 51 (40; 63)
Odds ratio (95% CI) 1,44 (0,85; 2,43) 0,83 (0,46; 1,49) valore p 0,171 0,529
CI = confidence interval, intervallo di confidenza, OxMdG = oxaliplatino più 5-FU/FA infusionale, OS = overall survival time, tempo di sopravvivenza globale, PFS = progression-free survival time, tempo di sopravvivenza libera da progressione Negli endpoint correlati al tempo non sono stati osservati andamenti che indichino un beneficio clinico nei pazienti che hanno ricevuto cetuximab in associazione con XELOX. Sono state effettuate riduzioni significative della dose e si sono verificati ritardi nella somministrazione di capecitabina e oxaliplatino principalmente a causa della maggiore frequenza di diarrea nel braccio contenente cetuximab. Un numero significativamente inferiore di pazienti trattati con cetuximab, inoltre, ha ricevuto una terapia di seconda linea. FIRE 3 (trattamento di prima linea con l’associazione di cetuximab e FOLFIRI): lo studio FIRE 3 è stato uno studio multicentrico, randomizzato, di fase III, basato sul confronto diretto (headto-head) di 5 FU, acido folinico e irinotecan (FOLFIRI) in associazione con cetuximab o con bevacizumab in pazienti affetti da mCRC senza mutazioni dell’esone 2 di KRAS (wild-type). Lo stato di RAS è stato valutabile in campioni di tumore di 407 pazienti con esone 2 di KRAS non mutato, corrispondenti al 69% della popolazione complessiva di pazienti con esone 2 di KRAS non mutato (592 pazienti). Tra questi, 342 pazienti erano affetti da tumori con RAS non mutato, mentre in 65 pazienti sono state rilevate mutazioni di RAS. La popolazione con RAS mutato comprende questi 65 pazienti insieme a 113 pazienti affetti da tumori con esone 2 di KRAS mutato trattati prima che l’arruolamento nello studio fosse limitato ai pazienti affetti da mCRC con esone 2 di KRAS non mutato.
I dati di efficacia ottenuti da questo studio sono riassunti nella tabella sottostante:
Variabile / statistica
Popolazione con RAS non mutato
Cetuximab più FOLFIRI (N=171)
Bevacizumab più FOLFIRI (N=171)
Popolazione con RAS mutato
Cetuximab più FOLFIRI (N=92)
Bevacizumab più FOLFIRI (N=86)
OS mesi, mediana (95% CI) 33,1 (24,5; 39,4) 25,6 (22,7; 28,6) 20,3 (16,4; 23,4) 20,6 (17,0; 26,7)
Rapporto di rischio (95% CI) 0,70 (0,53; 0,92) 1,09 (0,78; 1,52) valore p 0,011 0,60
PFS mesi, mediana (95% CI)
di rischio
Odds ratio (95% CI) 1,28 (0,83; 1,99)
valore p 0,32 0,097
(40,1;
CI = confidence interval intervallo di confidenza, FOLFIRI = irinotecan più 5-FU/AF infusionale, ORR = objective response rate, tasso di risposta obiettiva (pazienti con risposta completa o risposta parziale), OS = overall survival time, tempo di sopravvivenza globale, PFS = progression-free survival time, tempo di sopravvivenza libera da progressione.
Nella popolazione con KRAS non mutato dello studio CALGB/SWOG 80405 (n=1.137) non è stata dimostrata una superiorità di cetuximab più chemioterapia nei confronti di bevacizumab più chemioterapia sulla base di un’analisi preliminare. Per valutare in modo adeguato questi dati sono necessarie analisi della popolazione con RAS non mutato. • CA225006: questo studio randomizzato, condotto con pazienti con mCRC che avevano già ricevuto, per la patologia metastatica, un trattamento iniziale di associazione con oxaliplatino più fluoropirimidina, ha confrontato la associazione di cetuximab e irinotecan (648 pazienti) rispetto a irinotecan in monoterapia (650 pazienti). Conseguentemente alla progressione della malattia è stato iniziato un trattamento con agenti che hanno come bersaglio l’EGFR nel 50% dei pazienti nel braccio con irinotecan in monoterapia. Nella popolazione globale, indipendentemente dallo stato KRAS, i risultati riportati per cetuximab più irinotecan (648 pazienti) rispetto a irinotecan in monoterapia (650 pazienti) sono stati: tempo di OS 10,71 rispetto a 9,99 mesi (rapporto di rischio 0,98), tempo mediano di PFS 4,0 rispetto a 2,6 mesi (rapporto di rischio 0,69) e tasso di risposta obiettiva (ORR) 16,4% rispetto a 4,2%. Per quanto riguarda lo stato di KRAS, è stato possibile ottenere campioni del tumore solo dal 23% dei pazienti (300 su 1.298). Della popolazione su cui è stato valutato lo stato di KRAS, il 64% (192 pazienti) presentava tumori senza mutazioni di KRAS e 108 pazienti presentavano mutazioni di KRAS. Sulla base di questi dati e dal momento che non è stata condotta nessuna revisione indipendente dei dati di imaging, si ritiene che i risultati relativi allo stato della mutazione non siano interpretabili. • EMR 62 202-007: questo studio randomizzato, condotto con pazienti affetti da mCRC dopo fallimento del trattamento a base di irinotecan per la patologia metastatica come ultimo trattamento prima dell’inserimento nello studio, ha confrontato la associazione di cetuximab e irinotecan (218 pazienti) con cetuximab in monoterapia (111 pazienti). La associazione di cetuximab e irinotecan rispetto a cetuximab in monoterapia ha ridotto il rischio complessivo di progressione della malattia del 46% e ha aumentato in misura significativa il tasso di risposta obiettiva. Nello studio randomizzato, il miglioramento del tempo di sopravvivenza globale non ha raggiunto una significatività statistica; tuttavia, nel trattamento di follow-up, quasi il 50% dei pazienti del braccio di cetuximab in monoterapia ha ricevuto cetuximab e irinotecan in associazione dopo la progressione della malattia: ciò può aver influenzato il tempo di OS. Cetuximab in monoterapia • CA225025: questo studio randomizzato, condotto con pazienti con mCRC che avevano ricevuto trattamenti precedenti a base di oxaliplatino, irinotecan e fluoropirimidina per la patologia metastatica, ha confrontato l’aggiunta di cetuximab in monoterapia alla migliore terapia di supporto (best supportive care, BSC) (287 pazienti) rispetto alla sola migliore terapia di supporto (285 pazienti). La proporzione di pazienti affetta da tumore senza mutazioni di KRAS rispetto alla popolazione di pazienti valutabile per lo stato di KRAS è risultata essere del 58%.
I dati di efficacia ottenuti da questo studio sono riassunti nella tabella sottostante:
Variabile / statistica
OS
Popolazione con KRAS non mutato Popolazione con KRAS mutato Cetuximab più BSC (N=117) BSC (N=113) Cetuximab più BSC (N=81) BSC (N=83)
mesi, mediana (95% CI) 9,5 (7,7; 10,3) 4,8 (4,2; 5,5) 4,5 (3,8; 5,6) 4,6(3,6; 5,5)
Rapporto di rischio (95% CI) 0,552 (0,408; 0,748) 0,990 (0,705; 1,389) valore p <0,0001 0,9522
PFS mesi, mediana (95% CI) 3,7 (3,1; 5,1) 1,9 (1,8; 2,0) 1,8 (1,7; 1,8) 1,8 (1,7; 1,8)
Rapporto di rischio (95% CI) 0,401 (0,299; 0,536) 1,002 (0,732; 1,371) valore p <0,0001 0,9895
ORR % (95% CI) 12,8 (7,4; 20,3) 0 (-) 1,2 (0,0; 6,7) 0 (-)
valore p <0,001 0,314
BSC = best supportive care, migliore terapia di supporto, CI = confidence interval, intervallo di confidenza, ORR = objective response rate, tasso di risposta obiettiva (pazienti con risposta completa o risposta parziale), OS = overall survival time, tempo di sopravvivenza globale, PFS = progression-free survival time, tempo di sopravvivenza libera da progressione Carcinoma a cellule squamose di testa e collo Non è stato eseguito nessun test immunoistochimico per la determinazione dell’espressione dell’EGFR poiché oltre il 90% dei pazienti con carcinoma a cellule squamose di testa e collo presentano tumori che esprimono l’EGFR. Cetuximab in associazione con radioterapia per la malattia localmente avanzata • EMR 62 202-006: Questo studio randomizzato ha posto a confronto la associazione di cetuximab e radioterapia (211 pazienti) con la sola radioterapia (213 pazienti), in pazienti con carcinoma a cellule squamose di testa e collo localmente avanzato. La somministrazione di cetuximab è iniziata una settimana prima della radioterapia alle dosi descritte nel paragrafo 4.2 fino alla fine del periodo della radioterapia.
I dati di efficacia ottenuti da questo studio sono riassunti nella tabella sottostante:
Variabile / statistica Radioterapia più Cetuximab Sola radioterapia (N=211) (N=213)
Controllo locoregionale
mesi, mediana (95% CI) 24,4 (15,7; 45,1)
Rapporto di rischio (95% CI) 0,68 (0,52; 0,89) valore p 0,005
OS mesi, mediana (95% CI) 49,0 (32,8; 69,5+)
Rapporto di rischio (95% CI) 0,73 (0,56; 0,95) valore p 0,018
14,9 (11,8; 19,9)
29,3 (20,6; 41,4)
Follow-up mediano, mesi 60,0 60,1
tasso di OS a 1 anno, % (95% CI)
77,6 (71,4; 82,7)
tasso di OS a 2 anni, % (95% CI) 62,2 (55,2; 68,4)
tasso di OS a 3 anni, % (95% CI) 54,7 (47,7; 61,2)
tasso di OS a 5 anni, % (95% CI) 45,6 (38,5; 52,4)
73,8 (67,3; 79,2)
55,2 (48,2; 61,7)
45,2 (38,3; 51,9)
36,4 (29,7; 43,1)
CI = confidence interval intervallo di confidenza, OS = overall survival time, tempo di sopravvivenza globale, un ‘+’ indica che, al cut-off, il limite superiore non è stato raggiunto
Pazienti con buona prognosi, come indicato dallo stadio del tumore, dall’indice di performance status KPS e dall’età, hanno ottenuto un beneficio più pronunciato quando cetuximab è stato aggiunto alla radioterapia. Non è stato possibile dimostrare alcun beneficio clinico in pazienti con KPS ≤ 80 di età pari a 65 anni o superiore. L’uso di cetuximab in associazione con la chemio-radioterapia non è stato finora adeguatamente valutato. Perciò, un rapporto rischio-beneficio per questa associazione non è stato ancora stabilito. Cetuximab in associazione con chemioterapia a base di platino nella malattia ricorrente e/o metastatica • EMR 62 202-002: Questo studio randomizzato, in pazienti con carcinoma a cellule squamose di testa e collo ricorrente e/o metastatico che non avevano ricevuto alcun trattamento chemioterapico precedente per questa malattia, ha posto a confronto la associazione di cetuximab e cisplatino o carboplatino più 5-fluorouracile infusionale (222 pazienti) con la stessa chemioterapia da sola (220 pazienti). Il trattamento nel braccio con cetuximab consisteva in chemioterapia a base di platino in associazione con cetuximab, per un massimo di 6 cicli, seguita da cetuximab come terapia di mantenimento fino a progressione della malattia.
I dati di efficacia ottenuti da questo studio sono riassunti nella tabella sottostante:
Variabile / statistica Cetuximab più CTX CTX (N=222) (N=220)
OS mesi, mediana (95% CI) 10,1 (8,6; 11,2) 7,4 (6,4; 8,3)
Rapporto di rischio (95% CI) 0,797 (0,644; 0,986)
valore p 0,0362
PFS
mesi, mediana (95% CI) 5,6 (5,0; 6,0) 3,3 (2,9; 4,3)
Rapporto di rischio (95% CI) 0,538 (0,431; 0,672)
valore p < 0,0001
ORR
% (95% CI) 35,6 (29,3; 42,3) 19,5 (14,5; 25,4)
valore p 0,0001
CI = confidence interval, intervallo di confidenza, CTX = chemioterapia a base di platino, ORR = objective response rate tasso di risposta obiettiva, OS = overall survival time tempo di sopravvivenza globale, PFS = progression-free survival time, tempo di sopravvivenza libera da progressione
Pazienti con buona prognosi, come indicato dallo stadio del tumore, dall’indice di performance status KPS e dall’età, hanno ottenuto un beneficio più pronunciato quando cetuximab è stato aggiunto alla chemioterapia a base di platino. A differenza del tempo di PFS, non è stato possibile dimostrare alcun beneficio in pazienti con KPS ≤ 80 di età pari a 65 anni o superiore. Popolazione pediatrica L’Agenzia europea dei medicinali ha previsto l’esonero dall’obbligo di presentare i risultati degli studi con cetuximab in tutti i sottogruppi della popolazione pediatrica per le indicazioni adenocarcinoma del colon e del retto e carcinoma epiteliale orofaringeo, laringeo o nasale (carcinoma nasofaringeo o linfoepitelioma esclusi, vedere paragrafo 4.2 per informazioni sull’uso pediatrico). 5.2 Proprietà farmacocinetiche La farmacocinetica di cetuximab è stata valutata in studi clinici in cui cetuximab è stato somministrato in monoterapia o in associazione con chemioterapia o radioterapia concomitanti. Le infusioni endovenose di cetuximab hanno mostrato una farmacocinetica dose-dipendente a dosi settimanali comprese tra 5 e 500 mg/m² di superficie corporea. Quando cetuximab è stato somministrato a una dose iniziale di 400 mg/ m² di superficie corporea, il volume medio di distribuzione è risultato all’incirca equivalente allo spazio vascolare (2,9 L/m², con un range fra 1,5 e 6,2 L/m²). La Cmax media (± deviazione standard) era 185±55 microgrammi per mL. La clearance media era 0,022 L/h per m² di superficie corporea. Cetuximab ha una lunga emivita di eliminazione, con valori variabili da 70 a 100 ore alla dose di mantenimento. Le concentrazioni sieriche di cetuximab raggiungevano livelli stabili dopo tre settimane in monoterapia. Le concentrazioni massime medie di cetuximab erano di 155,8 microgrammi per mL nella settimana 3 e 151,6 microgrammi per mL nella settimana 8, mentre le corrispondenti concentrazioni minime medie erano rispettivamente di 41,3 and 55,4 microgrammi per mL. In uno studio di cetuximab somministrato in associazione con irinotecan, i livelli minimi medi di cetuximab erano 50,0 microgrammi per mL nella settimana 12 e 49,4 microgrammi per mL nella settimana 36. Sono state descritte diverse vie metaboliche che possono intervenire nel metabolismo degli anticorpi. Tutte queste vie comportano la biodegradazione degli anticorpi in molecole più piccole, e cioè piccoli peptidi o amminoacidi. Farmacocinetica in popolazioni speciali. Un’analisi integrata su tutti gli studi clinici ha mostrato che le caratteristiche farmacocinetiche di cetuximab non sono influenzate da razza, età, sesso, funzionalità epatica o renale. Ad oggi sono stati studiati solo pazienti con adeguata funzionalità renale ed epatica (creatinina sierica ≤ 1,5 volte il limite superiore di normalità, transaminasi ≤ 5 volte il limite superiore di normalità e bilirubina ≤ 1,5 volte il limite superiore di normalità). Popolazione pediatrica In uno studio di fase I in pazienti pediatrici (1-18 anni) con tumori solidi refrattari, cetuximab è stato somministrato in associazione con irinotecan. I risultati farmacocinetici sono stati paragonabili ai risultati ottenuti negli adulti. 5.3 Dati preclinici di sicurezza In studi di tossicità in scimmie Cynomolgus (uno studio di tossicità cronica a dosi ripetute e uno studio di sviluppo embrio-fetale), le alterazioni cutanee dose-dipendenti, a partire da livelli di dose equivalenti a quelli usati nell’uomo, sono state il principale effetto riscontrato. Uno studio di tossicità embrio-fetale in scimmie Cynomolgus non ha rilevato segni di teratogenicità. Tuttavia, a seconda della dose, è stato osservato un aumento dell’incidenza di aborti. I dati preclinici su genotossicità e tolleranza locale, comprendenti la somministrazione accidentale per vie diverse dall’infusione stabilita, non rivelano rischi particolari per l’uomo. Non sono stati eseguiti studi specifici su animali per stabilire il potenziale cancerogeno di cetuximab o per determinare i suoi effetti sulla fertilità maschile e femminile. Non sono stati eseguiti studi di tossicità con cetuximab e agenti chemioterapici in cosomministrazione. Ad oggi non sono disponibili dati preclinici sull’effetto di cetuximab sulla guarigione delle ferite. In modelli preclinici, è stato peraltro riscontrato che gli inibitori selettivi della tirosin-chinasi associata all’EGFR ritardano la guarigione delle ferite. 6. INFORMAZIONI FARMACEUTICHE 6.1 Elenco degli eccipienti Sodio cloruro, Glicina, Polisorbato 80, Acido citrico monoidrato, Sodio idrossido, Acqua per preparazioni iniettabili. 6.2 Incompatibilità Questo medicinale non deve essere miscelato con altri medicinali ad eccezione di quelli menzionati nel paragrafo 6.6. 6.3 Periodo di validità 4 anni. La stabilità chimico-fisica nelle condizioni d’uso di Erbitux 5 mg/mL è stata dimostrata per 48 ore a 25°C, se la soluzione viene preparata come descritto nel paragrafo 6.6. Erbitux non contiene conservanti antimicrobici o agenti batteriostatici. Da un punto di vista microbiologico, il prodotto dovrebbe essere usato immediatamente dopo l’apertura. Se non viene utilizzato immediatamente, i tempi e le condizioni di conservazione prima dell’uso sono sotto la responsabilità dell’utilizzatore e normalmente non dovrebbero superare le 24 ore a 2 - 8°C, a meno che l’apertura sia avvenuta in condizioni asettiche controllate e validate. 6.4 Precauzioni particolari per la conservazione Conservare in frigorifero (2°C - 8°C). Per le condizioni di conservazione dopo la prima apertura vedere paragrafo 6.3. 6.5 Natura e contenuto del contenitore 20 mL o 100 mL di soluzione in un flaconcino (vetro di tipo I), con tappo (gomma di alobutile) e sigillo (alluminio/polipropilene). Confezione da 1 flaconcino. È possibile che non tutte le confezioni siano commercializzate. 6.6 Precauzioni particolari per lo smaltimento e la manipolazione Erbitux può essere somministrato mediante fleboclisi a goccia, pompa per infusione o pompa a siringa. Per l’infusione deve essere utilizzata una linea di infusione separata, e al termine dell’infusione la linea deve essere lavata con una soluzione sterile per iniezione di sodio cloruro 9 mg/mL (0,9%). Erbitux 5 mg/mL è compatibile • con sacche di polietilene (PE), etil vinil acetato (EVA) o polivinil cloruro (PVC), • con set di infusione di polietilene (PE), poliuretano (PUR), etil vinil acetato (EVA), poliolefina termoplastica (TP) o polivinil cloruro (PVC), • con siringhe di polipropilene (PP) per pompa a siringa. Quando si prepara l’infusione si deve prestare attenzione a garantire una manipolazione asettica. Erbitux 5 mg/mL deve essere preparato come segue: • Per la somministrazione con pompa per infusione o fleboclisi a goccia (diluito con soluzione sterile di sodio cloruro 9 mg/mL (0,9%)): prendere una sacca per infusione contenente soluzione sterile di sodio cloruro 9 mg/mL (0,9%), di volume idoneo. Calcolare il volume richiesto di Erbitux. Prelevare un volume idoneo della soluzione di sodio cloruro dalla sacca per infusione servendosi di una siringa sterile e di un ago adatti. Prendere un’idonea siringa sterile e inserire un ago adatto. Aspirare il volume richiesto di Erbitux da un flaconcino. Trasferire Erbitux nella sacca per infusione preparata precedentemente. Ripetere la procedura finché è stato raggiunto il volume calcolato. Collegare la linea di infusione, e riempire la linea con Erbitux diluito prima di iniziare l’infusione. Somministrare mediante fleboclisi a goccia o una pompa per infusione. Impostare e controllare la velocità di infusione come spiegato nel paragrafo 4.2. • Per la somministrazione con pompa per infusione o fleboclisi a goccia (non diluito): calcolare il volume richiesto di Erbitux. Prendere un’idonea siringa sterile (minimo da 50 mL) e inserire un ago adatto. Aspirare il volume richiesto di Erbitux da un flaconcino. Trasferire Erbitux in un contenitore o sacca vuota sterile. Ripetere la procedura finché è stato raggiunto il volume calcolato. Collegare la linea di infusione e riempire la linea con Erbitux prima di iniziare l’infusione. Impostare e controllare la velocità di infusione come spiegato nel paragrafo 4.2. • Per la somministrazione con pompa a siringa: calcolare il volume richiesto di Erbitux. Prendere un’idonea siringa sterile e inserire un ago adatto. Aspirare il volume richiesto di Erbitux da un flaconcino. Rimuovere l’ago e mettere la siringa nella pompa a siringa. Collegare la linea di infusione alla siringa, impostare e controllare la velocità come spiegato nel paragrafo 4.2 e cominciare con l’infusione dopo aver riempito la linea con Erbitux o con soluzione sterile di sodio cloruro 9 mg/mL (0,9%). Se necessario, ripetere questa procedura finché è stato infuso il volume calcolato.
7. TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO Merck Europe B.V. Gustav Mahlerplein 102 1082 MA Amsterdam Paesi Bassi.
8. NUMERI DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO EU/1/04/281/003 - EU/1/04/281/005.
9. DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL’AUTORIZZAZIONE Data della prima autorizzazione: 29/06/2004 - Data del rinnovo più recente: 29/06/2009
10. DATA DI REVISIONE DEL TESTO 05/2022
Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell’Agenzia europea dei medicinali http://www.ema.europa.eu/
Merck Serono SpA Via Casilina, 125 - 00176 Roma tel. +39 - 06-703841 - fax. +39 - 06-70384823
Erbitux® is a trademark of ImClone LLC, used under license by Merck KGaA and its affiliates
Classificazione ai fini del rimborso: H
Classificazione ai fini della Fornitura: OSP
Prezzo al pubblico vigente: € 296,41
Con il contributo non condizionante di