Criteri di eleggibilità negli studi randomizzati in oncologia
 Andrea Caglio, Alessandro Rossi, Massimo Di Maio
Andrea Caglio, Alessandro Rossi, Massimo Di Maio

 Andrea Caglio, Alessandro Rossi, Massimo Di Maio
Andrea Caglio, Alessandro Rossi, Massimo Di Maio
I trial clinici randomizzati (randomized clinical trials, RCTs) hanno rappresentato sin dagli anni ’60 il gold standard per la dimostrazione di efficacia dei nuovi trattamenti, posizionandosi al vertice della “piramide dell’evidenza” tradizionalmente richiesta dalle Agen zie Regolatorie internazionali quali la Food and Drug Administration (FDA) statunitense e la European Medicines Agency (EMA) per la loro registrazione ed approvazione.1
Nell’ambito del trial clinico, grazie alla randomizza zione, l’eventuale differenza osservata fra il braccio sottoposto al trattamento sperimentale e quello di controllo dovrebbe essere legata all’efficacia del trat tamento stesso: 2 la randomizzazione riduce infatti l’errore legato alla presenza di fattori confondenti, allo scopo di rendere i dati ottenuti validi e replica bili su una popolazione con caratteristiche simili a quelle dei pazienti inseriti nello studio (validità inter na dello studio).3
Se da un lato vi è la necessità di selezionare un cam pione quanto più possibile omogeneo per evitare che l’eventuale dimostrazione di efficacia del tratta mento sperimentale sia diluita da fattori confonden ti, dall’altro è altrettanto importante la cosiddetta validità esterna, vale a dire è necessario ottenere dei dati che siano applicabili alla popolazione della pra tica clinica, di cui la popolazione dello studio rap
presenta un campione selezionato.4 La figura 1 evi denzia proprio come l’equilibrio fra validità interna ed esterna costituisca una delle basi fondamentali della corretta conduzione di uno studio clinico. La differenza fra l’efficacia dimostrata nello studio e quella che il trattamento produce nel cosiddetto “mondo reale” (dove con questo termine si intende la pratica clinica), può quindi essere più o meno ri levante, a seconda di quanto la popolazione cam pione inclusa nello studio si discosti dalla popola zione dei pazienti della pratica clinica. Grande importanza nella validità esterna di uno stu dio hanno i criteri di inclusione ed esclusione, ovvero le caratteristiche stabilite a priori dal protocollo di ri cerca per cui un paziente possa o meno essere inclu so: criteri troppo stringenti potrebbero selezionare un campione di pazienti “super fit”, esponendo poi il clinico al rischio di utilizzare un farmaco, nella pratica clinica, su pazienti clinicamente più eterogenee e fra gili, nei quali la sicurezza non è stata adeguatamente testata e il beneficio rischia di essere meno chiaro.5
Per le motivazioni sopra esposte, in oncologia alcu ne categorie di pazienti, quali quelli affetti da pato logie sincrone dal potenziale impatto sulla progno si, come neoplasie concomitanti, disfunzioni severe d’organo, infezione da HIV, venivano e spesso ven gono ancora escluse dagli studi clinici. Nel corso degli anni è stato segnalato più volte come l’utilizzo di criteri troppo restrittivi abbia comportato sia la difficoltà, da parte delle agenzie regolatorie, di approvare e rimborsare trattamenti studiati su popo lazioni le cui caratteristiche differivano sostanzialmen te dalla popolazione della pratica clinica, sia un pro gressivo aumento dei tempi di arruolamento e dei costi delle sperimentazioni per i ricercatori e le impre se produttrici: 6 già nel 1997 il National Cancer Institu te segnalava come vi fossero troppi criteri di esclusio ne nei trial clinici, e come questi dovessero essere semplificati e allargati; 7 nel corso degli anni, tuttavia, la situazione non è migliorata e il numero di criteri di inclusione/esclusione sembra invece in incremento.8
Dipartimento di Oncologia, Università di Torino, AO Ordine Mauriziano, Torino
La stessa FDA nel 2020 è intervenuta sul tema, ema nando una serie di raccomandazioni volte a favorire l’arruolamento di alcuni sottogruppi di pazienti 9-11 spesso esclusi dagli studi in assenza di un forte ra zionale che lo giustificasse. Spesso, infatti, il razionale di alcuni criteri di esclusio ne appare poco chiaro: una revisione sistematica condotta da Van Spall nel 2007 sui criteri di esclusio ne dei RCT pubblicati fra il 1994 e il 2006 in riviste a elevato impact factor mostrava come circa l’84% dei trial presentasse almeno un criterio di esclusione considerato poco giustificato, come ad esempio un cut-off di età (ad esempio ≥65 anni) senza che vi fossero rischi inaccettabili previsti per pazienti di età superiore.12
Di seguito approfondiremo alcuni sottogruppi che, data la prevalenza fra i malati oncologici, meritano a nostro avviso un’attenzione maggiore relativamen te alla questione dei criteri di inclusione e di esclu sione dagli studi clinici.
Le scale di valutazione della funzionalità globale dei pazienti correntemente utilizzate in oncologia com prendono la scala di Karnofsky 13 e la scala dell’Ea stern Cooperative Oncology Group.14 Quest’ultima viene spesso preferita per la sua maggiore sem plicità.
Nella scala ECOG, il valore di performance viene espresso attraverso una scala numerica, da 0 a 5, in base alla capacità del paziente di provvedere a sé stesso, al suo grado di indipendenza e alla percen tuale di tempo trascorsa a letto o in poltrona. Nono stante l’apparente semplicità, ha dimostrato essere un importante fattore prognostico15 praticamente in tutti i tipi di tumore; in particolare, il cut-off utiliz zato comunemente come criterio di esclusione è il PS 2, ovvero il paziente ambulatoriale capace di provvedere completamente a sé stesso ma incapa ce di svolgere attività lavorative di qualsiasi grado e
i risultati dello studio sono corretti per la popolazione che stiamo studiando
i risultati dello studio sono applicabili alla popolazione della pratica clinica
costretto spesso a letto o in poltrona, anche se per meno del 50% delle ore di veglia. L’esclusione dei pazienti con scarso performance sta tus, giustificata dai timori legati al rischio di tossicità e alla prognosi, non considera però la minore tossi cità dei nuovi trattamenti (quali quelli a bersaglio molecolare e immunoterapici) e il potenziale bene ficio che questi possano apportare anche in tale po polazione: ad esempio, una recente metanalisi ha suggerito come il beneficio apportato dall’immuno terapia possa essere uguale sia nel sottogruppo con PS 0/1 sia con PS=2.16 Peraltro, la loro esclusione dagli studi non consente di produrre evidenza di efficacia che sarebbe utilissima per una proporzione di pa zienti tutt’altro che trascurabile nella pratica clinica.
Circa il 60% di nuove diagnosi di neoplasia in Europa e negli Stati Uniti si registra nella popolazione anzia na (definita ai fini regolatori da un’età anagrafica superiore ai 65 anni)17 ma la popolazione arruolata negli studi clinici ha costantemente un età mediana inferiore rispetto a quella generale: negli USA, solo il 25% dei pazienti arruolati in trial fra il 1997 e 2000 risultava essere di età eguale o superiore ai 65 anni, e il panorama non sembra sostanzialmente miglio rato nel corso degli anni.18 Anche se molti trattamen ti di nuova generazione, come alcuni farmaci a ber saglio molecolare e gli inibitori del checkpoint im munitario pongono mediamente meno problemi di tollerabilità nei pazienti anziani rispetto al “tradizio nale” tema della tossicità della chemioterapia, il pro blema della selezione dei pazienti in base all’età ri mane evidente in molti studi clinici in oncologia.
Peraltro, la discrepanza fra l’età mediana registrata negli studi clinici e la popolazione della pratica cli nica riflette non solo l’utilizzo del semplice criterio anagrafico (ad esempio l’esclusione in caso di età superiore ai 65 anni) ma anche la diversa prevalenza fra le varie classi di età di patologie e disfunzioni
d’organo, quali insufficienza renale, deterioramento cognitivo, insufficienza cardiaca, ipertensione non controllata, ovvero tutti criteri di esclusione che ten dono a selezionare una popolazione più sana e gio vane; nel caso del tumore mammario ormono-sen sibile, ad esempio, è stato evidenziato come i risul tati ottenuti nei trial per pazienti di età ≥75 anni non siano perfettamente applicabili alla corrispondente popolazione della pratica clinica.19
Grazie ai miglioramenti ottenuti nella diagnosi pre coce, nel trattamento e nella terapia di supporto, il numero di pazienti vivi a cinque anni dalla diagnosi di neoplasia è in costante incremento; in parallelo aumentano però i casi di seconde neoplasie, sia in dipendenti che correlate al trattamento effettuato in precedenza: negli USA si stima che circa un sesto delle nuove diagnosi avvenga in pazienti con storia di neoplasia.20, 21
L’esclusione dei pazienti con pregressa neoplasia comporta anche una distorsione dovuta alla mag giore prevalenza di tale condizione nelle fasce di età più avanzate, selezionando quindi indirettamente una popolazione più giovane. 22 La diagnosi di una neoplasia già sottoposta a tratta mento anni prima, con un rischio di ripresa di ma lattia non significativo e clinicamente poco rilevante non dovrebbe rappresentare un rischio competitivo tale da escludere pazienti altrimenti eleggibili dall’ar ruolamento.23 La presenza di una neoplasia conco mitante che non richieda trattamento e senza effet ti sul protocollo non dovrebbe portare altresì ad esclusione, in quanto consentirebbe di produrre evidenze sull’efficacia del trattamento sperimentale in una popolazione più “vicina” all’eterogeneità del la pratica clinica.
L’incidenza di secondarismi al sistema nervoso cen trale (SNC), sincroni o metacroni, viene stimata in circa il 2% di tutti i pazienti con diagnosi di neoplasia, e sale a circa il 12% nei casi di malattia avanzata. 24 Nonostante il grande numero di pazienti, questi venivano classicamente esclusi dai trial a causa del la cattiva prognosi e della non ottimale farmacoci netica dei chemioterapici tradizionali (difficoltà nell’attraversare la barriera emato-encefalica).
L’avvento di farmaci con un meccanismo di azione completamente differente, quali quelli a bersaglio molecolare o immunoterapici, ha ampliato enorme mente le opzioni terapeutiche disponibili in questo setting per molti tipi di neoplasia, spesso miglioran do l’outcome e la qualità di vita dei pazienti; tuttavia, la presenza di lesioni secondarie al SNC (in alcuni casi senza ulteriori specifiche, in altri in assenza di stabilità clinica dei sintomi) è ancora presente come criterio di esclusione nella maggior parte dei trial registrativi, anche per farmaci rivolti verso patologie con un’alta incidenza di secondarismi encefalici.25
L’FDA ha emanato un’indicazione specifica, racco mandando l’arruolamento dei pazienti con meta stasi encefaliche stabili o trattate e invitando a non escludere automaticamente i pazienti con lesioni sintomatiche o carcinosi meningea, in particolare nei casi in cui vi sia un forte razionale di attività del farmaco.11
Le infezioni da HBV e da HCV rappresentano un fat tore di rischio noto per alcuni tipi di neoplasia, come ad esempio l’epatocarcinoma, e la sieroprevalenza sembra più alta per alcuni tipi di tumore, senza che vi sia ancora un chiaro rapporto causa-effetto.26
A causa dei timori legati alla riattivazione del virus in corso di chemioterapia, che in effetti è stata osser vata con un tasso compreso fra il 14 e il 72% per l’epatite B e minore ma comunque rilevante per l’e patite C, oltre ad una maggiore incidenza di danno epatocitario ed epatiti severe,27 questa popolazione è stata tradizionalmente esclusa dai trial registrativi. L’FDA ha raccomandato l’arruolamento di questi pa zienti valutando la somministrazione di un tratta mento profilattico per l’HBV e curativo per l’HCV, valutando la funzionalità epatica come nella popo lazione sana.10
L’infezione da HIV, sia asintomatica che conclamata nella sindrome da immunodeficienza acquisita (AIDS), ha rappresentato un classico criterio di esclu sione, correlato alla prognosi inizialmente infausta della malattia, ai timori legati all’immunodepressio ne e alla linfopenia. L’avvento della terapia antiretro virale (highly active antiretroviral therapy, HAART) nel 1996 ha però modificato radicalmente il quadro clinico, cronicizzando la patologia e migliorando notevolmente l’outcome di questi pazienti.28 In mol ti setting oncologici, la prognosi dei pazienti è con dizionata dalla patologia tumorale molto più che dalla eventuale positività HIV.
L’HAART ha modificato però l’epidemiologia delle comorbilità nei pazienti HIV+: mentre l’incidenza di neoplasie tipicamente associate all’AIDS, quali il sar coma di Kaposi, è andata diminuendo, l’incidenza di neoplasie non AIDS-correlate è rimasta invariata (o addirittura aumentata), e risulta sempre maggiore rispetto alla popolazione di pari età e caratteristiche HIV-negativa.29
L’FDA10 ha pubblicato una raccomandazione in me rito, esplicitando come la sola positività anticorpale non debba essere considerata criterio sufficiente per l’esclusione, ma vadano considerati il trattamento farmacologico in atto (eventualmente da modifica
re in base alle interazioni farmacologiche), la conta linfocitaria totale, l’anamnesi di infezioni opportuni stiche negli ultimi 12 mesi. La tabella 1 riepiloga alcuni tra i principali criteri di esclusione dai trial clinici.
Negli ultimi anni, la comunità scientifica internazio nale ha manifestato un interesse sempre maggiore verso la stesura di protocolli che includano popola
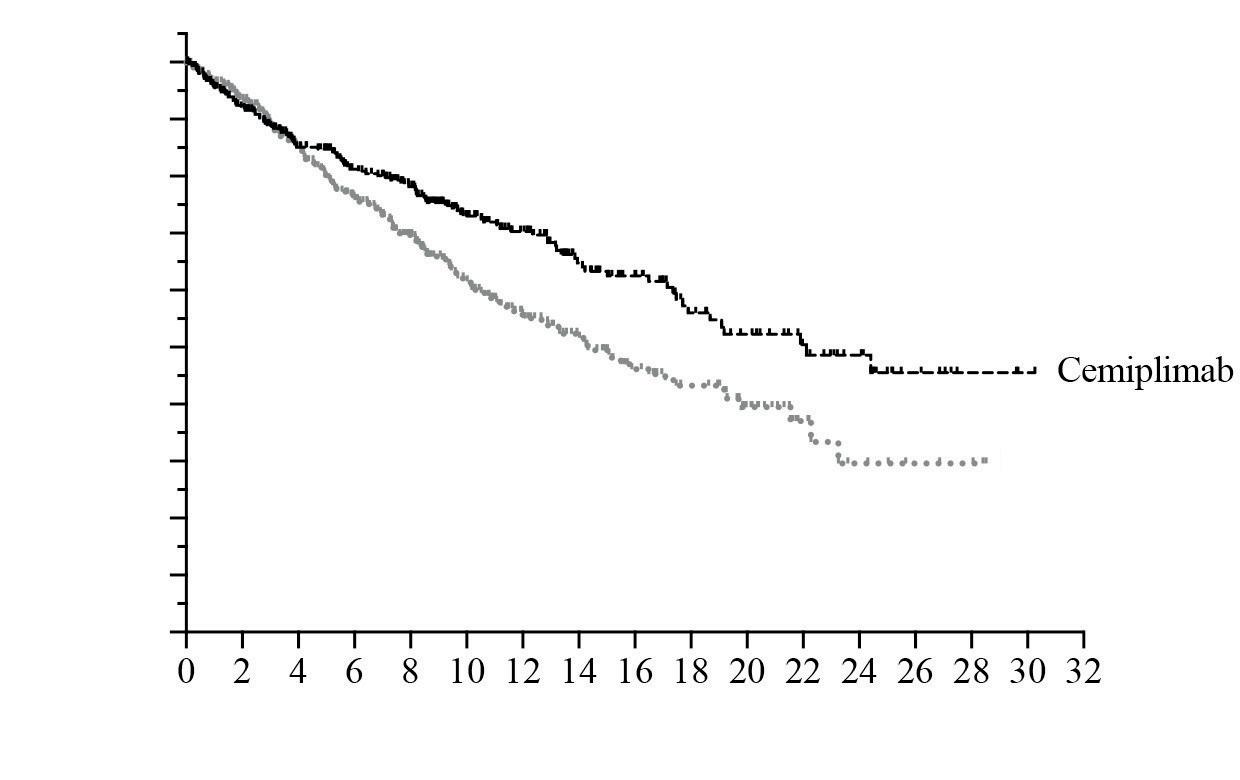
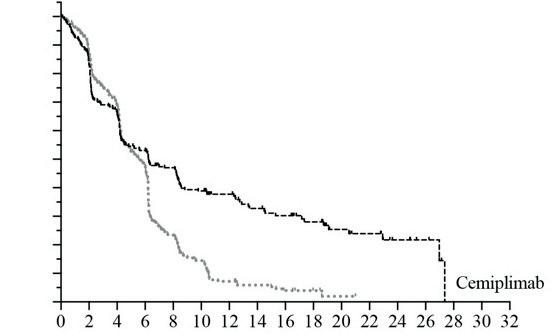
zioni quanto più possibile rappresentative di quelle della pratica clinica odierna, rendendo i criteri di inclusione ed esclusione meno stringenti. Almeno per alcuni dei criteri di esclusione prece dentemente descritti, un esempio di “allargamento” è rappresentato dallo studio EMPOWER-Lung 1, 31 studio di fase III multicentrico, randomizzato, in aperto, che ha comparato cemiplimab, agente im munoterapico diretto contro la molecola program med cell death protein 1 (PD-1), in monoterapia vs doppietta chemioterapica a base di platino come terapia di prima linea in 710 pazienti affetti da nonsmall cell lung cancer (NSCLC, tumore polmonare non a piccole cellule) avanzato, con espressione di PD-L1 superiore al 50%. Lo studio ha dimostrato un chiaro vantaggio nei pazienti trattati con cemipli mab, oltre che un profilo di tossicità nettamente diverso, come atteso, rispetto al braccio trattato con
Immunodeficienza primitiva e/o altre cause di immunodepressione
HIV positività nota o riscontro allo screening e/o AIDS
HBV o HCV note o riscontro allo screening
Infezioni attive, acute o croniche, non controllate e con necessità di trattamento attivo, incluso antibiotico
Allergie o ipersensibilità note al farmaco in studio o ad un suo componente
Anamnesi di malattia cardiovascolare e/o fattori di rischio, quali angina pectoris, ipertensione non controllata, infarto miocardico, scompenso cardiaco, stroke, o aritmia maligna
Anamnesi di malattie autoimmuni
Malattie gastroenteriche o qualsiasi condizione di malassorbimento
Disordini della coagulazione, sanguinamenti attivi, o diatesi emorragica
Metastasi encefaliche note, attive o sintomatiche (alcuni trial consentono arruolamento di pazienti con metastasi trattate e stabili)
Carcinomatosi leptomeningea
Donne in gravidanza
Donne in età potenzialmente fertile: richiesta adozione di validi metodi contraccettivi
Anamnesi di altre neoplasie (ad eccezione di neoplasie solide, trattate, in follow-up negativo per ripresa di malattia dopo determinato intervallo di tempo)
Anamnesi o corrente utilizzo di sostanze illecite o di abuso
Disturbo psichiatrico
Incapacità di fornire consenso informato
Tabella 1. Criteri comuni di esclusione dai trial clinici30chemioterapia. La figura 2 riassume il disegno dello studio clinico.
In generale lo studio EMPOWER-Lung 1, pur mante nendo alcuni dei limiti di validità esterna simili agli altri studi (es. escludendo i pazienti con PS2) per molti aspetti è più inclusivo dal punto di vista dei criteri di inclusione/esclusione.
Ad esempio:
era possibile arruolare pazienti con infezioni sta bili da HIV;
era consentito l’arruolamento di pazienti con una maggiore compromissione renale (GFR >30 ml/ min) e una peggiore funzionalità epatica. Inoltre lo studio ha arruolato una percentuale di pa zienti con PS 1 (73%) particolarmente alta rispetto a quelli PS 0 in confronto agli altri studi. Infine, fornisce informazioni particolarmente importanti su popo lazioni difficili da trattare come quella dei pazienti
con NSCLC con istologia squamosa, con una per centuale particolarmente elevata (43%) rispetto agli altri studi.
Sulla base dei risultati dello studio, cemiplimab si aggiunge agli altri farmaci immunoterapici che han no già dimostrato efficacia nel medesimo setting di malattia.32, 33
La tabella 2 confronta i tre studi registrativi condot ti con cemiplimab, atezolizumab e pembrolizumab nei pazienti affetti da NSCLC avanzato con espres sione elevata di PD-L1, per quanto riguarda i princi pali criteri di eleggibilità. È doveroso sottolineare che la tabella sopra illustra ta non è volta a riportare integralmente tutti i crite ri di inclusione ed esclusione previsti dai protocolli di studio, ma ad un confronto sulle principali diffe renze riscontrate confrontando i protocolli stessi. A titolo di esempio, risulta chiaro che in tutti gli studi
Figura 2. Disegno del trial EMPOWER-Lung 131Principali criteri di inclusione ed esclusione a confronto nei tre studi di cemiplimab, pembrolizumab e atezolizumab nel trattamento di prima linea dei pazienti
NSCLC avanzato con elevata espressione di PDL1
Funzionalità midollare
Emoglobina ≥9,0 g/dl
Granulociti neutrofili ≥1,5x 109/l
Conta piastrinica ≥100.000/ mm3
Emoglobina ≥9,0 g/dl (trasfusioni ammesse)
Granulociti neutrofili ≥1500/µL
Conta piastrinica ≥100.000/µl
Funzionalità renale GFR >30 ml/min Creatinina ≤1,5x limite superiore o GFR ≥60 ml/min
Funzionalità epatica Bilirubina totale ≤1,5x limite superiore (≤3x se metastasi epatiche)
AST e ALT ≤3x limite superiore (≤5x se metastasi epatiche)
ALP ≤2,5x limite superiore (≤5x se metastasi epatiche o ossee)
INR o aPTT ≤1,5x valori normali (ad eccezione dei pazienti in trattamento anticoagulante)
Bilirubina totale ≤limite superiore
AST e ALT ≤1,5x limite superiore
ALP ≤2,5x limite superiore
Emoglobina ≥9,0 g/dl (trasfusioni ammesse)
Granulociti neutrofili ≥1500/µL
Linfociti ≥500/µL
Conta piastrinica ≥100,000/µL
GFR ≥45 ml/min (se uso di cisplatino ≥ 60 ml/min)
INR o aPTT ≤1,5x valori normali (pazienti in terapia con anticoagulanti devono essere riportati a tali valori almeno 7 giorni prima della randomizzazione)
AST, ALT e ALP ≤2,5x limite superiore (≤5x se metastasi epatiche, per ALP anche metastasi ossee)
Per pazienti con morbo di Gilbert valori di bilirubina ≤3x limite superiore sono ammessi
HBV HBsAg+ con infezione controllata (HBV DNA indosabile e in terapia antivirale) ammessi
HCV HCV Ab+ con infezione controllata (HCV RNA indosabile spontaneo o dopo trattamento specifico) ammessi
HIV HIV+ con infezione controllata (carica virale non dosabile e CD4 ≥350 spontaneamente o sotto trattamento antivirale) ammessi
Pregresse neoplasie
Pazienti con pregresse neoplasie ammessi, purché in remissione da 2 anni dalla randomizzazione e nessun trattamento previsto
Ammessi pazienti senza HbsAg+
HCV Ab+ con infezione controllata (HCV RNA indosabile spontaneo o dopo trattamento specifico) ammessi
Anamnesi negativa per HIV (anticorpi anti-HIV1/2) ammessi
HBcAb+ e HBsAg- ammessi, previo dosaggio HBV DNA
HCV Ab+ con infezione controllata (HCV RNA indosabile spontaneo o dopo trattamento specifico) ammessi
Anamnesi negativa per HIV (anticorpi anti-HIV1/2) ammessi
Pazienti con pregresse neoplasie ammessi, purché in remissione da 2 anni dalla randomizzazione e nessun trattamento previsto
Pazienti con pregresse neoplasie ammessi, purché in remissione da 5 anni dalla randomizzazione, ad eccezione di neoplasie con OS stimata ≥90% a 5 anni e tumori trattati localmente in maniera radicale
Metastasi cerebrali Ammessi pazienti con metastasi cerebrali stabili ed adeguatamente trattate, tornati a stato neurologico basale (eccetto effetti del trattamento residui) minimo 2 settimane prima della randomizzazione. Non era richiesta la conferma radiologica della stabilità
Patologie autoimmuni
Ammessi pazienti che hanno fumato almeno un numero ≥100 sigarette nella vita
Ammessi pazienti con malattie che non hanno richiesto trattamento sistemico nei 2 anni precedenti. Vitiligine, DMI e tiroidite in terapia sostitutiva sono ammessi
Ammessi pazienti con metastasi cerebrali stabili da almeno due controlli di imaging, con sintomi neurologici tornati al basale o risolti. In caso di trattamento steroideo, questo deve essere stato completato almeno 3 giorni prima del trattamento di studio
Ammessi i pazienti con metastasi cerebrali asintomatiche solo in sede sovratentoriale, che non richiedono trattamento corticosteroideo. SRS almeno 7 giorni prima e WBRT almeno 14 giorni prima della randomizzazione. Farmaci anticonvulsivi a dose stabile ammessi
Ammessi pazienti con malattie che non hanno richiesto trattamento sistemico nei 2 anni precedenti. Vitiligine, DMI e tiroidite in terapia sostitutiva sono ammessi
Ammessi pazienti senza anamnesi positiva per patologie autoimmuni. Pazienti con DMI e tiroidite in terapia sostitutiva sono ammessi
Ammessi pazienti in trattamento con dose ≤10 mg/die di prednisone o equivalenti prima di 14 giorni dalla randomizzazione
Farmaci immunosoppressivi da sospendere prima di 3 giorni dalla randomizzazione, ammesso trattamento con 5-7,5 mg prednisone/die
Farmaci immunosoppressivi da sospendere prima di 14 giorni dalla randomizzazione, non esplicitata una dose di cortisone standard che permetta l’arruolamento
Altri criteri di esclusione
Chirurgia maggiore nei 28 giorni prima della randomizzazione
Disturbi psichiatrici o consumo di sostanze d’abuso che possano interferire con la compliance allo studio
TSH fuori range di laboratorio (pazienti con FT3 ed FT4 nel range ammessi)
Precedente trapianto di midollo allogenico o di organo solido
Disturbi psichiatrici o consumo di sostanze d’abuso che possano interferire con la compliance allo studio
Calcio sierico ≥12 mg/dl o calcio corretto > limite superiore
NYHA ≥ classe 2, IMA nei tre mesi precedenti la randomizzazione, angina o aritmie instabili
Chirurgia maggiore nei 28 giorni prima della randomizzazione
Precedente trapianto di midollo allogenico o di organo solido
Neuropatia periferica di grado ≥2 (cisplatino)
Pazienti con impairment uditivo (cisplatino)
ALP: fosfatasi alcalina; ALT: alanina aminotransferasi; aPTT: tempo di tromboplastina parziale attivata; AST: aspartato aminotransferasi DMI: diabete mellito di tipo I; ECOG: Eastern Cooperative Oncology Group; FT3: tri-iodotironina libera; FT4: tiroxina; GFR: glomerular filtration rate; HBV: virus dell’epatite B; HCV: virus dell’epatite C; HIV: virus dell’immunodeficienza acquisita umana; INR: international normalized ratio; NE: non esplicitato; TSH: thyroid stimulating hormone.
presi in esame i pazienti non devono aver ricevuto un trattamento di I linea per NSCLC, una preceden te terapia con agenti anti-PD1/PDL1, o avere anam nesi positiva per patologia interstiziale polmonare.
La necessità di ottenere dagli studi clinici dei dati applicabili in maniera ottimale alla quotidiana prati ca clinica sta sollecitando l’adozione di criteri di in clusione meno restrittivi del passato. Almeno per alcuni di tali criteri, il miglioramento delle terapie di supporto e quello delle comorbidità eventualmente presenti ha aperto le porte alla possibilità di inclu dere pazienti precedentemente ineleggibili per età e condizioni cliniche. La gestione multidisciplinare del paziente rimane un punto saldo dell’oncologia moderna, per porre ognuno di essi nelle condizioni di aver accesso al miglior trattamento possibile.
1. Baumfeld Andre E, Reynolds R, Caubel P, Azoulay L, Dreyer NA. Trial designs using real-world data: The changing landscape of the regulatory approval process. Pharmacoepidemiol Drug Saf. 2020 Oct;29(10):1201-1212.
2. Tannock IF, Amir E, Booth CM, et al. F. Relevance of randomised controlled trials in oncology. Lancet Oncol. 2016 Dec;17(12):e560-e567.
3. Nordon C, Bovagnet T, Belger M, et al.; IMI GetReal WP2 group. Trial exclusion criteria and their impact on the estimation of antipsychotic drugs effect: A case study using the SOHO database. Schizophr Res. 2018 Mar;193:146-153.
4. Cartabellotta A. Efficacia degli interventi sanitari: efficacy o effectiveness? Il ruolo dei trial pragmatici nei contesti assistenziali reali. Evidence 2008;1:2-3.
5. Sargent D. What constitutes reasonable evidence of efficacy and effectiveness to guide oncology treatment decisions? Oncologist. 2010;15 Suppl 1:19-23.
6. George SL. Reducing patient eligibility criteria in cancer clinical trials. J Clin Oncol. 1996 Apr;14(4):1364-70.
7. National Cancer Institute. Report of the National Cancer Institute, 1997.
8. Srikanthan A, Vera-Badillo F, Ethier J, et al. Evolution in the eligibility criteria of randomized controlled trials for systemic cancer therapies. Cancer Treat Rev. 2016 Feb;43:67-73.
9. FDA (2020, 10 07). https://www.fda.gov/regulatoryinformation. Tratto da www.fda.gov: https://www.fda. gov/regulatory-information/search-fda-guidancedocuments/cancer-clinical-trial-eligibility-criteriapatients-organ-dysfunction-or-prior-or-concurrent
10. FDA (2020, 10 07). https://www.fda.gov/regulatoryinformation. Tratto da www.fda.gov: https://www.fda. gov/regulatory-information/search-fda-guidancedocuments/cancer-clinical-trial-eligibility-criteriapatients-hiv-hepatitis-b-virus-or-hepatitis-c-virus
11. FDA (2020, 10 07). https://www.fda.gov/regulatoryinformation. Tratto da www.fda.gov: https://www.fda. gov/regulatory-information/search-fda-guidancedocuments/cancer-clinical-trial-eligibility-criteriabrain-metastases
12. Van Spall HG, Toren A, Kiss A, Fowler RA. Eligibility criteria of randomized controlled trials published in high-impact general medical journals: a systematic sampling review. JAMA. 2007 Mar 21;297(11):1233-40.
13. Karnofksy DA et al. The clinical evaluation of chemotherapeutic agents in cancer. New York: Columbia University Press, 1949.
14. Oken MM, Creech RH, Tormey DC, et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982 Dec;5(6):649-55.
15. Jang RW, Caraiscos VB, Swami N, et al. Simple prognostic model for patients with advanced cancer based on performance status. J Oncol Pract. 2014 Sep;10(5):e335-41.
16. Bersanelli M, Brighenti M, Buti S, Barni S, Petrelli F. Patient performance status and cancer immunotherapy efficacy: a meta-analysis. Med Oncol. 2018 Aug 20;35(10):132.
17. Aapro MS, Köhne CH, Cohen HJ, Extermann M. Never too old? Age should not be a barrier to enrollment in cancer clinical trials. Oncologist. 2005 Mar;10(3):198-204.
18. Hernandez-Torres C, Cheung WY, Kong S, O’Callaghan CJ, Hsu T. Accrual of older adults to cancer clinical trials led by the Canadian cancer trials group - Is trial design a barrier? J Geriatr Oncol. 2020 Apr;11(3):455-462.
19. van de Water W, Kiderlen M, Bastiaannet E, et al. External validity of a trial comprised of elderly patients with hormone receptor-positive breast cancer. J Natl Cancer Inst. 2014 Apr;106(4):dju051.
20. Wood ME, Vogel V, Ng A, et al. Second malignant neoplasms: assessment and strategies for risk reduction. J Clin Oncol. 2012 Oct 20;30(30):3734-45.
21. Townsley CA, Selby R, Siu LL. Systematic review of barriers to the recruitment of older patients with cancer onto clinical trials. J Clin Oncol. 2005 May 1;23(13):3112-24.
22. Patel RR, Parisi R, Verma V, et al. Association between prior malignancy exclusion criteria and age disparities in cancer clinical trials. Cancers (Basel). 2022 Feb 18;14(4):1048.
23. Lichtman SM, Harvey RD, Damiette Smit MA, et al. Modernizing Clinical Trial Eligibility Criteria: Recommendations of the American Society of Clinical Oncology-Friends of Cancer Research Organ Dysfunction, Prior or Concurrent Malignancy, and Comorbidities Working Group. J Clin Oncol. 2017 Nov 20;35(33):3753-3759.
24. Cagney DN, Martin AM, Catalano PJ, et al. Incidence and prognosis of patients with brain metastases at diagnosis of systemic malignancy: a population-based study. Neuro Oncol. 2017 Oct 19;19(11):1511-1521.
25. Tan AC, Boggs DH, Lee EQ, et al. Clinical trial eligibility criteria and recently approved cancer therapies for patients with brain metastases. Front Oncol. 2022 Jan 3;11:780379.
26. Kocoglu H, Karaca M, Tural D, et al. Hepatitis B and C rates are significantly increased in certain solid tumors: A large retrospective study. J Cancer Res Ther. 2018 Sep;14:S774-S778. doi: 10.4103/0973-1482.174544. Erratum in: J Cancer Res Ther. 2018 Oct-Dec;14(6):1451.
27. Torres HA, Davila M. Reactivation of hepatitis B virus and hepatitis C virus in patients with cancer. Nat Rev Clin Oncol. 2012 Jan 24;9(3):156-66.
28. Palmisano L, Vella S. A brief history of antiretroviral therapy of HIV infection: success and challenges. Ann Ist Super Sanita. 2011;47(1):44-8.
29. Monforte Ad, Abrams D, Pradier C, et al.; Data Collection on Adverse Events of Anti-HIV Drugs (D:A:D) Study Group. HIV-induced immunodeficiency and mortality from AIDS-defining and non-AIDS-defining malignancies. AIDS. 2008 Oct 18;22(16):2143-53.
30. Jin S, Pazdur R, Sridhara R. Re-evaluating eligibility criteria for oncology clinical trials: analysis of investigational new drug applications in 2015. J Clin Oncol. 2017 Nov 20;35(33):3745-3752.
31. Sezer A, Kilickap S, Gümüş M, et al. Cemiplimab monotherapy for first-line treatment of advanced non-small-cell lung cancer with PD-L1 of at least 50%: a multicentre, open-label, global, phase 3, randomised, controlled trial. Lancet. 2021 Feb 13;397(10274):592-604. doi: 10.1016/S0140-6736(21)00228-2.
32. Reck M, Rodríguez-Abreu D, Robinson AG, et al; KEYNOTE-024 Investigators. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N Engl J Med. 2016 Nov 10;375(19):1823-1833.
33. Herbst RS, Giaccone G, de Marinis F, et al. Atezolizumab for first-line treatment of PD-L1-selected patients with NSCLC. N Engl J Med. 2020 Oct 1;383(14):1328-1339.
Tutti i diritti riservati
Oncoinfo – Anno XII, ottobre 2022
ISSN 2385-0108

Confezione: 350 mg - 1 flaconcino; Classe di rimborsabilità: H; Prezzo ex-factory (IVA esclusa) € 6.975,00; Prezzo al pubblico (IVA inclusa) € 11.511,54; Sconto obbligatorio sul prezzo ex-factory come da condizioni negoziali; Classificazione ai fini della fornitura: Uso riservato agli ospedali, alle cliniche e alle case di cura. Vietata la vendita al pubblico (OSP).
