Istantanee di oncologia medica
L’utilizzo degli inibitori multichinasici per il miglioramento della sopravvivenza nei tumori del tratto gastrointestinale


Istantanee di oncologia medica

Il trattamento standard nel carcinoma del colonretto metastatico (mCRC) è ormai da qualche anno basato sull’integrazione tra la chemioterapia contenente fluoropirimidine, oxaliplatino e irinotecan, e le terapie biologiche come bevacizumab, cetuximab, panitumumab, aflibercept e regorafenib, inibitore multichinasico somministrato per via orale.1 Regorafenib è in grado di inibire sia i pathway di segnale coinvolti nella progressione di malattia (TIE 2, VEGFR 1-3), sia i recettori tirosin-chinasici come KIT e RET, con conseguente blocco della neovascolarizzazione e della crescita tumorale. L’azione di regorafenib si manifesta anche sul microambiente tumorale: qui contribuisce a mantenere intatti i fattori stromali che si oppongono alla progressione di malattia, inibendo sia il recettore per il fattore di cresci-

ta di derivazione piastrinica (PDGFR) sia quello per i fibroblasti (FGFR). Infine, l’attività immunogenica si esplica attraverso l’inibizione del CSF1R.3,9
Grazie all’incremento della sopravvivenza ottenuto da studi randomizzati di fase 3 nel colon retto, regorafenib è indicato9 per il trattamento dei pazienti adulti con mCRC precedentemente trattati oppure non candidabili al trattamento con le terapie disponibili (chemioterapia a base di fluoropirimidina, una terapia anti-VEGF e una terapia anti-EGFR).


Secondo uno studio di coorte americano, una buona percentuale di pazienti con mCRC può essere candidata ad una terza linea di trattamento (figura 2). Nel grafico viene evidenzata la percentuale di pazienti con mCRC che ha ricevuto chemioterapia tra il 2004 e il 2011.4 Cosa suggeriscono le linee gui-
da per questi pazienti? Sia le linee guida ESMO che quelle NCCN raccomandano il trattamento con regorafenib in terza linea in pazienti selezionati qualunque sia la mutazione del gene RAS, come evidenziato nella figura 3.1,2
Figura 2. Analisi del Database USA in pazienti con mCRC4
Figura 3. Scenari strategici nel continuum di cura del carcinoma del colon-retto metastatico1,2
* Valido
Diversi sono i fattori che hanno portato ad un miglioramento della sopravvivenza nei pazienti in fase metastatica: primo tra tutti il miglioramento dell’efficacia delle terapie sistemiche, dovuto sia alla disponibilità di nuovi schemi terapeutici sia alle diverse sequenze ed al numero di linee utilizzate; secondariamente, ma certo non per importanza, la selezione dei trattamenti in base ai biomarcatori tumorali.1
Per quanto riguarda regorafenib, i dati di due studi di fase 3, uno mondiale multicentrico (Nord America, Europa, Asia, Australia) ed uno asiatico, hanno raggiunto l’endpoint primario di prolungare la sopravvivenza (OS). Lo studio CORRECT, multicentrico, randomizzato, controllato verso placebo ha arruolato 760 pazienti con mCRC pesantemente pretrattati.5 I pazienti randomizzati nel braccio sperimentale (n=505) hanno ricevuto regorafenib in associazione alla migliore terapia di supporto (BSC), mentre i pazienti nel braccio di controllo (n=255) placebo + BSC. Obiettivo primario di questo studio era la sopravvivenza globale, che si è rivelata significati-
vamente a vantaggio di regorafenib con una riduzione del rischio di morte del 23% rispetto al braccio di controllo (HR 0,77; 6,4 vs 5,0 mesi, p=0,0052). Lo studio di fase 3 CONCUR ha studiato invece regorafenib nei pazienti di etnia asiatica.6 Il disegno dello studio era analogo a quello dello studio CORRECT, anche se con una dimensione ridotta del campione (n=204). Obiettivo primario era la sopravvivenza globale. L’OS nel braccio regorafenib (n=136) è risultata significativamente superiore al braccio placebo (n=68), con una riduzione del rischio di morte del 45% (HR 0,55, mediana 8,8 vs 6,3 mesi, p=0,00016). In questo studio, a differenza del CORRECT, potevano essere arruolati pazienti che non avevano ricevuto alcuna terapia biologica in associazione alla chemioterapia (41% dei pazienti).
Le analisi di sottogruppo dello studio CONCUR forniscono dati di efficacia anche in pazienti che non avevano ricevuto alcun precedente trattamento con anti-VEGF o anti-EGFR. Nei pazienti non pretrattati con alcuna terapia target, il beneficio in termini di OS è risultato superiore (HR: 0,31; 95% CI: 0,19-0,53)
Figura 4. Le curve di sopravvivenza negli studi di fase 3 CORRECT e CONCUR
rispetto a quello ottenuto dai pazienti pretrattati con almeno un farmaco anti-EGFR o anti-VEGF (HR: 0,78; 95% CI: 0,51-1,19).
In entrambi gli studi viene riportato anche un incremento della sopravvivenza libera da progressione (progression free survival – PFS) con una riduzione del rischio di progressione del 51% in CORRECT e del 69% in CONCUR. Il tasso di controllo di malattia (disease control rate – DCR) è stato del 41% nello studio CORRECT e 51,5% nello studio CONCUR. Nello studio CORRECT, inoltre, il 19% dei pazienti ha ottenuto una PFS superiore a 4 mesi.7
I risultati dell’endpoint primario di OS e dell’endpoint secondario di PFS sono riportati nelle figure 4 e 5. Questi dati sono stati confermati anche dallo studio multicentrico CONSIGN,7,8 studio di fase 3b con pazienti in terapia con regorafenib per mCRC nella pratica clinica. L’obiettivo primario in questo caso era quello di raccogliere dati sul profilo di sicurezza di regorafenib in pazienti pretrattati con mCRC. I pazienti arruolati (n=2872) hanno ricevuto regorafenib alla dose standard di 160 mg/die per 3 settimane
consecutive seguite da 7 giorni di riposo fino a decesso, tossicità inaccettabile o uscita dallo studio per volontà del paziente o dello sperimentatore. In caso di progressione di malattia, ogni singolo sperimentatore poteva decidere se proseguire regorafenib in assenza di alternative terapeutiche disponibili. Nello studio CONSIGN, più della metà dei pazienti (54%) aveva ricevuto tre o più precedenti trattamenti.7 La PFS mediana è stata di 2,7 mesi.
Come in CORRECT, anche in CONSIGN circa il 23% dei pazienti (674) ha ottenuto una PFS superiore a 4 mesi: in questo gruppo la mediana di trattamento è stata di 7 cicli e la mediana di PFS di 6,2 mesi. 8 Lo scopo della terza linea di trattamento è ben chiaro: aumentare la sopravvivenza stabilizzando la malattia, e garantendo una buona qualità di vita. I dati dei tre trial fanno di regorafenib una valida opzione terapeutica di terza linea.
Nello studio CORRECT solo l’8,2% dei pazienti ha dovuto interrompere il trattamento a causa di effetti collaterali (AE) correlati al farmaco, dimostrando una
Figura 5. Le curve di sopravvivenza libera da progressione negli studi di fase 3 CORRECT e CONCUR5,6
Figura 6. Correlazione tra HFSR e sopravvivenza in CORRECT12










buona tolleranza di questo agente in una popolazione di pazienti fortemente pretrattata. Gli AE riportati più frequentemente sono stati la reazione cutanea mano-piede (HFSR), la fatigue, la diarrea e il rash.10
Il monitoraggio attento dei pazienti permette una compliance e outcome clinici migliori. L’attenzione deve essere posta sulla corretta selezione dei pazienti (ECOG PS 0-1) e soprattutto nelle prime settimane di terapia. La HFSR si sviluppa solitamente durante il primo ciclo di trattamento con regorafenib, tende a non aumentare nel tempo, e può impattare negativamente sulla qualità di vita dei pazienti e sulle loro relazioni sociali, ma può essere gestita attraverso riduzioni temporanee del dosaggio. Per questo motivo, è molto importante prevenire l’evento avverso con adeguati accorgimenti, riconoscere precocemente le lesioni cutanee e trattarle immediatamente. Molti esperti consigliano visite settimanali per i pazienti durante il loro primo ciclo.11
Recentemente è stata dimostrata la correlazione tra HFSR e sopravvivenza.12 L’analisi esplorativa posthoc dello studio CORRECT suggerisce infatti che i
pazienti trattati con regorafenib che hanno manifestato HFSR hanno ottenuto un maggior beneficio dal trattamento rispetto ai pazienti che non la hanno manifestata (figura 6).
Lo stesso dato sulla tossicità HFSR correlato ad un miglioramento della PSF e dell’OS è stato segnalato all’ASCO GI 2017 da uno studio osservazionale post marketing giapponese (figura 7).13
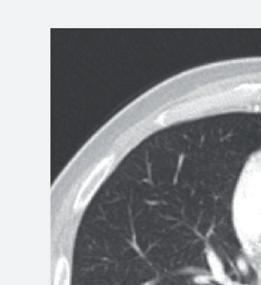
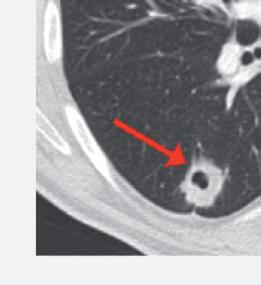
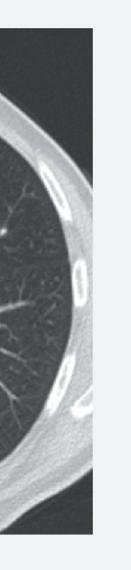
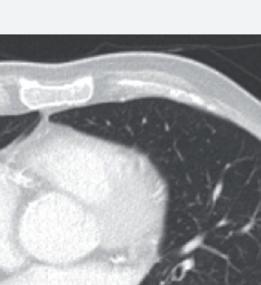
Anche la necrosi del tumore può essere considerata un marcatore predittivo di beneficio clinico. Cambiamenti della densità tumorale ed anche necrosi di lesioni polmonari sono state descritte in pazienti che ricevevano terapia antiangiogenica e vengono considerate come risposta della malattia. L’analisi post-hoc dello studio CORRECT (RadioCORRECT)14 ha mostrato che una precoce valutazione radiologica a 8 settimane è utile per predire i risultati clinici della terapia con regorafenib nei pazienti con metastasi polmonari al basale. Il 20% dei pazienti con metastasi polmonari nel braccio con regorafenib presentavano cavitazione alla CECT basale. Questi pazienti erano quelli che più verosimilmente
Figura 7. Correlazione tra HFSR e sopravvivenza nello studio osservazionale post-marketing giapponese13


















hanno sviluppato un aumento della cavitazione a 8 settimane e hanno raggiunto una maggiore PFS e OS rispetto ai pazienti che non presentavano cavitazione al basale.
Le opzioni di trattamento per mCRC rimangono una necessità: i pazienti devono essere esposti a più agenti possibili per prolungare la sopravvivenza globale.1
Regorafenib, con un meccanismo di azione unico e un profilo di tossicità diverso dalla chemioterapia, rappresenta uno standard di cura per i pazienti di terza linea con un buon performance status indipendentemente dallo stato mutazionale del RAS. Offre un maggior beneficio in pazienti meno pretrattati6 e permette ai pazienti a progressione candidabili ad un ulteriore linea di terapia di ottenere ancora un buon controllo di malattia.15
Figura 8. RadioCORRECT: esempio di cavitazione polmonare a 8 settimane14




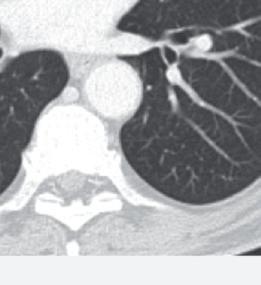

Prima del trattamento con regorafenib.
Dopo il trattamento con regorafenib.
I GIST sono i sarcomi più comuni del tratto GI, con circa 5000 nuovi casi diagnosticati ogni anno. Questi tumori furono descritti per la prima volta nel 1983 da Mazur e Clark.16 Nel 1995, il CD34 17 è stato identificato come un marker specifico GIST, marker che era presente anche sulle cellule interstiziali di Cajal,18 che sono ora considerate le cellule da cui originano questi tumori.
Nel 1998, Hirota e colleghi hanno mostrato come la colorazione KIT fosse presente nel 94% dei casi di GIST e che la maggioranza di questi pazienti avesse anche mutazioni attivanti nel gene KIT. Queste sco -
perte hanno indirizzato la ricerca verso i trial con imatinib – un agente che inibisce KIT – per il trattamento dei GIST, in seguito ad una risposta eclatante su un caso pubblicato nel 2001. Sono stati effettuati trial clinici, utilizzando diverse schedule di imatinib. Questi studi hanno fornito preziose informazioni sul dosaggio e hanno rivelato l’importanza delle mutazioni dei driver in KIT e PDGFR nella predizione della risposta.
La classificazione dei GIST è legata alle diverse mutazioni. Circa l’85% dei GIST ha una mutazione nel gene KIT, più comunemente nell’esone 11, seguito dall’esone 9. Le mutazioni primarie negli esoni 13 e 17 si verificano meno frequentemente. Le mutazioni PDGFR-α, che tendono ad essere reciprocamente esclusive rispetto alle mutazioni nel KIT, sono presenti nel 5%-7% dei GIST. La mutazione nell’esone 18 (D842V) conferisce resistenza ai TKI attualmente disponibili quali imatinib e sunitinib, mentre quella dell’esone 12 e le mutazioni PDGFR-α rispondono bene ad imatinib. I casi di GIST che sono KIT e PDGFR-α-wild tipe si verificano in circa il 10%-15% dei pazienti. Questi tumori sono guidati
Figura 9. Studio GRID: curva della PFS (endpoint principale dello studio)20
da mutazioni in BRAF V600E (≤1%), succinato deidrogenasi, AKT, PTEN. Recentemente è stato osservato che fusioni NTR-Ke hanno un’eccessiva espressione di IGF-1R.19
Lo studio GRID20 di fase 3 è uno studio internazionale, doppio cieco, con regorafenib vs. placebo in 199 pazienti con GIST avanzato. I pazienti con GIST metastatico o non resecabile in progressione dopo imatinib e sunitinib sono stati randomizzati in rapporto 2: 1 a regorafenib o placebo. Regorafenib è stato somministrato a 160 mg/die per 3 settimane con 1 settimana di pausa. A progressione, i pazienti trattati con placebo hanno potuto accedere al trattamento con regorafenib, così come i pazienti nel braccio con regorafenib, a discrezione del ricercatore, hanno potuto continuare la terapia anche dopo progressione. L’endpoint primario dello studio era la PFS mentre gli endpoint secondari includevano OS, TTP, ORR, tasso di controllo della malattia e profilo di sicurezza.
Regorafenib ha dimostrato un tasso di controllo di malattia del 53% (70/133) rispetto al 9% (6/66) del placebo. Nella figura 9 è riportato l’andamento del -
la curva relativa alla PFS, endpoint primario dello studio, con una mediana di 4,8 mesi, statisticamente significativa rispetto al placebo. La possibilità di crossover dei pazienti del braccio placebo non conferisce significatività alle curve di OS. Il profilo di sicurezza di regorafenib in questo studio si è mostrato sovrapponibile a quello osservato in precedenti trial clinici.
Recentemente sono stati presentati i dati del followup dello studio di fase 2 di regorafenib nei pazienti precedentemente trattati con sunitinib. L’OS mediana è stata di 25 mesi e la PFS mediana di 13,2 mesi come riportato nella figura 10. 21
Il profilo di sicurezza di regorafenib in questo studio era simile a quello osservato nei precedenti studi clinici.21
Regorafenib rappresenta quindi lo standard terapeutico attuale per i pazienti in progressione di malattia o con intolleranza a imatinib e sunitinib. 22
Figura 10. Follow-up a lungo termine dello studio di fase 2 di regorafenib nei pazienti precedentemente trattati con imatinib e sunitinib21
1. Van Cutsem E, Cervantes A, Adam R, Sobrero A, Van Krieken JH et al. ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Annals of Oncology 2016;1–37 doi:10.1093/annonc/mdw235.
2. NCCN Clinical Practice Guidelines. Colon cancer. V2.2017; NCCN Clinical Practice Guidelines. Rectal cancer. V3.2017; Van Cutsem E et al. Ann Oncol 2016;27(8):1386-1422.
3. Highlights of prescribing information for STIVARGA®, 2017.
4. Abrams T et al. Chemotherapy usage patterns in a US-wide cohort of patients with metastatic colorectal cancer. J Natl Cancer Inst 2014;106(2):djt371.
5. Grothey A, Van Cutsem E, Sobrero A et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2013; 381:303-12.
6. Li J, Qin S, Xu R et al. Regorafenib plus best supportive care versus placebo plus best supportive care in Asian patients with previously treated metastatic colorectal cancer (CONCUR): a randomised, double-blind, placebo controlled phase III trial. Lancet Oncol 2015;16:619-29.
7. García Alfonso P, Feliú J, García Carbonero R, Grávalos C, Guillén-Ponce C, Sastre J, García Foncillas J. Is regorafenib providing clinically meaningful benefits to pretreated patients with metastatic colorectal cancer? Clin Transl Oncol 2016;18:1072–1081 doi 10.1007/s12094-016-1499-8.
8. García Carbonero R, Van Cutsem E, Ciardiello F, Ychou M, Seitz JF, Hofheinz RD, Arriaga YE, Verma U, Grothey A, Miriyala A, Kalmus J, Kappeler C, Falcone A, Zaniboni A. Subgroup analysis of patients with metastatic colorectal cancer (mCRC) treated with regorafenib in the phase 3b CONSIGN trial who had progression-free survival (PFS) >4 months. European Society for Medical Oncology, 07–11 October 2016, Copenhagen, Denmark.
9. STIVARGA® RCP, 2017.
10. Davis SL, Eckhardt SG, Messersmith WA, Jimeno A. The development of regorafenib and its current and potential future role in cancer therapy. Drugs of Today 2013;49(2):105-115.
11. De Wit M, Boers-Doets CB, Saettini A, Vermeersch K, Roncero de Juan C, Ouwerkerk J, Raynard SS, Bazin A, Cremolini C. Prevention and management of adverse events related to regorafenib. Support Care Cancer 2013; doi 10.1007/s00520-013-2085-z.
12. Grothey A, Huang L, Wagner A, Van Cutsem E. Hand-foot skin reaction (HFSR) and outcomes in the phase 3 CORRECT trial of regorafenib for metastatic colorectal cancer (mCRC). Journal of Clinical Oncology 2017;35:15 suppl:3551.
13. Komatsu Y, Muro K, Yamaguchi K, Satoh T et al. Safety and efficacy of regorafenib post-marketing surveillance (PMS) in Japanese patients with metastatic colorectal cancer (mCRC). Journal of Clinical Oncology 2017;35(4)suppl 721-721 doi: 10.1200/JCO.2017.35.4_suppl.721.
14. Ricotta R, Verrioli A, Ghezzi S, Porcu L, Grothey A, Falcone A, Van Cutsem E et al. Radiological imaging markers predicting clinical outcome in patients with metastatic colorectal carcinoma treated with regorafenib: post hoc analysis of the CORRECT phase III trial (RadioCORRECT study). ESMO Open 2017;1:e000111 doi:10.1136/ esmoopen-2016-000111.
15. Sartore-Bianchi A, Siena S, Tonini G et al. Overcoming dynamic molecular heterogeneity in metastatic colorectal cancer: Multikinase inhibition with regorafenib and the case of rechallenge with anti-EGFR. Cancer Treatment Reviews 2016;51:54-62.
16. Mazur MT, Clark HB. Gastric stromal tumors: reappraisal of histogenesis. Am J Surg Pathol 1983;7:507-519.
17. Miettinen M, Virolainen M, Maarit-Sarlomo-Rikala. Gastrointestinal stromal tumors—value of CD34 antigen in their identification and separation from true leiomyomas and schwannomas. Am J Surg Pathol 1995;19:207-216.
18. Sircar K, Hewlett BR, Huizinga JD et al. Interstitial cells of Cajal as precursors of gastrointestinal stromal tumors. Am J Surg Pathol 1999;23:377-389.
19. Blay JY et al. Gastrointestinal Stromal Tumors (GIST): a Rare Entity, a Tumor Model for Personalized Therapy, and Yet Ten Different Molecular Subtypes. Discov Med 2012;13(72):357-367.
20. Demetri G et al. Randomized phase III trial of regorafenib in patients (pts) with metastatic and/or unresectable gastrointestinal stromal tumor (GIST) progressing despite prior treatment with at least imatinib (IM) and sunitinib (SU): GRID trial. J Clin Oncol 2012;30(suppl):abstract LBA10008.
21. Ben-Ami E, Barysauskas CM, von Mehren M et al. Long-term follow-up results of the multicenter phase II trial of regorafenib in patients with metastatic and/or unresectable GI stromal tumor after failure of standard tyrosine kinase inhibitor therapy. Annals of Oncology 2016;00:1–6 doi:10.1093/annonc/mdw228.
22. Poveda A, García del Muro X, López-Guerrero JA et al on behalf of GEIS (Grupo Español de Investigación en Sarcomas/Spanish Group for Sarcoma Research). GEIS guidelines for gastrointestinal sarcomas (GIST). Cancer Treatment Reviews 2017;55:107–119.

Medicinale sottoposto a monitoraggio addizionale. Il presente materiale verrà distribuito unicamente associato all’RCP aggiornato del prodotto. Nel sito www.bayer.com si trova sempre disponibile l’ultima versione approvata dell’RCP. Prezzo ex factory al netto delle riduzioni di legge: € 2.090,0 –Classe A, RNR. Depositato presso AIFA in data 02/08/2017 -
cod. mag. 86010690-
