2018 Milano Parola d’ordine: empatia



Se si potesse sintetizzare in un’unica parola il senso del corso “Skills interaction – Supportive care in cancer patients”, svoltosi a Milano il 22 e 23 giugno 2018 presso il Marriott Hotel di via Washington e realizzato con il supporto incondizionato di Kyowa Kirin, quella parola sarebbe probabilmente “empatia”. Capire come pensano i pazienti, capire cosa provano i pazienti, capire cosa si può fare di più per i pazienti e come si può comunicare meglio con loro: ecco il tema di fondo su cui oncologi, palliativisti e radioterapisti si sono confrontati, ognuno con la sua visione. E il concetto di empatia è stato davvero approfondito con passione e serietà, guardandolo da diversi punti di vista: etico, filosofico, organizzativo, formativo.
Durante “Skills interaction – Supportive care in cancer patients” si sono affrontate però anche questioni più eminentemente cliniche, secondo quanto suggerito dalle nuove evidenze: anticipare le cure palliative, porre particolare attenzione al controllo e alla corretta valutazione dei sintomi secondari alla malattia oncologica o alle terapie. Si è parlato quindi di controllo del dolore, gestione della stipsi indotta da oppiacei e della nausea e vomito da chemioterapia, sempre con un approccio operativo e diretto alla pratica clinica quotidiana.
Perché la richiesta che arriva dai pazienti oncologici è non solo di essere curati, ma di essere gestiti sempre di più nella loro totalità di persona: e a questa richiesta il Servizio Sanitario nazionale ha il dovere di dare una risposta.

Jennifer S. Temel Professor of Medicine, Harvard Medical School Director of Cancer Outcomes Research, Massachusetts General Hospital Cancer Center
Il ruolo delle cure palliative nel fine vita nel setting ospedaliero è una realtà ben definita da molti anni, ma i programmi generalmente per partire hanno bisogno che il paziente entri in fase terminale e di conseguenza lo lasciano da solo – per un periodo di tempo variabile – a vivere con la sua diagnosi infausta, con importanti sintomi fisiologici e psicologici, con numerosi unmet needs rispetto alla comunicazione e all’assistenza. Anche i familiari del paziente oncologico subiscono il peso della malattia, tanto che uno studio1 pubblicato da “Annals of Oncology” che ha messo a confronto l’incidenza di sintomi depressivi nei pazienti e nei loro caregiver ha scoperto che i livelli di ansia sono in media più elevati tra questi ultimi (42% vs 28,4%). Ma è importante ricordare che i sintomi fisici e psicologici non sono l’unico tipo di burden o stress che i pazienti e le loro famiglie devono affrontare nella fase di fine vita: devono prendere anche decisioni davvero difficili sul loro percorso clinico, per esempio quando interrompere la chemioterapia, quando e se ri-
nunciare alle terapie di supporto, quando entrare in hospice.
Sappiamo che affinché i pazienti siano in grado di prendere decisioni informate, in base ai loro obiettivi e ai loro desideri, devono avere conversazioni tempestive e chiare con l’oncologo che li ha in cura sin dall’inizio dell’assistenza: qual è la prognosi? Cosa accadrà con questa malattia? Ma sappiamo anche che come oncologi non sempre facciamo un buon lavoro comunicando con i pazienti e le loro famiglie.
Un recente studio ha dimostrato che i pazienti tendono a sopravvalutare le loro possibilità di guarigione, anche se hanno tumori in fase molto avanzata. Molti oncologi a questo riguardo dicono: “Qual è il problema? Se i pazienti con tumori incurabili pensano o sognano di guarire cosa c’è di sbagliato, eviteranno almeno un po’ di preoccupazione e disperazione!”. Il problema è che esiste una chiara correlazione tra il modo in cui i pazienti comprendono e valutano la loro prognosi e le scelte che fanno sia nel loro percorso terapeutico sia nella vita privata. Nello specifico delle terapie palliative, i pazienti che sovrastimano le loro probabilità di sopravvivenza tendono a richiedere terapie che prolungano la vita come il ricovero in Terapia intensiva o essere sottoposti a rianimazione e hanno meno probabilità di aver discusso dei servizi di hospice e di richiederne l’accesso. Ma ancor più importante è il modo in cui i pazienti percepiscono la loro prognosi, che impatta sulla loro vita personale e sulla cura della famiglia: ad esempio, se un paziente non capisce che la sua prognosi è solo di un anno potrebbe non prendere la decisione di andare per l’ultima volta in vacanza con la sua famiglia, oppure potrebbe non capire che quasi certamente non sarà qui per la laurea di un figlio o per il matrimonio di una figlia o potrebbe non capire che deve trovare il tempo di lasciare un’e-
redità per i suoi cari. Non conosco la situazione qui in Italia, ma negli Stati Uniti la discussione sul fine vita arriva troppo tardi nel percorso terapeutico – si stima che in media tra il primo accenno del medico all’argomento e il decesso passino 30 giorni – e la maggior parte di queste conversazioni avviene in ambiente ospedaliero, un setting che, a mio avviso, è il posto peggiore per avere una conversazione seria con il paziente e la sua famiglia, quando tutti sono o molto malati o molto stressati.
Dato questo background, quale ruolo possono giocare le cure palliative quando le facciamo entrare prima nel percorso terapeutico? Oltre al controllo dei sintomi, l’idea è che l’arruolamento in un percorso di cure palliative porti i pazienti a ragionare sulla loro patologia, a discuterne con familiari e amici, così da facilitare – per quanto possibile – il percorso di fine vita. C’è da fare una premessa, però. È essenziale ricordare che quando un paziente riceve una diagnosi di tumore ciò che vuole è il miglior trattamento disponibile per la sua patologia: il dovere di noi oncologi è trattare quei pazienti anche in modo aggressivo se necessario, arruolarli in trial sperimentali, curarli con appropriatezza e decisione. L’inserimento di cure palliative precoci nel percorso di cura deve avvenire in collaborazione con l’oncologo e non a detrimento dell’assistenza clinica, ovviamente. Oggi abbiamo un buon numero di studi randomizzati controllati e ben condotti che dimostrano che le cure palliative precoci sono fattibili e vantaggiose con pazienti con cancro avanzato e alcuni di questi studi hanno coinvolto anche i caregiver. I modelli assistenziali possono essere diversi: cure palliative precoci via telefono o di persona, svolte in setting domiciliare oppure ospedaliero. Tra i trial che hanno valutato programmi di cure palliative precoci effettuate via telefono, mi concentrerò principalmente sul trial ENABLE II2, che è stato pubblicato sul “Journal
of American Medical Association”, ma sono interessanti anche i dati di ENABLE III, che ha coinvolto anche i caregiver. ENABLE II ha preso in esame 322 pazienti con una diagnosi effettuata nelle precedenti 8-12 settimane di tumore gastrico, intestinale, polmonare, genito-urinario o mammario e una prognosi di circa 1 anno di vita. I pazienti sono stati randomizzati ad assistenza oncologica di routine oppure a un intervento telefonico di cure palliative precoci consistente in 4 telefonate al giorno effettuate da un’infermiera specializzata. I risultati indicano un significativo miglioramento in questo secondo gruppo non solo di parametri come la qualità di vita o l’umore del paziente, ma anche un trend positivo nel controllo dei sintomi, mentre non misuriamo un aumento davvero significativo delle disposizioni di fine vita, le “advanced directives”. ENABLE III dimostra inoltre che anche tra i caregiver, se arruolati in programmi di cure palliative precoci, registriamo un netto calo dei sintomi depressivi.
Per quanto riguarda invece i programmi di cure palliative precoci somministrati di persona, al Massachusetts General Hospital abbiamo testato un programma di cure palliative che parte al momento della diagnosi e arriva al decesso: 150 pazienti con diagnosi di NSCLC metastatico sono stati randomizzati a un’assistenza oncologica di routine oppure a un’assistenza integrata con cure palliative. Tra gli outcome misurati ancora una volta vari parametri di qualità della vita, sintomi di ansia o depressione, ma anche la consapevolezza della propria prognosi: tutti gli outcome si sono dimostrati significativamente migliorati dall’introduzione delle cure palliative, che hanno anche creato consapevolezza nei pazienti stimolandoli a discutere con l’oncologo la gestione del fine vita e portandoli a passare in hospice in media 24 giorni contro i 9 del gruppo assistito con terapie di routine. Anche in questo caso abbiamo
- Patient Reported Outcomes. Quality of life, symptom intensity, and mood scores for all patients
Functional Assessment of Chronic Illness Therapy for Palliative Care
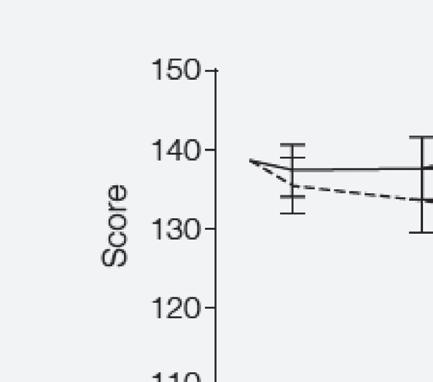


p =0.02

Edmonton Symptom Assessment Scale

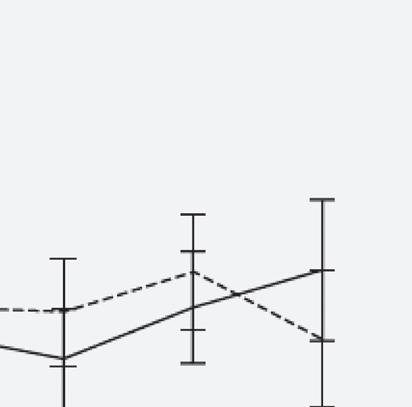


esteso il programma ai caregiver e i risultati sono stati ottimi, con un netto calo dei sintomi ansiosi e depressivi.
Center for Epidemiological Studies Depression Scale p =0.02 p =0.06



Nell’ambito di uno studio canadese pubblicato nel 2014 sul “Lancet”3 sono stati arruolati 461 pazienti con limitata aspettativa di vita (da 6 a 24 mesi) avviandoli a 4 mesi di cure palliative o ad assistenza di routine, quindi l’assistenza integrata non è partita alla diagnosi ed ha avuto una durata limitata: ciononostante si è registrato un decisivo miglioramento di tutti gli outcome – molto simili a quelli osservati nello studio che ho precedentemente preso in esame – nel gruppo assistenza integrata. Interessante sottolineare che per quanto riguarda i caregiver qui veniva misurata la soddisfazione riguardo all’assistenza del loro familiare, soddisfazione che è risultata nettamente maggiore con la presenza delle cure palliative. Tra i più recenti trial sull’argomento ce n’è uno italiano 4, condotto dall’Early Palliative Care Italian Study Group (EPCISG). Ha riguardato 207 pazienti che avevano ricevuto – al massimo 8 settimane prima – una diagnosi di tumore pancreatico metastatico o localmente avanzato inoperabile, con un’aspettiva di vita superiore ai 2 mesi. I pazienti sono stati avviati a cure palliative precoci sistematiche o su richiesta. Non è stata rilevata una differenza significativa nella insorgenza di sintomi depressivi, ma un trend positivo riguardante ansietà.
Per quanto riguarda le cure palliative effettuate in regime di ricovero ospedaliero, dati interessanti arrivano da due studi: uno parte dall’arrivo in Pronto Soccorso di pazienti oncologici, l’altro – anche questo svolto al Massachusetts General Hospital – riguarda pazienti avviati al trapianto di midollo osseo o di cellule staminali. Nel primo studio5, 136 pazienti con tumore in fase avanzata mai visitati da un palliativista sono stati randomizzati a ricevere un’assistenza oncologica di routine oppure a un’assistenza integrata
Figura 2. Long term effects of palliative care during transplant
con cure palliative. I risultati sono stati deludenti: quasi nessuna differenza negli outcome legati alla qualità di vita e ai sintomi ansiosi e depressivi, nessuna differenza nel ricorso all’hospice e nell’utilizzazione delle strutture ospedaliere. Nel secondo studio6, 160 pazienti avviati a trapianto autologo di cellule emopoietiche o allogenico e i loro caregiver sono stati randomizzati a un’assistenza oncologica di routine oppure a cure palliative mirate su alcuni sintomi (nausea, fatigue, insonnia, depressione, sintomi gastrici). Nel gruppo avviato alle cure palliative si sono avuti effetti notevoli sugli outcome clinici nel caso dei pazienti e sull’umore dei caregiver, effetti duraturi anche a lungo termine, nel periodo post-trapianto.
Quali conclusioni trarre da questi dati? Le cure palliative precoci migliorano la qualità della vita dei pazienti, ma solo quelle iniziate sin dalla diagnosi migliorano i sintomi depressivi, così come solo le cure palliative somministrate di persona migliorano la comunicazione sul fine vita. Le cure palliative precoci possono contribuire a rendere meno dolorosa
l’esperienza dei caregiver dei pazienti con tumore avanzato, migliorando il loro umore e aumentandone la soddisfazione riguardo all’assistenza ricevuta dal loro familiare.
Qual è il timing ottimale dunque per l’inizio delle cure palliative? Credo che la risposta dipenda da due fattori: innanzitutto i bisogni della popolazione, e in secondo luogo gli outcome che vogliamo ottenere. Probabilmente non esiste un modello che vada bene per tutti i pazienti oncologici, dobbiamo pensare a cure palliative centrate sul paziente. Dobbiamo anche però trovare un metodo efficace per disseminare modelli di cure palliative primarie sul territorio: una delle sfide più difficili è la scarsità di clinici adeguatamente addestrati alla somministrazione di cure palliative. È necessario credo pensare a dei triage che selezionino i pazienti che possano trarre il massimo vantaggio dalle cure palliative precoci e sviluppare nuove tecnologie (come la Telemedicina) per fornire servizi usando meno risorse. Negli Stati Uniti stiamo valutando un modello di assistenza “a gradi-
ni” in cui personale infermieristico e medici di medicina generale gestiscono la maggior parte delle cure palliative precoci, sebbene i pazienti siano costantemente monitorati dallo specialista: se l’assistenza che ricevono non è loro sufficiente si fa fare ai pazienti uno step ulteriore e si forniscono livelli più intensivi di cure palliative. Così soltanto i pazienti che necessitano davvero di cure palliative intensive le ricevono, si rivaluta il paziente a diversi punti chiave della traiettoria clinica.
A latere di tutto questo, occorre fare un lavoro di formazione migliore per gli oncologi in modo che possano utilizzare meglio le cure palliative. C’è chi pensa che a lungo termine questa strategia formativa debba portare alla scomparsa della figura del palliativista, ma istintivamente non sono d’accordo con questa impostazione: ho l’impressione che i pazienti apprezzino davvero avere due diversi clinici, due figure professionali distinte che si concentrano su diversi elementi di cura.
Trattasi di mera trascrizione dall’intervento orale del relatore.
1. Nipp RD, El-Jawahri A, Fishbein JN, Gallagher ER, Stagl JM, Park ER, Jackson VA, Pirl WF, Greer JA, Temel JS. Factors associated with depression and anxiety symptoms in family caregivers of patients with incurable cancer. Ann Oncol 2016;27(8):1607-12 doi: 10.1093/annonc/mdw205.
2. Bakitas M, Doyle Lyons K, Hegel MT, Balan S, Brokaw FC, Seville J, Hull JG, Li Z, Tosteson T, Byock IR, Ahles TA. The Project ENABLE II Randomized Controlled Trial to Improve Palliative Care for Patients with Advanced Cancer. JAMA 2009;302(7):741–749 doi: 10.1001/jama.2009.1198.
3. Zimmermann C, Swami N, Krzyzanowska M, Hannon B, Leighl N, Oza A, Moore M, Rydall A, Rodin G, Tannock I, Donner A, Lo C. Early palliative care for patients with advanced cancer: a cluster-randomised controlled trial. The Lancet 2014;383(9930):1721-30 doi: 10.1016/S01406736(13)62416-2.
4. Maltoni M, Scarpi E, Dall’Agata M, Zagonel V, Bertè R, Ferrari D, Broglia CM, Bortolussi R, Trentin L, Valgiusti M, Pini S et al for the Early Palliative Care Italian Study Group (EPCISG). Systematic versus on-demand early palliative care: results from a multicentre, randomised clinical trial. Eur J Cancer 2016;65:61-8 doi: 10.1016/j.ejca.2016.06.007.
5. Grudzen CR, Richardson LD, Johnson PN et al. Emergency Department–Initiated Palliative Care in Advanced Cancer: A Randomized Clinical Trial. JAMA Oncol 2016;2(5):591-598 doi: 10.1001/jamaoncol.2015.5252.
6. El-Jawahri A, LeBlanc T, VanDusen H, Traeger L, Greer JA, Pirl WF, Jackson VA, Telles J, Temel JS et al. Effect of Inpatient Palliative Care on Quality of Life 2Weeks After Hematopoietic Stem Cell Transplantation - A Randomized Clinical Trial. JAMA 2016;316(20):2094–2103 doi: 10.1001/jama.2016.16786.
Figura 3. Comparative effectiveness trial of in-person versus telehealth palliative care
Utilizing video technology to provide face to face care and enable palliative care clinicians to conduct vir tual home visits




Patients with advanced NSCLC (N=1250) [and their caregivers]
Baseline par ticipant-repor ted measures
Randomization
Telehealth early palliative care (monthly telehealth visits)
In-person early palliative care (monthly in-person visits)
Participant-repor ted measures every 3 months
Caregiver af ter death assessment
Carmine Pinto
UOC Oncologia
Medica
Clinical Cancer Centre
AUSL-IRCCS di Reggio Emilia
Oramai non è più in discussione il ruolo delle cure palliative nel percorso di cura, come non è in discussione l’impatto positivo delle cure palliative precoci. Quello su cui noi oggi dovremmo fare un ragionamento è come tutto questo si inserisce nella nostra realtà, come si inserisce nei cambiamenti che sono avvenuti nel mondo dell’Oncologia e come si inserisce in quell’equilibrio sempre più dinamico che deve esserci tra l’assistenza ospedaliera e l’assistenza territoriale, perché come sappiamo la vita dei nostri pazienti si svolge per il 20% in ospedale e per l’80% sul territorio.
E quali sono i cambiamenti più recenti in Oncologia?
Sicuramente c’è un cambiamento molto importante nella popolazione che noi andiamo a curare, cambia la percezione delle cure da parte dei pazienti e anche le loro aspettative sono diverse. Cronicizzazione e guarigione hanno un impatto molto rilevante sull’organizzazione dei processi assistenziali e quello che è ancor più rilevante – a mio avviso – è che sta cambiando la visione a silos che abbiamo avuto per molto tempo nella strategia di controllo dei tumori. Non esiste il silos della prevenzione, non deve esistere il silos di chi fa soltanto la terapia medica, non deve esistere il silos di chi fa le cure palliative e l’accompagnamento di fine vita: deve esserci una presa in carico completa e continua del paziente e questo è un passaggio molto importante da un punto di vista culturale. Quindi un’assistenza del malato non più a step, ma che deve essere vista in
un continuum. A seguire cambia l’aspetto organizzativo e culturale anche per quello che riguarda la multiprofessionalità: abbiamo sempre di più PDTA e gruppi multidisciplinari, abbiamo le reti oncologiche regionali, abbiamo le reti delle cure palliative, abbiamo le reti delle cure primarie, quindi bisogna integrare e mettere queste reti nella capacità e possibilità di lavorare tra di loro. Cambiano le risorse e l’idea di sostenibilità che abbiamo, cambiano anche le modalità di accesso e sopratutto la comunicazione di media tradizionali e web sull’Oncologia, e anche questo rappresenta un passaggio non da poco.
La popolazione diventa più anziana – e aumentano le famiglie costituite da anziani soli –, è sempre più rilevante il ruolo dell’immigrazione. Attualmente nel nostro Paese abbiamo cinque milioni di immigrati che vivono qui in pianta stabile, è più o meno la popolazione dell’Emilia-Romagna o quella della Danimarca. Questo comporta un forte impatto di ordine culturale e professionale del quale non possiamo non tenere conto. Lavorare in quest’ambito sulle cure palliative vuol dire garantire un’integrazione dell’assistenza sicuramente rilevante: noi questo non possiamo non considerarlo nella nostra attività di oncologi. Cambiano anche gli stili di vita, soprattutto nei giovani: dobbiamo tener conto di alcol, obesità, fumo. Sicuramente registriamo un miglioramento nei tassi di incidenza e mortalità: abbiamo raggiunto un plateau per quanto riguarda la mortalità, stiamo migliorando nella sopravvivenza praticamente in tutte le patologie neoplastiche in maniera più o meno importante. Questo è dovuto a diversi fattori rilevanti e tra questi sicuramente vanno inserite le cure palliative.
Abbiamo una quota rilevante – in Italia sono circa 3,4 milioni, circa il 6% della popolazione – di italiani che sono o sono stati pazienti oncologici, dovrem-
mo sicuramente lavorare sulla corretta gestione di questi pazienti o ex pazienti una volta che escono dai processi attivi di cura. Le cure palliative non possono più essere un settore a sé, vanno integrate all’interno del processo assistenziale: quindi è necessario ottimizzare il trattamento, creare una continuità tra i vari attori che ruotano attorno al paziente, caregiver compresi, ma soprattutto andare a ragionare sui modelli organizzativi. Anche per fare fronte alle difficoltà economiche sempre maggiori da parte dei pazienti, che rinunciano soprattutto alle cure accessorie: una difficoltà economica o all’inizio o in corso di trattamento rappresenta un fattore condizionale e autoconfinale.
Il tema della comunicazione è sicuramente particolarmente rilevante. Per chi fa il nostro mestiere comunicare una prognosi infausta ad un paziente con malattia avanzata mi sembra sia ancora una problematica non del tutto risolta. È necessaria poi la capacità di ascoltare – probabilmente è la difficoltà maggiore che abbiamo in alcune situazioni –, il tempo della comunicazione è un tempo di cura, non è un tempo accessorio che noi dedichiamo al paziente ma fa parte del tempo della cura che è previsto per il nostro malato e quindi le strutture pubbliche devono riuscire a garantirlo, come ha recentemente sancito la Legge n. 219 del 22 dicembre 2017 sulle “Norme in materia di consenso informato e di disposizioni anticipate di trattamento” all’articolo 1. È necessario saper recepire i bisogni che come dicevamo sono andati declinandosi diversamente negli ultimi anni e quindi riuscire a ragionare sulla strategia di cura globale che noi vogliamo per i nostri pazienti. C’è qualcuno che dice: non esistono un’Oncologia umana e un’Oncologia non umana, quando parliamo di umanizzazione delle cure intendiamo avere la capacità di prestare attenzione a tutte quelle che sono le problematiche psicosociali che fanno parte
della nostra quotidianità e anche della nostra capacità in alcune situazioni di intraprendere un processo terapeutico di tipo diverso.
Comunicazione è anche media, è anche web. Anche questo oggi è un mondo molto diverso rispetto a quello che abbiamo visto nel passato, all’ASCO 2018 di Chicago una intera sessione è stata proprio dedicata ai media nella gestione del paziente oncologico. I pazienti ormai si informano o comunicano attraverso il web, c’è un incremento progressivo dell’adesione ai social network, un cambiamento epocale di cui non possiamo non tenere conto. L’ho detto tante volte: social media e media tradizionali oggi fanno parte del sistema di sanità pubblica, perchè ci permettono di governare le conoscenze. Voi mi chiederete: tutto questo che peso ha nel ragionamento che facciamo sull’assistenza al paziente oncologico e sulle cure palliative? Ha un ruolo molto rilevante, perché da una parte abbiamo tutta quella che è la potenzialità dell’informazione che diamo ai malati, comunicazione e condivisione di progetti, dall’altra parte abbiamo tutto quello che può avvenire in negativo, la disinformazione, le fake news, l’isolamento e l’autogestione.
Si sta sviluppando un nuovo modello di Oncologia, che non è basata sull’oncologo medico che sta in ambulatorio con l’ago in mano ad aspettare il paziente, ma è un’Oncologia che si basa su di una presa in carico globale del paziente oncologico in tutte le fasi. Non è un passaggio facile, ma è un passaggio che a mio avviso fa parte del genoma dell’Oncologia italiana. Si sta sempre più diffondendo un approccio multidisciplinare, quindi competenze diverse e integrazione delle competenze: anche questo culturalmente è un messaggio forte, c’è sempre più la necessità di sviluppo delle reti oncologiche regionali per garantire qualità, accesso ed equità.
Ma quello su cui dovremmo lavorare tutti quanti insieme è la creazione di punti di interconnessione tra reti oncologiche regionali, rete delle cure primarie e rete delle cure palliative, per un supporto dei nostri pazienti che va sempre più spostato al di fuori dell’ospedale, nel territorio.
Trattasi di mera trascrizione dall’intervento orale del relatore.
Figura 5. Potential to integrate big data to improve precision oncology
Genetics
Germline
Somatic
Epigenetic
Clinical
Demographics
Pathology
Stage
Family History
Labs/Imaging
Treatments
Steps
Sleep patterns
Heart Rate
Blood Pressure
Biophysical sensors
Precision Cancer Care
Social Media
Beliefs
Attitudes
Social norms
Sentiment
Engagement
Risk factors
Community
Saverio Cinieri
Direttore UOC Oncologia Medica
Responsabile Breast Unit
Presidio Ospedaliero di Summa-Perrino, Brindisi
I nostri pazienti sono tanti, aumentano ogni anno, ma riusciamo a cronicizzarne molti. Proprio per questo l’impatto che abbiamo noi oncologi medici sulla società – e che i pazienti hanno su di noi – aumenta sempre di più. Dobbiamo gestire i nostri pazienti in aspetti completamente diversi di quello che facevamo fino a pochi anni fa. C’è un passaggio dalla cronicizzazione alla morte che il paziente vuole che venga gestito non solo dall’oncologo medico, certo, ma anche dall’oncologo medico, per evitare il cosidetto abbandono e su questo noi come Associazione Italiana di Oncologia Medica (AIOM) abbiamo lavorato. Abbiamo lavorato come? Per esempio stilando linee-
Figura 6.
HuCARE: i 6 interventi EBM
guida dedicate non solo a patologie d’organo ma anche a problemi specifici che i nostri pazienti si trovano ad affrontare in tutte le fasi del loro trattamento.
Ma dobbiamo fare di più e altro, perché ci sono i cosiddetti sopravvissuti, che – come è emerso da un’indagine che ho realizzato in prima persona sulla mia pagina web – non sanno come definirsi. Qualcuno si è definito “araba fenice”, sono i pazienti guariti che hanno delle tossicità e delle emozioni e anche dei bisogni medici che noi fino a qualche anno fa non trattavamo. Poi è stato implementato il progetto HuCare (Humanization of CAncer caRE), partito durante la Presidenza AIOM di Carmine Pinto, che continua in 15 centri di tutta Italia e prevede una forte attività fatta anche di interplay tra tutto lo staff sanitario e i pazienti in termini di comprensione dei bisogni. L’altro punto fondamentale dell’attività di AIOM su questo fronte è l’implementazione di centri designati per l’Oncologia integrata e le cure palliative, centri accreditati ESMO.
Raccomandazione Descrizione
Raccomandazione 1:
Formazione staff clinico
Raccomandazione 2: Lista di domande
Raccomandazione 3: Infermiere di riferimento
Raccomandazione 4: Screening psicologico
Raccomandazione 5:
Gestire i problemi sociali
Raccomandazione 6: PIS
Tutto lo staff clinico deve partecipare ad un corso di almeno 3 giorni, al fine di migliorare le capacità comunicative-relazionali e di poter mettere in atto interventi psicosociali
La Question Prompt List (QPL), è una lista di domande che il paziente può porre all’oncologo. Tale lista deve essere fornita ai pazienti durante la prima visita ed incoraggiato il suo utilizzo
Un infermiere di riferimento altamente qualificato (Specialist Nurse) deve essere assegnato ad ogni paziente fin dal primo ciclo di terapia
Lo screening del distress psicologico deve essere effettuato a tutti i pazienti fin dalle prime visite, utilizzando uno strumento validato che aiuti ad individuare coloro hanno bisogno di presa in carico da parte dello psicologo
Occorre rilevare i principali bisogni sociali connessi allo stato di salute attraverso l’utilizzo di uno strumento validato che consenta, fin dalle prime visite, di individuare i pazienti che necessitano di interventi a supporto
A tutti i nuovi pazienti prima dell’inizio del trattamento deve essere garantito l’accesso ad un Punto Informativo e di Supporto (PIS) dove ricevere dal personale infermieristico le informazioni sanitarie
AIOM condivide un approccio di cure simultanee, di integrazione tra le terapie oncologiche attive e le cure palliative dal momento della presa in carico del malato oncologico. Ma quindi le cure devono essere precoci o simultanee? In pratica si parte dalla presa in cura del paziente subito e quali sono i due scenari possibili? Con le cure simultanee valutazione condivisa tra oncologo e team di cure palliative; con le cure precoci l’oncologo invia il malato al team di cure palliative. Sono due modelli altrettanto validi, ma dobbiamo tenere presente che come Società scientifica noi gestiamo anche i rapporti con le piccole Oncologie della periferia del Paese, che non sempre hanno all’interno dell’ospedale un team di cure palliative, e pertanto sia le simultanee sia le palliative precoci possono essere tarate con la situazione in cui ognuno di noi poi va a lavorare. Non c’è soltanto un vantaggio per il paziente: c’è una crescita culturale reciproca fra noi oncologi e i palliativisti, ma c’è anche una crescita culturale etica, umana, fra di noi e i nostri pazienti. Questo si può fare bene in
7. Due possibili scenari







grossi centri di cura, non ovunque, ma ovunque si può cominciare a ragionare. Usando cosa? Per esempio usando il web, sfruttando i mezzi dei social network, sono molti ormai gli studi che dimostrano che in questo modo è possibile migliorare l’outcome di sopravvivenza dei pazienti. Abbiamo delle piattaforme a disposizione che possiamo usare. Sono molto più semplici di quanto ci immaginiamo, usiamole.
Che facciamo però domani mattina o lunedì nei nostri ambulatori affollati? La tutela della salute è un prodotto, l’assistenza sanitaria è un servizio, il malato un utente, l’ospedale un’azienda: lo Stato definisce, eroga, paga e controlla le prestazioni. Ormai siamo immersi in questo tipo di realtà, ma è corretto definire la salute come un prodotto o servizio e la persona malata come cliente o utente? Noi vorremmo essere utenti o clienti quando ci ammaleremo – perchè ci ammaleremo tutti, prima o poi? La comunicazione in Oncologia non è un’inutile complicazione dell’attività assistenziale ma diventa















una necessità clinica perché aumenta la fiducia del medico e la competenza nel discutere argomenti difficili, migliora il rapporto nel lavoro d’equipe, riduce la probabilità purtroppo reale che il paziente riceva chemioterapia o accertamenti inutili e costosi alla fine della vita. Le abilità comunicative sono diverse tra ognuno di noi, sono innate ma ci si può addestrare, magari parlando davanti allo specchio o pensando a come ci piacerebbe che ci venisse data quel tipo di informazione se noi fossimo dall’altra parte della scrivania.
La comunicazione in Oncologia spesso è ostacolata dai nostri comportamenti e convincimenti: nascondere la verità significa proteggere il paziente, i pazienti non vogliono davvero sapere la verità, i pazienti anziani sono fragili ed è meglio parlare prima con i familiari, un medico che non può più offrire terapie curative non ha niente da offrire, i medici devono sempre dire qualcosa, le emozioni sono in potenza ansia, tristezza, colpa, frustrazione, rabbia, vergogna. Bene, tutto questo è sbagliato. I pazienti italiani vogliono maggiore informazione, i medici italiani vogliono darla ma sono bloccati dalle richieste dei familiari di proteggere i pazienti, dalla mancanza di abilità nel fornire notizie difficili sulla prognosi e nella convinzione – errata, abbiamo detto – che comunicare una prognosi infausta sarà nocivo per il paziente. Non è quasi mai così. La sfida è molto importante, occorre preparare il colloquio, capire quanto sa il paziente, ricevere dal paziente l’invito a essere informato, dare l’informazione, essere empatici (o almeno provarci), esplorare le emozioni, pianificare e riassumere: sembra un processo molto complesso, ma poi diventa quasi istintivo quando viene affrontato più volte.
Roberto De Giorgio
Professore di Medicina Interna Dipartimento di Scienze Mediche,
Università di Ferrara
Da una parte abbiamo il dolore. Dall’altra invece abbiamo la disfunzione del tratto gastrointestinale, globalmente considerato, che viene indotta dalla terapia con oppioidi. In mezzo abbiamo un dato incontrovertibile: il trattamento con oppioidi sta aumentando in maniera vertiginosa, sia in Europa sia in Italia. Vengo da un recente congresso negli Stati Uniti dove addirittura sta emergendo l’impiego degli oppioidi nel trattamento del dolore in corso di malattia infiammatoria intestinale.
Trattasi di mera trascrizione dall’intervento orale del relatore.
Ma il problema qual è? Il problema è che purtroppo usando gli oppioidi aumenta il rischio di stipsi. Quando aumentiamo il problema della stipsi aumentiamo quindi anche la necessità di usare lassativi, ma se aumentiamo il dosaggio dei lassativi pensiamo di aver risolto tutto? No, perché il 50% dei pazienti, ben uno su due, non risponde alla terapia con i lassativi convenzionali, un problema importante che peraltro si applica anche a tutte le macro-aree della stipsi in generale. E non è soltanto un problema di stipsi, è un problema dell’intero apparato digerente: gli oppioidi ne alterano la fisiologia e, diciamo, la funzionalità. Di che cosa sto parlando? Sto parlando, per esempio, del fatto che oltre il 50% dei pazienti accusa gonfiore, che è una delle problematiche più complesse e più importanti; abbiamo la perdita di appetito; la flatulenza; abbiamo la necessità di dover attuare uno sforzo per ottenere la defecazione e così via, fino ad arrivare al reflusso gastroesofageo. Tutto questo in aggiunta a quello che è il problema di per sé, la
stipsi, che colpisce fino al 75% dei pazienti in trattamento con oppioidi.
Da dove parte questa situazione? Beh qui dobbiamo tornare un po’ indietro, alla fisiologia e all’anatomia dell’apparato gastroenterico. Ci sono, prima di tutto, due osservazioni da fare: la prima è che abbiamo una distribuzione pressoché ubiquitaria di questi vari tipi di recettori a livello appunto del sistema nervoso centrale, del sistema nervoso periferico, del sistema nervoso autonomo compreso, ovviamente, anche il sistema nervoso enterico che è l’ensemble prodigioso di neuroni che sono presenti all’interno della parete dell’intestino. Cosa succede a questi recettori? In particolar modo i recettori MIU o MOR (a seconda delle varie definizioni, dal punto di vista più strettamente farmacologico o funzionale) – presenti a livello della superficie della membrana citoplasmatica del neurone – tendono, una volta che interagiscono con il ligando, quindi con l’agonista, a internalizzare. E vanno incontro a tutta una serie di eventi che porta alla funzione e quindi alla trasduzione del segnale che essi stessi appunto codificano. Tutti i recettori che prima erano sulla superficie del plasmalemma, quindi della membrana citoplasmatica neuronale, si portano all’interno, si portano nel citoplasma. E questo avviene non soltanto nei cosiddetti neuroni eccitatori ma anche in quelli inibitori, che sono altrettanto importanti nel sistema nervoso enterico per coordinare appunto il riflesso cosiddetto della peristalsi. E quindi qual è il risultato finale? In termini strettamente motori questo meccanismo si traduce in un’inibizione, porta a un’attività intestinale a dir poco erratica, assolutamente scoordinata.
Ma non è soltanto un problema squisitamente motorio, è anche un problema di tipo sfinteriale. Gli oppioidi aumentano il tono dello sfintere anale in-
terno, determinando quindi un’azione peggiorativa, perché accanto a un meccanismo di transito alterato abbiamo anche difficoltà nell’espulsione delle feci. E non basta, c’è anche un altro fattore molto importante: gli oppioidi agiscono anche inibendo la secrezione, perché bloccano anche i neuroni preposti ai meccanismi secretori dell’apparato digerente. Le feci diventano più dure, più difficilmente movimentabili e quindi, chiaramente, evacuabili. Ecco quindi che cosa otteniamo: otteniamo quello che i radiologi definiscono una coprostasi. Dalla stasi deriva l’overgrowth batterico, dall’overgrowth batterico deriva la bacterial translocation, e alla fine abbiamo la sepsi. Quanti pazienti vediamo con infezioni da Escherichia coli a livello del sistema urinario?
Quanti ne vediamo con sepsi vere e proprie da Escherichia coli ? E da dove viene quell’Escherichia coli se non da questi fenomeni? E poi abbiamo ancora l’ostruzione o la sub-ostruzione intestinale, fino ad arrivare allo squilibrio elettrolitico e quindi ovviamente a danni di tipo cardiologico o nefrologico di vario ordine e grado. Per non parlare poi della potenzialità di arrivare anche alla perforazione. Questo è l’effetto conseguente all’utilizzo degli oppioidi, ecco il complesso insieme di fenomeni che noi definiamo stipsi da oppioidi ovvero OIC, opioidinduced constipation.
Ecco perché è importante, molto importante, gestire questi pazienti anche da un punto di vista gastroenterologico. È innanzitutto essenziale sapere che cosa evacua il paziente perché questo si correla con due dati oggettivi, scientificamente inappuntabili, che sono il tempo di transito colico e il tempo di transito globale di tutto quanto il tratto gastrointestinale. Può essere di grande utilità il cosiddetto Bowel Function Index (BFI), una scala con tre item molto semplici che sono la facilità con cui avviene la defecazione, il senso di incompletezza dell’atto eva-
cuativo e infine lo stato di benessere al termine della funzione evacuativa. Questi item vengono valutati con uno score da 0 a 100: più elevato è il punteggio maggiore è la severità della stipsi, in questo caso della stipsi da oppioidi. È un metodo direi abbastanza intuitivo, semplice, che ci permette di chiarire bene con cosa abbiamo a che fare, soprattutto quanto è importante la stipsi del paziente che assume oppioidi.
Veniamo al trattamento. Abbiamo diverse opzioni da un punto di vista terapeutico, cosa facciamo a questi pazienti? Possiamo chiaramente proporre una terapia con i lassativi. Abbiamo la possibilità di poter utilizzare i procinetici, poi abbiamo la disponibilità di prosecretori, meno conosciuti in Italia e quindi meno utilizzati soprattutto nella OIC. E infine, abbiamo la terapia target con la classe di farmaci Peripherally Acting Mu-Opioid Receptor Antagonist (PAMORA), che sono antagonizzanti soltanto in periferie dei recettori MOR o MIU, che dir si voglia. La terapia comportamentale nel caso di pazienti con OIC non è una grande soluzione, sopratutto per quanto riguarda l’incremento delle fibre. Anzi, per la precisione è del tutto inutile aumentare le fibre in questi pazienti. La OIC è una stipsi soprattutto dominata da un alterato transito a cui si associa un aumento del tono sfinteriale, quindi le fibre non fanno altro che aumentare la fermentazione endoluminale peggiorando il gonfiore.
Cosa possiamo dire della terapia lassativa? Fondamentalmente abbiamo gli stool softeners (che sono gli emolienti fecali, per esempio l’olio di paraffina), abbiamo i lassativi osmotici come il lattulosio o il glicole polietilenico (PEG) o abbiamo gli stimolanti, come senna e bisacodile. Per carità, tutte quante sono opzioni più che lecite, però attenzione: per tutte le forme di stipsi compresa anche quella da
oppioidi la raccomandazione è per l’utilizzo di lassativi osmotici, in particolare il PEG – con sali o senza sali – si dimostra essere particolarmente efficace. Questi prodotti però non rappresentano una panacea: sono dei prodotti sicuri, stimolano la motilità, sono efficaci nelle varie forme di stipsi, possono essere applicati a vari tipi di pazienti (compresi appunto quelli con OIC) e di solito sono ben tollerati. Purtroppo però, come succede con tutti gli altri lassativi, PEG o non PEG, uno su due pazienti torna indietro dal medico e gli dice: “Caro amico, non sono soddisfatto della terapia che mi hai dato”. E questo vale anche e soprattutto per il paziente con OIC. Attenzione a questo aspetto importante: non risolviamo tutti i problemi con l’olio di paraffina o con il PEG o con il macrogol che dir si voglia o con altri lassativi. Non solo, tanto più sono irritanti, tanto più possiamo indurre effetti indesiderati, tipo per esempio il peggioramento del dolore addominale.
Nella mia pratica clinica quotidiana utilizzo molto i procinetici nel trattamento della stipsi, anche nei pazienti con OIC. Uno dei prodotti più interessanti è una vecchia molecola, la piridostigmina. Si può dire che questo prodotto può avere delle potenziali limitazioni, certo, ma ben due trial – uno della Mayo Clinic su pazienti con stipsi in associazione a una neuropatia autonomica – hanno dimostrato chiaramente che questo prodotto ha un margine importante di applicazione e di efficacia. L’ultimo nato tra i procinetici è invece la prucalopride. È un agonista dei recettori 5-HT4 della serotonina: abbiamo circa il 95% di serotonina nel nostro tratto gastrointestinale, soltanto il 5% a livello del sistema nervso centrale. Cosa fa questo agonista dei recettori 5-HT4? Produce un effetto importante, ma l’efficacia è ristretta alla prima settimana, probabilmente è un fenomeno di adattamento e quindi di ridot-
ta stimolazione del recettore che tende probabilmente a internalizzare o comunque a desensibilizzarsi. Può dare degli effetti indesiderati soprattutto per quanto riguarda il dolore addominale, può determinare anche emicrania, può peggiorare anche il dolore. Al contrario della cisapride – che aveva anche delle interazioni pericolose a livello cardiaco – però è un farmaco almeno da quel punto di vista totalmente “safe”. Per quanto riguarda la pro-secrezione possiamo stimolare l’evacuazione attraverso l’aumento della quantità di fluidi nelle feci. Questo è possibile attraverso dei prodotti che interagiscono con i canali del cloro, che veicolano le secrezioni di cloro, che nel lume intestinale porta con sé l’acqua e questo fenomeno porta naturalmente idratazione delle feci. Quindi un meccanismo attivo. Di prodotti che esaltano questo fenomeno ce ne sono due: uno si chiama linaclotide, l’altro si chiama lubiprostone. La linaclotide è un prodotto disponibile in Italia, ma non è stato mai testato per l’OIC. Il lubiprostone non è disponibile in Italia ma in letteratura esistono trial convincenti sulla stimolazione della spontaneous bowel movement (SBM): è una molecola molto simile alle vecchie prostaglandine, può determinare nausea e può determinare anche – come effetto indesiderato – l’opposto della stipsi, cioè la diarrea.
Entriamo nel settore delle targeted therapy, il trattamento con PAMORA. Possiamo dire fondamentalmente che sono delle molecole che spiazzano in periferia l’agonista che agisce attraverso i recettori MIU o MOR, e questo chiaramente riduce l’impatto dell’effetto degli oppioidi sul tratto gastrointestinale, senza interferire col sistema nervoso centrale. Questo è l’obiettivo dei veri targeted therapy, dei veri PAMORA. Ce ne sono altre di molecole che possono determinare questo effetto, ma non sono
veri PAMORA, perché possono superare la barriera emato-encefalica potenzialmente riducendo l’azione anti-pain di questi prodotti. Ricorderete il metilnatrexone, non più così tanto utilizzato nell’ambiente italiano, l’alvinopan che non è mai entrato, certamente conosciamo il naloxone, e infine il naloxegol. Una grande meta-analisi7 del gruppo di Alexander Ford ha preso in cosiderazione ben 23 trial con i PAMORA, soltanto due con lubiprostone e uno solo con la prucalopride. Quindi in totale 26 studi, che vanno a porre la nostra attenzione sull’impiego dei PAMORA. Che cosa si può notare? Naloxegol mostra una funzione molto importante nell’aumentare la motilità a livello del colon discendente, nell’aumentare la motilità a livello del tratto rettosimoideo – questo in maniera significativa mentre il precedente era soltanto un trend – e poi significativamente tutta la motilità del colon e dell’intero tratto gastrointestinale viene a essere accelerata, questo chiaramente nel paziente che assume oppioide e che contemporaneamente assume il naloxegol. Quindi un farmaco piuttosto importante dal punto di vista generale, fisiologicamente e farmacologicamente.
Poi ci sono i due studi KODIAC su pazienti non oncologici ma comunque con OIC. Nel KODIAC-04 8 buona efficacia sia del dosaggio a 12.5 mg sia di quello a 25 mg, nel KODIAC-05 soltanto del dosaggio a 25 mg vs placebo. Abbiamo in corso, in questo momento, uno studio per cercare proprio di capire da dove venga questa eterogeneità, cos’è che succede a livello di internalizzazione del recettore. Qual è dunque l’approccio terapeutico da utilizzare? Si può iniziare – anche per venire incontro al legislatore e alla famosa Nota 90, almeno per quanto riguarda la parte oncologica – con una prima linea di farmaco lassativo, ma numerose pubblicazioni di-
mostrano che uno su due pazienti non risponderà. Possiamo utilizzare i pro-cinetici e infine arrivare alla targeted therapy, che potrebbe anche occupare un ruolo essenziale prima ancora di altre terapie, se mai potessero cambiare le regole e permetterci di far sì che i nostri pazienti possano stare un po’ meglio, soprattutto per quanto riguarda l’Opioid-Induced Constipation.
Trattasi di mera trascrizione dall’intervento orale del relatore.
7. Ford AC, Brenner DR, Schoenfeld P. Sa1150 Efficacy of Pharmacological Therapies for the Treatment of OpioidInduced Constipation: Systematic Review and Meta-Analysis. The American journal of gastroenterology 2013;108 10.1038/ ajg.2013.169.
8. Chey WD, Webster L, Sostek M, Lappalainen J, Barker PN, Tack J. Naloxegol for opioid-induced constipation in patients with noncancer pain. N Engl J Med 2014;370(25):2387-96 doi: 10.1056/NEJMoa1310246.
Vincenzo Montesarchio Direttore UOC Oncologia
AORN dei Colli, Napoli
Nella vita di tutti noi medici capitano degli episodi che poi restano fissati nella memoria. Più di 30 anni fa, forse 40, mi occupavo di AIDS. Avevo in cura una giovane paziente con un linfoma di Hodgkin, all’epoca si utilizzava ancora molto lo schema ABVD e anche il MOBB, entrambi comprendevano la vincristina. Questa paziente fece il ciclo di chemioterapia, dopo uno o due giorni cominciò ad avere dolori addominali, l’addome le si gonfiò, lei non parlava italiano, non aveva familiari, viveva da persone che la ospitavano che spaventate la portarono in un Pronto Soccorso. Bene, questa ragazza aveva un ileo paralitico da vincristina e fu sottoposta ad una inutile laparotomia esplorativa che causò anche delle complicanze, un po’ per l’AIDS un po’ perché dopo circa una settimana andò in neutropenia spinta e leucopenia. Eppure sarebbe bastata una fiala di prostigmina – la famosa fiala da 0.5, una mezza fiala sotto cute e poi ripetuta dopo due ore – per risolvere il problema senza procedure invasive.
Il punto di vista dell’oncologo sulla OIC è costituito da tre elementi. Il primo è il paziente, di cui dobbiamo considerare l’età, il performance status, le comorbilità soprattutto gastrointestinali, l’assunzione di altri farmaci (i pazienti per esempio molto più spesso di quanto crediamo assumono benzodiazepine, antidepressivi che in misura notevole peggiorano la stipsi), la storia personale di stipsi, l’aderenza alle terapie ed eventuali autoprescrizioni che in questo campo abbondano. Sulla problematica della stipsi noi oncologi per troppi anni siamo stati
poco attenti, ci bastava chiedere al paziente: “Di corpo va bene?”, ascoltare le risposte e ci accontentavamo. Non è così che va gestita la questione. Il secondo elemento è rappresentato dalle caratteristiche del tumore che stiamo trattando: la sede del tumore primario e il suo stadio, la sede di eventuali metastasi. Questo comporta grandi differenze di trattamento: in questa che è la terza epoca di sviluppo dell’oncologia, dai vecchi farmaci citotossici siamo passati alle target therapies (che hanno tossicità diverse molto spesso non a favore della stitichezza), agli inibitori degli immunocheckpoint (farmaci anche questi che possono dare più spesso diarrea che non stipsi), quindi in questo senso forse anche l’evoluzione dell’oncologia ci dà una mano. Il terzo elemento è l’oncologo, che deve fare autocritica: quante volte noi siamo stati realmente attenti a questo problema? Rispondo io con molta sincerità: mai.
Trattasi di mera trascrizione dall’intervento orale del relatore.
Alessandro Valle Direttore sanitario Fondazione FARO, Torino
Il punto di vista del palliativista, per certi versi, è sovrapponibile a quello dell’oncologo. La costipazione da oppiacei è un problema serio da molti punti di vista, anche perchè vi sono degli studi in cui si evidenzia il fatto che il malato, esasperato dalla stitichezza, riduce e qualche volta sospende l’uso delle terapie per il dolore, ovviamente con conseguenze gravissime. In termini di farmacoeconomia, una stipsi severa non solo rischia di inficiare l’efficacia della terapia antalgica, ma quanto più la stipsi è severa tanto più aumentano i costi anche indiretti dell’assistenza; inoltre, vi è un rischio consistente che i costi indiretti aumentino quando si usano terapie di seconda scelta. Anche a questo occorrerebbe prestare attenzione quando si fa un’analisi farmacoeconomica globale. Se poi abbiamo a che fare con un paziente anziano le cose si complicano ulteriormente, perché il paziente anziano, come sappiamo, può avere una serie di comorbilità, che possono aumentare l’intensità e la frequenza della OIC, in quanto vengono assunte politerapie contenenti farmaci costipanti di per sè, come gli anticolinergici, i calcioantagonisti e così via.
Un lavoro pubblicato9 nel 2015 dalla rivista “Academic Emergency Medicine” dimostra la trascuratezza con cui spesso molti medici affrontano questo problema: nei pazienti over 65 anni dimessi dai Pronto soccorso con terapia con oppiacei maggiori soltanto nell’1% dei casi si ha anche una prescrizione di terapia lassativa. Credo che nessuno di noi
smetterà di usare nella OIC i lassativi cosiddetti tradizionali, ossia osmotici, stimolanti e così via, ma onestamente ne possiamo anche riconoscere tutti i limiti. I PAMORA, anche in termini di number needed to treat, sembrano essere più efficaci rispetto al lubiprostone e alla prucalopride: ormai abbiamo negli studi in letteratura più di 5000 pazienti trattati con buoni risultati, scarsi effetti collaterali (sostanzialmente non tanto diversi dai lassativi tradizionali), ma soprattutto senza inficiare l’efficacia della terapia antalgica che naturalmente in questi pazienti è obbligatoria.
Trattasi di mera trascrizione dall’intervento orale del relatore.
Luigi Cavanna
Direttore Dipartimento Oncologia-Ematologia, Azienda USL di Piacenza
Direttore UOC Oncologia Medica, ASL di Piacenza
Bibliografia
9. Hunold KM, Smith SA, Platts-Mills TF. Constipation prophylaxis is rare for adults prescribed outpatient opioid therapy from US emergency departments. Academic Emergency Medicine 2015;22(9):1118-21 doi: 10.1111/acem.12745
Tra qualche giorno saremo tutti nei nostri ambulatori, avremo una fila di persone che aspettano di essere visitate, persone con dei problemi, conosciamo bene la complessità dei malati oncologici. E quindi se torniamo a casa con qualche cosa di pratico che possiamo mettere in atto da subito, bene, penso che ci aiuti un po’ a superare le nostre frustrazioni. E questo corso mi sembra che ci abbia dato davvero delle informazioni pratiche. Ma in più ci sta facendo riflettere, ci suggerisce delle idee. Non posso non condividere con voi un’osservazione. Io vengo dalla Medicina interna e faccio l’oncologo da un po’ di anni. Credo che noi tutti stiamo vivendo un momento particolarmente fortunato, ci sono cambiamenti enormi in Oncologia dal punto di vista terapeutico e organizzativo e tutto continua a cambiare, tutto è in movimento.
A gennaio del 2017, questo articolo speciale10 dell’ASCO sulle linee guida sull’integrazione delle cure palliative precoci nel malato oncologico spiegava che la maggior parte dei pazienti con tumore avanzato – o comunque quelli con un elevato “tumor burden” – deve entrare in un percorso di cure palliative precoci. Oggi, nel giugno 2018, la professoressa Jennifer Temel – tra gli autori dell’articolo ASCO in questione, ha parlato di “Patient centered early palliative care” e questo è davvero molto interessante perché ci fa capire, come vi dicevo, che le cose sono in movimento. Anche qui cerchiamo di personalizzare, di andare a cercare quei pazienti che han-
La seconda cosa che vi segnalo è una nostra metaanalisi11 pubblicata un mese e mezzo fa, in cui ci chiedevamo: “Ma le cure palliative precoci hanno un effetto, toccano l’esito del paziente?”. Beh, da questa meta-analisi sembra di sì: abbiamo preso in esame venti studi, poi con i criteri di selezione siamo arrivati a 5, che in complesso hanno riguardato circa 650 pazienti e le cure palliative sembrano avere un
Figura 8. Patient centered early palliative care (presentato da Jennifer S. Temel) no veramente bisogno delle cure palliative precoci. In Italia la situazione invece è che facciamo fatica ad aver vicino un’unità di cure palliative che si interfacci con l’oncologia tutti i giorni, per i malati che hanno un tumore metastatico, che sono una buona parte dei malati che vediamo.






effetto – oltre che, come è ben noto, sulla qualità di vita – anche sugli esiti.
Trattasi di mera trascrizione dall’intervento orale del relatore.
10. Ferrell BR, Temel JS, Temin S, Alesi ER et al. Integration of palliative care into standard oncology care: American Society of Clinical Oncology clinical practice Guideline update. Journal of Clinical Oncology 2017; 35(1):96-112.
11. Ambroggi M, Biasini C, Toscani I, Orlandi E, Berte R, Mazzari M, Cavanna L. Can early palliative care with anticancer treatment improve overall survival and patient-related outcomes in advenced lung cancer patients? A review of the literature. Supportive Care in Cancer 2018;26(9):2945-2953. doi: 10.1007/s00520-018-4184-3.



Deborah Schrag Professor of Medicine, Harvard Medical School Chief of Division of Population Sciences – Medical Oncology Dana-Farber Cancer Institute, Boston
Quanto è difficile parlare del fine vita in Oncologia! Ci sono tante teorie al riguardo, ma in fondo siamo americani e Hollywood e le nostre star del cinema a volte ci vengono in aiuto. Due delle star più amate negli Stati Uniti e in tutto il mondo, Jack Nicholson e Morgan Freeman, hanno recitato qualche anno fa in un film intitolato “The Bucket list” (in Italia “Non è mai troppo tardi”): questa espressione nella nostra lingua significa “le cose che devi fare prima di morire”. È un concetto che i pazienti capiscono molto bene, questo. Spesso ci capita di avere a disposizione come oncologi una buona terapia in prima linea, ma quando arriviamo in seconda linea può succedere di avere opzioni scadenti o poche opzioni.
Così, presentiamo al paziente la scelta tra andare a fare una chemioterapia di seconda o terza linea o concentrarsi sulla sua “bucket list”. Una curiosità: fare un viaggio in Italia è spesso una cosa che troviamo in cima alla lista delle “cose che devi fare prima di morire”.
Oggi il focus dell’Oncologia non è il controllo dei sintomi: quando studiavamo ci hanno istillato la paura del tumore che si nasconde dietro, dovevamo temere quello più che i sintomi o gli effetti
avversi! Chiaramente sappiamo che i sintomi sono importanti, ma spesso ci concentriamo su quelli solo se dobbiamo compilare dei moduli, perché la decisione è se continuare a somministrare la chemioterapia o no e concentrarsi sui sintomi è spesso secondario. Ma i pazienti hanno bisogni e domande più elementari, per esempio: “Come mi sentirò durante il trattamento?” e sfortunatamente non abbiamo sempre risposte da dare. Quando c’erano solo venti farmaci oncologici a disposizione, questo era un problema tutto sommato trascurabile. Ma ora abbiamo molti farmaci e questo è un problema più grande. Se i pazienti non sono a conoscenza degli effetti collaterali che li attendono, non possono prendere decisioni valide sul ricevere i trattamenti o meno. Quindi abbiamo pensato che avremmo potuto fare molto meglio nel descrivere gli effetti collaterali. Sono stati implementati i CTCAE (Common Terminology Criteria for Adverse Events): si tratta di una terminologia descrittiva da utilizzare per riferire gli eventi avversi, un lessico standard delle tossicità, un sistema semplice che valuta la severità dei sintomi, aggiornato frequentemente e gestito dal National Cancer Institute su input di Centri diffusi in tutto il mondo. Ogni termine ha una definizione e un grado associato.
La domanda da cui siamo partiti è: i pazienti sono in grado riportare sintomi e tossicità del trattamento? E i medici si fideranno di queste informazioni? Il metodo standard con cui vengono realizzati i bugiardini dei farmaci si basa su informazioni riportate dai clinici. Quando lavoravo al Memorial Sloan Kettering Cancer Center, quasi 15 anni fa, sviluppammo un sistema di monitoraggio basato sul reporting da parte dei pazienti ogni settimana quando venivano in ambulatorio per la chemioterapia. Abbiamo testato il sistema e abbiamo scoperto che funzionava molto bene. Ma all’inizio c’era molto
scetticismo sul fatto che i resoconti dei pazienti fossero affidabili. Di quale rapporto dovremmo fidarci di più? Di quello del paziente o di quello del medico? Abbiamo deciso di provare a rispondere a questa domanda. Abbiamo identificato 400 “coppie” formate da un clinico e da un paziente in chemioterapia e abbiamo sottoposto loro le stesse domande sui sintomi durante la visita, utilizzando i CTCAE. La maggior parte delle volte paziente e medico sono risultati d’accordo sul livello di gravità dei sintomi, ma in generale i pazienti segnalano sintomi più gravi rispetto ai clinici. È chiaro che riportano la tossicità in modo diverso. Abbiamo quindi testato quello che abbiamo chiamato un modello di “reporting collaborativo” nel contesto di un piccolo trial clinico di fase II svolto nel 2015. I partecipanti hanno segnalato le loro tossicità usando un iPad; in metà dei pazienti i rapporti non sono stati condivisi con i clinici, mentre nell’altra metà le relazioni sono state condivise come segue: i pazienti hanno completato i report e subito prima della visita i medici hanno visto i report. Quando i sintomi non sono stati condivisi tra pazienti e medici, si è registrata una convergenza di massima, ma ancora una
Figura 9.
Testing a “Collaborative”
Reporting Model





volta i medici tendono a sottostimare i sintomi. Quando i rapporti sono stati condivisi, si è registrata una convergenza maggiore e i medici hanno mostrato di credere ai report dei loro pazienti.
In realtà c’è ancora un grande divario tra pazienti e medici. Affinché un paziente riferisca un sintomo, deve avere un incontro con il suo medico in una clinica o in un ospedale. E quindi ci sono alcune barriere che devono saltare: tempo limitato con i medici (ed è facile per loro dimenticare di discutere i sintomi), paura da parte dei pazienti di “disturbare” i medici con problemi forse secondari o non importanti, alcuni ritengono addirittura che discutere di sintomi non sia legittimo. Se i pazienti sono a casa, potrebbero non chiamare, potrebbero avere problemi di connessione. Il nostro obiettivo era sviluppare un programma mediante il quale gestire il monitoraggio dei sintomi e avvicinare i pazienti e i medici usando la tecnologia, migliorando davvero il flusso di informazioni e comunicazioni. Volevamo cambiare quello che – almeno negli Stati Uniti – è un approccio non reattivo per trasformarsi in un modello proattivo. Usammo allora questo sistema: i pazienti




















utilizzando il computer e un’interfaccia molto semplice adatta anche ai pazienti anziani riportavano i loro sintomi, che venivano registrati in una piattaforma consultabile da diversi membri dello staff. Quando un paziente mostrava un elevato “burden” di sintomi, degli alert venivano inviati agli infermieri oncologici esperti nel controllo dei sintomi. Loro esaminavano questi rapporti e quindi adottavano le misure appropriate.
Volevamo mettere alla prova questo sistema, quindi circa un decennio fa, nel 2007, abbiamo effettuato un trial clinico mono-centrico arruolando 766 pazienti e seguendoli per un follow up medio di 7
Figura 10.
Standard Approach to Symptom Monitoring
anni (durante il quale il 77% dei pazienti è deceduto). Abbiamo randomizzato i nostri pazienti ad una assistenza standard oppure a riportare – lungo la traiettoria clinica del loro tumore – i loro sintomi durante le visite a personale infermieristico specializzato, che nel 77% dei casi ha fornito un feedback clinico ai pazienti offrendo loro counseling, medicazioni, modifiche dei dosaggi di chemioterapia e prescrizioni di imaging oppure anticipando l’appuntamento con l’oncologo o dirottando il paziente al Pronto Soccorso. Già a 6 mesi di follow up i pazienti nel gruppo di “self reporting” dichiaravano un 31% in più di beneficio sul fronte qualità di vita. Nel gruppo di “self reporting” risultavano significa-




Figura 11. Alternative: Systematic Symptom Monitoring



tivamente meno frequenti gli accessi al Pronto Soccorso e soprattutto – con nostra grande sorpresa – la sopravvivenza media era di 5 mesi più lunga rispetto ai pazienti seguiti con assistenza standard, indipendentemente dal tipo di tumore e dal tipo di paziente. Questo lavoro attirò l’attenzione del National Cancer Institute e li persuase che valesse la pena sviluppare un’appendice per i CTCAE denominata Pro CTCAE, che abbiamo implementato tra 2008 e 2015. I medici tendono a valutare i sintomi in un solo grado. Ma ci siamo resi conto che per i pazienti questo approccio non funzionava, avevamo bisogno di tre dimensioni, ogni sintomo può essere declinato in gravità, fre-
quenza e interferenza con le normali funzioni. Abbiamo testato centinaia e centinaia di pazienti per ciascuno dei 78 sintomi CTCAE fino a quando non abbiamo ottenuto una robusta library. La FDA si è interessata a questo nostro lavoro, cercando di capire se si potesse usare questo sistema per supportare il processo decisionale normativo per l’approvazione dei farmaci e se questo sistema potesse essere integrato con successo in una sperimentazione clinica. La critica che più spesso ci veniva fatta è che gli Stati Uniti sono un grande Paese e non tutti hanno le risorse per monitorare i sintomi con questa procedura.
Figura 12. http:// healthcaredelivery.cancer.gov/pro -ctcae/





Dovevamo trovare un trial e integrare il nostro report
Pro CTCAE12: abbiamo scelto un trial sul carcinoma del retto, il PROSPECT13, perché il carcinoma rettale è un tumore che causa un alto carico di sintomi e vi è una sostanziale tossicità sia nei trattamenti a breve che a lungo termine. I pazienti arruolati nel trial una volta alla settimana ricevevano un’email o una telefonata. Abbiamo chiesto a ogni paziente di elencare fino a 15 sintomi. I risultati sono stati molto significativi: la differenza tra la percezione dei pazienti e quella dei medici è risultata netta, e anche tra diverse modalità di report. Utilizzando i CTCAE il profilo degli eventi avversi era diverso in 4 casi su 15, mentre utilizzando i Pro CTCAE, più particolareggiati, era diverso in 11 casi su 15. E il carico dei sintomi è valutato al suo cambiare nel tempo.
A questo punto allora abbiamo fatto un’altra cosa. Cosa fanno veramente i medici con queste informazioni? Quindi abbiamo inserito il reporting direttamente nel disegno dello studio. E così abbiamo scoperto che i medici si fidano del “self reporting” dei pazienti. Da allora il sistema Pro CTCAE è utilizzato in numerosi trial clinici, è stato tradotto in molte lingue ed è disponibile gratuitamente sul sito del NCI all’indirizzo https://healthcaredelivery. cancer.gov/pro-ctcae/resources.html . Ma la vera sfida ora è l’integrazione del sistema Pro CTCAE nell’assistenza oncologica.
La nostra opinione è che la misurazione corretta dei sintomi è solo l’inizio. In realtà ciò che dobbiamo fare è agire sulle informazioni e lavorare per integra-
Neuropathy (8) A
Neuropathy A
Neuropathy B
Neuropathy (8) B
Neuropathy (I) A
Neuropathy (I) B
Diarrhea A
Diarrhea B
Diarrhea (F) A
Diarrhea (F) B
re queste informazioni direttamente nelle cartelle cliniche elettroniche. Abbiamo anche investito intensivamente nell’assistenza alla gestione dei sintomi, con un video tutorial, fogli informativi e coaching in remoto. Credo che una combinazione di queste strategie di segnalazione attive e di tecniche di segnalazione passiva (come i dispositivi indossabili) possano davvero migliorare l’esperienza di cura per un paziente, sia che sia curabile sia che stia ricevendo cure palliative e cure di fine vita.
Trattasi di mera trascrizione dall’intervento orale del relatore.
12. Basch E, Dueck AC, Rogak LJ, Mitchell SA, Minasian LM, Denicoff AM, Wind JK, Schrag D et al. Feasibility of Implementing the Patient-Reported Outcomes Version of the Common Terminology Criteria for Adverse Events in a Multicenter Trial: NCCTG N1048. Journal of Clinical Oncology 2018; DOI: 10.1200/JCO.2018.78.8620.
13. PROSPECT: Chemotherapy Alone or Chemotherapy Plus Radiation Therapy in Treating Patients With Locally Advanced Rectal Cancer Undergoing Surgery. Alliance for Clinical Trials in Oncology 2012.
Nausea A
Nausea B
Vomiting A
B
Nausea (F) A
Nausea (F) B
Nausea (S) A
Nausea (S) B
Vomiting (F) A
Vomiting (F) B
Vomiting (S) A
Vomiting (S) B
Gaetano Lanzetta
Responsabile UOC Oncologia Medica Gruppo INI, Grottaferrata
Il dolore nel paziente oncologico è una problematica sia epidemiologica che clinica. Sempre più dovremo confrontarci con un aumento della prevalenza della patologia: l’introduzione dei nuovi farmaci, e tanto più dell’immunoterapia, porta i nostri pazienti a vivere un tempo sempre più lungo con la patologia tumorale. Questo ci impone
come oncologi di affrontare la problematica dei sintomi nei nostri pazienti, che convivono per periodi lunghi con quadri sintomatologici complessi. E allora mi è venuto in mente di riprendere una vecchia diapositiva sulle traiettorie del decesso14
In passato il paziente con malattia metastatica dopo un periodo di stabilità aveva rapidamente una flessione, una perdita delle funzionalità vitali, fino al decesso. Se analizziamo la traiettoria media di un tumore della mammella oggi, notiamo subito una lunga sopravvivenza e che il grafico assomiglia – pur con alti e bassi e diverse fasi – molto più a quello di una malattia cronico-degenerativa piuttosto che alle vecchie traiettorie del decesso. Nelle diverse fasi di questa lunga traiettoria, quando abbiamo questi picchi di deflessione, ovvero quando la malattia va in progressione, sicuramente interviene un cambiamento sintomatologico che può essere il più delle volte il dolore – tutte le patologie neoplastiche purtroppo durante la fase di avanza-
h
of-life trajectories associated with advanced chronic illnesses
mento portano dolore –, ma anche la dispnea, la fatigue, l’anoressia, tutti sintomi che noi dobbiamo saper affrontare.
Si stima che nella malattia avanzata circa il 75% dei nostri pazienti purtroppo andrà incontro allo sviluppo di dolore, nei due terzi dei casi un dolore severo. Serve maggiore attenzione alla problematica del dolore, ma anche a tutti gli altri sintomi. Ecco perchè si parla di early palliative care: l’importanza della simultaneous care nasce dall’ambulatorio, da quando noi vediamo il nostro paziente per la prima volta. Eppure una review del 2007 dimostra che solamente nel 10% delle cartelle cliniche stilate dagli oncologi è registrato il sintomo dolore. Con la Legge 38 questo non è assolutamente possibile perchè siamo obbligati, medici e infermieri, a riportare quotidianamente il dolore, a valutarlo e a trattarlo. E non esiste soltanto il dolore di base, non dimentichiamolo anche quando prescriviamo i trattamenti, ma anche quello che viene definito un “breathrough cancer pain”, un dolore episodico. E allora dobbiamo pensare nella prescrizione sia un trattamento “around the clock”, cioè che controlla il dolore nelle 24 ore, ma anche qualcosa per le emergenze.
Trattasi di mera trascrizione dall’intervento orale del relatore.
14. Amblàs-Novellas J, Murray SA, Espaulella J, Martori JC, Oller R, Martinez-Muñoz M, Molist N, Blay C, Gómez-Batiste X. Identifying patients with advanced chronic conditions for a progressive palliative care approach: a cross-sectional study of prognostic indicators related to end-of-life trajectories. BMJ Open 2016;6:e012340. doi: 10.1136/ bmjopen-2016-012340.
Vittorio Andrea Guardamagna
Direttore Divisione Cure Palliative e Terapia del Dolore Istituto Europeo di Oncologia (IEO), Milano
Io lavoro in un grosso cancer center a Milano, e mi capita troppo spesso che il paziente riferisca di avere dolore e il chirurgo o l’oncologo dica: “No, non è vero che ha dolore”. E allora c’è qualcosa ancora che non va, c’è tanto da fare, noi palliativisti lo sappiamo bene. Il paziente oncologico di oggi è completamente diverso dal paziente oncologico di dieci anni fa o di venti anni fa. Di questo si rendono conto anche i palliativisti, perché c’è questa grossa fetta di pazienti lungosopravviventi. Però la frase tipica che il paziente arriva a dire in un ambulatorio di cure palliative è: “Dottore, mi creda, avrei preferito addirittura tenere il tumore piuttosto di sapere di avere questo dolore”. Molto spesso il resto dei sintomi viene gestito in tutti gli altri contesti, il sintomo del dolore invece è spesso quello di presentazione al servizio.
Ma a cosa è dovuto il dolore? La gran parte delle sintomatologie dolorose delle malattie tumorali è dovuta a un’invasione diretta, a un effetto massa, una compressione di strutture nervose. Un’altra percentuale, quantificata in letteratura tra il 15 e il 20% delle sintomatologie dolorose, è l’effetto collaterale di alcune terapie, classicamente radioterapie, quindi con sintomi post-attinici cutanei o neuropatie postattiniche importanti. È essenziale credere a quello che ci dice il paziente, perchè sappiamo benissimo quanto sia importante calare il sintomo dolore nell’esperienza personale ed emozionale del paziente. Un dolore poco controllato impatta sulla qualità di vita, sulla qualità del sonno, sulla qualità anche di cura del paziente. Perché oltre a portare a problemi di relazioni sociali e inabilità lavorativa, molto spesso un dolore poco controllato provoca anche un ral-
lentamento dello cure e un impatto importante sulle cure. Ma il paziente spesso riferisce di non essere compreso, di non essere ascoltato dal clinico. Ed è per questo che può essere importante avere uno strumento vero, applicabile nella pratica clinica quotidiana, che dia voce al paziente.
Per controllarlo e per gestirlo, il dolore va misurato bene. Le linee guida AIOM ci sostengono e ci ribadiscono l’importanza della misurazione, delle scale e del monitoraggio; la Legge 38 ci dice che il dolore non va solo misurato ma va monitorato, durante tutta la degenza. Di scale ce ne sono veramente tantissime, tutte validate. È ovvio ma purtroppo non scontato che si debba credere al paziente: quando il paziente riferisce “Dottore, ho dolore 8”, capita spesso che il collega o un infermiere dica “Non è vero che ha dolore 8 perché è lì che legge il giornale, sta guardando la televisione, è molto tranquillo, non può essere 8”. Attenzione però all’idea personale di qualità di vita che ognuno di noi può avere. Per me il dolore è 8 perché addirittura mi impedisce di leggere il giornale, a un altro permette di leggere il giornale ma sicuramente influisce sulla qualità di vita. Non è sufficiente misurare l’intensità del dolore, è necessario analizzare tutti gli aspetti del dolore. È importante, ad esempio, mentre visitiamo un paziente cercare di capire se è presente una componente neuropatica, in questo caso abbiamo a disposizione strumenti di tutti i tipi, questionari molto snelli, che ci permettono di fare una diagnosi anche in presenza di dolore neuropatico.
Trattasi di mera trascrizione dall’intervento orale del relatore.
Gaetano Lanzetta
Responsabile UOC Oncologia Medica Gruppo INI, Grottaferrata
Come dobbiamo e possiamo aiutarci con piccoli accorgimenti quando abbiamo situazioni di kidney failure o liver failure? Quali farmaci possiamo utilizzare? È una problematica chiaramente di tipo farmaco-cinetico, innanzitutto bisogna capire che tipo di entità di problematica renale abbiamo di fronte. Perché? Chiaramente se è una problematica renale di stadio 2, 2/3, possiamo utilizzare più o meno lo stesso dosaggio di oppioidi. Il fentanil di tutti i farmaci che noi abbiamo a disposizione è il farmaco che non avendo metaboliti attivi è più sicuro. È chiaro che il fentanil nei pazienti cachettici, per esempio, è meno utilizzabile perché viene somministrato per via transdermica e la problematica del paziente che ha poco tessuto adiposo può determinare ovviamente poco assorbimento. Farmaci che non dobbiamo utilizzare sono sicuramente ossicodone e codeina, dobbiamo usare con attenzione la morfina, riducendo il dosaggio quando abbiamo una filtrazione glomulare a meno del 10%. Ma sicuramente il farmaco di scelta nella pratica clinica è il fentanil, solo gli anestesisti e qualche clinico esperto possono utilizzare il metadone ma noi oncologi lo utilizziamo meno facilmente, è un farmaco molto difficile da gestire, necessita di uno stretto monitoraggio continuativo sul paziente. Non è pensabile prescrivere una terapia con metadone con un dosaggio già fissato senza titolarlo attentamente e rivedere il paziente dopo due settimane.
La stessa cosa vale per l’insufficienza epatica, perché anche qui ci sono delle situazioni fisio-patologiche che ci devono far porre attenzione, soprattutto edema e ipertensione portale. I farmaci possono portare delle alterazioni del metabolismo epatico, lega-
te fondamentalmente ai citocromi: attenzione alle interazioni con antibiotici, anti-fungini, anti-aritmici, addirittura agli steroidi. C’è un’interazione importante tra steroidi e ossicodone, che molto spesso tendiamo a sottovalutare. E quanti dei nostri pazienti fanno uso di steroidi? Un numero elevatissimo. Quindi attenzione, attenzione davvero alle interazioni. E anche ai non farmaci, perché ci sono dei forti inibitori e induttori del citocromo tra integratori, lassativi, il banale succo di pompelmo. E poi c’è la problematica farmaco genomica dei metabolizzatori lenti (poor metabolyzer) e degli ultra rapid metabolyzer. Differenze tra pazienti che possono portare a volte a delle tossicità inaspettate o a delle non risposte.
Trattasi di mera trascrizione dall’intervento orale del relatore.
Vittorio Andrea Guardamagna
Direttore Divisione Cure Palliative e Terapia del Dolore Istituto Europeo di Oncologia (IEO), Milano
Poor metabolyzer e fast metabolyzer: è un concetto che è alla base di quella nota che ha modificato la scheda tecnica di un farmaco che usiamo quotidianamente, codeina-paracetamolo. La scheda tecnica dice di utilizzarlo tre giorni e dopo valutare il paziente, perché non potendo sapere in partenza se siamo di fronte a un poor metabolyzer o a un fast metabolyzer, non possiamo sapere come reagirà al farmaco: capita il paziente anziano che con dell’innocua codeina-paracetamolo dopo due giorni è completamente soporoso e viceversa il paziente che assume codeina-paracetamolo e dice che è “acqua fresca”. Tre giorni e valutazione, a rimarcare ancora l’importanza del seguire il paziente.
In un paziente con insufficienza epatica poi attenzione a utilizzare l’associazione ossicodone-naloxone, perché anche in questo caso – dato che il naloxone viene metabolizzato a livello epatico – in un quadro di sofferenza epatica potrebbe tranquillamente essere che quel naloxone non venga metabolizzato a livello periferico e provochi inevitabimente un antagonismo a livello centrale, riducendo l’azione analgesica del farmaco. È il motivo per cui molto spesso sentiamo dire: “Quell’associazione non funziona”: in realtà è un farmaco valido ma va calato nel contesto giusto. E in un paziente con polipatologie, multi-farmacoterapie oppure con uno squilibrio o un’insufficienza epatica anche lieve, chiaramente una certa quota di naloxone andrà sicuramente a contrastarci l’effetto analgesico.
Trattasi di mera trascrizione dall’intervento orale del relatore.
Gaetano Lanzetta
Responsabile UOC Oncologia Medica
Gruppo INI, Grottaferrata
Sicuramente un dolore difficile da trattare per l’oncologo è il dolore da metastasi ossea. Capita spesso di vedere pazienti con metastasi ossea che devono, in maniera abbastanza rapida, aumentare il dosaggo degli oppioidi perchè c’è difficoltà nella gestione. Perché avviene questo? Mentre il dolore di base, il “background pain”, è un qualcosa che noi riusciamo a gestire, la problematica dei pazienti con metastasi ossea generalmente sono gli episodi di dolore transitorio. Questa è una caratteristica specifica dei pazienti con metastasi ossee ed è spiegabile semplicemente con il fatto che quando c’è un accrescimento all’interno dell’osso non c’è solamente la problematica della disfunzione ossea, ma c’è sicuramente una componente neuropatica. L’azione stessa degli osteoplasti attiva i recettori presenti sul periostio, alla base del dolore neuropatico. È emerso negli ultimi anni che le cellule tumorali una volta insediate nell’osso producono fattore di crescita delle cellule nervose (NGF), per cui si verifica il fenomeno detto sprouting, cioè la capacità del tumore all’interno dell’osso di generare fibre nervose che vengono direttamente inglobate nell’accrescimento tumorale. Per cui è normale che una componente neuropatica – sia per un discorso di alterazione del periostio, sia proprio perché viene inflitrata la fibra nervosa – ci sia sempre.
Allora, forse, sarebbe opportuno cominciare a parlare più che di dolore di una sindrome, perché c’è sempre un interessamento di tipo infiammatorio, un meccanismo neuropatico e ischemico e l’attivazione della microglia, che poi è alla base un po’ dei fallimenti dei nostri trattamenti. Sappiamo che gli oppioidi vanno ad inibire l’azione di alcuni neurotra-
smettitori, ma quello che è importante è quello che succede quando noi blocchiamo questa azione. Una delle problematiche è il fenomeno della tolleranza. Nell’idea della tolleranza c’è anche un po’ l’idea della sinapsi silente. Ovvero, che succede? Succede che in realtà gli oppioidi “gelano” la cellula, ma i neuroni non sono nati per stare fermi, questo meccanismo dopo un po’ deve essere superato, per cui probabilmente la tolleranza non è altro che una riattivazione del sistema nervoso, e voi immaginatevi che i recettori degli oppioidi sono anche nel sistema immunitario, nel sistema gastroenterico, nel sistema endocrino, per cui necessariamente noi dobbiamo a un certo punto aumentare il dosaggio.
Altro elemento fondamentale è che esistono delle cellule nel sistema nervoso in stato di quiescenza che possono essere di supporto che sono astrociti e microglia, che in situazioni di stress producono una iperattivazione. Tant’è che qualcuno suppone che il dolore cronico non è altro che una gliopatia. Questa si pensa possa essere la base anche del breakthrough cancer pain: una tempesta gliale, una liberazione improvvisa di neurotrasmettitori che porta a quel dolore per cui in uno stato di benessere controllato, di dolore controllato con i farmaci, improvvisamente il paziente avverte il dolore. Sarà quindi necessariamente la combinazione di più farmaci ad aiutarci a controllare nel miglior modo possibile il dolore nel paziente oncologico.
Trattasi di mera trascrizione dall’intervento orale del relatore.
Vittorio Andrea Guardamagna
Direttore Divisione Cure Palliative e Terapia del Dolore Istituto Europeo di Oncologia (IEO), Milano
Le cose si fanno difficili quando arriviamo a un dolore non responsivo. In letteratura si arriva, secondo alcune casistiche, anche al 40% di casi di pazienti con dolore non responsivo. E sono stati studiati anche dei fattori prognostici di dolore poco responsivo: per esempio un dolore che si presenta subito molto intenso già dall’inizio, dalla presentazione; se c’è una componente neuropatica; se abbiamo effetti collaterali con tutti i farmaci fino a ora utilizzati. Altri elementi che deporranno per un dolore difficile saranno la giovane età del paziente, ovviamente una storia di uso o abuso di sostanze stupefacenti, una fase avanzata di malattia e anche la presenza di breakthrough cancer pain. Quindi si parla ormai da anni del quarto gradino della scala analgesica, in cui troviamo due tecniche che possono superare questo empasse che sono la opiod rotation e le tecniche invasive. Della opioid rotation diciamo poco o nulla, se non che di fronte a una scarsa risposta analgesica a un oppiaceo o alla presenza di effetti collaterali, il consiglio è “shiftare” da un oppioide all’altro, secondo scale analgesiche e secondo tabelle di equivalenza che mi piacerebbe raccomandare che un giorno tutti abbiano nel taschino del camice, perché veramente è un’attenzione che dobbiamo al paziente. Quando anche la rotazione degli oppioidi non ci ha dato risposta, siamo di fronte a un paziente con dolore particolarmente intenso, sicuramente il passaggio ad un terapista del dolore potrebbe essere una cosa utile.
Soltanto un accenno alle tecniche invasive, che si differenziano in due grandi categorie: l’azione chimica, che utilizza la somministrazione di farmaci in vari distretti, oppure quella elettrica, che ovviamente utilizza la liberazione di elettricità a interferire con
Figura 16.
1986: scala OMS del dolore
Pain
PAIN RELIEF
Opioids for Severe pain
± Non-Opioids ± Adjuvants
Persistent or worsening pain
Opioids for Mild pain ± Non-Opioids ± Adjuvants
Persistent or worsening pain
Non-Opioids (NsAIDS) ± Adjuvants
WHO, Geneve 1986-1996
2
1
www.who.int/cancer/palliative/painladder/en/index.html
Figura 17.
Aggiornamento scala OMS del dolore
Pain
RELIEF
3
Opioids for Severe pain
± Non-Opioids ± Adjuvants Opioid rotation invasive techniques
Persistent or worsening pain
Opioids for Mild pain ± Non-Opioids ± Adjuvants
Persistent or worsening pain
Non-Opioids (NsAIDS) ± Adjuvants
WHO, Geneve 1986-1996
3 4 2 1
Tecniche mini-invasive
Tecniche mini-invasive
Tecniche mini-invasive
Cannabinoidi?
www.who.int/cancer/palliative/painladder/en/index.html
Study group of Italian Society of Anaesthesiology, 2002
lo stimolo doloroso. Tra i mezzi chimici molti di voi conoscono la mesoterapia antalgica, iniezioni di anestetico o di steroide nel mesoderma, quindi sottocutanee, che per esempio in una forma di dolore neuropatico localizzato possono trovare una rispo -
sta eccezionale: si tratta di una terapia che può essere fatta in regime ambulatoriale, con molta semplicità. Oppure, andando un pochettino più in profondità, le iniezioni di anestetico e cortisonico nello spazio miofasciale para-vertebrale. Oppure tecniche più centrali: il blocco epidurale – che dagli anestesisti e dai terapisti del dolore viene fatto ambulatorialmente in modo molto veloce e molto semplice –può essere veramente di grandissimo aiuto anche in sintomatologie neuropatiche complesse del distretto pelvico (pensate a tutto il dolore neuropatico del piano perineale, negli esiti del tumore del retto oppure nei tumori ginecologici). Possiamo anche arrivare a tecniche più complesse che prevedono, ad esempio, l’impianto di sistemi che introducono oppiodi nello spazio spinale.
Per quanto riguarda le vie elettriche, sono infinite. La scrambler therapy è una terapia dibattuta, una terapia un po’ empirica, ma in realtà un razionale c’è, anche in letteratura è stata dimostrata un’utilità in sindromi neuropatiche localizzate. Un’altra terapia interessantissima di fatto consiste, in anestesia locale, nel posizionare un ago sottocutaneo in un territorio di dolore neuropatico localizzato. Oppure tecniche ancor più mirate, come la radiofrequenza o la crioanalgesia, che anche nel dolore oncologico cronico possono dare un grandissimo beneficio. Vi ricordo che la neurostimolazione midollare, la spinal chord stimulation, è nata sul paziente oncologico: i primi due pazienti impiantati sono stati un mesotelioma pleurico e un tumore ginecologico. Ci sono poi tecniche che vengono effettuate in centri altamente specializzati, centri di terapia del dolore di secondo livello, da mani esperte. La cordotomia percutanea prevede l’interruzione del fascio spinotalamico alla sua insorgenza e in sindromi dolorose particolarmente severe può sicuramente dare dei grossi benefici. Oppure il blocco del plesso celiaco,
o l’infissione di un ago per un blocco fenolico del nervo, del plesso, passando attraverso l’aorta, tecnica affascinante.
Sul breakthorugh pain si è disquisito per anni: esiste non esiste? Ancora oggi capita di sentire nelle discussioni tra colleghi cose come: “Per me il breakthrough pain non esiste, è un’invenzione commerciale, semplicemente se io controllo bene il dolore di base non avrò mai il breakthrough pain”. Invece no, esiste. Ormai come sapete è un’entità nosologica ben definita, è una componente del dolore oncologico presente ben oltre il 50% nelle casistiche, di fatto consiste in picchi improvvisi di dolore su un dolore di base ben controllato. Quello che ha fatto la differenza è stato – dopo un lungo lavoro della comunità scientifica – accettare come brekthrough pain anche tutti quei dolori improvvisi che scappano alla terapia di base, ma che sono prevedibili. Quindi anche il dolore da procedure o un dolore incidente da metastasi ossea sono considerati breakthrough pain.
Volevo fare un’ultima provocazione su un tema che non solo in Italia ma in tutta Europa “spacca”, la titolazione. La scheda tecnica dei ROO, quindi dei fentanil sublinguali, dice che la titolazione va sempre fatta, essendo una scheda tecnica ha delle implicazioni anche di tipo medico-legale. Io consiglio di fare sempre questo percorso. Titolare vuol dire: iniziate un trattamento con un ROO dal dosaggio più basso, cioè 100 µg per via sublinguale o per via nasale. Il paziente non risponde? Al trattamento successivo utilizzerò 200 µg, e così via. Se siete super esperti del trattamento del dolore cronico oncologico provate la via proporzionale, altrimenti consiglio sempre di seguire la titolazione.
Trattasi di mera trascrizione dall’intervento orale del relatore.
Paolo Bossi
SC Oncologia Medica 3 - Tumori testa-collo
Fondazione IRCCS Istituto Tumori Milano
Se riesco ad avere un migliore controllo della CINV (Chemotherapy Induced Nausea and Vomiting) potrò erogare una dose più elevata di farmaci e quindi potenzialmente curare meglio il mio paziente, migliorare la qualità di vita, diminuire gli accessi ospedalieri, ridurre l’impatto economico sulle cure e ridurre le complicanze (disidratazione, alterazioni elettrolitiche, polmoniti da episodi emetici). Già più di dieci anni fa il gruppo di Enzo Ballatori e Fausto
Figura 18. Linee-guida
MASCC/ESMO 2016



Roila in un lavoro15 apparso su “Supportive Care in Cancer” sottolineava quanto l’impatto della CINV fosse uno degli aspetti di più alta considerazione nel paziente oncologico, evidenziando quanto l’impatto sia della CINV acuta sia della tardiva fosse presente nella vita quotidiana dei pazienti. La cosa che più mi ha colpito di questo lavoro è il fatto che sì, la nausea e il vomito impattavano parecchio sulle attività più piacevoli del paziente quindi sulla sua capacità di svago, sulla sua socialità, sulla possibilità di vedere amici e parenti, sulla sua funzionalità di tutti i giorni. Stiamo valutando un sintomo che non è soltanto limitato a una sfera gastroinstestinale e alimentare, ma che impatta molto sulla funzionalità completa del paziente.
Le linee guida MASCC/ESMO sulla prevenzione di nausea e vomito indotti da chemioterapia e radioterapia escono16 nel 2016 – prima firma Fausto Roila – sugli “Annals of Oncology”. Prima di tutto dobbiamo riconoscere che per capire quanto un farmaco






Figura 19.
Gruppi di potere emetogeno
Committee I {1/5}: The Four Emetic Risk Groups
HIGH Risk in nearly ali patients (> 90%)
MODERATE Risk in 30% to 90% of patients
LOW Risk in 10% to 30% of patients
MINIMAL Fewer than 10% at risk
oncologico sia emetogeno dobbiamo valorizzare diversi fattori: il tipo di farmaco che utilizziamo, ovviamente, il suo dosaggio, la schedule con cui utilizziamo il farmaco e l’eventuale associazione con altri farmaci. Da linee guida la emetogenicità del farmaco è legata – ove ci siano associazioni con più farmaci – al farmaco con più alto potere emetogeno, quindi se io associo un cisplatino ad una gemcitabina è chiaro che devo considerare il potere emetogeno del cisplatino più che quello della gemcitabina. Su questo non c’è ancora chiarezza, però è verosimile che l’associazione di due farmaci – sebbene a potere emetogeno diverso – sia comunque a maggiore impatto su nausea e vomito rispetto al singolo farmaco, pur se di potere emetogeno più elevato.
Le linee guida introducono una suddivisione in quattro gruppi di potere emetogeno rispettivamente alto, moderato, basso o minimo. Quello che è più interessante è che tendiamo, faccio io per primo un grosso mea culpa, a sottoconsiderare i farmaci per via orale, siano essi chemioterapici o target therapies. Per esempio conosciamo il potere emetogeno di crizotinib, lo vediamo tutti nel paziente che arriva in ambulatorio con nausea e vomito sotto crizotinib: la problematica di questi farmaci è che non dob -
biamo gestire una somministrazione di chemioterapia singola endovena, si tratta di un farmaco che il paziente prende tutti i santi giorni e perciò deve in qualche modo gestire questa sua problematica. Di nuovo le linee guida ci aiutano, perché schematizzano molto bene la profilassi di nausea e vomito in acuto a seconda del rischio di emetogenicità. Per i pazienti ad alto rischio, in trattamento con antracicline/ciclofosfamide o no, la prevenzione è ottenuta con farmaci 5-HT 3 antagonisti, desametasone e NK1 antagonisti. Quindi in caso di alto rischio emetogeno la profilassi viene fatta a tre farmaci. Nei casi di moderato potere emetogeno, profilassi a due farmaci. Quando utilizzo un farmaco a basso potere emetogeno posso scegliere in profilassi uno di questi tre principi. Per i farmaci a minimo potere emetogeno non c’è invece nessuna profilassi di routine. Cosa fare invece per prevenire nausea e vomito tardivi, quindi dal giorno 2 al giorno 5? Anche qui a seconda del tipo di rischio le linee guida ci forniscono le indicazioni.
Poi ci sono tutta una serie di trattamenti alternativi o complementari, quelli che spesso vengono citati dai nostri pazienti ancora prima che inizi il trattamento o dopo durante le varie visite: qui è necessario distinguere quello che realmente può essere utile dalle baggianate. Esistono una serie di tecniche diversionali, per esempio: lo yoga, la musicoterapia, l’immagine visiva, la psicoterapia. Su questo ci sono alcuni lavori anche di valore interessante, il problema è che non hanno un’altissima forza basata sull’evidenza, quindi il messaggio può essere: va bene la complementarità delle terapie diversionali, l’importante è che non sia alternatività.
Nel trattamento non farmacologico una delle prime cose che dovremmo considerare è l’esercizio fisico.
Nel 2015 è stato pubblicato17 dal “Journal of Clinical Oncology” un lavoro molto interessante in cui alcu-
ne donne in chemioterapia adiuvante per un tumore alla mammella venivano randomizzate in tre gruppi: un gruppo con i soliti consigli che il medico dà, un gruppo con una serie di consigli per un’attività fisica a domicilio abbastanza easy, e un gruppo con attività fisica più intensa e anche con un trainer. Lo studio ha dimostrato che le pazienti che facevano esercizio fisico avevano meno astenia, meno fatica e migliore qualità di vita e fin qui era abbastanza scontato. Molto meno scontati gli effetti dell’attività fisica su due sintomi che sembrerebbero non entrarci niente. Le pazienti randomizzate a fare attività fisica avevano meno dolore complessivo e avevano nell’interciclo una minore nausea tardiva, minore nausea anticipatoria e una minore nausea dal quinto al ventesimo giorno. E questo è interessante, abbiamo un’arma a quanto pare così potente da associare al trattamento farmacologico e troppo poco spesso la utilizziamo. Esiste qualche lavoro sull’agopuntura potenzialmente interessante, ma nessuno ha una numerosità sufficiente.
Quanto al ginger, lo zenzero, nei pazienti che fanno chemioterapia ad alto potere emetogeno, abbiamo pubblicato questo studio18 sugli “Annals of Oncology” ma abbiamo preso una grossa “musata”, nel senso che non abbiamo registrato nessun vantaggio nella nausea e nel vomito, anzi addirittura chi prendeva il ginger aveva proprio acidità da reflusso gastroesofageo. Questo per dire che riguardo a tutta una serie di sostanze naturali che spesso i pazienti ci dicono assumere non dobbiamo limitarci a dire “Va bene, se vuole lo prenda”, ma spingere il mondo scientifico a fare ricerche ben condotte per capire quale sia il ruolo effettivo di ogni singolo composto. Così quando si va a scoprire con una ricerca ben condotta che il principio non funziona, si può dire in ambulatorio: “Guardate questo non è da usare”, perlomeno qualche evidenza esiste.
Come migliorare la gestione della CINV e come predirne il rischio? Innanzitutto educando a riconoscerla e trattarla. Poi curando con attenzione l’aderenza ai trattamenti e valutando le nuove modalità di somministrazione degli antiemetici, perché se a un paziente con nausea e vomito io dico di assumere compresse per bocca, probabilmente può avere qualche difficoltà: abbiamo oggi un principio attivo quale il granisetron transdermico che viene assunto grazie a un cerotto quindi bypassando la somministrazione per bocca e che può rappresentare uno strumento molto utile. Come è utile ridurre il numero di farmaci complessivamente assunti, perché le terapie più sono semplici e più impattano e inoltre utilizzare terapie non farmacologiche: banalmente l’esercizio fisico è fondamentale per ridurre nausea e vomito.
L’Associazione Italiana di Oncologia Medica (AIOM) ha realizzato queste bellissime linee guida sulla terapia antimetica scaricabili e utilizzabili molto concretamente con lo smartphone in ambulatorio. Ma la non aderenza alle linee guida, per cause legate al medico o legate ai pazienti, è un problema serio, tanto che un team di ricercatori europei ha valutato in uno studio19 l’aderenza ai trattamenti con schemi altamente e moderatamente emetizzanti al ciclo 1. Si tratta di uno studio osservazionale su quasi mille pazienti, quindi non da poco, e l’aderenza complessiva è risultata del 55% nella fase acuta e del 46% nella fase tardiva. I colleghi hanno poi valutato gli outcome e hanno visto che soprattutto sulla risposta completa e sull’assenza di nausea chi era consistente con le linee guida migliorava di circa un 10%, che è lo stesso vantaggio che si ottiene aggiungendo un nuovo farmaco. Cioè se domani in ambulatorio soltanto seguiamo con attenzione le linee guida diminuiamo la CINV nei nostri pazienti del 10%. Ecco quanto è importante l’aderenza. Ma quanto incide invece la mancata aderenza? Sempre nello stesso studio si è visto che
in chi non è aderente alle linee guida si registrano un maggior numero di visite specialistiche e di visite al Pronto Soccorso potenzialmente legate a sintomi di nausea e vomito (essendo uno studio osservazionale non sono riusciti a estrapolare il dato preciso). È molto importante quindi migliorare la trasferibilità alla pratica clinica della ricerca sui farmaci antiemetici. E per non farci sempre le solite paranoie da europei nei confronti degli americani, volevo dirvi che la stessa cosa l’hanno valutata anche ricercatori americani in uno studio20 pubblicato dal “Journal of Oncology Practice” e hanno ottenuto gli stessi identici risultati.
È chiaro che il problema dell’aderenza è un Giano bifronte, perché è un problema che dipende sia dal medico (che magari non somministra la terapia adeguata perché si dimentica, perché non ha tempo, perché segue mille altre cose e lascia fuori questo pezzo di profilassi) sia dal paziente che non prende il farmaco. Un geniale editoriale apparso sul “New England Journal of Medicine” diceva: “Drugs don’t work in patients who don’t take them”. Quali possono essere altre cause della mancata aderenza alle linee guida da parte del medico? Poca attitudine a valutarle, poca conoscenza – per questo averle sullo smartphone è davvero un vantaggio enorme –, la complessità degli schemi, la non confidenza nella risposta, un mancato supporto ospedaliero, perché a volte la non introduzione di farmaci all’interno degli schemi già prefissati dal farmacista può essere una problematica. E le soluzioni? La disseminazione passiva di materiale, cioè continuare a far girare tra noi tutti questi fogliettini con “Utilizza questo farmaco”, “Leggi queste linee guida” non è utile, lo si vede anche dalla letteratura, non ci serve. Sappiamo che è importante il follow-up sull’outcome, ovvero chiedere al paziente come è andato il controllo di nausea e vomito: ci aiuta a capire come meglio gestire i sintomi nello stesso paziente per il prossimo ciclo o nel
prossimo paziente che verrà in ambulatorio. Sappiamo che è importante la collaborazione con il personale infermieristico, i maggiori supporti per questo tipo di sintomo e per la sua gestione arrivano da una stretta sinergia con gli infermieri. E poi condividere le nostre esperienze e infine ridurre il numero di farmaci nei nostri pazienti.
È possibile predire il rischio di nausea e vomito del prossimo paziente che viene in ambulatorio? E se sì, in base a quali parametri? Alcune ricerche un po’ grossolanamente ci hanno detto che sono a maggior rischio le persone giovani, le donne, chi ha avuto una precedente nausea e vomito. Ma recentemente è stato pubblicato il bellissimo lavoro21 di un gruppo francese su pazienti con tumore della mammella che ha provato a identificare un tool, uno strumento per identificare il rischio di nausea e vomito nei pazienti. Cosa è uscito fuori? Che per nausea e vomito dal giorno 0 al giorno 5 quello che impatta è: l’eta giovane, la presenza di nausee anticipatorie, dormire meno di 7 ore il giorno prima della chemioterapia, una storia di nausee e vomito in gravidanza, l’uso di farmaci non prescritti a casa (vuol dire che nell’interciclo ho avuto qualcosa e quindi a maggior ragione avrò un maggior rischio successivo), la chemioterapia con cisplatino o antraciclina. Sono stati così bravi questi autori che sono poi riusciti a sviluppare anche un algoritmo (disponibile per smartphone anche questo). C’è qualche imprecisione però è interessante: voi inserite il tipo di farmaco chemioterapico, inserite i fattori che il sistema vi chiede e l’algoritmo vi calcola automaticamente il rischio emetogeno di questa chemioterapia, suggerendovi altresì quale dovrebbe essere la scelta di farmaci antinausea e antivomito da utilizzare.
Trattasi di mera trascrizione dall’intervento orale del relatore.
15. Ballatori E, Roila F, Ruggeri B, Betti M, Sarti S, Soru G, Cruciani G, Di Maio M, Biffi A, Deuson RR. The impact of Chemotherapy Induced Nausea and Vomiting on healthrelated quality of life. Support Care Cancer 2007;15:179-185 doi: 10.1007/s00520-006-0109-7
16. Roila F, Molassiotis A, Aapro M, Gralla RJ, Bruera E et al on behalf of the partecipants of the MASCC/ESMO Consensus Conference Copenhagen 2015. Annals of Oncology 2016; 27(supplement 5):v119-v133 doi: 10.1093/annonc/mdw270
17. van Waart H, Stuiver MM, van Harten WH, Geleijn E, Kieffer JM, Buffart LM, de Maaker-Berkhof M et al. Effect of Low-Intensity Physical Activity and Moderate- to HighIntensity Physical Exercise During Adjuvant Chemotherapy on Physical Fitness, Fatigue, and Chemotherapy Completion Rates: Results of the PACES Randomized Clinical Trial. J Clin Oncol 2015;33(17):1918-27 doi: 10.1200/JCO.2014.59.1081
18. Bossi P, Cortinovis D, Fatigoni S, Cossu Rocca M, Fabi A, Seminara P, Ripamonti C, Alfieri S, Granata R, Bergamini C, Agustoni F, Bidoli P, Nolè F, Pessi MA, Macchi F, Michellini L, Montanaro F, Roila F. A randomized, double-blind, placebocontrolled, multicenter study of a ginger extract in the management of chemotherapy-induced nausea and vomiting (CINV) in patients receiving high-dose cisplatin. Ann Oncol 2017;28(10):2547-2551 doi: 10.1093/annonc/ mdx315
19. Aapro M, Molassiotis A, Dicato M, Peláez I, Rodríguez-Lescure Á, Pastorelli D, Ma L, Burke T, Gu A, Gascon P, Roila F; PEER investigators. The effect of guideline-consistent antiemetic therapy on chemotherapy-induced nausea and vomiting (CINV): the Pan European Emesis Registry (PEER). Ann Oncol 2012;23(8):1986-92.
20. Gilmore JW, Peacock NW, Gu A, Szabo S, Rammage M, Sharpe J, Haislip ST, Perry T, Boozan TL, Meador K, Cao X, Burke TA. Antiemetic guideline consistency and incidence of chemotherapy-induced nausea and vomiting in US community oncology practice: INSPIRE Study. J Oncol Pract 2014;10(1):68-74 doi: 10.1200/JOP.2012.000816
21. Dranitsaris G, Molassiotis A, Clemons M, Roeland E, Schwartzberg L, Dielenseger P, Jordan K, Young A, Aapro M. The development of a prediction tool to identify cancer patients at high risk for chemotherapy-induced nausea and vomiting. Ann Oncol 2017;28(6):1260-1267 doi: 10.1093/ annonc/mdx100
Figura 20. Un tool per predire il rischio emetogeno






Fabiola Paiar
Direttore UO Radioterapia
Azienda Ospedaliero-Universitaria Pisana
Da buona radioterapista mi sono concentrata sulla RINV, ovvero la nausea e vomito indotta da radioterapia, una entità piuttosto misconosciuta, non solo in ambito oncologico ma anche addirittura fra gli stessi radioterapisti. Perché è importante sapere che esiste? Perché tutto sommato si verifica in un’elevata percentuale di pazienti sottoposti a radioterapia, si stima circa il 50-80%. Analogamente alla CINV anche la RINV ha una fase acuta e una fase tardiva, ma gli esatti meccanismi fisiopatologici della nausea in corso di radioterapia non sono ben compresi quindi esistono diversi “buchi” nell’ambito delle linee guida per quanto riguarda la profilassi antiemetica.
È molto importante gestire la RINV perché questo tipo di effetto collaterale può impattare sul paziente determinando complicazioni importanti come disidratazione o malnutrizione, che possono da una parte peggiorare la qualità di vita dei pazienti e dall’altra determinare interruzioni o ritardi nell’effettuazione del trattamento radioterapico stesso, che sappiamo essere uno dei fattori principali condizionante l’outcome del trattamento. Quindi il fatto che esistano pochi dati in letteratura – gli studi randomizzati sulla profilassi della RINV sono estremamente scarsi ed effettuati su campioni numericamente
ridotti – fa sì che a oggi sia una condizione misconosciuta, sottotrattata o trattata in maniera del tutto inadeguata.
Come si realizza questo disturbo? Sappiamo che il riflesso della nausea e del vomito è gestito da centri localizzati al livello del tronco encefalico, il cosidetto complesso dorsale vagale, che si trova nel midollo allungato in corrispondenza della superficie dorsale del quarto ventricolo ed è composto da tre entità: l’area più estrema che è conosciuta altresì con il termine di trigger zone chemiorecettoriale, il nucleo del tratto solitario e il nucleo motore dorsale del vago. Queste strutture ricevono gli stimoli provenienti da buona parte dell’organismo, in particolar modo dal tratto gastrointestinale, dal cuore, dal peritoneo, dai dotti biliari. Arrivano informazioni anche dai sistemi vestibolari, dalle zone corticali superiori – che poi sono quelle responsabili della nausea o vomito collegati a determinati stati emozionali quali la paura e l’ansietà che probabilmente entra in gioco anche nella nausea anticipatoria – e infine la trigger zone che invece si trova al di fuori della barriera ematoencefalica e viene stimolata da sostanze disperse nel circolo sanguigno, quindi anche i chemioterapici, determinando la trasmissione degli impulsi agli altri effettori veri e propri della nausea e del vomito.
La radioterapia come agisce in questo contesto? Molto probabilmente sono implicati più meccanismi d’azione, quali per esempio la distruzione delle cellule enterocromaffini che si trovano al livello del sistema gastrointestinale o anche una stimolazione diretta delle fibre afferenti del sistema gastrointestinale – ovviamente la prerogativa principale è che l’intestino tenue o lo stomaco siano inclusi nel volume di trattamento. Oppure attraverso una stimolazione diretta del tronco encefalico, in particolar modo della trigger zone del complesso dorsale del
4th ventricle
Cerebellum
Area postrema and CTZ
Emetogenic potential
Risk of emesis without antiemetic prophylaxis Location
High Risk > 90 percent
Moderate Risk 60 to 90 percent
Low Risk 30 to 60 percent
Minimal Risk < 30 percent
Dorsal Vagai Complex (DVC)
¡ area postrema
¡ nucleus of the solitar y tract
¡ dorsal motor nucleus of the vagus
DVC is located in the medulla oblongata along the dorsal sur face of the four th ventricle
DVC is the termination site of vagai a erent nerve bers and ser ves as the nal common pathway linking a variety of emetic signals.
Total-body irradiation (TBI), total nodal irradiation (TNI)
Upper abdominal irradiation, hemibody irradiation (HBI), and upper body irradiation (UBI)
Cranium (all), craniospinal, head and neck, lower thorax region, pelvis
Breast and extremities
vago. Un altro meccanismo può essere rappresentato dalla comparsa e induzione di ipertensione intracranica conseguentemente all’edema, all’infiammazione radio-indotta quando ovviamente si irradia l’encefalo.
E infatti se andiamo a vedere le linee guida per quanto riguarda la gestione della RINV il fattore che viene preso in considerazione per stratificare i vari trattamenti a seconda del diverso livello di rischio emetogeno è proprio la sede anatomica irradiata. Su questa base vengono distinte quattro categorie: altamente emetogene sono sempre la Total-Body Irradiation (TBI) e la Total Nodal Irradiation (TNI), poi ci sono trattamenti con grado di rischio moderato come l’irradiazione dell’addome superiore e altri con un potenziale emetogeno più basso quale l’irradia-
zione del cranio, del distretto testa collo, dell’asse craniospinale. Infine altri trattamenti invece dotati di un potenziale emetogeno minimo come la radioterapia sulla mammella o sulle estremità.
In realtà, come abbiamo già visto per la CINV, anche per quanto riguarda la RINV i fattori implicati nel rischio di insorgenza di questa sintomatologia sono molteplici, in parte anche legati al paziente. In questo caso l’età, il sesso femminile, il consumo di alcol, il fatto di aver sperimentato e provato nausea e vomito in precendenza, la presenza di stato di ansietà e infine tutta una serie di fattori tecnici che vanno al di là di quello considerato dalle linee guida, cioè la sola serie di radiazioni. Questi altri fattori sono rappresentati dalle dimensioni del campo, dalla do -
se di frazione, dalla dose totale, dalle teniche di radiazione impiegate e infine da una chemioterapia concomitante.
Negli ultimi 20 anni nel campo radioterapico abbiamo assistito a una vera propria rivoluzione tecnologica, per cui grazie all’introduzione dell’imaging, alla diffusione di sistemi di pianificazione e computer altamente performanti, macchinari estremamente sofisticati, oggi è possibile impiegare delle tecniche che sono in grado di incrementare l’indice terapeutico della radioterapia, migliorando l’erogazione della dose sul target tumorale e risparmiando al massimo i tessuti sani circostanti. Un esempio emblematico sono la radioterapia statica, volumetrica ad arco, elicoidale, stereotassica. Il prezzo da pagare per l’impiego di questo tipo di tecniche è che si realizza un vero e proprio bagno di dose, ovvero le dosi elevate sono estremamente ridotte e conformate al target tumorale però le basse dosi si trovano a coinvolgere tessuti e organi che venivano in realtà risparmiati con le tecniche tradizionali di radioterapia.
Il trattamento a intensità modulata si è affermato soprattutto per il trattamento di certi tumori, in particolar modo i tumori del distretto cervico facciale, questo a causa della complessità anatomica della zona in cui insorgono. Qui si trovano una molteplicità di organi critici, che hanno delle dosi di tolleranza inferiori ovviamente a quelle che devono essere somministrate per la cure del tumore, ma in un distretto del genere la distribuzione della dose su target irregolari fa sì che basse dosi vadano a coinvolgere altri tessuti che si trovano interposti tra il target e il fascio di radiazione. E in effetti da un lavoro22 che è stato pubblicato nel 2008 in cui viene fatta un’analisi su circa 160 pazienti trattati con INRT emerge come questi pazienti vadano incontro a tossicità del tutto inaspettate sulla base delle esperienze dei trattamenti precedenti, tossicità quali essenzialmente la mucosite nella porzione anteriore della bocca, l’alo -
pecia posteriore, la cefalea e per l’appunto la nausea e il vomito. Vi ricordo che nelle linee guida mostrate precedentemente i trattamenti per tumore del distretto cervico facciale rientrano nella categoria di rischio bassa, anche se va detto che i dati che hanno portato alla formulazione di queste indicazioni fanno riferimento a studi estremamente vecchi in cui ancora la radioterapia a intensità modulata non veniva utilizzata. Questo per sottolineare come tra la radioterapia a intensità modulata e la radioterpia convenzionale vi siano differenze estremamente importanti e significative sulla dose al tronco encefalico che è una struttura come abbiamo già detto implicata nel riflesso della nausea e del vomito.
Anche per la gestione della RINV uno dei grossi problemi è la scarsa aderenza alle linee guida e una profilassi antiemetica viene in realtà prescritta in un numero estremamente esiguo di pazienti sottoposti a radioterapia. La radioterapia sempre più spesso viene impiegata in associazione alla chemioterapia nei cosidetti trattamenti concomitanti sia esclusivi che in setting adiuvante e sappiamo che questo tipo di approccio incrementa in maniera importante la tossicità acuta e tardiva. È vero che la nausea e il vomito da radioterapia sono un fenomeno meno frequente rispetto a quello riscontrato in corso di chemioterapia, però se non viene adeguatamente gestito, le problematiche legate a questo disturbo vanno a sommarsi a quelle legate alla chemioterapia impattando significamente sulla possibilità di effettuare un trattamento radioterapico nei tempi stabiliti, uno dei fattori più importanti sull’outcome. Altro fattore importante è l’ampiezza dei volumi, infatti sappiamo che l’ampiezza del volume di trattamento è in grado di impattare in maniera statisticamente significativa, è un fattore predittivo indipendente di tossicità di nausea e vomito, e generalmente i volumi che vengono impiegati in particolar
modo nei tumori del rinofaringe e nei tumori dell’orofaringe prevedono dimensioni superiori ai 400 cc che è appunto il cut-off che si associa a un incrementato rischio di nausea e vomito.
Perché è così complessa la gestione della RINV nei pazienti sottoposti a radioterapia? Perché in realtà questa problematica si va a sommare alla comparsa di altre tossicità strettamente correlate al trattamento radioterapico e chemioterapico quali la mucosite, la disfagia e la xerostomia, che se da una parte possono aumentare la percezione della nausea e vomito in questi pazienti, dall’altra possono concorrere insieme alla nausea e al vomito a determinare stati di malnutrizione e disidratazione esponendo il paziente al rischio di eventi fatali.
Trattasi di mera trascrizione dall’intervento orale del relatore.
22. Monroe AT, Reddy SC, Gibbs GL, White GA, Peddada AV. Factors associated with radiation-induced nausea and vomiting in head and neck cancer patients treated with intensity modulated radiation therapy. Radiother Oncol 2008;87(2):188-94 doi: 10.1016/j.radonc.2007.12.030
Gaetano Lanzetta
Responsabile UOC Oncologia Medica Gruppo INI, Grottaferrata
Sono nove nel Lazio i centri accreditati ESMO. Abbiamo cercato di valutare, con una survey, qual è il comportamento nella pratica quotidiana in centri di oncologia e cure palliative che chiaramente, essendo accreditati ESMO, dovrebbero avere un’esperienza maggiore o comunque più attenzione alle problematiche legate ai sintomi. Hanno risposto 33 colleghi dei 9 centri: non è un numero elevatissimo però è uno spaccato interessante di come viene gestita l’OIC nel Lazio. I dati sono stati raccolti sia per pazienti che venivano visti in regime di day hospital, la gran parte, o in ambulatorio, o in reparto. Questo, diciamo, è un dato che può far risalire a che cosa? La preponderanza di day hospital rispetto al reparto deriva dal fatto che ci sono molte strutture che hanno solamente il day hospital e non il reparto.
Per quanto riguarda la definizione, che cosa intendiamo per OIC, l’orientamento che prevale, con il 55%, è “sintomi di costipazione in pazienti in trattamento con oppioidi”: il 42% ha risposto invece “costipazione da oppioidi da almeno 7 giorni” e solo il 3% ha risposto “disfunzione intestinale indotta da oppioidi”. Quello che, diciamo, mi lascia un pochettino perplesso è quel 42%. Forse la modalità con cui è stata posta la domanda ha influito un pochino sulla risposta, nel senso che il criterio temporale potrebbe essere stato percepito come influente quan-
Figura 23. Tipologia partecipanti
Centri ESMO Lazio: 33
Ospedaliero
do poi in realtà la definizione prescinde dal numero di giorni rispetto alla prescrizione. Alla domanda “Nella tua esperienza qual è il tasso di insorgenza?”, togliendo i due estremi (>75% e <25%) che sono stati scelti da una percentuale molto piccola (rispettivamente 12 e 6%), abbiamo un 82% di risposte tra il 25 e il 75%. La domanda “Sei a conoscenza di linee guida sulla OIC?” ci dovrebbe far riflettere. Solo il 46% dei colleghi infatti ha risposto “Sì e riesco a seguirle nella pratica clinica”. Ben il 27% – ricordo che stiamo parlando di centri d’eccellenza – ha risposto “No”, mentre il 27% ha risposto “Sì, ma non riesco a seguirle nella pratica clinica”. Bisogna porsi delle domande. Ovvero, perché non riuscire a seguire delle linee guida? Perché sono complesse nell’applicazione? Perché non abbiamo tempo? O perché non diamo importanza al problema? Io credo che sia lo strumento di valutazione BFI (Bowel Function Index), sia le linee guida non siano qualcosa di così complesso, per cui il “non riesco a seguirle” ha poco senso. Ritengo che ci sia poca attenzione nell’andare ad affrontare questa problematica, però l’abbiamo visto: c’è voluto tempo per il dolore, c’è voluto tempo per altri sintomi come la nausea e il
vomito, dobbiamo iniziare a orientarci anche per la OIC, che è un problema clinico, lo è per il paziente. Quindi speriamo che se allargheremo questa survey, coinvolgendo un maggior numero di persone, potremo ottenere (e speriamo di ottenere) risultati un pochettino diversi.
“Esistono protocolli interni di gestione OIC nel tuo centro?”: “No” 73%, “Sì” 27%. È chiaro che se non seguo le linee guida è difficile che riesco ad avere protocolli interni di struttura. Quando facciamo i protocolli interni di struttura non facciamo altro che ricalcare quelle che sono le linee guida, si cercano sempre ovviamente poi dei dati scientifici che ti permettono di poter applicare il tuo procotollo all’interno della struttura.
Alla domanda “Misuri la stitichezza nei tuoi pazienti?” il 73% risponde “Sì” mentre il 27% risponde “No”. Seguire una linea guida vuol dire anche misurare, e se io seguo la linea guida del dolore misuro e poi metto in atto un trattamento. Invece io qua non non seguo le linee guida – se non in piccolissima parte – però poi misuro la stitichezza. Un po’ di confusione in questa riposta secondo me c’è. A meno che
Figura 24. Cosa si aspetta il paziente dalla terapia con naloxegol?
non si voglia dire: “La misuro, però poi non riesco a mettere in atto le linee guida”, cioè non sempre mi è facile mettere in pratica tutta una serie di strumenti che mi aiutano a superare la problematica dell’OIC. “Conosci il BFI?”: “No” 48%, “Sì” 52%. È uno strumento molto semplice, è validato, però se non lo conosci non lo usi e questo ti porta a non mettere in atto le linee guida, ed ecco che tornano un po’ di risposte che sembravano in prima battuta un po’ strane. “Quali caratteristiche dovrebbe avere un tool per la misurazione dell’OIC?”. Sicuramente dovrebbe essere semplice da compilare (37%), ma questo lo richiediamo un po’ a tutti gli strumenti. “Facile da interpretare” ottiene un 22%, “Fornire un dato affidabile” il 26%, “Fornire un supporto per la terapia” il 15%. Il BFI non è che ci aiuti molto sulla parte della terapia, ma è un supporto semplice, che però non viene utilizzato. Ecco che ritorna il discorso di prendere dimestichezza con una problematica che forse fino ad adesso è stata molto molto trascurata da parte di tutti noi. “Su quali parametri basi la diagnosi di OIC?”. Il 76% ha risposto “Sia oggettivi che soggettivi”, questa riposta è consona a quella che è la problematica di un sintomo. “Utilizzi le strategie preven-
tive nella gestione della OIC?”: abbiamo un “Sì” nel 94% dei casi. Quali strategie, però? Dobbiamo consigliare ai nostri pazienti, quando è possibile, una buona idratazione, possiamo consigliare loro ovviamente un’alimentazione corretta ma non è sufficiente perché qui è un problema recettoriale.
“Sai cosa sono i PAMORA?”: risponde “Sì” il 72%. E questo è importante, perchè ci dice che abbiamo a disposizione una categoria di farmaci, nello specifico un farmaco, che è il naloxegol, che ci permette di affrontare questa problematica. “Conosci naloxegol? Sai quando utilizzarlo?” Ecco, la Nota 90 limita la prescrizione ai pazienti con OIC che siano in fase terminale e in terapia continuativa con oppiacei da almeno due settimane e mostrino resistenza al trattamento con lassativi ad azione osmotica per più di tre giorni. Beh, in realtà la categoria di pazienti che vediamo con malattia avanzata che fanno utilizzo di oppioidi è una popolazione molto piccola. “Cosa si aspetta il paziente dalla terapia con naloxegol?”: qui ovviamente il medico interpellato dalla survey doveva chiedere ai suoi pazienti quali fossero le loro priorità ma il fatto che ci sia un 28% di pazienti
che non sa, non risponde fa capire che probabilmente non è stato ben spiegato quale fosse l’intento della domanda. Ci può stare, perché tra risoluzione sintomatologia (22%), azione rapida e duratura (11%) e riduzione degli effetti collaterali (39%) può capitare che non abbiano saputo darci una risposta ben precisa. Però sicuramente l’azione rapida e la risoluzione della sintomatologia è alla base di quello che ci chiede il paziente. “Hai esperienza con l’utilizzo di naloxegol?”: il 73% risponde “Sì, e sono soddisfatto”, ma c’è un 27% dei 33 colleghi che ha risposto che non ha avuto ancora un’esperienza in tal senso. Questo fa capire che se questo succede in centri ESMO che dovrebbero essere un po’ più dedicati a questo, sono necessarie una maggiore formazione e informazione. “Valuti positivamente la tollerabilità di naloxegol?”: ben l’80% risponde assolutamente sì, sia a breve che a lungo termine. Per chi ha utilizzato questo farmaco la risposta non può che essere questa. “Come utilizzi naloxegol?”: il 52% ha risposto “In modo protratto”, il 48% “Fino alla risoluzione del sintomo”. Va sottolineato che la sche -
da tecnica del farmaco dice che può essere utilizzato in modo protratto, riducendo anche la problematica della ricomparsa del sintomo, di una situazione clinica che il paziente ovviamente vive in maniera assolutamente negativa. “Con quale tempistica monitori l’efficacia di naloxegol?”: la maggior parte dei colleghi (85%) si è attenuto a quanto riportato nella scheda tecnica, cioè la valutazione deve essere fatta entro una settimana. Diciamo una volta prescritto il farmaco è d’uopo almeno in terza giornata risentire il malato e capire qual è la situazione, se si è risolta la problematica.
Questa survey, con le sue limitazioni, può essere un punto di partenza per capire in un setting “real life” quali sono le criticità della gestione dell’OIC, per valutare il punto di vista del malato, ma soprattutto per analizzare come il medico, in questo caso l’oncologo, affronta la problematica OIC.
Trattasi di mera trascrizione dall’intervento orale del relatore.

Realizzato con un contributo non condizionante di