Le terapie di supporto in radioterapia:

la gestione della CINV e il dolore oncologico nelle sue diverse manifestazioni
Report dal Simposio del XXIX Congresso Nazionale AIRO 2019 Rimini


la gestione della CINV e il dolore oncologico nelle sue diverse manifestazioni
Report dal Simposio del XXIX Congresso Nazionale AIRO 2019 Rimini
Francesco Cellini
Radioterapia oncologica – Gemelli A.R.T.
Fondazione Policlinico Universitario A. Gemelli IRCCS, Roma
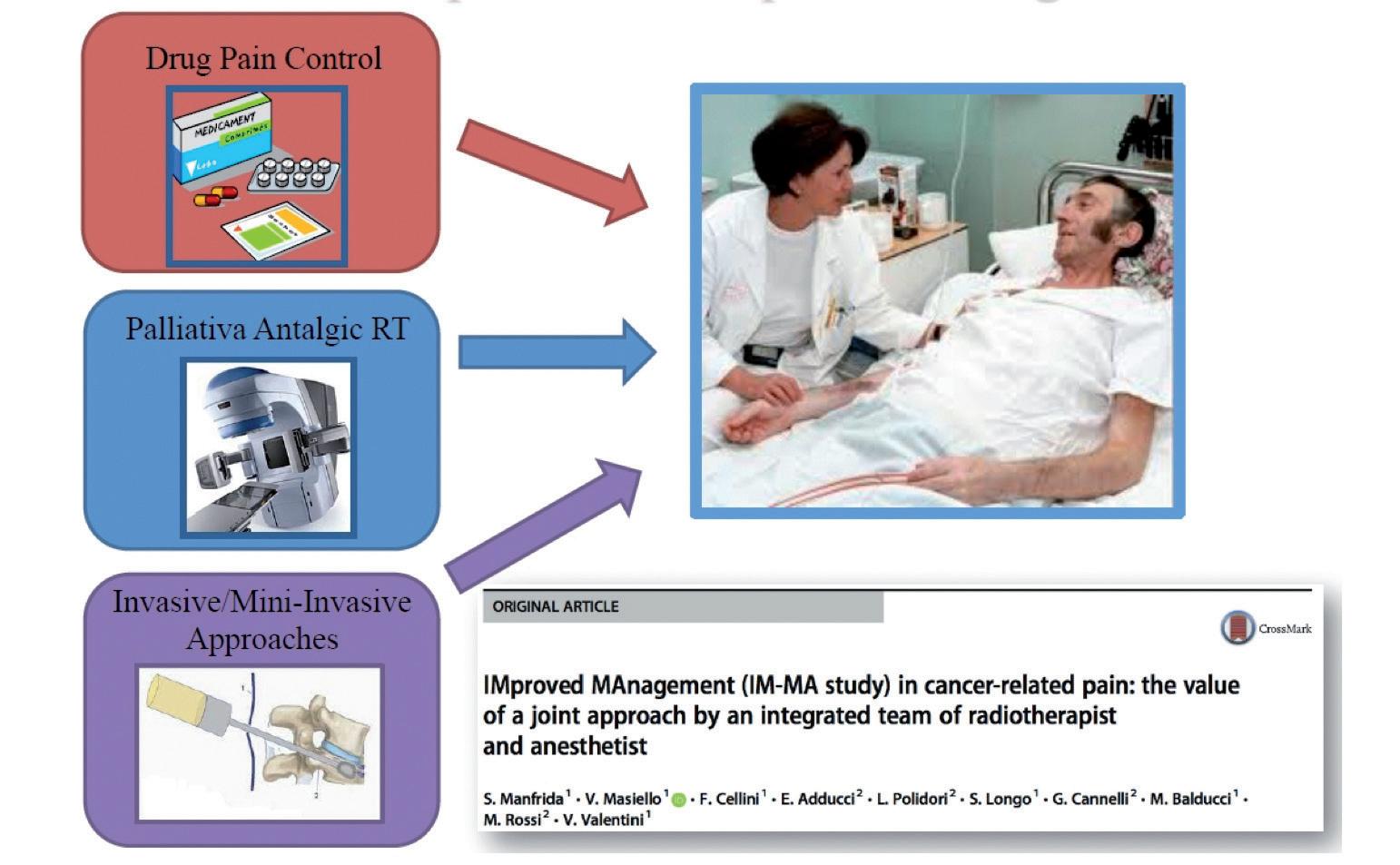
La radioterapia rientra tra le cosiddette “terapie del dolore”, come indicato dall’essere menzionata tra le opzioni terapeutiche elencate nelle moderne linee guida di Terapia del Dolore. 1,2 Si tratta di terapie ovviamente sia farmacologiche che non farmacologiche e (fra quest’ultime) la radioterapia rientra tra le non invasive. La Legge n°38 richiama al diritto della gestione del dolore per il malato, in particolare quello oncologico.
La gestione farmacologica del dolore è principalmente appannaggio dello specialista di terapia medica. Anche se impostare la terapia medica antalgica non è compito del radio-oncologo, è senz’altro suo compito relazionarsi con le figure specialistiche di terapia medica antalgica. Ad esempio, nella misura di applicare dove possibile un’integrazione multidisciplinare completa: in alcuni Centri esiste questo tipo di esperienza. Presso la Fondazione Policlinico Universitario A. Gemelli IRCCS da circa 15 anni è stato istituito un ambulatorio integrato di terapia del dolore in cui il radio-oncologo visita insieme all’anestesista (specialista di Terapia del Dolore farmacologica), quindi la compagine sistemica e la compagine locale si embricano completamente con risultati ottimi. Anche nelle normali visite per Radioterapia Palliativa antalgica, il radio-oncologo dovrebbe valutare se ci fossero elementi che per supporre la necessità di una rivalutazione della terapia antalgica medica da parte dello specialista. Dovrebbe rego -
larmente valutare altresì l’anamnesi del dolore del nostro paziente per poter essere più efficaci nella gestione del trattamento radiante.
Le caratteristiche generali dell’impostazione di un trattamento antalgico riguardano la personalizzazione della cura, la gestione per via orale (se possibile), la cosiddetta gestione “around the clock”, cioè invitando il paziente a rispettare la regolarità delle prescrizioni, mentre è ormai superato l’approccio che imponga di seguire il percorso dal primo all’ultimo gradino della scala farmacologica antalgica (nonoppioidi, oppioidi deboli e oppioidi forti). Infatti, linee guida come quelle dell’AIOM incorporano un approccio sempre più personalizzato in cui il livello di dolore può permettere di saltare alcuni di questi passaggi. Valutiamo ora alcune utili operatività da seguire visitando un paziente che debba sottoporsi a radioterapia palliativa antalgica.3,4 Indagare la terapia farmacologica antalgica in corso, esplorando se il paziente per qualche motivo avesse introdotto variazioni all’ultima prescrizione medica, annotando le motivazioni addotte. Nel giudicare l’efficacia della terapia farmacologica tenere conto che, a seconda delle tipologie diverse del trattamento prescritto, sono necessari in media almeno due o tre giorni perché queste instaurino effetto. Riferirsi sempre a delle scale quantitative per la definizione del dolore, come l’NRS, ma farlo possibilmente anche in una prospettiva locoregionale: associando quindi al valore numerico la sede del dolore riferito. Registrare, accanto all’NRS globale, multipli NRS (se presenti diverse sedi dolenti) nella prospettiva del trattamento radiante da avviare. Riferire la rivalutazione della risposta alla terapia radiante ai criteri indicati dalle moderne Consensus Conferences. Indagare sempre specificamente il “breakthrough pain” e se siano stati prescritti farmaci in tal senso. Indagare in generale l’assetto psicologico del paziente. Fare menzione in visita e controllare durante il trattamento l’insorgenza eventuale del “pain flaire”, per poter intervenire o specifi-
care al paziente come riferirsi al Reparto di Radioterapia di riferimento, in caso di necessità. Quando dovessimo ritenere che in qualche modo è inadeguata la terapia, è necessario riferire il paziente o allo specialista o al team multidisciplinare di base. Nell’eventualità in cui il paziente non avesse però una copertura farmacologica antalgica minima o adeguata è utile prescrivere una terapia anche di primo approccio prima di riferire il paziente allo specialista.
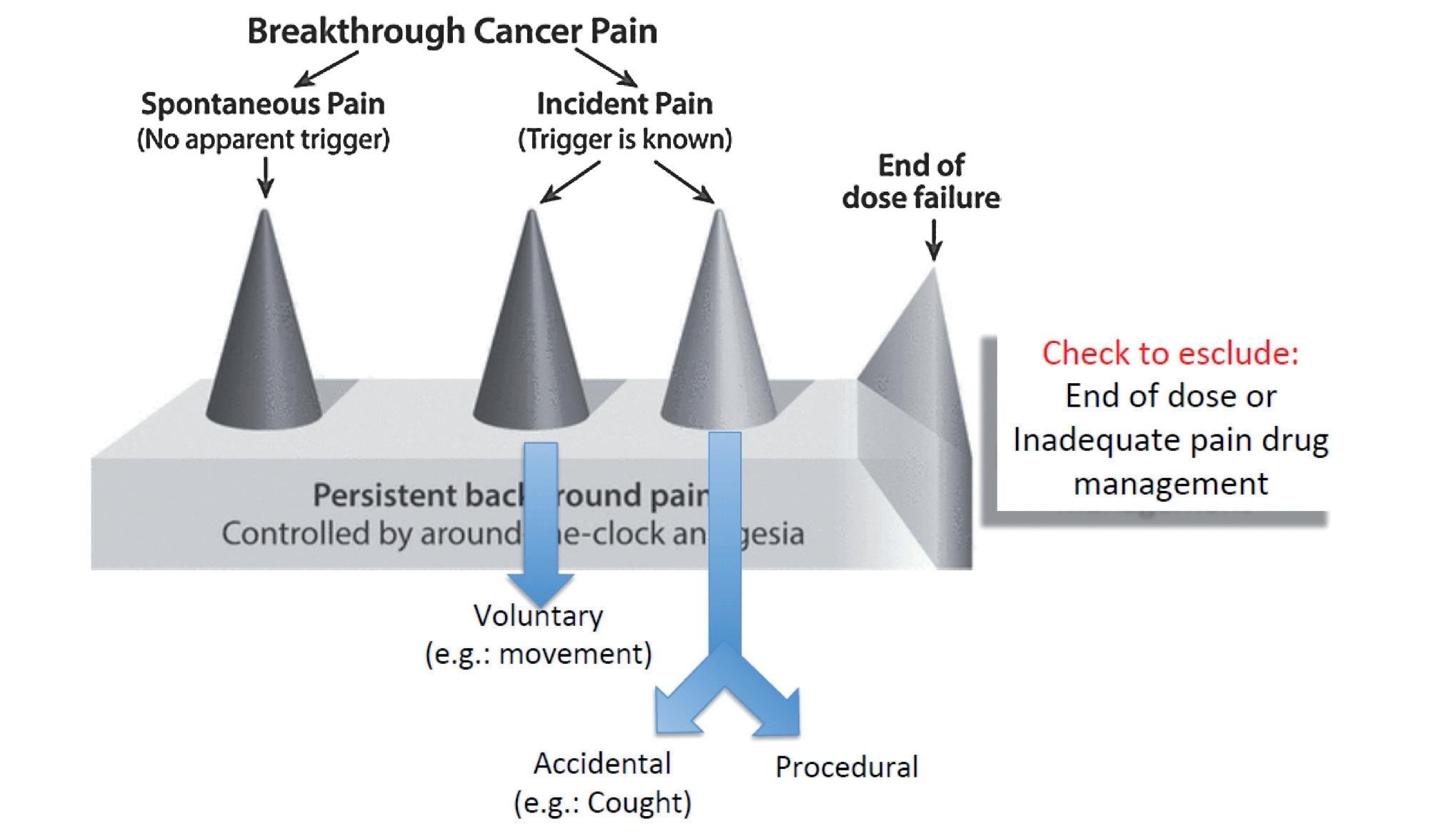
Un altro aspetto che coinvolge più direttamente il radio-oncologo è lo scenario del dolore episodico intenso (DEI) o breakthrough cancer pain (BTcP). Esistono varie definizioni per questa sintomatologia algica: rispetto alla terapia di base, anche quando questa fosse in grado di gestire il dolore in maniera corretta, possono verificarsi episodi di recrudescenza improvvisa con diretto impatto non solo sulla qualità della vita del paziente, ma sulla qualità del trattamen-
to radiante palliativo antalgico. Il BTcP (o DEI) induce errori di posizionamento (set-up), rischiando di interrompere o discontinuare un trattamento che invece è volto proprio a gestire il dolore. Sappiamo che il BTcP può essere spontaneo quando non riconducibile ad una causa specifica, o può essere collegato a movimenti volontari del paziente, ad esempio quando indotto sula base della localizzazione di malattia, o anche essere in teoria legato a movimenti involontari quali la tosse per presentazioni con lesioni costali; infine la procedura stessa può essere “trigger” per il BTcP. In ogni caso, il BTcP è diverso dalla condizione di fine effetto della copertura antalgica: distinguere questa differenza è cruciale per riferire eventualmente il paziente allo specialista. Definiamo le caratteristiche del BTcP. Innanzitutto il numero di episodi: anche se l’evoluzione del BTcP è variabile da paziente a paziente, in genere un numero netta- mente superiore a quattro episodi/die ci devono far pensa-

re alla necessità di rimodificare tutta la terapia (ovvero potrebbe non trattarsi di BTcP). Gli attacchi di BTcP presentano un picco di latenza tra insorgenza e raggiungimento dell’acme del dolore in pochi minuti. Hanno un’intensità molto elevata, con NRS in media 8 su 10 e durano in media da 15 minuti ad un’ora, molto meno frequentemente fino a due ore. Quindi servono farmaci antalgici che agiscano rapidamente e coprano adeguatamente questo intervallo.
I farmaci oppioidi sono i più utili in questo scenario. Tra questi, quelli ad azione prolungata sono da riservare alla terapia di base. Quelli più utili per il BTcP sono gli “short acting” opioid (SAO) per via orale, e quelli a più rapido intervallo d’azione (rapid onset opioid – ROO). Nelle Linee Guida vengono menzionate entrambe le ultime due tipologie. È sempre più diffuso l’assunto per cui la tempistica d’instaurazione dell’effetto antalgico dei SAO è troppo lunga. È quin-
di preferibile ricorrere ai ROO: più veloci, più efficaci, molto sicuri e molto maneggevoli, anche per il paziente. Le diverse formulazioni di ROO, con qualche differenza, agiscono mediamente nell’arco di 5-15 minuti, in particolare le formulazioni nasali sono leggermente più veloci; inoltre i diversi tipi di formulazioni del Fentanyl (ROO) soddisfano la durata di copertura per il tipico attacco di BTcP. Ecco dunque perché le Linee Guida AIOM e NCCN indicano questa classe di farmaci da prendere in considerazione più preferibilmente dei SAO. Le stesse però non entrano nel dettaglio di quale formulazione debba preferirsi. Come scegliere, dunque? Tra le principali formulazioni e dispositivi disponibili abbiamo i “lollipop”; i “tablet” ad iniziale destinazione per la mucosa geniena che adesso ha l’indicazione per essere usato in formulazione sublinguale (caratterizzati da un’effervescenza al rilascio); altre forme “nativamente” sublinguali (studiate e tarate per una mucosa più sottile di
quella geniena); e le più recenti formulazioni in spray nasale in forme acquose e, successivamente, in pectina. Ogni prodotto ha le proprie peculiarità, le evidenze di letteratura non indicano chiaramente quale possa essere preferibile a prescindere. Una sintesi equilibrata ma pratica potrebbe indicare come meno preferibile la soluzione acquosa per lo spray nasale rispetto alla formulazione con pectina, perché la soluzione acquosa tende a non rimanere adesa alla mucosa. Le formulazioni nasali sono molto veloci, ma in ragione di una minima variabilità per condizioni dei nostri pazienti, volendo essere sicuri che il paziente ottenga l’effetto antalgico prima di una procedura di radioterapia (dalla visita, alla simulazione o alla terapia stessa), può essere utile attendere comunque 10-15 minuti dopo la prima somministrazione. Abbiamo poi almeno tre formulazioni per via orale: tra queste ricordiamo che una è caratterizzata da effervescenza, un’altra ha un piccolo residuo capsulare
(che può essere indifferentemente eliminato o ingerito dal paziente) e la terza non lascia alcun residuo né presenta effervescenza.
Per gestire in acuto un episodio di BTcP nel setting dei trattamenti radianti palliativi antalgici il primo passo è scegliere (in base alle condizioni cliniche e preferenze del paziente) la via di somministrazione del ROO (via nasale o sublinguale). In pratica può essere utile aspettare 10-15 minuti dopo la prima somministrazione per saggiare l’effetto del ROO, prima di mobilizzare il paziente. Infine immaginiamo tre scenari principali. Il primo è di un paziente che ha già ROO in terapia per BTcP: in questo caso si può somministrare la prima dose, aspettare 10-15 minuti e in assenza di significativo effetto somministrare una seconda dose dello stesso ROO. In assenza d’efficacia potremmo riferire il paziente allo specialista. In secondo luogo potremmo incontrare un pazien-

te “naive” per assunzione di ROO, ma che dalla terapia in prescrizione ha già effettuato titolazione per oppioidi. In questo caso, ove indicato, è possibile somministrare il più basso dosaggio di ROO disponibile (nel range dei 100mcg).
Se infine il paziente non avesse mai assunto oppioidi è indicato usare un diverso presidio antalgico ed indirizzare il paziente allo specialista.In conclusione: la radioterapia è una delle terapie del dolore, non medica (ovvero non farmacologica), ad azione causale e non invasiva. La terapia di base antalgica farmacologica dovrebbe essere gestita da uno specialista ma il radio-oncologo deve saper valutare il paziente e, se necessario, rimandarlo a valutazione specialistica. Il radio-oncologo deve intervenire nella valutazione e gestione degli episodi di BTcP. Le formulazioni a base di Fentanyl come i ROO sono l’opzione preferibile; la scelta deve essere guidata dalle condizioni del paziente. Di sicuro, le formulazioni sublinguali hanno un’elevata maneggevolezza. Infine l’approccio multidisciplinare integrato tra radio-oncologi e tutte le altre discipline di terapie del dolore resta un presidio fondamentale.
1. Swarm RA, Paice JA, Anghelescu DL, Are M, Bruce JY, Buga S, Chwistek M, Cleeland C, Craig D, Gafford E, Greenlee H, Hansen E, Kamal AH, Kamdar MM, LeGrand S, Mackey S, McDowell MR, Moryl N1, Nabell LM1, Nesbit S, O’Connor N, Rabow MW, Rickerson E, Shatsky R, Sindt J, Urba SG, Youngwerth JM, Hammond LJ, Gurski LA. Adult Cancer Pain, Version 3.2019, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw 2019;17(8):977-1007 doi: 10.6004/jnccn.2019.0038
2. AIOM (Associazione Italiana Oncologia Medica) - Linee Guida Terapia Del Dolore In Oncologia 2018 https://www.aiom.it/ linee-guida-aiom-2018-terapia-del-dolore-in-oncologia/
3. Chow E, Hoskin P, Mitera G et al. Update of the international consensus on palliative radiotherapy endpoints for future clinical trials in bone metastases. Int J Radiat Oncol Biol Phys 2012 ;82(5):1730-7 doi: 10.1016/j.ijrobp.2011.02.008
4. Chow E, Zeng L, Salvo N et al. Update on the systematic review of palliative radiotherapy trials for bone metastases. Clin Oncol (R Coll Radiol) 2012;24(2):112-24 doi: 10.1016/j. clon.2011.11.004
Ernesto Maranzano
Direttore SC Radioterapia Oncologica
Direttore del Dipartimento di Oncologia
Azienda Ospedaliera “S. Maria”, Terni
Il vomito e/o la nausea ovvero l’emesi da radioterapia e da radio-chemioterapia (RINV e CINV) si verificano molto più spesso di quanto venga registrato nella pratica clinica. Il radioterapista oncologo spesso sottostima il rischio di RINV e CINV e le linee guida sulla prescrizione degli antiemetici sono in genere poco conosciute. Il problema relativo alla sottovalutazione degli effetti collaterali andrebbe risolto attraverso una maggiore sensibilizzazione dei giovani radioterapisti oncologi alla gestione clinica e alle terapie di supporto dei pazienti (Figura 4).
Esistono fattori di rischio correlati al malato ed altri al trattamento. I fattori che predispongono il malato a un maggior rischio di emesi sono l’età <55 anni, il sesso femminile, la non assunzione di alcolici, l’ansia e aver avuto in precedenza nausea/vomito. Purtroppo, non esistendo studi che abbiano validato questi fattori di rischio individuali, gli stessi non possono essere utilizzati nella pratica clinica per stilare tabelle che stratifichino il rischio di emesi sulla base di variabili associate al malato. Di conseguenza il profilo di rischio di un singolo malato può far riferimento ai soli fattori di rischio di emesi associati al trattamento: dose singola e totale, frazionamento della dose, volume irradiato, tecnica di irradiazione, energia del fascio e la chemioterapia associata. Gli studi osservazionali sull’argomento hanno dato appropriata evidenza a tutti questi fattori di rischio.1,2
Sono stati pubblicati tre studi osservazionali sull’argomento. Uno svedese del 2009 che evidenzia come il problema prevalente sia la nausea associata alla radioterapia più che il vomito, che i giovani ne sono più colpiti e che prevale nell’irradiazione di addome e pelvi. I rimanenti due studi, realizzati in Italia (1999 e 2010) con la partecipazione di molti Centri e il reclutamento di più di 2.000 malati, hanno dato risultati sostanzialmente simili fra loro: si è registrato vomito, nausea o entrambi nel 28% dei casi, i fattori di rischio sono l’irradiazione dell’addome, campi con area >400 cm2 e la chemioterapia concomitante o pregressa. Questi due studi osservazionali hanno anche evidenziato che i farmaci antiemetici sono prescritti solo in una minoranza di casi (17%), nel 12% come profilassi e nel 5% come trattamento sintomatico (rescue): vale a dire che nella pratica clinica il radioterapista oncologo tende a sottovalutare il sintomo e che, anche in presenza di emesi accertata, a non prescrivere terapia antiemetica! 3-5
Nel malato sottoposto a radioterapia o a radio-chemioterapia, RINV e CINV possono essere prevenute evitando di far rientrare nel campo d’irradiazione gli organi a maggior rischio di emesi. Nel caso di volumi addominali non si dovrebbero comprendere nel campo d’irradiazione i recettori periferici vagali e splancnici, così come quando si trattano malati con tumori della sfera otoiatrica bisognerebbe evitare di includere nel volume di trattamento il centro vestibolare, il tronco encefalico e l’area postrema del IV ventricolo. A tal proposito sono stati di recente pubblicati lavori con linee guida relative alla contornazione TC o MRI delle strutture coinvolte nel RINV 6-10 (Figure 5 e 6).
La prevenzione secondaria è quella che viene fatta prescrivendo i farmaci antiemetici: gli antidopaminergici (in primis la metoclopramide), gli antiserotoninergici (5HT3-RA), il desametasone (DEX) e gli antagonisti delle neurochinine (NK1-RA) sono i farmaci più utilizzati. Gli studi randomizzati di fase III relativi
CTZ
Farmaci
Oppiacei
Anestetici
Glicosidi cardiaci
Chemioterapia
Anomalie metaboliche
Uremia
Chetoacidosi
Ipossia
CORTECCIA CEREBRALE
Emesi anticipatoria
CENTRO DEL VOMITO
RECETTORI PERIFERICI
(vagali e splancnici)
Ingestione di tossine
Chemioterapia
Radioterapia
CENTRO
VESTIBOLARE
Cinetosi
Malattie
dell’orecchio interno
Chemoreceptor trigger zone - Area postrema IV ventricolo

agli antidopaminergici ci dicono che i risultati che si ottengono sul controllo dell’emesi sono poco soddisfacenti. Esaminando gli studi successivi che riguardano l’utilizzo dei 5HT3-RA nell’irradiazione dell’addome superiore, emerge che sono superiori al placebo e alla metoclopramide, mentre l’aggiunta del DEX aumenta le percentuali di risposta. Risultati simili si evincono dagli studi di irradiazione corporea totale e di irradiazione emicorporea, approcci meno frequenti nell’attuale pratica clinica. In conclusione gli studi di fase III concordano sul fatto che i 5HT3-RA (ondansetron, granisetron, tropisetron, palonosetron) sono equivalenti fra di loro e consentono il controllo di nausea e vomito in una buona percentuale (5060%) dei malati sottoposti a radioterapia o a radiochemioterapia; l’aggiunta del DEX ne migliora l’efficacia. Il trattamento profilattico dell’emesi risulta più efficace di quello fatto alla comparsa del sintomo (rescue). Gli effetti collaterali più spesso associati ai 5HT3-RA sono il mal di testa e la stipsi.11-17
I farmaci antiemetici sono in genere somministrati per os o per via parenterale. Un particolare cenno va fatto al granisetron transdermico. Il suo uso è stato validato in uno studio randomizzato di chemioterapia in pazienti con un moderato o alto rischio emetogeno, dove lo si è confrontato col granisetron per os. È uno studio di equivalenza che ha fatto vedere come il controllo dell’emesi sia sovrapponibile nei due bracci. Per questo se ci si trova di fronte a un malato che ha difficoltà a ingoiare perché sottoposto a radio-chemioterapia (ovvero radioterapia) per un tumore della testa-collo oppure che abbia l’esofagite o che sia comunque incapace di ingerire una compressa, il granisetron transdermico può essere una valida alternativa al trattamento parenterale.18,19 L’efficacia del fosaprepitant, una NK1-RA, è stata esaminata in uno studio di fase III in cui donne con tumore della cervice uterina venivano trattate con radioterapia pelvica e cisplatino concomitante. La prevenzione dell’emesi veniva fatta con l’antiseroto -
Figura 5. In head and neck cancer pts, IMRT reduces some toxicities by reducing RT dose to many OAR; however, other tissues not irradiated using 3D-CRT may receive clinically significant dose causing undesirable side-effects including nausea and vomiting.
ninergico più il DEX più/meno NK1-RA. L’aggiunta del NK1-RA ha migliorato le percentuali di controllo dell’emesi nella quarta e quinta settimana di radiochemioterapia. 20 Studi recenti randomizzati di fase III hanno indagato sull’efficacia nel controllo dell’emesi con approcci non farmacologici: sia l’agopuntura che il tè verde non si sono dimostrati efficaci nel controllare il sintomo in modo convincente.21,22
Le linee guida per l’utilizzo di antiemetici più accreditate sono quella della Multinational Association for Supportive Care in Cancer (MASCC), associazione trans-nazionale che abbraccia Europa, Nord e Sud America, Australia e Canada, quelle della European Society for Medical Oncology (ESMO) e quelle dell’American Society for Clinical Oncology (ASCO).23-25 In tutte queste linee guida il rischio viene stratificato in base alla regione corporea irradiata e definito come segue: alto (>90%, irradiazione corporea totale), moderato (30-90%, addome superiore e irradiazione
cranio-spinale), basso (10-30%, cranio, testa-collo, torace e pelvi), minimo (<10%, estremità e mammella). MASCC e ESMO concordano sul fatto che nel rischio alto va prescritta una profilassi con un 5HT3-RA più DEX; nel rischio moderato un 5HT3-RA più o meno DEX; nel rischio basso, se si irradia l’encefalo, il DEX – perché ha anche un’azione antiedema – mentre quando si irradia la testa-collo, il torace o la pelvi, la profilassi può essere fatta col DEX, con un 5HT3-RA ovvero con un dopamine-RA; nel rischio minimo viene suggerito il rescue col DEX, con un 5HT3-RA ovvero con un antidopaminergico. I malati sottoposti a radioterapia ed a chemioterapia concomitante devono ricevere la terapia antiemetica corrispondente al livello di rischio associato alla chemioterapia (a meno che il livello di rischio correlato alla radioterapia sia maggiore). L’ASCO dà all’incirca gli stessi suggerimenti, con due discrepanze rispetto alle linee guida MASCC/ESMO: nel rischio moderato suggerisce la profilassi con un 5HT3-RA e l’aggiunta del DEX nei
Figura 6. Stereotactic Body Radiotherapy (SBRT): a strategy to limit the irradiation of abdominal organ at risk for emesis.
primi 5 giorni di radioterapia; nel basso rischio propende per il rescue piuttosto che per la profilassi col DEX, con un 5HT3-RA ovvero con un antidopaminergico. Uno scenario evidenziato dalle linee guida ASCO è quello relativo a malati con patologie neoplastiche che prevedono schemi di trattamento alternato: iniziano con la radio-chemioterapia, continuano con la radioterapia e poi ricominciano con la radio-chemioterapia. Un esempio è il malato con carcinoma faringeo sottoposto a radio-chemioterapia con cisplatino alla dose di 100mg/m2 nelle 1a, 4a e 7a settimana di trattamento dove è prevista una profilassi antiemetica con 3-4 farmaci (5HT3-RA + DEX + NK1-RA ± Olanzapine). Mentre nella 2a, 3a, 5a e 6a settimana di radioterapia esclusiva le linee guida prevedono profilassi o rescue con DEX, con un 5HT3RA ovvero con un antidopaminergico. In questo caso lo stesso malato passa dalla categoria ad alto rischio di emesi associata alla terapia con cisplatino alla categoria a basso rischio di emesi correlata alla sola radioterapia sul distretto testa-collo.
I lavori pubblicati recentemente in letteratura hanno ribadito quanto già emerso negli studi osservazionali, vale a dire:
i radioterapisti oncologi (compresi i più giovani, specializzandi e neospecialisti) indipendentemente dal Paese in cui operano sottovalutano nella pratica clinica il problema RINV e CINV ritenendo che interessi solo una minoranza dei malati trattati;
la terapia antiemetica è spesso prescritta alla comparsa della nausea e/o del vomito piuttosto che come profilassi;
le linee guida sull’uso dei farmaci antiemetici sono poco conosciute;
la terapia antiemetica in genere viene prescritta per tutta la durata del ciclo di radioterapia.26-28
1. Feyer PC, Stewart AL, Titlbach OJ (1998) Aetiology and prevention of emesis induced by radiotherapy. Support Care Cancer 6(3):256-260
2. GI Symptoms: Radiation-induced Adverse Effects (2017). Chiu N, Pulenzas N, Maranzano E., De Angelis C, Zhang N, Yu H.H.M, Chow E. Handbook of supportive and palliative Radiation Oncology: pp 85-100
3. Italian Group for Antiemetic Research (1999) Radiationinduced emesis: a prospective observational multicenter Italian trial. The Italian Group for Antiemetic Research in Radiotherapy. Int J Radiat Oncol Biol Phys 44:619–625
4. Enblom A, Bergius Axelsson B, Steineck G, et al. (2009) One third of patients with radiotherapy-induced nausea consider their antiemetic treatment insufficient. Support Care Cancer 17:23–32
5. Maranzano E, De Angelis V, Pergolizzi S, et al. (2010) A prospective observational trial on emesis in radiotherapy: analysis of 1020 patients recruited in 45 Italian radiation oncology centres. Radiother Oncol 94:36–41
6. Beddok A, Faivre JC, Coutte A, et al. (2019) Practical contouring guidelines with an MR-based atlas of brainstem structures involved in radiation-induced nausea and vomiting. Radiother Oncol;130:113-120
7. Ciura K, McBurney M, Nguyen b, et al. (2011) Effect of Brain Stem and Dorsal Vagus Complex Dosimetry on Nausea and Vomiting in Head and Neck Intensity Modulated Radiation Therapy. Med Dosim; 36(1): 41–45
8. Kocak-Uzel E, Gunn GB, Colen RR, et al. Beam path toxicity in candidate organs-at-risk: assessment of radiation emetogenesis for patients receiving head and neck intensity modulated radiotherapy (2014). Radiother Oncol 111, 281-288
9. Lee VHF, NG SCY, Leung TW, et al. (2012) Dosimetric predictores of radiation-induced acute nausea and vomiting in IMRT for nasopharingeal cancer. Int J Radiat Oncol Biol Phys, Vol 84, No.1, 176-182
10. Choung MD, Springett GM, and Frelich JM (2013) Stereotactic body radiotherapy for locally advanced and borderline resectable pancreatic cancer is effective and well tolerated. Int J Radiat Oncol Biol Phys, Vol 86, No.3, 516-522
11. Dennis K, Nguyen J, Presutti R, et al. (2012) Prophylaxis of radiotherapy-induced nausea and vomiting in the palliative treatment of bone metastases. Support Care Cancer 20:1673–1678
12. McKenzi E, Chan D, Parsafar S, et al. (2019) Evolution of antiemetic studies for radiation-induced nausea and vomiting within an outpatient palliative radiotherapy. Support Care Cancer, doi.org/10.1007/s00520-019-04870-6
13. Dennis K, Maranzano E, De Angelis, et al. (2011) Radiotherapy-induced nausea and vomiting. Expert Rev Pharmaco-economics Outcomes Res Vol 11, No. 6, 681-692
14. Wong R, Paulk N, Ding K, et al (2006) 5-hidroxitriptamine-3 receptor antagonist with or without short-course dexamethasone in the prophylaxis of radiation-induced emesis: a placebo-control randomized trial of the National Cancer Institute of Canada clinical trials group (SC19). J Clin Oncol, Vol24, No.21, 3458-3464.
15. Horiot JC (2004) Orophylaxis versus treatment: is there a better way to manage radiotherapy-induced nausea and vomiting? Int J Radiat Oncol Biol Phys, Vol.60, No. 4, 1018-1025
16. Maranzano E, Bellavita R., De Angelis V, et al (2004) Double-blind randomized clinical trial comparing prophylaxis vs. rescue treatment in patients undergoing fractionated upper abdomen radiotherapy. Radiother Oncol 73 (Suppl 1):S388
17. Mystakidou K, Katsouda E, Linou E, et al (2006) Prophylactic tropisetron vs. rescue tropisetron in fractionated radiotherapy to moderate or high emetogenic areas: a prospective randomized open label study in cancer patients. Med Oncol 23:251-262
18. Howell J et al. Efficacy, safety and tolerability of transdermal granisetron patch for prevention of multiday chemotherapyinduced nausea and vomiting: phase III trial (Abstr No. PA-04) (2008) Support Care Cancer, 6, 335.
19. Keating GM, Duggan ST, and Curran MP (2012). Transdermal granisetron: a guide to its use in preventing nausea and vomiting induced by chemotherapy. CNS Drugs, Sep 1;26(9):787-90
20. Ruhlmann CH, Christensen TB, Dohn LH, et al. (2016) Efficacy and safety of fosaprepitant for the prevention of nausea and emesis during 5 weeks of chemo-radiotherapy for cervical cancer (the GAND-emesis study): a multinational, randomized, placebo-controlled, double-blind, phase 3 trial. Lancet Oncol 17:509–518
21. Enblom A, Johnsson A, Hammar M, et al. (2012) Agopuncture compared with placebo acgopuncture in radiotherapyinduced nausea - a randomized controlled study. Ann Oncol 23, 1353-1361
22. Emami H, Nikoobin F, and Reza Ziva H (2014). Doubleblinded, randomized, placebo-controlled study to evaluate the effectiveness of green tea in preventing acute gastrointestinal complications due to radiotherapy. J Res Med Sci Vol.19, No.5, 445-450
23. Ruhlmann CH, Jahn F, Jordan K, Dennis K, Maranzano E, et al. (2017) 2016 updated MASCC/ESMO consensus recommendations: prevention of radiotherapy-induced nausea and vomiting. Support Care Cancer, 25(1):309-316
24. Heskett PJ, Kris MG, Basch E, et al (2017) Antiemetics: American society of clinical oncology clinical practice guideline update. J Clin Oncol, Vol 35, No. 28:3241-3263
25. McKenzie E, Zaki P, Raman S, et al. (2019) Radiation-induced nausea and vomiting: a comparison between MASCC/ESMO, ASCO, and NCCN antiemetic guidelines. Support Care Cancer Vol. 27,No.3:783-791
26. Dennis K, Makhani L, Maranzano E, et al. (2012) Timing and duration of 5-HT3 receptor antagonist therapy for the prophylaxis of radiotherapy-induced nausea and vomiting: a systematic review of randomized and non-randomized studies. J Radiat Oncol 2:271– 284
27. Dennis K, Zhang L, Lutz S, Maranzano E, et al. (2012) International patterns of practice in the management of radiation therapy induced nausea and vomiting. Int J Radiat Oncol Biol Phys 84:e49–e60
28. Dennis K, Zhang L, Lutz S, Maranzano E, et al. (2013) International radiation oncology trainee decision making in the management of radiotherapy-induced nausea and vomiting. Support Care Cancer Vol. 21,No.7:2041-8

Realizzato con un contributo non condizionante di