6 minute read
BIOWISSENSCHAFTEN
from ChemieXtra 1-2/2021
by SIGWERB GmbH
Neue Erkenntnisse in der Immunologie
Natürliche Killerzellen mit Erinnerung
Advertisement
Gute Neuigkeiten für das menschliche Immunsystem: Forschende der Medizinischen Universität Wien konnten bestimmten Natürlichen Killerzellen (NK-Zellen) neu eine immunologische Erinnerungsfunktion zuschreiben. Bisher galten diese Immunzellen als unspezifisch. Rund ein Drittel aller menschlichen NK-Zellen der Leber kann sich demnach an Viren erinnern und somit spezifisch reagieren. Die Erkenntnisse wurden in der Fachzeitschrift «Science Immunology» veröffentlicht.
Das Immunsystem schützt den Organismus auf zwei Arten: Unser Körper beherbergt Immunzellen der unspezifischen Immunabwehr. Diese Zellen greifen allgemein unerwünschte Eindringlinge an. Neben diesen unspezifischen Immunzellen fliessen im Blut und im Lymphsystem aber auch die Zellen des spezifischen Immunsystems. Diese erkennen quasi den «Fingerabdruck» des eindringenden Erregers dank spezifischen Antigen-Rezeptoren und bilden Gedächtniszellen aus, damit sie das Pathogen immer wieder erfassen können. Die bekanntesten Vertreter dieser Gruppe sind die B- und T-Zellen. Sie gehören zu den Lymphocyten, weshalb sie auch B- und T-Lymphocyten genannt werden.
Ein weiterer Lymphocyt erinnert sich
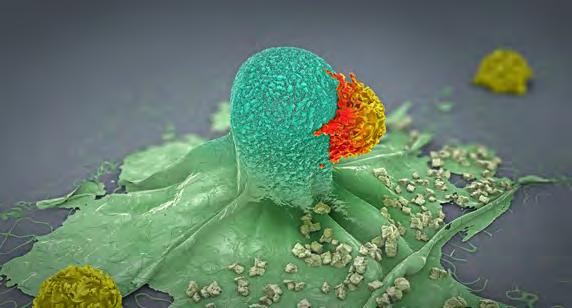
Zu den Lymphocyten gehören auch die Natürlichen Killerzellen (NK-Zellen). Im Gegensatz zu seinen «Geschwistern» besitzt dieser Lymphocyt jedoch keine spezifischen Antigen-Rezeptoren und bildet keine Gedächtniszellen aus. Dies ist die allgemeingültige Erklärung zur Funktion von NK-Zellen – bis jetzt. Denn Forschende unter der Leitung von Georg Stary und der Mitwirkung von Matthias Farlik konnten einer Untergruppe der zytotoxischen NKZellen eine immunologische Erinnerungsfunktion zuschreiben. Rund ein Drittel aller menschlichen NK-Zellen der Leber kann sich demnach an Viren erinnern und somit spezifisch reagieren. Damit gelten diese Zellen als interessantes Target, um sie für das menschliche Immunsystem gegen Infektionen und Viren prophylaktisch zu nutzen.
Ein Lymphocyt erfasst eine Krebszelle.
Entlarvt bestimmte Hepatitis-Viren
In der im Journal «Science Immunology» veröffentlichten Studie zeigten die Wissenschafterinnen und Wissenschaftler der Medizinischen Universität Wien, dass es in der Leber – das Organ gilt generell als grosses Reservoir von NK-Zellen – eine Subgruppe von NK-Zellen gibt, die in der Lage ist, etwa Infektionen bei Hepatitis A und B zu bekämpfen und sich auch daran zu erinnern. Diese Untergruppe zeigte auch ein anderes, einzigartiges Gen-Expressionsprofil im Vergleich zu den anderen NK-Zell-Gruppen.
Mögliches Target für Therapien
«Unsere Studienergebnisse zeigen, dass in dieser besonderen Gruppe von NK-Zellen antigenspezifische Prozesse ablaufen und wirksam sind. Daher könnte sich diese NKZell-Untergruppe für spezifische, therapeutische, aber auch prophylaktische Impfstrategien eignen», fasst Stary zusammen. Gesunde Menschen haben etwa einen Anteil von 5 bis 15 Prozent an NK-Zellen im Blut, wobei die Leber ein Reservoir für diese Zellen bildet. Als nächsten Schritt untersuchen die Autoren die Rolle dieser NK-Zellen im Verlauf von Infektionskrankheiten. Ausserdem wollen sie untersuchen, ob bei Patienten und Patientinnen mit seltenen Erkrankungen mit Defekten im Bereich von T- und B-Lymphocyten diese NK-Zellen fehlende Gedächtnisfunktionen zusätzlich übernehmen können.
Originalpublikation Victoria Stary et al., «A discrete subset of epigenetically primed human NK cells mediates antigen-specific immune responses.» Sci. Immunol. (2020); DOI: 10.1126/sciimmunol.aba6232.
Medienmitteilung Ludwig-Boltzmann-Gesellschaft www.lbg.ac.at
Mit Proteomik zu neuen Antibiotika
Wo dockt der Wirkstoff erfolgreich an?
Es gibt immer mehr antibiotikaresistente Erreger. Die Suche nach neuen antibiotischen Wirkstoffen läuft daher auf Hochtouren. Neue Substanzen sollen die Erreger auf unkonventionellem Weg angreifen. Wie analysiert werden kann, ob ein neues Antibiotikum einen neuen Wirkmechanismus aufweist, hat das Team des Centrums für systembasierte Antibiotikaforschung (Cesar) der Ruhr-Universität Bochum (RUB) in zwei Publikationen beschrieben.
Die Forscherinnen und Forscher, darunter viele Studierende der RUB, haben über Jahre hinweg Veränderungen des Proteoms des Modellorganismus Bacillus subtilis nach der Behandlung mit verschiedenen Wirkstoffen untersucht. «Die aktuelle Arbeit ist eine Zusammenstellung der Antworten auf fast 100 Substanzen», erklärt Prof. Dr. Julia Bandow, Inhaberin des Lehrstuhls für Angewandte Mikrobiologie und Leiterin des Cesar. Die Antwort des Bakteriums auf Antibiotikabehandlung stellt gleichsam einen Spiegel des physiologischen Stresses dar: Sorgt das Antibiotikum beispielsweise dafür, dass die Fettsäurebiosynthese gestört wird, werden die dafür nötigen Enzyme hochreguliert. «Da man recht gut versteht, wie Bacillus subtilis sich an wechselnde Bedingungen anpasst und wie das Bakte-


Dr. Sina Schäkermann ist Hauptautorin eines der beiden Berichte, die zur Proteom-basierten Suche nach neuen antibiotisch wirksamen Substanzen veröffentlicht wurden.
rium auf unterschiedliche Stressfaktoren reagiert, können wir von der Proteomantwort oft darauf zurückschliessen, welcher Prozess in der Zelle durch ein neues Antibiotikum beeinträchtigt ist», erklärt Julia Bandow den sogenannten Comparison-ofProteomic-Responses-Ansatz, kurz CoPR.
Ähnliche oder neue Wirkweise
Auf dieser Basis lässt sich ablesen, ob eine vielversprechende neue antibiotische Substanz ähnlich wirkt wie eine der bereits bekannten oder wirklich einen neuen Wirkmechanismus hat. «Wir freuen uns, wenn wir neue Proteomantworten sehen, denn das deutet darauf hin, dass die Substanz anders wirkt als die bisher untersuchten Antibiotika», erklärt die Forscherin. In diesem Fall müsse man sich intensiv mit den regulierten Proteinen beschäftigen, um der Ursache für die Antwort und damit dem Wirkmechanismus auf die Spur zu kommen.
Schweizer Wissenschaftspreis Marcel Benoist Vergangenes Jahr erhielt der Schweizer Pionier für Proteomik Ruedi Aebersold den begehrten Marcel-Benoist-Preis. Aebersold lehrt und forscht an den beiden Zürcher Hochschulen ETH und Universität Zürich. Er optimierte analytische Methoden, um die Gesamtheit der Proteine eines Organismus zu erfassen. In diesem Forschungsfeld ist er weltweit bekannt. 2020 wurde Aebersold emeritiert.

Dr. Christoph Senges mit Julia Bandow, Leiterin des Centers für systembasierte Antibiotikaforschung.

Als Beispiele haben die Forscherinnen und Forscher das erste jemals am Menschen eingesetzte Antibiotikum Salvarsan, das möglicherweise als Antibiotikum taugliche antirheumatische Auranofin, ein neues atypisches Tetracyclin sowie die neue Hemmstoffklasse der trans-Translationsinhibitoren näher untersucht.
Welches Protein das Ziel ist
Bei neuen Antibiotika mit innovativen Wirkmechanismen ist es im nächsten Schritt essenziell, das direkte molekulare Ziel in der bakteriellen Zelle aufzuklären. Dazu wurde in der zweiten Studie die Anwendbarkeit einer bereits bekannten Wirkort-Analytik untersucht. Die Forscherinnen und Forscher inkubierten die Proteine aus Bakterienzellen mit einem zu untersuchenden Wirkstoff, so dass dieser an sein Ziel binden konnte. Im nächsten Schritt wurden die Proteine chromatografisch getrennt, wodurch man das Gemisch in seine einzelnen Bestandteile zerlegt. Der Wirkstoff bleibt dabei an das Zielprotein gebunden. Mittels Massenspektrometrie suchte das Forschungsteam dann nach dem Wirkstoff. Neben dem an Proteine gebundenen Wirkstoff lässt sich auch der überschüssige Wirkstoff finden, der frei vorliegt. «Wenn man den Wirkstoff der gleichen chromatografischen Trennung ohne Proteine unterzieht, kann man feststellen, in welchen Fraktionen der freie Wirkstoff vorliegt. Die anderen Fraktionen sind dann die, die das Zielprotein enthalten», so Julia Bandow. In seiner Arbeit konnte das Team von Cesar nicht nur den Wirkort eines gut untersuchten Antibiotikums bestätigen, sondern auch klären, dass mithilfe dieser Technik viele mögliche Antibiotikazielorte erfasst werden können. «Das bestätigt das Potenzial dieser Methode zur Identifizierung neuer Wirkorte», so Bandow. Das Centrum für systembasierte Antibiotikaforschung wird an der RUB in Zusammenarbeit mit der Lead Discovery Center GmbH (Dortmund) aufgebaut. Es soll der Erschliessung neuer Wirkstoffe dienen und die Vernetzung mit Akteuren aus Wirtschaft und Hochschullandschaft regional und überregional intensivieren.

Originalpublikation Christoph H. R. Senges, Jennifer J. Stepanek et al., «Comparison of proteomic responses as global approach to antibiotic mechanism of action elucidation», Antimicrobial Agents and Chemotherapy (2020); DOI: 10.1128/AAC.01373-20
Kontakt Prof. Dr. Julia Bandow Ruhr-Universität Bochum Universitätsstrasse 150 D-44801 Bochum +49 234 32 23102 julia.bandow@rub.de www.ruhr-uni-bochum.de
Mein ERP. Macht mir die Entscheidungen leichter.
Die richtigen Entscheidungen treffen – das ist jetzt das Wichtigste für jedes Unternehmen. Detaillierte Reports, die aktuellsten Daten aus der Produktion, die Entwicklung der Auftragslage: Das CSB-System gibt Ihnen genau diese Transparenz auf Knopfdruck. Damit Sie auch in unsicheren Zeiten sicher entscheiden können.










