13 minute read
MEDIZIN
from ChemieXtra 7-8/2020
by SIGWERB GmbH
Forschung für bessere Immuntherapie
Blutgefässe versperren den Weg
Advertisement
Der gleichzeitige Einsatz von Antikörpern, die auf zwei verschiedenen Wirkungsmechanismen beruhen, führt zu einer effektiveren Zerstörung von Tumoren. Dies zeigt eine im Fachjournal «Pnas» veröffentlichte Studie von Onkologen und Wissenschaftlern der Universität Basel an Tiermodellen. Davon profitieren könnten vor allem Patientinnen und Patienten mit Tumoren, die nicht auf die bereits verfügbaren Immuntherapie-Behandlungen ansprechen.
In den letzten Jahren haben Immuntherapien gegen Krebs grosse Hoffnungen geweckt. Diese neuartigen Therapien rekrutieren das körpereigene Immunsystem zur Zerstörung des Krebsgewebes. Einen vielversprechenden Effekt in vorklinischen Studien zeigte ein Antikörper, der den CD40-Rezeptor auf der Oberfläche von Immunzellen aktiviert und so die Produktion von natürlichen T-Killerzellen ankurbelt. Doch in den darauffolgenden klinischen Studien blieb der Erfolg des CD40-Antikörpers weit hinter den Erwartungen zurück – weniger als 20 Prozent der Patienten sprachen darauf an. Die Forschungsgruppe «Cancer Immunology» der Universität Basel zeigte jetzt im Tiermodell, dass sich die Wirkung des Anti-CD40- Antikörpers durch die Kombination mit zwei weiteren Antikörpern, die an den Blutgefässen des Tumors ansetzen, erheblich erhöhen lässt.
Den Weg ins Innere des Tumors öffnen
Ausgangspunkt für die Studie war die Beobachtung, dass die Gabe von AntiCD40-Antikörpern zwar, wie vorgesehen, zu einer Vermehrung von T-Killerzellen führt – doch diese lassen sich dann nur in den Randbereichen und nicht im Inneren des Tumors nachweisen. Die Forschenden vermuteten, dass der Grund dafür in der Beschaffenheit der Blutgefässe des Tumors liegt. «Normalerweise sind die Blutgefässe eines Tumors nicht dicht oder sie sind ver kümmert. Deshalb gibt es für die T-Killerzellen keinen guten Weg ins Innere», sagt Studienleiter Dr. Abhishek Kashyap. «Unsere Hypothese war: Nur wenn es genug gesunde Blutgefässe gibt, können die T-Killerzellen in den Tumor eindringen und ihn zerstören.» Deshalb kombinierten sie den Anti-CD40-Antikörper mit zwei weiteren, sogenannten anti-angiogenetischen Antikörpern, welche die Blutgefässe von Tumoren stabilisieren können. Einer der verwendeten anti-angiogenetischen Antikörper ist unter dem Namen Avastin schon für die Krebs-Therapie zugelassen, der andere befindet sich noch in der klinischen Entwicklung. Alle Antikörper wurden von der Firma Roche zur Verfügung gestellt. Diese neue Kombination von Antikörpern testeten die Forschenden dann in mehre ren Tiermodellen für verschiedene Krebsarten wie Darm-, Brust- oder Hautkrebs. Wie erwartet sorgte die Kombination der drei Antikörper bei allen Krebsarten für eine signifikante Verbesserung bei der Zerstörung des Tumorgewebes. Eine genauere Analyse zeigte zudem, dass dieser Erfolg auf dem vorhergesagten Mechanismus beruhte: Durch die Zugabe der beiden anti-angiogenetischen Antikörper verfügten die Tumoren über mehr intakte Blutgefässe. Überraschenderweise zeigten die Untersuchungen aber auch, dass die Antikörper-Kombination das Immunsystem auf vielfältige Weise sehr effektiv stärkt – etwa durch die Aktivierung von Genen, die Produktion von Zytokinen, eine bessere Durchdringung des Tumors mit Killerzellen und durch die Förderung einer tumorfeindlichen Entzündungsreaktion in der Umgebung des Tumors. «Unser Ergebnis zeigt, wie wichtig es ist, die Biologie von Tumoren zu verstehen», sagt Kashyap. Er glaubt, dass vor allem Patientinnen und Patienten mit «kalten» Tumoren – also Tumoren, die nicht gut auf eine Immuntherapie ansprechen – von
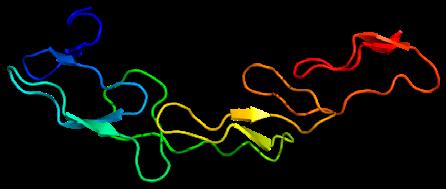
Für die Immuntherapie gegen Krebs wird das CD40-Protein (Bild) aktiviert, das sich auf der Oberfläche von Immunzellen befindet. Forscher berichten, dass der positive Effekt der Therapie zunimmt, wenn gleichzeitig die Blutgefässe des Tumors stabilisiert werden.
dieser neuen Kombination profitieren könnten. «Durch die anti-angiogenetischen Antikörper können wir die ‹kalten› Tumoren möglicherweise ‹heiss› machen, so dass die Immuntherapie besser funktioniert.» Mittlerweile gibt es auch schon einige frühe klinische Studien, die vergleichbare Therapien beim Menschen testen. Nach Ansicht von Kashyap besteht die Stärke der Studie nicht nur in den grossen gemessenen Effekten, sondern auch in der Tatsache, dass mehrere verschiedene Labors die gleichen Ergebnisse erzielten: Die Experimente wurden am Universitätsspital Basel, an der EPFL und im Roche Innovation Center Zürich durchgeführt. Dies bestätigt auch Prof. Alfred Zippelius, Professor für Translationale Onkologie an der Universität Basel und Letztautor der Studie: «Das Innovations- und Umset zungspotenzial dieser Arbeit ist das Ergebnis einer engen und exzellenten Zusammenarbeit zwischen angewandter und Grundlagenforschung, zwischen Universität Basel und der EPFL und schliesslich zwischen Wissenschaft und Industrie.»
Medienmitteilung Universität Basel www.unibas.ch
Une maladie génétique récessive
Un patient peut changer la médecine
Des chercheurs de l’Université de Genève (UNIGE) ont découvert un nouveau gène provoquant une cécité et une cardiomyopathie. Ils ont ensuite pu arrêter la progression de la maladie oculaire et traiter l’atteinte cardiaque grâce à l’administration d’un complément alimentaire.
Notre génome est composé de 20000 gènes, tous susceptibles de provoquer des pathologies. On estime qu’il reste 7000 gènes inconnus responsables de maladies génétiques récessives, c’est-à-dire découlant de mutations présentes sur les deux copies d’un gène, héritées de chaque parent. Des chercheurs de l’Université de Genève (UNIGE) ont identifié 45 nouveaux gènes responsables de cécités ou de déficiences intellectuelles. Leur intérêt s’est porté particulièrement sur le gène SLC6A6, qui transporte un acide aminé indispensable au fonctionnement de la rétine et du muscle cardiaque: la taurine. En cas de mutations du gène SLC6A6, la personne atteinte manque de taurine. Elle perd progressivement la vue jusqu’à devenir aveugle en quelques années et développe une faiblesse cardiaque. Les généticiens de l’UNIGE ont émis l’hypo thèse qu’il était possible de combler ce manque grâce à une complément de taurine et en ont administré à une petite fille atteinte de cette maladie, permettant de stopper la progression de la dégénérescence visuelle et de traiter sa cardiomyopathie. Une première dans le traitement des maladies génétiques récessives à lire dans la revue «Human Molecular Genetics». Les maladies génétiques récessives, comme la mucoviscidose, résultent d’une mutation sur les deux copies d’un même gène, héritées de chaque parent. Afin de pouvoir identifier toujours plus de gènes responsables de telles conditions, des chercheurs de l’UNIGE, en collaboration avec des scientifiques pakistanais, ont étudié les génomes de 500 familles pakistanaises ayant des enfants malades et en bonne santé. «Nous nous sommes intéressés aux familles pakistanaises, car celles-ci pratiquent encore couramment la

Photographies du fond d’œil gauche du patient au départ et après 24 mois de supplémentation en taurine, montrant la stabilité anatomique avec préservation des photorécepteurs.
consanguinité en favorisant à plus de 50% les mariages entre cousins germains, explique Stylianos Antonarakis, professeur honoraire à la Faculté de médecine de l’UNIGE. En effet, les risques de développer une maladie génétique récessive sont augmentés par la consanguinité, car environ 12 % du génome est identique chez des cousins.»
Un nouveau gène identifié
Une famille a particulièrement intéressé les chercheurs: les deux parents, cousins germains en bonne santé, ont quatre enfants dont deux malades: un garçon de 15 ans, devenu complètement aveugle en quelques années, et une fille de quatre ans, perdant progressivement la vue mais encore capable de discerner les formes et les couleurs. «Avec l’aide de l’Université médicale de Khyber au Pakistan, nous avons collecté le sang de chaque membre de la famille et le séquençage de leur génome a montré que leur maladie était liée à une mutation du gène SLC6A6», relève Muhammad Ansar, chercheur au Département de génétique de la Faculté de médecine de l’UNIGE. Ce gène produit une protéine de la membrane cellulaire qui transporte la taurine, un acide aminé important, notamment pour le fonctionnement de la rétine et du muscle cardiaque. «Il s’agit d’un complément alimentaire que l’on trouve en grande quantité dans certaines boissons énergisantes», précise-t-il. Les patients souffrant de cette maladie ont un taux extrêmement bas de taurine dans le sang; le professeur Keith Henry de l’Université du Dakota du Nord a montré que l’anomalie génétique dans cette famille réduisait la capacité de transport de la taurine à 15 % de son activité normale.
Une maladie récessive réversible ?
Les scientifiques ont émis l’hypothèse qu’il était possible de stopper l’évolution de la maladie en administrant de la taurine à
ces enfants. Ils ont alors fait venir la famille à Genève pour mener des investigations détaillées sur cette maladie génétique rare. En plus de l’atteinte visuelle progressive, malheureusement complète chez le garçon, les médecins ont diagnostiqué une atteinte du muscle cardiaque chez les deux enfants. La petite fille conservait encore une vision résiduelle. La taurine n’étant pas un médicament mais un complément alimentaire, la commission d’éthique de l’Etat a donné son accord à une administration par voie orale. «Nous avons donné 100 mg par kg de taurine chaque jour aux enfants, à poursuivre sur le long-terme, et nous avons organisé des suivis ophtalmologique et cardiaque réguliers au Pakistan », souligne Emmanuelle Ranza, médecin généticien aux Hôpitaux universitaires de Genève (HUG) et l’UNIGE en charge de la partie clinique de cette étude. Les résultats ne se font pas attendre. En trois jours, leur taux de taurine dans le sang passe de 6 à 85 μmol/l, atteignant des seuils normaux. Au bout de deux ans, la cardiomyopathie a totalement disparu chez les deux enfants. De plus, la dégénérescence de la vue de la fillette a été stoppée, marquant même une amélioration qui lui redonne une autonomie dans ses déplacements. Cette évolution a été malheureusement impossible pour le garçon qui avait déjà perdu toute sa rétine. «Ces résultats sont exceptionnels, car c’est la première fois qu’un complément alimentaire administré par voie orale permet un traitement de la rétine et du cœur avec succès, s’enthousiasme Stylianos Antonarakis. Cette petite fille a ouvert la voie à la guérison potentielle de nouveau-nés atteints de la même maladie récessive. Un patient peut changer l’histoire de la médecine!» En effet, les chercheurs estiment qu’il y a potentiellement 6000 bébés au monde, et environ 300 dans les pays européens et nord-américains, qui pourraient être atteints de la même maladie liée à SLC6A6. «Notre objectif est aujourd’hui de dépister précocement les nouveau-nés affectés par cette condition, afin de pouvoir les traiter dès la naissance avec un complément de taurine et de potentiellement éviter l’apparition de symptômes», poursuit Stylianos Antonarakis. L’objectif des généticiens est également de continuer à identifier de nouveaux gènes responsables de maladies récessives, et ce d’au tant plus qu’ils ont maintenant la preuve que certaines d’entre elles peuvent être traitées efficacement.

Contact Stylianos Antonarakis Université de Genève 24 rue du Général-Dufour CH-1211 Genève 4 +41 22 379 57 07 stylianos.antonarakis@unige.ch www.unige.ch


Rotronic HygroLab
QF 2500
Für die Bio- und Pharmaindustrie
Quattroflow™ QF2500
•
Durchflussbereich von 50 bis 2.500 l/h
Single-Use oder
Multiple-Use Ausführung
Neues Pumpenkammerdesign
Lineare Strömungsleistung
ALMATECHNIK AG
Rebgasse 2
CH-4314 Zeiningen Tel. +41 61 853 09 09 Fax +41 61 853 09 08 info@almatechnik.ch www.almatechnik.ch
Das neue Labormessgerät für Wasseraktivität, Feuchte und Temperatur

Messen Sie die Wasseraktivität von bis zu 4 Produktproben gleichzeitig oder asynchron. Einfach, schnell und zuverlässig!
AW-QUICK für Resultate in 5 Min. Bis 4 Messköpfe anschliessbar Automatisch generierte Messprotokolle Remote Control via PC/Tablet 4 USB Anschlüsse
Mehr Infos unter: www.rotronic.ch/aw
Sind Proteine aus dem Labor aufschlussreich?
Parkinson – Gewebeproben sind gefragt
Parkinson und Multisystematrophie (MSA) – beides neurodegenerative Erkrankungen – gehen mit der Ansammlung sogenannter Alpha-Synuclein-Proteine im Gehirn einher. Forschende haben den molekularen Aufbau dieser Protein-Ablagerungen untersucht und sind dabei auf eine grosse strukturelle Vielfalt gestossen. Die im Wissenschaftsjournal «Nature Communications» veröffentlichten Ergebnisse deuten darauf hin, dass Parkinson möglicherweise mit verschiedenen Arten von Protein-Aggregaten zusammenhängen könnte.
Das Protein Alpha-Synuclein kommt im Körper natürlicherweise vor und ist ver mutlich für die Signalübertragung zwischen Nervenzellen von Bedeutung. Es tritt sowohl an der Zellmembran auf als auch gelöst – quasi frei treibend – im Zellinneren. Neben diesen «normalen» Varianten gibt es jedoch noch weitere, die mit Hirnerkrankungen verknüpft sind. Das ist beispielsweise der Fall bei der ParkinsonErkrankung und der MSA. Beide Erkrankungen können mit diversen neurologischen Beeinträchtigungen einhergehen, einschliesslich Bewegungsstörungen. Bei Parkinson und MSA verkleben Alpha-Synuclein-Moleküle miteinander. Infolgedessen entstehen längliche Aggregate, die sich im Inneren von Nervenzellen und anderen Gehirnzellen niederschlagen. «Diese Ablagerungen tauchen nach und nach in diversen Hirnregionen auf. Sie sind ein typisches Krankheitsmerkmal», erläutert Prof. Markus Zweckstetter, Forschungsgruppenleiter am Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE) und am Max-Planck-Institut für biophysikalische Chemie (MPI-BPC). «Es gibt Hinweise dafür, dass diese Aggregate für die Nervenzellen schädlich sind und die Krankheitsentwicklung vorantreiben.»
Proteine direkt aus dem Gewebe entnommen
Diese Ablagerungen sind ein möglicher Ansatzpunkt für Medikamente. Sie könn
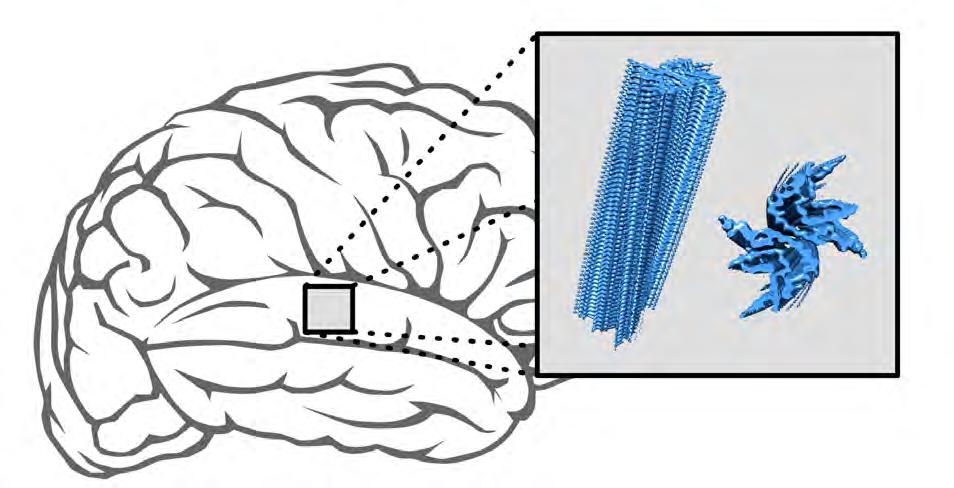
Neue Erkenntnisse über Hirnerkrankungen: Bei Parkinson und Multisystematrophie lagern sich Proteine schichtweise zu länglichen Aggregaten (blau) zusammen, die sich im Gehirn anhäufen. Göttinger Forscher haben die molekulare Struktur dieser Proteinablagerungen analysiert. Es stellte sich heraus, dass die Protein-Strukturen der klinischen Proben sich von den künstlich aggregierten unterscheiden und bei Parkinson-Patienten überraschend vielfältig sind.
ten das Zusammenlagern der Alpha-Synuclein-Moleküle unterbinden oder schon bestehende Aggregate auflösen, so die Idee. Um mögliche Andockstellen für Wirkstoffe identifizieren zu können, sind Daten über die Feinstruktur dieser Protein-Ansammlungen erforderlich. Die Frage ist also: Welche Gestalt – auch «Faltung» genannt – nehmen die Alpha-Synuclein-Moleküle innerhalb der Aggregate an? Informationen dazu gab es bisher nur aus Laborexperimenten. «Bislang hatte man

den molekularen Aufbau von Aggregaten untersucht, die sozusagen im Reagenzglas hergestellt wurden. Wir haben uns die Frage gestellt, wie gut diese die Situation beim Patienten widerspiegeln. Deshalb haben wir uns Aggregate angeschaut, die aus Gewebeproben von Patienten generiert wurden», so Zweckstetter. «Dabei haben wir eng mit internationalen Partnern zusammengearbeitet. Die Gewebeproben stammen aus Australien, die Aggregate wurden in Südkorea hergestellt. In Göttin
Morbus Parkinson Die Parkinsonkrankheit ist seit über 200 Jahren bekannt. Dennoch bleiben die Ursachen für diese neurodegenerative Erkrankung bis zum heutigen Tag ein Rätsel. In der Schweiz sind laut der Schweizerischen Parkinsonvereinigung 15 000 Menschen betroffen. Weltweit sind rund 10 Prozent der erkrankten Personen unter 50 Jahre alt.


Multisystematrophie (MSA) Im Gegensatz zum klassischen Parkinson (Morbus Parkinson) gibt es bei der Multisystematrophie (MSA) schlechtere Therapiemöglichkeiten. Sie bestehen im Wesentlichen aus der Milderung der Symptome. Das Fortschreiten der Er krankung kann gegenwärtig nicht verzögert werden, wodurch die Lebenserwartung der betroffenen Personen sich stark verkürzt.

gen haben wir die Struktur-Untersuchungen durchgeführt.» Aggregate aus Gehirnproben fünf verstorbener Parkinson- und fünf verstorbener MSA-Patienten wurden untersucht. Zum Vergleich stellten die Wissenschaftler verschiedene Varianten von Alpha-SynucleinAggregaten künstlich her. Dafür verwendeten sie gängige Verfahren. Mittels Kernspinresonanzspektroskopie (NMR) und weiterer Methoden haben die For scher dann die Struktur der verschiedenen Aggregate verglichen.
Strukturelle Unterschiede
«Wir haben festgestellt, dass die aggregierten Proteine aus dem Labor eine andere Struktur haben als alle aus Patientenmaterial generierten Aggregate», kommentiert Dr. Timo Strohäker, Erstautor der Studie, die Befunde. «Zudem unterschieden sich die Proteine der MSA-Patienten von jenen der Parkinson-Patienten. Die Proteine der verschiedenen MSA-Patienten hatten alle eine weitgehend ähnliche Form. Die Proteine der Parkinson-Patienten waren deut
Ein typisches Symptom der Parkinsonerkrankung ist der Ruhetremor. Meist zittern die Arme in Ruheposition.
lich uneinheitlicher. Vergleicht man die Proteine der verschiedenen Parkinson-Patienten untereinander, dann gibt es eine gewisse strukturelle Vielfalt.» Grundsätzlich enthalten die Alpha-Synuclein-Proteine sämtlicher Aggregate sogenannte Beta-Faltblatt-Strukturen – was im Einklang steht mit vorherigen Untersuchungen. Das molekulare Rückgrat ist demnach so gebogen, dass die Proteine weitgehend zweidimensional sind und innerhalb der Aggregate schichtweise aneinanderhaften. Die Faltung der Proteine ist allerdings nicht durchgängig, denn jedes enthält auch Abschnitte ohne definierte Struktur. Von Bedeutung ist zudem die Orientierung der Faltblatt-Bereiche. «Es geht darum, wie viel von einem Protein gefaltet ist und auch, wie es gefaltet ist», sagt Zweckstetter. Diverse Aggregatformen bei Parkinson In der Struktur des mit Parkinson verknüpften Alpha-Synucleins gab es zum Teil deutliche Unterschiede zwischen einzelnen Patienten. Dies könnte damit zusammenhängen, dass der Verlauf der Parkinson-Erkrankung von Mensch zu Mensch recht unterschiedlich sein kann. «Die Variabilität von Parkinson hängt möglicherweise mit Unterschieden in der Faltung des aggregierten Alpha-Synucleins zusammen. Das würde der sogenannten ‹one disease-one strain›-Hypothese widersprechen, also dass Parkinson nur mit einer einzigen, klar definierten Aggregatform einhergeht. Angesichts unserer relativ kleinen Stichprobe von fünf Patienten lässt sich das aber nur vermuten», so Zweckstetter. «Unsere Ergebnisse belegen jedoch sicherlich, dass Studien mit Gewebeproben von Patienten notwendig sind, um Labor-Experimente sinnvoll zu ergänzen.»
Originalpublikation Timo Strohäker et al., «Structural heteroge neity of alpha-synuclein fibrils amplified from patient brain extracts», Nature Communications (2019); DOI: 10.1038/s41467-
019-13564-w

Kontakt Prof. Dr. Markus Zweckstetter Max-Planck-Institut für biophysikalische Chemie Am Fassberg 11 D-37077 Göttingen +49 551 201 2220 mzwecks@mpibpc.mpg.de www.mpibpc.mpg.de










