
20 minute read
Wolfgang Domej
from Jahrbuch 2016
by bigdetail
❙ Wolfgang Domej ❙
Kälteaktivierung des braunen Fettgewebes
BAT-activation by cold exposure
SUMMARY
Obesity is a major social and medical challenge today, with increasing prevalence rates mainly in western industrial countries. Obesity seriously contributes to metabolic dysfunction and related cardiovascular diseases. Brown adipose tissue (BAT) is a specialized type of fat capable of providing energy for non-shivering thermogenesis. BAT is a major player in the regulation of metabolic functions and can deliver heat rapidly to adapt the organism to a cold environment. Cold atmosphere, pharmacological influences, and an exercise intensive life style may promote BAT-derived thermogenesis, while pollutants such as ambient fine particulate matter or high oxygen radical burden may impair it. The persistence of BAT even in human adults and the discovery of novel transcription factors for the control of brown adipocyte differentiation remain issues of high interest. Cold and beta-adrenergic stimulation can activate BAT and/or initiate browning of white adipose tissue (WAT). However, impairment or lack of BAT-thermogenic function may evoke metabolic dysfunctions and promote diabetes mellitus, dyslipidemia and obesity. BAT activity could be the basis for new strategies and pharmacological treatment options for obesity and related diseases. Keywords: Brown adipose tissue (BAT), cold-induced thermogenesis (CIT), obesity, thermogenic adipocytes, obesity-related disorders, white adipose tissue (WAT), energy expenditure.
ZUSAMMENFASSUNG
Fettleibigkeit ist heute weitverbreitet und stellt eine beträchtliche gesellschaftliche wie medizinische Herausforderung vor allem in westlichen Industrieländern dar. Adipositas trägt massiv zur steigenden Prävalenz metabolischer Funktionsstörungen und kardiovaskulärer Erkrankungen bei. Braunes Fettge-
87
webe (BAT) spielt eine führende Rolle in der Regulation metabolischer Funktionsabläufe und besteht aus speziellen Fettzellen, durch deren Aktivierung sich die Wärmeproduktion ohne muskuläres Kältezittern erhöht und den Organismus damit in die Lage versetzt, sich kalten Umgebungsbedingungen anzupassen. Kalte Umgebungstemperaturen, pharmakologische Einflüsse sowie ein bewegungsintensiver Lebensstil fördern, Umweltschadstoffe wie Feinstaub oder Sauerstoffradikale hingegen beeinträchtigen die thermogene Funktion des BAT. Die Persistenz des BAT auch bei Erwachsenen sowie Entdeckung neuer Transkriptionsfaktoren zur Kontrolle sowie Differenzierung brauner Fettzellen führte zu ungebrochenem Interesse an dieser Thematik. Kälteeinwirkung sowie Beta-adrenergika können das BAT aktivieren und zu einer Umwandlung weißer (WAT) in braune Fettzellen führen. Eine Beeinträchtigung oder ein Mangel der thermogenen Funktion des BAT kann metabolische Veränderungen hervorrufen und die Entwicklung von Typ-2-Diabetes mellitus, Dyslipidämien und Adipositas begünstigen. Auf Basis einer pharmakologischen BAT-Aktivierung zeichnen sich prospektiv neue Strategien und Therapieoptionen gegen Adipositas und assoziierte Erkrankungen ab. Schlüsselwörter: Braunes Fettgewebe (BAT), kälte-induzierte Thermogenese (CIT), Adipositas, thermogene Fettzellen, weißes Fettgewebe (WAT), Energieverbrauch.
EINLEITUNG
Übergewicht und Adipositas präsentieren sich in unseren Breiten heute als Volkskrankheit und sind üblicherweise Folge einer über dem Verbrauch liegenden Energiezufuhr. Als metabolische Störung tragen sie zur Entwicklung und Manifestation des Typ-2-Diabetes mellitus sowie zur Erhöhung des kardiovaskulären Risikos bei. Mit Adipositas ist eine signifikante Erhöhung der Morbidität und Mortalität verbunden. Überschüssige Nahrungsenergie wird in Form von Triglyzeriden in den Zellen des weißen Fettgewebes (WAT/Depotfett) gespeichert (Abb. 1a), das zugleich auch einige endokrine Faktoren wie beispielsweise Leptin freisetzt; Letzteres spielt bei der Regulation des Sättigungsgefühls eine besondere Rolle. WAT-Depots sind häufig zentral lobulär strukturiert und zeigen im Zytoplasma typische univakuoläre Lipidtröpfchen (Abb. 1b, 2a) (1). Braunes Fettgewebe (BAT) ist hingegen als Sonderform des retikulären Bindegewebes nicht uniform, son-
88
dern weist morphologische, funktionelle und farbliche Unterschiede auf. Die Synthese und Freisetzung verschiedenster Faktoren weist das Fettgewebe in seiner Gesamtheit heute als Teil des endokrinen Systems aus.
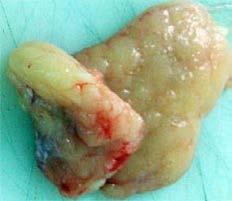
Abb. 1a, 1b: Autopsiepräparate: links weißes Fettgewebe (WAT), rechts braunes (BAT) (Mit freundlicher Genehmigung, OA Dr. E. Karpf, Pathol.-anatom Institut, MUG/Graz)
Größere BAT-Anteile finden sich bei neugeborenen Säugetieren, da diese stärker von Auskühlung bedroht sind als adulte Tiere ihrer Art (geringere isolierende Fettschicht, unreife Thermoregulation/Kältezittern). Speziell Winterschlaf haltende Tierspezies weisen in der Regel größere BAT-Anteile auf, die mit einer raschen Erwärmung während der Aufwachphase in Zusammenhang stehen. In der Neonatalperiode des Menschen macht das BAT ~6% des Körpergewichtes aus. Bei menschlichen Säuglingen findet sich BAT vor allem subkutan in der Axillar- und Scapularregion, auch mediastinal und ausgeprägt in der Nierenkapsel. Damit wird gewährleistet, dass die Körpertemperatur bei relativ großer Körperoberfläche jedoch noch kleiner Muskelmasse erhalten bleibt. Mit zunehmendem Alter wird das BAT in WAT umgewandelt.
Seit dem Jahre 2009 ist bekannt, dass BAT auch in individuell unterschiedlicher Menge beim Erwachsenen noch vorhanden ist (2-4). Mit Hilfe von PET-CT-Untersuchungen konnte ermittelt werden, dass Männer über einen durchschnittlichen BAT-Gehalt von 11,7 g, Frauen von 12,3 g verfügen (Abb. 2). Der Gehalt an Cyto- sowie eisenhältigen Lipochromen verleiht dem BAT bisweilen einen bräunlichen Farbton, allerdings ist makroskopisch eine ein-
89
Abb. 2: Ganzkörper-PET-CT (18FDG): Speichernde BAT-Anteile periclavikulär sowie irregulär im oberen Mediastinum bei einer jungen, normalgewichtigen, sportlichen Probandin (mit freundlicher Genehmigung OA Dr. T. Schwarz, Nuklearmedizin, Univ.-Klinik für Radiologie, MUG).

90
deutige Zuordnung nicht immer leicht möglich (Abb. 1b). Im Vergleich zum WAT (univakuoläre Fettzellen) (Abb. 1a) ist das stoffwechselaktivere BAT durch eine hohe Mitochondrienanzahl, verstärkte Expression von UCP-1 (uncoupling protein-1) sowie ein multilokuläres intrazytoplasmatisches Lipidverteilungsmuster (plurivakuoläres Fettgewebe) gekennzeichnet. Häufig finden sich histologisch braune Adipozyten auch interponiert im WAT (Abb. 3b).


Abb. 3: obere Reihe a–b: links plurivakuoläre Fettzellen (BAT) (H.E x 20), rechts plurivakuoläre Fettzellen (BAT) zwischen univakuolären Fettzellen (WAT); untere Reihe c–d: WAT-typische großunivakuoläre Adipozyten mit randständigen Zellkernen (H.E x 20)(5). (a, d mit freundlicher Genehmigung OA Dr. F. Kapp, Pathol.-anatom Institut, MUG)


Aktivität und Genese des BAT werden durch Faktoren wie PGC-1a (peroxisome proliferator-activated receptor-gamma coactivator) gesteuert. Letzterer wird v.a. unter Kälteeinwirkung verstärkt freigesetzt (6). Das BAT, das adrenerg innerviert wird, ist imstande, die Oxydation freier Fettsäuren von der Synthese des Energieträgers Adenosintriphosphat (ATP) zu entkoppeln. Dafür ist das
91
Transmembranprotein UCP-1 verantwortlich, das praktisch nur in reifen braunen bzw. beigen Adipozyten vorkommt und an der inneren Mitochondrienmembran agiert. UCP-1 supprimiert hier im aktivierten Zustand die ATP-Produktion durch Suppression des ATP-Synthase-Komplexes. Braune Adipozyten können durch „thermogene Respiration“ Körperwärme produzieren und sind im Gegensatz zu Zellen des WAT darauf ausgerichtet, chemische Energie rasch in Form von Wärme zur Verfügung zu stellen. Die Thermogenese dieser spezialisierten Fettzellen hat indirekt auch einen antiadipösen und antidiabetischen Effekt und wirkt der Entwicklung einer metabolischen Dysfunktion respektive des metabolischen Syndroms entgegen, da die Ankurbelung des Energieumsatzes gleichzeitig eine negative Energiebilanz bedeutet. Heute sucht man nach wirksamen Möglichkeiten, die zu einer verstärkten Expression weiterer Gene der Thermogenese führen (7). In diesem Zusammenhang wurde auch bereits eine Reihe weiterer wirksamer Faktoren wie PGC-1a, FGF-21, PRDM16, BMP-7 entdeckt, die ihrerseits die UCP-1-Freisetzung steigern, den Energieumsatz erhöhen und die Kältetoleranz verbessern. Neuesten Untersuchungen zufolge steht auch die Tumorkachexie mit einer verstärkten Thermogenese durch das BAT in engem Zusammenhang. Nach aktueller Meinung dürften tumorspezifische Faktoren und Signalwege für die Aktivierung des BAT und eine katabole Stoffwechselsituation verantwortlich sein (8).
BAT-FUNKTION UND REGULATION
Die Entdeckung, dass funktionelles braunes Fettgewebe beim erwachsenen Menschen zu einem kleinen Teil persistiert, führte in der Folge zu einem Boom in der Adipositasforschung (9). Das BAT stellt sich als spezialisiertes Fettgewebe dar, das nach intrinsischer Aktivierung den Energieverbrauch forciert und im Rahmen der kälteinduzierten Thermogenese (CIT) rasch Wärme zur Verfügung stellen kann (10). Verschiedene Faktoren wie Ernährung (diätetische Maßnahmen), Körperkerntemperatur, metabolisch wirksame Hormone (Noradrenalin, Thyroxin) aber auch eine prolongierte Abnahme der Umgebungstemperatur sind imstande, das BAT zu stimulieren (11). So gehen hyperthyreote Zustände mit erhöhter BAT-Aktivität einher, paradoxerweise auch Hypothyreosen. Bei Letzteren ist der BAT-Stoffwechsel gesteigert, damit die Körpertemperatur im Zustand einer verminderten basalen Wärmeproduktion aufrechterhalten werden kann (12). Eine länger anhaltende Kälteexposition durch Kaltluft oder kaltes Wasser führt offensichtlich dazu, dass auch
92
der Mensch einer humoralen Kälteanpassung, basierend auf einer verstärkten Freisetzung von Noradrenalin und Thyroxin, unterliegt. Die damit verbundene vermehrte Freisetzung und Verstoffwechselung freier Fettsäuren legt nahe, dass sich Alpin- sowie Wintersportarten in besonderem Maße zur ergänzenden Behandlung der Adipositas eignen könnten. So führte moderate physische Belastung mit gleichzeitiger Abkühlung des Gesichtes beim Menschen bereits innerhalb von 1–2 Wochen zu einem mit Proteinurie und Ketonurie einhergehenden substanziellen Fettverlust (13). Während eine adrenerge Stimulation des WAT in erster Linie die Lipolyse stimuliert (14), führt ein nachhaltiger Kältereiz im BAT über die Aktivierung des sympathischen Nervensystems zur Bindung von freigesetztem Noradrenalin bzw. ß3-Agonisten an den reichlich vorhandenen ß3-Rezeptoren (ß3-adrenergic receptor/ß3AR). Dieser Vorgang aktiviert die Adenylzyklase, die für die Umwandlung von ATP in zyklisches Adenosinmonophosphat (cAMP) relevant ist. Letzteres führt schließlich über die Proteinkinase A (PKA) zur Lipolyse und über diverse Transkriptionsfaktoren wie beispielsweise CREB (cAMP reponse element-binding protein) zu verstärkter Expression des Thermogenesefaktors UCP-1 (11). Dieser gelangt in die zahlreichen Mitochondrien des BAT, wo die Atmungskette entkoppelt von der ATP-Synthese abläuft. Untersuchungen zu dieser Thematik ergaben, dass eine akut innerhalb des BAT in Gang gesetzte Thermogenese mit einem deutlichen Anstieg mitochondrialer Sauerstoffradikale (ROS) einhergeht (7). Im Gegensatz dazu führt eine experimentell ausgelöste Depletion mitochondrialer ROS unter Kälteexposition zu Hypothermie und Hemmung des UCP1-abhängigen Anstieges des Energieumsatzes. Adipöse Menschen haben im Vergleich zu Normalgewichtigen eine deutlich verminderte BAT-Aktivität bzw. mitochondriale UCP-1-Konzentration. Obwohl BAT in erster Linie über das sympathische Nervensystem kontrolliert wird, wurden eine Reihe weiterer neuer BAT-Stimulatoren gefunden, die unabhängig vom adrenergen Einfluss den BAT-Metabolismus anfeuern (Irisin, IL-6, ANP, PPARg-Agonisten, GABA, FGF-21) (15). Es gibt auch Hinweise, dass eine gestörte Thermoregulation auch bei Morbus Alzheimer (DAT) eine nicht unbedeutende Rolle spielen könnte. In einem DAT-Modell mit transgenen Mäusen konnte unter Kälteeinfluss gezeigt werden, dass die Tiere im Vergleich zu normalen Kontrolltieren eine niedrigere Körpertemperatur aufwiesen und auch deutlich kälteempfindlicher waren. Eine 24-Stunden Kälteexposition (4°C) führte zu einer Zunahme neuropathologischer Schlüsselmarker der DAT (Amyloid-Beta, Tau-Protein Aggregate). Nach thermoneutraler Exposition und Normalisierung der Körpertemperatur
93
verbesserte sich das Erinnerungsvermögen der Tiere wieder und die Amyloid-Konzentration sowie synaptische Pathologie nahmen innerhalb einer Woche ab. Ähnliches könnte beim Menschen mit DAT der Fall sein, wo die Erkrankung ebenfalls mit einem Rückgang des Energieumsatzes sowie der basalen Körpertemperatur einhergeht (16). Es entstand die Idee, eines Tages die thermogene Kapazität auch bei DAT therapeutisch einsetzen zu können (17).
Abb. 4: Mit regelmäßiger Kälteexposition und Bewegung gegen Adipositas, kardiovaskuläre Erkrankungen und Morbus Alzheimer?

Die Kälteaktivierung des BAT (CIT) zieht eine verbesserte Insulinrezeptorsensitivität sowie Abnahme des Körperfettanteiles nach sich, was vor allem für Typ-2-Diabetiker von großer Bedeutung ist. Braune Fettzellen sind darüberhinaus fähig, Glukose sowie Lipide direkt zu utilisieren, was auf diesem Wege unabhängig vom Körpergewicht zu einer Verbesserung des Glukosemetabolismus sowie des Lipidstatus beiträgt. Neben weißen Fettzellen, die den Hauptanteil der dicht gepackten energiereichen Triglyzeride enthalten und den weniger zahlreich vorkommenden embryonalen braunen Adipozyten (cBAT) (Abb. 3a), gibt es auch „beige“ Adipozyten (r-BAT), die ähnliche
94
Eigenschaften wie braune Fettzellen aufweisen. Letztere entstehen innerhalb spezifischer Fettdepots in Reaktion auf bestimmte Reizeinwirkungen wie Abnahme der Umgebungstemperatur oder regelmäßige sportliche Betätigung. Bei anhaltender Reizeinwirkung können auch präexistente braune Adipozyten proliferieren bzw. sich im WAT aus braunen Präadipozyten zu solchen differenzieren (18). Braunen und beigen Adipozyten gemeinsam ist eine sehr hohe Stoffwechselaktivität, die sich in Form des hohen Mitochondriengehalts, der hohen UCP-1-Expression sowie ihrer aktivierbaren thermogenen Kapazität präsentiert. Die Aktivierung thermogener Fettzellen ist entscheidend für den gesamten Energieumsatz und führt einerseits zur Hydrolyse gespeicherter Triglyzeride andererseits zur Aufnahme von Glukose und Lipiden aus der Zirkulation. Beide sind als Treibstoff für die komplexe Wärmeproduktion durch thermogene Adipozyten erforderlich (19). Es ist nicht verwunderlich, dass auch intensive Interaktionen der verschiedenen Fettzellarten mit den Leberzellen bestehen, womit im endokrinen Verbund ein starker Einfluss auf den Gesamtstoffwechsel erfolgt. Damit wird die Bedeutung des Fettgewebes innerhalb des endokrinen Netzwerkes verdeutlicht. Stimulierbare beige Adipozyten (r-BAT), die sich durch Aktivierung aus den WAT-Zellen profilieren können, sind im Vergleich zu den klassischen Adipozyten unterschiedlichen Ursprungs und unterscheiden sich auch in molekularer Hinsicht. Beide thermogenen Fettzellarten lassen sich über Transkriptionsfaktoren wie Ebf 2 oder Prdm 16 identifizieren. Mechanismen, die in den weißen Fettzellen den genetischen Programmablauf der Thermogenese unterdrücken können und damit einen energiespeichernden adipösen Phänotyp unterstützen, werden heute noch nicht in allen Details verstanden. Der Transkriptionsfaktor Zfp 423 (zinc-finger protein 423) dürfte jedoch eine Schlüsselrolle bei der Blockade der thermogenen Funktion des BAT darstellen (20). Mit der Aktivierung und Vermehrung des BAT lässt sich im Tierversuch ein erhöhter Energieumsatz bzw. eine negative Energiebilanz erzielen. Letztere wirkt protektiv vor der Entwicklung einer Adipositas, eines Typ-2-Diabetes mellitus sowie eines metabolischen Syndroms. Neuere Studienergebnisse weisen bereits auf eine teilweise Reproduzierbarkeit der experimentellen Phänomene beim Menschen hin (14, 21).
95
REGELMÄSSIGES BEWEGUNGSPROGRAMM
Es ist hinlänglich bekannt, dass aerobes Ausdauertraining zu verschiedenen körperlichen Anpassungsvorgängen führt, womit gleichzeitig auch eine prophylaktische Wirkung gegenüber metabolischen Störungen einschließlich Adipositas und Typ-2-Diabetes mellitus verbunden ist. Experimentelle Untersuchungen bei verschiedenen Nagetieren haben gezeigt, dass es unter regelmäßigem Ausdauertraining zu einer verstärkten Braunfärbung („Browning“) des WAT kommt (22). Im Tierversuch führte regelmäßiges Bewegungstraining zu einer Zunahme brauner Adipozyten; konkordant dazu erfolgte eine signifikante Erhöhung der Mitochondrienzahl, der UCP-1-Expression sowie der Expression weiterer BAT-spezifischer Gene (23, 24). Die Frage, ob es auch beim Menschen durch regelmäßige Bewegung zu einer teilweisen Umwandlung von subkutanem WAT in BAT kommt und welche Faktoren im Detail dazu beitragen, bleibt weiter eine wissenschaftliche Herausforderung. Es gibt bereits einen gewissen Evidenzlevel, dass sportliche Aktivität bzw. regelmäßiges Ausdauertraining das WAT des Menschen soweit beeinflusst, dass die Größe der Fettzellen bzw. deren zytoplasmatischer Lipidgehalt abnimmt und sich gleichzeitig die mitochondriale Aktivität erhöht.
KÄLTEWIRKUNG UND OUTDOOR-SPORT
Für tierexperimentelle Untersuchungen zum Thema Kälteanpassung werden häufig Ratten herangezogen. Diese Nager sind unter Kältebedingungen imstande, ihre normale Körpertemperatur über mehrere Wochen aufrecht zu halten, obwohl ihre Wärmegeneration durch Muskelzittern („Kältezittern“) längst eingestellt ist. Dieser Effekt ist der thermogenen Kapazität ihres beträchtlichen BAT-Anteiles zuzuschreiben (25). In diesem Zusammenhang wäre es von Interesse zu erheben, ob Personen, die regelmäßig Alpinsport betreiben und häufig kälteexponiert sind auch eine niedrigere Diabetesprävalenz und CV-Mortalität aufweisen bzw. auch seltener an Fettstoffwechselstörungen leiden. Dazu existieren zum Zeitpunkt leider noch sehr wenige valide Daten. Tatsache ist, dass Kältesensibilität und Kälteresistenz von Alpinsportlern sehr unterschiedlich sind. Es ist sehr wahrscheinlich, dass die unterschiedliche Kältetoleranz auch beim Menschen mit dem Gehalt an braunem bzw. beigem Fettgewebe in Zusammenhang steht. Eine gezielte partielle Transformation von WAT in BAT würde auch beim Menschen eine sehr effiziente Methode darstellen, die
96
Gesamtfunktion des BAT zu forcieren und den Energieverbrauch zu erhöhen (17). Es ist gut vorstellbar, dass sich durch regelmäßige Kälteexposition (Kältekammer, Wintersport, Alpinsport) der Anteil und die Aktivität des BAT erhöhen lässt (Abb. 4, 5) (4); über die dafür erforderliche Transformationszeit und Kälteintensität ist zur Zeit beim Menschen noch wenig bekannt.
Abb. 5: Mit wiederholter Kälteexposition einer Adipositas- bzw. Diabetesentwicklung entgegenwirken?


BAT-AKTIVITÄT UNTER SAISONALEN KLIMATISCHEN VERÄNDERUNGEN
In einer rezenten Untersuchung mit zehn metabolisch gesunden adipösen männlichen Probanden konnte mit Hilfe von PET-Untersuchungen nach 10-tägiger Kälteexposition eine verstärkte Glukoseaufnahme [18FDG] innerhalb der Skelettmukulatur nachgewiesen werden. Die kälteinduzierte muskuläre Glukoseaufnahme zeigte eine tendenzielle Zunahme mit der Dauer der Kälteakklimatisation. Am Ende der Akklimationsperiode stand ein geringgradiger Anstieg der gemessenen Hauttemperatur, das subjektive Kälteempfinden war leicht verbessert. Allerdings verhielt sich die BAT-Aktivität invers zum Lebensalter und Körperfettanteil der Probanden (26). Es erscheint plausibel, dass auch saisonale klimatische Temperaturunterschiede Einfluss auf die BAT-Funktion nehmen. Eine rezente Studie mit 45 männlichen gesunden Probanden ergab während der Sommer- bzw. Winterperiode divergierende BAT-Aktivitätsmuster in der PET-Darstellung (10). Dabei wurde die kälteinduzierte Thermogenese (CIT) jeweils als Differenz des Energieverbrauches bei 27°C und nach zweistündiger Kälteexposition bei 19°C erhoben. Die CIT war im Winter gegenüber dem Sommer signifikant erhöht, wobei
97
sich Probanden mit metabolisch aktivem braunem Fettgewebe durch höhere Durchschnittswerte (BAT/Winter: 185.6 kcal/Tag, Sommer: 18,3 kcal/Tag, p <0,001) von jenen mit geringer basaler BAT-Aktivität (BAT/Winter: 90,6 kcal/ Tag, Sommer: 46.5 kcal/Tag; p <0,05) deutlich unterschieden. In diesem Zusammenhang ist die globale Erderwärmung durch eine allgemein abnehmende BAT-Aktivität und zunehmende Adipositas- sowie Diabetesprävalenz bereits deutlich abzulesen. In einige Studien wurde versucht, das Leben in sogenannten „thermischen Komfortzonen“ der Erde mit der zunehmenden Prävalenz für Adipositas und Typ-2-Diabetes mellitus in Bezug zu setzen. Tatsache ist, dass das Leben in den thermischen Komfortzonen zu einer fortlaufenden Aktivitätsminderung des BAT führt, was sich in einer allgemeinen Abnahme des Energieverbrauchs sowie der Thermogenese abbildet. Ein Rückgang der saisonalen Kälteexposition dürfte zusammen mit einer häufig verminderten Diät-induzierten Thermogenese (stark fetthältige oder zuckerhältige Ernährung) und ständig abnehmender körperlicher Aktivität zu explosionsartigem weiteren Ansteigen der Prävalenzzahlen von Adipositas und metabolischem Syndrom beitragen (27). Es ist damit nachvollziehbar, wenn das CV-Risiko mit zunehmender Klimaerwärmung weltweit weiter steigt.
KARDIOVASKULÄRE RISIKOMINIMIERUNG
Es besteht heute kein Zweifel, dass Fettleibigkeit in Beziehung zum Insulinspiegel, zum metabolischen Syndrom und zu kardiovaskulären Erkrankungen steht. Dazu tragen eine Zunahme des WAT sowie eine Dysfunktion des BAT in besonderem Maße bei. Das Risiko für die Entwicklung kardiovaskulärer Erkrankungen (CV) ist zwischen ethnischen Gruppierungen bekannterweise sehr unterschiedlich. So haben Südost-Asiaten infolge häufiger zentraler Adipositas, Insulinresistenz und Dyslipidämie ein überdurchschnittliches CV-Risiko (28). Trotz dieses klassischen Risikopakets gab es für das außergewöhnlich hohe Risiko von Südost-Asiaten bisher keine ausreichende Erklärung. Ein weiterer Risikofaktor, welcher der Entwicklung des unvorteilhaften metabolischen Phänotyps gewisser südost-asiatischer Populationen zugrunde liegt, ist vermutlich ein sehr kleines BAT-Volumen; infolgedessen weisen Südost-Asiaten auch häufig einen deutlich geringeren Energieverbrauch relativ zur Nahrungsaufnahme auf, womit gleichzeitig auch eine Abnahme der Lipidoxydation und der muskulären Glukoseaufnahme verbunden ist. Südost-Asiaten haben daher im Vergleich zur weißen Rasse eine deutlich höhere Prävalenz an
98
kardiovaskulären Erkrankungen auf Basis artherogener Dylipidämien, gestörter Endothelfunktion sowie entzündlichen Viszeralfettveränderungen; besonders Letztere gehen bekannter Weise mit erhöhter kardiovaskulärer Mortalität einher.
THERAPEUTISCHE VISIONEN
Auf Basis der partiellen Persistenz des BAT im Erwachsenenalter entwickelte sich die Vision, eines Tages die thermogene Kapazität auch zur Behandlung von Fettleibigkeit einsetzen zu können (17). Auf Grund der Fähigkeit des BAT, Glukose und Lipide oxidativ zu verwerten, ergeben sich auch neue Therapieoptionen bei artherogenen Gefäßveränderungen sowie bei Insulinresistenz (15). Die medizinische Forschung ist intensiv auf der Suche nach neuen nebenwirkungsarmen Therapieansätzen, womit eine Vermehrung und Aktivierung der BAT-Zellen erzielbar ist. Damit liegt im BAT ein hohes Potenzial für eine nachhaltige kardiovaskuläre Risikominimierung (17, 28). Eine medikamentöse Stimulation thermogener Fettzellen könnte sich beim Menschen zu einer wirksamen Strategie gegen Adipositas einschließlich metabolischer Komplikationen, vielleicht sogar gegen DAT weiterentwickeln. Im Tierversuch ließen sich braune Fettzellen von Mäusen einerseits mit Adenosin aktivieren, andererseits ließ sich bei adipösen Versuchstieren durch eine Kombination aus Clodronate-Liposomen und Kälte eine verstärkte Expression von Markergenen der Thermogenese erzielen (29). Die Zunahme der Fettverbrennung führte bei den Testtieren auch zu einer Gewichtsabnahme und Abnahme des Blutzuckerspiegels. Eine intraperitoneale Verabreichung von rekombinantem TNF-a supprimierte die UCP-1 Induktion in den adipösen Fettschichten der Versuchstiere; auf diese Weise dürften entzündliche Veränderungen des WAT nicht nur die Insulinresistenz, sondern auch die Abnahme des Energieverbrauches im adipösen Gewebe unterstützen (29). Auch wenn sich konkrete Therapieansätze am Horizont abzeichnen, stellen sportliche Aktivität und Kälte in Verbindung mit einer adrenergen Stimulation der Herz- und Skelettmuskulatur eine physiologische und praktikable Variante der Aktivierung thermogener Fettzellen dar, ß-Blocker hingegen unterbinden deren Aktivität. Bis dato waren Effekte einer kurzzeitigen Kälteanpassung erfolgversprechend, konnte doch über die BAT-Aktivität das muskuläre wie auch metabolische Profil verbessert werden. Besonders Typ-2-Diabetiker und Patienten mit metabolischem Syndrom würden von einer vermehrten muskulären
99
Glukoseaufnahme profitieren. Es gibt dafür bereits eine gewisse Evidenz, dass regelmäßige Kälteexposition in Verbindung mit Alpinsport einen nachhaltigen protektiven, antiadipösen Effekt generiert und sich die Insulinresistenz bei Typ-2-Diabetikern durch diese nichtmedikamentöse Maßnahme vielleicht erst später entwickelt oder sich bei diabetischer Stoffwechsellage entsprechend verbessern lässt. Es bedarf allerdings noch weiterer bewegungsbasierter, randomisierter Studien, um explizit aufzuzeigen, welche Bewegungsintensität und welcher Bewegungsumfang erforderlich sind, um das menschliche BAT aktiviert zu halten.
LITERATUR
(1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
(9) Barreau C., Labit E., Guissard C., Rouquette J., Boizeau M.L. et al. Regionalization of browning revealed by whole subcutaneous adipose tissue imaging. Obesity 2016; 24(5): 1081–1089. Virtanen K.A., Lidell M.E., Orava J., Heglind M., Westergren R. et al. Functional brown adipose tissue in healthy adults. N Engl J Med 2009; 360(15): 1518–1525. Cypress A.M., Lehman S., Williams G., Tal I., Rodman D. et al. Identification and importance of brown adipose tissue in adult humans. N Engl J Med 2009; 360(15): 1509–1517. Van Marken Lichtenbell W.D., Van Hommerig J.W., Smulders N.M., Drossaerts J.M. et al. Cold-activated brown adipose-tissue in healthy men. N Engl J Med 2009; 360(15): 1500–1508. Lurf P. Vorkommen und Verteilungsunterschiede von braunem Fettgewebe bei Erwachsenen, in Bezug auf kardiovaskuläre und metabolische Erkrankungen sowie bei Krebserkrankungen. Eine retrospektive Autopsiestudie. Diplomarbeit/Institut für Pathologie, Medizinische Universität Graz, 2012. Liang H., Ward W.F. PGC-1alpha: a key regulator of energy metabolism: Adv Physiol Educ 2006; 30(4): 145–151. Chouchani E.T., Kazak L., Jedrychowski M.P., Lu G.Z., Erickson B.K. et al. Mitochondrial ROS regulate thermogenic energy expenditure and sulfenylation of UCP1. Nature 2016; 532(7697): 112–116. Tsoli M., Swarbrick M.M., Robertson G.R. Lipolytic and thermogenic depletion of adipose tissue in cancer cachexia. Semin Cell Dev Biol 2015; Epub ahead of print. Nedergaard J., Bengtsson T., Cannon B. Unexpected evidence for active brown adipose tissue in adult humans. J Physiol Endocrinol Metabol 2007; 293(2) E 444–E453.
100
(10) Yoneshiro T., Matsushita M., Nakae S., Kameya T., Sugie H. et al. Brown adipose tissue is involved in the seasonal variation of cold-induced thermogenesis in humans. Am J
Physiol Regul Integr Comp Physiol 2016; Epub ahead of print. (11) Zhang G., Sun Q., Liu C. Influencing factors of thermogenic adipose tissue activity.
Front Physiol 2016; 7: 29. (12) Lapa C., Maya Y., Wagner M., Arias-Loza P., Werner R.A. et al. Activation of brown adipose tissue in hypothyreoidism. Ann Med 2015; 47(7): 538–545. (13) Sephard R.J. Adaptation to exercise in the cold. Sports Med 1985; 2(1): 59–71. (14) Fenzl A., Kiefer F.W. Brown adipose tissue – the new weapon to fight obesitiy? J Klin
Endokrinol Stoffw 2014; 7(1): 13–18. (15) Sanchez-Delago G., Martinez-Tellez B., Olza J., Aguilera C.M., Gil A., Ruiz J.R. Role of exercise in the activation of brown adipose tissue. Ann Nutr Metab 2015; 67(1): 21–32. (16) Vandal M., White P.J., Tournissac M., Tremblay C., St-Amour I. et al. Impaired thermoregulation and beneficial effects of thermoneutrality in the 3×Tg-AD model of Alzheimer’s disease. Neurobiol Aging. 2016; 43: 47–57. (17) Langin D. Recruitment of brown fat and conversion of white into brown adipocytes.
Strategies to fight metabolic complications of obesity? Biochim Biophys Acta 2010; 1801(5): 372–376. (18) Thuzar M., Ho K.K. Mechanisms in endocrinology: Brown adipose tissue in humans: regulation and metabolic significance. Eur J Endocrinol 2016; 175(1): R11–25. (19) Scheja L., Heeren J. Metabolic interplay between white, beige, brown adipocytes and the liver. J Hepatol 2016; 64(5): 1176–1186. (20) Shao M., Ishibashi J., Kusminski C.M., Wang Q.A., Hepler C. et al. Zfp423 maintains white adipocyte identity through suppression of beige cell thermogenic gene program.
Cell Metab 2016; 23(6): 1167–1184. (21) Kim S.H., Plutzky J. Brown fat and browning for treatment of obesity and related metabolic disorders. Diabetes Metab J 2016; 40(1): 12–21. (22) Stanford K.I., Goodyear L.J. Exercise regulation of adipose tissue. Adipocyte 2016; 5(2): 153–162. (23) Slocum N., Durrant J.R., Bailey D., Yoon L., Jordan H. et al. Responses of brown adipose tissue to diet-induced obesity, exercise, dietary restriction and ephedrine treatment. Exp Toxicol Pathol 2013; 65(5): 549–557. (24) Xu X., Ying Z., Cai M., Xu Z., Li Y. et al. Exercise ameliorates high-fat diet-induced metabolic and vascular dysfunction, and increases adipocyte progenitor cell population in brown adipose tissue. Am J Physiol Regul Integr Comp Physiol 2011; 300(5):
R1115–R1125. (25) LeBlanc J. Mechanisms of adaptation to cold. Int J Sports Med 1992; 13 Suppl 1: S169–172.
101
(26) Hanssen M.J., van der Lans A.A., Brans B., Hoeks J., Jardon K.M. et al. Short-term cold acclimation recruits brown adipose tissue in obese humans. Diabetes 2016; 65(5): 1179–1189. (27) Turner J.B., Kumar A., Koch C.A. The effects of indoor and outdoor temperature on metabolic rate and adipose tissue - the Mississippi perspective on obesity epidemic.
Rev Endocr Metab Disord 2016; 17(1): 61–71. (28) Boon M.R., Bakker L.E., van der Linden R.A., van Ouwerkerk A.F., de Goeje P.L. et al. High prevalence of cardiovascular disease in South Asians: Central role for brown adipose tissue? Crit Rev Clin Lab Sci 2015; 52(3): 150–157. (29) Sakamoto T., Nitta T., Maruno K., Yeh Y.S., Kuwata H. et al. Macrophage infiltration into obese adipose tissues suppresses the induction of UCP1 expression in mice. Am J
Physiol Endocrinol Metab 2016; Epub ahead of print.







